Capitulo 2
Anuncio

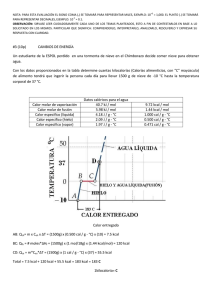
Capitulo 4 UTILIZACIÓN DEL CALOR El calor generado en la combustión es utilizado para el calentamiento de las partes del horno, de los materiales cargados al mismo, para compensar las pérdidas de calor producidas por las descargas de productos (escoria, metal, gases), como fuente de energía para producir las reacciones endotérmicas y cambios de fase, para reponer el calor perdido por conducción a través de las paredes del horno, pérdidas por aberturas y el calor que es arrastrado fuera del horno por los gases de combustión y generados en el proceso, además de otros requerimientos. 4.1 Calentamiento de sólidos, líquidos y gases 4.1.1 Capacidad calorífica y calor específico La capacidad calorífica de una sustancia se define como la cantidad de calor necesaria para incrementar la temperatura de un cuerpo en 1 ºC. El calor específico c de una sustancia es la capacidad calorífica por unidad de masa. El calor específico es una propiedad característica de cada sustancia. En el caso de la mayor parte de los hornos metalúrgicos, las sustancias se calientan a presión constante, por lo que se deben utilizar para los cálculos de calentamiento los calores específicos a presión constante. Las capacidades caloríficas de las sustancias suelen representarse por ecuaciones cuadráticas sobre un intervalo de temperaturas; así, cp = a + bT + cT2 La cantidad de energía transferida por calor entre una muestra de masa m de un material y sus alrededores por un cambio de temperatura de T1 a T2 es: Qm T2 T1 Cp dT Para algunas aplicaciones técnicas, es conveniente definir una capacidad calorífica molar media, T2 c P ,m c P dT b c a (T1 T2 ) (T12 T1T2 T22 ) T2 T1 2 3 T1 y la energía transferida se calcula por: Q = m cp, m (T2 – T1) - 43 - Esta cantidad de calor que recibe un cuerpo sin cambiar su estado físico, mientras se incrementa su temperatura, recibe el nombre de calor sensible. TABLA 4.1. Capacidades caloríficas a presión constante de elementos y compuestos inorgánicos. Cp SUSTANCIA Al Al2O3 Al2O3.SiO2 2Al2O3.2SiO2 4Al2O3.3SiO2 Sb CaCO3 CaO CaO.Al2O3.SiO2 CaO.SiO2 Cobre CuS Cu2S Sn SnO2 Fe Fe2O3 Au Ag SiO2 ESTADO S L S S, sillimanita S, disteno S, andalucita S, mullita S S L S S S, anortita S, wollastonita S L S S, S, S L S S, S, S, S, L S S L S L S, cuarzo, S, cuarzo, S, cristobalita, S, cristobalita, vitreo cal/ºK.mol 4.80 + 0.00322T 7.00 22.08 + 0.008971T – 522500/T2 40.79 + 0.004763T – 992800/T2 41.81 + 0.005283T – 1211000/T2 43.96 + 0.001923T – 1086000/T2 59.65 + 0.0670T 113.2 + 0.0652T 5.51 + 0.00178T 7.15 19.68 + 0.001189T 10.00 +0.00484T – 108000/T2 63.13 + 0.01500T – 1357000/T2 27.95 + 0.002056T – 745600/T2 5.44 + 0.01462T 7.50 10.6 + 0.00264T 9.38 + 0.0312T 20.9 5.05 + 0.00480T 6.6 13.94 + 0.00565T – 252000/T2 4.13 + 0.00638T 6.12 + 0.00366T 8.40 10.0 8.15 24.72 + 0.01604T – 423400/T2 5.61 + 0.00144T 7.00 5.60 + 0.00150T 8.2 10.87 + 0.008712T – 241200/T2 10.95 + 0.00550T 3.65 + 0.0240T 17.09 + 0.000454T + 897200/T2 12.80 + 0.00447T + 302000/T2 - 44 - INTERVALO DE TEMPERATURAS, ºK 273 - 931 931 – 1 273 273 – 1 973 273 – 1 573 273 – 1 673 273 – 1 573 273 - 576 273 - 575 273 - 903 903 - 1 273 273 – 1 055 273 – 1 173 273 – 1 673 273 – 1 573 273 – 1 357 1 357 - 1573 273 – 1 273 273 - 376 376 – 1 173 273 - 504 505 – 1 273 273 – 1 373 273 – 1 041 1 041 – 1 179 1 179 – 1 674 1 674 – 1 803 1 803 – 1 873 273 - 1 097 273 - 1 336 1 336 – 1 573 273 – 1 234 1 234 – 1 573 273 - 848 848 – 1 873 273 - 523 523 – 1 973 273 – 1 973 TABLA 4.2 Capacidades caloríficas a presión constante de gases Cp cal/ºK.mol GAS 6.946 – 0.000196T + 0.000 000 4757T2 6.457 + 0.001389T – 0.000 000 069T2 6.117 + 0.003167T + 0.000 001 005T2 6.350 + 0.001811T – 0.000 000 2675T2 6.440 + 0.002069T – 0.000 000 4206T2 7.136 + 0.002640T + 0.000 000 0459T2 6.339 + 0.01014T – 0.000 003 415T2 6.945 + 0.01001T – 0.000 003 794T2 7.454 + 0.01913T – 0.000 006 628T2 6.734 + 0.000431T + 0.000 000 3613T2 2.322 + 0.03804T – 0.000 010 97T2 3.204 + 0.01841T + 0.000 004 48T2 3.019 + 0.02821T – 0.000 008 537T2 7.653 + 0.002221T – 0.000 000 8733T2 6.836 + 0.001762T – 0.000 000 2656T2 5.92 + 0.008963 – 0.000 001 64T2 H2 N2 O2 CO NO H2O CO2 SO2 SO3 HCl C2H6 CH4 C2H4 Cl2 Aire NH3 TABLA 4.3 Capacidades caloríficas medias a presión constante de gases entre 25 y T ºC, cal/ºK.mol T, ºC H2 N2 CO 25 100 200 300 400 500 600 700 800 900 1 000 1 100 1 200 1 300 1 400 6.894 6.924 6.957 6.970 6.982 6.995 7.011 7.032 7.060 7.076 7.128 7.169 7.209 7.252 7.288 6.961 6.972 6.996 7.036 7.089 7.159 7.229 7.298 7.369 7.443 7.507 7.574 7.635 7.692 7.738 6.965 6.983 7.017 7.070 7.136 7.210 7.289 7.365 7.443 7.521 7.587 7.653 7.714 7.772 7.818 AIRE 6.972 6.996 7.021 7.073 7.152 7.225 7.299 7.374 7.447 7.520 7.593 7.660 7.719 7.778 7.824 O2 H2O CO2 CH4 SO2 7.017 7.083 7.181 7.293 7.406 7.515 7.616 7.706 7.792 7.874 7.941 8.009 8.068 8.123 8.166 8.024 8.084 8.177 8.215 8.409 8.539 8.678 8.816 8.953 9.109 9.246 9.389 9.524 9.66 9.77 8.884 9.251 9.701 10.108 10.462 10.776 11.053 11.303 11.53 11.74 11.92 12.10 12.25 12.39 12.50 8.55 8.98 9.62 10.29 10.97 11.65 12.27 12.90 13.48 14.04 14.56 15.04 15.49 9.54 9.85 10.25 10.62 10.94 11.22 11.45 11.66 11.84 12.01 12.15 12.28 12.39 Ejemplo 4.1: Cual es la cantidad de energía contenida en: a) 500 g de SnO2 a 700 ºC? b) 300 moles de aluminio a 750 ºC?. - 45 - C2H4 10.45 11.35 12.53 13.65 14.67 15.60 16.45 17.22 17.95 18.63 19.23 19.81 20.33 C2H6 12.63 13.76 15.27 16.72 18.11 19.39 20.58 21.68 22.72 23.69 24.56 25.40 26.15 c) 2.5 m3 de aire a 1.2 atm y precalentado a 90 ºC?. Solución: a) En la tabla 4.1 se tiene el calor específico a presión constante del SnO2: Cp = 13.94 + 0.00565T – 252000/T2 cal/ºK.mol Las unidades de Cp están en cal, moles y ºK, y el primer paso para resolver el problema es transformar los datos a estas unidades. El peso molecular de este óxido es 150.7 g/mol, y el número de moles contenidos en los 500 g es 500/150.7 = 3.318 moles. T = 273 + 700 = 973 ºK Q’ = m . Cp . T Q’ = 3.318 x (13.94 + 0.00565 x 973 – 252 000 / 9732) x 973 Q’ = 61 893 cal = 61. 89 kcal = 258.9 kJ b) La temperatura de fusión del aluminio es de 660 ºC, y por tanto a los 750 ºC del problema, se encuentra al estado líquido. De la tabla 4.1 se obtiene: Cp = 7.00 cal/ºK.mol T = 273 + 750 = 1023 ºK Q’ = m . Cp. T Q’ = 300 x 7.00 x 1023 Q ‘= 2 148 300 cal = 2 148 Mcal = 8.99 MJ c) De la Ley General de los gases PV = nRT se tiene: n 1.2 x 2 500 P.V 100.78 moles R.T 0.082 x (273 90) De la tabla 4.2 se obtiene Cp = 6.836 + 0.001762T – 0.000 000 2656T2 cal/ºK.mol Q’ = m. Cp . T Q’ = 100.78 x (6.836 + 0.001762 x 363 – 0.000 000 2656 x 3632) x 363 Q’ = 272 201 cal = 0.272 Mcal = 1.14 MJ Ejemplo 4.2: Cual es la cantidad de calor necesaria para calentar 100 kg de aluminio desde 20 ºC hasta 500 ºC?. Solución: A esta temperatura el aluminio se encuentra al estado sólido. De la tabla 4.1 se obtiene: Cp = 4.80 + 0.00322T cal/ºK.mol El peso molecular del aluminio es 27 gr/mol, y el número de moles en los 100 kg es de 100000/27 = 3 703.7 moles To = 20 ºC = 20 + 273 = 293 ºK Tf = 500 ºC = 500 + 273 = 773 ºK - 46 - Tf Q m. C P dT To 773 Q 3 703.7 (4.80 0.00322T) dT 293 Q = 3 703.7 [4.80 x (773 – 293) + 0.00161 x (7732 – 2932)] Q = 11 584 433 cal = 11.58 Mcal = 48.45 MJ Ejemplo 4.3: Se queman 10 m3N de metano con 15% de exceso de aire en una cámara de combustión, de la cual los gases salen a la atmósfera a 500 ºC. Calcular: a) El calor que es arrastrado fuera de la cámara por los gases formados en la combustión. b) El calor que queda en la cámara de combustión. Solución: a) La reacción de combustión del metano es: CH4 + 2 O2 CO2 + 2 H2O El aire seco teórico para esta combustión es: 2 x 10 / 0.21 = 95.23 m3N El aire en exceso es por tanto: 0.15 x 95,23 = 14.29 m3N El número de moles de los gases de combustión es: CO2 H2O O2 N2 10 / 22.4 2 x 10 / 22.4 14.29 x 0.21 / 22.4 (95.23 + 14.29) x 0.79 / 22.4 0.446 kmoles 0.892 kmoles 0.134 kmoles 3.863 kmoles El cálculo del calor arrastrado por los gases de combustión, es más simple utilizando los datos de la tabla 4.3, y tomando en cuenta que el calor acumulado en la mezcla de gases es igual a: Q m j . Cp j T Q(CO2) 0.446 x 10.776 x 773 Q(H2O) 0.892 x 8.539 x 773 Q(O2) 0.134 x 7.515 x 773 Q (N2) 3.863 x 7.159 x 773 3 711 kcal 5 888 kcal 778 kcal 21 377 kcal Q 31 754kcal b) Se debe aplicar el siguiente balance de calor: Calor generado por la combustión del = metano Calor retenido en la cámara de combustión + Calor arrastrado fuera de la cámara por los gases El agua formada por el proceso de combustión, sale de la cámara de combustión en forma de vapor, por esta razón se debe tomar el poder calorífico inferior del metano para el cálculo del calor generado en la combustión (35,807 MJ/m3N). 10 x 35,807 = Calor retenido + 31,754 * 4,184 MJ Calor retenido = 358,07 – 132,85 = 225.21 MJ - 47 - 4.1.2 Calor latente Una sustancia suele experimentar un cambio en su temperatura cuando se transfiere energía entre ésta y sus alrededores. Sin embargo, hay situaciones en las cuales la transferencia de energía no produce un cambio de temperatura. Este es el caso siempre que las características físicas cambian de una forma a otra; tal cambio es comúnmente relacionado a un cambio de fase. Dos cambios de fase comunes son de sólido a líquido (fusión) y de líquido a gas (ebullición); otro es un cambio en la estructura cristalina de un sólido. Todos estos cambios de fase involucran un cambio en la energía interna pero no un cambio en la temperatura. Si se requiere de una cantidad Q de energía para cambiar la fase de una masa m de una sustancia, la proporción HL = Q/m caracteriza una propiedad térmica de dicha sustancia. Puesto que la adición o remoción de energía no da como resultado un cambio de temperatura, a la cantidad HL se le llama calor latente (literalmente, el calor “oculto”) de la sustancia. El valor de HL para una sustancia depende de la naturaleza del cambio de fase, así como de las propiedades de la sustancia. A partir de la definición de calor latente, se encuentra que la energía necesaria para cambiar la fase de una masa m de una sustancia pura es: Q = m.HL TEMPERATURA Calor latente de fusión Hf es el término utilizado cuando el cambio de fase es de sólido a líquido, y calor latente de vaporización Hvap se emplea cuando el cambio de fase es de líquido a gas. Temperatura de cambio de fase Temperatura de cambio de fase Calor sensible Calor latente Calor Calor latente sencible Calor sensible ENERGIA Figura 4.1 Energía necesaria para el calentamiento de una sustancia que presenta cambios de fase. - 48 - TABLA 4.4 Calores de fusión y vaporización de elementos y compuestos inorgánicos. SUSTANCIA PUNTO DE FUSIÓN, °C CALOR DE FUSIÓN cal/mol Al Sb Sb4O6 Bi Bi2O3 CaCO3 CaO CaO.Al2O3.2SiO2 CaO.SiO2 Cu Cu2O CuO Cu2S Au H2O Fe FeO FeS Pb PbO PbS PbSO4 SiO2, cuarzo SiO2, cristobalita Ag Ag2S Na2CO3 Na2S Na2SiO3 Na2Si2O3 Sn4 CaAl2Si2O8 (Anortita) CaSiO8 (wollastonita) Fe2SiO4 (fayalita) 660 630.5 655 271.3 817 1 282 2 707 1 550 1 512 1 083 1 230 1 447 1 127 1 063 0.0 1 530 1 380 1 195 327.4 890 1 114 1 087 1 470 1 700 960.5 842 854 920 1 087 884 231.8 2 550 4 770 27 000 2 505 6 800 12700 12 240 29 400 13 400 3 110 13 400 2 820 5 500 3 030 1 463 3 5607 7 700 5 000 1 224 2 820 4 150 9 600 3 400 2 100 2 700 3 360 7 000 1 200 10 300 8 460 1 720 100 cal/g 100 cal/g 85 cal/g - 49 - PUNTO DE EBULLICIÓN °C CALOR DE VAPORIZACIÓN cal/mol 2 057 1 440 1 425 1 420 61 020 46 670 17 820 2 905 72 810 2 966 100.0 2 735 81 800 9 729 84 500 1 744 1 472 1 281 42 060 51 310 50 000 2 230 2 212 60 720 2 270 68 000 Ejemplo 4.4 Cuanto de calor se debe añadir a 1 kg de cobre sólido que se encuentra a 1 083 ºC para pasarlo al estado líquido?. Solución: De la tabla 4.4 se obtienen los siguientes datos para el cobre: Punto de fusión: 1 083 ºC Calor de fusión: 3 110 cal/mol El peso molecular del cobre es 63.54 g/mol, por tanto, el número de moles que hay en un kilogramo de cobre es 1000 / 63.54 = 15.74 moles. Qf = m x Hf Qf = 15.74 x 3 110 = 48 951 cal = 48.95 kcal = 204.8 kJ Ejemplo 4.5 Una pequeña fundición artesanal, tiene un horno de crisol para fundir el aluminio que utiliza en la fabricación de lápidas. Para fundir el metal utiliza un horno de crisol calentado por carbón, que le permite elevar la temperatura del aluminio hasta 800 ºC, temperatura a la que se vacía el metal a los moldes de arena. Calcular el peso de carbón (Qi = 6 300 cal/g) que se necesita para fundir 10 kg de aluminio, si se utiliza sólo el 20% del calor generado por la combustión en el calentamiento y fusión del aluminio, y realice una gráfica calor – temperatura para el proceso. Solución: En este problema, el aluminio sólido es cargado al horno a temperatura ambiente y calentado hasta la temperatura de fusión, pasado al estado líquido a esta temperatura, y el aluminio líquido calentado desde el punto de fusión hasta 800 ºC. De la tabla 4.4 se obtienen los siguientes datos para el aluminio: Punto de fusión: 660 ºC Calor de fusión: 2 250 cal/mol De la tabla 4.1 se obtienen las siguientes capacidades caloríficas Cp (aluminio sólido) Cp (aluminio líquido) 4.80 + 0.00322T cal/ºK.mol 7.00 cal/ºK.mol El calor necesario para calentar el aluminio desde la temperatura ambiente hasta 800 ºC es la suma de los siguientes calores. Calentamiento del aluminio sólido Q(20 660 ºC) = 933 m . Cp(Al sólido ) dT 273 Calor para fundir el aluminio Qf = m.Hf Calentamiento del aluminio líquido Q(660 800 ºC) = 1073 m . Cp (Al 933 QTotal = 933 1073 273 933 m . Cp(Alsólido ) dT + m.Hf + m . Cp (Al - 50 - líquido )dT líquido )dT 933 Q Total m 1073 (4.80 0.00322T) dT 2 550 x m m 273 7,0 dT 933 Qtotal = m [4.80 (933 – 273) + 0.00161 (9332 – 2732)] + 2 550 m + m [7 (1073 – 933)] El peso molecular del aluminio es de 27 g/mol, por tanto en los 10 kg existen 10 000/27 = 370.4 moles de este metal. QTotal = 1 648 093 + 944 520 + 362 992 cal = 2 955 605 cal El peso de carbón se calcula a partir de la relación: Peso de C = Q Total 2 955605 469.1 g Q i del carbón 6 300 El peso requerido de carbón, tomando en cuenta el rendimiento del horno es: Peso total de carbón = 469 .1 x 100 = 2 346 gr 20 3 2,5 Q, Mcal 2 1,5 1 0,5 0 0 200 400 600 800 Temperatura, ºC Figura 4.2 Cantidad de calor requerido para el calentamiento a 800 ºC de 10 kg de aluminio puro. - 51 - 4.1.3 Calores de formación y de reacción El calor de formación de un compuesto (HF) es el calor que debe ser añadido al sistema cuando un mol del compuesto es formado a la temperatura de interés y una atmósfera de presión a partir de elementos puros. El calor de reacción (HR) es el calor generado o absorbido por el sistema debido a cualquier reacción química dentro del sistema. El calor de reacción es dado usualmente por mol de un producto formado o reactivo consumido. Dado que la entalpía es una propiedad de estado, el cambio de entalpía para una reacción es igual a la entalpía en el estado final menos la entalpía en el sistema inicial del sistema. Para la reacción: aA + bB cC + dD el estado final es c moles de C y d moles de D, y el estado inicial es a moles de A y B moles de B. El calor de reacción es igual a: HR’ = c Hc + d HD – (a HA + b HB) Para la misma reacción, el calor de reacción por mol de C es igual a: H R H C d a b HD ( HA HB ) c c c Para el caso especial de la reacción de formación: HR = HF = HProducto - n H i i elementos TABLA 4.5 Calor de las reacciones metalúrgicas de tostación de sulfuros, en kcal/mol.g. REACCIÓN 600 °C 800 °C -398.00 -396.80 -99.63 -99.47 2 Sb2S3 + 9 O2 = Sb4O6 + 6 SO2 -722.60 -728.10 ZnS + 1.O2 = ZnO + SO2 -107.16 -107.20 ZnS + 2 O2 = ZnSO4 -186.10 -180.10 -77.50 -73.12 PbS + 2 O2 = PbSO4 -195.46 -193.12 PbO + SO2 + 0.5 O2 = PbSO4 - 95.82 -93.67 Cu2S + 3 O2 + SO2 = 2 CuSO4 -275.48 -272.33 2 FeS2 + 5.5 O2 = Fe2O3 + 4 SO2 PbS + 1.5 O2 = PbO + SO2 ZnO + SO2 + 0.5 O2 = ZnSO4 - 52 - TABLA 4.6 Calor de las reacciones de reducción carbotérmica de óxidos, a 1200 ºC kcal/mol.g REACCIÓN + 39.40 + 1.99 - 22.86 + 56.92 - 43.36 - 3.00 C + CO2 = 2 CO SnO2 + 2 CO = Sn + 2CO2 PbO + CO = Pb + CO2 ZnO + C = Zn + CO Sb2O3 + 3 CO = 2 Sb + 3 CO2 Fe2O3 + CO = 2 FeO + CO2 TABLA 4.7 Calor de las reacciones de formación de escorias, a 1200 ºC kcal/mol.g REACCIÓN - 2 FeO + SiO2 = 2FeO*SiO2 FeO + SiO2 = FeO*SiO2 CaO + SiO2 = CaO*SiO2 2 CaO + SiO2 = 2CaO¨SiO2 CaO + Al2O3 = CaO*Al2O3 CaO + 2Al2O3 = CaO*2Al2O3 CaO + Al2O3 + 2 SiO2 = CaO*Al2O3*2SiO2 6.91 2.76 - 21.98 - 28.16 - 5.29 - 12.08 - 22.85 Ejemplo 4.6 El calor de formación del dióxido de uranio (UO2) es –259 200 cal/mol a 298 ºK. Cual es la entalpía del UO2 a 298 ºK Solución: Para el cálculo, se debe usar la expresión: HR = HF = HProducto - n H i i elementos que para la reacción U + O2 UO2 toma la forma: HF = HUO2 – (HU + HO2) A 298 ºK, las entalpías del uranio y el oxígeno puro son por convención, iguales a cero. Así: HF = HUO2 = - 259 200 cal/mol La entalpía de un compuesto es igual al calor de formación únicamente a 298 ºK, debido a que a ésta única temperatura la entalpía de los elementos es igual a cero. Ejemplo 4.7 Las entalpías del hidrógeno (H2), monóxido de carbono (CO), metano (CH4) y agua a 500 ºK son 1 406, - 24 998, -15 910 y –56 143, respectivamente. Cual es el calor de reacción a 500 ºK para: CO + 3 H2 CH4 + H2O - 53 - Solución: Para esta reacción, la entalpía de los productos es CH4 + H2O, y de los reactantes CO + 3 H2, y HR = (HCH4 + HH2O) – (HCO + 3HH2) (- 15 910) + (-56 143) – [(-24 998) + 3(1 406)] - 51 273 cal Este calor es por mol de CO consumido. El calor de reacción por mol de hidrógeno consumido es igual a –51 273/3 = - 17 091 cal/mol de H2. Ejemplo 4.8 En los hornos reverbero de la E. M. Vinto, se obtiene estaño metálico por reducción carbotérmica de la casiterita (SnO2) a 1 200 ºC de acuerdo a la reacción: SnO2 + 2 CO Sn + 2 CO2 Calcular la cantidad de calor que se necesita para que la casiterita se reduzca a estaño y produzca una tonelada de metal a esta temperatura. Solución: De la tabla 4.6, se obtiene el calor de reacción para la obtención de estaño metálico a 1200 ºC de 1.99 kcal/mol de Sn. El peso molecular del Sn es 119 g/mol. El número de moles en una tonelada de metal es 106/119 = 8 403.4 moles. El calor necesario es por tanto: HR = 1.99 * 8 403.4 = 16 723 kcal/tn Sn = 16.72 Mcal/tn Sn 4.2 4.2.1 Reposición de las pérdidas de calor del horno Pérdidas de calor por las paredes Los aislamientos utilizados en hornos industriales pueden adoptar la forma de pared plana en el cuerpo del horno, de pared cilíndrica en los hornos rotatorios y tuberías, y de pantallas de radiación en los hornos de vacío. Las pérdidas de calor a través de las paredes planas, dependen fundamentalmente de las características de aislamiento de los materiales empleados, mientras que la transmisión de calor se realiza por conducción a través de la pared, y exterior del horno al ambiente. Las pérdidas de calor por conducción a través de una pared plana, se pueden calcular aplicando directamente la ley de Fourier, obteniéndose la siguiente expresión cuando la conductividad térmica se considera constante: T1 Q Q Q pared T2 k.A (T2 T1 ) e e Para una pared compuesta de tres capas de refractario se aplica, en régimen permanente, tomando en cuenta la conducción y la convección de calor, la siguiente expresión: - 54 - Q pared A.(Th Ta ) e eA e 1 1 B C h 1 .k A .k B .k C h 4 en la que: eA, eB, eC son los espesores de las paredes A, B y C, respectivamente kA, kB, kC son las conductividades térmicas de las sustancias A, B y C A, área de la sección transversal de la pared T1 Temperatura de la cara interior de la pared T4 Temperatura de la cara externa de la pared Ta Temperatura del ambiente h1 Coeficiente de convección (global) en el interior del horno. h4 Coeficiente de convección (global) en el exterior del horno T1 Th Q T2 Q Ta T3 e1 e2 e3 T4 Figura 4.3 Transferencia de calor unidimensional a través de una pared compuesta. Los coeficientes de convección h, pueden calcularse a partir de las siguientes ecuaciones empíricas para convección natural en aire en flujo laminar a 1 atmósfera de presión: Paredes verticales: Pared horizontal calentada hacia arriba ó enfriada hacia abajo Pared horizontal calentada hacia abajo ó enfriada hacia arriba Cilindros horizontales En estas ecuaciones, L = metros; y h = 1.37 ( T/L)1/4 W/m2.ºK h = 1.32 ( T/L)1/4 W/m2.ºK h = 0.59( T/L)1/4 W/m2.ºK h = 1.32( T/L)1/4 W/m2.ºK T = ºK. Para calcular las pérdidas de calor por las paredes de un horno rotatorio puede utilizarse la ley de Fourier para tubos cilíndricos concéntricos, como la que se muestra a continuación para el caso de aislamiento con dos capas de refractario. - 55 - Q Pared 2L (Ti To) ln(r2 / r1 ) ln(r3 / r2 ) 1 1 h i r1 kA kB h o r3 T1 r1 r2 TH T2 h1 ho r3 To A B Figura 4.4 Transferencia de calor unidimensional a través de paredes cilíndricas compuestas. TABLA 4.8 Conductividades térmicas de materiales refractarios, en kcal/m.h.ºC MATERIAL Ladrillo de chamota Ladrillo de sílice Sillimanita Ladrillo refractario liviano Ladrillo refractario liviano Ladrillo aislante Ladrillo aislante Ladrillo aislante Ladrillo vermiculita Aluminio Hierro fundido Acero 1.3 %C Cobre Latón Porcelana Crisol de grafito DENSIDAD Kg/m3 1 850 1 850 2 400 775 1 100 1 100 450 700 900 600 2 700 7 600 7 850 8 930 8 500 2 290 TEMPERATURA, ºC 0 0.75 0.75 1.47 0.15 0.31 0.20 0.075 0.132 0.150 0.130 197 43 39 133 96 1.0 200 400 600 800 1000 0.83 0.90 0.98 1.06 1.14 0.88 1.01 1.15 1.27 1.42 1.28 1.41 1.34 1.32 1.30 0.33 0.18 0.21 0.25 0.29 0.52 0.34 0.38 0.41 0.45 0.36 0.22 0.24 0.26 0.30 0.094 0.112 0.129 0.148 0.144 0.156 0.171 0.186 0.162 0.172 0.184 0.196 0.156 0.170 0.193 197 200 40 35 30 39 33 30 320 310 300 115 125 130 - 56 - 1200 1.22 1.57 1.26 Para cálculos técnicos aproximados, se puede estimar las pérdidas de calor a través de las paredes del horno utilizando la fórmula de Fishendon y Saunders, para ambientes en calma, temperatura ambiente de 20 ºC y emisividad de la pared de 0.9.: T 273 4 20 273 4 Pp k(Tp 20)1.25 5.67 e p 100 100 En la que: Pp Pérdidas de calor por m2 de área de pared, W/m2 Temperatura de la cara externa de la pared, ºC Tp k Coeficiente de proporcionalidad, que toma los siguientes valores: 2.71 para pared horizontal hacia arriba 1.36 para pared horizontal hacia abajo 2.09 para pared vertical La condición del problema, es que la temperatura del ladrillo aislante no debe sobrepasar los 1 000 ºC. La mayor temperatura a la que es sometido el ladrillo aislante es en la superficie de contacto refractario – aislante, que en el esquema es T2. Para determinar la temperatura en este punto, se hace uso de la Ley de Fourier: Q LADRILLO REFRACTARIO 1150 ‘C 12 cm Q pared T2 Q T3 14 cm k.A (T2 T1 ) e y aplicando la condición de conservación de flujo de calor en paredes compuestas: QRefractario = QAislante = Qordinario k refractario (T1 T2 ) k aislante (T2 T3 ) k ordinario (T3 T4 ) e refractario e aislante e ordinario - 57 - LADRILLO ORDINARIO El esquema muestra la disposición de la pared compuesta, y las temperaturas en cada una de las capas de ladrillo. LADRILLO AISLANTE Ejemplo 4.9 Para la construcción de las paredes de un horno se propone el empleo de tres capas de distintos materiales dispuestas en serie del modo siguiente: 1º, una capa interior de 12 cm de espesor de ladrillo refractario (k = 1.30 Kcal/m.h.ºC); 2º, una capa intermedia de 14 cm de espesor de ladrillo aislante (k 0 o.15 Kcal/m.h.ºC), y 3º, una capa exterior de 12 cm de espesor de ladrillo ordinario (k = 0.60 Kcal/m.h.ºC). La temperatura interna del refractario estará a 1 150 ºC, y la superficie externa del ladrillo ordinario se hallará expuesta a la atmósfera y se desea que su temperatura sea de unos 60 ºC. Como el ladrillo aislante que nos proponemos emplear no resiste temperaturas superiores a los 1 000 ºC, nos interesa saber la temperatura máxima a que quedará sometido para informar si es conveniente su empleo en las condiciones indicadas. En caso de no ser así, calcúlese el espesor el espesor que habrá de tener el refractario para que el aislante quede por debajo de los 1 000 ºC. Calcúlese también las pérdidas de calor por metro cuadrado de pared de horno sólo por conducción. Solución: 16 cm Ta 16 ‘C 60 ‘C 1.3 (1 150 T2 ) 0.15 (T2 T3 ) 0.60 (T3 60) 0.14 0.12 0.12 Resolviendo el sistema de ecuaciones se obtiene: T2 = 1 068.9 ºC El valor de la temperatura T2 es mayor que los 1 000 ºC que puede soportar el ladrillo aislante. Por tanto, se debe dimensionar nuevamente el espesor mínimo que debe tener el ladrillo refractario para que la temperatura intercara refractario – aislante tenga el valor de 1 000 ºC. El flujo de calor a través de las paredes en las condiciones del problema, por m2 de pared es: Qpared = Q refractario 1.3 (1 150 1 068.9) = 878.6 kcal/h 0.12 Despejando de la ecuación de Fourier el espesor de la pared y asignando a T2 el valor de 1 000 ºC (temperatura máxima que puede soportar el ladrillo aislante), se tiene: e refractario 1.3 (1150 1000) 0.22 metros 876.8 erefractario = 22 cm Ejemplo 4.10 Utilizando los datos del problema anterior, calcule el coeficiente global de transmisión de calor pared – ambiente (radiación + convección) si la temperatura del aire es de 16 ºC. Solución: La ecuación de transmisión de calor que debe usarse es: Q = h’ A (Tp – Ta) De la cual se obtiene h Q A.(Tpared Ta ) 878.6 1 x (60 16) h’ = 19.97 Kcal/h.m2.ºC 4.2.2 Pérdidas por calor almacenado en el revestimiento En hornos de funcionamiento intermitente, por ejemplo recocido de barras de acero en hornos de carro, puede ser más importante el calor almacenado en el revestimiento, que se pierde en cada tratamiento, que el calor perdido por conducción a través de las paredes. En hornos de funcionamiento continuo, pero con variaciones en la temperatura de trabajo, puede ser también importante la pérdida de calor almacenado al enfriar el horno hasta una temperatura menor de trabajo. El cálculo del calor almacenado es muy sencillo una vez determinadas las temperaturas de las diferentes capas. Tomando como origen la temperatura ambiente, para una pared compuesta por tres capas, como se muestra en la figura 4.3, el calor almacenado se calcula por la expresión: - 58 - T T T T T T Qalmacenado 1.e1.Cp1 1 2 Ta 2 .e 2 .Cp 2 2 3 Ta 3 .e3 .Cp3 3 4 Ta 2 2 2 kcal/m2 donde: e1, e2, e3 : Cp1, Cp2, Cp3: 1, 2, 3: 4.2.3 Espesores de pared en metros Calores específicos en kcal/kg.ºC Densidades en kg/m3 Pérdidas de calor por aberturas Dentro del concepto de aberturas en los hornos se incluyen las puertas principales de carga y descarga, las puertas auxiliares de inspección, los dinteles de separación entre zonas de diferentes temperaturas, las ranuras entre dinteles y puerta, las ranuras longitudinales y transversales de vigas, las juntas de arena y agua en hornos de solera giratoria, las salidas de humo en los hornos de llamas, etc. Las pérdidas de calor correspondientes pueden ser más importantes que las de conducción a través de las paredes y dan lugar a un deterioro prematuro de los dinteles, puertas, juntas, etc., con los dispositivos mecanismos anexos. 4.2.3.1 Pérdidas por radiación La figura 4.6, muestra un esquema de una abertura 1-1 en la pared del horno. Los ojos de un observador situado frente a la abertura (3) pueden ver el interior del horno, como si el interior fuera una superficie plana, o "diafragma" localizada en 1-1 y teniendo una magnitud 1-1. Si el grosor de la pared fuese infinitamente delgado, el diafragma podría verse de cualquier punto situado a la derecha de 1-1. El problema se reduciría entonces a encontrar la radiación de un diafragma libremente expuesto, por el uso de la figura 4.6, que muestra la radiación del cuerpo negro por m2 de orificio para diferentes temperaturas del horno. 1 2 3 2 1 Figura 4.5 Diagrama ilustrando la radiación de calor por aberturas en las paredes - 59 - El espesor finito de la pared, sin embargo, cambia estas condiciones debido a que obstruye la radiación directa en una magnitud que depende del radio espesor de la pared / ancho del orificio. Por otro lado, los lados del orificio se calientan por la radiación que ellos reciben y reirradian una porción de este calor al exterior. La re-irradiación compensa parcialmente la reducción de radiación directa. Por tanto, cuando la radiación se produce a través de un dintel o puerta con un determinado espesor de pared, debe introducirse un factor de corrección (factor de forma) que depende del tipo de abertura y sus dimensiones. Se determina mediante la figura 4.7. Figura 4.6 Radiación de cuerpo negro = Figura 4.7. Pérdidas por radiación de aberturas. - 60 - D E Ejemplo 4.11 La pared frontal de un horno ha sido construida con ladrillos de 15 cm de ancho, tiene una ventanilla de observación de 6.5 x 12 cm cuando está abierta. La temperatura del horno es de 1 200 ºC. ¿Cuánto calor escapa a través de la ventanilla por radiación?. Solución: De la figura 4.7, se obtiene que la energía perdida por radiación a través de la ventanilla por m2 de sección para la temperatura de 1200 ºC es de 260 kW/m2. El área de irradiación de calor (diafragma equivalente): 6.5 x 12 = 78 cm2 = 0.0078 m2. Q’radiación = 260 x 0.0078 = 2.03 kW Q’radiación = 2.03 kW x 859.824 Radio = kcal / h = 1745 kcal/h kW D 6 .5 0.43 E 15 Relación de lados del rectángulo (diafragma equivalente) = 12 1.8 6. 5 De la figura 4.8 levantando una vertical desde la relación D/E = 0.43 e interceptando con la línea para aberturas rectangulares 2/1 se obtiene el valor del factor de 0.41, y por tanto, las pérdidas por radiación son: Qradiación = 1745 x o.41 = 715.6 kcal/h 4.2.3.2 Pérdidas por juntas de arena, aceite y agua Se emplean las juntas de arena en hornos de carro, de solera móvil y solera giratoria, principalmente. La figura 4.8 da los valores medios de las pérdidas de calor por metro de longitud de junta. La sustitución de la arena por agua o aceite no aumenta los valores calculados con el uso de esta figura, ya que se suele disponer la junta con un cierto quiebro o laberinto. Figura 4.8 Pérdidas de calor por juntas de arena - 61 - 4.2.4. Pérdidas de calor por agua de refrigeración Es muy frecuente en los hornos refrigerar por agua determinados elementos para mantener una temperatura baja, protegiéndolos, a veces, de la acción directa de las llamas o de la temperatura. Citemos entre ellos: - En hornos de arco: paneles de cuba y bóveda, mordazas, tubos cortacorrientes y cables, puentes y dinteles. - Soleras y paredes en hornos de reverbero. - En hornos de recalentar de calentamiento superior e inferior: carriles y vigas, tubos verticales y transversales, dinteles y puertas, deshornadoras y rodillos de carga. - En hornos de tratamientos térmicos: ejes de ventiladores, juntas de goma y aceite, rodillos de descarga, etc. En un horno existente el método más exacto para determinar las pérdidas de calor por los elementos refrigerados, es medir simplemente los caudales de cada uno de los circuitos de refrigeración y las temperaturas de entrada y salida del agua en las distintas condiciones de trabajo del horno. 4.2.5 Pérdidas de calor por infiltración de aire Cuando la presión en el interior de horno es inferior a la del exterior al mismo nivel, se producirá una infiltración de aire. El calor requerido para calentar el aire hasta la temperatura del horno es energía perdida. Sin embargo, aunque a nivel de solera la presión en el interior y en el exterior sean idénticas, a nivel de la bóveda la presión en el interior del horno será superior a la del exterior, por lo que se producirá un escape de gases o aire en dicha zona, con la consiguiente entrada de aire a nivel inferior. Esta diferencia de presión positiva entre el interior y exterior es del orden de 9 Pa (0.9 mm H2O) por cada metro de elevación a 975 ºC. La presencia de un orificio, abertura, ranura, etc., en una zona en depresión crea una entrada de aire, si existe una posibilidad de salida del aire o gases calientes a nivel superior. Este fenómeno se presenta frecuentemente: una puerta que apoya mal sobre el dintel o el marco, una junta de cubierta o campana en mal estado, una mirilla mal cerrada, entradas de termopar, etc. El cálculo del calor perdido por infiltración de aire puede realizarse del modo siguiente: - El caudal de aire infiltrado es: q h Sa x - 2.(Pe Pi ) a El calor perdido para calentar el aire infiltrado es: Q aire q h . a .Cp aire (Ti Te) donde: qh Sa Pe Pi a Cpaire Ti Caudal infiltrado, m3/s Sección de los orificios, m2 Presión exterior, kg/ms2 (1 mm H2O = 10 kg/ms2) Presión interior, kg/ms2 Densidad del aire, kg/m3 Capacidad calorífica del aire, kJ/kg.ºC Temperatura interior el horno, ºC - 62 - kWh Te Temperatura exterior del horno, ºC Referencias 1. McCabe, W.; Smith, J; Harriott, P., “Operaciones Unitarias en Ingeniería Química”; McGaw Hill, Sexta Edición, Mexico, 2002. 1. Reinhardt Schumann; “Ingeniería Metalúrgica”, Tomo I, capítulo IV. 2. Perry, R., Green, D., Maloney, J.; “Manual del Ingeniero Químico”, sexta edición, McGraw Hill, Méjico, 2001. 3. Kasantev, E. I.; “Industrial Furnaces”, Mir Publishers, Moscú, 1977. 4. Baukal, Ch.; “Heat Transfer in Industrial Combustion”; CRC Press, Estados Unidos, 2000. 5. Himmelblau, D. M.; “Principios básicos y cálculos en ingeniería química”, Sexta Edición, Prentice Hall, Méjico, 1997. 6. Butts, Allison, “Problemas Metalúrgicos Resueltos”, Traducción de Edwin J. Urday. Primera Edición, Lima – Perú, 1982. 7. Eastop, T., D.; Croft, D. R., “Energy Efficiency”, Longman Group Ltda., USA, 1990. 8. Urday, E., “Evaluación de Procesos Metalúrgicos”, Editorial Ciencias, Lima – Perú, 1986. 9. Geankoplis, C. G., “Procesos de Transporte y Operaciones Unitarias”, Tercera Edición, CECSA, México, 1998. 10. Ocon Tojo; “Problemas de Ingeniería Química”, Colección Ciencia y Tecnología, Aguilar, Madrid, 1974. 11. Mills, A. F., “Transferencia de Calor”, McGraw-Hill, Colombia, 1999. 12. Astigarraga U., J., “Hornos Industriales de resistencias”; McGraw Hill, España, 1994. 13. Hinojosa, O.; “Estudio térmico de un horno de fabricación de ladrillo artesanal para sugerir cambio de combustible a gas natural”, Tesis de grado, FNI – UTO, Oruro, 2003. 14. Incropera F.; De With D., “Fundamentos de Transferencia de Calor”; Cuarta Edición, Pearson Prentice Hall, Mexico, 1996. 15. Trinks, W., Mawhinne, M., H.; “Hornos Industriales”, Quinta Edición, John Wyley y Sohn, Inc; New York, 1961. 16. Kuvachesvsky, E. L., Evans y Alcock, C. B., “Metallurgical Thermodynamics”, Pergamosn Press; New York, 1967. - 63 -