COLEGIO LAMATEPEC Ciencia, Salud y Medio Ambiente Octavo grado
Anuncio

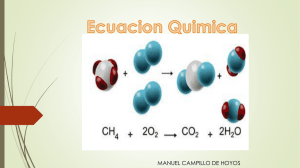
COLEGIO LAMATEPEC GUIA DE ESTUDIO Nº 1 2014-2015 Ciencia, Salud y Medio Ambiente Octavo grado Prof. Roberto Morán M. Tema: Reacciones Químicas PERIODO Nº 3 Unidad 4. Transformaciones químicas de la materia. Objetivo: Que el estudiante defina e identifique algunas reacciones químicas presentes en la vida cotidiana. I. Marco teórico: Las reacciones químicas son procesos que transforman una o más substancias llamadas reactivos en otras substancias llamadas productos. Los productos obtenidos dependen de las condiciones bajo las cuales se dan las reacciones. Tipo de reacciones químicas: 1- Reacciones de Síntesis o Adición Las reacciones de síntesis o adición son aquellas donde las substancias se juntan formando una única sustancia. A + B —– > AB Ejemplos : Fe + S —– > FeS 2 H2 + O2 —– > 2 H2O H2O + CO2—– > H2CO3 2- Reacciones de Análisis o Descomposición Las reacciones de análisis o descomposición son lo opuesto de las reacciones de síntesis, o sea, un reactivo da origen a productos más simples que él. AB —– > A + B Ejemplos: 2 H2O 2 H2 + O 2 2 H2O2 2 H2O + O2 3- Reacciones de Desplazamiento Las reacciones de desplazamiento o de sustitución simple merecen un poco más de atención que las anteriores. En su forma genérica la reacción puede ser escrita como: AB + C —– > A + CB En la reacción de desplazamiento el proceso es idéntico: C ve a B ligado a A, se aroxima y siendo más fuerte, desplaza A y asume la ligación con B. En caso que C no sea más fuerte que A, nada sucederá. Bastará entonces saber quien es más fuerte que quien. Au<Ag<Cu<H<Pb<Sn<Ni<Fe<Cr<Zn<Al<Mg<Na<Ca<K<Li Metales nobles < hidrogeno < metales De esta forma, tenemos: 2Na + 2 H2O —– > 2NaOH + H2 (el sodio desplaza al hidrógeno del agua H-OH) Au + HCl —– > no reacciona (el oro no consigue desplazar al hidrógeno) 4- Reacciones de Doble Sustitución Son también muy simples, pero debemos quedar atentos a los detalles. El mecanismo es fácil: AB + CD —– > AD + CB Ciertamente ya habrá podido ver lo que sucede. A cambió de lugar con C. La diferencia de este tipo de reacción con el desplazamiento, es que ni A ni C estaban solos y en ambos casos ninguno de ellos quedó solo luego de la sustitución. Para entender como es cuando una reacción de este tipo ocurre, tendremos que observar lo siguiente: La substancia AB esta en solución y de esta forma lo que tenemos en verdad son los iones A+ y B- separados unos de los otros. La substancia CD también está en solución, por tanto tenemos también los iones C+ y D- separados. Cuando juntamos las dos soluciones estamos promoviendo una gran mezcla entre los iones A+, B-, C+ y D-, formando una gran “sopa de iones”. Si al combinar C+ con B-, el compuesto CB fuera soluble, los iones serán nuevamente separados en C+ y B-, resultando exactamente en la misma cosa que teníamos anteriormente. Lo mismo sucede con A+ y BAsí, al mezclar AB con CD, estamos en verdad haciendo: (A+ ) + (B- ) + (C+ ) + (D- ) II. Actividad Personal. Resolver los siguientes planteamientos: 1. Clasifique las siguientes reacciones como uno de los cinco tipos de reacciones descritos. a. 2 H2 + O2 2 H2O __________________________________ b. H2CO3 + 2 Na Na2CO3 + H2 __________________________________ c. Ba(OH)2 H2O + BaO __________________________________ d. Ca(OH)2 + 2 HCl 2 H2O + CaCl2 _________________________________ e. CH4 + 2 O2 CO2 + 2 H2O _________________________________ f. 2 Na + Cl2 2 NaCl __________________________________ g. Cl2 + 2 LiBr 2 LiCl + Br2 __________________________________ 2. ¿Cuál de las siguientes ecuaciones representa la descomposición del cloruro de potasio? a. K + Cl KCl b. 2 KCl + F2 2 KF + Cl2 c. KCl K + Cl d. 2 KCl 2 K + Cl2 e. 2 KCl K2 + Cl2 f. Ninguna de las anteriores 3. ¿Cuál de las siguientes ecuaciones representa una reacción de neutralización? a. b. c. d. e. 2 K + 2 HCl 2 KCl + H2 KOH + HNO3 KNO3 + H2O K2SO4 + 2 NaOH Na2SO4 + 2 KOH Ca(OH)2 H2O + CaO Ninguna de las anteriores 4. Complete las siguientes reacciones adecuadamente y clasifíquelas. a. CaO b. Na + F2 c. Al + Mg(NO3)2 d. HClO + LiOH e. C2H5OH + O2 f. HNO3 + Ca g. BaCl2 + Na2SO4 5. Investigar y definir los tipos de reacción de combustión y de neutralización, así como dar 3 ejemplos de cada tipo: a) Reacciones de Combustión:_______________________________________________ 1) 2) 3) b) Reacciones de Neutralización: _____________________________________________ 1) 2) 3)