MANUEL CAMPILLO DE HOYOS
Anuncio
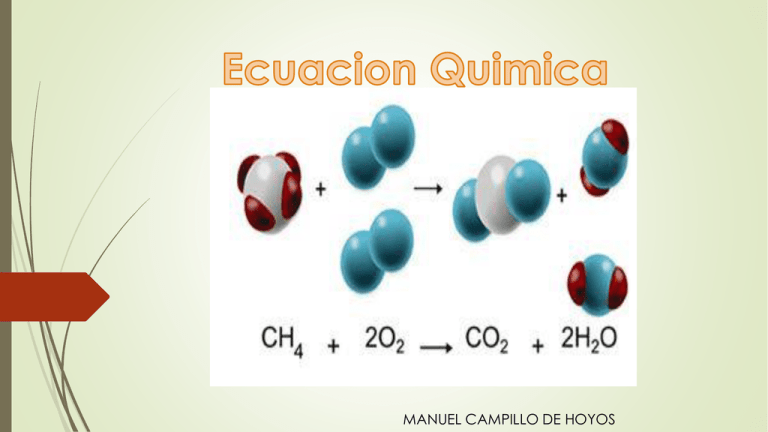
MANUEL CAMPILLO DE HOYOS Sentido de La reacción CARACTERÍSTICAS DE LAS REACCIONES QUÍMICAS A.La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida. B.Durante la reacción se desprende o se absorbe energía: A.Reacción exotérmica: se desprende energía en el curso de la reacción. B. Reacción endotérmica: se absorbe energía durante el curso de la reacción. C.Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta. ECUACIONES QUÍMICAS Una reacción química se representa mediante una ecuación química. Para leer o escribir una ecuación química, se deben seguir las siguientes reglas: •Las fórmulas de los reactivos se escriben a la izquierda, y las de los productos a la derecha, separadas ambas por una flecha que indica el sentido de la reacción. •A cada lado de la reacción, es decir, a derecha y a izquierda de la flecha, debe existir el mismo número de átomos de cada elemento. Cuando una ecuación química cumple esta segunda regla, se dice que está ajustada o equilibrada. Para equilibrar reacciones químicas, se ponen delante de las fórmulas unos números llamados coeficientes, que indican el número relativo de átomos y moléculas que intervienen en la reacción. http://www.youtube.com/watch?feature=player_detailpage&v=gd42eKVg7PQ Factores que afectan a la velocidad de reacción la velocidad de una reacción se ve influida por una serie de factores; entre ellos se pueden destacar: Naturaleza de los reactivos Se ha observado que según los reactivos que intervengan, las reacciones tienen distinta velocidad, pero no se ha podido establecer aún unas reglas generales. Concentración de los reactivos La velocidad de reacción aumenta con la concentración de los reactivos. Para aumentar la concentración de un reactivo: •Si es un gas, se consigue elevando su presión. •Si se encuentra en disolución, se consigue cambiando la relación entre el soluto y el disolvente. . Superficie de contacto de los reactivos Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma. Temperatura En general, la velocidad de una reacción química aumenta conforme se eleva la temperatura Presencia de catalizadores Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador. Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma. Como interpretar una ecuación química Como interpretar la anterior ecuacion Cl2 + Dos atomos(1 mole) 1 molecula H2 2 HCL dos atomos (1 mole) * 1 molecula produce dos moleculas ------------------ 2 moleculas Como interpretar la anterior ecuacion Dos atomos(1 mole) 1 molecula dos atomos (1 mole) * 1 molecula produce dos moleculas ------------------ 2 moleculas 1.Clasifique las siguientes reacciones como uno de los cinco tipos de reacciones descritos. a.2 H2 + O2 à 2 H2O b.H2CO3 + 2 Na à Na2CO3 + H2 c.Ba(OH)2 à H2O + BaO d.Ca(OH)2 + 2 HCl à 2 H2O + CaCl2 e.CH4 + 2 O2 à CO2 + 2 H2O f.2 Na + Cl2 à 2 NaCl g.Cl2 + 2 LiBr à 2 LiCl + Br2 5.Cuál de las siguientes ecuaciones representa la descomposición del cloruro de potasio? a. K + Cl KCl b.2 KCl + F2 2 KF + Cl2 c.KCl K + Cl d.2 KCl 2 K + Cl2 e.2 KCl K2 + Cl2 6.Cuál de las siguientes ecuaciones representa una reacción de neutralización? a. 2 K + 2 HCl 2 KCl + H2 b.KOH + HNO3 KNO3 + H2O c.K2SO4 + 2 NaOH Na2SO4 + 2 KOH d.Ca(OH)2 H2O + CaO 7.Complete las siguientes reacciones adecuadamente y clasifíquelas. a.CaO b.Na + F2 c.Al + Mg(NO3)2 d.HClO + LiOH e.C2H5OH + O2 f.HNO3 + Ca g.BaCl2 + Na2SO4 7.Complete las siguientes reacciones adecuadamente y clasifíquelas. a.CaO à b.Na + F2 à c.Al + Mg(NO3)2 à d.HClO + LiOH à e.C2H5OH + O2 à f.HNO3 + Ca à g.BaCl2 + Na2SO4 à




