Fisicoquimica - Universidad Juárez Autónoma de Tabasco
Anuncio

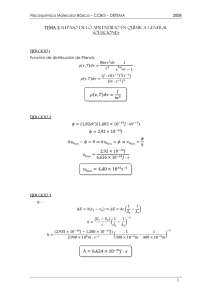
UNIVERSIDAD JUÁREZ AUTONOMA DE TABASCO DIVISIÓN ACADEMICA DE CIENCIAS BIOLÓGICAS NOMBRE DEL PROGRAMA: FISICOQUÍMICA AREA DE FORMACIÓN: SUSTANTIVA PROFESIONAL HORAS A LA SEMANA: TEORICAS : 3 PRACTICAS : 3 CREDITOS: 9 CREDITOS: 9 PRESENTACIÓN El programa de estudio de Fisicoquimica, dentro del mapa curricular de la Licenciatura en Ingeniería Ambiental, forma parte del Area de Formación Sustantiva Profesional. La fisicoquímica es una disciplina donde el Ingeniero Ambiental, aplica los fundamentos de la física y la química con el propósito de proteger la salud y el medio ambiente; para ello debe contar con un buen entendimiento de los principios en que se basan los procesos físicos y químicos que ocurren en la naturaleza. Para alcanzar los objetivos, el programa se ha dividido en cuatro unidades sustanciales: 1) 2) 3) 4) Conceptos básicos de Fisicoquimica Equilibrio químico Cinética química Soluciones Cada una de estas unidades termina con una aplicación práctica de los conocimientos adquiridos, que le permitirán al estudiante analizar y resolver problemas de tipo ambiental. Es necesario recalcar que el buen entendimiento y aplicación práctica del contenido del programa demandan al estudiante las siguientes herramientas : 1) Química general 2) Física 3) Calculo diferencial e integral OBJETIVO GENERAL Conocer y aplicar los conceptos básicos de la fisicoquímica con los cuales el estudiante puede comprender y manipular la rapidez con la que ocurre una reacción, las variables que la afectan, sus mecanismos y los resultados finales o productos de la reacción; con los cuales evaluará el destino y tratamiento de un compuesto. METODOLOGÍA DE TRABAJO Al desarrollar los contenidos de este curso, se utilizarán los métodos y técnicas que faciliten la construcción del conocimiento creativo, colectivo y participativo, mediante el estímulo al trabajo de todas sus capacidades y habilidades intelectuales. Para dar cumplimiento a esta metodología se propone desarrollar las siguientes actividades: • Trabajos individuales y grupales • Elaboración de Resúmenes • Aprendizaje basado en problemas(PBL). El profesor abrirá cada tema con una problemática lo más apegada a la realidad, la cual deberá ser resuelta por los estudiantes una vez brindados los conocimientos necesarios. • Tareas. Investigación extra del tema y ejercicios que permitan a los alumnos la aplicación de los conceptos aprendidos los cuales desarrollarán su habilidad en el manejo de conceptos y en la solución de problemas • Solución de problemas. Durante la sesión de trabajo en forma grupal que permita mejorar la habilidad para aplicar los conceptos teóricos estudiados. CRITERIOS DE EVALUACIÓN Se evaluarán todas aquellas situaciones, actividades y experiencias de aprendizaje donde el estudiante participe en las diferentes sesiones de trabajo. Los criterios de evaluación tomarán en cuenta: Actividades Trabajos de individuales Trabajos grupales Exposiciones del alumno PBL Exámenes Porcentaje(%) 10 10 10 30 40 CONTENIDO DEL PROGRAMA UNIDAD 1: Conceptos básicos de Fisicoquímica Objetivo de la unidad: Manejar y aplicar una serie de conceptos esenciales empleados en la solución de problemas de la fisicoquímica. Contenido: 1.1 Las leyes de los gases 1.2 Mezclas; variables de composición 1.3 Ecuación de estado para una mezcla de gases; ley de Dalton 1.4 Concepto de presión parcial 1.5 Ley de las presiones parciales de Dalton 1.6 Presión de vapor 1.7 Concentración y Métodos para medir concentraciones PRODUCTOS DE APRENDIZAJE - Aplicar las leyes de los gases en la solución de problemas - Dominar los conceptos correspondientes a mezclas de gases - Conocer las magnitudes y unidades de concentración más usuales en los diversos sistemas naturales y de ingeniería RECURSOS DIDACTICOS METODOS DE EVALUACIÓN Bibliografía[ 1,2 ] - Examen -Acetatos -Participación en clases -plumones -Por habilidad en la resolución de problemas -Proyector de acetato -Laminas -Manual de realización de práctica -Material para realizar la práctica( indicado en el manual de práctica) UNIDAD 2: Equilibrio químico Objetivo de la unidad:Aplicar los principios del equilibrio químico para entender los aspectos químicos de los contaminantes de diversos sistemas naturales y artificiales 2.1Calor de reacción 2.2Reacción de formación 2.3 Determinación de los calores de formación 2.4 Secuencia de reacciones; ley de Hess 2.5 Dependencia del calor de reacción con la temperatura 2.6 Equilibrio químico en una mezcla de gases ideales y reales 2.7 Energía libre estándar de formación 2.8 Equilibrio entre gases ideales y fases condensadas puras 2.9 El principio de Le Chatelier-Braun 2.10 Efecto de los gases inertes sobre el equilibrio 2.11 La constante de equilibrio en las reacciones heterogéneas 2.12 Dependencia de la constante de equilibrio con la temperatura 2.13 Constantes de ionización de ácidos y bases débiles 2.14 Producto iónico del agua 2.15 Producto de solubilidad PRODUCTO DE APRENDIZAJE - Calculo del cambio de energía libre en una reacción - Determinación de la dirección en la que procede una reacción - Calculo de constantes de equilibrio - Utilización de la constante de equilibrio en la solución de problemas, como en la determinación de la composición de equilibrio RECURSOS DIDACTICOS METODO DE EVALUACION -Bibliografía[ 1,2 ] -Examen -Acetatos -Participación en clases -Plumones -Por habilidad en la resolución de problemas -Laminas -Proyector de acetatos - Por trabajos de investigación extra del tema UNIDAD 3: Cinética química Objetivo de la unidad: Determinar la rapidez con la que ocurre una reacción, sus mecanismos y manejar las técnicas para determinar el orden de una reacción Contenido: 3.1 Introducción a la cinética química 3.2 Leyes de velocidad 3.3 Reacciones de orden cero 3.4 Reacciones de primer orden 3.5 Reacciones de segundo orden 3.6 Reacciones seudoprimer orden 3.7 Dependencia de la velocidad de la reacción de la temperatura 3.8 Reacciones consecutivas 3.9 Reacciones en solución 3.10 Energía de activación PRODUCTOS DE APRENDIZAJE - Manejo y aplicación de las formas integradas de las tasa de reacción RECURSOS DIDACTICOS EVALUACIÓN DEL APRENDIZAJE - Bibliografía[ 3 ] -Examen -Acetatos -Participación en clases - Calculo de vida media -plumones -Proyector de acetatos - Manejo de técnicas para Determinar el orden de una reacción -Por habilidad en la resolución de problemas UNIDAD 4: Soluciones Objetivo de la unidad: Establecer los principios básicos de las soluciones, conocer sus propiedades, establecer condiciones de equilibrio y las leyes que rigen el equilibrio de las soluciones Contenido: 4.1 Tipos de soluciones 4.2 Equilibrio entre una solución y su fase de vapor 4.3 Presión de vapor de una solución ideal 4.4 Solubilidad de los gases en los líquidos 4.5 Ley de distribución de Nernst 4.6 Equilibrios químicos en solución 4.6 Soluciones no electrolíticas y propiedades coligativas 4.7 Soluciones de los electrolitos y propiedades coligativas 4.8 La teoría de Arrhenius de la disociación electrolítica 4.9 La teoría de las atracciones interionicas de Debye-Huckel PRODUCTOS DE APRENDIZAJE - Aplicación de la ley de Raoult en problemas de equilibrio entre una solución y su vapor - Aplicación de la ley de Henry en la solución de problemas de solubilidad de gases en líquidos - Manejo adecuado de los conceptos de actividad y coeficientes de actividad - Cálculos de descenso de presión de vapor, aumentos del punto de ebullición y descenso del punto de congelación de las soluciones - Manejo de los coeficientes de reparto o de distribución en la solución de problemas prácticos RECURSOS DIDACTICOS EVALUACIÓN DEL APRENDIZAJE -Bibliografía[ 1,2 ] -Examen -Acetatos -plumones -Proyector de acetatos -Laminas -Direcciones Web -Participación en clases -Por habilidad en la resolución de problemas Material Bibliográfico 1. Gilbert W. Castellan. Fisicoquimica. Segunda edición.1987. Adisson –Wesley Iberoamericana. 2. James R. Mihelcic. Fundamentos de Ingeniería Ambiental. Primera edición. 2001. Limusa Wiley. Cap. 2 y 3. 3. Clair N. Sawyer. Perry L. McCarty. Gene F. Parkin. Química para Ingeniería Ambiental. Cuarta edición. Octubre de 2000. McGraw Hill.