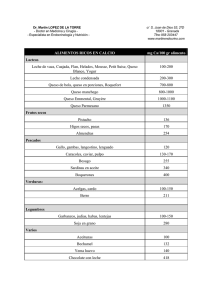
TESIS de Maestría en “Tecnología de los Alimentos” "ESTUDIO DE
Anuncio

TESIS de Maestría en “Tecnología de los Alimentos” "ESTUDIO DE LA VIDA ÚTIL DE QUESO CREMA UTILIZANDO MICROBIOLOGÍA PREDICTIVA" Tesista: Miryam Siciliano Director: Sandra Guerrero Codirector: Stella Alzamora Ciudad Autónoma de Buenos Aires, 2010 A mi marido, Guillermo, por alentarme siempre en mi superación como profesional. A mis hijas,Bárbara y Cecilia, a quienes dediqué principalmente mi vida. A mi nietito, Juani , rey de mi corazón. A mi madre y a la memoria de mi padre. INDICE 1-INTRODUCCIÓN, 2 1.1 Origen del queso, 2 1.2 Producción y consumo nacional e internacional del queso, 3 1.3 Proceso de elaboración del queso, 5 1.3.1 Preparación de la leche, 6 1.3.2 Cuajado, 7 1.3.3 Corte de la cuajada, 7 1.3.4 Moldeado, 8 1.3.5 Prensado, 8 1.3.6 Salado, 9 1.3.7 Madurado, 9 1.3.8 Acabado, 10 1.4 Producción de queso untable sin conservante (sorbato de potasio) efectuada por Danone para el presente estudio, 10 1.5 Variedades de quesos, 13 1.6 Clasificación de quesos, 14 1.7 El queso y la salud, 16 1.8 El queso como alimento nutritivo,16 1.8.1 Aporte de macronutrientes, 17 1.8.2 Aporte de micronutrientes, 18 1.9 El queso como alimento seguro, 19 1.10 Tecnologías combinadas de preservación, 22 1.10.1 Efecto de la reducción de la aw, 23 1.10.2 Efecto de la reducción de pH, 24 1.10.3 Efecto del sorbato de potasio, 26 1.10.4 Utilización de antimicrobianos naturales, 26 1.10.4.1 Timol, 27 1.11 Calidad, vida útil y seguridad, 28 1.12 Microbiología predictiva, 29 1.12.1 Generalidades, 29 2-OBJETIVOS, 36 2.1 Objetivo general, 36 2.2 Objetivos específicos, 36 3- MATERIALES Y MÉTODOS, 39 3.1 Matriz utilizada, 39 3.1.1 Elaboración del queso untable base, 39 3.1.2 Medición del pH, 40 3.1.3 Medición de la actividad de agua (aw),40 3.2 Reactivos utilizados, 41 3.2.1 Medios líquidos de enriquecimiento selectivo y no selectivo, 41 3.2.2 Medios sólidos de aislamiento diferencial y selectivo, 42 3.2.3 Otros reactivos utilizados, 43 3.3 Microorganismos utilizados, 43 3.3.1 Caracterización de los microorganismos utilizados en este estudio, 45 3.4 Metodología, 46 3.4.1 Preparación de los inóculos, 46 3.4.2 Preparación de la solución de timol.Evaluación sensorial,46 3.4.3 Inoculación del queso untable base, 46 3.4.4 Recuento de los microorganismos, 47 3.5 Estudios realizados, 47 3.5.1 Estudio del efecto de la temperatura de almacenamiento, 47 3.5.2 Estudio del efecto de la ausencia de sorbato de potasio (queso untable base), 48 3.5.3 estudio sobre el efecto del pH, 48 3.5.4 Estudio de reto microbiano, 50 3.5.5 Utilización de timol, 50 3.6 Obtención de las curvas de crecimiento o supervivencia.Modelado matemático, 51 3.6.1 Modelado primario, 51 3.6.1.1 Modelo para caracterizar curva de crecimiento, 51 3.6.1.2 Modelo para caracterizar curva de supervivencia, 53 3.6.2 Modelado terciario, 54 3.7 Análisis estadístico, 56 4- RESULTADOS, 58 4.1 Estudio de la microbiología predictiva en queso untable base. Efecto de la temperatura de almacenamiento, 58 4.2 Estudio en queso untable base, 64 4.3 Efecto combinado del pH y la temperatura de almacenamiento, 68 4.4 Estudio de reto microbiano en queso untable base utilizando cepas responsables de ETAS, 86 4.4.1 S.aureus, 86 4.4.2 E.coli, 96 4.4.3 S.Enteritidis, 105 4.4.4 L.monocytogenes, 113 4.5 Uso de antimicrobianos naturales:timol, 121 5-CONCLUSIONES, 132 6-APÉNDICE, 136 6.1 Definiciones y fórmulas, 137 6.1.1 Población estadística, 137 6.1.2 Distribución normal, 137 6.1.3 Parámetros y estimadores, 138 6.1.4 Significancia estadística, 140 6.2 Análisis de la varianza (ANOVA), 141 6.2.1 Test F de significación de la regresión, 143 6.2.2 Coeficiente de determinación R2, 144 6.2.3 Análisis de residuales, 145 6.2.3.1 Versus valores predichos,Y1, 145 7- BIBLIOGRAFÍA, 147 RESUMEN En microbiología predictiva los modelos matemáticos son utilizados para predecir el comportamiento de los microorganismos bajo diferentes condiciones. Antes de ser utilizados en una situación práctica, estos modelos matemáticos deben ser validados con el propósito de demostrar que las bacterias se comportan de igual modo tanto en los alimentos reales como en los sistemas modelo que se utilizaron para generar dichos modelos. En este trabajo se estudió el crecimiento o la inactivación de diferentes microorganismos pátogenos de relevancia en queso untable (S.aureus; E. coli; S. Enteritidis y L. monocytogenes) bajo diferentes condiciones microambientales (pH; temperatura; presencia de sorbato de potasio; presencia de timol). Dichas respuestas fueron caracterizadas por los modelos primarios de Gompertz y Gompertz modificado para muerte obteniendo los parámetros característicos. También se utilizó para la predicción el programa terciario de modelado de patógenos PMP. Los modelos fueron validados estadísticamente y también por los estudios de reto microbiano en queso untable. El modelo de Gompertz, utilizado para describir el crecimiento microbiano no presentó limitaciones estadísticas. No ocurrió lo mismo con el modelo de Gompertz modificado para muerte, el cuál sobreestimó la caída global al final del almacenamiento en muchas situaciones. El programa de simulación modelado de patógenos mostró debilidades al momento de predecir la conducta microbiana en el queso untable debido seguramente a las limitaciones biológicas imperantes en el queso. Este estudio resaltó la necesidad de validar los modelos matemáticos en un alimento real. RECONOCIMIENTOS • A la Dra. Sandra Guerrero por el tiempo que me ha dedicado y por su excelente dirección y dedicación . • A la Dra. Stella Alzamora por su valiosa co-dirección. • Al Director Municipal de Salud Ambiental de la Secretaría de Salud Pública de la Municipalidad de Lomas de Zamora quien comprendió , incentivó y avaló siempre y desde un principio toda la capacitación que enriquece profesionalmente a las personas, Ingeniero Arturo Villafañe. • A los Ingenieros Jorge Orlandini y Jorge Millosi de la empresa Danone-La Serenísima por proveerme gentilmente el queso expresamente preparado para esta Tesis y toda la información necesaria. • A los técnicos y auxiliares del Laboratorio de Control de Alimentos de la Municipalidad de Lomas de Zamora ,Sra. Hilda Alvarez, Srita.María Victoria Alves Fernandes y Sra.Nelly Santillán, por asistirme con la preparación de medios y material en todo momento que fuera necesario. • A mis compañeros de trabajo por amenizar largas horas de trabajo. LISTADO DE FIGURAS Y TABLAS INTRODUCCIÓN Y MATERIALES Y MÉTODOS Cuadro 1. Principales variables del mercado internacional (año 2002) (PAG.3) Figura 1. Consumo mundial de quesos per cápita (PAG.4) Figura 2.Producción nacional de quesos (PAG.4) Figura 3. Consumo nacional per cápita de diferentes quesos (PAG.5) Figura 4: Diagrama de flujo de la elaboración de Queso (PAG.6) Figura 5: Preparación de la leche (PAG.7) Figura 6: Proceso de cuajado (PAG.7) Figura 7: Corte de la cuajada (PAG.8) Figura 8: Moldeado (PAG.8) Figura 9: Prensado (PAG.9) Figura 10: Salado (PAG.9) Figura 11: Madurado (PAG.10) Figura 12: Acabado (PAG.10) Figura 13. Pirámide nutricional (PAG.17) Figura 14. Parámetros matemáticos de la ecuación de Gompertz (PAG.52) Figura 15. Parámetros de la ecuación de Gompertz modificada para muerte (PAG.53) Figura 16: Ejemplo de curva de crecimiento bacteriano (PAG.55) Figura 17: Ejemplo de curva de supervivencia bacteriana (PAG.55) RESULTADOS Figura 1: Efecto de la temperatura de almacenamiento : 5°C (-■- ) y 15°C ( -■- ) en el desarrollo de S.aureus inoculado en caldo BHI (a) y en queso untable (b); (I) desvío estándar. (PAG.59) Figura 2: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable almacenado a 5ºC, () valores experimentales; (—) predicción (PAG.61) Tabla 1: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable almacenado a 5 ºC. (PAG.61) Figura 3 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable almacenado a 5ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.62) Figura 4 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable almacenado a 15ºC, () valores experimentales; (—) predicción. (PAG.63) Tabla 2 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable almacenado a 15 ºC. (PAG.64) Figura 5: Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable almacenado a 15 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.64) Figura 6: Comportamiento de S.aureus a 15ºC en queso untable sin (base, -▲-) y con agregado de 1000 ppm de sorbato de potasio (-■-); (I) desvío estándar. (PAG.65) Figura 7 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 15ºC, () valores experimentales; (—) predicción . (PAG.66) Tabla 3 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 15 ºC. (PAG.66) Figura 8 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 15 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.67) Figura 9 : Comportamiento de S. aureus en el queso untable base almacenado a 10ºC (-♦- ), 15ºC ( -■- ) y 22ºC ( -▲-). (a) pH 5,0; (b) pH 4,3; (I): desvío estándar. (PAG.69) Figura 10 : Comportamiento de S.aureus en el queso untable base a pH 5,0 y diferentes temperaturas de almacenamiento. (a): 10º C, (b): 15ºC y (c): 22ºC . ( ▬ ) predicción , ( --- ) limite de confianza superior predicho, ( --- ) limite de confianza inferior predicho, (-♦- ) datos experimentales; (I) desvío estándar. (PAG.71) Figura 11: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 5.0) almacenado a 10ºC, () valores experimentales; (—) predicción . (PAG.73) Tabla 4: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 10 ºC. (PAG.73) Figura 12 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 10 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.74) Figura 13: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 22ºC, () valores experimentales; (—) predicción (PAG.75) Figura 14 : Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 22 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.76) Tabla 5: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 22 ºC (PAG.76) Figura 15: Comportamiento de S.aureus a pH 4,3 y 10º C(a), 15ºC (b) y 22ºC (c): (▬) predicción , ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho ,(-♦- ) datos experimentales. (PAG.78) Figura 16 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 4.3) almacenado a 10ºC, () valores experimentales; (—) predicción . (PAG.79) Tabla 6: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 10 ºC (PAG.80) Figura 17: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 10 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.80) Figura 18: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 4.3) almacenado a 15ºC, () valores experimentales; (—) predicción . (PAG.81) Tabla 7: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 15 ºC (PAG.82) Figura 19: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 15 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción.(PAG.82) Figura 20 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base ( pH 4.3) almacenado a 22ºC, () valores experimentales; (—) predicción . (PAG.83) Tabla 8: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC (PAG.84) Figura 21: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC: Valores observados vs valores predichos (PAG.84) Figura 22: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC:Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.85) Figura 23: Evaluación del comportamiento de S.aureus en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ), 17ºC ( -■- ) y 25ºC ( -▲-); (I) desvío estándar. (PAG.87) Figura 24: Comportamiento predicho de S.aureus a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦-) datos experimentales. (PAG.88) Figura 25: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 6ºC, () valores experimentales; (—) predicción (PAG.89) Tabla 9: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 6 ºC (PAG.90) Figura 26: Validación del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 6 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.90) Figura 27: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 17ºC, () valores experimentales; (—) predicción. (PAG.91) Tabla 10: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 17 ºC. (PAG.91) Figura 28 : Validación del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 17 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.92) Figura 29: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción (PAG.94) Tabla 11: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 25 ºC (PAG.94) Figura 30: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos. () valores experimentales; (—) predicción (PAG.95) Figura 31: Evaluación del comportamiento de E.coli en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦),17ºC ( -■- ) y 25ºC (-▲- ); (I):desvío estándar. (PAG.97) Figura 32: Comportamiento predicho de E.coli a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c): ( ▬ ) predicción , ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) experimentales (PAG.98) datos Figura 33: Ajuste del modelo de Gompertz modificado a la curva de inactivación de E.coli en queso untable base almacenado a 6ºC, () valores experimentales; (—) predicción (PAG.99) Tabla 12: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 6 ºC (PAG.99) Figura 34: Validación interna del modelo propuesto para la supervivencia de E.coli en queso untable base (pH 5,0) almacenado a 6 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.100) Figura 35: Ajuste del modelo de Gompertz modificado a la curva de inactivación de E.coli en queso untable base almacenado a 17ºC, () valores experimentales; (—) predicción. (PAG.100) Tabla 13: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 17 ºC. (PAG.101) Figura 36: Validación interna del modelo propuesto para el comportamiento de E.coli en queso untable base (pH 5,0) almacenado a 17 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.101) Figura 37: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de E.coli en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción (PAG.102) Tabla 14: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 25 ºC (PAG.103) Figura 38: Validación interna del modelo propuesto para el crecimiento de E.coli en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.104) Figura 39: Evaluación del comportamiento de S.Enteritidis en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (♦- ),17ºC ( -■- ) y 25ºC ( -▲- ); (I):desvío estándar. (PAG.105) Figura 40 : Comportamiento predicho de S.Enteritidis a pH 5,0 y 6º C (a), 17ºC (b) , 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) datos experimentales. (PAG.106) Figura 41 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.Enteritidis en queso untable base (pH 5,0) almacenado a 6ºC, () valores experimentales; (—) predicción (PAG.107) Tabla 15: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 6 ºC (PAG.108) Figura 42: Validación interna del modelo propuesto para S.Enteritidis en queso untable base (pH 5,0) almacenado a 6 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.108) Figura 43: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.Enteritidis en queso untable base (pH 5,0) almacenado a 17ºC, () valores experimentales; (—) predicción (PAG.109) Tabla 16: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 17 ºC (PAG.109) Figura 44: Validación interna del modelo propuesto para el crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 17 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.110) Figura 45: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción (PAG.111) Tabla 17 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 25 ºC (PAG.112) Figura 46: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.112) Figura 47: Evaluación del comportamiento de L.monocytogenes en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ),17ºC ( -■- ) y 25ºC ( -▲- ); (I): desvío estandar (PAG.113) Figura 48: Comportamiento predicho de L.monocytogenes a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) datos experimentales. (PAG.114) Figura 49 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de L.monocytogenes en queso untable base (pH 5,0) almacenado a 6ºC (a),17°C (b) y 25°C (c) () valores experimentales; (—) predicción (PAG.116) Tabla 18: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 6 ºC (PAG.117) Tabla 19: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 17 ºC (PAG.117) Tabla 20: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 25 ºC (PAG.118) Figura 50: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de L.monocytogenes en queso untable base (pH 5,0). a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (PAG.119) Figura 51: Comportamiento de S.aureus en queso untable base con (-♦-) y sin agregado de (-♦-) timol (0,3% p/p), pH 5,0, almacenado a tres temperaturas: (a) 6ºC, (b) 17ºC, (c) 25ºC ; (I):desvío estándar. (PAG.122) Figura 52: Comportamiento de S.Enteritidis en queso untable base con (-♦-) y sin agregado de (-♦-) timol (0,3% p/p), pH 5,0 almacenado a 17ºC; (I): desvío estandar. (PAG.123) Figura 53: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base con timol (pH 5,0) almacenado a 6ºC (a); 17°C (b); y de S. Enteritidis en igual matriz almacenada a 17°C (c) () valores experimentales; (—) predicción (PAG.126) Tabla 21: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) con timol almacenado a 6 ºC (PAG.127) Tabla 22 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) con timol almacenado a 17 ºC. (PAG.127) Tabla 23: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) con timol almacenado a 17 ºC. (PAG.128) Figura 54: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) con timol almacenado a 6ºC ; 17°C; y de S. Enteritidis en igual matriz almacenada a 17°C: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. (PAG.129) Figura 55: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base con timol almacenado a 25ºC, () valores experimentales; (—) predicción (PAG.130) Tabla 24: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base con timol (pH 5.0) almacenado a 25 ºC (PAG.130) Figura 56: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base con timol (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos. () valores experimentales; (—) predicción (PAG.131) 1. INTRODUCCIÓN 1 1.1 Origen del queso Según el Código Alimentario Argentino (C.A.A.), queso es el producto fresco ó madurado que se obtiene por separación del suero de leche ó leche reconstituída (entera, parcial ó totalmente descremada), ó de sueros lácteos , coagulados por la acción física, del cuajo, de enzimas específicas, de bacterias específicas, de ácidos orgánicos, solos ó combinados, todos de calidad apta para uso alimentario; con ó sin el agregado de sustancias alimenticias y/o especias y/o condimentos, aditivos específicamente indicados, sustancias aromatizantes y materiales colorantes (Art 605, C.A.A.) La elaboración de quesos es una actividad que comenzó aproximadamente 8000 años atrás y en la actualidad existen cerca de 1000 variedades diferentes de queso cada uno de los cuales resulta ser único con respecto a sus características organolépticas. La elaboración del queso seguramente fue descubierta por diversas comunidades al mismo tiempo. En el antiguo Egipto se cuidaban vacas y se les ordeñaban para tener la leche por lo que se piensa que también esas comunidades elaborarían quesos. La leche se conservaba en recipientes de piel, cerámica porosa o madera, pero como era difícil mantenerlos limpios, la leche fermentaba con rapidez. El siguiente paso fue el de extraer el suero de la cuajada para elaborar algún tipo de queso fresco, sin cuajo, de sabor fuerte y ácido. Cuenta la leyenda que un pastor árabe volvía a su morada con la leche de las ovejas dentro de una bolsa hecha con la tripa de uno de sus corderos y que después de caminar a pleno sol, al abrir la bolsa la leche estaba cuajada, sólida y hecha queso. Los romanos lo incluían en su dieta condimentándolo con tomillo, pimienta, piñones y otros frutos secos, cuando sus soldados se asentaban en un campamento, elaboraban queso. Con el auge del comercio y el aumento de la población urbana, el queso se convirtió en producto importante para la economía, empezó a comercializarse con queso, fuera de las zonas de producción y más allá de las fronteras y cuando se colonizó el Nuevo Mundo, se llevaron sus tradiciones queseras. Al principio se utilizaba leche cruda, pero en la década de 1850 el microbiólogo Louis Pasteur estableció el proceso de pasteurización como una herramienta fundamental en la preservación de alimentos, hecho que cambió 2 radicalmente el proceso de elaboración de este producto. Empezó a mezclarse leche de distinta procedencia y distintos rebaños para obtener un producto homogéneo y de ese modo disminuyó considerablemente el riesgo de aparición de organismos que pudieran contaminar el producto. 1.2. Producción y consumo nacional e internacional de quesos El queso tiene una producción anual superior a otros productos del mundo muy importantes tales como café, té, cacao y tabaco. Estados Unidos es el mayor productor mundial y casi la totalidad de esa producción está dirigida al mercado local, siendo casi nula su exportación. Alemania es el mayor exportador en cuanto a cantidad y Francia el mayor exportador en cuanto a valor monetario. Así mismo, siguen a Estados Unidos en cuanto a producción. Dentro de los países productores en cuarta posición encontramos a Italia y en décimo lugar a la Argentina. Los países importadores de quesos por excelencia son: Alemania, Reino Unido e Italia. El mayor consumo per cápita lo registra Grecia, seguido de Francia y en tercera posición, Italia. Luego siguen Suiza, Alemania, Países Bajos, Austria, Suecia, etc.(SAGyP, MINAGRI,2010) En el cuadro 1 se presenta un resumen de los volúmenes producidos, consumidos y los stocks finales de los principales productos comercializados en el mercado mundial. Cuadro 1. Principales variables del mercado internacional (año 2002) Producción Consumo Stocks 3.473 3.116 12.470 6.211 (tonelada) 3.127 2.438 12.091 5.854 970 186 716 310 Productos Leche en Polvo descremada Leche en Polvo entera Quesos Manteca Fuente: United States Department of Agriculture ( 2009) USDA 3 La Argentina se encuentra dentro de los países cuyas costumbres dietarias incluyen el consumo de este producto alimenticio tal como se evidencia en la Figura 1. Figura 1. Consumo mundial de quesos per cápita Fuente: SAGPyA, (2000). Según la Food and Agriculture Organization FAO, en 2004, Argentina fue el 9º país productor mundial de quesos (con una participación del 2,4%) con una estadística que se describe en el gráfico de la Figura 2. Figura 2.Producción nacional de quesos Fuente: Dir. de Industria Alimentaria y Agroindustrias ..sobre la base de datos del Convenio SAGPyA-CIL-FIEL (2009) 4 La producción nacional de quesos según el tipo de pasta se puede observar en la Figura 3. Si se observan los datos estadísticos de elaboración de quesos de pasta blanda, se denota un aumento progresivo en los últimos años (2004-2008). Luego de alcanzar el récord histórico de casi 455.000 toneladas en 1999, la producción argentina acusó una merma del 27% hasta 2003. En 2004 se produjo un interesante repunte del 20%, hasta ubicarse en las 398.000 toneladas. Mientras que los quesos blandos crecieron el 13% en 2004, los quesos semiduros y duros exhibieron ritmos superiores al promedio general del grupo, con alzas del 28 y 31%, respectivamente. El crecimiento de la elaboración de quesos verificado en 2004 fue impulsado principalmente por la demanda interna –alrededor del 80% de la producción adicional respecto de 2003 fue absorbido por el consumo doméstico- y en menor medida por las exportaciones, que se llevaron el 20% restante (SAGyP, MINAGRI, 2010). Figura 3. Consumo nacional per cápita de diferentes quesos Fuente: Dir. de Industria Alimentaria y Agroindustrias sobre la base de datos del Convenio SAGPyA-CIL-FIEL (2009). 1.3. Proceso de elaboración de queso Son numerosas las recetas queseras tradicionales con las que se cuenta actualmente y que dan lugar a la gran variedad de quesos artesanales. Pero independientemente del tipo de leche y del lugar de procedencia, hay un proceso general (Figura 4) que a continuación se describe (ICMSF, 1980): 5 Figura 4: Diagrama de flujo de la elaboración de Queso Leche ↓ Filtrado ↓ Pasteurización ↓ Enfriamiento ↓ Inoculación con fermentos lácticos ↓ Adición de CaCl2 y cuajo ↓ Cuajado ↓ Corte de la cuajada ↓ Moldeado ↓ Prensado ↓ Salado ↓ Maduración, previo oreado, volteado y limpieza de los quesos ↓ Acabado 1.3.1 Preparación de la leche Una vez que la leche llega a la quesería, procedente del establecimiento lácteo, es sometida a una serie de análisis químicos y microbiológicos (Figura 5) para asegurar la calidad inicial de la misma. En esta etapa, la leche es filtrada y/o higienizada para eliminar cualquier tipo de impurezas que hayan podido pasar a la leche durante el ordeño. Posteriormente se almacena en los tanques de refrigeración donde permanece a una temperatura de 4ºC. En el caso de las queserías que elaboran quesos con leche pasteurizada, la leche es sometida a temperaturas superiores de 70ºC durante unos segundos. 6 Figura 5: Preparación de la leche 1.3.2 Cuajado Una vez la leche en la cuba de cuajado (Figura 6), se añaden los fermentos lácticos, bacterias que contribuirán a la posterior maduración del queso. Es en esta fase donde se le adiciona el cuajo, que dependiendo del tipo de queso podrá ser vegetal, animal o microbiano, formándose “la cuajada”. Físicamente, consiste en la precipitación de las micelas de caseína formando un gel que retiene además los glóbulos de grasa, agua y sales. Figura 6: Proceso de cuajado 1.3.3 Corte de la cuajada Una vez transcurrido el tiempo de coagulación, el cuál será distinto dependiendo del tipo de queso, se procede al corte de la cuajada (Figura 7). Esta fase consiste en la división de la cuajada mediante las liras en granos más pequeños para favorecer el desuerado. El tamaño del grano viene determinado por el queso a 7 elaborar. Luego se trabaja el grano mediante agitación y elevación de la temperatura favoreciendo todavía más la expulsión del suero. Figura 7: Corte de la cuajada 1.3.4. Moldeado El moldeado consiste en el llenado de los moldes con los granos de cuajada (Figura 8). Figura 8: Moldeado 1.3.5. Prensado Una vez llenados los moldes se pasa a la etapa de prensado, la cual en la actualidad se realiza con unas prensas neumáticas en la mayoría de las queserías. Debido a la presión, que variará dependiendo del tipo de queso que estemos elaborando, se facilita la unión entre los granos de la cuajada y el desuerado (Figura 9). 8 Figura 9: Prensado 1.3.6. Salado Una vez finalizado el tiempo de prensado, se procede al salado del queso a mano ó bien, sumergiéndolo en salmuera (Figura 10). Con la fase de salado, se consigue realzar el sabor del queso; preservar del crecimiento de microorganismos indeseables, favorecer la pérdida de suero y la formación de la corteza. Figura 10: Salado 1.3.7. Madurado A esta fase pasan los quesos tiernos, semicurados y curados. Son mantenidos en cámaras donde se controla la temperatura y la humedad. Durante esta fase los quesos son volteados frecuentemente para evitar que se deformen y la corteza se forme de forma uniforme. La maduración comprende una serie de cambios en las 9 propiedades físicas y químicas adquiriendo el queso su aspecto, textura y consistencia así como aromas y sabores característicos (Figura 11). Figura 11: Madurado 1.3.8. Acabado La fase de acabado se refiere a las distintas presentaciones en las que podemos encontrar algunos de los quesos, por ejemplo, quesos al pimentón, al romero, etc.(Figura 12) Figura 12: Acabado VBCV 1.4. Producción de queso sin conservante (base) efectuada por Danone para el presente estudio. El proceso de elaboración del queso untable base utilizado en el presente estudio y realizado por la empresa Danone posee varios pasos alguno de los cuales son específicos para esta variedad. Como primer paso se realizó la pasteurización con el fin de destruir flora indeseada. Posteriormente al tratamiento térmico se dió comienzo a un proceso bioquímico pero de decisiva importancia: se adicionaron el cuajo, los cultivos 10 iniciadores o fermentos lácticos (fermentación) y cloruro de calcio (por tratarse de leche pasteurizada) (Johnson,1997). La función principal de este paso es la de producir ácido, principalmente ácido láctico, destinado a: a) favorecer la formación de la cuajada por enzimas coagulantes, como el cuajo; b) favorecer el drenaje del suero de los granos de cuajada; c) impedir o inhibir el crecimiento de los microorganismos patógenos y de los causantes de alteraciones, y d) gobernar las actividades de las enzimas que inducen los cambios organolépticos deseados. Los cultivos lácticos iniciadores producen ácido láctico a partir de la lactosa propia de la leche rindiendo componentes del sabor y aroma como diacetilo. Estos cultivos solo son adecuados para aquellos quesos en los que la temperatura de esta etapa no supera los 40ºC durante algunos minutos. El cuajo ,con la colaboración del ácido formado, precipita la caseína (proteína principal de la leche) y forma un gel. La termización se realizó a 65ºC durante 6 minutos a un pH < 4,6 y tiene tres aspectos tecnológicos: • Aumentar la tasa de recuperación de proteínas solubles, por insolubilización de algunas lacto albúminas en medio ácido y mejorar el rendimiento del proceso. • Ajustar la temperatura óptima de separación de la masa magra del suero. • Disminuir la carga microbiológica del fermento presente en la cuajada la cual pasa aproximadamente de 1 x 107 UFC/mL (unidades formadoras de colonias por mililitro) a valores del orden de 1 x 103 / 1 x 104 UFC/mL. Esta disminución es necesaria para reducir la pos-acidificación del producto. Cuando la masa misma (luego de la adición del resto de los ingredientes como el cloruro de sodio cuyo objetivo es potenciar el sabor y ayudar a controlar el crecimiento de microorganismos alterantes) adquirió la firmeza adecuada se sometió al proceso de homogenización y envasado. Esta operación puede ir acompañada por la aplicación de una determinada presión (acondicionamiento). El enfriamiento se realizó a una temperatura de aproximadamente 40ºC. Finalmente se almacenó en cámara fría (0-5ºC). 11 Proceso de elaboración del queso untable base utilizado en el presente trabajo. Recepción, descarga y pasteurización de la leche cruda Pasteurización Incorporación de cloruro de calcio,cuajo y fermento Fermentación Fermentación Termización Inyección de crema Inyección de ingredientes Homogeneización Envasado Acondicionamiento Enfriamiento Homogeneización Almacenamiento en cámara fría 12 1.5 Variedades de quesos Aunque es casi imposible realizar una lista única de quesos, sólo en Francia hay más de 400 variedades de quesos, y en España encontramos, por ejemplo, queso Burgos, Cabrales, Cebreiro, Mató, Quesaillas, Roncal (por sólo nombras algunos) y el queso manchego, típico de la región de La Mancha . En Argentina, existen numerosas variedades de queso (http://www.todoagro.com.ar). Una clasificación muy general comprende: Quesos blandos: son los que tienen abundante materia grasa y humedad. La textura de ellos es muy cremosa, Eso hace que se los pueda extender con facilidad. Son elásticos al tacto y tienen un aroma similar al de las nueces. Los quesos que pertenecen a esta variedad son: el Camembert, el Cuartirolo y el Fontina. En esta categoría entran los semiblandos como el Port Salut y el Mozzarella. Las características de estos quesos los hacen ideales para ser usados en pizzas, budines, terrinas, arroces, polentas y fondues. Quesos duros y semiduros: son muy grasos pero con muy poca humedad. Son de sabores suaves ó fuertes y texturas flexibles ó desmenuzadas. Algunos quesos de este tipo tienen agujeros producidos por bacterias lácticas durante la maduración. En esta categoría están: el Emmenthal, el Parmesano, el Reggianito, el Sardo, el Provolone y el Pecorino. En esta categoría también se incluyen los quesos semiduros, como el Cheddar, el Fontina y el Pategrás. Los quesos duros son apropiados para rallar, preparar salsas y gratinar carnes, y los semiduros para fondue. Quesos azules: son aquellos a los que se les introduce un cultivo fúngico (p.e. Penicillium roquefortii) para generar las características vetas azules. Son intensos. No deben oler a amoníaco ni tener sabor terroso ni muy salado. En esta variedad se encuentran : el Azul y el Cabrales. Quesos frescos: Estos quesos comprenden un proceso de elaboración sin la etapa de maduración. Carecen de corteza. Su consistencia puede ser desde cremosa y homogénea hasta otra mucho más densa. El queso fresco tiene que ser húmedo, blando y sin moho. En esta variedad encontramos: el queso Crema, el Mascarpone, la 13 Ricota y el Fundido. Estos quesos son muy aptos para ser incorporados en ensaladas y para elaborar salsas livianas y frías para acompañar carnes. 1.6. Clasificación de quesos Los criterios para la clasificación de quesos son múltiples, ya que pueden basarse en cuestiones documentales, jurídicas o tecnológicas. Sin embargo, los criterios de clasificación más utilizados son los siguientes: : - Contenido en materia grasa expresado en porcentaje de grasa / masa sobre el extracto seco total ( % G/ES). De acuerdo a este criterio puede ser: Extra graso; Graso; Semi graso; Bajo contenido de grasa y Magro. - Consistencia de la pasta teniendo en cuenta el porcentaje del queso sin considerar su grasa, ó lo que es igual, la humedad del queso desgrasado ( %HSMG o HQD, contenido de humedad sin extracto seco). De acuerdo a este criterio puede ser: Extraduro; Duro; Semiduro; Semiblando y Blando. - Período de maduración atendiendo a su maduración ó ausencia de ella. Pueden ser frescos o madurados. Queso fresco es el que está dispuesto para el consumo al finalizar el proceso de fabricación. Queso madurado es el que, tras el proceso de elaboración, requiere mantenerse durante cierto tiempo a una temperatura y en condiciones tales que se produzcan los cambios físicos y químicos característicos del mismo. - Tipo de leche utilizada. Aparte de su clasificación por el origen de la leche del animal, también se clasifica por los diferentes tratamientos que tiene la leche antes de empezar el proceso de elaboración del queso. Pueden utilizar leche cruda (leche que no ha sido calentada a una temperatura superior a 40º C térmicamente, ni sometida a un tratamiento de efecto equivalente); pasteurizada (se obtiene al calentar la leche a una temperatura entre 71,3°C - 73°C durante 15 segundos o 61°C - 63º C durante 30 minutos, seguido de un enfriamiento inmediato); termizada (leche que ha tenido un tratamiento térmico consistente en elevar la leche a una temperatura entre 57°C - 62°C durante 15 a 20 segundos, 14 seguido de un enfriamiento inmediato ó microfiltrada (leche que ha sufrido una micro-filtración. Este proceso consiste inicialmente en separar la nata de la leche, posteriormente se filtra la leche desnatada a través de unas membranas muy delgadas que retienen las bacterias y finalmente a esta leche filtrada se le incorpora la nata en proporciones adecuadas). - Tipo de Elaboración atendiendo al método de elaboración de los mismos. Pueden ser Quesos "Fermier" ó de Granja (son elaborados con métodos tradicionales y en la propia granja); Artesanales (elaborados siguiendo métodos tradicionales y en general mediante estructuras pequeñas que suelen oscilar entre 1 y 5 personas); Quesos "Latiere" (elaborados en forma semi-automatizada con leche de los propios tambos de la cooperativa) y Quesos Industriales (producto industrial obtenido a partir de leche adquirida a diferentes granjas, a veces muy distantes unos de otras, con un proceso de fabricación automatizado que se realiza a gran escala. De ahí su necesidad de estandarizar la materia prima, con el indispensable uso de la pasteurización, termización o micro-filtración). - Intensidad del sabor o gusto. Es una clasificación que se expresa en términos de intensidad: Fresca ó Dulce (quesos de Burgos, cuajadas, petit suisse, y quesos de cabra lácticos); Poco Pronunciada (quesos cuya maduración es corta; p.e. Camembert, Brie, Coulommiers); Pronunciada (quesos donde su maduración está en su punto y predominan sabores a leche cocida, cereales, frutos secos, vegetales; p.e. Gruyère o los Beaufort y los de pasta azul blandos como el Cashel Blue y de cabra de pasta prensada semicurados); Fuerte (quesos con toque picante además de tener un punto de salado razonable; p.e. quesos de pasta blanda y de corteza lavada- Livarot, Maroilles , Epoisses , Munster; quesos azules - Fourme d'Ambert ó Montbrison); Muy Fuerte (quesos algo más picantes y salados que la intensidad fuerte; p.e. azules y de doble fermentación). 15 1.7 El queso y la salud Todos los tipos de queso aportan a nuestra dieta un gran valor nutritivo. El ser humano puede vivir sin sufrir enfermedades causadas por carencias vitamínicas consumiendo únicamente queso, pan y fruta, puesto que el conjunto de estas tres llevan las vitaminas, sales minerales y proteínas necesarias para vivir. Según pasa el tiempo el queso aumenta el aporte de calorías y mejora su calidad bacteriológica. El queso también contiene la proporción adecuada de ácidos grasos. Es un alimento fácilmente digerible a su vez. El conjunto de moho, bacterias que confiere puede actuar de forma favorable en nuestra flora intestinal. El queso combinado con pan se convierte en una dieta equilibrada para nuestra salud porque se complementan, el primero con las proteínas y los lípidos y el segundo con los hidratos de carbono. Los quesos frescos por su alto contenido en agua son más adecuados para una dieta con inferior número de calorías que uno semicurado ó ya curado (Mahaut y col.,2003). 1.8 El queso como alimento nutritivo Los alimentos lácteos a los cuales acudimos como fuente de calcio nos aportan mucho más a nuestra nutrición y salud. En una dieta, los productos lácteos contribuyen aproximadamente sólo con el 9% de las calorías disponibles. En cambio proveen el 73% del calcio, el 31% de la riboflavina, el 33% del fósforo, el 19% de las proteínas, el 16% del magnesio, el 21% de la vitamina B12, el 17 % de la vitamina A, el 10% de la vitamina B6, 6% tiamina, apreciables cantidades de vitamina D y niacina equivalentes. De hecho los productos lácteos se reconocen como “ricos” o “fuentes de muchos nutrientes” en sí mismos sin tener que ser modificados (Mahaut y col.,2003). En la pirámide nutricional que especifica el Departamento de Agricultura de los Estados Unidos (USDA, por sus siglas en Inglés) (Figura 13), se reconocen a los alimentos lácteos como uno de los grupos de mayor relevancia, recomendando un consumo de los mismos de 2 a 3 porciones/día (leche, yogur, quesos). Las nuevas 16 recomendaciones previstas por el MERCOSUR, recogiendo los consejos mundiales, establecen 1000 mg de calcio como Ingesta Diaria Recomendada o Ingesta Adecuada para mayores de 18 años. Teniendo en cuenta los hábitos locales, ese requerimiento es alcanzable sólo consumiendo no menos de 4 porciones/día de leche ó su equivalente en derivados. Esta cantidad representa la cantidad que al menos el 97% de la población necesita (Portela, 2007) . 1.8.1 Aporte de macronutrientes El contenido de los quesos sobresale ante otros productos ya que posee proteínas de alto valor biológico y calcio de fácil asimilación, fósforo, magnesio, vitaminas del grupo B y liposolubles. Proteínas - A la proteína de la leche se la califica de alta calidad, con alto valor biológico y alta digestibilidad, usada como estándar para evaluar el valor nutritivo de las proteínas de los alimentos. Figura 13. Pirámide nutricional Carbohidratos- La lactosa es el azúcar principal en leche. En los niños se ha comprobado que mejora la absorción de calcio y una porción pasa al colon y funciona como prebiótico en la flora intestinal. 17 Grasas- Aparte de ser fuente de energía (42% de la energía de la leche entera) aporta a la textura, sabor y al poder de saciedad de este alimento. . Los lácteos son la fuente natural más rica en ácido linoleico conjugado siendo identificado este producto como potencial fuente benéfica para la salud, teniendo propiedades antioxidantes habiendo evidencias de tener propiedades anticarcinogénicas (colon mama) antiarteroesclerosis, estimular el sistema inmune. 1.8.2 Aporte de micronutrientes Es bien sabido que el calcio y la vitamina D contribuyen de manera esencial a mantener la buena salud y el bienestar nutricional en el curso de la vida. Sin embargo, aunque gran parte del interés por estos nutrientes sigue centrándose en su importancia para el buen estado de los huesos, recientes investigaciones han arrojado interesantes resultados sobre una amplia variedad de cuestiones nutricionales y sanitarias relacionadas con ellos. Las variaciones en los procedimientos utilizadas en su línea de producción tales como diferentes temperaturas y diferentes técnicas de obtención de la cuajada juegan un papel decisivo en determinar las características organolépticas del producto final, pero los microorganismos o bacterias ácido lácticas (BAL) utilizadas juegan un papel crítico en el desarrollo de sus características distintivas (Beresford y col., 2001; Lars 2004). La primera función de las BAL es producir ácido durante el proceso fermentativo a partir de la lactosa, hidrato de carbono mayoritario de la leche. Ellas también contribuyen en la proteólisis y conversión de los aminoácidos en componentes responsables del flavour (aroma + sabor) del queso (Lars, 2004).Las BAL producen suficiente ácido láctico como para descender el pH a < 5.3 en 6 hs. a 30-37ºC. Estas bacterias, también llamadas “starters” pueden ser agregadas al comienzo del proceso de producción de quesos o pueden ser contaminantes naturales de la leche como en el caso de muchos quesos artesanales fabricados con leche cruda. Una vez presentes junto al resto de los ingredientes comienzan su proceso de crecimiento y logran alcanzar recuentos aproximados de 1 x 108 UFC/gr. en pocas horas. Según su temperatura óptima de crecimiento se clasifican en mesófílas 30ºC45ºC o termófílas 55ºC-75ºC. 18 Las BAL más comúnmente usadas desde el punto de vista de la tecnología alimentaria pertenecen a los géneros Lactococcus, Lactobacillus, Streptococcus, Leuconostoc , Enterococcus, Aerococcus, Carnobacterium, Oenococcus, Pediococcus, Tetragenococcus, Vagococcus y Weisella (Axelsson, L. 2004). Se utilizan también cultivos “mixtos” como Lactococcus lactis ssp. cremoris y L. lactis ssp. lactis (ambos mesófilos), Streptococcus salivarius ssp. Thermophilus , Lactobacillus delbrueckii ssp. delbrueckii, Lb. delbrueckii ssp. bulgaricus, Lb.delbrueckii ssp. lactis o Lb. helveticus. Otro de los roles de las BAL es proveer un ambiente óptimo con respecto al potencial redox, pH y contenido de humedad del queso (Wood, 1995). 1.9 El queso como alimento seguro La principal causa de deterioro de los alimentos es causada por la presencia de diferentes tipos de microorganismos. El deterioro microbiano de los alimentos tiene pérdidas económicas sustanciales, tanto para los fabricantes (pérdida de materias primas y de productos elaborados antes de su comercialización, deterioro de la imagen de marca, etc.) como para distribuidores y consumidores (deterioro de productos después de su adquisición y antes de su consumo). La producción de alimentos seguros está basada en la implementación de medidas generales de Buenas Prácticas de Higiene (BPH) y Buenas Prácticas de Manufactura (BPM). Estos conocimientos son esenciales para contar con productos alimenticios seguros, corregir errores y si fueran necesarias tomar medidas preventivas. Es conocido que en la práctica la recontaminación con patógenos es una causa frecuente de Enfermedades Transmitidas por Alimentos (ETAS). Se ha establecido que los riesgos microbiológicos en quesos están más vinculados con quesos blandos, de humedad superior al 46%. En cambio, los quesos duros, de humedad menor al 36% pueden ser elaborados con leche termizada (tratamiento térmico más suave que la pasteurización), la larga maduración requerida para alcanzar esos niveles de humedad dificulta el desarrollo de los patógenos que 19 pudieran haber contaminado inicialmente, aunque de no haberse respetado las Buenas Prácticas de Elaboración podrían presentar enterotoxina estafilocóccica. La demanda creciente del consumo de quesos y su consecuente elaboración ha incrementado el interés en obtener más información acerca de su calidad y estabilidad. Muchos de los estudios realizados sobre la calidad microbiológica de los quesos de pasta blanda y pasta semiblanda fueron ya publicados (Scott y col., 2002). Diferentes microorganismos tales como Staphylococcus aureus, Escherichia coli, Salmonella spp. y Listeria monocytogenes son microorganismos asociados desde 1970 con brotes asociados a quesos (Roberts, 2002). Muchos de estos microorganismos están distribuidos en el ambiente y pueden ocasionar contaminaciones naturales durante la producción, maduración y almacenamiento así como contaminaciones cruzadas en restaurantes y hogares debido a un inapropiado uso. La distribución ubicua de Salmonella spp,, su prevalencia, su virulencia y su potencial impacto económico en la industria alimentaria predice la necesidad de un continuo control (Iurlina y Fritz, 2004). La contaminación de S.aureus, coco Gram positivo (Jablonsky, 1997), en productos lácteos puede tener lugar en varias etapas del proceso. E.coli, bacilo Gram negativo asporógeno, es usualmente considerada un habitante no patógeno del tracto intestinal humano y es utilizada como indicador de un inadecuado proceso de sanitización de agua y comidas. A pesar de ésto en los años recientes algunas cepas de E.coli halladas han sido implicadas en enfermedades trasmitidas al hombre por alimentos (Doyle,1997). Salmonella spp. es un bacilo Gram negativo no formador de esporas, aerobio facultativo, que puede sobrevivir en condiciones favorables. Hay mas de 2000 serotipos basados en la presencia de antígenos somáticos (O) y flagelares (H) (Daoust, 1997). A pesar de ésto solo un pequeño número son patógenos para el hombre .Su crecimiento está favorecido por la temperatura (20 a 45ºC ) y el pH (4.5 a 9.0). Su tolerancia al pH convierte a este microorganismo en sobreviviente en comidas fermentadas como quesos y salsas Salmonella spp. crece también en ambientes con aw 0.94 pero no puede tolerar altas concentraciones de sal o temperaturas elevadas. 20 La dosis infectiva depende del estado inmunológico del individuo y ha sido demostrado que alimentos ricos en grasa tienden a dar un ambiente protector al microorganismo (Eley, 1996). Salmonella spp. se distingue de otros patógenos por su frecuente presencia en alimentos, su habilidad para crecer en una gran variedad de alimentos, su fácil diseminación y contagio persona a persona y su prolongado período de excreción (10 semanas). L.monocytogenes es un bacilo Gram positivo, asporógeno, anaerobio facultativo y sobrevive a temperaturas de 0 a 45ºC. Su aw óptima de crecimiento es de 0,97 con un mínimo de 0,93 y su pH óptimo de crecimiento está en el rango 5,69,6 (Rocourt, 1997). La dosis infecciosa no está bien establecida pero L.monocytogenes no representa un problema hasta tanto no alcance altos niveles de contaminación, en personas sanas. Este microorganismo es ubicuo y puede contaminar diferentes alimentos y bebidas. Aunque la listeriosis humana es esporádica, se han reportado en algunos casos consecuencias severas a partir del consumo de productos crudos, inadecuadamente calentados, y recontaminación de alimentos tratados (Yuste y col., 2002). Ha sido asociada con varios brotes en los cuales estaban implicados los quesos y consecuentemente su ocurrencia ha sido muy bien estudiada. L. monocytogenes es un importante microorganismo asociado a enfermedades transmitidas por alimentos debido a la severidad de la infección causada y a la mortalidad que produce (30%). La contaminación de muchos alimentos con L. monocytogenes es casi inevitable debido a su naturaleza ubicua en el medio ambiente. Mas aún su inusual habilidad por sobre otros patógenos de crecer a temperaturas de refrigeración la asocia con productos normalmente almacenados en estas condiciones (Smith-Palmer y col., 2001). Ha sido detectada en numerosos alimentos incluyendo paté( Mc Lauchlin ,1991), comida lista para consumo y particularmente en quesos blandos ( Linnan y col., 1999). La supervivencia de este patógeno a valores de pH muy bajos (3,0 a 4,5) ha recibido poca atención, probablemente debido a que se asume su rápida muerte bajo estas condiciones, pero resultados obtenidos por Parish y col. (1989) indican que en productos de bajo pH puede encontrarse Listeria y se puede producir una masiva contaminación si estos alimentos son consumidos en un período corto de tiempo. Su crecimiento a pH <4,4 está influenciado por la temperatura y el tipo de ácido (McLauchlin, 1990). 21 1.10 Tecnologías combinadas de preservación La estabilidad microbiológica y la calidad sensorial de la mayoría de los alimentos, están basados en la combinación de factores de preservación. Esto es cierto, tanto para alimentos tradicionales con factores empíricos inherentes, como para productos nuevos para los cuales se han seleccionado racionalmente los factores de estrés y se han aplicado intencionalmente (Alzamora y col., 2000). El objetivo de las tecnologías de obstáculos es seleccionar y combinar factores de preservación o barreras de forma tal que la estabilidad y seguridad microbiológica puedan ser garantizadas, reteniendo las características nutritivas y la aceptación sensorial (Leistner, 1992). Este método usa varias barreras que separadamente pueden no dar una adecuada preservación, pero que cuando se las combina pueden brindar la protección necesaria. Las barreras pueden incluir la disminución de la temperatura, pH o actividad de agua (por adición de por ejemplo NaCl o azúcares); el calentamiento mínimo; o la adición de antimicrobianos (Buchanan y Phillips, 1990; Leistner, 1992; Leistner, 1995). Para que este concepto sea aplicado exitosamente, es necesario cuantificar la influencia de los distintos factores sobre el crecimiento microbiano. La aplicación de este concepto ha sido muy exitosa en los últimos años, dentro del conjunto de tecnologías de preservación de mínimo procesamiento, y ello ha sido posible debido a los grandes avances ocurridos en el conocimiento del modo de acción de los distintos factores de preservación y de su interacción en los microorganismos (Sajur, 1985; Alzamora y col., 1989; Guerrero y col., 1993; Rojas y col., 1994). La estabilidad u homeostasis del medio interno (composición y volumen de los fluidos) es vital para la supervivencia y el crecimiento de los microorganismos. En los alimentos preservados por factores combinados, la homeostasis activa de los microorganismos vegetativos y la homeostasis refractaria pasiva de las esporas se interfieren en “un número de sitios” o de “manera cooperativa”, utilizando una combinación de factores de conservación, aplicando cada uno de ellos en forma no letal, disminuyendo la severidad de los tratamientos. Por ejemplo, en el caso de células vegetativas, se reduce la disponibilidad de energía (removiendo O2, limitando nutrientes, reduciendo la temperatura) y/o se incrementa la demanda de energía 22 (reduciendo aw y pH, añadiendo compuestos activos a nivel de membrana). Para esporas, la idea es dañar estructuras claves (por ataque químico, enzimático o físico sobre el cortex) o provocar la germinación de las mismas (con “falsos disparadores”, por aplicación de altas presiones, etc.) (Gould y col., 1983; Gould, 1995). Este concepto de combinación no sólo se aplica a la estabilidad microbiológica, sino que se hace extensivo a la calidad total. También desde el punto de vista microbiológico, el concepto se ha tornado más abarcativo y se refiere no sólo a la interferencia de la homeostasis por barreras sinérgicas o aditivas sobre un mismo microorganismo, sino a la aplicación selectiva de factores de conservación que puedan ser efectivos contra un organismo específico o un grupo de microorganismos solamente. Es así, que en los últimos años, un gran número de publicaciones en la literatura internacional se refiere a la utilización de este concepto con distintas finalidades: optimizar tecnologías tradicionales; desarrollar nuevos productos y como medida de seguridad o “back-up” para asegurar la calidad microbiológica de alimentos mínimamente procesados (Alzamora, 1997). La adopción de altos estándares en el control de calidad, buenas prácticas de manufactura y el sistema HACCP son esenciales para asegurar la calidad microbiológica del producto. Más aún, debido a los reducidos márgenes de seguridad, los distintos organismos de contralor internacionales han recomendado el uso de “obstáculos” adicionales en el diseño de los sistemas de preservación tal que procesos, distribución y almacenamiento no adecuados puedan todavía garantizar productos microbiológicamente seguros. Así, el uso de factores combinados juega un importante rol en la seguridad microbiológica de aquellos productos donde los puntos críticos de control sean imposibles o difíciles de controlar. Los valores altos de aw en quesos blandos no son suficientes para garantizar la seguridad microbiológica de este tipo de alimentos, por lo que es necesaria la combinación con otros factores y/o formas tradicionales de preservación. Varios factores de preservación, cuyos efectos se describen a continuación, son frecuentemente utilizados en estas tecnologías. Algunos de ellos han sido empleados en este trabajo. 1.10.1 Efecto de la reducción de la aw 23 Cuando la aw del medio externo se reduce, los microorganismos tienden rápidamente a alcanzar el equilibrio osmótico con el medio que los rodea, principalmente a través de la pérdida de agua, produciéndose plasmólisis de la célula con pérdida de la turgencia de membrana. Inmediatamente se pone en marcha un mecanismo osmoregulador que les permite recuperar el agua pérdida y mantener la homeostasis con respecto de su contenido de agua. Se produce la acumulación intracelular de solutos “compatibles” por síntesis y/o por transporte activo desde el medio extracelular hasta balancear la osmolalidad externa (Gould, 1995). El modo de acción de estos solutos “compatibles” no sólo se explica por su papel de osmolitos, sino que se cree, tienen una propiedad molecular fundamental: estabilizar la estructura proteica (y por lo tanto sus funciones) preservando las funciones de la capa de hidratación (Leistner y Russell, 1991). En las bacterias, los solutos compatibles de mayor importancia son los aminoácidos (ácido glutámico, glicilbetaína, ácido γ-aminobutírico, prolina, etc.) y en las levaduras y los hongos, los polioles (manitol, arabitol, sorbitol, glicerol, etc.).Las diferencias en la capacidad de biosíntesis o de mecanismos de transporte son responsables de la diferencia en los valores de aw límite de crecimiento de las varias especies y géneros de microorganismos. También se puede producir una alteración de la composición de los lípidos de la membrana, incrementándose la proporción de lípidos aniónicos de forma tal de impedir el pasaje de la fase lamelar (o bicapa) a la fase no lamelar (hexagonal) (Bygraves y Russel, 1988). La disrupción de la conformación lipídica normal de la membrana, destruiría sus propiedades de permeabilidad pasiva y alteraría las interacciones lípido-proteína, influenciando las actividades proteíno-mediadas de la misma (por ej. metabolismo intermedio, bombeo de iones, sistemas de transporte) (Leistner y Russell, 1991). 1.10.2 Efecto de la reducción del pH 24 El pH es otro factor básico en la preservación de alimentos, afectando la conformación de las proteínas, el camino de síntesis enzimática y los productos finales del metabolismo. El crecimiento y la supervivencia de los microorganismos están fuertemente influenciados por el pH y el contenido de ácidos orgánicos del alimento. Éstos determinan, de acuerdo a su valor, floras contaminantes diferentes y de distinta resistencia a los factores de conservación. Las bacterias, en general, requieren un rango de pH externo entre 4 y 9 para poder crecer, mientras que los hongos y las levaduras exhiben mayor tolerancia, pudiendo desarrollarse en los rangos de pH externo 1,5-11,0 y de 1,5-8,0, respectivamente (Alzamora, 1997). Los microorganismos necesitan mantener su pH intracelular (pHi) dentro de cierto rango muy estrecho y cercano a la neutralidad para poder crecer. Éste valor óptimo de pH depende de la especie: las bacterias acidófilas tienen pHi comprendidos entre 4,5-6,0, al igual que hongos y levaduras; las neutrófilas entre 7,5-8,0 y las alcalófilas, entre 8,4-9,0. Los organismos tienen distintas capacidades para regular su pH, y por lo tanto, exhiben también diferente tolerancia a la perturbación del pH externo. Los microorganismos que son más resistentes a valores bajos de pH (hongos, levaduras y bacterias acidófilas), poseen también valores menores de pHi, lo que indicaría una adaptación específica al medio ácido (Booth y Kroll, 1989). Existen tres formas en que puede actuar el pH como factor de conservación (Corlett y Brown, 1980; Brown y Booth, 1991), si bien todavía no se conoce totalmente el mecanismo por el cual los microorganismos interactúan con el pH: Vía ácidos fuertes: éstos disminuyen el pH externo, pero no permean a través de las membranas celulares y ejercerían su acción alterando la conformación y la actividad de una o más enzimas esenciales presentes en las capas externas de la célula, y por lo tanto disminuyendo la efectividad de los sistemas de transporte de iones esenciales y nutrientes. Tales niveles de acidez son generalmente inaceptables en los alimentos y sólo permisibles en bebidas carbónicas, en las que se emplea el ácido fosfórico como acidulante. Vía ácidos débiles lipofílicos (ácidos cítrico, sórbico, benzoico, propiónico, etc.): las formas no disociadas de estos ácidos débiles, permean a través de las 25 membranas y actúan como transportadores de protones, ionizándose en el citoplasma y acidificando el medio interno. El efecto primario es disminuir el pHi, pero además, el anión del ácido no disociado puede tener efectos inhibitorios específicos en el metabolismo, incrementando el efecto del pH (ej: ácido acético, fórmico, sórbico). Vía iones ácido-potenciados: el bajo pH potencia la actividad de compuestos tales como bicarbonato, sulfito y nitrito, incrementando la acción de la especie antimicrobiana; es decir, que el efecto del pH es indirecto. 1.10.3 Efecto del sorbato de potasio El sorbato de potasio es principalmente efectivo contra mohos y levaduras, aunque tiene cierta efectividad sobre algunas bacterias. El efecto sobre los hongos, se debe a la inhibición de los sistemas de enzimáticos de deshidrogenasas, las cuales intervienen en el mecanismo de oxidación de los ácidos grasos (Jay, 1991) y enzimas sulfihidrílicas tan importantes como aspartasas, succinodeshidrogenasas y fumarasas. Es altamente efectivo en la inhibición de la producción de micotoxinas por algunas cepas (Ryu y col., 1993). Su efectividad depende de muchos factores tales como pH, aw, presencia de otros aditivos, procesamiento y envasado, temperatura y condiciones de almacenamiento (Sofos y Busta, 1983). La cantidad a utilizar depende del tipo de microorganismo, la aw del alimento y de la carga inicial considerados. En general, concentraciones de sorbato añadidas en el orden de 0,05 – 0,10 %, inhiben el desarrollo de hongos y levaduras en una amplia gama de alimentos. 1.10.4 Utilización de antimicrobianos naturales La incidencia creciente de enfermedades transmitidas por alimentos, junto con las implicancias socio-económicas moviliza a una constante necesidad de producir alimentos seguros y desarrollar nuevos agentes antimicrobianos. Considerando la seguridad de ciertos conservantes químicos y la reacción negativa 26 de los consumidores quienes los perciben como artificiales, ha surgido un creciente interés en alternativas más naturales. Particular interés se ha planteado en la potencial aplicación de aceites esenciales de plantas. La propiedades antimicrobianas están bien establecidas contra un gran espectro de microorganismos incluyendo bacterias (Smith-Palmer y col., 1998) ,levaduras ( Lachowicz y col.,1998; Mangena y Muyima, 1999) y hongos (Paster y col., 1990; Mishra y Dubey 1994). Diversos autores han estudiado el efecto de aceites esenciales como agentes bactericidas (Smith-Palmer, 2001). Skandamis y col. (2001) testearon, por ejemplo, la efectividad del aceite esencial del orégano contra E.coli en caldo BHI hallando resultados positivos en cuanto a su efecto inhibitorio. Azzous y Bullerman (1982) encontraron que el clavo de olor era un eficiente antimicótico contra Aspergillus flavus, A. parasiticus y A. ochradeus y cuatro cepas de Penicillium demorando su crecimiento por más de 21 días. Cerrutti y col. (1997) evaluaron el potencial uso de vainillina como antimicrobiano (en lugar de sorbato de potasio y bisulfito de sodio) en la formulación para obtener puré de frutillas mínimamente procesado. Vrinda Menon y Garg (2001) estudiaron el efecto bactericida del aceite del clavo de olor sobre Listeria monocytogenes en carnes y quesos. Wilkins y Board (1989) reportaron que más de 1389 plantas son potencialmente fuente de agentes antimicrobianos como es el caso del timol obtenido del tomillo y orégano, el aldehído cinámico de la canela y el eugenol de clavos de olor. Sin embargo la actividad antimicrobiana de algunos aditivos, combinados o no, en sistemas como agua o medios de cultivo reflejan pobremente, en general, su comportamiento en sistemas más complejos como los alimentos (Alzamora y col., 2005). En algunos casos, el responsable de la reducción de su actividad antimicrobiana es la interacción con los diferentes nutrientes del alimento (proteínas, grasas, etc.) y otros factores de preservación (Sofos y col., 1998). Así y todo, los mecanismos por los cuales se podría explicar cierta toxicidad o resistencia antimicrobiana a determinados preservantes son menos conocidos. 1.10.4.1 Timol 27 El aceite de tomillo es obtenido por destilación por arrastre de vapor de las hojas de Thymus vulgaris. Sus componentes mas importantes son los alcoholes fenólicos los que expresados como timol se encuentran en una concentración superior al 35%. Otros componentes observados lo constituyen el p-cimeno y el terpineno los que junto al timol le imparten su aroma y sabor característico. El timol es empleado para aromatizar todo tipo de alimentos. Dentro de la industria farmacéutica el timol es un conocido antiséptico, su color es amarillo intenso, olor agradable, densidad 0,91 - 0,94 e índice de refracción 1,492 - 1,499. El mismo es reconocido también como conservante natural contra Staphylococcus aureus y Salmonella Enteritidis (Juven y col. 1994; Lambert y col., 2001). Algunos de los sinónimos con los que se lo puede encontrar en la bibliografía son: ácido tímico, alcohol timólico, fenol timólico, isopropilmetacresol, etc. Medina y col. (2004) estudiaron la actividad bactericida “in vitro”, por el método de difusión en agar, frente a cultivos puros de cinco bacterias patógenas (Listeria monocytogenes, Staphylococcus aureus, Salmonella Enteritidis, Enterococcus sp. y Escherichia coli) y seis cepas de bacterias lácticas que alteran alimentos. Los resultados encontrados destacan la efectividad del aceite de tomillo frente a cultivos puros de bacterias patógenas así como frente a bacterias lácticas (Alzamora y col.,2003). 1.11 Calidad, vida útil y seguridad La falta de calidad en los alimentos puede ser la consecuencia de cambios físico-químicos, enzimáticos o microbiológicos. Los microorganismos desempeñan un papel clave en la pérdida de calidad a través de las actividades de bacterias, hongos y levaduras pero también a través del crecimiento o supervivencia de especies patógenas. Por lo tanto, si se quieren obtener juicios confiables sobre la calidad del alimento, su vida útil y su seguridad, es necesario disponer de datos cuantitativos sobre los efectos de los factores que afectan el crecimiento, la supervivencia y/o la inactivación. Recientemente, con el avance informático, las técnicas para desarrollar modelos predictivos se han mejorado enormemente y es posible pensar en una Base de Datos para Predicciones Microbiológicas a ser usada por la industria y otros organismos relacionados a esta temática. 28 Los quesos presentan problemas de vida útil en heladera asociados al hábito de consumo (alimentos de abre y cierre) que provocan un deterioro prematuro por desarrollo de microorganismos. Estos productos pasteurizados poseen un pH relativamente elevado (5,1- 6,2) y una actividad de agua (aw) óptima para el desarrollo microbiano. Numerosos estudios han establecido que el deterioro de los mismos depende de factores intrínsecos tales como variedad del queso, aw, contenido de sal, contenido y tipo de emulsificante, pH y de factores extrínsecos, de los cuales los más importantes resultan la temperatura de almacenamiento y la contaminación post-pasteurización. Datos de bibliografía muestran que Listeria monocytogenes, Salmonella spp, y Staphylococcus coagulasa positivo representan a los patógenos de mayor incidencia en quesos (Ahmed y col.,1988; Abdalla y col,1992; Altekrus y col.,1998; Larson y col.,1999; Jorgensen y col.,2005). Si se quieren obtener juicios confiables sobre la calidad de este alimento, su vida útil y su seguridad, es necesario disponer de datos cuantitativos sobre los efectos de los factores que afectan el crecimiento, la supervivencia y/o la inactivación. Los modelos matemáticos son la mejor manera de hacer predicciones bajo estas circunstancias. Una herramienta para el desarrollo de tecnologías para poder estimar la conducta microbiana, es la aplicación de la microbiología predictiva (Mc Meekin y col., 1993). 1.12 Microbiología Predictiva 1.12.1 Generalidades La microbiología predictiva consiste en el desarrollo de modelos matemáticos para predecir la velocidad de crecimiento o de declinación de los microorganismos bajo un dado conjunto de condiciones ambientales (Walls y Scott, 1997). El conocimiento detallado de las respuestas de crecimiento de los microorganismos frente a las condiciones ambientales, es decir, el conocimiento de la ecología microbiana, permite evaluar objetivamente el efecto del procesamiento, la distribución y el almacenamiento en la seguridad microbiológica y la calidad de los alimentos. Utilizando diseños experimentales adecuados y modelos matemáticos 29 apropiados, la microbiología predictiva permite la selección de los factores de preservación para alcanzar la vida útil deseada de diversos alimentos. Antes de ser usados estos modelos matemáticos en la práctica deben ser validados a los fines de demostrar que el comportamiento bacteriano es el mismo tanto en el laboratorio como en el alimento real. El testeo de todo modelo es su habilidad para predecir respuestas en nuevas situaciones. En microbiología de alimentos esto significa la habilidad del laboratorio de generar modelos para predecir el comportamiento de los microorganismos concernientes al alimento en preparaciones comerciales, almacenamiento y distribución. Claramente la validación en este nivel debe ser realizada antes que los modelos predictivos puedan ser usados en la práctica con cierto grado de certeza. Existen potenciales consecuencias de un prematuro uso comercial de un modelo predictivo. Desde el punto de vista de la seguridad de los consumidores y la aceptación de la industria de los conceptos de microbiología predictiva un fracaso de un modelo no validado puede ser serio (Mc Meekin y col., 1993). Draper y Smith (1981) indicaron que una vez que el modelo fue validado en la práctica es todavía necesario realizar algún procedimiento para mantener el modelo y reconocer cuando deviene en obsoleto. Ellos recomiendan que por rutina el modelo debe ser periódicamente chequeado mediante análisis estadísticos que deben permitir discernir mas formas de desviaciones sutiles. No es un problema cuán bien un modelo puede ajustar una serie de datos, el verdadero valor de un modelo recae en cuán bien ese modelo puede predecir la respuesta microbiana bajo nuevas condiciones que no son las que fueron específicamente testeadas. Es decir, cuán bien ese modelo funciona en el mundo real. El modelado microbiano comenzó aproximadamente en 1920 con los cálculos del tiempo de muerte térmica y el uso de los valores D (tiempo de reducción decimal) y z (grados de variación en la temperatura, necesarios para reducir el valor de D en un 90%), para describir la resistencia térmica bacteriana. En la década del ‘70, se profundizó principalmente en el modelado de la probabilidad de producción de toxinas de C. botulinum, principalmente en USA y en el Reino Unido (Roberts e Ingram, 1973). En los años ’80 el marcado incremento en la incidencia de brotes de enfermedades producidas por alimentos, llevó a tomar conciencia pública de la necesidad de un abastecimiento seguro de alimentos. En ese momento, los 30 microbiólogos de alimentos comenzaban a aceptar que los métodos microbiológicos tradicionales para determinar la calidad y seguridad alimenticia, estaban limitados por el tiempo requerido para obtener los resultados y que los métodos indirectos basados en cambios químicos, físicos o fisicoquímicos, no proporcionaban una respuesta hasta que un gran número de células se encontraba presente. Lo mismo ocurría con varios métodos rápidos que necesitaban, o bien un alto nivel de contaminación para que la respuesta sea evidente, o dependían del uso de equipamiento muy sofisticado y oneroso. Antes del advenimiento de la microbiología predictiva, la mayor parte de la bibliografía definía las condiciones ambientales limitantes del crecimiento, cuando los demás factores ambientales se encontraban en los valores óptimos. Además, sólo ocasionalmente los efectos de dos o más factores de conservación se estudiaban de tal forma que permitieran cuantificar la interacción de los mismos. A consecuencia de ello, muchos de estos datos no eran de utilidad o bien no permitían predecir la respuesta microbiana. Si bien el modelado no revela comportamientos microbianos extraños o poco esperados, los modelos se pueden usar para predecir, por interpolación, el crecimiento bajo una combinación de condiciones que no fueron específicamente testeadas en el protocolo experimental (Whiting, 1995). Se han propuesto varios esquemas para categorizar los modelos, uno de ellos propone dividirlos en modelos de crecimiento y modelos de inactivación/supervivencia. Dentro de cada categoría se subdividen en modelos primarios, secundarios y terciarios (Whiting y Buchanan, 1994; Alzamora y col., 1995; López-Malo, 2000; Alzamora y col.,2010). Los modelos primarios describen cambios en la respuesta microbiana con el tiempo en un ambiente específico. El modelo puede cuantificar unidades formadoras de colonia por mililitro o por gramo (UFC/mL), formación de toxinas, niveles de sustrato o productos metabólicos (que son medidas directas del crecimiento); absorbancia e impedancia (medidas indirectas de la respuesta). Una vez generada la curva de crecimiento o muerte microbiana, se utiliza una función o ecuación matemática para describir el cambio de la respuesta en función del tiempo. Ejemplos de modelos primarios son: la función de Gompertz para crecimiento exponencial; el modelo de Gompertz modificado para describir la inactivación microbiana; modelos para describir la declinación no lineal de esporas sobrevivientes con el tiempo; el 31 modelo logístico aplicado a destrucción térmica; el modelo de Stannard; el modelo de Schnute; la ecuación de Fermi; etc. (Mc Meekin y col., 1993). El valor D (tiempo necesario a una determinada temperatura para reducir en un 90% la población microbiana ) es también ejemplo de un modelo primario (Whiting y Buchanan,1994). Los modelos secundarios describen las respuestas de los parámetros de los modelos primarios frente a cambios en uno o más factores ambientales como temperatura, pH o aw. Ejemplos de modelos secundarios son el modelo de Arrhenius y el modelo de la raíz cuadrada (Bělehrádek), que describen la dependencia con la temperatura, y el modelo polinómico. El valor z (ºC necesarios para disminuir el valor D un ciclo logarítmico) utilizado en procesos térmicos es también un ejemplo de modelo secundario (Whiting y Buchanan, 1994). Los mismos no serán objeto de estudio en el presente trabajo. Los modelos terciarios son rutinas de software para computadora menos difundidas que convierten a los modelos primarios y secundarios en programas amigables. Estos programas pueden calcular las respuestas microbianas frente a condiciones que no fueron evaluadas inicialmente, comparar el efecto de diferentes condiciones o contrastar el comportamiento de varios microorganismos, por lo que permiten elegir a el o los microorganismos blanco de ataque en situaciones específicas de formulación-procesamiento de alimentos. Ejemplos de modelos terciarios son el programa “USDA Pathogen Modeling Program” realizado por el Departamento de Agricultura de los Estados Unidos, disponible gratuitamente en Internet (http://www.arserrc.gov) y el “Food Micromodel” avalado por el Ministerio de Agricultura Pesca y Alimentación del Reino Unido (Wilson y col., 2002). Es necesario remarcar que llevando a cabo este modelado se puede describir exitosamente el comportamiento microbiano en la mayoría de los alimentos pero hay ocasiones en las que se encuentran discrepancias entre el modelo y el crecimiento observado . Estas discrepancias son descriptas como “fallas”. Un ejemplo sería que el crecimiento observado es más lento que el predicho por el modelo (Wilson y col., 2002). La validación de los modelos matemáticos es esencial para demostrar su aplicabilidad en alimentos. Si bien buenas coincidencias son observadas también suelen observarse algunas debilidades. 32 Una de las debilidades mayormente encontradas está dada por la severidad del medio que representa la matriz alimentaria con respecto a los medios de cultivos que se utilizan en los ensayos de laboratorio. Otra debilidad observada está relacionada con cuanto de rápido se adapte el microorganismo a su nuevo medio ambiente. Si en los experimentos se utilizan los mismos microorganismos a los utilizados en el programa PMP, medios similares y las mismas condiciones de crecimiento es de esperar que el alimento en estudio provea condiciones más favorables aún para el crecimiento bacteriano que el medio utilizado en Laboratorio (Walls y Scott ,1997). Otra consideración a tener en cuenta es que muchos modelos utilizan una mezcla de cepas es decir cepas de rápido crecimiento junto con cepas de lento crecimiento .Idealmente la mezcla de cepas representarían lo que normalmente se podría encontrar en los alimentos o al menos lo más parecido. Existen cepas como Salmonella senftenberg termoresistente que debería tener un modelo de inactivación separado del resto. Los microbiólogos deben chequear ambos modelos y aplicar su propio criterio (Whiting y Buchanan ,1997). Recientes estudios han indicado que las condiciones bajo las cuales el inóculo utilizado debe crecer tienen un impacto importante en el crecimiento o inactivación bacteriana. Los datos utilizados para generar los modelos están basados en el crecimiento de cepas a su vez crecidas en ambientes favorables antes de ser usadas en el medio de cultivo. Estas células pueden tener diferencias en sus tiempos de fase lag , en sus características de crecimiento, etc., con respecto a células que no fueron pre-adaptadas. Los modelos matemáticos microbianos proveen información sumamente útil para tomar decisiones en determinadas situaciones. Estas situaciones pueden resumirse en (Whiting y Buchanan, 1994) : • Predicción en seguridad y tiempo de vida útil: Crecimiento y supervivencia microbiana permiten estimar peligros potenciales provocados por microorganismos patógenos en alimentos luego de un normal o abusivo tiempo de almacenamiento. 33 • Control de Calidad: Los modelos pueden brindar ayuda en desarrollar programas HACCP mostrando que condiciones permiten crecer o sobrevivir y así identificar los puntos críticos de control. Esto es particularmente importante en alimentos en donde pueden existir interacciones de diferentes factores que influyen en el crecimiento microbiano. • Desarrollo de nuevos productos; Cambios en la composición del alimento o una nueva formulación pueden ser rápidamente evaluadas en cuanto a posible crecimiento o supervivencia de microorganismos. Los modelos muestran que factores tienen más influencia en la población microbiana y permite comparar nuevas versus viejas formulaciones. • Educación: a través de la generación de gráficos o estimando el tiempo de generación de una población microbiana crítica, los modelos permiten demostrar drásticamente la importancia de mantener la correcta temperatura o los beneficios que representa trabajar con materias primas de alta calidad con bajos contenidos microbianos iniciales. • Planeamiento en Laboratorio y análisis de bases de datos: Ahorra recursos, tiempo y dinero permitiendo al laboratorio a concentrar sus esfuerzos en los puntos críticos. El modelado representa cada vez más una técnica de rutina para análisis de datos de comportamientos bacterianos. Estos datos pueden ser manipulados matemáticamente y estimas así los errores. 34 2. OBJETIVOS 35 2.1 Objetivo general En microbiología predictiva los modelos matemáticos son utilizados para predecir el comportamiento de los microorganismos bajo diferentes condiciones. Antes de ser utilizados en una situación práctica, estos modelos matemáticos deben ser validados con el propósito de demostrar que las bacterias se comportan de igual modo tanto en los alimentos reales como en los sistemas modelo (p.e. medio de laboratorio) que se utilizaron para generar dichos modelos. La presente propuesta tiene como objetivo general la aplicación de una estrategia que integra el concepto de factores combinados de preservación y la microbiología predictiva para contribuir al aseguramiento de la calidad microbiológica de un derivado lácteo mediante la validación de diferentes tipos de modelos matemáticos. 2.2 Objetivos específicos 1) Obtener respuestas microbiológicas de crecimiento, supervivencia y/o inactivación de microorganismos de interés a distintos factores de conservación utilizados y potenciales (temperatura: presencia de distintos aditivos; pH) y a sus combinaciones en queso untable comercial. 2) Modelar y validar internamente la cinética de crecimiento/supervivencia/inactivación de un microorganismo clave utilizando como herramienta fundamental a la microbiología predictiva a fin de establece la matriz a utilizar. 3) Realizar estudios de reto microbiano utilizando pátógenos comúnmente causantes de ETAS en este tipo de alimento. Modelar y validar internamente la cinética de crecimiento/supervivencia/inactivación utilizando como herramienta fundamental a la microbiología predictiva. 36 4) Una vez validados los modelos, evaluar la influencia de los factores de estrés aplicados de uso corriente o potenciales (p.e. uso de antimicrobianos naturales) a través del análisis de los parámetros obtenidos para los distintos modelos. 5) Predecir la conducta microbiana y evaluar el riesgo ante situaciones de abuso térmico. 6) Cuando sea posible, comparar la aplicabilidad y concordancia de los diferentes modelos utilizados primarios y terciarios en la predicción de la conducta microbiana en queso untable. 37 3. MATERIALES Y MÉTODOS 38 3.1- Matriz utilizada Para el presente estudio se han utilizado dos matrices que responden a la denominación de queso (Introducción, sección 1.1) con la única diferencia de poseer o no (1000 ppm) sorbato de potasio. A los fines prácticos llamaremos queso untable base al queso untable sin sorbato de potasio y queso untable al que posee sorbato de potasio (1000 ppm) y que es el que se adquiere para consumo masivo. 3.1.1 Elaboración del queso untable base El queso untable base fue elaborado a escala piloto y provisto por la empresa Danone S.A. El mismo fue fraccionado en potes comerciales flexibles (capacidad ≅ 150 gramos), usualmente usados para el envasado de yogures. El proceso de elaboración del queso incluyó como primer paso la elaboración de un producto intermedio: la masa magra descremada, a base de leche descremada, fermento, cuajo y cloruro de calcio. En un segundo paso, se adicionó a la masa magra, crema, gelatina, cloruro de sodio y citrato de sodio en los siguientes porcentajes: • Masa magra 54,3% • Crema 44,5% • Gelatina 0,7% • Cloruro de sodio 0,2% • Citrato de sodio 0,3% La composición porcentual del producto final resultó: Leche seleccionada descremada pasteurizada 84% 39 Crema 15,98% Gelatina (textura) 0,002% Citrato de Sodio (estabilizante de proteínas) 0,0008% Cloruro de Sodio 0,0006% Cloruro de Calcio 0,004% Fermento(cultivo iniciador) 0,02% Cuajo 0,0001% El fermento mencionado anteriormente estaba compuesto por una mezcla de cultivos de las siguientes bacterias lácticas: Lactococcus lactis subsp. lactis, Lactococcus lactis biovar. diacetylactis y Leuconostoc mesenteroides ssp. cremoris los cuales generan ácido láctico hasta pH ~ 4,5. Estos cultivos lácticos generan diacetilo a partir del citrato (Axelsson, L., 2004), producto que le confiere al queso un sabor amargo característico. El pH del producto final se ajustó a ~ 5,0. Una vez alcanzado este valor, el porcentaje final de ácido láctico en el queso untable base tuvo un valor aproximado de 0,6-0,7%. 3.1.2 Medición de pH Para la medición de pH se utilizó un equipo marca Orion, ión selectivo, modelo 710 (Orion, Inc, USA) calibrado con soluciones buffer (Hanna Instruments, Italia) de pH 4,01 +/- 0,01 y pH 7,01 +/- 0,01. Las determinaciones se realizaron por duplicado informándose el valor promedio. 3.1.3 Medición de actividad de agua (aw ) La actividad de agua se midió con un higrómetro de punto de rocío AquaLab CX-2 (Decagon Devices, Inc., Pullman, WA) calibrado con soluciones saturadas de NaCl, (NH4)2SO4, KCl y BaCl2; como lo describen Roa y Tapia de Daza (1991). Las determinaciones se realizaron por duplicado informándose el valor promedio. 40 3.2- Reactivos utilizados Tanto para el enriquecimiento como para el aislamiento de las bacterias se usaron medios selectivos y diferenciales entendiéndose por “selectivo” aquel medio de cultivo que posee en su composición algún ingrediente con capacidad de inhibir el crecimiento de la flora acompañante permitiendo “seleccionar” el crecimiento de la bacteria deseada. Bajo el término de diferencial se entiende aquel medio que posee algún componente que acentúa alguna característica “exclusiva” de la bacteria en estudio de tal forma de poder “diferenciarla” del resto de las bacterias que pueda crecer. 3.2.1- Medios líquidos de enriquecimiento selectivos y no selectivos Caldo BHI (Merck, Darmstadt, Alemania), composición: Extracto de cerebro, corazón y peptona D-glucosa 27,5 gr, 2,0 gr Cloruro sódico 5,0 gr Hidrógenofosfato di sódico 2,5 gr Agar-agar 15,0 gr Caldo FDA (Merck, Darmstadt, Alemania), composición: Peptona de caseína 17,0 gr Peptona de harina de soja D-glucosa 3,0 gr 2,5 gr Cloruro sódico 5,0 gr Hidrógenofosfato di potásico 2,5 gr Extracto de levadura 6,0 gr, Suplemento: acriflavina, cicloheximida, ac.nalidíxico. Agua peptonada ( Britania, Buenos Aires, Argentina), composición: Peptona 10,0 gr Cloruro de sodio 5,0 gr Fosfato disódico 3,5 gr 41 Fosfato monopotásico 1,5 gr 3.2.2-Medios sólidos de aislamiento diferenciales y selectivos Agar Baird Parker (Merck, Darmstadt, Alemania), composición: Peptona de caseína 10,0 gr Extracto de carne 5,0 gr Extracto de levadura 1,0 gr Cloruro de litio Glicina 5,0 gr 12,0 gr Piruvato de sodio 10,0 gr Agar 17,0 gr. Aditivos : emulsión de yema de huevo con telurito. Agar Oxford ( Difco, Detroit, USA),composición: Agar base Columbia 39,0 gr Esculina 1,0 gr Citrato de amonio férrico Cloruro de litio 0,5 gr 15,0 gr Agar 2,0 gr Suplemento: cycloheximida, colistina, cefotetán, fosfomicina,acriflavina. Agar BPL ( Merck, Darmstadt, Alemania), composición: Peptona de carne 5,0 gr Peptona de caseína 5,0 gr Extracto de carne 5,0 gr Cloruro de sodio 3,0 gr Hidrógenofosfato disódico Lactosa 10,0 gr Sacarosa 10,0 gr 2,0 gr Rojo de fenol 0,08 gr Verde brillante Agar-agar 0,0125 gr 12,0 gr 42 Agar Levine ( Difco, Detroit, USA), composición: Peptona 10,0 gr Lactosa 10,0 gr Fosfato dipotásico 2,0 gr Eosina 0,4 gr Azul de metileno Agar-agar 0,065 gr 15,0 gr 3.2.3- Otros reactivos utilizados Solución fisiológica (Rivero SRL, Buenos Aires, Argentina). Timol en polvo (Firmenich, Buenos Aires, Argentina) 3.3- Microorganismos utilizados Se utilizaron para este estudio cepas de Staphylococcus aureus ATCC 25923, Listeria monocytogenes ATCC 19114D, Salmonella Enteritidis obtenida de material clínico y Escherichia coli de igual procedencia. Las cepas fueron conservadas a 5ºC en pico de flauta de agar nutritivo y repicadas periódicamente con el propósito de mantener su viabilidad .Los aislamientos iniciales fueron realizados en un medio sólido diferencial y selectivo apropiado para cada microorganismo. S. aureus fue aislado en agar Baird Parker (protocolo en estándar internacionales: United States Pharmacopea XXI,1995;Internacional Organization for Standarization-ISO, 1977/1978; Federación Internacional de Lechería,1978) . L. monocytogenes fue aislada en agar Oxford (Protocolo 143 de IDF-FIL para productos lácteos , 1990). S. Enteritidis fue aislada en agar Verde brillante-rojo de fenol-lactosa (BPL) (protocolo sugerido por Kauffmann-1935) . E .coli fue aislada en agar Levine (Protocolo sugerido por Standard Methods for the examination of Water and Wastewater-1975; United Status Pharmacopoeia XXI-1985). 43 El enriquecimiento de cada colonia pura fue realizado en los caldos o medios líquidos correspondientes: S. aureus en caldo cerebro-corazón (BHI), L. monocytogenes en caldo de enriquecimiento FDA (Food and Drug Administration) y, S. Enteritidis y E. coli en agua peptonada. Aislamiento de S.aureus ATCC 25923 utilizados en este estudio, medio agar Baird Parker. Aislamiento de L.monocytogenes ATCC 19114D utilizados en este estudio, medio agar Oxford. 44 Aislamiento de S.Enteritidis aislada de material clínico utilizada en este estudio, medio agar Verde brillante-rojo de fenol-lactosa. Aislamiento de E.coli aislada de material clínico utilizada en este estudio, medio agar Levine. 3.3.1 Caracterización de los microorganismos utilizados en este estudio Las cepas provenientes de material clínico (materia fecal humana) fueron tipificadas por el Instituto Nacional de Microbiología “Carlos G. Malbran”. Allí se realizaron todas las pruebas microbiológicas y serológicas necesarias para su clasificación taxonómica. Las cepas de colección S.aureus ATCC 25923 (ATCC) y L.monocytogenes ATCC 19114D fueron adquiridas comercialmente (Medicatec SRL, Bs As, Argentina ). 45 3.4-Metodología 3.4.1- Preparación de los inóculos Para cada una de las cepas, se aisló una colonia a partir del agar diferencial y selectivo correspondientes (Figuras 2a, b, c y d). Dicha colonia se inoculó en 10 ml de caldo de enriquecimiento (Materiales y Métodos, sección 3.2), el cual se incubó durante 24 hs a 37ºC. Para la elaboración de un inóculo madre, se tomó 0,5ml del inóculo de cada microorganismo y se diluyó en 500 ml de agua peptonada alcanzando en todos los casos una solución con un recuento aproximado de entre 105 y 107 UFC/ml . 3.4.2-Preparación de la solución de timol. Evaluación sensorial Se hizo una prueba piloto de aceptación organoléptica con un panel de 5 personas (provenientes del laboratorio de trabajo) para establecer la máxima concentración de timol aceptable desde el punto de vista sensorial. La preparación de la solución de timol se realizó utilizando etanol como diluyente. Se evaluaron las siguientes concentraciones en el queso untable base: 0,2; 0,3; 0,5 y 1 %. Para cada concentración de timol, se pesaron 100 gr de queso untable base en bolsas estériles (Whirl-pack, Nasco, U.S.A). Posteriormente, se añadió la solución de timol necesaria para alcanzar la concentración deseada en el queso untable base y se homogeneizó en stomacher durante dos minutos a baja velocidad. La degustación de las muestras de queso untable base adicionadas con distintos niveles del antimicrobiano se realizó en el sentido de concentraciones crecientes neutralizando entre muestra y muestra con agua y en caso de ser necesario con grisines sin sal (Lawless y Heymann, 1999). Se descartaron aquellas concentraciones que resultaban inaceptables organolépticamente. Se seleccionó, para la realización del estudio, la máxima concentración promedio aceptada por el panel de degustadores. 3.4.3- Inoculación del queso untable base Se pesaron 160 gr. de en bolsa estéril (Whirl-Pack, Nasco, U.S.A) y se agregaron 3,25 ml del inóculo madre, se homogeneizó en stomacher durante 2 46 minutos a baja velocidad. Las bolsas, conteniendo los 160 gr de queso inoculado y 0,48 gr de timol, se cerraron manualmente sacando todo el oxígeno remanente y se almacenaron a las distintas temperaturas correspondientes en cada ensayo (5ºC25ºC) para su posterior análisis. 3.4.4- Recuento de microorganismos De cada bolsa inoculada y almacenada a la temperatura correspondiente a la experiencia se tomaron en los días de recuento10 gr de la muestra de queso, por duplicado (duplicado de experiencia). Se agregaron 90 ml de agua peptonada a cada bolsa y se homogeneizaron 2 minutos a baja velocidad en stomacher (Seward Medical,Londres,UK) para asegurar un correcto mezclado. A partir de dichos homogenatos se calcularon las diluciones correspondientes como para lograr un recuento de no más de 100 colonias por placa y minimizar el error de conteo. Se inocularon las placas de Petri, por duplicado (duplicado de placa) realizando la metodología de recuento combinado. Para la metodología del recuento combinado se tomó 1 ml del homogenato presente en las bolsas agitadas en el stomacher, se distribuyó homogéneamente en 3 placas de Petri (0,33 ml en cada placa), se esparció con espátula de Drigalsky hasta absorción total y se puso a incubar. El medio utilizado para las placas fue el agar de aislamiento específico para cada microorganismo (Materiales y Métodos, sección 3.2.2). La incubación se llevo a cabo en incubadoras (Velp, Italia) a 37ºC ,el tiempo correspondiente a cada experiencia. Se realizó el recuento informando UFC/gr. 3.5 Estudios realizados 3. 5.1 Estudio del efecto de la temperatura de almacenamiento Se estudió el comportamiento de S. aureus en el queso untable (conteniendo 1000 ppm de sorbato de potasio) a temperatura de refrigeración: 5ºC y temperatura de abuso térmico: 15ºC y se comparó con el comportamiento a las mismas temperaturas pero en caldo nutritivo (BHI) a modo de tener un parámetro mas de referencia. 47 La experiencia se llevó a cabo tal como se indica en el siguiente cuadro: Matriz Temperatura de Días de recuento almacenamiento Queso untable 5ºC 0,7,12,17 y 21 Queso untable 15ºC 0,3,5,7,10,12,14,17 y 19 BHI 5ºC 0,1,2,3,10,12 y 14 BHI 15ºC 0,2,5,9,12,13,y 14 3. 5.2 Estudio del efecto de la ausencia de sorbato de potasio (queso untable base) Matriz Temperatura de Días de recuento almacenamiento Queso untable 15ºC 0,3,5,7,10,12,14,17 y 19 Queso untable base 15ºC 2,4,6,8,10,12,14 y 16 3. 5.3 Estudio sobre el efecto del pH El pH del queso untable base se ajustó mediante la utilización de diferentes volúmenes de jugo de limón. Se realizó de modo complementario una prueba de aceptación organoléptica con un panel de 5 personas evaluando muestras de queso untable base con su pH original (5,0-5,1) y en el rango de pH 4,1- 5. Según el volúmen de jugo de limón agregado a 10 gr de queso untable base se llegó a los siguientes valores de pH: 48 Volumen de jugo de limón agregado pH final medido (ml) 0,1 5,0 0,3 4,6 0,5 4,5 0,7 4,4 0,9 4,3 1,1 4,2 1,3 4,1 El valor de pH seleccionado fue el de menor valor organolépticamente aceptado. Una vez ajustado el pH se procedió a preparar la matriz sobre la cual se desarrollaría el estudio .Para dicho propósito se trabajo con el queso untable base a dos pH: 5,0 y 4,3. Las condiciones de temperatura y pH y en las que se desarrolló el presente estudio se detallan en la siguiente tabla: Temperatura/pH Días de recuento 10ºC/ 5,0 0,5,7,12,20,25,30 y 40 15ºC/ 5,0 0,2,4,6,8,11,13,15 y 17. 22ºC/5,0 0,2,5,7,12,16,19,26,28,30,33 y 38 10ºC/ 4,3 0,20,40,50,60 y 65. 15ºC/ 4,3 0,3,7,11,14,17 y 19. 22ºC/ 4,3 0,2,6 y 20 49 3. 5.4 Estudio de reto microbiano De acuerdo a la información aportada por la microbiología predictiva que describe el comportamiento de los microorganismos en medio de cultivo en determinadas condiciones de pH y temperatura, se intentó estudiar el comportamiento de cuatro bacterias seleccionadas. En base a esta información se elaboraron programas de estudio a 6, 17 y 25ºC. La matriz utilizada fue queso untable base y las bacterias fueron S.aureus, E.coli, S. Enteritidis y L.monocytogenes A Temperatura/pH Días de recuento 6ºC/ 5,0 0, 6, 13, 20, 27, 30, 33 y 36 17ºC/ 5,0 0, 2, 5, 8, 11, 12, 13 y 14 25ºC/ 5,0 0, 1, 2, 3, 4, 5, 6 y 7 cada día de recuento fueron removidas 2 bolsas de la cámara de incubación y cada una fue sometida al estudio microbiológico descripto (Materiales y Métodos, sección 3.4) 3. 5.5 Utilización de timol Considerando el comportamiento observado en el apartado anterior se intentó estudiar el comportamiento de los mismos microorganismos adicionando al queso untable base un antimicrobiano natural compatible con este tipo de productos, timol, componente principal del aceite esencial de orégano y observar así el efecto que el mismo produce sobre su desarrollo. El queso untable base fue adicionado con timol (0,3% p/p) y luego inoculado con S.aureus ó S. Enteritidis (Materiales y Métodos, sección 3.4.3) y almacenados a diferentes temperaturas. Los días de recuento (y temperaturas de almacenamiento) fueron similares a los establecidos en el mismo ensayo pero en ausencia de timol a 50 los fines de poder realizar una comparación del comportamiento del microorganismo ensayado. Se realizó el siguiente esquema de muestreo: Matriz Microorganismo Temperatura/pH Días de recuento Queso untable S.aureus 6ºC/ 5,0 0,7,14,21,31,33 y 35 17ºC/ 5,0 0,4,7,11,12,18 y 21 base + 0,3%timol Queso untable S.Enteritidis 25ºC/ 5,0 0,3,4,10,12,14 y 17 17 ºC/ 5,0 0,2,7,9,13,14,15 y 20 base + 0,3%timol 3. 6 Obtención de curvas de crecimiento o supervivencia. Modelado matemático En los casos en donde experimentalmente se observó crecimiento bacteriano se graficó Log N en función del tiempo y en donde se observó muerte bacteriana se graficó Tiempo en función de declinación logarítmica (Log decline) con el objeto de obtener una mejor comparación con la información brindada por el programa predictivo de modelado terciario Pathogen Modeling Program (Agricultural Research Service, USDA; 2010). 3. 6. 1 Modelado primario Se describe a continuación los modelos primarios utilizados en esta tesis. 3.6.1.1 Modelo para caracterizar curvas de crecimiento La ecuación de Gompertz y su forma modificada fue usada primariamente en el modelado de curvas asimétricas sigmoideas de crecimiento microbiano (Mc Meekin y col. 1993). La ecuación de Gompertz (Zwietering y col., 1990; Gibson y col. , 1987; Gibson y col., 1994) para describir crecimiento bacteriano se describe como: Log N = A + C exp (-exp ( - B (t – M ))) eq (1) donde: 51 Log N: Log. decimal del recuento bacteriano a tiempo t Los parámetros matemáticos estimados (A, B, C y M ) representan las diferentes regiones de la curva pero no tienen un significado biológico (Figura 14). Con el propósito de un mejor entendimiento y caracterización de la curva de crecimiento, dichos parámetros pueden manipularse con el propósito de recalcular a partir de ellos los parámetros biológicos tiempo de generación (TG): tiempo en que se duplica la Log N (UFC/g) Figura 14. Parámetros matemáticos de la ecuación de Gompertz Tiempo (día) población; velocidad de crecimiento exponencial (VCE):velocidad en el punto de inflexión de la curva y tiempo de fase lag (LAG): tiempo a partir del cual comienza el crecimiento, según: TG (día ) = Log10 (2 ) ⋅ exp(1) BC VCE((Log10 UFC / g ) / día ) = LAG(día ) = M − 1 B eq(2 ) BC exp(1) eq(3) eq(4) 52 Los valores de los parámetros se pueden determinar por el ajuste de la función de Gompertz a los datos experimentales por un procedimiento de estimación iterativa que determine el mejor ajuste de acuerdo al criterio de los cuadrados mínimos. 3.6.1.2. Modelo para caracterizar curvas de supervivencia La ecuación de Gompertz modificada para describir supervivencia o inactivación bacteriana se describe como: Log [Nt/N0] = C exp (-exp(A + Bt)) – C exp ( -exp(A)) eq (5) donde Log [Nt/N0]: fracción logarítmica de supervivencia Los parámetros estimados (A, B y C) representan las diferentes regiones de la curva de supervivencia ó inactivación (Figura 15). A: hombro de la curva de muerte (día); B: velocidad máxima de muerte (1/día) y C: cambio total en el número de sobrevivientes (-). Figura 15. Parámetros de la ecuación de Gompertz modificada para muerte 53 3.6.2 Modelo terciario El progreso logrado en el modelado microbiano ha sido importante y los modelos presentados han logrado ser una herramienta de mucho valor para evaluar y diseñar diferentes procesos en la industria alimentaria. Sin embargo no es posible aún contar únicamente con estos modelos para determinar la seguridad de los alimentos y sistemas. Las validaciones en laboratorio son aún necesarias para determinar inequívocamente el crecimiento posible de microorganismos patógenos o su supervivencia en los alimentos. El Programa de modelado de patógenos ó su sinónimo en el habla inglesa, Pathogen Modeling Program (PMP) fue desarrollado por los científicos Whiting y Buchanan del Departamento de Agricultura de USDA. El mismo es de acceso gratuito y ofrece una serie de menúes (Figuras 16 y 17) para la entrada del microorganismo cuya conducta se desea evaluar; la selección de la atmósfera (aeróbica ó anaeróbica); la población bacteriana inicial; pH; el nivel de cloruro de sodio; la temperatura y la concentración de nitrito. Luego se puede elegir si se quieren obtener los parámetros cinéticos, el tiempo estimado para alcanzar una dada población ó un gráfico mostrando la curva. Las variables pueden ser modificadas fácilmente permitiendo al usuario estimar que sucedería si las condiciones variaran. Este modelos de programa provee un formato amigable que permite disponer de respuestas para Salmonella, S.aureus, L.monocytogenes, S.flexneri, B.cereus, A.hydrophila y E.coli O157:H7 (Buchanan, 1993). El Servicio de Inspección y Seguridad Alimentaria de USDA ha utilizado este modelo para asesorar sobre el crecimiento de microorganismos patógenos en formulaciones de alimentos a base de carne. Los modelos, sin embargo, no reemplazan completamente el test microbiológico experimental. Ellos permiten realizar asesoramiento en cuanto a respuestas microbiológicas esperadas, objetivas y más eficientes en cuanto a costos posibles. 54 Figura 16: Ejemplo de curva de crecimiento bacteriano Figura 17: Ejemplo de curva de supervivencia bacteriana 55 3. 7 Análisis estadístico Los ajustes del modelo de Gompertz y del modelo de Gompertz modificado para muerte a los datos experimentales se validaron internamente mediante el análisis de varianza y la aplicación de los siguientes tests (ver Apéndice ). • Test F de significación de la regresión • Cálculo del coeficiente de determinación corregido por grados de libertad del sistema ( R2 aj.) • Análisis de residuales Todas las regresiones no lineales se analizaron utilizando el software Statgraphics plus para Windows, versión 5.1 (Statistical Graphics corp., USA) 56 4. RESULTADOS 57 4.1 Estudios de microbiología predictiva en queso untable. Efecto de la temperatura de almacenamiento En el presente estudio se evaluó mediante modelado primario la respuesta de S.aureus en función del tiempo a 2 temperaturas 5 y 15°C, tal como se detalla en Materiales y Métodos, sección 3.5.1. Una vez realizada la inoculación del queso untable se almacenó a temperatura de refrigeración (5°C ) y temperatura de abuso térmico (15°C ) durante 20 días. Cabe aclarar que en este primer estudio no se evaluó la utilización del programa terciario de modelado de patógenos, PMP dado que la matriz contenía sorbato de potasio, hecho que no es contemplado por dicho programa. La Figura 1b muestra los resultados obtenidos. Adicionalmente, con el propósito de disponer de un control se obtuvieron las curvas de respuesta de S.aureus en caldo nutritivo (BHI) (Figura 1a). El desarrollo de S. aureus en caldo BHI a 5°C y 15 °C durante 15 días de almacenamiento (Figura 1a) resultó predecible dado que dichas temperaturas no son óptimas para el desarrollo de este microorganismo. Pudo observarse que la población se mantuvo aproximadamente constante a 5°C durante el almacenamiento, con leve crecimiento a 15°C durante los primeros días para luego mantenerse constante. La población de S.aureus en queso untable (valor inicial ~ 1 x 10 7 UFC/g) decreció conforme aumentó el tiempo de almacenamiento a las dos temperaturas ensayadas (Figura 1b). En el caso de almacenamiento del producto a temperatura de refrigeración (5°C), la inactivación alcanzó 2,0 ciclos logarítmicos en 19 días. En el caso de almacenamiento del producto inoculado a temperatura de abuso térmico (15°C), la inactivación fue menos pronunciada, alcanzando solo 1,5 ciclos logarítmicos en aproximadamente 19 días. Las curvas de supervivencia fueron modeladas con la versión modificada de la ecuación de Gompertz para muerte microbiana (Linton y col., 1995) donde los parámetros obtenidos A, B y C representan las diferentes partes de la curva: hombro de la curva de muerte ( A), máxima velocidad de muerte (B) y cambio total en el número de sobrevivientes (C) (Materiales y Método, sección 3.6.1.2). 58 Figura 1: Efecto de la temperatura de almacenamiento : 5°C (-■- ) y 15°C ( -■- ) en el desarrollo de S.aureus inoculado en caldo BHI (a) y en queso untable (b); (I) desvío estándar. a b 59 Este modelo se ha venido aplicando con éxito para caracterizar el comportamiento de una variada gama de microorganismos y alimentos. Bhaduri y col. (1991) fueron los primeros en demostrar que la curva descripta por la ecuación de Gompertz modificada podía describir el comportamiento no lineal de curvas de supervivencia en el caso de L.monocytogenes en pasta de salchichas. Posteriormente, Linton y col. (1995) utilizaron exitosamente esta ecuación para describir el comportamiento no lineal de L.monocytogenes y encontraron que esta ecuación era efectiva para modelar curvas de supervivencia lineales y curvas de supervivencia con región de hombro y cola. Char (2006) estudió la respuesta de L.innocua en jugo de naranja combinando tratamientos térmicos a diferentes temperaturas (57 a 61ºC) y adicionando diferentes niveles de vainillina (0 a 1100 ppm). La ecuación de Gompertz modificada explicaba más del 98% de las variaciones observadas .En general altas concentraciones de vainillina combinada con tratamientos térmicos se traducían en curvas cercanas a la linealidad con pequeños o ausentes hombros (con consecuentes bajos valores del parámetro A) y altas tasa de muerte caracterizadas a través del parámetro B. Un descenso en el parámetro B refleja una disminución en la resistencia microbiana. Chhabra y col. (2002) obtuvieron similares respuestas cuando estudiaron la respuesta de L.monocytogenes en cuanto a resistencia térmica (50, 60 y 65ºC) en diferentes condiciones de pH y niveles de grasa en leche. Ellos también encontraron que este modelo era muy versátil describiendo diferentes tipos de curvas de inactivación (curvas cercanas a la linealidad, curvas con región de hombro y curvas sigmoideas) con altos niveles de correlación. Como puede observarse en la Figura 2, en el caso de S.aureus inoculado en queso untable almacenado a 5ºC, el modelo ajustó correctamente con valores predichos muy cercanos a los obtenidos experimentalmente. El análisis de la varianza (Tabla 1) arrojó un coeficiente de determinación ajustado por grados de libertad elevado, con lo cual se evidencia que el modelo pudo explicar un 73% de las variaciones observadas en las repuesta con un valor del estadístico F significativo (α < 0,05%). El análisis de valores observados vs. valores predichos mostró una distribución homogénea alrededor 60 Figura 2: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable almacenado a 5ºC, () valores experimentales; (—) predicción . 0 LogN/N0 -0,4 -0,8 -1,2 -1,6 -2 -2,4 0 4 8 12 16 20 24 Tiempo (día) Tabla 1: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable almacenado a 5 ºC. Parámetro Estimador Error Estándar A 1,21 0,08 B -0,35 0,03 C -8,6 8,1 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 10,12 3 RESIDUAL 0,005 2 R2 ajustado FISHER 1348* 99,70 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 de la diagonal mientras que la distribución de los residuales no mostró anomalías de conos o herraduras (Apéndice)(Figura 3a y b). 61 Este modelo predijo un hombro inicial (A) de ~ 1 día; una velocidad de muerte (B ) de 0,35 día-1 y un cambio global en el número de sobrevivientes que cuadriplica al observado (C= 8,6), hecho que probablemente se deba a la ausencia de una cola marcada en la curva de muerte (Alzamora y col,2010). Ferrante y col. (2007) utilizó el modelo de Gompertz modificado para modelar supervivencia de L.monocytogenes en jugo de naranja fresco (pH 3.5) ultrasonicado (600 W,2 0 KHz, 95.2 µm de amplitud de onda; 45ºC). Este modelo representó exitosamente las curvas de supervivencia de L.monocytogenes que resultaron completamente sigmoideas y semi-sigmoideas dependiendo del tratamiento. Estos autores también describieron la sobreestimación del parámetro C para las condiciones más severas en donde combinaban 1000 y 1500 ppm de vainillina mas tratamiento con ultrasonido dado que la población microbiana disminuía muy rápidamente describiendo una curva sin cola. Figura 3 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable almacenado a 5ºC: a) Valores observados vs valores predichos; b) 0 (b) (a) 0,06 -0,4 residuales valores observados Residuales vs. valores predichos . () valores experimentales; (—) predicción. -0,8 -1,2 -1,6 -2 0,04 0,02 0 -0,02 -0,04 -2,4 -2,4 -2 -1,6 -1,2 -0,8 -0,4 0 -0,06 valores predichos -2,4 -2 -1,6 -1,2 -0,8 -0,4 0 valores predichos Cuando este modelo se utilizó para caracterizar la curva de supervivencia de S. aureus en queso untable almacenado a 15°C, se observó que el mismo ajustó correctamente con valores predichos muy cercanos a los obtenidos experimentalmente (Figura 4). El análisis de la varianza (Tabla 2) arrojó un coeficiente de determinación ajustado por grados de libertad elevado (98,6 %) , con lo cual se evidencia que el modelo pudo explicar un importante % de las variaciones observadas en las repuesta con un valor del estadístico F significativo (α < 0,05%). El análisis de valores observados vs. valores predichos mostró una 62 distribución homogénea alrededor de la diagonal mientras que la distribución de los residuales no mostró anomalías de conos o herraduras (Figura 5 a y b). Este modelo predijo para S. aureus inoculado en queso untable base almacenado a 15°C un hombro inicial (A) de 4,55 días; una velocidad de muerte (B) de 0,39 día-1 y un cambio global (C) de 1,55 ciclos, el cual es muy cercano al valor observado experimentalmente. Figura 4 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable almacenado a 15ºC, () valores experimentales; (—) predicción. 0 LogN/N0 -0,3 -0,6 -0,9 -1,2 -1,5 -1,8 0 4 8 12 16 20 Tiempo (día) 63 Tabla 2 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable almacenado a 15 ºC. Parámetro Estimador Error Estándar A 4,55 0,17 B -0,39 0,04 C -1,65 2,97 ANÁLISIS DE LA DESVIACIÓN Fuente SS FISHER gl MODELO 6,49 3 RESIDUAL 0,03 6 432 R2 ajustado 98,59 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 5: Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable almacenado a 15 ºC: a) Valores observados vs valores predichos; b) 0,16 0 (a) -0,3 Residuales Valores observados Residuales vs. valores predichos . () valores experimentales; (—) predicción. -0,6 -0,9 (b) 0,11 0,06 0,01 -0,04 -1,2 -0,09 -1,5 -1,8 -0,14 -1,8 -1,5 -1,2 -0,9 -0,6 -0,3 0 -1,8 valores predichos -1,5 -1,2 -0,9 -0,6 -0,3 0 Valores predichos 4.2 Estudio en queso untable base Con el propósito de estudiar si la presencia de sorbato de potasio en el queso untable afectaba el crecimiento de S. aureus, se trabajó con la misma matriz alimentaria pero sin la presencia de este aditivo. La experiencia se realizó tal como se 64 detalla en Materiales y Métodos, sección 3.5.2. Para ello se trabajó con la misma cepa de S.aureus y una vez inoculado el queso untable base (sin agregado de 1000 ppm de sorbato de potasio) se procedió a incubarlo a 15ºC. En este caso se observó un leve decaimiento de la población (1 ciclo logarítmico en ~ 18 días). Este comportamiento fue similar al observado en queso untable con la presencia de sorbato de potasio a igual temperatura de almacenamiento (Figura 6). Estos datos experimentales podrían estar indicando la falta de relación entre el comportamiento observado de S. aureus en el queso untable y la presencia del sorbato de potasio ya que en ausencia del mismo el perfil de supervivencia de la población se mantuvo. Figura 6: Comportamiento de S.aureus a 15ºC en queso untable sin (base, -▲-) y con agregado de 1000 ppm de sorbato de potasio (-■-); (I) desvío estándar. Con el propósito de caracterizar dichas curvas y de realizar una comparación más cuantitativa, se aplicó el modelo de Gompertz modificado a las curvas de inactivación de S. aureus en queso untable base (sin agregado de sorbato de potasio) almacenado a 15°C, obteniendo los parámetros característicos del mismo, según la metodología descripta en Materiales y Métodos, sección 3.6.1.2. La Figura 7 presenta las curvas de supervivencia predichas por el modelo, junto a los respectivos datos experimentales. La Tabla 3 exhibe los parámetros estimados que representan 65 las diferentes regiones de la curva de supervivencia: el hombro inicial (A~ 5,9 días), la máxima velocidad de muerte (B~ 0,5 día-1) y el cambio global en el número de sobrevivientes (C~ 1,4 ciclos), junto a los estadísticos de ajuste del modelo. Se obtuvo un R2 ajustado por grados de libertad 99%. El valor de F muy significativo (α<0,01), demostró que el modelo fue apropiado para describir el comportamiento observado. La validación interna determinó concordancia entre los valores observados y predichos y una adecuada distribución de residuales (Figura 8 a y b). Figura 7 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 15ºC, () valores experimentales; (—) predicción . 0,1 Log N/N0 -0,1 -0,3 -0,5 -0,7 -0,9 -1,1 0 3 6 9 12 15 18 Tiempo (día) Tabla 3 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 15 ºC. Parámetro Estimador Error Estándar A 5,88 1,84 B -0,43 0,15 C -1,35 0,22 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 1,95 3 RESIDUAL 0,006 3 R2 ajustado FISHER 325** 99,08 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 66 Figura 8 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 15 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. 0,1 (X 0,001) 55 -0,1 35 Residuales Valores observados (a) -0,3 -0,5 -0,7 -0,9 -1,1 -1,1 (b) 15 -5 -25 -45 -0,9 -0,7 -0,5 -0,3 -0,1 0,1 Valores predichos -1,1 -0,9 -0,7 -0,5 -0,3 -0,1 0,1 Valores predichos El modelo de Gompertz modificado permitió mediante la adecuada caracterización de las curvas de supervivencia establecer que la presencia de sorbato de potasio no tuvo una influencia notoria en modificación de los parámetros A, B y C que caracterizan a las curvas de supervivencia (Tablas 2 y 3). Un estudio realizado utilizando diferentes bacterias patógenas tales como E.coli O157:H7,Salmonella , L .monocytogenes y S. aureus (Roberts y col.,2002) inoculadas en diferentes tipos de queso (mozzarella y cheddar) durante un período de almacenamiento que rondó entre los 14 y los 50 días demostró que, en general, se observó un decaimiento significativo de recuento bacteriano en el producto lácteo (queso) con respecto al control que se puso de manifiesto a partir del día 14. Roberts y col. (2002) describen que el sorbato (aditivo generalmente reconocido como seguro) es uno de los más usados en la industria láctea como preservante debido a su poder inhibitorio sobre microorganismos patógenos, no así sobre flora fermentativa. También hace mención a situaciones en donde se observó una ineficiente protección del mismo. Si bien no se observaron diferencias notorias en la respuesta del microorganismo de prueba (S. aureus) inoculado en ambas matrices, se decidió evaluar los resultados posteriores de este trabajo utilizando como matriz, queso untable base con el propósito de evitar introducir un agente de stress microbiano (tal como es el uso de sorbato de potasio) y así poder estudiar la influencia de distintos factores evaluados. 67 4.3 Efecto combinado del pH y la temperatura de almacenamiento Con el objeto de evaluar la influencia que el pH ejerce sobre el crecimiento de S.aureus en el queso untable base se estudió su comportamiento a pH original del queso (5,0) y un pH más bajo (4,3) pero organolépticamente aceptable tal como se detalla en Materiales y Métodos, sección 3.5.3. Esta experiencia se llevó a cabo a 10, 15 y 22 °C. En la Figura 9a se puede observar que hubo un decaimiento de la población de S. aureus en queso untable base con pH 5,0 durante el almacenamiento a 10 y 15ºC pero se observó crecimiento de la misma a 22ºC. Puede observarse que la reducción de pH a 4,3 (Figura 9b) provoca la muerte del microorganismo a las tres temperaturas estudiadas siendo este descenso más pronunciado conforme aumenta la temperatura. Los resultados obtenidos muestran que el efecto a pH 4,3 resultó desfavorable para el normal crecimiento de S. aureus coincidiendo con lo descripto por Freitas y Malcata (2000), tanto a 10ºC ,como a 15ºC y 22ºC, quienes observaron que tanto en quesos semi-duros como en quesos blandos elaborados con leche de oveja la flora microbiana contaminante compuesta por diferentes géneros de la familia Enterobacteriaceae y el género Staphylococcus disminuía lentamente. La única flora constitutiva que se encontraba presente era la correspondiente a Bacterias Ácido Lácticas (BAL) (predominantemente los géneros Lactococcus, Lactobacillus y Leuconostoc) la cual, aumentaba su concentración desde un recuento inicial aproximado de 106-107 UFC/g en el día 0 hasta aproximadamente 108 UFC/g luego de 20 días de maduración. Estos autores observaron también que las BAL aumentaron su concentración desde el día 7 al 21 aproximadamente y luego se estabilizaron a los 35 días de almacenamiento. Por el contrario, el género Staphylococcus disminuía 2 ciclos logarítmicos a los 140 días. Con un propósito predictivo y de comparación con los resultados experimentales, se utilizó el programa de modelado de patógenos Pathogen Modeling Program (PMP), tal como se describe en Materiales y Métodos, sección 3.6.2. En el queso untable base (pH 5,0) y almacenado a 10ºC se observó una disminución de aproximadamente 4,5 ciclos logarítmicos en 40 días (Figura 9a). Esta situación se contradice con lo predicho por el programa PMP, el cual 68 Figura 9 : Comportamiento de S. aureus en el queso untable base almacenado a 10ºC (-♦- ), 15ºC ( -■- ) y 22ºC ( -▲-). (a) pH 5,0; (b) pH 4,3; (I): desvío estándar. a b 69 establece crecimiento de S. aureus (en un caldo de cultivo) con una fase de latencia de 10 días, aumento exponencial de la población hasta el día 35 y fase estacionaria a partir de allí (Figura 10a). En queso untable base almacenado a 15ºC, la respuesta de S.aureus fue nuevamente de muerte a lo largo del tiempo de almacenamiento pero con una reducción de 1 ciclo logarítmico en 22 días contradiciéndose nuevamente con lo predicho por el programa PMP (Figura 10 b). La Figura 10c muestra la curva de crecimiento de S. aureus en queso untable base (pH 5,0) a 22ºC junto a los datos predichos mediante la aplicación del programa predictivo PMP. En la misma se observa que el comportamiento de S. aureus a 22°C, predicho por el programa PMP determina que la fase de crecimiento exponencial comienza inmediatamente (sin período de fase lag) y termina en el día 5, mientras que experimentalmente se observó que el crecimiento exponencial comienza a partir del día 12 (tiempo de fase lag) y termina aproximadamente el día 28. Es decir que, si bien hay coincidencia en los valores observados y predichos para este microorganismo en las condiciones estudiadas, se produce un corrimiento en el tiempo ya que el comportamiento en la matriz alimentaria presenta un período de adaptación inicial que retrasa el crecimiento exponencial. Si bien este software predictivo es de muchísima utilidad en sistemas simples (como los sistemas modelo y medios de cultivo), en alimentos reales podría fallar dado que los factores intrínsecos propios del alimento así como también las interacciones que pudieran derivar entre ellos y los microorganismos (se trate de sinergismos o antagonismos) alteran la respuesta observada y la alejan de la predicción. En todo modelo predicho el comportamiento bacteriano está descripto para un medio de cultivo con los nutrientes óptimos para permitir, si fuera factible, el crecimiento bacteriano. Esta es posiblemente la causa por la que no se observó concordancia con la predicción (Whiting, 1997). 70 Figura 10 : Comportamiento de S.aureus en el queso untable base a pH 5,0 y diferentes temperaturas de almacenamiento. (a): 10º C, (b): 15ºC y (c): 22ºC . ( ▬ ) predicción , ( --- ) limite de confianza superior predicho, ( --- ) limite de confianza inferior predicho, (-♦- ) datos experimentales; (I) desvío estándar. a b c 71 Los modelos matemáticos usualmente se realizan con una mezcla de 3 a 5 cepas “típicas” (Whiting, 1997). De esta forma estos modelos predichos se traducen muchas veces en rápido crecimiento o por decirlo de otra forma en cepas de fácil desarrollo. Este mecanismo tiene la ventaja de que el modelo se convierta en un sistema “seguro”. Pero existe una diversidad natural en los tiempos de crecimiento o supervivencia de cepas de microorganismos patógenos. La otra fuente de variación no incluída en los modelos existentes es el estado fisiológico de la cepa y su historia previa. Hudson (1993) ha demostrado que la duración de la fase lag de Aeromonas hydrofila depende de la temperatura a la cual la cepa estaba sometida o mantenida en su estadío previo y de la nueva temperatura en la cual la cepa se encuentra en el alimento que ha contaminado. En cambio la fase de crecimiento exponencial posterior a la finalización de la fase lag no es afectada por la temperatura previa. Un patógeno en un determinado alimento adaptado a temperatura de refrigeración en una planta de procesamiento a 10ºC presentará una fase lag más corta y un comienzo más temprano del crecimiento exponencial ,si accidentalmente contamina ese mismo alimento refrigerado, que la que debería observarse en un modelo corriente. Baranyi y Roberts (1994) consideraron que la fase lag es una consecuencia de dos procesos, el primero reflejado por el estado previo en el que se encontraba la bacteria (por ejemplo temperatura) y el segundo dependiente del grado de ajuste de un ambiente (fisiológica y bioquímicamente) al siguiente ambiente o medio intrínseco. Con el propósito de determinar estadísticamente la influencia de la variable temperatura se realizó un análisis cuantitativo. Dado que a pH 5,0 se observó decaimiento de la población durante el almacenamiento a 10 y 15 °C se caracterizaron dichas curvas mediante la utilización del modelo primario antes descripto: Gompertz modificado. En el caso en donde se trabajó con queso untable base (pH 5,0) inoculado y almacenado a una temperatura de almacenamiento de 10ºC se observó que el modelo ajustó adecuadamente a los datos experimentales (Figura 11) con un coeficiente de determinación R2 de 99%. La Tabla 4 muestra los parámetros A, B y C que caracterizan a la curva así como también la significación del modelo (F = 927 muy significativo, α<0,01). La validación interna (Figura 12a y b) del modelo propuesto mostró concordancia entre los datos experimentales y predichos así como también 72 una distribución homogénea de los residuales. Como puede analizarse el modelo predijo la ausencia de hombro inicial (A= - 0,16 días); una velocidad de muerte de 0,05 día-1 y un cambio global (C) de 9,4 ciclos. Al parecer este modelo falló en la predicción de la caída total observada y esto pudiera deberse a la ausencia de una cola marcada en los datos experimentales, hecho que ya ha sido comentado. Figura 11: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 5.0) almacenado a 10ºC, () valores experimentales; (—) predicción . Log N/N0 0,6 -0,4 -1,4 -2,4 -3,4 -4,4 0 10 20 30 40 Tiempo (día) Tabla 4: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 10 ºC. Parámetro Estimador Error Estándar A -0,16 1,17 B -0,05 0,03 C -9,38 8,64 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 55,61 3 RESIDUAL 0,12 5 R2 ajustado FISHER 927** 99,01 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 73 Figura 12 : Validación interna del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 10 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (b) (a) 0,6 0,32 0,22 -0,4 Residuales Valores observados (—) predicción. 0,12 -1,4 0,02 -2,4 -0,08 -3,4 -0,18 -4,4 -4,4 -0,28 -3,4 -2,4 -1,4 -0,4 0,6 -4,4 Valores predichos -3,4 -2,4 -1,4 -0,4 0,6 Valores predichos El análisis correspondiente a queso untable base (pH 5,0) inoculado y almacenado a 15ºC fue efectuado en el ítem anterior (sección 4.2, Tabla 3) en donde se obtuvo en comparación con la temperatura anterior evaluada, 10 °C, un hombro inicial mayor (A= 5,9 días), una velocidad de muerte similar (B = - 0,43 d-1) y un cambio global en el numero de sobrevivientes significativamente menor (C = 1,4), hecho que está de acuerdo con el establecimiento de una temperatura más propicia para el desarrollo del microorganismo. A 22°C se observó crecimiento de S. aureus en queso untable base (pH 5,0). Dado que el comportamiento observado no fue lineal, se caracterizó la curva mediante el modelo de Gompertz (Figura 13), obteniendo los parámetros matemáticos característicos del mismo: A, B, C y M. Tal como se describió en Materiales y Métodos, sección 3.6.1.1 con los valores matemáticos de los parámetros correspondientes a la curva se obtuvieron los parámetros biológicos tiempo de generación (TG); velocidad de crecimiento exponencial (VCE) y tiempo de fase lag (LAG). La Figura 13 muestra una adecuada correlación entre los datos experimentales y los predichos por este modelo primario. 74 Figura 13: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 22ºC, () valores experimentales; (—) predicción 9,1 Log N 8,1 7,1 6,1 5,1 4,1 0 10 20 30 40 Tiempo (dia) La Tabla 5 resume el análisis de la varianza para el modelo propuesto. El valor de F para la regresión completa resultó muy significativo (α< 0,01) indicando que existe una relación estadísticamente significativa entre la respuesta observada y el modelo. El valor del coeficiente de determinación (R2) ajustado por grados de libertad indica que casi el 95,8 % de la variación de la respuesta ha sido explicada por el modelo propuesto. La Tabla 5 también presenta a los fines comparativos los valores de TG; VCE y LAG predichos por el programa terciario PMP para el microorganismo y condiciones estudiadas. Se realizó también validación interna del modelo mediante métodos gráficos, los cuales se presentan en la Figura 14. El gráfico de valores observados versus los valores predichos (Figura 14 a) presenta una distribución homogénea alrededor de la diagonal, con puntos muy cercanos a la misma, indicando alta correlación entre los mismos. Cuando se graficaron los residuales en función de los valores predichos (Figura 14b) se observó una distribución homogénea de los mismos en una banda horizontal alrededor de la predicción sin detectar conos o herraduras. Por todo lo expuesto, se concluyó que no existe razón para dudar que el modelo propuesto sea adecuado para describir la respuesta observada. 75 Figura 14 : Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 22 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (b) 0,4 (a) Residuales Valores observados 0,6 9,1 8,1 7,1 6,1 0,2 0 -0,2 -0,4 5,1 -0,6 4,1 4,5 5,5 6,5 7,5 8,5 4,1 9,5 5,1 6,1 7,1 8,1 9,1 Valores predichos Valores predichos Tabla 5: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 22 ºC Parámetro Estimador Error Estándar A 4,54 0,18 B 0,14 0,05 C 4,43 0,73 M 18,60 1,70 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 510,35 4 RESIDUAL 1,02 8 R2 ajustado 95,85 FISHER3 981** PARAMETROS BIOLÓGICOS2 Gompertz PMP TG (día) 1,17 0,10 VCE (Log UFC/g/día) 0,26 1,35 LAG (día) 18 0,67 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2 TG: tiempo de generación; VCE: velocidad de crecimiento exponencial; LAG: tiempo de fase lag.3NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. 1 76 El análisis de la Tabla 5 determina que comparando los parámetros biológicos característicos de la curva de crecimiento de S. aureus en queso base (pH 5,0; 22 °C) adecuadamente estimados por el modelo de Gompertz con la estimación del programa PMP puede verse que, este programa predice escaso tiempo de latencia (0,7 días vs. 18 días); triplica la velocidad de crecimiento exponencial respecto de la observada (1,4 Log UFC/g/día vs 0,3 Log UFC/g/día) y disminuye notoriamente el tiempo de generación respecto del observado (0,1 día vs 1,2 días). Si bien la temperatura favorece el crecimiento del microorganismo el alimento real no ofrece en este caso condiciones tan favorables como el medio de cultivo probablemente debido a la presencia de flora competitiva y/o posibles inhibidores. El análisis del comportamiento predicho por el programa PMP para la supervivencia de S. aureus en queso untable base con pH reducido (4,3) a 10, 15 y 22 °C se exhibe en la Figura 15 junto a los datos experimentales observados. Se observa que a 10ºC los datos experimentales siguen un comportamiento similar que el predicho por el programa PMP considerando los límites de confianza superior e inferior (Figura 15a). Hasta el día 20, la caída en ciclos logarítmicos en función del tiempo es perfectamente coincidente con el modelo. A partir de allí y hasta el día 40 se observa que experimentalmente el decrecimiento de la población se detiene registrándose una mayor pendiente lo que significa que la muerte del microorganismo se desacelera. Aún así el comportamiento bacteriano experimental entra dentro del rango predicho por el modelo. Para el tiempo de almacenamiento evaluado (~ 40 días) el programa PMP predice, en promedio, una declinación de 4 ciclos logarítmicos. A 15ºC (Figura 15 b) se observa que el programa PMP no predice decaimiento hasta el día 10 (1 ciclo logarítmico). Los datos experimentales demostraron que hubo un decaimiento de 3 ciclos logarítmicos en 14 días mientras que el programa PMP predice un decaimiento igual en 29 días. Esta tendencia se mantuvo conforme fue transcurriendo el tiempo de almacenamiento. Algo similar se observó a 22ºC (Figura 15 c) en donde los datos experimentales demostraron una caída de 4 ciclos logarítmicos en 18 días mientras que el programa PMP predice la misma caída en 30 días. 77 Figura 15: Comportamiento de S.aureus a pH 4,3 y 10º C(a), 15ºC (b) y 22ºC (c): (▬) predicción , ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho ,(-♦- ) datos experimentales. a b c 78 Si bien en las experiencias de reto microbiano realizadas en queso untable base con pH reducido (pH 4,3) se dispuso de escasos puntos experimentales se realizó un modelado primario solo con el fin de orientar sobre los parámetros característicos de las curvas obtenidas a 10, 15 y 22 °C y comparar con la predicción del programa PMP. A 10ºC se observó que el modelo de Gompertz modificado para supervivencia ajustó adecuadamente los datos experimentales (Figura 16). El análisis de la varianza (Tabla 6) estimó un valor de coeficiente de determinación R2 de 99,99% con un valor de F muy significativo (F = 8,4x108; α<0,001). El modelo fue validado internamente observando una distribución homogénea en torno a la línea diagonal de valores experimentales vs. valores predichos y desestimando anomalías en la distribución de residuales (Figura 17 a y b). En estas condiciones, el modelo estimó un hombro inicial de 3 días (A); una velocidad de muerte (B) de 0,17 día-1 y un cambio global en el número de sobrevivientes al final del almacenamiento de 3,6 ciclos logarítmicos (C), siendo este valor algo inferior a la caída predicha por el PMP (~ 4 ciclos logarítmicos, Figura 15a). Figura 16 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 4.3) almacenado a 10ºC, () valores experimentales; (—) predicción . Log N/N0 0,5 -0,5 -1,5 -2,5 -3,5 0 10 20 30 40 Tiempo (día) 79 Tabla 6: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 10 ºC Parámetro Estimador Error Estándar A 2,91 1,0x104 B -0,17 0,9x103 C -3,56 0,5x104 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 25,25 3 RESIDUAL 1,0x10-8 1 FISHER 8,4x108** R2 ajustado 99,99 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -) 1 Figura 17: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 10 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () -0,5 -1,5 -2,5 -3,5 -3,5 (b) (X 0,00001) 8 (a) 0,5 Residuales Valores observados valores experimentales; (—) predicción 4 0 -4 -8 -2,5 -1,5 -0,5 Valores predichos 0,5 -3,5 -2,5 -1,5 -0,5 0,5 Valores predichos A 15ºC el modelo primario de Gompertz modificado ajustó adecuadamente con un valor de R2 de 94% con un F muy significativo (Figura 18 y Tabla 7) .Esto indicaría que el modelo explica el 94% de las diferencias encontradas. 80 Figura 18: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base (pH 4.3) almacenado a 15ºC, () valores experimentales; (—) predicción . 0 Log N/N0 -0,5 -1 -1,5 -2 -2,5 -3 0 3 6 9 12 15 Tiempo (día) El análisis de validación interna (Figura 19 a y b), mostró una distribución homogénea de los datos experimentales alrededor de los datos predichos y una distribución sin alteraciones de los residuales en torno a una banda horizontal. Este modelo predijo un hombro inicial (A) cercano a los 2 días mientras que en la práctica éste resulto de aproximadamente 3 días. El parámetro C en ambos casos rondó los 3 ciclos logarítmicos en 15 días de almacenamiento y no se observó cola ya que la predicción es que la caída en ciclos logarítmicos continúa conforme transcurre el tiempo. 81 Tabla 7: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 15 ºC Parámetro Estimador Error Estándar A 1,60 0,90 B -0,20 0,17 C -3,89 2,14 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 14,76 3 RESIDUAL 0,20 2 R2 ajustado FISHER 49** 94,12 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 19: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 15 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; 0 (b) 0,34 (a) -0,5 Residuales Valores observados (—) predicción. -1 -1,5 -2 0,24 0,14 0,04 -0,06 -2,5 -0,16 -3 -3 -2,5 -2 -1,5 -1 -0,5 Valores predichos 0 -0,26 -3 -2,5 -2 -1,5 -1 -0,5 0 Valores predichos El análisis de la aplicación del modelo de Gompertz modificado a la curva de supervivencia de S. aureus en queso untable base con pH reducido (pH 4,3) y 22°C mostró que el mismo ajustó adecuadamente a los datos experimentales (Figura 20 y Tabla 8). El modelo representó en un 99,9 % la variación en la respuesta observada con la obtención del estadístico F muy significativo (α<0,01). La validación interna 82 realizada no mostró anomalías (Figuras 21 y 22). El modelo no predijo, tal como se observó experimentalmente, un hombro inicial (A); predijo una velocidad de muerte de 0,3 día-1 y un cambio global en el número de sobrevivientes (C) en 18 días de almacenamiento muy superior al observado experimentalmente (9 vs 4). Ya se ha comentado la debilidad de este modelo para predecir un salto en el número de sobrevivientes cuando la curva de supervivencia carece de cola marcada. Otros autores han observado igual desenvolvimiento del modelo en otros sistemas alimenticios estudiados. Figura 20 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base ( pH 4.3) almacenado a 22ºC, () valores experimentales; (—) predicción . Log (N/N0) 0 -1 -2 -3 -4 0 4 8 12 16 20 Tiempo (día) 83 Tabla 8: Ajuste del modelo de Gompertz modificado a los datos experimentales y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC Parámetro Estimador Error Estándar A -0,49 0,25 B -0,27 0,01 C -8,80 1,62 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 26,95 3 RESIDUAL 0,0004 1 FISHER 22458** R2 ajustado 99,98% SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 21: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC: Valores observados vs valores Valores observados predichos; 0 -1 -2 -3 -4 -4 -3 -2 -1 0 Valores predichos 84 Figura 22: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 4,3) almacenado a 22 ºC:Residuales vs. valores predichos . () valores experimentales; (—) predicción Residuales (X 0,001) 23 13 3 -7 -17 -4 -3 -2 -1 0 Valores predichos Ferrante y col. (2007) observaron que el valor del parámetro C estaba sobreestimado para las condiciones más severas de su experiencia en jugo de naranja tratado con ultrasonido y crecientes concentraciones de vainillina a modo de inhibir el crecimiento de L.monocytogenes. Linton y col. (1995) evaluaron la resistencia térmica de L.monocytogenes en fórmulas de alimentos infantiles tratadas a 50, 55 y 60ºC, pH cuyos valores ascendían de 5 a 7 y a concentraciones crecientes de NaCl (0,2 a 4 %).Estos autores observaron que conforme al aumento de temperatura se producía aceleración de la muerte bacteriana describiendo curvas con escasa o nula región de hombro y cola. El modelo sobreestimó el parámetro C. 85 4.4 Estudio de reto microbiano en queso untable base utilizando cepas responsables de ETA. 4.4.1 S.aureus Una vez evaluado el comportamiento de S.aureus en queso untable base frente a las diferentes variables estudiadas (temperatura, presencia de conservante y pH) se procedió a bacterias estudiar de manera análoga el comportamiento de cuatro distribuidas en el medio ambiente, fuertemente relacionadas con enfermedades transmitidas por alimentos y frecuentemente encontradas en productos lácteos: S.aureus, E.coli, S. Enteritidis y L.monocytogenes (Araujo y col., 2002). La experiencia se llevó a cabo tal como se describe en Materiales y Métodos, sección 3.5.4, en primer lugar, inoculando S.aureus en queso untable base y almacenando dicho producto a 6, 17 y 25°C para su posterior análisis. Se observó un decrecimiento no lineal de la población de S. aureus a 6ºC y 17ºC (Figura 23). A 25ºC, el comportamiento del mismo fue de neto crecimiento describiendo una curva algo sigmoidea. Todos estos datos resultaron coincidentes con los ensayos anteriormente descriptos a temperaturas similares (10°C; 15ºC y 22ºC) (Figura 9a ). La Figura 24a muestra la predicción por modelado terciario (programa PMP) del comportamiento de este microorganismo en un medio de cultivo pH 5,0 almacenado a 6°C, junto a los datos experimentales. El programa predice, en coincidencia con lo observado, un decrecimiento de la población. La muerte de este microorganismo en el queso untable base fue más rápida que la predicción promedio en un medio de cultivo a un dado tiempo de almacenamiento, más cercana al límite inferior predicho. De la misma manera la Figura 24b muestra que en queso untable base almacenado a 17ºC y pH 5.0, mientras experimentalmente se observó muerte de este microorganismo, el programa de modelado de patógenos, PMP predice el crecimiento del mismo. Las bacterias ácido-lácticas presentes en quesos son generalmente inhibitorias del crecimiento de S.aureus (Jorgensen y col., 2005). El pH y la presencia de flora láctica competitiva son factores importantes que probablemente afecten la presencia del patógeno ensayado (Ercolini y col., 2005). 86 Figura 23: Evaluación del comportamiento de S.aureus en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ), 17ºC ( -■- ) y 25ºC ( ▲-); (I) desvío estándar. La eficacia de los organismos competidores para controlar el crecimiento depende de la proporción del competidor con respecto a las células de microorganismo en cuestión (en este caso, S.aureus), del tipo de competidor, de la temperatura y del sustrato de crecimiento. El efecto de los competidores en la inhibición del crecimiento de S.aureus es muy variable, dependiendo del organismo y de la cepa. Las interacciones de los factores extrínsecos e intrínsecos sobre el crecimiento, sobre la supervivencia y sobre la muerte de S.aureus limitan el crecimiento a temperaturas sub-óptimas y retardan el crecimiento a temperaturas óptimas (ICMSF, 1996) A 25ºC, se observó que los datos experimentales describían un comportamiento similar al predicho por el programa PMP pero con una fase de latencia mayor, dato concordante con la necesidad de las células de S.aureus de llegar a una situación de equilibrio o situación amigable con los factores intrínsecos de la matriz alimentaria (Figura 24c). 87 Figura 24: Comportamiento predicho de S.aureus a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦-) datos experimentales. a b c 88 Dado que las curvas cinéticas obtenidas exhibieron un comportamiento no lineal, se realizó una evaluación cuantitativa de las mismas mediante la aplicación de modelado primario (Materiales y Métodos 3.6.1). Se aplicó los modelos de Gompertz en el caso en donde se observó crecimiento (25°C) y de Gompertz modificado en los casos de muerte (6 °C y 17°C). En las Figuras 25 y 27 se observa que la aplicación del modelo de Gompertz modificado representó adecuadamente el comportamiento de S.aureus en queso untable base almacenado a 6ºC y 17°C, respectivamente. Las Tabla 9 y 10 exhiben los parámetros A, B y C característicos del modelo junto a los estadísticos relacionados. Los ajustes logrados fue satisfactorios, obteniéndose valores de R2 ajustado entre 93% y 96 % con valores de F significativos (α<0.05). El análisis de los valores observados vs valores predichos (Figuras 26a y 28a) demostró que hubo una adecuada correlación entre los mismos. La distribución de residuales en torno a los valores predichos (Figuras 26b y 28b) fue homogénea no detectando esparcimiento en forma de herradura ó cono. Figura 25: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 6ºC, () valores experimentales; (—) predicción Log(N/N0) 0,6 -0,4 -1,4 -2,4 -3,4 0 10 20 30 40 Tiempo (día) 89 Tabla 9: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 6 ºC Parámetro Estimador Error Estándar A -1,17 0,43 B -0,06 0,006 C -14,43 1,27 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 39,38 3 RESIDUAL 0,38 4 FISHER2 146* R2 ajustado 93,00 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad. 2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. A: hombro de la curva de muerte (día) ; B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 26: Validación del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 6 ºC: a) Valores observados vs valores predichos; (b) (a) 0,6 0,51 Residuales Valores observados b) Residuales vs. valores predichos . () valores experimentales; (—) predicción -0,4 -1,4 0,11 -0,09 -2,4 -3,4 -3,4 0,31 -0,29 -2,4 -1,4 -0,4 Valores predichos 0,6 -0,49 -3,4 -2,4 -1,4 -0,4 0,6 Valores predichos 90 Figura 27: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base almacenado a 17ºC, () valores experimentales; (—) predicción. 0,1 Log(N/N0) -0,3 -0,7 -1,1 -1,5 -1,9 0 4 8 12 16 20 Tiempo (día) Tabla 10: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base almacenado a 17 ºC. Parámetro Estimador Error Estándar A -0,39 0,096 B -0,46 0,073 C -3,44 0,74 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 15,65 3 RESIDUAL 0,07 4 R2 ajustado FISHER2 261** 96,00% SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 91 Figura 28 : Validación del modelo propuesto para la inactivación de S.aureus en queso untable base almacenado a 17 ºC: a) Valores observados vs valores predichos; (a) 0,1 0,18 -0,3 0,08 -0,7 -0,02 -1,1 -0,12 -1,5 -1,9 -1,9 (b) 0,28 Residuales Valores observados b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. -1,5 -1,1 -0,7 -0,3 0,1 -0,22 -1,9 Valores predichos -1,5 -1,1 -0,7 -0,3 0,1 Valores predichos Nuevamente el modelo de Gompertz modificado falló en predecir la caída global del numero de sobrevivientes a 6 °C (C=14,4 ciclos) donde la curva experimental no presenta cola marcada con un descenso final a 34 días de almacenamiento de ~3,4 ciclos logarítmicos. Esto no ocurrió a 17°C donde la predicción de la caída global (C=3,4) fue más cercana a la observada experimentalmente (~ 2 ciclos) debido a la presencia de una fracción importante de microorganismos resistentes. Roberts (2002) observó caídas similares de la población de S. aureus en queso cheddar (pH 5,4) y en mozzarella (pH 5,3) sin agregado de sorbato de potasio y almacenados a 10°C, de entre 2,4 y 4 ciclos logarítmicos, respectivamente. Ambas condiciones de almacenamiento provocaron que la curva de muerte de este microorganismo no presentara hombro inicial (valores negativos de A). La velocidad de muerte fue algo mayor a 17°C (B = - 0,46 día-1) , hecho que probablemente se atribuya a que a esta temperatura se observó un descenso constante de la población durante todo el período de almacenamiento ensayado, hecho que podría atribuirse a una mayor proliferación a esta temperatura de flora competitiva. En el caso del comportamiento de S.aureus en queso untable base almacenado a 25ºC se observó crecimiento. Se aplicó el modelo de Gompertz modificado (Figura 29) obteniendo los parámetros característicos del mismo, 92 encontrándose que la aplicación de este modelo representó adecuadamente su comportamiento. Tal como se describió en Materiales y Métodos, sección 3.6.1.1 con los valores matemáticos de los parámetros correspondientes a la curva se obtuvieron los parámetros biológicos. Se determinaron por el ajuste de datos a la función de Gompertz por un procedimiento de estimación iterativa que determinó el mejor ajuste (Tabla 11). Al observarse una correcta representación del modelo se asimilaron dichos parámetros biológicos como los característicos de la curva experimental. El elevado valor de R2 ajustado, indica que el modelo ajustó adecuadamente a los datos experimentales, pudiendo explicar el 98,5 % de las variaciones en la respuesta observada. Asimismo, el estadístico F resultó muy significativo (α≤0,01) lo que confirma que las variaciones de la información explicada por el modelo es significativamente mayor que la variación debida a causas no identificables y que el efecto observado no se debió al azar. En el gráfico de valores observados vs valores predichos (Figura 30a) se observa que hubo una adecuada correlación .Los distribución de residuales (Figura 30 b) también fue homogénea entorno a los valores predichos. Se realizó finalmente el estudio comparativo de los datos biológicos tiempo de generación (TG), fase de latencia (LAG) y crecimiento exponencial (VCE), calculados a partir de los parámetros extraídos de la ecuación de Gompertz con los valores predichos por el programa de modelado terciario, PMP. En el caso de S.aureus inoculado en queso crema base almacenado a 25ºC, se observa que el tiempo de generación, predicho por PMP fue 0,07 días mientras que el predicho por el modelo primario fue 0,54 días. Ambos modelos, en concordancia, predijeron TG inferiores a 1 día aunque, como es de esperar algo menor en el caso de la predicción medio de cultivo donde no se considera la presencia de flora competitiva y/o inhibidores (Tabla 11). Ambos modelos coincidieron en la predicción de la velocidad de crecimiento. La fase de latencia predicha por el modelo primario fue superior (5días) a la estimación del programa PMP (0,42 días). La fase de latencia representa el tiempo de ajuste que necesita el inóculo desde la fase de preincubación en su medio de cultivo 93 Figura 29: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción 9 Log N 8 7 6 5 0 3 6 9 12 15 18 Tiempo (dia) Tabla 11: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) almacenado a 25 ºC Parámetro Estimador Error Estándar A 5,11 0,12 B 1,41 0,30 C 2,79 0,18 M 6,42 3,29 ANÁLISIS DE LA DESVIACIÓN1 Fuente MODELO RESIDUAL R2 ajustado SS 313,63 0,09 98,46 FISHER3 gl 4 3 2613** PARAMETROS BIOLÓGICOS2 TG (día) VCE (Log UFC/g/día) Gompertz 0,54 0,55 PMP 0,07 0,59 LAG (día) 5,0 0,42 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. 1 94 Figura 30: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos. () valores experimentales; (a) 9 (b) 0,21 Residuales Valores observados (—) predicción 8 7 6 0,11 0,01 -0,09 -0,19 5 5,1 5,6 6,1 6,6 7,1 Valores predichos 7,6 8,1 5 6 7 8 9 Valores predichos óptimo y la nueva fase, probablemente menos favorable, con otras condiciones intrínsecas (pH, nutrientes, flora extra, etc) .La duración de la fase de latencia depende de ambas situaciones : la primera situación de crecimiento en el medio de cultivo y la nueva situación de crecimiento en el queso (Hudson,1993). 95 4.4.2 E. coli Los datos experimentales correspondientes al desarrollo de E. coli en queso unatble base a 6ºC; 17ºC y a 25ºC mostraron un comportamiento similar al observado con S.aureus (Figura 31). Utilizando el programa de modelado terciario PMP se observó que, en el caso de temperatura de almacenamiento 6ºC, el mismo predice una disminución de la población de E. coli en medio de cultivo, de forma coincidente con los datos experimentales observados pero con un perfil muy diferente (Figura 32a). Mientras el programa PMP predice un hombro inicial de aproximadamente 7 días, para luego inmediatamente caer 3 ciclos logarítmicos y a partir de allí un descenso progresivo, la curva experimental no presenta hombro y exhibe una declinación muy escasa de la población. A 17ºC, la población de E.coli disminuyó conforme aumentó el tiempo de almacenamiento, resultados que no condicen con la predicción del programa PMP, el cual, propone crecimiento para dichas condiciones y en medio de cultivo (Figura 32b). Las diferencias observadas se deben posiblemente a que se trata de una temperatura sub-óptima y que E.coli patógena no desarrolla en los quesos fermentados a pH <5,4 (ICMSF,1996). Ya se ha comentado que también podría deberse a la presencia de algún componente inhibidor de crecimiento en el queso. Montville (1997) describió que el crecimiento bacteriano está gobernado al menos por tres factores (pH, aw y temperatura) y en muchos casos existen interacciones entre ellos. Estos autores mencionaron también que estas interacciones o sinergismos describen como diferentes factores extrínsecos e intrínsecos del alimento afectan la habilidad del microorganismo de sobrevivir o iniciar su fase de crecimiento. Ciertas investigaciones (Roberts e Ingram, 1973) observaron la necesidad de estudiar los efectos interactivos de varios parámetros influyentes en el crecimiento bacteriano sumado a la producción de metabolitos tóxicos. Esto podría explicar la no coincidencia con lo predicho por el programa PMP. A 25ºC, temperatura cercana a la temperatura óptima de crecimiento (35ºC40ºC) definida en la bibliografía (ICMSF,1996), se observó que los datos experimentales son coincidentes con lo predicho por el programa de modelado de patógenos, PMP con la diferencia de una fase de latencia de mayor duración (3 días 96 aproximadamente), una fase de crecimiento exponencial que va desde el día 3 al día 8 (con una pendiente ó velocidad de crecimiento menos pronunciada que la predicha) ,para finalmente, a partir del día 8, llegar al período de crecimiento estacionario, perfil que es coincidente con lo comentado en los párrafos anteriores (Figura 32c ). Figura 31: Evaluación del comportamiento de E.coli en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ),17ºC ( -■- ) y 25ºC (-▲- ); (I):desvío estándar. Dado que las curvas de inactivación presentaron desviaciones significativas de la linealidad, se consideró apropiado aplicar regresión no lineal, teniendo en cuenta todas las partes de la curva de inactivación (Linton y col., 1995). Se aplicó el modelo de Gompertz modificado a las curvas de inactivación de E. coli obtenidas a 6°C y 17°C, calculando los parámetros característicos del mismo, según la metodología descripta en Materiales y Métodos, 3.6.1.2 Las Figuras 33 y 35 muestran un correcto ajuste del modelo a los datos experimentales. Las tablas 12 y 13 exhiben los parámetros característicos A; B y C junto a los estadísticos relacionados. El modelo ajustó correctamente en ambos casos, tal como se evidencia por los elevados coeficientes de determinación obtenidos (R2 = 99,9 y 98,1%, respectivamente); la adecuada correlación entre valores observados y predichos y una homogénea distribución de residuales (Figuras 34 y 36). 97 Figura 32: Comportamiento predicho de E.coli a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c): ( ▬ ) predicción , ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) datos experimentales a b c 98 Figura 33: Ajuste del modelo de Gompertz modificado a la curva de inactivación de E.coli en queso untable base almacenado a 6ºC, () valores experimentales; (—) predicción Log(N/N0) 0,07 -0,03 -0,13 -0,23 -0,33 -0,43 0 4 8 12 16 20 Tiempo (día) Tabla 12: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 6 ºC Parámetro Estimador Error Estándar A 2,39 0,06 B -0,10 0,01 C -1,84 0,37 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 0,28 3 RESIDUAL 0,00002 3 R2 ajustado FISHER2 13283** 99,98 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 99 Figura 34: Validación interna del modelo propuesto para la supervivencia de E.coli en queso untable base (pH 5,0) almacenado a 6 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) (a) -0,03 -0,13 -0,23 -0,33 -0,43 -0,43 -0,33 -0,23 (b) (X 0,0001) 48 0,07 Residuales Valores observados predicción. -0,13 -0,03 28 8 -12 -32 -0,43 0,07 -0,33 -0,23 -0,13 -0,03 0,07 Valores predichos Valores predichos Figura 35: Ajuste del modelo de Gompertz modificado a la curva de inactivación de E.coli en queso untable base almacenado a 17ºC, () valores experimentales; (—) predicción. Log(N/N0) 0,6 0,1 -0,4 -0,9 -1,4 -1,9 -2,4 0 3 6 9 12 15 18 Tiempo (día) 100 Tabla 13: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 17 ºC. Parámetro Estimador Error Estándar A 2,88 2,00 B -0,25 0,20 C -2,80 0,89 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS FISHER2 gl MODELO 8,02 3 RESIDUAL 0,04 2 133** R2 ajustado 98,12 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. A: hombro de la curva de muerte (día); B: máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 36: Validación interna del modelo propuesto para el comportamiento de E.coli en queso untable base (pH 5,0) almacenado a 17 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (b) (a) 0,6 0,2 0,1 Residuales Valores observados (—) predicción -0,4 -0,9 -1,4 -1,9 -2,4 -2,4 -1,9 -1,4 -0,9 -0,4 0,1 Valores predichos 0,6 0,1 0 -0,1 -0,2 -2,4 -1,9 -1,4 -0,9 -0,4 0,1 0,6 Valores predichos El análisis del comportamiento de E.coli que permite el modelo de Gompertz modificado define a 17 °C una curva sigmoidea con un hombro extenso en función del tiempo (~ 3 días) para luego exhibir una caída mayor que la estimada a 6°C. 101 Esto sugiere la presencia de otros factores influyentes en el comportamiento ó adaptación de las células bacterianas al alimento. Roberts y col. (2002) describieron que no hubo diferencias significativas en el recuento bacteriano de E. coli O157:H7 entre el sistema control (0% sorbato de potasio) y sistemas con concentraciones crecientes de sorbato de potasio (0.1, 0.15, 0,20 y 0.30 %) en queso cheddar y mozzarella, durante 70 días de almacenamiento a 10°C. Esto podría ser una evidencia de que la muerte observada de E.coli en queso con humedad media y alta no estaría relacionada al poder inhibitorio de un conservante químico. Se ajustó con éxito el modelo de Gompertz a la curva de crecimiento de E.coli en queso crema base a 25ºC (Figura 37). La Tabla 14 exhibe los parámetros característicos del modelo junto a los estadísticos relacionados evidenciando que el ajuste logrado fue muy satisfactorio (α< 0,01) obteniéndose un R2 ajustado de 94,5%; adecuada distribución de valores observados en torno a los predichos y de residuales vs. valores predichos (Figura 38 a y b). Figura 37: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de E.coli en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción 8,4 Log N 7,4 6,4 5,4 4,4 3,4 0 2 4 6 8 10 Tiempo (dia) 102 Tabla 14: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de E.coli en queso untable base (pH 5.0) almacenado a 25 ºC Parámetro Estimador Error Estándar A 3,93 0,19 B 0,56 0,05 C 5,33 1,63 M 6,77 1,00 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS FISHER3 gl MODELO 239,77 4 RESIDUAL 0,60 4 R2 ajustado 94,51 399 ** PARAMETROS BIOLÓGICOS2 Gompertz PMP TG (día) 0,26 0,04 VCE (Log UFC/g/día) 1,18 5,9 LAG (día) 5,75 0,22 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *: significativo al 5% ;**: muy significativo al 1%. 1 El estudio comparativo entre los parámetros biológicos que caracterizan el crecimiento de E.coli almacenado a 25ºC entre y los valores predichos por PMP evidencian que el PMP predice LAG y TG menores, concordantes con una VCE mayor que los correspondientes estimados por Gompertz (Tabla 14). 103 Figura 38: Validación interna del modelo propuesto para el crecimiento de E.coli en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) 8,4 0,55 (a) 7,4 Residuales Valores observados predicción. 6,4 5,4 4,4 3,4 3,9 4,9 5,9 6,9 7,9 Valores predichos 8,9 (b) 0,35 0,15 -0,05 -0,25 -0,45 3,4 4,4 5,4 6,4 7,4 8,4 Valores predichos Con lo anteriormente observado se puede deducir que el microorganismo en queso precisó mayor adaptación al medio y asimismo creció a menor velocidad que la predicha en un sistema ideal. Datos bibliográficos (Lars, 2004) indican que ciertas especies de los géneros más usados en la industria láctea, Lactococcus y Leuconostoc, desarrollan a temperatura de refrigeración (~ 10ºC) y no desarrollan a mayores temperaturas (~ 40ºC) hecho que podría relacionarse con su mayor y menor poder inhibitorio, respectivamente. Si bien en el presente estudio se utilizaron 2 temperaturas cercanas a 10ºC (6 y 17 ºC) y una temperatura mayor (25ºC) el comportamiento observado no se contradice con lo anteriormente explicado ya que E.coli presentó muerte conforme transcurrió el tiempo (6 y 17ºC) y neto crecimiento a mayor temperatura (25ºC). Su comportamiento frente a las temperaturas estudiadas es justamente inverso al comportamiento de las bacterias lácticas; dicho de otra manera mientras a bajas temperaturas algunas bacterias lácticas desarrollan el patógeno E.coli muere. Lars (2004) afirma que las bacterias lácticas tienen un importante rol en la preservación de alimentos. Sería causa de otros estudios para explicar la mayor caída (aunque leve) en ciclos log observada a 17ºC con respecto a lo observado a 6°C. 104 4.4.3. S. Enteritidis En la Figura 39 puede observarse el desarrollo de S.Enteritidis en queso untable base almacenado a 6ºC, 17ºC y 25ºC. Al igual que con S. aureus y E. coli; la población de S.Enteritidis decreció en función del tiempo a 6ºC y 17ºC pero mostró crecimiento neto a 25°C. El programa PMP predijo a 6ºC y 17ºC muerte bacteriana coincidente con los resultados obtenidos, pero si se observan los gráficos superpuestos (Figura 40 a y b) se evidencia la curva de muerte de S.Enteritidis en el queso untable base a una velocidad muy inferior (2 ciclos logarítmicos en 37 días) a la predicha por el programa PMP, el cual estimó una caída de 5 ciclos logarítmicos en 2,5 días. A 25ºC experimentalmente se comprobó crecimiento a pesar que la predicción por el PMP es de muerte bacteriana Figura 39 c) ; PMP predice crecimiento de S.Enteritidis a 25ºC a un pH > 5.4 (en caldo nutritivo). Figura 39: Evaluación del comportamiento de S.Enteritidis en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ),17ºC ( -■- ) y 25ºC ( -▲- ); (I):desvío estándar. 105 Figura 40 : Comportamiento predicho de S.Enteritidis a pH 5,0 y 6º C (a), 17ºC (b) , 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) datos experimentales. a b c* *en este caso no se superpuso la respuesta observada ya que se registró crecimiento (ver figura 39) 106 Datos bibliográficos indican que Salmonella spp. en medios ligeramente ácidos (pH 5.5) (prechoque) seguida de la exposición de las células adaptadas al valor de pH menor (choque ácido) desencadenan una compleja respuesta de ácidotolerancia que potencia la supervivencia del microorganismo en medios ácidos (pH< 5,4). La respuesta se traduce en una síntesis de de 43 proteínas de choque ácido en la fase logarítmica de crecimiento y de 15 proteínas de choque ácido en la fase estacionaria. Probablemente estos sistemas actúan en los medios ácidos que predominan en los alimentos fermentados y acidificados. El estrés ácido también puede desencadenar resistencia bacteriana aumentada frente a otras condiciones ambientales adversas (Daoust, 1997). Las curvas de supervivencia obtenidas a 6 y 17°C se caracterizaron utilizando el modelo de Gompertz modificado. Las Figura 41 y 43 muestra un adecuado ajuste del modelo a los datos experimentales. El análisis de la varianza (Tablas 15 y 16) arrojó valores de R2 entre 99,2% y 97,3% con F muy significativo (α < 0,01). La validación interna realizada (Figuras 42 y 44) mostró que en los gráficos de valores observados vs predichos así como en el gráfico de residuales vs. valores observados los datos experimentales y los predichos presentaron distribución homogénea. Figura 41 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.Enteritidis en queso untable base (pH 5,0) almacenado a 6ºC, () valores experimentales; (—) predicción Log(N/N0) 0 -0,4 -0,8 -1,2 -1,6 -2 0 10 20 30 40 Tiempo (día) 107 Tabla 15: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 6 ºC Parámetro Estimador Error Estándar A 1,12 0,28 B -0,12 0,02 C -2,17 0,16 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 15,23 3 RESIDUAL 0,02 4 2 FISHER2 1016** 99,23 R ajustado SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 Figura 42: Validación interna del modelo propuesto para S.Enteritidis en queso untable base (pH 5,0) almacenado a 6 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) Valores observados predicción (b) (a) 0,3 0,1 -0,1 Residuales 0,06 -0,5 0,02 -0,9 -0,02 -1,3 -1,7 -2,1 -2,1 -0,06 -1,7 -1,3 -0,9 -0,5 -0,1 Valores predichos 0,3 -0,1 -2 -1,6 -1,2 -0,8 -0,4 0 Valores predichos 108 Figura 43: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.Enteritidis en queso untable base (pH 5,0) almacenado a 17ºC, () valores experimentales; (—) predicción Log(N/N0) 0,9 -0,1 -1,1 -2,1 -3,1 0 4 8 12 16 20 24 Tiempo (día) Tabla 16: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 17 ºC Parámetro Estimador Error Estándar A 0,94 0,03 B -0,16 0,06 C -3,65 0,07 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 29,90 3 RESIDUAL 0,15 4 R2 ajustado FISHER2 249** 97,29 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 109 Figura 44: Validación interna del modelo propuesto para el crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 17 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción (b) 0,33 0,9 Residuales Valores observados (a) -0,1 -1,1 -2,1 0,23 0,13 0,03 -0,07 -0,17 -0,27 -3,1 -3,1 -2,1 -1,1 -0,1 0,9 Valores predichos -3,1 -2,1 -1,1 -0,1 0,9 Valores predichos De acuerdo a los parámetros estimados, S. Enteritidis en queso untable base almacenado presentó perfiles de supervivencia similar a 6° C y 17°C con valores de hombro inicial (A) cercanos a 1 día; velocidades de muerte similares (B) entre 0,12 y 0,16 día-1 y una caída global algo mayor a 17°C que a 6°C, tal como se observó con los otros microorganismos estudiados. Dado que S. Enteritidis creció en el queso untable base almacenado a 25°C, se caracterizó dicha curva mediante el modelo de Gompertz. En la Figura 45, puede observarse que hubo un buen ajuste con el modelo propuesto ya que la predicción es coincidente con los valores experimentales. El análisis de la varianza (Tabla 17) arrojó un R2 de 96,5% con F significativo (α < 0,05). La validación interna del modelo no mostró tampoco en este caso anomalías (Figura 46 a y b). 110 Figura 45: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 25ºC, () valores experimentales; (—) predicción 8,7 Log N 7,7 6,7 5,7 4,7 3,7 0 2 4 6 8 10 Tiempo (dia) Varios estudios han subrayado la capacidad aumentada de los microorganismos que crecen en condiciones ácidas (pH~5) o en medios de salinidad elevada (>2% NaCl) a temperaturas óptimas para su crecimiento o cercanas (Ferreira, 1987;Thomas, 1992). El género Salmonella está integrado por microorganismos resistentes que se adaptan fácilmente a las condiciones extremas del medio. Además, la capacidad de adaptación fisiológica de Salmonella spp. se demuestra por su capacidad de multiplicarse a valores de pH desde 4.5 a 9.5 con un pH óptimo de crecimiento de 6.5 hasta 7.5 al igual a lo observado con respecto a la temperatura de almacenamiento (temperatura óptima de crecimiento 37ºC con un rango que va desde 2ºC a 54ºC), tal como se ha observado en el presente estudio. 111 Tabla 17 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) almacenado a 25 ºC Parámetro Estimador Error Estándar A 4,14 0,16 B 0,82 0,16 C 4,42 0,71 M 7,04 0,40 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS FISHER3 gl MODELO 213,98 4 RESIDUAL 0,24 3 R2 ajustado 96,50 668** PARAMETROS BIOLÓGICOS2 Gompertz TG (día) 0,27 VCE (Log UFC/g/día) 1,10 LAG (día) 5,33 PMP ------- SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2 TG: tiempo de generación; VCE: velocidad de crecimiento exponencial; LAG: tiempo de fase lag.3NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%. 1 0,06 8,7 (a) 7,7 (b) 0,04 Residuales Valores observados Figura 46: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de S.Enteritidis en queso untable base (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción 6,7 5,7 4,7 0,02 0 -0,02 -0,04 3,7 -0,06 4,1 5,1 6,1 7,1 Valores predichos 8,1 4,4 5,4 6,4 7,4 8,4 Valores predichos 112 4.4.4. L.monocytogenes La Figura 47 exhibe el comportamiento de L.monocytogenes inoculada en el queso untable base a pH 5,0 y almacenado a 6ºC, 17ºC y 25ºC. Esta experiencia se llevó a cabo tal como se describe en Materiales y Métodos, sección 3.4.5.4. Puede observarse una disminución de la población, con similar perfil de inactivación en todos los casos aunque a 6°C, se observó una leve recuperación parcial de la población a partir de los 23 días de almacenamiento. Figura 47: Evaluación del comportamiento de L.monocytogenes en queso untable base, pH 5,0 a diferentes temperaturas de almacenamiento: 6ºC (-♦- ),17ºC ( -■- ) y 25ºC ( -▲- ); (I): desvío estandar. Haciendo un estudio comparativo entre los datos experimentales y los predichos por el programa de modelado de patógenos PMP se observó (Figura 48) que mientras a las tres temperaturas estudiadas el programa PMP predice crecimiento en caldo de cultivo, los datos experimentales confirmaron muerte de la población bacteriana. Debe considerarse una vez más, que la inhibición del crecimiento encontrada experimentalmente en el queso untable base no es contemplada por el programa de modelado terciario PMP ya que están presentes ciertas variables propias del queso untable que no son consideradas en el modelo predicho. 113 Figura 48: Comportamiento predicho de L.monocytogenes a pH 5,0 y 6º C (a), 17ºC (b) y 25ºC (c) : ( ▬ ) predicción, ( --- ) límite de confianza superior predicho, ( --- ) límite de confianza inferior predicho, (-♦- ) datos experimentales. a b c 114 Una de las bacterias lácticas utilizadas en la elaboración del queso es Lactococcus lactis subsp.lactis, productor de nisina. La nisina, fue la primer bacteriocina aislada a partir de la bacteria ácido láctica Lactococcus lactis subsp lactis. Es la bacteriocina mejor caracterizada y es utilizada como conservador de alimentos .Es la única reconocida por la FDA con categoría GRAS (Generally Recognized as Safe). Se produce de forma natural en algunos productos lácteos y se utiliza en la producción de alimentos como un aditivo en dichos productos para prevenir la descomposición ocasionada por bacterias Gram positivas, especialmente de los géneros Clostridium, Staphylococcus, Bacillus y Listeria ( Delves-Broughton, 1990 ; Gonzalez y col.,2003). Esta podría ser la razón de la diferencia observada entre los datos experimentales y los predichos por el programa de modelado de patógenos PMP. Con el propósito de caracterizar las curvas de muerte obtenidas se aplicó el modelo de Gompertz modificado a las tres temperaturas estudiadas. Las Tablas 18; 19 y 20 exhiben los parámetros estimados que representan las diferentes regiones de la curva de supervivencia junto a los estadísticos de ajuste del modelo. El ajuste del modelo resultó altamente satisfactorio a las 3 temperaturas de almacenamiento, obteniéndose valores de R2 ajustado por grados de libertad entre 94 y 98%.El mismo describió a las 3 temperaturas curvas sigmoideas donde la temperatura pareció no tener influencia en el cambio global de numeró de sobrevivientes. Los valores de F muy significativos (α<0,01), demostraron que el modelo fue apropiado para describir el comportamiento observado tal como se observa en la Figura 49. La validación del modelo fue correcta tal como puede observarse en los gráficos de valores observados y predichos (Figuras 50). 115 Figura 49 : Ajuste del modelo de Gompertz modificado a la curva de inactivación de L.monocytogenes en queso untable base (pH 5,0) almacenado a 6ºC (a),17°C (b) y 25°C (c) () valores experimentales; (—) predicción 0,8 (a) -0,3 LogNN0 LogNN0 0,7 -1,3 -2,3 (b) -0,2 -1,2 -2,2 -3,2 -3,3 0 10 20 30 40 0 50 4 8 12 16 20 24 Tiempo (día) Tiempo (día) LogNN0 0,7 -0,3 (c) -1,3 -2,3 -3,3 0 10 20 30 40 Tiempo (día) A 6ºC y 25°C el modelo primario de Gompertz modificado estimó valores de los parámetros característicos similares: una región de hombro (A) muy poco marcada coincidiendo con los datos experimentales observados. El cambio global en el número de sobrevivientes (C) en los 3 ciclos logarítmicos observando una cola larga (Figura 49 a). El modelo, como ocurre generalmente, no pudo caracterizar la leve recuperación observada luego de 27 días de almacenamiento. A 17ºC el modelo estimó un mayor tiempo de latencia antes de comenzar la inactivación del microorganismo (hombro). Tal como ocurrió en los apartados anteriores, el mismo sobrestimó el cambio global en el número de sobrevivientes (C) en comparación con los valores observados. El parámetro B, el cual indica la velocidad de muerte máxima, fue similar a las 3 temperaturas estudiadas, demostrando que la temperatura no tuvo influencia en al inactivación observada. Este hecho confirma, junto con la predicción de crecimiento a estas temperaturas del programa PMP la posible presencia de un agente inhibidor en el queso untable base. 116 Tabla 18: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 6 ºC Parámetro Estimador Error Estándar A 1,64 0,27 B -0,25 0,10 C -3,02 0,18 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 51,77 3 RESIDUAL 0,41 5 R2 ajustado FISHER2 215** 94,26 Tabla 19: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 17 ºC Parámetro Estimador Error Estándar A 1,78 0,50 B -0,11 0,05 C -4,76 1,65 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 21,18 3 RESIDUAL 0,12 4 R2 ajustado FISHER2 235** 98,14 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -) 1 117 Tabla 20: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de L.monocytogenes en queso untable base (pH 5.0) almacenado a 25 ºC Parámetro Estimador Error Estándar A 1,34 0,65 B -0,22 0,08 C -3,36 0,37 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 18,83 3 RESIDUAL 0,33 4 R2 ajustado FISHER2 76** 94,23 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 118 Figura 50: Validación interna: Análisis estadístico del modelo propuesto para el crecimiento de L.monocytogenes en queso untable base (pH 5,0). a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción - 6°C (b) 3 -0,3 Residuales Valores observados (a) 0,7 -1,3 -2,3 2 1 0 -1 -2 -3,3 -3,3 -2,3 -1,3 -0,3 -3 0,7 -3,3 Valores predichos -0,3 0,7 17°C 0,8 0,4 -0,2 -1,2 -2,2 -3,2 -3,2 -2,2 -1,2 -0,2 0,2 0 -0,2 -0,4 0,8 -3,3 Valores predichos - -2,3 -1,3 -0,3 0,7 Valores predichos 25°C 6 0,7 Residuales Valores observados -1,3 Valores predichos Residuales Valores observados - -2,3 -0,3 -1,3 -2,3 4 2 0 -2 -4 -3,3 -3,3 -2,3 -1,3 -0,3 Valores predichos 0,7 -6 -3,3 -2,3 -1,3 -0,3 0,7 Valores predichos La bibliografía reporta resultados contradictorios en cuanto al desarrollo de L. monocytogenes en quesos. 119 Roberts (2002) encontró que este microorganismo no se desarrollaba cuando se lo inoculaba en queso mozzarella (pH 5,3) y cheddar (pH 5,0) almacenado a 10°C y sin la presencia de sorbato de potasio siguiendo, en concordancia con este trabajo, una cinética no lineal. Por otro lado, Urlich y col. (2006) estudiaron el comportamiento de L.monocytogenes en queso Blanco (queso blanco, semi-blando elaborado con leche pasteurizada ,sal, enzimas y cultivos lácticos, sin aditivos) y observaron que a las diferentes temperaturas de almacenamiento (5ºC, 10ºC, 15ºC, 20ºC y 25ºC) el microorganismo describía una marcada curva de crecimiento de forma típicamente sigmoidea. La leche y los quesos fueron los alimentos investigados primero y se encuentran entre los alimentos estudiados más extensamente. Pueden estar contaminada una gran variedad de quesos, pero son de interés máximo los quesos blandos con una frecuencia de contaminación con L.monocytogenes del 2 al 10%. Rocourt (1997) vió que existe una correlación significativa del crecimiento de L.monocytogenes con los valores de pH (>5.5) y con la ausencia de cultivos iniciadores durante la fabricación del queso. El yogur (los cultivos lácticos termófilos inhiben el crecimiento de Listeria) rara vez está contaminado Queda por evaluar si la única recuperación observada experimentalmente luego de los 35 días de almacenamiento a 6ºC no responde al patrón descripto por Urlich y col. (2002) luego de superado un período de stress traducido en muerte bacteriana. Los resultados de reto microbiano con patógenos relevantes obtenidos en esta tesis están en concordancia con otros resultados reportados en bibliografía. Smittle y Flowers (1994) observaron que el programa PMP falló en predecir el comportamiento de Salmonella spp. y L. monocytogenes en una ensalada con jamón. Hudson y Mott (1993) observaron que L. monocytogenes, Aeromonas hydrophila; y Yersinia entercolítica creció más lentamente a 4°C y 10°C en paté que lo que predijo el programa PMP. Estudios realizados por Buchanan y Bagi (1994) han demostrado que este programa puede proveer una buena primera estimación del comportamiento de E. coli O157:H7 en alimentos. Walls y Scott (1997) encontraron discrepancias entre la predicción del tiempo de fase lag en este programa y el crecimiento de Listeria spp en un alimento infantil estéril evaluado a diferentes temperaturas (1235°C), pH (5,3-6,8) y niveles de sal agregada (2,9%-4,1% NaCl). 120 4.5 Uso de antimicrobianos naturales: timol Con el objetivo de evaluar la posible capacidad antimicrobiana del timol se estudió el comportamiento a lo largo del tiempo de S.aureus en queso untable base con el agregado de (0,3% p/p) timol y almacenado a 6ºC, 17ºC y 25ºC y de S.Enteritidis en la misma matriz alimenticia, almacenada a 17ºC. La experiencia se llevó a cabo tal como se describió en Materiales y Métodos, sección 3.4.5.5. La concentración de timol utilizada resultó ser la más apropiada desde el punto de vista organoléptico (Materiales y Métodos, sección 3.4.2). Los datos experimentales muestran que a 6 y 17ºC (Figura 51 a y b) S.aureus y a 17ºC S.Enteritidis (Figura 52) respectivamente la pendiente de la curva de inactivación descripta fue mayor en ausencia de timol. La experiencia observada fue diferente conforme aumentó la temperatura de almacenamiento (Figura 51 c). Tal es así, que a 25ºC la curva descripta por S.aureus demostró crecimiento pero llamativamente el crecimiento observado fue mayor en ausencia de timol. En muchos estudios se ha observado una rápida acción germicida del timol. Zhou y col. (2006), Viuda-Martos y col.(2006) investigaron la actividad antimicrobiana de cinamaldehido, timol y carvacrol contra S. typhimurium en un medio de cultivo. Ellos encontraron que concentraciones de estos compuestos entre 0,02 y 0,04% p/p fueron suficientes para inhibir a este microorganismo. Sokmeny col. (2004) demostraron la capacidad del aceite esencial de tomillo en para inhibir el crecimiento de hongos como Alternaria spp, A. flavus, Fusarium spp. y Penicillium spp. Esta capacidad antifúngica del aceite esencial de tomillo también ha sido demostrada por Montes y Carvajal (1998) y Basilico y Basilico (1999) sobre los hongos, tales como A. flavus, Aspergillus parasiticus, Aspergillus ochraceus, Aspergillus fumigatus y Fusarium spp. Según Soliman y Badeea (2002), este efecto antifúngico podría ser causada por el contenido de b-pineno de aceite esencial de tomillo, ya que puede alcanzan valores de 30 a 37.6%. En el presente estudio el tratamiento con timol en una concentración superior (0,3% p/p) no resultó en una mayor inactivación bacteriana sino que por el contrario, el mismo ejerció una acción protectora. 121 Figura 51: Comportamiento de S.aureus en queso untable base con (-♦-) y sin agregado de (-♦-) timol (0,3% p/p), pH 5,0, almacenado a tres temperaturas: (a) 6ºC, (b) 17ºC, (c) 25ºC ; (I):desvío estándar. a b c 122 Figura 52: Comportamiento de S.Enteritidis en queso untable base con (-♦-) y sin agregado de (-♦-) timol (0,3% p/p), pH 5,0 almacenado a 17ºC; (I): desvío estandar. Juven y col. (1994) sugirieron que los alimentos con cierto tenor de grasa (Materiales y Métodos, sección 3.1.1) podrían formar una barrera protectora alrededor de las bacterias protegiéndolas de los agentes antimicrobianos. Estos estudios sugirieron también que la fracción lipídica del alimento absorbe el agente antimicrobiano, reduce su concentración en la fase acuosa y por ende su acción bactericida. El contenido proteico del alimento podría también ser un factor influyente en la inefectividad del timol ya que la albúmina de suero bovino neutralizaba la acción antimicrobiana del timol sugiriendo formación de complejos entre los componentes fenólicos del timol y las proteínas del alimento. Estas reacciones podrían haber prevenido toda otra formación de complejos similares entre compuestos fenólicos y proteínas u otros componentes de la membrana celular bacteriana que es considerada el sitio de acción blanco de los aceites esenciales (Peter, 2004). Es necesario evaluar también el comportamiento de la flora láctica frente al timol. Nuevos estudios serían necesarios para evaluar si el timol tiene algún tipo de efecto sobre su crecimiento lo que provocaría que el accionar metabólico de las BAL se vea alterado así como también su capacidad competitiva. Esto, de comprobarse, podría explicar la causa por la cual la muerte bacteriana observada tanto en S. aureus 123 como en S. Enteritidis a las temperaturas ensayadas es menor con timol que sin la presencia del mismo. Es decir, el timol en cierta forma altera la capacidad biopreservativa y competitiva de las BAL permitiendo mayor desarrollo de otra flora acompañante. El análisis de modelado terciario no se pudo incluir en el estudio del comportamiento microbiano en queso con y sin timol ya que el programa PMP no contempla, dentro de las variables que ofrece, el agregado de este producto. Esta es la razón por la cual no fue posible comparar las respuestas observadas y las predichas. Con el propósito de caracterizar las curvas de supervivencia de los microorganismos estudiados en queso untable base adicionado con aceite esencial de timol se aplicó el modelado primario utilizando la ecuación de Gompertz modificado.(Materiales y Métodos,3.6.1.2). Las Tablas 21; 22 y 23 exhiben los parámetros estimados que representan las diferentes regiones de la curva de supervivencia junto a los estadísticos de ajuste del modelo. El ajuste del modelo resultó altamente satisfactorio, obteniéndose valores de R2 ajustado por grados de libertad entre 89,3% y 99,1%. Los valores de F muy significativos (α<0,01), demostraron que el modelo fue apropiado para describir el comportamiento observado tanto para S. aureus a 6°C y 17°C como para S. Enteritidis a 17°C tal como se observa en la Figura 53. La validación del modelo fue correcta tal como puede observarse en los gráficos de valores observados y predichos y la distribución de residuales (Figuras 54). En el caso del comportamiento de S.aureus en queso untable base almacenado a 6ºC, el perfil de las curvas de supervivencia difiere escasamente, sobre todo en los primeros días de almacenamiento donde la caída de la población es más acelerada en el caso del queso sin adición de timol (Figura 51a). El modelo de Gompertz modificado caracterizó correctamente el cambio global observado dada la presencia de una cola marcada (C= 4,2 ciclos; Tabla 21), mientras que en ausencia de timol, la falta de cola marcada hizo que el modelo sobrestimara dicho valor(C= 14,4 ciclos; Tabla 9); cuando en realidad el cambio observado experimentalmente fue de 3,4 ciclos logarítmicos (Figura 51a). Aunque finalmente este microorganismo termina muriendo en un nivel similar al observado en queso base sin 124 timol, la presencia de timol aumentaría levemente su resistencia a esta temperatura o bien, actuaría indirectamente, inhibiendo la flora competitiva. A 17°C, se observó que las curvas de supervivencia de S. aureus en queso untable base con timol presentaron un perfil de curva quebrada similar al observado para la curva de supervivencia en igual sistema sin agregado de timol, aunque la inactivación fue mucho menor. Ello queda evidenciado en los parámetros característicos de ambas curvas. En el caso de la presencia de timol (Tabla 22), la curva no presentó hombro inicial (A ~ - 4 días) al igual que en ausencia de timol (Tabla 10). La velocidad de muerte y el cambio global en el numero de sobrevivientes fueron significativamente mayores (Bc/ timol=1,3 día-1 ; Bs/ timol= 0,5 -1 día ; Cc/ timol= 3,4 ciclos; Cs/ timol =0,07 ciclos). Tal como se comentó anteriormente, son varios los factores que en combinación podrían estar generando este efecto protector observado. Estos estudios debieran intensificarse evaluando varias concentraciones de este antimicrobiano con el propósito de arribar a una conclusión más definitiva. En el caso de S. Enteritidis en queso untable base con agregado de timol almacenado a 17°C, la misma fue más indiferente a la presencia de este antimicrobiano natural generando una curva de inactivación de perfil similar a la obtenida en ausencia del mismo. Ello se evidencia también en la concordancia de los parametros característicos de las mismas. En presencia de timol (Tabla 23), el parámetro A (hombro inicial) indica un valor predicho de 1,76 días. El cambio global en el numero de sobrevivientes (C) en 20 días de almacenamiento fue de 3,3 ciclos logarítmicos y la velocidad de muerte (B), 0,20 día-1. Cuando se caracterizó la respuesta de este microorganismo en iguales condiciones pero en ausencia de timol (Tabla 16) se obtuvieron similares valores de hombro inicial (A~ 1 día); de velocidad de muerte (B= 0,16 día-1) y de caída global predicha en 20 días (C=3,7 ciclos). 125 Figura 53: Ajuste del modelo de Gompertz modificado a la curva de inactivación de S.aureus en queso untable base con timol (pH 5,0) almacenado a 6ºC (a); 17°C (b); y de S. Enteritidis en igual matriz almacenada a 17°C (c) () valores experimentales; (—) predicción (a) (b) 0,19 Log (N/N0) -0,5 -1 -1,5 -2 -2,5 -0,01 -0,21 -0,41 -0,61 -0,81 -3 0 10 20 30 0 40 4 8 12 16 20 24 Tiempo (día) Tiempo (día) (c) 0 Log (N/N0) Log (N/N0) 0 -0,5 -1 -1,5 -2 -2,5 -3 0 4 8 12 16 20 Tiempo (día) 126 Tabla 21: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) con timol almacenado a 6 ºC. Parámetro Estimador Error Estándar A 1,43 0,30 B 0,08 0,02 C -4,19 0,82 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 30,97 3 RESIDUAL 0,06 4 R2 ajustado FISHER 516** 99,07 Tabla 22 : Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base (pH 5.0) con timol almacenado a 17 ºC. Parámetro Estimador Error Estándar A -4,17 102,50 B -1,33 27,11 C -0,07 0,31 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 1,67 3 RESIDUAL 0,03 4 R2 ajustado FISHER 55** 89,29 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 127 Tabla 23: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.Enteritidis en queso untable base (pH 5.0) con timol almacenado a 17 ºC. Parámetro Estimador Error Estándar A 1,76 0,47 B -0,20 0,06 C -3,28 0,34 ANÁLISIS DE LA DESVIACIÓN Fuente SS gl MODELO 26,44 3 RESIDUAL 0,12 5 R2 ajustado FISHER 367** 98,27 SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2NS: no significativo; *:significativo al 5% ;**: muy significativo al 1%.A: hombro de la curva de muerte (día); B : máxima velocidad de muerte (1/día) y C : cambio total en el número de sobrevivientes ( -). 1 En el caso de S. aureus inoculado en queso untable base con ó sin agregado de timol y almacenado a 25°C se observó crecimiento por lo que las curvas se caracterizaron mediante el modelo de Gompertz, obteniendo los parámetros matemáticos (A;B;C y M) a partir de los cuales se calcularon los parámetros biológicos TG;VCE y LAG. En la Figura 54, puede observarse que hubo un buen ajuste con el modelo propuesto ya que la predicción es coincidente con los valores experimentales. El análisis de la varianza (Tabla 24) arrojó un R2 de 99,1% con F muy significativo (α < 0,01). La validación interna del modelo no mostró tampoco en este caso anomalías (Figura 55 a y b). Los perfiles de las curvas de supervivencia predichas en este caso fueron similares , del tipo sigmoideo con valores semejantes (Tablas 11 y 24) de tiempo de generación (TGc/timol=0,51días;TGs/timol=0,54 días); velocidad de crecimiento (VCEc/timol=0,59 LogUFC/gr /día ; VCEs/timol= 0,55 LogUFC/gr/día) y tiempo de fase lag (LAGc/timol=5,5 días; LAGs/timol=5,0 días) aunque con una tendencia a mayor crecimiento en el caso del sistema con timol. La observación de las curvas experimentales de crecimiento (Figura 51c) evidencian que S. aureus en queso untable 128 Figura 54: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base (pH 5,0) con timol almacenado a 6ºC ; 17°C; y de S. Enteritidis en igual matriz almacenada a 17°C: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos . () valores experimentales; (—) predicción. 0,8 0,22 Residuales Valores observados S.aureus- 6°C -0,2 -1,2 -2,2 -3,2 0,12 0,02 -0,08 -0,18 -3,2 -2,2 -1,2 -0,2 0,8 -3 -2,5 Valores predichos -2 -1,5 -1 -0,5 0 Valores predichos 0,12 0,19 Residuales Valores observados S.aureus- 17°C -0,01 -0,21 -0,41 -0,61 -0,81 -0,81 0,08 0,04 0 -0,04 -0,08 -0,61 -0,41 -0,21 -0,01 -0,12 -0,81 0,19 -0,61 Valores predichos -0,41 -0,21 -0,01 0,19 Valores predichos 0,21 0 -0,5 Residuales Valores observados S.Enteritidis- 17°C -1 -1,5 -2 0,11 0,01 -0,09 -2,5 -0,19 -3 -3 -2,5 -2 -1,5 -1 Valores predichos -0,5 0 -3 -2,5 -2 -1,5 -1 -0,5 0 Valores predichos 129 Figura 55: Ajuste del modelo de Gompertz modificado a la curva de crecimiento de S.aureus en queso untable base con timol almacenado a 25ºC, () valores experimentales; (—) predicción 8,9 Log N 7,9 6,9 5,9 4,9 3,9 0 3 6 9 12 15 18 Tiempo (dia) Tabla 24: Ajuste del modelo de Gompertz modificado y sus respectivos parámetros característicos, correspondientes al comportamiento de S.aureus en queso untable base con timol (pH 5.0) almacenado a 25 ºC Parámetro Estimador Error Estándar A 4,01 0,20 B 0,26 0,46 C 5,24 0,05 M 7,49 0,61 ANÁLISIS DE LA DESVIACIÓN1 Fuente SS gl MODELO 314,25 4 RESIDUAL 0,12 3 2 R ajustado FISHER3 1964** 99,14 PARAMETROS BIOLÓGICOS2 Gompertz PMP TG (día) 0,51 --- VCE (Log UFC/g/día) 0,59 --- LAG (día) 5,5 --- SS: suma de cuadrados; gl: grados de libertad; α: nivel de significación; R2 ajustado: coeficiente de determinación ajustado por grados de libertad.2 TG: tiempo de generación; VCE: velocidad de crecimiento exponencial; LAG: tiempo de fase lag.3NS: no significativo; *:significativo al 5% ;**: muy significativo al 1% 1 130 Figura 56: Validación interna del modelo propuesto para el crecimiento de S.aureus en queso untable base con timol (pH 5,0) almacenado a 25 ºC: a) Valores observados vs valores predichos; b) Residuales vs. valores predichos. () valores experimentales; (—) predicción (b) 8,9 0,33 7,9 0,23 Residuales Valores observados (a) 6,9 5,9 0,13 0,03 -0,07 4,9 -0,17 3,9 4 5 6 7 Valores predichos 8 9 -0,27 3,9 4,9 5,9 6,9 7,9 8,9 Valores predichos con agregado de timol creció aproximadamente 2 ciclos logarítmicos más que en queso untable sin agregado de (0,3%p/p) timol y con una tendencia hacia el final del almacenamiento estudiado de seguir incrementándose la población mientras que, en el caso de la ausencia de timol, la población alcanzó un estado estacionario a los 11 días de almacenamiento, el cuál mantuvo hasta el final del mismo (17 días). Estos estudios coincidentes, si bien deben profundizarse con más condiciones de prueba y ensayando más microorganismos, permiten inferir una posible acción protectora de este antimicrobiano natural presente en la esencia de orégano y pone atención en la necesidad de tener en cuenta este hecho al momento de elaborar quesos untables saborizados. 131 5. CONCLUSIONES 132 La microbiología predictiva se ha convertido en los últimos años en una herramienta muy valorable y necesaria para un correcto diseño de los procesos de preservación de alimentos. Los modelos matemáticos generales que se utilizan para describir el crecimiento ó la inactivación microbiana generalmente se derivan de estudios en sistemas modelo con factores ambientales controlados tales como el pH; el nivel de sal; la temperatura; etc. La comparación de las predicciones brindadas por estos modelos con el comportamiento de los microorganismos en un alimento real puso en evidencia en este estudio las limitaciones de los mismos. En particular, cuando no todas las condiciones ensayadas quedaron bien descriptas este análisis permitió determinar qué factores adicionales (ó consideraciones del microambiente) se necesitan incluir en el modelo o considerar para aumentar su aplicabilidad. En particular este estudio permitió arribar a las siguientes conclusiones: La aplicación de modelos matemáticos no lineales conceptualmente diferentes como modelos primarios y terciarios , resultó muy útil para explicar de forma más completa el crecimiento ó lasupervivencia/ inactivación microbiana en queso untable, brindando información complementaria para la industria para la selección de las combinaciones más efectivas y seguras desde el punto de vista microbiológico. La observación de una respuesta de crecimiento/supervivencia no lineal y su caracterización mediante modelos primarios (Gompertz y Gompertz modificado), especialmente en los niveles de factores de estrés más críticos, resultó de destacada importancia. El modelo de Gompertz, utilizado para describir el crecimiento microbiano no presentó limitaciones estadísticas. No ocurrió lo mismo con el modelo de Gompertz modificado para muerte, el cuál sobreestimó la caída global al final del almacenamiento debido a la ausencia en esos casos de una verdadera curva sigmoidea con cola marcada. La presencia de sorbato de potasio (1000 ppm) no generó diferencias en las curvas de supervivencia obtenidas con el microorganismo de prueba (S. aureus) en el queso, hecho por el cuál no se lo consideró responsable de la diferencia de respuesta 133 observada entre el medio de cultivo (crecimiento) y el alimento real (supervivencia /inactivación) La reducción del pH del queso untable base (pH 5,0) hasta un valor organolépticamente aceptable (pH 4,3) generó una alternativa interesante ya que aumentó notoriamente la inactivación observada del microorganismo de prueba (S. aureus) sobretodo en situaciones de abuso térmico (15 y 22°C), donde este efecto se ve incrementado. Es posible que al aumentar la temperatura, la flora acidoláctica, que no se ve afectada por el descenso de pH, incremente su población por tener una temperatura más propicia y por lo tanto aumente su poder biopreservante eliminando al microorganismo de prueba que es más sensible al microambiente imperante. El programa de simulación modelado de patógenos mostró debilidades al momento de predecir la conducta microbiana en el queso untable debido seguramente a las limitaciones biológicas imperantes en el queso. En algunos casos (p.e S.aureus ; pH 5,0 y T: 6, 10; 15;17; 22 y 25°C; E. coli pH 5,0 T: 17 y 25°C L.monocytogenes; pH 5,0 T: 6,17 y 25°C) realizó una predicción errada pero conservativa ya que predijo un crecimiento más acelerado del realmente observado o de modo más extremo predijo crecimiento y se observó muerte bacteriana. En otros casos su predicción fue de riesgo (p.e. E.coli pH 5,0 T: 6°C; S.Enteritidis pH 5,0 T: 6 y 17 °C) pues predijo muerte a velocidades más rápidas que las observadas y en el peor de los casos predijo muerte y se observó crecimiento (S.Enteritidis pH 5,0 T:25°C). La posible presencia de inhibidores en el queso así como también el establecimiento de flora competitiva, factores no considerados en la predicción de este programa, podrían ser los causantes de las diferencias observadas y ponen en alerta sobre una cautelosa utilización de este programa. La inclusión de timol (0,3%) con el posible propósito de su utilización como agente antimicrobiano y a su vez saborizante no condujo a los resultados esperados. No se observó actividad antimicrobiana adicional contra S.aureus y S. Enteritidis presentes en queso untable, sino que por el contrario se incrementó la resistencia de los mismos en presencia de este compuesto en todas las condiciones ensayadas. Este 134 resultado fue relevante pues señala un punto de inicio para futuras investigaciones y aspectos a tener en cuenta al momento de desarrollar quesos untables saborizados. Actualmente y por ahora, no es posible basarse solamente en la predicción de los modelos matemáticos para determinar la seguridad de los alimentos y los procesos. Los estudios de reto microbiano en el alimento son aun inequívocamente necesarios para determinar la propensión al crecimiento de patógenos en el alimento. 135 6. APÉNDICE 136 Este capítulo incluye información con respecto a los métodos estadísticos que se utilizaron para el análisis de los resultados, definiciones y fórmulas. 6.1 Definiciones y Fórmulas 6.1.1- Población estadística Una población estadística se define como un conjunto completo de elementos de interés. La medidas tomadas sobre los elementos de una población están gobernadas por una distribución de probabilidad, usualmente expresada en forma de ecuación matemática, la cual relaciona la ocurrencia de un valor específico con la probabilidad de dicha ocurrencia. 6.1.2-Distribución normal Distribución normal es el tipo de distribución que más comunmente se encuentra. En general cuando se procesan los datos estadísticamente se asume que su distribución es normal. La siguiente fórmula es la función de la distribución normal y se puede usar para verificar si realmente una serie de mediciones sigue tal distribución ( f ( x) = 1 / 2πσ ) ∗ exp[ (Y − Y ) 2 / 2σ 2 ] (6.1) Donde: exp = función exponencial con base e Y= medición realizada Y = media del total de las mediciones σ = desviación estándar σ² = varianza 137 6.1.3- Parámetros y estimadores Un parámetro estadístico es una función definida sobre los valores numéricos de la población. Es un valor representativo de una población que provee información sobre su distribución como la media aritmética o su desviación típica. En estadística aplicada se asume que la forma de la distribución aplicada es conocida pero no así los parámetros que la representan. Los mismos deben ser estimados mediante la aplicación de funciones matemáticas a las mediciones obtenidas. Los datos estadísticos extraídos de dichas funciones se denominan estimadores. Media de la distribución ( Y ); es el promedio aritmético de las mediciones realizadas: N Y= donde ∑Y i i=1 (6.2) N Yi : valor individual del sistema i N: número total de datos Desviación estándar (σ) o desviación típica; es una medida de dispersión de las variables con respecto a su media y es de gran utilidad en la estadística descriptiva. Es en realidad la raíz cuadrada de la varianza: N ∑ (Y − Y ) 2 i σ= i=1 (N − 1) (6.3) Varianza ( σ2 ); la varianza de una variable es una medida de la dispersión. Corresponde al promedio del cuadrado de la distancia de los distintos valores de la variable con respecto a su media . 138 N σ = 2 ∑ (Y − Y ) 2 i i =1 N −1 (6.4) Error estándar de la media (SE); está relacionado a la desviación estándar y el número de los casos con los cuales se trabaja. Su fórmula es: SE = σ (6.5) N Intervalos de confianza; es siempre aconsejable que un analista determine los intervalos de confianza de los parámetros que dermina. Los intervalos de confianza dan información sobre la precisión de los cálculos realizados. Habitualmente se utiliza el intervalo de confianza a dos colas, es decir el que precisa el límite superior e inferior. Se calcula con la siguiente formula utilizando la media Y : Y ± t α 2,n−1 ⋅ σ2 N (6.6) Donde tα/2,n-1 = el estadístico t de Student de nivel de confianza α/2 y de n-1 grados de libertad del sistema. Grados de libertad (gl) ;se usan para estimar el número de categorías independientes en un test o experimento. gl=n-r (6.7) donde: n= el número de sujetos en la muestra r=el número de sujetos estadisticamente dependientes. Cuando se trata de ajustar modelos estadísticos a un conjunto de datos, los residuos se encuentran habitualmente en un espacio de menor dimensión que aquél 139 en el que se encontraban los datos originales. Los grados de libertad del error los determina, precisamente, el valor de esta menor dimensión. 6.1.4 - Significancia estadística Un resultado se denomina estadísticamente significativo cuando no es probable que haya sido debido al azar. Una "diferencia estadísticamente significativa" significa que hay evidencias estadísticas de que hay una diferencia. El nivel de significación muchas veces se asocia con los test a los cuales se someten los datos con fin de verificar una hipótesis. En cuanto al test de la hipotesis nula, el nivel de significación es nada más que la probabilidad de tomar la decision de rechazar la hipotesis nula cuando ella es verdad (cometiendo el error tipo I o α) o de aceptar la hipótesis nula cuando la última no es cierta (cometiendo el error tipo II o β). En la toma de la esa decisión muchas veces se usa el valor P donde P= 1- α. Entonces el valor experimental se compara con el valor correspondiente a la tabla (para dado nivel de significación y dados grados de libertad). Si el valor experimental es superior al número de la tabla la hipótesis nula se rechaza mientras que al ser superior el número de la tabla la hipótesis nula se tiene que aceptar para dado nivel de significación. Cuanto mayor sea el valor experimental , más significativo será el resultado y más fuerte será la evidencia de que el resultado no se debe a una mera coincidencia. El nivel de significación es comunmente representado por el símbolo griego α (alpha). Cuando se hacen este tipo de comparaciones es importante tomar en cuenta si el ensayo es unilateral o bilateral. Por ejemplo si el ensayo es unilateral y se trabaja en un nivel de significación α = 0,05 en realidad 5 valores en cada cien se pueden dar por azar y entonces la probabilidad de que sean no debidos al azar es P= 1-0,05=0,95. Si, en cambio, el ensayo es bilateral en el mismo caso P= 1-2α = 0,90. En muchos trabajos el nivel de significación se denota con una , dos o tres estrellitas. Existen tres niveles; cuando P ≥ 0,95 (α ≤ 0,05); P ≥ 0,99 (α ≤ 0,01 ) y P ≥ 0,999 (α ≤ 0,001 ) cuya mención indica la significación de las conclusiones que se formulan. Cuando el valor experimental obtenido es inferior al tabulado se concluye que "no hay significación" y se indica con (-) ó (NS); cuando dicho valor supera al valor tabulado para P ≥ 0,95 y no al tabulado para P ≥ 0,99 se indica con (*); si el 140 valor experimental es mayor que el tabulado para P ≥ 0,99 la conclusión es (**) y para P ≥ 0,999 (***). Cuando : VE < VT (NS)/(-) VE> VT(P 0,95) * VE > VT(P O,99) ** VE > VT(P 0,999) *** Siendo VE=valor experimental; VT=valor tabulado Generalmente, en el caso de los alimentos lod niveles (*) y (**) se consideran suficientes. 6.2 - Análisis de varianza (ANOVA ) Análisis de varianza (ANOVA )es un método general con aplicaciones muy variadas y que puede llegar a ser complejo de acuerdo a las derivaciones que tome. Se utiliza en reemplazo del uso de una batería de test t-Student cuando se poseen varias muestras. Cuanto mayor es el número de sistemas de análisis, realizar una batería de test t no solo resulta dificultoso sino que ofrece pocas ventajas. Esta técnica compara las medias de varias muestras y verifica si todas ellas pertenecen a la misma población o si, unao más son significativamente diferentes y provienen de poblaciones diferentes. El ANOVA debe ser considerado en la práctica un test de diferencias de medias a dos colas (ya que las medias en sí mismas pueden aumentar o decrecer) que opera vía un test de cambio de varianza a una cola, el cual se describirá más adelante (test F). La variación total que existe en una distribución global de valores o medidas puede ser segregada en categorías representando por un lado los efectos identificables y por otro lado la variación debida a causas no identificables. La variación total del conjunto de datos es llamada Suma de Cuadrados Totales (SST). Dicha suma puede dividirse en dos contribuciones: una Suma de Cuadrados debida a la Regresión (SSR) y una Suma de Cuadrados Residual (SSE). 141 Suma de Cuadrados Totales (SST) se obtiene sumando los cuadrados de las desviaciones del valor observado en cada sistema Yi respecto de la media Y . N ( i =1 ) 2 SST = ∑ Yi − Y (6.9) La Suma de cuadrados Totales tiene asociados N-1 grados de libertad ya que existe la restricción N ∑Y − Y = 0 (6.10) i i =1 Suma de Cuadrados debida a la Regresión (SSR) es una expresión de la variación que resulta tomando en cuenta por un lado la relación de la variable independiente con la dependiente a partir del modelo de regresión aplicado y por otro lado la medición de la variable dependiente que se obtiene experimentalmente. En otras palabras es la suma para N elementos de la población de los cuadrados de la diferencia entre la media Y muestreal y el valor predicho del modelo Ŷi para una corrida i. ( SSR = ∑ Ŷi − Y ) 2 (6.11) Los grados de libertad en este caso se definen a partir del número de parámetros p que usa el modelo para relacionar la variable medida y la variables independientes del experimento. Esta suma de cuadrados tiene asociados p-1 grados de libertad. Dividiendo la SSR por p-1 obtenemos la Media de Cuadrados debida a la Regresión (MSR): MSR = SSR p −1 (6.12) Suma de Cuadrados Residual(SSE) es la variación debida a causas no identificables y representa el error observado de las variables medidas (dado que el modelo es correcto). Se define como la suma de los cuadrados de las diferencias 142 entre los valores medidos de N elementos de la población y los valores de los mismos elementos tal como son predichos por el modelo. N ( SSE = ∑ Yi − Ŷi i=1 ) = ∑r 2 N i 2 (6.13) i=1 En el caso de la Suma de Cuadrados Residual se asocian N-p grados de libertad La SSE se usa para calcular la Media de Cuadrados Residual(MSE) al dividirla por los grados de libertad asociados a ella, según la siguiente fórmula: MSE = SSE N−p (6.14) Los residuales se usan para evaluar el ajuste del modelo a los valores experimentales. La suma de los residuales de cada corrida teóricamente es siempre cero, sin embargo, en la práctica puede no serlo exactamente pero debería aproximarse. Modelo de los parámetros de un ANOVA Fuente gl DEBIDO A LA REGRESION RESIDUAL TOTAL p-1 N-p Suma de Cuadrados SSR SSE N-1 Media de cuadrados SSR MSR = p-1 SSE MSE = N-p SST 6.2.1- Test F de significación de la regresión Un test que comunmente se realiza para verificar la significancia de la regresión es el test F. Si el valor calculado de F > F tablas nos permite inferir que 143 la variación de la información explicada por el modelo o relación propuestos es significativamente mayor que la variación debida a causas no identificables (residuales) y que el efecto observado no se debió al azar . Es de destacar que los test t-Student y F son esencialmente los mismos . Para un diseño completamente aleatorio donde se estudian sólo dos tratamientos y dos test t a dos colas para muestras independientes se verifica que: F = t² F= MSR SSR (p − 1) = MSE SSE (N − p ) (6.15) (6.16) Una vez calculado el F se busca en las correspondientes tablas el valor de F para el nivel de significación con el cual se trabaja para grados de libertad p-1 y N1. El F de las tablas se compara con el F calculado. Si el valor del F calculado es mayor que el de las tablas la hipótesis nula se rechaza para α nivel de significación, y significa que por lo menos un parámetro de los que describen la regresión tiene efecto sobre la respuesta. Cuanto más grande sea el F calculado mejor describirá la regresión el modelo propuesto ya que también significa que aumenta la razón de la varianza debida a la regresión sobre la viarianza debida a causas no identificables. 6.2.2 -Coeficiente de determinación (R2) El coeficiente de determinación nos informa sobre la proporción de la variación que existe entre los valores experimentales y lo propuesto por el modelo. Es un estadístico que evalúa cuán bien se ajusta el modelo estadístico aplicado. En la regresión, en particular, el coeficiente de determinación es una medida de cuánto la linea de regresión se aproxima a los datos experimenteles. Su expresión porcentual se da por la fórmula: R2 = SSR ⋅ 100 SST (6.17) 144 También se usa el coeficiente de determinación ajustado por los grados de libertad del modelo: Raj2 = 1 − SSE (N − p ) SST (N − 1) (6.18) Siempre se busca que tanto R2 como R2aj se acercan a lo posible al 100 ya que es una medida del ajuste del modelo. Cabe añadir que por mucho que se acerque el coeficiente de deteriminación al cien nunca lo será, ya que en este caso se trabajaría sin error. 6.2.3 - Análisis de residuales En el análisis de los residuales siempre se asume que los errores: • son normalmente distribuídos con media igual a cero • tienen varianza constante • son independientes entre ellos Existen herramientas gráficas y pruebas estadísticas se usan con fin de comprobar la validez de las suposiciones recién mencionadas. ∧ 6.2.3.1- Versus valores predichos, Yi Se grafican los valores de los residuales (ri) versus los valores predichos por el modelo. Dichos residuales no se grafican en función de los valores observados (Yi) debido a que ambos grupos de valores están correlacionados. Debe observarse una distribución uniforme horizontal de los residuales en torno a los valores ∧ predichos, Yi (homocedasticidad). Pueden manifestarse algunos comportamientos anormales tales como los que se describen a continuación. • Si la varianza del modelo no es constante y se incrementa, es necesario realizar un análisis de cuadrados mínimos especial o bien una transformación (Ln (Y); Y ; 1/Y; etc.) en la respuesta de interés : 145 ri ∧ Yi • Si el término independiente β0 no fue incluido en el análisis, la banda se desplaza: ri ∧ Yi • Si falta incluir algunos términos lineales y/o cuadráticos en el modelo postulado la banda se curva: ri ∧ Yi Estas desviaciones, además de detectarse visualmente, pueden medirse mediante parámetros definidos, los cuales no se detallarán en este apéndice. 146 7. BIBLIOGRAFÍA . 147 1. Abdalla O.M., Davidson P.M. y Christen,G.L. (1992). “Survival of selected pathogenic bacteria in white pickled cheese made with latic acid bacteria or antimicrobials”. Journal of Food Protection. 56:972-976. 2. Ahmed, A.H., Ahmed, S.H. y Moustafa, M.K. (1988). “Occurrence of fecal coliforms and enteropathogenic Escherichia coli (EEC) in Egyptian Soft Cheese”. Journal of Food Protection. 51:442-444. 3. Altekrus, S.F., Babagaleh, T.B., Mowbray, J.C., Bean, N.H. y Potter, M.E. (1998) .”Cheese associated outbreaks of human illness in the United States”. 1973-1992.Journal of Food Protection. 61:1405-1407. 4. Alzamora, S.M. (1997). “ Preservación I. Alimentos conservados por factores combinados”. En Temas en Tecnología de Alimentos. Ed. J.M. Aguilera p. 4588. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (CYTED). Instituto Politécnico Nacional, México, D.F. 5. Alzamora, S.M., Guerrero, S.N., López Malo, A., Palou, E., Char, C.D. y Raffellini, S. (2010). “Models for microorganism inactivation: application in food preservation design”. Effects on Safety and Quality of Foods, pp 87-115. Ed. E. Ortega-Rivas, CRC Press . 6. Alzamora, S.M., Lopez Malo, A., Guerrero, S. y Palou, E. (2005). “Plant Antimicrobials combined with conventional preservatives for refrigerated and shelf stable fruit products”. Cap.11 en Natural Antimicrobials for the Minimal Processing of Foods, Carey,M. . 7. Alzamora, S.M.; Tapia, M.S. y López-Malo, A. (2000). “Overview”. En Minimally Processed Fruits and Vegetables: Fundamental Aspects and Applications. Eds. S.M. Alzamora, M.S. Tapia y A. López-Malo. Aspen Publishers Inc., Maryland, USA. 8. Alzamora, S.M.; Gerschenson, L.N.; Cerrutti, P. y Rojas, A.M. (1989). “Shelf-stable pineapples for long-term non refrigerated storage”. Lebensmittel-Wissenschaft und-Technologie 22: 233-236. 9. Alzamora, S.M.; López-Malo, A.; Guerrero, S. y Palou, E. (2003). “Plant antimicrobials combined with conventional preservatives for fruit products”. En Natural Antimicrobials for the Minimal Processing of Foods. Ed. S. Roller. pp 189-202. S. Roller (Ed).245 p. Woodhead Publishing Limited, Inc. Cambridge, Inglaterra. 148 10. Alzamora, S.M; Cerrutti, P.; Guerrero, S. y López-Malo, A. (1995). “Minimally processed fruits by combined methods”. En Food Preservation by Moisture Control. Fundamentals and Applications. ISOPOW PRACTICUM II. Eds. G.V. Barbosa-Cánovas y J. Welti-Chanes p. 463-492. Technomic Publication, Pennsylvania, USA. 11. Araújo, V.S., Pagliares, J.A., Quiroz, M.L.P. y Freitas- Almeida, A.C. (2002). “Occurrence of Staphylococus and enteropathogens in soft cheese commercialized in the city of Río de Laneiro, Brazil”.Journal of Applied Microbiology, 92, p.1172-1177. 12. Axelsson, L. (2004). “Lactic Acid Bacteria: Classification and Physiology”. En Lactic Acid Bacteria. Microbiology and Functional Aspects. 3rd ed. Seppo Salminen, Atte Von Wright y Arthur Ouwehand , Inc. New York, Basel. p.166. 13. Azzous, M.A. y Bullerman, L.R (1982). “Comparative antimycotic effects of selected herbs, spices, planta components and commercial antifungal agents”. J. Food Prot. Ames. 45(14): 1298-1301. 14. Baranyi, J. y Roberts, T.A. (1994). “A dynamic approach to predicting bacterial growth in food”. International Journal of Food Microbiology 23: 277-294. 15. Basilico, M.Z. and Basilico, J.C. (1999) “ Inhibitory effect of some spice essential oils on Aspergillus ochraceus NRRL 3174 growth and ochratoxin production”. Letters in Applied Microbiology. 29(4), 238–241. 16. Bhaduri, S., Smith, P. W., Palumbo, S. A., Turmer-Jones, C. O., Smith, J. L. y Marmer, B. S. (1991).” Thermal destruction of L. monocytogenes in liver sausage slurry”. Food Microbiology, 8,75–78. 17. Beresford, T.P., Fitzsimons ,N.A., Brennan ,N.L.y Cogan T.M. (2001). “Recentt advances in cheese microbiology”. International Dairy Journal 11: 259-274. Blacksburg, VA 18. Booth I.R. y Kroll R.G. (1989). “The preservation of foods by low pH”. En Mechanisms of Action of Food Preservation Procedures. Ed. G.W. Gould, p. 119. Elsevier Applied Science, Londres,Inglaterra. 19. Brown, M.H. y Booth, I.R (1991). “Acidulants and low pH”. En Food Preservatives. Ed. N.J. Russell y G.W. Gould, p. 22. Van Nostrand Reinhold, Nueva York, USA. 149 20. Buchanan, R.L. y Phillips, J.G. (1990). “Response surface model for predicting the effects of temperature, pH, sodium chloride content, sodium nitrite concentration and atmosphere on the growth of Listeria monocytogenes”. Journal of Food Protection 35: 370-376. 21. Buchanan,R.L., Bagi,L.K., R.V. Goins,R.V. y J.G. Phillips,J.G. (1993) “Response Surface Models for the Growth Kinetics of Escherichia coli O157:H7” . Food Microbiology 10:303-315. 22. Buchanan, R.L. y Bagi, L.A. (1994).”Expansion of response surface models for the growth of Escherichia coli O157:H7 to include sodium nitrite as a variable”. International Journal of Food Microbiology, 23:317-332. 23. Bygraves, J.A. y Russell, N.J. (1988). “Solute tolerance and membrane lipid composition in some halotolerant food-spoilage bacteria”. Food Microbiology 5: 109. 24. CAA, Código Alimentario Argentino. Anexo Mercosur E-287-289. (1997). Ed. De la Canal y Asociados S.R.L. p. 177-183. Buenos Aires, Argentina. 25. Cerruti,P., Alzamora,S.M. y Vidales, S.L. (1997). “Vainillin as an antimicrobial for producing shelf-satble strawberry purée” Journal of Food Science,62: 608-610. 26. Char, C. (2006). “Procesamiento mínimo de jugo de naranja mediante tratamiento térmico combinado con otros factores de estrés”. Tesis Doctoral. Universidad de Bs. As. Tesis N° 4097 (www.bl.fcen.uba.ar). 27. Chhabra A.T., Carter W.H., Linton R.H. y Cousin M.A. (2002). “A predictive model that evaluates the effect of growth conditions on the thermal resistance of Listeria monocytogenes”. Int J Food Microbiol 78:235–43. 28. Corlet, D.A. y Brown, M.H. (1980) . “pH y acidez”. En Ecología Microbiana de los Alimentos I,Factores que afectan a la supervivencia de los microorganismos en los alimentos. Silliker, J.H., Elliot, R.P., Baird-Parker, A.C., Bryan, F.L., Chiristian J.H.B., Clark, D.H.S., Olson, J.C. y Roberts, T.A. p.97-114. Ed.Acribia, Zaragoza, España. 29. Daoust, J.Y. (1997).”Especies de Salmonella”. En Microbiología de los Alimentos: fundamentos y fronteras” .Ed. Acribia ,Zaragoza , España. 150 30. Doyle, M.P., Zhao,T., Jianghohg, M. y Zhao, S. (1997). “Escherichia coli O157:H7”. En Microbiología de los Alimentos: fundamentos y fronteras” .Ed.Acribia ,Zaragoza , España. 31. Draper, N.R. y Smith, H. (1981). Applied Regression Analysis. 2da Edición, Wiley. New York, USA 32. Eley,A.R. (1996).”Microbial Food Poisoning”.2da.Edición.Ed.Chapman and Hall,London,UK. 33. Ercolini, D., Fusco, V., Blaiotta, G., Sarghini, F. y Coppola, S. (2005). “Response of Escherichia coli O 157:H7, Listeria monocytogenes, Salmonelle Typhimurium, and Staphylococcus aureus to the Termal Stress occurring in Model Manufactres of Grana Padano Cheese”. Journal of Dairy Science 88: 3818-3825 © American Dairy Science Association. 34. Ferrante, S., Guerrero, S., y Alzamora, S. M. (2007). “Combined use of ultrasound and natural antimicrobials to inactivate Listeria monocytogenes in orange juice”. Journal of Food Protection, 70, 1850–1856. 35. Ferreira,M.A y Lund,B.M. .(1987) “The influence of pH and temperature on initiation of growth of Salmonella spp”..Letters in Applied Microbiology, 5: 67-70. 36. Freitas, C. y Malcata, F.X. (2000). “Microbiology and Biochemistry of Cheeses with Appelation d’Origine Protegee and Manufactured in the Iberian Peninsula from Ovine and Caprine”. En Our Industry today. Journal of Dairy Science,83: 584-599. 37. Gibson, A.M.; Baranyi, J.; Pitt, J.L.; Eyles, M.J. y Roberts, T.A. (1994). “Predicting fungal growth: the effect of water activity on Aspergillus flavus and related species”. International Journal of Food Microbiology, 23: 419-431. 38. Gibson, A.M.; Bratchell, N. y Roberts, T.A. (1987). “The effect of sodium chloride and temperature on the rate and extent of growth of Clostridium botulinum Type A in pasteurized pork slurry”. Journal of Applied Bacteriology, 62: 479-490. 39. Gonzalez-Martinez,B.E., Gomez-Treviño,M. y Jimenez-Salas,Z. (2003). “Bacteriocinas de probióticos”.Revista Salud Pública y Nutrición, Vol.4,Nº2. 40. Gould, G.W (1995). “Homeostatic mechanisms during food preservation by combined methods”. En Food Preservation by Moisture Control. 151 Fundamentals and Applications. ISOPOW PRACTICUM II. G.V. Eds. Barbosa-Cánovas y J. Welti-Chanes p. 397-410. Technomic Publication. Pennsylvania, USA. 41. Gould, G.W., Brown, M.H. y Fletcher, B.C. (1983). “Mechanisms of action of food preservation procedures”. En Food Microbiology: Advances and Prospects. Ed. T.A. Roberts y F.A. Skinner p. 67. Academic Press, Nueva York, USA. 42. Guerrero, S.N (1993). “Desarrollo de una tecnología de factores combinados para preservar puré de banana de alta humedad”. Tesis Doctoral, Universidad de Buenos Aires. 43. Hudson, J.A. (1993). “Effect of pre-incubate temperature on the lag time of Aeromonas hydrophila”. Letters in Applied Microbiology, 16:274-276. 44. Hudson, J.A. y Mott, S.J. (1993).”Growth of Listeria monocytogenes, Aeromonas hydrophila, and Yersinia enterocolitica in paté and a comparison with predictive models”. International Journal of Food Microbiology, 20: 111. 45. International Commission on Microbiological Specifications for Foods (1996). “Microorganisms in Foods 5, Characteristics of Microbial Pathogens”. Ed. Blackie Academic and Professional ,USA. 46. International Commission on Microbiological Specifications for Foods” (1980).”Leche y productos lácteos”. En Ecología microbiana de los alimentos 2.Ed.Acribia, Zaragoza, España. 47. Iurlina, M. O. y Fritz R. (2004). “Microbiological quality of Por Salut Argentine cheese stored at two temperatura treatments”. LebensmittelWissencraft undTechnologie,37:739-748. 48. Jablonsky, L.M. y Bohach, G.A. (1997).”Staphylococcus aureus”. En Microbiología de los Alimentos: fundamentos y fronteras” .Ed.Acribia ,Zaragoza , España. 49. Jay, J.M. (1991). Modern Food Microbiology. Chapman & Hall, Nueva York, USA. 152 50. Johnson,M.E. y Steele,J.L. (1997) “ Productos lácteos fermentados”. En Microbiología de los alimentos: fundamentos y fronteras. Ed. Acribia, Zaragoza, España. 51. Jorgensen, H.J., Mork, T. y Rorvik, L.M. (2005). “The Occurrence of Staohylococcus aureus on a Farm with Small Scale Production of Row Milk Cheese”. Journal of Dairy Science, 88: 3810-3817. 52. Juven, B.J., Kanner, J., Schved, F. y Weisslowicz, H.( 1994)”.Factors that interact with the antibacterial action of thyme essential oil.and its active constituents”. Journal of Applied Microbiology, 76: 626–631. 53. Lachowicz ,K.J., Jones ,G.P.,Briggs , D.R.,Bienvenu, F.E., Wan, J. , Wilcock, A. y Coventry, M.J.(1998). “The synergistic preservative effects of the essential oils of sweet basil (Ocimum basilicum L) against acid-tolerant food microflora” Letters in Applied Microbiology,26: 209-214. 54. Lambert, R.J.W., Skandamis, P.N., Coote, P. y Nychas, G.J.E. (2001).” A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol”. Journal of Applied Microbiology, 91: 453–462. 55. Lars, A. (2004) “Lactic Acid Bacteria: Classification and Physiology”. En Lactic Acid Bacteria. , p.119-185. Ed.Board, USA. 56. Larson, A.E., Johnson E.A. y Nelson J.H. (1999). “Survival of Listeria monocytogenes in commercial cheese brines”. Journal Dairy Science 82:1860-1868. 57. Lawless H.T. y Heymann H. (1999). “Sensory Evaluation of Food. Principles and Practices”. Ed. H.T. Lawless y H. Heymann. Aspen Publishers, Maryland, USA. 58. Leistner, L. (1992). “Food preservation by combined methods”. Food Research International 25: 151-158. 59. Leistner, L. (1995). “Principles and applications of hurdle technology”. En New Methods of Food Preservation. Ed. G.W. Gould, p. 1-21. Blackie Academic & Professional, Glasgow, USA. 153 60. Leistner, L. y Russell, N.J. (1991). “Solutes and low water activity”. En Food Preservatives. Eds. N.J. Russell y G.W. Gould, p. 111. Van Nostrand Reinhold, Nueva York, USA. 61. Linnan, M. J., Mascola, L., Lou, X. D., Goulet, V.,May, S., Salminen, C., Hird, D.W.,Yonekura, M. L., Hayes, P.,Weaver, R., Audurier, A., Plikaytis, B. D., Fannin, S. L., Kleks, A. and Broome, C.V. (1999) “Epidemic listeriosis associated with Mexican- style cheese”. New England Journal of Medicine, 319: 823-828. 62. Linton, R.H.; Carter, W.H.; Pierson, M.D. y Hackney, C.R. (1995).” Use of a modified Gompertz equation to model nonlinear survival curves for Listeria monocytogenes “Scott A. Journal of Food Protection, 58: 946-954. 63. López-Malo, A. (2000). “La preservación multiobjetivo de alimentos: efecto de factores tradicionales y emergentes en la respuesta de Aspergillus flavus”. Tesis Doctoral. Universidad de Buenos Aires. 64. Mahaut,M.,Jeantet,R. Y Brulé,G. (2003). “Introducción a la Tecnología quesera”.Ed.Acribia,Zaragoza,España. 65. Mangena,T. y Muyima, N.Y.O. (1999). “Comparative evaluation of the antimicrobial activities of essential oils of Artemisia afra, Pteronia incana and Rosmarinus officinalis on selected bacteria and yeast strains” Letters in .Applied Microbiology, 28:291-296. 66. McLauchlin, J., Hall, S.M., Velani, S.K. y Gilbert, R.J (1991) “Human listeriosis and pate a possible association”. British Medicine Journal, 303:773775. 67. Mc Lauchlin, J. y Gilbert, R.J. (1990) “Listeria in food”. PHILS . Microbiological Diagnostic,7:54-55. 68. McMeekin, T.A.; Olley, J.N.; Ross, T. y Ratkowsky, D. (1993). “Predictive Microbiology: Theory and Application”. Research Studies Press Ltd. y John Wiley & Sons Inc., Gran Bretaña. 69. Medina, R. E. y Mirales, S. (2004). “Aceite esencial de tomillo mendocino (Acantholippia seriphioides): efecto antioxidante en medallones de carne vacuna.” Facultad de Ciencias Agrarias, UNCuyo, Mendoza, Argentina. 154 70. Mishra, A.K. and Dubey, N.K. (1994) “Evaluation of some essential oils for their toxicity against fungi causing deterioration of stored food commodities”. Applied and Environmental Microbiology, 60:1101-1105. 71. Montes, R. and Carvajall, M. (1998) “ Control of Aspergillus flavus in maize with plant essential oils and their components”. Journal of Food Protection, 61:616–619. 72. Montville, T.J. (1997). “Principios que influyen en el crecimiento, la supervivencia y la muerte microbiana de los alimentos”. En Microbiología de los Alimentos. p.13-31. Ed.Acribia, Zaragoza, España. 73. Parish M.E. y Higgins D.P. (1989).” Survival of Listeria monocytogenes in low pH model broth systems”. Journal of Food Protection, 52:144-147. 74. Paster, N., Juven,B.J. , Shaaya,E., Menasherov, M., Nitzan,R., Weisslowicz,H. and Ravid,U. (1990) “ Inhibitory effect of oregano and thyme essential oils on moulds and foodborne bacteria”. Letters in .Applied Microbiology, 11:33-37. 75. Peter,K.V. (2004) “Handbook of herbs and spices” Whoodhead Publishing in Food Science and Technology,Cambridge,England. 76. Portela, M.L. (2007). “Necesidades de calcio y recomendaciones de ingesta”. Actualización Osteología , 3: 66-75. 77. Roa, V. y Tapia de Daza, M.S. (1991) “Evaluation of water activity measurements with a dew point electronic humidity meter”. Lebensmittel Wissenschaft und Technologie , 24: 208-213. 78. Roberts, A., Pierson, M.D., Marcy, J.E. , Alvarado, C.Z. y Summer, S.S. (2002). “The effect of sorbic acid on the survival of E. coli O157:H7; Salmonella; L. monocytogenes and S. aureus on shredded cheddar and mozzarella cheese”. M.S. Thesis. Virginia Polytechnic Institute and State University.http://scholar.lib.vt.edu/theses/available/etd-03102003151240/unrestricted/ALISONTHESIS.pdf 79. Roberts, T.A. e Ingram, M. (1973). “Inhibition of growth of C. botulinum at different pH values by sodium chloride and sodium nitrite”. Journal of Food Technology, 8: 467. 155 80. Rocourt, J. y Cossart, P. (1997) “Listeria monocytogenes”. .En Microbiología de los Alimentos: fundamentos y fronteras” .Ed.Acribia , Zaragoza , España. 81. Rojas, R.; Quintero, J.S.; Rojas, J.C. y Coronado, B.D. (1994). “Conservación de puré de mango mediante factores combinados envasado en grandes recipientes sin adición de sacarosa”. Boletín Internacional de Divulgación CYTED, N 2, p. 45, Universidad de las Américas, Puebla, Méjico. 82. Ryu, D. y Holt, D. (1993). “Growth inhibition of Penicillium expansum by several commonly used food ingredients”. Journal of Food Protection 56: 862-867. 83. Sajur, S. (1985). “Preconservación de duraznos por métodos combinados”. Tesis de Maestría. Universidad Nacional de Mar del Plata. 84. Scott, R., Robinson, R.K. y Wilbey, R.A. (2002).”Fabricación de queso”.Ed.Acribia, Zaragoza, España. 85. Skandamis, P., Koutsoumanis, K., Fasseas, K. y Nychas, G.-J.E. (2001) Evaluation of the inhibitory effect of oregano essential oil on E. coli 0157:H7, in broth culture with or without EDTA, using viable counts, turbidity and impedance. It J Food Sci Technol 13, 65–75. 86. Smith-Palmer, A., Stewart, J. y Fyfe, L. (2001). “The potential application of plant essential oils as natural food preservatives in soft cheese”. Food Microbiology,18:463-470. 87. Smith-Palmer, A., Stewart, J. y Fyfe,L. (1998) “Antimicrobial properties of plants essential oils and essence against five important food-borne pathogens”.Letters in Applied .Microbiology,26:118-122. 88. Smittle, R.B. y Flowers, R.S. (1994) “ Predictive modeling and microbiological food studies”. SCOPE, 9:1-5, 7. 89. Sofos, J.N. y Busta, F.F. (1983). “Sorbates”. En Antimicrobials in Foods. Eds. A.L. Branen y P.M. Davidson p.141. Marcel Deker, Nueva York, USA. 90. Sofos, J.N., Beuchat, L.R., Davidson, P.M. y Johnson, E.A. (1998) “Naturally Occurring Antimicrobials in Food”. Council of Agricultural Science and Technology report no. 132. Ames, Iowa, USA. 156 91. Sokmen, A., Gulluce, M., Akpulat, H.A., Daferera, D., Tepe,B., Polissiou, M., Sokmen, M. y Sahin, F. (2004). “The in vitro antimicrobial and antioxidant activities of the essential oils and metanol extracts of endemic Thymus spathulifolius”. Food Control, 15: 627–634. 92. Soliman, K.M. y Badeea, R.I. (2002) “Effect of oil extracted from some medicinal plants on different mycotoxigenic fungi”. Food Chemistry and. Toxicology,40: 1669–1675. 93. Thomas, L.B., Wimpenny, J.W.T. y Peters, A.C. (1992) “ Testing multiple variables on the growth of a mixed inoculums of Salmonella strains using gradient plates” International Journal of Food Microbiology, 15: 165-175. 94. Urlich, G.A., Luchansky, J.B., Tamplin , M.L., Molina Corral, F.V., Arrandan, S. y Porto-Fett, A.C.S. (2006) “Effect of storage temperature on the growth of Listeria monocytogenes on white cheese slices .Journal of Food Safety, 26: 202–214. 95. Viuda-Martos, M., Ruiz–Narvaja, J., Fernández-López, J. y Perez- Alvarez, J.A. (2006) “ Antifungical Activities of Thyme,Clove and Oregano essential oils”. Journal of Food Safety,27: 91-101. 96. Vrinda Menon, K. y Garg, S.R. (2001) “Inhibitory effect of clove oil on Listeria monocytogenes in meat and cheese”. Food Microbiology, 18: 647650. 97. Walls, I. y Scott ,V. (1996).”Validation of predictive mathematical models describing growth of Staphylococcus aureus”. Journal of Food Protection, 59:1331-1335. 98. Walls, I. y Scott ,V. (1997) “ Validation of Predictive Mathematical Models describing the growth of Listeria monocytogenes”. Journal of Food Protection, 60: 1142-1145. 99. Whiting, R.C. (1995). “Microbial modeling in foods”. Critical Reviews in Food Science and Nutrition 35: 467- 494. 100. Whiting, R.C. (1997). “Microbial Database Building: what have we learned?”. Food Technology, 51:82-86. 101. Whiting, R.C. y Buchanan, R.L. (1997) “Predictive Modeling” . En Food Microbiology Fundamentals and Frontiers. Ed. M.P.Doyle, L. R.Beuchat y T. J. Montville. Cap.40 p. 728-739 . 157 102. Whiting, R.C. y Buchanan, R.L. (1994). “Microbial modeling”. Scientific Status Summary. Institute of Food Technologists, Expert Panel on Food Science and Nutrition, 48: 113- 120. 103. Wilkis,K.M. y Board,R.G. (1989).”Natural antimicrobial systems”.In Mechanisms of Action of Food Preservation Procedures.Ed. G.W.Gould.Cap.11 p.285-362. 104. Wilson, P.D.G., Brocklehursta, T.F., Arinob, S., Thuaultc, D., Jakobsend, M. , Langee, M., Farkasf, J., Wimpennyg, J.W.T. y Van Impe, J.F. (2002). “Modelling microbial growth in structured foods: towards a unified approach”. Journal Food Microbiology, 73:275-281. 105.Wood, B.J.B. y Holzapfel, W.H. (1995).” The Genera of Lactic Acid Bacteria”. Ed. Chapman and Hall, Londres, Inglaterra. 106.Yuste, J. y Fung, D.Y.C. (2002). “Inactivation of Listeria monocytogenes Scott A 49594 in apple juice supplemented with cinnamon”. Journal of Food Protection, 65:1663-1666. 107.Zhou, F., Ji, B., Zhang, H., Jiang, H., Li, J. y Yau, W. (2006) “The antibacterial effect of cinnamaldehyde, thymol, carvacrol and their combinations against the foodborne pathogen Salmonella typhimurium”. Journal of Food Safety,27: 124-133. 108.Zwietering, M.H.; Jongenburger, I.; Rombouts, F.M. y Van’t Riet, K. (1990). “Modeling of the bacterial growth curve”. Applied and Environmental Microbiology 56: 1875-1881. Páginas web consultadas 1. Center for Desease Control and Prevention(2002) Disponible en: http://www.cdc.gov/ncidod/dbmd/deseaseinfo/escherichiacoli_g.htm 2. Center for Desease Control and Prevention (2002)Disponible en: http://www.cdc.gov/ncidod/dbmd/deseaseinfo/listeriosis_g.htm 3. Center for Desease Control and Prevention.2002.Disponible en: http://www.cdc.gov/ncidod/dbmd/deseaseinfo/salmonellosis_g.htm 158 4. http://quimica.unp.edu.ar/grado/qa2/2003/tomillo.htm 5. http://www.minagri.gob.ar 6. http://www.sagpya.mecon.gov.ar/new/00/programas/economia_agraria/regio nales/cordoba.php 7. www.sagpya.mecon.gov.ar/aliment/lecheria/estadisticas 8. http://www.alimentosargentinos.gov.ar/lácteos Ministerio de Agricultura,ganadería y Pesca-Estadística de productos lácteos. 9. Pathogen Modeling Program. Disponible en http://pmp.arserrc.gov/PMPHome.aspx 159 --------------------------------BIOQ. MIRYAM SICILIANO TESISTA ---------------------------------DRA. SANDRA GUERRERO DIRECTORA 160