BUENAS PRACTICAS CLINICAS EN VACUNAS
Anuncio

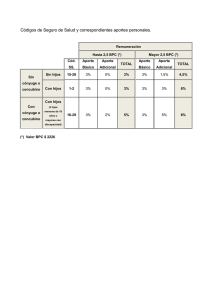
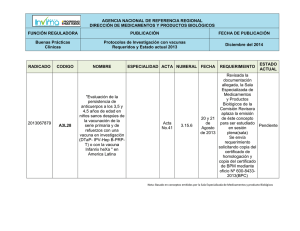
BUENAS PRACTICAS CLINICAS EN VACUNAS MC. Ing. Juan V. Bayolo Guanche. E-mail: [email protected] MC. Lic. Yohana Diáz Roque. E-mail: [email protected] Instituto Finlay VACUNAS •Clases heterogéneas de productos medicinales •Contienen sustancias antigénicas •Capaces de producir inmunidad activa •Contra agentes infecciosos, sustancias antigénicas toxinas y otras Vacunas de uso humano • Organismos vivos atenuados. • Organismos inactivados por medios físicos o químicos o alguna de sus fracciones. • Antígenos producidos por tecnología DNA recombinante. • Antígenos conjugados a portadores. • Vacunas anti-idiotípicas. • Vacunas antitumorales. Vacunas combinadas • Protege contra una enfermedad infecciosa causada por diferentes cepas o serotipos de un organismo. • Protege contra múltiples enfermedades infecciosas. • La combinación de las dos anteriores. BUENAS PRACTICAS CLÍNICAS (BPC) Conjunto de medidas sistemáticas y sistémicas que normalizan internacionalmente la calidad científica y ética de los estudios que requieren la participación de sujetos humanos. BUENAS PRACTICAS CLÍNICAS (BPC) ¿Para qué ? • Proteger los derechos, la seguridad y bienestar de los sujetos que participan en el ensayo. • Asegurar la credibilidad de los datos. • Mejorar la calidad científica, técnica y ética. BUENAS PRACTICAS CLÍNICAS (BPC) •Declaración de Helsinki. •Conferencia Internacional de Armonización (ICH) •Normas de BPC de organismos regulatorios. Declaració n de Helsinki (Adoptada en 1964 por la XVIII Asamblea Médica Mundial, en Helsinki (Finlandia) como guía para investigaciones Biomédicas en seres humanos y enmendada en Tokio (Japon), 1975; en Venecia (Italia), 1983; en Hong Kong, 1989; en Sudáfrica, 1996 y Escocia, 2000.) En 1983 es aprobada por la OMS. Cómo se materializa? - Consentimiento Informado - Comité de ética ¿ Qué es ICH ? (International Conference of Harmonization) • Norma Internacional de Buena Práctica Clínica (BPC) adoptada por la conferencia internacional de armonización de requerimientos técnicos de medicamentos farmacéuticos de uso humano. • Adoptada en 1996 (USA, Japón, Unión Europea, Australia, Canadá, Países Nórdicos) Normas de BPC de organismos regulatorios. • Normas de autoridades regulatorias del país en cuestión, por ejemplo: Centro para el Control Estatal de los Medicamentos (CECMED), Food and Drug Administration (FDA), etc. • Normas de BPC de los patrocinadores (Procedimientos normalizados de operación o PNO). Principios generales para el cumplimiento de las Buenas Prácticas Clínicas (BPC) Evaluación Riesgo-Beneficios • Los objetivos se deben trazar en proporción a los riesgos • Mejor ¨Bueno que malo¨ • Predecir los riesgos • Los intereses del sujeto es lo primario. • Detener el estudio si aparecen mas riesgos que beneficios Principios generales para el cumplimiento de las Buenas Prácticas Clínicas (BPC) Consideraciones Éticas • Especial atención en poblaciones vulnerables (niños, ancianos, etc.) • Uso de placebo como control solo en casos justificados • Pruebas de reto, solo en casos excepcionales Partes y responsabilidades COMITE ETICO INVESTIGADOR PATROCINADOR MONITOR AC yy AUDITORIA AUDITORIA AC Partes y responsabilidades(I) • Investigador: Persona responsable de la realización de un ensayo clínico en el lugar del ensayo. • Promotor o patrocinador: Institución u organización que tiene la responsabilidad del inicio, dirección y/o financiamiento de un ensayo clínico. • Monitor: Persona designada por el promotor para: 1. Proteger los derechos y el bienestar de los sujetos participantes. 2. Garantizar el cumplimiento de las BPC, el Protocolo de investigación, los Procedimientos Normalizados de Operación del Promotor y los requisitos reguladores vigentes. 3. Velar por la credibilidad de los datos. Partes y responsabilidades(II) Comité de Ética: Cuerpo independiente responsable de garantizar la protección de los derechos, seguridad y bienestar de los seres humanos implicados en un ensayo, así como velar por la validez científica y la justificación ética y social del mismo. Emite un dictamen escrito de aprobación/rechazo del ensayo indispensable para la ejecución o no de este. Auditoría y Aseguramiento de Calidad(AC): Actividades planificadas sistemáticas y sistémicas establecidas para asegurar que el ensayo sea realizado y los datos sean generados registrados y comunicados de acuerdo con las normas de BPC y los requisitos reguladores vigentes. Partes y responsabilidades(III) Organización de investigación por contrato: Persona u organización (comercial, académica u otras) contratada por el promotor para realizar una o más de las funciones y obligaciones de este, relacionadas con el ensayo. Instituciones participantes PATROCINADORES O PROMOTORES SITIOS DE INVESTIGACION • • • • Institutos Hospitales Facultades de Medicina Policlínicos, etc. • Organizaciones de Investigación, Desarrollo o Producción de productos farmacéuticos. ORGANIZACIÓN DE INVESTIGACION POR CONTRATO • Centro coordinador de ensayos clínicos. Equipo de Trabajo • Investigador principal: médico clínico, pediatra, epidemiólogo, inmunólogo,especialista de Grupo Básico. • Otros autores contribuyentes: médicos de otras especialidades, médicos generales integrales, bioestadísticos, informáticos, farmacólogos, bioquímicos, biólogos, enfermeras, técnicos de laboratorio. • Otros profesionales y técnicos. Ruta crítica de un proyecto de investigación clínica • Planificación de la investigación. • Selección del investigador principal y su equipo de trabajo. • Confección del Protocolo del estudio y el resto de la documentación relevante (Formulario de Consentimiento Informado, Cuaderno de Recogida de Datos (CRD), Manual del Investigador, etc.) • Aprobación del Protocolo del estudio por el Comité de Ética y posteriormente por la autoridad reguladora nacional. • Diseño de la estrategia de reclutamiento. • Visita previa al estudio. • Entrenamiento del equipo médico participante. Ruta crítica de un proyecto de investigación clínica (II) • Entrega del (los) productos al investigador. • Visita de inicio del ensayo. • Ejecución del estudio. • Visitas de monitorización en cada etapa. • Recolección de los datos en los CRD en cada visita. • Entrada de datos en las bases electrónicas. • Depuración de los datos. • Análisis estadístico. • Confección del reporte final del estudio. PROTOCOLOS DE INVESTIGACIÓN • En acuerdo con la guía para la confección del protocolo de ensayos clínicos que orienta la autoridad reguladora pertinente • Adaptar diseño Ensayos Clínicos a Vacunas • Participan: Promotor, Monitor e Investigador • Someterlo a la aprobación del Comité de Ética (CEIC/CER) • Someterlo a la aprobación de la autoridad reguladora. Aspectos a considerar en el diseño de un ensayo cl ínico • Fase del ensayo • Cantidad de grupos de tratamiento • Uso de grupo control • Enmascaramiento • Aleatorización • Población de estudio (criterios de selección) • Tamaño de muestra (n) • Objetivos • Variables de medida de la respuesta Recogida y manejo de la información generada en el ensayo clínico • Documentos fuentes ( Historia clínica, tarjeta diaria de vacunación, registros de laboratorio clínico (como libreta o libro de anotaciones), etc. • Cuaderno de Recogida de Datos (CRD): diseñado de acuerdo a los requerimientos del estudio y dónde se recogen todos los datos necesarios para cumplir los objetivos de la investigación. Desarrollo clínico de vacunas. Recomendaciones (I). • Estudio de reto (solo en casos excepcionales). • Estudio de seguridad:“n” reducida (10-40 voluntarios, pudieran ser aleatorizados y controlados, vigilancia de parámetros clínicos y primera observación de eventos adversos: seguimiento activo durante 7 días para vacunas de celulas muertas y recombinantes y durante 14 para la mayoría de las vacunas vivas. • Estudio de reactogenicidad: “n” mayor, observación de eventos adversos y determinación de la frecuencia de aparición de los mismos, pudieran ser aleatorizados y controlados, exploración de dosis y esquema. Desarrollo clínico de vacunas. Recomendaciones (II). • Estudio de inmunogenicidad: Mayor tamaño de muestra, deben ser aleatorizados y controlados, caracterización del tipo de respuesta inmune y evaluación de la capacidad protectora del producto (TGM, % seroconversión, etc.) determinación de la dosis y el esquema óptimo. • Estudio de eficacia: Mayor tamaño de muestra en función de la incidencia de la enfermedad (decenas de miles de voluntarios), BIEN controlados, aleatorizados y enmascarados; se determina la efectividad del producto como medida de protección contra la enfermedad en cuestión y confirmación de evidencias de estudios anteriores. Observación de reacciones adversas menos frecuentes y estimación de la duración de la protección. Vigilancia sistemática de la enfermedad. Desarrollo clínico de vacunas. Recomendaciones (III). Estudio de efectividad: Monitoreo del comportamiento del producto en condiciones de campo (no controladas), determinación del grado de protección en las condiciones reales o usuales de su aplicación y observación de reacciones adversas de muy baja frecuencia de aparición. “EN LA PRACTICA ES POSIBLE COMBINAR VARIOS TIPOS DE ESTUDIO O DAR RESPUESTA A VARIAS PREGUNTAS EN UN MISMO ENSAYO CLÍNICO”. FIN