Poster SEOM 2015 estudio TTCC-2009/03
Anuncio
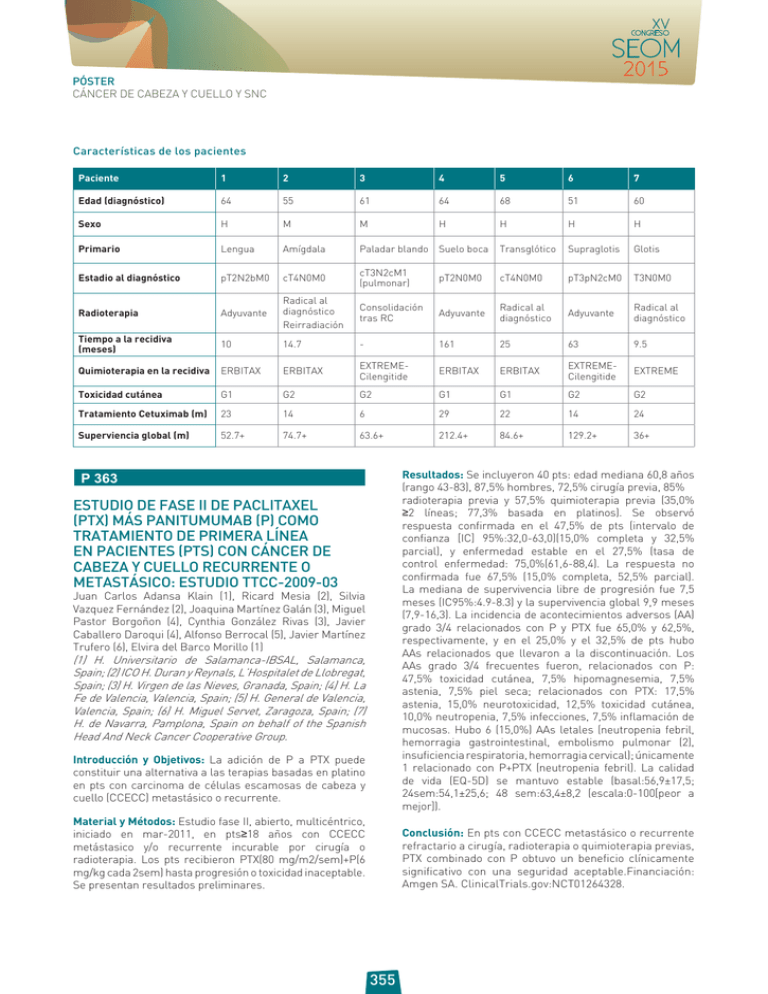
PÓSTER CÁNCER DE CABEZA Y CUELLO Y SNC Características de los pacientes Paciente 1 2 3 4 5 6 7 Edad (diagnóstico) 64 55 61 64 68 51 60 Sexo H M M H H H H Primario Lengua Amígdala Paladar blando Suelo boca Transglótico Supraglotis Glotis Estadio al diagnóstico pT2N2bM0 cT4N0M0 cT3N2cM1 (pulmonar) pT2N0M0 cT4N0M0 pT3pN2cM0 T3N0M0 Radioterapia Adyuvante Radical al diagnóstico Reirradiación Consolidación tras RC Adyuvante Radical al diagnóstico Adyuvante Radical al diagnóstico Tiempo a la recidiva (meses) 10 14.7 - 161 25 63 9.5 Quimioterapia en la recidiva ERBITAX ERBITAX EXTREMECilengitide ERBITAX ERBITAX EXTREMECilengitide EXTREME Toxicidad cutánea G1 G2 G2 G1 G1 G2 G2 Tratamiento Cetuximab (m) 23 14 6 29 22 14 24 Superviencia global (m) 52.7+ 74.7+ 63.6+ 212.4+ 84.6+ 129.2+ 36+ Resultados: Se incluyeron 40 pts: edad mediana 60,8 años (rango 43-83), 87,5% hombres, 72,5% cirugía previa, 85% radioterapia previa y 57,5% quimioterapia previa (35,0% ≥2 líneas; 77,3% basada en platinos). Se observó respuesta confirmada en el 47,5% de pts (intervalo de confianza [IC] 95%:32,0-63,0)(15,0% completa y 32,5% parcial), y enfermedad estable en el 27,5% (tasa de control enfermedad: 75,0%(61,6-88,4). La respuesta no confirmada fue 67,5% (15,0% completa, 52,5% parcial). La mediana de supervivencia libre de progresión fue 7,5 meses (IC95%:4.9-8.3) y la supervivencia global 9,9 meses (7,9-16,3). La incidencia de acontecimientos adversos (AA) grado 3/4 relacionados con P y PTX fue 65,0% y 62,5%, respectivamente, y en el 25,0% y el 32,5% de pts hubo AAs relacionados que llevaron a la discontinuación. Los AAs grado 3/4 frecuentes fueron, relacionados con P: 47,5% toxicidad cutánea, 7,5% hipomagnesemia, 7,5% astenia, 7,5% piel seca; relacionados con PTX: 17,5% astenia, 15,0% neurotoxicidad, 12,5% toxicidad cutánea, 10,0% neutropenia, 7,5% infecciones, 7,5% inflamación de mucosas. Hubo 6 (15,0%) AAs letales (neutropenia febril, hemorragia gastrointestinal, embolismo pulmonar (2), insuficiencia respiratoria, hemorragia cervical); únicamente 1 relacionado con P+PTX (neutropenia febril). La calidad de vida (EQ-5D) se mantuvo estable (basal:56,9±17,5; 24sem:54,1±25,6; 48 sem:63,4±8,2 (escala:0-100[peor a mejor]). P 363 ESTUDIO DE FASE II DE PACLITAXEL (PTX) MÁS PANITUMUMAB (P) COMO TRATAMIENTO DE PRIMERA LÍNEA EN PACIENTES (PTS) CON CÁNCER DE CABEZA Y CUELLO RECURRENTE O METASTÁSICO: ESTUDIO TTCC-2009-03 Juan Carlos Adansa Klain (1), Ricard Mesia (2), Silvia Vazquez Fernández (2), Joaquina Martínez Galán (3), Miguel Pastor Borgoñon (4), Cynthia González Rivas (3), Javier Caballero Daroqui (4), Alfonso Berrocal (5), Javier Martínez Trufero (6), Elvira del Barco Morillo (1) (1) H. Universitario de Salamanca-IBSAL, Salamanca, Spain; (2) ICO H. Duran y Reynals, L’Hospitalet de Llobregat, Spain; (3) H. Virgen de las Nieves, Granada, Spain; (4) H. La Fe de Valencia, Valencia, Spain; (5) H. General de Valencia, Valencia, Spain; (6) H. Miguel Servet, Zaragoza, Spain; (7) H. de Navarra, Pamplona, Spain on behalf of the Spanish Head And Neck Cancer Cooperative Group. Introducción y Objetivos: La adición de P a PTX puede constituir una alternativa a las terapias basadas en platino en pts con carcinoma de células escamosas de cabeza y cuello (CCECC) metastásico o recurrente. Material y Métodos: Estudio fase II, abierto, multicéntrico, iniciado en mar-2011, en pts≥18 años con CCECC metástasico y/o recurrente incurable por cirugía o radioterapia. Los pts recibieron PTX(80 mg/m2/sem)+P(6 mg/kg cada 2sem) hasta progresión o toxicidad inaceptable. Se presentan resultados preliminares. Conclusión: En pts con CCECC metastásico o recurrente refractario a cirugía, radioterapia o quimioterapia previas, PTX combinado con P obtuvo un beneficio clínicamente significativo con una seguridad aceptable.Financiación: Amgen SA. ClinicalTrials.gov:NCT01264328. 355