Química - Bloque 1 - Relación con otras ciencias (147502)
Anuncio

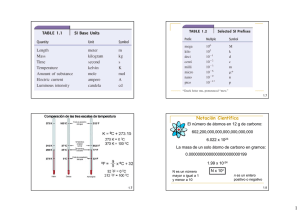
1 2 CONTENIDO INTRODUCCIÓN .............................................................................................................................. 2 BLOQUE UNO ................................................................................................................................. 3 TEMA UNO ..................................................................................................................................... 5 Los peligros de la medición.......................................................................................................... 5 MASA Y PESO .............................................................................................................................. 6 MEDICIÓN Y CIFRAS SIGNIFICATIVAS ........................................................................................... 7 CIFRAS SIGNIFICATIVAS Y REDONDEO (I) ..................................................................................... 9 CIFRAS SIGNIFICATIVAS Y REDONDEO (II)................................................................................... 10 NOTACIÓN CIENTÍFICA .............................................................................................................. 11 TEMA DOS .................................................................................................................................... 12 LOS CÁLCULOS Y LAS CIFRAS SIGNIFICATIVAS ............................................................................ 14 TEMA TRES ................................................................................................................................... 15 SISTEMA INTERNACIONAL DE UNIDADES (SI) ............................................................................. 17 TEMA CUATRO ............................................................................................................................. 19 MEDICIÓN DE LA LONGITUD (I).................................................................................................. 19 MEDICIÓN DE LA LONGITUD (II)................................................................................................. 20 MEDICIÓN DE LA MASA ............................................................................................................. 21 MEDICIÓN DEL VOLUMEN (I) ..................................................................................................... 23 MEDICIÓN DEL VOLUMEN (II) .................................................................................................... 24 MEDICIÒN DE LA TEMPERATURA (I) .......................................................................................... 25 MEDICIÓN DE LA TEMPERATURA (II).......................................................................................... 26 MEDICIÒN DE LA DENSIDAD ...................................................................................................... 27 DENSIDAD RELATIVA ................................................................................................................. 29 INTRODUCCIÓN La Química es la ciencia que estudia la composición, estructura y propiedades de la materia, así como los cambios que experimenta y la energía que acompaña a estos cambios. La Química como ciencia aplica el método deductivo – inductivo y viceversa. 3 La Química como cualquier otra ciencia, posee dos campos: uno teórico, de abstracción y método riguroso, y otro experimental y descriptivo que nos lleva hacia la realidad y la experimentación. Los dos conceptos son imprescindibles; si solo nos limitamos al segundo, la Química se reduciría a un inmenso número de recetas, que no nos ayudarían a razonar. El campo de la Química es el de las sustancias en transformación, fenómenos a los que hay que acceder y entender. La química siempre ha estado estrechamente ligada a nuestro planeta y al universo; no andaríamos mal encaminados si dijésemos que la Tierra y los millones de seres vivos que la habitan, son en sí mismos un admirable conjunto de reacciones químicas complejas y asombrosas. Es evidente que está relacionada con otras ciencias, así podemos decir que tiene influencia en la biología, ya que en los seres vivos se realizan cambios químicos; se relaciona íntimamente con la física ya que el estudio de los procesos físicos referidos a la energía y sus transformaciones, son necesarios para entender las reacciones térmicas; es necesario utilizar la matemática para realizar operaciones para el estudio de los procesos químicos. La química no sólo dio vida a nuestro planeta, sino que desde su origen se ha convertido en el motor que ha permitido avanzar a la Humanidad. Sin el desarrollo de esta ciencia, nuestra vida sería muy corta, sin medicamentos, vacunas o antibióticos; sin materiales para potabilizar el agua, sin productos que garanticen nuestra higiene o que protegen y mejoren el rendimiento de los cultivos. Sin la química no podríamos: navegar por internet, hablar por nuestros móviles o simplemente leer un libro, escuchar un disco o ir al cine. Todo el conjunto de aportaciones de esta ciencia nos han facilitado la vida y ha aumentado nuestra comodidad, mediante la síntesis de cauchos, resinas plásticas y otros materiales. En la Estación Espacial Internacional los materiales plásticos son imprescindibles. Las naves deben soportar temperaturas extremas que van desde –200º C a más de 200º C, variaciones de presión, una enorme aceleración cuando despega el cohete, turbulencias cuando la cápsula entra en la atmósfera. Para la ingeniería aeronáutica la química es fundamental. La Química es la ciencia de ayer, hoy y siempre. BLOQUE UNO Relaciones de la Química con otras ciencias Medición y unidades 4 1.1. Masa y peso. 1.2. Medición y cifras significativas. 1.3. Redondeo de números. 1.4. Notación científica. 1.5. El Sistema Internacional. 1.6. Medición de longitud, masa, volumen, temperatura y densidad. ESTUDIANTES EN EL LABORATORIO AL FINALIZAR EL PRESENTE BLOQUE DESARROLLARÁS LAS SIGUIENTES DESTREZAS CON CRITERIOS DE DESEMPEÑO Valorar el proceso de medición en todas las actividades del ser humano, mediante la realización de experiencias de campo, recolección de datos y conclusión de resultados, utilizando las unidades del S.I., las cifras significativas adecuadas, los redondeos correspondientes y la notación científica que sea del caso. Interpretar situaciones cualitativas y cuantitativas de medición de longitudes, masas, volúmenes, temperaturas y densidades, por medio de la experimentación, la recolección de datos, el cálculo para la obtención de resultados de conversiones entre las unidades del SI y otros sistemas aún utilizados. Interpretar las relaciones de la Química con otras ciencias, mediante la resolución de ejercicios cuantitativos y cualitativos que involucran situaciones de Astronomía, Geografía, Matemáticas, Física, Deportes, Ciencias Sociales, problemas del mundo contemporáneo, etc. …….. Y LOS SIGUIENTES INDICADORES NOS DARÁN CUENTA DE TU PROCESO Identifica masa y peso, realiza ejercicios de transformación de unidades S.I. a otros sistemas y viceversa. Aplica la teoría de errores y las reglas de las cifras significativas en la resolución de ejercicios concretos. Resuelve exitosamente ejercicios sobre transformaciones de unidades de longitud, masa, volumen, temperatura y densidad. 5 PARA EL INICIO DE ESTE BLOQUE ES NECESARIO QUE RECUERDES ASPECTOS COMO ¿Cuál es la importancia de la ciencia para la vida en el planeta¡ ¿Las comparaciones siempre son odiosas? ¿Por qué será importante el proceso de medición? ¿Por qué ahora ya no se utilizan unidades de medida como el codo, la palma, etc.? TEMA UNO MEDICIÓN Y UNIDADES Lee con atención Los peligros de la medición Tratar de medir la calidad, puesto que... Es muy posible que no demos con medidas que tengan "sustancia". Lo que hay que medir son los parámetros de los procesos. Medir para controlar, premiar o castigar a otro, porque... Con seguridad provocaremos reacciones defensivas y se distorsionará la información. Cada uno ha de medir lo suyo, para mejorar él. Medir sólo los resultados finales , pues ... No sabremos bien por qué los hemos obtenido Hay que medir "aguas arriba" del proceso Medir demasiadas cosas, ya que... Podemos caer en una burocracia horrible. Hay que concentrarse en lo esencial. Pero si alguien llega a la conclusión de que lo mejor es no medir, dado lo molesto y peligroso que resulta, que tenga muy en cuenta que así nunca entenderá bien lo que está haciendo y que lo que no se mide, no mejora Tomado de: http://www.tqm.es/TQM/Articulo8.htm Luego, contesta en tu cuaderno, las siguientes preguntas: 1.- ¿Podrías citar dos ejemplos en los cuáles se mide para corregir procesos? Escríbelos. 2.- ¿Crees que en la educación se mide? ¿Por qué? 3.- ¿Crees que medir te permite entender mejor las cosas? ¿Por qué? 6 4.- ¿Qué elementos facilitan los procesos de medición en la actualidad? ¿Por qué? INTRODUCCIÓN Imagina que eres un médico cirujano y que debes realizar una delicada intervención quirúrgica. ¿Qué sucedería si uno de tus cortes no tiene la longitud y la profundidad adecuadas? Una vida podría extinguirse. O si tal vez tienes que inyectarle una dosis de anestesia al paciente… si cometes un error en la medición del volumen de fármaco, podrías ocasionar problemas irreversibles. Estas ideas iniciales te darán una clara imagen de que los procesos de medición son importantes y no solamente en la medicina, sino en actividades tan simples y diversas como cocinar, arreglar vehículos, comprar y vender. MASA Y PESO La Química es una ciencia natural experimental, por lo tanto, requiere de mediciones para sus procesos; podrás observar que en un trabajo de laboratorio usualmente vas a medir masa, peso, longitud, volumen, presión, temperatura y tiempo; magnitudes usualmente muy relacionadas en los fenómenos propios del planeta y del universo. Usualmente, existe la tendencia a pensar que masa y peso es lo mismo. Esto no es así. La masa de un cuerpo es la cantidad de materia que posee, es una cantidad fija e invariable que no depende de la ubicación del cuerpo sobre la Tierra. La masa se puede medir mediante el uso de una balanza, a través de la comparación con masas ya establecidas. En el S.I. la unidad de medida es el gramo (g) o el kilogramo (Kg). Peso en cambio es la medida de la atracción gravitacional que la Tierra ejerce sobre un cuerpo; NO es una cantidad fija e invariable, pues depende de la ubicación del objeto sobre la Tierra o de la distancia entre él y nuestro planeta. El peso se puede medir a través de un dinamómetro (un resorte dentro de una escala). En el S.I. la unidad de medida es el Newton (N). 7 BALANZA ROMANA Y DINAMÓMETRO Investigación individual. La base terrestre se comunica con un astronauta de 85 Kg, que está en una nave en el espacio exterior. Le piden que diga su masa y su peso. ¿Cuáles crees que serán sus respuestas?, ¿Por qué? MEDICIÓN Y CIFRAS SIGNIFICATIVAS MEDICIÓN Todo en el estudio de las ciencias parte de las mediciones, una medición es comparar una cantidad con su respectiva unidad para averiguar cuantas veces está contenida la segunda en la primera. Por ejemplo, si deseamos medir la longitud de una pista atlética, la compararemos con otra longitud ya establecida, conocida como metro (m), y veremos cuántas veces está contenida en dicha pista. Con seguridad veremos que en la pista hay 400 metros. El resultado de un proceso de medición se conoce como medida y es importante tomar en cuenta que se realizan con algún tipo de error debido, primeramente, al mal estado del instrumental y a las limitaciones de la persona que mide. A este tipo de errores se los conoce como errores sistemáticos. El error también se debe, en segundo lugar, a la imprecisión de los aparatos y a la dispersión propia del proceso de medida. A este tipo de errores se los conoce como errores accidentales. En los siguientes gráficos definir los tipos de errores Error ………………… 8 Error …………………. Error …………………….. Cada magnitud (como la longitud, masa, tiempo, etc.) tiene su unidad ya establecida por convención internacional. Esto permite que la información científica sea fácil de interpretar en cualquier parte del mundo. Una unidad de medida debe cumplir con tres condiciones fundamentales: - Debe ser inalterable: no debe cambiar con el tiempo ni de acuerdo con la persona que realice la medición. Debe ser universal, es decir de uso generalizado en todos los países del mundo. Debe ser fácilmente reproducible, es decir, le puede obtener réplicas de ella para su uso en cualquier parte. Las mediciones son de dos tipos, directas (cuando se concretan a través del uso de un instrumento de medida debidamente calibrado) e indirectas (para los casos en los que no existe un instrumento adecuado de medición y se deben utilizar expresiones algebraicas en las que se van introduciendo los valores obtenidos en las mediciones directas y las procesamos matemáticamente). El resultado de una medición se expresa mediante un valor numérico y una unidad de medida Baúl de conceptos.Bureta.- Tubo graduado de vidrio, de diámetro grande y uniforme, uno de cuyos extremos se puede cerrar con una llave. Sirve para medir volúmenes líquidos. 9 Convención.- Norma o práctica admitida por responder a precedentes o a la costumbre. CIFRAS SIGNIFICATIVAS Y REDONDEO (I) Las cifras significativas de un número son aquellas que tienen significado real o que le aportan alguna información al investigador. Para expresar las cifras significativas de una medida, debemos tomar en cuenta las siguientes normas: 1.- Son significativas todas las cifras distintas a cero. Ejemplo: 1 400 tiene dos cifras significativas 1 y 4. 2.- Los ceros colocados entre cifras que no sean cero sí son significativos. Ejemplo: 102 tiene tres cifras significativas. 3.- Los ceros colocados antes de la primera cifra significativa no son significativos. Ejemplo: 0,415 tiene tres cifras significativas. . 4.- Los ceros colocados después de la última cifra significativa no son significativos, SALVO que vayan seguidos de la coma decimal o que estén situados a la derecha de la coma decimal. Ejemplos: 1 040, tiene cuatro cifras significativas (por la coma que está a la derecha del cero) y en 105,0 hay cuatro cifras significativas. . Las medidas que se obtengan sobre datos experimentales se deben expresar únicamente con las cifras que entreguen las lecturas de los instrumentos, sin quitar ni aumentar cifras dudosas e indicando en los resultados la incertidumbre en la medida. BALANZA DIGITAL- INSTRUMENTOS AFORADOS PARA MEDIR LÍQUIDOS TIC´s científicos. 10 Ingresa a http://www.educaplus.org/formularios/cifrassignificativas.html y repasa las normas de las cifras significativas, analiza los ejemplos y luego comprueba tus conocimientos mediante la realización de veinte ejercicios en los que tienes que determinar cuántas cifras significativas hay en las cantidades que irán apareciendo. Baúl de conceptos.Investigador.- Persona que hace ciencia aplicando el método científico; lee, observa, calcula, analiza, interpreta y procesa la información. Incertidumbre.- Desconocido. En ciencias es lo que un instrumento o un cálculo no puede medir, y si mide, lo hace sin confiabilidad. NO TEMAS AL CÁLCULO CIFRAS SIGNIFICATIVAS Y REDONDEO (II) Las cifras no significativas de un número aparecen como resultado de los cálculos y no poseen significación alguna. Las cifras significativas de un número dependen de su incertidumbre y ocupan una posición igual o superior al orden o lugar de la incertidumbre o error. Veamos un ejemplo: si luego de medir el radio de un átomo, obtenemos un valor de 247,4743 pm con un error de 0,8 pm, nos daremos cuenta que el error es del orden de décimas de picómetro por lo tanto aquellas cifras que ocupan una posición menor que las décimas, no aportan información alguna, por lo tanto, los números 7, 4 y 3 no son cifras significativas. Es entonces necesario, eliminar estas cifras no significativas pues lo único que ocasionan es confusión. La forma de hacerlo es mediante el redondeo, que obedece a las siguientes reglas: 1.- Si la cifra que se elimina es menor que cinco, se la elimina, sin realizar ningún tipo de ajuste en el número que queda. Por ejemplo si queremos dejar tres cifras significativas en el siguiente número 5,874, el resultado sería 5,87. 2.- Si la cifra que se eliminará es mayor que cinco, la última cifra retenida sube una unidad. Si queremos redondear a tres cifras significativas a 5,876 el resultado sería 5,88. 11 3.- Si la cifra que se eliminará es cinco, se deja como última cifra un número par, de la siguiente manera: si la cifra retenida es par, se la deja tal como está, y si es impar, se la lleva al número par superior más próximo. Para redondear a tres cifras significativas 5,875 el resultado será 5,88 Trabajo en equipo.- En las hojas de sus cuadernos, redondeen al número indicado de cifras significativas los siguientes valores y entreguen sus trabajos al maestro/a: a. 42,157 a dos cifras. b. 87,027 a tres cifras. c. 0,08763 a tres cifras. d. 0,07955 a dos cifras . e. 335,2 a tres cifras. f. 23,250 a tres cifras NOTACIÓN CIENTÍFICA En las ciencias, la notación científica es un recurso matemático muy útil, ya que nos ayuda a presentar de forma práctica cálculos y mediciones muy grandes o muy pequeños. Para hacerlo se utilizan potencias de diez. En el sistema decimal, cualquier número real puede expresarse mediante la denominada notación científica. Resulta fácil comprender el proceso si analizamos los siguientes ejemplos: Si obtenemos el valor: 432, 4041 y queremos expresarlo en notación científica, movemos la coma decimal dos lugares hacia la izquierda, el resultado es el siguiente: 4,324041.102. El exponente es positivo para indicarnos que el valor original es mayor que uno. Si por el contrario, en un proceso de cálculo obtenemos un resultado como -0,004512 y queremos expresarlo en notación científica, movemos la coma decimal tres lugares hacia la derecha y obtenemos el siguiente resultado: -4,512.10-3. El exponente negativo indica que el valor original es menor que uno. Observemos que el exponente de la base diez tiene un valor igual al número de puestos que recorre la coma. Siempre que un número se exprese en notación científica, debe quedar un solo dígito entero (diferente de cero) a la izquierda de la coma. 12 Trabajo individual. Ahora que ya tienes una idea completa de las cifras significativas, redondeo y notación científica, realiza los siguientes ejercicios en tu cuaderno y entrégaselos a tu profesor/a: 1. ¿Cuántas cifras significativas hay en cada uno de los siguientes valores?: 2. a. 5,7.10-6 metros b. 4,035 litros c. 137,0 gramos d. 0,003 millas e. 35, 0 aves f. 23, 30 Kelvin g. 2,572.103 personas h. 304 pies Escribe los siguientes números en notación científica: a. 2 400 b. 0,00567 d. -57 201 e. 134 000 g. 0,432 c. 0,00056 f. -0,00456 h. -347,5 3. Escribir los siguientes números en notación decimal: a. 2,34.10-4 b. -1,24.102 c. 6,023.106 d. 3,35.10-5 e. 3,65.10-6 f. -3,709.107 g. 7,05.108 h. -5,785.10-5 TEMA DOS CIFRAS SIGNIFICATIVAS EN LOS CÁLCULOS QUÍMICOS Lee con atención Eureka Herón II, rey de Siracusa, pidió un día a su pariente Arquímedes que comprobara si una corona que había encargado a un orfebre local era realmente de oro puro. El rey le pidió también de forma expresa que no dañase la corona. Arquímedes dio vueltas y vueltas al problema sin saber cómo resolverlo, hasta que un día, mientras tomaba un baño, se le ocurrió la solución. Pensó que el agua que se desbordaba tenía que ser igual al volumen de su cuerpo que estaba sumergido. Si medía el agua que rebosaba al meter la corona, conocería el volumen de la misma y a continuación podría compararlo con el volumen de un objeto de oro del mismo peso que la corona. Si los volúmenes no fuesen iguales, sería una prueba de que la corona no era de oro puro. A consecuencia de la excitación que le produjo su descubrimiento, Arquímedes salió del baño y fue corriendo desnudo como estaba hacia el palacio gritando: "¡Lo encontré! ¡Lo encontré!". La palabra griega "¡Eureka!" 13 utilizada por Arquímedes, ha quedado desde entonces como una expresión que indica la realización de un descubrimiento. Adaptación http://www.reduy.com/libre/diverticiencia/docs/v0000004.htm Contesta en tu cuaderno las siguientes preguntas: 1.- ¿En qué época vivió Arquímedes?, ¿Cuáles son sus trabajos más importantes? 2.- ¿Qué lección deja para tu vida la actitud de Arquímedes? 3.- El grito ¡Eureka! ¿Qué quiere decir? 4.- ¿Podrías explicar de qué manera hubiera podido Arquímedes relacionar los conceptos volumen, masa y densidad para resolver el problema de la corona? SIEMPRE…. PIENSA INTRODUCCIÓN El mundo de los científicos está lleno de desafíos, constantemente deben desarrollar procesos de observación e investigación y luego, para demostrar la validez de sus trabajos, deben desarrollar una serie de cálculos, inducciones y deducciones que a la final sustentarán sus procesos y permitirán generalizar los resultados. Los cálculos son vitales para los hombres de ciencia, por ello debemos introducirnos en aquellos ámbitos importantes de las Matemáticas que son útiles para hacer ciencia. 14 LOS CÁLCULOS Y LAS CIFRAS SIGNIFICATIVAS Uno de los aspectos básicos que debemos tener en cuenta cuando realicemos cálculos, es el manejo de las cifras significativas, podríamos empezar diciendo que los resultados de un cálculo basado en mediciones no pueden ser más precisos que la medida menos precisa. Cifras significativas en la adición o sustracción El resultado de una adición o sustracción debe tener tantas cifras significativas como tenga el término CON MENOR número de decimales. Dicho de otra manera, la respuesta de una suma o resta deberá tener la misma precisión que la medida menos precisa (llamada también la de mayor incertidumbre). Examinemos un ejemplo: 3,14159 + 2,1 = 5,24159 5,2 (con redondeo). Analicemos otro: Restar: 14,2 de 133,96 Resolviendo: 133,96 – 14,2 = 119,76 119,8 (con redondeo). Cifras significativas en la multiplicación o división En una multiplicación o división el resultado no puede contener más cifras significativas que las del término CON MENOR número de cifras significativas. Veamos los siguientes ejemplos: 195,6 x 2,4 = 469,44 Este resultado se obtuvo en una calculadora, pero solamente debe tener dos cifras. 4,7.102 respuesta correcta, observe que la notación científica fue útil para resolver este caso. Ahora resolvamos: 7,7 15 PROFESOR DICTANDO CLASES Trabajo para la casa.1.- Investiga y define los términos: - Inducción: - Deducción: 2.- Resuelve en tu cuaderno las siguientes operaciones, cuidando que las respuestas tengan el número correcto de cifras significativas: a. 9,3 + 0,225 b. c. 2,6 + 46 – 0,004 d. e. 4672 + 0,00047 f. 0,1543 x 6,3 Baúl de conceptos: Precisión.- Dispersión del conjunto de valores obtenidos de mediciones repetidas de una magnitud, cuanto menor es la dispersión, mayor es la precisión. Exactitud.- Es cuán cerca del valor real está el valor medido, mientras más cerca esté, más exacta es la medición. TEMA TRES UTILIDAD DEL SISTEMA INTERNACIONAL EN LOS CÁLCULOS QUÍMICOS Lee con atención He aquí lo que puede suceder por no usar un sistema de medición homologado El 23 de septiembre de 1999, el “Mars Climate Orbiter” se perdió durante una maniobra de entrada en órbita y se estrelló contra Marte. La causa principal del contratiempo fue achacada a una tabla de calibración del propulsor, en la que se usaron unidades del sistema británico en lugar de unidades métricas. El software para la navegación celeste en el Laboratorio de Propulsión del Chorro (Jet Propulsion Laboratory) esperaba que los datos del impulso del propulsor estuvieran expresados en newton segundo, pero Lockheed Martin Astronautics en Denver, que construyó el Orbiter, dio los valores en libras de fuerza segundo, y el impulso fue interpretado como aproximadamente la cuarta parte de su valor real. El fallo fue más sonado por la pérdida posterior de su compañero el ingenio espacial “Mars Polar Lander”, debido a causas desconocidas, el 3 de diciembre. Adaptación 16 http://www.terra.es/personal6/gcasado/si.htm Fotografías del Mars Climate Orbiter Contesta las siguientes preguntas en tu cuaderno: 1.- ¿Cuál crees que fue el problema que ocasionó el accidente del “Mars Climate Orbiter”? 2.- ¿Te has dado cuenta de que ciertos países se empeñan en no utilizar el S.I. (Sistema Internacional de unidades) pese a que su uso debe ser generalizado? ¿Por qué crees que lo hacen? 3.- ¿Qué harías tú para que el S.I. sea de uso mundial? Explica cuatro medidas que tomarías. 4.- Ahora que has realizado este análisis, ¿podrías decirnos algunas utilidades del Sistema Internacional de unidades? INTRODUCCIÓN El hecho de que la comunidad internacional de naciones buscara la manera de unificar sus unidades de medida ocasionó muchos problemas, hasta que apareció el Sistema Internacional de Unidades. Este sistema es una herramienta “ejemplo de globalización”, que se ha difundido mucho en nuestra comunidad actual, en donde el intercambio de productos y las actividades comerciales son una norma general y, por lo tanto, urge la unificación de los lenguajes. Aunque aún hay países que no lo emplean con la rigurosidad que deberían, hay que reconocer que se va alcanzando un uso cada vez mayor. 17 El hecho de que algunos países aún no utilicen de forma debida el SI, obliga a los demás a manejar factores de conversión que bien podrían evitarse si todos usaran SI. SISTEMA INTERNACIONAL DE UNIDADES (SI) Es el nombre que recibe el sistema de unidades que se usa en todos los países y es la forma actual del sistema métrico decimal. Fue creado en 1960 por la Conferencia General de Pesos y Medidas, DISCUSIÓN ENTRE CIENTÍFICOS Está constituido sobre un conjunto de unidades básicas y utiliza factores de potencias de 10 para expresar los múltiplos y submúltiplos de las unidades. Para formar unidades que son mayores o menores que las unidades básicas, se agregan prefijos a los nombres de éstas. Aunque por los estudios que has realizado en años anteriores ya conoces esta información, te la presentamos a manera de recordatorio: Magnitudes y unidades fundamentales del SI Magnitud Unidad Símbolo Longitud Metro m Masa Kilogramo Kg Tiempo Segundo s corriente eléctrica ampere o amperio A Temperatura Kelvin K cantidad de materia Mol mol intensidad luminosa Candela cd 18 Tomado de: http://recursostic.educacion.es/descartes/web/materiales_didacticos/m2m3/unidades.htm Múltiplos y submúltiplos del SI Prefijo yotta Símbolo Y Factor multiplicativo 1 000 000 000 000 000 000 000 000 10 zetta Z 1 000 000 000 000 000 000 000 10 exa E 1 000 000 000 000 000 000 10 peta P 1 000 000 000 000 000 10 tera T 1 000 000 000 000 10 giga G 1 000 000 000 10 mega M 1 000 000 10 kilo k 1000 10 hecto h 100 10 deca da 10 10 1 (Unidad) 24 21 18 15 12 9 6 3 2 1 0 10 −1 deci d 0,1 10 centi c 0,01 10 mili m 0,001 10 micro μ 0,000 001 10 nano n 0,000 000 001 10 pico p 0,000 000 000 001 10 femto f 0,000 000 000 000 001 10 atto a 0,000 000 000 000 000 001 10 zepto z 0,000 000 000 000 000 000 001 10 yocto y −2 −3 −6 −9 −12 −15 −18 −21 −24 0,000 000 000 000 000 000 000 001 10 Tomado de: http://www.vaxasoftware.com/doc_edu/gen/simulsub.pdf ¿Sabías que…? La Oficina Internacional de Pesos y medidas (BIPM por sus siglas en francés: Bureau international des poids et mesures)es el coordinador mundial de la metrología. Está ubicada en el suburbio de Sérves, en París, es exclusiva depositaria del kilogramo patrón internacional, única unidad metalizada del Sistema Internacional de unidades (SI) que persiste. 19 TEMA CUATRO MEDICIÓN DE LONGITUD, MASA, VOLUMEN, TEMPERATURA Y DENSIDAD MEDICIÓN DE LA LONGITUD (I) El metro patrón Internacional está en el museo de Sérves (Francia) y es una aleación de platino e iridio para que no se deteriore por oxidación, humedad, y mantenga su longitud. La unidad básica de la longitud en el S.I. es el metro (m), que se define -según la Oficina Internacional de Pesos y Medidas- como la distancia que recorre la luz en el vacío durante una fracción de 1/299 792 458 de segundo. Conversiones comunes: 1m = 100cm = 1 000mm = 106 um = 109nm 1cm = 10mm =0,01m 1pulgada = 2,54cm 1 pie = 12 pulgadas 1milla = 1,61km Veamos los siguientes ejercicios sobre conversiones: a. ¿Cuántos centímetros hay en 4,00 pies? Estrategia: El proceso se resume así: pie pulgada cm Los factores de conversión necesarios son: 20 Por lo tanto, para cumplir nuestra primera parte, ir de pie a pulgada hacemos: NOTA.- Como 1 pie y 12 pulg son exactos, el número de cifras significativas que se permite en la respuesta es tres, basándose en el número 4,00. Y para obtener nuestra respuesta final, vamos de pulgadas a centímetros, así: Curiosidades.- Conversa con tus abuelos y ellos te contarán que hace años, existían unidades muy raras para medir longitudes. Guárdalas en tu mente y comparte la información con tu grupo. MEDICIÓN DE LA LONGITUD (II) Analicemos otro ejercicio, algo más interesante: b. ¿Cuántos metros hay en una pista de 80 yardas? Estrategia: La sucesión de pasos sería yd pie pulgada cm m Entonces, aplicando los factores de conversión: - Vamos de yd a pie. - Vamos ahora de pie a pulgada. - Ahora, de pulgadas a centímetros. - Finalmente, de centímetros a metros. NOTA.- Como buen estudiante de Matemática que eres, bien podrías hacer todo este proceso simultáneamente. 21 Trabajo para la casa.En tu cuaderno realiza las siguientes transformaciones: a. 25 pulgadas a centímetros b. 200 millas a kilómetros c. 25 metros a micrómetros. d. 237 metros a kilómetros e. 2546 milímetros a decámetros MEDICIÓN DE LA MASA Para medir la masa se utiliza la unidad llamada gramo (g), sin embargo por tratarse de una unidad muy pequeña de masa se ha hecho necesario buscar otra más significativa, y se ha establecido al kilogramo (kg) como la unidad fundamental de masa en el SI. De acuerdo con la Oficina Internacional de Pesos y Medidas, un kilogramo se define como la masa de un cilindro patrón de platino-iridio (kilogramo prototipo internacional), el cual se conserva en el museo de Sévres, Francia. Para medir la masa se utiliza la balanza, las hay de diversos tipos como vemos en las ilustraciones. 22 Fotografía de una balanza de plato Balanza analítica Algunas conversiones importantes: 1kg = 1 000 g 1g = 1 000 mg 1kg = 2, 2 lb 1lb = 454 g Veamos el siguiente ejercicio sobre conversiones: Una pelota de golf tiene una masa de 78g. Determine su equivalente en libras. Estrategia: El paso que se debe seguir sería: g lb Entonces, utilizando el factor de conversión adecuado tenemos: Analicemos otro problema algo más vivencial: Un paquete contiene 2,5lb de cloruro de sodio. ¿Cuántos kilogramos de sustancia contiene? Estrategia: Los pasos a seguir podrían ser: lb → g → Kg Con la ayuda de los factores de conversión adecuados, procedemos a la resolución: Paso uno: de libras a gramos: Paso dos: De gramos a kilogramos: Ciencia y realidad nacional.- En una hoja de tu cuaderno desarrolla un ensayo de doscientas palabras sobre la estructura y funcionamiento de “la romana” una balanza que se usaba hace mucho tiempo atrás (y que, en algunos casos, aún se utiliza en la actualidad). 23 Trabajo en equipo.- Transformar en sus cuadernos: a. 25,6 Kilogramos a miligramos b. 125,3 Kilogramos a libras c. 345 gramos a libras d. 254 300 miligramos a decigramos e. 0,025 kilogramos a miligramos MEDICIÓN DEL VOLUMEN (I) Definimos volumen como el espacio ocupado por la materia. En el SI, la unidad utilizada para medir el volumen es el metro cúbico (m3), pese a ello, en los trabajos e instrumental de laboratorio se utiliza el litro (L) y el mililitro (mL). Los materiales volumétricos de uso más habitual en los laboratorios son la probeta, el matraz aforado, la bureta, la pipeta, la jeringa. Matraz aforado Probeta Algunas conversiones importantes: 1L = 1 000mL 1L = 1 000cm3 1mL = 1cm3 1L = 1dm3 1L = 1,057qt (cuartos de galón) 946mL = 1qt Pipetas Jeringa Bureta 24 Biografías ejemplares.Hola, soy el Dr. Alejandro Wood. Nací en Edinburgo en 1817 dediqué mucho tiempo a investigar sobre la aplicación de drogas terapéuticas a pacientes por medio de agujas de coser modificadas. Fallé muchas veces, pero al final tuve éxito y publiqué mis trabajos en los que presentaba una aguja hueca con un contenedor superior que permitía suministrar cantidades controladas de droga. Al principio mi invento se usó solamente para inyectar drogas contra el dolor, pero con el paso del tiempo, el uso de mi invento se generalizó. ¨Mi querido estudiante, pon tesón en tu trabajo y llegarás a ser grande”. MEDICIÓN DEL VOLUMEN (II) Veamos un ejercicio sobre conversiones: Una botella de gaseosa contiene 2,5 L. ¿Cuántos mililitros hay en ese volumen? Estrategia: El paso a seguir sería: L mL Ahora procedemos utilizando el factor de conversión más adecuado: Analicemos otro ejemplo interesante: ¿Cuántos centímetros cúbicos hay en un recipiente de 3,2 cm de largo por 2,8 cm de ancho y por 3,5 cm de alto?: Estrategia: Me doy cuenta que es un recipiente tridimensional, por lo tanto, aplicando algo de geometría, su volumen puede ser calculado multiplicando sus tres valores: V = largo x ancho x alto V = 3,2 cm x 2,8 cm x 3,5 cm = 31,36 cm3 Trabajo para la casa.En tu cuaderno realiza las siguientes transformaciones a. 760 mililitros a decalitros b. 2450 centímetros cúbicos a litros c. 25 litros a cuartos de galón d. 756 litros a decilitros 25 e. 275 mililitros a litros MEDICIÒN DE LA TEMPERATURA (I) Aunque en el curso de Física del próximo año tú podrás comprender todos los detalles que hacen que calor y temperatura sean dos conceptos diferentes, es necesario por ahora, que te hagamos una pequeña diferenciación. Calor es una forma de energía que está asociada con el movimiento de las partículas de la materia, mientras que temperatura es la medida de la intensidad de esa energía. La unidad de medida de la temperatura en el SI es el Kelvin (K). Como todos sabemos, el instrumento que se utiliza para medir la temperatura de los cuerpos es el termómetro. Las escalas que más se utilizan para expresar la temperatura son: La escala Celsius.- (Llamada también centígrada). Tiene como puntos de referencia: 0oC como temperatura de congelación del agua, conocido como el punto de equilibrio hielo – agua a una atmósfera de presión, y 100oC como temperatura de ebullición del agua, conocido también como el punto de equilibrio vapor – agua a una atmósfera de presión. La escala Kelvin o absoluta. Tiene establecidos dos puntos de referencia que son: 273K para el punto de congelación del agua a una atmósfera y 373K, y para el punto de ebullición del agua a una atmósfera de presión. 0K que es equivalente a -373 oC, es la menor temperatura teóricamente alcanzable. La escala Fahrenheit.Tiene como puntos de referencia: 32oF como temperatura de congelación del agua y 212 oF como temperatura de ebullición del agua. . Observa y analiza la siguiente ilustración comparativa. C K F Punto de ebullición del agua .....................................373............212......... Punto de congelación del agua.....................0...........273.............32 Mínima temperatura teoricamente posible..-373.............0..............- 460....... 26 Ciertos científicos dedujeron algunas expresiones matemáticas que permiten hacer transformaciones de temperatura de una escala a otra y estas son: K = ºC + 273 ºF = (1,8 x ºC) + 32 NOTA.- Observa que la escala kelvin no se expresa en grados pues es absoluta, es decir, parte de cero y tiene valores únicamente positivos). Investigación individual.- En los cuadernos de trabajo, los estudiantes investigarán: ¿Cuál es el origen del valor 1,8 que aparece en la fórmula utilizada para relacionar las escalas Celsius y Fahrenheit? Baúl de conceptos.Escala.- Graduación que utilizan los diferentes instrumentos de medición. MEDICIÓN DE LA TEMPERATURA (II) Veamos algunos ejemplos de conversiones: 1.- Experimentalmente se ha determinado que la temperatura de fusión del cloruro de sodio es 813 ºC. Expresa esta temperatura en K y ºF. Estrategia: Las etapas POR SEPARADO serían ºC K y ºC ºF Entonces, resolvemos la primera parte apoyándonos en las expresiones matemáticas: K = ºC + 273 K = 813ºC + 273 27 K = 1086 Por lo tanto, la respuesta es 1086K Ahora vamos con la parte dos: ºF = (1,8 x ºC) + 32 Despejando de la expresión = ºF = (1,8 x 813ºC) + 32 ºF = 1463,4 + 32 ºF = 1495,4 Entonces, la respuesta es 1495,4ºF Otro ejemplo: ¿Qué temperatura en la escala Fahrenheit equivale a -15,0 ºC? Estrategia: Debemos utilizar la expresión matemática que relaciona estas dos escalas: ºF = (1,8 x ºC) + 32 ºF = 1,8 x (-15,0ºC) + 32 NOTA.- No pierdas de vista al signo menos. ºF = -27 + 32 ºF = 5 Entonces, la respuesta es 5 ºF Trabajo en equipo.Los estudiantes realizaran en sus cuadernos las siguientes transformaciones: a. 4 kelvins a grados Celsius b. 9, 8 grados Fahrenheit a Kelvin c. 345,0Kelvins a grados Fahrenheit d. -87, 3 grados Fahrenheit a Kelvin e. – 273 grados centígrados a Kelvin MEDICIÒN DE LA DENSIDAD La densidad se define como la relación entre la masa de una sustancia y el volumen que ocupa dicha masa, y se determina con la ecuación: 28 La densidad es una característica propia de cada sustancia, por lo tanto, nos puede servir muy bien cuando se nos presente la necesidad de diferenciar una de otra. La densidad es una magnitud derivada del SI. Cuando queremos expresar la densidad de un sólido o líquido, lo hacemos en g/mL o en g/cm3 y si se trata de un gas, la expresamos en g/L salvo que se especifique otra cosa. INSTRUMENTOS PARA MEDIR DENSIDADES En líquidos y gases, sobre todo, la densidad varía con la temperatura, por eso es necesario indicar el valor de la temperatura junto al valor de la densidad. Las densidades de los gases se expresan a 0ºC y 1atm de presión (condiciones normales) como ya veremos más adelante. Si ponemos en una probeta tres líquidos inmiscibles podremos ver que el más denso va al fondo, el menos denso ocupa el estrato superior, y el de densidad intermedia queda atrapado en el estrato medio. Podrás observar si mezclas mercurio, agua y aceite: el primero irá al fondo por ser el más denso, el agua ocupará el estrato intermedio; el aceite quedará en el estrato superior. SUSTANCIAS INMISCIBLES Baúl de conceptos.Estrato.- Capa de grosor diverso de una sustancia. Inmiscibles.- Sustancias que comparten un mismo envase y no se mezclan. 29 Página 31 DENSIDAD RELATIVA La densidad relativa se obtiene relacionando la densidad de un sólido o líquido con la densidad del agua (que es el referente para estos dos estados). La densidad relativa también se puede obtener al relacionar la densidad de un gas con la densidad del aire (que es referente para esta fase de la materia). Ilustración de varios estudiantes ecuatorianos con mandil midiendo densidades en un laboratorio. A continuación podrás observar y analizar algunos ejercicios sobre densidades: ¿Cuál será la densidad de un mineral si 325g de él ocupan un volumen de 25,0 mL? Estrategia: Aplico la expresión matemática sabiendo que la unidad resultante será g/mL. d = 13,0g/mL (con tres cifras significativas) Resolvamos otro ejercicio: Calcular el volumen (en L) de 250,0g de etanol. Estrategia.- Aplico la expresión matemática sabiendo que la densidad del etanol es (0,789g/mL). V = 316,9mL (con cuatro cifras significativas) Trabajo para la casa.Resuelve los siguientes ejercicios en tu cuaderno: a. La plata pura tiene una densidad de 10,5 g/mL. Un collar que se vendió como si fuera de plata pura, tiene una masa de 25,0 g. Al sumergirlo en una probeta con agua, el nivel del 30 líquido sube 2,0 mL. Realiza el proceso que sea necesario para que nos indique si el collar es efectivamente de plata o no. b. El nivel de agua en un recipiente aforado es de 0,75 L, antes de agregar 300 g de manteca. Después de haberlo hecho, el nivel de agua sube 0,34 L. Calcula la densidad de la grasa. Prueba de bloque consultar si va aquí o al final con todas las demás pruebas. La haremos cuando corresponda en cronograma, se recomienda que todas las pruebas se hagan al final, luego de tener cuadrado el texto.