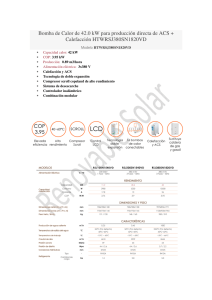
Descargar
Anuncio

Volumen 23 (2); 2011 Nº 80 Sociedad Española de Transfusión Sanguínea y Terapia Celular En Portada ¡Cómo hemos cambiado! L a medicina transfusional no es lo que era. Ha cambiado y ha cambiado a mejor. Hoy es reconocida, respetada y estamos entre los mejores. Este un hecho evidente y constatable. Esos cambios no suceden espontáneamente sino que obedecen al esfuerzo de personas y entidades que se empeñan en que se produzcan. Aunque los profesionales han contribuido a dar pasos importantes en la buena dirección, ha sido la unión de fuerzas y el empuje colectivo de nuestra sociedad científica lo que ha contribuido definitivamente a que se lograran esos cambios. Sin la Sociedad Española de Transfusión Sanguínea, el avance habría sido más lento o no se habría producido. Probablemente nos tendríamos que remontar setenta años para ver el recorrido completo de la transfusión española hasta nuestros días pero indudablemente han sido estos últimos 25 años los que han visto la total transformación del panorama transfusional español. Es un buen momento para la reflexión, para echar la vista atrás y recapitular, para analizar todos los logros conseguidos y también lo que se ha quedado en el tintero. A finales de los ochenta la medicina transfusional española, salvo honrosas excepciones, se encontraba con enormes deficiencias en comparación con la mayoría de los países de Europa Occidental. Los concentrados de hematíes con frecuencia escaseaban en los hospitales, la atomización y la dispersión de los bancos de sangre era la norma; se atendía el día a día del hospital de referencia y poco más. El plasma y sus fracciones se vendían directamente a la industria o se intercambiaban por recursos de toda índole desde equipamiento para el propio banco hasta recursos para el hospital que poco o nada tenía que ver con la medicina transfusional. La donación retribuida de plasma se aceptaba como un mal menor ante la importante escasez que se padecía. En este panorama nuestra sociedad científica recién nacida se empeñó en cambiar esta situación anacrónica y los resultados comenzaron a verse pronto. Disponer de un Plan Nacional de Hemoterapia fue también un factor determinante para que el panorama cambiara radicalmente. Ha tardado en completarse, pero hay que reconocer que no era fácil su implantación porque hacía falta una legislación específica, la decisión firme de las comunidades autónomas y una considerable inversión. En ese Plan se proponía la creación de centros comunitarios y regionales de transfusión que han sido el pilar fundamental para que se produjeran los avances adecuados. Se apostó porque la sangre y sus derivados fueran considerados medicamentos y porque cada depósito de sangre hospitalario, ahora servicio de transfusión, tuviera la responsabilidad de planificar y realizar la hemoterapia de su hospital. Todo un logro en aquellos años. Al mismo tiempo se creo el Comité Técnico de Directores de Centros de Transfusión como foro de debate sobre la gestión de los centros, la aplicación de nuevas tecnologías en el área transfusional y como herramienta para estandarizar guías y procedimientos. En las últimas dos décadas se ha luchado contra injustificadas demandas judiciales, pero siempre la SETS se ha posicionado contra la llamada medicina defensiva y ha apostado decididamente por la medicina basada en la evidencia científica. Se ha estimado el riesgo de transmisión de enfermedades víricas por transfusión en España y se ha apostado por la calidad con el Comité de Acreditación en Transfusión Sanguínea (CAT) y la cooperación internacional. La creación del Comité Científico del Ministerio de Sanidad y la implantación del Sistema Estatal de Hemovigilancia en el año 2000 supuso otro espaldarazo importante. Hay que agradecer también el empuje europeo. En concreto la Directiva Europea y su transposición a la legislación española nos han acercado más aun a los países de nuestro entorno. Nuestra SETS siempre ha luchado por la autosuficiencia como meta sin perder de vista el autoabastecimiento, y la seguridad para donante y receptor. Avanzamos a pasos Continúa en página 2 Sumario agigantados para conseguirlo. Hemos pasado de la hemoterapia lúgubre de los sótanos de los hospitales a disponer de una excelente red de centros comunitarios eficientes y de prestigio, bien dotados y con profesionales muy cualificados. Tenemos centros de excelencia con certificaciones de calidad que avalan nuestra forma de trabajar rigurosa y segura. ¿Qué hemos logrado en estos años? Mucho y bueno. La medicina transfusional es ahora admirada y respetada. La Dirección: José Manuel Cárdenas mayoría de propuestas han avanzado en el camino correcto y se han conseguido. En fin, la hemoterapia ha mejorado con los años, nosotros también. Hemos cambiado y somos mejores. j Dr. Isidro Prat. CRTS de Málaga EN PORTADA ¡Cómo hemos cambiado!. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 Equipo de Redacción: Erkuden Aranburu Miquel Lozano Carmen Martín Vega Eduardo Muñiz-Díaz ARTÍCULOS Significado clínico de los anticuerpos antieritrocitarios. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Julia Rodríguez Villanueva Miguel Angel Vesga Acerca de la Aféresis en los diferentes servicios hospitalarios. Ventajas y desventajas de las técnicas de separación. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 Colaboran en este número: ¿Qué son los proyectos sobre medicina transfusional financiados por la Unión Europea?. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14 Iñigo Romón Erkuden Aranburu (Pamplona) José Manuel Cárdenas (San Sebastián) Mercedes Corral (Salamanca) Carmen Fernández (Gijón) Santiago Jimeno (Madrid) Carmen Martín (Barcelona) Eduardo Muñiz-Díaz (Barcelona) MISCELÁNEA Premios de la SETS y Gotas de plata 2011 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 18 Amigos de la SETS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 Isidro Prat (Málaga) Aurora Viejo (Madrid) HEMEROTECA Edita: SETS Sociedad Española de Transfusión Clínica e inmunohematología. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22 Donación y procesamiento. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 Sanguínea y Terapia Celular C/ Mariano Cubí, 4 08006 – Barcelona [email protected] NORMAS DE PUBLICACIÓN. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 Correspondencia con el Editor: [email protected] Imprime: BOLETÍN DE INSCRIPCIÓN DE LA SETS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 Texto y Color 65, s.l. [email protected] Depósito Legal: B46.283/99 2 AGENDA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30 Artículo Significado clínico de los anticuerpos antieritrocitarios Dr. E Muñiz-Diaz /Jefe de la División de Inmunohematología. Banc de Sang i Teixits. Barcelona Introducción La Sociedad Internacional de Transfusión Sanguínea reconoce la existencia de algo más de 300 antígenos (ags) pertenecientes a alguno de los 30 sistemas de grupos sanguíneos recientemente aceptados. Todos ellos tienen capacidad inmunogénica, pero de los anticuerpos (acs) que resultan sólo algunos tienen importancia clínica en transfusión sanguínea donde pueden producir reacciones transfusionales, y en la enfermedad hemolítica del feto y del recién nacido (EHFRN) donde pueden inducir distintos grados de afectación fetal y neonatal (1). Decimos que un anticuerpo es clínicamente significativo cuando puede destruir los hematíes portadores del correspondiente antígeno, o contribuir a la destrucción de los mismos. En la EHFRN se le exige, además, que el feto y/o el RN hayan requerido transfusión. Atendiendo al grado de gravedad y al mecanismo patogénico, las reacciones transfusionales se clasifican en Intravasculares (RI) y Extravasculares (RE). Las RI están producidas por anticuerpos de clase IgM que activan el complemento y producen las formas clínicas más graves (2). Las RE están mediadas por anticuerpos de clase IgG, fundamentalmente IgG1 e IgG3 y suelen tener un curso clínico moderado-leve. Las llamadas reacciones retardadas (RR) son de carácter extravascular y se diferencian de las RE en que el bajo nivel de anticuerpo impide su detección antes de la transfusión, motivando que no se seleccionen los hematíes adecuados y se produzca una reación anamnéstica que comporta la progresiva destrucción de los hematíes transfundidos. En ausencia de clínica, las RR se clasifican como reacciones retardadas serológicas. Casi sin excepción, los adultos que carecen de los antígenos A o B en sus hematies son portadores de anticuerpos IgM contra estos antígenos. Otros anticuerpos IgM que aparecen de forma “natural” son los de especificidad antiH y anti-PP1Pk, de los raros fenotipos Bombay (Oh) y p, respectivamente. Los restantes anticuerpos son mayoritariamente de clase IgG y aparecen tras el estímulo antigénico que supone la exposición a hematíes que expresen antígenos incompatibles con el receptor. En este texto se revisan los factores que determinan el significado clínico de un anticuerpo, algunos de los aspectos clínicos y serológicos que pueden orientarnos para precisar la especificidad de acs. poco comunes, la estrategia a seguir para la selección de sangre en diferentes circunstancias y, finalmente, la estrategia a seguir para prevenir la aloinmunización en pacientes dependientes de transfusión y, muy especialmente, en los afectos de hemoglobinopatías estructurales. Factores que determinan el significado clínico de un Ac La detección e identificación de acs irregulares constituye un requisito previo fundamental para realizar una transfusión segura basada en la selección de hematíes carentes de los antígenos correspondientes a los acs. detectados en el paciente. El posible significado clínico del anticuerpo es deducible a partir de ciertas características manifestadas en el curso de las pruebas serológicas realizadas: intensidad de la reacción, reactividad en la fase de antiglobulina, rango térmico, especificidad, clase de inmunoglobulina, subclase de IgG, y afinidad y habilidad para fijar el C. Probablemente, el rango térmico es el factor clave, ya que si el anticuerpo no reacciona a 37ºC difícilmente podrá causar destrucción hemolítica in vivo. Otros factores que pueden condicionar la patogenicidad del anticuerpo son la cantidad y distribución del antígeno sobre la membrana de los hematíes, la cantidad de IgG y/o C unidos al hematíe, y la presencia del antígeno en otros tejidos y fluidos del organismo. Aunque, generalmente, todos estos aspectos nos permiten predecir con éxito el significado clínico del anticuerpo, las pruebas serológicas comunes no siempre son capaces de distinguir claramente entre un anticuerpo clínicamente significativo y un anticuerpo clínicamente benigno. Además, mientras que existen diferentes guías para la detección de anticuerpos y el tipaje Rh(D) (3), apenas existen guías de cómo proceder en la identificación de acs. y, menos, en las situaciones de especial complejidad. Es importante que cada laboratorio tenga claramente establecido el procedimiento a seguir ante un escrutinio de acs. positivo, tanto para asignar una determinada especificidad como para excluir en paralelo otras posibles especificidades adicionales. Es fundamental que las técnicas básicas no sean excesivamente sensibles para no magnificar problemas inexistentes. Las situaciones que más habitualmente ocasionan problemas en la identificación de acs. son la presencia de mezclas de acs. comunes (Rh, Kell, Kidd, Duffy, MNS, Le, Lu, P), o bien la de un anticuerpo dirigido contra un antígeno de alta frecuencia acompañado, o no, de otros acs.. En ambos casos la práctica totalidad de células cruzadas van a resultar incompatibles, y la búsqueda de unos hematíes compatibles con el paciente se convierte en una situación muy complicada. 3 Artículo Aspectos clínicos y serológicos de interés para catalogar la especificidad de anticuerpos poco comunes Una de las características clínicas del paciente que puede resultar muy útil conocer es la etnia del paciente: j algunos fenotipos son exclusivos de ciertas poblaciones como In(b-) en asiáticos, y S-s-U-, Js(b-), hrs en negros; j en orientales también son más frecuentes los fenotipos Gy(a-), Jr(a-) y Di(a+b); j en la raza negra son más comunes los fenotipos Fy(a-b-), Le (a-b-), Cr(a-) y Lu(b-); j en latinoamericanos se dan con más frecuencia los fenotipos Di (a+b-), Ge: -2,3 y Ge: -2,-3; j en un paciente de raza blanca es más frecuente que un anticuerpo de alta frecuencia vaya dirigido contra los antígenos k, Kpb, Yta, Vel, Coa y Lub; y en el este de Europa también es más común el fenotipo Gy(a-); j en la península ibérica es frecuente el fenotipo Jr(a-) entre los miembros de la comunidad gitana que residen en España y Portugal. La historia clínica del paciente y los hallazgos serológicos previos también pueden resultar de ayuda. El conocimiento de las fases en que los diferentes acs. acostumbran a reaccionar, exclusiva o preferentemente, supone otra pista adicional: j a menudo, los acs. que reaccionan muy intensamente son clínicamente significativos; j cuando la reactividad es débil, las células negativas pueden no carecer del antígeno sino expresarlo de forma más débil, como sucede con las especificidades Ch, Rg, Csa, Kna/McCa; j algunos acs. reaccionan débilmente con las células que expresan el antígeno en una sola dosis, como es el caso de los acs. contra M, N, S, s, Jka y Jkb; j los acs. que producen hemólisis, total o parcial, pueden ser los de especificidad anti- Le, -Jk, PP1Pk, Vel, H. Una observación muy atenta de todas estas características puede resultar muy útil para una correcta identificación. Actualmente disponemos de una gran cantidad de información en torno al significado clínico de los diferentes 4 acs. antieritrocitarios en los diversos contextos clínicos, sin embargo esta información es menor, a menudo controvertida y, en ocasiones, inexistente, en el caso de especificidades poco comunes. El conjunto de información acumulada hasta el momento nos permite establecer la siguiente clasificación de acuerdo con la importancia clínica manifestada por los diferentes acs. antieritrocitarios: 1. Anticuerpos que suelen producir una reacción transfusional grave Los acs. del sistema ABO suelen producir una reacción transfusional hemolítica (RTH) intravascular de gravedad variable, pero que puede conllevar la muerte de hasta un 10% de pacientes. Los acs. antiA1 generalmente carecen de significado clínico; por el contrario los de especificidad anti-H pueden producir reacciones muy graves, sin embargo la búsqueda de un donante compatible, obviamente, puede representar un serio problema. Los acs. Rh, especialmente anti-D, pueden ocasionar RTH inmediatas de carácter grave, y tanto éste como el resto de especificidades también pueden producir RTH retardadas. Son predominantemente de clase IgG, la mayoría IgG1, pero también se han descrito de clase IgG2, IgG3 e IgG4. La incidencia de aloinmunización en los individuos Rh(D)-negativo que reciben sangre Rh(D)-positivo es muy variable oscilando entre el 30% y el 85% (2,4). En el sistema Kell, anti-K, anti-k y anti-Ku (el anticuerpo desarrollado por los individuos de fenotipo Ko) han producido RTH graves. Las restantes especificidades se decantan por las RTH retardadas. Anti-Fya, anti-Fyb y anti-Fy3 (el anticuerpo desarrollado por los individuos Fy(a-b-) de origen no africano) han sido incriminados en RTH inmediatas graves y en reacciones de tipo retardado. Los acs. del sistema Kidd (anti-Jka, antiJkb y anti-Jk3) han producido RTH graves e, incluso, fatales, y también reacciones retardadas. Estos acs. tienen tendencia a decaer rápidamente en el plasma del paciente hasta niveles indetectables, por lo que a menudo causan RTH retardadas. Hasta una tercera parte de las RTH retardadas son debidas a acs. anti-Jka (5). De los acs. del sistema MNS, anti-S, anti-s y anti-U pueden producir RTH inmediatas y retardadas, y anti-U (el anticuerpo desarrollado por los individuos que carecen de glicoforina B) resulta especialmente peligroso. Por el contrario, anti-M y anti-N raramente producen una RTH. Los acs. contra los hematíes de fenotipo GP.Mur (antiMur, anti-Mia) han sido relacionados con RTH inmediatas y tardías. Aunque raros en nuestro medio, ambos acs. son relativamente comunes en el sudeste asiático, hasta el punto que los correspondientes antígenos deben estar presentes en las células empleadas para el escrutinio de acs. irregulares. Los acs. frente a los antígenos de baja frecuencia Vw (MNS9) y Far (MNS22) también producen RTH graves e, igualmente, anti-Ena, un anticuerpo dirigido contra un antígeno de alta frecuencia de la glicoforina A, se asoció a un caso de RTH fatal. Los acs. anti-Dombrock (anti-Doa y antiDob) han sido responsables de RTH inmediatas y retardadas y, a menudo, resulta compleja la identificación de los mismos. Anti-P y anti-PP1Pk, como acs. “naturales” siempre presentes en los individuos de fenotipo Pk y p, pueden ocasionar RTH graves. Los acs. de alta frecuencia de especificidad anti-Vel suelen ser de clase IgM y fijadores de C, por lo que pueden causar RTH inmediatas muy graves. Anti-AnWj, un anticuerpo dirigido contra un antígeno de muy alta frecuencia de la glicoproteina CD44 ha sido relacionado con RTH graves. Anti-Wra (sistema Diego), un anticuerpo relativamente común dirigido contra un antígeno de baja frecuencia, también ha ocasionado RTH graves. Anti-Coa ha producido RTH retardadas, y anti-Cob y anti-Co3 sólo se han asociado a reacciones leves. Anti-Kx (el anticuerpo detectado en los individuos afectos de un síndrome de McLeod), a menudo asociado con anti-Km, también pueden producir RTH graves. Artículo 2. Anticuerpos que raramente producirán una reacción transfusional grave Anti-A1, anti-Lewis, anti-P1, anti-LKE y anti-I son anticuerpos habitualmente de clase IgM y raramente reactivos por encima de los 25ºC, por lo que raramente pueden ocasionar una RTH. No obstante, de forma excepcional, anti-P1 ha sido relacionado con RTH inmediatas y retardadas, y en un reducido número de casos se han descrito RTH producidas por antiA1, anti-Lea y, posiblemente, por anti-Leb. Los acs. anti-Lutheran (Lu) no suelen ser clínicamente significativos, sin embargo existen algunos ejemplos publicados de RTH moderadas de carácter retardado producidos por anti-Lua y anti-Lub. Con la excepción de los acs. anti-Wra, el resto de especificidades pertenecientes al sistema Diego no parecen producir RTH y, sin embargo, poseen potencial hemolítico como demuestra su capacidad de causar EHFRN. Otras especificidades que raramente producirán RTH son las dirigidas contra los antígenos Yta, Scianna, LW, Chido/ Rodgers, Gerbich, Cromer, Knops e Indian, los acs. anti-Er, -COST, -Xga, -MER2, -JMH, -GIL, -LKE, -Sda, -Lan, -Ata, -Jra, y -Emm. No obstante, se han descrito algunos ejemplos de RTH grave inducida por anti-Yta, -Tca (CROM2), -Inb, -Lan, -Ata y -Jra. Aunque con escasa evidencia de su responsabilidad, también se ha descrito un caso de RTH aguda intravascular inducida por anti-JMH (6). Los acs. anti-Oka, -GIL, -PEL, -MAM son extraordinariamente infrecuentes y aunque no hay evidencia de RTH producidas por ellas, sí que tienen el potencial hemolítico para producirlas. Los acs. anti-HLA también han sido relacionados con RTH, aunque el grado de evidencia es incierto (7,8). 3. Anticuerpos que más habitualmente producen una EHFRN grave A pesar del programa profiláctico con gammaglobulina anti-D, los acs. antiRh(D) continúan siendo los que más habitualmente pueden ocasionar una EHFRN grave, seguido de anti-Rh(c). Aunque poco frecuente, el resto de acs. (anti-C, -E, -e y -G) también pueden dar lugar a formas clínicas graves. Otras especificidades poco comunes que también han sido relacionadas son anti-ce (-f), -Ce, -Cw, -Ew, -Hro, -Hr, -Rh29, -Goa, -Rh32, -Bea, -Evans, -Tar, -Sec, -JAL y -MAR-like. Los acs. anti-K pueden resultar especialmente peligrosos por su capacidad de suprimir la eritropoyesis fetal. La glicoproteína Kell es uno de los primeros antígenos específicos que aparecen en los progenitores eritroides durante la eritropoyesis permitiendo que los acs. anti-K los destruyan precozmente en el hígado fetal antes de que se hemoglobinicen. El título de anticuerpo no resulta de ninguna utilidad y es poco menos que imposible predecir el riesgo pues la anemia hemolítica se ve superada por la anemia aplásica. En muchos casos el anticuerpo materno es adquirido por transfusión, lo que ha llevado a implantar programas de selección de hematíes K-negativo para las mujeres en edad fértil que inevitablemente han de ser transfundidas. 4. Anticuerpos que ocasionalmente producen EHFRN grave La EHFRN por acs. del sistema ABO es muy poco frecuente y habitualmente queda restringida a los casos de madre de grupo O y feto de grupo A o B, un escenario que en Europa acontece en un 15% de las gestaciones. Las razones de la baja prevalencia de formas graves son varias: 1) los acs. ABO suelen ser de clase IgM, 2) están presentes en numerosos tejidos, como el tejido placentario que acaba por adsorber cualquier anticuerpo de clase IgG que atraviese la barrera placentaria, 3) los acs. ABO de clase IgG suelen ser IgG2 que carece de capacidad hemolítica, y 4) los antígenos ABO no están totalmente desarrollados en el RN. Por esta misma razón los acs. anti-H de las gestantes Oh no suelen producir EHFRN grave. Las restantes especificidades del sistema Kell suelen dar lugar a formas clínicas leves, no obstante los acs. de especificidad anti-k, -Kpa, -Jsa, -Jsb, -Ula, -Ku y -K22 han estado asociados a casos en los que como mínimo fue necesaria la transfusión del RN. En el sistema MNS, los casos graves de EHFRN han sido producidos por anti-S, -s y -U. Aunque habitualmente benigno, también han sido comunicados algunos casos de EHFRN grave inducida por anti-M. Otros acs. asociados con EHFRN son los dirigidos contra el antígeno de alta frecuencia Ena y contra los de baja frecuencia Mia, Vw, Mur, Hut, Hil, Mta, Mv, Far, sD, Or y MUT. El raro fenotipo GP.Mur resulta relativamente común en el sudeste asiático con frecuencias que oscilan entre el 2% y el 10%, y los correspondientes acs. (anti-Mur y anti-Mia) han causado EHFRN grave. En un estudio de 68 gestantes portadoras de anti-Fya, 10 produjeron un cuadro moderado y 3 un cuadro grave, dos de las cuales requirieron exsanguinotransfusión (9). Sólo 1 caso de EHFRN por anti-Fyb ha sido comunicado. A pesar de inducir numerosos casos de RTH retardada, los acs. anti-Jka y anti-Jkb no suelen producir EHFRN, con la excepción de 1 caso publicado que provocó kernicterus. Los acs. anti-Coa y anti-Co3 han sido asociados a formas graves de EHFRN. En el sistema Scianna, los primeros antiRd identificados fueron relacionados con formas leves o moderadas, excepto 1 caso que requirió exsanguinotransfusión. En el sistema Diego, anti-Dia puede ocasionar formas graves de EHFRN. Tres casos inducidos por anti-Dib que precisaron exsanguinotransfusión también han sido publicados. Igualmente, las especificidades anti-Wra, -ELO y -BOW, de este mismo sistema, también han causado EHFRN grave. Los acs. anti-Gerbich generalmente no causan EHFRN, pero 2 RN hijos de una misma madre portadora de anti-Ge3 precisaron transfusión entre 2 y 4 semanas después del parto por una EHFRN que inicialmente pasó desapercibida (10). Este antígeno está presente en la glicoforina C que es una de las primeras proteínas de grupo sanguíneo en aparecer sobre las células eritroides en el curso de la eritropoyesis, por lo que el mecanismo patogénico predominante de EHFRN, basado en la supresión de la eritropoyesis, es homologable al que producen los acs. anti-K. De los acs. dirigidos contra antígenos 5 Artículo que todavía no han sido adscritos a un determinado sistema de grupo sanguíneo, sólo unos pocos han ocasionado una EHFRN grave. Entre los de baja frecuencia se han comunicado casos producidos por anti-HJK, -Kg, -REIT, -JFV y JONES, y entre los de alta frecuencia sólo antiMAM ha sido asociado a un caso grave. 5. Anticuerpos que muy raramente producen EHFRN grave Los acs. anti-PP1Pk de los individuos con fenotipo p no han sido implicados en formas graves de EHFRN. Estos acs. contienen habitualmente una fracción IgG3, pero que no es capaz de inducir complicaciones graves. Por el contrario, anti-PP1Pk y anti-P se asocian a abortos recurrentes, especialmente dentro del primer trimestre, donde se supone que la diana principal es la placenta y no el feto. Los acs. anti-Lutheran (Lu) no causan EHFRN porque los antígenos Lu están poco desarrollados en los hematíes fetales y probablemente porque los acs. son adsorbidos por los antígenos Lu presentes en la placenta. Los acs. anti-Lewis (Le) tampoco inducen EHFRN porque no suelen ser activos a 37ºC y no se expresan en los hematíes del feto. Finalmente, los siguientes sistemas de grupo sanguíneo nunca han sido descritos en relación con EHFRN grave: Yt, Dombrock, LW, Chido/Rodgers, Cromer, Knops, e Indian. Tampoco los siguientes acs.: anti-Cost, -Er, -Sc1, -Sc2, -Sc3, -Xga, -Oka, -MER2, -JMH, -GIL, -Emm, -AnWj, -Sda, -Duclos (sólo 1 caso publicado), -PEL, -ABTI, y -HLA. Los acs. anti-Vel sólo suelen causar formas leves, seguramente porque acostumbra a tratarse de un anticuerpo de clase IgM y el antígeno se expresa débilmente en las células fetales; no obstante, existe una publicación de EHFRN grave inducida por estos acs. (11). Los acs. anti-Lan, -Ata y -Jra sólo han inducido casos leves de EHFRN. Selección adecuada de los hematíes a transfundir en pacientes con anticuerpos antieritrocitarios La selección sistemática de hematíes carentes del antígeno o antígenos incompatibles además de compleja suele resultar cara y, en muchos casos, innecesaria, lo que ha conducido a una selección racional de la sangre adecuada en base a la información disponible en torno al significado clínico de los anticuerpos antieritrocitarios (Tabla I). En la mayoría de ocasiones los hematíes pueden ser obtenidos de fuentes locales, pero existen situaciones en que estas fuentes son insuficientes. Estas situaciones incluyen los casos de mezclas de acs. y/o acs. contra antígenos de alta frecuencia. Los ensayos clínicos in vitro pueden ser útiles para predecir el riesgo hemolítico ante acs. de capacidad hemolítica incierta en las que no se dispone de los hematíes carentes del anticuerpo o se ignora la especificidad exacta presente en el plasma del paciente. Los ensayos in vitro para predecir el significado clínico de los acs. (MMA o técnica de los monocitos en monocapa, ADCC o técnica de citotoxicidad celular dependiente del anticuerpo y CLT o técnica de quimioluminiscencia) han venido empleándose en la EHFRN y en situaciones de acs. no identificados y/o de especificidad conocida pero de capacidad hemolítica incierta, con resultados un tanto heterogéneos en cuanto a su grado de fiabilidad. Recientemente Arndt y Garratty (12) han hecho balance de 20 años de uso de la técnica de MMA para tomar la decisión de transfundir, o no, hematíes incompatibles a pacientes portadores de acs. de alta frecuencia. Concluyen que un resultado negativo (< 5%) suele indicar que los hematíes incompatibles pueden ser empleados sin riesgo de producir una RTHA, aunque la supervivencia normal de los hematíes no pueda ser garantizada. Los autores afirman que la estrategia es segura y preferible a la más conservadora de buscar sistemáticamente para todos los pacientes hematíes carentes del antígeno problema. En un estudio comparativo entre las técnicas de MMA y CLT (13) en el que se emplearon acs. de alta frecuencia de los que en un 50% de casos se conocía su significado clínico, se obtuvo una concordancia total entre ambas técnicas que consiguieron una predicción correcta en más del 80% de los casos. Ambas erraron con un anti-Kna que no produjo ningún efecto indeseable en el paciente. En este caso el anticuerpo, ligado al CR1 se unió a la molécula CR1 de los monocitos induciendo un falso resultado positivo. La repetición con monocitos autólogos resultó negativa. Este es un ejemplo de la precaución a tener en la interpretación de resultados con las técnicas de MMA y CLT ante acs. de especificidad no definida en los que la presencia del correspondiente antígeno sobre los monocitos se desconoce. Si la información disponible y/o el riesgo hemolítico detectado en el ensayo in vitro hacen imprescindible la transfusión de hematíes carentes del antígeno problema, existe la opción de consultar con Centros de Transfusión nacionales e internacionales que disponen de listas de donantes con fenotipos poco comunes y con unidades congeladas de Tabla I - Recomendaciones para la selección de hematíes compatibles para transfusión en función de las especificidades identificadas Hematíes carentes del antígeno (Ag) Acs. anti-ABO, -Rh, -Kell, -Kidd, -Duffy, -Coa, -Vel. Hematíes compatibles en prueba cruzada a 37ºC en ATG indirecta Anti-Le, -A1, -P1, -Lua, -Doa, -Dob, -Cob Hematíes menos incompatibles y hematíes carentes del Ag si el Ac es muy fuerte Anti-Cro, -Yta, -Gya, -Hy, -Joa, -Lan, -Ata, -Jra Hematíes menos incompatibles Anti-Ge, -Kn, -LWa, -LWab, -JMH, -Emm, -PEL, -ABTI Idealmente hematíes carentes del Ag, pero dada su rareza pueden usarse con extrema precaución los menos incompatibles Anti-Sc3, -Co3, -Oka, -MAM 6 Artículo algunos de ellos. La OMS dispone de un Panel de donantes con fenotipos poco comunes que se gestiona y mantiene en el IBGRL de Bristol (Reino Unido) que actualmente incluye la información procedente de 60 Centros repartidos en 26 países. Si hay tiempo, la donación autóloga también debe ser contemplada. Disponemos de una información muy escasa del soporte transfusional y de la evolución en los pacientes portadores de acs. de alta frecuencia. Un estudio reciente realizado por laboratorios de referencia de Suiza, Alemania y Austria ha arrojado cierta luz en torno a este problema (14). Un total de 52 pacientes con acs. de alta frecuencia fueron estudiados en un periodo de 20 meses. Cuatro especificidades estaban presentes en dos tercios de los pacientes: anti-Kpb, -Vel, -Lub, y -Yta. Un total de 22 pacientes fueron transfundidos con hematíes carentes del antígeno, y un 20% de los hematíes fueron suministrados internacionalmente. En 8 casos se emplearon hematíes con prueba cruzada negativa y se produjeron 5 RTH retardadas. Si el estado clínico del paciente nos impide posponer la transfusión, y no se dispone de hematíes carentes del antígeno, se aconseja emplear las unidades “menos incompatibles”. En algunos casos pueden emplearse inmunoglobulinas a dosis altas y/o esteroides para modificar o minimizar la respuesta inmune. Se transfundirá la cantidad mínima necesaria para rescatar al paciente de la urgencia, con una velocidad de infusión adecuada a las características clínicas del mismo y con una rigurosa monitorización durante todo el acto transfusional. El problema de las hemoglobinopatías Con el término hemoglobinopatía denominamos al conjunto de trastornos heredados de la estructura y síntesis de las cadenas de globina que forman parte de la molécula de hemoglobina (Hb), los cuales constituyen una de la patologías genéticas más frecuentes en todo el mundo. Se clasifican en: talasemias, en las que existe un defecto de síntesis de al menos una de las cuatro cadenas de globina, y en hemoglobinopatías estructurales, en las que se produce la síntesis de una cadena de globina anormal. En los individuos heterocigotos no suele haber repercusión clínica, pero en el estado homocigoto o doble heterocigoto con variantes estructurales, el cuadro clínico, en el que la hemólisis tiene un papel preponderante, puede ser muy grave. Las talasemias se encuentran ampliamente distribuidas, alcanzando tasas altas de prevalencia en los países mediterráneos (Italia, Grecia, Chipre), sudoeste asiático, Oceanía y África tropical. Entre las hemoglobinopatías, la HbS es la más frecuente y afecta a millones de individuos en África tropical y subtropical, península arábica, India, América central y Estados Unidos. Le siguen en frecuencia las HbC, D y E, que se presentan en poblaciones del oeste de África, India y sudoeste de Asia. Los pacientes afectos de estas anomalías, especialmente los portadores de hemoglobinopatías en forma homocigota o de combinaciones de HbS con talasemia, sufren manifestaciones clínicas graves en forma de crisis hemolíticas agudas u otras complicaciones (crisis dolorosas, crisis de secuestro, síndrome torácico agudo y accidentes vasculares cerebrales) que exigen la transfusión de hematíes durante las mismas y la entrada de los pacientes en programas de transfusión crónica con el objetivo de mantener un nivel de HbS tolerable. El uso apropiado de las transfusiones de hematíes ha sido uno de los recursos terapéuticos que junto a otras medidas específicas, fundamentalmente de carácter preventivo (cribado neonatal, prevención de la infección, cribado de los problemas clínicos, y tratamiento adecuado y precoz de los mismos), ha permitido que la supervivencia media del paciente con drepanocitosis haya pasado de los 14 años en la década de los años setenta, a los 50 años en la década de los noventa, e incluso más en la actualidad. En los pacientes que van a ser transfundidos está asumido que debe realizarse una tipificación completa de los hematíes que incluya, como mínimo, los principales antígenos eritrocitarios con significado clínico. Sin embargo, es menos claro el grado de compatibilidad que le vamos a exigir a los hematíes seleccio- nados para transfundir y, menos aún, cuál será el protocolo de selección de hematíes a aplicar en el caso de tratarse de un paciente que inicia un programa de transfusión crónica. En los pacientes que ya han sido transfundidos sin tipificar sus hematíes cabe la posibilidad de estudiar su configuración antigénica mediante el análisis del genotipo. Un estudio comparativo de la incidencia de aloinmunización en pacientes afectos de drepanocitosis residentes en el Reino Unido respecto a los residentes en Jamaica (15) demostró una incidencia muy superior en el primer grupo (76%) con respecto al segundo (2.6%). La aparición de múltiples anticuerpos sólo se dio en los pacientes residentes en el Reino Unido (63%) y, sin embargo, el promedio de pacientes transfundidos no difería entre ambos grupos. La causa de esta alta incidencia en los pacientes del Reino Unido se atribuyó al mayor número de transfusiones recibidas por cada paciente y a la disparidad antigénica entre los donantes, mayoritariamente de raza blanca, y los pacientes, predominantemente de raza negra. El fenotipo Dce, S-, K-, Fy(a-b-), Jk(b) es muy común en la raza negra y excepcional en la raza blanca, y los anticuerpos anti-C, E, S, K, Fya y Jkb son muy frecuentes en estos pacientes, especialmente los de especificidad anti-C, E y K. Los protocolos de selección de hematíes compatibles para los pacientes afectos de drepanocitosis oscilan entre los que optan por respetar exclusivamente la compatibilidad ABO y Rh(D) a los que abogan por conseguir la máxima compatibilidad posible incluyendo a los antígenos C, c, E, e, K, Fya, Fyb, Jka, Jkb y S. Quienes abogan por la compatibilidad total, sin duda la opción óptima desde la perspectiva del paciente, a menudo no tienen en cuenta las dificultades que va a entrañar mantener un protocolo de estas características, derivadas de la baja prevalencia de determinados fenotipos entre los donantes de raza blanca. Un problema inicial lo plantea el fenotipo Ro, presente hasta en un 53% de los pacientes de raza negra, mientras que entre los donantes de raza blanca sólo va a estarlo en un 3,2% de los mismos. Esta situación obliga a escoger 7 Artículo fenotipos Rh(D)- negativo (rr) que de por sí ya son escasos en nuestro medio, aproximadamente un 15% de nuestros donantes. Sólo una política de captación de donantes de raza negra podría paliar en parte la complejidad del problema. En un trabajo publicado por Castro et al (16) sobre una serie de 351 pacientes afectos de drepanocitosis que fueron transfundidos con hematíes ABO- y Rh(D)-compatibles, se analizan hasta 5 posibles protocolos de selección de hematíes con un grado de compatibilidad creciente entre receptor y donante para valorar el número de anticuerpos que se habrían evitado empleando las distintas opciones y las dificultades que, en cada caso, conllevaría encontrar los fenotipos escogidos entre la población de donantes según estos fueran de raza blanca o de raza negra. La primera observación de interés es que la transfusión de hematíes exclusivamente ABO/ Rh(D) compatible sólo supuso la aparición de anticuerpos en el 29% de pacientes de la serie. Posteriormente calculan que un protocolo que respetara la compatibilidad de los antígenos Rh mayores (C, c, E, e) y Kell hubiera evitado la sensibilización del 53,3% de estos pacientes, y un protocolo más amplio que incluyera la compatibilidad de los antígenos Fya, Jkb y S hubiera beneficiado hasta un 70,8% de los pacientes aloinmunizados. En contrapartida, la prevalencia de un fenotipo Ro- (o, rr-), K-negativo sería del 13,6% y del 41,2% entre los donantes de raza blanca y negra, respectivamente; y la prevalencia de un fenotipo Ro- (o, rr-), K-, S-, Fya- y Jkb-negativo sería del 0,6% y del 14,6%, respectivamente. Considerando el beneficio obtenido por el paciente, pero también las dificultades de poder aplicar sistemáticamente uno u otro protocolo, los autores abogan por el de compatibilidad limitada a los antígenos Rh mayores y K e, incluso, se abren a la posibilidad de comenzarlo a aplicar después de la aparición de un primer anticuerpo en el paciente. Las especificidades identificadas deben respetarse siempre, aunque algunas de ellas lleguen a desaparecer en el curso del proceso: las reacciones hemolíticas retardadas son muy frecuentes en estos pacientes y, a veces, vienen agravadas por la aparición de un síndrome hiperhemolítico agudo. En este síndrome, la destrucción de las células alogénicas se combina con la destrucción autóloga de los hematíes del paciente, y cada nueva transfusión puede exacerbar la hemólisis, aunque se trate de hematíes de fenotipo idéntico y con prueba cruzada negativa (17). Conclusiones Disponemos en la actualidad de una serie de recursos que nos pueden ayudar a simplificar la compleja situación que se genera en pacientes con mezclas de acs. y/o acs. no comunes en nuestro medio que necesitan ser transfundidos: el conocimiento actual en torno al significado clínico de la gran mayoría de acs. antieritrocitarios, ensayos in vitro que predicen con ciertas limitaciones la capacidad hemolítica de los acs., y bases internacionales de donantes con fenotipos poco comunes, sin olvidar las experiencias clínicas con ciertos acs. de capacidad hemolítica incierta que han sido descritas. En el caso de los pacientes afectos de hemoglobinopatías existen pautas claras de actuación para la selección de hematíes a transfundir en previsión de los posibles acs. a desarrollar por el paciente. Sería deseable que nuestras bases de donantes fueran incorporando de forma progresiva y segura a donantes de otras razas y etnias, porque los hematíes más adecuados siempre serán los de donantes pertenecientes a la misma etnia que el paciente. Paradójicamente, los avances tecnológicos y de conocimiento siguen sin traernos una técnica que nos permita predecir de manera inequívoca la importancia clínica de un anticuerpo. Seguimos sin saber porqué algunos acs. son hemolíticos y clínicamente significativos, y otros no, y mientras se mantenga esta situación, la predicción del riesgo continuará sujeta, hasta cierto punto, al frágil azar. j Referencias 1. Poole J., Daniels G.: Blood group antibodies and their significance in Transfusion Medicine. Transfus. Med. Rev., 21, 58-71, 2007. 2. Klein H.G., Anstee D.J.: Blood transfusion in clinical medicine (11 edición). Blackwell, Oxford, 2005. 3. Chapman J.F., Elliott C., Knwoles S.M. et al.: Guidelines for compatibility procedures in blood transfusion laboratories. Working Party of the Bristish Committee for Standards in Haematology Blood Transfusion Task Force. Transfus. Med.,14, 59-73, 2004. 4. Frohn C., Dümbgen L., Brand J.M. et al.: Probability of anti-D development in D- patients receiving D+ RBCs. Transfusion, 43, 893-898, 2003. 5. Pineda A.A., Vamvakas E.C., Gorden L.D. et al.: Trends in the incidence of delayed hemolytic and delayed serologic transfusion reactions. Transfusion, 39, 1097-1103, 1999. 6. Hoppe B., Pastucha L., Seltsam A. et al.: Acute hemolytic transfusion reactions due to weak antibodies that in vitro did not seem to be clinically significant. Vox Sang., 82, 207-210, 2002. 7. Nance S.T.: Do HLA antibodies cause hemolytic 8 transfusion reactions or decreased RBC survival? Transfusion, 43, 687-690, 2004. 8. Takeuchi C., Ortho H., Miura S. et al.: Delayed and acute hemolytic transfusion reactions resulting from red cell antibodies and red cell reactive HLA antibodies. Transfusion, 45, 1925-1929, 2005. 9. Goodrick M.J., Hadley A.G., Poole J.: Hemolytic disease of the fetus and newborn due to anti-Fya and the potential clinical value of Duffy genotyping in pregnancies at risk. Transfus. Med., 7, 301-304, 1997. 10.Arndt P.A., Garratty G., Daniels G. et al.: Late onset neonatal anemia due to anti-Ge: possible association with destruction of erythroid progenitors. Transfus. Med., 15, 125-132, 2005. 11.Le Masne A., Vachée A., Horbey C. et al.: Forme sévère de malaladie hémolytique néonatale par alloimmunisation anti-Vel. Arch. Fr. Pediatr., 49, 889-901, 1992. 12.Arndt P.A., Garratty G.: A retrospective analysis of the value of monocyte monolayer assay results for predicting the clinical significance of blood transfusions antibodies. Transfusion, 44, 1273-1281, 2004. 13.Hadley A., Wilkes A., Poole J. et al.: A chemiluminiscence test for predicting the outcome of transfusing incompatible blood. Transfus. Med., 9, 337-342, 1999. 14.Seltsam A., Wagner F.F., Salama A. et al.: Antibodies to high frequency antigens may decrease the quality of transfusion support: an observational study. Transfusion, 43, 1563-1566, 2003. 15.Olujohungbe A., Hambleton I., Stephens L. et al.: Red cell antibodies in patients with homozygous sickle cell disease: A comparison of patients in Jamaica and the United Kingdom. Br. J. Haematol., 113, 216-220, 2001. 16.Castro O., Sandler S.G., Houston-Yu P., Rana S.: Predicting the effect of transfusion only phenotypematched RBDs to patients with sickle cell disease: theoretical and practical implications. Transfusion, 42, 684-690, 2002. 17.Petz L.D., Calhoun L., Shulman I.A. et al.: The sickle cell hemolytic transfusion reaction syndrome. Transfusion, 37, 382-392, 1997. Artículo Acerca de la Aféresis en los diferentes servicios hospitalarios Ventajas y desventajas de las técnicas de separación Santiago Jimeno Herráiz, Aurora Viejo Llorente / Servicio de Hematología y Hemoterapia. Hospital Universitario La Paz (Madrid). Introducción. Procedimientos de Aféresis La Aféresis es un procedimiento que consiste en la separación extracorpórea de los componentes sanguíneos con fines de recolección o terapéuticos. Los pasos o fases de la Aféresis son: Extracción, Anticoagulación, Separación, Procesamiento de componentes o Sustitución, Reunificación de componentes y Retorno al paciente. Solamente hay diferencias entre los distintos procedimientos en las fases de Separación y Procesamiento de componentes. El procesamiento depende del objetivo a alcanzar: Recolección de componentes, depleción de los mismos o de sustancias consideradas patógenas, reposición de factores deficitarios del plasma, Inmunomodulación, etc. La separación pueden realizarse mediante dos sistemas: Centrifugación y Filtración. El sistema de Centrifugación consiste en la separación en una centrifuga de los distintos componentes sanguíneos que, en base a su diferente densidad, se disponen en sucesivas capas desde la periferia (elementos formes) hasta el centro de la centrífuga (plasma). Además de la separación del plasma permite la separación de cualquiera de las células sanguíneas (citoaféresis). Este sistema puede utilizar a su vez dos técnicas diferentes: j Flujo Intermitente: Consiste en la extracción por ciclos de un 10-15% del Volumen Sanguíneo para realizar la separación de los diversos componentes, el procesamiento correspondiente y el posterior retorno al paciente. Cada una de las fases de 10 cada ciclo se realiza separadamente y una tras otra. j Flujo Continuo: extrae y procesa la sangre de forma continuada, sin ciclos y todas las fases son simultáneas, es decir, se extrae la sangre del paciente a la vez que la centrifuga, la procesa y la retorna. El sistema de Filtración utiliza para la separación membranas microporosas de alta permeabilidad, similares a las utilizadas para diálisis, que permiten el paso del plasma y moléculas de tamaño reducido pero retienen los elementos celulares. Los sistemas de filtración también operan con flujo continuo, pero al contrario que los sistemas de centrifugación no es posible la separación ni la recolección de los componentes celulares (citoaféresis). Servicios que realizan Aféresis La Aféresis se viene realizando en los servicios de Hematología (Centros de Transfusiones, Unidades de Aféresis y Bancos de Sangre), Nefrología y Dermatología. En la mayoría de los servicios de Hematología se realizan todos los tipos de Aféresis, tanto de recolección de elementos sanguíneos para trasfusión, como de recolección de progenitores hematopoyéticos para su posterior trasplante, y Aféresis terapéutica en todo tipo de patologías indicadas. En algunos servicios de Nefrología se realiza solamente Aféresis mediante filtración y los procedimientos terapéuticos asociados (Recambio plasmático, Adsorción), y muchas veces limitados a las patologías relacionadas con la especialidad. En algunos servicios de Dermatología se realiza solamente Fotoaféresis para tratamiento de patologías dermatológicas. Últimamente se está suscitando una polémica basada en ciertos argumentos, falsos a nuestro juicio, con la intención de reivindicar la realización de la Aféresis terapéutica para el servicio de Nefrología y reducir la realización de la misma para los servicios de Hematología. Estos argumentos expuestos en una carta enviada por los nefrólogos al Ministerio de Sanidad y a los gerentes de los Hospitales, alertando del riesgo (?) de la realización de Recambio Plasmático por los servicios de Hematología, parecen basados y tomados del libro de Fernando Anaya (1) (nefrólogo del Hospital Gregorio Marañón de Madrid) y basados a su vez en el artículo de Gurland (ciertamente desfasado). (2) El primer argumento falso es identificar una técnica concreta de separación con un servicio o especialidad determinada. En Hematología se realizan procedimientos de aféresis con ambas técnicas: Centrifugación en un número importante de casos y Filtración en el caso de la Inmunoadsorción. La elección de la técnica de separación está en función de las ventajas o desventajas de cada tipo, la patología a tratar y las decisiones de las gerencias o directores médicos de los Hospitales. Este argumento va más bien en contra de sí mismos, que obstinados en asociar nefrología/filtración solamente realizan Aféresis mediante filtración. Por otro lado, esta técnica tiene una Artículo limitación importante ya que, al contrario que la centrifugación, no permite la realización de citoaféresis y los procedimientos terapéuticos asociados (Leucoaféresis, Recambio de Hematíes, Fotoaféresis y Trasplante de Médula Ósea). Veamos otros argumentos: j “La plasmaseparación por centrifugación está indicada casi exclusivamente para la obtención de plasma por parte de los bancos de sangre” (Cfr. Anaya F. l.c.). En el argumento anterior ya veíamos que las indicaciones de la técnica de centrifugación desmienten esta afirmación tan categórica. Por otro lado según las Guidelines de la American Society For Apheresis ASFA (3) (que no se define por la técnica de separación a utilizar y menos aún por el servicio o especialidad concreta a efectuarla) las indicaciones de las patologías nefrológicas son todas de categoría II y III, excepto el Sind. de Goodpasture. Por el contrario las patologías de tipo hematológico y neurológico, ampliamente tratadas en las Unidades de Aféresis de Hematología, son mayoritariamente de tipo I. j “La plasmaseparación por centrifugación requiere una maquina especial de plasmaféresis, mientras que la plasmaseparación con membranas (sistema Asahi) está diseñado para poder ser utilizado con una máquina de hemodiálisis” (Cfr. l.c.). Esto, dado como un argumento para minimizar el coste, quizás sea solamente aplicable a países económicamente deprimidos. No es así en los países avanzados, donde priman los aspectos de seguridad y calidad. Utilizar una máquina genérica de hemodiálisis, con la simple incorporación de un plasmafiltro y sin la presencia de los controles apropiados para la Aféresis, difícilmente alcanzaría los estándares de calidad y seguridad. En ambas técnicas, por tanto, son necesarias máquinas específicas con monitores adecuados. j También se afirma que el sistema de filtración “puede adaptarse a cual- quier técnica de Aféresis” (Cfr. l.c.). Teniendo en cuenta que no se puede realizar citoaféresis, no es necesario hacer un esfuerzo especial para demostrar que esto tampoco es cierto. Con algunos sistemas de filtración (AdaColumn) se puede obtener la eliminación de leucocitos, pero no se puede separarlos ni tratarlos. j Acerca de otros argumentos como: “diferencias de costo”, “pérdida de elementos celulares”, “anticoagulación”, etc. trataremos en los siguientes apartados. Eficacia No existen diferencias importantes entre los diversos tipos y técnicas de Aféresis desde el punto de vista del aclaramiento de sustancias y de la eficacia del tratamiento. En los sistemas de filtración, el aclaramiento de las moléculas más grandes del factor von Willebrand en la PTT es nulo con un coeficiente de cribado de 0, lo cual podría incidir negativamente en el tratamiento, aunque los controles pre y postaféresis de los niveles de LDH son semejantes en ambos sistemas. Coste/beneficio Tampoco se puede argumentar la ventaja de un sistema sobre otro en lo relativo al costo del procedimiento. Actualmente, la mayoría de los Hospitales no soportan el gasto de los aparatos de Aféresis que son cedidos en préstamo por las casas comerciales. El gasto se reduce entonces al costo de los equipos de líneas y los materiales utilizados en cada sesión. Aunque pueda haber diferencias de precio de los materiales empleados o de aquellos específicos de procedimientos muy especializados (Adsorción, Fotoaféresis), no conocemos estudios serios en este aspecto. Como aproximación a este estudio podemos citar que comparando los sistemas más utilizados, el plasmafiltro Plasmaflo de Asahi tiene un precio ligeramente superior a todo el conjunto de líneas y canal separador de Cobe-Spectra (en torno a los 200 €), y a esto hay que añadir el precio del conjunto de líneas para conectar el plasmafiltro. Se asegura que, debido a la crisis económica, las compañías van a abandonar el sistema de préstamo para las nuevas máquinas. Lo cual posiblemente nos obligará a elegir para su compra las máquinas más versátiles. Y las máquinas más versátiles son las de centrifugación, que además de Recambio Plasmático pueden realizar Citoaféresis y Recolección de Progenitores y con la incorporación de los kits adecuados posiblemente también Inmunoadsorción y Fototerapia Extracorpórea. Duración de los procedimientos El sistema de centrifugación intermitente al realizar separadamente las fases de extracción, procesamiento y retorno es más largo que los otros dos (centrifugación continua y filtración) en los que esas fases son simultáneas, necesitando 2-3 veces más tiempo y con una duración por sesión superior a las 3-4 horas. Los otros dos sistemas tienen una duración menor, entre 1,5 y 2,5 horas dependiendo de volumen de plasma a extraer y el flujo de entrada de sangre, pero con ventaja para la centrifugación continua. En el sistema de centrifugación la bomba de extracción de plasma trabaja a un ritmo de aprox. 50% del flujo de entrada. La extracción de plasma en la filtración, que depende del flujo de entrada y de la presión transmembrana (PTM), tiene un valor máximo de un 1/3 del flujo de entrada para evitar la hemólisis, hemoconcentración o rotura de membrana, siendo lo óptimo y recomendable trabajar con un ritmo de extracción de 1/4 e incluso menos en los primeros 15 minutos de la sesión. Es decir, para un mismo flujo de entrada de 80 ml/min, la extracción de 3000 ml con la centrifugación se realizaría en 75 minutos y con la filtración en 150 minutos (el doble de tiempo). En la práctica la duración de los procedimientos no difiere tanto ya que, mientras el sistema de centrifugación trabaja con flujos de entrada entre 40-90 ml/ 11 Artículo min, el sistema de filtración trabaja con flujos de entrada bastante más elevados (100-150 ml/min.) para poder mantener la PTM en los rangos necesarios e impedir la coagulación del sistema, pero a costa de aumentar el riesgo de alteraciones hemodinámicas. Incluso así, la duración del procedimiento por filtración es mayor. Acceso vascular Los sistemas de centrifugación pueden adaptarse tanto a un único acceso vascular como a un doble acceso. Los sistemas de filtración únicamente pueden utilizarse con accesos de doble punción. Efectos adversos Al hablar de las ventajas o desventajas, las diferencias más importantes están relacionadas con las complicaciones o efectos secundarios atribuibles a cada sistema (4). Pero en cualquier caso esto solo afecta a la elección de la máquina adecuada para cada tratamiento, y no constituye un argumento para exigir la exclusividad de la Aféresis Terapéutica (en este caso del Recambio Plasmático o Plasmaféresis) a un servicio determinado. j El sistema de centrifugación intermitente es el que trabaja con más alto volumen extracorpóreo (campanas de 125 y 225 ml. más aprox. 100 ml de volumen de líneas, es decir entre 225 y 325 ml.), por lo que la incidencia de hipovolemia es mayor que en los otros dos. Su utilización en Aféresis pediátricas es, por el mismo motivo, muy comprometida incluso utilizando la campana de 125 ml. Igualmente, al mantener la sangre fuera del cuerpo más tiempo que los otros, se reduce su temperatura y son frecuentes las manifestaciones de hipotermia. El volumen extracorpóreo de los otros dos sistemas oscila entre 150-250 ml. j El sistema de filtración trabaja con unos flujos de entrada de sangre muy altos (entre 80-150 ml/min), debido a que necesita obligatoriamente ese flujo para mantener la PTM entre 25-40 mmHg, evitar la coagulación del 12 sistema, la adherencia de los elementos formes a la membrana y el taponamiento de los poros. Al contrario que en hemodiálisis no es posible aumentar la PTM por encima de 50 mmHg. para aumentar la extracción ya que 1º provocaría hemólisis y 2º a partir de una PTM entre 25-40 mmHg no se aumenta la tasa de extracción, que pasaría a depender exclusivamente del flujo de entrada. Estas cifras altas de flujo de entrada, independientemente del volumen corporal del paciente, supone un riesgo mayor de alteraciones hemodinámicas que en el caso de la centrifugación. Además, en caso de producirse esas alteraciones, si no se pudiera mantener el flujo de entrada y fuera necesario reducirlo mucho o parar la máquina se podría provocar la coagulación del sistema, obligando a recambiar y desechar líneas y filtro. Este es un inconveniente importante para el control hemodinámico durante la sesión, además de incrementar el costo. En los sistemas de centrifugación el flujo de entrada puede pararse momentáneamente o adecuarse perfectamente y en cualquier momento al estado paciente, ya que la separación se realiza en la centrifuga en la que velocidad de rotación necesaria para la separación es independiente del flujo de entrada de sangre. Los casos de coagulación del sistema y de hemolisis así como la necesidad de sustituir el equipo utilizando la centrifugación son excepcionales en las series publicadas de efectos adversos. j En el sistema de filtración, debido a las presiones de entrada y extracción del filtro, ocurre con cierta frecuencia la ruptura de la membrana. Generalmente son de pequeño tamaño y se solucionan parando la bomba de extracción de plasma hasta que las proteínas plasmáticas taponan la rotura. Pera a veces pueden ser roturas importantes y obligar a retornar el circuito extracorpóreo y la sustitución de los filtros, con la consiguiente pérdida hemática. Las complicaciones por rotura de los sistemas en la centrifugación (producidas al retorcerse por mala colocación en la centrifuga) son excepcionales y generalmente se producen en las fases de preparación de la máquina, antes de iniciar el proceso de extracción de sangre del paciente. j El plasma separado mediante centrifugación contiene una cierta cantidad de plaquetas, que son eliminadas con él (cuya cifra depende del recuento del paciente, del volumen a tratar y sobre todo del ajuste más o menos fino de la interfase en la centrífuga) y puede aumentar la trombopenia en patologías como la PTT en la que el recuento es ya bajo. La separación del plasma mediante filtración es más completa porque impide el paso de las plaquetas y otras células por los poros y por este motivo es el sistema de elección (en nuestro Hospital) para la Inmunoadsorción o Adsorción Selectiva. Pero la depleción de plaquetas en cada sesión es similar (1520%) porque durante la filtración se produce un efecto de activación de las plaquetas que se adhieren a la membrana del filtro y no retornan al paciente. En el caso de la filtración hay que añadir que en algunos casos puede producirse la peligrosa Trombopenia Inducida por Heparina (HIT) causada por anticuerpos antiplaquetas inducidos por la heparina con trombosis, embolias y sangrado simultáneo. j Al exponerse la sangre a cualquier tipo de superficies extrañas, como es el caso del circuito extracorpóreo, se activa el sistema kinina produciendo bradikininas que causan vasodilatación e hipotensión [5]. Igualmente hay interacción humoral que provoca la activación del complemento [6]. También existen interacciones celulares que provocan cambios en su recuento, función y secreción como neutropenia, trombopenia, adhesión a las líneas y secreción de interleukina 1 (hipotensión, inflamación, fiebre, inmunomodulación). Pero no todos los componentes del sistema extracorpóreo tienen el mismo impacto Artículo para provocar cambios inmunológicos en el paciente. La membrana, dependiendo de su material y la complejidad e irregularidad de su superficie, tiene un mayor impacto que el sistema de líneas (liso y sin poros) en la generación de complicaciones como las citadas anteriormente. (7) El sistema de líneas es idéntico en ambos sistemas, pero mientras que en el sistema de centrifugación el canal de separación esta realizado con el mismo material de las líneas, en el sistema de filtración el material de la membrana tiene características especiales y diferentes. j Utilizando el sistema de filtración tiene lugar una astenia prolongada post-aféresis (24-48 horas) que es atribuida a problemas de biocompatibilidad del material de las membranas que provocan cambios inmunológicos (también con los filtros de hemodiálisis) (8). Con la centrifugación la astenia post-aféresis también existe pero revierte inmediata y rápidamente. j Aquellos sistemas de filtración en los que para la esterilización de la membrana se utiliza vapor de Oxido de Etileno (ETO) se han revelado como fuente de importantes efectos adversos (hipotensión, anafilaxia) (9). Los filtros esterilizados con radiación gamma no presentan dichos inconvenientes. Tampoco existen dichas complicaciones en los sistemas de centrifugación cuyas líneas también se han esterilizado con ETO, con lo que este diferente comportamiento sólo puede atribuirse a la principal diferencia entre ambos sistemas: la existencia de las membranas del filtro. j Los sistemas de filtración usan heparina como anticoagulante (el doble que en hemodiálisis) que produce anticoagulación sistémica, exige rigurosos controles pre, intra y post-aféresis y aumenta el riesgo de alteraciones de la coagulación y de hemorragia. Transformar el modo de anticoagulación sistémica en regional (circuito extracorpóreo), añadiendo protamina en la línea de retorno, se ha abandonado actualmente debido al aumento de las complicaciones y es desaconsejada por las guías europeas de anticoagulación. Esto no sucede con los sistemas de centrifugación que utilizan ACD como anticoagulante y reducen notablemente el riesgo de sangrado. Por un lado la anticoagulación es siempre de tipo regional (con un porcentaje de ACD de aprox. 12% respecto al volumen plasmático extracorpóreo) y una cantidad importante del citrato utilizado es extraído junto al plasma retirado (70-80%). Por otro lado, el citrato que logra pasar al paciente junto al plasma no retirado (dependiendo del hematocrito: 20-30% del utilizado o 2-3% en volumen) es rápidamente metabolizado y raramente causa anticoagulación sistémica, pero en cambio puede tener la hipocalcemia y raramente la alcalosis metabólica como efectos secun- darios. Cuando el fluido de reposición es plasma, que contiene citrato en forma de CPD, la probabilidad de hipocalcemia es similar en ambos sistemas debido a que el contenido de la bolsa en volumen (14%) es 5-7 veces más elevado que el del citrato que contiene el plasma no retirado. Por lo que, en este caso, el sistema de filtración une las complicaciones del citrato a las de la anticoagulación con heparina. Ha habido excesiva y exagerada alarma sobre la utilización de citrato por parte de algunos fabricantes de máquinas con sistema de filtración, algunos de los cuales también incorporan la anticoagulación con citrato. Por ej. en el libro de instrucciones de la máquina MultiFiltrate de Fresenius (10) dice: “Cualquier tratamiento asociado a la anticoagulación con citrato sólo puede ser realizado en unidades de cuidados intensivos o bajo una estrecha monitorización medica similar.” (Cursiva nuestra). En la práctica, con el correcto control del flujo y la tasa de ACD y con la administración preventiva intraaféresis de Gluconato o Cloruro Cálcico la hipocalcemia se evita en la mayoría de los casos y sólo se producen, ocasionalmente, manifestaciones muy leves que el personal de enfermería trata eficazmente reduciendo el flujo de entrada o aumentando ligeramente la administración de gluconato y por supuesto sin necesidad de ningún tipo de intervención por parte de los intensivistas. j 4. Neal A, Gyselen MP. Therapeutic Plasma Exchange A Review of Centrifugation versus Filtration. Gambro BCT. 2004. 5. Cyr M et al. Bradykinin metabolism and hypotensive transfusion reactions. Transfusion. 2001 January; 41: 136-150 6. Stegmayr B, Tarnvik A. Complement Activation in Plasma Exchange by Single Filtration and Centrifugation and in Cascade Filtration. Blood Purif. 1989;7:10-15 7 Henderson LW et al. Hemodialysis hypotension: the interleukin hypothesis. Blood Purif. 1983;1:3. 8. Murabayashi S et al. Biocompatibility in Membrane Plasmapheresis: The Necessity of Global Understanding. Ther Apher (International Society for Apheresis). 2000; 4(2):173-182. 9. Aucella F et al. Effects of Ethylene Oxide and Steam Sterilisation in Dialysis-Induced Cytokine Release by Cuprophane Membrane. Artif Organs. 2002; 26; 6:543 10.MultiFiltrate, Instrucciones de Uso. Versión de software: 1.9. Edición: 4/06.08. Cap. 1.2.3 Referencias 1. Anaya F. Consideraciones Técnicas. En: Anaya F. Aféresis Terapéutica. 1ª ed. Madrid: Norma-Capitel; 2005. p. 15-16 2. Gurland HJ, Lysaght MJ, Samtleben W, Schmidt B. A comparison of centrifugal and membranebased apheresis formats. Int J Artif Organs. 1984 Jan;7(1):35-8 3. Szczepiorkowski ZM et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice - EvidenceBases Approach from the Apheresis Applications Committee of ASFA. J Clin Apher. 2010; 25:83–177 13 Artículo ¿Qué son los proyectos sobre medicina transfusional financiados por la Unión Europea? José Manuel Cárdenas / Centro Vasco de Transfusión y Tejidos Humanos. E n el congreso de la sociedad internacional de transfusión sanguínea, International Society of Blood Transfusion (ISBT), celebrado en Berlín en julio de 2010 se presentaron los resultados de tres “proyectos financiados por la Unión Europea (UE)”, uno sobre donación de sangre, otro sobre uso óptimo de la transfusión y otro sobre inspección sanitaria de los centros de transfusión. En 2011 se están difundiendo los manuales que condensan estos proyectos, cuyas versiones en español están patrocinadas por la SETS o por el Ministerio de Sanidad. ¿Qué valor tienen los proyectos financiados por la UE? ¿Quién los genera? ¿Sus conclusiones son obligatorias? ¿Quién puede participar en su elaboración? ¿Porqué en la lista de países participantes no siempre sale España? Las respuestas a estas preguntas pueden clarificar el sentido y la aplicación de estos estudios, que como veremos no son oficiales pero tampoco meros documentos particulares puesto que se desarrollan al amparo de la Comisión Europea (CE). Habría que empezar por repasar qué competencias tiene la UE en materia de medicina transfusional. Están descritas con brevedad y claridad en la constitución europea. El artículo 152 del Tratado de Ámsterdam establece la necesidad de garantizar la protección de la salud humana, y de acuerdo con este objetivo encomienda al Consejo la adopción de: medidas que establezcan altos niveles de calidad y de seguridad de los órganos y sustancias de origen humano, así como de la sangre y derivados de la sangre; 14 estas medidas no impedirán a ningún Estado miembro mantener o introducir medidas de protección más estrictas (Art. 152, 4.a), y un poco más adelante: podrá también adoptar recomendaciones para los fines establecidos en el presente artículo (Art. 152, 4. párrafo final). Las competencias legales de la UE se completan con el clarificador apartado 5: La acción comunitaria en el ámbito de la salud pública respetará plenamente las responsabilidades de los estados miembros en materia de organización y suministro de servicios sanitarios y asistencia médica. En particular, las medidas contempladas en el apartado 4.a no afectarán a las disposiciones nacionales en materia de donaciones o de uso médico de órganos y sangre (Art. 152, 5). De acuerdo con estas disposiciones constitucionales la UE puede legislar sobre definición y requisitos de calidad de los componentes sanguíneos, sobre sistemas de calidad de los centros de transfusión, sobre los criterios de selección del donante, sobre almacenamiento y transporte, pero no sobre promoción de la donación, sobre el modo de utilizar la sangre, o sobre la inspección, puesto que estas áreas están sujetas a la normativa de cada país según el Art. 152, 5. La UE no tiene competencias normativas sobre esto. Un ejemplo de estas restricciones es la hemovigilancia: como la legislación de la UE afecta a los productos pero no a cómo se usan, la Directiva de hemovigilancia establece la obligatoriedad de comunicar un error si afecta al producto pero no si está mal transfundido. Claro que al hacer la transposición de la legislación europea a la legisla- ción de cada país cada estado sí puede ampliar el ámbito a toda la cadena transfusional. Según la constitución europea la detección de unas plaquetas mal irradiadas o etiquetadas como irradiadas sin estarlo, se tiene que comunicar al sistema de hemovigilancia. Sin embargo no puede obligar a comunicar cuando se indican plaquetas no irradiadas a un enfermo que está recibiendo fludarabina o si se le ponen al enfermo que no es. Al hacer la transposición, con muy buen criterio la legislación española sí incluye el uso de la sangre dentro del ámbito de la hemovigilancia y por lo tanto en el ejemplo citado en España sí es obligatorio comunicar que a un enfermo se le ha administrado un componente sanguíneo equivocado, tanto si es por error en el producto, como si es un error en la indicación o en la administración. El Tratado de Ámsterdam se aprobó en 1997, entró en vigor el 1 de mayo de 1999, y como resultado del mismo se aprobó la Directiva principal de la transfusión en 2002 de la que se derivan la Directiva de 2004 y las dos de 2005. Todo esto está ya transpuesto en la legislación española (con interesantes ampliaciones de los ámbitos) en el RD de 1088/2005 del año 2005, en el RD 1343/2007 del año 2007 y la OM SCO/322/2007 también de 2007 Una vez aclarado que la UE no tiene capacidad normativa sobre una parte considerable de la actividad transfusional porque hay áreas que están reservadas de modo explícito a cada estado miembro, también hay que reconocer que la UE puede impulsar y financiar programas de acción comunitaria en el ámbito de la salud (Decisión Artículo 1350/2007/CE del Parlamento y del Consejo aprobada en 2007 para el periodo 2008 – 2013), de resultas del cual la Comisión ha ido publicando en los años subsiguientes cada año un programa de promoción de actividades de interés general para ese año asignado a cada uno una considerable ayuda económica. Por ejemplo en el documento Decisión de la Comisión de 22 de febrero de 2011, (Decisión de la Comisión 2011/C 69/01) en el anexo I apartado 3 define las prioridades en las ayudas. El Punto 3.1.3 hace referencia a la sangre y a la transfusión y establece como prioritario: 1) el apoyo a Consejo de Europa (que como se sabe año tras año publica la siguiente edición de la Guía), 2) formación de inspectores de centros de transfusión, 3) promoción de la donación de órganos, 4) sistema único europeo de codificación de células y de tejidos. El siguiente paso es que la Comisión publique un concurso para que se presenten proyectos; cada aspirante tiene que definir el título y objetivo, el calendario de actividades (suele ser de tres años), el presupuesto, y un compromiso sobre la entrega de resultados. Cuando se resuelve el concurso se adjudica a una institución, es decir que intervienen instituciones, no personas, aunque es cierto que hay un coordinador general o Project Leader. Además hay un equipo que también forma parte del proyecto, formado por instituciones adicionales procedentes de distintos países europeos, elegido por la institución principal. Por ejemplo en 2003 la Comisión aprobó un proyecto de tres años presentado por el Clínic de Barcelona sobre un sistema de calidad europeo para bancos de tejidos, EQSTB. La institución principal en este caso era el Hospital Clínic, su Leader Project era Martí Manyalich, del Clínic, y luego una serie de fundaciones, de hospitales, de universidades, hasta un total de quince incluyendo la ONT, de Bélgica, Francia, Italia, Países Bajos, Letonia, Rumania, Polonia, etc. elegidos o contactados por el Clínic. El resultado de este proyecto es el conocido manual para implantar un sistema de calidad homologado en bancos de tejidos, por medio de ítems (parecido al Jacie). El Ministerio de Sanidad de un país también puede estar presente en la elaboración de un proyecto enviando a una persona para que participe. Puede ser porque forme parte del equipo del proyecto desde el principio, pero también porque al gobierno de un país de la UE le interese participar, en cuyo caso se pone en contacto con la institución ganadora del concurso y le comunica su intención de enviar a una persona al proyecto. La diferencia es sólo económica porque los gastos de las actividades y reuniones de quienes forman parte del proyecto se cubren con fondos del proyecto, mientras que si es un gobierno el que ha añadido un miembro es el gobierno quien costea los gastos. Cuando hablamos de que en el proyecto participan Portugal, Eslovenia o Alemania, no es que participen estos países como tales sino que por ejemplo, el Instituto Portugues do Sangue, el Centro Nacional de Transfusión en Llubllana, o la Cruz Roja de Hamburgo han enviado a alguna persona a trabajar en el proyecto El desarrollo del proyecto tiene lugar de acuerdo con el calendario aprobado, por medio de sucesivas reuniones de trabajo, mucho contacto con medios electrónicos, y largas discusiones. Como los contenidos de los proyectos no suelen tener carácter normativo, los temas se centran en aspectos técnicos y científicos con poco o nulo contenido político o ideológico. Están desprovistos de la rigidez de un trámite legislativo y en cambio más próximos al enfoque de las recomendaciones. Generalmente los trabajos empiezan por un sondeo sobre la situación, sobre el punto de partida. En la recogida de datos se cuenta con el apoyo decidido de las autoridades sanitarias de cada país bien a través del ministerio de sanidad o bien a través del sistema nacional de salud. Esta colaboración inicial es muy valiosa porque no suele ser fácil reunir datos cuando se organiza el estudio desde una institución particular no oficial; el hecho de contar oficialmente con el apoyo de la Comisión Europea abre muchas puertas de la administración pública. A partir de los datos reunidos, y determinado el objetivo, se hace una hoja de ruta y se establecen grupos de trabajo, cada uno formado por no más de seis personas. Las conclusiones de los grupos se redistribuyen y se discuten entre todos los participantes, por correo electrónico, por teleconferencia, y también con reuniones presenciales (1 ó 2 en un año). El resultado final del proyecto es la publicación de un texto, la mayoría de las veces un manual. Al comienzo de este artículo mencionábamos los tres últimos proyectos financiados por la UE relacionados con la transfusión y presentados en el congreso de la ISBT en Berlín 2010. Una somera revisión de los objetivos y contenidos de estos proyectos puede resultar clarificadora. Proyecto Domaine El objetivo de este proyecto es facilitar un suministro de sangre suficiente y segura destinada a transfusión para los ciudadanos europeos por medio unas “buenas prácticas de gestión de donantes de sangre”. El acrónimo DOMAINE en inglés está algo parafraseado: good DOnor MAnagement IN Europe. La institución coordinadora es Sanquin, el Instituto Holandés de Transfusión, y el líder es Wilhem de Kort. Junto con el Sanquin colaboran 14 centros europeos sin participación directa de ninguno español aunque desde España se ha participado suministrado muchos datos para el proyecto. Está dotado con €500.000 y se ha desarrollado en el periodo 2007 – 2010. Como resultado del proyecto se ha publicado un manual, accesible a través de la página web www.domaine-europe.eu. El manual empieza por resumir la situa15 Artículo ción actual en Europa, algunas reflexiones teóricas y aclaración de conceptos, para luego enumerar las herramientas con las que hay que dotar la gestión de la donación de sangre. Trata mucho y bien la base de donantes, el marketing y captación de nuevos donantes, y a fondo el tema crucial del mantenimiento del donante regular, que no lo olvidemos, es mucho más importante que la captación de donantes nuevos y responsabilidad sobre todo del personal de extracción. De hecho el manual dedica bastante espacio a temas de extracción y a la seguridad del donante. La parte final presenta algunas herramientas de apoyo tales como recursos humanos, tecnología informática, y consideraciones éticas. Las últimas sesenta páginas son apéndices recogiendo la legislación europea, que a mi juicio sobran. El manual es un excelente libro de texto para todo el personal relacionado con la donación, médico, de enfermería, promotores, administrativos, que debrían no sólo leerlo sino también estudiarlo. Los profesionales de la transfusión no directamente responsables de temas de donación quizás no lo necesitan tan a fondo, pero desde luego deben de leerlo y conocerlo, y si lo estudian, pues mucho mejor. En mi opinión se complementa muy bien con ese otro libro de texto para personal de extracción que es el libro Promoción de la donación de sangre (tomo I) que el Ministerio editó en 2004 y que se puede bajar de la página web del Ministerio de Sanidad www. msps.es. El manual del DOMAINE trata temas de organización mientras que el del Ministerio entra en las líneas de acción. Son dos libros sinérgicos que el profesional tiene que estudiar. Proyecto Eubis El objetivo de este proyecto está relacionado con las inspecciones sanitarias. 16 Parte de la idea de que todos los estados de la Unión Europea disponen de una legislación básica que regula el funcionamiento de los centros de transfusión, lo cual entre otras cosas permitiría la circulación de componentes sanguíneos homologados dentro de la Unión. Sin embargo la inspección sanitaria de los centros es responsabilidad de cada estado no de la Unión, y la profundidad y el rigor de la inspección puede variar mucho de un estado a otro. Por medio del proyecto EuBIS se ofrece un sistema de inspección sanitaria homologada y listas de comprobación estandarizadas. Las autoridades de cada país europeo pueden decidir cómo y con qué criterios inspeccionan los centros de transfusión, siempre que utilicen la legislación europea como referencia (en realidad, la legislación nacional tal como se haya transpuesto la europea). No tienen ninguna obligación de basarse en el proyecto EuBIS. Sin embargo para la propia autoridad sanitaria puede ser interesante adherirse a la política metodologica del Eubis porque tiene un perfil fuertemente técnico y es una referencia europea. El acrónimo EuBIS procede de las siglas European Blood Inspection System. El promotor del proyecto es el Centro de Transfusión de la Cruz Roja Alemana de Baden – Wurttemberg – Hessen cuya sede principal está en Francfort. Participan instituciones de quince países, entre ellas el Ministerio de Sanidad de España. El proyecto ha concluido en 2010 y como resultado se están difundiendo el manual y la guía de inspección. El manual comprende los conceptos, la formación de inspectores, la evaluación de los incumplimientos, la redacción de actas de inspección. La guía va enumerando los artículos de las Directivas de la UE y describe paso a paso los ejemplos de evidencia que el inspector deberá observar para asegurarse que la legislación se cumple. El objetivo es suministrar tanto a los inspectores como a los inspeccionados las mismas reglas del juego. La guía también incluye métodos relacionados con las auditorías internas. Hay que tener presente que el EuBIS trabaja todo el tiempo con la legislación. Sólo si hay algún aspecto confuso en la letra de las leyes se recurre a otras normativas de referencia como son la Guía del Consejo de Europa, el PICS, las ISO 9000, la ISO 10011, y la Farmacopea Europea. En eso se diferencia mucho del CAT o del Red Book británico. No se trata de acreditar que el centro está homologado con una norma de buenas prácticas sino de comprobar que se cumple la legislación. A nosotros como profesionales de la transfusión nos resulta más atractivo el enfoque del CAT, claramente orientado hacia la mejora. Sin embargo las autoridades sanitarias se encontrarán más identificadas con la metodología del EuBIS a la hora de inspeccionar y autorizar el funcionamiento de un centro de transfusión. La página web por la que se puede entrar en los detalles del proyecto EuBIS es www.eubis-europe.eu. Proyecto Euobup El proyecto EUOBUP European Union Optimal Blood Use Project, es un buen ejemplo de cómo la Unión Europea, que no tiene competencias para regular la transfusión, puede sin embargo impulsar proyectos que traten del tema, en este caso dentro del concepto de uso óptimo. Este proyecto está promovido por el Servicio de Transfusión Escocés, Scottish Blood Transfusion Service, y su líder es Brian Mc Clelland que ha venido repetidamente a España y por lo tanto le conocemos bien en nuestro País. Presentó las líneas principales del proyecto en el Congreso de la SETS de Valladolid. Como los anteriores el proyecto se ha desarrollado entre 2007 y 2010 con la colaboración de instituciones de varios países de Europa, ninguno de ellos de España. Como resultado del proyecto se ha publicado un Manual de Uso Óptimo de la Sangre, del que hay al menos dos versiones Artículo en castellano. El manual tiene una declaración explícita del objetivo: Fomentar mejoras en la calidad del proceso de transfusión definido como: la transfusión de la sangre adecuada al paciente correcto, en el momento oportuno, en las condiciones idóneas, y de acuerdo con las guías clínicas apropiadas. El manual es más que nada metodológico. Analiza muy bien y a fondo el proceso de la transfusión, qué variables influyen, qué elementos hay que controlar, dónde están los principales peligros. Quien busque un recetario o una guía de uso clínico se llevará un chasco. En algunos aspectos es superficial. Su principal utilidad es como documento maes- tro sobre cómo hay que organizar la transfusión dentro del hospital en todos sus aspectos. Por ejemplo, la formación en transfusión dentro del hospital que es un tema poco tratado y lleno de dificultades, está muy bien presentado y puede ser una ayuda. Como se trata de un documento “de la Unión Europea” puede tener más impacto en la dirección del hospital y en los servicios clínicos más relacionados con la transfusión. Conclusión Como pasa con todo, estos proyectos, los manuales y documentos que llevan aparejados, son herramientas. Son como ordenadores potentes que si se quedan en un rincón sin usar sólo estorban. No tienen poderes per se, sino que su eficacia dependerá del uso que hagamos de ellos. Quizás no tanto el manual y la guía del EuBIS, o el manual del DOMAINE, pero sí desde luego el manual de uso óptimo. Teniendo en cuenta que gran parte de la actividad transfusional sobre todo en el hospital, está relacionada con otros servicios clínicos, el recurrir a documentos que tienen el marchamo de la Unión Europea les da una mayor credibilidad en servicios ajenos a la hematología. Pueden ser muy buenos apoyos de los servicios de transfusión y sobre todo de mejora de la práctica transfusional. j 17 Miscelánea Premios de la SETS y Gotas de plata 2011 Æ Al final del Congreso de la SETS celebrado en Málaga, se hicieron públicos los Premios de la SETS y Gotas de Plata correspondientes a la edición SETS – año 2011. Son los siguientes: Premios de la sets 2011 Estos premios están dotados con un cheque de 1.000 euros a nombre del primer firmante del trabajo premiado. Premio SETS en las áreas de Organización, Gestión y Promoción. “La Web corporativa como soporte a la estrategia 2.0. Herramientas de promoción para la gestión del donante”. A Román, P Muñoz, JL Gómez Villagrán. CRTS de Córdoba. Premio SETS en el área de Producción de componentes sanguíneos: extracción, procesamiento y cribado de agentes transmisibles. “Brote epidémico por virus del Nilo occidental en la provincia de Cádiz. Medidas tomadas para garantizar la seguridad transfusional”.A Salat, MA Barbero, M L Meca, E Romero Vega. CRTS de Cádiz. Premio SETS en el área de Tejidos y Terapia celular. “Factores obstétricos y neonatales que condicionan la calidad de la sangre de cordón umbilical”. L Ponce, I Bellido, MC Hernández, P Gómez, Y Rodriguez, I Prat. CRTS de Málaga. Premio Dr Duran i Jordà en la áreas de Práctica transfusional, Inmunohematología y Hemovigilancia. Se ha concedido “ex-aequo” a: “Aplicaciones de la tipificación molecular de los antígenos eritrocitarios en la población inmigrante”. L Barea, E Castro. C de T de la Cruz Roja de Madrid. “Supervisión telefónica personalizada en reacciones adversas de la donación de sangre en equipos móviles durante un período de cuatro años”. N Nomen, C Pastoret, J Olles, K Reyes, G Pliego, S González, D Padrón, P Vicente, G Gallego, E Bruguera, M Coscollola, S Costas, M Saucedo, G Oliva, M Tarifa, R López, M giménez, LL Puig. Banc de Sang i Teixits. Barcelona. Premios Gotas de plata 2011 Trofeos gota de plata para los mejores materiales de promoción de la donación presentados: Gota de plata a mejor material de promoción en soporte de papel GOTA A GOTA de la Fundación Banco de Sangre y Tejidos de las Illes Baleares. Gota de plata al mejor spot publicitario de radio o T.V DONAR SANGRE ES REGALAR VIDA del Centro Vasco de Transfusión y Tejidos Humanos. Gota de plata al mejor material Multimedia JÓVENES del Centro de Hemoterapia y Hemodonación de Castilla y León. Gota de plata a la mejor campaña TU TAMBIÉN PUEDES del Centro de Transfusión de la Comunidad de Madrid. j ¡ENHORABUENA A TODOS LOS PREMIADOS! Æ Socios protectores de la SETS - Octapharma, S.A - Diagast Ibérica, S.L - Fenwal España, S.L - Cerus - Abbott - Menarini - Ortho 18 - Novartis Vaccines and Diagnostics S.L. - Terumo Europe España - Grupo Grífols - Movaco - Maco Spania - Gambro - Immucor, S.L. Informes Miscelánea Amigos de la SETS Dra. C Fernández / Gijón. Æ La creación de la red de amigos de la SETS fue aprobada en la Asamblea General de la SETS celebrada en el último Congreso de Málaga, junio de 2011. Los contenidos principales son los siguientes: Objetivo de la red de amigos de la SETS Ofrecer a visitantes de la página web de la SETS que no tengan la categoría de socios la posibilidad de tener acceso a los contenidos reservados para los mismos, así como ofrecer acceso a cursos de formación en el aula virtual. Quien puede solicitar formar parte de la red de amigos de la SETS Puede solicitar la condición de amigo de la SETS cualquier profesional cuyo trabajo esté relacionado con los objetivos y funciones de nuestra sociedad. (actividades propias de la Medicina Transfusional y/o la Terapia Celular) que no residan en el estado español ni en Portugal (médicos, otros licenciados superiores, enfermeros, técnicos, promotores de la donación, etc.). Derechos y obligaciones de los miembros de la red de amigos de la SETS Respecto al uso de la página web, publicaciones SETS y formación “on line” Podrán consultar todos los contenidos habilitados para socios registrados sin exclusión, incluyendo acceso y descarga de las publicaciones elaboradas por la SETS: Boletines SETS, Programas Educacionales, Ponencias y Comunicaciones de los congresos de la sociedad. Podrán participar en los Foros de Socios y podrán participar en los Foros de los Grupos de trabajo, previa aceptación del Coordinador del Grupo. Podrán acceder a los cursos de formación “on line” de la SETS con tarifas preferenciales respecto a los no socios. Tendrán derecho a la adquisición de los fondos editoriales de la SETS en edición papel o electrónico con un descuento respecto al precio de venta fijado al público. Obligaciones La condición de amigo de la SETS es personal e intransferible, estando sujeto a las obligaciones y limitaciones contenidas en las normas éticas y de funcionamiento de la sociedad y la web: http://www.sets.es/index.php?option=com_content&view=c ategory&id=88&Itemid=71 http://www.sets.es/index.php?option=com_content&view=a rticle&id=148:etica-web&catid=92:web-sets&Itemid=73 Tarifas Inscripción individual cuota 2011: 25 euros/año. Proceso de alta en la red de amigos de la SETS 1. Solicitud: Se deberá realizar a través de la página web, cumplimentando el formulario de alta como amigo de la SETS. http://www.sets.es/index.php?option=com_rsform&view= rsform&Itemid=118 2. Aceptación: La Junta Directiva, una vez valorada la solicitud le notificará a la mayor brevedad posible a la dirección de correo que haya facilitado. 3. Pago de cuota: Una vez notificada la aceptación se deberá hacer efectivo el pago de la cuota anual mediante tarjeta de crédito (VISA o MASTERCARD) desde la tienda virtual (SETS-Store). http://www.sets.es/index.php?option=com_virtuemart& page=shop.browse&category_id=1&Itemid=111 4. Alta en la web: Una vez realizado el pago se enviará un correo con la clave de acceso e instrucciones para el registro en la web. Otras actividades de la sociedad Los amigos de la SETS no tendrán condición de socio numerario, ni tendrán voz o voto en las asambleas, ni podrán participar en la configuración o elección de los órganos rectores de la sociedad. 20 Politica de privacidad Los datos de la red de amigos de la SETS estarán sujetos a la misma política de protección y privacidad que se aplica a los socios. j Hemeroteca A partir del Boletin de la SETS nº 80, se ha incorporado a la Redacción la Dra. Erkuden Aranburu, del Centro de Transfusión de Navarra. Se ha ofrecido a colaborar en la sección de hemeroteca, que a partir de ahora tendrá dos partes. Hemeroteca I presentará a los lectores del Boletín de la SETS artículos relevantes de publicación reciente relacionados con la clínica o con la inmunohematología, y será presentado como hasta ahora por la Dra. Mercedes Corral, del Hospital Clínico y Universitario de Salamanca. Hemeroteca II tratará de las publicaciones relacionadas con la promoción / donación, y con el procesamiento analítico y de componentes, por la Dra. Erkuden Aranburu. Muchas gracias Mercedes, muchas gracias Erkuden por vuestra colaboración. Hemeroteca Clínica e inmunohematología Dra. Mercedes Corral / Salamanca. Æ Reikvam H., van de Watering L., Prowse C., et al. Evaluation of non invasive methods for the estimation of haemoglobin content in red blood cell concentrates. Transfusion Medicine 2011; 21, 145- 149 Conocemos bien la gran variabilidad que existe en la respuesta de los enfermos a la transfusión de concentrados de hematíes (CH) en función tanto de la volemia del paciente, como del contenido de hemoglobina (Hb) de los CH transfundidos. La realidad es que el contenido de Hb de los CH no es homogéneo, y las transfusiones de CH se prescriben en base a una “suposición” más o menos cualificada de la dosis de Hb que se aporta. Si pudiéramos precisar la dosis de Hb de los CH a administrar, podríamos mejorar el pronóstico del enfermo, en términos de predicción del incremento postransfusional de la Hb. En el año 2004 Arslan y cols. demostraron que definir la dosis de Hb que el receptor precisaría para alcanzar el objetivo de Hb circulante, podría reducir el número de CH transfundidos aproximadamente en un 30%. En el año 2010, los autores del artículo que comentamos, demostraron que el incremento de Hb postransfusional podría predecirse conociendo el contenido de Hb de las unidades de CH transfundidas; esta predicción podría mejorarse conociendo la volemia del enfermo. La nueva estrategia clínica transfusional supondría por tanto conocer la volemia del enfermo, la dosis de Hb que precisaria para alcanzar el objetivo de Hb circulante, y el contenido de Hb de las unidades de CH. El “estándar de oro” para conocer el contenido de Hb de las unidades de CH sería conocer la concentración de Hb en cada unidad, pero, dado que se trata de un método invasivo, se han estudiado otras alternativas para estimar el contenido de Hb de los CH, entre otras el estudio que presentan los autores, cuyo objetivo fue evaluar el contenido de Hb de los CH a través del peso y volumen de los mismos. Recogieron datos de 4 países: Canadá, Escocia, Holanda y Noruega, 22 que fueron analizados por separado. En todos los CH estudiados, almacenados en solución SAGM, se había eliminado el buffy coat o habían sido leucorreducidos por filtración en el proceso de fraccionamiento. Los CH fueron seleccionados aleatoriamente del stock de cada centro. Las muestras para la determinación de Hb se obtuvieron manteniendo el sistema cerrado; en todos se determinó el peso o volumen. Para definir la estrategia óptima para estimar el contenido de Hb de las unidades realizaron distintos cálculos de correlación. El artículo muestra los datos y análisis estadísticos, y la correlación entre el peso de los CH y el contenido total de Hb de las unidades, y la correlación entre volumen de los CH y el contenido total de Hb. Conclusiones del estudio l estudio confirma la gran variabilidad en la Hb total en E los CH transfundidos. j Aunque la medida directa de la Hb sería el estándar ideal, la alternativa de los autores es más simple y permite una estimación razonable; los resultados demuestran una estrecha correlación entre el peso y el volumen de los CH y su contenido total de Hb. j Las correlaciones varían entre países y entre métodos de producción de CH; las diferencias en el volumen, la solución conservadora, y el periodo de almacenamiento podrían explicar estas diferencias. j Los autores recomiendan que cada centro establezca una curva estándar para la relación peso/volumen y Hb. j Este método simple y barato puede ser el origen de una práctica transfusional basada sobre una “dosis” de Hb. Idealmente deberían realizarse estudios amplios para evaluar la utilidad en la práctica de rutina; me parece que puede ser un trabajo de los Centros y S. de Transfusión que, realizado con la metodología y rigor obligado, podría realmente ser una vía de potenciar el uso óptimo de este componente sanguíneo. j Hemeroteca Æ Chaurasia P.,Berenzon D. and Hoffman R. Chromatinmodifying agents promote the ex vivo production of functional human erythroid progenitor cells. Las células de cordón umbilical son una fuente efectiva de células stem (cu CS) y de células progenitoras hematopoyéticas (cu CPH), que usamos para la reconstitución hematológica de enfermos que han recibido radioterapia o quimioterapia mieloablativa. Numerosos investigadores han realizado ensayos con células stem y progenitoras hematopoyéticas de cordón umbilical para aumentar su número ex vivo, mediante cultivo de células CD34+ en diferentes condiciones, pero el éxito ha sido limitado. Investigaciones mas recientes utilizan estas células con el objetivo de generar fuentes alternativas de células terminalmente diferenciadas de la sangre (maduras), que pudieran usarse como producto para transfundir. Las células progenitoras hematopoyéticas retienen la capacidad de dividirse y diferenciarse hacia una línea específica, y el planteamiento de su uso como producto para transfusión, asumiendo que las mismas podrían continuar generando células diferenciadas por periodos prolongados de tiempo, representaría un cambio conceptual importante. Un problema que debe afrontarse en el proyecto, aún no resuelto, es que para generar este producto para transfusión debería disponerse de un número suficiente de células stem y progenitoras hematopoyéticas a partir de fuentes fácilmente accesibles. El trabajo publicado en este número de Blood comunica los resultados obtenidos en el desarrollo de un producto para transfusión de células progenitoras eritroides y células precursoras, generadas ex vivo. Partiendo de células CD34+ de cordón umbilical, utilizando in vitro una combinación de citocinas y diversos inhibidores de la histona deacetilasa, lograron: j promover la diferenciación preferente de las mismas a células progenitoras eritroides j las células progenitoras eritroides generadas fueron capaces de diferenciarse en los diferentes estadios del desarrollo eritroide j se produjeron modificaciones epigenéticas (aumento en la acetilación H3) de los promotores para los genes eritroide-específicos, lo que dio lugar a la adquisición de una estructura de expresión génica característica de células eritroides primitivas j lograron un producto para transfusión que cuando se infundió en ratones NOD/SCID produjo eritrocitos maduros (que se mantuvieron 3 semanas), que contenían globina humana adulta y fetal (β globina y γ globina), lo que confirmó la presencia de Hb humana en la sangre periférica del ratón, e indica la desviación de γ globina fetal a β globina adulta; tenían también antígeno Rh D. j La presencia prolongada de eritrocitos humanos nuclea- dos y anucleados en sangre periférica, se asoció a la implantación de células progenitoras y precursoras eritroides en la médula ósea del ratón receptor. Hasta el momento sólo se puede especular acerca de lo que ocurriría si se infundieran en receptores inmunocompetentes estos productos transfusionales de células progenitoras eritroides. Se desconoce, por supuesto, qué ocurriría si se infundieran en un enfermo anémico que requiriera transfusión de CH. Dadas las diferencias entre un modelo xenogénico y un potencial enfermo anémico a la hora de recibir un producto de células humanas alogénicas generadas ex vivo, sería imposible predecir el número de células que serían clínicamente eficaces a partir de los datos generados de los estudios que se describen en el artículo. En ratones que recibieron solo hematíes 0+ humanos en gran número, no se detectaron eritrocitos humanos circulantes. Los autores piensan que son aún necesarios estudios preclínicos, usando modelos de animales inmunocompetentes mas adecuados, antes de que estos productos puedan ser clínicamente útiles en humanos. Una barrera añadida para implementar esta estrategia en humanos es que se desconoce la dosis de células que sería necesario infundir para mejorar la anemia en un enfermo específico. Me parece que aunque se trata de ensayos preclínicos y que probablemente tardarán aún en trasladarse a nuestra práctica transfusional, son de extraordinario interés. Tantos años esperando las hemoglobinas sintéticas, y un nuevo campo bien esperanzador se abre ahora. Recomendaciones: Æ De la Rubia J, Contreras E., del Río Garma J. Púrpura trombótica trombocitopénica. Revisión. Medicina Clínica 2011. 136(12): 534- 540 Una revisión de nuestros compañeros que actualiza, en castellano, los aspectos epidemiológicos, la fisiopatología, clínica, diagnóstico, y las estrategias actuales de tratamiento. Æ Richter J., Strandberg K., Lindblom A., etr al. Successful management of planned pregnancy in severe congenital thrombotic thrombocytopenic purpura: the UpshawSchulman syndrome. Letter to the editor. Transfusion Medicine, 2011; 21:211-213 Comunican el caso de una mujer de 34 años, con una PTT congénita , debido a mutaciones en el gen del ADAMTS 13, que fue tratada con éxito durante el embarazo con infusiones de plasma regulares. j 23 Hemeroteca Hemeroteca Donación y procesamiento Dra. Erkuden Aranburu / Pamplona. Æ INTERNATIONAL FORUM. Pathogen Inactivation of platelet concentrates. Autores: H.W. Reesink, S. Panzer, Z. KMc Quilten, E.M Wood, D.C. Marks, S. Wendel, F. Trigo, S. Biagini, S. Olyntho, D.V .Devine, I. Mumford, J.-P. Cazenave, P. Rasonglès, O. Garraud, P. Richard, F. Schooneman, G. Vezon, R.Al Radwan, A. Brand, T. Hervig, E. Castro, M. Lozano, L. Navarro, L. Puig, C. Almazán, S. MacLennan, R. Cardigan, I.M. Franklin εt C. Prowse. Vox Sanguinis (2010) 99, 85-95 La Técnica de Inactivación de Patógenos (IP) de los Concentrados de plaquetas (CP) se ha implantado en algunos países. Este Forum internacional recoge la información y la experiencia acerca de esta nueva metodología de 11 países/centros. Se enviaron estas dos preguntas a expertos en este campo de cada país/centro. Pregunta nº 1: ¿Se ha implantado en su país la Inactivación de Patógenos en Concentrados de plaquetas? Si es así ¿Qué técnica se ha elegido? j ¿Se aplica a todos los CP o aquellos que van dirigidos a un grupo de pacientes? j ¿Cuántos CPI se han transfundido y cual es la experiencia de su utilización? j ¿Se ha detectado efectos o reacciones adversas imputables al proceso de inactivación? j ¿El número de transfusiones que requiere un paciente es comparable tanto si se usan CP inactivados (CPI) como noinactivados? j Si está indicada la irradiación ¿También es necesaria cuando se utilizan CPI? j Si la plaquetas de obtiene por aféresis ¿Qué test, de los que se realizan habitualmente, podría ser eliminado si los CP son inactivados? Pregunta nº 2: Si no se ha implantado la Inactivación ¿Cuales han sido las razones? Resumen 1. Once países/ centros han respondido. Solamente en 4 países de 9 se ha implantado la Inactivación de los CP (Francia, España, Noruega y Kuwait) pero, excepto en Kuwait, no en todos los centros del país. 2. Hasta el momento se ha transfundido un total de 190.000 CPI. La técnica utilizada es amotosaleno + UVA; en un centro de Noruega se ha usado riboflavina. 3. No se han observado reacciones adversas imputables al proceso de inactivación 4. Se ha observado un menor número de reacciones febriles y alérgicas en pacientes transfundidos con CPI debido quizás al uso de solución conservante y por lo tanto la cantidad de plasma transfundido es menor. 5. La irradiación no es necesaria ya que el daño en el ADN de las células es más severo en el proceso de inactivación que durante la irradiación. 6. Los test realizados a los CP obtenidos por aféresis y sometidos a Inactivación han sido los mismos aunque pudiera eliminarse el test de detección bacteriana. Conclusión Aunque solo se han obtenido respuestas de 4 países es muy interesante el disponer de resultados de aproximadamente 190.000 unidades CPI transfundidas. En otros países la inactivación de patógenos (IP) forma parte de estudios de investigación, necesarios antes de su implantación. Se están investigando ambas técnicas: Amotosaleno+UVA y riboflavina +UVA. Los autores recomiendan leer detenidamente las interesantes reflexiones que plantean los expertos consultados. El resumen de los datos se recoge en la tabla de la página 26. Æ Bienvenida a los nuevos socios de la SETS Victoria Paz González Rodríguez – Zaragoza Isabel Picon Roig – Valencia Edgardo Fabián Iñiguez Racculia – Argentina Josefina Galende Del Canto – Ponferrada (león) Nuria Nomen Calvet – Barcelona Milagros Gracia Escudero – Almería Angelica María Patiño Pedraza – Niza Norte (Colombia) 24 Eva Martínez Revuelta – Siero (Asturias) Cristina Pardo Alfonso – Leioa (Vizcaya) Isabel Saez Serrano – Madrid Maria Luz Simon González – Madrid Maria Asunción Mora Casado – Madrid Alexandra Pinto Pacheco – Fafe (Portugal) Luis Manuel Valero Saldaña – Tlalpan (Mexico DF) Hemeroteca Inactivación de Patógenos de los Concentrados de Plaquetas País Australia Cuestión 1 La Cruz Roja australiana ha implantado medidas generales para disminuir el riesgo de ITT de los CP: Historia clínica, criterios estrictos de rechazo de donantes, técnicas de desinfección de la piel, recogida de muestras, test CMV, malaria, control bacteriano. Canadá Francia Kuwait 26 Conclusiones Ventajas: Disminuir el riesgo asociado a infección trasmitida por transfusión (ITT). Disminuir el rechazo de donantes (viaje…) Disminuir el rechazo de unidades por falsos positivos (T. detección bacteriana) Sustituir la Irradiación Gamma(IG) Inconvenientes: No elimina completamente el riesgo de ITT (bacterias formadoras de esporas) Problemas de toxicidad a largo plazo desconocidos (especialmente en jóvenes, embarazadas e inmunodeprimidos) No existen estudios que comparen ambas técnicas (Amotosaleno y riboflavina) Se precisa regulación No está implementada la IP El tratamiento de plasma con azul de metileno dispone de licencia pero no está implantado de forma rutinaria La IP por amotosaleno está a la espera de licencia De la revisión de la literatura consultada concluyen: Ventajas: potencial para disminuir las reacciones febriles, TRALI y TA-GVHD y la irradiación Los sistemas de IP: Theraflex®, Intercept® y Mirasol parece que previenen las ITT especialmente los patógenos emergentes. El coste es el mayor obstáculo para su implantación. Hay otras necesidades más urgentes El método amotosaleno-UVA esta siendo validado Inconvenientes: No hay evidencia de que se elimine el riesgo de IT. No pueden eliminarse test de rutina con seguridad. Es necesaria su aprobación por parte de las Autoridades 2007 Toronto: Conferencia sobre la IP: recomendación de uso cuando las técnicas sean seguras y accesibles, considerando la seguridad y eficacia de los productos tratados y su impacto en las rutina de los bancos de sangre y tras valoración del coste/eficacia. No está implantada. Tienen licencia amotosaleno y riboflavina. Los CP inactivados se consideran un producto nuevo: debe de regularse antes de su utilización. En fase de estudio Mirasol. No tienen tomada una decisión final. En estudio la respuesta de los médicos y de los pacientes. Tardará unos 24 meses el obtener la aprobación de estos productos para su uso en los hospitales. Necesaria Regulación Ventajas: Disminuiría el rechazo de donantes o viajes, sexo entre hombres.... Test que pudieran ser eliminados: CMV, Control bacteriano, VWN, Chagas, sífilis…. Desventajas: No se eliminarían: HVC, HVB, HIV, HTLVI y II En 2005 AFSSAPS aprobó el amotosaleno. Desde 2006 se ha implantado en 4 centros Entre marzo 2007 y noviembre 2009 se han transfundido 61700 CP Inactivados. Experiencia No se han detectado diferencias en la respuesta clínica postransfusional de los CPI (transfundidos a todo tipo de pacientes) y tanto CP de aféresis como de pool. Tampoco entre CP tratados y sin tratar. En discusión su implantación en todos los Centros. Solo aprobado el amotosaleno-UVA. El uso extendido en Alsacia (50000 CPI) ha aportado evidencia de que la tecnología es robusta y segura. Su aplicación se retrasa por el problema económico. Experiencia: Disminución (40%) de reacciones agudas a la Tx (grado 1: r. febriles y alérgicas). Debido al uso de solución aditiva y reducción del plasma (53-65%) Han eliminado el test CMV en pacientes tratados con CPI. No se ha detectado ninguna infección bacteriana transmitida por trasfusión. Se ha eliminado la irradiación de los CPI No se han detectado r. o efectos adversos relacionados con el proceso de inactivación. Vida CPI:5 días KCBB: 60000 unidades de ST y 6500 aféresis. El Gobierno aprueba la IP en enero 2008. Técnica amotosaleno validada en junio 2008 100% de los CP (3757 de junio a diciembre de 2008) Ventajas: Liberación rápida del producto. Disponibilidad de más productos. Disminución del riesgo bacteriano. Disminución del riesgo de ITT viral. Eliminación NAT individual. Elimina CMV, irradiación y detección bacteriana. Previene introducción de futuros test de screening .Evita la pérdida de donantes. Desventajas: Disminución del número de plaquetas Proceso de validación 1-3 meses La Implantación de la IP no debería basarse solo en su coste ya que en los BS se han implementado muchas técnicas de alto coste de cara a la seguridad transfusional. Futuro: Introducción de IP del plasma y de los CH. El coste con su implantación irá disminuyendo. La técnica de IP no está implementada. Brasil Cuestión 2 No tienen prevista su implantación a corto plazo. Estudios de investigación en marcha. Debate abierto con Servicios de transfusión y las compañías Intercept® y Mirasol™. Se requieren más datos acerca de la funcionalidad y viabilidad de las plaquetas. Deben realizar estudios acerca de coste/ eficacia Hemeroteca Inactivación de Patógenos de los Concentrados de Plaquetas País Cuestión 1 Cuestión 2 Conclusiones La IP no está implantada. CP:95% pooles y 5% CP aféresis (casos especiales) Control bacteriológico CP con control bacteriano :Vida de 7 días CP en Solución Aditiva PAS-II): Vida de 5 días Se considera un producto experimental. Estudiar la seguridad y eficacia clínica en estudios comparativos con los productos estándar antes de analizar el costes/ eficacia Estudio de IP con amotosaleno en marcha, controlado :CPI en PAS III y CP en plasma hasta los 7 días En perspectiva estudio similar con la Riboflavina Desventajas: Insuficiente evidencia clínica de la eficacia de los RP-CP y su Vida de 7 días (poco estudiado) Noruega Implantada en 4 Centros (3 utilizan amotosaleno y 1 riboflavina). Su uso no se ha limitado a un grupo de pacientes Ventajas: Impresión de que se han detectado un menor número de reacciones adversas Desventajas: No se ha implementado en la mayoría de los BS por que persiste un riesgo residual de TTI. Por la disminución de plaquetas en los contajes de CCPI( sin consecuencias clínicas) y la posible alteración en su calidad y por el Po su coste tan alto La posibilidad de prevenir patógenos emergentes antes de su detección junto la incertidumbre acercad de la calidad de los test de control bacteriológico ha contrarestado los efectos negativos del proceso de IP y hay más centros que la han implantado La Autoridad sanitaria deberá regular. España Cruz Roja Madrid En España está implantada en 6 Centros Decisión tomada para: Reducir patógenos (5 centros) o para prolongar la vida media plaquetar a 7 días y disminuir TA-GVHD (1 centro). No reacciones adversas detectadas Eliminación de la irradiación ( algunos médicos requieren más información) No se ha detectado aumento de n º de transfusiones requeridas El Problema mayor :el económico Técnica implantada en todos los centros: amotosaleno riboflavina: En breve podrá utilizarse para CP extraídos en Solución aditiva Cruz Roja: Implantación hace 5 años: 20000 unidades transfundidas. 90% transfundidas a pacientes oncohematológicos. No se ha eliminado ningún test (CP de aféresis provenientes de procesos de multicomponentes) Implantado en 6 Centros (23% de los CP del país son inactivados) Transfundidas 120000 unidades inactivadas con Amotosaleno No efectos ni reacciones adversas en relación con el proceso de inactivación No se ha detectado un incremento del número de transfusiones requeridas No se ha implantado Por problemas económicos Por la idea de que no es necesaria y reservas sobre el proceso y su seguimiento En general sustituye a la irradiación y vida de 7 días. En otros Centros estudio técnicas Riboflavina y Amotosaleno No implantada Alto coste. Decisión Dto de Salud. Organismo asesor del SaBTO. A estudio: aspectos éticos, legales y regulación Beneficios: Disminución de riesgo de TTI, eliminar Gamma irradiación, eliminar algunos test de screening y Evitar eliminación donantes SaBTO: se requiere más información acerca de los beneficios de los CPI y examinar el coste/eficacia resultado del ensayo clínico en marcha en los Paises Bajos ( Amotosaleno) Riesgos: No se conoce toxicidad a largo plazo No implantada. En estudio clínico en 1 centro En UK se usa plasma inactivado con azul de metileno importado a los pacientes <16 años. Todos los CP son sometidos a control bacteriológico IP: Proceso muy caro. Ventajas: Eliminar control bacteriano, irradiación, prevenir GVHD-AT, test CMV y evitar implantación de test de screening de otros patógenos emergentes. Desventajas: Incertidumbre acerca calidad de las plaquetas después del tratamiento y con almacenamiento tan largo, particularmente si se utilizan determinadas soluciones aditivas Decisión de Autoridad Sanitaria Imprescindible incrementar la experiencia SaBTO: En evaluación el control bacteriológico de lo CP y la inactivación. Reunión Enero 2010 no se recomienda la IP de CP pero es una decisión que está en revisión Países Bajos España Barcelona Reino Unido Escocia 27 Normas Artículo de publicación Normas de publicación en el boletín de la SETS Presentación y estructura de los trabajos. Los trabajos se acompañarán de una carta de presentación en la que conste la aceptación de su envío por parte de todos los autores, la aseveración de no haber sido publicados anteriormente ni estar simultáneamente enviados a otra publicación. Todos los originales aceptados quedan como propiedad permanente del Boletín de la SETS y no podrán ser reproducidos en parte o totalmente sin permiso del director y del equipo de redacción del mismo. El autor cede, en el supuesto de publicación de su trabajo, de forma exclusiva al Boletín de la SETS todos los derechos de reproducción, distribución, traducción, comunicación pública, transformación y colección (por cualquier medio o soporte, incluso sonoro, audiovisual o electrónico) de su trabajo durante el plazo máximo de vigencia que en cada momento fije la ley para estos derechos, y para todo el mundo. Los trabajos se enviarán mecanografiados en hojas de tamaño DIN A4, a doble espacio (30 líneas de 70 pulsaciones), dejando un margen a la izquierda de, al menos, 3 cm. Las hojas irán numeradas correlativamente en el ángulo superior derecho. En la primera hoja se indicarán, en el orden que aquí se establece, los siguientes datos: título del artículo, nombre y apellidos de los autores, nombre completo de centro en que se ha realizado el trabajo y dirección completa del mismo. A continuación se especificará la persona con la que debe mantenerse la correspondencia, su dirección completa, correo electrónico, un número de teléfono y de FAX donde pueda ser más fácil contactar con el autor. Originales. Vendrán acompañados de un resumen que deberá estructurarse en: Introducción, Material y métodos, Resultados y Discusión y tener una extensión aproximada de 250 palabras. En dicha página se incluirán de tres a diez palabras claves obtenidas del Medical Subject Headings (MeSH) del Index Medicus/Medline, disponible en: http://www.ncbi.nlm.nih.gov/entrez/meshbrowser,cgi, en inglés y español. A continuación seguirán las hojas con el texto del artículo en el que los distintos apartados (Introducción, Material y métodos, Resultados, discusión, Bibliografía) se sucederán sin interrumpir página. La bibliografía se comenzará en hoja aparte y se redactará de acuerdo con los “Requisitos de uniformidad para manuscritos presentados para publicación en revistas biomédicas” elaborados por el Comité Internacional de Editores de Revistas Médicas y conocidos como normas de Vancouver. Seguidamente se incluirán las tablas (cada una en una hoja) y ordenadas correlativamente. Al final se incluirán las figuras, gráficos, fotografías, etc., presentadas dentro de un sobre y convenientemente identificadas indicando con una flecha en el reverso su adecuada orientación. En dicho sobre, en hojas aparte, se incluirá una lista con los pies de tablas y figuras. Se aceptarán diapositivas o fotografías. Las fotografías se remitirán en blanco y negro o bien en archivo fotográfico electrónico con una resolución de 300 puntos por pulgada. Los gráficos deben realizarse con ordenador. La extensión máxima del texto será de 12 páginas y se admitirán hasta 6 figuras y 6 tablas. Sólo extraordinariamente se permitirá rebasar esta extensión. Se aconseja que el número de firmantes no sea superior a seis. Casos clínicos. Se aceptarán fundamentalmente los casos que destaquen por su carácter insólito o su interés práctico. La extensión máxima del texto será de 5 páginas y se admitirán hasta 2 figuras y 2 tablas. El orden a seguir será el mismo que en los Originales, pero disminuyendo al mínimo los detalles metodológicos. Se aconseja que el número de firmantes no sea superior a cuatro. Cartas al director. Podrán aportarse como tales comentarios a artículos publicados recientemente en el Boletín y observaciones o experiencias no relacionadas con material publicado a condición 28 de que sean resumidas en un breve texto. La extensión máxima del texto será de 2 páginas y podrá admitirse hasta una figura y una tabla. Si es preciso, puede incluirse bibliografía que en ningún caso superará las 5 citas. Se aconseja que el número de firmantes no sea superior a cuatro. Revisiones. Aunque habitualmente se efectuarán por encargo, podrán aceptarse revisiones que intenten poner al día un tema de interés en medicina transfusional acompañadas de detalle bibliográfico más extenso. La extensión máxima del texto será de 10 páginas y se admitirán hasta 4 figuras y 4 tablas. Solo extraordinariamente se permitirá rebasar esta extensión. Otras instrucciones a considerar Unidades. La revista aceptará unidades convencionales de medida. Agradecimientos. Cuando se considere necesario se citará a las personas centros o entidades que hayan colaborado en la realización del trabajo. Bibliografía. Se presentará según el orden de aparición en el texto con la correspondiente numeración correlativa. En el texto constará siempre la numeración de la cita en números volados. Los nombres de las revistas deber abreviarse de acuerdo con el Index Medicus/Medline; consultar “List of Journal Indexed” que publica todos los años el Index Medicus en el número de enero, o bien consultar la base de datos de revistas disponible en: http://ncbi.nlm.nih.gov/entrez/jrbrowser,cgi. Las citas deberán comprobarse sobre los artículos originales y se elaborarán según normas de Vancouver, disponibles en http://www.icmje.org/ Se evitará el uso de frases imprecisas como citas bibliográficas. No pueden emplearse como tales “observaciones no publicadas” ni “comunicación personal”, pero sí pueden citarse entre paréntesis dentro del texto. Los trabajos aceptados, pero aún no publicados, se incluyen en citas bibliográficas como “en prensa”, especificando el nombre de la revista precedido por la expresión (en prensa) entre paréntesis. Las citas bibliográficas deben comprobarse por comparación con los documentos originales, indicando siempre la página inicial y final de la cita. Información para los autores 1. El consejo de Redacción acusará recibo de los trabajos enviados a la Revista e informará de su aceptación. 2. Los manuscritos serán revisados anónimamente por dos expertos en el tema tratado. El Equipo de Redacción ser reserva el derecho de rechazar los artículos que no juzgue apropiados, así como de introducir modificaciones de estilo y /o acortar los textos que lo precisen. comprometiéndose a respetar el contenido del original. El Boletín de la SETS no acepta la responsabilidad de las afirmaciones realizadas por los autores. 3. Los manuscritos se enviarán por una de estas dos vías: – Por correo postal, por triplicado, acompañados de un disquette o CD conteniendo el documento en formato WORD, junto con una carta de presentación en la que se solicite el examen de los mismos para su publicación en alguna de las secciones de la Revista con indicación expresa de tratarse de un trabajo original, no haber sido publicado excepto en forma de resumen y que sólo es enviado al Boletín de la SETS. La dirección es: Dr. José Manuel Cárdenas. Centro Vasco de Transfusión. Zuatzu, 4 - bajo. 20018 – SAN SEBASTIÁN. – Por correo electrónico a la dirección cardenas.jm@infonegocio. com incluyendo la carta de presentación. j Normas de publicación Boletín de inscripción de la SETS Remitir a: SETS – C/ Marià Cubí, 4 – 08006 Barcelona Tel. 932 388 777 – Fax 932 387 488 [email protected] DATOS PERSONALES 1. Apellidos y nombre:_____________________________________________________________________________________ 2. Domicilio particular:___________________________________________________________ D.P.:_____________________ Localidad:_________________________________ Provincia:__________________________ Teléfono:__________________ Email:____________________________________ DATOS DE LA INSTITUCIÓN O LUGAR DE TRABAJO 3.Denominación_________________________________________________________________________________________: Dirección:_________________________________________________________________________ D.P.:________________ Localidad:_________________________________ Provincia:__________________________ Teléfono:__________________ E-mail____________________________________ 4. Indique la dirección preferida para su correspondencia: c Particular c Laboral 5. Marque si desea recibir publicidad de las empresas del sector: c SI c NO CURRICULUM DEL SOLICITANTE: Profesión:____________________________________ Título:_________________ Grado académico:_______________________ Especialidad:___________________________________________ Otros títulos:________________________________________ Puesto que ocupa en su organización:_________________________________________________________________________ Áreas principales de trabajo:________________________________________________________________________________ Otros puestos desempeñados con anterioridad y fechas:_________________________________________________________ SOCIOS QUE AVALAN SU SOLICITUD DE INGRESO EN LA SETS: A) Apellidos y nombre:________________________________________________ Lugar de trabajo:____________________________________________________ Provincia:______________________________ B) Apellidos y nombre:________________________________________________ Lugar de trabajo:____________________________________________________ Provincia:______________________________ De ser admitida mi solicitud, declaro aceptar los estatutos de la SETS y comprometerme a su cumplimiento. Adjunto orden a mi entidad bancaria para el cobro de las cuotas de la SETS. ! Fecha:________________________________________________ Firma:_____________________________________________ Sr. Director: Entidad:____________________________________________________________ Oficina:________________________________ Domicilio:________________________________________ Localidad:______________________ Provincia:_________________ Autorizo el cobro de los recibos que con cargo a mi cta. nº:_______________________________________________________ de esa entidad, pase periódicamente la Sociedad Española de Transfusión Sanguínea. Fecha:________________________________________________ Firma:_____________________________________________ NOTA: Los datos que nos facilite el usuario se incorporarán a un fichero de Grupo Pacífico, inscrita en el Registro General de Protección de Datos (Agencia de Protección de datos). Grupo Pacífico es una mera depositaria del fichero de datos, la propiedad pertenece a la SETS y lo utilizará con el fin exclusivo de mantener informado al usuario de actividades relacionadas con la Sociedad Española de Transfusión Sanguínea y Terapia Celular. De conformidad con la Ley Orgánica 15/1999 de Protección de Datos de Carácter Personal. Cualquier usuario puede ejercitar los derechos de oposición, acceso, rectificación y cancelación de los datos facilitados dirigiéndose por escrito al siguiente domicilio: Grupo Pacífico, Marià Cubí, 4. 08006 Barcelona. 29 Agenda Agenda de eventos Todos los asociados que deseen ver publicados en la Agenda los eventos que organicen o tengan noticia de ellos, se ruega comunicarlo a: [email protected] 2011 - 2012 Æ A ABB Annual Meeting. San Diego, California. EEUU 22 – 25 de octubre de 2011-08-31 Æ 53 Reunión Nacional de la SEHH. Zaragoza 27 – 29 de octubre de 2011 Æ 23 Congreso de la SETS. Zaragoza 6 – 9 de junio de 2012 Æ 3 2nd International Congress of the ISBT. Cancún, México 7 – 12 de Julio de 2012 Æ 2 2nd Regional Congress of the ISBT, Taipei, Taiwan 20 – 23 de noviembre de 2011 Æ A nnual NATA Symposium. Copenague, Dinamarca 12 – 13 de abril de 2012 Visita nuestra web: www.sets.es 30 Además la SETS informa sobre varios cursos ya abiertos o en preparación que se pueden consultar a través de la página web de la Sociedad (www. sets.es) pulsar la sección Programa Formativo 2011. Flexibilidad sin precedentes. stat (urgencias) El poder para incrementar la productividad. La flexibilidad de priorizar, con un acceso continuo real, para un optimo control de la carga de trabajo. La velocidad de ejecución con resultados fiables. diga hola a neo. Para poner a trabajar para usted la última innovación en medicina transfusional o para saber mas, contacte con su representante local de ventas o visite www.ImmucorNeo.com ©2010 Immucor, Inc.