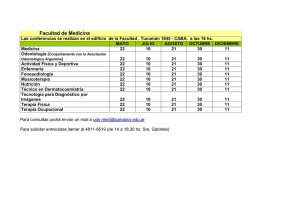
Módulo 2: Banco de Tejidos. Terapia celular y tisular
Anuncio

plan docente Módulo 2: Banco de Tejidos. Terapia celular y tisular Coordinador: Dr. Joan García López Profesores: Dr. Jordi Barquinero Dr. Joan García López Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Presentación 2. Objetivos 3. Contenidos 4. Actividades 5. Evaluación y calendario 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Presentación En los últimos años hemos asistido, por una parte a un crecimiento explosivo en el conocimiento sobre los tejidos, la biología de las células madre (CM), y la inmunología, y por otro a una serie de avances tecnológicos que, en conjunto, se han materializado en la aparición de novedosas formas de terapia celular (TC) y tisular, muchas de ellas todavía experimentales, pero que podrían convertirse en rutinarias en un futuro cercano. La TC es la principal herramienta en que se basa la denominada medicina regenerativa, una joven disciplina que promete remedios contra males tan comunes como la cirrosis hepática, la diabetes mellitus o la enfermedad de Parkinson. Se ha descrito la presencia de CM en prácticamente todos los tejidos adultos, así como la posibilidad de generar células “embrionarias” a partir de células adultas, mediante técnicas de transferencia nuclear. Se han investigado y caracterizado las condiciones óptimas para cultivar distintos tipos celulares en condiciones que permitan su expansión y/o su diferenciación hacia linajes específicos. Se han descubierto nuevas fuentes de células progenitoras como la sangre de cordón umbilical (SCU), un material que hasta hace pocos años era considerado de deshecho, o el tejido adiposo como una extraordinaria fuente de progenitores mesenquimales. Los avances tecnológicos también han contribuido a mejorar la obtención, la manipulación y el almacenamiento de los productos celulares o tisulares para su aplicación clínica, lo que ha redundado en un mayor número de indicaciones y en una mejora de los resultados terapéuticos. Muchos de estos “nuevos” productos celulares ya están en este momento siendo utilizados en la clínica humana, en algunos casos de una manera prácticamente rutinaria, como los trasplantes de SCU, o bien de forma experimental, como el empleo de células mesenquimales en la regeneración ósea o de cartílagos, o como agentes inmunomoduladores en el tratamiento de la enfermedad del injerto contra el huésped tras un trasplante alogénico de progenitores hematopoyéticos. Al lado de estos productos, los bancos de tejidos, una actividad ya “clásica”, mantienen su vigencia, con una utilización cada vez mayor de tejidos 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 procedentes de donantes. Ello ha motivado el desarrollo de estrategias específicas de promoción, donación, obtención, procesamiento y control de calidad. La enorme complejidad de esta disciplina nos ha obligado a dividirla en 6 Unidades Didácticas (UD), como veréis en el apartado de contenidos. Esperamos que las disfrutéis. 2. Objetivos El objetivo general es que los alumnos se familiaricen con algunos conceptos básicos y técnicos sobre células y tejidos, que adquieran una visión amplia de lo que representa su empleo en la clínica humana, las bases de la medicina regenerativa, y finalmente los aspectos legales que afectan al empleo de los productos celulares como tratamientos en enfermedades humanas. Los objetivos específicos para cada UD son: UD1. Conceptos generales sobre CM. - Familiarizarse con los aspectos básicos y aplicados de los distintos tipos de CM. UD2. Terapias celulares consolidadas. - Conocer las principales formas de terapia celular que se aplican en la clínica humana como tratamientos consolidados. En esta unidad se trataran las manipulaciones de célula progenitoras hemopoyéticas, el autoimplante de queratinocitos y regeneradores dérmicos (Adela Miralles), el trasplante de islotes pancreáticos y el autoimplante de condrocitos (Luciano Rodríguez). UD3. Terapias celulares experimentales. - Familiarizarse con los aspectos básicos de las formas de terapia en fase investigacional. Se abordará la terapia génica (Jordi Barquinero), la inmunoterapia (Ramón Gimeno), diversos aspectos 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 de la medicina regenerativa (Luciano Rodríguez) y la ingeniería tisular (Jordi Cairó). UD4. Banco de tejidos. - Adquisición de conocimientos sobre la donación y obtención de tejidos, la selección de donantes y receptores, temas de organización y logística (Flora Moya), y sobre implantes tisulares y sus aplicaciones (Adela Miralles). UD5. Banco de Sangre de Cordón Umbilical. - Familiarizarse con los aspectos técnicos y organizativos de un banco público de SCU, el programa de donación y obtención, el procesamiento, validación, almacenamiento, gestión de datos, suministro y el propio trasplante (Marta Torrabadella). UD6. Control de calidad y aspectos legales. - Conocer la legislación vigente que regula las actividades de los Bancos de Tejidos y producción celular. Conocer las distintas recomendaciones de actuación de sociedades científicas afines (Adela Miralles). 3. Contenidos UD1. Células madre (5 horas). Dr. Jordi Barquinero Dr. Gregorio Martín UD2. Terapia celular. Terapias consolidadas (18 horas). Obtención de progenitores hematopoyéticos. Manipulaciones ex vivo no genéticas. Técnicas de criopreservación. Descongelación e infusión de progenitores hematopoyéticos. Controles de calidad del procesamiento celular (Gregorio Martín, 10 horas). 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Otros (Luciano Rodríguez, Adela Miralles y Marta Torrabadella, 8 horas): Autoimplante de queratinocitos y regeneradores dérmicos Trasplante de islotes pancreáticos Autoimplante de condrocitos UD3. Terapias experimentales (Jordi Barquinero, Ramón Gimeno, Luciano Rodríguez y Jordi Cairó, 13 horas) Terapia génica Inmunoterapia Medicina Regenerativa Ingeniería Tisular UD4. Banco de tejidos (Adela Miralles y Flora Moya, 13 horas) Donación y obtención de tejidos. Selección de donantes y receptores: organización y logística. Técnicas de procesamiento y criopreservación. UD5. Banco de sangre de cordón umbilical (Marta Torrabadella y Joan García, 8 horas). Programa de donación y obtención. Procesamiento. Evaluación y validación. Almacenamiento. Gestión de datos. Suministro y trasplante. UD6. Legislación, acreditación y aseguramiento de la calidad (Gregorio Martín, Adela Miralles, Marta Torrabadella y Flora Moya, 5 horas) 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4. Actividades Se efectuará una actividad específica para cada unidad docente, que incluirán discusiones de casos prácticos, debates, ejercicios, etc, que se irán programando durante el desarrollo del módulo. 5. Evaluación En cada unidad didáctica se incluirán ejercicios de autoevaluación. Al final del módulo se realizará un examen tipo test de respuesta múltiple. En la evaluación final también se tendrá presente la participación activa en el programa. 7 Unidad didáctica 1: Células madre Dr. Jordi Barquinero Dr. Gregorio Martín Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular. Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Células madre. Generalidades 4. Células madre embrionarias 5. Células madre adultas 5.1. Células progenitoras adultas multipotentes (Multipotent Adult Progenitor Cells o MAPC) 5.2. Otras CM adultas 5.3. Transdiferenciación: una historia de verdades a medias 6. Células madre hematopoyéticas (CMH) 7. Células Madre Mesenquimales 7.1. Definición y nomenclatura. 7.2. Localización 7.3. Obtención 7.4. Unidades formadoras de colonia de fibroblastos (CFU-F) 7.5. Morfología y ciclo celular 7.6. Inmunofenotipo 7.7. Expansión 7.8. Diferenciación 7.9. MSC y sistema inmune 7.10. Comentarios finales sobre las CMM 8. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción Aunque el concepto teórico de células madre (CM) o troncales es muy antiguo, y algunas de ellas se vienen utilizando terapéuticamente desde hace décadas (p.ej. el trasplante de médula ósea o de progenitores hematopoyéticos), en los últimos 10 años se ha producido una auténtica avalancha de nuevos conocimientos, entre los que destaca la derivación y el cultivo de las células embrionarias humanas, la definición de condiciones que permitan su proliferación in vitro prácticamente indefinida, y su diferenciación en distintos linajes, así como el descubrimiento y caracterización de CM en los tejidos adultos, habiéndose llegado en algunos casos a la aparición de novedosas aplicaciones terapéuticas de dichas células. En esta unidad didáctica no se ha pretendido hacer un tratado exhaustivo sobre CM, sino plasmar unas pocas nociones, las que hemos creído más relevantes teniendo siempre en cuenta la aplicabilidad práctica del uso de las CM en medicina. 2. Objetivos Después de estudiar esta unidad, el alumno debería de ser capaz de: - Conocer los aspectos básicos de las CM, diferenciar los distintos tipos de CM, tanto embrionarias como adultas, y tener nociones de las principales aplicaciones derivadas del empleo de las CM en la clínica humana, así como de las perspectivas futuras de la investigación con dichas células. - Estar familiarizado con los aspectos básicos y aplicados de los distintos tipos de CM. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Células madre. Generalidades Aunque por el momento la investigación en células madre (CM) no es más que una puerta que se está abriendo y que podría conducir a la curación de algunas enfermedades, lo cierto es que las primeras incursiones en el tema están planteando muchas más preguntas que respuestas, y han creado una agria polémica entre partidarios de permitir la investigación y el uso terapéutico de células procedentes de embriones humanos y los de vetarlas, que a su vez priorizan que se investigue en células de origen somático (adulto). En su definición clásica, CM serían aquéllas que tienen el potencial para generar células maduras de distintos linajes a la vez que se autorrenuevan. En la práctica, las CM se definen por su capacidad de repoblación in vivo, y éste es el principal criterio para demostrar experimentalmente su presencia y funcionalidad. Hasta la fecha se han descrito varios tipos de CM, en función de su origen (embrionario o adulto), de su grado de diferenciación (potencialidad, plasticidad), o del tejido en que se encuentran (CM neurales, CM cutáneas, etc.). La ontogenia o desarrollo embrionario a partir de una sola célula es la prueba más definitiva del potencial de las CM embrionarias. De hecho, las CM embrionarias se consideran totipotentes pues cada una de ellas es capaz de generar los aproximadamente 200 tipos de tejido de un humano además de los tejidos extraembrionarios. Las CM serían pluripotentes si pueden generar cualquier estirpe celular del embrión pero no los tejidos extraembrionarios; multipotentes si sólo pueden dar lugar a un subconjunto de tipos celulares, oligopotentes cuando este subconjunto es más reducido (estas definiciones son un tanto arbitrarias), o unipotentes si sólo pueden generar un tipo celular. Una simplificación del concepto de CM sería el término de progenitor o célula progenitora, que se refiere exclusivamente a una célula capaz de generar otras más diferenciadas. En función de su procedencia, de embriones o de tejidos diferenciados, podemos establecer una primera clasificación de éstas en CM embrionarias y CM adultas. Se puede ampliar la información sobre el tema en: http://es.wikipedia.org/wiki/C%C3%A9lula_madre 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4. Células madre embrionarias Las células de la masa interna del blastocisto de un embrión humano de 5 a 7 días se denominan células ES (embryonic stem cells), y a ellas nos referimos cuando hablamos de CM embrionarias. En este período, el embrión todavía no ha formado las tres capas embrionarias (ectodermo, mesodermo y endodermo) y dichas células conservan su totipotencialidad. Las células ES de ratón se han venido cultivando con éxito desde hace 20 años, pero las condiciones para cultivar las humanas se describieron en 1998. Las células ES murinas pueden proliferar indefinidamente manteniendo su estado indiferenciado en medios definidos que contengan el factor de crecimiento LIF (leukemia inhibitory factor) u otros factores. Si se modifican las condiciones de cultivo, p. ej. retirando el LIF o añadiendo determinados factores de crecimiento, estas células toman decisiones y sufren procesos de diferenciación, habiéndose descrito la generación de linajes celulares de cualquiera de las tres capas embrionarias. Figura 1 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sobre el papel, la posibilidad de disponer de cantidades virtualmente ilimitadas de estas células, expandidas en cultivo, y de diferenciarlas a voluntad mediante factores de crecimiento en hepatocitos, neuronas, cardiomiocitos o células beta productoras de insulina, además de resolver de un plumazo la escasez de donantes, podría convertirse en una herramienta para tratar dolencias tan prevalentes como la insuficiencia hepática, la enfermedad de Parkinson o la diabetes. Sin embargo, a pesar de que los medios de comunicación nos prometen a corto plazo éstas y otras muchas maravillas, los científicos y los estudiosos del tema no son tan optimistas. Sin entrar en el terreno de la ética, y de si está o no justificado el empleo embriones humanos con finalidades terapéuticas, el uso clínico de CM embrionarias debe antes resolver dos graves inconvenientes o limitaciones todavía no resueltas. El primero es la capacidad tumorigénica de las CM no diferenciadas (pueden formar teratomas) cuando se implantan en individuos adultos. Por ello es imprescindible que absolutamente todas las células que se vayan a trasplantar estén correctamente diferenciadas. El otro gran inconveniente es que, al no tener nadie sus propias células embrionarias disponibles para su uso terapéutico, hay que recurrir a células de otros embriones, por tanto no histocompatibles, con todas las limitaciones de los trasplantes de órganos (necesidad de inmunosupresión, etc). Una posible vía para resolver esta limitación es la clonación terapéutica, que consistiría en transferir el núcleo de una célula somática del propio individuo a un oocito de una donante (transferencia nuclear) para dar lugar a un embrión genéticamente similar al donante del núcleo, y cuyas células podrían expandirse en cultivo para luego diferenciarlas hacia el linaje deseado. Este procedimiento es análogo a la clonación reproductiva, la diferencia es que en esta última el oocito sería transferido al útero para dar lugar a un individuo completo. Este procedimiento es tremendamente ineficiente y mal conocido. De hecho, en las pocas especies en que se ha logrado, los individuos obtenidos de esta manera en su inmensa mayoría fallecen intraútero, y los escasos que no lo hacen padecen casi indefectiblemente el denominado large offspring syndrome (LOS), caracterizado por el tamaño anormalmente grande de las placentas y los fetos (macrosomía). Además, los ratones generados mediante clonación reproductiva tienden a la obesidad, tienen más incidencia de tumores y de muerte prematura. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Estas alteraciones son debidas, no a mutaciones genéticas, sino a fallos en la reprogramación epigenética de los núcleos transferidos a los oocitos (1). No hay que olvidar que los genes únicamente contienen las instrucciones codificadas, pero para decidir qué genes se expresan o dejan de hacerlo en cada célula y en qué momento, también son importantes las influencias externas del microambiente, así como otros factores llamados epigenéticos, como pueden ser el estado de metilación del propio DNA, o el grado de acetilación de las histonas. Esta inestabilidad epigenética no sólo afectaría a los individuos clonados, sino también a las células ES cultivadas y a su progenie generada in vitro. Además, desde el punto de vista de la histocompatibilidad, se ha descrito que ciertos polimorfismos en los genes mitocondriales, que seguirían siendo de la donante del oocito (ya que sólo se ha transferido el núcleo celular), podrían resultar en diferencias antigénicas capaces de inducir respuestas inmunes en los receptores. En este momento la investigación con células embrionarias es motivo de controversia y de un intenso debate social e institucional a nivel mundial, con sus defensores y sus detractores, que aducen razones de tipo ético y/o religioso para que se prohíba el uso de embriones humanos para este tipo de aplicaciones. Por el momento, varios países como Gran Bretaña, Suecia, Bélgica, Corea del Sur o España han aprobado leyes favorables al uso investigacional de las CM embrionarias, mientras que otros como Estados Unidos mantienen el veto legal a dicho uso. En general, existe unanimidad en que no se permita la clonación reproductiva, pero el debate se centra en si se permite o no la clonación terapéutica, o que se investigue con los embriones criopreservados “sobrantes” de los bancos de embriones y que ya no van a ser implantados. Con todo, es de esperar que a corto o a medio plazo se legalice su uso investigacional en un número creciente de países y que, una vez resueltos los problemas técnicos actuales, se diseñen y se lleven a cabo ensayos clínicos basados en el uso racional de estas células. En cuanto a la disyuntiva entre CM embrionarias y CM adultas para su empleo en medicina regenerativa, no se corresponde con ninguna realidad científica. Es cierto que en este momento se desconoce cual de los dos tipos de CM tendrá mayor aplicabilidad terapéutica. Ambas tendrán que demostrar sus ventajas y sus inconvenientes, y lo más probable es que unas terminen resultando óptimas 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 para unas aplicaciones y otras para otras. Para los detractores del uso de las CM embrionarias, la raíz del problema radica en el origen de éstas. En este momento ya existen muchas líneas celulares derivadas de embriones humanos. La opinión mayoritaria y el sentido común nos dice que deben investigarse ambas vías, superando cualquier prejuicio ya que, en ciencia, el único avance posible es el que deriva del conocimiento contrastado. No hay que olvidar que, a pesar de los fascinantes avances en el conocimiento de las CM y de la terapia génica, su aplicabilidad clínica es todavía muy limitada. El potencial existe sobre el papel, pero hay que investigar mucho más y no sobrevalorar las hipotéticas ventajas de su uso terapéutico. Es tanto lo que falta por conocer sobre estas células que no podemos permitirnos el lujo de cerrarnos puertas que se están empezando a abrir, sin antes saber lo que esconden y lo que nos pueden aportar. Tabla 1: Principales diferencias entre células madre embrionarias y adultas CM embrionarias CM adultas Embriones humanos (éticamente controvertido) Adultos (sin problemas éticos) Cultivables in vitro Sí Sí Pluripotenciales in vitro Sí Sí Pluripotenciales in vivo (inyección en blastocisto) Sí Sí Tumorigénicas en adultos Potencialmente sí No Sí No Sí (alogénicas) No (autólogas) Origen Potencial terapéutico demostrado Inmunogenicidad 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Células madre adultas En la mayoría de órganos y tejidos de los individuos adultos se han descrito, con mayor o menor detalle, distintos tipos de CM. Aunque se sabía de la existencia de CM en los tejidos sujetos a autorenovación (como la piel o el tubo digestivo), las dificultades en su estudio se deben en parte a su extrema rareza, a la imposibilidad de distinguirlas morfológicamente de sus homólogas maduras y a los problemas técnicos para cultivarlas ex vivo o trasplantarlas. En la regulación de las CM juega un papel crucial el microambiente en que se encuentra, el lugar anatómico conocido como nicho (2). Las primeras CM adultas que se conocieron con detalle fueron las hematopoyéticas (CMH), pero a éstas dedicaremos el siguiente capítulo. Respecto a las no hematopoyéticas, las primeras que se identificaron y caracterizaron con cierto detalle fueron las neurales, hace más de 10 años. Así, se comprobó que el cerebro adulto, un órgano que hasta entonces se había considerado incapaz de regenerarse, contenía unos progenitores sumamente versátiles capaces de convertirse en neuronas, oligodendrocitos o astrocitos. Se les denominó CM neurales (NSC o neural stem cells), hoy consideradas una de las herramientas más prometedoras para tratar diversas enfermedades neurológicas. Las CM neurales pueden ser transducidas de forma estable con genes terapéuticos y reimplantadas en el sistema nervioso central (SNC). Se ha comprobado que tras el implante pueden migrar a puntos lejanos del SNC y diferenciarse a varios de los linajes propios del SNC. Otra fuente de progenitores neurales es la llamada glía envolvente de bulbo olfatorio, que ya ha demostrado tener potencial terapéutico. Con todo, por el momento los niveles de regeneración que se observan con el uso de CM neurales en la mayoría de modelos estudiados todavía distan mucho de tener utilidad terapéutica en la clínica humana. 5.1. Células progenitoras adultas multipotentes (Multipotent Adult Progenitor Cells o MAPC) En el año 2001 se describió la presencia en la médula ósea humana y murina de un nuevo tipo de células pluripotenciales, que se denominaron células progenitoras adultas multipotentes (Multipotent Adult Progenitor Cells o MAPC), y 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 que poseían algunas semejanzas con las CM embrionarias. Se hallan en una frecuencia aproximada de 1 entre 108 células (100 veces menor que las CMH) y tienen un fenotipo CD45-, CD44-, HLA de clase I- y II-, y c-kit-. Pueden ser cultivadas y expandidas in vitro durante decenas de pases sin aparentes cambios morfológicos, fenotípicos ni funcionales detectables y, tras cambiar las condiciones de cultivo añadiendo determinados factores de crecimiento, se diferencian a linajes tan diversos como el hepático, el neuronal o el mesenquimal (3). Se ha comprobado que, tras la inyección de MAPC de ratón marcadas genéticamente en el blastocisto, una vez desarrollado el animal, las células marcadas habían contribuido a formar distintas clases de tejidos, incluyendo células sanguíneas, sistema nervioso, hígado, músculo y pulmón. Además, MAPC inyectadas en ratones inmunodeficientes adultos (NOD/scid) generaron quimerismo hematopoyético en múltiples órganos y tejidos. 5.2 Otras CM adultas Además de las MAPC, en la médula ósea existen al menos otras dos poblaciones de CM distintas de las hematopoyéticas: las mesenquimales y las endoteliales. Las primeras se han considerado tradicionalmente células estromales, meramente de soporte, un concepto muy impreciso. De ellas se hablará con mucho más detalle en otro capítulo de este mismo módulo. En cuanto a las CM endoteliales, tienen un fenotipo CD133+, Flk-1+, y muchas son también CD34+, marcador que comparten con las CMH. Las CM endoteliales pueden circular por el torrente sanguíneo para convertirse en células endoteliales maduras donde y cuando hay necesidad de formar nuevos vasos. El tejido muscular también contiene distintos tipos de células progenitoras. Las mejor conocidas son las células satélite o mioblastos, que pueden ser expandidas en cultivo y trasplantadas para generar células musculares maduras. También se han descrito poblaciones muy minoritarias de células SP, que expresarían CD45 y tendrían potencial hematopoyético y miogénico. 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Otros tejidos en los que se han identificado CM son el hígado, la piel, el páncreas, la próstata, el riñón, el intestino o el tejido adiposo subcutáneo, entre otros. 5.3 Transdiferenciación: una historia de verdades a medias Tradicionalmente se ha aceptado como un dogma que muchos órganos y tejidos adultos sujetos a renovación celular contienen una reserva local de CM, pero que éstas poseen un cierto grado de diferenciación, estando comprometidas a convertirse exclusivamente en células maduras propias del tejido u órgano en cuestión. Así, las CM de la piel sólo podían dar lugar a piel, las de médula ósea generaban células sanguíneas, y las del hígado sólo se convertirían en hepatocitos. La transdiferenciación es el fenómeno por el que CM de un tejido adulto, teóricamente comprometidas para convertirse en células maduras de aquél tejido, se convierten en células maduras de un tejido distinto. La misma palabra indica una transgresión del dogma sobre la irreversibilidad de la diferenciación celular. Hasta 1997 la frontera entre las tres capas embrionarias se consideraba infranqueable, pero a partir de esa fecha comienzan a aparecer observaciones que sugerían que células de médula ósea podían generar o regenerar tejidos no hematopoyéticos como el miocárdico, el hepático, el cerebral o el óseo. La médula ósea y el SNC contienen las CM que más plasticidad han demostrado experimentalmente. De hecho, para algunos investigadores la médula ósea podría actuar como un reservorio de CM pluripotenciales que en caso de necesidad podrían migrar y transformarse en CM propias de otros tejidos, o bien directamente en células maduras. En este sentido, recientemente se ha comprobado que al menos una fracción de las células ovales del hígado y de las células satélite del músculo expresan CD45 lo que muy probablemente indica un origen hematopoyético, una afirmación en concordancia con el hecho que las evidencias de transdiferenciación mejor 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 contrastadas son las observadas entre la médula ósea, el hígado y el músculo esquelético (ver figura 2). Figura 2 Con todo, en estos últimos tiempos, se han publicado numerosos estudios documentando o desmintiendo conversiones de unos tipos celulares a otros. Para explicar la aparente transdiferenciación observada en estos estudios se han postulado al menos tres mecanismos. El primero sería la presencia en los injertos (p. ej. de médula ósea) de progenitores más inmaduros, con potencialidad para generar tipos celulares distintos (p. ej. los llamados hemangioblastos, progenitores comunes hematopoyéticos y endoteliales). Alternativamente, podría ser que las poblaciones de CM con las que se trabaja 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 experimentalmente (p. ej. de médula ósea) sean en realidad mezclas heterogéneas y contengan distintos tipos de CM. (p. ej. hematopoyéticas, mesenquimales y endoteliales) (4). En este sentido, muchos de los primeros estudios publicados fueron realizados trasplantando médula ósea total, y hoy se sabe que ésta contiene CM de estos tres tipos, por lo que no se puede descartar que la aparente transdiferenciación tras el trasplante de médula ósea total sea debida en realidad a la diferenciación de estas otras CM o de CM más inmaduras (precursoras comunes). Otro posible mecanismo es que la aparente transdiferenciación sea en realidad consecuencia de la fusión entre CM y células maduras de otra estirpe distinta. Dicha fusión generaría una célula con dos o más núcleos (heterocarión) que poseería marcadores fenotípicos de ambos tipos celulares (5). Se ha descrito que la aparente transdiferenciación de células de médula ósea a hígado o a miocardio podría deberse fundamentalmente a fenómenos de fusión celular (ver figura 3). Figura 3 Para reducir la posibilidad que sean otras CM no hematopoyéticas las responsables de esta aparente transdiferenciación muchos grupos han realizado estudios trasplantando CMH más o menos purificadas (basándose en el aislamiento de células con fenotipo más o menos inmaduro), en general con resultados superponibles a los obtenidos con médula ósea total. Dado que en la separación celular nunca se puede garantizar una pureza del 100%, nos quedarnos con la misma duda, que otras CM contaminantes puedan ser responsables de la aparente transdiferenciación observada. 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 A la vista de todo lo dicho, en este momento los nuevos conocimientos obligan, si no a reconsiderar la validez de los resultados publicados hasta ahora, cuanto menos a juzgar con mucha más cautela todo lo que se diga al respecto, especialmente en foros o fuentes no científicas como son los medios de comunicación, y sin que ello implique que las CM hayan perdido potencial o futuro alguno para la terapia celular o la medicina regenerativa (6). 6. Células madre hematopoyéticas (CMH) El trasplante hematopoyético ha constituido durante casi medio siglo la prueba más palpable de la existencia de CMH adultas. De hecho, hasta hace poco más de una década, hablar de CM adultas era referirse casi inequívocamente a la médula ósea o a las CMH, ya que fueron éstas las primeras en conocerse con cierto detalle y en ser aplicadas al tratamiento de enfermedades humanas (trasplante de médula ósea). Las CMH se encuentran en la médula ósea adulta en una frecuencia aproximada de 1 entre 105-106 células, expresan el marcador panleucocitario CD45 y tradicionalmente también se han considerado positivas para el marcador CD34, presente en el 1% de las células de la médula ósea, mientras que serían negativas o de baja expresión para CD38, para el receptor del factor de células madre (CD117 o c-kit), así como para todos los marcadores propios de los distintos linajes hematopoyéticos (Lin-) (ver tabla 2). En el ratón, quizás la especie en que están mejor caracterizadas, las CMH tienen un fenotipo CD45+, CD34-, Lin-, Sca-1+ y c-kit+. Al ser el hematopoyético un tejido líquido trasplantable que se puede cultivar y manipular ex vivo, las CMH se han convertido en una herramienta insustituible para numerosas formas de terapia celular, además del trasplante hematopoyético (p. ej. para la generación de células dendríticas en protocolos de inmunoterapia), así como en una de las dianas preferidas para la terapia génica. 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Tabla 2 6.1 Células SP Las células SP (Side Population) constituyen una rara subpoblación celular (en la médula ósea humana normal representa menos del 0.1 % del total de las células nucleadas). Inicialmente descrita en 1996 por el grupo de M. Goodell, se definen por su capacidad para extruir el colorante vital Hoechst 33342 (Ho342) (7). Este fluorocromo es un agente intercalante del DNA que se excita óptimamente con radiación ultravioleta y tiene una emisión dual en el azul y en el rojo. Puede difundir pasivamente a través de la membrana celular, por lo que las células que lo extruyen (expulsan al exterior) acumulan menos fluorocromo intracelularmente y emiten con una menor intensidad en ambos canales (azul y rojo) tras ser excitadas con luz ultravioleta, dando lugar a una población con una distribución característica en los histogramas de citometría de flujo (ver figura 4). 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 4 Esta población está enriquecida unas 1000 veces en capacidad de repoblación hematopoyética respecto a la médula ósea total, aunque no todas las células SP de la médula ósea son progenitores hematopoyéticos, pues también se ha descrito que algunas células NK o de la serie roja pueden también tener un fenotipo SP. Se han encontrado células SP en prácticamente todos los tejidos y en todas las especies de mamíferos estudiadas. Aunque el Ho342 puede ser extruido por distintos transportadores de membrana, en la población SP de la médula ósea, la capacidad de extrusión se describió mayoritariamente asociada al transportador ABCG2 (o bcrp), una molécula que extruye distintos tipos de genotóxicos al exterior de las células y que también se expresa en otros tejidos como la placenta, el intestino o la vía biliar, en general lugares donde se acumulan o sufren una mayor exposición a toxinas de manera natural (vía biliar) o que requieren una especial protección (placenta, médula ósea). En este momento se sabe que ni todas las CM de la médula ósea tienen el fenotipo SP ni todas las células SP son CM, si bien se desconoce si las células SP presentes fuera de la médula son en realidad progenitores inmaduros equivalentes a los medulares. 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 7. Células Madre Mesenquimales 7.1 Definición y nomenclatura Las Células Madre Mesenquimales (MSC) han despertado un gran interés en los últimos años en la comunidad científica debido a sus potenciales aplicaciones terapéuticas (8). Sin embargo, distintos autores han empleado diferentes criterios para definirlas, sin que exista una definición aceptada por todos. Esto hace que dichas células pueden encontrarse en la literatura con diferentes nombres: Célula Madre Mesenquimal (MSC): Célula Progenitora Mesenquimal (MPC), Célula del Estroma Medular (MSC), Unidad Formadora de Colonias de Fibroblastos (CFU-F), Fibroblastos de Médula Ósea.o Célula Madre No Hematopoyética. Recientemente, un comité de la Sociedad Internacional de Terapia Celular (ISCT) haya establecido unos criterios mínimos que dichas células deben cumplir para ser catalogadas como tales. 1.- las MSC deben ser adherentes al plástico cuando se mantienen en condiciones de cultivo estándar. 2.- las MSC deben expresar los antígenos de membrana (en más del 95% de la población celular) CD105, CD73, CD90 y no deben expresar en su superficie (en menos del 2% de la población celular) CD45 (marcador panleucocitario), CD34 (marcador de células progenitoras hematopoyéticas y endoteliales), CD14 o CD11b (expresado por monocitos y macrófagos), CD79-α o CD19 (marcadores de linfocitos B) y HLA-DR. 3.- las MSC deben poder diferenciarse in vitro a células del tejido óseo (osteoblastos), adiposo (adipocitos) y cartilaginoso (condroblastos). 7.2 Localización Las MSC se localizan en diversos tejidos, siendo su frecuencia mayor en médula ósea (1 por cada 105 células mononucleadas). También se han descrito en la circulación durante la vida fetal, en la sangre placentaria y en la sangre periférica 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 post-natal, aunque su frecuencia en estas localizaciones va disminuyendo desde la vida fetal a la adulta. También se han localizado en otros tejidos, como el tejido adiposo, una fuente rica en MSC. 7.3 Obtención Las MSC pueden, por tanto, obtenerse de distintas fuentes, aunque los tejidos más empleados para su obtención son la médula ósea y el tejido adiposo. La obtención de médula ósea implica la realización de aspirados, generalmente de las crestas ilíacas, el enriquecimiento de la capa de células mononucleadas (generalmente en gradiente de densidad) y las del tejido adiposo se obtienen tras liposucción y centrifugación para eliminar los adipocitos del sobrenadante. Posteriormente las células son sembradas en placas de cultivo (generalmente a baja densidad) en medio de cultivo apropiado. Tras unos días, las MSC se adhieren al plástico y son separadas de forma fácil del resto de las células no adherentes mediante lavados repetidos. Dichas células están enriquecidas en MSC y, como se ha comentado, esta adherencia es una característica esencial para definir a las MSC como tales. 7.4 Unidades formadoras de colonia de fibroblastos (CFU-F) Cuando las células fuente de MSC se cultivan bajo condiciones apropiadas, se forman diferentes agrupaciones de células (colonias), cada una de las cuales deriva de un solo precursor, llamado CFU-F. Las CFU-F representa el ensayo in vitro para cuantificar la cantidad de MSC obtenidas, si bien no todas las células clonogénicas son verdaderas MSC. 7.5 Morfología y ciclo celular La mayoría de las MSC obtenidas tras cultivo tienen una morfología similar a los fibroblastos, son alargadas, espiculadas. La mayor parte de las MSC se encuentran en fase G0/G1 del ciclo celular (más del 50%), un 10% aprox. en 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 fase G2/M existiendo un subtipo en fase G0, lo que sugiere que dentro del cultivo de MSC existen células con diferente grado de inmadurez. 7.6 Inmunofenotipo En la actualidad no existe ningún marcador de membrana que pueda hacer que las MSC sean aisladas de forma prospectiva. Por tanto, las características a las que nos referimos de las MSC son las de las células obtenidas tras un cultivo “in vitro. Además de los antígenos de membrana antes mencionados y que se emplean para catalogar a las MSC como tales, dichas células también son positivas para los marcadores de membrana CD133, CD10 y HLA de clase I. Otros marcadores negativos en las MSC son las moléculas CD40 y CD40L, CD80 y CD86, moléculas coestimulatorias que intervienen en el reconocimiento inmune y la activación de las células T. 7.7 Expansión Tras la obtención de las MSC, el cultivo primario puede dividirse (tras “despegar” las células de las placas de cultivo mediante tripsina) y resembrarse en placas adicionales (subcultivos). Esto puede hacerse repetidas veces (“pases”), hasta llegar a obtener una gran cantidad de MSC. Esto es, la capacidad de expansión es enorme y con pocos mL de aspirado de médula ósea se pueden llegar a obtener decenas de millones de MSC tras varios pases de cultivo. Además, y lo que es importante, mientras están en expansión, dichas células no parecen perder su capacidad de autorenovación, la potencialidad de diferenciarse en diferentes tejidos, su fenotipo, la estabilidad genética y además sus cromosomas mantienen la longitud de sus telómeros (un signo de inmadurez celular). 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 7.8 Diferenciación Como se ha mencionado, bajo determinadas condiciones de cultivo las MSC pueden diferenciarse in vitro a diferentes linajes, como adipocitos, condrocitos y osteoblastos (son por tanto células madre multipotentes). Además, también se ha descrito su capacidad de diferenciación a estroma de la médula ósea y a músculo esquelético y cardíaco. La jerarquía de diferenciación de las MSC hasta su progenie de células maduras y diferenciadas fue propuesta por Caplan quien lo denominó “proceso mesengénico” y es similar a la del tejido linfo-hematopoyético, de tal forma que desde las MSC más inmaduras, las células se van diferenciando hacia células de un tejido particular hasta dar lugar a la célula madura (ver figura 5), ya sin capacidad de autorenovación. Figura 5 7.9 MSC y sistema inmune Otro aspecto interesante de las MSC es su capacidad antiinflamatoria e inmunomoduladora. Se ha descrito que estas células escapan al reconocimiento inmune e inhiben la respuesta inmune. Las MSC pueden modular las poblaciones mayores del sistema inmune, como son las células presentadoras de antígeno (APCs), los linfocitos T y B y las células NK (natural killer). El hecho de que sean poco inmunogénicas y a su efecto inmunosupresor ha hecho que 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 sean catalogadas como células inmunoprivilegiadas. Si estos datos se confirman, significa que dichas células podrían emplearse a partir de donantes no histocompatibles con el receptor. 7.10 Comentarios finales sobre las CMM En resumen, debido a su fácil obtención, a que pueden obtenerse de diferentes tejidos, a su importante potencial de expansión in vitro, a su capacidad de diferenciarse a distintos linajes mesenquimales y a sus propiedades inmunológicas, las MSC han despertado un gran interés, por todas las aplicaciones clínicas potenciales que pueden tener. Estas aplicaciones van desde la reparación/regeneración de diferentes tejidos dañados (óseo, cartilaginoso, cardíaco, muscular, estroma médula ósea, cierre de fístulas anorectales en la enfermedad de Crohn, etc), como su aplicación en el trasplante hematopoyético, bien para acelerar el implante de los progenitores hematopoyéticos como para tratar o prevenir la enfermedad injerto contra el huésped en el contexto del trasplante alogénico. 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 8. Bibliografía 1. Allegrucci, C., Thurston, A., Lucas, E., and Young, L. 2005. Epigenetics and the germline. Reproduction 129:137-149. 2. Fuchs, E., Tumbar, T., and Guasch, G. 2004. Socializing with the neighbors: stem cells and their niche. Cell 116:769-778. 3. Jiang, Y., Jahagirdar, B.N., Reinhardt, R.L., Schwartz, R.E., Keene, C.D., Ortiz-Gonzalez, X.R., Reyes, M., Lenvik, T., Lund, T., Blackstad, M., et al. 2002. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 418:41-49. 4. Kucia, M., Ratajczak, J., and Ratajczak, M.Z. 2005. Are bone marrow stem cells plastic or heterogenous--that is the question. Exp Hematol 33:613-623. 5. Vassilopoulos, G., and Russell, D.W. 2003. Cell fusion: an alternative to stem cell plasticity and its therapeutic implications. Curr Opin Genet Dev 13:480-485. 6. Spyridonidis, A., Zeiser, R., Follo, M., Metaxas, Y., and Finke, J. 2005. Stem cell plasticity: the debate begins to clarify. Stem Cell Rev 1:37-43. 7. Goodell, M.A., Brose, K., Paradis, G., Conner, A.S., and Mulligan, R.C. 1996. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med 183:1797-1806. 8. Keating, A. 2006. Mesenchymal stromal cells. Curr Opin Hematol 13:419425. 22 Unidad didáctica 2: Autoimplante de condrocitos Dr. Luciano Rodríguez Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Tipos de cartílago 3.1 Cartílago hialino 3.2 Cartílago elástico 3.3 Fibrocartílago 4. Estructura del cartílago articular 5. Biomecánica del cartílago articular 6. Implante autólogo de condrocitos (ACI): 6.1 Evolución histórica 6.2 La técnica quirúrgica 6.3 El cultivo ex vivo de condrocitos 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Introducción El cartílago es un tejido conectivo denso y especializado que forma el esqueleto transitorio en el embrión y persiste en el adulto en articulaciones, tracto respiratorio, costillas y orejas. Casi todos los huesos largos del cuerpo se forman primero en el embrión como cartílago que actúa de plantilla reemplazada posteriormente por hueso (osificación). En el sujeto adulto hay distintos tipos de cartílago que se diferencian en su composición bioquímica, su microestructura molecular, sus propiedades biomecánicas y sus funciones. Así se distinguen: cartílago hialino, elástico y fibrocartílago. 1. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer las bases teóricas de la regeneración de cartílago hialino mediante el implante de condrocitos autólogos - Comprender las limitaciones y requerimientos de esta tipo de terapia celular. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 2. Tipos de cartílago 3.1 Cartílago hialino Se encuentra cubriendo las superficies articulares de la mayor parte de las articulaciones y en los cartílagos costales, los nasales y las paredes de las vías respiratorias. La palabra hialino se deriva del griego hyalos (vidrio). El cartílago hialino aparece como una masa translucida color blanco azuloso en estado natural. Con excepción de los cartílagos articulares, este tejido siempre esta cubierto por pericondrio. El pericondrio es una capa resistente de tejido conectivo denso que envuelve al cartílago, excepto el de la superficie articular. Figura 1 Figura 2 Imágenes disponibles en línia: http://meded.ucsd.edu/hist-img- bank/chapter_2/Slide_13_hyaline/ 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.2 Cartílago elástico Este es semejante al cartílago hialino, excepto que tiene abundantes fibras elásticas en su matriz, además de muchas fibras colágenas delgadas. También esta rodeado por un pericondrio. Este tipo de cartílago se encuentra en los lugares en que se necesita sostén con flexibilidad, como el oído externo, trompa faringotimpanica, epiglotis y algunos cartílagos de la laringe. Figura 3 Figura 4 Imágenes disponibles en línia: http://meded.ucsd.edu/hist-img- bank/chapter_2/Slide_14_elastic/ 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.3 Fibrocartílago Este tipo de cartílago se presenta donde se necesita apoyo firme; se encuentra en los discos intervertebrales. Es el cartílago que rodea la fosa glenoidea del hombro y del acetábulo de la cadera y esta también en los discos interarticulares de las articulaciones esternoclavicular, acromioclavicular y temporomaxilar, así como en la sínfisis púbica. Nunca se presenta solo, sino que se fusiona gradualmente con el cartílago hialino vecino o con el tejido fibroso denso. El fibrocartílago es un tipo transicional entre el cartílago hialino y el tejido conectivo fibroso denso de tendones y ligamentos, sus células tienden a agruparse en cápsulas separadas unas de otras por gruesos haces de fibras colágenas. Figura 5 Figura 6 Imágenes disponibles en línia: http://meded.ucsd.edu/hist-img- bank/chapter_2/Slide_15_fibrous/ 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 El cartílago hialino es el más abundante de la anatomía. Recubre la superficie articular de los huesos, es flexible, elástico, de color blanco nacarado y opalescente. Su grosor varía según la función y el área de cada articulación e incluso en las distintas áreas de una misma articulación. En la rodilla su espesor oscila entre 2 y 3 milímetros y, en condiciones normales, permanece constante hasta la aparición de los fenómenos de fibrilación y erosión que conducen a la degeneración artrósica. La sustancia del cartílago no esta vascularizada y no está conectada a nervios o vasos linfáticos; reciben su nutrición de vasos sanguíneos de tejidos conectivos circundantes mediante difusión a través de la matriz, constituida por una abundante matriz extracelular y un número relativamente bajo de células, los condrocitos. Los condorcitos ocupan aproximadamente un 10% del volumen tisular normal y se sitúan en pequeñas cavidades llamadas lagunas dentro de la matriz. Son células de origen mesenquimal, metabólicamente muy activas y son responsables de la formación, mantenimiento y reparación de la matriz extracelular en la que se encuentran inmersos. La matriz cartilaginosa contiene agua (70%), colágeno (20%) (en su mayoría tipo II (95%), trazas de tipo IX y XI y no contiene colágeno tipo I), proteoglicanos (4-10%), lípidos, componentes inorgánicos, elastinas, integrinas (organización de la matriz). Figura 7 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Estructura del cartílago articular Estructuralmente, el cartílago articular (hialino) está dividido en cuatro capas o zonas morfológicamente distintas: I. una zona superficial, con condrocitos aplanados, en forma de huso, y una matriz con una proporción relativamente alta de colágeno y agua; II. una zona de transición, con condrocitos esféricos, de pequeño tamaño y una matriz con un mayor contenido en proteoglicanos y un menor porcentaje en agua y colágeno; III. una zona radial, que ocupa hasta un 95% del volumen del cartílago articular, con condrocitos de mayor tamaño, más redondeados, metabólicamente muy activos que, a menudo, se disponen en grupos de células autónomos (condronas). IV. una zona calcificada adyacente al hueso, en la que se produce el anclaje del cartílago al hueso subcondral. Figura 8 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4. Biomecánica del cartílago articular Biomecánicamente, en las articulaciones los segmentos óseos proporcionan la rigidez necesaria para la locomoción mientras que el cartílago es el encargado de amortiguar el impacto de las fuerzas. El hueso es unas mil veces más resistente que el cartílago, aunque con deformaciones muy pequeñas, inferiores al 1%, ya puede fracturarse, sin embargo, el cartílago puede soportar deformaciones del 50% o superiores sin aparentes fracturas microscópicas. En general, la rigidez y resistencia del cartílago se relacionan principalmente con el contenido en colágeno y la orientación de las fibras mientras que las propiedades de compresión se relacionan con el contenido en proteoglicanos. Sin duda, las relaciones entre la estructura y la función del cartílago articular dependen de la interrelación de los condrocitos y la matriz extracelular (los condrocitos regulan la síntesis y degradación (turnover) de la matriz). Figura 9 Figura 10 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Las funciones mecánicas del cartílago hialino incluyen la transmisión y distribución de carga (determinada por su capacidad de deformación), suavizar el movimiento de la articulación y lubricar mediante la absorción o exudación de fluido hacia el tejido intersticial. Las moléculas de protoglicanos están muy cargadas negativamente y atraen moléculas de agua hacia el tejido hialino creando una fuerte presión de absorción hasta que satura la capacidad elástica del colágeno en el tejido. En cuanto el cartílago recibe una fuerte presión de forma súbita, la expulsión del agua fuera del tejido confiere la elasticidad necesaria para resistir mecánicamente. Tal y como se apuntaba anteriormente el cartílago articular es un tejido sin aporte vascular, nervioso ni linfático, propiedades condicionan su baja capacidad intrínseca de curación. Cuando se produce una lesión el cartílago no existe respuesta inflamatoria al daño tisular y por lo tanto no se producirá la invasión macrofágica para fagocitar y eliminar el tejido desvitalizado ni la migración de células con capacidad reparadora dentro del área lesionada. Las lesiones condrales no se solventan por sí mismas y con el tiempo pueden progresar a osteoartrosis (enfermedad degenerativa que evoluciona con desgaste gradual del cartílago). Sin embargo, en lesiones profundas del tejido que llegan hasta el hueso subcondral, el flujo de sangre resultante introduce células progenitoras y factores de crecimiento que pueden iniciar un proceso de regeneración. No obstante, el tejido resultante contiene una matriz de colágeno desorganizada y heterogénea con capacidades biomecánicas reducidas. Otros factores como la edad, enfermedad, inestabilidad estructural y predisposición genética afectan la regeneración fisiológica del cartílago. La resolución más adecuada de una lesión condral debería implicar la regeneración con un tejido idéntico al cartílago hialino. La simple reparación supone el relleno con un tejido no idéntico que debería ser capaz de sellar el área defectuosa con una buena adhesión al hueso subcondral y una completa integración al cartílago circundante así como de resistir el desgaste mecánico con el paso del tiempo e incluirse gradualmente en el recambio natural del tejido normal. En este contexto se desarrolla en implante antólogo de condrocitos (ACI). 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Implante autólogo de condrocitos (ACI): 6.1 Evolución histórica El aislamiento y crecimiento de condrocitos en un medio de cultivo lo consiguió por primera vez Smith, en el año 1965. En ese momento se inyectaron estas células experimentalmente en la rodilla de conejo pero no se logró una reparación significativa. En el año 1982, se diseñó e inició en el Instituto Ortopédico de Nueva York un modelo experimental, con un grupo control, en conejos utilizando condorcitos articulares aislados y desarrollados en medios de cultivo. La idea consistía en utilizar condrocitos autólogos como células encargadas de formar cartílago hialino. Los primeros resultados de esta técnica se presentaron en 1984 y se demostró la aparición de un cartílago similar al hialino con un relleno del 80% en el grupo tratado con células. En el grupo control, en el que sólo se trató el defecto con recubrimiento perióstico pero no con células, no se observó relleno de la lesión. Desde ese año se han sucedido numerosos y extensos estudios en animales en la Universidad de Goteborg, en Suecia. Peterson y cols en 1984 y Grande y cols en 1985 presentaron sus resultados con esta técnica en defectos condrales, en conejos, que no afectaban hueso subcondral. En 1985, se planteó la posibilidad de realizar esta técnica en seres humanos y así, en 1987 se llevó a cabo en Suecia el primer trasplante autólogo de condrocitos en una rodilla humana. En 1991 Vacanti y cols producieron cartílago hialino en matrics poliméricas a partir de condrocitos bovinos. En octubre de 1994 Brittberg y cols publicaron en el New England Journal of Medicine los resultados de un estudio piloto realizado con 23 pacientes. Era el primer estudio que publicaba los resultados de este procedimiento aplicado a seres humanos. Actualmente existen productos para la regeneración de cartílago como el Carticel de Genzime, BioSeed de BioTissue o el MACI de Verigen. 11 Más información - Carticel de Genzime: http://www.carticel.com/ - BioSeed de BioTissue: http://www.biotissuetec.com/ - MACI de Verigen: http://biomed.brown.edu/ Courses/BI108/BI108_2004 _Groups/Group01/crMA.htm Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 6.2 La técnica quirúrgica Las indicaciones para la realización del trasplante autólogo de condrocitos están sujetas en lo fundamental a las lesiones aisladas del cartílago que ocurren en sujetos jóvenes después de un rauma deportivo o de otra etiología, con superficies de lesión de entre 2 y 4 cm2 y tengan un grado IV de la clasificación de Oustedbridge. También se seleccionan sujetos en los cuales con lesiones de 2cm2 han fallado otros métodos o en osteocondritis disecante (necrosis simultánea de cartílago y hueso que resulta en el desprendimiento de capas de cartílago en una articulación). El trasplante autólogo de condrocitos es una técnica que se realiza en dos tiempos: en una primera intervención se realiza una extracción de láminas de cartílago articular de una zona que soporte baja carga. Esta muestra se cultiva hasta alcanzar un número suficiente de condrocitos para el injerto. En una segunda intervención se extirpa la lesión condral y se cubre con un injerto de periostio al que se deja una pequeña apertura para inyectar los condorcitos cultivados. Una vez realizado este proceso, se cierra el periostio con un par de suturas y se sella con un pegamento biológico de fibrina. Figura 11 Se estima que para cubrir una lesión de 4 mm de profundidad y 40mm de diámetro (unos 5 cm3) se necesitaría una expansión de entre 125-250 veces de la población condrocitaria aislada del paciente (asumiendo que se obtienen 2 millones de condrocitos en el cultivo primario). Esto representa una densidad 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 celular en el defecto articular de entre 50 y 100 x106 células/ cm3, o lo que es lo mismo un total de 2,5-5 x 108 células totales. 6.3 El cultivo ex vivo de condrocitos El condrocito es una célula embebida en el cartílago, con escasa actividad mitótica y una capacidad de síntesis relativamente baja. Es la única célula del cartílago adulto y por tanto la responsable de mantener la matriz cartilaginosa en un estado de equilibrio. Al igual que ocurre con otros tipos celulares, cuando los condrocitos se aíslan y cultivan en monocapa pueden aumentar su capacidad mitótica, sin embargo, estas células tienen tendencia a desdiferenciarse en cultivos en monocapa que resulta en la imposibilidad de estas células de reducir matriz extracelular (los condrocitos presentan inicialmente una forma redondeada y ligeramente poligonal que con el paso del tiempo y subcultivos cambia progresivamente a una morfología de fibroblasto. Figura 12 Este fenómeno de desdiferenciación es la limitación más importante en el cultivo de expansión de condrocitos y aunque la siembra a bajas densidades es una técnica habitual para aumentar la tasa de proliferación de células en cultivo 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 de monocapa, no es aplicable si queremos obtener condrocitos funcionales. Se cree que la desdiferenciación se da por la expresión de fibras de actina en respuesta a la expansión de los condrocitos en sustratos que permiten la adherencia. La rediferenciación de los condrocitos expandidos es posible siempre que estos se encuentren en un ambiente apropiado en el que se prevenga la expresión de actina y se han desarrollado diferentes aproximaciones técnicas: Cultivos en monocapa de alta densidad son capaces de mantener el fenotipo condrocitario. Los condrocitos así cultivados expresan proteoglicanos capaces de agregarse con ácido hialurónico mientras que en cultivos de baja densidad éstos no se agragan. Aun así, y a pesar de sus ventajas, los condrocitos presentan en ellos una expresión de colágeno tipo II más lábil que la de proteoglicanos. Cultivo en agregados (pellets): este tipo de cultivo es capaz de expandir el número de condrocitos manteniendo su funcionalidad pero las fuertes interacciones generadas por el contacto célula-célula disminuye enormemente la viabilidad celular en el producto final. Normalmente estos pellets se forman previamente y se siembran en cultivos en suspensión aunque se han descrito regímenes de agitación durante la expansión en suspensión de células aisladas que permiten la formación de micropellets de 10-30 µm que contienen entre 1 y 16 células. Cultivo en hidrogeles: el cultivo sobre hidrogeles de colágeno, agarosa o alginato así como sobre matrices tridimensionales (pe microcarriers) ha demostrado que condrocitos desdiferenciados vuelven a adquirir las propiedades de los condrocitos primarios en estas estructuras y su viabilidad en cultivo no se ve afectada. La rediferenciación post cultivo en monocapa en estos sistemas de expansión necesita de 2 o más semanas de cultivo. El cultivo sobre soportes dotan de una alta relación área/volumen reduciendo así la necesidad de utilizar grandes volúmenes de medio de cultivo pero en ellos se pueden producir fenómenos de transferencia de masa reducida que limita los índices de proliferación así como cambios inesperados en el crecimiento celular debido a la exposición a las fuerzas de agitación en el sistema. 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Asimismo, se han diseñado matrices (scaffolds) que sirven de soporte a los condrocitos que pueden dividirse en matrices biodegradables y no degradables. Entre estas últimas cabe destacar los polímeros naturales, que son materiales basados en la triple hélice de colágeno o sintéticos, como el ácido poliláctico (PLA) o poliglicólico (PGA). Los condrocitos se cultivan en el biomaterial y una vez uniformemente distribuidos en su interior se procede al implante de la matriz en el tejido lesionado. Figura 13 Este tipo de cultivos, capaces de mantener el fenotipo, se encuentran con la problemática de un crecimiento celular lento. La segunda problemática en el cultivo de condrocitos de origen humano consiste en que el origen de la muestra recibida no es reproducible y presentan una enorme variabilidad en sus respuestas. Por ejemplo, es un hecho conocido que los condrocitos humanos adultos tienen una menor capacidad de proliferación que los condrocitos procedentes de individuos más jóvenes. Por último destacar la regeneración de tejido cartilaginoso a través de células madre pluripotenciales. En general, se utilizan células madre somáticas y entre ellas las más utilizadas son las células madre mesenquimales, es decir los progenitores no hematopoyéticos de la médula ósea adulta. Estas células tienen 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 un notable potencial condrogénico, así como una facilidad para ser cultivadas y crecer y expandirse en dichos cultivos. Su utilización, al margen de un elevado potencial terapéutico, obviaría la necesidad de extraer del propio paciente zonas de cartílago sano para conseguir una regeneración de la lesión 16 Unidad didáctica 2: Terapias consolidadas: autoimplante de queratinocitos y regeneradores dérmicos Dra. Adela Miralles Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. La piel 4. Anatomía de la piel 5. Propiedades ideales de los sustitutos biosintéticos de piel 6. Recubrimientos dermicos o substitutos de piel 5.1 Piel artificial de origen natural 5.2 Piel artificial sintética 7. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción La piel, el manto protector que recubre nuestra anatomía, a pensar de su aparente simplicidad, desarrolla un sin-número de funciones fisiológicas. Las lesiones extensas de la piel, tienen difícil tratamiento. Concretamente las unidades de pacientes quemados frecuentemente ven limitado su arsenal terapéutico a la realización de implantes antólogos o heterólogos en las áreas dañadas. La alternativa que representan las técnicas que se exponen en este capítulo pueden ser de gran valor en la práctica médica. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Tener conocimientos generales sobre la anatomía y fisiología de la piel. - Conocer las alternativas terapéuticas que existen cuando se necesita cubrir o regenerar lesiones cutáneas extensas 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. La piel La piel es un órgano esencial del cuerpo humano por sus numerosas funciones entre las destacan la protección contra las agresiones externas y los microorganismos, el mantenimiento del contenido hídrico y el control de la temperatura corporal, siendo también vehículo del tacto y las sensaciones, todas funciones primordiales que hacen que cualquier lesión de este tejido deba ser tratada con rapidez. La reparación cutánea o cicatrización espontánea se realiza básicamente de dos maneras diferentes: una, desde las células del borde si la herida es de pequeñas dimensiones; la segunda se lleva a cabo a partir de las células epiteliales contenidas en los anexos cutáneos, si la herida es amplia pero no profunda. Si la herida es amplia y profunda, afectando a la totalidad de la dermis, no podrá ser reparada espontáneamente, lo cual crea un grave problema con riesgo de muerte si la lesión cubre un elevado porcentaje del cuerpo, como ocurre usualmente en los pacientes con quemaduras de 3er grado. Hasta el siglo veinte, los injertos de piel fueron desarrollados como una manera de prevenir tales consecuencia, usando la piel propia del paciente (autoimplante) o piel de cadáver (aloimplante). Mientras la piel injertada de una parte del cuerpo del paciente a otra está inmunizada al rechazo, en casos de grandes quemados esta opción no es factible. En estos casos, en que la extensión del área cruenta no permite obtener suficiente epitelio autólogo, crearon un grave problema y por esta razón, el lograr una estructura equivalente a la piel autóloga, se convirtió en un objetivo prioritario, por ello se pensó en recurrir a las técnicas de cultivo de tejidos que permitieran, partiendo de una pequeña porción de piel sana, obtener grandes porciones de epitelio. Un aporte crucial en este sentido fue hecho por Rheinwald y Green en 1975, quienes lograron desarrollar un sistema capaz de generar grandes superficies de epitelio cultivado a partir de una pequeña muestra de piel autóloga. Para el desarrollo de este epitelio emplearon como feeder layer fibroblastos de ratón, la línea celular 3T3, previamente irradiadas o tratadas con mitomicina para inhibir su crecimiento, a la cual se le sumaron las células obtenidas tras procesar el fragmento de piel. Los fibroblastos de ratón, sirven de soporte a los queratinocitos humanos al proporcionarles factores de crecimiento e inhibiendo a la vez, el desarrollo de los fibroblastos presentes en la dermis, por lo cual las 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 células con mayor capacidad de crecimiento en el cultivo son las células epiteliales de la epidermis. Por otra parte fue importante el desarrollo de una base dérmica sobre la cual el cultivo de queratinocitos alcance gran expansión, ocurra su diferenciación y una vez realizado el trasplante tuviese todas las posibilidades de éxito. Hasta la fecha se han descrito distintas superficies sobre las que los queratinocitos pueden desarrollarse, siendo tales “pseudodermis” mezclas de los componentes básicos de la dermis natural, como el colágeno, el condroitin-sulfato los fibroblastos humanos y la fibrina, proteína derivada del fibrinógeno disuelto en el plasma. Se ha podido demostrar que en los geles de fibrina los fibroblastos son capaces de sintetizar múltiples factores de crecimiento, similares a los que son producidos y secretados por ellos in vivo. Además, la fibrina puede servir como reservorio de otras sustancias, como los factores de crecimiento y antibióticos, que favorecen y permiten la correcta cicatrización. Con estas características, la fibrina puede formar parte de los denominados equivalentes dérmicos, tanto más que del análisis de las distintas mezclas de los componentes ya descritos, se ha observado que aquellos geles basados en fibrina y fibroblastos permiten un rápido crecimiento de los queratinocitos, brindando también una matriz ideal que permite un manejo fácil de la lámina de células para su transplante, aparte de hacer posible cultivar grandes superficies sobre una base que sirve muy bien de equivalente dérmico. Figura 1 Más información http://www.ir.vhebron.net /easyweb_irvh/Activitats/ Conferencies/TerapiaCellulari Genica/Jorcano/tabid/228/ Default.aspx 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En estudios previos, donde se emplean equivalentes dérmicos en la cobertura de grandes áreas cruentas, se dimensionaron las principales ventajas de estas “pieles artificiales completas” en base a su menor fragilidad, escasa retracción y mayor porcentaje de éxito al ser utilizadas en lesiones de considerable superficie. Así, en clínica, estos equivalentes epidérmicos se han utilizado fundamentalmente en el tratamiento de lesiones extensas como las producidas en personas quemadas en un 50-60% de su superficie corporal epitelización de las zonas donde han sido tomados los injertos, cobertura de lesiones donde no hayan prendido los injertos, ulceras cutáneas crónicas, tratamiento de la epidermolisis bullosa, cobertura tras excisión de nevus gigantes, tratamiento de diversas lesiones de la mucosa oral y uretral y otra serie de lesiones tanto traumáticas como de orden patológico. 4. Anatomía de la piel La piel es el tejido más extenso del cuerpo, ocupa el 15% del peso corporal y cubre aproximadamente 1.7m2, en el adulto promedio, es una estructura biláminal, epidermis y dermis. La epidermis es translúcida, permite que la luz pase a través de ella parcialmente, no contiene ningún vaso sanguíneo pero consigue su oxígeno y nutrientes de capas mas profundas. Esta capa de células esta compuesta de diferentes queratinocitos. En la parte inferior de la epidermis existe una membrana muy fina, llamada lámina basal. El colágeno es un componente de importante de esta lamina basal. La segunda capa se encuentra a mayor profundidad y es llamada Dermis. Está compuesta principalmente de fibroblastos, contiene vasos sanguíneos, nervios, raíces de pelo y glándulas de sudor. Debajo de la dermis se extiende una capa de grasa llamada Hipodermis, que se adhiere a la dermis mediante fibras colágenas. En la mayoría de las áreas del cuerpo la epidermis es solamente 35-50 µm de gruesa. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 2 5. Propiedades ideales de los sustitutos biosintéticos de piel Idealmente los sustitutos biosintéticos deberían cumplir las siguientes propiedades: • Adhesión rápida a la herida • Impermeable a bacterias • Emisión de vapor de agua • Permitir la emigración de las células, la proliferación celular y el crecimiento de nuevo de tejido • Flexibilidad para permitir la conformación de una superficie irregular en la herida, elasticidad para permitir el movimiento de los tejidos subyacentes • Resistencia lineal a tensiones de cizallamiento • Prevención de proliferación de flora en la superficie de la herida • Resistencia a la fuerza de tracción cuando esta es retirada • Biodegradable • Bajo costo 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • Caducidad indefinida • Mínimos requisitos de almacenamiento • Tejido compatible • Ausencia de toxicidad local o sistémica Aunque el criterio más importante está relacionado con la adhesión ya que de esta depende en buen porcentaje el éxito del injerto. 6. Recubrimientos dermicos o substitutos de piel El principal objetivo en el tratamiento de un gran quemado cuando llega al hospital es mantener vivo al paciente, eliminar el tejido dañado y tapar las heridas con los materiales y técnicas que se dispongan en el centro. El segundo paso es la sustitución de la piel quemada por piel sana lo más rápidamente posible y con los mejores resultados estéticos y funcionales, bien con injertos de piel del propio paciente, con injertos temporales de piel de cadáver, implante autologo de queratinocitos cultivados o con regeneradores dérmicos. Los sustitutos cutáneos los podemos clasificar en: temporales o permanentes (según sean o no rechazados y/o reabsorbidos por el huésped), epidérmicos, dérmicos o compuestos (según sustituyan a una sola capa de la piel ó a las dos), biológicos o sintéticos (según su origen). 5.1 Piel artificial de origen natural Cultivo de queratinocitos. Con el cultivo de queratinocitos se pretende obtener un epitelio que se puede incorporar a una base dérmica. Básicamente, la técnica consiste en separar los queratinocitos de la matriz celular en aproximadamente 2-4 cm de piel del propio paciente y aumentar su número mediante cultivo celular. Después se incorporan a una matriz dérmica artificial constituyendo una especie de piel elemental que se trasplanta al paciente y que, cuando prende, ya forma la piel completa. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 El tejido que se cultiva incrementa entre 3.000 y 6.000 veces su tamaño original, de modo que una pieza de unos cuatro centímetros cuadrados puede proporcionar casi un metro cuadrado de piel. Con esta terapia aunque en líneas generales se están logrando buenos resultados, la recuperación de los pacientes no es generalizada. El problema principal radica en que la dermis o capa profunda de la piel, que también se daña en estas quemaduras, no se regenera mediante el trasplante de queratinocitos cultivados. Otro problema no resuelto es el excesivo tiempo que se necesita para obtener el cultivo celular, que oscila entre 21 y 28 días. AlloDerm® es una matriz proteica formada por dermis de donante criopreservada y liofilizada, destruyendo con ello la totalidad de las células. No incluye la capa epidérmica o sustitutoria de la epidermis. AlloDerm® esta diseñada servir de matriz biológica para reformar tejido normal, contiene tanto la estructura como la información bioquímica para dirigir la revascularización normal y la repoblación celular, de vasos sanguíneos, colágenos, proteoglicanos y elastina. Esta matriz extracelular contiene los canales de los vasos sanguíneos que sirven de conductos para revascularización; colágenos, proteoglicanos y elastina que suministran a la estructura la información para la repoblación celular aún más importante los proteoglicanos son conservados y las proteínas ordenan a las células propias del paciente que inicien revascularización y repoblación de celular. Figura 3 Figura 4. Matriz de Alloderm 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Apligraf® es proporcionado como un sustituto de piel viviente (bicapa). De la misma manera que piel humana, Apligraf® consta de células vivas y proteínas estructurales. La capa dérmica más baja combina colágeno bovino tipo I y fibroblastos humanos (células dermales), que producen proteínas adicionales a la matriz. La capa epidérmica superior está formada por el ascenso de queratinocitos humanos (células epidermales) primero se multiplican y luego diferencian para reproducir la arquitectura de la epidermis humana. A diferencia de piel humana. Apligraf® no contiene melanocitos, células de Langerhans, macrófagos, y linfocitos, u otras estructuras como vasos sanguíneos, folículos pilososo o glándulas de sudor. Figura 5 Figura 7: Estructura de Apligraft Figura 6 Figura 8: Dermagraft Dermagraft ® consiste en un una matriz de acido poliglicólico bioabsorbible sembrada con fibroblastos humanos neonatales. Los fibroblasts proliferan en el interior de la matriz secretando colágeno, factores de crecimiento y citoquinas creando un substituto cutáneo humano tridimensional. 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Hyalograft y Laserskin (Hyaff-11) son matrices de ácido hialurónico sembradas con fibroblastos humanos neonatales se indican para el uso en úlceras diabéticas del pie y úlceras venosas de la pierna. Figura 9: Láminas de Hyalograft Transcyte® está formado por 2 capas, una capa externa que es una lámina de silicona y una capa profunda que es una malla de nylon donde se introducen fibroblastos neonatales. Durante 3 semanas esos fibroblastos van produciendo matriz proteica y factores de crecimiento, entonces se somete el producto a un proceso de criopreservación con lo cual se destruyen los fibroblastos y quedan la matriz proteica, los factores de crecimiento y la lámina de silicona superficial. Figura 10 Figura 11 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5.2 Piel artificial sintética Biobrane® es una fibra sintética sustituta de la piel constituida por una bicapa (análoga a la epidermis y dermis). Figura 12 La silicona capa exterior actúa como una barrera epidérmica protectora. La superficie interior se compone de entretejido tridimensional de filamentos de nylon sobre cual se vincula colágeno péptido. La adherencia inicial a la herida es el resultado de la unión entre el colágeno de la membrana con la superficie de fibrina. La segunda fase de adherencia resulta de las células epidérmicas que proliferan entre las matrices de nylon. Figura 13: Estructura del Biobrane® Integra® fue el primer sustituto cutáneo comercializado y con capacidad para regenerar la dermis. Fue desarrollado por John Burke en el Shriners Burns Institute y por Ioannis Yannas del M.I.T. (Instituto Tecnológico de Massachusetts). Es un producto con 2 capas, la externa es una membrana de silicona y la profunda es una matriz de colágeno de origen bovino con glicosaminoglicanos. Tiene 2 funciones, como piel artificial y como regenerador dérmico; como piel artificial proporciona una cobertura fisiológica postescisional disminuyendo el stress metabólico; como regenerador dérmico 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 genera una neodermis similar a la original, que ayudará a mejorar la calidad estética y funcional de la cicatriz [9]. Omiderm® es una lámina sintética de poliuretano que permite de forma semipermeable intercambiar con el medio ambiente pero deteniendo el ritmo de evaporación y la penetración de bacterias. A medida que crece el tejido hacia la lámina, el Omiderm® aumentará su adherencia, su elasticidad y su ransparencia. Permite una aplicación fácil, movimientos completos de las articulaciones y facilidad para inspeccionar las heridas. El Omiderm ® es útil para proteger sitios donadores, es ampliamente usado como único tratamiento en quemaduras de 2° grado superficial. Si se presenta integración a la herida, el manejo de esta consistiría en cambios diarios de apósitos solamente. Esta rutina se lleva a cabo hasta que haya buena adhesividad a la herida. También, puede ser colocado sobre heridas ya debridadas esperando autoinjerto y sobre injertos mallados, previniendo resequedad y deslizamiento de estos. 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 7. Bibliografía 1. Next generation products for wound management. Stewart J. Wound Healing Research Unit University of Wales College of Medicine, Heath Park, Cardiff, UK. Enlace: http://www.worldwidewounds.com/2003/april/Stewart/NextGeneration-Products.html 2. Piel artificial. Ramos Lopez. Revista Colombiana de tecnologías avanzadas 2006 vol2 nº8. Enlace: http://www.control- automatico.net/PDF/Revista%208/8_6.pdf 3. Obtención de láminas de piel humana mediante ingenieria de tejidos. Arvelo F., Perez P., Cotte C. Acta cientifica venezolana 2005: 55;74-82. Enlace: http://acta.ivic.ve/55-1/articulo9.pdf 4. Tratamiento de las Quemaduras en el Siglo XXI desde la Cirugía. Gomez P., Palao R. Cirurgìa Plàstica Ibero-Latinoamericana - Vol 28 Núm. 1. Enero Febrero Marzo 2002. Enlace: http://www.medbc. com/meditline/review/chir_es/vol_28/num_1/text/vol28n1p69.asp 14 Unidad didáctica 2: Terapias consolidadas: Obtencion y procesamiento de progenitores hematopoyéticos Dr. Gregorio Angel Martín-Henao Banco de Sangre y Tejidos. Centro de Tejidos y Terapia Celular. Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Obtención de las Células Progenitoras Hematopoyéticas: 3.1. Procedentes de médula ósea 3.2. Procedentes de sangre periférica movilizada 4. Transporte 5. Procesamiento de las Células Progenitoras Hematopoyéticas: 5.1. Recepción 5.2. Conservación 5.3. Manipulación 5.4. Criopreservación 5.5. Almacenado a largo término 5.6. Distribución 5.7. Descongelación 5.8. Infusión 5.9. Otros elementos (controles analíticos, etiquetado, gestión de datos, validaciones, desviaciones, sistema de calidad, regulación) 6. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción El trasplante de progenitores hematopoyéticos (TPH) es una terapia bien establecida para el tratamiento curativo de diferentes enfermedades neoplásicas hematológicas y no hematológicas y otro tipo de enfermedades (genéticas, autoinmunes, etc). Un programa de TPH se basa en tres pilares básicos, la unidad de obtención, encargada de la recolección de las células progenitoras hematopoyéticas (CPH), la unidad de procesamiento, encargada de la manipulación, el almacenado y la distribución de las CPH y la unidad clínica, que es la responsable de establecer la indicación del TPH y en última instancia del cuidado y seguimiento de los pacientes. En esta unidad didáctica trataremos de los diferentes elementos que intervienen en un programa de TPH, de las interacciones entre ellos así como del marco que regula dicho programa. 2. Objetivos Después de estudiar esta unidad, el alumno debería conocer: - Los principales elementos de un programa de trasplante hematopoyético. - La metodología básica para la obtención de células progenitoras hematopoyéticas, procedentes de médula ósea y de sangre periférica. - Realizar cálculos básicos en el procesamiento de células progenitoras hematopoyéticas. - Los principales tipos, fundamentos teóricos e indicaciones de las diferentes técnicas de manipulación ex vivo no genética. - Los fundamentos teóricos de las técnicas de criopreservación actuales. - Las técnicas de descongelación e infusión de las células progenitoras. - Los principales controles de calidad realizados durante el procesamiento celular. - Los principales elementos de soporte y estratégicos de un programa de trasplante. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Obtención de las Células Progenitoras Hematopoyéticas Las CPH, incluyendo las células más inmaduras (células madre hamatopoyéticas) (“La Célula”) (figura 1) se utilizan a nivel clínico para el trasplante y de forma experimental en el campo de la medicina regenerativa. Figura 1. Célula Madre Hematopoyética El trasplante de progenitores hematopoyético (“El Trasplante”) se puede clasificar, según el tipo de donante, en autólogo (las CPH son obtenidas del propio paciente), singénico (las CPH son obtenidas de un gemelo univitelino idéntico al paciente), alogénico (procedentes de un individuo de la misma especie distinto a un gemelo del paciente), bien sea emparentado (donante familiar del receptor) o no emparentado o xenogénico (el donante es de distinta especie). Según la fuente de donde las CPH se obtengan (“La Obtención”), se distingue entre el TPH de médula ósea, sangre periférica, sangre de cordón umbilical o de hígado fetal. Las CPH procedentes de médula ósea (CPH-M) (“La Médula Ósea”) se obtienen mediante punciones múltiples en las crestas ilíacas posteriores, anteriores y de forma ocasional en el esternón o en la meseta tibial (figura 2). El donante está en la mayoría de los casos bajo anestesia general. La cantidad de médula ósea a obtener tiene como objetivo superar el límite de 2x108 células nucleadas por kilogramo (kg) de peso del receptor, considerado de forma clásica el mínimo necesario para el trasplante, con un contenido de 2x106 células CD34+/kg de peso de receptor, pero en todo caso la cantidad máxima viene limitada por el peso del donante y no debe exceder los 20 ml por kg. 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 2. Aspiración de médula ósea En comparación con médula ósea, en sangre periférica (“La Sangre Periférica”) existe un número muy pequeño de CPH, pero se puede aumentar su cantidad tras movilizar dichas células desde la médula ósea –su residencia habitual- a la sangre periférica tras la administración de factores de crecimiento solo (el más empleado es el factor estimulante de colonias de granulocitos, GCSF) o en ocasiones, acompañado con la administración de quimioterapia (en el caso del TPH autólogo) (“La Movilización”). El mecanismo de movilización no es conocido de forma completa, aunque se han implicado una serie de moléculas de adhesión, incluyendo el antígeno LFA-1 (lymphocyte functionassociated antigen-1), VLA-4 (very late antigen-4), c-kit, CD44, VCAM (vascular cell adhesión molécula) and Mac-1, que participan en la interacción del microambiente medular con las CPH. Otras chemocinas implicadas son el SDF1 (stromal-derived factor-1), el cual se expresa de forma constitutiva en las células del estroma de la médula ósea y su receptor, el CXCR-4, expresado por las CPH. La interacción entre SDF-1 y CXCR-4 parece jugar un papel primordial en la retención de las CPH en la cavidad medular. La disrupción de las interacciones entre estas moléculas y sus ligandos promueve la movilización de las CHP a la circulación (figura 3). 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 3: Modelo de movilización inducida por estrés. El daño del DNA causado por la quimioterapia o el G-CSF induce a través de diversos mecanismos un incremento de citocinas, proteasas, etc, que conducen a la degradación del las señales que mantienen retenidas las CPH en la cavidad medular (Hematology 2003, 419) Las CPH expresan en su superficie el antígeno CD34 (“El Antígeno CD34”). Por tanto, la cantidad de CPH que se movilizan a sangre periférica puede medirse por citometría de flujo mediante la determinación de células que expresan dicho marcador (“La Monitorización”). Los días en los que la concentración de CPH en sangre periférica es mayor varía, dependiendo de la droga empleada para la movilización (“La Cinética de Movilización”). Así, tras administración de quimioterapia (tipo ciclofosfamida y G-CSF), la máximo concentración de células CD34+ en sangre periférica suele ser el día +9 a +11 y tras la administración de G-CSF solo, el día +4 a +6. Si existe un número suficiente de estas células en sangre periférica (se considera que al menos debe existir 5 células CD34+/µl), las CPH pueden recolectarse por un procedimiento de aféresis (“La Aféresis”). La leucoaféresis consiste en extraer la sangre del donante, separar dicha sangre en diferentes componentes, generalmente mediante centrifugación, retener las células mononucleadas (CMN), que es la fracción celular donde están contenidas las CPH, y devolver el resto de componentes sanguíneos al donante (figura 4). El procedimiento se realiza con una máquina, en circuito cerrado y el donante no requiere anestesia. La cantidad de volumen extraído al donante es variable pero el objetivo es conseguir al menos 2x106 células CD34+ por kg de peso de receptor, considerado el mínimo para un implante hematopoyético rápido y seguro. A 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 veces es necesario realizar más de un procedimiento de aféresis para alcanzar la cifra de CPH requerida para trasplante. El producto obtenido se denomina CPH-Aféresis (CPH-A). La cantidad de células CD34+/kg de peso de receptor obtenidas en un procedimiento de aféresis depende, entre otros factores, del volumen de sangre que se procese y de la eficiencia en la recolección de dichas células. La eficiencia de recolección de células CD34 se calcula según la siguiente fórmula = (Total CD34 en sangre periférica/Total CD34 en producto)*100. El total de células CD34 en sangre periférica se calcula con la siguiente fórmula = CD34/ml x Volumen procesado). La cantidad de células CD34+/kg de peso se calcula dividiendo la cantidad total de células CD34+ en el producto de aféresis por el peso real del paciente. Figura 4. Representación esquemática de un procedimiento de aféresis 1) El suero fisiológico ( ) y el anticoagulante ( ) entran en el circuito. 2) La sangre ( ) comienza a circular a través del separador y comienza su colección. 3) El separador separa ( ) y extrae plasma ( ) y células mononucleadas ( ). 4) El resto de los componentes celulares ( ) son devueltos al paciente 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La separación del componente celular en las máquinas de aféresis se realiza mediante centrifugación o filtración. La centrifugación usa la fuerza centrífuga para separar la sangre en plasma y los elementos celulares. El principio es que cada componente sanguíneo tiene una gravedad específica (figura 5). Una máquina de aféresis basada en centrifugación puede ser de flujo continuo, lo que permite que la sangre sea extraída del cuerpo del donante, procesada de forma continua y devuelta al paciente de forma simultánea. Por el contrario, en la centrifugación de flujo discontinuo, la sangre es procesada en cantidades pequeñas y es devuelta al donante de forma intermitente. La filtración separa los diferentes componentes sanguíneos basados en sus diferencias de tamaño. El proceso una la tecnología de membranas para separar el plasma y las células. La existencia de poros de varios tamaños permite la colección del componente celular deseado. Figura 5. Principio de la separación celular mediante aféresis. Se muestra la gravead específica de cada componente sanguíneo. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La siguiente tabla describe diferentes tipos de máquinas de aféresis: Fabricante Máquina Tipo Baxter Healthcare Corporation, Fenwal Division CS 3000 Plus® C/FC Amicus® AutopheresisC® C/FC SM/DF Fresenius Hemocare, Inc AS 104 C/FC Gambro BCT Inc COBE® Spectra™ C/FC COBE® Trima™ C/FD V-50 C/FD MCS®, MCS/Plus® C/FD PCS® C/FD Haemonetics C, Centrifugación; SM, membrana de centrífuga; CF, flujo continuo; DF, flujo discontinuo; SN. Figura 6. Máquina de aféresis (Cobe Spectra) 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Durante el procedimiento de aféresis el donante puede experimentar efectos secundarios (“Las Reacciones Adversas”) las cuales son en su mayoría leves, e incluye escalofríos, toxicidad por el citrato (empleado como anticoagulante en la sangre extracorpórea), hipovolemia y reacciones vasovagales. El enfriamiento de la sangre durante el circuito extracorpóreo y la infusión de la solución salina y el anticoagulante a temperatura ambiente causa que el donante sienta frío y escalofríos. El anticoagulante usado durante el procedimiento es generalmente el ACD (Anticoagualnt Citrate Dextrose) o ACD-A. Esto es debido a que no causa, al contrario de la heparina, anticoagulación sistémica o reacciones alérgicas y es efectivo en reducir la agregación plaquetaria durante el circuito extracorpóreo. La toxicidad del ACD está relacionada con la unión del citrato al calcio iónico, lo que puede producir hipocalcemia. Esto causa síntomas que van desde leves, como parestesias u hormigueos (alrededor de la boca y en la parte distales de las extremidades), moderados (parestesias progresivas, náuseas, vómitos, calambres abdominales) a efectos más graves (tetania, pérdida de conciencia, hipotensión, arritmia cardiaca, etc). La severidad de las reacciones adversas al ACD es dependiente de la velocidad y la duración de la infusión de citrato y su incidencia y severidad es mayor en pacientes pediátricos que en adultos. En estos casos, se debe disminuir la proporción de anticuagulante si se puede o administrar gluconato cálcico por vía oral (y en casos excepcionales por vía endovenosa). En muchos centros, se usa una combinación de ACD-A y heparina, lo que parece disminuir las reacciones de hipocalcemia. Las reacciones alérgicas son raras durante la aféresis de CPH. La hipovolemia puede causar hipotensión, taquicardia, diaforesis. Por su parte, las reacciones vasovagales se manifiestan con palidez de piel, debilidad, mareos, vómitos, pérdida de conciencia, convulsiones, relajación de esfínteres, hipotensión, bradicardia. En cuanto a la composición celular, esta varía entre la médula ósea y la sangre periférica, conteniendo esta última un mayor número de células nucleadas totales (x2,3 veces), de CPH (tanto de células CD34+ -x3,7 veces- como de 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 unidad formadora de colonias granulo-monocitarias -CFU-GM-, -x3,7 veces ) y de linfocitos T (x6,4 veces) y B (x5,4 veces). Las ventajas de emplear CPH de sangre periférica en relación a la médula ósea, es la disminución en los tiempos de implante del injerto tras el trasplante, el aumento en la cantidad de CPH infundidas, que se realiza sin anestesia al donante, puede realizarse de forma ambulatoria y el donante necesita menos cuidados, diminuyendo los costes del procedimiento. Todos estos factores hacen que en la actualidad sea la fuente de CPH más empleada en el trasplante. 4. Transporte Con frecuencia, las CPH obtenidas son enviadas desde centros de obtención hasta centros de procesado especializados distantes, por lo que se requiere un paso de transporte (“El Transporte en Fresco”). El transporte de productos celulares en fresco se realiza en contenedores especiales (figura 7) y en unas condiciones específicas, que incluye la monitorización de la temperatura durante el mismo. Figura 7. Contenedor de transporte de productos en fresco 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Procesamiento de las Células Progenitoras Hematopoyéticas: Tras la obtención, las CPH pueden infundirse directamente en fresco (CPH no manipuladas) (en el caso de trasplante alogénico) o lo más frecuente es que requieran ser procesadas antes de su infusión al paciente (“El Procesamiento”). El procesamiento comprende todos los aspectos de manipulación, criopreservación, empaquetado, etiquetado, incluyendo la preparación de las CPH para infusión o para su almacenado. Una vez que las CPH llegan al cetro de procesamiento, el primer paso es la recepción del producto (“La Recepción”). Cada centro de procesamiento debe tener protocolos escritos que definan los criterios para la aceptación de un producto para su procesamiento o en su caso para su rechazo. Si las CPH no pueden procesarse el mismo día, se conservan a corto término (“La Conservación”) para su procesado al día siguiente. Algunas variables a considerar en este aspecto son la temperatura de almacenado, la concentración celular, la solución para diluir el producto celular, el contenedor del producto, el método de almacenado (estático o en agitación) y el tiempo máximo hasta su manipulación. Los datos de diferentes estudios muestran que la viabilidad celular se conserva mejor cuando las CPH se almacenan a 4ºC y cuando la concentración celular es baja (por debajo de 3x108/ml). Para ello, el producto celular se diluye en plasma autólogo o se emplea una solución salina suplementada con una fuente de proteína (ej. albúmina humana) y un anticoagulante, en un contenedor primario que tenga intercambio gaseoso (figura 8). La mayoría de los centros almacenan las CPH antes de su procesado hasta el día siguiente, aunque pueden almacenarse hasta 72 horas antes de su infusión en fresco o manipulación y congelación. Posteriormente, las CPH pueden ser sometidas a manipulación ex vivo (“La Manipulación”). Los componentes celulares sometidos a manipulación pueden clasificarse en “minimamente manipulados” (los sometidos a un procesamiento que no altera las características biológicas relevantes de las células) o “más que minimamente manipulados” (los sometidos a un procesamiento que altera las características biológicas relevantes de las células que generalmente implica el uso de métodos de cultivo celular). 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 8. Almacenado de las CPH a corto plazo en bolsas de intercambio gaseoso. Dentro de las manipulaciones mínimas se incluye la separación de diferentes componentes celulares, como la reducción de plasma, lavado de plasma, reducción de hematíes mediante sedimentación, el enriquecimiento en la capa leucoplaquetar –obtención de buffy-coat- o el enriquecimiento en la capa de células mononucleadas –empleando sustancias que separan las células en función de su densidad-. “La reducción de plasma” se lleva a cabo mediante simple centrifugación manual (figura 9) o automática, y puede aumentarse la reducción mientras el lavado celular. En éste último caso puede realizarse igualmente de forma manual o empleando centrifugación semiautomática (Cobe 2991) (figura 10) o automática (Cytomate de Baxter) (figura 11). El producto obtenido tras reducción de plasma se denomina “CPH-reducidas de plasma”. Esta técnica está indicada en caso de incompatibilidad ABO menor entre donante y receptor (el donante tiene anticuerpos anti-ABO contra los hematíes del receptor). La recuperación de células CD34+ con estas técnicas suele ser superior al 90% (ver más adelante, “Los Cálculos”) con un grado de eliminación de anticuerpos antihematíes del receptor que debería estar por debajo de una titulación de 1/256. Para “La reducción de hematíes”, existen diferentes aproximaciones técnicas, como la obtención de células mononucleadas en gradiente de densidad o la sedimentación utilizando una sustancia (hydroxyethyl Starch (HES)). 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 9. Centrífuga manual (tipo Sorvall) Figura 10. Procesador celular semiautomático (Cobe 2991) Figura 11. Procesador celular automático (Cytomate, Baxter) 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En “La separación en gradiente de densidad” se emplea una sustancia (ficoll, densidad 1.077 g/l) que separa a las células en función de su diferente densidad, de tal forma que los granulocitos y los hematíes pasarán a través de la capa de ficoll, ya que tienen una densidad superior a 1.077 g/l, quedando la capa de células mononucleares (linfocitos, monocitos y CPH) y las plaquetas por encima de dicha capa (figura 12). Esta técnica se puede realizar de forma semiautomática (ej. con Cobe 2991) y para volúmenes más pequeños con el procesador celular automático Sepax (figura 13). Las principales limitaciones de la separación en gradiente de densidad es que la eficacia es dependiente de la ratio entre leucocitos y hematíes, del grado de contaminación de neutrófilos y la poca reproducibilidad en la recuperación celular, además de lo tedioso de la técnica y del hecho que el ficoll o percoll no están autorizados para su uso en humanos. Figura 12. Tubo donde se muestra la capa de células mononucleadas. La otra técnica de reducción de hematies es “La sedimentación en HES”, que induce la formación de rouleaux y ayuda a la sedimentación de los mismos. Esto puede hacerse de forma manual o empleando un procesador automático de reciente aparción (Sepax, Biosafe) (figura 13). La reducción de hematíes está indicada en caso de incompatibilidad ABO mayor entre donante y receptor (el receptor tiene anticuerpos anti-ABO de los hematíes del donante). La recuperación de células CD34+ con esta técnica suele ser superior al 70% con un grado de eliminación de hematíes superior al 95%. El objetivo es conseguir un producto final con menos de 20 ml de hematíes en adultos o de 0,3 ml/kg de peso en caso de pacientes pediátricos. Para conseguirlo, si el producto es de médula ósea, generalmente se requiere emplear un primer paso de reducción de 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 hamatíes (mediante la obtención de un buffy-coat) y posteriormente conseguir una reducción adicional mediante el uso de HES. Figura 13. Procesador celular automático Sepax (Biosafe) “La obtención de buffy-coat” (figura 14) consiste en el enriquecimiento en la capa leucoplaquetar, eliminando plasma y hematíes. Se usan técnicas de centrifugación (bien manual, semiautomática o automática). Esta técnica está indicada en casos de incompatibilidad menor ABO entre donante y receptor, sobre todo si se utiliza médula ósea, como primer paso antes de una reducción de hematíes adicional, en caso de incompatibilidad ABO mayor entre donante y receptor. La recuperación de células CD34+ suele ser superior al 80%. Figura 14. Tubo donde se muestra la capa de buffy-coat 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Otras indicaciones de dichas técnicas son el en caso de que el producto celular se vaya a someter a una manipulación adicional (ej. reducción de plasma de aféresis u obtención de buffy-coat o reducción de hematíes de médula ósea antes de su criopreservación). Las técnicas de manipulación mencionadas hasta ahora basan la separación celular en función del tamaño y la densidad de las distintas poblaciones celulares y de los medios empleados y viene determinado por la siguiente fórmula: µ = 2 r2 (d – d0) G 9η µ = Velocidad Sedimentación r = Radio Celular d = Densidad Celular d0 = Densidad Medio (ó Plasma) G = Centrifugación η = Viscosidad Medio Otras técnicas de manipulación ex vivo no genética algo más sofisticadas, incluyen las técnicas de selección celular (“Las Selecciones”). Dentro de están se distinguen la “selección negativa” (donde se eliminan una o más poblaciones de células específicas), de “selección positiva” (donde se enriquece en una o más población celular específica) o selección combinada positiva-negativa (combinación de las dos técnicas anteriores). En otras técnicas de manipulación se incluye la “expansión” (crecimiento de una o más poblaciones celulares en un sistema de cultivo ex vivo). Dentro de las técnicas de “selección negativa o purgado”, están los “métodos no inmunológicos”, basados en la separación física (bien mediante centrifugación o aglutinación), farmacológica (empleando drogas que alteran la capacidad proliferativa de las células que se quieren eliminar, ej. 4HC, Mafosfamida, VP-16, etc), lectinas (sobian aglutinina), fisico-químicos (ej. 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 fotoactivación), o bien los “métodos inmunológicos”, basados en el uso de anticuerpos monoclonales –AcMo-, que son las técnicas más utilizadas en la actualidad. Dentro de estas últimas están aquellas basadas en el uso de AcMo que se unen a las células diana las cuales son lisadas tras la incubación y activación del complemento (el cual es añadido a la suspensión celular) (figura 15); AcMo que se unen a la células diana y hematíes recubiertos de anticuerpos que se unen al complejo célula diana-AcMo a través de un anticuerpo secundario, separando a las células diana del resto mediante métodos físicos (figura 16); AcMo unidos a toxinas –inmunotoxinas-, que consiguen la muerte de las células diana tras su unión y penetración en las mismas; separación celular empleando AcMo y citómetro de flujo (sorting) o bien el uso de AcMo y partículas magnéticas, que son las más usadas en práctica clínica actual. Los dos sistemas más empleados son el sistema de esferas inmunomagnéticas (Dynal®) (de un tamaño aproximado de 450 µm) unidas a un anticuerpo secundario, que se une al AcMo específico primario unido a las células diana. Las esferas magnéticas se unes a las célula dianas (figura 17), que se separa de forma física del resto del producto celular al pasar la suspensión celular por un campo magnético. En este caso, se utilizan esferas magnéticas que están recubiertas de anticuerpos (ej. anticuerpos oveja anti-ratón, SaM, Dynal®) que reconocen al AcMo primario (aj. Anticuerpo ratón anti-humano) unido a las células diana. Los complejos células diana-esferas magnéticas (“inmunorosetas”) quedarán retenidos en el campo magnético. La máquina usada en esta técnica es el separador celular magnético Max-Sep (figura 18). Figura 15. Selección negativa con anticuerpos monoclonales y complemento. 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 16. Selección negativa con anticuerpos monoclonales y hematíes. Figura 17. Selección negativa con anticuerpos monoclonales y esferas magnéticas. Figura 18. Separador celular magnético Max-Sep. Otra técnica de selección negativa de reciente incorporación es la basada en el método MACS (magnetic activated cell sorting). El sistema MACS emplea AcMo específicos unidos a unas micropartículas magnéticas de pequeño tamaño (aprox. 50 µm) que se unen a las células diana (figura 19), ej, partícula mangética- AcMo anti-CD3-linfocito T. Estas partículas magnéticas junto al AcMo unido a las células diana son retenidas al pasar por un campo magnético, de tal forma que el resto de la suspensión celular “no retenida” en el campo magnético estará deplecionada de las células “no deseadas”. El proceso se realiza de forma automática empleando el procesador celular CliniMACS (figura 20) 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 19. Partículas inmunomagnéti cas (50 µm) unidas a una célula diana Figura 20. Procesador celular CliniMACS 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Por otra parte están las técnicas de “Selección Positiva”. En el caso de progenitores hematopoyéticos nos referimos a la selección de células CD34+ (que contiene las CPH) o de células CD133+ (también un marcador de CPH). Los dos sistemas de selección CD34+ más usados en la actualidad son el sistema Isolex y el sistema MACS. En el sistema Isolex (Baxter Heathcare), se usa un AcMo anti-CD34 (clase II, 9C5), las esferas magnéticas (de tamaño aprox. 450 µm, mencionadas anteriormente, de Dynal) y un péptido liberador que compite con el AcMo antiCD34 y lo desplaza de las células. El procedimiento se realiza con el procesador Isolex 300i (figura 21). Esta máquina tiene una serie de bombas, detectores de fluidos y de presión, que mediante el control de un software, permite realizar todo el procedimiento de forma completamente automática y en circuito cerrado. Los principales pasos del procedimiento son: 1º La suspensión celular es transferida a la bolsa de reciclado; 2º en la bolsa de reciclado tiene lugar el lavado de las plaquetas, que pasan a bolsas de desechado –no visibles en el dibujo-; 3º transferencia del AcMo hasta la bolsa de reciclado; 4º incubación y posteriormente lavado con el AcMo en la bolsa de reciclado; 5º transferencia de la suspensión celular ya sensibilizada con el AcMo a la cámara; 6º incubación en la cámara con las esferas magnéticas; 7º exposición del imán en la cámara –las células con las esferas magnéticas quedarán retenidas en el imán y el resto de las células –no diana- son transferidas a la bolsa de desecho; 8º transferencia del péptido liberador a la cámara e incubación –el péptido desplaza al AcMo-esfera magnética de las células CD34+- ; 9º exposición del imán –quedarán retenidos los complejos AcMo-esfera mangética-péptido; 10º transferencia de las células CD34+ desde la cámara a la bolsa de reciclado; 11º concentración de las células CD34+ purificadas en la bolsa de reciclado y 12º transferencia de las células CD34+ purificadas desde la bolsa de reciclado a la bolsa final. Por otra parte, el sistema MACS emplea un AcMo anti-CD34 (clase II, QBend 10) y unas micropartículas magnéticas de pequeño tamaño (aprox. 50 µm) que se unen a las células CD34+ (figura 19). Estas partículas magnéticas junto al AcMo unido a las células diana son retenidas al pasar por un campo magnético y 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 posteriormente son eluidas. El proceso se realiza de forma automática empleando el procesador celular CliniMACS. En este caso, tanto el lavado de plaquetas, como la incubación y lavado de anticuerpo debe realizarse con otra máquina (bien manual o empleando el procesador celular Cobe2991 o Cytomate). El resto del procedimiento se realiza de forma automática con el procesador CliniMACS, que controla el procedimiento mediante un software incorporado. Figura 21. Procesador celular Isolex 300i Ambos sistemas consiguen enriquecer las células CD34+ a purezas superiores al 90% con una recuperación de células CD34+ entre 50-70%. El resto de las células se elimina de forma pasiva, con una eliminación de linfocitos T alrededor de 3-4 logaritmos con el sistema Isolex y 4-5 logaritmos con el sistema CliniMACS y de linfocitos B alrededor de 2 logaritmos con ambos sistemas. La selección de células CD133+ se realiza mediante el sistema CliniMACS y el principio es el mismo, excepto que se utiliza un AcMo anti-CD133 en lugar de anti-CD34. Las técnicas de selección celular están indicadas principalmente, en el contexto del trasplante autólogo, para reducir o eliminar las células tumorales que contaminan el inóculo y que podrían contribuir a la recaída tras el trasplante o 22 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 para el purgado de células T autoreactivas en el contexto del trasplante en enfermedades autoinmunes. En el caso del trasplante alogénico, para disminuir la cantidad de linfocitos T aloreactivos y así disminuir la severidad de la enfermedad del injerto contra el huésped, que es la principal causa de mortalidad relacionada con el procedimiento en esta modalidad de trasplante. Otras indicaciones son como un paso previo a la expansión de CPH, para la generación de células dendríticas o en protocolos de terapia génica. De forma más reciente, también se están usando en el campo de la medicina regenerativa (ej. previa a su inyección en el miocardio en casos de infarto de miocardio). En cualquier técnica de manipulación hay que tener en cuenta los resultados que se esperan (“Los Cálculos”). Las principales variables a considerar son: -Recuperación de CNT o CMN = CNT (o CMN) en producto final ÷ CNT (o CMN) en producto inicial)*100 - Recuperación de células CD34+ = (Células CD34+ en producto final ÷ Células CD34+ en producto inicial)*100 - Recuperación de CFUs = (Nº total de CFUs en producto final ÷ Nº total de CFUs en producto inicial)*100 CNT: Células Nucleadas Totales CMN: Células Mononucleadas CFU: Unidades Formadoras de Colonias En determinadas técnicas, además: - log depleción de células diana (ej, células CD3+) = -log10 (Nº total de células CD3+ en producto final ÷ Nº total de células CD3+ en producto inicial) –en casos de selección celular- % Reducción de células diana (ej. hematíes) = 100- (volumen de hematíes en producto final ÷ volumen de hematíes en producto inicial)*100 – en los casos de depleción de hematíes-. La bondad de una técnica de manipulación debe resultar en una recuperación aceptable de CPH (células CD34+), que mantengan su viabilidad y su potencia (ej. funcionalidad), con una eliminación aceptable del componente objeto de la 23 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 técnica en particular (ej. grado eliminación de hematíes en la técnica de reducción de hematíes por sedimentación en HES o grado eliminación de linfocitos T en las técnicas de selección CD3 negativa o CD34 positiva), además de resultar en un producto final estéril. Además debe ser una técnica que de resultados reproducibles y consistentes. Tras la manipulación, las CPH pueden ser enviadas a la unidad clínica para su infusión en fresco (en caso de transplante alogénico), o ser criopreservadas (“La Criopreservación”). La criopreservación tiene por objetivo someter a las células a temperaturas muy bajas con lo que en teoría las reacciones bioquímicas se detienen y las células se pueden conservar a largo plazo. Sin embargo, durante el proceso de enfriamiento se forma hielo lo que podría conducir a daño celular. Hay diferentes variables a considerar en el proceso de criopreservación (cabe tener en cuenta que una suspensión celular está formada en su mayoría por agua y solutos). Una de las variables es la velocidad de enfriamiento a la que se somete la suspensión celular. Si la velocidad de enfriamiento es muy lenta, se empieza a formar hielo en el espacio extracelular con lo cual aumenta la concentración de solutos y por tanto la osmolaridad en dicho espacio. En consecuencia el agua contenida en el interior de las células pasa al espacio extracelular y las células reducen su volumen –las células se deshidratan-, con lo que se puede llegar a producir una lesión celular irreversible. Por otra parte, si la velocidad de enfriamiento es muy rápida no da tiempo a que el proceso de deshidratación celular tenga lugar, con lo que hay suficiente agua en el interior de las células para que se forme hielo intracelular – sobreenfriamiento-, lo que origina la disrupción de la membrana plasmática y la muerte celular inmediata. Por tanto, la velocidad de enfriamiento a de ser lo suficientemente lenta para prevenir el daño celular debido a la formación de hielo intracelular, pero suficientemente rápida para evitar la disminución del volumen celular debido a la exposición a ambientes hipertónicos (figura 22). Para conseguir un punto de equilibrio se emplean unas sustancias (“Los Crioprotectores”), que unen moléculas de agua y hacen que la concentración de solutos sea similar dentro que fuera de las células (isotónica), protegiendo a 24 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 % S u p e r v i v e n c i a Daño osmótico Formación de hielo intracelular Zona óptima Velocidad de Enfriamiento Figura 22 las células del estrés por el ambiente hipertónico. Al mantener la concentración similar en ambos lados de la membrana plasmática, permite al agua moverse desde el interior al exterior de las células a una velocidad lenta como para prevenir su deshidratación, manteniendo la concentración de sales a un nivel correcto, evitando el daño por la formación de cristales de hielo. Los crioprotectores se clasifican según su capacidad de penetrar en el interior de las células en penetrantes (ej. dimetilsulfóxido –DMSO-, glicerol, metanol, etc) y no penetrantes (ej. HES, dextrano, etilenglicol). Dentro de la técnica en sí de criopreservación, se pueden distinguir 3 fases: 1) Preparación de la suspensión celular. 2) Preparación/adición de la solución de criopreservación. 3) Enfriamiento. “La suspensión celular” puede someterse a una manipulación previa o proceder directamente a la criopreservación sin manipulación alguna. La mayoría de los laboratorios reducen el volumen de la suspensión celular (generalmente mediante reducción de plasma) (figura 23) con el objetivo de disminuir la cantidad de volumen a criopreservar, lo que tiene implicaciones 25 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 tanto en menores costes del procedimiento, menor espacio para su almacenado posterior, como en mejor tolerancia para el paciente a la hora de proceder a la descongelación e infusión. Figura 23. Reducción de plasma de la suspensión celular previo a la criopreservación. “La solución de criopreservación” contiene un agente crioprotector -el más empleado es el DMSO solo o el DMSO y un agente no penetrante a (ej. DMSO y HES)-, una fuente de proteínas que también tiene propiedades crioprotectoras y en algunos laboratorios un anticoagulante (ACD-A o citrato) para minimizar el riesgo de coagulación durante el procesamiento y/o tras la descongelación. Las diferentes sustancias de la solución de criopreservación deben estar en frío (alrededor de 4 ºC) ya que el DMSO hace aumentar mucho la temperatura y podría desnaturalizar las proteínas contenidas en la solución. La concentración de las diferentes sustancias varía entre laboratorios aunque lo más frecuente es que el DMSO quede a una concentración final del 10%, la albúmina humana al 2-4% y el anticoagulante al 5-10%. Tras enfriar la solución de criopreservación (el DMSO es tóxico para las células a temperatura ambiente), se añade a la suspensión celular (previamente enfriada a 4 ºC) a una velocidad lenta –generalmente durante un periodo de 7-10 minutos- y con cantidades crecientes para minimizar el riesgo de los cambios bruscos de osmolaridad que provocaría el DMSO añadido de forma rápida (figura 24). 26 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 24. Adicción de la solución de criopreservacón a la suspensión celular en circuito cerrado a través de un sistema multillaves. La suspensión celular junto con la solución de criopreservación se almacena en bolsas especiales (“Las Bolsas”) que pueden soportar temperaturas muy bajas (ej. bolsas cryocyte, figura 25, bolsas macopharma, etc). Las bolsas se introducen entre placas para protegerlas físicamente de los golpes (figura 26). Figura 25. Bolsas de congelación tipo Cryocyte (Baxter) 27 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 26. Placas metálicas para proteger a las bolsas criopreservadas En la mayoría de los laboratorios, “El Enfriamiento” se realiza de forma controlada – congelación programada – a una velocidad de 1-3ºC/minutos, que se ha mostrado la adecuada para la criopreservación de las CPH. Los programas de congelación están diseñados por segmentos lineales en los que la velocidad de enfriamiento es constante. Durante el descenso de temperatura, la suspensión celular está en estado líquido (figura 27 y 28) hasta que llega un momento en que se empizan a formar pequeños núcleos de hielo (nucleación), lo cual provoca un desprendimiento de energía con un aumento consiguiente de la temperatura del producto (fase de transición, donde coexisten parte de la suspensión en estado sólido y parte en estado líquido). Al inicio de esta fase, se induce un sobreenfriamiento (por inyección de vapor de nitrógeno líquido), que induce la nucleación y evita el sobrecalentamiento por la liberación del calor latente que se produce por la formación del hielo. Una vez la nucleación ha comenzado, el cambio al estado sólido se extiende a toda la suspensión, la cual se solidificará con la estructura de un sólido amorfo. 28 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 T e m p E R A T U R a Fase Líquida Fase Transición Δ F A S e Figura 27. Diagrama de una curva de congelación de CPH. S ó l i d a Tiempo • • • 1º C/min - 40º C 2º C/min - 60º C 10º C/min - 120º C Figura 28. Curva de congelación típica de CPH. Se observan 3 curvas, una que representa la temperatura de la muestra, otra la de la cámara y otra la programada (ambas superpuestas). La congelación programada se consigue de forma automática mediante el uso de congeladores biológicos programables (figura 29), que congelan las células a una velocidad de enfriamiento constante hasta llevarlas a –120 ºC. De forma alternativa a la congelación programada, las CPH se pueden congelar de forma no controlada – congelación no programada -, introduciendo el contenedor con las células en congeladores mecánicos (-80º C). Para obtener una velocidad de enfriamiento aproximada de 1ºC/min., la bolsa con las células debe aislarse del congelador por medio de algodón o alcohol. Las ventajas de la congelación no programada es su bajo coste y que es un procedimiento simple. Por el contrario, no se puede controlar la velocidad del enfriamiento ni se puede garantizar la repetitividad de los procesos. 29 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 29. Congelador Biológico Programable Tras su congelación, las CPH son almacenadas en tanques de nitrógeno líquido (figura 30) (“El Almacenado”). Dentro de los tanques de nitrógeno líquido se pueden distinguir 2 fase, una fase líquida, que permite mantener la temperatura a –196 ºC y una fase vapor. Con menos frecuencia, las CPH criopreservadas se almacenan en congeladores mecánicos con temperaturas de almacenado entre –80 ºC y –135 ºC. El tiempo máximo de almacenado en tanques de nitrógeno líquido no está establecido, pero se han realizado trasplantes con células almacenadas durante más de 20 años. Por el contrario, el tiempo máximo recomendado de las células almacenadas en congeladores mecánicos antes de su uso para trasplante no debe superar los 6 meses. 30 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 30. Tanque de nitrógeno líquido para el almacenado a largo plazo de los productos hematopoyéticos criopreservados. Una vez que el paciente está programado para el trasplante, se somete a un tratamiento (“El Tratamiento de Acondicionamiento”) que consiste en la administración de dosis altas de quimioterapia, radioterapia o ambas, que tiene por objetivo eliminar las CPH –y tumorales en caso de enfermedad neoplásica del receptor- así como inmunosuprimir al paciente para evitar el rechazo de las CPH en caso de TPH alogénico. Posteriormente se procede al envío de las CPH para su administración al paciente (“La Distribución”). Previo al suministro de un producto de CPH final para infusión, este debe cumplir con una serie de requisitos de calidad, fundamentalmente en lo referente a la seguridad y a su potencia, los cuales deben estar definidos de forma previa (“Los Criterios de Liberación o Dispensación”). Dentro de estos criterios están el estudio de esterilidad del producto suministrado, de endotoxinas (en el caso de productos que hayan sido previamente cultivados), la caracterización del producto en cuanto a contaje (células nucleadas, células CD34+, linfocitos T –éstos en caso de trasplante alogénico-) y viabilidad celular, tipificación ABO/Rh como punto de análisis de identidad o que los criterios de elegibilidad de un donante alogénico han sido adecuados (elegibilidad definida como un producto de terapia celular de un donante quien cumple con todos los requisitos relacionados con la determinación de agentes implicados en la 31 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 transmisión de enfermedades infecciosas tal como lo define la legislación vigente). Si el producto cumple con los criterios que están definidos, pasa a ser un producto “Disponible para Distribución”, en caso contrario, el producto pasa a ser “Producto No Conforme para distribución” y su utilización en un paciente determinado se realizará bajo la forma de “Necesidad Médica Urgente” (definida como situación en la cual no se dispone de un producto de terapia celular comparable y que el receptor es probable que fallezca o sufra una morbilidad seria sin el producto de terapia celular) y requerirá la aprobación por parte del Director Médico de la unidad de procesado y del Responsable Médico del paciente. Una vez el producto está disponible para distribución se procede a su transporte. Si el producto no está criopreservado previamente, se procederá al transporte (en condiciones ya descritas para el transporte de productos en fresco) hasta la unidad clínica para proceder a su administración. Si las células están criopreservadas y almacenadas en centros de procesado distantes de la unidad clínica donde está el paciente, estas deben ser transportadas. El Transporte de las CPH-criopreservadas se realiza en unos contenedores de transporte especiales (“dry shippers”) que tienen un sistema que absorbe el nitrógeno líquido dentro de su paredes, permitiendo mantener temperaturas por debajo de–120ºC por varios días. Estos contenedores van introducidos en otro recipiento tipo carcasa (figuras 31 y 32b). Figura 31. Esquema de un Dry-Shipper Tapa de cerrado Aluminio Tubo de cuello Sistema de retención de vacío Absorbente hidrofóbico Aislamiento 32 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 32a. Contenedores para el transporte de productos hematopoyéticos criopreservados (Dry-Shippers) Figura 32b. Contenedores tipo carcasa, donde se introduce el dry-shipper. El día del trasplante (día 0), se procede a la descongelación de las CPH criopreservadas (“La Descongelación”). La descongelación se realiza generalmente en baño maría a 37-41 ºC (figura 33a), donde se introduce la bolsa con las células y tras masajeo se procede a su descongelación rápida (figura 33a a 33j). Posteriormente, las células se enfrían alrededor de 4º C (que puede conseguirse manteniendo las células en acumuladores de frió) (figura 33f). Los siguientes pasos son, la colocación de un punto de inyección en la bolsa descongelada (tiene por objeto sacar muestras para controles de calidad y para limpiar la bolsa con el resto producto una vez se ha infundido), se coloca un equipo de infusión, se introduce en una bolsa secundaria (de seguridad), se introduce en una bolsa terciaria y en un contenedor de transporte (el cual está con acumuladores térmicos a 4 ºC y con papel superabsorbente, por si hay fugas de producto). Posteriormente se procede a su trasporte hasta la unidad clínica. 33 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figuras 33 a-h. Descongelación de CPH en diferentes fases de la descongelación. Figura 33a. Baño maría para la descongelación de productos hemopoyéticos Figura 33b. Extracción de la bolsa de las placas metálicas. Figura 33c. Introducción dentro de una bolsa secundaria. Figura 33d. CPH descongelándose en el baño maría Figura 33e. Aspecto de las CPH durante la descongelación. Figura 33f. CPH tras descongelación en acumuladores térmicos de frío. 34 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 33g. Colocación de un punto de inyección (para extraer muestras para controles de calidad y para lavar la bolsa tras la infusión. Figura 33h. Colocación de un equipo de infusión. Figura 33i. Introducción de la bolsa dentro de otra bolsa secundaria (de seguridad) Figura 33j. Introducción de la bolsa en el contenedor de transporte (con acumuladores de frío a 4ºC) Algunos aspectos a consideran durante la descongelación: La descongelación debe ser rápida debido a los fenómenos de recristalización que pueden producirse durante la misma. Estos consisten en que pequeños cristales de hielo intracelular que pudieron formarse durante la congelación, se reorganizan en ciristales de mayor tamaño si se realiza una descongelación lenta, lo que conduciría a la muerte celular por destrucción mecánica. Otro fenómeno a tener en cuenta en el proceso de descongelación es el shock osmótico. Este es un proceso inverso al producido durante la congelación y consiste en que conforme se va produciendo la descongelación, el medio extracelular se va haciendo progresivamente hipotónico, por lo que el agua pasa al interior de las células y puede llegar a la lisis celular por incremento de su volumen. Este efecto se disminuye de forma considerable por el uso de los agentes crioprotectores (ej. DMSO), que debido a su elevada difusividad puede 35 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 pasar desde el interior de las células al medio extracelular y retener moléculas de agua libre. Tras la descongelación las células son transferidas a jeringas para su infusión al paciente o lo más habitual se infunden en la misma bolsa donde se congelaron, lo que tiene la ventaja del menor riesgo de contaminación, de pérdida de CPH y de mayor facilidad para el personal que realiza la administración de las células (“La Infusión”). Lo más frecuente es que las células se infundan sin filtro, aunque puede usarse un filtro (filtro de 170 µm o más) si se ven agregados celulares. La infusión generalmente se realiza a través de un catéter colocado en una vía venosa central. La infusión de las CPH descongeladas debe producirse en el menor tiempo posible y no debe exceder 1 hora desde su descongelación debido a que el DMSO es tóxico para las células sobre todo a temperatura ambiente. El ritmo habitual de infusión es de 5-20 ml/min. Un aspecto importante a considerar con la infusión son las Reacciones Adversas producidas en el paciente (definidas como una respuesta nociva y no intencionada a la infusión de un producto de terapia celular para el que hay una posibilidad razonable de que dicho producto sea la causa de la respuesta). Los efectos secundarios tras la infusión de las CPH descongeladas son frecuentes y se deben principalmente al contenido en DMSO empleado para la criopreservación. Estas suelen ser leves en forma de reacciones gastrointestinales (náuseas, vómitos), respiratorias (tos, disnea), cardiovasculares (hipo o hipertensión, bradicardia), enrojecimiento, reacciones anafilácticas, aunque se han descrito casos graves de arritmias cardiacas, complicaciones neurológicas e incluso el fallecimiento del paciente. Las reacciones adversas debidas al DMSO son dosis dependiente, por lo que no debe sobrepasarse la dosis de 1 ml de DMSO/kg de paciente, pero también son idiosincrásicas. Otro tipo de reacciones adversas incluye reacciones de tipo inmunológico, como la reacción hemolítica aguda (en caso de TPH-Alogénico con incompatibilidad de grupo sanguíneo ABO), reacción febril no hemolítica (por liberación de citocinas), TRALI (“Daño Pulmonar Agudo Relacionado con la Transfusión”), reacciones no inmunológicas, como las producidas por contaminación bacteriana del inóculo, transmisión de enfermedades infecciosas, embolia grasa, hemorragias –en caso de excesiva anticoagulación-, sobrecarga circulatoria o hipotermia. 36 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Reacciones de tipo inmunológico y no inmunológico se producen también con la infusión de productos celulares en fresco. Para minimizar estos efectos adversos, el paciente es sometido a una medicación previa a la infusión (con hidratación, antihistamínicos y corticoides). De forma alternativa, las CPH descongeladas pueden ser manipuladas para reducir el DMSO antes de su infusión (“El Lavado de DMSO”). En teoria, el lavado de DMSO tiene como ventajas la disminución de la osmolaridad de la suspensión celular a infundir (la osmolaridad de una suspensión celular con 10% de DMSO es de 1500 mOsm/L, mientras que la del plasma es de 285 mOsm/L aproximadamente), reducir la caga de hemoglobina libre (los hematíes se lisan durante el proceso de descongelación) y detritus celulares, disminuir el volumen de infusión y principalmente disminuir la toxicidad del DMSO. Como desventajas está la posible pérdida adicional de CPH producidas durante el procedimiento de lavado. Las técnicas de lavado automático (ej. Cytomate) resultan en una recuperación de CPH superiores al 90% con un grado de eliminación de DMSO superior al 95% lo que resulta en una osmolaridad del producto lavado similar a la del plasma) Un aspecto importante a considerar en el procesamiento de las CPH son los controles analíticos (“Los Controles”) de cualificación de producto, en el componente tras su obtención y en determinados puntos durante la manipulación que deben estar previamente definidos. El objetivo es doble, por una parte determinar la idoneidad del producto para transplante a un paciente determinado y por otra monitorizar las diferentes técnicas de manipulación utilizadas. Cada laboratorio debe establecer programas de control de calidad para cumplir con ambos objetivos. Las recomendaciones mínimas en el producto previo a su congelación o antes de su infusión serían la realización de un contaje de células nucleadas, de células CD34+ para determinar la dosis celular infundida, el hematocrito, para determinar el volumen de hematíes infundido, la viabilidad de las células infundidas, la determinación del grupo sanguíneo ABO/Rh (por razones de trazabilidad) y la esterilidad (para bacterias –aerobias y anaerobias- y hongos). En todos los diferentes pasos que hemos descrito en esta unidad didáctica, los componentes celulares deben estar marcados con la etiqueta apropiada. Debe 37 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 existir un procedimiento de etiquetado (“El Etiquetado”) donde se definan las operaciones para identificar el producto de CPH original en la colección y cualquiera de las modificaciones adicionales, la revisión del contenido de la etiqueta y su fijación al contenedor primario que contiene las CPH. De igual forma, el contenido de la etiqueta debe identificar de forma clara los datos del paciente, su número de identificación único, los datos del donante y su número de identificación (en caso de trasplante alogénico), el número de identificación único del producto, el nombre adecuado del producto, los datos del centro donde se ha obtenido y donde se ha procesado, y otros datos como se muestra en la figura 34 (el contenido de la etiqueta viene definido en los estándares, ver más adelante). Figura 34. Ejemplo de etiqueta para infusión alogénica y autóloga que se emplea en la actualidad en nuestro laboratorio. 38 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Todos los datos generados durante el procesamiento de las CPH, incluyendo los controles de calidad deben ser gestionados de forma ideal también de forma electrónica (“La Base de Datos”). El objetivo es identificar de forma unívoca a pacientes y productos, facilitar el trabajo con la introducción de los datos mientras estos se vayan generando, ayudar a la gestión de las técnicas (ej. ayuda en los cálculos que se tienen que realizar), gestionar los registros (con su posibilidad de impresión), ayudar en el control del proceso, gestión del almacenado de los productos criopreservados, facilitar el análisis de los datos, etc. Figura 35. Menú principal de la base de datos de nuestro laboratorio, desde donde se accede a cada una de las etapas del procesado Todas las técnicas de procesamiento empleadas deben ser asépticas y deben estar validadas (“Las Validaciones”) con el objetivo de proporcionar una recuperación y viabilidad aceptables de las CPH. Los aspectos claves de un proceso de validación son: 1) El protocolo de validación, donde se describe el proceso o técnica a ser validada, incluyendo los equipos y como se llevará a cabo la validación, lo que incluye la definición de objetivos, producto y características del proceso, la descripción de unas especificaciones predefinidas y 39 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 la identificación de factores que determinarán la obtención de resultados aceptables. 2) El proceso de validación, que es establecer a través de evidencia documentada, un alto grado de aseguramiento que un proceso específico producirá de forma consistente un producto que cumple con las especificaciones predeterminadas y las características de calidad. 3) El método de validación, que establece, a través de evidencia documentada, un grado alto de aseguramiento que un método analítico dará de forma consistentes resultados precisos que reflejan las características de calidad del producto analizado. De la validación de un procedimiento o técnica resultará en la definición de parámetros críticos dentro de rangos aceptables que pueden usarse en última instancia como criterios de liberación o dispensación de un determinado producto final. La validación no solo afecta a las técnicas de manipulación, sino a los aspectos del procesamiento incluyendo máquinas, reactivos, registros, etiquetas, base de datos, etc. El proceso de validación de una técnica determinada finalizará en la escritura de la misma (“Los Procedimientos Normalizados de Trabajo (PNT)”), con su consiguiente registro para cada vez que se usa esa técnica particular (“Los Registros”). Además, los registros deben cumplir con la misión de mantener la trazabilidad de un producto determinado desde su donante a su receptor y viceversa. La incorporación de nuevas técnicas validadas en la rutina de un centro de procesamiento requerirá la adecuada formación de los profesionales que la vayan a realizar (“La Formación”). Cada una de las unidades que forman un programa de trasplante deben tener un “Plan de Formación” escrito que establezcla las actividades a desarrollar por dichos profesionales con el objetivo de asumir la habilidad necesaria para desarrollar una técnica en particular. Una vez la aptitud sea adquirida y documentada dichos profesionales estarán capacitados para la realización de dicha técnica (“La Capacitación”). Además, dichos profesionales deben demostrar de forma periódica su aptitud para desarrollar dicha técnica (“La Competencia Continuada”). Durante cualquier etapa desde la comunicación para la obtención de CPH hasta su suministro para infusión, pueden existir errores, fallo en las máquinas, no seguimiento de lo escrito en un determinado PNT, accidentes, producto final que no cumple con sus especificaciones, problemas durante el transporte o 40 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 durante la infusión, etc (“Las Desviaciones”). Debe existir un procedimiento escrito que defina dichas incidencias, las documente cuando se produzcan y que establezca los mecanismos para la comunicación de las mismas a las personas que intervienen el en programa de trasplante (“Procedimiento de incidencias, errores, accidentes y reacciones adversas”). Cuando se produce una desviación, deben realizarse las acciones correctoras apropiadas (“Acciones Correctoras”) y en su caso las acciones preventivas (“Acciones Preventivas”) para evitar en lo posible que dichas incidencias puedan repetirse. Todos los aspectos desde las obtención de CPH hasta el suministro de un producto final para infusión deben estar definidos dentro de una organización particular y formar una parte de un sistema de gestión de la calidad (“El Sistema de Calidad”) donde se definan de forma clara las directrices, políticas y requisitos que se deben satisfacer en una empresa. Formando parte del sistema de calidad está toda la estructura documental (“Los Documentos”), desde el Manual de Calidad – que implica a toda la empresa – hasta los procedimientos, técnicas y registros de un proceso en particular. Formando parte del sistema de calidad, cada laboratorio debe tener un sistema de aseguramiento de calidad (“El Aseguramiento de la Calidad”), incluyendo la definición de indicadores de calidad (“Los Indicadores”) de cada proceso o técnica, que permitan establecer si un determinado procedimiento o técnica a lo largo del tiempo está cumpliendo con las expectativas. De igual forma existen unos estándares (“Los Estándares”) internacionales diseñados para proporcionar unas guías en el campo del trasplante de CPH incluyendo la obtención y el procesamiento de las mismas (estándares CAT/JACIE). De forma reciente, el procesamiento de CPH también está además regulado (“Las Regulaciones”) por una ley europea (ya transpuesta en España, REAL DECRETO 1301/2006). El trasporte de CPH (material biológico) está regulado por una directiva de la comunidad europea. Dicha directiva puede consultarse en el siguiente link: http://www.cit.gva.es/fileadmin/conselleria/images/Documentos/transportes /tmercancias/pdf/dir96_86ce.pdf 41 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Desde que un paciente entra en programa de trasplante debe pasar por una serie de etapas que comienza con la programación por parte de la unidad clínica de la obtención de las CPH y/o manipulación. En la actualidad, con más frecuencia los centros de obtención de CPH de sangre periférica y los centros de procesamiento están integrados en los bancos de sangre, y puede estar geográficamente distantes de las unidades clínicas adscritas a los hospitales donde el paciente será tratado. Esto hace que deba existir una organización óptima para que un determinado programa de trasplante pueda llevarse a cabo con las máximas garantías de seguridad y calidad (“La Organización y La Logística”) y en ocasiones implica a empresas externas (ej. empresas de transporte). Es importante que dichas empresas tengan experiencia en el campo, las personas sean debidamente formadas para tal misión y su relación con los centros de trasplante sea contractual con responsabilidades definidas. De igual forma, entre las distintas unidades que constituyen un programa de trasplante (unidad de obtención, unidad de procesado y unidad clínica), debe existir un documento de acuerdo técnico (“Los Acuerdos”) donde se recojan los términos de colaboración entre las mismas y se definan las responsabilidades y compromisos durante todo el proceso, desde la notificación de la recolección de CPH hasta la distribución/infusión de un producto final para trasplante. Existen una serie de sociedades internacionales y nacionales especialmente focalizadas en el ámbito del trasplante hematopoyético y la terapia celular (“Las Sociedades Científicas”). La web de dichas sociedades se puede consultar en los siguientes links: Grupo europeo para el trasplante de sangre y médula (EBMT): http://www.ebmt.org Sociedad Internacional de Terapia Celular (ISCT): http://www.celltherapysociety.org Sociedad Americana de Aféresis (ASFA): http://www.apheresis.org Sociedad Española de Hematología y Hemoterapia (AEHH): http://www.aehh.org 42 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 6. Bibliografía - R Powles, J Mehta, S Kulkarni, et al. Allogeneic blood and bonemarrow stem-cell transplantation in haematological malignant diseases: a randomised trial. Lancet 2000; 355: 1231 - T Papayannopoulou. Current mechanistic scenarios in hematopoietic stem/progenitor cell mobilization. Blood 2004; 103: 1580 - J. Yu, W. Leisenring, W.I. Bensinger, et al. The predictive value of white cell or CD34+ cell count in the peripheral blood for timing apheresis and maximizing yield. Transfusion 1999; 39: 442 - C. Bordignon, C Carlo-Stela, MP Colombo, et al. Cell therapy: achievements and perspectives. Haematologica 1999; 4:1110 - J McCullough. Cellular engineering for the production of blood components. Transfusion, 2001; 41: 853 - GA Martín-Henao, M Picón, B Amill, et al. Isolation of CD34+ progenitor cells from peripheral blood by use of an automated immunomagnetic selection system: factors affecting the results. Transfusión 2000;40: 35. - Rodríguez, B Velasco, J García, GA Martín-Henao. Evaluation of an automated cell processing device to reduce the dimethyl sulfoxide from hematopoietic grafts after thawing. L Transfusión 2005; 45: 1391 - S Heilborn A, Kadidlo D, McCullough J. Patient care during infusion of hematopoietic progenitor cells. Transfusion 2004; 44: 907 43 Unidad didáctica 2: Terapias consolidadas: trasplante de islotes pancreáticos Dr. Luciano Rodríguez Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular) Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Islotes Pancreáticos. 4. Diabetes Mellitus tipo 1. 4.1. Tratamiento 5. Trasplante de islotes pancreáticos. 5.1. El protocolo de Edmonton. 6. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción La Diabetes es una enfermedad de elevada prevalencia y graves consecuencias médicas. En una proporción elevada de casos, los tratamientos clásicos se vuelven ineficaces o no consiguen estabilizar los pacientes que sufren esta enfermedad. Ello ha estimulado la investigación no farmacológica, cuyo exponente mas mediático es la investigación con células madre. No obstante, mucho antes, hace más de 20 años, se inició una aproximación muy lógica al problema: El tratamiento mediante el trasplante de islotes pancreáticos. Actualmente, aunque su práctica no se ha diseminado de manera amplia, es una alternativa que puede útil en un grupo de pacientes de difícil tratamiento convencional. 2. Objetivos Después de estudiar esta unidad, el alumno debería de ser capaz de: - Conocer los aspectos más importantes relacionados con: o Las técnicas de procesamiento o El trasplante de islotes pancreáticos. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Islotes pancreáticos El páncreas (del griego: todo carne) es una glándula de secreción, tanto exocrina como endocrina, de forma lobulada situada detrás de la parte inferior del estómago por su parte más ancha, entre la concavidad del duodeno y el hilio esplénico, y a la izquierda del abdomen junto al bazo por su cola. Tiene forma cónica, un peso de entre 50 y 70 g y una longitud que oscila entre 15 y 20 cm, su anchura es de unos 3,8 cm y su grosor de 1,3 a 2,5 centímetros (el tamaño aproximado de una mano). El páncreas produce y segrega insulina, glucagón, polipéptido pancreático y somatostatina para regular la cantidad de glucosa en sangre. También produce y secreta enzimas al duodeno que ayudan la digestión de alimentos. Asimismo secreta grandes cantidades de bicarbonato de sodio para neutraliza el ácido proveniente del estómago a través del conducto pancreático. Figura 1 Figura 2 La parte exocrina del páncreas contiene unas glándulas redondas u ovaladas llamadas acinos serosos y compuestas por células acinosas y centroacinosas. Su función es básicamente asistir a la digestión de grasas, proteínas y carbohidratos. Sin los enzimas liberados al intestino delgado por el páncreas, estos alimentos pasarían por los intestinos sin ser absorbidos. La glándula exocrina y los conductos de liberación al intestino representan Más del 95 % de las células del páncreas. 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La parte endocrina de este órgano representa 1 gramo de peso del total de un páncreas y se agrupa en los islotes de Langerhans (2.5 -106 por páncreas). Estos “micro órganos” se ven en una histología normal como grupos celulares de tonos pálidos en un inmenso tejido exocrino oscuro, tienen un diámetro de 150 µm y son más numerosos en la zona de la cola del páncreas. En los islotes se encuentran distintos tipos celulares especializados: - Las células beta son del 60 al 90 % del total y producen insulina (disminuye los niveles de glucosa sanguínea). - Las células alfa producen glucagón (eleva el nivel de glucosa en la sangre), se distribuyen de forma periférica y representan entre el 10 y el 20% del volumen del islote. - Las células delta producen somatostatina (inhibe la secreción de insulina y glucagón). - Las células γ producen y liberan polipéptido pancreático). Figura 3 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 4 Figura 5 4. Diabetes Mellitus tipo 1 La diabetes mellitus tipo 1 (diabetes insulino-dependiente o juvenil) es una enfermedad autoinmune en la que el organismo es incapaz de producir insulina, provocando la permanencia constante de glucosa en cantidades superiores a las normales en sangre. Esta enfermedad aparece, generalmente, en personas de menos de 30 años aunque puede ocurrir a cualquier edad, esta es una enfermedad de por vida para la cual aún no existe cura. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 6 El proceso de desarrollo de la diabetes tipo 1 es gradual, pudiendo ser necesarios varios años antes de su manifestación clínica. La enfermedad se desarrolla por el ataque del sistema inmune contra las propias células beta del páncreas, encargadas de producir la insulina. En este proceso intervienen múltiples factores: existe primero una susceptibilidad o predisposición genética con la que se han relacionado varios genes y parece necesario que ocurra un factor desencadenante ambiental (infección viral, estrés, toxinas, etc.), tras el cual, aparece el ataque inmunológico frente a las propias células beta que son destruidas. Existe reacción inmunológica mediada por anticuerpos (reacción humoral) y células (reacción celular), habiéndose detectado autoanticuerpos frente a proteínas presentes en la superficie de las células beta como la descarboxilasa del ácido glutámico (GAD). Otros anticuerpos incluyen los IA2, dirigidos contra una fosfatasa presente en el interior de las células beta y anticuerpos contra la propia insulina. Estos anticuerpos pueden ser detectados en el suero de los pacientes meses y años antes del desarrollo de la enfermedad, y se han convertido en marcadores de un estado conocido como prediabetes. 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La destrucción progresiva de las células beta reduce la capacidad reproducir insulina, y sin suficiente insulina, la glucosa se acumula en el torrente sanguíneo en lugar de penetrar en las células. El cuerpo, a pesar de los altos niveles de glucosa en el torrente sanguíneo, es incapaz de utilizarla como energía, lo que lleva a que aumente el apetito. Los altos niveles de glucosa en la sangre hacen que el paciente orine más, lo que a su vez causa sed excesiva. En un lapso de 5 a 10 años después del diagnóstico, las células beta del páncreas productoras de insulina están completamente destruidas y el cuerpo ya no puede producir más insulina. Los síntomas generalmente son severos y se desarrollan con rapidez. Figura 7 4.1 Tratamiento de Diabetes tipo1 Las personas que carecen de insulina no pueden procesar la glucosa como fuente de energía, y cuando la glucosa no está disponible, la grasa corporal es descompuesta en su lugar. Los subproductos del metabolismo de las grasas, las cetonas se acumulan en la sangre. Cuando la sangre se vuelve más ácida que los tejidos del organismo, se presenta una afección llamada cetoacidosis. Al mismo tiempo, los niveles de glucosa se elevan, generalmente por encima de los 300 mg/dL, por que el hígado produce más glucosa para tratar de combatir el problema de que las células no puedan absorber ese azúcar. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En el momento del diagnóstico de la diabetes tipo 1, los objetivos inmediatos son tratar la cetoacidosis diabética (también denominada coma diabético) y los altos niveles de glucosa sanguínea. Debido a la aparición súbita y gravedad de los síntomas en la diabetes tipo 1, el tratamiento para las personas diagnosticadas recientemente puede implicar la hospitalización. Los objetivos a largo plazo del tratamiento son prolongar la vida, reducir los síntomas y prevenir complicaciones relacionadas con la diabetes tales como ceguera, insuficiencia renal y amputación de extremidades. Estos objetivos se logran por medio de educación, uso de insulina, control riguroso de la ingesta, control de peso, ejercicio y un autocontrol atento y vitalicio de los niveles de glucosa en sangre. Alternativamente, el trasplante de islotes pancreáticos se ha definido como una terapia útil en el tratamiento de esta enfermedad. Hay gran expectativa por el trasplante de islotes pero esta técnica no está disponible en todo el mundo, ni siquiera en modo experimental, aunque se ha demostrado que independiza de la insulina a los trasplantados. Además, aún en países con muchos donantes, como España, no hay número suficiente para hacer frente a la demanda porque hay unos cien mil pacientes afectos de diabetes Tipo 1 y hay 1350 donaciones por año. Asimismo, cada año se suman dos mil pacientes menores de treinta años y se necesitan por lo menos dos páncreas para lograr éxito con un paciente. 5. Trasplante de Islotes pancreáticos Después de varios años de evolución de la enfermedad, un porcentaje de los pacientes, y dependiendo del control metabólico que hayan tenido, puede presentar complicaciones secundarias como retinopatías (llevando a la ceguera), neuropatía periférica (resultando principalmente en pérdida de sensibilidad en los miembros inferiores), nefropatía (diálisis), micro y macroangiopatía (amputaciones) así como un aumento del riesgo cardiovascular. La incidencia de estas complicaciones está relacionada estrechamente con los episodios repetidos de hiperglucemia. 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Así, el objetivo terapéutico del trasplante de páncreas es diferente según el momento en el que se realice. En pacientes que ya se encuentran en diálisis, la mejor opción es el trasplante simultáneo de páncreas entero y riñón, mientras que los que aún no presentan complicaciones, o están en una etapa incipiente se beneficiarían con un trasplante de islotes pancreáticos. El trasplante de islotes pancreáticos puede otorgar todos los beneficios del trasplante de órgano entero, con mucho menor riesgo asociado porque el trasplante de páncreas entero es una cirugía de alta complejidad. Aunque los potenciales beneficios del trasplante de islotes pancreáticos fueron demostrados por Paul Lacy (Universidad de Minnesota) hacia comienzos de 1970, el trasplante en pacientes no logró responder a las grandes expectativas que se habían creado porque, básicamente, no existían en ese momento protocolos de inmunosupresión adecuados y la cantidad de islotes trasplantados, en la mayoría de los casos, resultaba insuficiente. En cuanto a la inmunosupresión, una de las dificultades que se presentaba era que estas mismas drogas, en especial los corticoides, podían causar daño en las células trasplantadas. En el año 2000 la respuesta a estos problemas llegó desde la Universidad de Alberta (Edmonton, Canadá), donde se desarrolló el conocido método de trasplante “Protocolo de Edmonton” 5.1 El protocolo de Edmonton El Protocolo de Edmonton combina el uso de enzimas especializados para la disgregación del tejido pancreático y utiliza un régimen de inmunosupresión sin esteroides que incluye sirolimus (Rapamune), bajas dosis de tacrolimus (Prograf) y dacluzimab (Zenapax) así como anticuerpos anti receptor de IL2. Este protocolo consistió en trasplantar a pacientes diabéticos insulinodependientes, jóvenes y sin falla renal, pero con dificultades para mantener la glucemia a pesar de las múltiples aplicaciones diarias de insulina, islotes pancreáticos obtenidos de páncreas de donante cadáver. Este método utiliza enzimas especiales durante la extracción de islotes del páncreas del donante y no emplea glucocorticoides para la inmunosupresión, así se pueden trasplantar un promedio de 11500 islotes por Kg. de peso corporal del paciente. Para la inmunosupresión se utilizó una combinación de drogas a 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 dosis menores que las empleadas para el trasplante de otros órganos y los pacientes tratados requirieron entre 2 y 4 trasplantes secuenciales de islotes. Actualmente permite pasar del 13% al 85% de independencia del uso de Insulina para regular la glucemia durante 2 años post-trasplante. Los páncreas se obtienen de donantes multiorgánicos y se logran entre trescientos mil y ochocientos mil islotes por cada páncreas. Los islotes se inyectan en el hígado del receptor y se puede hacer en fresco o después de uno o un par de días de cultivo en laboratorio. Figura 8 Durante el proceso los islotes son aislados, purificados y transferidos al receptor. Una vez implantados las células beta comienzan a producir y liberar insulina aunque la funcionalidad completa de los islotes y su vascularización lleva tiempo. A causa de la labilidad de los islotes el trasplante se realiza en la mayoría de los casos en el menor tiempo posible y el paciente recibe una dosis media de 104 islotes por Kg de peso. El trasplante es realizado a menudo por radiólogos que utilizan rayos x y ultrasonidos para guiar el catéter que introduce las células en el receptor. 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 9 Los pasos de aislamiento y purificación en el trasplante de islotes pancreáticos se realizan mediante la digestión del tejido endocrino del exocrino en la cámara de Ricordi y se utiliza colagenasa o liberasa (conjunto de isoformas I y II de colagenasa y termolisina altamente purificadas y de bajo contenido en endotoxina) conjuntamente con un homogenizador (cámara Recordi) que realiza una disgregación mecánica. Posteriormente se realiza la Purificación de los islotes mediante separación en gradiente de densidad utilizando Ficoll, dextrano o algún otro gradiente de densidad no iónico. Figura 10 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Los pacientes candidatos a trasplante de islotes (sin trasplante simultáneo de riñón) deben reunir estas características: Edad entre 18 y 65 años. Diabetes tipo 1 (insulinodependiente) con más de 5 años de diagnóstico de la enfermedad. Labilidad metabólica, con severas variaciones glucémicas a pesar de haber estado bajo un régimen estricto de tratamiento con insulina. Aparición de complicaciones progresivas, que no pudieron ser evitadas o detenidas por el tratamiento previo con insulina. Función renal normal. Quedan varios desafíos por delante. Uno de ellos es optimizar los métodos de obtención de islotes de tal manera que un sólo páncreas sea suficiente para alcanzar la insulinoindependencia. Sin embargo, debido a la escasez de donantes de órganos, aun cuando el objetivo anterior pudiera lograse, no habría suficientes páncreas para trasplantar a todos los potenciales candidatos. Es posible que la solución provenga del cultivo de islotes pancreáticos a partir de células pluripotenciales o madre o de órganos de otra especie. El rechazo post-trasplante sigue siendo la principal causa de pérdida de las células trasplantadas y para evitarlo se utiliza medicación inmunosupresora. Pero debido a que baja las defensas de los pacientes, éstos se hallan más expuestos a infecciones. Por lo tanto, otro de los desafíos futuros será lograr que las células trasplantadas sean aceptadas por el receptor, creando tolerancia a las mismas, con mínima o ninguna inmunosupresión. A diferencia de las estrategias convencionales, en las cuales se interviene sobre el sistema inmune del receptor, se buscaría modificar las células antes de ser trasplantadas para hacerlas menos antigénicas. Otra alternativa que está siendo explorada es la de proteger los islotes dentro de cápsulas. Las más serias limitaciones a este último método consisten en que las cápsulas, una vez trasplantadas, se recubren de un tejido fibroso que dificulta el ingreso de oxígeno y nutrientes para los islotes, los cuales pierden vitalidad en un plazo relativamente corto. Además esta aproximación es económicamente poco viable y no demostrado buenos resultados en modelos animales. En todo el mundo se están realizando numerosos esfuerzos abocados a resolver los problemas planteados en esta clase. Por el momento, el Protocolo de Edmonton ha demostrado que el trasplante de islotes es capaz de lograr insulinoindependencia sin los temidos riesgos de la inmunosupresión, aunque 13 Para conocer el estado actual del tema: Balibrea del Castillo, JM y cols. Estado actual del trasplante de islotes pancreáticos Disponible en: http://www.aecirujanos.es/ revisiones_cirugia/2007/ Abril2_2007.pdf Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 hará falta algo más de tiempo para comprobar que también se podrían prevenir las complicaciones secundarias de la diabetes. 6. Bibliografía 1. AABB: Technical manual, 15th ed.. American Association of Blood Banks 2005. 2. Estándares de Acreditación en Transfusión Sanguínea. CAT 3ª ed. 2006. Capítulo 6: Transfusión de componentes sanguíneos 3. BOE nº 255 del 20/09/2005: Real Decreto 1088/2005 del 16-de Septiembre por el que se establecen los requisitos técnicos y condiciones mínimas de la hemodonación y de los centros y servicios de transfusión. 4. Guía práctica de medicina transfusional. M. Petrides, G. Stack. Edición Española 2005. 5. Guía sobre la transfusión de componentes sanguíneos y derivados plasmáticos. SETS 3ªed. 2006 6. Guidelines for compatibility procedures in blood transfusion laboratories. Transfusion Medicine 14(1): 59-73, 2004 Sitios Web 1. Página web de la Sociedad Española de Transfusión Sanguínea: www.sets.es 2. Página web de la Nacional Health and Medical Research Council: www.nhmrc.gov.au 3. Guias de la British Committee for standards in Haematology: www.bcshguidelines.com 4. Página con información muy útil sobre medicina transfusional: www.hemoterapiamedicos.net 14 Unidad didáctica 3: Ingeniería tisular Dr. Joan García López Banc de Sang i Teixits. Hospital de la Vall d’Hebrón. Barcelona Dr. Jordi Joan Cairó Departamento de Bioingeniería. Facultad de Ingeniería Química. Universidad Autónoma de Barcelona Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Concepto de ingeniería tisular 4. Características físicas de los tejidos y sus matrices 5. Elementos de la ingeniería tisular 6. Células madre 7. Matrices y polímeros biocompatibles 8. Factores de crecimiento, diferenciación y angiogénesis 9. Potencial terapéutico de la ingeniería tisular y aplicación clínica 10. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción La Ingeniería Tisular es un campo de investigación dentro de la medicina regenerativa que utiliza células, matrices, factores de crecimiento y diferenciación y biorreactores para la obtención de un tejido vivo, tridimensional y fisiológicamente funcional, para su trasplante en tejidos enfermos o dañados. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer la importancia de la ingeniería tisular en el ámbito de la medicina regenerativa. - Ser capaz de definir los conceptos básicos. - Conocer los 4 pilares en que se basa la ingeniería tisular: las células madre, los biomateriales biocompatibles, los factores de crecimiento y diferenciación y, finalmente, los biorreactores de cultivo, que permiten el mantenimiento de las variables fisicoquímicas óptimas durante el proceso de generación del tejido. 3 Lectura Consultar el documento del Directorate for Engineering of the National Science Foundation, Emergence of Tissue Engineering, Final Report, el documento de Lavik y Langer 2002, y el documento Regenerative Medicine del National Institute of Health (Referencias 1, 2 y 3 de la bibliografía) Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Concepto de ingeniería tisular Esta área nueva de la medicina surge, en su concepción inicial, como consecuencia de la necesidad y desequilibrio existente entre la demanda y la oferta de órganos para el trasplante. Actualmente en esta disciplina se aplican principios y métodos de ingeniería y ciencias biomédicas para obtener información relevante sobre las relaciones de estructura-función en tejidos con alguna patología y el desarrollo de sus substitutos para remplazar, restablecer, reparar, regenerar, reconstruir, mantener o mejorar la función tisular afectada. Para ello se presupone que las células, cultivadas en un ambiente tridimensional y fisicoquímico adecuado, serán capaces de organizarse en un tejido que se asemeje al máximo al tejido original. Por tanto, esta disciplina intenta reproducir un tejido ex vivo que se parezca lo más posible al original (Figura 1). La génesis de estos tejidos in vitro ha de ser rápida, para evitar los procesos de reparación propios del cuerpo humano, ya que tienden a cicatrizar la zona afectada sin conservar las características estructurales y funcionales originales. Figura 1 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4. Características físicas de los tejidos y sus matrices En el cuerpo humano encontramos alrededor de un trillón de células, que conforman los aproximadamente 260 fenotipos de los más de 100 tejidos que configuran un organismo humano. Entre los más importantes para la ingeniería tisular están el hueso, el cartílago, los tendones y ligamentos, la piel, el músculo, los vasos sanguíneos, el miocardio y válvulas cardíacas, la córnea, el oído, los nervios periféricos, la espina dorsal, el hígado, el riñón, el páncreas, la vejiga, la tráquea, los pulmones, el esófago, estomago e intestinos, los órganos genitales y las encías y dientes. Las características citológicas, histológicas, funcionales y estructurales de cada uno de ellos son completamente diferentes, por lo que su génesis requiere de multitud de combinaciones, básicamente de 4 elementos esenciales: células, matrices extracelulares, factores de crecimiento y/o diferenciación y un entorno fisicoquímico ex vivo. 5. Elementos de la ingeniería tisular La base de la ingeniería tisular radica en la combinación de las células adecuadas, con un elemento arquitectural que permita la generación de la estructura tridimensional, el cual debe tener unas propiedades muy determinadas de composición química y de respuesta mecánica. Todo ello debe permitir la generación del tejido en un entorno fisicoquímico muy controlado. La correcta elección de las fuentes celulares, de las matrices tridimensionales y los sistemas artificiales donde deben alojarse y como deben estimularse fisicoquímicamente las células son la base de la ingeniería tisular (Figura 2). 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 2 6. Células madre La utilización de células en ingeniería tisular es un campo en constante evolución. Como premisa para la regeneración de muchos tejidos, la cantidad de células requeridas hace necesario su expansión en condiciones y cantidades suficientes para su utilización a partir de la fuente de extracción. Las principales fuentes celulares utilizadas en ingeniería tisular van desde células diferenciadas a células progenitoras y células madre (stem cells). Actualmente, muchos de los trabajos se llevan a cabo con células madre adultas obtenidas de diferentes fuentes del propio paciente. La percepción actual es que las tanto las células madre embrionarias y las adultas serán los pilares en los que se basará la ingeniería tisular del futuro (Figura 3), dado que las células diferenciadas, en general, no pueden expandirse in vitro. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 3 En cualquier caso, las células madre adultas (autólogas o heterólogas) son los candidatos preferidos en la actualidad para llevar a cabo los estudios de ingeniería tisular. Esas células tienen la capacidad de duplicarse ex vivo, así como la capacidad de diferenciarse y especializarse mediante la adquisición de las características y funciones específicas de las células adultas (multipotencia). A diferencia de las células embrionarias, su obtención es difícil, ya que sólo conforman un porcentaje muy bajo de las células totales del tejido fuente (entre un 0,01 y un 0,001%). Entre ellas cabe destacar las hematopoyéticas (médula ósea), las neuronales (cerebro), las epidérmicas (piel), y las progenitoras mesenquimales (médula ósea, tejido graso, cartílago…). Quizá las más interesantes para ingeniería tisular son las progenitoras mesenquimales. Estas se distinguen por sus antígenos específicos de superficie, los receptores específicos de citocinas y factores de crecimiento así como la producción específica de citocinas y factores de crecimiento propios y moléculas de la matriz extracelular. Se ha probado experimentalmente su diferenciación a adipocitos, condrocitos, osteoblastos, tenocitos, estroma, músculo esquelético, músculo liso, músculo cardíaco, y a astrocitos, oligodendrocitos y neuronas. La fuente mejor estudiada de células mesenquimales es la médula ósea, pero se pueden obtener de músculo, cartílago, tendón, tejido adiposo y vascular, así 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 como de la placenta y cordón umbilical. La fuente de obtención es uno de los elementos más críticos para la ingeniería tisular. Es obvio que su obtención de tejidos como el graso es simple, segura, indolora y quizá una de las fuentes preferidas, pero cada tipo de fuente presenta unas peculiaridades diferenciales, ya que en función del origen pueden ser más eficientes para un tipo de diferenciación con respecto a otros. 7. Matrices y polímeros biocompatibles Diseño y arquitectura tisular. (Consultar el documento del Tissue Engineering Research del International Technology Research Institute (WTEC), el documento de Lavik y Langer 2002 y el documento Regenerative Medicine del National Institutes of Health) Como se ha comentado, el material para la construcción tridimensional del tejido es de vital importancia en ingeniería tisular. Las características arquitecturales, de composición y mecánicas son críticas en la creación del nuevo tejido. Las células deben adherirse, proliferar (si es el caso) y diferenciarse en su interior. Deben tener una buena red interconectada de poros para la transferencia de nutrientes y eliminación de subproductos. Deben ser moldeables para poder guiar la forma y estructura del nuevo tejido. Deben ser biodegradables y absorbibles en tasas controladas que coincidan con la formación del tejido in vivo e in vitro, de manera que permitan a éste generar su propia matriz extracelular. Sus propiedades mecánicas (compresible, tensil, flexible, elástica, no deformable) son de vital importancia según el tejido a mimetizar. Deben ser biocompatibles, de nula toxicidad y mínimamente inmunogénicos. Respecto a su naturaleza y composición, se han usado multitud de compuestos para generar la matriz en función del tejido a regenerar: Los metales y materiales cerámicos (como la hidroxiapatita, Figura 4) se han utilizado con éxito en el tejido óseo en aplicaciones ortopédicas, pero no se 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 pueden utilizar en otros tejidos. Los materiales poliméricos, tanto naturales como sintéticos, han sido los más empleados en todas las aplicaciones descritas. Figura 4 Los polímeros naturales incluyen colágeno (Figura 5), matrigel, agarosas, alginatos, ácido hialurónico, elastina, laminina, gelatina y fibrina. Tienen importantes limitaciones en cuanto a sus propiedades mecánicas y sobre todo a su tasa de reabsorción. Figura 5 Los polímeros artificiales tienen un abanico mucho más amplio de manipulación de sus propiedades mecánicas y químicas. Los no degradables como el teflón y el polietileno se han utilizado de manera muy restringida en regeneración vascular e implantes. Los degradables ocupan una posición muy importante en la ingeniería tisular. Los ácidos poliláctico (PLA), poliglicólico (PGA) y sus copolímeros (PLGA) han sido de los más utilizados (Figura 6), sobretodo por estar aprobados por la FDA. Junto a éstos, los polialcanoatos (poli-4-hidroxibutirato) y las policaprolactonas, son también los preferidos en procesos de regeneración tisular. Existen, además, todo un conjunto de polímeros que van adquiriendo gran importancia en este área, como los poliaminoácidos, el polipropilenfumarato, los poliortoésteres, los polianhídridos, las polidioxanonas y los polifosfazenos. 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 6 La manera de realizar la polimerización también es de especial importancia en la elaboración de la matriz y en sus características fisicoquímicas finales. Como premisa general, la inclusión de las células debería ir asociada a la polimerización, pero muchos métodos de polimerización son letales para las células, de manera que el polímero debe ser colonizado posteriormente a la elaboración del mismo. La polimerización puedes ser física (temperatura, presión, separación de fases, disolución, fotopolimerización láser o eléctrica) química (formación de enlaces iónicos, covalentes) y se pueden obtener o bien hidrogeles, cuando el material de partida es hidrosoluble, o esponjas, donde el material es soluble en medios orgánicos y éste es retirado y eliminado totalmente al final del proceso. Actualmente, para la polimerización y obtención de la forma y arquitectura requerida se utilizan técnicas de prototipado rápido y de impresión tridimensional asistidos por modelos CAD/CAM que pueden producir estructuras 3-D con resoluciones de hasta 200 micras (con aparatos parecidos a impresoras de tinta muy sofisticados) 8. Factores de crecimiento, diferenciación y angiogénesis Tanto en las etapas de expansión de células madre (donde mayoritariamente se utilizan factores de crecimiento en forma de sueros fetales bovinos como sueros humanos tanto autólogos como heterólogos), como en las de diferenciación en las matrices, es necesaria la utilización de factores de crecimiento y 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 diferenciación que también suelen ser específicos de cada célula y tejido a obtener. Otro de los apartados fundamentales en la generación de tejidos, y en concreto de los vasculares (que son la mayoría), radica en el proceso de vascularización o angiogénesis que debe garantizar la llegada futura de nutrientes una vez transplantado el tejido. Entre la gran cantidad de estos factores destacan todas las familias del factor de crecimiento fibroblástico (FGF), del factor de crecimiento epidérmico (EGF), del factor de crecimiento derivado de plaquetas (PDGF), las IGFs (Insulin e Insulin like growth factors), diversas interleucinas (ILs), interferones, así como todo un conjunto de vitaminas y hormonas no peptídicas. También hay que añadir los factores de angiogénesis y vascularización y los de morfogénesis ósea (BMPs) entre la multitud de substancias biológicas que se utilizan para la expansión y diferenciación en Ingeniería Tisular. Tanto para la obtención de cantidades suficientes de células madre como para la elaboración del tejido, el entorno controlado en el que debe llevarse a cabo el proceso implica el uso de biorreactores que varían en su sofisticación en función del producto final que se pretende obtener. El biorreactor proporciona un ambiente adecuado para expandir y proliferar las células, para promover la colonización de los polímeros en los que no se han co-polimerizado las células y para hacer el crecimiento-diferenciación y estimulación fisicoquímica (mecánica o eléctrica según el tejido) de los tejidos de nueva construcción. El reactor se diseña en función de las necesidades de cada célula-tejido para que no exista limitación en la transferencia de materia o energía en los procesos de ingeniería tisular. Por otra parte garantizan la esterilidad y calidad durante todo el proceso de reconstrucción tisular. Normalmente en ellos se monitorizan y/o controlan la temperatura, el pH, la concentración de oxígeno y CO2, diversos nutrientes, factores de crecimiento y diferenciación, etc. Por otra parte, en el biorreactor se emplazan también los 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 elementos de estimulación mecánica, que permiten la orientación correcta de la matriz extracelular bajo esfuerzos mecánicos y la estimulación eléctrica en tejidos como los musculares y el neuronal. Los biorreactores pueden ser discontinuos, donde se realiza una carga de células-tejido y medio al inicio del proceso, semicontinuos, donde hay entrada continua de nutrientes pero no salida, y perfundidos, donde hay una entrada y salida constante de nutrientes del sistema. La agitación también determina el tipo de biorreactor, pudiéndose distinguir los que son estáticos de los agitados (Figura 7). Los agitados utilizan sistemas mecánicos, sistemas pendulares, ejes de agitación acoplados a turbinas o bien rotación del reactor o elementos externos que producen un efecto similar al oleaje. Figura 7 La utilización de elementos de monitorización es recomendable pero encarece y sofistica mucho el reactor. En cuanto a los materiales que los conforman, se encuentran según la aplicación desde metálicos, pasando por vidrio a materiales plásticos. 9. Potencial terapéutico de la ingeniería tisular y aplicación clínica Actualmente, en mayor o menor medida, la ingeniería tisular se utiliza para aplicaciones en obtención de piel artificial, substitución/regeneración de cartílago, tendón, ligamentos y hueso, sustitución de córnea y también en 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 odontología. Las perspectivas futuras son muy esperanzadoras, dada la variedad de tejidos del cuerpo humano, citados con anterioridad, y reportados ampliamente en el material de lectura, susceptibles de ser mimetizados mediante Ingeniería Tisular. 10. Bibliografía 1. Directorate for Engineering of the National Science Foundation, Emergence of Tissue Engineering, Final Report, 2. Lavik y Langer, 2002 3. Regenerative Medicine (National Institutes of Health) Estos documentos estarán disponibles en el apartado de recursos correspondiente a la UD3. 13 Unidad didáctica 3: Inmunoterapia Dr. Ramón Gimeno Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Enfermedades de base inmune 4. El sistema inmune como red 5. Inmunoterapia 5.1 Anticuerpos 5.2 Adyuvantes 6. Inmunoterapia celular 7. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción El desarrollo de la inmunología como especialidad y el advenimiento, en los últimos años, de tecnologías que permiten analizar e incluso separar células antígeno-específicas ha permitido concebir y poner a punto novedosas estrategias terapéuticas, algunas de las cuales ya se han llevado a la práctica con éxito para tratar infecciones o tumores. A pesar de ello, y debido a su enorme complejidad, distan mucho de ser terapias consolidadas, por lo que las hemos incluido en la categoría de experimentales. En esta clase se analizarán los principios básicos de esta prometedora disciplina, que se complementarán con ejemplos prácticos. 2. Objetivos Hay tres ideas fundamentales que deben asimilar los alumnos: - La inmunoterapia tiene carácter funcional. - Es un tipo de terapia que exige una cualificación muy elevada por parte del personal médico tanto para su aplicación como para la evaluación de su eficacia. - La inmunoterapia celular no es una técnica de primera elección. La decisión de emplearla debe ser consensuada entre los diferentes profesionales que atienden al enfermo y los inmunólogos del centro. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Concepto Conjunto de procedimientos destinados a restaurar de forma terapéutica el funcionamiento normal del sistema inmune. El sistema inmune tiene como función preservar la integridad del organismo mediante la eliminación de elementos potencialmente dañinos, ya sean microbiológicos o de cualquier otra naturaleza. A efectos didácticos podemos considerar que el sistema inmune está dividido en dos grandes sistemas. La inmunidad innata y la inmunidad adquirida o específica, cada una con sus componentes y sus mecanismos de actuación. La realidad es que estos dos sistemas actúan de forma coordinada y a menudo interrelacionada. 4. Enfermedades de base inmune Con respecto a la inmunopatología podemos considerar dos grandes grupos: - Enfermedades causadas por la falta de respuesta del sistema inmune, y - Enfermedades causadas por una reactividad excesiva del sistema inmune. La primera categoría incluye las inmunodeficiencias, que pueden ser primarias, de origen genético y las secundarias a otros procesos. Entre las primeras podemos encontrar inmunodeficiencias que por el defecto genético afectan exclusivamente a un componente celular o inmunodeficiencias más complejas que afectan a más componentes celulares. También podemos ver inmunodeficientes más específicas del sistema innato y otras que afectan de forma preferente a la inmunidad adquirida. Las inmunodeficiencias secundarias no suelen ser tan específicas dando son cuadros mas generales. Una situación particular se da en casos en los que el sistema inmune no actúa aunque no exista ninguna alteración detectable. Es el caso de los tumores. El sistema inmune dispone de linfocitos que pueden reconocer diversos antígenos tumorales Sin embargo, el tumor es un tejido 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 propio y por tanto el sistema inmune no considera que sea algo nocivo y que haya que eliminar. Los mecanismos que previenen este ataque son múltiples yendo desde la baja afinidad de los receptores a la secreción por parte de las células tumorales de sustancias que previenen la activación de los linfocitos T. En el otro extremo se encuentran las enfermedades causadas por la reactividad excesiva del sistema inmune. Aquí también podemos distinguir varios escenarios. Las enfermedades autoinmunes están causadas porque el sistema inmune ha perdido la capacidad de distinguir entre lo que le es propio y lo que no. Consecuentemente ataca estructuras propias. Aquí distinguimos enfermedades que están más restringidas a un órgano, como la diabetes y otras de afectación más sistémica como el lupus. En las enfermedades de base alérgica lo que ocurre es que hay una reacción excesiva hacia a antígenos frente a los que la mayoría de la población reacciona de forma moderada. 5. El sistema inmune como red De una forma muy simplista, y centrándonos en la inmunidad específica podríamos explicar la respuesta inmune de forma secuencial. Existen células que captan el antígeno allá donde se encuentre, lo procesan y lo presentan a los linfocitos T en los órganos linfoides secundarios. Los linfocitos T, ya sean CD4 o CD8, se activan y sufren un proceso madurativo cuya fase final es la adquisición de una serie de funciones que les permiten eliminar los agentes nocivos bien directamente o bien modulando la actuación de otras células. En realidad todos los elementos, celulares y solubles del sistema inmune actúan de forma interrelacionada y sujetos a unos mecanismos de regulación muy delicados. En la diapositiva se ejemplifica este hecho con unas ilustraciones que intentan reflejar la actuación de las células CD8 con capacidad reguladora y la existencia de relaciones entre el sistema innato y el adaptativo mediadas por las células dendríticas. 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Esta complejidad se traduce en una consideración conceptual que se ha de tener muy presente desde el punto de vista terapéutico. La inmunoterapia celular trata de restaurar equilibrios, es por tanto una terapia funcional y no una mera infusión de células. A este respecto los avances en el campo de la inmunología permiten hacer un seguimiento de la efectividad de la actuación que se deben realizar como complemento de la administración del producto terapéutico. 6. Inmunoterapia Dejando a un lado los tratamientos farmacológicos clásicamente se ha distinguido entre inmunoterapia pasiva y activa. En el primer caso son los productos finales de la respuesta inmune los que se transfieren a los pacientes mientras que el objetivo de la inmunoterapia activa es que el propio organismo reaccione y elimine o neutralice al agente nocivo. Actualmente se han añadido aproximaciones más enfocadas a la inmunomodulación de la respuesta. En el siguiente cuadro aparecen algunos ejemplos de inmunoterapia, algunos ya en uso clínico y otros todavía en experimentación. • Vacunas (toxinas, patógenos muertos o atenuados, DNA) • Adyuvantes • Anticuerpos (IVIG, anticuerpos humanizados) • Citocinas o antagonistas de sus receptores (anti-TNF) • CTLA4-Ig • Terapia Celular (Células T específicas,…) • Péptidos antagonistas del TCR • Inducción de tolerancia oral 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Anticuerpos En el mercado podemos encontrar preparados de inmunoglobulinas purificados a partir del suero de animales inmunizados frente a determinadas toxinas o agentes infecciosos y preparados de inmunoglobulinas humanas de administración intravenosa que tienen un efecto inmunosupresor y que se emplean para frenar una respuesta inmune exacerbada (síndrome de GuillainBarré). También se pueden encontrar anticuerpos monoclonales dirigidos frente a diversas estructuras. Inicialmente estos anticuerpos eran de origen murino, y por tanto el organismo reaccionaba contra ellos y pronto dejaban de ser funcionales. Con el tiempo partes de estos anticuerpos se han ido sustituyendo por las porciones equivalentes en humanos y ahora se habla de anticuerpos humanizados, que son menos inmunogénicos. Ejemplos de estos anticuerpos son el Rituximab dirigido frente al CD20 que se usa en el tratamiento de algunos tipos de linfoma o el infliximab, un anticuerpo dirigido frente al TNF que se usa en la enfermedad de Crohn y otras enfermedades inflamatorias. Algunos de estos anticuerpos se emplean conjugados a toxinas o radiooisótopos para potenciar sus efectos. La vacunación es la forma más eficaz de inmunoterapia. Las fuentes de antígeno y las vías de administración son muy diversas. Se pueden utilizar organismos vivos atenuados, microorganismos muertos, fragmentos subcelulares o toxinas. El empleo de la biología molecular ha permitido sintetizar pequeños fragmentos peptídicos o genes enteros que se han utilizado para la producción industrial de vacunas altamente eficaces como la vacuna frente a la hepatitis B. Una fase más en el desarrollo de vacunas, utilizando también la tecnología del ADN recombinante, es la producción in situ, en el propio organismo, de grandes cantidades de antígeno. Para ello el gen de interés se clona en un vector que se inyecta en la proximidad de un ganglio linfático y allí se replica y con él el antígeno. Una variante de esta técnica utiliza el ADN correspondiente al 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 antígeno de interés sin necesidad de un vector en el que se pueda replicar, inyectándolo directamente. En otras ocasiones los vectores van a ser las propias células del enfermo, inyectando células tumorales como fuente de antígeno o células dendríticas preparadas para expresar los antígenos de interés. Ya sea frente a antígenos correspondientes a microorganismos o tumorales, en los casos anteriores se pretende establecer una respuesta frente a un agente nocivo, en las vacunas antialérgicas, el objetivo es cambiar el tipo de respuesta que el paciente da frente a un alergeno, de una respuesta predominantemente humoral, con producción de IgE y liberación de mediadores vasoactivos a una respuesta celular y más limitada. Adyuvantes De forma inespecífica podemos aumentar el grado de respuesta mediante el uso de diversas substancias conocidas con el nombre genérico de adyuvantes. El más utilizado en la producción de vacunas es el hidróxido de aluminio. También se pueden utilizar productos bacterianos, como extractos de B. pertussis. Parece que el mecanismo de acción de los adyuvantes es doble. Por una parte, concentra los antígenos en un determinado lugar, facilitando la tarea de las células presentadoras de antígeno y, por otra, activa una respuesta inflamatoria con la consiguiente producción de citocinas y factores quimiotácticos. Muchos de los componentes que se han empleado como adyuvantes en la preparación de vacunas también se han usado para potenciar la actividad del sistema inmune. Un caso particular son las citocinas y factores de crecimiento. Algunas de ellas ya con un uso regular en la clínica. Como ejemplos tenemos el interferón, principalmente en el tratamiento de enfermedades virales y autoinmunes pero también en el de algunos tumores, la interleucina 2, también en el tratamiento de ciertas formas de cáncer y el G-CSF que se utiliza para acelerar la reconstitución mieloide tras un trasplante hematopoyético. En el otro extremo se esta estudiando el uso de agentes que puedan bloquear la acción de estos factores, interfiriendo la unión a sus receptores. Otras modalidades terapéuticas centran su actividad en prevenir la activación de una respuesta que pueda resultar prejudicial. Entre estos agentes encontramos el Copaxone (Copolímero 1) que se utiliza en el tratamiento de la esclerosis múltiple. Entre los mecanismos de acción que se han descrito para explicar sus 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 propiedades inmunomoduladoras se encuentra la activación parcial y por tanto la inducción de tolerancia de las células específicas que reconocen la proteína básica de la mielina, uno de los antígenos diana en la esclerosis múltiple. La molécula CTLA-4-Ig bloquea la interacción de CD28 con sus ligandos dando origen a una señal inhibitoria en los linfocitos T. Además, se puede unir a las moléculas B7 en las células dendríticas activando el catabolismo del triptófano, lo cual da origen a señales tolerizantes en los linfocitos que interactúan con las células dendríticas. 7. Inmunoterapia celular La inmunoterapia también puede utilizar células como producto terapéutico. Hemos señalado con anterioridad la infusión de células dendríticas que, como presentadoras de antígeno tenían la misión de activar in vivo una respuesta inmune. Utilizando la inmunoterapia de forma pasiva lo que inyectamos son células efectoras, linfocitos T con la capacidad de actuar eliminando los agentes nocivos. El trasplante de progenitores hematopoyéticos es hasta la fecha el procedimiento de inmunoterapia pasiva más eficaz. El trasplante requiere un tratamiento de acondicionamiento previo y de intensidad variable que irremediablemente daña al sistema hematopoyético. En casos de neoplasias hematológicas este tratamiento incluye la quimio/radioterapia necesaria para la eliminación de las células cancerosas. Con la infusión de progenitores hematopoyéticos lo que se consigue es la regeneración del sistema hematopoyético que en el caso de los trasplantes alogénicos ha sido destruido. La inmunología ha puesto en evidencia el hecho de que el trasplante no es una mera operación de relleno, sino que es una actuación inmunoterapéutica. En el injerto se incluyen un numero variable de linfocitos T que van a reconocer 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 disparidades a nivel de los antígenos de histocompatibilidad mayores y menores en el receptor, un aspecto que ya ha sido tratado en otros capítulos del máster. Muchos de estos antígenos, especialmente los menores, se expresan mayoritariamente en las células del sistema hematopoyético y son fácilmente reconocibles por el sistema inmune del donante, representado por las células T del injerto. La importancia de la contribución de los linfocitos T del donante en el tratamiento antitumoral se evidencia en los casos en los que el injerto se trata para eliminar o reducir el número de linfocitos T con el objetivo de reducir el número y/o gravedad de los episodios de enfermedad del injerto contra el huésped (graft versus host disease o GVHD). En estos casos se ha visto que hay en primer lugar mayores dificultades para el injerto además de un aumento franco del número de recaídas que se explican por la pérdida del efecto antitumoral. La administración de linfocitos del donante (DLI, del inglés donor lymphocyte infusions) con posterioridad al trasplante es un procedimiento controlado que pretende eliminar las células tumorales en casos de recaída tras un trasplante alogénico una vez superada la fase de injerto y cuando ya se ha establecido el quimerismo celular. Al seguir siendo un procedimiento carente de especificidad el riesgo de GVHD se mantiene. En 1994, un grupo del Memorial Sloan Kettering Cancer Center pudo conseguir la remisión de un proceso linfoproliferativo causado por el EBV en pacientes tratados con trasplante de medula ósea utilizando linfocitos del donante sin someterlos a ningún tipo de selección previa. Sin embargo, esta falta de especificidad llevó a la aparición de cuadros de GVHD y dos de los pacientes murieron. La evolución lógica de estas aproximaciones es la infusión de linfocitos con especificidad definida. Las enfermedades infecciosas y el cáncer son los dos grandes grupos de patologías que se pueden abordar con inmunoterapia. Entre las primeras las causadas por virus, especialmente el citomegalovirus (CMV) y el virus de Epstein-Barr (VEB), son las que más estudios han generado. Entre las neoplásicas, los mayores avances se han conseguido en el tratamiento del melanoma. 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 1 Aislar células T Generar in vitro células T con especificidad frente al antígeno de interés Infecciones víricas Tumores Expansión in vitro Terapia celular Las líneas generales del procedimiento se esbozan en la figura 1. En el caso de los tumores, la fuente principal de linfocitos con especificidad frente a los antígenos tumorales son las células que infiltran el tumor. El principal problema en estos casos es la baja afinidad de los receptores de los linfocitos que pueden reconocer estos antígenos. Otros factores a considerar son los mecanismos de escape de los tumores. Esto hace que la terapia anti-tumoral no haya conseguido todavía los efectos deseados. En el caso de la terapia antiviral, hay numerosos estudios que avalan su utilización en diferentes contextos. En lo que resta de exposición nos centraremos en explicar esta aplicación. En líneas generales se pueden dar dos situaciones: A. El paciente es una persona que no ha tenido contacto con el virus. B. El paciente ha estado expuesto previamente al virus. La diferencia se encuentra en el número de células T específicas frente al virus. Un contacto previo presupone que el repertorio inicial ha aumentado. Al tener un número de precursores mayor la generación de linfocitos con actividad citotóxica resulta menos complicada que tenerlos que expandir a partir de la dotación original. 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Existen diversas técnicas que permiten hacer una estimación del porcentaje de células que van a reaccionar frente a un antígeno determinado. Con tetrámeros o pentámeros y citometría de flujo se puede determinar el número de células que son capaces de establecer un contacto con un péptido determinado presentado por una molécula de histocompatibilidad concreta. En el mercado existen diferentes combinaciones disponibles, aunque no cubren ni todos los antígenos ni todas las posibles moléculas de histocompatibilidad. En www.proimmune.com o www.immunomics.com se puede encontrar información referente a estas técnicas. Otras técnicas permiten la cuantificación desde un punto de vista funcional. Las más usuales miden la producción de interferón en respuesta al estímulo. Mediante citometría de flujo se puede detectar el interferón intracelular. Becton Dickinson® explica en su página web los principios de la técnica (ver http://www.bdbiosciences.com/pharmingen/protocols/Intracellular_Cytokine s.shtml). El ELISPOT detecta la producción local de interferón utilizando una técnica similar al ELISA que en lugar de medir la concentración de un producto en solución cuantifica mediante el contaje de puntos (spots) el número de células que responden secretando interferón ya que éste queda retenido en una membrana. Mabtech® es una de las casas comerciales que sirve este producto. En su página web se detallan los principios fundamentales del procedimiento www.mabtech.com. Una vez establecida la reactividad del paciente, el porcentaje de células que potencialmente van a responder al estímulo condiciona el tipo de procedimiento a seguir. Mediante restimulaciones in vitro se consigue seleccionar y expandir la población reactiva y en el caso de donantes no relacionados, evitando la presencia de células aloreactivas. Se han descrito diferentes estrategias para generar linfocitos con reactividad frente a antígenos virales. Para estimular los linfocitos se han utilizado fibroblastos autólogos infectados con CMV, células B activadas transformadas con el VEB, células dendríticas presentando péptidos o antígenos virales o modificadas genéticamente. Algunos de estos métodos se han empleado para generar linfocitos T utilizados eficazmente en protocolos de terapia celular. Sin embargo, todavía hay que resolver algunas cuestiones antes de que estos procedimientos puedan ser 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 aplicados de manera habitual en la clínica. Una de ellas es la necesidad de largos periodos de cultivo in vitro antes de la infusión. Para reducir este tiempo, y con ello el coste del proceso, en los últimos años se han ido introduciendo técnicas que permiten la purificación previa de las células T reactivas, de forma que se puede hacer la expansión celular de forma selectiva. Una de estas técnicas emplea tetrámeros diseñados para identificar células que reconocen un péptido presentado en una molécula de histocompatibilidad definida y partículas magnéticas. Cobbold y sus colaboradores han descrito recientemente como la infusión de una mínima cantidad (menos de 1 millón por paciente) de células purificadas de esta forma es capaz de combatir la reactivación de la infección por CMV tras un trasplante de médula ósea. Otra de estas técnicas emplea la producción de interferón, un criterio funcional, para seleccionar las células de interés utilizando igualmente un sistema de Más información purificación magnética. De esta forma no existe la necesidad absoluta de conocer los epítopos más immunogénicos ni las limitaciones que impone el MHC y se puede aplicar para luchar contra patógenos que ni siquiera están caracterizados desde el punto de vista de su inmunidad. Los últimos ensayos clínicos publicados combinan ambas aproximaciones: la selección funcional y los procedimientos de expansión. 13 En la página web del NIH http://clinicaltrials.gov/ se puede encontrar información referente a los ensayos clínicos aprobados en terapia celular. Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 8. Bibliografía 1. Meyers JD, Bowden RA, Counts GW. Infections after bone marrow transplantation. In: Infections in Transplant Patients (Lode H, Huhn D, Melzahn M, eds). Stuttgart: Georg Thieme Verlag 1987; pp17–32. 2. Hanto DW, Frizzera G, Gajl- Peczalska KJ, Simmons RL. Epstein-Barr virus, immunodeficiency and B cell proliferation. Transplantation 1985; 39:461–72. 3. Shapiro RS, McClain K, Frizzera G et al. Epstein-Barr virus associated B-cell lymphoproliferative disorders following bone marrow transplantation. Blood 1988; 71:1234–43. 4. Quinnan GV, Jr, Kirmani N, Rook AH et al. Cytotoxic T cells in cytomegalovirus infection: HLA restricted T-lymphocyte and nonTlymphocyte cytotoxic responses correlate with recovery from cytomegalovirus infection in bone marrow transplant recipients. N Engl J Med 1982; 307:7–13. 5. Reddehase MJ, Weiland F, Munch K et al. Interstitial murine cytomegalovirus pneumonia after irradiation: characterization of cells that limit viral replication during established infection of the lungs. J Virol 1985; 55:264–73. 6. Riddell SR, Watanabe KS, Goodrich JM et al. Restoration of viral immunity in immunodeficient humans by the adoptive transfer of T cell clones. Science 1992; 257:238–41. 7. Papadopoulos EB, Ladanyi M, Emanuel D et al. Infusions of donor leukocytes as treatment lymphoproliferative of disorders Epstein- Barr complicating virus associated allogeneic marrow transplantation. N Engl J Med 1994; 330:1185–91. 8. Rooney CM, Smith CA, Ng CY et al. Use of gene-modified virusspecific T lymphocytes to control Epstein- Barr-virus-related lymphoproliferation. Lancet 1995; 345:9–12. 9. Reusser P, Riddell SR, Meyers JD, Greenberg PD. Cytotoxic Tlymphocyte response to cytomegalovirus after human allogeneic bone marrow transplantation: pattern of recovery and correlation with cytomegalovirus infection and disease. Blood 1991; 78:1373–80. 10. Li CR, Greenberg PD, Gilbert MJ et al. Recovery of HLA-restricted cytomegalovirus (CMV) specific T cell responses after allogeneic bone 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 marrow transplantation: correlation with CMV disease and effect of ganciclovir prophylaxis. Blood 1994; 83:1971–9. 11. Walter EA, Greenberg PJ, Gilbert MJ et al. Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T-cell clones from the donor. N Engl J Med 1995; 333:1038–44. 12. Locatelli F, Percivalle E, Comoli P et al. Human cytomegalovirus infection in paediatric patients given allogeneic bone marrow transplantation: role of early treatment of HCMV antigenaemia on patients’ outcome. Br J Haematol 1994; 88:64–71. 13. Goodrich JM, Bowden RA, Fisher L et al. Ganciclovir prophylaxis to prevent cytomegalovirus disease after allogeneic marrow transplant. Ann Intern Med 1993;118:173–8. 14. Rickinson AB, Moss DJ. Human cytotoxic T lymphocyte responses to Epstein-Barr virus infection. Annu Rev Immunol 1997; 15: 405–31. 15. Nalesnik MA. Posttransplantation lymphoproliferative disorders (PTLD): current perspectives. Semin Thorac Cardiovasc Surg 1996; 8:139– 48. 16. Heslop EE, Rooney CM. Adoptive cellular immunotherapy for EBV lymphoproliferative diseases. Immunol Rev 1997; 157:217–22. 17. O’Reilly R, Small TN, Papadopulos E et al. Biology and adoptive cell therapy of Epstein-Barr-virus associated lymphoproliferative disorders in recipients of marrow allografts. Immunol Rev 1997; 157:195–216. 18. Hale G, Waldmann H. Risks of developing Epstein-Barr virusrelated lymphoproliferative disorders after T-cell-depleted marrow transplants. CAMPATH Users. Blood 1998; 1:3079–83. 19. Rooney CM, Loftin SK, Holladay MS et al. Early identification of Epstein-Barr virus associated posttransplant Lymphoproliferative disorders. Br J Haematol 1995; 89:98–103. 20. Thomas JA, Allday MJ, Crawford DH. Epstein-Barr virus-associated lymphoproliferative disorders in immunocompromised individuals. Adv Cancer Res 1991;57:329–80. 21. Bonini C, Ferrari G, Verzeletti PS et al. HSV-tk gene transfer into donor lymphocytes for control of allogeneic graft-versus-leukemia. Science 1997; 276:1719–24. 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 22. Heslop HE, Ng CY, Li C et al. Long-term restoration of immunity 12 Adoptive Immunotherapy in Transplant Recipients • HERPES 7:1 2000 . Nat Med 1996; 2:551–5. 23. Rooney CM, Smith CA, Ng CYC et al. Infusion of cytotoxic T cells for the prevention and treatment of Epstein-Barr virus-induced lymphoma in allogenic transplant recipients. Blood 1998;92:1549–55. 24. Imashuku S, Goto T, Matsumura T et al. Unsuccessful CTL transfusion in a case of post-BMT Epstein Barr virus-associated lymphoproliferative disorder (EBV-LPD). Bone Marrow Transplant 1997; 20:337–40. 25. Randhawa PS, Yousem SA, Paradis IL et al. The clinical spectrum, pathology, and clonal analysis of Epstein-Barr virus-associated lymphoproliferative disorders in heart-lung transplant recipients. Am J Clin Pathol 1989; 92:177–85. 26. Craig FE, Gulley ML, Banks PM. Post-transplantation lymphoproliferative disorders. Am J Clin Pathol 1993; 99:265–76. 27. Cox KL, Lawrence-Miyasaki LS, Garcia-Kennedy R et al. An increased incidence of Epstein- Barr virus infection and lymphoproliferative disorder in young children on FK506 after liver transplantation. Transplantation 1995; 59:524–9. 28. Newell KA, Alonso EM, Whitington PF et al. Posttransplant lymphoproliferative disease in pediatric liver transplantation. Interplay between primary Epstein- Barr virus infection and immunosuppression. Transplantation 1996;62:370–5. 29. Shapiro RS, Chauvenet A, McGuire W et al. Treatment of B-cell lymphoproliferative disorders with interferon alfa and intravenous gamma globulin. N Engl J Med 1988; 318:1334. 30. Fisher A, Blanche S, Le Bidois J et al. Anti-B-cell monoclonal antibodies in the treatment of severe B-cell lymphoproliferative syndrome following bone marrow and organ transplantation. N Engl J Med 1991; 324:1451–6. 31. Savoldo B, Cubbage ML, Durett AG et al. Generation of EBV-specific CD4+ cytotoxic T cells from virus naïve individuals. J. Immunol. 2002; 168: 909-918 32. Ho WY, Nguyen HN, Wolfl M et al. In vitro methods for generating CD8+ T-cell clones for immunotherapy from the naive repertoire. J. Immunol. Methods 2006; 310: 40-52 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 33. Park KD, Marti L, Kurtzberg. J et al. In vitro priming and expansion of Cytomegalovirus-Specific TH1 and Tc1 T cells from naïve cord blood lymphocytes. 2006; 34. Melzi ML, Sonzogni A, Comoli P, et al. Specific autologous cytotoxic T lymphocytes for chronic varicella in a liver transplanted child. Pediatr. Transplantation. 2006; 10: 240-243 35. Khanna R and Diamond DJ. Human cytomegalovirus vaccine: time to look for alternative options. Trends in Molecular Medicine. 2006; 12: 1 , 26-33 36. Emanuel DJ, Lucas KG, Mallory GB et al. Treatment of post-transplant lymphoproliferative disease in the central nervous system of a lung transplant recipient using allogeneic leukocytes. Transplantation 1997; 63:1691–4. 37. Haque T, Amlot PL, Helling N et al. Reconstitution of EBV-specific T cell immunity in solid organ transplant recipients. J Immunol 1998; 160:6204–9. 38. Comoli P, Locatelli F, Gerna G et al. Autologous EBV-specific cytotoxic T cells to treat EBV-associated post transplant lymphoproliferative disease (PTLD). Blood 1997; 90(Suppl 1):249a. 39. Khanna R, Bell S, Sherritt M et al. Activation and adoptive transfer of Epstein-Barr virus-specific cytotoxic T cells in solid organ transplant patients with posttransplant lymphoproliferative disease. Proc Natl Acad Sci USA 1999; 96:10391–6. 40. von Bergwelt-Baildon MS, Vonderheide RH, Maecker B et al. Human primary and memory cytotoxic T lymphocyte responses are efficiently induced by means of CD40-activated B cells as antigen-presenting cells: potential for clinical application. Blood 2002; 99: 3319-3325 41. Kleihauer A, Grigoleit U, Hebart H et al. Ex vivo generation of human cytomegalovirus-specific cytotoxic T cells by peptide-pulsed dendritic cells. Br. J. Haematol. 2001; 113: 231-139 42. Peggs K, Verfueth S, Mackinnon S. Induction of Cytomegalovirus (CMV)-specific T cell responses using dendritics cells pulsed with CMV antigen: a novel culture system free of live CMV virions. Blood 2001; 97: 994-1000 43. Foster AE, Bradstock KF, Sili U. A comparison of gene transfer and antigen-loaded dendritic cells for the generation of CD4+ and CD8+ 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 cytomegalovirus-specific T cells in HLA-A2+ and HLA-A2- donors. Biol. Blood Marrow Transplant 2004; 10(11): 761-71 44. Cobbold M, Khan N, Pourgheysari B. Adoptive transfer of cytomegalovirus-specific CTL to stem cell transplant patients after selection by HLA-peptide tetramers. J. Exp. Med. 2005: 202 (3): 379386 45. Beck O, Topp MS, Koehl U et al. Generation of highly purified and functionally active human TH1 cells against Aspergillus fumigatus. Blood 2006; 107 (6): 2562-2569 18 Unidad didáctica 3: Medicina regenerativa Dr. Luciano Rodríguez Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular. Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión Sumario 1. Introducción 2. Objetivos 3. Medicina regenerativa. Conceptos básicos 4. Células madre 4.1 Conceptos básicos 4.2 Clasificación 4.2.1 Según su capacidad de diferenciación 4.2.2 Según su origen 5. Estrategias prácticas en medicina regenerativa 5.1 Terapia celular 5.2 Regeneración sobre matrices 5.3 Regeneración con biomoléculas activas 6. Células mesenquimales 6.1 Aplicación clínica de las MSC. Terapia Celular. Trasplante de Progenitores Hematopoyéticos (TPH) 6.1.1 Facilitación de injerto 6.1.2 Tratamiento de la Enfermedad de Injerto Contra el Huésped (EICH) 6.1.3 TPH de progenitores de sangre de cordón umbilical (SCU) 7. Aplicaciones de Medicina Regenerativa 7.1 Traumatología 7.2 Infarto de miocardio 8. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión 1. Introducción Nuestro organismo tiene una capacidad natural de autorenovar algunos de sus tejidos y frente a una lesión en la piel, un músculo, incluso un hueso, el tejido dañado se regenera con el tiempo. Además, muchas de las patologías que afectan al ser humano se relacionan con el desgaste o degeneración de sus tejidos bien sea de forma aguda (p.e.: accidentes vasculares) o crónica (desgasteenvejecimiento). Sin embargo, esta capacidad de autorenovación es limitada y depende, en general, de la extensión del daño tisular. Así, la muerte de gran cantidad de tejido de forma aguda no puede ser reparado por mecanismos naturales debido a que resulta incompatible con la vida o a que falla alguno de los procesos que sigue una regeneración fisiológica; las células encargadas de la regeneración no llegan de forma eficiente al lugar del daño (bien sea porque no se encuentran en número suficiente o no reciben señales adecuadas para su movilización) o porque el proceso de inflamación, una infección o la falta de vascularización sitúa a esas células en un escenario que impide el resto de mecanismos necesarios para llevar a cabo la sustitución del tejido dañado. En este contexto, el de la regeneración natural, y para el tratamiento de diversas patologías vienen desarrollándose diferentes aproximaciones terapéuticas que se engloban dentro de la denominada medicina regenerativa. 2. Objetivos Después de estudiar esta unidad, el alumno debería de ser capaz de: - Definir los conceptos básicos a nivel teórico y práctico que se utilizan en medicina regenerativa. - Entender y valorar objetivamente la información que surge cada día en esta disciplina. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión 3. Medicina regenerativa. Conceptos básicos La medicina regenerativa busca la mejora, mantenimiento o restitución funcional de un órgano o tejido mediante el uso de células vivas como agentes terapéuticos (terapia celular), bien sean aisladas o como parte de estructuras complejas que mimetizan la estructura histológica del órgano o tejido a reparar (ingeniería tisular). Esta última disciplina aplica los principios de la ingeniería y de las ciencias de la vida para conocer los fundamentos básicos de la relación estructura-función tanto en tejidos normales como patológicos con el objetivo de desarrollar sustitutos que reemplacen funcionalmente un tejido. Esta nueva especialidad, por definición multidisciplinar, se encuentra en pleno desarrollo y ofrece una alternativa a los medicamentos “clásicos” que basan su acción terapéutica en la mejora de los síntomas pero que generalmente no representan una solución definitiva para la restitución funcional de un órgano o tejido dañado. Adicionalmente, la medicina regenerativa se vislumbra como el punto de partida de tratamientos efectivos de enfermedades para las que hoy por hoy no existe ninguna terapia efectiva como el parkinson o las lesiones medulares. Figura 1 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión Actualmente se acepta que las células con más posibilidades de traslación clínica a corto-medio plazo, por su fácil accesibilidad, la ausencia de controversia éticolegal en su utilización y el hecho de que son las más activamente ensayadas en humanos, son las células madre adultas (células madre específicas de tejido). Estos tipos celulares se encuentran en muy baja proporción en el tejido en el que residen y necesitan, en la mayoría de los casos, un proceso de aislamiento y posterior expansión ex vivo para su uso clínico. Un ejemplo en la clínica actual son las células mesenquimales derivadas de la médula ósea o de grasa subcutánea. Por último, destacar que la producción industrial, el mercado y la comercialización de estas herramientas terapéuticas para uso humano ya han sido reguladas por la Comisión Europea y reciben la denominación de medicamentos de terapias avanzadas. 4. Células madre 4.1 Conceptos básicos Las células madre son células indiferenciadas con capacidad de autorenovación (pueden replicarse de forma infinita sin perder sus propiedades) y capaces de dar lugar a células especializadas maduras de distintos linajes (con diferentes características y funciones). Estas cualidades hacen de ellas algo único en organismos donde la gran mayoría de sus unidades funcionales son células diferenciadas con una única función, pero lo más importante es que son una fuente, en teoría casi inagotable, de células que pueden regenerar un órgano o tejido que ha sufrido un daño o traumatismo imposible de ser superado por un proceso de regeneración natural. 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión Figura 2 En general, los términos célula madre, troncal (stem), progenitora o precursora se utilizan sin mucha rigurosidad y de forma indistinta porque todos ellos hacen referencia a la capacidad de diversos tipos celulares de “regenerar” algún nicho biológico. No obstante, estos términos, heredados de la experiencia con progenitores hematopoyéticos CD34+, no hacen referencia a un mismo tipo celular sino que incluyen en realidad una miscelánea que va desde células con capacidad de autorenovación y diferenciación (progenitoras) hasta células comprometidas a linaje con poca o ninguna capacidad de autorenovación (precursoras). Troncal (stem) es un término descrito inicialmente para células procedentes del estado embrionario pero que ha sido acuñado dentro del contexto de las células madre adultas (origen NO embrionario). Del conocimiento adquirido con las células madre hematopoyéticas se desprende que la transición desde el compartimiento stem, aquel que puede regenerar totalmente un nicho biológico funcional, hasta el de célula progenitora (compromiso a linaje) se asocia con una disminución de las capacidades de autorenovación y proliferación. Estas capacidades se pierden cuando una célula progenitora se compromete a un linaje concreto (pérdida de la capacidad de autorenovación) o inicia su maduración hacia un tipo celular concreto (pérdida de su capacidad de proliferación). Se entiende que el compartimiento de células 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión progenitoras está formado por células con una capacidad de diferenciación más limitada y pueden ser uni-, bi- o multipotenciales (capacidad de diferenciación a diversos linajes). En términos prácticos, lo que suscita tanto interés sobre las células madre es que en un microambiente determinado, es decir, bajo la influencia de señales, interacciones y una estructura tridimensional correcta pueden diferenciarse a uno u otro tejido. Las células maduras totalmente diferenciadas bajo las mismas condiciones no tienen la posibilidad de dar lugar a células que funcionalmente sean diferentes a lo determinado en su origen. El gran reto, y el campo en el que se están invirtiendo más esfuerzos y recursos, es el de conocer cuáles son las señales y los factores determinantes que influyen en la decisión de una célula progenitora para dar lugar a uno u otro tipo funcional para así poder utilizarlas terapéuticamente. En este sentido las primeras experiencias clínicas se han basado en la introducción de células madre esperando que las señales de regeneración producidas en el lugar de la lesión sean suficientes para activar y dirigir la diferenciación de estas células hacia el tejido a sustituir. Los resultados experimentales obtenidos muestran claramente que esta aproximación no es suficiente y que una decisión crítica en el desarrollo de terapias útiles es elegir qué células madre son más adecuadas en cada aplicación. 4.2 Clasificación La bibliografía científica propone diferentes fuentes de células madre: a) Embriones almacenados en clínicas de fertilidad que no fueron utilizados por las parejas donantes. b) Embriones creados por medio de fertilización in vitro para el propósito específico de obtener células madre. c) Embriones clonados por medio del método de transferencia somática nuclear. d) Fetos de desarrollo temprano que han sido abortados. e) Cordones umbilicales. f) Tejidos u órganos de individuos adultos obtenidos mediante cirugía. 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión g) Cadáveres: El aislamiento y supervivencia de células progenitoras neurales de tejidos post-mortem (hasta 20 horas después de la muerte) ha sido reportado. h) De células adultas reprogramadas para desdiferenciarse. Figura 3: Clasificación de las células madre Desarrollo embrionario 2 días. 3-4 días. Post-natal Mórula. Blastocito. Tejido placentario. Adulto. Cordón Umbilical. Líquido Amniótico. Totipotenciales Pluripotenciales Células Madre Embrionarias. 4.2.1 Pluripotenciales o Multipotenciales Células Madre Adultas. Según su capacidad de diferenciación Independientemente del origen de las células madre a las que se refieren los textos científicos, podemos clasificarlas en: - Células totipotenes: Pueden dar lugar a un organismo completo y por tanto a todos los tejidos de un organismo adulto. Cualquier célula totipotencial colocada en el útero de una mujer tiene la capacidad de originar un feto y un nuevo individuo. Se incluirían aquí cualquier célula embrionaria desde el zigoto hasta la formación del blastocito. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión - Células pluripotentes: Capaces de producir la mayor parte de los tejidos y cualquier tipo de célula de un organismo aunque no pueden generar un embrión. Podrían dar lugar a un tejido funcional de cualquiera de las tres capas embrionarias (ecto-, meso- o endodermo). Las células de la masa interna del blastocito son pluripotenciales pero se han publicado diferentes trabajos que señalan la existencia de células pluripotenciales en tejidos adultos. - Células multipotentes: Se encuentran en los individuos adultos. Pueden generar células especializadas de un solo tejido concreto aunque in vitro puedan producir otros tipos, indicando que en las condiciones necesarias pueden tener más versatilidad de la que muestran. Aunque las células madre embrionarias se han considerado como pluripotenciales y las células madre adultas solo multipotenciales, la bibliografía actual sugiere que algunos tipos concretos de células madre adultas incluye células pluripotenciales en algunos tejidos y órganos. Cuando una célula madre multipotencial es capaz de diferenciarse a tejidos ajenos a aquellos derivados de su capa embrionaria de origen hablamos de plasticidad o capacidad de transdiferenciación. 4.2.2 Según su origen: Células embrionarias Estas células derivan de la masa celular interna del embrión en estadio de blastocisto (7-14 días), y son capaces de generar, en teoría, todos los tipos celulares del cuerpo. De estas células se supone derivaran, tras diversas divisiones celulares, las células madre órgano-específicas. El cigoto formado tras la fecundación de un óvulo por un espermatozoide es una célula capaz de generar un nuevo individuo completo con todos sus órganos y tejidos. Entre los días primero al cuarto del desarrollo embrionario, la célula original va dividiéndose en varias células que, si fueran separadas del resto, podrían generar un individuo completo. A partir del cuarto día del desarrollo embrionario humano se forma el blastocito que está formado por una 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión capa externa, una masa celular interna y una gran cavidad interior. La capa externa (trofoblasto) formará la placenta y las envolturas embrionarias y la masa celular interna (embrioblasto) formará todos los tejidos del cuerpo humano. Las células de un blastocisto ya no son totipotentes, porque una sola de estas células no es capaz de generar un individuo completo. Las células de la masa celular interna del blastocisto son células pluripotentes. Si en las primeras fases del desarrollo del embrión extraemos las células de la masa celular interna del blastocisto y logramos especializarlas, podríamos obtener cualquier tejido para trasplante. Figura 4 Las células embrionarias con las que se experimenta en medicina regenerativa provienen, en la mayoría de los casos, del aislamiento directo de la masa interna de un blastocito (aprox. 30 células) sobre un plástico de laboratorio en el que se incuban sobre estromas epiteliales de ratón (actualmente existen alternativas que evitan el uso de las células murinas) que actúa como capa alimentadora y soporte físico al que se adhieren. Si estas células proliferan durante más de seis 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión meses sin diferenciarse y sin ningún tipo de modificación genética se consideran como pluripotenciales y determinan una línea de células madre embrionarias. Destacar que las células embrionarias en cultivo, si se permite su unión para formar colonias o cuerpos embriónicos (embryoid bodies), por ejemplo cultivándolas en suspensión, éstas diferenciarán espontáneamente. Para la caracterización de células madre embrionarias se utiliza uno o varios de los siguientes métodos: - Cultivo y resiembra de las células candidatas durante varios meses para asegurar que son capaces de autorenovación. Durante el cultivo, estas células son inspeccionadas para asegurar que su morfología se mantiene y por tanto que siguen indiferenciadas. Además, se examinan los cromosomas para verificar si existe un cariotipo correcto. - Identificar en las células candidatas marcadores de superficie, Marcadores proteínas o factores de trascripción propios de células indiferenciadas (http://stemcells.nih.gov/info/scireport/appendixe.asp#eii). - Examinar la capacidad pluripotencial permitiendo a las células candidatas diferenciarse espontáneamente en cultivo y examinar que los diferentes tipos celulares a los que puede dar lugar pertenecen a las tres capas embrionarias. Manipular las células candidatas para inducir algún tipo de diferenciación específica o introducirlas en animales inmunosuprimidos para examinar la formación de teratomas. Las células madre embrionarias presentan ventajas respecto a las células madre adultas porque poseen el potencial de formar cualquier célula del cuerpo, son inmortales y por tanto un linaje celular puede potencialmente suministrar una cantidad infinita de células con características definidas y son fácilmente accesibles porque los embriones humanos pueden ser obtenidos de las clínicas de fertilidad. Sin embargo, la diferenciación de estas células es difícil de controlar y una vez activado un programa de diferenciación, actualmente resulta técnicamente imposible pararlo pudiendo generar células no deseadas. Adicionalmente, estas células podrían activar respuestas inmunes porque las células trasplantadas difieren en su perfil inmune de las del recipiente y serán rechazadas. Por último 11 El siguiente enlace contiene amplia información sobre las CM: http://stemcells.nih.gov/info/ basics/defaultpage.asp Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión destacar la controversia ético-legal que supone destruir embriones congelados para desarrollar este tipo de terapias y que imposibilitan en muchos casos su utilización. Células específicas de tejidos Célula derivada o residente de un tejido post-natal o adulto. Incluye las células placentarias, de cordón umbilical y aquellas derivadas del líquido amniótico. Se han identificado células madre adultas (células madre somática) en casi todos los tejidos del organismo entre los que se destacan el cerebro, el corazón, la sangre periférica, la médula ósea, la grasa, la piel y el hígado. Sin embargo no se conoce el origen de estas células y se supone que provienen del desarrollo embrionario y se mantienen en los tejidos adultos en un estado quiescente hasta que son activadas para reparar el tejido dañado. Figura 5 Para identificar células madre adultas se utiliza uno o varios de los siguientes métodos: - Se marcan las células candidatas con marcadores moleculares y se introducen en un tejido vivo para determinar qué tipos celulares son capaces de generar. 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión - Se aíslan las células, se marcan durante su cultivo in vitro y se inyectan en un nuevo individuo para observar si pueden repoblar su tejido de origen. - Las células son aisladas y expuestas in vitro a factores de crecimiento o modificación genética para observar qué tipos celulares genera. Adicionalmente, estas células han de demostrar crecimiento clonal, es decir que pueden dar lugar in vitro a una línea celular genéticamente idéntica a la célula origen. Es de destacar que estos tipos celulares residentes de tejido muestran en diversos casos algún tipo de especialización o programas de diferenciación que prevalecen sobre otros y por tanto la inducción de la diferenciación a algunos tipos celulares concretos puede resultar más sencilla que en el caso de las células embrionarias. Además, el hecho que pueden ser utilizadas de forma autóloga, extraídas y reimplantadas en un mismo paciente, presenta ventajas inmunológicas respecto a las células madre embrionarias. Sin embargo, el hecho de que se encuentren en pequeñas cantidades en los tejidos de origen introduce una clara desventaja para su utilización porque estos tipos celulares crecen con cinéticas lentas y no es fácil obtenerlas en grandes cantidades. Además, se ha reportado la aparición de aberraciones cromosómicas después de 30 pases en cultivo con estos tipos celulares. Las células madre somáticas (adultas o tejido-específicas), en la mayoría de los casos descritos, no se diferencian significativamente del resto de células del tejido en el que se localizan, tanto morfológica cómo fenotípicamente son prácticamente iguales al resto de células del tejido, lo que dificulta enormemente su identificación y en consecuencia su aislamiento. Únicamente puede identificarse una célula progenitora por su capacidad de dar lugar a tipos celulares diferentes funcionalmente y siendo estrictos debería demostrarse que es capaz a nivel clonal (a partir de una sola célula) de dar lugar a una estructura funcional y no transitoria in vivo. Las células que tienen que ser cultivadas o manipuladas ex vivo para uso humano son consideradas medicamentos y en la legislación actual están definidas como medicamentos de terapia celular somática en el grupo de medicamentos de 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión terapia avanzada (ley 29/2006), y como tales deberán demostrar efectividad y seguridad en el balance beneficio riesgo antes de ser una realidad clínica. Adicionalmente, las instalaciones donde se producirán, expandirán o manipularan estas células-medicamento deberán ser legalizadas por las autoridades competentes como laboratorios farmacéuticos (RD 2183/2004) y los procesos de fabricación serán del mismo nivel de seguridad y trazabilidad que los utilizados en la industria farmacéutica. Pero el proceso de fabricación de este tipo de medicamentos es complejo y todavía está en pleno desarrollo. Debemos tener en cuenta que el proceso de producción y el producto final están íntimamente ligados, es decir, el proceso define la totalidad del producto, que además está vivo y debe permanecer así cuando se implante en el paciente (se necesitan múltiples manipulaciones, normalmente son manuales y el producto final debe ser estéril y hasta el empaquetado de éste debe cumplir requisitos médicos) y como no se ha definido si esta clase de terapias serán “a medida” o bajo la base de grandes producciones, no están todavía bien definidos ni los productos ni los procesos productivos. 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión 5. Estrategias prácticas en medicina regenerativa En general, todas las aproximaciones técnicas de terapia regenerativa se basan en la combinación de algún tipo de células progenitoras con matrices / soportes y la presencia o no de moléculas reguladoras. Dependiendo del tipo de tejido a reparar o sustituir se emplean una o varias combinaciones de las estrategias básicas que se exponen a continuación: Figura 6 5.1 Terapia celular Se basa en situar nuevas células sanas, progenitoras o diferenciadas ex vivo, en el tejido a reparar esperando que puedan sustituir la estructura dañada o defectuosa directamente o bien facilitando el reclutamiento de otras células que ayuden a su reparación. Aunque debemos ser conscientes que estamos todavía dando los primeros pasos en la definición de qué células pueden ser las más adecuadas para cada una de las necesidades, la terapia ideal sería aquella que 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión permita que las células lleguen de forma preferente al lugar donde se requiere su acción, se integren funcionalmente en el contexto tisular existente y que no produzcan rechazo inmunológico. En este contexto se sitúan tanto el uso de células mesenquimales para regeneración ósea como para el control de la enfermedad de injerto contra el huésped en el trasplante hematopoyético, pasando por la utilización de células madre de limbo corneal para regenerar córneas, hasta la infusión de células inmunocompetentes (linfocitos T específicos, dendríticas) para reforzar o restituir la funcionalidad de sistemas inmunes comprometidos. 5.2 Regeneración sobre matrices Se basa en la siembra de una estructura porosa y biodegradable con células y/o factores de crecimiento que actúa de andamiaje (estructura primaria) a modo de matriz extracelular fisiológica que soporta y dirige la diferenciación de las células hacia el tejido funcional. Este primer paso es seguido de un cultivo ex vivo que persigue la expansión y colonización de la estructura temporal para su posterior implante. El objetivo final es una sustitución progresiva del andamiaje biodegradable por matriz extracelular generada por las células sembradas que actúe, cual matriz fisiológica, como soporte y regulador funcional. En este sentido, los puntos clave para el desarrollo de este tipo de aproximaciones son actualmente: qué composición y dimensiones deben tener las matrices, cómo colonizarlas para asegurar una distribución que no comprometa la funcionalidad pero que permita el aporte de nutrientes y gases y cómo integrar estas estructuras en los tejidos in vivo. Para este tipo de estrategia sin duda será imprescindible el desarrollo de materiales y tecnología de micro ingeniería. Sin duda el mejor ingeniero de tejidos que ha existido nunca es la propia naturaleza. Así, el diseño de soportes tridimensionales (scaffolds) sobre los que se siembran, crecen y se diferencian las células progenitoras deberían mimetizar las estructuras de las matrices extracelulares fisiológicas, tanto en lo que se refiere a su composición, comportamiento mecánico como a su estructura jerárquica. Sin embargo, la composición exacta de muchas de estas matrices fisiológicas no se 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión conoce con suficiente precisión y en aquellas en las que se conoce lo suficientemente bien, se está experimentando con la tecnología que permita crear un proceso de nano-fabricación efectivo para uso clínico. Adicionalmente estas estructuras deben ser biocompatibles y en lo posible biodegradables y han de permitir que las células vivas de las que se componen sean vascularizadas in vivo o que lleguen al paciente con algún tipo de vasculatura funcional. En este sentido una de las estrategias que se baraja para el desarrollo de la medicina regenerativa es la del “bioreactor in vivo”, es decir, la creación de primordios tisulares in vitro que son implantados in vivo para permitir el desarrollo del tejido que se está reparando o sustituyendo. Figura 7 5.3 Regeneración con biomoléculas activas Regeneración con biomoléculas activas es la utilización de factores de crecimiento para guiar la expansión y diferenciación tejido específica de las células progenitoras. Sobre la utilización de biomoléculas activas debemos tomar en consideración no solo qué tipo de factores se utilizan sino cómo se integran en el tejido o estructura desarrollada, durante cuanto tiempo deben ser activas para producir un efecto funcional, cómo interaccionan las diferentes 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión señales para dirigir una diferenciación y por último, como controlar su acción una vez introducidas en el organismo. Figura 8 Estas aproximaciones, únicas o en combinación, pueden aplicarse básicamente de dos formas: generando un tejido ex vivo para su posterior implantación o acelerando la regeneración el tejido in vivo, es decir, que la maduración del tejido funcional se da en el propio individuo y no in vitro. 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión 6. Células mesenquimales El término “célula mesenquimal” define un grupo altamente heterogéneo de células, progenitoras o no, que provienen del tejido conectivo (mesénquima) Más información derivado de la capa mesodérmica embrionaria. Asimismo, este término se utiliza En el enlace: para denominar a las llamadas células madre mesenquimales (MSC, mesenchymal http://arthritis-research.com/ content/pdf/ar2116.pdf stem cells), células multipotentes con capacidad de diferenciación a diversos encontraréis una reciente revisión sobre estas células. tejidos mesodérmicos; hueso, cartílago, tejido adiposo y estroma medular. Las células MSC son candidatas preferentes para el desarrollo de nuevos protocolos clínicos de terapia celular debido, principalmente, a su rápida accesibilidad y capacidad de supervivencia en diferentes tejidos. Adicionalmente, su alta tasa de proliferación sin pérdida de potencial de diferenciación, sus propiedades inmunomoduladoras, la seguridad de su utilización en humanos (se ha reportado que la infusión de hasta 5x107 no provoca toxicidad en pacientes con enfermedades hematológicas en completa remisión) y la carencia de controversias ético legal para su obtención avalan su uso clínico a corto plazo. Figura 9 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión La médula ósea es la fuente de MSC más estudiada y se estima que la frecuencia de estas células es de 1 cada 104-106 células nucleadas totales, asimismo se ha reportado el aislamiento de MSC de sangre de cordón umbilical, placenta humana, fluido amniótico y sangre periférica movilizada con G-CSF. La presencia de MSC en estas fuentes es igual o menor que en el caso de la médula ósea haciendo de la expansión ex vivo un requerimiento previo para el inicio de cualquier estudio clínico. Las células MSC crecen formando colonias adherentes características compuestas de, principalmente, dos grupos celulares fibroblásticos con tamaños y capacidades proliferativas distintas. Estas colonias se expanden con una cinética inicial lenta (2-4 días), seguida de una etapa de gran proliferación y una fase final estacionaria que permiten expandir, por resiembra a baja densidad, hasta 3 logaritmos la población inicial. Se ha estimado teóricamente que las MSC aisladas de solo 2 mL de médula ósea pueden expandirse hasta una población de 12-35 x 109 células en tres semanas. La adherencia al plástico es el método más utilizado para el aislamiento de MSC y su identificación se basa fundamentalmente en la coexpresión de algunas proteínas de membrana (coexpresión de CD105, CD73, CD90) y falta de expresión de marcadores hematopoyéticos (CD45) y endoteliales. Este perfil fenotípico no es exclusivo de estas células y se suele acompañar de un ensayo de diferenciación de la población expandida a tres linajes mesodérmicos; tejido adiposo, cartílago y hueso para su identificación como MSC. Aunque se ha descrito la capacidad de estas células para diferenciarse in vitro a tejidos de las capas ecto y endodérmicas del embrión, fenómeno conocido como plasticidad o transdiferenciación celular, este es un punto de extenso debate y controversia porque las condiciones de los cultivos in vitro de larga duración, los fenómenos de fusión celular y la expresión de genes confluente en distintos programas genéticos de diferenciación pueden haber actuado como artefactos en la determinación de la capacidad de diferenciación de estas células in vivo. Se han descrito diferentes protocolos de aislamiento y expansión de MSC a partir de médula ósea que varían en el método y densidad de siembra del cultivo primario, la densidad celular en los pases de expansión y en la utilización de medios de cultivo. Asimismo, los diferentes métodos de obtención y el tiempo de cultivo rinden poblaciones celulares que aunque con perfiles fenotípicos 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión similares muestran características morfológicas, capacidades de diferenciación y cinéticas de crecimiento muy diversas. Esto se debe, principalmente al hecho de que en un cultivo MSC existe sólo una pequeña proporción de células con capacidad de diferenciación a tres linajes mesodérmicos mientras que la mayoría de células exhiben una capacidad uni o bipotencial. La proporción de cada subpoblación en el producto celular final está directamente relacionada con las condiciones y extensión cultivo y queda por demostrar si un determinado protocolo de expansión favorece una determinada aplicación clínica en detrimento de otras. Los actuales protocolos de expansión ex vivo de MSC incluyen sueros de origen animal como suplemento nutricional del cultivo celular que no se asocian con la posibilidad de transmisión de enfermedades priónicas pero presentan un riesgo real de desarrollo de reacciones inmunes o inflamatorias locales por la presencia de proteínas xenogénicas en el cultivo de expansión que pueden no ser eliminadas incluso después de intensos lavados celulares. En estas circunstancias, la formación de anticuerpos podría alterar los procesos de injerto o provocar rechazo inmunológico sobretodo en aquellas aplicaciones que necesiten dosis repetidas de este producto. Asimismo, se ha reportado que el uso de suero autólogo en sustitución de sueros animales durante el cultivo de expansión reduce la posibilidad de arritmias después de una cardiomioplastia celular. 6.1 Aplicación clínica de las MSC Terapia Celular. Trasplante de Progenitores Hematopoyéticos (TPH) 6.1.1 Facilitación del injerto. Se ha reportado que la coinfusión de MSC y progenitores hematopoyéticos es una técnica abordable que resulta en una disminución significativa del tiempo de recuperación hematológica después de un TPH. Además, en modelos animales NOD/SCID se ha reportado que en condiciones de recuentos mínimos de CD34+, sólo aquellos trasplantes realizados mediante coinfusión con MSC mostraron el injerto. Más recientemente, un ensayo clínico con 36 pacientes ha reportado que la infusión de 1-2.5 106 MSC/kg con CD34+ de sangre periférica resultó en mejores índices de recuperación hematológica así como ausencia de 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión toxicidad, sugiriendo que la coinfusión de progenitores y MSC puede rendir beneficios clínicos significativos. Existen evidencias de que las MSC expandidas ex vivo y trasplantadas no injertan en la médula ósea y por tanto parece difícil que regeneren el estroma medular del recipiente, mecanismo propuesto para la facilitación de injerto con estas células. Así, se ha sugerido que los efectos clínicos beneficiosos observados en la coinfusión de MSC es debida a la producción local de citoquinas y factores de crecimiento (SDF-1, TGF-ß, MIP-1α) que favorecerían la localización y/o la expansión in vivo de los precursores trasplantados. 6.1.2 Tratamiento de la Enfermedad de Injerto Contra el Huésped (EICH) La enfermedad del injerto contra el huésped es una de las complicaciones más graves del TPH y una importante fuente de morbilidad y mortalidad post trasplante. El tratamiento preventivo actual de la EICH incluye la depleción de linfocitos T del injerto y/o la administración de agentes inmunosupresores. Sin embargo, estas medidas pueden aumentar la aparición de infecciones oportunistas y en casos graves una reducción significativa de la recuperación hematológica. En este contexto las MSC han demostrado que pueden evadir el reconocimiento del sistema inmune del recipiente (no expresan MHC-II) pudiendo además modular y/o suprimir la respuesta inmune frente a células alogénicas hasta de origen xenogénico. Aunque los mecanismos exactos de estos efectos no se conocen, se ha reportado que incluso la administración de MSC de un tercer donante aumenta la tasa de supervivencia en el TPH alogénico de médula ósea. Asimismo se ha descrito que la infusión de MSC en un paciente que recibiendo un TPH alogénico no relacionado había desarrollado un EICH grado IV resistente a tratamiento pudo revertir los síntomas hasta un año post trasplante. Estos resultados sugieren que la infusión de MSC puede desarrollarse como una terapia profiláctica y de tratamiento de la temida EICH. 6.1.3 TPH de progenitores de sangre de cordón umbilical (SCU) 22 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión La mayor limitación para el uso de la SCU en el TPH es la dosis celular del injerto, la limitación de progenitores hematopoyéticos causa, sobretodo en pacientes adultos, retraso en la recuperación hematopoyética y un mayor índice de fallo de injerto. En este sentido, las aproximaciones experimentales más interesantes que se están investigando actualmente incluyen la expansión de progenitores mediante el cocultivo con MSC y la coinfusión de dos o más unidades de cordón. Las MSC forman en cultivo un estroma que no sólo interacciona físicamente con las células progenitoras CD34+ sino que produce señales reguladoras mediante la producción de citocinas y factores de crecimiento. Se ha descrito el uso de soportes estromales de MSC de médula ósea y de SCU para la expansión de progenitores de cordón resultando en una mayor producción de CD34+ (x37) que los cultivos líquidos a partir de células seleccionadas y aporte de citocinas (x20). Además, el cocultivo y coinfusión del producto puede beneficiarse de la aparente actividad facilitadora de injerto de las MSC. En el contexto de un TPH de varias unidades de UCB, la coinfusión de MSC (multidonante) disminuye la predominancia de una unidad sobre las otras, principal causa de los limitados resultados de esta aproximación terapéutica, facilitando así el uso de múltiples unidades de UCB en el TPH cuando no exista médula ósea compatible o la dosis celular de la unidad de SCU baje de unos determinados límites (107 células nucleadas totales/kg; 105 CD34+/kg). 7. Aplicaciones de Medicina Regenerativa 7.1 Traumatología Una de las aplicaciones in vivo más exitosas en el ámbito de la medicina regenerativa ha sido la reparación de hueso y cartílago mediante la aplicación local de MSC aisladas o embebidas en matrices de soporte, normalmente hidroxiapatita / fosfato-tricálcico. No en vano, de las tres líneas de diferenciación mesodérmicas que exhiben las MSC, la diferenciación 23 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión osteogénica en cultivo es predominante y representa un 60% de los clones de células estromales aislados de médula ósea. Adicionalmente, se ha utilizado el trasplante alogénico de MSC para tratar pacientes pediátricos diagnosticados de osteogénesis imperfecta grave. Pocos meses después del trasplante, la masa mineral corporal total se incrementó significativamente en todos los casos y se observó aumento de la densidad ósea en el hueso trabecular. La falta de reacciones adversas y los resultados clínicos reportados avalan la utilización de MSC en esta disciplina. 7.2 Infarto de miocardio Diferentes ensayos clínicos en humanos han mostrado que la administración local de la fracción mononuclear de médula ósea mejora, tanto a corto como a largo plazo, la perfusión ventricular después de un episodio de infarto de miocardio (IM). Estos efectos beneficiosos se han relacionado con la formación de nuevos vasos sanguíneos así como con el aumento de la producción de factores angiogénicos en la zona infartada. En este sentido, la aplicación de MSC aisladas o cotrasplantadas con la fracción mononuclear podría ser una mejora en el tratamiento del IM. Resultados recientes demuestran que la inyección intracoronaria de MSC mejora de forma sustancial y sostenida el aumento de la fracción de eyección del ventrículo izquierdo, mostrando resultados más beneficiosos que los publicados mediante la aplicación de células mononucleadas. Destacar que estos resultados proporcionan a su vez evidencias de que la infusión de MSC no está asociada a efectos adversos mediados por el tamaño celular tal y como se había reportado anteriormente que avalan su utilización terapéutica. 24 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión Figura 10 25 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 1. Área Transfusión 8. Bibliografía Se incluirá como material docente un par de revisiones recientes sobre células mesenquimales, una sobre su biología y otra sobre su efecto inmunomodulador. 26 Unidad didáctica 3: Terapia génica Dr. Jordi Barquinero Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Terapia génica. Generalidades. 3.1. Vectores 4. Ensayos clínicos 4.1 Aplicación a enfermedades monogénicas 4.2 TG en células madre hematopoyéticas: los primeros éxitos 5. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción Desde los primeros ensayos de terapia génica (TG), a principios de los 90, y a pesar de los notables avances producidos en esta joven disciplina, son todavía muy pocos los pacientes en el mundo que se han beneficiado de ella. Las razones son muy diversas: vectores subóptimos, limitaciones técnicas, escaso conocimiento en biología celular, precipitación, exceso de optimismo, falsas expectativas, o la nefasta influencia de los medios de comunicación, entre otras. En esta unidad abordaremos las bases de la TG, así como los riesgos y los beneficios de los ensayos clínicos más relevantes que se están realizando. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer las bases teóricas de la terapia génica, sus actuales limitaciones, y la situación y resultados de los primeros ensayos clínicos que podrían considerarse exitosos con esta nueva forma de terapia. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Terapia génica. Generalidades. En este capítulo vamos a revisar el concepto de TG, los tipos de vectores que se están empleando en la actualidad, así como una visión general de los primeros ensayos clínicos que han llegado a tener éxito. En primer lugar, recordar que un gen es un segmento de ADN que lleva la información para transcribirse en un ARN mensajero que posteriormente se traducirá a una o más proteínas. Las mutaciones, o cambios en la secuencia de ADN, para ser patológicas tienen que conllevar un aumento o disminución de la función de la proteína. Distinguimos entre enfermedades monogénicas y poligénicas si se originan por alteración de uno o varios genes. La idea de la TG surgió en los años 80, inicialmente como una posible solución para las enfermedades monogénicas. Es una forma de intervención médica basada en la modificación del material genético de las células. Se puede aplicar in vivo, es decir, introduciendo el material genético en el interior del organismo o ex vivo con células extraídas del paciente que posteriormente se implantan (ver figura). Figura 1 En los protocolos de TG hay que considerar en primer lugar dos elementos básicos: los genes terapéuticos y los vectores a utilizar. Los genes terapéuticos pueden reemplazar genes que producen proteínas no funcionales, inhibir el efecto de genes que están patológicamente activos, o incluso pueden ser genes 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 tóxicos o suicidas con la idea de eliminar células tumorales. Los vectores son los vehículos que van a transportar estos genes a las células diana y de ellos dependerá que el gen se integre o no en su genoma, el porcentaje de células que expresan el gen terapéutico, el que la expresión del gen sea estable o transitoria, o que la expresión del gen sea selectiva y específica en un particular tejido. El diseño de nuevos vectores es uno de los grandes desafíos actuales en TG. 3.1 Vectores Existen dos grandes categorías de vectores, según deriven de virus o no. Los vectores no virales suelen ser compuestos macromoleculares basados en lípidos o en polímeros catiónicos que se unen al ADN y que facilitan su transporte a las células diana. La transferencia de ADN desnudo o envuelto en liposomas se utiliza cuando existen posibilidades terapéuticas sin necesidad de transducir eficientemente el tumor, por ejemplo, cuando se busca la inducción de una respuesta inmune antitumoral. Cuando, por el contrario, se requiere una elevada eficiencia de transducción o que ésta sea estable, hay que usar vectores virales. Para generar vectores se han utilizado diversos tipos de virus: retrovirus, virus adenoasociados, adenovirus, herpesvirus, etc. Los retrovirus son virus de ARN, con un genoma de 8 kilobases mayoritariamente substituible por genes terapéuticos (ver esquema de su estructura en la siguiente figura). Los vectores retrovirales basados en el virus de la leucemia murina de Moloney (MoMLV) sólo se integran en el genoma de células en división, mientras que los derivados de lentivirus (otro tipo de retrovirus cuyo representante más conocido es el virus del SIDA) tienen la ventaja de no requerir división celular para integrarse y expresarse. La integración conlleva la presencia estable del ADN terapéutico en la célula diana pero por otra parte tiene el potencial para producir alteraciones genéticas secundarias de tipo oncogénico, como luego se verá. En general los retrovirus no se pueden concentrar a títulos superiores a 107 partículas infectivas por mL y son inactivados por el complemento de la sangre lo que limita su uso in vivo. Los virus adenoasociados (AAV) son virus de ADN de doble cadena de 5 kilobases que, como los retrovirus, se pueden integrar en la célula transducidas. Los AAV pueden concentrarse hasta títulos de 1013 viriones por mL y no se inactivan en sangre con lo que son aptos para su administración in vivo. Al contrario que los retrovirus y AAV, los adenovirus son 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 2 muy inmunogénicos y no se integran en la célula transducida. Se usan mayoritariamente en TG del cáncer o en situaciones en las que la expresión estable del transgén no sea esencial. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 3 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4. Ensayos clínicos 4.1 Aplicación a enfermedades monogénicas Las enfermedades monogénicas constituyen el paradigma de las candidatas a máximas beneficiarias de la TG. De las casi 10000 enfermedades genéticas descritas, por el momento sólo unas pocas son un objetivo de este tipo de terapia por el mejor conocimiento que se tiene de sus bases moleculares, por el órgano o tejido afectado, por la necesidad de regulación en la expresión del gen terapéutico, o porque ya se dispongan de los vectores y de la experiencia preclínica adecuada en su corrección a nivel molecular. Desde los inicios de la TG a principios de los 90, y hasta la actualidad se han iniciado más de un centenar de ensayos clínicos para enfermedades monogénicas, lo que representa casi un 10% del total de ensayos aprobados en el mundo (ver http://www.wiley.co.uk/genmed/clinical). La corrección permanente de los defectos genéticos requiere generalmente de vectores que integren los genes terapéuticos en el genoma de las células diana, de forma que éste se transmita a toda su progenie. Los vectores retrovíricos basados en el MoMLV fueron los primeros en ser utilizados como vectores en los ensayos clínicos y siguen siendo, casi dos décadas después, los vectores integrativos más utilizados, sobretodo en aplicaciones basadas en las células madre. Dada la relativamente alta prevalencia de la hemofilia, la TG para las diversas formas de esta enfermedad ha sido objeto de intensa investigación en los últimos años. Actualmente, los modelos caninos de hemofilia (A y B) son curables mediante TG. Sin embargo, los ensayos en humanos no han sido tan exitosos. Ha finalizado un total de tres ensayos clínicos y otros dos están todavía en marcha, que incluyen diversas estrategias (músculo esquelético, hígado y fibroblastos cutáneos como tejido diana), así como distintos tipos de vectores (retrovirus, adenovirus y AAV). En general sólo se ha conseguido producción del factor (VIII o IX) de forma subóptima y/o transitoria. 4.2 TG en células madre hematopoyéticas: los primeros éxitos Para los defectos genéticos que afectan a los distintos linajes hematopoyéticos las dianas ideales son las células madre hematopoyéticas (CMH), ya que una vez 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 trasplantadas son capaces de reconstituir la hematopoyesis (incluyendo el sistema inmune) de por vida. A pesar de no estar completamente caracterizadas, las CMH humanas pueden ser enriquecidas unas 100 veces seleccionando la fracción CD34+, transducidas en cultivo y trasplantadas, de forma análoga a un trasplante convencional de progenitores hematopoyéticos. Con todo, la primera ola de ensayos realizados desde 1990 se saldó mayoritariamente con fracasos, de forma que un panel de expertos recomendó en 1995 una vuelta a los laboratorios y a la investigación básica. Los clínicos se habían precipitado en iniciar los ensayos con herramientas que aún no estaban a punto. A finales de los 90 se volvió a la carga con mejores herramientas y más conocimientos hasta que en verano del 2000 un equipo francés reportó el primer gran éxito de TG en niños con inmunodeficiencia combinada severa ligada al cromosoma X (SCID-X1). La enfermedad se caracteriza por un defecto en el gen de la cadena gamma común (γc), que codifica para una subunidad de los receptores para las interleucinas 2, 4, 7, 9, 15 y 21. Figura 4 Se hereda de forma ligada al cromosoma X, representando aproximadamente la mitad de todos los casos de SCID. Cursa con una ausencia casi total de células B, T y NK funcionales, lo que resulta en infecciones graves y frecuentes que suelen ser fatales durante los primeros años de vida. 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 5 El ensayo del grupo francés se basó en la introducción del gen γc utilizando un vector retrovírico en las células CD34+ de la médula ósea de los propios pacientes, que se reinfundieron de nuevo a los pacientes en ausencia de tratamiento mieloablativo. Pocos meses después de la infusión de las células corregidas genéticamente, los recuentos de células T alcanzaron cifras normales y la función inmunitaria mejoró significativamente en prácticamente todos los niños tratados. Estos resultados fueron confirmados independientemente por investigadores británicos usando un protocolo similar en otros seis pacientes. La clave del éxito radicaba en el hecho que las células genéticamente modificadas, con su receptor para las interleucinas ya funcional y por tanto capaces de responder a los factores de crecimiento adecuados, podían proliferar y diferenciarse y tenían una ventaja selectiva para repoblar los nichos (células T y NK, y secundariamente B) virtualmente vacíos, mientras que las células no corregidas seguían muriendo por apoptosis, lo que dió como resultado una repoblación completa por células T y NK genéticamente corregidas. El segundo éxito reconocido de la TG para enfermedades monogénicas fué publicado en el 2002 por investigadores italianos en pacientes con otra forma de inmunodeficiencia primaria llamada SCID-ADA. El enzima ADA cataliza la desaminación de la desoxiadenosina a adenosina, resultando su ausencia en un acúmulo de metabolitos altamente tóxicos para las células T. Como ocurre en la SCID-X1, el trasplante de médula ósea de un donante compatible (hermano), si está disponible, constituye la mejor alternativa terapéutica. Si no hay disponibilidad de donante, los pacientes pueden ser tratados con ADA bovino 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 pegilado (PEG-ADA), que corrige parcialmente la deficiencia inmune en la mayoría de casos, aunque esta terapia resulta extremadamente cara. Curiosamente, el primer ensayo clínico de TG se realizó en niños con deficiencia de ADA en Estados Unidos en 1990. Consistió en la inserción de una versión funcional del gen ADA en células T autólogas o bien en células progenitoras hematopoyéticas, que fueron reinfundidas de nuevo a los pacientes. Doce años más tarde, los pacientes tratados, a los que se les mantuvo la terapia con PEG-ADA, expresaban el enzima, pero a unos niveles subterapéuticos. Este ensayo clínico se consideró fallido, probablemente porque la terapia substitutiva con ADA recombinante estaba anulando la ventaja selectiva para las células genéticamente modificadas. Los investigadores italianos fueron más atrevidos, acondicionaron a los pacientes con una dosis moderada de busulfán, con el fin de facilitar el injerto, y retiraron el tratamiento substitutivo con PEGADA, de manera que se pudiera poner de manifiesto la potencial ventaja selectiva de las células genéticamente “corregidas”. Estos primeros éxitos aportaron renovadas esperanzas a esta joven disciplina. El hecho que dos tipos de SCID fueran las primeras enfermedades en ser curadas mediante TG no fue una sorpresa. Ya hemos comentado la fuerte ventaja selectiva que opera en las células genéticamente corregidas para proliferar o escapar de la apoptosis, y por ello también para repoblar in vivo. Por desgracia, no se espera que resulte tan fácil para la mayoría de enfermedades candidatas a ser corregidas usando células madre en las que no existe ninguna ventaja selectiva para las células modificadas (que son la inmensa mayoría). Una prometedora línea consiste en el empleo de genes seleccionables que, una vez introducidos junto al gen terapéutico permiten la selección in vivo de las células “corregidas” usando agentes farmacológicos. Inserciones retrovirales y riesgo oncogénico Por definición, todas las inserciones en el genoma son mutagénicas. Sin embargo, el riesgo de oncogénesis por inserción tras los procedimientos de transferencia génica estándar usando vectores integrativos en los modelos preclínicos se consideraba extraordinariamente remoto. Por ello, el hallazgo que cuatro de los once niños tratados en el ensayo clínico francés para SCID-X1 antes mencionado desarrollaran leucemias, años después de recibir la TG, 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 sorprendió a toda la comunidad médica y científica, especialmente cuando se descubrió la existencia de una zona “caliente” para la inserción retroviral y crítica para la transformación leucémica en el locus del protoncogén LMO2. Figura 6 Previamente no se habían descrito efectos adversos similares en los cerca de 200 pacientes tratados en ensayos clínicos similares que también usaban vectores integrativos, incluyendo la SCID- ADA, o, exceptuando casos puntuales, en los miles de animales experimentales sometidos a procedimientos de transferencia génica integrativa. Esto planteaba la pregunta crucial de si la TG basada en este tipo de vectores era más peligrosa de lo que se pensaba, o de si estos dos casos estaban más relacionados con factores dependientes del contexto, y por lo tanto eran excepcionales y no podían ser extrapolables a otras situaciones. Buscando en una base de datos de varios miles de cánceres hematológicos murinos inducidas por inserciones retrovirales (IR) experimentales (http://RTCGD.ncifcrf.gov), Dave et al. encontraron dos casos asociados a inserciones cercanas al locus LMO2 y dos con inserciones en el locus IL2RG (el del gen terapéutico en esta enfermedad). Una de ellas contenía una inserción en cada uno de ambos loci. Las probabilidades de que esos dos eventos se produjeran en la misma célula son tan remotas que el hallazgo sugiere que la 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 expresión no regulada del transgén γc dirigida por el LTR retroviral se convirtió en un inesperado cofactor para la transformación leucémica. Estos casos de leucemia descritos por los investigadores franceses generaron una respuesta desmedida por parte de los medios de comunicación y la sociedad, así como escepticismo hacia la TG por parte de la comunidad científica. Las agencias reguladoras de diversos países prohibieron los ensayos clínicos basados en vectores integrativos. En conjunto, estas reacciones condujeron a una profunda recesión en el campo, llegándose a la paradoja que a los niños con SCID-X1 se les vetaba una terapia que podía salvarles la vida. A pesar del riesgo de desarrollar una leucemia tras el tratamiento genético (por otra parte potencialmente curable), la única alternativa terapéutica es un trasplante alogénico de medula ósea, con una probabilidad de éxito del 90% si el donante es un hermano compatible (para los europeos disponible en menos de un tercio de los casos), y alrededor de un 70% si el donante es no emparentado (no familiar). Esto representaba un gran dilema ético, ya que la TG para dicha enfermedad era probablemente una alternativa superior al transplante no relacionado, y de hecho la realidad era que la TG había salvado a la mayoría de los pacientes tratados. En este momento, muchos países han levantado el veto a los vectores integrativos, que se han rediseñado y optimizado para minimizar sus potenciales riesgos. 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Bibliografía 1. Cavazzana-Calvo, M., Hacein-Bey, S., de Saint Basile, G., Gross, F., Yvon, E., Nusbaum, P., Selz, F., Hue, C., Certain, S., Casanova, J.L., et al. 2000. Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease. Science 288:669-672. 2. Aiuti, A., Slavin, S., Aker, M., Ficara, F., Deola, S., Mortellaro, A., Morecki, S., Andolfi, G., Tabucchi, A., Carlucci, F., et al. 2002. Correction of ADA-SCID by stem cell gene therapy combined with nonmyeloablative conditioning. Science 296:2410-2413. 3. Fischer, A., and Cavazzana-Calvo, M. 2005. Integration of retroviruses: a fine balance between efficiency and danger. PLoS Med 2:e10. 4. Naldini, L. 2006. Inserting optimism into gene therapy. Nat Med 12:386-388. 14 Unidad didáctica 4: Banco de tejidos. Donación y obtención de tejidos. Selección de donantes y receptores: organización y logística Dra. Flora Moya Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Donantes. Consideraciones generales 3.1 La donación de tejidos 3.2 Proceso de donación 3.2.1. Tipos de Donantes 3.2.2. Normativa Legal. 3.2.3. Gratuidad de las Donaciones. 3.2.4. Confidencialidad. 3.2.5. Finalidad. 3.2.6. Publicidad y Promoción. 4. Consentimiento informado 4.1 Condiciones del Consentimiento 4.2 Criterios de selección 5. Requerimientos técnicos – quiroófano extracción BST 5.1 Climatización 5.2 Entorno 5.3 Iluminación 5.4 Mesa operatoria 6. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción. Los bancos de tejidos son estructuras funcionales complejas que abordan todos los aspectos de la cadena operativa, desde la obtención del tejido hasta su suministro a los prescriptores finales, para su utilización clínica. Como se ha podido comprobar en otras secciones de este módulo, la mayor parte de sus procesos son eminentemente técnicos y, aunque complejos, son asequibles y estandarizables. No obstante, todos ellos están supeditados a la existencia de tejidos, la materia prima, que solo puede ser asegurada a través de un exquisito proceso de promoción de la donación y consentimiento del donante. Esta es una actividad médica con una gran carga positiva de valores humanos que generalmente es llevada a cabo por los coordinadores hospitalarios de trasplante. En el presente capítulo se desarrollan las bases fundamentales de la promoción y donación de tejidos, así como los aspectos regulatorios de esta actividad. Como podrán comprobar, gran parte de la información que se presenta está basada en el modelo español, especialmente referenciado a nivel internacional y pionero en muchos aspectos. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer los aspectos generales del proceso de donación de tejidos - Conocer los criterios de evaluación de donantes de tejidos - Conocer los estándares y aspectos legales y regulatorios de esta actividad. - Conocer los aspectos técnicos asociados al proceso de donación de tejidos 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Donantes. Consideraciones generales 3.1 La donación de tejidos La donación de tejidos es una gran desconocida. Es tal la divulgación en los medios de comunicación de la donación de órganos, que la donación de tejidos queda en el terreno de lo secundario i parece que si no sirve para “salvar vidas” no sea importante su obtención. En algunos medios ni tan solo se cree que sean verdaderos “trasplantes” ya que la dinámica es totalmente distinta y se habla de tejido implantado y no de tejido trasplantado. El origen es común. Obedecen a un acto de altruismo, totalmente desinteresado. Hay una organización de profesionales sanitarios que detectan el potencial donante. Se evalúa la causa de la muerte mediante historia i análisis, i un vez que se cumplen los requisitos, se procede a solicitar a los familiares el consentimiento de donación. Una vez obtenido se organiza el operativo de extracción de los tejidos. Fiura 1. Evaluación del donante. Proceso multidisciplinar (Dra. Teresa Pont, Dra. Núria Masnou, Dr. Pere Salamero. Direcció de Planificació i Avaluació de Trasplantaments d’Òrgans i Teixits. H. V.H. Barcelona) Intensivistas Patólogos Radiólogos Inmunólogos Hepatólogos Microbiólogos Neumólogos Bioquímicos 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 El Coordinador de Trasplante es la figura médica que se ocupa de todo el proceso de donación, junto a un equipo de profesionales, ( fig.1) y avisa a los distintos equipos de extracción. Figura 2. Misión del coordinador (Dra. Teresa Pont, Dra. Núria Masnou, Dr. Pere Salamero Direcció de Planificació i Avaluació de Trasplantaments d’Òrgans i Teixits) Una vez obtenido el tejido, en la mayor parte de ellos el equipo de extracción lo remite a los Bancos de Tejidos que se encargan de procesarlos, conservarlos y prepararlos para su aplicación clínica. En algunos casos el mismo equipo extractor se encarga de la evaluación i trasplante. Es el caso del tejido corneal. Todas estas actividades son reguladas por disposiciones y normas por los organismos competentes. La Organización Nacional de Trasplantes (ONT) es quien tiene la responsabilidad de redactar y desarrollar una reglamentación que rija el trasplante de órganos y Tejidos en España, elabora estadísticas e informes de todo el estado. www.ont.es . En Catalunya es la Organització Catalana de Trasplantaments (OCATT) quien se ocupa de su control a nivel autonómico (www.ocatt.net). Las sociedades científicas tales como la Asociación Española de Bancos de Tejidos, www.aebt.es, consensúan estándares de calidad que aseguran la calidad de los tejidos, desarrollándose una política de calidad propia validada por distintos organismos de calidad. 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.2 Proceso de donación 3.2.1. Tipos de Donantes a. Donante vivo: persona que dona tejidos o células humanas para trasplante autólogo y homólogo de forma altruista b. Donante cadáver: persona fallecida en muerte encefálica o asistolia, que no habiendo manifestado en vida su oposición, dona, de forma altruista, tejidos y células destinados a ser aplicados en el ser humano. 3.2.2. Normativa Legal. El Real Decreto 1301/2006, de 10 noviembre por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos. 3.2.3. Gratuidad de las Donaciones. La donación de tejidos y células será voluntaria y altruista, no pudiéndose percibir contraprestación económica o remuneración alguna. 3.2.4. Confidencialidad.-Se debe garantizar la confidencialidad de los datos de los donantes en relación a la salud, resultados y trazabilidad de sus donaciones de acuerdo con la Ley Orgánica 15/1999, de 13 de noviembre, de Protección de Datos de Carácter Personal. Los establecimientos de tejidos deben tratar los datos relacionados con los donantes siguiendo las medidas de seguridad más estrictas que se prevén en el Reglamento de medidas de seguridad de los ficheros automatizados que contengan datos de carácter personal, Real Decreto 994/1999, de 11 de Junio. 3.2.5. Finalidad. La obtención de tejidos humanos de donante cadáver podrá realizarse con fines terapéuticos y/o científicos y la de donantes vivos será exclusivamente terapéutica, sin perjuicio de las investigaciones que adicionalmente se puedan realizar. 3.2.6. Publicidad y Promoción. La promoción y publicidad de la donación de tejidos debe realizarse con carácter general y señalando su carácter voluntario, 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 altruista y desinteresado. El beneficio de la promoción y publicidad no debe en ningún caso buscar un beneficio para personas ni instituciones concreta Las diferentes organizaciones de trasplantes estatales i autonómicas, ofrecen modelos de promoción de la donación de tejidos basados en la información de las diferentes modalidades de donación y de la necesidad del trasplante de tejidos. En la web de l’Organització Catalana de Trasplantament OCATT: www.gencat.net/catsalut/ocatt/es también en ONT: www.ont.es hay ejemplos de este sistema de promoción 4. Consentimiento informado 4.1 Condiciones del Consentimiento En España toda persona que no haya manifestado explícitamente su oposición a ser donante, es donante. Pero, en cambio siempre se consulta a la familia o allegados si consideran que lo puede ser. Este protocolo de actuación obedece a que una vez la persona ha fallecido, sus familiares i herederos son los responsables de decidir todo lo referente al finado, incluso si puede o no ser donante. Los familiares que obran en conciencia deben respetar en todo caso la voluntad del fallecido, tanto en caso afirmativo como en caso negativo. • En el caso de que se trate de menores o personas incapaces de consentir, la oposición de la donación podrá hacerse constar por quienes hubieran ostentado en vida de aquellos su representación legal. • En el caso del donante vivo, la obtención de células o tejidos humanos para trasplante o investigación requiere de su autorización a través del consentimiento informado. El consentimiento podrá ser revocado en cualquier momento antes de la obtención de la célula o tejido. • En el donante cadáver, la donación requiere de un documento donde conste la ausencia de conocimiento de oposición expresa a la donación, declarada y firmada por los familiares o personas allegadas al donante cadáver. obteniendo la voluntad de donar sin ningún tipo de coacción. 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En este tipo de donante y más aún en el caso de una muerte no esperada es cuando más difícil es abordar a la familia para solicitar su consentimiento. En estos casos se produce un bloqueo i una negación de muerte del familiar, más importante según la relación que exista entre ellos y su idiosincrasia particular. Es importante que el personal sanitario y no sanitario del entorno de la donación de tejidos conozca los rasgos fundamentales de lo que significa la obtención del consentimiento familiar para una donación. La inversión en cultura de la donación de tejidos redundará en un mayor respeto a la donación y a una mayor valoración del producto a implantar. Figura 3: Ejemplo de taller de formación para el personal de Banc de Sang i Teixits Así como se debe explicar la necesidad de realizar una evaluación de la historia médica y social, determinaciones serológicas con la finalidad de evitar la posible transmisión de enfermedades al receptor. En el caso del donante cadáver, si las circunstancias no permiten obtener el consentimiento en persona, éste podría ser obtenido por teléfono, dejando constancia escrita del consentimiento, especificando que éste ha sido dado por teléfono y con testimonio de la conversación telefónica. Se registrarán los datos identificativos de la persona que ha dado el consentimiento, la relación que tiene con el donante, el número del teléfono al que se ha llamado y a través del cual se ha obtenido el consentimiento, la firma de la persona responsable que lo ha obtenido así como la del testigo de la conversación. Es recomendable, sí las 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 condiciones técnicas lo permiten grabar la conversación previa explicación y consentimiento. De igual forma podría hacerse a través de la transmisión de un fax. La persona responsable de obtener el consentimiento envía el documento a través del fax, que deberá firmar la persona que autoriza la donación, y éste lo remitirá completado y firmado. Hay diferentes modelos para el consentimento. Lo más seguro es seguir el formulario propuesto por los organismos oficiales. 4.2 Criterios de selección Generales A diferencia de la donación de órganos hay unos criterios excluyentes por edad, más o menos seguidos por los distintos Bancos de Tejidos para cada tejido en concreto. Recomendamos consulta de los estándares de la AEBT. El proceso que causó la muerte, excepto en la donación de tejido corneal, no debe corresponder a una neoplasia ni a un proceso infeccioso sin controlar. El detalle de procesos que contraindican y no contraindican lo pueden consultar en el Real Decreto de noviembre del 2006 que podrán consultar en las Webs de OCATT y ONT. Examen Físico Estará encaminado a descartar la presencia de lesiones sugestivas de drogadicción. Requisitos de la Historia Médica Es fundamental que la evaluación descarte la presencia de cáncer con mención especial en los tumores del Sistema Nervioso Central que contraindican y no contraindican. Para recalcar su importancia los resumimos en la tabla 1. Con respecto a infecciones hay también valoración. Contraindican: causas sistémicas • Infecciones diseminadas causantes de la ME • Sepsis bacteriana activa • Funguemia activa 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • Meningitis per Listeria, M tuberculosis , hongos y protozoos. • Encefalitis herpética No contraindican: • Meningitis bacteriana correctamente tratada de manera eficaz. • Endocarditis bacteriana ( sin abscesos a otros órganos) por gérmenes identificados y con tratamiento eficaz • Bacteriemia (5% de los donantes) por gérmenes poco virulentos y correctamente tratados. • Infecciones locales ( valorar cada tejido) Tabla 1: Valoración específica de las tumoraciones cerebrales en la donación de tejidos 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Análisis Serológicos Requerimientos Generales Las muestras de sangre que se obtienen para realizar tests o determinaciones analíticas relacionadas con el donante deben ir debidamente etiquetadas con la información relativa al lugar y el momento en que se han recogido las muestras. Valoración de los análisis con transfusión de sangre reciente del paciente Cuando los donantes han recibido transfusiones de sangre, componentes sanguíneos y/o coloides dentro de las 48 horas previas a la muerte, o cristaloides en la hora previa, si se espera una hemodilución superior al 50%, debe aplicarse un algoritmo de decisión. Se podrán aceptar los donantes de tejidos y/o células con tasas de hemodilución superior al 50% si se dispone de una muestra de sangre previa a la transfusión o si los tests de laboratorio están validados para muestras hemodiluidas. En caso contrario se debe descartar al donante por el efecto de la hemodilución sobre los resultados de las determinaciones serológicas. Obtención de Muestras de Sangre En los donantes fallecidos las muestras deberían obtenerse antes del fallecimiento o lo antes posible siempre antes de transcurridas 24 horas desde la muerte. En el caso de donantes vivos las muestras de sangre para realizar las serologías se obtienen en el momento de la donación o en el margen de los 7 días siguientes a la donación cuando los tejidos no son almacenados. Cuando los tejidos y/o células de donantes vivos se almacenan durante largos periodos se requerirá una segunda determinación a los 180 días. En estos casos la muestra de sangre obtenida en el momento de la donación se puede tomar entre los 7 días previos y 30 posteriores. La segunda determinación podrá evitarse si se realizan técnicas de amplificación de DNA para HIV, HBV y HLV.En los donantes neonatos la muestra se debe obtener de la madre para evitar procedimientos médicos innecesarios al niño. 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 4: Ejemplo de algoritmo para el cálculo de la hemodilución de un donante que ha recibido sangre, componentes sanguíneos, o expansores de volumen plasmático, en las 48 horas previas a la muerte. 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Notificación de Resultados Positivos Confirmados Los resultados positivos para HBs Ag, anti-VHC, anti-VIH y, en general, para cualquier marcador que tenga significación clínica, deberán confirmarse mediante los procedimientos adecuados antes de su notificación. Una vez confirmados, se deberán comunicar al donante vivo o al familiar más próximo en el caso del donante cadáver. Así mismo, si se trata de enfermedades infecciosas de declaración obligatoria, serán notificadas a las autoridades sanitarias locales o nacionales. Seroteca Los establecimientos de tejidos deberán mantener un archivo de sueros de los donantes al menos 10 años a partir de la última aplicación clínica o de la fecha de caducidad de las células/tejidos, con el fin de realizar los controles biológicos cuando sean necesarios. Cribado Serológico 1. Pruebas biológicas indispensables para los donantes de tejidos y células (salvo los donantes de células reproductoras): • VIH 1 y 2: Anticuerpos Anti VIH 1 y 2. Debería realizarse la determinación de anticuerpos frente a VIH 1 y 2 con una prueba con capacidad para detectar el Grupo O del VIH. El resultado positivo es suficiente para la exclusión del donante. Los falsos negativos debidos a periodos ventana pueden minimizarse con una técnica NAT para los distintos virus. • Hepatitis B: - HBs Ag El resultado positivo es suficiente para la exclusión del donante. - Anti HBc cuando el resultado sea positivo y el HBs Ag sea negativo, deben realizarse pruebas adicionales para determinar si los tejidos y células pueden ser utilizados o, por el contrario, deben descartarse, (por ejemplo: Ac HBs, DNA VHB). 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Mostramos algoritmo para Virus B en la Tabla 2. • Hepatitis C: - Anticuerpos Anti VHC: El resultado positivo es suficiente para la exclusión del donante. - En caso de progenitores hematopoyéticos se requerirá además PCR. • Sífilis: Se aplicará un algoritmo diagnóstico para excluir la presencia de infección activa por Treponema Pallidum: - Test negativo, específico o no: permite la utilización de tejidos o células. - Test no específico positivo: deberá utilizarse un test específico; si éste último es negativo, podrán utilizarse tejidos o células. - Test específico positivo: es necesaria una evaluación específica del riesgo para determinar el uso o no de las células y tejidos. Aunque el treponema puede ser erradicado por distintos métodos, el resultado positivo para treponema deberá ser considerado como un factor de riesgo para las enfermedades de transmisión sexual. 2. Virus de la Leucemia de células T: • Anticuerpos Anti HTLV I y II: deben, al menos, realizarse en aquellos donantes que viven o proceden de zonas endémicas. También debe realizarse en los donantes que sean parejas sexuales o hijos de personas que viven o vienen de dichas zonas endémicas. Es recomendable realizarlo en todos los donantes de tejidos. El cribado serológico se lleva a cabo mediante la detección de anticuerpos IG G específicos mediante la utilización de pruebas que deberían detectar conjuntamente los anticuerpos IgG frente al HTLV I y II (ELISA). La positividad contraindica la donación. 3. En determinadas circunstancias es recomendable realizar tests adicionales dependiendo de la historia del donante o las características de las células o tejidos a utilizar (CMV, Trypanosoma Cruzi, Toxoplasma, Plasmodium sp, Dengue, VEB, HLA, RhD). 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Tabla 2: Algoritmo utilizado en el Centre de Teixits i Terapia Cel·lular 4. Donante vivo: • Donante vivo autólogo: si las células o tejidos obtenidos van a ser almacenados, cultivados o sometidos a algún proceso de transformación “ex vivo” deberán realizarse los mismos tests que en el donante alogénico. Los resultados positivos de cualquiera de los tests no impedirán el reimplante de las células, los tejidos o los productos derivados. 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • Donante vivo alogénico: en los casos de trasplante de progenitores hematopoyéticos pueden aceptarse donantes con marcadores virales B y C positivos. En la donación de gametos dentro de la pareja se seguirán los criterios especificados al efecto y recogidos en el anexo IV del R.D. 1301/2006 de 10 de noviembre. • Cuando las células y tejidos se vayan a almacenar durante largos periodos, será necesaria una segunda determinación a los 180 días, o bien, pueden emplearse técnicas de amplificación de DNA o RNA para determinar la presencia de VIH, VHB y VHC. Tampoco sería necesaria si durante la fase de procesamiento del tejido o grupo celular se incluye algún proceso validado de inactivación viral. 5. Si bien en la actualidad las diferentes técnicas utilizadas para detectar marcadores de trasmisibilidad poseen una elevada calidad en términos de sensibilidad, especificidad y valores predictivos, todavía existe la posibilidad, poco frecuente, de falsos negativos obtenidos en período ventana. Con objeto de minimizar este riesgo, además de un minucioso estudio de la historia médicosocial es recomendable adoptar alguna de las siguientes determinaciones: • Antígeno P24 (VIH): El resultado positivo es suficiente para la exclusión del donante. • Antígeno core del VHC (HCcAg): El resultado positivo es sugestivo de infección por VHC en período ventana y suficiente para la exclusión del donante. • PCR para VIH, hepatitis B y hepatitis C: El resultado positivo es suficiente para la exclusión del donante. Por otro lado, también es recomendable realizar: - Hemograma y fórmula leucocitaria, para el despistaje de posibles enfermedades hematológicas malignas. - Bioquímica hepática para el despistaje de procesos infecciosos o neoplásicos hepáticos agudos o crónicos que no consten en la historia clínica. - Determinación de Beta HCG para el despistaje de procesos tumorales tanto en el varón como en la mujer (ej: cariocarcinoma, tumor testicular de origen embrionario). - Grupo sanguíneo y antígeno rhesus (Rh (d)): los tejidos procedentes de individuos positivos para el antígeno Rh (d), podrían sensibilizar a los 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 receptores que son negativos para dicho antígeno. Tal tejido no debería ser implantado en mujeres en edad potencial de embarazo. Esta decisión es responsabilidad del cirujano que trasplanta. Estudios Bacteriológicos del donante. Realización de hemocultivos La realización de hemocultivos para el aislamiento en sangre de microorganismos aerobios y anaerobios podría ser útil para la evaluación del donante y para la interpretación de los resultados de los cultivos en los propios tejidos extraídos. Como principios básicos para la correcta interpretación de dichos resultados se debe tener en cuenta la correcta extracción de las muestras, realizar al menos dos hemocultivos (para poder discriminar las contaminaciones de las infecciones) y utilizar los viales adecuados para pacientes que hayan estado o no en tratamiento antibiótico. OBTENCIÓN DE TEJIDOS Y/O CÉLULAS Consentimiento e Identificación del Donante Antes de iniciar la extracción de los tejidos y/o células, la identidad del cadáver deberá ser confirmada por el Coordinador de Trasplantes y por el responsable del equipo extractor o por una persona autorizada por el centro de tejidos, comprobando que los datos registrados corresponden al donante identificado. La verificación de la identidad del donante deberá ser documentada en el registro de la extracción. También deberá confirmarse que el consentimiento para la extracción se ha obtenido conforme a lo establecido en la legislación vigente, tanto si el donante es vivo o cadáver. Número de Identificación del Donante, Tejidos y Células Se deberá asignar un código de identificación único a cada donante y a cada tejido y/o grupo de células donadas, en el momento de su obtención o a su llegada al centro de tejidos, que asegure su identificación adecuada y la trazabilidad de todo el material donado. Se deberá elaborar un registro para introducir todos los datos de la codificación referente al donante, y a los tejidos y células. El diseño del sistema de codificación de los tejidos y células se ajustará a los requisitos mínimos exigidos en el Anexo VII del Real Decreto 1301/2006 de 10 de Noviembre que regula las actividades relacionadas con los 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 tejidos y células humanas; se tendrá en cuenta la identificación de la donación, del centro de tejidos, el código de producto básico, el número de partición y la fecha de caducidad. Lugar de realización de la Extracción y Procesamiento La obtención tendrá lugar en instalaciones apropiadas, mediante procedimientos que minimicen la contaminación de tejidos y células que se obtengan. En la hoja 1, se recoge el documento de requerimientos técnicos para el Necroquirófano del Banc de Sang i Teixits. Deberán ser lugares de acceso restringido al personal implicado en dichos procesos. En las donaciones de vivo se llevarán a cabo en instalaciones que garanticen su salud y seguridad y que respeten su intimidad. Cuando se lleve a cabo el procesamiento de tejidos o células en condiciones de exposición abierta, se deberán especificar las condiciones de calidad de aire y limpieza para minimizar los riesgos de contaminación incluyendo la contaminación cruzada. La efectividad de las medidas necesarias para cumplir estas condiciones deberá validarse y monitorizarse. Siempre que los tejidos o células se procesen en exposición abierta y sin un procedimiento de inactivación microbiológica posterior se exigirá una calidad de aire con un número de partículas y de colonias microbiológicas equivalente a la especificada como Grado A en el anexo I de la Guía Europea de Normas de Correcta Fabricación en el lugar del procesamiento, excepto en las siguientes condiciones: • Cuando se vayan a aplicar procedimientos de esterilización o inactivación microbiológica validada. • Cuando esté demostrado que la exposición a un ambiente de Grado A tiene efectos perjudiciales sobre las propiedades biológicas que se requieren al tejido o grupo de células afectado. • Cuando no sea técnicamente posible realizar el procesamiento de los tejidos o células en un ambiente Grado A. • Cuando esté demostrado que la vía o procedimiento de aplicación de los tejidos o las células implican un riesgo de transmisión de • enfermedades bacterianas o fúngicas significativamente menor que el trasplante de tejidos o células. 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En estas circunstancias se deberán especificar las condiciones del aire ambiente y demostrar y documentar que se alcanzan las normas requeridas de calidad y seguridad de los tejidos y células, teniendo en cuenta la vía o modo de aplicación, el objeto terapéutico o de aplicación y la situación inmunológica del receptor. Para el aire ambiente del resto del local de trabajo se exigirá una calidad adecuada para las actividades que se van a llevar a cabo, al menos equivalente al Grado D de dicha guía europea. Deberán desarrollarse procedimientos y normas para el acceso a los locales del establecimiento, para la circulación interna, la higiene y el mantenimiento, para la eliminación de residuos y material sucio o de desecho, y para la restauración de todos los servicios tras una situación de emergencia. Tabla 3. Establecimiento de circuitos y normas para la extracción en necroquirófano CIRCUITOS DEL NECROQUIRÓFANO 1) TIP0 DE TEJIDO; Cuando Coordinacion obtiene un donant, este puede tratarse d Donante solo de córneas Extracción Córneas Las extracciones= residents d’oftamo, pueden hacerse en el pre-quirófano Donante de córneas & otros tejidos MULTITEIJIDO (-CV, AL, PIEL) Extracción equipo multitisular EXTRACCIÓ ¾Huesos ¾Piel ¾vasos 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Requerimientos técnicos – quiroófano extracción BST De acuerdo al consenso del BST y el equipo de extracción de tejidos, y según lo señalado en el RD. 1301/2006 del Ministerio de Sanidad y Consumo que establece las normas de calidad y seguridad para la donación, obtención y procesamiento de células y tejidos, consideramos oportunas las siguientes mejoras locativas en el quirófano de extracción del BST. 5.1 Climatización El quirófano debe tener un sistema de regulación de temperatura, humedad y filtrado de partículas. El sistema deberá incorporar pre-filtros, filtros intermedios, filtros absolutos (HEPA), además de sistema de control de humedad (50%), presión (10) y renovación del flujo de aire. Estos estándares equivalen a un quirófano de la Clase A ó B. 5.2 Entorno Suelos, paredes y techos deben ser duros, no porosos, resistentes (fuegomanchas-golpes), impermeables y de fácil limpieza. Las uniones suelo – pared deben ser redondeadas para evitar el deposito de suciedad y facilitar su limpieza. Los materiales idóneos son PVC o Resinas, en colores verde o blanco, poco brillantes. 5.3 Iluminación La iluminación general debe ser uniforme y proporcional al tamaño del quirófano. La iluminación quirúrgica debe ser intensa y sin reflejos, de color azul-blanco (luz diurna), no producir calor, ajustable en posiciones y de fácil manipulación y limpieza. La lámparas sialiticas (de techo) cumplen con estos requerimientos. 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5.4 Mesa operatoria Debe ser adaptable a las diferentes posiciones quirúrgicas. Consta de dos partes, un tablero operatorio (segmentado - articulado) y una base fija o móvil. El mecanismo hidraulico/mecanico o electro/hidraulico es el mas adecuado. Personal Extractor y Material de Extracción La obtención de tejidos y células deberá ser realizada por personal específicamente formado por un equipo clínico de especialistas en la obtención de tejidos y células que deban obtenerse, o un centro de tejidos autorizado para tal fin, y en la reconstrucción del cadáver del donante, con programas de formación continuada. El personal deberá disponer de una descripción detallada de los puestos de trabajo, tareas, responsabilidades y relaciones con otros puestos de trabajo. Dicho personal deberá usar indumentaria adecuada para cada tipo de obtención, incluyendo lavado estéril, prendas y guantes estériles, visera facial, mascarilla y gorro. Se deberá utilizar instrumentos y aparatos estériles, de buena calidad, validados o certificados específicamente para la obtención de los tejidos y células, mantenidos a intervalos regulares, y siempre que sea posible con el marcado CE. Cuando se utilice material reutilizable se deberá crear procedimientos validados de limpieza y esterilización para eliminar los agentes infecciosos. La utilización del material y equipos de obtención se realizará conforme a las normativas nacionales e internacionales pertinentes, las normas y directrices relativas a la esterilización de los medicamentos y productos sanitarios. Todo el personal involucrado deberá recibir información sobre su utilización. Límites de Tiempo para la Extracción Dependerá de cada tejido y de las condiciones de conservación del cadáver. En general se recomienda no superar las 15 horas si el cuerpo ha sido mantenido a temperatura ambiente, o 24 horas si el cuerpo ha sido enfriado en las primeras 6 horas después de la asistolia y se mantiene a dicha temperatura. Será preceptivo que en los formularios se recoja el dato de si el cuerpo ha estado en refrigeración o no. 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Procedimientos de Obtención de Tejidos y Células Los procedimientos de obtención deberán ser apropiados para cada tipo de donante y para cada tipo de tejido y/o células, y deberán realizarse mediante diversos procedimientos operativos estandarizados, debidamente documentados y validados. Estos procedimientos deberán ser adecuados para proteger las propiedades de los tejidos y células necesarias para su uso clínico, a la vez que se minimizan los riesgos de contaminación microbiológica. Deberán existir guías de procedimientos estandarizados disponibles para minimizar el riesgo de contaminación por parte del personal que pudiera estar infectado con enfermedades transmisibles. A. Donantes cadavéricos: La obtención de tejidos y células de personas fallecidas se podrá realizar según lo dispuesto en el artículo 11 de la Ley 41/2002 de 14 de Noviembre. En el caso de menores de edad o personas incapaces de consentir, la oposición a la donación podrá hacerse constar por quienes hubieran ostentado en vida su representación legal. Se deberá facilitar a los familiares y allegados información sobre la necesidad, naturaleza y circunstancias de la obtención, especificando qué procedimientos de restauración y conservación del cadáver y prácticas de sanidad mortuoria se llevarán a cabo. La obtención de tejidos y/o células de donantes fallecidos se realizará después de la certificación de la muerte y del consentimiento judicial si así fuera requerido. Además deberá registrarse el lugar de la extracción, la hora del fallecimiento y de la extracción. También deberá registrarse cualquier suceso que ocurra durante la extracción y que haya sido o pueda ser perjudicial para el donante y/o tejidos y células, así como cualquier investigación adicional que se derive de estos hechos para determinar su causa. La obtención de material reproductor de personas fallecidas con finalidad reproductiva se regirá por lo dispuesto en la Ley 14/2006 de 26 de Mayo, sobre técnicas de reproducción asistida. B. Donantes vivos: Sólo podrá realizarse si el donante es mayor de edad, cuenta con plenas facultades de obrar, estado de salud adecuado y da por escrito su consentimiento informado. La información que el médico responsable transmite al receptor debe incluir: el objetivo y la naturaleza de la obtención de los tejidos 22 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 y/o células, consecuencias y riesgos, pruebas de laboratorio que se vayan a realizar, registro y protección de datos y los fines terapéuticos. El consentimiento podrá ser revocado en cualquier momento antes de la obtención de los tejidos y/o células, excepto en los casos de obtención de progenitores hematopoyéticos de sangre periférica o de médula ósea, en que la revocación sólo podrá producirse antes del inicio del tratamiento de acondicionamiento del receptor. Procedimientos de Empaquetado, Etiquetado y Transporte de Tejidos y Células El empaquetado, etiquetado y transporte de tejidos y células se deberá realizar mediante procedimientos operativos estandarizados, debidamente documentados y validados. Si los tejidos y células son enviados a un centro de tejidos para su procesamiento, el procedimiento de obtención, empaquetado, etiquetado, mantenimiento y transporte hasta dicho centro deberá constar de un documento acordado entre la unidad de obtención y el centro de tejidos. El empaquetado y transporte de los tejidos y/o células deberá realizarse de manera que se minimicen los riesgos de contaminación microbiológica y se asegure la temperatura y condiciones requeridas para prevenir el deterioro de las propiedades biológicas y funcionales necesarias para su uso clínico, y quedar especificados en procedimientos documentados según el tipo de tejido y/o grupo de células a transportar. Deberán utilizarse contenedores adecuados para el transporte de material biológico y para mantener su calidad y seguridad. Las muestras de tejido o sangre (que acompañen a los tejidos y células extraídas) que se obtengan con el fin de servir para ulteriores tests o determinaciones de laboratorio, deberán ir adecuadamente etiquetadas, figurando la identificación del donante, y la información relativa al lugar y el momento en que se recogió la muestra. En los contenedores internos de los tejidos y/o células extraídos deberá figurar una etiqueta con la identificación del donante y el tipo de tejido y/o células. Si sus dimensiones lo permiten, en el contenedor deberá además figurar la fecha y hora de obtención, precauciones y aditivos utilizados (si procede), el receptor (en caso de donaciones directas). 23 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 En los contenedores externos de los tejidos y/o células extraídos deberá figurar una etiqueta con: • “Muestra biológica de tejidos/células - Manejar con cuidado”. • Identificación del centro de tejidos de origen del tejido y/o grupo celular, incluyendo la dirección, el teléfono y la persona de contacto para cualquier contingencia. • Identificación del centro de tejidos de destino del tejido y/o grupo celular, incluyendo la dirección, el teléfono y la persona de contacto a quien se debe entregar el contenedor. • Fecha y hora de inicio del transporte. • Especificaciones para mantener las características biológicas de los tejidos o células durante el transporte (si procede). • Especificaciones de almacenamiento (si procede). • En caso de que los tejidos y/o células puedan verse afectados por los rayos X debe figurar claramente: “NO IRRADIAR”. • En casos de productos que se conoce que son potencialmente contaminantes o de los que se desconoce los resultados de los tests serológicos debe especificarse: “RIESGO DE CONTAMINACIÓN BIOLÓGICA”. Reconstrucción del Cuerpo Una vez finalizada la obtención de los tejidos y células, el cuerpo del donante deberá ser reconstruido de manera que se aproxime lo más cercanamente posible a su configuración anatómica original y para hacer posibles los procedimientos funerarios habituales. Deberá disponerse del personal y equipos necesarios para la reconstrucción del cadáver del donante, quien procederá a tal reconstrucción. Documentación Los centros de tejidos dispondrán de un sistema de recogida y custodia de la información relativa a sus actividades que asegure la trazabilidad de todos los tejidos y células procesadas. En caso de que el sistema sea electrónico deberá asegurarse la disposición de copias de seguridad. Deberá existir un procedimiento documentado de la recogida y custodia de la información con un responsable de dicho sistema, designado por el propio centro de tejidos. Para cada donante se preparará un fichero que contenga: 24 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Identificación del donante (nombre, apellidos y fecha de nacimiento). 2. En neonatos, sangre de cordón u otro tejido o grupo de células obtenidos en el momento del parto, se registrará el nombre y fecha de nacimiento de la madre, la fecha de nacimiento del donante y su nombre si se conoce). 3. Edad, sexo, historial médico-social. 4. Resumen de la exploración física. 5. Fórmula de cálculo de la hemodilución (si procede). 6. Documento de consentimiento para la obtención. 7. Datos clínicos, resultados de los tests de laboratorio y cualquier otra determinación o prueba realizada. 8. Resultado del informe del examen necrópsico, en caso de haberse realizado. 9. En caso de tratarse de progenitores hematopoyéticos se registrará la documentación relativa a la idoneidad del donante para un determinado receptor. 10. Informe del equipo responsable del procedimiento de la extracción del cual se enviará una copia al centro de procesamiento de tejidos, donde se recogerá: • Identificación, nombre y dirección del centro de destino que va a recibir el tejido y/o grupo celular extraídos. • Identificación del donante, incluyendo cómo se llevó a cabo y quién lo realizó. • Causa, fecha y hora de asistolia (en donante cadavérico). • Descripción e identificación de los tejidos y células extraídos y de las muestras obtenidas para la evaluación. • Identificación del responsable del equipo extractor y firma del mismo. • Fecha y hora de inicio y finalización de la extracción. • Lugar de la extracción. • Descripción del procedimiento utilizado, el área y las condiciones en las que se realizó la extracción (si procede). • Incidentes ocurridos durante la extracción. 25 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • Información sobre los métodos y condiciones de la conservación del cadáver: refrigeración, temperatura, inicio, fin (en donantes cadavéricos). • Reactivos y soluciones de preservación utilizados (Identificación de lotes, control de la caducidad). • En los casos de donantes de esperma la información mínima a consignar será: nombre del centro de tejidos de destino, datos de identificación del donante y fecha y hora de obtención. La historia del donante será confidencial y completa. Todos los archivos deben ser legibles e indelebles y mostrarán los resultados de los tests así como la interpretación de dichos resultados. Los datos serán tan detallados como sea necesario para un entendimiento claro de cada paso, por una persona con experiencia en los centros de tejidos y estarán disponibles para una inspección solicitada por personas autorizadas, dentro de los límites de la confidencialidad médico-legal. Los datos identificarán al donante, documentarán la evaluación clínica y microbiológica del mismo. La información relativa al donante deberá ser archivada y protegida como mínimo hasta 30 años después del uso clínico o caducidad de los tejidos o células obtenidas, en la unidad de Coordinación de Trasplantes, y/o en el Banco de Tejidos. Control de la Viabilidad del Donante y los Tejidos Antes de procesar los tejidos, la persona designada como responsable revisará la historia médico-social del donante, el examen físico, los resultados de las determinaciones analíticas y microbiológicas, que se hayan realizado. Revisará las solicitudes de los que todavía no se tengan los resultados y no calificará su viabilidad hasta que se tenga el resultado de la autopsia si ésta se hubiera llevado a cabo. Los tejidos permanecerán en cuarentena mientras no se hayan completado satisfactoriamente todos los resultados. Cuando el donante y los tejidos sean considerados viables pasarán a estar disponibles para su distribución. 26 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 6. Bibliografía - Real Decreto de Células y Tejidos 1301/ 2006. - Estándares de la Asociación Española de Bancos de Tejidos - Recomanacions per a la prevenció de les infeccions quirúrgiques. Barcelona: Generalitat de Catalunya, 2002 - Resúmenes de la Jornada de Donación de Órganos y Tejidos. ONT, Madrid noviembre 2006 - Criterios de evaluación del Donante de órganos y Tejidos. Reúmenes del 6º Curs de Donació i Trasplantament. 2007. Formació continuada per a personal sanitari - Paredes D, Valero R, Navarro A, Miranda B, Viedma M, Cabrer C, Manyalich M.: Transplant procurement management: a training tool to increase donation. Transplant Proc. 1999 Sep;31(6):2610-1 27 Unidad didáctica 4: Banco de tejidos. Implantes tisulares. Aplicaciones Dra. Adela Miralles Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Bancos de tejidos: organización y funcionamiento 3.1 Legislación vigente aplicable a la preservación de tejidos 3.2 Organización general 3.3 Centros extractores 3.4 Obtención y envío al Banco 3.5 Procesamiento y controles de calidad del material biológico aplicables en el Banco de Tejidos 3.5.1 Manipulación 3.5.2 Serologia 3.5.3 Estudio anatomo patológico 3.5.4 Aspecto macroscópico 3.5.5 Determinación de la viabilidad 3.5.6 Microbiologia 3.5.7 Validación 3.6 Distribución desde el Banco de Tejidos a los usuarios 3.7 Condiciones del transporte 3.8 Seguimiento 3.9 Devolución del material no utilizado 3.10 Registros 4. Preservación de células y tejidos 4.1 Métodos de preservación 4.1.1 Preservación en Isotermia 4.1.2 Preservación en hipotérmia o refrigeración 4.1.3 Liofilización 4.1.4 Congelación 4.1.4.1 Agentes crioprotectores 4.1.4.2 Descongelación 4.1.4.3 Vitrificación 4.1.4.4 Congelación a altas presiones 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Preservación de tejidos 5.1 Tejido ocular 5.2 Tejido vascular 5.3 Piel 5.4 Membrana amniótica 5.5 Tejido músculo-esquelético 5.6 Tejido paratiroideo 5.7 Tejido reproductor 5.7.1 Tejido ovárico 5.7.2 Oocitos 5.7.3 Tejido testicular 5.7.4 Semen 5.7.5 Embriones 6. Conclusión 7. Bibliografía 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción. Antecedentes históricos y estado actual El interés por descubrir los mecanismos que permiten detener temporalmente las funciones vitales de un ser vivo viene de antiguo. En 1683, Robert Boyle, publica New Experiments and Observations Touching Cold, donde relata sus experiencias sobre la observación de los efectos de la congelación en organismos vivos. Aunque estas experiencias, podrían considerarse como la semilla que daría lugar a la Criobiología, no fue hasta 1949, cuando el descubrimiento por parte de Polge, Smith y Parkes de las propiedades crioprotectoras del glicerol, abrió definitivamente las puertas de la preservación a largo plazo de células y tejidos, dando lugar al nacimiento y desarrollo de los actuales Bancos de Tejidos. Hoy en día se aplican técnicas criobiológicas a distintos modelos celulares y tisulares, con la finalidad de restituir con el implante una función biológica deteriorada, con las máximas garantías de calidad y adecuación del tejido a las necesidades del receptor. Así mismo, los Bancos de Tejidos han incorporado otros métodos de preservación a corto y medio plazo. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer la organización básica y funcionamiento de los Bancos de Tejidos. - Conocer las diferentes opciones terapéuticas que los Bancos de Tejidos ofrecen a la sanidad para contribuir a mejorar la calidad de vida de los pacientes. - Conocer los diferentes métodos de preservación celular y tisular a corto, medio y largo plazo. - Conocer la legislación vigente que regula las actividades de los Bancos de Tejidos. - Conocer el alcance de las actividades desarrolladas en los Bancos de Tejidos. Estadísticas de actividad. 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Bancos de tejidos: organización y funcionamiento 3.1 Legislación vigente aplicable a la preservación de tejidos La preservación de células y tejidos para un posterior uso clínico viene regulada por una legislación que determina los procedimientos a seguir. El marco regulador básico en España es el Real Decreto 1301/2006 de 10 de noviembre de 2006, que define al Banco de Tejidos como la unidad técnica que tiene por misión garantizar la calidad de los tejidos después de la obtención y hasta su utilización clínica como aloinjertos o autoinjertos y regula la donación, obtención, preparación, procesamiento, preservación, almacenamiento, transporte, entrada y salida de España, distribución y suministro e implante. 3.2 Organización general Los Bancos de Tejidos deberán contar como mínimo con: - Área de recepción de muestras. - Área de trabajo que disponga del utillaje necesario para la correcta manipulación de los tejidos. - Área de almacenamiento, conservación de muestras y archivo. - Sistema de protección contra robos en el área de conservación de muestras y archivo. - Sistemas de seguridad que garanticen el almacenamiento de las muestras en las condiciones térmicas adecuadas. - Sistemas de seguridad que eviten la contaminación cruzada de las muestras. 3.3 Centros extractores Podrán ser Centros extractores de Tejidos, todos aquellos debidamente autorizados para esta actividad por la Administración competente. 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.4 Obtención y envío al Banco Los tejidos se han de extraer en condiciones de esterilidad y depositar en un recipiente de plástico, estéril, apirógeno y con cierre hermético, debidamente etiquetado y conteniendo una solución isotónica en cantidad suficiente para evitar la desecación a excepción, del tejido osteotendinoso que no requieren de solución de conservación. El tejido se enviará al Banco acompañado de una ficha técnica en la que han de constar como mínimo: - Datos de identificación del paciente. - Causa de la muerte y antecedentes médicos de interés. - Equipo extractor, hora de la extracción y condiciones de conservación. - Medios de resuspensión utilizados. - Caracterización del tejido. El plazo límite para el procesamiento en el Banco de Tejidos tras la obtención varía según el tejido de que se trate. 3.5 Procesamiento y controles de calidad del material biológico aplicables en el Banco de Tejidos 3.5.1 Manipulación La manipulación y procesamiento del tejido debe hacerse en condiciones de asepsia, en cámara de flujo laminar en un entorno que tenga una certificación de calidad del aire. Todo el tejido deberá ser procesado de forma aséptica, el material de contacto con el tejido debe ser estéril. El método de preservación a sguir dependerá del tipo de Tejido y del periodo deseado de conservación como se describe en el apartado 4 de este documento. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 1: Procesado de Tejidos en condiciones de esterilidad en sala blanca 3.5.2 Serologia Toda intervención destinada a obtener Tejido para uso clínico, deberá estar precedida de las oportunas pruebas de detección de marcadores, siendo de obligado cumplimiento la determinación de los marcadores para los virus de las hepatitis B y C , del virus de la inmunodeficiencia humana y sifilis. Del resultado se dejará la correspondiente constancia y certificación. El resultado positivo en estas pruebas no invalidará la utilización clínica del Tejido como autoinjerto, sin embargo, su conservación en el Banco de Tejidos se realizará de manera separada a otros Tejidos. En caso de no haberse realizado ninguna de las pruebas necesarias, el tejido debe ir acompañado del tubo con la sangre o el suero extraído al donante para llevar a cabo el mencionado cribaje y posterior custodia y mantenimiento del suero. 3.5.3 Estudio anatomo patológico Ante cualquier sospecha de alteración susceptible de contraindicar la donación se remitirá un fragmento del Tejido extraído a Anatomía Patológica para verificar la idoneidad del mismo y descartar cualquier anomalía. El envío a Anatomía Patológica puede hacerse directamente desde quirófano, antes de ser remitido al Banco. 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.5.4 Aspecto macroscópico La simple observación, de la apariencia física o morfológica, puede dar una idea general del estado del tejido. Debe realizarse un cribaje macroscópico del tejido a procesar y deben anotarse en la ficha técnica las características, número de fragmentos recibidos y tamaño de los mismos. Se determinaran también otras características del tejido como peso, longitud, diámetros, celularidad, según el modelo biológico de que se trate. 3.5.5 Determinación de la viabilidad Dependiendo del Tejido, se realizará un estudio de la viabilidad celular. Una opción en tejido sólido es centrifugar el medio en el que se ha disecado el Tejido y mediante una tinción vital tipo azul de tripano, determinar la viabilidad celular en el botón celular resultante. 3.5.6 Microbiologia Se recomienda la realización de cultivos aerobios, anaerobios y hongos de la solución de recogida y/o de la solución crioprotectora en la que se ha suspendido el Tejido para la congelación. Si la muestra objeto de estudio microbiológico contiene agentes antibióticos, se tomarán las medidas adecuadas para minimizar el riesgo de falsos negativos. Este tipo de controles tienen una doble finalidad, por una parte, la detección de posibles septicemias o micosis no documentadas en la paciente y por otra, el control de la esterilidad durante todas las manipulaciones que sufre el tejido desde el momento de su obtención hasta su posterior implante. En función de los resultados obtenidos en los controles bacteriológicos, se decidirá la actuación posterior: - Los tejidos contaminados en el momento de la extracción podrán utilizarse si se identifica y elimina el microorganismo demostrándose la negativización en cultivos posteriores. - Un tejido positivo para un Gram-negativo no se utilizará a no ser que se demuestre la eficacia en la destrucción y eliminación de endotoxinas en procesos posteriores. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Dependiendo de las características de los gérmenes aislados (microorganismos constituyentes de la flora bacteriana habitual de la piel), su uso puede estar sujeto a una valoración individual, por los responsables del banco de tejidos. Descontaminación Antibiótica Cuando los tejidos no han sido obtenidos en condiciones de esterilidad garantizada, es necesario realizar una esterilización posterior. El método a seguir debe garantizar la esterilización, minimizando a su vez, el riesgo de alteración de la viabilidad y funcionalidad. Como método de descontaminación se suele utilizar el tratamiento con antibióticos que permitan la destrucción de aerobios, anaerobios, miccobacterios y hongos. En ningún caso se empleará sin embargo penicilina, a fin de evitar posibles reacciones adversas en los receptores. 3.5.7 Validación El responsable del Banco informará al médico responsable del paciente de cualquier anomalía detectada en el control de calidad. Será el médico responsable del paciente quien decidirá la utilización o no del Tejido para autotrasplante. 3.6 Distribución desde el Banco de Tejidos a los usuarios Los Bancos podrán remitir Tejidos exclusivamente a centros autorizados para su utilización clínica, previa solicitud por escrito del médico responsable del paciente. El responsable del Banco informará al Centro implantador del resultado de los controles de calidad efectuados. La responsabilidad final de la utilización clínica corresponde al equipo implantador, con el consentimiento informado del receptor. La documentación que obligatoriamente deberá acompañar al envío del tejido al Centro implantador será: - Descripción de las características del tejido y de las soluciones de preservación. - Relación de las pruebas efectuadas. - Instrucciones, en su caso, para la descongelación y la utilización. - Código del Banco que permita el seguimiento de los tejidos enviados. 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.7 Condiciones del transporte Si la preservación del tejido se ha realizado a 4º C el transporte al Centro implantador se realizará en estas condiciones térmicas. En caso de que el tejido haya sido conservado mediante congelación, si el implante se va a realizar en el recinto en que está el Banco o cercano a él, se podrá enviar el producto descongelado, en un recipiente que conserve una temperatura de 4º C, en caso contrario, el transporte se hará en fase vapor de nitrógeno o nieve carbónica. El recipiente debe garantizar la temperatura adecuada de conservación, la integridad del Tejido y debe llevar un etiquetado exterior en el que figure: - Tipo de muestra. - Procedencia y destino del paquete: instituciones involucradas con el nombre de los responsables del envío y la recepción, sus direcciones y teléfonos de localización. - Día y hora de salida del Banco. - Instrucciones de transporte. Figura 2: Recipiente para el de transporte de Tejidos 3.8 Seguimiento Será responsabilidad del facultativo encargado del implante, informar al Banco sobre las condiciones de recepción y calidad del Tejido recibido, así como de las incidencias que hubieran podido sobrevenir. 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3.9 Devolución del material no utilizado Como norma general, se recomienda evitar el retorno al Banco de los Tejidos que por cualquier causa no hayan podido ser implantados, salvo en circunstancias especiales. El envío sólo podrá ser devuelto y aceptarse por el Banco, si el producto no ha sido descongelado, si puede ser demostrada la integridad del embalaje (no se han roto los precintos) y la temperatura de almacenamiento/congelación adecuada ha sido mantenida en todo momento. 3.10 Registros Los registros recogerán la información de cada una de las etapas del proceso, desde datos del donante, como nombre y diagnóstico, entre otros, al resultado de las pruebas efectuadas al Tejido, manipulación, procesamiento y el destino final de los mismos, de forma que en todo momento pueda garantizarse la trazabilidad. 4. Preservación de células y tejidos Las Células y Tejidos destinados a preservación en un Banco de Tejidos pueden tener distintos orígenes: - Donación para uso alogénico: - Donantes vivos. - Donantes a corazón parado. - Donantes en estado de muerte encefálica. - Preservación para uso autólogo. 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4.1 Métodos de preservación Entre los métodos de preservación Celular y Tisular más utilizadas destacan: - La isotermia. - La refrigeración. - La liofilización. - La congelación. La elección de uno método u otro va a depender de si se pretende: - Conservar la estructura tisular. - Conservar las funciones vitales. - Promover la proliferación celular. - La conservación a corto, medio o largo plazo. El período máximo de almacenamiento vendrá determinado por el método de preservación utilizado: - Isotermia (32 - 37º C): días o semanas. - Refrigeración (2 - 8º C): días o semanas. - Congelación entre -20º C y -40º C: 6 meses. - Congelación entre -40º C y -80º C: 5 años. - Criopreservación a temperatura inferior a -80º C: indefinido. - Liofilización: al vacío, indefinido; en ausencia de vacío, 5 años - Desecación: al vacío, indefinido; en ausencia de vacío, 5 años. 4.1.1 Preservación en Isotermia También denominada Cultivo Celular consiste en la aplicación de técnicas que permiten el mantenimiento de las Células/Tejidos in vitro, conservando al máximo sus propiedades fisiológicas, bioquímicas y genéticas. Permite la propagación, aumentando notablemente la masa celular a lo largo del tiempo. 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 3: Cultivos Celulares en incubación en una estufa a 37º C en un ambiente al 5% de CO2 4.1.2 Preservación en hipotérmia o refrigeración Tiene como objetivo disminuir o detener el metabolismo a fin de evitar la degradación Celular/Tisular, permitiendo el mantenimiento de las características fisiológicas. 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4.1.3 Liofilización La liofilización es un proceso en el que se pretende la deshidratación mediante la congelación inicial del producto seguida de la sublimación del agua congelada mediante aplicación del vacío. Mediante diversos ciclos de congelación/sublimación, se consigue eliminar prácticamente la totalidad del agua libre contenida en el producto original. La duración del proceso va a depender del volumen del producto. La eliminación del agua tiene como objetivo reducir las pérdidas de calidad debidas a reacciones químicas, causadas por degradación enzimática y no enzimática. Los productos liofilizados, retienen las propiedades físicas, químicas, biológicas y organolépticas de sus estados frescos. Los productos liofilizados pueden ser reconstituidos a su forma y estructura original por la adición de líquidos. El contenido de agua residual en el Tejido debe ser inferior o igual al 5% del peso inicial en fresco, (método gravimétrico o de Karl Fisher); o inferior al 8% cuando se analice mediante resonancia magnética nuclear. Formula para el cálculo del agua residual: H2O residual = (m x 100)/M m: el peso perdido y M: el peso inicial, en fresco. 4.1.4 Congelación Es un hecho conocido que las bajas temperaturas son capaces de detener los procesos biológicos y metabólicos, conservando las estructuras morfológicas. Utilizando adecuadamente los parámetros implicados en un proceso de enfriamiento y técnicas específicas, es posible conservar además, la capacidad funcional de diversos especímenes tras períodos más o menos prolongados de almacenamiento. Esta tecnología es la base del desarrollo de una nueva disciplina científica: La Criobiología. Un proceso clásico de criopreservación incluye la exposición inicial del material biológico a una solución crioprotectora, el enfriamiento previo al cambio de 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 estado, la congelación y el almacenamiento a temperaturas bajo cero, la descongelación y finalmente, la dilución y extracción del crioprotector, con el retorno a las condiciones fisiológicas. Al final del proceso, si se ha desarrollado adecuadamente, el material biológico criopreservado deberá mantener, su estructura morfológica y su actividad funcional. Con la aplicación de esta nueva tecnología, la conservación a largo plazo del material biológico adquiere cada vez mayor importancia, siendo utilizada en distintos campos de la medicina y la biología entre otros. Actualmente, son muchas las especies celulares y tejidos, a los que se aplican las técnicas criobiológicas, con un interés que va desde la necesidad de mantener una provisión celular de características estables para experimentación in vitro, hasta su manipulación ex vivo para la ulterior utilización en clínica. En este sentido, se están congelando entre otros, precursores hematopoyéticos, córneas, segmentos vasculares, válvulas cardíacas, huesos, paratiroides y concretamente, en el ámbito de la reproducción asistida, semen, embriones y oocitos. A pesar de ello, las técnicas implicadas en los procesos de criopreservación no están exentas de problemas de tipo teórico y técnico, que derivan fundamentalmente, del precario conocimiento que aún hoy se posee sobre los mecanismos físico-químicos que condicionan la respuesta de la célula viva ante el cambio de estado y sobre la génesis de las lesiones crioinducidas Un proceso clásico de criopreservación incluye la exposición inicial del material biológico a una solución crioprotectora, el enfriamiento previo al cambio de estado, la congelación y el almacenamiento a temperaturas bajo cero, la descongelación y finalmente, la dilución y extracción del crioprotector, con el retorno a las condiciones fisiológicas. Al final del proceso, si se ha desarrollado adecuadamente, el material biológico criopreservado deberá mantener, su estructura morfológica y su actividad funcional. Dado que la exposición del material biológico a los crioprotectores, en las concentraciones necesarias para producir un efecto protector no suele afectar significativamente a la supervivencia celular, las dificultades de la criopreservación derivan principalmente de los procesos de congelación y descongelación, que son muy críticos, especialmente en el rango de 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 temperaturas entre -5º y -20º C. El punto de congelación de la mayoría de células, se sitúa alrededor de los -2 °C. Sin embargo, la mayoría de células se congelan a temperaturas por debajo de los -5 °C, incluso, cuando el medio extracelular contiene hielo. El daño en las células sometidas a temperaturas bajo cero, parece debido principalmente a dos factores físico-químicos: la concentración de solutos que acompaña a la formación de hielo y la aparición de cristales de hielo en el interior celular. La incidencia de la lesión, en estos casos depende de diversos parámetros y especialmente de la permeabilidad de la membrana celular, que determina notablemente la probabilidad de la nucleación intracelular y también de la relación superficie/volumen celular. Si el enfriamiento es lo suficientemente lento, la célula va perdiendo agua de manera que se incrementa la concentración intracelular de solutos y el potencial químico del agua intracelular se equilibra con el agua extracelular. Así la célula se deshidrata pero no se produce cristalización intracelular. Si el enfriamiento es rápido, la célula no consigue perder agua suficiente para conseguir el equilibrio y se produce un sobreenfriamiento que conduce a la cristalización del agua intracelular. El tamaño de los cristales de hielo intracelulares dependerá de la velocidad de enfriamiento. A más velocidad, los cristales son más pequeños. Tanto una excesiva deshidratación celular, como la formación de hielo intracelular son causas de muerte celular durante la congelación. El que ocurra una de ambas situaciones depende de la permeabilidad de la membrana plasmática al agua. La exposición a soluciones hipertónicas puede producir desnaturalización de proteínas y desestabilización de membranas. La muerte celular por efectos osmóticos también puede deberse a la reducción a un volumen mínimo del cual la célula ya no puede recuperarse. Más recientemente, propone como causa de muerte celular por efectos osmóticos, la rotura de las membranas celulares a consecuencia de la presión que supone el flujo de agua hacia el exterior celular, hecho, que a su vez permitiría la entrada de hielo extracelular. Cada modelo celular, en función de sus características intrínsecas, tiene una velocidad óptima de congelación en la cual la supervivencia es máxima. Siendo esta velocidad un compromiso entre la excesiva deshidratación y la aparición de 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 hielo intracelular, aunque una velocidad de congelación idónea no es suficiente para asegurar el máximo de viabilidad del material criopreservado. Figura 4 S up er vi ve nc i 70 Embriones murinos 60 Stem Cells Células hámster Hematies 50 40 30 Levaduras 20 10 0 0 1 10 10 100 Velocidad de congelación (ºC/min) 1000 Mazur, Nature, 1970 4.1.4.1 Agentes crioprotectores Si se expresa la supervivencia en función de la velocidad de enfriamiento se delimita un rango de velocidades dónde la viabilidad es máxima, aunque bastante reducida (de un 10 al 20% en el mejor de los casos), de forma, que interaccionando estrictamente con la regulación de la velocidad de congelación, difícilmente se podrán conseguir buenas recuperaciones de viabilidad tras un proceso de congelación. Únicamente, alterando el comportamiento físicoquímico de las soluciones implicadas, se puede mejorar considerablemente el resultado de un proceso de congelación. Desde que Polge en 1949 descubrió las propiedades crioprotectoras del glicerol, se han descubierto múltiples sustancias que adicionadas a las soluciones o medios de congelación, aumentan considerablemente la supervivencia después de este proceso. Clásicamente, se han clasificado en dos grupos según puedan o no atravesar las membranas celulares: - Penetrantes. Son moléculas de bajo peso molecular que actúan provocando inicialmente, una disminución del volumen celular por deshidratación y luego un aumento del mismo, por la entrada del 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 crioprotector ligado al agua. El grado de permeabilidad, está determinado además de su peso molecular, por la propia permeabilidad y relación superficie/volumen celular, el gradiente de concentraciones establecido entre el interior y el exterior celular y la temperatura de exposición. - No penetrantes. Tienen un peso molecular más elevado y no pueden penetrar la membrana celular, pero actúan favoreciendo la deshidratación celular por aumento de la concentración osmótica en el medio extracelular. Se suelen utilizar en combinación con crioprotectores penetrantes y en especial cuando se utilizan velocidades de congelación rápidas. Los crioprotectores, son sustancias muy hidrosolubles que además de contribuir a la deshidratación celular por efectos osmóticos, actúan modificando el comportamiento físico-químico de las soluciones acuosas. Modifican la estructura de las moléculas de agua, por una parte rompiendo uniones de hidrógeno y por otra, ligando las moléculas de agua. Al actuar ligando moléculas de agua e impidiendo así la formación de hielo contribuyen a favorecer la vitrificación, especialmente, a partir de ciertas temperaturas. Cuando el crioprotector alcanza una cierta concentración a bajas temperaturas, la viscosidad es suficientemente alta para impedir la cristalización (en función de la velocidad de enfriamiento) en favor de la vitrificación. Un aspecto a tener en cuenta en la utilización de crioprotectores es que la permeabilidad celular al crioprotector es menor que al agua, lo que implica un efecto osmótico durante su introducción y extracción con cambios de volumen celular transitorios A esto cabe añadir, el posible efecto adverso de la exposición de las proteínas intracelulares a concentraciones bajas y altas de electrólitos. Por tanto, la introducción y extracción del crioprotector son pasos de extrema importancia para la posterior supervivencia de las células sometidas a procesos de criopreservación. 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 4.1.4.2 Descongelación Durante la descongelación, pueden ocurrir al menos tres fenómenos capaces de provocar por si mismos la pérdida de la viabilidad celular: - Recristalizacion. Está directamente relacionada con la velocidad de congelación y descongelación. Tras una congelación rápida, con una deshidratación celular insuficiente, es muy probable que se forme hielo intracelular si la descongelación es lenta. La forma de evitarlo es aumentar la velocidad de descongelación especialmente en la proximidad al punto de fusión. - Efectos osmoticos. Si tras una congelación lenta, se realiza una descongelación rápida, la concentración extracelular se diluye al deshacerse el hielo, pudiéndose producir shock osmótico si el crioprotector no tiene tiempo de salir evitando la entrada de agua y la dilatación celular. La muerte celular también puede deberse a la reducción a un volumen mínimo del cual la célula es incapaz de recuperarse. - Burbujas de gas. Es un fenómeno a tener en cuenta especialmente en cultivos celulares que han permanecido en incubación en una atmósfera con una composición de gases determinada. El gas solubilizado por el descenso térmico y desplazado por el frente de hielo, al aumentar la temperatura y retornar a su forma gaseosa puede reagruparse, formando unas burbujas de dimensión tal, que pueden llegar a provocar el estallido celular. 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 5: Esquema de un proceso clásico de criopreservación de Células y/o Tejidos Figura 6: Congelador biológico programable CM 2000. Carburos Metálicos 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 7: Descenso térmico clásico de congelación de células y tejidos utilizando un congelador biológico programable Dos modalidades de conservación a largo plazo de aplicación mas reciente son la vitrificación y la congelación a altas presiones 4.1.4.3 Vitrificación Consiste en la solidificación de un líquido por aumento de su viscosidad con el descenso de la temperatura, por interacción de agentes químicos con las moléculas de H2O evitando que contacten entre ellas y precipiten en forma de hielo. Al descender la temperatura, la energía térmica para mover las moléculas también disminuye. Al detenerse el movimiento el líquido pasa a estado sólido. Este líquido detenido en su movimiento molecular es lo que se conoce como vidrio y el proceso, vitrificación. Para conseguir la vitrificación de un órgano, aproximadamente la mitad del líquido que contiene debe sustituirse por agentes crioprotectores, pero a unas concentraciones tan altas que pueden resultar tóxicas. Una opción consiste en incrementar la concentración del crioprotector a medida que se va disminuyendo la temperatura. Así se ha conseguido la vitrificación y trasplante con éxito de 2 riñones de rata conservados a –46 ºC. Existe una dificultad añadida que resolver, y es la devitrificación: la cristalización del vidrio con el incremento de la temperatura en el proceso de retorno a temperaturas fisiológicas 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Para prevenir la devitrificación es necesario un incremento rápido y homogéneo de la temperatura: por ondas electromagnéticas de manera que se consiguiera un ascenso térmico superior a 300 ºC/min. 4.1.4.4 Congelación a altas presiones Una forma de reducir la concentración de crioprotector para conseguir la vitrificación de un órgano, es mediante la aplicación de una presión hidrostática de 1000 atmósferas. Sin embargo, estas presiones se han demostrado que no son bien toleradas por los órganos. 5. Preservación de tejidos 5.1 Tejido ocular Existen referencias bibliográficas de protocolos de criopreservación corneal que ofrecen una supervivencia endotelial y conservación de las características corneales dentro de los límites considerados válidos para trasplante. Además, la criopreservación ofrece como ventaja la posibilidad de tipificar antigénicamente el tejido, de manera que puede permitir mejorar el rendimiento del acto quirúrgico en trasplantes con alto riesgo de rechazo. Sin embargo, la criopreservación de córneas no es una practica habitual en los Bancos de Ojos, probablemente debido a que la demanda de este tejido es muy superior a la oferta, por lo que la relación coste-beneficio de la aplicación de estas técnicas no aconseja su uso, siendo las técnicas habituales de preservación, la conservación a 4º C por un periodo de alrededor de 7 días o a 31 – 37º C por un periodo de unos 30 días, en ambos casos, utilizando como solución de preservación, medios de cultivo suplementados con antibióticos. Otro tipo de tejido ocular ampliamente utilizado es la esclerótica, que suele conservarse en etanol y a temperatura ambiente. 22 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La preservación de globo ocular entero, cuya demanda esta incrementando últimamente, se realiza a 4º C en cámara húmeda y el periodo de preservación en estas condiciones no debería exceder de las 48 h para no comprometer la calidad del tejido. Figura 8: Córnea en medio de preservación Figura 9: Análisis de la densidad de células endoteliales mediante analizador de imagen Figura 10: Esclera conservada en etanol 23 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5.2 Tejido vascular El objetivo de la preservación de segmentos vasculares, es poder disponer de un depósito arterial, que poder utilizar para implante en enfermos con isquemia crítica en extremidades, cuando es imposible utilizar venas autológas, por no disponer de safena propia o cuando éstas son de calibre inadecuado o han sufrido un proceso tromboflebítico previo. Otro ámbito de aplicación, es en enfermos con isquemia crítica de extremidades sometidos a intervenciones previas de revascularización, destinados a la amputación de la extremidad y en los que sólo sea posible evitar implantando un injerto en los troncos distales de pequeño calibre. Como método de preservación se suele utilizar la criopreservación, pues otros métodos de preservación a largo plazo como la liofilización, se han mostrado menos eficaces, observándose acelularidad y calcificación tisular tras el proceso, al igual que ocurre, cuando se aplican estos métodos a la preservación de válvulas cardíacas. Un estudio publicado con una serie amplia y un largo periodo de seguimiento, mostró que un tercio de las válvulas fallaban y que la mayoría de las funcionantes, a los tres años estaban calcificadas. Otro método de preservación consiste en el almacenamiento a 4º C en medio nutritivo, sin embargo, no se pueden mantener en estas condiciones, con garantías de calidad, por un periodo superior a 8 semanas, por lo que no es un método aconsejable a no ser que se sepa seguro que se van a utilizar dentro de ese periodo. Figura 11: Bifurcado aortoileofemoral 24 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5.3 Piel De todas las alternativas posibles para el recubrimiento cutáneo en un quemado, la opción de elección es el trasplante autólogo. De todas maneras, según la magnitud de la lesión, esto no siempre es posible y con el objetivo de reducir el riesgo de contaminación bacteriana, de pérdida de agua, electrolitos y proteínas, de reducir el número de curas y el dolor así como, mejorar la cicatrización, se han de buscar alternativas. Entre las opciones posibles, la más habitual es la utilización de piel de cadáver criopreservada. Otra modalidad de preservación de piel a largo plazo es la liofilización y más recientemente, la conservación utilizando elevadas concentraciones de glicerol. Estos métodos, tienen como ventaja, que permiten el almacenamiento del tejido a temperatura ambiente. Además, la piel así preservada, tiene reducida la posibilidad de transmisión de agentes infecciosos y de rechazo pero por el contrario, tiene nula capacidad de prendimiento y de efecto cicatrizante. Figura 11: Piel preparada para criopreservación 5.4 Membrana amniótica La membrana amniótica es un tejido cuya demanda está incrementando en los últimos tiempos. Es de fácil obtención y manejo y es eficaz en el tratamiento de patología de la superficie ocular, en casos de resección conjuntival, erosión o defectos epiteliales y procesos inflamatorios de diversa índole. Su capacidad para regenerar tejidos dañados y minimizar lesiones superficiales lo hace muy útil. Otra aplicación de demanda creciente es para reconstrucciones vaginales en operaciones de cambio de sexo. 25 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Como método de preservación a largo plazo se utiliza la criopreservación, pues otros métodos como la desecación o liofilización, por las características intrínsecas de elasticidad y escaso grosor del tejido, no ofrecen de momento, una buena alternativa. Figura 12: Membrana amniótica 5.5 Tejido músculo-esquelético El método de preservación de tejido óseo más extendido, es la congelación directa en un congelador convencional a -80° C, ya que es un método, sencillo, rápido, económico y eficaz, cuando no se requiere la conservación de la viabilidad celular y el único objetivo que se pretende lograr con el implante, es la aportación de un entramado óseo o soporte estructural en el receptor. Otra ventaja importante de este método es que la respuesta inmunitaria es generalmente escasa y clínicamente inapreciable, por lo que no es necesaria la aplicación de ningún método profiláctico. Cuando realmente se requiere conservar la viabilidad celular, como se puede pretender del material cartilaginoso, es necesaria la utilización de agentes crioprotectores y descensos controlados de temperatura y, en estos casos, el almacenamiento se realiza en fase vapor de nitrógeno líquido. 26 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Otro sistema de preservación a largo plazo, de aplicación creciente, es la conservación mediante liofilización o desecación. Estos métodos tienen como gran ventaja respecto a la congelación, que el producto se almacena y transporta a temperatura ambiente, pero son métodos complejos, costosos y poco apropiados para grandes fragmentos. Con estos métodos, se producen importantes cambios biomecánicos y la incorporación de los injertos es más lenta que cuando que con la congelación. Figura 13: Fémur Figura 15: Hemitendones rotulianos 5.6 Figura 14: Tejido óseo esponjoso Figura 16: Polvo de hueso esponjoso liofilizado Tejido paratiroideo La criopreservación de tejido paratiroideo, es una práctica establecida en el ámbito de la medicina endocrinológica y cuya finalidad es contribuir a la restauración de la función paratiroidea tras una ablación quirúrgica. El hiperparatiroidismo, aparece frecuentemente en pacientes diagnosticados de insuficiencia renal crónica. Las manifestaciones clínicas pueden variar en grado y severidad, pero, indefectiblemente, entre un 10 y un 25% de los pacientes sometidos a hemodiálisis acaban desarrollando un elevado grado de osteodistrofia. El tratamiento de elección suele ser la paratiroidectomía subtotal, intentando conservar la mínima cantidad de tejido glandular necesario para 27 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 asegurar un adecuado paratiroidectomía metabolismo subtotal, puede del en calcio. ocasiones No obstante, devenir en esta un hipoparatiroidismo definitivo. Por este motivo, se suele recurrir a la criopreservación del material extraído, por si fuera necesario intentar restituir la función paratiroidea. Sin embargo, a pesar del importante auge de estas técnicas, en las dos últimas décadas, la aparición de importantes fibrosis en el lugar anatómico del implante está provocando un retroceso en su aplicación. 5.7 Tejido reproductor 5.7.1 Tejido ovárico La criopreservación de tejido ovárico, es una práctica establecida recientemente en el ámbito de la medicina endocrinológica y de la reproducción. Tiene como finalidad el restituir la función ovárica, cuando ésta ha fallado de forma prematura, debido en la mayoría de los casos, a los efectos secundarios o colaterales de los tratamientos oncológicos en mujeres jóvenes. Se aconseja su aplicación lo antes posible una vez efectuado el diagnóstico y antes de iniciar el tratamiento antineoplásico. Se desaconseja su aplicación en pacientes mayores de 35 años, debido a la reducción drástica en la dotación folicular que se presenta a partir de esa edad. Figura 16: Fragmentos de cortical ovárica 28 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 17: Tejido ovárico descongelado y reinsertado en el ovario residual. Inserción ortotópica Figura 18: Tejido ovárico Tejido ovárico descongelado y reinsertado en el espesor del músculo recto anterior del abdomen. Inserción heterotópica 5.7.2 Oocitos La criopreservación de oocitos sigue sin ser una práctica habitual en reproducción asistida, a pesar de las importantes aplicaciones que podría suponer y entre las que destacan: • Solventar la problemática de tipo ético y social que conlleva la congelación de embriones. • Preservar la fertilidad de pacientes susceptibles de esterilidad por enfermedad o tratamiento médico específico. • Permitir la creación de un banco de donantes, evitando la necesidad de sincronización de los ciclos ovulatorios de donante y receptora, así como un mayor seguimiento serológico en la donante. 29 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5.7.3 Tejido testicular La idea de criopreservar muestras obtenidas de una biopsia testicular en pacientes con azoospermia obstructiva o no obstructiva, surge sobre la base de minimizar el riesgo de no lograr espermatozoides en el momento de la ICSI (Intracytoplasmatic Sperm Injection), así como evitar tener que repetir la microcirugía si se requieren posteriores ciclos, en particular, para evitar lesionar el tejido testicular y el epidídimo. Otra aplicación es en pacientes oncológicos que no puedan acogerse a la criopreservación de semen, bien por ser prepuberales, o adultos azoospérmicos. Otros beneficiarios son los lesionados medulares. 5.7.4 Semen La criopreservación de semen humano es una práctica habitual en el medicina reproductiva. Las principales aplicaciones son: • Creación de un banco de donantes para el tratamiento de la esterilidad masculina. • Conservación de semen de individuos sometidos a vasectomía. • Conservación preventiva en pacientes portadores de semen patológico que requiera un proceso de concentración o mejora. • Preservación de la fertilidad en pacientes oncológicos. Figura 19: Espermatozoides 30 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Figura 20: Criopreservación de semen en tubos 5.7.5 Embriones La criopreservación de embriones es un complemento a las técnicas de FIV (Fertilización in vitro) que aporta múltiples ventajas y posibilidades diagnósticas y terapéuticas: • Preservar la fertilidad de determinadas pacientes. • Reducir el riesgo de embarazo múltiple. • Evitar la pérdida de embriones en un ciclo de reproducción asistida. • Facilitar la donación de embriones. • Permitir el diagnostico de anomalías genéticas. Figura 21: Embriones en estadio de 8 células 31 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 6. Conclusión Gracias al desarrollo y aplicación de las técnicas criobiológicas, son miles los pacientes que anualmente consiguen una mejoría en su calidad de vida. Aunque se han desarrollado otros métodos de preservación celular y tisular a largo plazo, la criopreservación sigue siendo el método más extendido. 32 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 7. Bibliografía - Evolución de la actividad de trasplante de tejidos en Cataluña. Período 1999-2005. Organización Catalana de Trasplantes. http://www10.gencat.net/catsalut/ocatt/es/htm/est_evolucio_transpl antaments_teixits.htm - Actividad de obtención e implante de tejidos humanos. Revista española de trasplantes, 2002. http://www.medynet.com/elmedico/publicaciones/trasplantes2/99116.pdf - Memoria actividad de Tejidos, 2006. Organización Nacional de Trasplantes. ONT http://www.ont.es/Estadistica?accion=1&id_nodo=19&id_estadistica =39&perfil= - Legislación vigente aplicable a la preservación de tejidos. Organización Nacional de Trasplantes. http://www.ont.es/Legislacion?id_nodo=35&accion=0&&keyword= &auditoria=F - Asociación Española de Bancos de Tejidos, AEBT. http://www.aebt.org/ - Asociación Europea de Bancos de Tejidos,EATB. http://www.eatb.de/ - Asociación Americana de Bancos de Tejidos, AATB. http://www.aatb.org/ 33 Unidad didáctica 5: Los Bancos de sangre de cordón umbilical Dr. Joan García y Dra. Marta Torrabadella Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Historia y Situación actual de los Bancos de Sangre de Cordón Umbilical (en adelante BSCU) 4. Organizaciones relacionadas con los BSCU 4.1. EUROCORD 4.2. NETCORD 4.2.1. Los Estándares NETCORD/FACT 4.2.2. La “Virtual Office” 4.3. ASIACORD 5. Funcionamiento de los BCU 5.1. El Programa de Sangre de Cordón Umbilical (PSCU) del BST 5.1.1. Área de donación 5.1.1.1. Obtención de la Sangre de Cordón (SCU) 5.1.2. Procesamiento y almacenamiento de la SCU 5.1.3. Registro búsquedas y suministro de la SCU 6. Legislación vigente que afecta a los BSCU 7. Conclusión 8. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción El trasplante de progenitores hemopoyéticos es una herramienta terapéutica consolidada en el tratamiento de numerosas enfermedades de base hematológica. No obstante, solo un tercio de los pacientes cuentan con un donante adecuado. Este hecho ha motivado el desarrollo de alternativas, como la utilización de donantes familiares no compatibles o donantes voluntarios no emparentados procedentes de registros internacionales. En este sentido, los bancos y registros de sangre de cordón, han representado un paso adelante aumentando significativamente las posibilidades de hallar donantes adecuados y, consecuentemente, mejorar las expectativas de curación de pacientes carentes de ellos. En la presente unidad didáctica se exponen los conocimientos básicos sobre el funcionamiento de los BSCU, su logística y su organización tanto a nivel local como internacional, finalizando con una breve cita a la legislación vigente. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer la organización básica y funcionamiento de los Bancos de Sangre de Cordón - Conocer los métodos de procesamiento y preservación de la Sangre de Cordón. - Conocer la organización de los BSCU a nivel Nacional e Internacional. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Historia y Situación actual de los BSCU Durante la gestación, la placenta y la circulación sanguínea feto-placentaria tienen cubren una importante número de funciones imprescindibles para el correcto desarrollo fetal. A pesar de ello, hasta la década de los noventa, la placenta y la sangre contenida en ella eran consideradas, después del parto, productos de desecho. Lógicamente, unas estructuras tan cruciales durante el largo periodo de la gestación debían poseer ciertas características que podían ayudar a entender ciertas áreas de la ontogenia y, en última instancia, ser de alguna utilidad. De hecho, el reducido conocimiento que se poseía de éstas era, básicamente, un exponente de la limitación de los métodos de investigación y análisis vigentes. En el ámbito de la hematología, el desarrollo de nuevas posibilidades de estudio fenotípico y funcional de las células madre y progenitores hemopoyéticos hizo que, durante los ochenta, numerosos investigadores volvieran a situar sus miras en el estudio de la ontogenia hemopoyética descubriendo, entre otras cosas, que la sangre de la placenta, fácilmente accesible a través de la punción de la vena umbilical, posee unas cualidades diferentes de la sangre adulta e incluso de la de los recién nacidos de más de 48 horas. Dos de estas cualidades son de especial relevancia: a) la sangre placentaria posee una concentración relativamente elevada de células madre hemopoyéticas de elevada capacidad proliferativa y, b) las células responsables de la respuesta inmune son relativamente “naive”, como posible exponente de la tolerancia feto-materna y de su falta de contactos previos con antígenos externos. Estas características convirtieron la sangre de cordón umbilical (SCU) en una fuente de progenitores hemopoyéticos potencialmente útil en trasplantes; hecho que se demostró en modelos animales y, posteriormente, en una primera experiencia exitosa publicada en 1989 por E. Gluckman. Se trataba de un niño que sufría una aplasia de Fanconi que recibió un trasplante de SCU de su hermano recién nacido. Una vez demostrada la capacidad de implante de los progenitores de la SCU entre familiares histocompatibles, con la experiencia previa del desarrollo estratégico de los registros de donantes no emparentados de médula ósea y la 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 premisa de la mayor permisividad inmunológica de las células inmunocompetentes de la SCU, se propuso la utilización de donaciones no emparentadas con el objetivo de completar el abanico de posibles donantes alternativos de progenitores hemopoyéticos para aumentar las posibilidades terapéuticas de pacientes que carecen de un donante familiar idóneo. Para posibilitar esta estrategia fue necesario el desarrollo de programas de donación, obtención, manipulación y almacenamiento de la SCU; en resumen, la creación de los bancos de sangre placentaria o de cordón umbilical (BSCU), con el objeto de poder suministrar este producto, con las máximas garantías de calidad, a los centros de trasplante. En este sentido, a pesar de la limitación que le confiere su escaso volumen y contenido de progenitores obtenidos, la SCU tiene una serie de ventajas adicionales sobre la MO procedente de registros de donantes no emparentados: a) menor incidencia y mejor control de enfermedades transmisibles, b) disponibilidad casi inmediata, c) ausencia de pérdidas del registro d) coste económico menor. El banco de sangre de cordón umbilical de Nueva York fue el pionero, iniciando su actividad en 1993, y también fue el primero que suministró una unidad de SCU no emparentada, durante el mismo año, para la realización del primer trasplante de este tipo en la “Duke University” de Durham. A esta iniciativa se sumaron los BSCU de Milan, Duesseldorf y Barcelona, entre 1994 y 1995, a los que progresivamente se sumaron otros hasta un total de más de 100 en el año 2007. En la actualidad hay más de 270.000 unidades de SCU disponibles de las cuales, aproximadamente la mitad, están situadas en BSCU Europeos y se han contabilizado más de 7000 trasplantes aunque esta cifra, probablemente esté subestimada ya que se están reportando más de 1500 nuevos trasplantes cada año. 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig 1. Crecimiento anual de las unidades de SCU registradas en BMDW 4. Organizaciones relacionadas con los BSCU Generalmente, los BSCU transfieren los datos de sus unidades a los registros nacionales (en España, el Registro Español de Donantes de Médula Osea “REDMO” patrocinado por la Fundación Internacional José Carreras) e internacionales (Netcord, Bone Marrow Donors Word Wide “BMDW”, National Marrow Donors Program “NMDP”, etc.) de manera relativamente homogénea, haciendo accesible, la mayor parte del inventario internacional a los centros de trasplante. Que ello sea posible hoy en día, se debe al trabajo y colaboración de diversas entidades, organizaciones y comités. Entre ellos cabe destacar: el BSCU de Nueva York, EUROCORD, NETCORD, ASIACORD y los registros nacionales de donantes de médula ósea; concretamente, en España, el Registro Español de Donantes de medula Ósea –REDMO– gestionado por la Fundación Internacional José Carreras. El BSCU de Nueva York fue el primero en establecerse, posee el más grande inventario de unidades de SCU del mundo y ha contribuido a, prácticamente, un 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 tercio de todos los trasplantes no emparentados de SCU realizados hasta ahora. Además ha generado contribuciones significativas al desarrollo de tecnologías para el procesamiento, almacenamiento, control de calidad y, por supuesto, al análisis del comportamiento clínico de los trasplantes de SCU. 4.1. EUROCORD EUROCORD es un registro internacional, liderado por la Dra. Eliane Gluckman, que actúa dentro del seno del European Blood and Marrow Transplant group (EBMT), que colabora con centros de trasplante europeos y no europeos que realizan trasplantes de SCU emparentados y no emparentados. Las bases de datos de EUROCORD y EBMT son cuidadosamente contrastadas y comprobadas para asegurar y validar todos los datos que se comunican. Los análisis del registro EUROCORD contribuyen al control y estudio de las respuestas clínicas, suministrando periódicamente estos datos a los BSCU asociados. Los resultados mas importantes generados por EUROCORD fueron los que demostraron la menor incidencia de enfermedad del injerto contra el huésped – EICH–, comparada con los trasplantes de medula ósea, lo que confirmaba la posibilidad de realizar trasplantes no compatibles, desde el punto de vista del sistema HLA y, también, en 1997, el grupo EUROCORD demostró, que el número de células de SCU trasplantadas (más de 0,37 x108/kg) era el factor pronostico mas importante para el implante y la supervivencia de los pacientes sometidos al TSCU. Ello modificó substancialmente la logística de los BSCU ya que, desde entonces, la mayor parte de los BSCU decidieron recolectar y almacenar unidades de gran volumen y contenido celular. EUROCORD ha demostrado que existen tres factores asociados significativamente a la probabilidad y velocidad de recuperación de los neutrófilos post trasplante: diagnóstico diferente a anemia aplásica, compatibilidad HLA y número de células recolectadas e infundidas. Los mismos tres factores están asociados con la recuperaciones de las plaquetas y la mortalidad relacionada con el trasplante. Análisis mas recientes han demostrado que el trasplante de un numero elevado de células disminuye la 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 influencia de la incompatibilidad en el sistema HLA y que, inversamente, el numero de células necesario para producir un implante es inferior en los trasplantes con mejor histocompatibilidad. En este sentido, un número ≥ 2x107/kg recolectadas o, alternativamente ≥ 1,5x107/kg infundidas, debería ser suficiente para implantar en pacientes adultos, siendo la compatibilidad HLA el segundo factor en importancia para determinar el donante de elección. Estos datos, por supuesto, plantean la cuestión de la factibilidad del trasplante de SCU en individuos de mayor peso, aunque, la proporción creciente de unidades de SCU que contienen un número elevado de células y los resultados alentadores demostrados en niños han incrementado substancialmente el numero de trasplantes realizados en pacientes adultos. Como se ha mencionado, el registro EUROCORD realiza análisis periódicos; en uno de ellos, con casi 700 trasplantes analizados, ya se pudo demostrar una mejora en la mortalidad relacionada con el procedimiento, a los cien días del trasplante, en los pacientes adultos sometidos a este tipo de tratamiento a partir de 1998, confirmándose la cifra de células infundidas como el factor pronóstico mas relevante en relación al implante y la supervivencia. De hecho, el número de células infundidas fue el único factor estadísticamente diferente entre los pacientes que recibieron un trasplante antes o después de 1998. Actualmente es ampliamente reconocido el relevante papel que tiene el grupo EUROCORD en el ámbito del trasplante de la sangre de cordón umbilical. 4.2. NETCORD En 1998 los BSCU pioneros (Milan, Duesseldorf, Barcelona, Londres, París, Bélgica, Tokio, Denver, San Luis, Nueva York y Leiden) crearon el embrión de una organización internacional, NETCORD, a la que posteriormente se han sumado otros bancos hasta llegar a poseer mas de 25 BSCU asociados. La fundación NETCORD (www.netcord.org) se estableció en 1998, para promover los bancos de alta calidad y el uso de la sangre de cordón umbilical en el trasplante alogénico. 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 NETCORD es una organización internacional, sin ánimo de lucro, que promueve el establecimiento de BSCU de alta calidad. Para ello ha generado unos estatutos, estándares y guías para promocionar estudios e investigación en torno a la obtención, procesamiento, caracterización y preservación de la sangre placentaria con el objetivo primario de promover la calidad en un entorno internacional. (Ver presentación 1 que se adjunta) 4.2.1. Los estándares NETCORD/FACT A fin de asegurar que dicha calidad elevada y uniforme, especialmente, en las unidades mostradas en su inventario, NETCORD ha establecido unos estándares de específicos, en colaboración con la Foundation for the Accreditation of Cellular Therapy (FACT), sobre la obtención, criopreservación, almacenamiento y suministro de las unidades de SCU. Fig.2: Estándares Netcord FACT (segunda y tercera edición) Todos los BSCU de NETCORD deben obtener la acreditación de NETCORD/FACT para ser miembros definitivos de esta organización. Estos estándares han sido adoptados por un numero importante de organizaciones internacionales y nacionales como: ASBMT, EBMT, ISCT, JACIE, ONT, CBMTG y WMDA, entre otras, y son objeto de frecuentes actualizaciones. El aseguramiento de la calidad, los procesos de validación y los procedimientos operativos basados en los estándares son la base de las inspecciones del proceso 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 de acreditación formal que, así mismo, deben observar las normativas de cada país. Hasta ahora mas de mas de BSCU han solicitado esta acreditación en EEUU, Europa, Australia y Asia. Ya se han realizado un número importante de inspecciones, mas de quince bancos ya han sido formalmente acreditados y otros diez están cubriendo las ultimas etapas del proceso. Cuarenta y un inspectores con experiencia específica en BSCU han sido entrenados y participan activamente en esta actividad. La FACT esta reclutando un numero creciente de inspectores a fin de poder cubrir las necesidades de acreditación a escala internacional. 4.2.2. La “Virtual Office” A fin de facilitar las búsquedas directas de unidades de SCU desde los centros de trasplante y los registros internacionales, NETCORD ha establecido un programa de búsqueda y asignación de unidades “on-line”, en forma de oficina virtual (Virtual Office –VO–). Este programa permite búsquedas, en tiempo real, de las unidades compatibles entre las disponibles en un momento dado. En la VO se puede obtener información detallada de las unidades pertenecientes al inventario de NETCORD en el que constan, actualmente, mas de 150000 perfectamente caracterizadas y disponibles. Tabla 1. Inventario y número de trasplantes de los BSCU asociados a NETCORD 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Los informes iniciales incluyen el tipaje HLA (muy frecuentemente, de alta resolución), volumen, contenido celular y análisis de marcadores de enfermedades transmisibles. De esta manera cuando un centro de trasplante solicita información a la VO, a los pocos minutos reciben un informe unificado de todas las unidades aceptables existentes en el inventario de NETCORD. La VO además posee información actualizada de la disponibilidad de unidades para evitar posibles conflictos o coincidencias enen su asignación. Hasta ahora, la VO ha facilitado la utilización de mas de 6000 unidades de SCU en todo el mundo y, recientemente, ha establecido un convenio de colaboración con diversos registros de donantes no emparentados, entre los que cabe destacar el Nacional Marrow Donor Registry (NMDP). La posibilidad de compartir las búsquedas de sangre de cordón umbilical en una única base de datos en la VO, facilita la rápida identificación de la mejor unidad posible para un paciente dado. Por otra parte, la interacción directa entre los centros de trasplante y el BSCU elegido, optimiza la programación del procedimiento y minimiza el trabajo burocrático requerido para el suministro a los centros de trasplantes. 4.3. ASIACORD Un fenómeno especial es el acaecido en Asia, donde la adopción de la tecnología del trasplante de sangre de cordón se ha difundido rápidamente, en parte debido al pequeño tamaño de las familias, que hace difícil hallar un donante adecuado que permita un trasplante hemopoyético. Para facilitar la búsqueda de unidades de SCU y fomentar su trasplante, la red asiatica de bancos de SCU fundó ASIACORD en el año 2000 en Bangkok. Los miembros de ASIACORD son los BSCU lideres en Asia: Bangkok, Pekin, Ho Chi Minh City, Seul, Taipei, Tianjin y Tokio. También han establecido unos estatutos y estándares basados, en parte, en los NETCORD/FACT. Además un sistema similar a la VO, adaptado al entorno asiático, esta en fase de implementación. El inventario actual en ASIACord incluye mas de 55000 unidades y mas de 400 trasplantes realizados (mas de 2/3 en Tokio ). (Ver información ampliada en manuscrito adjunto) 11 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Funcionamiento de los Bancos de Sangre de Cordón Después de múltiples análisis consecutivos (grupo EUROCORD, BSCU de Nueva York, Universidad de Minesotta, la Universidad de Duke i CIBMTR) se desprenden ya una serie de conclusiones relevantes: a) La SCU es capaz de implantar correctamente en la mayoría de los pacientes, aunque la velocidad de este implante es menor que la que se obtiene con progenitores de médula ósea o sangre periférica b) La incidencia de complicaciones inmunológicas, como la enfermedad del injerto contra el huésped, es comparativamente menor y por ello, c) El trasplante de SCU es más permisivo en cuanto a su histocompatibilidad aunque, a mejor compatibilidad mejores resultados, y, d) Los resultados clínicos, en términos de recuperación inmunológica y supervivencia, son comparables (en ocasiones incluso mejores) a los obtenidos con médula ósea o sangre periférica adulta de donantes no emparentados. En este contexto, los BSCU juegan un papel crucial ya que son el primer eslabón que condiciona el resultado clínico final. Los BSCU deben conjugar una serie de estrategias, técnicas y funciones encaminadas a la obtención de un producto con las máximas garantías de calidad. Precisamente, la aplicación de criterios comunes de calidad ha generado un elevado nivel de estandarización entre los diferentes bancos diferenciándose relativamente poco las estrategias y técnicas adoptadas en la mayoría de ellos. Por ello, nos permitimos documentar su funcionamiento siguiendo el hilo conductor del sistema organizativo del Programa de Sang de Cordó del Banc de Sang i Teixits de Cataluña que, en muchos aspectos, es similar a los programas de parecidas dimensiones. (Se recomienda revisar las presentaciones 2 y 3 durante la lectura del texto) 5.1. El Programa de Sangre de Cordón Umbilical (PSCU) del BST El primer embrión se constituyó en Septiembre de 1995, en forma de proyecto de investigación, con el objetivo de almacenar 10000 unidades de SCU perfectamente caracterizadas y de óptima calidad para su uso en programas clínicos de trasplante no emparentado. Desde entonces el proyecto ha crecido progresivamente hasta tener un inventario y una actividad trasplantadora 12 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 considerable. Actualmente, a un año de culminar este primer objetivo, entendemos que, a tenor de los datos presentes, una cifra deseable estaría alrededor del doble de la cantidad propuesta inicialmente. Por ello, hemos incrementado nuestra actividad con el objeto de alcanzar las 22000 unidades en cinco años. La actividad del PSCU se establece en tres áreas de actuación: el área de donación, u obstétrica, el laboratorio de procesamiento/almacenamiento y la unidad de registro, búsquedas y suministro. 5.1.1. Área de donación El área de donación se ha modificado profundamente desde el inicio del programa: desde dos maternidades activas en el año 1996 hasta más de 27 en Cataluña en el año 2007. Además, durante los últimos años, nuestro programa ha establecido unas fructíferas colaboraciones con algunas CCAA para establecer programas de sangre de cordón en su propio territorio. De esta manera, Illes Balears, Aragón, Navarra y Extremadura (a las que próximamente se añadirá Andorra) han implantado sus programas de Sangre de Cordón, en muy corto espacio de tiempo, beneficiándose de los aspectos técnicos y logísticos aportados por el PSCU de Cataluña. De esta manera se han añadido al proyecto unas 25 maternidades adicionales. Fig 3: Composición del Programa Inter-autonómico de BSCU Programa Inter autonómico de BSCU Programa SCU Aragón Programa Nodal Programa SCU Illes Balears Programa SCU Navarra Programa SCU Extremadura Programa SCU Andorra 13 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Las donantes son incluidas en el programa durante la gestación. Para ello es necesario descartar antecedentes personales y familiares de enfermedades transmisibles, genéticas o infecciosas, y la realización de análisis durante el embarazo, para descartar las infecciones por HIV, hepatitis y sífilis. Tabla 2: Analíticas obligatorias en la gestante (de los estándares NETCORD/FACT) Las madres seleccionadas e informadas apropiadamente consentimiento para la donación previo al parto. firman un No se debe solicitar el consentimiento para la donación una vez iniciado el trabajo de parto. 5.1.1. Obtención de la Sangre de Cordón Todas las madres incluidas en el programa con una gestación que supere las 32 semanas son potenciales candidatas a la recogida de SCU existiendo unos criterios consensuados de inclusión. Tabla 3. Criterios de Inclusión de las donantes de Sangre de Cordón Umbilical Antecedentes personales y familiares Serología anti-infecciosa de la madre Consentimiento Descartar enfermedades genéticas transmisibles en los padres y familiares de primer grado Negatividad para VIH, VHC, Lues (RPR), y antígeno de superficie de VHB Entender y aceptar las condiciones de donación antes del parto 14 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Transfusiones el último año Enfermedades autoinmunes Criterios de exclusión maternos Enfermedades neoplásicas Factores de riesgo para VIH Enfermedades neurodegenerativas Tª materna < 38ºC Gestación > 32 semanas Características del parto No existan complicaciones obstétricas No exista isoinmunización No se evidencie sufrimiento fetal El material necesario para la recogida de la SCU y las muestras anexas es: • Bolsa de recogida con anticoagulante, específica de este procedimiento. • Tubos con anticoagulante para controles de la sangre materna y SCU. • Frasco para guardar un fragmento de cordón como fuente extra de ADN del donante Fig. 4. KIt de obtención de SCU 15 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La SCU se obtiene cuando la placenta está “in útero” y el recién nacido ha sido separado de ella. Es posible (y, es práctica habitual de algunos bancos prestigiados) la obtención de la SCU “ex útero”, una vez la placenta ha sido alumbrada. La obención de la SCU se realizará por parte de personal sanitario, médico o diplomado, que específicamente realizará la recogida y será distinto del personal que asiste directamente el parto. La técnica “in útero” es la siguiente: • Doble “clampaje” y sección del cordón umbilical a 3-4 cm del ombligo. • Aseptización de la zona de punción. • Identificación y punción de la vena umbilical lo más distalmente posible. • Recolección por gravedad en la bolsa específica, agitando suavemente para evitar la formación de coágulos. • Expresión suave del cordón para ayudar al vaciado del mismo. • Practica de una segunda punción en zona mas cercana al periné. • Una vez recogido el máximo volumen posible se espera al alumbramiento de la placenta, cuyas venas de la cara fetal también se puncionan para obtener sangre adicional para las pruebas complementarias. Fig. 5. Punción de la vena umbilical • Se secciona un fragmento de cordón, y se guarda en el frasco correspondiente. La conservación y transporte del material se realiza a 4ºC durante un máximo de 40 horas desde la obtención. 16 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig 5. Maleta homologada para transporte “en fresco” Seguimiento posparto: Aunque no es obligado por estándares, es recomendable realizar un seguimiento clínico y analítico de la madre y el recién nacido durante el puerperio hospitalario, después de la cuarentena y, si es posible, a los seis meses, registrándose todas las incidencias que presenten la madre y el recién nacido. 5.1.2. Procesamiento y almacenamiento de la SCU El procesamiento consta de 4 fases diferenciadas: a) Caracterización inicial de la muestra: Se aceptan las muestras recibidas dentro de las 24 horas post-recogida. La caracterización inicial consiste en un recuento automático de células nucleadas (incluyendo eritroblastos), una extensión en portaobjetos para citología convencional. También se envían 4 ml para realización de tiraje HLA (A, B y DRB1), y una muestra para grupo sanguíneo. b) Reducción de volumen: Con el fin de almacenar las unidades en bolsas de 25 ml, 17 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig 6. Separación manual de la capa de células nucleadas de la unidad de SCU Método manual: inicialmente, se realizaba una reducción de volumen utilizando una técnica similar a la reportada por Rubinstein et al. Brevemente, se mezcla la SCU recibida con HES 6% en salino (HES Grifols, Barcelona) hasta una concentración final del 2,4%. Se centrifuga a 50xg, 5 minutos. Se obtiene un sobrenadante rico en células que se separa mediante extractor manual de plasma. Para ello se utiliza un kit de bolsas interconectadas cerrado donde están unidas la bolsa de procesamiento, la del plasma y la bolsa de criopreservación. El pellet de hematies resultante se utiliza para obtener ADN del donante. Se realiza una segunda centrifugación para desplasmatizar y obtener un sobrenadante sin células a 400xg, 15 minutos. Se separa el plasma y se ajusta por peso a 20 ml finales de células y hematíes residuales. Método automático: a fin de estandarizar y optimizar los resultados obtenidos hace siete años introdujimos un método automático de centrifugación y separación celular (Sepax® de Biosafe SA), que utilizando un sistema cerrado de bolsas, rotor y válvulas de separación permite centrifugar, separar las fracciones y depositar en la bolsa de congelación el producto final en menos de 30 minutos. 18 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig 7. Separador celular Sepax® de Biosafe SA Figs. 8 y 9. Esquemas de equipo desechable i secuencias del proceso de separación 19 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 c) Caracterización final: Se obtienen 0,3 ml de sangre separada para realización de recuento automático de células nucleadas y citometría de flujo para CD34. También se realiza test de esterilidad en frascos de hemocultivo pediátrico tras adición de DMSO (1 ml). Tabla 3. Caracterización de la muestra INICIAL1 FINAL2 CONTROL CRIOP3 CONTAJE AUTOMATICO4 0,3 0,2 ML 0,2 ML EXTENSION5 ML - - ABO Rh 1 - - GOT - 0,1 ML A - 0,1 ML 0,1 0,1 ML - ML 1 ML - HLA6 Unidades Formadoras de CD34 (citometria de Colonias7 flujo)8 ESTERILIDAD (hemocultivo) 4 ML Sobre la muestra a la recepción, sin ningún tipo de manipulación Sobre la muestra que va a ser criopreservada 3 Sobre un tubo control o segmento conteniendo la muestra, criopreservado junto con la bolsa 4 Contaje mediante el contador automático JT3 (Coulter) 5 Extensión sanguínea sobre porta y tinción rápida 6 Clase I (A,B) y DRB1 por SBT (sequencing-based typing) 7 CFU-GM, BFU-E y CFU-Mix 8 Población positiva para el anticuerpo HPCA-2-PE, sobre población de células vivas de tamaño y complejidad baja, CD45+ 1 2 d) Criopreservación: Se añaden 5 ml de DMSO y dextrano (peso molecular: 40,000 KD) para obtener un producto final consistente en células nucleadas de SCU, DMSO 10%, Dextrano 40 1% y HES 0,8%. Esta maniobra se realizaba, históricamente, en 15 minutos utilizando acumuladores de frío. Actualmente, se utiliza un sistema automático (Coolmix®, Biosafe), de enfriamiento controlado a 4ºC con agitación constante de la muestra y registro de temperatura La congelación programada y el almacenamiento se realizan utilizando el sistema Bioarchive (Thermogenesis). Este sistema criopreserva la muestra en 20 minutos con una cinética en la fase de cambio de estado de – 5ºC/minuto, en la fase de vapor de un tanque de nitrógeno. Una vez criopreservada (temperatura de la muestra inferior a -50ºC) es almacenada en el mismo tanque mediante un brazo robótico. La historia térmica de la muestra queda registrada. 20 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig. 10. Aparato Coolmix® de mezcla con Del crioprotector con control de temperatura y tiempo Fig 10. Sistema Bioarchive® de Thermogénesis MUESTRAS PARALELAS: Con el fin de garantizar la trazabilidad y proceder a re-tipajes o re-análisis de las muestras, cada unidad criopreservada posee muestras en paralelo, identificadas con el mismo código y congeladas a –80ºC. Estas corresponden a: - Plasma de la madre del día del parto, para realización de test anti- infecciosos: HbsAg, Ac-HCV, Ac-HIV1+2, RPR, Ac-CMV IgG+IgM. - Células de la madre, para trazabilidad, utilizando sistema HLA (confirmación de haplotipo) 21 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 - Plasma de la SCU (obtenido durante la reducción de volumen) - Fragmento tisular de cordón umbilical (para extracción de ADN del donante) - Células de SCU obtenida de las venas de la cara fetal de la placenta para obtención de ADN. - Durante la visita de cuarentena, la maternidad realiza un seguimiento post-parto de la madre y del recién nacido. En este momento se obtiene una muestra de sangre para realización de pruebas de “screening” serológico contra enfermedades transmisibles. 5.1.3. Registro, búsquedas y suministro de la SCU Todas las unidades son registradas con un código interno. El nombre de la madre es mantenido de forma confidencial para poder informarla de cualquier anomalía analítica observada. Todas las unidades validadas son incluidas en dos registros de datos con la información mínima necesaria para la búsqueda: código, celularidad nucleada criopreservada, volumen inicial obtenido, Células CD34+ y HLA (A,B, DRB1). Estos registros son REDMO (nacional, en el caso de España) y NETCORD (internacional). A través de estos registros se pueden consultar las unidades. Si existe alguna compatible para un paciente el centro de trasplante puede ponerse en contacto directamente con el banco para realizar las gestiones necesarias para el envío de la muestra. Estas incluyen, además de las propiamente administrativas, comprobación del tipaje, ampliación del estudio de enfermedades transmisibles, verificación de trazabilidad y estudios de viabilidad y estudios funcionales de la unidad. Las unidades se envían, a través de una empresa especializada, utilizando “dry shippers” capaces de mantener temperaturas de -140ºC durante una semana. Estos son validados antes de cada transporte e incluyen un registrador de temperatura que permite reconstruir toda la evolución térmica durante todo el recorrido. Cada unidad se acompaña de un formulario donde se registran las incidencias de la descongelación y los eventuales efectos adversos y que debe ser remitido al BCU. 22 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Fig 11. Dry Shipper, con recipiente protector y registro de temperatura Una vez se ha suministrado la unidad, el BSCU notifica a EUROCORD el trasplante realizado, a la par que suministra los datos biológicos de la unidad. A partir de este momento, EUROCORD realizará el seguimiento de la evolución clínica de los pacientes, realizando informes periódicos para el BSCU. 6. Legislación vigente, en España, que afecta a los BSCU Hemos creído interesante incluir esta información, ya que España ha sido uno de los primeros países en realizar la transposición de la reciente directiva de la UE sobre células y tejidos. Siendo, quizás, una de las mas avanzadas en este momento. El RD 1301/2006, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos contempla el uso autólogo eventual: las células o tejidos así obtenidos pueden ser preservados para su aplicación hipotética futura en la misma persona pero siempre y cuando se cumplan los siguientes requisitos: • La donación de células y tejidos será en todo caso voluntaria y altruista. 23 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • La promoción y publicidad de la donación se realizará de forma general, sin buscar un beneficio para personas concreta y señalándose su carácter voluntario, altruista y desinteresado. • Las actividades de los establecimientos de tejidos no podrán tener carácter lucrativo. • En todo caso se mantendrá confidencialidad de los datos. • Los centros y unidades de obtención de células y tejidos deberán tener autorización administrativa • Deberá asegurarse la trazabilidad de las donaciones • Existirá un sistema de codificación y de bio-vigilancia • Las autoridades competentes de las comunidades autónomas efectuarán inspecciones periódicas para garantizar que los establecimientos de tejidos autorizados cumplen los requisitos del RD 1301/2006 y aplican las medidas de control de calidad exigidas en él. • Los BSCU en España deberán cumplir unos requisitos de calidad y estar acreditados. Los BSCU que desarrollen actividad para eventual uso autólogo deberán: - Estar autorizados. - Disponer de un convenio o acuerdo entre la maternidad donde nazca el hijo y el banco donde se almacene la SCU del recién nacido. - Además debe informarse a las donantes que todas las unidades de SCU almacenadas en este tipo de bancos quedarán a disposición del Registro Español de Donantes de Médula Ósea (REDMO) y podrán ser utilizadas para tratar a cualquier paciente que necesite un trasplante de SCU y sea compatible con alguna de las unidades de SCU La SCU de donantes españolas podrá sacarse fuera de España siempre que lo desee la donante, sin embargo deben cumplirse las siguientes circunstancias: - El centro donde nazca el niño debe tener una autorización específica para extraer SCU - El banco de SCU al que se envíe la unidad de SCU de su hijo debe estar autorizado para la actividad de almacenamiento. 24 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 - Debe existir un convenio o acuerdo entre la maternidad donde nazca el niño y el banco donde se almacene la SCU. - Además, y en el caso de que el banco a donde envíe la SCU se encuentre fuera de la Unión Europea, debe cursarse una solicitud de salida de nuestro país de la unidad de SCU a la Organización Nacional de Trasplantes. Esta solicitud podrá realizarla directamente a la Organización Nacional de Trasplantes o a través de la Coordinación Autonómica de la CCAA donde resida. La maternidad es la que debe cursar la solicitud al Director de la Organización Nacional de Trasplantes para que se le autorice la salida de dicha unidad de SCU de nuestro país. Para ello, junto con la solicitud, deberá presentar: o Certificación o documento que demuestre que el banco de SCU al que se vaya a enviar para almacenamiento la unidad de SCU del recién nacido esta autorizado para tal actividad o Certificación o documento que demuestre la existencia de un convenio o acuerdo entre la maternidad donde nazca el niño y el banco donde se almacene la SCU del niño. Los BSCU para eventual uso autólogo deben: mantener los mismos estándares de calidad en la obtención, procesamiento y almacenamiento que los bancos de SCU públicos, asegurar que en caso de cese de actividad las unidades de SCU almacenadas serán transferidas a otro banco sin ningún riesgo de perdida ni deterioro y poner a disposición del Registro Español de Donantes de Médula Ósea (REDMO) todas las unidades almacenadas para que puedan ser utilizadas para tratar a cualquier paciente que necesite un trasplante de SCU y sea compatible con alguna de las unidades almacenadas en el banco. 25 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 7. Conclusión El trasplante de SCU es una actividad terapéutica establecida, aunque en continua evolución y mejora. Su “éxito” se debe, en parte, al desarrollo e implantación de los BSCU. Estos, a través de la innovación continuada y a la aplicación de rigurosos estándares de calidad han conseguido que la sangre de cordón haya pasado de ser un producto de desecho a ser, prácticamente, un medicamento celular de composición y cualidades cada vez las reproducibles y definidas. Sin haber llegado al final del camino, se puede afirmar que los BSCU han contribuido de manera decisiva a la mejora de las expectativas de vida de pacientes que, hasta hace poco carecían de un donante adecuado. 26 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 8. Bibliografía 1. Gluckman E, Broxmeyer HE, Auerbach AD et al. Hematopoietic reconstitution in a patient with Fanconi’s anemia by means of umbilical-cord blood from an HLA-identical sibling. New Engl J Med 1996; 335:157-66. 2. Broxmeyer HE, Douglas GW, Hangoc G et al. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells. Proc Natl Acad Sci U S A 1989; 86;3828-32. 3. Rubinstein P, Taylor PE, Scaradavou A et al. Unrelated placental blood for bone marrow reconstitution: organization of the placental blood program. Blood Cells 1994; 20: 587-600. 4. Gluckman E. European organization for cord blood banking. Blood Cells 1994; 20: 600-8. 5. Rubinstein P, Carrier C, Scaradavou A, Kurtzberg J, Adamson J, Migliaccio, AR, Berkowitz RL, Cabbad M, Dobrila NL, Taylor PE, Rosenfield RE, Stevens CE. Outcomes among 562 recipients of placental-blood transplants from unrelated donors. N Engl J Med. 1998;339:1565-77. 6. Rubinstein P, Dobrila L, Rodsenfield R et al. Processing and cryopreservation of placental/umbilical CB for unrelated marrow reconstitution. Proc Natl Acad Sci U S A 1995;92:10119-22. 7. Gluckman E, Rocha V, Chastang C. Cord blood banking and transplant in Europe. Eurocord. Vox Sang. 1998;74 Suppl 2:95-101. 8. Querol S, Gabarro M, Amat L, Gonzalez S, Gomez MD, de la Calle O, Madoz P, Badell I, Garcia J. The placental blood program of the Barcelona Cord Blood Bank. Bone Marrow Transplant. 1998;22 Suppl 1:S3-5. 27 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 9. Rocha V, Cornish J, Sievers EL et al. Comparison of outcome of unrelated bone marrow and umbilical cord blood transplants in children with acute leukemia. Blood 2001; 97: 2962-2971. 10. Laughlin MJ, Eapen M, Rubinstein P et al. Outcomes after transplantation of cord blood or bone marrow from unrelated donors in adults with leukaemia. N Engl J of Med 2004; 351: 2265-2275. 11. Rocha V, Labopin M, Sanz G et al. Transplants of umbilical-cord blood or bone marrow from unrelated donors in adults with acute leukaemia. N Engl J Med 2004; 351: 2276-2285. 12. Eapen M, Rubinstein P, Zhang MJ et al. Outcomes of transplantation of unrelated donor umbilical cord blood and bone marrow in children with acute leukaemia: a comparison study. Lancet 2007; 369: 1947-1954. 28 Unidad didáctica 6: Legislación, acreditación y aseguramiento de la calidad Dra. Adela Miralles Banc de Sang i Teixits. Centro de Tejidos y Terapia Celular Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Sumario 1. Introducción 2. Objetivos 3. Legislación, acreditación y aseguramiento de la calidad 4. Estándares de Calidad generales de aplicación en Bancos de Tejidos y Terapia celular 5. Bibliografía 2 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 1. Introducción El marco regulador básico en España referente a la obtención, procesamiento, preservación y distribución de células y tejidos para implante es el Real Decreto 1301/2006 de 10 de noviembre de 2006, que define al Banco de Tejidos como la unidad técnica que tiene por misión garantizar la calidad de los tejidos después de la obtención y hasta su utilización clínica como aloinjertos o autoinjertos. 2. Objetivos Después de estudiar esta unidad, el alumno debería: - Conocer la legislación vigente que regula las actividades de los Bancos de Tejidos y producción celular. - Conocer los distintos modelos de gestion de calidad aplicables en las actividades de Banco de Tejidos. - Conocer las distintas recomendaciones de actuación de sociedades científicas afines. 3 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 3. Legislación, acreditación y aseguramiento de la calidad Partiendo de la base del cumplimiento de la legislación vigente y como valor añadido a sus líneas de actuación, los Bancos de Tejidos están optando por la implantación de sistemas de calidad y normas de correcta de fabricación (NCF) o normas GMP (Good Manufacturing Practices). La jerarquia de normas aplicables en la gestión de los Bancos de Tejidos se distribuye como sigue: - Legislación nacional e internacional específica - - Real Decreto 1301/2006 Recomendaciones de asociaciones científicas afines o Estándares de calidad - Asociación Española de Bancos de Tejidos (AEBT) - Asociación Europea de Bancos de Tejidos (EATB) - Asociación Americana de Bancos de Tejidos (AATB) - Estándares FAHT/JACIE (Foundation for the Acreditation of Cell Therapy/ Joint Accreditation Committee ISCT-EBMT) - Netcord - Sistema de calidad - Norma ISO 9001:2000 - Normas de Correcta fabricación Estándares de calidad Los estándares de calidad tienen como objetivo proporcionar unas guías mínimas para las intituciones y las personas que implicadas en la obtención, procesamiento, preservación almacenamiento y suministro de células y tejidos para implante. Sistema de calidad Se entiende por sistema de calidad el conjunto de directrices, políticas y requisitos que se deben satisfacer en una empresa con el fin de dar cumplimiento a los estándares de calidad definidos o acordados con el cliente para un producto o proceso. Los sistemas de calidad se diseñan para establecer y facilitar las tareas productivas de la empresa, mediante métodos relacionados con la actividad; que permiten controlar, evaluar y resolver de manera permanente el proceso operativo y los problemas inherentes, tomando en cuenta los aspectos directos e indirectos respecto de la calidad. 4 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 La norma ISO 9001 elaborada por la Organización Internacional para la Estandarización especifica los requisitos para un sistema de gestión de la calidad que pueden utilizarse para su aplicación interna por las organizaciones, para certificación o con fines contractuales. La actual versión de ISO 9001 data de diciembre de 2000, por ello se expresa como ISO 9001:2000 y ha sido reorganizada en 5 secciones de requisitos que reflejan el ciclo de Deming "Planificar, Hacer, Comprobar, y Actuar", bien conocido en el mundo de la calidad. Las 5 secciones son: - Sección 4: Sistema de Gestión de Calidad - Sección 5: Responsabilidades de Dirección - Sección 6: Gestión de los Recursos - Sección 7: Realización del Producto - Sección 8: Mediciones, Análisis y Mejora Las Normas de Correcta Fabricación (NCF) o normas GMP (Good Manufacturing Practice) es el conjunto de normas y procedimientos a seguir en la industria farmacéutica para conseguir que los productos sean fabricados de manera consistente y acorde a ciertos estándares de calidad. Este sistema se elaboró para minimizar errores en la manufactura de productos farmacéuticos. Ya que nunca se puede asegurar al 100% que los errores vayan a detectarse al someter al producto a las pruebas finales, es decir, antes de ser distribuido. Las normas GMP abarcan todos los aspectos de la fabricación de productos farmacéuticos. Existen varias GMPs: las de la unión europea, las americanas (FDA, las japonesas, todas tienen contenido similar y un objetivo común. Las GMPs de la unión europea se dividen en dos partes principales: una dedicada a la producción de principios activos farmacéuticos (APIs) y otra dedicada a la fabricación de medicamentos. Estas dos partes son ampliadas mediante anexos, actualmente 18) que se revisan periódicamente. Se puede encontrar el contenido en http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/homev4.htm Es importante destacar que las Normas de Correcta Fabricación tienen tres objetivos claros: evitar errores, evitar contaminación cruzada del producto fabricado con otros productos y garantizar la trazabilidad hacia adelante y hacia atrás en los procesos. Sin embargo, la base de estas normativas de calidad es la 5 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 seguridad del paciente durante el uso de los medicamentos destinados a la prevención, atenuacion y recuperación de la salud. La gestión de calidad tiene que ver con la organización interna que ejerce la determinación de los procesos productivos y de las características y cualidades de los productos, es decir es la gerencia o el manejo de los proceso productivos enfocada al mejoramiento continuo. El Control de Calidad realiza o participa en la caracterización de los nuevos productos en sus diferentes fases de desarrollo y en el establecimiento de las especificaciones de calidad de los mismos. Desarrolla, ejecuta o coordina la ejecución de los métodos de ensayo para determinar las características de calidad de las materias primas, materiales, productos intermedios y productos finales. Diseña y realiza los estudios de estabilidad de los productos intermedios. Participa en el desarrollo, ejecución y perfeccionamiento del Sistema de Calidad. El aseguramiento de la calidad, se puede definir como el conjunto de acciones para plantear, organizar, dirigir y controlar la calidad en un sistema de producción con el objetivo de dar al cliente productos con la calidad adecuada. Es simplemente asegurar que la calidad sea lo que debe ser. Estas acciones deben ser demostrables para proporcionar la confianza adecuada (tanto a la propia empresa como a los clientes) de que se cumplen los requisitos del Sistema de la Calidad. La verificación del cumplimiento de las normas mencionadas se realiza de acuerdo a dos modalidades: - Acreditación - Certificación La Acreditación es el procedimiento por el cual un organismo autorizado reconoce formalmente que una entidad o persona es competente para llevar a cabo unas funciones específicas. 6 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 http://miro.h3m.com/~s04be433/calidad/aseguramiento/aseguramiento.html En España ENAC (Entidad Nacional de Acreditación) es el único organismo para acreditar: - Laboratorios de ensayo y calibración - Organismos de control (inspectores de instalaciones) Organismos de certificación (de productos, empresas o personas): de estos solo ha sido acreditado AENOR y solo para certificar. La acreditación de un determinado programa de trasplante es documentar que dicho programa cumple los requisitos definidos en los estándares y se lleva a cabo tras pasar por una inspección in situ realizada por personas cualificadas y con experiencia. La acreditación actualmente es voluntaria y debe ser solicitada por cada institución. Cada una de las partes que intervienen en el trasplante pueden acreditarse de forma independiente (programa clínico, centros de obtención y centros de procesamiento), pero últimamente el programa clínico 7 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 requiere que el centro de obtención y el centro de procesamiento asociados estén acreditados. La Certificación es el procedimiento mediante el que una tercera parte da garantía escrita de que un producto, proceso o servicio es conforme a unos requisitos específicos. En el ámbito de los Bancos de Tejidos la certificación del sistema de calidad se refiere al cumplimiento de la norma ISO/GMP correspondiente. La acreditación se refiere al cumplimiento de los estándares de instituciones y sociedades científicas afines. Organismos acreditadores son: - CAT (Comite de Acreditación Transfusional): acredita la extracción, procesado, análisis, almacenamiento y suministro para implante de tejidos - JACIE (Join Acreditation Commitee of ISCTe-Europe and European Bone Marrow Transplantation): acredita la extracción, procesado y trasplante de precursores hematopoyético de sangre periférica y médula ósea - NETCORD-FAHCT: acredita la extracción, procesado, análisis, almacenamiento y suministro para implante de la sangre de cordón umbilical. 4. Estándares de Calidad generales de aplicación en Bancos de Tejidos y Terapia celular A modo de resumen, los distintos estándares emanados de las diferentes asociaciones científicas contienen básicamente cuatro apartados, el primero (Parte A) dedicado a “terminología, abreviaciones y definiciones”, una parte (Parte B) que desarrolla los estándares de programa clínico, la Parte C y D, desarrollan los estándares de la colección y del procesamiento de los productos. Los puntos desarrollados en los estándares clínicos son: • B1 General –tamaño del programa y organización- • B2 Instalaciones de la Unidad Clinica • B3 Personal • B4 Gestión de la calidad 8 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 • B5 Politicas y procedimientos • B6 Valoración de donante • B7 Administración de altas dosis de terapia • B8 Investigación clínica • B9 Gestión de datos • B10 Registros Los puntos desarrollados en los estándares de la unidad de obtención son: • C1 General • C2 Instalaciones de la unidad de obtención • C3 Personal • C4 Gestión de la calidad • C5 Politicas y procedimientos • C6 Selección del donante, evaluación y gestión • C7 Etiquetado • C8 Procedimiento para la colección de productos de terapia celular • C9 Almacenado de productos de terapia celular • C10 Transporte de productos de terapia celular • C11 Registros • C12 Distribución directa al programa clínico Los puntos desarrollados en los estándares de la unidad de procesado son: • D1 General • D2 Instalaciones de la unidad de procesado • D3 Personal • D4 Gestión de la calidad • D5 Politicas y procedimientos • D6 Control de proceso • D7 Etiquetado • D8 Distribución • D9 Almacenado • D10 Recepción y transporte • D11 Eliminación de productos • D12 Registros 9 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 Aparte de estos estándares generales, sociedades científicas internacionales han publicado sus propios estándares de calidad en lo que hace referencia a las células progenitoras hematopoyéticas. Cada uno de ellos establece sus propios criterios para que una determinada institución –unidades clínicas, centros de obtención de CPH o laboratorios de procesamiento- llege a estar acreditáda para tales estándares. La diversidad de criterios a la hora de acrediatar a un determinado programa ha conducido a que se forme un grupo común denominado “Alliance for Harmonisation of Cellular Therapy Accreditation – AHCTA-“. En dicho grupo se integran las siguientes sociedades científicas europeas y americanas: EBMT (European Group for Blood & Marrow Transplantation), JACIE (Joint Accreditation Committee ISCT-EBMT), WMDA (World Marrow Donor Association), ISCT (International Society for Cellular Therapy), FACT (Foundation for the Accreditation of Cellular Therapy) , FACT-Netcord (International NETCORD Foundation), EFI (European Federation for Immunogenetics), ASBMT (American Society for Blood & Marrow Transplantation) y la AABB (American Association of Blood Banks). La misión de dicho grupo es alcanzar la armonización de los diferentes estándares y últimamente alcanzar unos estándares consistentes en cuanto a la calidad, seguridad y requerimiento profesional para la terapia celular, incluyendo el trasplante de progenitores hematopoyéticos. Actualmente en España se ha constituido un grupo conjunto formado por la ONT (Organización Nacional de Trasplante), CAT (Comité para la Acreditación en Transfusión) y JACIE. Dicho grupo co-ordinará la inspección y últimamente la acreditación de los diferentes programas de trasplante de progenitores hematopoyéticos. 10 Programa de Postgrado en Medicina transfusional y Terapia tisular y celular Módulo 2 5. Bibliografía - Legislación vigente aplicable a la preservación de tejidos. Organización Nacional de Trasplantes. http://www.ont.es/Legislacion?id_nodo=35&accion=0&&keyword= &auditoria=F - AEBT. http://www.aebt.org/ - EATB. http://www.eatb.de/ - AATB. http://www.aatb.org/ - International standards for cellular therapy product collection, processing, and administration. http://www.jacie.org/ - Norma ISO 9001:200 http://www.homoqualitas.com/castella/infos/iso90002000/portada.ht m http://www.buscarportal.com/articulos/iso_9001_2000_gestion_calida d.html - Aseguramiento de la calidad. http://miro.h3m.com/~s04be433/calidad/aseguramiento/aseguramie nto.html http://es.wikipedia.org/wiki/Calidad#Gesti.C3.B3n_Interna_y_Asegur amiento_de_la_Calidad 11