asserachrom® vwf:cb - Annar Diagnóstica Import
Anuncio

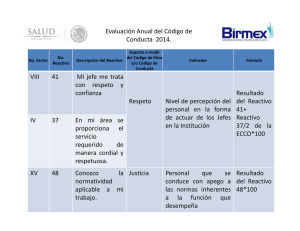
4/ COMPOSICIÓN DEL KIT ASSERACHROM® VWF:CB Enzimoinmunoensayo para la determinación de la capacidad de unión del factor von Willebrand al colágeno –3 –3 –3 –3 –1 –3 –3 –1 –1 (REF 00239) • • • Contenido del kit de 96 tests: x 2 tiras de Reactivo 1 (Coated Strip) viales de Reactivo 2 (Anti-VWF-Peroxidase) viales de Reactivo 3 (TMB) viales de Reactivo 4 (Dilution Buffer) vial de Reactivo 5 (Washing Solution) viales de Reactivo 6 (VWF:CB Calibrator) viales de Reactivo 7 (VWF:CB Control) soporte de tiras tapa de placa • • • • Español 6 Noviembre 2009 • 1/ UTILIZACIÓN DEL KIT Valoración de la capacidad de unión del factor von Willebrand al colágeno (VWF:CB) por el método ELISA. 2/ INFORMACIÓN SOBRE EL FACTOR VON WILLEBRAND • Enfermedad de Willebrand La enfermedad de Willebrand es la anomalía constitucional más frecuente de la hemostasis. Desde el punto de vista clínico, se caracteriza principalmente por hemorragias mucosas y cutáneas (7). Se diferencian tres grandes tipos de enfermedad de Willebrand (1, 7): – el tipo 1 corresponde a un déficit cuantitativo de VWF; clásicamente se consideraba el tipo más frecuente (70 a 80 % de los casos de enfermedad de Willebrand); sin embargo, este punto es discutido en la actualidad; – el tipo 2 agrupa las anomalías cualitativas del VWF; en general, la anomalía está relacionada con la estructura multimérica; – el tipo 3 se caracteriza por la ausencia casi completa de VWF en el plasma y en los compartimentos celulares. Principales tipos de enfermedad de Willebrand (6, 7) Test Tipo 1 Tipo 2A Tipo 2B Tipo 2M Tipo 2N Tipo 3 VWF:Ag ↓ No↓ No↓ No↓ N No detectable VWF:RCo* ↓ ↓↓ ↓ o ↓↓ ↓↓ N No detectable VWF:RCo/ VWF:Ag N Disminuido No No N / VWF:CB ↓ VWF:CB/ VWF:Ag HMWM** N N ↓↓ disminuido disminuido ↓↓ Disminuido Disminuido No No↓ N No detectable N N / N No detectables No Ausentes ausentes disminuido * VWF:RCo: actividad cofactor de la ristocetina del factor von Willebrand ** Multímeros de alto peso molecular N Normal • • Además, los déficits en VWF pueden estar asociados a diversos estados clínicos (mieloma, linfoma, lupus eritematoso diseminado, hipotiroidismo...). En estos casos se habla de enfermedad de Willebrand adquirida (2). Capacidad de unión del VWF al colágeno Sólo los multímeros de VWF de alto peso molecular funcionales se pueden unir al colágeno (3). Un valor disminuido de VWF:CB indica un defecto cuantitativo o cualitativo de dichos multímeros. El cálculo de la relación [VWF:CB]/[VWF:Ag] es importante para distinguir entre los tipos 2 de la enfermedad de Willebrand, los subtipos en los que existe una pérdida de multímeros de alto peso molecular (HMWM) (4). Esta valoración permite diferenciar entre el tipo 2A (relación [VWF:CB]/[VWF:Ag] muy disminuida) y el tipo 2M (relación [VWF:CB]/[VWF:Ag] normal o ligeramente disminuida). Algunos reactivos de este kit contienen productos de origen humano y/o animal. Cuando se ha utilizado plasma humano en la preparación de estos reactivos, se excluye previamente la presencia del antígeno HBs, de los anticuerpos anti-HCV, anti-HIV 1 y anti-HIV 2 con los correspondientes análisis. En el suero de cada placenta utilizada se realizan los mismos análisis. Sin embargo, ningún test puede garantizar de manera absoluta la ausencia de agentes infecciosos. Por eso, estos reactivos de origen biológico han de ser manipulados con las precauciones habituales, ya que se trata de productos potencialmente infecciosos. 5/ PRECAUCIONES El estuche intacto se debe conservar a 2-8 °C. Estos reactivos se destinan exclusivamente a un uso in vitro y deben ser manipulados por personal de laboratorio. Utilizar únicamente reactivos de un mismo kit o de un mismo lote. Los residuos se eliminarán con arreglo a la reglamentación local vigente. 6/ OBTENCIÓN Y TRATAMIENTO DE LA MUESTRA La obtención de la muestra debe ajustarse a las recomendaciones para los exámenes de hemostasis. • Obtención de sangre sobre solución de citrato trisódico 0,109 M: 1 vol. de citrato por 9 vol. de sangre. • Centrifugación: 15 minutos a 2000-2500 g. • Conservación del plasma: 4 horas a 20 ± 5 °C 1 mes a –20 °C. 7/ CONSERVACIÓN Y PREPARACIÓN DE LOS REACTIVOS Conservados a 2-8 °C en su embalaje original, los reactivos son estables hasta la fecha de caducidad indicada en el estuche. • Reactivo 1 Antes de abrir el embalaje, mantener el Reactivo 1 a temperatura ambiente (18-25 °C) durante 30 minutos; tras este periodo, las tiras están listas para usar. Comenzar la valoración (ver apartado 9.4.) inmediatamente después de sacar las tiras de su embalaje. • Reactivo 2 Reconstituir cada vial con 8 ml de Reactivo 4 (R4). Dejar que la solución se estabilice durante 30 minutos a temperatura ambiente (18-25 °C). A continuación, homogeneizar antes de usar con un agitador tipo Vortex. Debido a las características del Reactivo 4, el Reactivo 2 es irritante tras su reconstitución. Estabilidad tras la reconstitución: 4 horas a 20 ± 5 °C. • Reactivo 3 Mantener el Reactivo 3 a temperatura ambiente (18-25 °C) durante 30 minutos. A continuación, utilizar inmediatamente. PRECAUCIONES: EVITAR CUALQUIER CONTACTO CON UN ELEMENTO METÁLICO O CON AGENTES OXIDANTES. • 3/ PRINCIPIO DEL TEST Un soporte de plástico recubierto de colágeno humano (Reactivo 1) fija el factor von Willebrand existente en el plasma a probar, por medio de los multímeros de alto peso molecular. El VWF fijado se revela con anticuerpos de conejo anti-VWF humano marcados con peroxidasa (Reactivo 2) que se fijan sobre los determinantes antigénicos libres. La cantidad de peroxidasa unida se mide por su actividad sobre el sustrato TMB (Reactivo 3). Tras detener la reacción con un ácido fuerte, la intensidad de la coloración está en función de la concentración inicial de VWF capaz de unirse al colágeno (VWF:CB) presente en el medio. Reactivo 1: tira de 16 pocillos, recubierta de colágeno humano placentario de tipo III. Reactivo 2: inmunoglobulinas de conejo anti-VWF humano marcadas con peroxidasa, liofilizadas. Reactivo 3: vial de 8 ml de tetrametilbenzidina (TMB < 1 %), listo para usar. Reactivo 4: vial de 50 ml de tampón fosfato, listo para usar. Reactivo 5: vial de 50 ml de solución de lavado, concentrado 20 veces Reactivo 6: plasma humano liofilizado que contiene tras su reconstitución una cantidad conocida de VWF:CB (ver la hoja incluida en el kit). Esta cantidad se determina respecto a un estándar secundario del Estándar Internacional 02/150 establecido en 2003. Reactivo 7: plasma humano liofilizado que contiene tras su reconstitución una cantidad conocida de VWF:CB (ver la hoja incluida en el kit). Esta cantidad se determina respecto a un estándar secundario del Estándar Internacional 02/150 establecido en 2003. • Reactivo 4 Mantener el Reactivo 4 (R4) a temperatura ambiente (18-25 °C) durante 30 minutos antes de su utilización. Estabilidad tras la apertura: 15 días a 2-8 °C en ausencia de cualquier contaminación. • Reactivos 6 y 7 Reconstituir cada vial de Reactivos 6 (R6) y 7 (R7) con exactamente 0,5 ml de agua destilada. Mantener la solución durante 30 minutos a temperatura ambiente (18-25 °C) para que se estabilice y, a continuación, homogeneizar antes de usar con un agitador tipo Vortex. Estabilidad tras la reconstitución: 4 horas a 20 ± 5 °C. 8/ REACTIVO Y MATERIAL AUXILIARES • • • • Ácido sulfúrico 1 M (el ácido sulfúrico concentrado es aproximadamente 18 M). Material de lavado. Lector de placas a 450 nm. Equipamiento habitual en los laboratorios de análisis clínicos (centrifugadora, agitador tipo Vortex, cronómetro, pipetas multicanales, agua destilada…). 9/ PROCEDIMIENTO 9.1. Calibración La calibración se efectúa en tubos de plástico con el Reactivo 6. Preparar la solución inicial t diluyendo el Reactivo 6 a 1/51 en Reactivo 4 (20 µl de Reactivo 6 + 1 ml de Reactivo 4). Esta solución constituye el punto más alto de la calibración y su valor se indica en la hoja incluida en el kit. A partir de esta solución inicial, preparar la siguiente curva de calibración con Reactivo 4. Dilución de los diferentes puntos de la calibración Reactivo 6 (µl) t Reactivo 4 (µl) 1000 A título de ejemplo, 86 plasmas humanos que se consideran normales se han analizado con el kit Asserachrom® VWF:CB. Los resultados obtenidos son los siguientes: [VWF:CB] (%)* relación [VWF:CB]/[VWF:Ag]* Población total (n = 86) 103 (64 - 155)** 1,01 (0,82 - 1,18)** Grupo O (n = 53) 96 (62 - 138) 1,00 (0,80 - 1,15) Grupos no O (n = 33) 127 (86 - 160) 1,01 (0,87 - 1,20) t/8 t/16 500 500 500 500 En los sujetos del grupo O se observan niveles más bajos de VWF:CB, tal y como se describe en la literatura (5). 500 500 500 500 12/ CARACTERÍSTICAS DEL MÉTODO Dispensar en el pocillo: Muestra 200 µl Tapar los pocillos y mantener 1 hora a temperatura ambiente (18-25 °C). Lavar 5 veces con Reactivo 5, y añadir inmediatamente: FIJACIÓN DEL INMUNOCONJUGADO 11/ VALORES NORMALES t/4 9.2. Plasmas a probar Los plasmas se diluyen en tubos de plástico a 1/51 en Reactivo 4 (20 µl de plasma + 1 ml de Reactivo 4) y, si es necesario, a 1/2 en Reactivo 4 de esta dilución a 1/51. Para esta segunda dilución, el valor leído en la curva de calibración se multiplicará por 2. 9.3. Control El control de calidad se realiza con el Reactivo 7. Este reactivo se analiza a 2 diluciones realizadas en tubos de plástico: una dilución a 1/51 en Reactivo 4 y una dilución a 1/2 en Reactivo 4 de esta dilución a 1/51. Para esta segunda dilución, el valor leído en la curva de calibración se multiplicará por 2. 9.4. Valoración Inmediatamente después de sacar las tiras de su embalaje, distribuir por duplicado: – las diluciones estándares así como los controles y plasmas diluidos a analizar (en la hora siguiente a su preparación) – el Reactivo 4 (blanco reactivo). Todos estos pipeteos sobre la placa deben efectuarse en menos de 10 minutos. FIJACIÓN DEL ANTÍGENO En papel bilogarítmico, representar en abscisas el valor de VWF:CB (%) de los diferentes puntos de la calibración y en ordenadas el valor de la absorbancia correspondiente. Trazar la curva de calibración (modo no lineal). Si el calibrador y los plasmas se han diluido de forma idéntica, el valor de VWF:CB en las muestras analizadas se lee directamente en la curva de calibración. Calcular la relación [VWF:CB]/[VWF:Ag]. El resultado debe interpretarse en función del estado clínico y biológico del paciente. Comprobar que el resultado obtenido para el Reactivo 7 se sitúa en el intervalo indicado en la hoja incluida en el kit. Si no es el caso, asegurarse del buen funcionamiento de todo el sistema: condiciones operativas, reactivos, calibración, plasmas a analizar, etc. Si es necesario, repetir las muestras. t/2 20 Solución inicial o su dilución (µl) 10/ RESULTADOS Reactivo 2 200 µl Tapar los pocillos y mantener 1 hora a temperatura ambiente (18-25 °C). Lavar 5 veces con Reactivo 5, y añadir inmediatamente activando un cronómetro: 200 µl TMB (Reactivo 3) Esperar exactamente 5 minutos a 18-25 °C para cada muestra, y a continuación añadir: PRECAUCIONES: El Reactivo 4 contiene la mezcla 5-cloro-2-metil-2H-isotiazol-3-ona / 2metil-2H-isotiazol-3-ona (3:1). A la concentración a la que se presenta (< 0,06 %), esta mezcla se clasifica como irritante. R43: Posibilidad de sensibilización en contacto con la piel. S26: En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico. S28: En caso de contacto con la piel, lávense inmediata y abundantemente con agua y jabón. S36/37/39: Úsense indumentaria y guantes adecuados y protección para los ojos/la cara. COLORACIÓN Reactivo 5 Diluir a 1/20 en agua destilada. Para dos tiras, utilizar 15 ml de Reactivo 5 y completar hasta 300 ml con agua destilada. Estabilidad tras la dilución: 15 días a 2-8 °C en ausencia de cualquier contaminación. Si el Reactivo 5 presenta cristales, disolverlos manteniendo el vial 15 minutos a 37 °C. Comentarios – En cada lavado, llenar los pocillos con Reactivo 5 hasta el borde y después vaciarlos completamente; debe respetarse escrupulosamente el número de lavados. – No dejar nunca los pocillos vacíos, si es necesario llenarlos con Reactivo 5. – No poner las tiras bajo una luz intensa. – La temperatura influye en la intensidad de la coloración obtenida. La técnica se ha optimizado para una temperatura de 22 ± 2 °C. H2SO4 1 M 50 µl Tras distribuir el ácido en todos los pocillos, agitar la placa. 15 minutos a 1 hora tras detener la reacción, medir la absorbancia a 450 nm (ajustar el 0 con el blanco reactivo). * Mediana ** 95 % de la población incluida presenta un valor de VWF:CB o una relación VWF:CB/VWF:Ag situada dentro del intervalo establecido. • • Límite de detección - Intervalo de medición Con el protocolo indicado, el límite de detección es de 1 % de VWF:CB. El intervalo de medición se extiende de 1 a 140 % de VWF:CB. No obstante, para un lote dado, el límite superior del intervalo de medición corresponderá al valor indicado en la hoja para el Reactivo 6. Reproducibilidad Los resultados de los estudios de reproducibilidad se indican en la siguiente tabla: Reproducibilidad intra-serie Reproducibilidad inter-series Muestra Muestra 1 Muestra 2 Muestra 3 Muestra 4 _ n X (%) SD (%) CV (%) 21 44,5 1,7 3,9 21 75,3 3,5 4,6 10 41,9 2,3 5,4 10 76,2 2,1 2,8 BIBLIOGRAFÍA 1. SADLER J.E.: “A revised classification of von Willebrand disease”. Thromb. Haemostasis, 71, 4, 520-525, 1994. 2. VEYRADIER A., JENKINS C.S.P., FRESSINAUD E., MEYER D.: “Acquired von Willebrand syndrome: from pathophysiology to management”. Thromb. Haemostasis, 84, 175-182, 2000. 3. FAVALORO E.J.: “von Willebrand factor collagen-binding (activity) assay in the diagnosis of von Willebrand disease: A 15-year journey”. Sem. Thromb. Haemost., 28, 2, 191-202, 2002. 4. FRESSINAUD E., MAZURIER C., MEYER D.: “Molecular genetics of type 2 von Willebrand disease”. Int. J. Hematol., 75, 9-18, 2002. 5. HALEY E., BABAR N., RITTER C., DOWNES K.A., GREEN D., SHURIN S., SARODE R.: “Effect of ABO blood group on the collagen-binding assay for von Willebrand factor”. Am. J. Hematol., 71, 229-231, 2002. 6. FRESSINAUD E., MEYER D.: “Von Willebrand disease: biological diagnosis” dans “Textbook of hemophilia”. Lee C.A., Berntorp E., Hoots K., Oxford: Blackwell Publishing, 272-278, 2005. 7. FRESSINAUD E., MEYER D.: “La maladie de Willebrand : du diagnostic au traitement”. Revue du praticien, 55, 20, 2209-18, 2005. Los cambios significativos son indicados por las líneas punteadas en el margen. DIAGNOSTICA STAGO S.A.S. 9 rue des Frères Chausson 92600 Asnières sur Seine (France) +33 (0)1 46 88 20 20 [email protected] Las informaciones y/o las imágenes contenidas en este documento están protegidas por copyright y otros derechos de propiedad intelectual, © 2009, Diagnostica Stago, todos derechos reservados. Los logotipos y/o los nombres de los productos de Español Diagnostica Stago son marcas registradas.