6S,8R
Anuncio
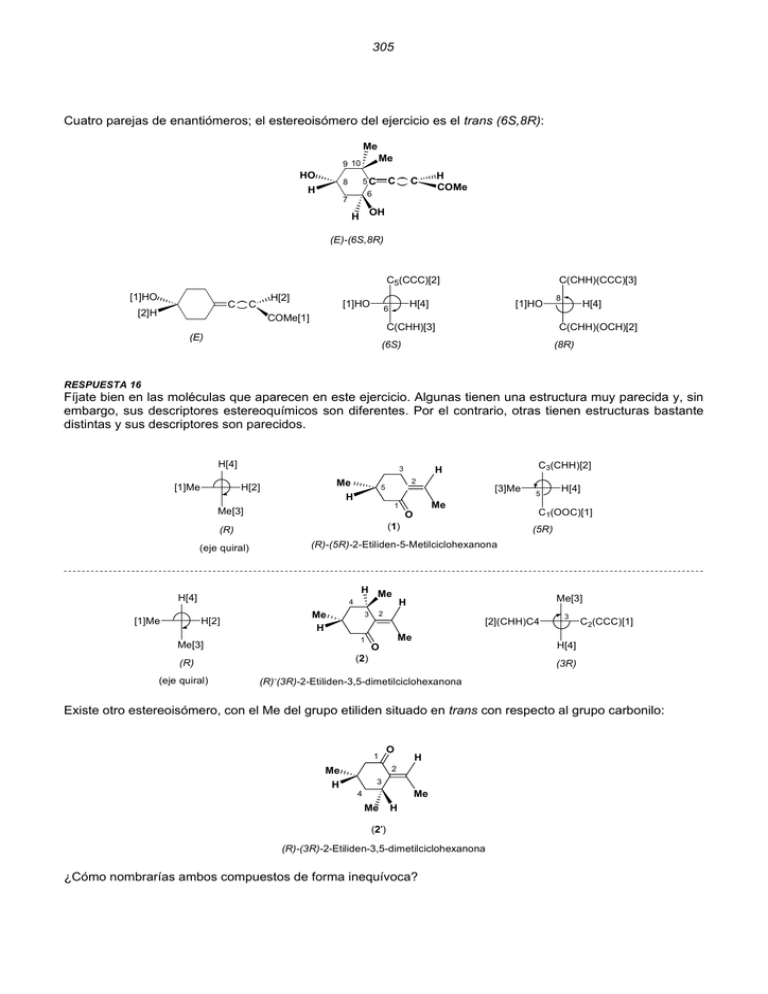
305 Cuatro parejas de enantiómeros; el estereoisómero del ejercicio es el trans (6S,8R): Me Me 9 10 HO H C 5C 8 H COMe C 6 7 H OH (E)-(6S,8R) C5(CCC)[2] [1]HO C [2]H H[2] C [1]HO H[4] 6 COMe[1] C(CHH)(CCC)[3] [1]HO C(CHH)[3] (E) 8 H[4] C(CHH)(OCH)[2] (6S) (8R) RESPUESTA 16 Fíjate bien en las moléculas que aparecen en este ejercicio. Algunas tienen una estructura muy parecida y, sin embargo, sus descriptores estereoquímicos son diferentes. Por el contrario, otras tienen estructuras bastante distintas y sus descriptores son parecidos. H[4] [1]Me Me H[2] 2 5 H 1 Me[3] (R) O 5 H[4] C1(OOC)[1] (5R) (R)-(5R)-2-Etiliden-5-Metilciclohexanona H[4] 4 H Me Me H H[2] Me[3] H 2 3 1 Me[3] [2](CHH)C4 Me O 3 C2(CCC)[1] H[4] (2) (R) (eje quiral) [3]Me Me (1) (eje quiral) [1]Me C3(CHH)[2] H 3 (3R) - (R) (3R)-2-Etiliden-3,5-dimetilciclohexanona Existe otro estereoisómero, con el Me del grupo etiliden situado en trans con respecto al grupo carbonilo: 1 Me H O H 2 3 Me 4 Me H (2') (R)-(3R)-2-Etiliden-3,5-dimetilciclohexanona ¿Cómo nombrarías ambos compuestos de forma inequívoca? 306 H Me H[2] [2](CHH)C3 2 Me[1] [1](OOC)C1 Me[3] H 3 4 1 6 (Z) 4 [2](CHH)C6 Me O C2(CCC)[1] H[4] (3) (4R) (Z)-(4R)-2-Etiliden-4-metilciclohexanona 1 H Me 2 CH C 4 H Me (4) (Z)-1-(4-Metilciclohexiliden)-1-propeno H 4' Me Me 4 H (5) (E)-4-Metil-1-(4-metilciclohexiliden) ciclohexano [1](CCC)C1 3 H Me Me[3] C5(CHH)[2] (3S) Me 5' Me[3] 3 1' 1 H[4] 5 (6) H[4] Me[3] 3 1 1 Me 4 [2](CHH)C6 3 H 6 C6(CHH)[4] H[4] (7) (R)-(3R)-1-(3-Metilciclohexiliden)-4-metilciclohexano (3R) (eje quiral) 5 6 1 H 3 Me 2 C C 4' H Me (8) (Z)-(3R) H[4] [2](CHH)C5 C [1](CCH)C3 C 4' H[2] Me[1] [1](CCC)C1 3 C5(CHH)[2] Me[3] (Z) C 1'(CCC)[1] (3R') H Me Me[1] (R) 3' [2](CHH)C'5 (3S,3'R)-1-(3'-Metilciclohexiliden)-3-metilciclohexano C3(CCH)[3] [2]H H 3' (3R) C1(CCC)[1] 307 Me[3] Me C 4 H C H 4' [1]Me Me H[2] (9) H[4] (R) (R) (eje quiral) H Me[3] H[2] C 4 () [1]Me 2' Me C Me[3] H 4' H H[4] Me 3' 3' [2](CHH)C2' Me H[4] (10) (3'R) (S)-(3'R) (S) C4'(CCH)[1] (eje quiral) 5 1' 1 Me C 3 C C 4' 5' (11) H Me H 3' H Me (3S,3'R,4'R) Me[3] 3 [1](CCC)C1 C5(CHH)[2] [1](CCC)C1' H[4] H C4'(CCH)[2] 3' [3]Me 4' (3'R) (4'R) Me[3] Me 9 [1]Me 3 H H[2] H[4] (12) (R) (R)-3,9-Dimetil espiro[5,5]undecano Me H (eje quiral) 4 9 5 Me 2 (13) H trans-(2R)-2,9-Dimetil espiro[5,5]undecano Me[3] [1]Me [2]H 9 C4(CHH)[2] C2(CCH)[1] trans H[4] C5'(CHH)[2] Me[3] (3S) Me C3'(CCH)[1] H[4] [2](CHH)C4 2 H[4] (2R) C5(CCC)[1] 308 10 4 Me 6 8 2 H Me H (14) (2R,8S)-r-2-Metil-t-8-metil espiro[5,5]unecano [2](CHH)C10 Me[3] Me[1] 2 [2](CHH)C4 2 [1](CCH)C8 C10(CHH)[2] C6(CCC)[1] [4]H H[4] H[2] C6(CCC)[1] (2R) r-2-Metil-t-8-metil Me[3] 8 (8S) RESPUESTA 17 La molécula no se puede dividir en dos mitades iguales; tiene un átomo de carbono estereogénico (C5 es asimétrico) y un eje quiral: 1 H 5 O Cl n = 2 ; N = 2n = 4 ; N' = 0 2 Me H 2-Clorometilen-5-metilciclohexanona Dos parejas de enantiómeros: (R)-(5R) / (R)-(5S) y (S)-(5R) / (S)-(5S) 3 Me H [1] Me 5 H [2] Cl 1 C3(CHH)[2] H [4] H [3] (HHH)C Cl[3] O C1(OOC) [1] (5R) (R) (eje quiral) (R)-(5R)-2-Clorometilen-5-metilciclohexanona H Me Me [1] [2]H 5 1 O C3(CHH)[2] Cl [3] Cl 3 H [4] H H [4] Me H (5S) 1 O H C3(CHH)[2] Cl[3] [1]Me 5 H[2] H[4] (S) (S)-(5R)-2-Clorometilen-5-metilciclohexanona C(HHH) [3] (eje quiral) Cl 3 5 C1(OOC) [1] (R) (R)-(5S)-2-Clorometilen-5-metilciclohexanona H [4] 5 (eje quiral) [3]C(HHH) 5 H[4] C1(OOC)[1] (5R) 309 H Me Me[1] [2]H 5 1 Cl O C3(CHH)[2] H [4] H 3 [4] H 5 Cl [3] C(HHH)[3] C1(OOC)[1] (5S) (S) (eje quiral) (S)-(5S)-2-Clorometilen-5-metilciclohexanona RESPUESTA 18 La molécula no se puede dividir en dos mitades iguales; tiene dos átomos de carbono estereogénicos (C1 y C6 son asimétricos) y presenta isomería cis / trans: HO H 1 2 5 H n = 3 ; N = 2n = 8 ; N' = 0 7 6 OH 1,6-Dihidroxi espiro[4,4]nonano Existen 8 estereoisómeros (cuatro parejas de enantiómeros): cis-(1R,6R) / cis-(1S,6S) trans-(1R,6R) / trans-(1S,6S) cis-(1R,6S) / cis-(1S,6R) trans-(1R,6S) / trans-(1S,6R) H OH 2 9 OH 1 7 5 6 4 H (1R,6R)-r-1-Hidroxi-c-6-hidroxi espiro[4,4]nonano [2]H 1 OH[1] OH[1] OH[1] C9(CHH)[2] [3](CHH)C2 C6(OCH)[1] 1 [3](CHH)C7 C5(CCC)[2] H[4] H[4] cis (1R) r-1-Hidroxi-c-6-hidroxi H OH 2 9 5 4 (6R) HO H OH 9 OH 1 7 6 H cis (1R,6R)-r-1-Hidroxi-c-6-hidroxi 6 1 7 6 H 2 5 4 cis (1S,6S)-r-1-Hidroxi-c-6-hidroxi C5(CCC)[2] 310 H OH H 9 7 HO H 2 1 1 5 6 4 H OH (1S,6S)-r-1-Hidroxi-t-6-hidroxi 9 1 4 OH OH cis 2 5 6 6 4 9 7 7 5 HO H H H 1 cis (1R,6S)-r-1-Hidroxi-c-6-hidroxi 6 OH trans (1R,6R)-r-1-Hidroxi-t-6-hidroxi 7 6 4 trans OH 9 7 5 OH 2 H 9 2 (1S,6R)-r-1-Hidroxi-c-6-hidroxi HO H H OH 9 2 2 1 5 5 4 4 H OH 1 trans 7 6 H trans (1S,6R)-r-1-Hidroxi-t-6-hidroxi (1R,6S)-r-1-Hidroxi-t-6-hidroxi RESPUESTA 19 La molécula no se puede dividir en dos mitades iguales; tiene dos átomos de carbono estereogénicos (C1 y C6 son asimétricos) y presenta isomería cis-trans: Me 8 2 Cl n = 2 ; N = 2n = 4 ; N' = 0 6 2-Cloro-8-metil espiro[5,5]undecano Existen 8 estereoisómeros (cuatro parejas de enantiómeros): cis-(2R,8R) / cis-(2S,8S) trans-(2R,8R) / trans-(2S,8S) cis-(2R,8S) / cis-(2S,8R) trans-(2R,8S) / trans-(2S,8R) H Me 8 7 5 Cl 4 3 6 9 1 10 cis 2 H (2R,8R)-r-2-Cloro-c-8-metil espiro[5,5]undecano 311 [1](CCH)C8 Cl[1] Cl[1] [2](CCC)C6 2 [2](CHH)C10 2 Me[3] C4(CHH)[3] [2](CHH)C10 H[4] H[2] H[4] (2R) cis (8R) r-2-Cloro-c-8-metil H Me 7 8 Cl 5 4 3 10 7 8 5 4 2 H 5 4 7 8 3 1 cis Me H 9 9 10 8 7 H 5 4 3 6 2 1 10 Cl Cl trans trans (2R,8R)-r-2-Cloro-t-8-metil (2S,8S)-r-2-Cloro-t-8-metil H Cl 5 4 7 8 3 6 2 1 H Me Me 9 8 H 5 4 3 6 9 10 7 2 1 10 H Cl trans trans (2R,8S)-r-2-Cloro-t-8-metil (2S,8R)-r-2-Cloro-t-8-metil RESPUESTA 20 El compuesto (1) tiene una pareja de enantiómeros: Cl 9 10 (2S,8R)-r-2-Cloro-c-8-metil Me H 6 2 1 H (2R,8S)-r-2-Cloro-c-8-metil 7 8 Me H 6 H cis 5 4 3 2 1 10 cis Cl 3 10 9 (2S,8S)-r-2-Cloro-c-8-metil Cl 6 9 1 H (2R,8R)-r-2-Cloro-c-8-metil Me H 2 Me 7 8 6 H cis 4 5 3 2 1 H Cl 6 9 H H H H Me H O O O 8 O H H Cl H Me C6(CCC)[1] 312 Z[3] 1 Cl O Z 4 H 2 3 3 [2](OOO)C2 O Cl[1] 4 [2](CZH)C3 C4(ClCH)[1] H[4] H (1) C5(CHH)[3] H[4] (3R) (4S) (1R,2S) 1 Cl O H 4 2 3 H [2](OOO)C2 Z Z Cl 5 Cl[1] 1 4 [3](CHH)C3 O 2 3 (4S) (3S) O 4 Z[3] 5 [2]O1 C5(CZH)[2] H[4] (3) H 5 H Z 2 3 (5R) Cl[1] 1 O O [3](CHH)C3 4 H[4] C5(CZH)[2] 5 [2](ClCH)C4 H[4] (4) C4(ClCH)[1] H[4] (4R) (4R,5R) C5(CHH)[3] H[4] Z[3] (1S,2S) Cl 4 4 [2](CZH)C3 C4(ClCH)[1] 3 (2) H H Cl[1] H[4] O O1[1] Z[3] (5S) (4R) (4R,5S) diastereoisómeros: (1) y (2) ; (3) y (4) Cl H3 H1 H H 4 H3 Diastereotópicos O O H1-H2 O O H3-H4 H2 H1 H2 (1) Cl Diastereotópicos H1-H2 H4H H3-H4 (1) El compuesto (2) también es quiral. 1 C3(CHH)[4] H [1]O 6 H[4] 3 5 4 O CH2Cl 4 C(ClHH)[2] C5(OCH)[3] (4R) [3](CHH)C6 5 O[1] C4(OCC)[2] (5R) 313 C3(CHH)[4] H 1 3 4 5 ClCH2 [2](OCC)C4 6 O H[4] O[1] 4 5 [1]O C5(OCH)[3] C6(CHH)[3] C4(OCC)[2] (4S) (5S) Análisis de los H del grupo CH2Cl: 1 H 5 6 4 O 4 O Cl Z Z H (1) (1') (4R,5R,4'S) (4R,5R,4'R) C4(OCC)[2] C4(OCC) 4' 3 5 6 4' Cl H H Z H 1 3 [3]Z C4(OCC)[2] Cl[1] [4]H C4(OCC) Cl[1] Z H Cl H[4] Z[3] (S) 4' Cl (R) diastereoisómeros: (1) y (1’) 1 6 H 3 5 H1-H2 4 O H2 (1) H 1 3 Diastereotópicos Diastereotópicos 4 4' Cl Cl H1 5 H1-H2 6 O 4' H1 H2 (2) El compuesto (3) es aquiral. H H1 Cl H3 H2 H4 H Cl H Z Cl H H Cl H H (1) H H H H Cl H Z Cl H H (2) 1800 H Cl Cl H Z H 1800 Cl H H Z H H H Cl (2) enantiotópicos: H1-H2 314 H Z Cl H H Cl H H H H H Z Cl Z H Cl 1800 H H (H1) Cl H H Cl H H (H1) (H3) H Z H H Cl H H Cl Cl H H Cl H H Cl H H Z H H H Cl 1800 Z H H H1 Cl H3 H2 H4 H Cl enantiotópicos: H1-H4 (H4) (H4) (H1) homotópicos: H1-H3 Enantiotópicos Homotópicos H1-H2 H1-H2 H3-H4 H3-H4 H1-H4 H1-H3 H2-H3 H2-H4 (3) El compuesto (4) es aquiral. Z[3] C2(ClClC)[1] [2](CHH)C4 1 O Cl 4 Z 2 H[4] H Cl (R) Z[3] Cl Z 4 1 2 H O H[4] Cl (S) pareja de enantiómeros Cl H1 Enantiotópicos O Cl C4(CHH)[2] [1](ClClC)C2 H1-H2 H2 (4) El compuesto (5) es quiral. Me 3 4 Me[3] 2 H 5 Me 1 Z N CH2C6H5 [2](CCH)C5 2 N[1] Z[4] (2R) H[4] [1]N 5 C4(CHH)[2] Me[3] (5R) 315 Me 3 4 Me[3] 2 Z 1 5 N CH2C6H5 [2](CCH)C5 H Me 2 Z[4] N[1] [1]N H[4] C4(CHH)[2] 5 Me[3] (2R) (5R) Los hidrógenos de C2 y C5 son homotópicos. Análisis de los H del grupo CH2C6H5 El núcleo de pirrolidina lo designamos por N-R: NR[1] 1' 1' C6H5[2] [4]H Z H Z[3] C6H5 (1'S) NR[1] NR NR [2]C6H5 Z H C6H5 H[4] Z[3] (1'R) pareja de enantiómeros Los dos derivados son ahora diastereoisómeros: (1’S,2R,5R) y (1’R,2R,5R) Me H2 Me C6H5 N H1 H3 H4 Homotópicos H1-H2 Diastereotópicos H3-H4 (5) En la cis-N-Bencil-2,5-dimetilpirrolidina, los hidrógenos H1 y H2 ; H3 y H4 son enantiotópicos. El compuesto (6) es aquiral y los dos grupos metilo son enantiotópicos: Ar[2] [3]Z OR OR[1] Me[4] Me [1]RO Me Z NO2 Ar[2] RO Z O2N Z[3] Me[4] (R) (S) OR Me1 Me2 NO2 (6) Enantiotópicos Me1-Me2 316 El compuesto (7) es aquiral y los dos hidrógenos del grupo bencilo son enantiotópicos: H H C H C H C C C6H5 C6H5 Z Z H C C H H H H H C H C Enantiotópicos C H1-H2 C6H5 H1 H2 (7) El compuesto (8) es quiral: R R 4' 1 4 R R 3 2 O[1] R H O 3' [3]Z H[4] Me[2] Z 3' (3'S) Me (3'S) R R R R R Diastereotópicos H1-H2 H2 H1 O (8) Me RESPUESTA 21 Molécula (1) La molécula es quiral. H[4] Z C C C H Me Me[3] Z[4] Z Me C C () Z[2] () [1]Me H Me [1]Me C Me H[2] Me[3] (R) (R) HB HA C C (1) () Me C Homotópicos HA-HB Me 317 Molécula (2) La molécula no es quiral. Z[3] [2]Me Z Et[1] Me C Et C Me C C Et H H[4] H[4] H C C [2]Me Z Z[3] pareja de enantiómeros (R) HA Me C Et C (S) Enantiotópicos C HA-HB HB (2) Et[1] Molécula (3) La molécula es quiral: Me[3] Me H H H H[4] H (3) (R) Z[3] [2](CCH)C3 2 C1(CCC)[1] H Me 1 Z HO2C 3 H[4] H[4] Me H 1 H HO2C H 2 2 H (2R) CO2H[1] [2]H HO2C 3 [2](CCH)C3 H Z[3] Z (R)-(2R) (2S) (R)-(2S) pareja de diastereoisómeros H Me 1 HA HO2C 2 3 H Diastereotópicos HA-HB HB (3) Molécula (4) La molécula es quiral: Me H[4] H H H [1]Me Me H 2 H[2] Me[3] (R) C1(CCC)[1] 318 Me H 1 Me Z H 2 3 1 H Me H H H 2 3 Me Z (R)-(2R) (R)-(2S) pareja de diastereoisómeros H[4] Z[3] 2 [3](CHH)C9 [3](CHH)C9 C1(CCC)[1] C1(CCC)[1] 2 Z[3] H[4] (2R) (2S) H Me Diastereotópicos HA H HA-HB Me HB (4) Molécula (5) La molécula es quiral: H[4] H H Me H H [2]H Me[1] NH2 NH2[3] (S) 3 4 H Me Z 1 H 2 NH2 3 H Me 4 H H 2 1 H Z (S)-(1S) (S)-(1R) NH2 pareja de diastereoisómeros H[4] Z[3] [1](NCH)C2 1 H[4] (1S) C4(CCC)[2] [1](NCH)C2 1 Z[3] (1R) C4(CCC)[2] 319 H Me H Diastereotópicos HA HA-HB NH2 HB (5) RESPUESTA 22 SULFITO DE ETILENO O O 3 S O O : Z 1 4 3 H O O Z 1 O O O S 1 O H (1R) H (OO) 3 (HHC)C(C)O C(OHH) Z (1R) 4 O (HHC)C(C)O S H (OO) (3R) (1S) H (HHO)C S (3R) (HHO)C : H 4 3 S S (3S) Z : Z (HHC)C(C)O : H C(OHH) : O : H 1 O(C)C(CZH) O(C)C(CZH) : S O (OO) 3 4 (HHC)C(C)O O S Z (OO) (3S) (1S) H1 O(C)C(CZH) : 3 Z O O H3 H2 H4 : Z O O S O diastereotópicos: H1_H2 ; H1_H4 ; H2_H3 ; H3_H4 O(C)C(CZH) 320 500 400 300 200 100 0 Hz H H1 H3 H2 H4 8.0 acoplamientos H1 : H2 : H3 : H4 O O S O H1 con H2 y H4 (dd) H2 con H1 y H3 (dd) Sulfito de etileno H3 con H4 y H2 (dd) diastereotópicos: H1_H2 ; H1_H4 ; H2_H3 ; H3_H4 H4 con H3 y H1 (dd) 7.0 6.0 5.0 4.0 3.0 2.0 [16 líneas] 1.0 0.0 321 RESPUESTA 23 CHO HO HOCH2 OH NH2 NH2 OH CH CH CH CH CHO H 4 H 2 NH2 H 3 H2N H 4 H OH 5 CHO HO H NH2 3 H2N (2S,3R,4R,5R)-3,4-Diamino-2,5,6-trihidroxihexanal H 2 OH H 5 HOH2C CH2OH CHO HO H OH HOCH2 CH OH NH2 NH2 OH CH CH CH CH CHO 4 NH2 5 HO HO HO H NH2 3 H (2S,3R,4S,5R,6S)-3,4-Diamino-2,5,6,7-tetrahidroxiheptanal H 2 H H2N H HO H H 6 CH2OH RESPUESTA 24 Me 1 2' Me Me 6 7 8 H 2 5 3 4 10 O 9 Me β−Vetivona (5S,10S) C1(CHH)C2(CCC)[2] [3](CCH)C10 5 H[4] [2](CHH)C9 C6(CCC)C7(CCH)[1] C4(CHH)C3(CHH)[4] 10 C(HHH)[3] (5S) (10S) Me 3 3' Me 5 H 3' 6 4 2 H 1 Me Me Elemol (1S,3R,4R) OH C5(CCC)[1] 3 Me Me 2 Me H 4 OH 1 H 5 6 CHO 2 NH2 H 3 4 5 6 H OH CH2OH 322 C3'(CCC)[2] C(OCC)[1] [2](CCH)C3 (CHH)C2 1 [1](CCC)C4 C6(CHH)C5(CHH)[3] H[4] (1S) (4R) Me OH Me 3 2 1 2 H 4 4 C3(CCH)[1] C(CCH)[2] (3R) 3 4 [3](CHH)C5 C2(CHH)[3] 3 H[4] C(HHH)[4] CH2CH2OH 1 H Me Grandisol (1S,2R) H[4] [1](CCC)C2 1 C(HHH)[4] C4(CHH)[3] [3](CHH)C4 (CHH)C3 C(CCC)[2] 2 C1(CCH)[1] C(CHH)C(OHH)[2] (1S) (2R) Me Me H1 OH 2 5 3 4 10 9 8 6 Me 7 Me H β−Acorenol (1R,4R,5S) C(OCC)[1] [3](CHH)C2 1 C5(CCC)[2] C3(CHH)[2] [3](HHH)C H[4] 4 H[4] C(OCC)[1] [3](CCH)C7 (CHH)C6 (4R) (5S) H Me H 4 3 10 5 2 1 OH Me Me C10(CHH)C9(CHH)[4] C4(CCH)[2] C5(CCC)[1] (1R) 5 9 Me 6 8 7 Agarospirol (2R,5R,10R) 323 C3(CHH)C4(CHH)[3] 2 [4]H C4(CHH)C3(CHH)[4] [1](CCC)C6 C(OCC)[1] [1](CCC)C5 C10(CCH)[2] 5 C1(CHH)C5(CCC)[2] H[4] C1(CHH)C2(CCH)[3] (2R) C(HHH)[3] (5R) Me (10R) 6 5 11 H 7 4 3 8 Me H 2 Me H 9 Me C9(CHH)[2] 10 1 10 Cedreno (2S,3S,7S,9R) C4(CHH)C5(CCH)[4] C3(CCC)[1] [3](HHH)C 2 [3](CCH)C7 (C7HH)C11 H[4] C1(CHH)[2] (3S) C3(CCC)C11(CHH)[2] C6(CCC)[2] 7 C2(CCH)C1(CHH)[2] C9(CCH)C8(CCC)[1] (2S) [4]H 3 [1](CCH)C7 (CCC)C8 C11(CHH)[3] C8(CCC)[1] 9 C10(CHH)[3] H[4] (7S) (9R) 3 2 4 Me Me Me 11 H Me 5 7 6 HH OH 1 8 10 9 Alcohol de Patchouli (1S,2R,5S,6S,8R) C2(OCC)[1] [2](CCH)C 1 6 C10(CHH)[3] C(HHH)[4] (1S) C4(CHH)[2] C3(CHH)[4] [3](CHH)C7 (CCH)C8 (CCC)C11 2 O[1] C1(CCC)C6(CCH)C5(CCH)[2] (2R) [4]H 5 C(HHH)[3] C6(CCH)[1] (5S) 324 C1(CCC)[1] [2](CCH)C5 6 H[4] [2](CCH)C6 (CHH)C7 C7(CHH)[3] C9(CHH)C10(CHH)[3] 8 C11(CCC)[1] H[4] (6S) (8R) Me HO O 7 1 6 2 3 Me 5 4 Me Me H OH Illudin-s C(OO)[1] 1 [4](HHH)C C4(CCC)[3] O[2] C2(CCC)[3] O[1] C6(CCC)[2] (1S) (5S) Me O 12 5 [4]H 11 H Me O 13 12 11 13 H 9 H 16 14 8 H 15 7 HO 10 9 HO 8 14 16 15 H 5 6 7 H 6 Estrona (8R,9S,13S,14S) C7(CHH)[3] 8 [2](CCC)C10 (CCH)C9 C14(CCH)C13(CCC)[1] C11(CHH)[3] [1](CCC)C10 H[4] (9S) C12(CHH)[3] 13 C(HHH)[4] C(OO)[1] (13S) C8(CCH)[2] H[4] (8R) [2](CCH)C14 9 C13(CCC)[1] [2](CCH)C8 14 H[4] (14S) C15(CHH)[3] 325 HO H 9 7 11 H 2 4 8 12 10 HO H 6 15 14 H 13 16 9 CO2H 3 5 18 17 H H 1 8 C13 H 10 Me 20 12 11 OH OH C7 19 HO H H Prostaglandina PGF 2α (8R,9S,11R,12S,15S) PG quiere decir prostaglandina; F denota el hidrógeno C9; α significa que el OH en C9 está hacia abajo; 2 indica que hay dos dobles enlaces H[4] [1](OCH)C9 H[4] C12(CCH)[2] 8 [3](CHH)C10 H[4] C8(CCH)[2] 9 C7(CHH)[3] [2](CCH)C12 O[1] (8R) O[1] (11R) (9S) C13(CCH)[3] 12 [1](OCH)C11 C10(CHH)[3] 11 C14(CCH)[2] C8(CCH)[2] [1](HO) H[4] 15 C16(CHH)[3] H[4] (12S) (15S) 5 O H 15 H 13 H 14 H 7 6 N 16 9 8 12 Me 10 OH 11 HO Morfina (5R,6S,9R,13S,14R) H[4] [2](OCH)C6 5 H[4] C13(CCC)[3] [3](CCH)C7 O[1] N[1] C5(OCH)[2] 6 O[1] (5R) 13 C14(CCH)[3] C12(CCC)[2] (13S) (9R) C8(CCH)[3] [2](CCC)C13 9 H[4] C10(CHH)[3] (6S) C15(CHH)[4] [1](OCH)C5 [2](CCH)C14 14 H[4] (14R) C9(NCH)[1] 326 Me 12 H 11 Me H 9 1 13 10 O 4 5 H 8 2 15 H 11 Me 16 14 2 COMe 17 4 O 7 1 10 9 6 5 H 6 H 8 7 Me COMe 13 12 17 14 15 H 16 H Progesterona (8S,9S,10R,13R,14R,17S) H[4] [3](CHH)C7 C11(CHH)[3] C14(CCH)C15(CHH)[2] 8 9 [1](CCC)C10 C9(CCH)C10(CCC)[1] C17(CCH)C16(CHH)[2] (10R) 14 [3](CCH)C8 (13R) H 4 5 C15(CHH)[2] N1 2 H[4] (14R) (17S) 10 H 11 9 H (1S,6R,7S,9R,11R,16R) C6(CCH)C7(CCH)[2] 13 12 14 C17(CHH)(N)[2] N[1] C9(CCH)C11(NCH)[1] [3](CHH)C5 [4] 6 C7(CCH)[2] [4]H H[4] (1S) 9 H[4] (9R) C11(NCH)[1] (7S) C15(CHH)C14(CHH)[3] H[4] [2](CCH)C9 11 N[1] (11R) C8(CHH)C9(CCH)[3] 7 C6(NCH)[1] (6R) C8(CHH)[3] [2](NHH)C10 15 N Esparteina 1 C16(CHH)[3] 17 16 N 17 [2](CCC)C13 H[4] 7 3 COMe[1] 8 H 6 C9(CCH)[2] C(HHH)[4] C13(CCC)[1] C(HHH)[4] [3](CHH)C3 10 [3](CHH)C1 (9S) C14(CCH)C8(CCH)[1] 13 C8(CCH)[2] H[4] (8S) [3](CHH)C12 C5(CCC)[1] C12(CHH)[3] [2](CCH)C7 (CHH)C17 N 16 [4] (16R) C11(CCH)[1] 327 2 9 10 3 H HO 13 H 11 Me 16 14 8 H 2 15 3 4 5 14 7 6 18 13 17 12 10 9 1 H 6 H Me 8 HO 7 5 4 H H 17 11 Me 1 H Me Me 12 16 15 H H H Colesterol (3S,8S,9S,10R,13R,14S,17R,18R) C1(CHH)[3] 3 [4]H O[1] H[4] [3](CHH)C7 C5(CCC)[2] 8 C14(CCH)C15(CHH)[2] [1](CCC)C10 C9(CCH)C10(CCC)[1] (3S) 10 9 C8(CCH)[2] H[4] (8S) C5(CCC)[1] [3](HHC)C1 C11(CHH)[3] (9S) C13(CCC)[1] C14(CCH)C8(CCH)[1] C9(CCH)[2] [3](CHH)C12 C(HHH)[4] 13 14 [2](CCH)C8 C17(CCH)C16(CHH)[2] H[4] C(HHH)[4] (10R) (13R) (14S) C18(CCH)[2] [1](CCC)C13 C16(CHH)[3] 17 H[4] [1](CCH)C17 C(CHH)[2] 18 C(HHH)[3] H[4] (17R) (18R) REACCIONES DE ADICIÓN ELECTRÓFILA RESPUESTA 25 H 1 OH 3 CH2OH OH 3-Hidroximetil1,3-ciclohexanodiol H 3 CH2 1 OH (1R)-3-Metilenciclohexanol C15(CHH)[3] 328 Apartado 1 O O Os O O H OH H3O+ CH2 H 3 CH2OH 1 3 H 1 CH2 OH OsO4 OH (1R,3S) 2 OH H O (1R)-3-Metilenciclohexanol OH H3O+ CH2 O 3 OH 1 Os OH O O CH2OH H (1R,3R) Se obtiene una mezcla de (1R,3R) y (1R,3S)-3-hidroximetil-1,3-ciclohexanodiol. Apartado 2 1 H H 3 H 1 CH2 H OH OH OH H2O CH2 2)H3O+ 2 (1R,3R) 2 1 3 OH 1 O+ 1)RCO3H CH2OH OH H 2 (1R)-3-Metilenciclohexanol 3 CH2OH 1 OH (1R,3S) Se obtienen los mismos estereoisómeros que en la reacción con OsO4. RESPUESTA 26 H 1 OH 3 3 H CH2Cl CH2 1 OH OH 3-Clorometil-1,3ciclohexanodiol (1R)-3-Metilenciclohexanol + Cl 1 H CH2 HO _ H OH (1R,3S) OH H 1 CH2 ClOH carbocatión terciario incipiente 2 OH H CH2 2 (1R)-3-Metilenciclohexanol OH Cl + 3 OH 1 3 CH2Cl HO _ OH H 3 CH2Cl 1 OH (1R,3R) 329 La reacción también puede transcurrir a través del carbocatión primario incipiente, pero los productos sólo aparecerán en cantidades muy pequeñas: + Cl 1 H HO CH2 _ Cl H 3 CH2OH 1 OH OH 3 H 1 CH2 ClOH (1R,3S) carbocatión primario incipiente 2 OH H (1R)-3-Metilenciclohexanol HO CH2 2 _ 3 Cl 1 Cl + OH CH2OH H OH (1R,3R) carbocatión primario incipiente Ahora el compuesto obtenido es diferente. Se trata de una mezcla de estereoisómeros del 3-cloro-3hidroximetilciclohexanol. RESPUESTA 27 A(C5H10) es un alqueno. Su reacción con OsO4 da lugar a un diol en el que los grupos OH están en posición syn: OH OH CH3 CH CH CH2 CH3 2,3-Pentanodiol H Me Et H 2 3 OH HO OH Me H H Et OH H Me H Et HO OH H HO HO H Me Et H (2S,3R) H Et A Me 3 (2) (1) (2R,3S) 2 (Z)-2-Penteno O O Os H Me H H Et Me A Enantiómeros: (1) y (2) O O H H 3O + Et H Me Et O O Os O O (1) H Me OsO4 H OH HO H3O+ Me H Et H H Et (2) HO OH 330 La reacción de A con ácido peroxifórmico conduce a una adición neta anti de los dos grupos OH: Me H OH 1 (3) H + O H H 1)HCO3H Me Et 2)H3O+ Et HO H Et 1 H H2O H H Me HO 2 Et (4) 2 HO OH H H 2 H Me Me Me 2 OH + Et 3 OH HO 3 H H (2S,3S) (2R,3R) Et (racémico del 2,3-Pentanodiol) La reacción de A con HOCl transcurre a través de cationes cloronio: Me H Cl 1 + Cl HO _ H H Me (5) HO Et 1 Et H Cl 2 H Et (6) 2 H H Et Me Cl HO H Et 1 2 1 H H Me (7) H Me _ HO Et X + Enantiómeros: (5) y (7) ; (6) y (8) OH + A Compuestos: (5) = (7) ; (6) = (8) H Me Me H Cl OH (8) 2 Cl H Et 331 H H 2 HO Me Me 2 OH (racémico del 3-Cloro-2-pentanol) + Et Cl 3 Cl Et 3 H H (5)(2S,3S) (7)(2R,3R) H H 2 Me Cl Cl 2 Me (racémico del 2-Cloro-3-pentanol) + HO 3 Et Et OH 3 H H (6)(2R,3R) (8)(2S,3S) RESPUESTA 28 Apartado 1 La reacción del estereoisómero A con ácido peroxibenzoico da lugar a una adición neta anti de los dos grupos HO al doble enlace: OH OH CH3 CH CH CH3 H 2 Me HO 3 H Me OH CH3 CH CH CH3 OH 2 2 3 Me H H HO Me 3 OH H H Me Me (Z) (2R,3R) (2R,3R) 2 3 H Me H Me HO H Me HO H Me HO Me Me H 2 OH 2 3 3 OH H Me H HO OH Me H H H Me Me (Z) (2S,3S) (2S,3S) El compuesto A es el estereoisómero (Z) del 2-buteno. Por consiguiente, el estereoisómero (E) debe ser el compuesto B: O O Os H Me H Me H Me B(E) O O Me H3O+ H (2R,3R) H Me OsO4 H Me Me H O O Os O O OH HO H3O + Me H H Me Me H (2S,3S) HO OH 332 Apartado 2 La reacción del estereoisómero A(Z) con HCl transcurre a través de carbocationes: H Cl H3O + (electrófilo) H2O + + Cl _ (nucleófilo) carbono asimétrico CH3 CH CH CH3 H+ + CH2 CH CH3 CH3 Cl _ * CH2 CH CH3 CH3 Cl 3 1 1 1 H H Me Me H + H + H Me 2 Cl H 2 (1) Me H Me H Me _ Cl Cl H 2 H C3 (2S) Me H H 2 3 2 2 H Me C3 Me (2) Me Cl 2 H Cl (2R) RESPUESTA 29 Reacción 1 OH Me CH CH Pr + Me CH * OsO4 OH CH Pr * 2,3-Hexanodiol Estereoisómeros: una pareja de enantiómeros. O O Os H Me H Pr H Me O O Pr H3O+ H OH HO (1)(2R,3R) H Me H Pr OsO4 B(E) H Pr Me H O O Os O O H3O+ Me H Pr H (2)(2S,3S) HO OH 333 Reacción 2 Br H2C CH C6H5 + CH3 CH C6H5 * 1-Bromo-1-feniletano HBr Estereoisómeros: una pareja de enantiómeros: Br 1 1 H H H + H+ C6H5 H + Me Br _ Me 2 (3) (2R) C6H5 2 H C6H5 H 2 Me C6H5 2 Br (4) (2S) Reacción 3 Me Me * H + HCl * Me Me Cl 1,2-Dimetilclorociclohexano Estereoisómeros: dos parejas de enantiómeros cis/trans. 1 H 2 1 H Me 1 + Cl Me _ (5) trans-(1R,2R) H 2 2 Me 1 Me Me 2 Me H+ 1 Cl Me 1 Cl (6) cis-(1S,2R) Me 2 1 Me 2 2 Me H 1 + 2 Cl H _ Cl 1 Me (7) cis-(1R,2S) Me 2 Me 2 H Me 1 Cl (8) trans-(1S,2S) 334 Reacción 4 Me Me + HCO3H Me H3O+ O H Me + O H H H2O * * H OH OH H 1-Metil-1,2-ciclopentanodiol Estereoisómeros: una pareja de enantiómeros trans Me OH 1 (9) (1S,2S) O+ Me H 2 1 H Me H OH H OH H H2O 1)HCO3H + 2)H3O 2 1 2 1 (10) (1R,2R) 2 Me OH RESPUESTA 30 Apartado 1 La reacción de una olefina con un peroxiácido da lugar a una adición neta anti de dos grupos hidroxilo a los átomos de carbono del doble enlace. En el estereoisómero inicial existe un grupo metilo unido a uno de los carbonos del doble enlace; por consiguiente, después de realizar la reacción de hidroxilación, uno de los grupos OH introducidos debe estar también unido a dicho carbono. El otro grupo OH lo estará al carbono contiguo, y ambos se encontrarán en posición trans (adición anti) El átomo de carbono al que está unido el OH en el estereoisómero de partida, no cambia de configuración durante la reacción de hidroxilación; es decir, su configuración será la misma en la pareja de estereoisómeros finales (3S) y, en este caso, coincide con la de A, ya que las prioridades relativas de los grupos son las mismas. En los dibujos se han representado con negrita los dos grupos OH introducidos en la reacción de hidroxilación: H Me 1 OH OH 2 3 H OH (3S) OH 1 H Me (1R,2R,3S) H 2 OH (1S,2S,3S) El estereoisómero (A) es el (3S)-1-metil-3-hidroxiciclohexeno: H 3 Me 1 2 (A) (3S) OH 3 OH (3S) 335 Reacción de hidroxilación: OH C6H5CO3H O Me OH H OH OH H3O+ + O H H2O OH Me Me Me H 1 H 1)C6H5CO3H 2)H3O+ OH Me OH 1 H 2 OH H 1 2 OH OH Me H2O 3 (1S,2S,3S) OH Me H O+ (A) (3S) H Me 2 1 OH OH 3 2 OH H (1R,2R,3S) Apartado 2 El enantiómero de (A) es el (3R)-1-metil-3-hidroxiciclohexeno: OH 3 Me 1 2 H (3R) La reacción con HBr acuoso transcurre a través de carbocationes: _ H+( electrófilo) + Br (nucleófilo más abundante) HBr _ H+( electrófilo) + HO (nucleófilo menos abundante) H2 O El primer paso de la reacción es la unión del electrófilo (H+) al átomo de carbono menos sustituido del doble enlace (regla de Markownikoff) Se obtiene el carbocatión más estable (el más sustituido) En el segundo paso el carbocatión reacciona con los dos nucleófilos presentes en la disolución (Br− y HO−): OH Br Me Br OH H OH H _ H+ Me H + Me OH (carbocatión más estable) HO _ OH Me 336 OH 3 Me OH + H+ H H 1 H + Me H H C2 (carbono menos sustituido) (carbocatión más estable) OH 1 Br Br 3 H 1 _ Me (1S,3R) OH Me 2 1 + Me 3 H 1 OH Br (1R,3R) H H H OH 1 2 Cl OH 3 H 1 _ Me (1S,3R) OH Me 2 3 H 1 OH (1R,3R) RESPUESTA 31 Reacción 1 OH OH Me CH CH Bu Me CH CH Bu + OsO4 * * 2,3-heptanodiol Estereoisómeros: una pareja de enantiómeros. O O Os H Me H Bu H Me O O Bu H3O+ H HO OH (1) H Me OsO4 Bu H (2R,3R) (E) H Bu Me H O O Os O H3O + Me H (2) OH HO (2S,3S) O Bu H 337 Reacción 2 Br CH3 CH CH C6H5 + CH2 CH C6H5 * 1-Bromo-1-fenilpropano HBr CH3 Estereoisómeros: una pareja de enantiómeros (es indiferente partir del estereoisómero Z o del E) Br 1 Et 1 H H + H+ C6H5 CH3 H + Et Br _ 3 (3R) H C6H5 (3) C6H5 2 H 2 Et C6H5 3 (4) Br (3S) Reacción 3 Et Et H * * + HCl Et Cl Et 1,2-Dietil-1-clorociclohexano Estereoisómeros: dos parejas de enantiómeros cis/trans. 1 1 H Et 1 + Cl _ Et Cl Et Et (5) trans-(1R,2R) Et 2 2 H+ 1 H H Et Et Cl (6) cis-(1S,2R) Et 2 1 2 Et H 1 + 2 Cl _ Et Et H Cl (7) cis-(1R,2S) Et 2 Et Et H Cl trans-(1S,2S) (8) 338 Reacción 4 Et Et Et Et + + O HCO3H H + O H H3O H2O * * H H H OH OH 1-Etil-1,2-ciclopentanodiol Estereoisómeros: una pareja de enantiómeros trans. Et OH 1 (9) O+ Et Et H 2 1 H OH H H2O 1)HCO3H H (1S,2S) + 2)H3O OH 2 1 H 2 1 (10) 2 Et OH (1R,2R) RESPUESTA 32 Apartado 1 C6H5 CH3 CH CH CH2 1)RCO3H 2)H3O+ C6H5 CH3 CH CH CH2 C6H5 H2O CH3 CH CH CH2OH OH O+ (3R) H La reacción de la olefina con el peroxiácido, seguida de hidrólisis ácida, no afecta a la geometría de C3. Sin embargo, su configuración absoluta si cambia, ya que varían las prioridades relativas de los grupos unidos a él: H[4] [2]C6H5 3 CH3[3] CHOHCH2OH[1] (3R) 3 H H[4] Me Me 3 CHOHCH2OH H C6H5 CH CH2 C6H5 (3R) Me 3 H CH CH2 C6H5 (3S)-3-Fenil-1-buteno 3 CH3[3] CH=CH2[2] (3S) Por consiguiente, el 3-Fenil-1-buteno tendrá configuración (3S): [1]C6H5 (3S) 339 Reacciones C6H5 Designamos por R el radical CH3 : CH La reacción transcurre con regioselectividad Markovnikov (se forma el carbocatión incipiente más estable: el secundario): H R O+ H H H R H 1)RCO3H H H 2)H3O+ H H 2O R HO OH (1) H H HO H H H 2O H R H H R O+ H OH (2) H H R H CH2OH HO (1) OH HO H HO Me 2 R HOCH2 HOCH2 H 2 HOCH2 3 3 H C6H5 H Me C6H5 (3R) (2R,3R) OH HO HOCH2 CH2OH R H 2 R HO (2) Me HOCH2 HO H H 3 H H 2 3 H C6H5 CH2OH Me C6H5 (3R) (2S,3R) Apartado 2 La reacción de las olefinas con haluros de hidrógeno transcurre a través de carbocationes con regioselectividad Markovnikov: C 6H 5 CH3 CH CH CH2 * 3-Fenil-1-buteno H+ C 6H 5 CH3 + CH CH CH3 Br _ C6H5 Br CH3 CH * carbocatión secundario no estabilizado CH CH3 * 2-Bromo-3-fenilbutano [transposición] C6H5 CH3 + CH CH CH3 carbocatión secundario estabilizado por C6H5 Br _ Br CH3 C6H5 CH CH CH3 * 1-Bromo-1-fenil-2-metilbutano 340 Carbocatión secundario estabilizado por deslocalización de la carga: CH3 + C6H5 CH CH CH3 * + CH3 * + CH CH CH3 * * * CH3 CH * * * ... CH CH3 sistema conjugado de siete carbonos Estereoquímica: H Br Me 1 3 H C6H5 CH CH2 H + Me + H C6H5 H Br C6H5 2 3 Me H Me H C6H5 1 Me 3 2 CH3 H 2 H Me (3S) 3 2 2 H C6H5 Me C6H5 3 Br Br 2 Me C6H5 2 CHMe2 H C6H5 + Br [2]C6H5 1 Br[1] CHMe2[3] (1S) _ H CH3 Me H[4] Br 1 1 Me H (2R,3R) transposición de CH3 H Br H (2S,3R) _ Me (1S) H[4] C6H5 H CHMe2 2 [1]Br Br 1 C6H5[2] CHMe2[3] (1R) (1R) RESPUESTA 33 Apartado 1 C6H5 CH3 CH CH CH CH3 1)OsO4 2)KOH, H2O C6H5 CH3 OH CH CH CH CH3 OH (4S) La reacción de la olefina con el tetraóxido de osmio, seguida de hidrólisis básica, no afecta a la geometría de C4. Sin embargo, su configuración absoluta si cambia, ya que varían las prioridades relativas de los grupos unidos a él: 341 C6H5[2] [4]H 4 4 CH3[3] H CHOHCHOHCH3[1] 4 CHOHCH2OH CH CH CH3 H CH3 (4S) C6H5[1] C6H5 C6H5 4 [4]H CH3 (4S) CH3[3] CH=CHCH3[2] (4R) (4R)-4-Fenil-2-penteno Por consiguiente, el 4-fenil-2-penteno tendrá configuración (4R): C6H5 4 CH CH CH3 H CH3 (4R)-4-Fenil-2-penteno Reacciones C6H5 Designamos por R el radical CH3 CH La reacción de la olefina con OsO4 da lugar a la adición sin de dos grupos OH al doble enlace: H 3 R CH3 2 OH HO OH 3 H CH3 H OH H 2 R H R CH CH CH3 1)OsO4 R H CH3 (Z)-(4R)-4-Fenil-2-penteno (2S,3R) 2)KOH, H2O H HO 3 R R H CH3 H 3 HO 2 CH3 HO H (2R,3S) La configuración absoluta del 4-fenil-2-penteno será (Z)-(4R): H H CH3 CH3 H C6H5 (Z)-(4R)-4-Fenil-2-penteno H R 2 OH H CH3 (Z)-(4R)-4-Fenil-2-penteno 342 Apartado 2 La reacción con bromo transcurre a través de un catión bromonio: C6H5 CH3 Br2 CH CH CH CH3 + Br C6H5 CH3 CH CH Br CH CH3 C6H5 _ CH3 Br CH CH CH CH3 Br (4R) 2,3-Dibromo-4-fenilpentano Estereoquímica C6H5 Designamos por R el radical CH3 CH H R H Br 3 Br2 H H H H CH3 R Br + Br Br _ (1) 2 Br 2 H CH3 R 3 H (2S,3S) H 2 1 H Br 3 2 CH3 Br Br R 2 CH3 H (2) 3 H (2R,3R) Configuración absoluta de los productos obtenidos: R Br 3 3 H CH3 Br (1) Br R 2 H Br 2 Br 2 3 H CH3 4 C6H5[2] Br 3 2 H CH3 Br H CH3 Br Br H H CH3 R Br Br H 4 CH3[3] CHBr[1] (4S) CH3 H H CH3 3 CHBr[1] [3]CH3 2 4 Br C6H5 (2) (2R,3R) [4]H (2S,3S,4S) H R C6H5 H CH3 (2S,3S) H Br CH3 R (Z)-(4R)-4-Fenil-2-penteno H CH3 (2R,3R,4S) 4 H[4] C6H5[2] (4S) Br R 343 REACCIONES DE SUSTITUCIÓN NUCLEÓFILA RESPUESTA 34 La reacción en medio ácido de un oxirano sustituido asimétricamente, tiene lugar en el átomo de carbono más sustituido. Si el ácido empleado carece de un anión nucleófilo (p.e. H2SO4; anión: SO4H−) es una molécula de agua la que reacciona con el oxirano protonado: OH2 H H Me H O H3O+ H H2SO4 H H + OH2 H H Me +O OH H2O HOCH2 H Me HO H (2R)-1,2-Epoxipropano H Me (2S)-1,2-Propanodiol La reacción de un oxirano con un nucleófilo, en ausencia de ácidos, tiene lugar en el átomo de carbono menos sustituido (menor impedimento estéreo): HO _ NaOH H Me H H Me HO H H2O O H O H H Me H2O HOCH2 _ OH (2R)-1,2-Propanodiol (2R)-1,2-Epoxipropano RESPUESTA 35 H Me NC 1 2 2 3 H Me NC H Me H Me _ O H Me NC H2O 3 _ 2 H Me OH (2R,3R)-3-Ciano-2-butanol O Me (2S,3R)-1,2-Epoxipropano _ H CN Me H2O CN 3 H Me O H 2 H Me HO (2S,3S)-3-Ciano-2-butanol RESPUESTA 36 C6H5 MgBr H H 2 H Me SN2 C6H5 H H O H 2 H Me H3O + C6H5CH2 O HBr SN2 2 OH MgBr A Me B (2R)-1,2-Epoxipropano (2R)-3-Fenil-2-propanol Br C6H5CH2 C Me 2 H Me (2S)-3-Fenil-2-bromopropano C SN2 C H _ C6H5CH2 Me 4 C C CH3 (4R)-5-Fenil-4-metil-2-pentino 344 REACCIONES DE ELIMINACIÓN Y DE ADICIÓN NUCLEÓFILA RESPUESTA 37 Secuencia 1 Haluro de alquilo primario que puede dar lugar a un carbocatión estabilizado. Reacción de sustitución SN1: SN 1 H Me C6H5 CH2Br Me H C6H5 CH2 + _ HO H Me C6H5 CH2OH [C] (Z)-3-Fenil-2-buten-1-ol HO 1 1 Me Me H C6H5 CH2 + + C6H5 _ HO CH2 CH Me C6H5 CH CH2 [A] (S)-2-Fenil-3-buten-2-ol CH CH2 [B] (R)-2-Fenil-3-buten-2-ol Me C6H5 2 2 HO Secuencia 2 Haluro de alquilo secundario, base fuerte y temperatura moderadamente alta. Reacción de eliminación E2: H Et H Et EtO _ H H Et 3 Et Me Me Cl E2 4 Cl Et H Me Et [C] (E)-4-Metil-3-hexeno (3R,4R) Me Me 1 H H Et HC EtO _ 3 2 Me CH Et H H1 2 E2 Me Et 4 Me H Cl H Me 2 Cl H (3R,4R) H H [B] (Z)-(4R)-4-Metil-2-hexeno Me Me 2 H H Et HC 1 Me H Cl EtO _ H2 3 1 H Me CH Et H H E2 Me Et H1 4 (3R,4R) Cl Me H [A] (E)-(4R)-4-Metil-2-hexeno 345 Secuencia 3 Haluro de alquilo primario con dos sustituyentes en C-β y disolvente polar. Reacciones simultáneas E1 y SN1: Me CH3CH2CH2 Me H2O C CH2I Pr 0 50 C Me C + CH2 transposición Pr Me + C CH2CH3 Me Reacción de eliminación E1: H Pr + Pr Me H H Me H H [C] 2-Etil-1-penteno H1 Pr + Me H2 Me Pr H2 Me Me [A] (E)-3-Metil-2-hexeno H2 Pr + Me H1 Me Pr Me Me H1 [B] (Z)-3-Metil-2-hexeno Reacción de sustitución nucleófila SN1: HO 3 1 Pr Me 1 Pr + Me Et [D] (3R)-3-Metil-3-hexanol Et [E] (3S)-3-Metil-3-hexanol H2O Pr Me 2 2 RESPUESTA 38 Et 3 HO La reacción de A con HO−(dil.) (SN2) da lugar a 1,2-butanodiol. Este resultado indica que los halógenos están situados en los carbonos 1 y 2. Por otra parte, la hidrogenación de (B + C) origina 1-bromobutano; es decir, el átomo de bromo está en el carbono 1. 346 El compuesto A sólo puede ser el 1-bromo-2-yodobutano: E2 H2 BrCH2CH2CH2CH3 BrCH2-CH=CH-CH3 [(Z)-B + (E)-B] [Pd] BrCH=CH-CH2CH3 + I H2C C CH2CH3 G(C4H7I) I BrCH2-CH-CH2CH3 * A(C4H8BrI) [(Z)-D + (E)-D] 1-Bromobutano OH HO-(dil.) HOCH2-CH-CH2CH3 (2R)-1,2-Butanodiol * SN2 La reacción de A con HO− (dil.) (SN2) provoca la inversión de la configuración del carbono 2. En consecuencia, la configuración de dicho carbono en el compuesto A debe ser (S): _ HO Et H HO BrCH2 OH _ HOCH2 SN2 I (2S)-1-Bromo-2-yodobutano + I Et H _ (2R)-1,2-Butanodiol Estereoquímica de las reacciones de eliminación E2: BrCH2 H H1 E2 Me I A(2S) BrCH2 H -IH1 H 2 H2 H Me -IH2 H Me B(E) CH2Br Me (min.) I H1 BrCH2 H1 H B(Z) E2 A(2S) H2 H H2 1 I Me BrCH2 H H2 CH2Br H1 Me I (may.) 347 Et H1 Br 2 H E2 -IH1 I Br Et 2 H H H1 Et H2 Br Et H Br H -IH2 I H Et Et Br H 1 1 H2 H H1 H Br I Et E2 1 -BrH 2 (may.) I 2 Et H H Br D(E) H (min.) D(Z) E2 2 H I A(2S) H2 1 H I H H H I H1 (min.) Et Br G Abundancia relativa: D(E) > B(E) > G = D(Z) ≅ B(Z) RESPUESTA 39 Comenzamos averiguando la estructura de G, realizando su síntesis: Me Me Et CH CH2 I + H2C(CO2Et)2 CO2Et Et CH CH2 CH CO2Et HO _ CO2 Me _ _ CH CO2 Et CH CH2 (H) H3O+ CO2H Me Et CH CH2 CH CO2H -CO2 Q Me Et CH CH2 CH2 CO2H (G) Los pasos D R I F + G y E MeCOCH2CO2Et F EtO G son síntesis acetilacéticas: _ MeCOCH R CO2Et (D) _ 1)HO (conc.) 2)H3O+ Me R CH2CO2H Et CH CH2CO2H (G) (F) R' Cl + (E) MeCOCH2CO2Et EtO _ MeCOCH R' CO2Et (F) _ 1)HO (conc.) 2)H3O+ Me R' CH2CO2H Et CH CH2CO2H (G) 348 Me Los derivados halogenados D y E son: R = R' = CH3CH2CH CH2 Me Me CH3CH2CHCH2I CH3CH2CHCH2Cl (D) (E) En la reacción de eliminación con EtO−, el racémico A da lugar a dos únicos productos. Esto significa que el mecanismo no transcurre a través de carbocationes, porque de ser así se obtendrían cuatro estereoisómeros (dos B + C es una eliminación bimolecular (E2) Z y dos E) En consecuencia, el paso A Por otra parte, en el compuesto A los halógenos deben estar unidos al mismo átomo de carbono, ya que es la única posibilidad de obtener sólo dos productos. Esta exigencia queda confirmada por el hecho de que R = R’. Me Cl CH3CH2CH CH I Me E2 Me CH3CH2 C CH I + CH3CH2 C CH (C) (B) (A) H I Me Et Cl Cl H (Z)-B Me Et (E)-C El racémico A es [(1R,2S) + (1S,2R)]: EtO _ H H I 1 E2 2 Me Cl Et Me H Et I E2 H I 2 Cl (Z)-B EtO Cl H H 2 Et A(1R,2S) Et Me A(1S,2R) 1 Me _ EtO 1 A(1R,2S) _ H I E2 Me Cl Et H (E)-C E2 Cl H H _ 1 2 I EtO Et Me A(1S,2R) Si el racémico A fuese [(1R,2R) + (1S,2S)] se obtendría una mezcla de (E)-B y (Z)-C. RESPUESTA 40 Apartado 1 Puesto que se obtiene un solo producto, la reacción del (1S,2S)-1-fenil-1,2-propanodiol con HBr es una reacción SN2, que transcurre con inversión de la configuración: 349 C6H5 H HO Me 2 HBr SN 2 1 OH H Me H Br 2 1 Br H (1) C6H5 (1R,2R) (1S,2S) La reacción de eliminación E2 de (1) da lugar a los siguientes productos: Br CH3 Br Br Br E2 CH CH C6H5 CH3 CH (1) CH3 C C6H5 + C Br CH C6H5 CH2 + CH CH C6H5 (3) (2) (4) Estereoquímica: Br Br 1 H 2 Me C6H5 Br Br Me H H 2 1 :B H :B Br 1 CH H :B H 2 H H C6H5 Br (1) (1) (1) (1R,2R) (1R,2R) (1R,2R) C6H5 Br Me Me H H H C6H5 H Me Br H C6H5 H H CHC6H5 H Br E2 E2 Br (2) (Z) Br H Br Br C6H5 E2 C6H5 C6H5 Me H Br CH2 CH (4) (3S) (3) (Z) 3 C6H5 H Abundancia relativa: (4) (Hofmann) > (2) (Saytzev) = (3) (Saytzev) Apartado 2 Reacciones del compuesto (2): Br CH3 CH C C6H5 (2) H2 [Pd] Br CH3 CH2 CH C6H5 * (5) + (6) _ HO E1 CH3 CH CH C6H5 (7) + (8) 350 Estereoquímica: H MeCH2 C6H5 H Me (2) (Z) H2 Br HO 1 C6H5 Br (5) (1R) H _ + E1 H Me H C6H5 H H C6H5 Me C6H5 H (7) (Z) [Pd] C6H5 Br MeCH2 1 HO H _ + E1 H H Me (6) (1S) C6H5 H Me H (8) (E) Reacciones del compuesto (3): Br CH3 C CH C6H5 Br H2 CH3 [Pd] CH CH2 * NH3 C6H5 SN2 NH2 CH3 (9) + (10) (3) CH CH2 * C6H5 (11) + (12) Estereoquímica: H 2 Br C6H5 Me (3) (Z) H H2 [Pd] Br Me Br CH2C6H5 Me (9) (2S) H NH3 SN2 Br CH2C6H5 H Me (10) (2R) CH2C6H5 2 H2N H Br Me 2 CH2C6H5 Me H Me NH3 SN2 CH2 CH CH C6H5 _ HO SN1 CH2 + CH CH C6H5 + CH2 H2N CH CH C6H5 _ _ HO HO CH2 * CH CH C6H5 HO CH2 CH CH C6H5 OH (13) + (14) (15) + (16) (11) (2R) H Reacciones del compuesto (4): Br CH2C6H5 2 CH2C6H5 (12) (2S) 351 Estereoquímica: OH 1 CH2 CH 1 Br HO- 3 CH2 CH C6H5 H SN1 C6H5 H + CH2 CH HO 3 _ C6H5 H C6H5 H 2 (4) (3S) (14) (3R) CH2 CH 2 (13) (3S) OH C6H5 H + H CH CH2 = C6H5 + + CH2 H CH2 C6H5 H _ HO H H C6H5 CH2OH H (15) (E) H CH2 H + CH2 C6H5 H C6H5 _ HO H CH2OH H C6H5 + H (16) (Z) RESPUESTA 41 C6H5 CH3 1)MeMgI CH CHO * 2)H3O+ C6H5 OH CH3 CH * CH CH3 * H H C6H5 CHO Me C6H5 CHO Me (2S) (2S) Regla de Cram Conformación más favorecida en relación con el grupo carbonilo: O Me H O H C6H5 (2S) Me H C6H5(H) el carbonilo está situado entre los grupos pequeño (H) y mediano (Me) 352 OMgX H Me 1 H H H3O Me C6H5 O Me OH H Me + H (I) (mayoritario) Me C6H5 IMgMe 1 2 C6H5(H) 2 Me OMgX H Me H C6H5 H Me OH C6H5 H H Me 3 H Me C6H5 OH Me OH Me Me C6H5 H H C6H5 (II) (minoritario) C6H5 H Me OH 2 H Me Me Me OH 3 H Me 2 H Estereoisómero mayoritario: (2S,3S)-3-fenil-2-butanol (I) 3 OH H (2S,3S) (mayoritario) H Me Me (II) 2 C6H5 (I) H Me H3O+ 2 3 OH H C6H5 (2R,3S) (minoritario) APÉNDICE I VOCABULARIO DE TÉRMINOS EMPLEADOS EN ESTEREOQUÍMICA Aquiral (molécula). La molécula que es idéntica a su imagen especular. Átomo de carbono asimétrico. El átomo que está unido a cuatro sustituyentes distintos. cis (Z). Del mismo lado de un anillo o doble enlace. Configuración. Es el término utilizado para describir la disposición absoluta de los átomos de una molécula, con independencia de las disposiciones relativas que puedan adoptar como consecuencia de la rotación alrededor de enlaces sencillos. Conformación. Es el término utilizado para describir la disposición relativa de los átomos en una molécula. Las conformaciones de una molécula son las distintas disposiciones que pueden adoptar sus átomos en el espacio, como consecuencia de la rotación alrededor de enlaces sencillos. Dextrorotatorio. Que gira el plano de polarización de la luz en el mismo sentido de las manecillas del reloj. Diastereoisómeros. Los estereoisómeros que no son imágenes especulares entre sí. Los diastereoisómeros pueden ser quirales y aquirales. Los diastereoisómeros tienen propiedades químicas distintas. Enantiómeros. Los estereoisómeros que son imágenes especulares entre sí. Dos enantiómeros tienen las mismas propiedades químicas. Estereogénico (átomo) Cualquier átomo que de lugar a estereoisomería. Estereogénico (eje) Eje común a dos planos perpendiculares en los que están situados cuatro sustituyentes (dos en cada plano) Por ejemplo, los alenos del tipo abC=C=Cab Estereoisómeros. Son los isómeros que sólo se diferencian en la disposición de los átomos en el espacio. Isómeros. Se denominan isómeros los compuestos que tienen la misma fórmula molecular, pero se diferencian en el tipo o en la ordenación de los enlaces entre sus átomos, o en la disposición de sus átomos en el espacio. Isómeros cis-trans / (Z)-(E). Son los estereoisómeros que sólo se diferencian en las posiciones de los átomos respecto a un plano determinado de referencia (en el supuesto de que dichos átomos formen parte de una estructura rígida: ciclos o dobles enlaces. Isómeros constitucionales. Son los isómeros que se diferencian en el tipo de ordenación de los enlaces entre los átomos. Levorrotatorio. Que gira el plano de polarización de la luz en el sentido contrario a las manecillas del reloj. Meso. Estereodescriptor para un estereoisómero aquiral con átomos asimétricos. No estereogénico. Un átomo de carbono se denomina no estereogénico cuando al intercambiar dos de sus sustituyentes se obtiene la misma configuración. Su geometría es irrelevante y no se le asigna ningún descriptor. Ópticamente activo. Capaz de girar el plano de polarización de la luz. Pseudoasimétrico. Un átomo de denomina pseudoasimétrico cuando está unido tetraédricamente a un par de grupos constitucionalmente idénticos y de configuraciones opuestas y, además, a dos átomos o grupos aquirales que sean diferentes uno de otro (ver página 48) Quiral (molécula). La molécula que no es idéntica a su imagen especular y, por consiguiente, es ópticamente activa. Racémico. Es la mezcla equimolecular de dos enantiómeros: [50% (R,R) + 50% (S,S)] ; [50% (R,S) + (50%) (S,R)] trans (E). En lados opuestos de un anillo o doble enlace. A-IV 354 RELACIÓN DE ISOMERÍA ENTRE DOS MOLÉCULAS ¿TIENEN LA MISMA FÓRMULA MOLECULAR? NO NO SON ISÓMEROS SI ¿SON EL MISMO COMPUESTO? NO SON ISÓMEROS CONSTITUCIONALES SI ¿SE PUEDEN INTERCONVERTIR MEDIANTE EL GIRO DE ENLACES SENCILLOS? SI SON ESTEREOISÓMEROS CONFORMACIONALES NO SON ESTEREOISÓMEROS CONFIGURACIONALES SON ENANTIÓMEROS MOLÉCULAS ACÍCLICAS DELTIPO: ¿SON IMÁGENES ESPECULARES? SI (R,R) / (S,S) (R,S) / (S,R) (*) ISÓMEROS CIS O TRANS CÍCLICOS DELTIPO: (R,R) / (S,S) (R,S) / (S,R) (*) NO SON DIASTEREOISÓMEROS ISÓMEROS (Z)/(E) ACÍCLICOS ¿PRESENTAN ACTIVIDAD ÓPTICA? NO ISÓMEROS CIS-TRANS CÍCLICOS SIN CONFIGURACIÓN (R) / (S) SI MOLÉCULAS ACÍCLICAS DEL TIPO: (R,R) / (R,S) ; (R,R) / (S,R) (S,S) / (S,R) ; (S,S) / (R,S) (*) ISÓMEROS CIS-TRANS CÍCLICOS CON CONFIGURACIONES (R) / (S) (*) Si los dos carbonos asimétricos tienen el mismo tipo de sustituyentes, los estereoisómeros (R,S) y (S,R) son la misma forma meso, ópticamente inactiva. A-I 355 PRIORIDADES RELATIVAS DE GRUPOS CON ENLACES DOBLES O TRIPLES (Prioridades de los átomos: 12 C < 14N < 32S) Los átomos escritos con negrita son átomos "extra", que se añaden porque existen enlaces dobles o triples. 12 C C 2 C C C 1 C1(C2C) C2(C) C1(C2CC) C2(CC) C1(N2N) N2(C) C1(N2NN) N2(CC) C1(O2O) O2(C) C1(S2S) S2(C) (C) (C) (C) C N C 2 1 C C (C) (C) 2 C (C) N C 1 (C) (N) (C) N O C 2 1 N C (C) (N) 2 C (N) O C 1 (C) (O) S 2 C S C 1 (C) (S) 14 N C 2 N C N 1 N1(C2C) C2(N) (N) (C) N 2 N N N 1 N1(N2N) N2(N) (N) (N) O 2 N O N 1 N1(O2O) O2(N) (N) (O) O O (N) (O) O N N1(O2O2OO) O2(N) N (N) O (O) A-I 356 32 S O 2 S O S 1 S1(O2O) O2(S) (S) (O) O O (S) (O) O S S1(O2O2OO) O2(S) S (S) O (O) CRITERIOS EMPLEADOS PARA DEFINIR LAS PRIORIDADES RELATIVAS DE LOS RADICALES (Cahn, Ingold y Prelog) (CIP) La prioridad de los átomos aumenta al crecer su masa atómica. Las prioridades de los isótopos de cualquier elemento aumentan también con su masa atómica. Por ejemplo, los isótopos de hidrógeno tienen las prioridades siguientes: 1H > 2D > 3 T. (Prioridades de los átomos: 127I > 80Br > 35Cl > 32S > 31P > 28Si > 19F > 16O > 14N > 12C > 1H) Los átomos se han numerado de derecha a izquierda, comenzando por el átomo del radical, que se numera como 1: 6 CH3 5 4 3 2 1 CH2 O CH2 C CH2 O En la lista (ver p., 627), cada radical aparece con un átomo escrito con negrita. Este átomo indica que el radical tiene prioridad sobre todos los que le preceden. Por ejemplo: CH3CH2CH2CH2− C1(CHH) C2(CHH) C3(CHH) C4(HHH) (menor prioridad) CH3(CH2)3CH2− C1(CHH) C2(CHH) C3(CHH) C4(CHH) (mayor prioridad) El radical pentilo tiene mayor prioridad que el butilo: en el pentilo, C4 está unido a un carbono y dos hidrógenos [C4(CHH)], mientras que en el butilo C4 está unido a tres hidrógenos [C4(HHH)] Los átomos subrayados indican la presencia de enlaces dobles o triples. Por ejemplo: HC C CH2 C1(CHH) C2(C3CC) O=N− N1(OO) O2(N) O1(C) C2(OOH) O H C O En el radical 2-propinilo, el átomo de carbono 2 está unido al carbono 3 y a dos carbonos extra (dos dobles enlaces, dos carbonos extra) A-I 357 En el radical nitroso el átomo de nitrógeno está unido al oxígeno 2 y a otro oxígeno extra (un doble enlace) En el radical formiloxi, el átomo de carbono 2 está unido al oxígeno del carbonilo y a otro oxígeno extra (un doble enlace Si resulta imposible establecer las prioridades de dos radicales, se recurre a la regla siguiente: tienen prioridad los átomos de carbono reales sobre los duplicados. En el 3,4-dimetilciclobuteno se plantea este problema: Me Me 4 3 H 1 H 2 Me[3] Me[3] [1](C1CH)C4 3 C2(C1CH)[2] [2](C2CH)C1 H[4] 4 C3(C2CH)[1] H[4] (3S) (4R) Átomo de carbono 3 (prioridades): C4(C1CH)[1] > C2(C1CH)[2] Átomo de carbono 4 (prioridades): C3(C2CH)[1] > C1(C2CH)[2] Si los átomos X1, X2, etc., de dos radicales distintos están unidos al mismo tipo de átomos, tiene mayor prioridad el radical con mayor número de átomos. H2N− N1(HH) H3N+− N1(HHH) la prioridad aumenta O=N− N1(OO) O O N N1(OOOO) El “grupo” de menor prioridad es un par de electrones que no formen enlace (p.e., el par de electrones libres del átomo de nitrógeno) A-I 358 ORDEN DE PRIORIDAD CRECIENTE DE ALGUNOS RADICALES HIDRÓGENO 1. 1 H− 2. 2 D− 3. 3 T− CARBONO 4. CH3− C1(HHH) 5. CH3CH2− C1(CHH) C2(HHH) 6. CH3CH2CH2− C1(CHH) C2(CHH) C3(HHH) 7. CH3CH2CH2CH2− C1(CHH) C2(CHH) C3(CHH) C4(HHH) 8. CH3(CH2)3CH2− C1(CHH) C2(CHH) C3(CHH) C4(CHH) C5(HHH) 9. CH3(CH2)4CH2− C1(CHH) C2(CHH) C3(CHH) C4(CHH) C5(CHH) C1(CHH) C2(CHH) C3(CCH) 12. CH3 CH CH2 C1(CHH) C2(CCH) C3(HHH) 11. CH2=CHCH2− C1(CHH) C2(CCH) C3(CHH) C1(CHH) C2(CCC) C3(HHH) C1(CHH) C2(CCC) C3(CCH) C1(CHH) C2(CCC) C3(CCH) C1(CCH) C2(HHH) CH 3 10. CH 3 CH CH 2CH 2 CH3 CH3 15. CH3 C CH2 CH3 13. HC C CH2 1 CH2 14. C4(CHH) CH3 18. CH3 CH A-I 359 16. CH2=CH− 19. CH3CH2CH C1(CCH) C2(CHH) C1(CCH) C2(CHH) C3(HHH) C1(CCH) C2(CHH) C3(CHH) C1(CCH) C2(CCH) C1(CCC) C2(HHH) C1(CCC) C2(CHH) C1(CCC) C2(CCH) C1(CCC) C2(CCH) C3(CCH) C4(CCH) C1(CCC) C2(CCH) C3(CCH) C4(CCC) C1(CCC) C2(CCH) C3(CCH) C4(NCC) C1(CCC) C2(CCH) C3(CCC) C4(CCH) C5(CCH) C1(CCC) C2(CCH) C3(CCC) C4(CCH) C5(CCC) C1(CCC) C2(CCH) C3(NCC) C4(CCH) C5(CCH) CH3 1 20. 17. CH3 CH CH 35. CH3 C CH3 CH3 CH3 23. CH2 21. HC C C 1 24. 25. CH3 26. O2N H3C 4 1 4 3 1 27. H3C 3 1 28. H3C O2N 29. 1 5 3 1 A-I 360 O2 N 3 1 30. C2(CCH) C3(NCC) C1(CCC) C2(CCC) C3(HHH) C1(CCC) C2(CCC) C3(CCH)........... C6(CCH) C1(CCC) C2(CCC) C3(CCH)........... C6(CCC) C1(CCC) C2(NCC) C3(CCH) C4(CCH) C1(CCC) C2(NCC) C3(CCH) C4(NCC) C4(CCH) C5(NCC) 5 O2N 22. C1(CCC) CH3 C C 2 CH3 1 31. 2 CH3 1 32. 6 2 CH3 NO2 1 33. 2 NO2 4 34. O2N 36. H C 1 O C1(OOH) O 37. CH3 C C1(OOC) C2(HHH) C1(OOC) C2(CCC) C1(OOO) O2(H) O 38. C6H5 C 39. HO C 40. CH3O C C1(OOO) O2(C) C3(HHH) 41. O CH3CH2O C C1(OOO) O2(C) C3(CHH) O O C4(HHH) A-I 361 O 42. C6H5CH2O C C1(OOO) O2(C) C3(CHH) C1(OOO) O2(C) C3(CCC) C4(CCC) O 43. Me3C O C NITRÓGENO 44. H2N− N1(HH) 45. H3N+− N1(HHH) 46. CH3-NH− N1(CH) C2(HHH) 47. CH3CH2-NH− N1(CH) C2(CHH) 48. C6H5-NH− N1(CH) C2(CCC) 49. CH3 C NH N1(CH) C2(OOC) C3(HHH) N1(CH) C2(OOC) C3(CCC) N1(CH) C2(OOO) N1(CC) C2(HHH) N1(CC) C2(CHH) O O 50. C6H5 C NH O 51. C6H5CH2O C NH 52. CH3 N CH3 CH2CH3 53. 54. CH3CH2 CH3 N CH3 + N N1(CCC) CH3 55. C6H5-N=N− N1(NN) 56. O=N− N1(OO) O 57. O N N1(OOOO) A-I 362 OXÍGENO 58. HO− O1(H) 59. CH3O− O1(C) C2(HHH) 60. CH3CH2O− O1(C) C2(CHH) C3(HHH) 61. C6H5CH2−O− O1(C) C2(CHH) C3(CCC) 62. C6H5−O− O1(C) C2(CCC) O1(C) C2(OOH) O1(C) C2(OOC) C3(HHH) O1(C) C2(OOC) C3(CCC) O1(S) S2(OOC) O1(S) S2(OOOO) O 63. H C O 64. CH3 C O O O 65. C6H5 C O O 66. CH3 S O 67. CH3 S O O O AZUFRE 68. HS− S1(H) 69. CH3−S− S1(C) C2(HHH) 70. CH3CH2−S− S1(C) C2(CHH) O 71. CH3 S 72. CH3 S S1(OOC) O S1(OOOOC) O O 73. HO S S1(OOOOO) O HALÓGENOS 74. Cl− 75. Br− 76. I− A-I 363 NOMENCLATURA DE LOS RADICALES INCLUIDOS EN EL APARTADO ANTERIOR (Orden alfabético: un número más alto indica una prioridad mayor) 49. Acetilamino 9. Hexilo 37. Acetilo 1. Hidrógeno 64. Acetoxilo 58. Hidroxilo 11. Alilo 12. Isobutilo 44. Amino 10. Isopentilo 45. Amonio 31. Isopropenilo 13. Bencilo 17. Isopropilo 61. Benciloxi 68. Mercapto 51. Benciloxicarbonilamino 46. Metilamino 42. Benciloxicarbonilo 4. Metilo 50. Benzoilamino 71. Metilsulfinilo 38. Benzoilo 66. Metilsulfiniloxi 65. Benzoiloxi 72. Metilsulfonilo 75. Bromo 67. Metilsulfoniloxi 7. Butilo 69. Metiltio 16. sec-Butilo 59. Metoxilo 23. terc-Butilo 40. Metoxicarbonilo 43. terc-Butoxicarbonilo 14. Neopentilo 39. Carboxilo 57. Nitro 18. Ciclohexilo 29. m-Nitrofenilo 74. Cloro 35. o-Nitrofenilo 2. Deuterio 53. Dietilamino 52. Dimetilamino 21. 2,4-Dinitrofenilo 30. 3,5-Dinitrofenilo 47. Etilamino 5. Etilo 26. p-Nitrofenilo 56. Nitroso 8. Pentilo 19. 1-Propenilo 6. Propilo 32. 1-Propinilo 15. 2-Propinilo 70. Etiltio 73. Sulfo 22. Etinilo 27. m-Tolilo 60. Etoxilo 33. o-Tolilo 41. Etoxicarbonilo 25. p-Tolilo 48. Fenilamino 54. Trimetilamino 55. Fenilazo 3. Tritio 24. Fenilo 20. Vinilo 62. Fenoxi 34. 2,6-Xililo 36. Formilo 28. 3,5-Xililo 63. Formiloxi 76. Yodo A-I 364 EJERCICIO RESUELTO Ordena los radicales siguientes de menor a mayor prioridad. Me−CO−CH2−CO− Acetoacetilo Me−CO−CH2− Acetonilo H2C=CH−CH2−O− Aliloxi H2N−CH=N− Aminometilenamino H2N−O− Aminooxi C6H5−N=N−O− Bencenoazoxi C6H5 Bencenosulfinilo S O O C6H5 S NH Bencenosulfonamido O O C6H5 S Bencenosulfonilo O (C6H5)2CH− Difenilmetilo Br Bromoformilo C O H2C=CH−CH=CH− 1,3-Butadienilo CH3CH=CH−CH2− 2-Butenilo NH2 C Carbamoilo O N C O Cianato N C Ciano C6H5 S Feniltio HO−NH− Hidroxiamino Me C Tioacetilo S C6H5 C Tiobenzoilo S NH2 C Tiocarbamoilo S A-I 365 CH2 C CH2 CH3 2-Metil-2-propenilo CH2 1-Metil-2-propenilo CH CH CH3 CH2 C 2-Etil-2-propenilo CH2 CH2CH3 CH3CH2 CH CH CH2 2-Pentenilo CH2 1-Etil-2-propenilo CH CH CH2CH3 CH2 C 1-Etiletenilo CH2CH3 CH3CH2 CH CH2 CH C CH2CH2 1-Butenilo 3-Metil-3-butenilo CH3 CH3 CH3 C CH3 CH CH2 CH C CH2 3-Metil-2-butenilo 2-Metil-2-butenilo CH3 CH2 CH CH2 CH 1-Metil-3-butenilo CH3 CH3 CH CH CH 1-Metil-2-butenilo CH3 CH2 CH CH CH2 2-Metil-3-butenilo CH3 A-I 366 RESPUESTA Un número más alto indica una prioridad mayor. CARBONO CH3 CH2 C CH2CH2 CH3−CH=CH−CH2− C1(CHH) C2(CHH) C1(CHH) C2(CCH) C3(CCH) C4(HHH) C1(CHH) C2(CCH) C3(CCH) C4(CHH) C1(CHH) C2(CCH) C3(CCH) C4(CCH) C1(CHH) C2(CCH) C3(CCC) C1(CHH) C2(CCC) C3(CHH) CH3(HHH) C1(CHH) C2(CCC) C3(CHH) CH2(CHH) CH3 CH2 CH CH CH2 CH3CH2 CH CH CH2 CH3 CH3 C CHCH2 CH3 CH2 C CH2 CH2CH3 CH2 C CH2 CH 3 C1(CHH) C2(CCC) C1(CHH) C2(OOC) C1(CCH) C2(CHH) C1(CCH) C2(CCH) C3(CHH) C1(CCH) C2(CCH) C3(CHH) C4(HHH) C1(CCH) C2(CCH) C3(CHH) CH2(CHH)(etilo) CH3 CH CH CH C1(CCH) C2(CCH) C3(CCH) C4(HHH) H2C=CH−CH=CH− C1(CCH) C2(CCH) C3(CCH) C4(CHH) C1(CCH) C2(CCC) CH 3 CH C CH 2 CH3−CO−CH2− C3(CCH) CH3 CH2 CH CH2 CH CH2 CH CH CH3 CH3CH2 CH CH CH2CH3 CH2 CH CH CH3 C6H5 C6H5 CH CH2CH3 CH2 N C C C1(CCC) C1(NNN) A-I 367 Me−CO−CH2−CO− C1(OOC) H2N C C1(OON) O Me C C1(SSC) C2(HHH) C1(SSC) C2(CCC) S C6H5 C S H2N C C1(SSN) S C1(BrOO) Br C O NITRÓGENO H2N−CH=N− N1(CC) HO−NH− N1(OH) O C6H5 S NH N1(SH) O OXÍGENO H2C=CH−CH2−O− O1(C) C2(CHH) N O1(C) C2(NNN) H2N−O− O1(N) N2(HH) C6H5−N=N−O− O1(N) N2(NN) C O AZUFRE C6H5 S S1(C) C6H5 S S1(OOC) O O C6H5 S S1(OOOOC) O A-I 368 ISÓMEROS CONSTITUCIONALES Y ESTEREOISÓMEROS Se denominan isómeros los compuestos que, teniendo la misma fórmula molecular, se diferencian entre sí porque: a) los enlaces entre los átomos son distintos, o b) la disposición de los átomos en el espacio es diferente. OH OMe O O C_Cl O C_H Cl O (C5H8O) (C6H12O) Me Et Me H H H (C7H5OCl) OH OH H Et H Cl H Me Me (C5H10) Cl (C2H5OCl) La constitución de un compuesto designa el tipo y ordenación de los enlaces entre los átomos. Los isómeros que se diferencian en la constitución se denominan isómeros constitucionales: O C OH Me O HO Me C N Me N Me Me Me (C5H8O2) (C9H15N) Los isómeros se denominan estereoisómeros cuando se diferencian sólo en la disposición de los átomos en el espacio: OMe H OMe OMe H H H H Me OMe H C C C Me (C8H16O2) H Et H Et H Br C Me C C H (C5H8) H H Br Me H Br (C6H12Br2) Et Et Br OH Cl Cl H H H OH (C6H11OCl) A-I 369 ISÓMEROS OH OMe O O O C Cl Y Y Cl Y C H O OH OH Me H Et H Me H Y H Et Y H Cl H Me Me Cl ISÓMEROS CONSTITUCIONALES O Me Me C OH C N O Y HO Me Y N Me Me CH3 ESTEREOISÓMEROS Me H H COMe Me H Y COMe H (Z) (E) OMe OMe OMe H H H Y H H H H 3 Et 4 3 Et (3S,4R) Br C 4 Me Et (3S,4S) Me 3 C C C H (R) Cl H Et Br Y C H H Y Br C (S) (trans) (cis) Br OMe H Me Me H 1 H OH trans (1R,3R) Cl H Y H 1 3 OH trans (1S,3S) A-I 370 ESTEREOISÓMEROS CONFORMACIONALES Cl H Cl OH H H Cl H Cl 600 H OH H (eclipsada) 600 Cl H H Cl OH (alternada) H (eclipsada) Br Cl 1 4 H H Br Cl 4 1 H H cis(1a,4e) cis(1e,4a) MOLÉCULAS QUIRALES HO H Me Cl Me Et (2R) 3 H Me H C C Me (R) Me (1S,3S) OH H HO H 3 H (2S,3S) C H 1 Me H Me OH 2 2 H H H Me Me (R) (R) ENANTIÓMEROS H Me 2 Cl Me H (2S) 3 OH H HO H OH 2 Cl H trans (1R,2R) OH H 2 H 1 Cl trans (1S,2S) Me H Me C C Me Me C C H (R) H (2S,3S) (2R,3R) 1 Me 2 3 Me H HO 2 Cl Et (2R) OH Me 2 Et H C C H H Me (S) A-I 371 DIASTEREOISÓMEROS Me H H Me OH Y 3 Me H OH 2 2 3 Cl 2 1 Me H HO OH HO H Cl H 1 Cl 2 H Me H Me Me Y Me 4 H H H H H (2E,4Z) (2Z,4Z) (2E,4E) H 2 4 Me H (E) H Me Me H (Z) 2 Y H Y H 4 Me H H cis (1R,2S) H Cl trans (1R,2R) Me Me H H 2 H 2 H trans (1R,2R) 1 2 H Cl 1 Y Cl Y cis (1S,2R) (2R,3S) (2R,3R) H HO MOLÉCULAS AQUIRALES CON CARBONOS ESTEREOGÉNICOS (FORMAS MESO) H Me OH OH 2 2 3 H Me Cl OH 1 H H H Cl 1 H 3 H H cis (1R,3S) cis (1S,3R) cis (1S,2R) Et Et OH (2R,3S) 3 1 MOLÉCULAS AQUIRALES (NO TIENEN CARBONOS ESTEREOGÉNICOS: NO SON FORMAS MESO) Cl H H H H Me trans Cl Me cis H H Cl Me Et Et Et Et cis trans A-I 372 CONFIGURACIÓN ABSOLUTA. NOMENCLATURA (R)−(S) DE CHAN, INGOLD Y PRELOG (CIP) (Prioridades relativas de los grupos: 1 > 2 > 3 > 4) 1 1 4 3 proyección configuración (R) en el plano 3 2 1 1 3 proyección 2 en el plano 2 3 4 configuración (R) 4 1 1 4 2 2 proyección configuración (S) en el plano 2 3 3 1 1 2 proyección 3 en el plano 3 2 4 configuración (S) 4 En una proyección de Fischer, el grupo de menor prioridad debe quedar situado arriba o abajo; si aparece a la izquierda o a la derecha, la configuración real de la molécula es la inversa de la obtenida. Si una proyección de Fischer se gira 1800 en el plano del papel, se obtiene otra proyección de Fischer de la misma molécula: 2 4 4 3 2 3 1 [configuración (R)] 1 1800 (en el plano) 1 1 3 2 3 4 2 [configuración (R)] 4 A-I 373 CONFIGURACIONES DE MOLÉCULAS CON ÁTOMOS DE CARBONO ESTEREOGÉNICOS MOLECULAS ACÍCLICAS H Cl CH3 CH CH2OH Cl Me 2-Cloro-1-propanol CH2OH H[4] H 2 Me [3](HHH)C CH2OH C(OHH)[2] 2 Cl[1] Cl (2S) Cl Cl O CH CH C H CH2 2-Cloro-3-butenal H CH2=CH CHO Cl[1] Cl CH2=CH 2 [3](CCH)C CHO 2 H C(OOH)[2] H[4] (2R) Cl Cl HC C CH CH CH2 3-Cloro-1-penten-4-ino CH H C Cl[1] Cl CH 3 C CH=CH2 CH=CH2 3 [2](CCC)C C(CCH)[3] H[4] H (3S) CH2COMe OCH2CH3 CH3 CO CH2 C CH2 OCH3 OCH3 EtO MeOCH2 OMe 4-Etoxi-4,5-dimetoxi-2-pentanona C(CHH)[4] CH2COMe MeOCH2 4 OEt OMe [3](OHH)C 4 O(C)C(HHH)[2] O(C)C(CHH)[1] (4S) A-I 374 NEt2 OCH3 CH3 CO CH2 C MeO MeCOCH2 N CH2CH3 OH CH2CH3 OH 4-(N,N-Dietilamino)-4-hidroxi-4-metoxi-2-butanona N(CC)[3] NEt2 MeOCH2 4 4 [4](OHH)C OH O(H)[2] O(C)[1] OMe (4R) C6H5 C6H5 CH3 CH CH C C CH MeCH CH Me3C CMe3 C CH 3-terc-Butil-3-Fenil-3-4-hexen-1-ino C3(CCC)(CCH)(CCH)[1] C6H5 Me3C 3 C CH [3](HHH)(CCC)C 3 C(CCC)(CCH)(H)[2] C(CCH)(CCH)(HHH)[4] CH CHMe (3R) Cl CH3 CH C H Me Cl NH2 2 CH2CH3 CH3 3 Me 2-Cloro-3-metil-3-pentanamina Et NH2 H Cl 2 [1]Cl Me C(ClCH)[2] H[4] Me 3 NH2 2 C(HHH)[3] C(NCC)[2] [4](HHH)C 3 N(HH)[1] C(CHH)[3] Et (2S,3R) (2S) (3R) A-I 375 CH3CH2 H CH2NH2 Et CH2NH2 3 CH CH CH3 2 OH H OH Me 3-Metilamino-2-pentanol H H[4] C(CCH)[2] Et Me 3 CH2NH2 2 OH [3](HHH)C [3](CHH)C O(H)[1] 2 C(NHH)[2] 3 C(OCH)[1] H[4] H (2S,3S) (3S) (2S) H Cl Et Cl 3 CH3 CH2 CH CH CH2Br 2 Me H CH2Br Me 1-Bromo-3-cloro-2-metilpentano H Et 3 [3](HHH)C Me 2 H[4] C(ClCH)[2] Cl CH2Br 2 [3](CHH)C C(BrHH)[1] 3 Cl[1] C(CCH)[2] H[4] H (2S,3R) (2S) (3R) H Br Et Br 3 CH3 CH2 CH CH CH2Cl 2 Me Me 1-Cloro-3-bromo-2-metilpentano H CH2Cl H Et Me 3 2 H[4] C(BrCH)[1] Br [3](HHH)C CH2Cl 2 H[4] C(ClHH)[2] [3](CHH)C 3 Br[1] C(CCH)[2] H (2R,3R) (2R) (3R) A-I 376 H CH=CH2 Et CH2CH3 3 CH2 CH CH CH CH CH2 4 CH3 H CH=CH2 Me 3-Etil-4-metil-1,5-hexadieno H Et Me 3 4 C3(CCH)(CCH)[1] H[4] CH=CH2 [3](HHH)(CHH)C C(CCH)(CHH)[2] 3 CH=CH2 4 [3](HHH)C C4(CCH)(CCH)[1] H C(CCH)(CHH)[2] H[4] (3S) (4R) (3S,4R) MOLECULAS MONOCÍCLICAS Me Cl 2 Et OH 1 (1R,2S)-2-Cloro-1-etil -2-metilciclopropanol C(CHH)(ClCC)[3] 1 [1](O) C(CHH)[3] C(CHH)(HHH)[4] 2 [4](HHH)C C(ClCC)[2] Cl[1] C(OCC)[2] (1R) (2S) O H MeO 3 H 2 CH2Cl (2S,3R)-2-Clorometil-3-metoxiciclobutanona C(OOC)[2] [1](ClHH)C 2 C(CHH)[3] H[4] [1](O)C C(OCH)[3] 3 H[4] C(CCH)[2] (2S) (3R) H HO Me 2 O 1 5 H (2R,5S)-2-Hidroxi-5-metiloxolano C(CCH)[3] [4]H 2 O[2] O(C)[1] (2R) C(CHH)[2] [4]H 5 C(HHH)[3] O(C)[1] (5S) A-I 377 Et Me 5 OH O 3 H (3S,5S)-5-Etil-3-hidroxi-5-metilciclohexanona C(CHH)(CCC)[3] [4]H 3 C(CHH)(HHH)[3] O[1] [1](OOC)(CHH)C 5 C(CHH)(OCH)[2] C(HHH)[4] C(CHH)(OOC)[2] (3S) (5S) H OMe 3 EtO 1 Me (1S,3S)-3-Etoxi-1-metil-1-metoxiciclopentano C(CHH)(CHH)[3] [4](HHH)C 1 C(CHH)(CHH)[3] O[1] [4]H C(CHH)(OCH)[2] 3 O[1] C(CHH)(OCC)[2] (1S) (3S) 2 H 3 1 CH=CH2 4 (3R)-3-Vinilciclobuteno C2(CCH)C1(CCH)[1] 3 [2](CHH)(CCH)C H[4] C4(CHH)[3] (3R) EtOCH2 EtOCH2CH2 4 5 3 O1 2 (3R)-3-(2-Etoxietil)-3-etoximetiloxolano C4(CHH)(OHH)O(CHH)−C3[4] [2]C(HHH)(CHH)O(OHH)C 3 C(CHH)(CHH)O(CHH)(HHH)[3] C2(OHH)O(CHH)(CHH)−C3[1] (3R) A-I 378 MeOCH2 3 MeOCH2CH2CH2 2 O1 (3S)-3-Metoximetil-3-(3-metoxipropil) oxano CH2CH2CH2OCH2-(C3) 3 MeOCH2 C(CHH)(CHH)(OHH)(O)(CHH)-(C3)[3] (CH2)2CH2OMe 3 [2](HHH)(O)(OHH)C CH2O-(CH2)3-(C3) C(CHH)(CHH)(OHH)(O)(HHH)[4] C(OHH)(O)(CHH)[1] (3S) ESPIRANOS R1 R2 R3 C C C [eje estereogénico] R4 H 9 1 Cl 6 3 H Me R 4 R Cl Cl H H [2]H R4 H Me Cl[3] Cl[3] 3-Cloro-9-metilespiro[5,5]undecano R2 R1 R2 H Me R3 R3 1 [1]Me Me[1] H[2] H[4] H[4] (S) (R) CUMULENOS Número impar de dobles enlaces 1,2,3-Butatrieno: H2C C C H CH2 H C C CH C H H σ [C(sp2)-C(sp)] . . . . [H(1s)-C(sp2)]σ . . . . [C(sp)-C(sp)] σ . . . . . . H H C C C C H H σ [C(sp)-C(sp2)] A-I 379 π [pz(C)-pz(C)] π [pz(C)-pz(C)] . . . . H . . H H H H H C C H C C H [py(C)-py(C)] π [pz(C)-pz(C)] π H π[py(C)-py(C)] C H C C π [pz(C)-pz(C)] C 2 H H σ [C(sp)-C(sp2)] [C(sp )-C(sp)] σ σ [C(sp)-C(sp)] Los cumulenos con un número impar de dobles enlaces pueden presentar isomería (Z) / (E): H Me C C C C H H Me Me (Z)-2,3,4-Hexatrieno C C C Me C H (E)-2,3,4-Hexatrieno Número par de dobles enlaces H 1,2-Propadieno: H2C C CH2 σ [C(sp2)-C(sp)] . . . . H C C . . H H H σ [H(1s)-C(sp2)] C C H . [C(sp )-C(sp)] σ [H(1s)-C(sp )]σ C H . 2 2 C . . . . H π [pz(C)-pz(C)] H . H . . . H H H H C C C H H [py(C)-py(C)] π A-I 380 π [py(C)-py(C)] [pz(C)-pz(C)] π H H C H C σ[H(1s)-C(sp2)] C H [C(sp2)-C(sp)] σ σ[C(sp2)-C(sp)] Los cumulenos con un número par de dobles enlaces pueden ser ópticamente activos: R3 R3 1 R R2 C C R4 R4 H H C Me C R2 R1 [eje estereogénico] C H C C Me C H C Me Me Los átomos de carbono con doble enlace son los que definen la quiralidad de la molécula (eje quiral) Los sustituyentes del carbono con doble enlace más próximos al observador tienen prioridad sobre los más alejados: C(HHH)[3] Me H Me C C [2]H C H C(HHH)[1] H[4] (R) H[4] H H Me C C [2]H C Me C(HHH)[1] C(HHH)[3] (S) Lo más cómodo es mirar la molécula desde el lado en el que los sustituyentes son perpendiculares al plano del papel (desde la izquierda en el ejemplo anterior) H ¡ ASÍ NO ! C Me C C H Me Si en un cumuleno se intercambian los sustituyentes de uno de los carbonos con doble enlace, se obtiene su enantiómero: A-I 381 H[4] H C Me C C [2]H () H C(HHH)[1] Et C(CHH)[3] [intercambio] (S) C(CHH)[3] Et C C [2]H () H Me C C(HHH)[1] H H[4] (R) ALQUILIDENCICLOALCANOS Los alquilidencicloalcanos tienen el mismo tipo de geometría que los cumulenos con tres átomos de carbono en el esqueleto insaturado. H H 1 4 Me Et 1-(1-Propiliden)-4-metilciclohexano H Me H H Et Et H[4] H[4] [2]H H Me [1]Me Me[1] H[2] Et[3] Et[3] (R) (S) H[4] H HO2C C Br [2]HO2C 4 Me Me[3] Ác. (S)-2-Bromo-(4-metilciclohexiliden)acético (S) Me[3] Me H C HO2C H[4] Ác. (R)-(4-Metilciclohexiliden)acético H (R) Cl[3] Cl C CO2H[1] [2]H 4 H HOCH2 Br[1] [1]HOCH2 3 H (S)-(3-Clorociclobutiliden)etanol H[2] H[4] (R) A-I APÉNDICE II REACCIONES DE LAS DE OLEFINAS (ESTEREOQUÍMICA) 1 Reacciones con XH (X = Nu = Cl, Br, I, SO4H) (carbocationes) Nu 1 Me 1 R1 R2 H H + H+ 1 R + Me R1 (1) R2 _ Nu R2 R1 2 R 2 Me 2 (2) Nu H Nu 1 1 H + 1 R1 R2 2 R3 Nu _ R4 2 1 R1 R3 R4 R2 H (1) R3 R1 R2 R4 H R3 R4 (2) R1 R2 Nu R1 Nu + 2 1 R2 R1 1 + 2 H 2 R3 Nu R2 (3) H _ R4 R2 R1 R3 R4 R3 R4 (4) 2 H Nu 383 H Nu 1 1 H 1 R1 Nu + _ R3 R4 R2 2 (5) R3 R1 R2 R4 R1 H R2 (6) 2 1 R1 R3 R4 R2 H R3 Nu R4 Nu R3 R4 + 2 1 1 R1 2 R3 R4 + R2 Nu R2 H R1 R3 R4 _ H 2 (7) R1 R2 2 (8) Nu H Compuestos : (1) = (2) = (3) = (4) ; (5) = (6) = (7) = (8) Enantiómeros: (1) y (4) ; (2) y (3) ; (5) y (8) ; (6) y (7) H Nu 1 (1) 1 H + R2 Nu 1 R1 _ 2 R2 H R2 (2) 2 1 R1 R1 R2 H R1 Nu R1 Nu + 2 1 (3) 1 R1 + R2 Nu H R2 R1 R2 _ 2 H 2 (4) 2 H Nu 384 Nu 1 1 R1 H + Nu 1 _ R2 2 (5) R1 R2 R1 H (6) 2 1 R1 H R2 H Nu R2 Nu R2 + 2 1 1 R1 R2 + Nu _ (7) R1 H R1 R2 2 H 2 (8) 2 Nu H H Nu R1 R2 H R2 R1 Nu R1 Nu H R2 R1 R2 H Nu Compuestos : (1) = (2) = (3) = (4) ; (5) = (6) = (7) = (8) Enantiómeros: (1) y (4) ; (2) y (3) ; (5) y (8) ; (6) y (7) 1 1 H R1 1 + Nu _ R2 2 R1 2 H+ 1 (1) (2) R2 2 1 2 R1 H Nu 1 + 2 _ (3) R2 2 (4) 385 1 1 1 + R1 Nu H _ H R1 R2 R1 H Nu R2 Nu R2 R1 H R1 R2 Nu H (5) R2 2 2 H+ 1 Nu (6) R2 R1 2 1 1 2 + R1 Nu R2 _ (7) H 2 2 (8) Compuestos : (1) = (2) = (3) = (4) ; (5) = (6) = (7) = (8) Enantiómeros: (1) y (4) ; (2) y (3) ; (5) y (8) ; (6) y (7) 2 Reacciones con halógenos (X = Cl, Br, I) (iones onio) R2 R 1 X 1 R1 R3 R2 R4 X + X + X R3 R1 R2 (1) _ R3 X R4 X R3 R4 1 2 R4 (2) 2 R1 R1 R2 X + R2 R1 X 1 X 1 + X R1 X R2 _ 2 (1) X R2 X R2 (2) 2 R1 X 386 1 1 X R1 + R2 X X R2 X R2 R1 X (1) _ R2 1 ; X R1 2 Compuestos: (1) = (2) + X R1 2 2 (2) Enantiómeros: (1) y (2) 3 Reacciones con XOH (X = Cl, Br, I) (iones onio) R 2 R1 X 1 + X (1) HO _ R3 R1 R2 HO R1 R3 R4 X R4 (2) 2 2 R2 R3 X R4 1 R4 R3 R1 + OH R2 R3 HO R4 1 (3) R1 2 1 _ HO R3 R1 R2 R 2 R1 R4 X + X R2 OH (4) 2 X Compuestos: (1) = (3) ; (2) = (4) R4 ; Enantiómeros: (1) y (3) ; (2) y (4) R1 X 1 + X R1 R2 _ HO (1) OH R2 X R2 (2) 2 1 2 R1 R3 R2 X R1 OH OH R2 + 1 1 2 R1 R2 _ HO X + Compuestos: (1) = (3) ; (2) = (4) ; Enantiómeros: (1) y (3) ; (2) y (4) (3) R1 X R1 OH (4) 2 X R2 387 1 R2 X R2 R1 OH OH R2 R1 X R1 OH X R2 2 + 1 _ HO 2 1 R1 R2 2 X + Compuestos: (1) = (3) ; (2) = (4) R2 (1) (2) 2 1 R2 OH HO R1 R1 X _ + X X R1 (3) (4) ; Enantiómeros: (1) y (3) ; (2) y (4) 4 Reacciones con peroxiácidos (R-CO3H) R2 R1 OH 1 (1) H + O R1 R3 1)RCO3H R2 R4 2)H3O+ HO R4 HO R3 H2O R3 R1 R2 R4 1 R3 R4 (2) 2 2 R1 OH R2 Enantiómeros: (1) y (2) R1 1 H (1) O+ R1 R2 1)RCO3H R1 2)H3O+ OH R2 1 H 2O OH R2 OH R2 2 (2) 2 R1 OH Enantiómeros: (1) y (2) 1 1)RCO3H 1 H 2O 2 2)H3O+ R1 R2 R1 O+ H Enantiómeros: (1) y (2) R2 2 OH R2 R1 OH R1 OH OH R2 (1) (2) 388 5 Reacciones con tetraóxido de osmio (OsO4) O O Os O R1 R2 R1 OH HO H3O+ R3 (1) R4 R1 R3 R2 R4 R1 R3 R OsO4 R3 R4 R2 O R2 H3O 4 (2) R4 O O R2 + R3 R1 OH HO Os O O Enantiómeros: (1) y (2) O O Os O R1 R1 R2 O OH R2 H3O OH + (1) R1 R2 R1 R2 OsO4 R2 R1 O H3O O + (2) OH OH Os O O Enantiómeros: (1) y (2) O O Os O H3O+ O R1 R2 OsO4 R1 R2 H3O+ R1 O O Os O Enantiómeros: (1) y (2) O R2 OH OH R1 R2 R1 R2 OH OH (1) (2)







