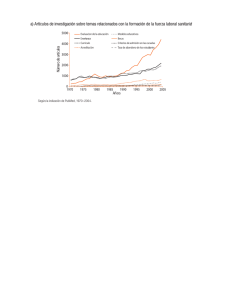
Pruebas reumáticas
Anuncio

TEMA 1 I Freire González, Mercedes Pruebas reumáticas I ntroducción Las pruebas de laboratorio son una parte importante de la evaluación de pacientes con enfermedades reumáticas. A medida que se progresa en la compresión de las enfermedades reumáticas, se desarrollan nuevos biomarcadores y se perfila la utilidad de los existentes. Las pruebas reumáticas nos ayudan a confirmar diagnósticos, establecer el estadio de la enfermedad y el pronóstico, así como controlar la actividad de la misma y valorar la respuesta al tratamiento. No existe una prueba que nos pueda indicar por si sola certeza absoluta sobre el diagnóstico, por lo que aquellas más útiles son las que se solicitan para responder a preguntas bien definidas. Velocidad de Sedimentación Globular (VSG) Es sensible en todos los tipos de inflamación, pero no nos permite distinguir si la causa en infecciosa, inflamatoria o neoplásica. Un valor normal puede ayudar a descartar una enfermedad inflamatoria, pero una VSG elevada de forma moderada puede dar lugar a confusión. Su normalización casi siempre va detrás de la resolución de la inflamación (Bridgen M, 1998). Proteína C Reactiva (PCR) Es una proteína de fase aguda sintetizada en respuesta a lesiones tisulares. Sus niveles varían más rápido que los de la VSG, puede incrementarse en cuestión de 4-6 horas ante un estímulo suficiente y normalizarse en 1 semana. A diferencia de la VSG un valor normal o indeterminado no excluye un proceso inflamatorio (Morley JJ, 1982). Factor Reumatoide (FR) Es un autoanticuerpo que se fija a la región Fc de la IgG humana. IgM es el isotipo más común de FR, aunque también pueden detectarse IgG e IgA. Se consideran positivos títulos mayores de 1:20. En Artritis Reumatoide (AR) establecida tiene una sensibilidad de un 70% y de un 50% en AR de inicio, ya que la seroconversión en algunos pacientes se produce tras una clínica de semanas o meses. No es específica de AR y puede aparecer en otras enfermedades autoinmunes así como en un pequeño porcentaje de personas sanas. El isotipo Ig A está relacionado con enfermedad erosiva y vasculitis reumatoide. Títulos elevados de FR se asocian a enfermedad más agresiva, sin embargo no es válido para el seguimiento longitudinal de la actividad de la enfermedad, siendo en este caso más fiables los valores de la PCR (Witherington RH, 1984). Tabla 1. Frecuencia de FR en enfermedades reumáticas y otras. Enfermedades Artritis Reumatoide Síndrome de Sjögren Frecuencia aproximada (%) 80 75-90 LES 15-35 EMTC 50-60 Esclerosis Sistémica PM/DM 20 5-10 Crioglobulinemia Mixta 90 Endocarditis bacteriana subaguda 40 Hepatitis Infecciosa 25 Tuberculosis 15 Sarcoidosis 10 Artritis Idiopatica Juvenil 10 Adultos sanos 5-7 Mayores de 60 años 15 1 Reumatología Anticuerpos anti-péptidos cíclicos citrulinados (anti-CCP) Son autoanticuerpos dirigidos contra aminoácidos formados por la modificación postranslacional de la arginina. Se cree que pueden tener un papel en la patogénesis de la AR. Tienen una sensibilidad similar al FR para la AR pero son mucho más específicos, sus características hacen que sea una prueba muy útil en pacientes seronegativos con sospecha de padecer una AR. Pueden detectarse en AR precoz y en algunos casos previo a la sinovitis inflamatoria (Vossenaar ER, 2004) Los anti-CCP pueden ser un mejor predictor de enfermedad erosiva que el FR, pero no se correlaciona con afectación extraarticular. Los anti-CCP positivos combinados con positividad para FR IgM presentan buena correlación con progresión radiográfica y al igual que el FR no son útiles en el seguimiento longitudinal de la enfermedad (Niewold TB, 2007). Anticuerpos Antinucleares (ANA) Son autoanticuerpos que reaccionan con antígenos del núcleo celular. Los distintos patrones reflejan diferentes componentes celulares (Tabla 2). Tabla 2. Patrones de ANA. Patrón Homogéneo Antígeno nuclear ADN doble cadena Histona Difuso Topoisomerasa I ENAS (Sm,RNP) Ro-SSA/La-SSB Moteado Asociaciones clínicas Lupus eritematoso sistémico Reacción a fármaco Lupus eritematoso sistémico Esclerosis sistémica EMTC Lupus eritematoso sistémico Síndrome de Sjögren Poli/dermatomiosistis Otros Otras enfermedades autoinmunes Infección Neoplasia Nucleolar Ag asociados a ARN Esclerosis sistémica Periférico ADN de doble cadena Lupus eritematoso sistémico Centrómero Centrómero Esclerosis sistémica limitada ADN ácido desoxirribonucleico. ARN ácido ribonucleico ENAS Antígenos nucleares extraíbles. EMTC enfermedad mixta del tejido conectivo. Ag Antígeno (Tan E, 1997). Los anticuerpos antinucleares son positivos en el Lupus Eritematoso Sistémico (LES) hasta el punto de que lupus ANA negativo son prácticamente inexistentes y hasta un 30% de personas sanas pueden tener títulos positivos. La prevalencia aumenta en mujeres y personas ancianas. La positividad no es específica de LES o enfermedad autoinmune sobre todo si es transitoria y a títulos bajos (Lyon R, 2005). Tabla 3. Anticuerpos en las enfermedades reumáticas. Tipo Descripción Asociación clínica Anti ADNdc Ac contra ADN doble cadena Alta especificidad para LES Enfermedad activa más grave Anti-histona Existen 5 tipos principales LES, LES inducido por fármacos Anti-ENA Sm RNP ARN-complejos proteína Alta especificidad para LES EMTC Pacientes afroamericanos y Asiáticos Anti-SSA (Ro) Ribonucleoproteínas LES (LECS), lupus neonatal Síndrome de Sjögren Anti-SSB (La) Ribonucleoproteínas S. De Sjögren, LES y LES Neonatal Continúa 2 Análisis en las enfermedades reumáticas Tipo Descripción Asociación clínica Anti-centrómero Ac contra centrómero Esclerodermia limitada Alta tasa de HTP Esclerosis biliar primaria Anti Scl 70 Ac. contra topoisomerasa Esclerodermia difusa Riesgo de fibrosis pulmonar Anti-Jo1 Ac contra la histidil ARN t Sintetasa Poli/dermatomiosistis Los pacientes tienden a tener EPI, Raynaud y artritis Resistente al tratamiento Anti-SRP Ac contra proteína de reconocimiento de señal Cardiomiopatia Mal pronóstico An-PM-Scl Ac contra componentes granulares del nucléolo Síndrome de solapamiento PM/ESP Anti-Mi-2 Ac contra un Ag nucleolar de función desconocida Dermatomiositis Pronóstico favorable ADN: ácido dexosiribonucleico. ENA: antígenos nucleares extraíbles EMTC: enfermedad mixta del tejido conectivo. LECS: lupus eritematoso cutáneo subagudo. HTP: hipertensión pulmonar. EPI: enfermedad pulmonar intersticial. PM: polimiositis. ESP: esclerosis sistémica progresiva Las pruebas para estos anticuerpos se solicitan separadamente del test para ANA. Anticuerpos anticitoplasma de neutrófilos (ANCA) Los ANCA son autoanticuerpos que reaccionan con los gránulos citoplasmáticos de los neutrófilos. Mediante inmunofluorescencia pueden detectarse dos patrones: citoplásmico (c-ANCA) o perinuclear (p-ANCA). En las vasculitis sistémicas como Wegener, poliangeítis microscópica y Churg Strausss estos patrones reflejan autoanticuerpos contra dos enzimas lisosomales contenidas en los gránulos de los neutrófilos la proteinasa 3 (PR3) y la mieloperoxidasa (MPO) respectivamente. Los anticuerpos antinucleares dirigidos contra PR3 y MPO se denominan PR3-ANCA y MPO-ANCA. La combinación de c-ANCA y PR3-ANCA tiene un valor predictivo positivo para vasculitis asociada a ANCA especialmente la granulomatosis de Wegener, igualmente la combinación de p-ANCA y MPO-ANCA tienen un valor predictivo positivo para la poliangeítis microscópica. Se correlacionan con la actividad y extensión de la enfermedad, y con frecuencia se normalizan con el tratamiento aunque no siempre. Una elevación persistente o títulos positivos una vez que se han negativizado pronostican el riesgo de enfermedad recurrente. Sin embargo la biopsia de tejidos continúa siendo el criterio diagnóstico de referencia y las decisiones terapéuticas no deben basarse solo en el resultado de los ANCA ya que estos pueden deberse a una infección, fármacos o incluso a otra enfermedad autoinmune (Bartunkova J, 2003). Complemento (C’ ) La cascada de complemento corresponde a un conjunto de proenzimas, proteínas reguladoras y receptores de superficie celular que median y aumentan la respuesta inmune humeral y celular. La vía clásica (C1, C4, C2), la vía alternativa (factores B, D y porperdina) y la vía de la lecitina de unión a manosa comparten el paso final, la partición de C3. El producto liberado (C3b) induce formación del complejo de ataque a la membrana C5-C9. Una reducción de los niveles séricos del C3 y C4 se correlaciona con el incremento del consumo observado en las enfermedades mediadas por inmunocomplejos activos como el LES. En cambio las enfermedades inflamatorias presentan niveles elevados de complemento debido a que son proteínas y por lo tanto reactantes de fase aguda. La hipocomplementemia no es específica de ninguna enfermedad y puede ser consecuencia de enfermedades no reumáticas como la endocarditis bacteriana subaguda y la glomerulonefritis postestreptococica. Los niveles de C4 desproporcionadamente bajos en comparación con los de C3 pueden indicar la presencia de crioglobulinas. Los pacientes con déficits genéticos de componentes del complemento C1-C4 tienen un mayor riesgo de desarrollar enfermedades por inmunocomplejos, especialmente algunas formas de LES (Ratnoff WD, 1996). Crioglobulinas Son inmunoglobulinas que precipitan de forma reversible a bajas temperaturas. En algunas enfermedades se fijan a proteínas del complemento y otros péptidos para formar Inmunocomplejos. 3 Reumatología Se clsifican en 3 tipos: n Tipo I: inmunoglobulinas monoclonales del isotipo IgM. n Tipo II: son una mezcla de IgG policlonal e IgM monoclonal. n Tipo III: son una combinación de IgG e IgM ambas policlonales. En las de tipo II y III el componente IgM tiene actividad FR, por lo que todos los pacientes con estos trastornos son positivos para el FR. Para una recogida idónea debe extraerse la sangre entera y mantenerse a temperatura corporal hasta que coagule, luego la muestra se centrifuga, se retira el coágulo y se deja reposar el suero restante a 4ºC varios días hasta que se observe precipitación. La muestra se centrifuga de nuevo y se mide el criocrito en un tubo calibrado. Las crioglobulinas no son específicas de ninguna enfermedad. Las de tipo I no activan el complemento por lo que los niveles de complemento son normales. Se asocian a trastornos linfoproliferativos, neoplasias malignas y síndromes de hiperviscosidad, y a aglutinación en los vasos de extremidades, ojos o cerebro. Las de tipo II y III, fijan complemento, y se relacionan con infecciones por virus de hepatitis C y un síndrome de vasculitis de pequeño vaso (Ferri C, 2002). A rtrocentesis . A nálisis de líquido sinovial A pesar del desarrollo de pruebas serológicas, el análisis de liquido sinovial es la herramienta de diagnóstico más importante en reumatología. Una artritis monoarticular inflamatoria aguda debe considerarse infecciosa o inducida por cristales y la artrocentesis es la única técnica que nos permite diferenciarlas con certeza. Debe realizarse una artrocentesis si existe sospecha de infección para iniciar un tratamiento antibiótico lo antes posible por el riesgo de destrucción de hueso y articulaciones. El análisis de líquido sinovial permite que el médico identifique los cristales responsables. Si se utiliza un microscopio polarizado la sensibilidad para identificar una artropatía por cristales es del 80-90% (Swan A, 2002) La artrocentesis es útil en la evaluación de artropatías crónicas o poliarticulares. Nos permite distinguir una artritis crónica inducida por cristales como una gota poliarticular o una artritis por depósito de pirofosfato cálcico, de otras artropatías como la AR. Aunque la infecciones crónicas micobacterianas o fúngicas pueden identificarse en el líquido sinovial a veces se requiera de una biopsia sinovial para diferenciar infecciones de otros procesos inflamatorios crónicos. Una artritis monoarticular aguda en un paciente con una enfermedad inflamatoria crónica que está bien controlada es indicación de artrocentesis diagnóstica. En una articulación séptica pueden ser necesarias artrocentesis repetidas para reducir la acumulación de material purulento que puede dañar los tejidos articulares y periarticulares. En articulaciones inflamadas el drenaje del liquido elimina la células y otros mediadores inflamatorios, reduce la presión intrarticular y disminuye la probabilidad de daño articular. La presencia de sangre en una articulación puede provocar adherencias que limitan la movilidad de la articulación por lo que es necesario la artrocentesis terapéutica (Zuber TJ, 2002). Tabla 4. Abordaje anatómico para la aspiración. Articulación Posición de la articulación Localización abordaje Rodilla Extendida Interno o externo bajo rotula Hombro Aducción/Rotación externa Anterior: infero externo a coracoides Posterior: bajo el acromion Tobillo Flexión plantar Anterointerno: interno a LEL 1º dedo Anteroexterno: externo a LEC 5º dedo Subastragalina Dorsiflexión 90ª Dorsal hacia la articulación radiocarpina Muñeca Posición media Dorsal hacia la articulación radiocarpina 1ª carpo-MTC Pulgar abducido y flexionado Proximal a la base del metacarpiano MCF/IF Dedo ligeramente flexionado Bajo el mecanismo extensor superointerno o superoexterno MTF/IF Dedos ligeramente flexionados Superointerno o superoexterno Codo Flexionado a 90º Externo, en triángulo formado por epicóndilo externo, cabeza radial y olécranon LEL: ligamento extensor largo. LEC: ligamento extensor corto. MTC: metacarpiano MCF: metacarpofalángica. IF: interfalángica. 4 Análisis en las enfermedades reumáticas La mayoría de las articulaciones pueden aspirarse sin asistencia radiológica, otras como las caderas o sacroilíacas deben aspirarse bajo control radiológico/ecográfico. Debemos tener en cuenta que no deben realizarse aspiraciones a través de áreas de infección, ulceración, tumor o estructuras vasculares evidentes. Tabla 5. Tipos de liquido sinovial. Tipo I Normal Tipo II Inflamatorio Tipo III Séptico Tipo IV Hemorrágico Color Claro/amarillo Amarillo/blanco Amarillo/blanco Rojo Claridad Trasparente Traslúcido/Opaco Opaco Opaco Viscosidad Alta Variable Baja NA Coagulo de mucina Firme Variable Disgregable NA Recuento leucocitos < 2.000 2.000/100.000 >100.000 NA Diferencial < 25% PMN >50% PMN >95 PMN NA Cultivo Negativo Negativo Positivo Variable NA: no aplicable. PMN: polimorfonucleares El líquido sinovial contiene menos de 200 células/ml. El de las artropatías no inflamatorias puede tener 2.000 células/ ml, las artropatías inflamatorias no infecciosas tienen recuentos muy variables que van desde 2.000 a 100.000 células. Cuanto más se acerque el recuento a 100.000 células/ml, mayor es la probabilidad de una artritis séptica. Aunque un paciente con una artropatía inducida por cristales, AR o una artropatía seronegativa puede tener un recuento de leucocitos superior a 100.000 células/ml. De la misma manera un recuento de células menor de 100.000 no excluye la infección. El líquido sinovial de una articulación séptica normalmente contiene más del 95% de PMN. Los ragocitos son PMN con inclusiones citoplasmáticas refringentes que contienen inmunocomplejos y complemento que pueden observarse en el examen de liquido sinovial de pacientes con AR (Pasqual E, 2005). B iopsia sinovial Puede aportar información diagnóstica importante y la artroscopia ha facilitado la obtención de tejido sinovial. Las enfermedades granulomatosas son difíciles de diagnosticar por medio del análisis del líquido sinovial ya que los cultivos son negativos en un número importante de pacientes. El diagnóstico de artritis tuberculosa se basa en la demostración histológica del granuloma caseificante o evidencia en el cultivo de Mycobacterium tuberculosis en el tejido sinovial. La biopsia sinovial está indicada si existe sospecha de neoplasia articular maligna. El diagnóstico de algunos procesos infiltrativos no malignos depende de la evaluación histológica o microscópica del material sinovial como en el caso de amiloidosis, hemocromatosis o sinovitis villonodular pigmentada. La comodidad de la biopsia directa de tejidos diana gracias a la técnicas artroscópicas no ha modificado las indicaciones de la biopsia sinovial y está debe realizarse si resulta imposible hacer un diagnóstico mediante procedimientos tradicionales menos invasivos (Gerlag D, 2005). B ibliogr afía Bartunkova J, Tesar V, Sediva A. Diagnostic and pathogenic role of antineutrophil cytoplasmic autoantibodies. Rheumatology 2003;106:73-82. PubMed PMID: 12672398 Bridgen M. The erythrocyte sedimentation rate. Still a helpful test when used judiciously. Postgrad Med 1998;103:257-262. PubMed PMID: 9590999 Brouet JC, Clauvel JP, Danon F, Klein M, Seligmann M. Biologic and clinical significance of cryoglobulins. A report of 86 cases. Am J Med. 1974 Nov;57(5):775-88. PubMed PMID: 4216269 Dorwart BB, Schumacher HR. Joint effusions, chondrocalcinosis and other rheumatic manifestations in hypothyroidism. A clinicopathologic study. Am J Med 1975;59:780-790. PubMed PMID: 171946 Egner W. The use of laboratory tests in the diagnosis of SLE. J Clin Pathol 2000;53:424-432. PubMed PMID: 10911799 Ferri C, Zignego AL, Pileri SA. Cryoglobulins. J Clin Pathol 2002;55:4-13. PubMed PMID: 11825916 Texto completo Gerlag D, Tak PP. Synovial biopsy. Best Pract Res Clin Rheumatol 2005;19:387-400. PubMed PMID: 15939365 Krcy PR, Bailen DA. Synovial fluid leukocytosis. A study of extremes. Am J Med 1979;67:436-442. PubMed PMID: 474588 Lyon R, Sonale N. Effective use of autoantibody tests in the diagnosis of systemic lupus erythematosis. Ann N Y Acad Sci 2005;1050:217228. PubMed PMID: 16014537 Morley JJ. Kushner I. Serum C-reactive protein levels in disease. Ann N Y Acad Sci 1982;389:406-418. PubMed PMID: 6953917 Niewold TB, Harrison MJ, Paget SA. Anti-CCP antibody testing as a diagnostic and prognostic tool in rheumatoid arthritis. QJM 2007;100:193-201. PubMed PMID: 17434910 Texto completo Pasqual E, Jovani V. Synovial fluid analysis. Best Pract Res Clin Rheumatol 2005;19:371-386. PubMed PMID: 15939364 5 Reumatología Ratnoff WD. Inherited deficiencies of complement in rheumatologic diseases. Rheum Clin North AM 1996;22:1-21. PubMed PMID: 8907066 Sack KE. Joint aspiration and injection: a how-to guide. J Musculoskel Med 1999;16:419-427. Shmerling RH. Synovial fluid analysis. A critical appraisal. Rheum Dis Clin North Am 1994;20:503-512. PubMed PMID: 12006320 Texto completo Swan A, Amer H, Dieppe P. The value of synovial fluid assays in the diagnosis of joint disease: a literature survey. Ann Rheum Dis 2002;61:493-498. PubMed PMID: 12006320 Texto completo Tan EM, Feltkamp TE, Smolen JS, Butcher B, Dawkins R, Fritzler MJ et al. Range of antinuclear antibodies in”healthy” individuals. Arthritis Rheum. 1997 Sep;40(9):1601-11. PubMed PMID:9324014 Tan EM, Feltkamp TE, Smolen JS, Butcher B, Dawkins R, Fritzler MJ et al. Range of antinuclear antibodies in “healthy” individuals. Arthritis Rheum 1997;40:1601-1611 PubMed PMID: 9324014 Trampuz A, Hanssen AD, Osmon DR, Mandrekar J, Steckelberg JM, Patel R. Synovial fluid leukocyte count and differential for the diagnosis of prosthetic knee infection. Am J Med 2004;117:556-562. PubMed PMID: 15465503 Vossenaar ER, Smeets TJ, Kraan MC, Raats JM, van Venrooij WJ, Tak PP. The presence of citrullinated proteins is not specif for rheumatoid arthritis. Arthritis Rheum 2004;50:3485-3494. PubMed PMID: 15529392 Texto completo Walport MJ. Complement. First of two parts. N Engl J Med. 2001 Apr 5;344(14):1058-66. Review. PubMed PMID: 11287977 Teitsson I, Withrington RH, Seifert MH, Valdimarsson H. Prospective study of early rheumatoid arthritis. I. Prognostic value of IgA rheumatoid factor. Ann Rheum Dis. 1984 Oct;43(5):673-8. PubMed PMID: 6497459 Texto completo Withrington RH, Teitsson I, Valdimarsson H, Seifert MH. Prospective study of early rheumatoid arthritis. II. Association of rheumatoid factor isotypes with fluctuations in disease activity. Ann Rheum Dis. 1984 Oct;43(5):679-85. PubMed PMID: 6497460 Texto completo Zendman AJW, Van Venroij, Prujin GJM. Use and significance of anti-CCP autoantibodies in rheumatoid arthritis. Rheumatology 2006;45:2025. PubMed PMID: 16188946 Texto completo Zuber TJ. Knee joint aspiration and injection. Am Fam Physician 2002;66:1497-1507. PubMed PMID: 12408424 Texto completo 6 TEMA 2 Lumbalgia María Pastora Castro Dono; Grupo Fisterra ¿D e I qué habl amos? Hablamos de lumbalgia cuando un paciente refiere dolor, acompañado generalmente de tensión muscular, en la región lumbar, entre la parrilla costal y la región glútea inferior. Puede ser aguda o crónica (>12 semanas). Puede irradiarse a la pierna más abajo de la rodilla (ciática) o no (lumbalgia simple). Un tercio de la población tiene dolor lumbar a lo largo de 1 año y el 20% de ellos consultan a su médico de cabecera (NICE, 2009). Entre un 60-80% de las personas tiene dolor lumbar a lo largo de su vida. La lumbalgia aguda tiene buen pronóstico y generalmente se manifiesta como una entidad autolimitada (más del 90% se recuperan en 3-6 meses y más del 90% de las bajas duran menos de 2 meses) (Pengel LH, 2003; Koes B, 2006). En más del 85% de las personas no se encuentra una causa subyacente. Clasificar a los pacientes en: lumbalgia simple o irradiada, lumbalgia sospechosa y lumbalgia crónica puede ser el punto de partida para decidir el manejo y las pruebas de estudio indicadas. Hablamos de lumbalgia sospechosa en estas situaciones: nPrimer episodio ocurre antes de los 20 años o después de los 50. nDolor de características no mecánicas. nFiebre. nHistoria previa de cáncer. nTratamiento con esteroides. nInmunodepresión. nPérdida de peso. nSíntomas o signos de déficit neurológico. nTraumatismo previo. P ronóstico y derivación El dolor lumbar disminuye rápidamente en el primer mes tras el inicio, la mayoría de pacientes recuperan su nivel previo de dolor. Continúa decreciendo en los 3 meses siguientes y permanece estable a partir de ahí. Entre el 68% y el 86% de participantes volvieron al trabajo en el plazo de un mes. Entre 3-6 meses la recuperación laboral fue del 93% (Pengel LH, 2003). Aunque existe una gran heterogeneidad y poca concordancia en los resultados de los estudios sobre pronóstico de la lumbalgia, este listado resume algunos factores a tener en cuenta (Grupo COST B13, 2005; Enthoven P, 2006; Shelerud RA, 2006): nHaber sufrido episodios previos en los últimos 5 años. nSexo femenino. nEdad superior a 50 años. nPoco ejercicio físico. nDolor irradiado. nSigno de Lasègue positivo. nIncapacidad producida por el dolor al inicio del episodio. nProblemas laborales (conflictos, trabajos con altas demandas, baja satisfacción laboral, trabajos monótonos). nProblemas emocionales (depresión, ansiedad). En caso de que al inicio o a lo largo del proceso exista paresia progresiva, incontinencia de esfínteres o síndrome de cauda equina, debe derivarse al paciente con urgencia para su intervención quirúrgica. También debe considerarse la valoración quirúrgica en caso de (Grupo COST B13, 2005): nDolor intolerable de ≥6 semanas pese a tratamiento médico. nDolor que limita la deambulación y cede con reposo de ≥ 6 meses e imagen radiológica positiva. 7 Reumatólogía A lgoritmo 8 de manejo Lumbalgia ¿Q ué tr atamiento usar? Aunque aconsejar el aumento de la actividad física no ha demostrado que pueda prevenir el dolor de espalda en adultos sanos, tiene otros beneficios probados como la disminución del riesgo cardiovascular, la obesidad y la osteoporosis (USPSTF, 2005). No hay un tipo de ejercicio más recomendable que otro, elige el paciente el que más se adapta a sus características y posibilidades. Es recomendable informar al paciente sobre la lumbalgia basándonos en un modelo biopsicosocial. Explicar al paciente que la lumbalgia inespecífica no se debe a ninguna enfermedad grave y que si no hay signos que vayan a modificar el tratamiento no se precisan pruebas especiales (Henrotin YE, 2006; Grupo COST B13, 2005). La entrega de material informativo no es suficiente prevenir el absentismo y reducir costes de los cuidados de salud (Henrotin YE, 2006). ¿Reposo o actividad? Salvo en los primeros días en que el dolor puede ser severo e invalidante, no está indicado hacer reposo (NICE, 2009). Existen evidencias suficientes para afirmar que el reposo en cama es menos eficaz que cualquier otra alternativa terapéutica. Así pues, no debe recomendarse y debería limitarse a los pocos días en los que el paciente normalmente tiene dolor severo al moverse (generalmente menos de 4). Mantener el máximo de actividad posible (incluso su actividad laboral habitual) es beneficioso para los pacientes: mejoran más rápido los síntomas, disminuye el riesgo de paso a la cronicidad y se reduce el tiempo que están fuera del trabajo. En los pacientes con ciática, hay poca o ninguna diferencia entre la recomendación de reposo en cama y la de permanecer en actividad, entre el reposo en cama y los ejercicios o la fisioterapia y entre siete días de reposo en cama o dos a tres días. (Hagen KB, 2004). El tratamiento con ejercicios es efectivo para disminuir el dolor y mejorar la función en adultos con dolor lumbar crónico (Van Tulder MW, 2006). En el dolor lumbar subagudo (6-12 semanas) la base fundamental del tratamiento es la realización de ejercicio físico (Pérez Irazusta I, 2007). En el dolor lumbar agudo, el tratamiento con ejercicios es tan efectivo como otros tratamientos conservadores (Hayden JA, 2004). Fármacos Los analgésicos y los antiinflamatorios son útiles para aliviar el dolor y mejoran la capacidad funcional. Debemos pensar en ellos como agentes de alivio mientras la evolución natural permite la recuperación. Podemos usar Paracetamol a intervalos regulares (no a demanda). Si no fuera suficiente para controlar el dolor añadiremos Ibuprofeno y/o un opioide débil (Codeína o Tramadol a dosis bajas) (NICE, 2009; Pérez Irazusta I, 2007). Los ensayos clínicos con analgésicos en la lumbalgia aguda se hicieron con pocos pacientes, por lo que su beneficio podría ser mas discutible, por contra los antiinflamatorios tienen más efectos secundarios, aunque las pruebas de su eficacia son más contundentes (Koes B, 2006). No existen evidencias de la eficacia de los antidepresivos en la lumbalgia aguda. En la crónica pueden ser útiles aunque quizás sea más importante tomarse el tiempo suficiente para evaluar la existencia de problemas sociales, psicológicos o económicos y abordarlos. Podemos usar ISRS, son más seguros y mejor tolerados que los tricíclicos y tan eficaces como los nuevos antidepresivos. En pacientes con exacerbaciones importantes de lumbalgia crónica que no responden a Paracetamol o Ibuprofeno pueden usarse opioides, con preferencia Tramadol. Éstos deben usarse durante periodos cortos (<16 semanas) ya que su efecto a más largo plazo es incierto y con frecuencia se hace un mal uso de esta medicación (Martell BA, 2007). Existen evidencias que demuestran que los relajantes musculares son útiles en el dolor lumbar agudo sin que se hayan encontrado diferencias definitivas entre ellos. No tienen utilidad en la lumbalgia crónica. Deben usarse con precaución ya que tienen efectos secundarios importantes (inestabilidad, somnolencia, dependencia). No es aconsejable prolongar la duración del tratamiento más de una semana. Puede usarse Diazepam a dosis bajas, usando la mayor fracción por la noche o Ciclobenzaprina. No existen evidencias que demuestren la utilidad de las inyecciones de esteroides a ningún nivel. Además en algunos casos los efectos secundarios pueden ser importantes. Tampoco existen evidencias sobre la utilidad de la vitamina B, por lo que se desaconseja. Otros tratamientos Las escuelas de dolor lumbar (programas educativos que incluyen ejercicios) no tienen utilidad alguna en el dolor lumbar agudo. En el dolor crónico parece que los resultados son beneficiosos por disminuir el dolor y mejorar la capacidad funcional, a corto y medio plazo y en los sitios de trabajo. No existe ninguna evidencia de que prevengan el dolor de espalda en individuos sanos o con riesgo para el dolor de espalda (Heymans MW, 2003). Los acercamientos multidisciplinarios que incluyeron un componente psicológico tienen efectos positivos a corto plazo en la mejora del dolor y a largo plazo en vuelta al trabajo (Hoffman BM, 2007). 9 Reumatólogía Los programas multicomponentes que incluyen información, consejos posturales y ejercicios pueden ser útiles en las personas que sufren lumbalgia crónica. Existen ensayos clínicos que apoyan esas recomendaciones. No tienen utilidad en la lumbalgia aguda y parece razonable valorar su indicación a partir de las 6 semanas de la presentación del cuadro. Los tratamientos físicos (masajes, ultrasonidos, calor local y onda corta) se recomiendan habitualmente para aliviar el dolor agudo. Sin embargo no existen pruebas de que tengan efecto alguno sobre los resultados ni utilidad clara en el manejo de la lumbalgia crónica (French SD, 2005). Tampoco tienen efectos secundarios significativos. Tampoco la tracción es efectiva en ningún tipo de dolor. El uso de corsés u otro tipo de sujeción lumbar puede ser perjudicial por la atrofia muscular secundaria y no es útil en la lumbalgia. Existen numerosos ensayos clínicos sobre la manipulación en la lumbalgia simple con resultados contradictorios. Puede producir alivio del dolor y mejora de la satisfacción en los pacientes a corto plazo, con efectos discretos o nulos a medio plazo. No es mejor que los cuidados habituales en atención primaria (Koes B, 2006). En la lumbalgia crónica también puede disminuir el dolor, aunque esta mejoría es poco relevante clínicamente. No parece que tenga mayores complicaciones si la efectúa un individuo entrenado, aunque no debe realizarse en personas con algún tipo de déficit neurológico o dolor radicular. La tracción, continua o intermitente, no fue más efectiva para mejorar el dolor, la discapacidad o la ausencia al trabajo que el placebo (Clarke JA, 2007). Los ensayos clínicos realizados para evaluar la eficacia de la acupuntura son de baja calidad. En varias revisiones sistemáticas se encontró nula o dudosa evidencia que sustente su recomendación en el dolor crónico. Sin utilidad en el agudo (Furlan AD, 2003). La neurorreflexoterapia consiste en la implantación de varios dispositivos epidérmicos en puntos gatillo de la espalda y en el pabellón auricular. Parece una intervención segura y eficaz para el tratamiento del dolor lumbar crónico inespecífico, aunque los estudios fueron realizados por médicos específicamente adiestrados y experimentados. No se puede recomendar de forma generalizada, se necesitan más estudios en otros contextos (Urrútia G, 2009; Pérez Irazusta I, 2007). B ibliogr afía Clarke JA, van Tulder MW, Blomberg SEI, de Vet HCW, van der Heijden GJMG, Bronfort G. Tracción para el dolor lumbar con o sin ciática; 2007 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2006 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Resumen] Henrotin YE, Cedraschi C, Duplan B, Bazin T, Duquesnoy B. Information and low back pain management: a systematic review. Spine. 2006 May 15;31(11):E326-34. [PubMed] Enthoven P, Skargren E, Carstensen J, Oberg B. Predictive factors for 1-year and 5-year outcome for disability in a working population of patients with low back pain treated in primary care. Pain. 2006 May;122(1-2):137-44. [PubMed] French SD, Cameron M, Walker BF, Reggars JW, Esterman AJ. Calor o frío superficial para el dolor lumbar; 2005 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http:// www.update-software.com [Texto completo] Furlan AD, van Tulder MW, Cherkin DC, Tsukayama H, Lao L, Koes BW, Berman BM. Acupuntura y técnica de aguja seca para el dolor lumbar; 2003 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. [Resumen] Grupo Español de Trabajo del Programa Europeo COST B13. Guía de Práctica Clínica par la Lumbalgia Inespecífica [Internet]. European Commission COST B13, Fundación Kovacs; 2005 [acceso 15/01/2010]. Disponible en: http://www.webdelaespalda. org/cientifica/guias/guiascost.asp Hagen KB, Hilde G, Jamtvedt G, Winnem M. Reposo en cama para el dolor lumbar y la ciática agudos; 2004 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2009 Número 4. Oxford: Update Software Ltd. Disponible en: http://www. update-software.com [Texto completo] Hayden JA, Tulder MW van, Malmivaara A, Koes BW. Tratamiento con ejercicios para el dolor lumbar inespecífico; 2004 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. [Resumen] Heymans MW, van Tulder MW, Esmail R, Bombardier C, Koes BW Escuelas de espalda para el dolor lumbar inespecífico; 2003 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2009 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Texto completo] Hoffman BM, Papas RK, Chatkoff DK, Kerns RD. Meta-analysis of psychological interventions for chronic low back pain. Health Psychol. 2007 Jan;26(1):1-9. [PubMed] Koes B, van Tulder M. Low back pain (acute). Clin Evid. 2006 Jun;(15):1619-33. [Acceso] Martell BA, O’Connor PG, Kerns RD, Becker WC, Morales KH, Kosten TR, Fiellin DA. Systematic review: opioid treatment for chronic back pain: prevalence, efficacy, and association with addiction. Ann Intern Med. 2007 Jan 16;146(2):116-27. [PubMed] Pengel LH, Herbert RD, Maher CG, Refshauge KM. Acute low back pain: systematic review of its prognosis. BMJ. 2003 Aug 9;327(7410):323. [PubMed] 10 Lumbalgia Pérez Irazusta I et al. Caso Martinez J. Guía de Práctica Clínica sobre Lumbalgia. Vitoria-Gasteiz; Osakidetza; 2007. GPC 2007/1 [Texto completo] Schnitzer TJ, Gray WL, Paster RZ, Kamin M. Efficacy of Tramadol in treatment of chronic low back pain. J Rheumatol 2000;27:772?778 [PubMed] Shelerud RA. Epidemiology of occupational low back pain. Clin Occup Environ Med. 2006;5(3):501-28, [PubMed] Tulder MW van, Touray T, Furlan AD, Solway S, Bouter LM. Miorrelajantes para el tratamiento del dolor lumbar inespecífico; 2002 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Resumen] Urrútia G, Burton AK, Morral A, Bonfill X, Zanoli G. Neurorreflexoterapia para el tratamiento del dolor lumbar inespecífico; 2009 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2009 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Resumen] U.S. Preventive Services Task Force. Primary care interventions to prevent low back pain in adults: recommendation statement. Am Fam Physician. 2005 Jun 15;71(12):2337-8. [PubMed] [Texto completo] Van Tulder MW, Koes B. Low back pain (chronic). Clin Evid. 2006 Jun;(15):1634-53. [PubMed] Van Tulder MW, Scholten RJPM, Koes BW, Deyo RA. Non-steroidal anti-inflammatory drugs (NSAIDs) for non-specific low back pain; 2007. In: The Cochrane Library, Issue 1, 2009. Oxford: Update Software. [Resumen] Componentes del grupo Redactores Fisterra Emilio Casariego Vales. Especialista en Medicina Interna. Complexo Hospitalario Xeral-Calde de Lugo. Mª del Carmen Castiñeira Pérez. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyC- SAP de Fingoy - Lugo. Carmen Costa Ribas. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyC- SAP de Fingoy - Lugo. Carlos González Guitian. Bibliotecario. Biblioteca del Complejo Hospitalario Universitario A Coruña (CHUAC). Arturo Louro González. Especialista en Medicina Familiar y Comunitaria - Tutor de atención primaria de la UD de MFyC- SAP de Cambre - A Coruña. Cristina Viana Zulaica. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyC- SAP de Elviña-Mesoiro - A Coruña. Patricia Vázquez Millán. Especialista en Medicina Familiar y Comunitaria - Servizo Galego de Saúde - A Coruña- España [miembro del grupo desde 1/2008]. María Consuelo Naya Cendón. Especialista en Medicina Familiar y Comunitaria - Colaboradora docente de atención primaria de la UD de MFyC- PAC de Culleredo - A Coruña- España [miembro del grupo desde 9/2008]. Constituido como grupo en 2003 dentro de la Red Temática de Investigación sobre Medicina Basada en la Evidencia (Expediente FIS: G03/090) y reconocido por la Consellería de Innovación e Industria de la Xunta de Galicia dentro del Plan Galego de Investigación, Desenvolvemento e Innovación Tecnolóxica - INCITE (2006-2010) con una ayuda para consolidación y estructuración de unidades de investigación competitivas del sistema gallego de I+D+I. Código INCITE08ENA917089ES, resolución de la Consellería de Innovación e Industria del 9 de octubre de 2008. 11 TEMA 3 I Cristina Viana Zulaica ¿Q ué Fibromialgia es? La fibromialgia (FM) es un problema crónico de etiología desconocida. Los pacientes afectados presentan dolor musculoesquelético crónico y generalizado, una reducción del umbral del dolor y múltiples puntos sensibles de localización característica. El dolor no puede ser explicado por la presencia de trastornos degenerativos o inflamatorios. Hay una serie de características asociadas como mala calidad del sueño, rigidez matutina, cansancio, depresión, ansiedad, cefalea, hábito intestinal irregular, dolor abdominal difuso, parestesias y sensación subjetiva de hinchazón. Es un problema muy frecuente, tiene una prevalencia del 2% en la población general. Ocupa el 15% de las consultas de reumatología y del 5 al 10% de las consultas de atención primaria. Es más frecuente en mujeres con una relación hombre mujer de 1 a 6–10. La prevalencia mayor es a la edad de 30-50 años, puede afectar a niños y a personas mayores. Aproximadamente en la mitad de las ocasiones la FM se presenta después de un acontecimiento específico, un trauma físico o emocional o después de una enfermedad similar a la gripe. Se puede asociar a artritis reumatoide, lupus eritematoso, osteoartritis y síndrome de Sjögren. No es raro que afecte a varios miembros de una misma familia (Goldenberg DL, 2007; Provenza, 2004). La patogenia de la enfermedad es desconocida. Se ha investigado sobre la hipótesis de la existencia de una hiperexcitabilidad central y periférica, la percepción alterada para el dolor, la temperatura y la somatización (Carville SF, 2007). Los datos existentes sugieren que los síntomas de la FM probablemente procedan de una alteración central de la sensibilidad al dolor más que una disfunción en los tejidos periféricos (Abeles AM, 2007). Se ha encontrado que las personas afectadas por FM tienen una concentración de sustancia P en el LCR que es superior a los controles (Goldenberg DL, 2004). A pesar de que los factores psicológicos tienen una gran influencia en la expresión clínica de la FM y de los problemas asociados, no se considera adecuada su inclusión en el grupo de alteraciones mentales comunes (Henningsen P, 2003). ¿C ómo se diagnostica? La FM se presenta con dolor difuso y crónico, la descripción del dolor es variable (quemante, punzante, como un peso o como un golpe), es frecuente la referencia a una mayor percepción del dolor con el frío, con los cambios en la temperatura, humedad ambiental, tensión emocional o esfuerzos físicos. Para el diagnóstico de la FM se requiere la presencia de dolor crónico (>6 semanas), generalizado (3 de los 4 cuadrantes del cuerpo) inexplicable por otros motivos. Para clasificar a estos pacientes y seleccionarlos para estudios clínicos se utilizan los criterios establecidos en el año 1990 por la Academia Americana de Reumatología (Wolfe F, 1989-1990): Fig 1. Puntos dolorosos Dolor a la presión en 11 de los 18 puntos gatillos a ambos lados del cuerpo. El dolor se considera generalizado cuando está presente en cada una de las localizaciones siguientes: en el lado izquierdo del cuerpo, en el lado derecho del cuerpo, sobre la cintura y bajo la cintura. Además hay dolor axial cervical o en la parte 13 Reumatólogía anterior del tórax o en la columna torácica o lumbar. El dolor en los hombros y en nalgas se considera por cada uno de los segmentos afectados. El dolor lumbar se considera afectación del segmento inferior. El dolor es de evolución crónica con una duración mínima de tres meses y se acompaña de otras alteraciones como cansancio, alteraciones del sueño, ansiedad y depresión. Hay dolor a la presión en 11 de los 18 puntos gatillos situados en los siguientes lugares a ambos lados del cuerpo (Wolfe F, 1989-1990): nOccipucio: en la inserción de ambos músculos suboccipitales. nCervical bajo: en la parte anterior de los espacios intertransversos C5-C7. nTrapecio: en los puntos medios del borde superior. nSupraespinoso: sobre la espina de la escápula próximo al borde medial. nSegunda costilla: en la segunda unión condroesternal. nEpicóndilo lateral: 2 cm. distal del epicóndilo. nGlúteo: cuadrantes superiores externos de las nalgas. nTrocánter mayor: posteriores a las prominencias trocantéreas. nRodilla: en las almohadillas grasas próximas a la línea articular interna. Los criterios de clasificación descritos tienen una sensibilidad y especificidad próxima al 80% para distinguir la FM de otras causas de dolor músculo esquelético crónico y son los que se usan de manera habitual en la clínica y en la investigación (Carville SF, 2007). En la práctica se puede hacer el diagnóstico de FM sin tener el número de puntos sensibles recomendados. Desafortunadamente no existe ninguna prueba de tipo analítico o histológico patognomónica para el diagnóstico, ni se han propuesto criterios de exclusión (Goldenberg DL, 2007). La exploración de los puntos sensibles se realiza usando el primer dedo de la mano del examinador ejerciendo una presión con la fuerza necesaria para apretar una goma de borrar o para que el dedo pulgar se ponga de color blanco. El criterio de respuesta en 11 de los 18 puntos se recomienda como propuesta de clasificación, pero no se considera esencial para el diagnóstico (Wolfe F, 1990). Se puede utilizar la presión sobre la región media del brazo o la frente como puntos de control. Descripción de síntomas asociados (Hannonen P, 2007): nCansancio, sueño no reparador, sensibilidad general debida a una bajo umbral para los estímulo nociceptivos. nSíntomas psicosimáticos que afectan a varios órganos, síndrome del colon irritable, síntomas cardíacos, vejiga irritable, lipotimia, inestabilidad, tos irritativa, problemas ginecológicos e intolerancia farmacológica múltiple. nSíntomas neurológicos (adormecimiento de los dedos, pinchazos, tensión muscular y cefalea tensional). nAlteraciones mentales (ansiedad y depresión, es rara la depresión severa). nProblemas cognitivos (incapacidad para concentrarse, dificultad para aprender). nSensación subjetiva de edema. nHiperlaxitud (presente el 30-50% de los pacientes). nTendencia a ruborizarse (eritema fugax) limitado a la parte superior del cuerpo. nSíntomas que varían con cambios de tiempo, con el nivel de ansiedad y la tensión psíquica. nLa FM no es un problema separado sino una combinación de síntomas y hallazgos que se pueden atribuir a diferentes mecanismos. No existen pruebas complementarias, tanto de laboratorio como de imagen que tengan utilidad diagnóstica para la FM, excepto cuando existen enfermedades concomitantes. Se consideran datos elementales para el diagnóstico: nHistoria clínica completa y diagnóstico diferencial. nEvaluación del dolor, su intensidad, grado de afectación y localización. Presencia de astenia, trastornos del sueño y del estado de ánimo. nExamen físico general que incluya evaluación de puntos sensibles. Es recomendable realizar una exploración articular y neurológica. Valorar la necesidad de evaluación psicológica y funcional. nPruebas de laboratorio que incluya hematología, VSG, enzimas musculares, pruebas hepáticas y función tiroidea. nValorar la presencia de enfermedades que mimetizan una FM como hipotiroidismo, espondilitis anquilopoyética, o que se pueden asociar a la FM como tendinitis, lupus eritematoso diseminado, artritis reumatoide u osteoartritis. nNo se considera necesario realizar pruebas de laboratorio que pueden producir confusión. Por ejemplo la pre- valencia del los anticuerpos antinucleares (ANA) en personas sanas es importante, de tal manera que el valor 14 Fibromialgia predictivo positivo de la prueba en un paciente sin los síntomas y los signos de lupus eritematoso sistémico es baja (Goldenberg DL, 2007). nDerivar para evaluación psicológica si se considera necesario (Buckhardt CS, 2005). ¿Q ué diagnóstico diferencial? Entidades con las que se debe realizar diagnóstico diferencial: nSíndrome del dolor miofascial. nReumatismo articular que afecte a varias áreas. nPolimialgia reumática o arteritis de células gigantes. nPolimiositis o dermatopolimiositis. nMiopatías endocrinas, hipotiroidismo, hipertiroidismo. nHiperparatiroidismo insuficiencia adrenal. nMiopatía metabólica por alcohol. nEnfermedades somatomorfes y trastornos de somatización. nNeoplasias. nEnfermedad de Parkinson. nEfectos secundarios de fármacos: estatinas, esteroides, cimetidina, fibratos, drogas de consumo. Dentro de las enfermedades a incluir en el diagnóstico diferencial es preciso destacar el síndrome de dolor miofascial por su similitud con la fibromialgia, en la zona afectada existen puntos sensibles (trigger points), nódulos dolorosos y/o bandas musculares palpables. Existe también una zona de dolor profundo de referencia que se agrava por la presión en los puntos sensibles, que se localiza a distancia de dichos puntos (Chakrabarty S, 2005; Goldenberg DL, 2007; Provenza JR, 2004). ¿C ómo se tr ata? Hay unos aspectos básicos que se consideran de gran importancia: realizar el diagnóstico lo antes posible, evitar la solicitud de pruebas complementarias innecesarias y hacer una aproximación biopsicosocial (Hannonen P, 2007). Los objetivos del tratamiento son aliviar el dolor, mantener o restablecer el equilibrio emocional, mejorar la calidad del sueño, la capacidad física, la astenia y los problemas asociados (Provenza JR, 2004). Información al paciente Muchos pacientes tienen el problema muchos años antes de que se realice el diagnóstico, han consultado con varios profesionales y se les han realizado pruebas diagnósticas, pueden llegar a sentirse rechazados por la profesión médica y con la idea de estar sufriendo una enfermedad grave que amenace su vida (Goldenberg DL, 2007). Por ello es importante proporcionar la máxima información al paciente y a su familia, asegurarle que los síntomas son reales y no producto de la imaginación. Se intentará que asuma una actitud positiva frente a los síntomas y las propuestas terapéuticas. Debe realizarse una aproximación centrada en el paciente (Muñoz Álamo M, 2002; Raymond MC, 2000) que nos permita conocer y reconvertir las concepciones falsas sobre las causas del dolor y el cansancio y los temores sobre los efectos en la capacidad funcional (Hannonen P, 2007), se insistirá en el carácter benigno del problema y la improbable aparición de deformación o deterioro físico, sobre la posibilidad de evolucionar con altibajos y que no se verá incapaz de llevar una vida normal y activa (Goldenberg DL, 2007). Tratamiento farmacológico nAntidepresivos tricíclicos (ADT) Amitriptilina: La administración de una dosis baja (de 10 a 25 mg) de amitriptilina por la noche, mejora la calidad del sueño, el bienestar global y el dolor musculares en el 25-45% de los pacientes tratados (Haüser W, 2009; Uçeyler N, 2008; Anold LM, 2000; O Malley, 2000). No hay datos sobre los efectos de los ADT durante períodos de tiempo superiores a 8 semanas (Nishishinya B, 2008) . Se propone comenzar con dosis bajas e incrementar en función de los resultados (GoldenbergDL, 2007-2005; Hannonen P, 2007; Buckhardt CS, 2005; Maizels M, 2005; Yousefi P, 2005). Ciclobenzaprina: Fármaco utilizado como relajante muscular, con la misma estructura que los anti- depresivos tricíclicos, sin efectos antidepresivos. A dosis de 10-30 mg administrado 2-4 horas antes de acostarse mejora la astenia, el cuadro doloroso y en mayor medida el sueño con un NNT de 4.8 (Tofferi JF, 2004; Buckhardt CS, 2005; Maizels M, 2005; Hannonen P, 2007). Hay autores que 15 Reumatólogía recomiendan su utilización en tomas repartidas 1, 2 ó 3 veces por día con una dosis máxima de 40 mg día (Goldenberg DL, 2007). La amitriptilina y la ciclobenzaprina son los fármacos sobre los que se dispone de evidencias más fuertes sobre eficacia en la FM. Hay estudios que demuestran las ventajas de la asociación de los ISRS tanto con la amitriptilina como con la ciclobenzaprina (Goldenberg DL, 1996). nInhibidores selectivos de la recaptación de serotonina (ISRS) Los ISRS se pueden utilizar en la FM en toma matutina y dosis personalizada para el tratamiento de la depresión (Buckhardt CS, 2005). Hay estudios en los que se compara la Fluoxetina, la Fluvoxamina, la Paroxetina, el Citalopram y la Sertralina con placebo y algunos entre sí, con resultados favorables en intensidad de dolor, la astenia y el sueño, excepto el citalopram. Asociados a los tricíclicos mejoran el dolor, el sueño y producen bienestar global (Provenza JR, 2004). Los inhibidores de la recaptación de serotonina y norepinefrina y los ISRS de efecto dual como la Venlafaxina han demostrado ser eficaces (Hannonen P, 2007) en dosis altas, no en dosis bajas; la Duloxetina ha demostrado ser eficaz en un número elevado de variables, como el dolor y la sensación subjetiva de bienestar, en ensayos clínicos de buena calidad (Mease PJ 2008; Goldenberg DL, 2007), sus efectos secundarios son menos intensos que los de la amitriptilina, su coste mucho más alto (Russell IJ, 2005). nAntiinflamatorios no esteroideos En los pocos estudios disponibles no se ha demostrado efectividad en el tratamiento de los síntomas de la FM motivo por el que no se recomienda su utilización rutinaria, sin embargo, pueden ser útiles asociados a otros fármacos que actúan sobre el SNC como la ciclobenzaprina (Buckhardt CS, 2005; Hannonen P, 2007; Carville SF, 2007; Goldenberg DL, 2007). nAnalgésicos El Tramadol a dosis de 50-100 mg cada 6 u 8 horas mejora los síntomas dolorosos y funcionales en la FM (Furlan AD, 2006; Yousefi P, 2005). Tanto el inicio como la retirada deben ser graduales. El Tramadol asociado a Paracetamol en dosis de 37,5/325 demostró ser más eficaz que el placebo (Buckhardt CS, 2005; Goldenberg DL, 2007). Se desconoce la eficacia y la tolerabilidad del tramadol a largo plazo. nAnticonvulsivantes Gabapentina: en un ensayo clínico, los pacientes tratados con gabapentina tuvieron mejores resulta- dos que los del grupo control. Los efectos secundarios más frecuentes son la somnolencia, el mareo y la ganancia ponderal (Arnold LM, 2007; Goldenberg DJ, 2007). Pregabalina: anticonvulsivante de segunda generación, en un ensayos clínicos comparado con placebo se ha visto su utilidad para el tratamiento de la FM, para reducir el dolor, mejorar el sueño, el cansancio y la calidad de vida relacionada con la salud, sobre todo en el grupo que recibió dosis más altas, 450 mg/ día (Goldenberg DL, 2007; Maizels M, 2005; Crofford LJ, 2005). La FDA ha incluido la fibromialgia entre las indicaciones del tratamiento de la pregabalina (FDA, 2007). Clonazepan: puede ser útil en pacientes que tienen mioclonias nocturnas o realizan movimientos repetitivos con las piernas durante la noche y que responden a dosis bajas de benzodiazepinas. Los pacientes con mioclonia nocturna o síndrome de apnea del sueño deben ser remitido al segundo nivel (Goldenberg DL, 2007). nOtros Fármacos y sustancias que ha sido utilizados o investigados para su uso en la FM que no se consideran válidos en la actualidad por no haber pruebas sobre su efectividad o por sus efectos secundarios: Carisoprodol, oxibato de sodio, hormona del crecimiento, dihidroepiandrosterona, corticosteroides, hormona tiroidea, opiáceos, 5-hydroxytryptamine, melatonina, calcitonina, guaifenesina, magnesio (Alegre de Miguel, 2005; Goldenberg DL, 2004; Bennett, 98). Fármacos en proceso de investigación: Antagonistas de los receptores de la serotonina 5-HT3: tropise- tron y ritanserina, agonista de la dopamina: pramipexol. El mal cumplimiento terapéutico fue una causa importante de falta de respuesta en un estudio observacional realizado en 117 mujeres en las que el 47% no seguían el tratamiento. En estos casos era determinante la presencia de una mala comunicación entre el profesional y el paciente durante la consulta (Sewitch MJ, 2004). Tratamiento no farmacológico El tratamiento no farmacológico pretende mejorar la habilidad funcional y la calidad de vida del paciente. Se insiste una vez mas en la necesidad de proporcionar una información básica sobre la enfermedad y las opciones de tratamiento, enseñar el 16 Fibromialgia manejo de dichas opciones y animar a la realización de programas de autoayuda en los casos necesarios. Los tratamiento no farmacológicos evaluados en estudios controlados incluyen: fortalecimiento muscular, terapia física, biofeedback con electromiografía, hipnoterapia y terapia cognitivo conductual (TCC) (Goldenberg DL, 2007; Buckhardt CS, 2005). nActividad física Los programas de ejercicios supervisados tienen efectos beneficiosos sobre la capacidad física y los síntomas de la FM a corto plazo (Busch AJ, 2007). Los mejores resultados se obtienen con programas personalizados, con actividad física realizada 2 ó 3 veces por semana, de inicio gradual y evitando los ejercicios que produzcan dolor por forzar una zona determinada, sobre todo en los individuos con hiperlaxitud. La actividad física más adecuada es la aeróbica como la gimnasia, la danza, la natación y la hidrogimansia. Una caminata diaria de 30 minutos proporciona efectos terapéuticos. Se deben eliminar todos los factores que alteran la calidad del sueño (Hannonen P, 2007; Goldenberg DL, 2007-2004; Rooks DS, 2007; Yousefi P, 2005; Rossy LA, 1999). nTerapia cognitivo conductual La terapia cognitivo conductual se basa en la idea de que la percepción de la persona sobre si misma y sobre lo que le rodea afecta a las emociones y al comportamiento. El objetivo de la terapia es cambiar la idea sobre el dolor, lo que permite tener una actitud positiva frente a la enfermedad. Hay evidencias muy coherentes en los resultados de los tratamientos con terapia cognitivo conductual en la FM. Disminuye la intensidad del dolor y el cansancio y mejora el ánimo y la capacidad funcional (Goldenberg DL, 2004; Rossy LA, 1999). nRetroalimentación Los ensayos clínicos realizados sobre los efectos del biofeedback demostraron respuestas positivas en relación con el dolor, el entumecimiento matutino, los puntos sensibles y la depresión. El biofeedback es un proceso educativo en el que se combina la tecnología y los métodos de retroalimentación con el objetivo de que cada persona conozca sus respuestas fisiológicas a diversos estímulos, con la posibilidad de modificarlas a su favor y con la práctica aprender a controlarlas mejor (Goldenberg DL, 2007; Yousefi P, 2005). nOtros La hipnoterapia y la meditación basada en la relajación son procedimientos que tienen resultados positivos en estudios con personas afectadas por FM, cuando se evalúa la calidad de vida sin que se haya podido demostrar que mejoran el dolor y la capacidad funcional (Goldenberg DL, 2007). Se han estudiado otros procedimientos como la inyección en puntos sensibles, la estimulación nerviosa transcutánea, el tratamiento con láser y la acupuntura en personas con FM que no han podido demostrar eficacia (Goldenberg DL, 2007). ¿Q ué pronóstico? La mayoría de los pacientes continuarán con dolor y cansancio, según las conclusiones de los estudios de seguimiento a 14 años. Las dos terceras partes aseguran que pueden mantener su capacidad de trabajo y reconoce que la FM interfiere poco en su vida, otro treinta por ciento no se siente capacitado para trabajar. Si se compara a los pacientes con FM con otros grupos de personas con dolor crónico, el grupo de FM presenta un porcentaje mayor de sensación de incapacidad y de invalidez. Hay una serie de factores psicológicos que se asocian a un pronóstico mejor: sentimiento de control del dolor, no sentirse incapacitado, no interpretar el dolor como un signo de daño, la realización de ejercicio físico y de tareas rutinarias o rítmicas (Goldenberg DL, 2007). B ibliogr afía Abeles AM, Pillinger MH, Solitar BM, Abeles M. Narrative review: the pathophysiology of fibromyalgia. Ann Intern Med. 2007 May 15;146(10):726-34. [PubMed] [Texto completo] Alegre de Miquel C, Alejandra-Pereda C, Betina-Nishishinya M, Rivera J. Revisión sistemática de las intervenciones farmacológicas en la fibromialgia. Med Clin (Barc). 2005 ;125(20):784-7 [PubMed] Arnold LM, Goldenberg DL, Stanford SB, Lalonde JK, Sandhu HS, Keck PE Jr et al. Gabapentin in the treatment of fibromyalgia: a randomized, double-blind, placebo-controlled, multicenter trial. Arthritis Rheum 2007; 56:1336 [PubMed] [Texto completo] Arnold LM, Keck PE Jr, Welge JA. Antidepressant treatment of fibromyalgia. A meta-analysis and review. Psychosomatics. 2000 MarApr;41(2):104-13 [PubMed] Arnold LM, Lu Y, Crofford LJ, Wohlreich M, Detke MJ, Iyengar S, Goldstein DJ. A double-blind, multicenter trial comparing duloxetine with placebo in the treatment of fibromyalgia patients with or without major depressive disorder. Arthritis Rheum. 2004 Sep;50(9):2974-84 [PubMed] [Texto completo] Bennett RM, Clark SC, Walczyk J. A randomized, double-blind, placebo-controlled study of growth hormone in the treatment of fibromyalgia. Am J Med. 1998 Mar;104(3):227-31 [PubMed] Bennett RM, Schein J, Kosinski MR, Hewitt DJ, Jordan DM, Rosenthal NR. Impact of fibromyalgia pain on health-related quality of life before and after treatment with tramadol/acetaminophen. Arthritis Rheum. 2005 Aug 15;53(4):519-27. [PubMed] 17 Reumatólogía Buckhardt CS, Goldenberg D, Crofford L, Gerwin R, Gowens S, Jackson K, Kugel P, McCarberg W, Rudin N, Schanberg L, Taylor AG, Taylor J, Turk D. Guideline for the management of fibromyalgia syndrome pain in adults and children [Internet]. Glenview (IL): American Pain Society (APS); 2005. 109 p. (Clinical practice guideline; no. 4) [acceso 16/02/2009]. Disponible en http://www.guideline.gov Busch AJ, Barber KAR, Overend TJ, Peloso PMJ, Schachter CL. Ejercicio para el tratamiento del síndrome de fibromialgia; 2007 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 1. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 Issue 1. Chichester, UK: John Wiley & Sons, Ltd.). [Texto completo] Carville SF, Arendt-Nielsen S, Bliddal H, Flotman F, Branco JC, Buskila D, Da Silva J AO, Danneskiold-Samsoe B, Dincer F, Henriksson, C, Heniksson K, Kosek E, Longley K, McCarthy GM, Perrot S, Puszczewicz M J, Sarzi-Puttini P,. Silman A, Späth and Choy EH. Eular Evidence based recommendations for the management of fibromyalgia syndrome. Ann Rheum Dis 2008 Apr;67(4):536-41 [PubMed] Crofford LJ, Rowbotham MC, Mease PJ, Russell IJ, Dworkin RH, Corbin AE, Young JP Jr, LaMoreaux LK, Martin SA, Sharma U; Pregabalin 1008-105 Study Group. Pregabalin for the treatment of fibromyalgia syndrome: results of a randomized, doubleblind, placebo-controlled trial. Arthritis Rheum. 2005 Apr;52(4):1264-73. [PubMed] [Texto completo] Crofford LJ. Pain management in fibromyalgia. Curr Opin Rheumatol. 2008 May;20(3):246-50.PMID: 18388513 [PubMed] Chakrabarty S, Zoorob R. Fibromyalgia. Am Fam Physician. 2007 Jul 15;76(2):247-54. [PubMed] FDA. U.S. Food and Drug Administration. Label aproved Lyric [FDA; 2007] [Acceso 16/02/2009] Disponible en: http://www.fda.gov/ cder/foi/label/2007/021446s010lbl.pdf Furlan AD, Sandoval JA, Mailis-Gagnon A, Tunks E. Opioids for chronic non cancer pain: a meta-analysis of effectiveness and side effects. CMAJ.2006;174(11):1589-94. PMID: 16717269 [PubMed] [Texto completo] Goldenberg DL, Mayskiy M, Mossey C, Ruthazer R, Schmid C. A randomized, double-blind crossover trial of fluoxetine and amitriptyline in thetreatment of fibromyalgia. Arthritis Rheum. 1996 Nov;39(11):1852-9 [PubMed] Goldenberg DL, Burckhardt C, Crofford L. Management of fibromyalgia syndrome. JAMA. 2004 Nov 17;292(19):2388-95. [PubMed] Goldenberg DL. Clinical manifestations and diagnosis of fibromyalgia in adults. [Internet]. Massachusetts: Uptodate Waltham; 2008 [acceso 2/5/2008]. Disponible en: http://www.uptodate.com Goldenberg DL. Differential diagnosis of fibromyalgia. [Internet]. Massachusetts: Uptodate Waltham; 2008 [acceso 2/5/2008]. Disponible en: http://www.uptodate.com Goldenberg DL. Treatment of fibromyalgia in adults. [Internet]. Massachusetts: Uptodate Waltham; 2008 [acceso 2/5/2008]. Disponible en: http://www.uptodate.com Häuser W, Bernardy K, Uçeyler N, Sommer C. Treatment of fibromyalgia syndrome with antidepressants: a meta-analysis. JAMA. 2009 Jan 14;301(2):198-209. [PubMed] Henningsen P, Zimmermann T, Sattel H. Medically unexplained physical symptoms, anxiety, and depression: a meta-analytic review. Psychosom Med. 2003;65(4):528-33. [PubMed] [Texto completo] Hannonen P. Fimbromyalgia 2007. ebm00395 (020.082). [Internet]. Duodecim Medical Pubications Ltd. [acceso 16/02/2009]. Disponible en http://ebmg.wiley.com/ebmg/ltk.koti Maizels M, Mccarberg B. Antidepressants and Antiepileptic Drugs for Chronic Non-Cancer Pain. Am Fam Physician 2005;71:483-90. [PubMed] [Texto completo] Mease PJ, Russell IJ, Arnold LM, Florian H, Young JP Jr, Martin SA, Sharma U. A randomized, double-blind, placebo-controlled, phase III trial of pregabalin in the treatment of patients with fibromyalgia. J Rheumatol. 2008 Mar;35(3):502-14. [PubMed] Muñoz Álamo M, Ruiz Moral RR, Perula de Torres LA. Evaluation of a patient-centered approach in generalized musculoskeletal chronic pain/fibromyalgia patients in primary care. Patient Educ Couns. 2002;48:23-31. [PubMed] Nishishinya B, Urrutia G, Walitt B, Rodriguez A, Bonfill X, Alegre C et al. Amitriptyline in the treatment of fibromyalgia: a systematic review of its efficacy. Rheumatology (Oxford). 2008 Dec;47(12):1741-6 [PubMed] O’Malley, PG, Balden E, Tomkins G, Santoro J, Kroenke K, Jackson JL.Treatment of fibromyalgia with antidepressants: a meta-analysis. J Gen Intern Med. 2000 Sep;15(9):659-66 [PubMed] [Texto completo] Provenza JR, Pollak DF, Martinez JE, Paiva ES, Helfenstein M, Heymann R, Matos JMC, Souza EJR. Fibromialgia, Projeto diretrizes, Sociedade Brasileña de Reumatología. [Internet]. Associação Médica Brasileira e Conselho Federal de Medicina; 2004 [acceso 16/02/2009]. Disponible en http://www.projetodiretrizes.org.br/ Raymond MC, Brown JB.Experience of fibromyalgia. Qualitativ study. Can Fam Physician 2000; 46:1100-1106 [PubMed] Rooks DS, Gautam S, Romeling M, Cross ML, Stratigakis D, Evans B, Goldenberg DL, Iversen MD, Katz JN. Group exercise, education, and combination self-management in women with fibromyalgia: a randomized trial. Arch Intern Med. 2007 Nov 12;167(20):2192200. [PubMed] Rossy LA, Buckelew SP, Dorr N, Hagglund KJ, Thayer JF, McIntosh MJ, Hewett JE, Johnson JC. A meta-analysis of fibromyalgia treatment interventions.Ann Behav Med. 1999 Spring;21(2):180-91. [PubMed] Russell IJ, Mease PJ, Smith TR, Kajdasz DK, Wohlreich MM, Detke MJ, Walker DJ, Chappell AS, Arnold LM. Efficacy and safety of duloxetine for treatment of fibromyalgia in patients with or without major depressive disorder: Results from a 6-month, randomized, double-blind, placebo-controlled, fixed-dose trial. Pain. 2008 Jun;136(3):432-44 [PubMed] Sewitch MJ, Dobkin PL, Bernatsky S, et al. Medication non-adherence in women with fibromyalgia. Rheumatology (Oxford) 2004; 43:648. [PubMed] [Texto completo] Tofferi JK, Jackson JL, O’Malley PG. Treatment of fibromyalgia with cyclobenzaprine: A meta-analysis. Arthritis Rheum. 2004;51(1):913. [PubMed] [Texto completo] University of Birmighan. Horizon Scanning Review.National Horizont Scanning Centre. Duloxetina for Fibromyalgia. 2005. [Internet] [acceso 3/5/2008]. Disponible en: http://www.pcpoh.bham.ac.uk/publichealth/horizon/ Uçeyler N, Häuser W, Sommer C. A systematic review on the effectiveness of treatment with antidepressants in fibromyalgia syndrome. Arthritis Rheum. 2008 Sep 15;59(9):1279-98 Wolfe F. Fibromyalgia:The Clinical Syndrome. Rheum Dis Clin North Am 1989; 15:1-18 [PubMed] Wolfe F, Smythe HA, Yunus MB, Bennett RM, Bombardier C, Goldenberg DL et al. The american college of rehumatology 1990 criteria for the classification of fibromyalgia. Eport of the Multicente Criteria Committee. Arthritis Rheum 1990;33: 160-172 [PubMed] Yousefi P, Coffey J. Clinical inquiries. For fibromyalgia, which treatments are the most effective?. J Fam Pract. 2005 Dec;54(12):10945. [PubMed] 18 TEMA 4 Carlos Rodríguez Pago. ¿Q ué I Síndrome de túnel carpiano es y a qué puede deberse ? El síndrome del túnel carpiano (STC) es la neuropatía por atrapamiento más frecuente. Deriva de la compresión del nervio mediano al nivel de la muñeca. Es más frecuente en el sexo femenino 2:1, entre los 40 y 60 años con otro pico alrededor de los 75 y con claro componente ocupacional (Tanaka S, 1994; Bland JD, 2003). Los síntomas son bilaterales en el 50% de los pacientes. El síndrome de túnel carpiano es la principal causa de acroparestesias de la extremidad superior. Puede estar causado por: n Causa idiopática (degeneración hipertrófica del ligamento anular no específica), hasta un 50% de casos. n Traumas y microtraumas (fracturas mal consolidadas, fracturas de Colles, callosidades, obreros de máquinas neumáticas, amas de casa, ...) n Artritis inflamatorias: artritis reumatoide, lupus, ... n Artritis microcristalinas: gota, condrocalcinosis, ... n Endocrinopatías: diabetes melitus, hipotiroidismo, acromegalia, ... n Tenosinovitis de los flexores. n Embarazo. n Anticonceptivos. n Enfermedades de depósito: amiloidosis, mucopolasacaridosis, ... n Artropatía del hemodializado. n Mieloma múltiple. n Gangliones. n Tumores: lipoma, hemangioma, ... n Infecciones: enfermedad de Lyme, artritis séptica, ... n Obesidad. n Un estudio de casos control encontró una serie de factores de riesgo en la población general, en los que se incluía la flexo-extensión repetida de la muñeca, dietas rápidas, bajo peso, histerectomía con oforectomía y menopausia reciente. Aunque la patología del túnel carpiano presenta una serie de etiologías ya descritas, podríamos diferenciarla en aguda y crónica. La forma aguda suele ser poco frecuente y es debida a un aumento rápido y sostenido de la presión en el túnel carpiano, suele asociarse a fractura de radio. También puede asociarse a quemaduras, coagulopatía, infecciones locales y a las inyecciones. La forma crónica es mucho más común y los síntomas pueden persistir durante meses o años. El STC es el síndrome más común por traumatismo repetido, en EE.UU representa casi el 62% de todos los casos notificados de enfermedad profesional. Ocupaciones de riesgo: trituradoras, cajeros, envasadores y carniceros, trabajadores de costura de los asientos de automóviles, tiendas de comestibles y gran parte de las líneas de montaje. Debemos realizar un diagnóstico diferencial con una serie de patologías como: hernia discal cervical, síndrome del desfiladero salida torácico, compresión del nervio mediano a otro nivel hernia discal cervical, síndrome del desfiladero salida torácico, compresión del nervio mediano a otro nivel. ¿C ómo se manifiesta? El paciente refiere habitualmente síntomas de larga evolución. Es raro el debut agudo. El inicio de los síntomas suele ser nocturno e insidioso. El enfermo describe las molestias como hormigueo y tumefacción de la mano de carácter progresivo. Los síntomas más frecuentes son dolor y parestesias en el territorio de inervación del nervio mediano, ocasionalmente irradia a antebrazo y codo (diagnóstico diferencial con radiculopatías cervicales) de predominio nocturno con afectación del sueño, puede ceder con elevación del brazo y agitación de la mano. 19 Reumatología Pueden existir síntomas más precoces que los sensitivos, relacionados con una leve debilidad de la musculatura (abductor corto, flexor corto y oponente del 1er dedo) y discreta atrofia de eminencia tenar. La mano puede estar seca y caliente por disminución del sudor normal, por desequilibrio vasomotor. Exploración física En los casos avanzados puede haber atrofia de eminencia tenar, debilidad y dificultad para los movimientos de abducción y oposición del primer dedo (ver fotografías en Fisterra-e). El signo con mayor valor predictivo es el de Flick. Es positivo cuando el paciente al ser preguntado: “¿Qué hace usted con la mano cuando los síntomas están peor?” responde agitando su mano de la misma manera que lo hace para bajar un termómetro. También son útiles y bastante seguros: incapacidad para distinguir estímulos dolorosos en la región palmar del dedo índice en relación con el otro lado y el diagrama de la mano de Katz (patrón clásico o probable). Menos útiles aunque más utilizados son el signo de Phalen (la flexión máxima de ambos carpos (ventral) durante 2 minutos produce parestesias) y el signo de Tinel (la percusión con el martillo de reflejos sobre el ligamento anular -cara ventral muñeca- produce sensación de descarga eléctrica sobre 2º y 3º dedos) (ver fotografías en Fisterra-e) (D’ArCy CA, 2000). La evolución espontánea de la enfermedad es hacia el progresivo deterioro irreversible de la función nerviosa (dolor, fallos de sensibilidad y pérdida de fuerza). (: Esta guía incluye imágenes que podrán ver visitando la web: http://www.fisterra.com/fisterrae/). ¿Q ué pruebas complementarias hacer? EMG: detecta la disminución de la velocidad de conducción sensitiva y motora. Útil para confirmar el diagnóstico y valorar la severidad de la compresión. Si es normal, no descarta síndrome de túnel carpiano. Valores normales: Latencia sensitiva >3,7 milisegundos. Diferencia de 0,4 miliseg ó + entre el mediano y el radial o cubital. Latencia motora >4 miliseg. Radiología: preferible en casos postraumáticos. Anteroposterior de carpo para valorar deformidades y axial para valorar estrechez de canal o existencia de prominencias. Radiografía cervical si existe sospecha de radiculopatía cervical. Aunque el diagnóstico del STC se basa en la clínica y en el estudio electromiográfico, existe entre un 13-27% de pacientes sintomáticos con electromiograma normal. En estos casos la ecografía y la resonancia magnética son de utilidad (Keles I, 2005). Analítica: hemograma, VSG, proteinograma, glucemia, creatinina, uricemia, ANA, FR, TSH y T4. Otras pruebas complementarias que pueden utilizarse para el diagnóstico: el TAC, la RNM y la ecografía, más utilizadas para el diagnóstico diferencial que para su diagnóstico etiológico. ¿C ómo tr atarlo? Un 34% de casos de causa idiopática remite sin tratamiento en 6 meses, con mejor pronóstico en: mujeres, embarazadas y jóvenes. Existen pocos estudios que comparen las diferentes opciones terapéuticas en casos con síntomas leves (Verdugo Renato J, 2008). Tratamiento etiológico Controlar y tratar el problema específico: diabetes, hipotiroidismo, artritis reumatoide, gota, ... Valorar la retirada de los anticonceptivos orales y en gestantes evaluar después del parto. Tratamiento conservador Indicado en casos con síntomas leves, sin atrofia de la eminencia tenar, embarazo o con historia de sobreuso. Puede recomendarse reposo de la mano, AINEs y/o una férula dorsal nocturna en extensión que abarque mano y antebrazo (se ha demostrado que la cirugía obtiene mejores resultados que esta última). En casos crónicos la rehabilitación ocupacional se asoció a un mayor porcentaje de regreso al trabajo que los cuidados habituales (Gerritsen AA, 2002; O’Connor D, 2003). En una revisión de la utilización de ultrasonidos como tratamiento fisioterapéutico, éstos demostraron ser de utilidad para el tratamiento sintomático con un elevado nivel de evidencia, pero no para el tratamiento etiológico (Alvayay CS, 2008). 20 Síndrome de túnel carpiano Existen discrepancias sobre la utilidad del uso de corticoides locales. En algún estudio apuntan que resultan tan eficaces como la descompresión quirúrgica en la mejoría de la sintomatología a corto y medio plazo hasta 1 año (Ly Pen D, 2005; Hui AC, 2005) aunque no mejoran la fuerza de prensión de la mano (Hui AC, 2005). Una revisión Cochrane que analiza la utilidad de la inyección local de corticoesteroides concluye que ésta proporciona una mejoría clínica frente a placebo al mes de la infiltración, sin utilidad más allá del mes. Igualmente refiere que la infiltración local presenta una mejoría clínica mayor que la administración oral de corticoides hasta 3 meses y que comparando la infiltración de corticoides con el tratamiento antiinflamatorio convencional no mejora el resultado clínico, así como si se realiza una inmovilización de 8 semanas o un tratamiento con láser de Helio-Neón después de 6 semanas. Resuelve también que 2 inyecciones de corticoides no presentan una ventaja evidente frente a una sola (Marshall S, 2007). La utilización de medicinas alternativas es cada vez mayor en nuestra sociedad. El yoga puede tener alguna utilidad, ya que reduce el dolor y mejora el pulso en la mano en los pacientes con STC (National Institute of Neurological Disorders and Stroke, 2009; O’Connor D, 2003). En un estudio observacional, los pacientes con STC leve a moderado tratados con acupuntura tuvieron una mejoría en los parámetros electromiográficos mayor que los tratados con esteroides (Yang CP, 2010), aunque esta eficacia no se ha demostrado en un metaanalisis reciente (Sim H, 2010). El uso de diuréticos, la toxina botulínica y la terapia láser de bajo nivel no demostraron mayor eficacia que placebo en pacientes con STC (Tascioglu F, 2010; Breuer B, 2006; Nalamachu S, 2006). Tratamiento quirúrgico El tratamiento quirúrgico es más eficaz que el entablillado para aliviar los síntomas del STC (Verdugo Renato J, 2008). Se planteará en los casos de: n Persistencia de síntomas a pesar del tratamiento médico o estudio electrofisiológico muy patológico. n Déficit sensitivo o motor (atrofia eminencia tenar) establecidos. n Lesiones ocupantes de espacio que requieran extirpación. n Síntomas severos o progresivos de más de 12 meses. No existen pruebas sólidas que apoyen la necesidad de reemplazar la liberación del túnel carpiano mediante técnica estándar a cielo abierto por procedimientos quirúrgicos alternativos, como la vía endoscópica. La decisión de aplicar una u otra técnicas depende del cirujano y de las preferencias de paciente (Scholten RJPM, 2008). En los últimos años el avance de las cirugías no invasivas hace que la técnica endoscopica sea más utilizada (Bejarano Herruzo B, 2009; Pereira EE, 2010). Ambos tipos de cirugía son eficaces en la mejora del dolor con lenta o nula recuperación de déficits sensitivos y motores, dependiendo del grado de afectación en el momento de la intervención. El retorno al trabajo es más rápido con la vía endoscópica. Existe una tasa del 1,8% de complicaciones y un 0.8% de lesiones nerviosas, con la vía endoscópica. Existe una baja probabilidad de recidiva a largo plazo (Wong KC, 2003; Verdugo Renato J, 2008). La mejoría del dolor suele ser similar en ambas técnicas (98% en la técnica abierta y un 99% en la endoscópica). el creciente interés de las técnicas quirúrgicas mínimamente invasivas y la popularización de la endoscopia han ido incrementando el uso de las técnicas endoscópicas para el tratamiento del STC, de manera que desde finales de los años 80 se ha abierto una amplia controversia entre ambas en cuanto a eficacia, resultados y seguridad. Los defensores de las técnicas endoscópicas argumentan que se obtiene un dolor postoperatorio menor en el sitio de la incisión, unos resultados cosméticos mejores, una recuperación de la prensión más rápida y un retorno más precoz al trabajo y a las actividades de la vida diaria. Por el contrario, los partidarios de los procedimientos abiertos esgrimen un riesgo mayor de lesiones vasculares y neurales, sobre todo en aquellos individuos con variantes anatómicas. Sólo aquellos pacientes que presenten síntomas claros son candidatos a esta cirugía, que tiene una serie de contraindicaciones: n Anomalias anatómicas conocidas. n Tumoraciones, neurinomas, quistes sinoviales o gangliones a nivel del canal carpiano. n Traumatismos previos de la muñeca que produzcan limitación a la extesión. n Dupuytren o cirugía de mano previa. n Tenosinovitis recurrente u otras inflamaciones palmares. n Artritis reumatoide. n Tratamiento con ACO, hemodiálisis, embarazo. 21 Reumatología A lgoritmo diagnóstico B ibliogr afía Alvayay CS, Arce A. Revisión sistemática de tratamientos fisioterapéuticos con mejor evidencia para el síndrome de túnel carpiano. Rev. Soc. Esp. Dolor 2008; 7:475-480 [Texto completo] Aroori S, Spence. Carpal tunnel syndrome. Ulster Med J. 2008; 77(1): 6–17. PubMed PMID: 18269111; PubMed Central PMCID: PMC2397020 Texto completo Bejarano Herruzo B. Síndrome del túnel carpiano [Internet]. Navarra: Clínica de la Universidad de Navarra; 2009 [acceso 18/1/2011]. Disponible en: www.cun.es Bland JD, Rudolfer SM. Clinical surveillance of carpal tunnel syndrome in two areas of the United Kingdom, 1991-2001. J Neurol Neurosurg Psychiatry. 2003 Dec;74(12):1674-9. PubMed PMID: 14638888; PubMed Central PMCID: PMC1757436 Texto completo Branco K, Naeser MA. Carpal tunnel syndrome: clinical outcome after low-level laser acupuncture, microamps transcutaneous electrical nerve stimulation, and other alternative therapies--an open protocol study. J Altern Complement Med.1999 Feb;5(1):526. PubMed PMID: 10100028 Breuer B, Sperber K, Wallenstein S, Kiprovski K, Calapa A, Snow B, Pappagallo M. Clinically significant placebo analgesic response in a pilot trial of botulinum B in patients with hand pain and carpal tunnel syndrome. Pain Med. 2006 Jan-Feb;7(1):16-24. PubMed PMID: 16533192 D’Arcy CA, McGee S. The rational clinical examination. Does this patient have carpal tunnel syndrome? JAMA. 2000 Jun 21;283(23):3110-7. Review. Erratum in: JAMA 2000 Sep 20;284(11):1384. PubMed PMID: 10865306 Dammers JW, Roos Y, Veering MM, Vermeulen M. Injection with methylprednisolone in patients with the carpal tunnel syndrome: a randomised double blind trial testing three different doses. J Neurol. 2006 May;253(5):574-7. Epub 2005 Dec 15. PubMed PMID: 16362532 22 Síndrome de túnel carpiano Gerritsen AA, de Krom MC, Struijs MA, Scholten RJ, de Vet HC, Bouter LM. Conservative treatment options for carpal tunnel syndrome: a systematic review of randomised controlled trials. J Neurol. 2002 Mar;249(3):272-80. PubMed PMID: 11993525 Hui AC, Wong SM. Surgery versus steroid injection in carpal tunnel syndrome: comment on the article by Ly-Pen et al. Arthritis Rheum. 2005 Aug;52(8):2578; author reply 2578-9. No abstract available. PubMed PMID: 16059896 Texto completo Keles I, Karagülle Kendi AT, Aydin G, Zög SG, Orkun S. Diagnostic precision of ultrasonography in patients with carpal tunnel syndrome. Am J Phys Med Rehabil. 2005 Jun;84(6):443-50. PubMed PMID: 15905658 Ly-Pen D, Andreu JL. Tratamiento del syndrome del túnel carpiano. Med Clin (Barc). 2005 Oct 29;125(15):585-9. PubMed PMID: 16277952 Marshall S, Tardif G, Ashworth N Inyección local de corticosteroides para el síndrome del túnel carpiano (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com Nalamachu S, Crockett RS, Gammaitoni AR, Gould EM. A comparison of the lidocaine patch 5% vs naproxen 500 mg twice daily for the relief of pain associated with carpal tunnel syndrome: a 6-week, randomized, parallel-group study. MedGenMed. 2006 Aug 9;8(3):33. PubMed PMID: 17406167 National Institute of Neurological Disorders and Stroke. Síndrome del túnel carpiano [Internet]. Bethesda, Maryland: National Institute of Neurological Disorders and Stroke; 2009 [acceso 18/1/2011]. Disponible en: http://espanol.ninds.nih.gov/trastornos/ tunel_carpiano.htm O’Connor D, Marshall S, Massy-Westropp N. Non-surgical treatment (other than steroid injection) for carpal tunnel syndrome. Cochrane Database Syst Rev. 2003;(1):CD003219. Revie. PubMed PMID: 12535461 Pereira EE, Miranda DA, Seré I, Arce G. Endoscopic release of the carpal tunnel: a 2-portal-modified technique. Tech Hand Up Extrem Surg. 2010 Dec;14(4):263-5. PubMed PMID: 21107228 Scholten RJPM, Mink van der Molen A, Uitdehaag BMJ, Bouter LM, de Vet HCW. Opciones de tratamiento quirúrgico para el síndrome del túnel carpiano (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Texto completo] Sim H, Shin BC, Lee MS, Jung A, Lee H, Ernst E. Acupuncture for Carpal Tunnel Syndrome: A Systematic Review of Randomized Controlled Trials. J Pain. 2010 Nov 17 [Epub ahead of print]. PubMed PMID: 21093382 Tanaka S, Wild DK, Seligman PJ, Behrens V, Cameron L, Putz-Anderson V. The US prevalence of self-reported carpal tunnel syndrome: 1988 National Health Interview Survey data. Am J Public Health. 1994 Nov;84(11):1846-8. PubMed PMID: 7977933 Texto completo Tascioglu F, Degirmenci NA, Ozkan S, Mehmetoglu O. Low-level laser in the treatment of carpal tunnel syndrome: clinical, electrophysiological, and ultrasonographical evaluation. Rheumatol Int. 2010 Dec 1. [Epub ahead of print]. PubMed PMID: 21120497 Verdugo Renato J, Salinas Rodrigo A, Castillo José L, Cea José G Tratamiento quirúrgico versus tratamiento no quirúrgico para el síndrome del túnel carpiano (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com [Texto completo] Wong KC, Hung LK, Ho PC, Wong JM. Carpal tunnel release. A prospective, randomised study of endoscopic versus limited-open methods. J Bone Joint Surg Br. 2003 Aug;85(6):863-8. PubMed PMID: 12931807 Texto completo Yang CP, Wang NH, Li TC, Hsieh CL, Chang HH, Hwang KL et al. Randomized Clinical Trial of Acupuncture Versus Oral Steroids for Carpal Tunnel Syndrome: A Long-Term Follow-Up. J Pain. 2010 Nov 24. [Epub ahead of print]. PubMed PMID: 21111685 23 TEMA 5 Osteoporosis I Grupo Fisterra. ¿D e qué habl amos? La osteoporosis es una enfermedad esquelética progresiva y sistémica, caracterizada por un descenso de la masa ósea y un deterioro en la microarquitectura del hueso, que aumenta su fragilidad y el riesgo de fracturas (Consensus, 1991). La posibilidad de desarrollar fracturas osteoporóticas es lo que establece la importancia de esta entidad. Suele afectar a cadera, vértebras, antebrazo, extremo proximal del húmero, pelvis, costillas y extremo distal de tibia y peroné. En ocasiones pueden producirse fracturas “por fragilidad” o de “bajo impacto”, ocurren espontáneamente o tras una caída de una altura no mayor que la del paciente. Tras la fractura de cadera puede haber un importante aumento de la morbimortalidad y tras cualquier tipo de fractura mayor riesgo de una posterior. Supone un elevado gasto para los sistemas sanitarios (Cooper C, 1993; Kanis JA, 2008; Lash RW, 2009; Rosen HN, 2009). Existen varios factores de riesgo conocidos para el desarrollo de osteoporosis y fracturas osteoporóticas (ICSI, 2008; Kanis JA, 2008; MOH, 2009; Lash RW, 2009; Sweet MG, 2009; AATRM, 2010): 1. Edad: ssu prevalencia aumenta con el envejecimiento (44% en mujeres de 80 o más años). 2. Sexo: a los 50 años, la prevalencia es 3 veces mayor en las mujeres que en los hombres. 3. IMC inferior a 20 o pérdida significativa de peso. 4. Historia personal previa de fractura por fragilidad principalmente de cadera, muñeca y vertebral. 5. Historia familiar de osteoporosis: Existen evidencias de que una fractura de cadera en familiares directos de menos de 70 años, es un factor de riesgo de fractura independiente de la densidad mineral ósea. 6. Ingesta de alcohol superior a 3 unidades/día, cafeína o tabaco. 7. Ingesta de medicamentos: a. Riesgo conocido: Glucocorticoides, ciclosporina A, tacrólimus, micofenolato mofetil, medroxiprogesterona depot, tamoxifeno, inhibidores de la aromatasa (anastrozol y letrozol), pioglitazona y rosiglitazona, anticonvulsivantes (fenitoina o fenobarbital, mas que carbamazepina y ácido valproico) y heparinas (las no fraccionadas más que las de bajo peso molecular). b. Posible riesgo: Litio, ISRS, antipsicóticos, inhibidores de la bomba de protones y topiramato. 8. Raza caucásica o asiática. 9. Baja actividad física. 10. Trastorno de la conducta alimentaria (anorexia, bulimia, etc.). 11. Malnutrición crónica y malabsorción. 12. Baja ingesta de calcio y Vitamina D. 13. Historia de caídas. 14. Inmovilización prolongada. 15. Menopausia temprana (40-45 años). ¿C ómo se diagnostica? Aunque clínicamente puede manifestarse como una fractura por fragilidad o de bajo impacto, lo habitual es que el diagnóstico se establezca mediante pruebas radiológicas. El abordaje inicial tendrá como objetivo (ICSI, 2008; Kanis JA, 2008; Lash RW, 2009; Sweet MG, 2009): 1. Excluir causas secundarias de osteoporosis (Tabla 1). 2. Evaluar los factores de riesgo de osteoporosis y fractura con el objeto de determinar el pronóstico. 3. Seleccionar el tratamiento adecuado en función de los factores de riesgo mencionados. 25 Reumatología Tabla 1. Causas secundarias de osteoporosis. Entidades clínicas Riesgo clínico de osteoporosis y fracturas osteoporóticas Endocrinas nCushing nHipogonadismo en hombres o mujeres nHipertiroidismo nHiperparatiroidismo primario nAmenorrea premenopausica nMenopausia precoz (<45 años) nAddison nDiabetes tipo 1 nModerado nModerado nModerado nModerado nModerado nModerado nModerado nModerado Reumatológicas nArtritis reumatoide nEspondilitis anquilopoyética nLES nModerado Fármacos nGlucocorticoides nAnticonvulsivantes nHeparinas intravenosas nLitio nFármacos que causen hipogonadismo nISRS nAntiacidos que contengan aluminio nRiesgo alto o muy alto Gastrointestinales nCeliaca nEnfermedad Inflamatoria Intestinal nCirugía bariática nGastrectomía nCirrosis biliar primaria nInsuficiencia pancreática nModerado nModerado nModerado nModerado nModerado nModerado Neoplasia nMieloma múltiple nLeucemia nMastocitosis Renales nInsuficiencia renal o fallo renal nModerado Otras nTrasplante de órganos sólidos nConsumo de alcohol nSarcoidosis nDepresión nAmiloidosis nAnorexia nerviosa/bulimia nTalasemia nEsclerosis múltiple nHemocromatosis 26 nExtremadamente alto nModerado nModerado nModerado nModerado nModerado nModerado nModerado nModerado Osteoporosis Para ello se realizará (ICSI, 2008; Kanis JA, 2008; Lash RW, 2009; Sweet MG, 2009; Rosen HN, 2009; Blake GM, 2010): 1. Historia clínica y examen físico adecuado, con especial atención a los factores de riesgo 2. Analítica: Hemograma, VSG, calcio, fósforo, albúmina, creatinina, fosfatasa alcalina, transaminasas y hormonas tiroideas. En función de la sospecha diagnóstica esta petición se ampliará con los parámetros necesarios para el diagnóstico. Los marcadores bioquímicos de turnover óseo no se recomiendan para el diagnóstico. 3. Radiología: Lateral de columna lumbar y dorsal. La fractura vertebral se confirma con una pérdida de tamaño vertebral del 20% o mayor. 4. Medición de la densidad mineral ósea: Establece el diagnóstico definitivo de osteoporosis, aunque éste puede realizarse sin esta medición ante la presencia de fractura por fragilidad. Existen varios métodos de medida: a. DEXA (Dual energy X-ray absortiometry): es el más sencillo y el más utilizado. Es un buen predictor del riesgo de fractura (cadera, vertebral y muñeca) y puede utilizarse también en la monitorización del tratamiento. Aporta dos valores: T-score (número de desviaciones estándar (DS) de la densidad mineral ósea de un individuo en comparación a una población de referencia normal) y Z-score (número de DS de la densidad mineral ósea de un individuo en relación a una población de su mismo sexo, raza y edad). El lugar de referencia de la medición es el cuello femoral, del que se obtienen las siguientes definiciones aplicables tanto a hombres como a mujeres (ICSI, 2008; Kanis JA, 2008; Rosen HN, 2009; Compston J, 2009) (Tabla 2). Tabla 2. Medición de la densidad mineral ósea (DEXA). Definiciones Normal Baja densidad ósea (osteopenia) Osteoporosis Osteoporosis severa (osteoporosis establecida) DEXA T-score ≥ -1 DS T-score entre -1 y -2.4 DS T-score ≤ -2.5 DS Presencia de fractura por fragilidad y T-score ≤ -2.5 DS b. El Z-score no se utiliza para definir osteoporosis, pero puede identificar pacientes con menor densidad mineral ósea que la esperada para su edad. Los valores de la DEXA pueden estar elevados en presencia de fracturas, osteofitos vertebrales, artropatía degenerativa calcificaciones aórticas y osteomalacia. Debe utilizarse la misma técnica y evaluar el T-score siempre en la misma zona anatómica, si se utiliza para seguimiento. c. pDEXA (peripheral Dual energy X-ray absortiometry) (ICSI, 2008; Sweet MG, 2009): Mide la densidad mineral ósea en antebrazo, dedo y calcáneo. Es más barata que la DEXA central y, con aparatos validados, puede predecir el riesgo de fractura vertebral y de cadera en mujeres posmenopáusicas. Esta predicción no ha podido demostrarse en los hombres. Sus valores no suelen correlacionarse con la DEXA central, y por el momento no tiene indicación en el diagnóstico ni en la monitorización del tratamiento. d. QTC (Absortimetría basada en tomografia computada) (ICSI, 2008; Sweet MG, 2009): Mide el volumen trabecular y la densidad ósea cortical de la columna, cadera (central) o de antebrazo y tibia (periférica). Aunque puede predecir el riesgo de fractura vertebral (la central) y de cadera (la periférica), su empleo está más limitado por su mayor coste y exposición a radiaciones que la DEXA. No hay evidencia suficiente para la predicción de fracturas en los hombres. e. QUS (Densitometría ultrasónica cuantitativa) (ICSI, 2008; Sweet MG, 2009; Lash RW, 2009): La medición de ultrasonidos en calcáneo, tibia, patela y otras localizaciones puede utilizarse en programas de cribado, de tal forma que aquellos pacientes con T-score bajo deben ser evaluados por DEXA para el diagnóstico definitivo. Los aparatos validados, predicen el riesgo de fracturas en mujeres posmenopáusicas y hombres de más de 65 años. ¿C uándo re aliz ar cribado con DEX A? Existen evidencias suficientes para recomendarlo en (USPSTF, 2002; ICSI, 2008; Sweet MG, 2009): 1. Mujeres de más de 65 años. 2. Mujeres entre 60 y 65 años con un riesgo incrementado de fractura (ver factores de riesgo en el primer apartado). 27 Reumatología Algunos autores recomiendan hacerlo también en (NOF, 2008; NAMS, 2010): 1. Hombres de 70 o más años. 2. Adultos con fractura de bajo impacto previa. 3. Mujeres posmenopáusicas de 50 años o más y hombres con factores de riesgo para fracturas. No hay evidencia suficiente para recomendar cribado de rutina en mujeres posmenopáusicas de menos de 60 años (Sweet MG, 2009). Con el fin de integrar los factores de riesgo y la solicitud racional de DEXA, se ha desarrollado una herramienta informática: Simple Calculated Osteoporosis Risk Estimation (SCORE) que permite evaluar a través de 6 ítems qué mujeres pueden tener una alta probabilidad de tener un T-score <2 y, por lo tanto, ser candidatas al cribado. El test está validado para mujeres americanas, tiene una sensibilidad del 91%, una especificidad del 40% y está accesible en http://osteoed. org/tools.php (Lydick E, 1998; Cadarette SM, 2001). ¿C ómo se tr ata? La OMS ha desarrollado un algoritmo que evalúa el riesgo de fractura de cadera y de fracturas osteoporóticas (cadera, vertebral, antebrazo y hombro) a 10 años. Es la aplicación matemática de los resultados de varios metaanálisis que incluye 60.000 hombres y mujeres de Norte América, Europa, Asia y Australia y analiza la probabilidad de fractura en función de unos factores de riesgo y el valor de T-score en el cuello femoral o el IMC. Puede obtenerse en Español: http:// www.shef.ac.uk/FRAX/index_SP.htm y es aplicable a hombres y mujeres de más de 50 años. La decisión final de tratamiento debe ser individualizada, teniendo en cuenta el resultado de la DEXA, la presencia de factores de riesgo para fracturas, las condiciones clínicas del paciente y la relación coste-eficacia del mismo. Estará indicado en los siguientes casos (NOF, 2009; NAMS, 2010): Mujeres posmenopáusicas de 65 años o mayores y hombres de 50 o más años con uno o más de los siguientes criterios: a. Fractura previa de cadera o vertebral. b. T-score -2.5 o menos en cuello femoral, cadera o vértebra c. T-score entre -1 y -2.5 en cuello femoral, cadera o vértebra y uno o más de los siguientes criterios: nOtras fracturas previas. nCausa secundaria de osteoporosis asociada a alto riesgo de fractura. nRiesgo de fractura a 10 años, calculado por el FRAX del 3% o más para cadera o del 20% para una fractura osteoporótica mayor (columna, cadera, muñeca y hombro). Medidas generales: a. Nutrición: muchos nutrientes alteran la absorción de calcio en el organismo, por ello debe realizarse una ingesta adecuada de calcio y vitamina D, proteínas (1 g/Kg de peso), Vitaminas K y C, limitar la ingesta de sal y productos ricos en oxalatos y fosfatos (Kanis JA, 2008). El té y el café no tienen efecto sobre la densidad mineral ósea (DMO) a menos que exista un consumo excesivo y baja ingesta de calcio (Stránský M, 2009). Los suplementos de calcio, asociados o no a Vitamina D con una cumplimentación correcta (1200 mg/día de calcio y 800-1000 UI/día de Vitamina D) previenen el riesgo de fractura (NAMS, 2010) y aumentan la DMO principalmente en pacientes ancianos, institucionalizados, con bajo IMC, baja ingesta de calcio y riesgo elevado de fractura. La Vitamina D sola no tiene eficacia para prevenir fracturas salvo en población de alto riesgo (Tang B, 2007; MacLean C, 2008; Avenell A, 2009). El Carbonato calcico es la presentación más barata pero necesita un ph ácido para su absorción y debe administrarse con las comidas. Esta condición no es necesaria para el citrato cálcico, pero es más caro (Kanis JA, 2008; Lash RW, 2009). b. Ejercicio físico: mejora la masa muscular, la función física, el dolor y la vitalidad (Li WC, 2009). Su efecto sobre la DMO y la prevención de fracturas es discutida (Martyn-St James M, 2008; De Kam D, 2009). Los programas de ejercicio específicos bajo supervisión de fisioterapeutas tienen algún beneficio sobre la DMO, pero también mayor dificultad para conseguir una buena adherencia. Los más sencillos, como caminar, TaiChí y clases de aerobic, obtienen mejor cumplimentación, aunque son menos efectivos para la prevención de fracturas (Schmitt NM, 2009; Lash RW, 2009). c. Prevención de caídas: los factores de riesgo para caídas son: movilidad limitada, trastornos de estabilidad, presencia de enfermedades neuromusculares o musculoesqueléticas, edad avanzada, disminución de la visión, enfermedades cardíacas, antecedentes de caídas, uso de fármacos que bajen el sistema de alerta o provoquen hipotensión y presencia de deterioro cognitivo. Las medidas generales de prevención pueden disminuir el 28 Osteoporosis riesgo de fracturas (Gillespie LD, 2009). El uso de protectores de cadera puede disminuir el riesgo de fractura en mujeres institucionalizadas con antecedentes de caída y bajo peso, pero no ha podido demostrarse ese efecto en ancianos que viven en su domicilio; su mayor limitación es la correcta cumplimentación (Parker MJ, 2006; Kiel DP, 2007; Gillespie LD, 2009). 2. Tratamiento farmacológico en pacientes con baja densidad ósea (osteopenia) (prevención primaria) Las mujeres con osteopenia tienen un riesgo relativamente bajo de padecer fracturas. En este grupo suelen ser de muñeca o fracturas menores, con menos frecuencia las vertebrales y mucho menos las de cadera. El tratamiento farmacológico ha demostrado un aumento en la DMO pero no una variación clara en el riesgo de fracturas, por lo que no pautar tratamiento farmacológico es una opción adecuada (MOH, 2008). En aquellas mujeres a las que se decidiese tratar, los fármacos a utilizar son: a. Estrógenos: (Estrógeno solo o Estrógeno + Progestágeno): disminuyen el riesgo de fracturas no vertebrales (MacLean C, 2008). Su empleo estará condicionado por la necesidad de tratamiento de síntomas vasomotores en la menopausia, y puede ser una buena opción en mujeres con síntomas moderados o severos utilizando la menor dosis efectiva y durante el menor tiempo posible (Sweet MG, 2009; MOH, 2008). El incremento de riesgo de cáncer de mama, ACV y tromboembolismo ha limitado su uso (Sweet MG, 2009). b. Bifosfonatos: sólo el alendronato ha demostrado reducir las fracturas vertebrales en este grupo de población (Wells GA, 2008; MOH, 2008; MacLean C, 2008). c. Raloxifeno: en algunos ensayos ha demostrado una reducción en el riesgo total de fracturas, pero puede empeorar los síntomas menopáusicos (MacLean C, 2008). 3. Tratamiento farmacológico de la osteoporosis (prevención secundaria) En pacientes con alto riesgo de fractura (Tabla 3). a. Bifosfonatos: son agentes antireabsortivos. Son los fármacos de primera elección (NAMS, 2010). El Alendronato ha demostrado que reduce de forma significativa las fracturas vertebrales, no vertebrales, de cadera y de muñeca (Wells GA, 2008) y es eficaz tanto en la osteoporosis posmenopáusica, como en la inducida por corticoides y en la del hombre (Sweet MG, 2009). El Risedronato a dosis de 5 mg/día disminuye el número de fracturas vertebrales, no vertebrales y de cadera principalmente en el grupo de población de 70-79 años. No disminuye las de muñeca ni es efectivo en las mujeres de más de 80 sin evidencia de osteoporosis (Kanis JA, 2008; ICSI, 2008; Wells GA, 2008); también es eficaz en la osteoporosis de la mujer posmenopáusica, del hombre y en la inducida por corticoides. El Etidronato a dosis de 400 mg/día demostró una reducción en las fracturas vertebrales, pero no en las no vertebrales, de cadera o muñeca (Wells GA, 2008). El Risedronato y el Etidronato serían una alternativa al alendronato en caso de intolerancia al mismo o contraindicación o en mujeres con T score < -3/-2.5 mayores de 55 años sin factores de riesgo para fractura o mayores de 50 años con 1 ó más factores de riesgo para fractura (NICE, 2008). El Ibandronato a dosis de 2,5 mg/día disminuye el número de fracturas vertebrales y, sólo en mujeres con T-score de < -3, tiene efecto sobre las fracturas no vertebrales (Kanis JA, 2008; Sweet MG, 2009; Sebba AI, 2009). A dosis de 150 mg/mes y 3 mg intravenoso/3 meses, se obtiene mayor incremento en la reducción de fracturas vertebrales (Kanis JA, 2008; Cranney A, 2009). El Zoledronato a dosis de 5 mg intravenoso anualmente reduce la incidencia de fracturas vertebrales y de cadera, puede utilizarse en pacientes de alto riesgo que no toleran los Bifosfonatos orales y para la prevención de nuevas fracturas después de una de cadera (MacLean C, 2008; Kanis JA, 2008; ICSI, 2008). El periodo de tiempo durante el cual habría que realizar el tratamiento no está bien establecido, aunque en un ensayo clínico se sugiere que las mujeres con riesgo muy alto de fracturas vertebrales podrían realizarlo durante 10 años. En todas las demás, la supresión de Alendronato a los 5 años de comenzar el tratamiento no incrementó el riesgo de fracturas vertebrales (Black DM, 2006). Actualmente comienzan a describirse casos de fracturas de bajo impacto subtrocantereas y de diáfisis femoral con un patrón radiológico específico, asociado al uso prolongado estos fármacos (Lenart BA, 2009). Su empleo se ha relacionado con un ligero aumento del riesgo de úlceras esofágicas y reflujo. Se han descrito complicaciones más serias como perforaciones y sangrados en algunos ensayos que presentan limitaciones en el número de participantes (MacLean C, 2008). También se ha observado un incremento en el riesgo de desarrollar fibrilación auricular (Loke YK, 2009; Bhuriya R, 2010) y se recomienda vigilar su aparición. Los resultados no son por el momento concluyentes a la hora de relacionarlos con otro tipo de eventos cardiovasculares (Loke YK, 2009). La incidencia de osteonecrosis de mandíbula es baja, aunque se ha descrito con el uso de Alendronato y Risedronato vía oral y Zolendrónico intravenoso (Pazianas M, 2007; Grbic JT, 2008; ICSI, 2008; MacLean C, 29 Reumatología 2008). Generalmente aparece en pacientes con mieloma múltiple o con metástasis óseas de cáncer de mama o de próstata. Los factores que aumentan el riesgo de desarrollarlo son: cáncer, uso de bifosfonatos intravenosos y traumas o infecciones dentarias (ICSI, 2008). No hay evidencia de que en mujeres sanas que utilizan Bifosfonatos sea necesario un manejo especial de su patología dentaria aunque podría ser recomendable evitar la cirugía dental agresiva (Grbic JT, 2008; ICSI, 2008). Tampoco hay evidencias que apoyen la determinación de marcadores de turnover óseo en pacientes a tratamiento con Bifosfonatos y que requieran intervención dental (Don-Wauchope AC, 2009). b. Ranelato de estroncio: en un ensayo clínico en el que sólo lo finalizan el 53% de las mujeres, se observa una reducción de la incidencia de fracturas vertebrales y no vertebrales (incluida la de cadera) a los 5 años (O’Donnell S, 2006; Reginster JY, 2008). El seguimiento a 8 años, parece aportar alguna evidencia de que este efecto se mantiene al cabo de estos años de tratamiento (Reginster JY, 2009). No está aprobado por la FDA. Puede ser una opción de tratamiento en caso de intolerancia o contraindicación del uso de Bifosfonatos o en mujeres con T store < -4/-2.5 mayores de 55 años sin factores de riesgo para fractura o mayores de 50 años con 1 ó más factores de riesgo para fractura (NICE, 2008). La dosis diaria recomendada es de 2 gr/día, su absorción se altera con la comida, la leche y derivados por lo que debe prescribirse a la noche, 2 horas después de la cena. Está contraindicado en pacientes con un aclaramiento de creatinina inferior a 30 ml/min (Kanis JA, 2008). Por el momento no está definido el tiempo que se debe de mantener este fármaco. La mayoría de los efectos secundarios son gastrointestinales y aparecen al comienzo del tratamiento. Algunos estudios han un aumento del riesgo de trombosis venosa profunda por lo que se recomienda utilizarlo con mucha precaución y un seguimiento más estricto en pacientes que hayan padecido algún episodio (Kanis JA, 2008). c. Moduladores selectivos de los receptores de estrógenos (SERM): Raloxifeno: ha demostrado disminuir el riesgo de fracturas vertebrales en mujeres posmenopáusicas con y sin antecedentes de fractura vertebral previa (Sontag A, 2010). Puede ser una opción de tratamiento en pacientes con intolerancia o contraindicación del uso de Bifosfonatos o en mujeres con T store < -4/-2.5 mayores de 55 años sin factores de riesgo para fractura o mayores de 50 años con 1 ó más factores de riesgo para fractura (NICE, 2008). Reduce el riesgo de cáncer de mama invasivo que se mantiene ligeramente tras dejar el tratamiento (Vogel VG, 2009). Su uso se ha relacionado con un incremento del riesgo de eventos coronarios, trombosis venosa y ACV fatal (Adomaityte J, 2008; Mosca L, 2009) y tromboembolismo pulmonar (Adomaityte J, 2008), por lo que debe emplearse adecuadamente en relación al balance riesgo-beneficio. Otros fármacos de este grupo son Bazedoxifeno, Arzoxifene y Lasofoxifene. Bazedoxifeno ha demostrado aumento de la DMO y disminución de fracturas en un grupo de mujeres de alto riesgo (Kanis JA, 2009; Silverman SL, 2008). Su posición en el tratamiento de la osteoporosis está todavía por establecer, ya que se precisan más ensayos y a más largo plazo que los existentes hasta el momento. d. Péptidos de la familia de la hormona paratiroidea: Teriparatide: ha demostrado una reducción en la incidencia de fracturas vertebrales y no vertebrales mientras duraron los ensayos clínicos (18-24 meses) (Kanis JA, 2008). Dosis: 20 microgramos diarios durante 24 meses (Trevisani VF, 2008; NAMS, 2010). Debido a su elevado coste y menor experiencia sólo se recomienda cuando existiese contraindicación, intolerancia o falta de respuesta a los Bifosfonatos o Ranelato de estroncio en mujeres de más de 65 años con T-score de -4 o menos o T-score de -3.5 o inferior y 2 fracturas o edad entre 55 y 65 años y T-score de -4 o menos y más de 2 fracturas (NICE, 2008; NAMS, 2010). Los efectos secundarios más frecuentes son nauseas, artralgia, calambres, hipercaliemia transitoria, hipotensión ortostática, cefalea y mareo. También puede provocar aumento de la excreción urinaria de calcio, por lo que debe utilizarse con precaución en pacientes con litiasis renal. Está contraindicado en pacientes con hipercalemia preexistente, hiperparatiroidismo, enfermedad de Paget, elevación inexplicable de la fosfatasa alcalina, enfermedades malignas óseas o metástasis y en presencia de implantes de radioterapia ósea. En ratas se ha descrito un incremento en la incidencia de osteosarcoma que por el momento no se ha descrito en humanos, sin embargo se recomienda no utilizarla en aquellos pacientes con riesgo de desarrollarlo con enfermedad de Paget ósea, elevación de fosfatasa alcalina de causa no aclarada y antecedentes de radioterapia ósea (Kanis JA, 2008; Trevisani VF, 2008). e. Calcitonina: su efecto en la disminución de la incidencia de fracturas es dudoso, pero puede ser útil en mujeres con fractura vertebral aguda. No se considera fármaco de primera línea en el tratamiento de la osteoporosis (Kanis JA, 2008). f. Terapia hormonal sustitutiva (THS): en el momento actual no se recomiendan como fármacos de elección del tratamiento de la osteoporosis. Únicamente pueden valorarse ante la presencia de síntomas menopáusicos, utilizados a la menor dosis posible y durante el menor tiempo valorando el balance riesgo-beneficio sobre el hueso una vez que los síntomas vasomotores estén controlados (Kanis, 2008; NAMS, 2010). 30 Osteoporosis g. Otras terapias: la isoflavona de soja, progestágenos naturales, magnesio, vitamina K, suplementos de acido gammalinoleico y eicosapentaenoico y el kampo formulae se han ensayado en el tratamiento y prevención de la osteoporosis sin que por el momento existan evidencias que demuestren su eficacia antifractura (ICSI, 2008; Ma DF, 2008). h. Terapia de combinación: aunque se han ensayado tratamientos con dos antireabsortivos, THS y Bifosfonatos o SERM y PTH con antireabsiortivos, por el momento no hay datos suficientes para apoyar su uso con efecto antifractura, debiendo, en caso necesario, valorar con precaución la posible suma de efectos adversos, aumento del coste y la posibilidad de suprimir en exceso el turnover óseo (Kanis JA, 2008; Sweet, 2009; Lash RW, 2009; Mitchner NA, 2009; NAMS, 2010). Tabla 3. Eficacia antifractura de los fármacos. Fármaco Fr. Vertebral Fr. No vertebral Fr. Cadera Fr. Muñeca + Bifosfonatos Alendronato + + + Risedronato + + + Etidronato + Ibandronato + Zoledronato + Ranelato de estroncio + Raloxifeno + Teriparatide + + (tscore<-3) + + + + En el momento actual se están desarrollando o existen ensayos en marcha con múltiples fármacos: Análogos de la PTH, agonistas/antagonistas de estrógenos, inhibidores de la cathepsin K y anticuerpos monoclonales humanos, cuyos resultados habrá que comprobar (Mitchner NA, 2009). Por el momento no se ha evaluado el riesgo de fractura una vez que se finaliza el tratamiento farmacológico (NAMS, 2010). Uno de los mayores inconvenientes en el tratamiento de la osteoporosis es el pobre cumplimiento terapéutico. Se calcula que del 30-50% de los pacientes a los que se les prescribe lo dejan al inicio, lo que se traduce en un incremento del riesgo de fracturas y del gasto en recurso médicos y de hospitalización. Varios estudios apoyan la mejora en la adherencia con las formulaciones semanales o mensuales frente a las diarias (Kothawala P, 2007; ICSI, 2008; Kanis JA, 2008; Hiligsmann M, 2010). ¿C ómo debemos re aliz ar el seguimiento? No existen evidencias al respecto, aunque es recomendable que, una vez pautado el tratamiento farmacológico, se evalúe anualmente el cumplimiento y la efectividad del mismo así como una valoración de los factores de riesgo de fractura (Kanis JA, 2008; ICSI, 2008; Sweet, 2009; Mitchner NA, 2009). Cada 1-2 años, dependiendo de la situación clínica, debe solicitarse DEXA. Los marcadores de turnover ósea no deben utilizarse en el seguimiento. En mujeres que no reciben tratamiento farmacológico, la DEXA se repetirá cada 2-5 años (NAMS, 2010). Una falta de respuesta en la DEXA podría estar causada por: 1. Pobre adherencia al tratamiento. 2. Malabsorción del fármaco administrado por vía oral (no cumplimentación de la técnica adecuada). 3. Ingesta inadecuada de calcio y vitamina D. 4. Fallo real del tratamiento prescrito. 5. Causa secundaria de osteoporosis. Debemos valorar la derivación en caso de (MOH, 2009): 1. Mujeres premenopáusicas. 2. Varones. 3. Pacientes a tratamiento con corticoides durante un periodo largo de tratamiento. 4. Sospecha de osteoporosis secundaria. 5. Pacientes con fracturas patológicas. 31 Reumatología O steoporosis en situaciones especiales Osteoporosis en el hombre Está infradiagnosticada e infratratada, en relación con la de mujeres posmenopáusicas (MOH, 2009). Son factores de riesgo (Lash RW, 2009): 1. Edad superior a 70 años. 2. IMC inferior a 20. 3. Pérdida de peso del 10% en relación a su peso basal. 4. Inactividad física. 5. Fracturas osteoporóticas previas. 6. Uso prolongado de corticoides. 7. Terapia antiandrogénica. 8. Tabaquismo. El diagnóstico se realiza mediante DEXA con los mismos criterios que para mujeres posmenopáusicas (Compston J, 2009). Dado que en este grupo de población es frecuente el hipogonadismo y la deficiencia de Vitamina D, las determinaciones para descartar estas patologías estarían indicadas (Lash RW, 2009). El cálculo de riesgo de fracturas se puede realizar a través del FRAX (http://www.shef.ac.uk/FRAX/index_SP.htm) de igual forma que en las mujeres. La decisión sobre el tratamiento se expone en la guía de osteoporosis en mujeres posmenopáusicas (Finkelstein JS, 2009). Las medidas generales del tratamiento se consideran de igual forma que en las mujeres. Los suplementos de calcio y Vitamina D demostraron disminución del riesgo de fracturas, pero en la mayoría de los casos es necesario tratamiento farmacológico adicional (Finkelstein JS, 2009). Si se objetiva el hipogonadismo como causa de la osteoporosis, está indicado el tratamiento con Testosterona. El Alendronato y el Risedronato han demostrado disminuir el riesgo de fracturas vertebrales y no vertebrales en el hombre y serían los fármacos de primera línea de tratamiento (ICSI, 2008; MOH, 2009; Lash RW, 2009; Zhong ZM, 2009). La Teriparatide reduce la incidencia de fracturas vertebrales y se reserva para cuando el tratamiento con Bifosfonatos ha fallado (MOH, 2009; Lash RW, 2009). El Etidronato, la Calcitonina no han demostrado eficacia antifractura (MOH, 2009; Lash RW, 2009). Existe para este grupo de población menos evidencia de cómo realizar el seguimiento. Por consenso se decide recomendar la realización de DEXA como en las mujeres posmenopáusicas. No se recomienda el uso de marcadores de turnover ósea para el seguimiento (Finkelstein JS, 2009). Osteoporosis inducida por glucocorticoides La ingesta de glucocorticoides esta asociado a un incremento en la incidencia de fractura vertebral y de cadera. Este riesgo ocurre cuando se utilizan dosis orales de 5 mg/dia de Prednisolona o equivalentes durante un periodo de tiempo superior a los 3 meses o bien cuando se utilizan corticoides inhalados de alta potencia o dosis bajas durante un periodo prolongado de tiempo (la Budesonida y la Fluticasona tienen menor efecto que la Beclometasona). El uso de espaciadores reduce el efecto de los corticoides inhalados sobre la pérdida de masa ósea (MOH, 2009). Sería conveniente la realización de DEXA en todos aquellos pacientes que estén o vayan a estar a tratamiento con glucocorticoides a las dosis referidas durante más de 3 meses. En este caso, un t-score de -1.5 es diagnóstico de osteoporosis (MOH, 2009). Para la prevención podemos utilizar suplementos de calcio y vitamina D (a la misma dosis que en mujeres posmenopáusicas), análogos de la vitamina D y calcitonina en episodios de fractura aguda por su efecto analgésico, aunque ésta no ha demostrado que reduzca el riesgo de fractura en este tipo de osteoporosis (MOH, 2009). Para el tratamiento, los fármacos que han demostrado ser útiles son el Alendronato, Risedronato y Teriparatide. Todos ellos disminuyen el riesgo de fracturas vertebrales en este grupo de pacientes (ICSI, 2008; MOH, 2009). Osteoporosis en mujeres premenopausicas En este grupo de población existen menos evidencias que en las situaciones clínicas anteriores. El cribado con DEXA no esta recomendado de forma rutinaria, aunque debe realizarse en caso de (Becker CB, 2009): 1. Mujeres con antecedentes de fractura por fragilidad. 2. Si existen causas secundarias de osteoporosis conocidas. Cuando una mujer premenopáusica presenta una fractura por fragilidad o un DEXA diagnóstico de osteoporosis deben realizarse los estudios y diagnósticos diferenciales como en la mujer posmenopáusica con el objeto de buscar una causa 32 Osteoporosis secundaria de su osteoporosis. En algunos casos, la realización de marcadores de turnover ósea, DEXA repetidos o biopsia ósea puede ser preciso con este mismo fin (Becker CB, 2009). Los suplementos de calcio, vitamina D y las medidas generales de tratamiento son iguales que en mujeres posmenopáusicas. En mujeres premenopáusicas con osteopenia, sin fracturas ni causa secundaria de la misma no está indicado el tratamiento farmacológico. En mujeres premenopáusicas con osteoporosis idiopática en quienes no estuviese indicada la THS, los Bifosfonatos serían los fármacos de primera elección, aunque los demás grupos farmacológicos pueden utilizarse siempre considerando que en este grupo de mujeres, los estudios sobre seguridad y eficacia son mucho más limitados, principalmente para las mujeres en edad reproductiva. Si la osteoporosis es secundaria, el tratamiento sería el de la patología de base (Becker CB, 2009). B ibliogr afía AATRM. Grupo de trabajo de la Guía de Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Guía de Práctica Clínica sobre Osteoporosis y Prevención de Fracturas por Fragilidad. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Agència d´Avaluació de Tecnologia i Recerca Mèdiques de Cataluña (AATRM); 2010. Guías de Práctica Clínica en el SNS: AATRM Nº 2007/02 [Texto completo] Adomaityte J, Farooq M, Qayyum R.Effect of raloxifene therapy on venous thromboembolism in postmenopausal women. A metaanalysis. Thromb Haemost. 2008 Feb;99(2):338-42. PubMed PMID: 18278183 Avenell A, Gillespie WJ, Gillespie LD, O’Connell D. Vitamina D y análogos para la prevención de fracturas asociadas con la osteoporosis senil y postmenopáusica; 2008 (Revision Cochrane traducida). En: Biblioteca Cochrane Plus 2009 Número 3. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2009 Issue 2 Art no. CD000227. Chichester, UK: John Wiley & Sons, Ltd [Resumen]. Becker CB, Cohen A. Evaluation and treatment of premenopausal osteoporosis. Uptodate; version 18.3, septiembre 2010 [acceso 14/2/2011]. Disponible en: http://www.uptodate.com Bhuriya R, Singh M, Molnar J, Arora R, Khosla S. Bisphosphonate use in women and the risk of atrial fibrillation: A systematic review and meta-analysis. Int J Cardiol. 2010 Jan 3. PubMed PMID: 20051297 Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA et al; for the FLEX Research Group. Effects of Continuing or Stopping Alendronate After 5 Years of Treatment: The Fracture Intervention Trial Long-term Extension (FLEX): A Randomized Trial. JAMA. 2006;296(24):2927-2938. PubMed PMID: 17190893 Blake GM, Fogelman I. An update on dual-energy x-ray absorptiometry. Semin Nucl Med. 2010 Jan;40(1):62-73. PubMed PMID: 19958851 Cadarette SM, Jaglal SB, Murray TM, McIsaac WJ, Joseph L, Brown JP, for the Canadian Multicentre Osteoporosis Study (CaMos) Evaluation of Decision Rules for Referring Women for Bone Densitometry by Dual-Energy X-ray Absorptiometry JAMA. 2001;286:57-63 PubMed PMID: 11434827 Compston J, Cooper A, Cooper C, Francis R, Kanis JA, Marsh D, McCloskey EV, Reid DM, Selby P, Wilkins M; National Osteoporosis Guideline Group (NOGG). Guidelines for the diagnosis and management of osteoporosis in postmenopausal women and men from the age of 50 years in the UK. Maturitas. 2009 Feb 20;62(2):105-8. PubMed PMID: 19135323 Consensus development conference: prophylaxis and treatment of osteoporosis. Am J Med. 1991 Jan;90(1):107-10. PubMed PMID: 1986575 Cooper C, Atkinson EJ, Jacobsen SJ, O’Fallon WM, Melton LJ 3rd. Population-based study of survival after osteoporotic fractures. Am J Epidemiol. 1993 May 1;137(9):1001-5. PubMed PMID: 8317445 Cranney A, Wells GA, Yetisir E, Adami S, Cooper C, Delmas PD et al. Ibandronate for the prevention of nonvertebral fractures:a pooled analysis of individual patient data Osteoporos Int (2009) 20:291–297. PubMed PMID: 18663402 De Kam D, Smulders E, Weerdesteyn V, Smits-Engelsman BC. Exercise interventions to reduce fall-related fractures and their risk factors in individuals with low bone density: a systematic review of randomized controlled trials. Osteoporosis Int 2009; 20:21112125. PubMed PMID: 19421702 Don-Wauchope AC, Cole DE The (mis) use of bone resorption markers in the context of bisphosphonate exposure, dental surgery and osteonecrosis of the jaw. Clin Biochem. 2009 Jul;42(10-11):1194-6. PubMed PMID: 19265689 Finkelstein JS, Rosen CJ, Mulder JE. Treatment of osteoporosis in men. Uptodate; version 18.3, septiembre 2010 [acceso 14/2/2011]. Disponible en: http://www.uptodate.com Gillespie LD, Gillespie WJ, Robertson MC, Lamb SE, Cumming RG, Rowe BH. WITHDRAWN: Interventions for preventing falls in elderly people. Cochrane Database Syst Rev. 2009 Apr 15;(2):CD000340 [Resumen]. Grbic JT, Landesberg R, Lin SQ, et al. Health Outcomes and Reduced Incidence with Zoledronic Acid Once Yearly Pivotal Fracture Trial Research Group. Incidence of osteonecrosis of the jaw in women with postmenopausal osteoporosis in the health outcomes and reduced incidence with zoledronic acid once yearly pivotal fracture trial. J Am Dent Assoc. 2008 Jan;139(1):32-40. PubMed PMID: 18167382 Texto completo Hiligsmann M, Rabenda V, Gathon HJ, Ethgen O, Reginster JY. Potential Clinical and Economic Impact of Nonadherence with Osteoporosis Medications. Calcif Tissue Int. 2010 Jan 10. PubMed PMID: 20063188 Institute for Clinical Systems Improvement. Diagnosis and Treatment of Osteoporosis. 6 th ed. ICSI; September 2008 [acceso 3/5/2010]. Disponible en: [Entrar] Kanis JA, Burlet N, Cooper C, Delmas PD, Reginster JY, Borgstrom F, Rizzoli R; European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2008 Apr;19(4):399-428. PubMed PMID: 18266020 Texto completo Kanis JA, Johansson H, Oden A, McCloskey EV. Bazedoxifene reduces vertebral and clinical fractures in postmenopausal women at high risk assessed with FRAX. Bone. 2009 Jun;44(6):1049-54. PubMed PMID: 19254788 33 Reumatología Kiel DP, Magaziner J, Zimmerman S, Ball L, Barton BA, Brown KM et al. Efficacy of a Hip Protector to Prevent Hip Fracture in Nursing Home Residents: The HIP PRO Randomized Controlled Trial. JAMA. 2007;298:413-422 PubMed PMID: 17652295 Koike T, Orito Y, Toyoda H, Tada M, Sugama R, Hoshino M, Nakao Y, Kobayashi S, Kondo K, Hirota Y, Takaoka K. External hip protectors are effective for the elderly with higher-than-average risk factors for hip fractures. Osteoporos Int. 2009 Sep;20(9):1613-20. PubMed PMID: 19137351 Kothawala P, Badamgarav E, Ryu S, Miller RM, Halbert RJ. Systematic review and meta-analysis of real-world adherence to drug therapy for osteoporosis. Mayo Clin Proc. 2007 Dec;82(12):1493-501. PubMed PMID: 18053457 Texto completo Lash RW, Nicholson JM, Velez L, Van Harrison R, McCort J Diagnosis and management of osteoporosis. Prim Care. 2009 Mar;36(1):18198. PubMed PMID: 19231609 Lenart BA, Neviaser AS, Lyman S, Chang CC, Edobor-Osula F, Steele B, van der Meulen MC, Lorich DG, Lane JM. Association of lowenergy femoral fractures with prolonged bisphosphonate use: a case control study. Osteoporos Int. 2009 Aug;20(8):1353-62. PubMed PMID: 19066707 Li WC, Chen YC, Yang RS, Tsauo JY.Effects of exercise programmes on quality of life in osteoporotic and osteopenic postmenopausal women: a systematic review and meta-analysis. Clin Rehabil. 2009 Oct;23(10):888-96. PubMed PMID: 19717503 Loke YK, Jeevanantham V, Singh S.Bisphosphonates and atrial fibrillation: systematic review and meta-analysis. Drug Saf. 2009;32(3):219-28. PubMed PMID: 193383793 Lydick E, Cook K, Turpin J, Melton M, Stine R, Byrnes C. Development and validation of a simple questionnaire to facilitate identification of women likely to have low bone density. Am J Manag Care. 1998 Jan;4(1):37-48. PubMed PMID: 10179905 MOH Clinical Practice Guidelines 3/2008: Osteoporosis Ministry of Health Singapore Enero 2009 [acceso 14/2/2011]. Disponible en: http://www.moh.gov.sg/mohcorp/publications.aspx?id=22958 Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake increases bone mineral density in the spine of menopausal women: metaanalysis of randomized controlled trials. Clin Nutr. 2008 Feb;27(1):57-64. PubMed PMID: 18063230 MacLean C, Newberry S, Maglione M, McMahon M, Ranganath V, et al. Systematic Review: Comparative Effectiveness of Treatments to Prevent Fractures in Men and Women with Low Bone Density or Osteoporosis. Ann Intern Med.2008;148:197-213. PMID: 18087050 Texto completo Management of osteoporosis in postmenopausal women: 2010 position statement of The North American Menopause Society. Menopause. 2010 Jan-Feb;17(1):25-54; quiz 55-6 PubMed PMID: 20061894 Martyn-St James M, Carroll S. Meta-analysis of walking for preservation of bone mineral density in postmenopausal women. Bone. 2008 Sep;43(3):521-31. PubMed PMID: 18602880 Mitchner NA, Harris ST. Current and emerging therapies for osteoporosis. J Fam Pract. 2009 Jul; 58 (7 Suppl Osteoporosis):S45-9. PubMed PMID: 19825319 Mosca L, Grady D, Barrett-Connor E, Collins P, Wenger N, Abramson BL et al. Effect of raloxifene on stroke and venous thromboembolism according to subgroups in postmenopausal women at increased risk of coronary heart disease. Stroke. 2009 Jan;40(1):147-55. PMID: 18948611 Texto completo NICE. Alendronate, etidronate, risedronate, raloxifene, strontium ranelate and teriparatide for the secondary prevention of osteoporotic fragility fractures in postmenopausal women: Technology Appraisal 161 (issued October 2008) Disponible en: http://www.nice. org.uk/nicemedia/pdf/TA161guidance.pdf National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. January 2010 [acceso 14/2/2011]. Disponible en: http://www.nof.org/professionals/clinical-guidelines O’Donnell S, Cranney A, Wells GA, Adachi JD, Reginster JY. Ranelato de estroncio para la prevención y el tratamiento de la osteoporosis postmenopáusica; 2006 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus 2008 Número 4. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. (Traducida de The Cochrane Library, 2008 Issue 3. Chichester, UK: John Wiley Sons, Ltd.) [Resumen]. Parker MJ, Gillespie WJ, Gillespie LD. Effectiveness of hip protectors for preventing hip fractures in elderly people: systematic review. BMJ. 2006 Mar 11;332(7541):571-4. PubMed PMID: 16513687 Texto completo Pazianas M, Miller P, Blumentals WA, Bernal M, Kothawala P. A review of the literature on osteonecrosis of the jaw in patients with osteoporosis treated with oral bisphosphonates: prevalence, risk factors, and clinical characteristics. Clin Ther. 2007 Aug;29(8):1548-58. PubMed PMID: 17919538 Reginster JY, Felsenberg D, Boonen S, Diez-Perez A, Rizzoli R, Brandi. Effects of long-term strontium ranelate treatment on the risk of nonvertebral and vertebral fractures in postmenopausal osteoporosis: Results of a five-year, randomized, placebo-controlled trial. Arthritis Rheum. 2008 Jun;58(6):1687-95. PubMed PMID: 18512789 Reginster JY, Bruyère O, Sawicki A, Roces-Varela A, Fardellone P, Roberts A, Devogelaer JP. Long-term treatment of postmenopausal osteoporosis with strontium ranelate: results at 8 years. Bone. 2009 Dec;45(6):1059-64. PubMed PMID: 19679207 Rosen HN, Drezner MK. Diagnosis and evaluation of osteoporosis in postmenopausal women. Uptodate; version 18.3, septiembre 2010 [acceso 14/2/2011]. Disponible en: http://www.uptodate.com Schmitt NM, Schmitt J, Dören M. The role of physical activity in the prevention of osteoporosis in postmenopausal women-An update. Maturitas. 2009 May 20;63(1):34-8. PubMed PMID: 19356867 Sebba AI, Emkey RD, Kohles JD, Sambrook PN. Ibandronate dose response is associated with increases in bone mineral density and reductions in clinical fractures: Results of a meta-analysis Bone 44 (2009) 423–427. PubMed PMID: 19049913 Seeman E, Devogelaer JP, Lorenc R, Spector T, Brixen K, Balogh A, et al. Strontium ranelate reduces the risk of vertebral fractures in patients with osteopenia. J. Bone Miner Res. 2008 Mar;23(3):433-8. PubMed PMID: 17997711 Silverman SL, Christiansen C, Genant HK, Vukicevic S, Zanchetta JR, de Villiers TJ, Constantine GD, Chines AA. Efficacy of bazedoxifene in reducing new vertebral fracture risk in postmenopausal women with osteoporosis: results from a 3-year, randomized, placebo-, and active-controlled clinical trial. J Bone Miner Res 2008;23:1923–1934. PubMed PMID: 18665787 34 Osteoporosis Sontag A, Wan X, Krege JH.. Benefits and risks of raloxifene by vertebral fracture status. Curr Med Res Opin. 2010 Jan;26(1):71-6. PubMed PMID: 19908937 Stránský M, Rysavá L. Nutrition as prevention and treatment of osteoporosis. Physiol Res. 2009;58 Suppl 1:S7-S11. PubMed PMID: 19857038 Sweet MG, Sweet JM, Jeremiah MP, Galazka SS. Diagnosis and treatment of osteoporosis. Am Fam Physician. 2009 Feb 1;79(3): 193200. PubMed PMID: 19202966 Tang B, Eslick GD, Nowson C Smith C, Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis Lancet 2007; 370: 657–66. PubMed PMID: 17720017 Trevisani VF, Riera R, Imoto AM, Saconato H, Atallah AN.Teriparatide (recombinant human parathyroid hormone 1-34) in postmenopausal women with osteoporosis: systematic review. Sao Paulo Med J. 2008 Sep;126(5):279-84. PubMed PMID: 19099162 Texto completo U.S. Preventive Services Task Force (USPSTF). Screening for Osteoporosis in Postmenopausal Women Recommendations and RationaleRockville, MD: Agency for Healthcare Research and Quality, Research and Quality, January 2011 [acceso 12/2/2011]. Disponible en http://www.ahrq.gov/clinic/3rduspstf/osteoporosis/osteorr.htm. Vogel VG, Qu Y, Wong M, Mitchell B, Mershon JL. Incidence of invasive breast cancer in postmenopausal women after discontinuation of long-term raloxifene administration. Clin Breast Cancer. 2009 Feb;9(1):45-50. PubMed PMID: 19299240 Wells G, Cranney A, Peterson J, Boucher M, Shea B, Robinson V, Coyle D, Tugwell P. Risedronato para la prevención primaria y secundaria de las fracturas osteoporóticas en mujeres postmenopáusicas; 2007 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 2. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. [Resumen]. Wells GA, Cranney A, Peterson J, Boucher M, Shea B, Robinson V, Coyle D, Tugwell P. Alendronato para la prevención primaria y secundaria de las fracturas osteoporóticas en mujeres posmenopáusicas; 2007 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, Número 2, 2008, uptodate november 2010. Oxford: Update Software Ltd. Disponible en: http://www.updatesoftware.com [Resumen]. Wells GA, Cranney A, Peterson J, Boucher M, Shea B, Robinson V, Coyle D, Tugwell P. Etidronato para la prevención primaria y secundaria de las fracturas osteoporóticas en mujeres postmenopáusicas; 2007 (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 2. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. [Resumen] Zhong ZM, Chen JT. Anti-fracture efficacy of risedronic acid in men: A meta-analysis of randomized controlled trials. Clin Drug Investig. 2009;29(5):349-57. PMID: 19366276 ] Componentes del grupo Redactores Fisterra Emilio Casariego Vales. Especialista en Medicina Interna. Complexo Hospitalario Xeral-Calde de Lugo. Mª del Carmen Castiñeira Pérez. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyCSAP de Fingoy - Lugo. Carmen Costa Ribas. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyC- SAP de Fingoy - Lugo. Carlos González Guitian. Bibliotecario. Biblioteca del Complexo Hospitalario Universitario A Coruña (CHUAC). Arturo Louro González. Especialista en Medicina Familiar y Comunitaria - Tutor de atención primaria de la UD de MFyC- SAP de Cambre - A Coruña. Cristina Viana Zulaica. Especialista en Medicina Familiar y Comunitaria - Tutora de atención primaria de la UD de MFyC- SAP de Elviña-Mesoiro - A Coruña. Patricia Vázquez Millán. Especialista en Medicina Familiar y Comunitaria - Servizo Galego de Saúde - A Coruña- España [miembro del grupo desde 1/2008]. María Consuelo Naya Cendón. Especialista en Medicina Familiar y Comunitaria - Colaboradora docente de atención primaria de la UD de MFyC- PAC de Culleredo - A Coruña- España [miembro del grupo desde 9/2008]. Constituido como grupo en 2003 dentro de la Red Temática de Investigación sobre Medicina Basada en la Evidencia (Expediente FIS: G03/090) y reconocido por la Consellería de Innovación e Industria de la Xunta de Galicia dentro del Plan Galego de Investigación, Desenvolvemento e Innovación Tecnolóxica - INCITE (2006-2010) con una ayuda para consolidación y estructuración de unidades de investigación competitivas del sistema gallego de I+D+I. Código INCITE08ENA917089ES, resolución de la Consellería de Innovación e Industria del 9 de octubre de 2008. 35 TEMA 6 Mono y poliartritis I Fernando Prieto Formoso. Ana Zamora Casal M onoartritis , ¿ de qué habl amos? Una monoartritis se caracteriza por la presencia de signos inflamatorios en una sola articulación (membrana sinovial, ligamentos intrarticulares, cápsula articular). Se considera aguda si su duración es inferior a 6 semanas y crónica si persiste más de 6. Si se afectan 2 ó 3 articulaciones se habla de oligoartritis, y si más de 3, de poliartritis. En la exploración articular aparecen los signos cardinales: calor, rubor, tumefacción e impotencia funcional. En articulaciones profundas pueden no apreciarse, apareciendo el dolor como única guía de procesos inflamatorios, demorando el diagnóstico. En la inspección y la palpación puede ser difícil distinguir el origen articular del proceso por confundirse con la afectación periarticular (ligamentos extrarticulares, tendones, bolsas, músculos, fascia, hueso, nervios y piel), es en el estudio de los arcos de movimiento donde está el elemento diferenciador: si es articular el dolor aparece a la movilización activa y pasiva, si es extraarticular predomina claramente el dolor activo sobre la movilización pasiva. En cualquiera de las dos situaciones el arco de movimiento articular (es decir, la amplitud del movimiento articular) puede estar limitado por el dolor o por la contractura muscular concomitante. La rigidez articular es otro dato orientador crucial, en los procesos inflamatorios la rigidez es precipitada por el reposo prolongado y aparece por la mañana (rigidez matutina) persistiendo a menudo entre 30-60 minutos y va mejorando con la movilidad, en los procesos mecánicos suele aparecer durante reposos leves y se exacerba con la actividad, durando menos de 30 minutos. Tabla 1. Diagnóstico diferencial del origen del dolor por la exploración física. Origen del dolor Movilidad activa Movilidad pasiva Articular (sinovitis) Limitada Limitada Periarticular (bursitis,...) Limitada Normal Referido Normal Normal Pueden existir datos de afectación sistémica. En la anamnesis y exploración física, fiebre, fatiga, malestar, pérdida de peso o erupciones, y en las pruebas complementarias, elevación VSG, PCR, trombocitosis, anemia de trastornos crónicos o hipoalbuminemia. ¿C uáles son sus causas? Por su frecuencia o gravedad destacan entre todas las monoartritis las sépticas y las microcristalinas. En la artritis séptica la demora en su diagnóstico constituye la principal causa de destrucción articular. n Artritis microcristalinas. Son las más frecuentes, los cristales se estudian con microscopio de luz polarizada en el líquido sinovial. Tabla 2. Birrefringencia Cristales Radiología Ácido úrico sérico Respuesta colchicina Composición Gota Pseudogota Oxalato cálcico Negativa Positiva débil Positiva intensa Aguja Romboidales Bipiramidales Ostolitis geodas Condrocalcinosis cristales radiopacos Elevado (su normalidad durante un ataque no descarta una gota) Normal Normal ++++ +/- ++ Urato monosódico Pirofosfato cálcico Oxalato cálcico 37 Reumatología La Artritis gotosa es la de más prevalente, suele afectar a mayores de 40 años. Su primera manifestación es la afectación de la primera articulación MTF. Son factores desencadenantes: abusos dietéticos, ingesta alcohol, diuréticos, traumatismos locales, insuficiencia renal, … La Condrocalcinosis (Pseudogota). Puede desencadenarse ante procesos estresantes (cirugía, IAM, ACV…) pudiendo acompañarse de fiebre. Suele ser autolimitada y menos dolorosa que la gota. Afecta normalmente a la rodilla y se asocia a múltiples enfermedades. n Artritis séptica requiere un drenaje y terapia antibiótica IV inmediata. Se trata de una urgencia médica y el paciente debe ser remitido al hospital ante su sospecha. Suelen ser monoarticulares y afectar a articulaciones de gran tamaño. Los signos inflamatorios son muy llamativos, con dolor intenso (incluso en reposo), impotencia funcional marcada y precoz, y fiebre. Factores asociados: inmunodepresión, tratamientos con citotóxicos o corticoides, DM, insuficiencia renal, hepática, ADVP, conducta sexual de riesgo, instrumentación urogenital, … Tabla 3. Artritis sépticas. Etiología. Edad Gérmenes < 3 meses S. aureus, enterobacterias 3-6 meses S. aureus, H.influenzae, Steptococcus Adultos sin contactos sexuales de riesgo S. aureus, S. pneumoniae, enterobacterias Adultos con contactos sexuales de riesgo N. gonorrhoeae Por inoculación directa S. epidermidis, S. aureus, enterobacterias Prótesis S. aureus, S.epidermidis n Artritis reactivas: asociadas a infección gastrointestinal (Salmonella, Shigella, y Yersinia) o genitourinaria (Clamydea, Ureaplasma urealiticum, Neisseria). También se incluyen las artritis post-infección estreptocócica (Streptococo pyogenes). n Artritis postraumática: un traumatismo puede causar derrame agudo articular con o sin hemartros. Suelen mostrar edema, eritema y a veces equimosis. ¿C ómo orientar el diagnóstico? Anamnesis n Antecedentes personales y familiares: presencia de cuadros dolorosos agudos semejantes al actual. Despistaje de enfermedades que en su evolución se asocien con monoartritis (Enfermedad inflamatoria intestinal, hiperuricemia, Psoriasis, Síndrome de Reiter, …). Presencia de enfermedades reumáticas familiares. n Localización: indicar al paciente que debe señalar la zona dolorosa. Tener en cuenta que puede ser referido. n Forma de inicio: repentino en horas (orienta a artritis microcristalinas y bacterianas) o progresivo o insidioso como la artritis reumatoide. n Existencia de factores desencadenantes: exceso dietético, alcohólico, o traumatismo orienta a artritis gotosa). n Características del dolor: es importante diferenciar el dolor de tipo inflamatorio (no calma en reposo, rigidez matutina de más de 30 minutos) del dolor mecánico (aumenta con movilización y disminuye en reposo). Este último orienta más a procesos intrarticulares. n Tratamientos previos y respuesta a los mismos, tolerancia gastrointestinal a AINES, así como tratamientos actua- les por otras patologías. n Tiempo de evolución: los procesos agudos (duración <6 semanas) tienden a ser artritis infecciosas, inducidas por cristales o reactivas y, los crónicos (duración > 6 semanas) incluyen las artritis inflamatorias, no inflamatorias (artrosis) y la fibromialgia. n Forma de evolución: crónicos con brotes de dolor (artrosis), intermitentes (artritis por microcristales o enferme- dad de Lyme), migratorios (fiebre reumática, artritis gonocócica o vírica), o aditivos( artritis reumatoide, artritis psoriásica), palindrómicos. n Capacidad funcional del individuo: tipo de trabajo que realiza, horas diarias de ocupación, actividad doméstica, número de personas a su cargo, … Exploración física Se debe hacer un estudio sistemático por aparatos, según las lesiones que aparecen podemos intuir el diagnóstico. n Lesiones digestivas: n Úlceras orales: enfermedad de Behçet, síndrome de Reiter artritis enteropáticas, LES. 38 Mono y poliartritis n Diarrea: enfermedad inflamatoria intestinal, Whipple, reactiva. n Disfagia: esclerosis sistémica (ES). n Xerostomía: síndrome de Sjögren. n Lesiones oculares: n Uveítis: espondilitis anquilopoyética, artritis psoriásica (AP), enfermedad de Behçet, artritis crónica juvenil, sarcoidosis. n Queratoconjuntivitis: síndrome de Sjögren, LES, artritis reumatoide (AR). n Epiescleritis: AR. n Visión borrosa: arteritis temporal. n Xeroftalmía: síndrome de Sjögren. n Lesiones cutáneas: n Psoriasis cutánea: AP. n Eritema nodoso: infecciones, fármacos, sarcoidosis, enfermedad de Behçet. n Nódulos subcutáneos: AR, fiebre reumática. n Tofos: gota tofácea. n Eritema heliotropo: dermatomiositis. n Pápulas de Gottron: dermatomiositis. n Síndrome de Raynaud: ES, enfermedad mixta del tejido conectivo, AR, LES. n Esclerodactilia: ES. n Dactilitis o dedo en salchicha: espondiloartropatías. n Eritema en alas de mariposa: LES. n Lesiones fotosensibles: LES. n Cicatrices y alopecia cicatricial: Lupus discoide crónico. n Queratodermia blenorrágica (vesículas con hiperqueratosis que antes de desaparecer dejan costra. Más frecuentes en palmas y plantas): síndrome de Reiter. n Hiperqueratosis palmo-plantar: AP. n Lesiones urogenitales: n Úlceras genitales: enfermedad de Behçet, síndrome de Reiter, LES. n Uretritis/cervicitis: síndrome de Reiter. n Balanitis circinada (erosiones superficiales e indoloras en glande): síndrome de Reiter. Pruebas complementarias: n Artrocentesis. Es la clave del estudio, permite estudiar las características del líquido sinovial. Enviar rápidamen- te el líquido sinovial al laboratorio. De hecho ante una monoartritis con inflamación llamativa la incapacidad para realizar una artrocentesis es motivo para derivar al paciente a un servicio hospitalario, dada la destrucción articular que produce una artritis séptica no diagnosticada a tiempo. Tabla 4. Características del líquido sinovial. Líquido sinovial Aspecto Viscosidad Glucosa Leucocitos PMN (%) Tinción de Gram y cultivo, lo puse en vez de gérmenes Proteínas (mg/dl) Normal No inflamatorio Transparente, incoloro Transparente, amarillo Inflamatorio Séptico Translúcido, amarillo Opaco Alta Alta Baja Variable Normal Normal <50% glucemia <50% glucemia <200/mm3 200-2.000/mm3 2.000-50.000/mm3 50.000-150.000/mm3 <25 <25 >50 >75 Negativo Negativo Negativo Positivo 1.5-2.5 1.5-2.5 >2.5 >3 Ante la sospecha de una artritis infecciosa debemos solicitar hemocultivos, cultivos de orina, orofaringe…con el fin de localizar el origen infeccioso. Si la glucosa en el líquido sinovial es de 0, puede ser indicativo de artritis tuberculosa o reumatoide; si es <50 mg respecto a la glucemia indica líquido séptico. 39 Reumatología n Radiología: se estudiará la articulación afecta y la contralateral. Normalmente se objetiva aumento de partes blandas, aunque en ocasiones puede verse afectación del hueso subcondral, calcificaciones, u osteonecrosis... La ecografía puede confirmar el diagnóstico en múltiples patologías peri y yuxtarticulares. n Analítica: la solicitud inicial incluirá: hemograma, VSG y bioquímica (función renal, hepática y niveles de ácido úrico).La hiperuricemia por sí sola no es diagnóstica de gota. Todos los pacientes con gota tienen en algún momento niveles elevados en sangre de ácido úrico, pero pueden estar normales en el ataque agudo por lo que no deberíamos basar el diagnóstico sólo en este parámetro. Ante la sospecha de actividad biológica (aumento de VSG, PCR, trombocitosis, anemia normocítica y normocrómica) continuar estudios con el fin de filiar una posible etiología reumática. P oliartritis Se habla de poliartritis cuando hay presencia de signos inflamatorios en 3 o más articulaciones. Muchas poliartritis debutan inicialmente como monoartritis. Pueden seguir varios patrones de aparición: n Aditivo: la afectación de una articulación se suma a otras articulaciones inflamadas previamente. n Migratorio: aparición de una articulación inflamada tras la remisión completa de la inflamación de otra. n Palindrómico: ataques repetidos que desaparecen sin secuelas. Enfermedades más frecuentes que cursan con poliartritis aguda: 1. Artritis microcristalinas: n Gota: inicialmente se suele presentar con afectación monoarticular, pero a lo largo de la evolución puede hacerse poliarticular. Se asocia a tofos y nefropatía. El diagnóstico se realiza visualizando los cristales en el líquido sinovial. n Condrocalcinosis: aunque de predominio monoarticular puede aparecer como poliartritis manifestándose en brotes recurrentes. 2. Artritis reumatoide Es la enfermedad representativa de este grupo y una de las enfermedades centrales en el campo de la Reumatología. Más frecuente en mujeres, necesita 4 de los siguientes criterios para su diagnóstico: afectación simétrica de 3 o más articulaciones, afectación de articulaciones de las manos y pies, rigidez matutina > de una hora, afectación radiológica característica (erosiones), nódulos reumatoides y factor reumatoide positivo (75% sensibilidad en AR). 3. Espondiloartropatías seronegativas: n Espondilitis anquilosante. Afecta habitualmente a hombres jóvenes con dolor lumbar nocturno por afectación sacroilíaca en sus fases iniciales, ocasionando una gran rigidez en columna en su evolución con afectación de articulaciones axiales. n Artropatía psoriásica: asimétrica, erosiva y deformante. Existen varios subtipos pero la afectación más frecuente es la presentación mono-oligoarticular asimétrica en pequeñas articulaciones en manos y pies. 4. Infecciosas y reactivas: gonococica, heptitis B y C, VIH, fiebre reumática, síndrome de Reiter (artritis reactiva asociada a uretritis y conjuntivitis), enfermedad de Lyme (producida por la espiroqueta Borrelia burgdorferi, suele iniciarse con un eritema crónico migrans, lesiones cutáneas diseminadas, pudiendo darse afectaciones neurológicas e incluso cardíacas. En la fase crónica aparece una mono-oligoartritis de grandes articulaciones). 5. Enfermedades colágeno-vasculares: lupus eritematoso sistémico, esclerodermia, vasculitis, Sd Sjögren, polimiositis, enfermedad mixta del tejido conectivo, polimialgia reumática. Tabla 5. Manifestaciones articulares y extraarticulares de algunas poliartritis. Afectación Articulaciones más afectadas 40 E. anquilosante Reiter Esclerodermia Psoriasis Oligoarticular asimétrica Oligoarticular asimétrica Poliartritis Simétrica Mono u oligoarticular Asimétrica Sacroilíacas Columna Caderas Hombros Rodillas Tobillo 1/2 posterior pie Muñeca Dedos manos Manos Rodillas Dedos manos y pies, sacroileítis y afectación columna cervical(10-20% Mono y poliartritis Criterios de derivación: n Sospecha de artritis séptica. n Paciente con afectación importante del estado general y/o afectación importante del aparato locomotor. n Ante evidencia de líquido sinovial hemático sin trastorno de coagulación. n Sospecha de proceso neoplásico subyacente. n Fiebre elevada. A lgoritmo 41 Reumatología B ibliogr afía Cush JJ, Lipsky PE. Estudio de las enfermedades articulares y musculoesquelética. En: Fauci, Braunwald, Kasper, Hauser, Longo, jameson, Loscalzo, editors. Harrison Medicina Interna.17ª edición. McGraw-Hill interamericana editors SA, 2009:2149-57 Lingling MA, Cranney A, Jayna M. Acute monoarthritis: What is the cause of my patient’s painful swollen joint? CMAJ. 2009; 180(1):59-65. Baker JF, Schumacher HR. Update on gout and hyperuricemia. J Clin Pract. 2010; 64(3):371-7. Trejo RC. Diagnóstico diferencial de monoartritis. Reumatología. 2005; 21(4):222-5. 42 TEMA 7 I Artritis reumatoide Mercedes Freire González; Jenaro Graña Gil; Fausto Galdo Fernández; Antonio Atanes Sandoval; Francisco Javier Blanco García Luis Fernández Sueiro; José A. Pinto Tasende; J. Carlos Fernández López; Manuel Acasuso Diaz; Fe Maria Rodríguez Nuñez; Alberto Miranda Filloy; Natividad Orebro Villar; Alejandro San Martín Álvarez ¿D e qué habl amos? La Artritis Reumatoide (AR) es una enfermedad inflamatoria crónica caracterizada por inflamación articular, artralgias y destrucción sinovial dando lugar a una discapacidad severa y mortalidad prematura. Dada la presencia de autoanticuerpos como el factor reumatoide (FR) y anticuerpos anti péptidos citrulinados (anti-CCP), que pueden preceder a las manifestaciones clínicas de la AR por muchos años, la AR se considera una enfermedad autoinmune. La prevalencia se sitúa entre el 0,5 y el 1%. El factor de riesgo más potente proviene de ciertos alelos del complejo mayor de histocompatibilidad (HLA). Hay una prevalencia aumentada de AR asociada a un subgrupo de alelos DR4 en poblaciones de Europa Occidental o a un subgrupo de alelos DR1 en otras poblaciones como cohortes españolas, del país vasco o israelí. En pacientes con AR hay una secuencia de aminoácidos conservada representada en exceso, esta secuencia se sitúa en la tercera región hipervariable de las cadenas beta de DR del aminoácido 70-74. El epítopo compartido (EC) corresponde a la secuencia glutamina-leucina-arginina-alanina-alanina (QKRAA) y la presencia de este EC se asocia a un incremento de la susceptibilidad a AR y a la gravedad de la enfermedad (Gregersen PK, 1987). Otra reciente hipótesis sugiere que la producción de determinados autoanticuerpos especialmente los anticuerpos anti-CCP son los responsables de este vínculo genético. Recientemente con el estudio del genoma se ha ampliado la predisposición genética de la AR y una variante funcional (R620W) de la proteína tirosina fosfatasa intracelular N22 (PTPN22) se ha relacionado con el riego de presentar AR hasta 2 veces más en heterocigotos y cuatro veces en homocigotos portadores de este polimorfismo (Gregersen PK, 2005). La influencia de factores hormonales (estrógenos y progesterona) es bien conocida, así como la exposición a diversos factores ambientales como el tabaco. Y desde hace mucho tiempo los agentes infecciosos se han considerado factores desencadenantes de la AR, sin embargo la investigación sobre un agente etiológico específico ha sido infructuosa (Klareskog L, 2006). ¿C ómo se diagnostica? Historia clínica Las manifestaciones principales son el dolor y la tumefacción articular, de inicio insidioso, que se instaura en semanas o meses, aunque una minoría puede debutar como una poliartritis de inicio brusco. Las articulaciones más afectadas son las muñecas, metacarpofalángicas (MCF), interfalángicas proximales (IFP) y las metatarsofalángica (MTF). A medida que progresa se afectan las rodillas, tobillos, codos y hombros. La afectación articular es simétrica con rigidez matutina de más de 1 hora de duración. Además de estos síntomas articulares el paciente puede tener síntomas generales como fiebre, cansancio, pérdida de peso y mialgias. La afectación extraarticular puede afectar al 50% de los pacientes. La manifestación más frecuente es el síndrome de Sjögren que aparece en el 35% y que se caracteriza por sequedad bucal y ocular. Los nódulos reumatoides se presentan sobre superficies de presión como codos, tendón de Aquiles y dedos con una frecuencia del 25%. El 50% de los pacientes con AR tienen engrosamiento pleural en la necropsia, ya que suelen ser asintomáticos. Derrame pleural y pleuritis suelen ser bilaterales y hasta el 30% de los pacientes presenta enfermedad parenquimatosa pulmonar, incluyendo nódulos pulmonares. Exploración física A los pacientes con sospecha de AR se le debe hacer una exploración física inicial para estimar la extensión de la afectación articular y extraarticular. Las manifestaciones articulares como la tumefacción y el dolor a la palpación simétricos de las articulaciones son los hallazgos más frecuentes. Una sinovitis franca puede ser sutil precozmente pero a medida que la enfermedad progresa se hacen aparentes el calor, eritema leve y la hinchazón de las articulaciones. También deben identificarse las articulaciones dolorosasa la movilidad activa y/o pasiva, así como la amplitud del movimiento y las deformidades. 43 Reumatología La presencia de tumefacción articular indica una sinovitis activa, mientras que la deformidad, la disminución de la amplitud del movimiento, la alteración de la alineación o una luxación indican daño articular. Las manifestaciones extraarticulares se presentan en pacientes afectos de AR en algún momento de la evolución de la enfermedad por lo que debería realizarse una evaluación de órganos periódicamente y si aparecen nuevos síntomas. Tabla 1. Sistemas orgánicos afectados en la AR. Piel Nódulos Reumatoides (25-50%) Hematológico Anemia normocitica y normocromica (25-30%) Trombocitosis. Trombocitopenia. Linfadenopatia. Síndrome de Felty Esplenomegalia con neutropenia, linfocitos granulares grandes y trombocitopenia Hepático Transaminitis inespecífica Pulmonar Engrosamiento pleural, derrames pleurales, nódulos pulmonares, neuropatía intersticial difusa, BONO, síndrome de Kaplan, artritis cricoaritenoidea (Arteritis pulmonar, HP, retracción pulmonar). Cardiaco Pericarditis, arteriosclerosis acelerada, valvulitis Oftamológico Queratoconjuntivitis seca (10-15%), epiescleritis, escleritis, uveitis, queratitis ulcerativa Neurológico Neuropatía de compresión periférica, mielopatía cervical debida a subluxación d columna cervical Muscular Atrofia muscular, miositis inflamatoria Renal Nefropatía glomerular membranosa leve, amiloide reactivo Vascular Vasculítis de pequeños vasos, vasculítis sistémica Turesson C., 2003. La AR se diagnostica clínicamente. Una artritis poliarticular, simétrica que afecta a pequeñas articulaciones de las manos y de los pies en una mujer casi es exclusiva de esta enfermedad. Los anti-CCP y FR y la detección de cambios erosivos confirman el diagnóstico. A continuación se exponen los nuevos criterios 2010 para la clasificación de la AR. Criterios para la clasificación 2010 del American College of Rheumatologist/Europan League Against para AR: Población objetivo (¿Quién debe hacerse la prueba?). Pacientes que: 1. Tienen al menos una articulación con sinovitis clínica definitiva (edema). 2. Con sinovitis no explicada mejor por otra enfermedad. Los criterios tienen por objeto la clasificación de nuevos pacientes. Además, los pacientes con enfermedad erosiva típica de AR con una historia compatible con cumplimiento previo de los criterios de 2010 se deben clasificar como AR. Los pacientes con enfermedad de larga duración, incluidos aquellos cuya enfermedad está inactiva (con o sin tratamiento) que, basados en datos disponibles en forma retrospectiva, y que cumplan los criterios 2010 deben ser clasificados como AR. Los diagnósticos diferenciales varían entre los pacientes con diferentes presentaciones, pero pueden incluir Lupus eritematoso sistémico, artritis psoriásica y gota.. Criterios de clasificación de AR (Algoritmo basado en puntuación: sumar la puntuación de las categorías A-D, una puntuación de ≥6/10 es necesaria para clasificar a un paciente con AR definitiva. Los pacientes con una puntuación de <6/10 no pueden clasificarse como AR, su condición debe ser reevaluada y los criterios pueden cumplirse acumulativamente con el tiempo. A. Compromiso articular 1 articulación grande 0 2-10 articulaciones grandes 1 1-3 articulaciones pequeñas (con o sin compromiso de articulaciones grandes) 2 4-10 articulaciones pequeñas (con o sin compromiso de grandes articulaciones) 3 >10 articulaciones (al menos 1 articulación pequeña) 5 44 Artritis reumatoide B. Serología (al menos 1 resultado de la prueba es necesario para la clasificación) FR negativo y anti-CCP negativo 0 FR débil positivo o anti-CCP débil positivo 2 FR fuerte positivo o anti-CCP fuerte positivo 3 C. Reactantes de fase aguda (al menos 1 prueba es necesaria para la clasificación) PCR normal y VSG normal 0 PCR elevada o VSG elevada 1 D. Duración de los síntomas <6 semanas 0 ≥6 semanas 1 La afectación articular se refiere a cualquier articulación tumefacta o dolorosa, que puede ser confirmada por presencia de sinovitis en una prueba de imagen. Las articulaciones interfalángicas dístales (IFD), las primeras carpometacarpianas y las primeras metatarsofalángicas (MTF) están excluidas de la evaluación. Articulaciones grandes se refiere a hombros, codos, caderas, rodillas y tobillos. Articulaciones pequeñas se refiere a articulaciones metacarpofalángicas (MCF), articulaciones interfalángicas proximales (IFP), de la 2ª a 5ª MTF, articulaciones interfalángicas del pulgar y la muñeca. Cuando hay mas de 10 articulaciones afectas y 1 de ellas debe ser pequeña, las otras articulaciones pueden incluir otras articulaciones que no figuren en el listado previo como la temporomandiblar, acromioclavicular y esternoclavicular. En la serología cuando hablamos de resultado negativo se refiere a valores menores o iguales al límite superior de lo normal, positiva débil cuando los valores son más altos que el límite superior de lo normal pero ≤3 veces el límite superior normal y positiva fuerte se refiere a valores que son mas de 3 veces el límite superior normal. La duración de los síntomas se refiere a la duración de los signos y síntomas de sinovitis (dolor, tumefacción y sensibilidad al tacto) de las articulaciones que están afectadas clínicamente en el momento de la evaluación, independiente del estado del tratamiento (Funovits J, 2010). A nálisis de l abor atorio Una vez establecido el diagnóstico y determinada la seropositividad, no se debe realizar el análisis de FR y anti-CCP para el seguimiento de la actividad de la enfermedad. Los reactantes de fase aguda como son la VSG y la PCR son las mejores medidas de inflamación sistémica. Una VSG y PCR elevadas indican enfermedad activa y si son repetidamente elevadas indican riesgo de progresión de la enfermedad. El FR es detectable en el 75-85% de los pacientes durante el curso de la enfermedad, el 50% es positivo en los primeros 6 meses y el 85% se vuelve positivo en los primeros dos años. La sensibilidad para el diagnóstico es de un 66% y la especificidad de un 82%. En cuanto a los anti-CCP la sensibilidad es similar sin embargo la especificidad es alrededor de un 95%. Además el 35% de los pacientes FR (-) al inicio serán positivos para los anti-CCP. Cuanto mayor sea el valor de anticuerpos anti-CCP mayor será la correlación con enfermedad erosiva, incapacidad funcional y manifestación extraarticular (Schcllekens G, 2000). I ndices de actividad de l a enfermedad La evaluación de la actividad de la AR se obtiene por el conjunto de medidas clínicas, analíticas y radiológicas. El número de articulaciones dolorosas y tumefactas es la variable dominante en la evaluación global de la actividad. Una puntuación global de dolor del paciente, el grado de discapacidad funcional, la cifra de reactantes de fase aguda y la extensión de la progresión radiológica influyen en la valoración de la actividad. El DAS 28, escala que valora la actividad de la enfermedad, se calcula a partir del número de articulaciones dolorosas y tumefactas (28 articulaciones), la escala analógica visual de la actividad de la enfermedad por el paciente y el nivel sérico de PCR y VSG, nos ayuda a monitorizar la actividad de la enfermedad y a guiar las decisiones terapéuticas. 45 Reumatología Tr atamiento de l a artritis reumatoide El tratamiento debe dirigirse a disminuir al mínimo la actividad inflamatoria y evitar la progresión de la lesión estructural articular y sus consecuencias. La curación de la AR se considera todavía una utopía a pesar de los avances de los últimos años en el tratamiento. Por ello y con el objetivo de llegar a una remisión cuanto antes, los reumatólogos recomiendan un tratamiento intensivo y precoz con las terapias actuales. Los fármacos que en estudios controlados han demostrado que enlentecen o detienen la progresión de la enfermedad son los fármacos antirreumáticos modificadores de la enfermedad (FAME) entre los que destacan por su eficacia y rapidez de acción el Metotrexato (MTX), Sulfasalazina y Leflunomida. Se recomienda por orden alfabético las siguientes pautas para conseguir el objetivo terapéutico: 1. Leflunomida 20 mg/día 3 meses. 2. Metotrexato en escalada rápida: 7,5 mg semanales durante 1 mes y si al mes persiste la artritis se aumenta a 15 mg y si al mes todavía persiste se aumenta a 20 mg. Si después de 2 meses con esta dosis o la máxima tolerada por el paciente no se ha obtenido objetivo terapéutico, está indicado el cambio de tratamiento. Actualmente disponemos de fármacos biológicos que inducen remisión en muchos pacientes y modifican la evolución en otros. Es aconsejable integrar su uso dentro de una estrategia terapéutica de la enfermedad en general. El Consenso sobre fármacos biológicos que ha elaborado la Sociedad Española de Reumatología (SER), y que actualiza las pautas que se indicaron en el último consenso realizado en el 2006, recomienda un tratamiento intenso y precoz. La AR como hemos dicho es una enfermedad inflamatoria progresiva, lo que hace que el paciente pierda funcionalidad y vea seriamente reducida la calidad de vida. Las novedades de este consenso indican que el tratamiento más aconsejable es la combinación de un FAME como es el MTX con un fármaco biológico como son los anti-TNF (inhibidores del factor de necrosis tumoral) desde el momento más precoz posible. El objetivo de abordar la enfermedad desde un estadio precoz es alcanzar la remisión o en su defecto el menor grado de actividad posible. Para lograr un resultado más óptimo es necesario un acceso rápido a un tratamiento especializado, a través de las unidades de Artritis Precoz disponibles en la actualidad en diversos hospitales. La terapias biológicas están diseñadas para actuar sobre una diana terapéutica específica y son un gran avance en el tratamiento y el control de la progresión de la AR. Sin embargo hay que tener en cuenta que no se consigue una respuesta óptima en alrededor de un 40-50% de los pacientes, además muchos de estos fármacos dejan de ser eficaces con el tiempo. En la actualidad existen 7 agentes biológicos, 3 anti-TNF y otros 4 dirigidos a dianas terapéuticas concretas que juegan un papel importante en el proceso de la enfermedad. Los anti-TNF son superiores al MTX en monoterapia y en estudios controlados se ha visto que un tratamiento precoz con estos fármacos hace que se pueda llegar a una remisión duradera. Actualmente no existe datos para indicar que un anti-TNF es superior a otro, por lo que los 3 tipos de fármacos son necesario pero no sustituibles entre si, por lo que la elección depende tanto del criterio médico como de las circunstancias del paciente. Cuentan con diferentes estructuras y diferentes mecanismos de acción por lo que la falta de respuesta a uno de ellos no implica ineficacia del resto. La utilización de un agente biológico debe ir acompañada de un FAME y solo se utilizará como tratamiento único inicial en casos extraordinarios o en aquellos pacientes donde el primer tratamiento no haya logrado el objetivo terapéutico. La utilización de este tipo de fármacos requiere de una evaluación periódica de la evolución del paciente, que debe reducirse a 3 meses si no se consigue el objetivo terapéutico o incrementarse a 6 meses si la evolución es favorable. Es importante hacer hincapié que no se deben combinar 2 fármacos biológicos, ya que incrementa el riesgo de infecciones y sin aumento claro de eficacia. Es aconsejable no utilizar estos tratamientos en pacientes con infecciones activas o con antecedentes de las mismas. Una mención especial merece el riesgo de tuberculosis con clínica y localización atípicas. Se considera obligado excluir en todo paciente que vaya a recibir tratamiento biológico la existencia de tuberculosis activa o contacto reciente, así como investigar la infección tuberculosa latente. Se debe realizar una radiografía de tórax y una prueba de tuberculina (PPD). 46 Artritis reumatoide Si la induración es ≥5 mm a las 48-72 h se considera positivo y por lo tanto infección tuberculosa latente. Si es negativa o induración <5 mm se debe realizar otra prueba (Booster) 1-2 semanas después. Se debe poner tratamiento para la infección tuberculosa antes de iniciar el tratamiento biológico en los siguientes casos: 1. Contacto reciente con pacientes con tuberculosis documentada. 2. Antecedentes de tuberculosis parcialmente tratada. 3. PPD positivo. 4. Lesiones residuales en la radiografía de tórax. Se ha recomendado iniciar el tratamiento de infección tuberculosa latente 1 mes antes del inicio del biológico, aunque probablemente es suficiente con un intervalo de días o incluso iniciarlos simultáneamente. (Carmona L., 2005). C riterios de mal pronóstico El pronóstico es variable de unos pacientes a otros. El objetivo terapéutico actual es conseguir la minima actividad inflamatoria y mantenerla durante el mayor tiempo posible. Los tratamientos precoces e intensos mejoran el pronóstico en cuanto a incapacidad funcional, daño estructural y/o mortalidad. La mayoría de las alteraciones radiológicas y la pérdida de capacidad funcional se produce en los 2/3 primeros años de la evolución de la enfermedad, por lo que cuanto antes se establezca un pronóstico antes tomaremos una decisión sobre la estrategia terapéutica más adecuada. Se consideran factores predictivos de incapacidad funcional, erosiones radiológicas y/o mortalidad, los siguientes: n Factores sociodemográficos el sexo femenino, la edad al inicio de la enfermedad y el bajo nivel de estudios. n Factores dependientes de la enfermedad el FR positivo, la presencia de anti-CCP, el número elevado de arti- culaciones tumefactas, la elevación de reactantes de fase aguda, el HAQ ≥1, la afectación precoz de grandes articulaciones, la rapidez de aparición de erosiones y la presencia de manifestaciones extra-articulares (nódulos reumatoides, vasculitis) (Harrison BJ, 1996). El pronóstico en relación con el tratamiento ha cambiado como ha cambiado este en los últimos 15 años. Existe una asociación entre mayor tiempo de tratamiento con FAME y un mejor pronóstico funcional largo plazo. Los pacientes que tardan en iniciar el tratamiento tienen un peor pronóstico funcional. Cuanto mayor es el retraso en el inicio del tratamiento menor es la probabilidad de alcanzar una respuesta satisfactoria (Tsakonas E, 2000). B ibliogr afía Carmona L, Gómez-Reino JJ, Rodríguez-Valverde V, Montero D, Pascual-Gómez E, Mola EM, Carreño L et al. BIOBADASER Group. Effectiveness of recommendations to prevent reactivation of latent tuberculosis infection in patients treated with tumor necrosis factor antagonists. Arthritis Rheum. 2005 Jun;52(6):1766-72. PubMed PMID: 15934089 Drosos AA. Epidemiology of rheumatoid arthritis. Autoimmun Rev. 2004 Jun;3 Suppl 1:S20-2. Review. PubMed PMID: 15309773. Funovits J, Aletaha D, Bykerk V, Combe B, Dougados M, Emery P, et al. The 2010 American College of Rheumatology/European League Against Rheumatism classification criteria for rheumatoid arthritis methodological report phase I (Ann Rheum Dis 2010 sep;69(9):1589-95. PubMed PMID: 20872596 Gregersen PK, Silver J, Winchester RJ. The shared epitope hypothesis. An approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthritis Rheum 1987;30:1205-1213 PubMed PMID:2446635. Gregersen PK. Pathways to gene identification in rheumatoid arthritis: PTPN22 ant beyond. Immunol Rev 2005;204:74-86 PbMed PMID: 15790351 Harrison BJ, Symmons DP, Brennan P, Barrett EM, Silman AJ. Natural remission in inflammatory polyarthritis: issues of definition and prediction. Br J Rheumatol. 1996 Nov;35(11):1096-100. PubMed PMID: 8948295 Texto completo Klareskog L, Stolt P, Lundberg K, Källberg H, Bengtsson C, Grunewald J et al. A new model for an etiology of rheumatoid arthritis: smoking may trigger HLA-DR (shared epitope)-restricted immune reactions to autoantigens modified by citrullination. Arthritis Rheum 2006;54:38-46. PubMed PMID:16385494. Texto completo Tornero Molina J, Sanmartí Sala R, Rodríguez Valverde V, Martín Mola E, Marenco de la Fuente JL, González Avaro I et al. Segunda actualización del Consenso de la Sociedad Española de Reumatologia sobre la Terapia Biológica en la Artritis Reumatoide ReumatolClin.2010;6(1):23–36 Texto completo Schcllekens G, Visser H, de Jong B. The diagnostic properties of rheumatoid arthritis antibodies recognizing a cyclic citrullinated peptide. Arthritis Rheum 200;43:155-163 PubMed PMID: 0643712 Texto completo Tsakonas E, Fitzgerald AA, Fitzcharles MA, Cividino A, Thorne JC, M’Seffar A, et al. Consequences of delayed therapy with secondline agents in rheumatoid arthritis: a 3 year followup on the hydroxychloroquine in early rheumatoid arthritis (HERA) study. J Rheumatol. 2000 Mar;27(3):623-9. PubMed PMID: 10743799 Turesson C, O Fallon W, Crowson C. Extra-articular disease manifestations in rheumatoid arthritis: incidence trends and risk factors over 46 years. Ann Rheum Dis 2003;62:722-727 PMID:12860726 Texto completo 47 TEMA 8 Ana Castaño Carou. Bruno Castro Míguez ¿D e I Artrosis qué habl amos? La artrosis (OA) es una enfermedad degenerativa que se produce al alterarse las propiedades mecánicas del cartílago y del hueso subcondral y que, a su vez, es expresión de un grupo heterogéneo de patologías de etiología multifactorial, con manifestaciones biológicas, morfológicas y clínicas similares (Miguel de E, 2000). La OA es la enfermedad articular más frecuente y es la causa más importante de discapacidad entre los ancianos en nuestro país y en otros del mundo occidental. Su prevalencia en España es de un 10,2% para OA de rodilla y de 14% para OA de manos. Las enfermedades osteomusculares están relacionadas con el 50.7% de las incapacidades laborales. La OA es la enfermedad más frecuente tanto en número de episodio de Incapacidad Temporal como en número de días de pérdida laboral (Laffon A, 2001; Martín Lascuevas P, 1992). Aunque las causas de OA no son completamente conocidas, se sabe que en el desarrollo de la enfermedad intervienen factores bioquímicos, biomecánicos, inmunológicos y de la respuesta inflamatoria. La teoría más generalizada defiende que se produce un desequilibrio entre el programa catabólico y el anabólico del condrocito, cuyo resultado final es una destrucción acelerada de la degradación de la matriz extracelular (Miguel de E, 2000). La OA puede estar asociada o ser causada por (Miguel de E, 2000): n Factores genéticos. n Sexo femenino. n Edad (mayor edad). n Obesidad (IMC >30). n Ocupación y actividad laboral. n Práctica de deporte profesional. n Alteraciones de la alineación. n Traumatismos o artritis previas (sépticas, sobre todo). n Trastornos del desarrollo o enfermedades congénitas: factores mecánicos y locales (diferente tamaño de las piernas, varo o valgo exagerado, síndrome de hipermovilidad, escoliosis), displasias óseas n Menopausia. n Enfermedades por depósito de calcio. n Enfermedades metabólicas: hemocromatosis, ocronosis, enfermedad de Gaucher, hemoglobinopatía, Ehlers- Danlos. n Enfermedades endocrinas: diabetes mellitus, acromegalia, hipotiroidismo, hiperparatiroidismo. n Otras enfermedades óseas y articulares: necrosis avascular artitis reumatoide, artritis gotosa, artritis séptica, enfermedad de Paget, osteoporosis, osteocondritis. ¿C ómo se manifiesta clínicamente ? Desde el punto de vista clínico se caracteriza por (Miguel de E, 2000; Kalunian KK, 2005): n Dolor de características mecánicas, en relación con el uso de la articulación. Puede ser intermitente y autolimi- n n n n n tado en su inicio y más persistente conforme avanza la enfermedad. Cuando aparece durante el reposo y por la noche suele indicar enfermedad severa, aunque hay que descartar otros diagnósticos. Rigidez: después de un período de inactividad. Es característica la rigidez matutina menor de 30 minutos. Limitación de la función articular e inestabilidad. Deformidad articular y aumento del tamaño articular. Grados variables de inflamación local. Incapacidad funcional, que ocasiona problemas de dificultad para la deambulación o realización de tareas de la vida diaria, generando trastornos ansiosos y depresivos entre los afectados. Cualquier articulación puede verse afectada por OA, aunque tiene predilección por algunas de ellas y suele respetar otras. Las localizaciones más frecuentes de OA primaria son: manos (interfalángicas distales y proximales, articulación 49 Reumatología trapeciometacarpiana de primer dedo), rodillas, caderas, columna cervical y lumbar y pies (metatarsofalángica del primer dedo). Es raro que afecte a: hombro, codo, carpo, tarso y tobillo. Su implicación debe hacernos buscar otra etiología, sobre todo traumática y metabólica. La exploración articular muestra áreas de sensibilidad y dolor a la presión o al movimiento, crepitación, deformidad, ensanchamiento óseo, restricción de movimientos articulares y, en etapas avanzadas subluxaciones. Los derrames articulares no son infrecuentes. En la OA de rodilla la debilidad y la atrofia muscular también son frecuentes. D iagnóstico de l a OA El diagnóstico de la OA es clínico y radiológico. La radiología por sí misma no es diagnóstica, mientras el 60-70% de las personas mayores de 60 años presentan alteraciones radiográficas de OA, sólo el 20% tienen sintomatología de enfermedad. En las extremidades es aconsejable realizar radiografía de la articulación contralateral ya que habitualmente las lesiones son bilaterales y asimétricas. Los hallazgos radiológicos traducen los cambios patológicos que ocurren en la OA y son: n Pinzamiento o estrechamiento del espacio articular. n Esclerosis subcondral. n Osteofitos. n Quistes subcondrales. n Luxaciones articulares y/o alteraciones del alineamiento óseo. Actualmente, desde el punto de vista clínico no está justificado realizar una ecografía o una RMN para el diagnóstico de OA, sin embargo, estas dos técnicas pueden ser de ayuda para descartar otras patologías asociadas (bursitis, meniscopatías,...). La artroscopia es un procedimiento que permite la visualización e instrumentación en patología articular sin necesidad de apertura quirúrgica. Su principal finalidad es terapéutica, permite realizar lavados articulares para la extracción de cuerpos libres y reparar lesiones que se pueden asociar a la OA como meniscopatía degenerativa. No existen pruebas de laboratorio específicas para la OA. La velocidad de sedimentación globular, el hemograma, bioquímica y orina elemental son normales. El líquido sinovial es viscoso, filante, transparente y con escasa celularidad (con menos de 2.000 células por microlitro). Tr atamiento Los objetivos del tratamiento de la artrosis son: fomentar la educación sanitaria del paciente respecto a la artrosis y su tratamiento, aliviar el dolor, mantener o mejorar la función articular y retrasar la progresión del daño estructural de las distintas articulaciones (Pendleton A, 2003). El tratamiento de esta enfermedad debe ser individualizado y multidisciplinar (Garret W, 2003; Manek NJ, 2001; Hochberg MC, 1995; Conhaghan PG, 2008). Las modalidades terapéuticas pueden clasificarse en tres grandes grupos: tratamiento no farmacológico, tratamiento farmacológico y tratamiento quirúrgico: Tratamiento no farmacológico Debería constituir una parte integral del plan terapéutico (Conhaghan PG, 2008). El tratamiento no farmacológico se considera la piedra angular en el tratamiento de la OA y debería mantenerse siempre para el control de la enfermedad. Las medidas farmacológicas son más efectivas cuando se combinan con medidas no farmacológicas. El tratamiento de la artrosis debe individualizarse en función de los factores de riesgo de la misma, la sintomatología y discapacidad, los signos inflamatorios, localización y grado de lesión estructural, y de los deseos y expectativas del paciente (Pendleton A, 2003; Zhang W, 2005; Zhang W, 2007). La información al enfermo y a sus familiares acerca de la artrosis, autocuidados, ejercicios y nutrición mejora la relación médico paciente y algunos parámetros relacionados con la calidad de vida (Hochberg MC, 1995; Barlow JH, 2000). La educación pretende estimular la autoeficiencia y modificar el comportamiento. Su objetivo debe ser enseñar al paciente a vivir de acuerdo con sus limitaciones articulares, evitando sobrecargas, modificando posturas incorrectas y realizando actividades adecuadas (Tejedor Varillas A, 2009). El apoyo de los servicios sociales, la terapia ocupacional y las terapias físicas pueden resultar útiles en determinadas ocasiones. Ya que el sobrepeso es un factor de riesgo de artrosis es aconsejable intentar conseguir un peso apropiado (Kalunian KK, 2005; ICSI, 2003; ACR, 2000). En la artrosis de rodilla una reducción del 10% del peso mediante una dieta supervisada de ocho semanas produjo una mejoría funcional del 24,5% en WOMAC (Western Ontario and McMaster Universities index) (Tejedor Varillas A, 2009). 50 Artrosis Ejercicio físico. Hay suficiente evidencia científica sobre la eficacia del ejercicio en el alivio del dolor, mejoría subjetiva global del paciente y mejoría de parámetros funcionales en los pacientes con OA. Aún no se ha determinado la pauta de ejercicio óptima (Pendleton A, 2003), a pesar de lo cual se recomienda realizar ejercicio de forma constante o, al menos, 3 días por semana, durante no menos de 20 ó 30 minutos en cada sesión. Se debe evitar la sobrecarga articular, eliminando fuertes y repetidos impactos sobre las articulaciones dañadas, a fin de preservarlas de un posible desgaste adicional por sobreuso. Debemos recomendar la práctica regular de ejercicio suave y adaptado a las diferentes condiciones del paciente, como una indicación más de su tratamiento (Riemsma RP, 2005; Fransen M, 2005). El uso de dispositivos externos en pacientes con artrosis de rodilla está respaldado por una evidencia débil, excepto para los dispositivos de ortosis de la rodilla que reducen el dolor y mejoran la función (Pendleton A, 2003). No hay evidencia que apoye el uso de estos dispositivos en la artrosis de cadera (Zhang W, 2005). En las recomendaciones EULAR (European League Against Rheumatism) para el control de la artrosis de manos se recomienda el uso de calor local o ultrasonidos, antes o en combinación con ejercicio, esta recomendación está basada en la opinión de expertos, no hay estudios que lo evidencien (Zhang W, 2007). Tratamiento farmacológico El tratamiento farmacológico es básicamente para el control de síntomas. Actualmente no existe ningún fármaco al que se le haya reconocido de forma definitiva capacidad para frenar la enfermedad artrósica. La mayor parte de los estudios que evalúan el tratamiento farmacológico de la artrosis se realizan en población seleccionada y homogénea, sobre todo con artrosis de rodilla y/o cadera, por lo que la evidencia obtenida puede no ser directamente aplicable a la totalidad de la población con artrosis, ya que se excluyen variables que pueden influir en el resultado, a pesar de lo cual los resultados se aplican en pacientes con artrosis en cualquier localización (Tejedor Varillas A, 2009; Zhang W, 2005; Zhang W, 2007; Svensson O, 2006). n Paracetamol La mayoría de las guías para el tratamiento de la OA recomiendan el Paracetamol como fármaco de primera elección para el control del dolor y solo el fracaso de este fármaco es indicación de iniciar otra terapia (Pendleton A, 2003; Conhaghan PG, 2008; Zhang W, 2005; Zhang W, 2007; Berenbaum F, 2008). La indicación de paracetamol se base en su eficacia, seguridad y en la relación coste-beneficio (Tejedor Varillas A, 2009). Tiene eficacia comprobada en el tratamiento del dolor de la OA leve y es seguro a largo plazo. Es menos efectivo que los antiinflamatorios no esteroideos (AINE) en en control del dolor moderado-grave (Towheed TE, 2005; Zhang W, 2004). Respecto a la seguridad gastrointestinal del paracetamol, dos estudios observacionales (Rahme E, 2002; García Rodríguez LA, 2001) han generado controversia, sugiriendo que el uso de este fármaco a dosis menores de 2 gr/día no incrementa dicho riesgo (Berenbaum F, 2008; Towheed TE, 2005; Gonzalez-Perez A, 2006). Son necesarios nuevos estudios que confirmen o rechacen la seguridad gastrointestinal del paracetamol a altas dosis (Gonzalez-Perez A, 2006). Actualmente la conclusión clínica aboga por un mejor perfil del paracetamol comparado con los AINE no selectivos en cuanto a seguridad gastrointestinal y se recomienda como fármaco de primera elección (Pendleton A, 2003; Conhaghan PG, 2008; Zhang W, 2005; Zhang W, 2007; Berenbaum F, 2008). La guía NICE (National Institute for Health and Clinical Excellence) recomienda su uso como segundo paso para el alivio del dolor en la artrosis, después de las medidas no farmacológicas: paracetamol y/o aines tópicos (NICE, 2008). Debe usarse con precaución en: hepatopatías, pacientes anticoagulados (sigue siendo el fármaco de elección aunque es necesario hacer un control más estricto del INR) (Tejedor Varillas A, 2009) y consumo excesivo de alcohol. Está indicado en pacientes con función renal alterada. n Opioides En pacientes con dolor crónico severo que no se controla con Paracetamol o con AINEs o en los casos en que estos estén contraindicados, una alternativa adecuada pueden ser los opiáceos menores como la Codeína, el Dextropropoxifeno o el Tramadol (Pendleton A, 2003; Conhaghan PG, 2008; Zhang W, 2005). Pueden utilizarse solos o en combinación con Paracetamol, AINEs... También pueden ser útiles en pautas cortas en pacientes con exacerbaciones agudas para tratar el dolor (Kalunian KK, 2005). Muchos pacientes incumplen el tratamiento con opioides por sus efectos secundarios (Noble M, 2010), motivo por el que no se recomienda su uso rutinario incluso en el dolor severo (Nüesch E, 2009). El uso de opiáceos mayores no parece justificado en el tratamiento de la artrosis, si bien recientemente se ha aprobado el uso de Fentanilo y Buprenorfina transcutáneo en el tratamiento del dolor crónico severo no oncológico, pero los potenciales efectos secundarios y sobre todo la tolerancia y dependencia a esta clase de fármacos limita su uso en la artrosis a situaciones excepcionales (Langford R, 2006; Choquette D, 2008). La guía NICE sugiere la utilización de opiodes en pacientes tratados con paracetamol y/o AINEs tópicos con insuficiente alivio del dolor, una vez valorados los riesgos/beneficios de estos fármacos sobre todo en ancianos (NICE, 2008). 51 Reumatología n Analgésicos y otros AINEs tópicos Puede ser útil la capsaicina tópica en pacientes con OA de rodilla con dolor leve-moderado, que no responden al Paracetamol y/o que no quieren tomar medicación sistémica (Pendleton A, 2003; Conhaghan PG, 2008; Tejedor Varillas A, 2009; ACR, 2000; Zhang W, 2007). Puede usarse en monoterapia o asociada a Paracetamol. Su mayor beneficio se obtiene por el uso repetido a partir de tres a siete días de uso. Se recomienda aplicar 4 veces al día en la zona del dolor durante 6-8 semanas (Kroenke K, 2009). Su mayor utilidad es en OA de manos y rodilla. Como efecto secundario destaca la sensación de calor y enrojecimiento local durante los primeros días de tratamiento (Towheed TE, 2005). Los AINEs tópicos son muy usados y bien tolerados (Pendleton A, 2003; Barthel HR, 2009; Biswal S, 2006). Son preparados seguros que no presentan efectos secundarios gastrointestinales, siendo las reacciones locales cutáneas su principal secundarismo (Pendleton A, 2003; Zhang W, 2007; Underwood M, 2008). Una revisión sistemática sobre el uso de AINEs tópicos concluyó que son efectivos en el alivio del dolor (Moore RA, 1998), aunque una revisión posterior (Lin J, 2004) mostró que la eficacia en la reducción del dolor frente a placebo era a corto plazo (2 semanas). Nuevos estudios han demostrado que mejoran el dolor y la funcionalidad de pacientes con artrosis de rodilla y mano (Barthel HR, 2009; Biswal S, 2006; Altman RD, 2009). El estudio TOIB (Underwood M, 2008) concluye que aconsejar preparaciones tópicas u orales tiene un efecto equivalente en la artrosis de rodilla. Se indican como tratamiento adyuvante o en monoterapia en pacientes con dolor leve-moderado mono y oligoarticular. La guía NICE recomienda, después de las medidas no farmacológicas, el uso de paracetamol y/o AINEs tópicos para el alivio del dolor. La guía de la SEMFYC considera su uso como una alternativa eficaz en el tratamiento del dolor leve-moderado en articulaciones accesibles. La guía EULAR recomienda el uso de AINEs tópicos y capsaicina en la artrosis de mano y rodilla, por su efectividad comparada con placebo y porque no causa efectos secundarios sistémicos (Pendleton A, 2003; Zhang W, 2007). No hay trabajos que comparen el mismo AINE administrado vía oral versus vía tópica o que compare la efectividad con otras terapias habituales. n AINE Los AINEs son fármacos más efectivos que el paracetamol para el control del dolor en pacientes con artrosis (Berenbaum F, 2008; Wegman A, 2004). La guía NICE y las recomendaciones de la EULAR indican su uso cuando el tratamiento con paracetamol o AINEs tópicos ha fracasado o es insuficiente. Algunos autores recomiendan, sin embargo, iniciar el tratamiento con AINEs, especialmente si el cuadro clínico cursa con signos inflamatorios. En general es conveniente iniciar el tratamiento con dosis bajas en caso de dolor leve o moderado y solo utilizar dosis máximas cuando han fracasado las anteriores, o en caso de dolor severo, o en presencia de signos inflamatorios. Como norma se evitará la asociación de AINE, se usará la menor dosis posible, durante el menor tiempo posible. En cuanto a la elección del AINE a utilizar, no existen diferencias significativas en cuanto a la eficacia de uno u otro, pero puede haber variaciones en las respuestas individuales. La elección debe ser individualizada según las patologías concomitantes que padezca el enfermo, la medicación concomitante que esté recibiendo y los factores de riesgo de sufrir evento gastrointestinal alto severo (Towheed T, 2005; Watson MC, 2005; Brooks PM, 1991). Los factores de riesgo de sangrado gastrointestinal alto en pacientes tratados con AINEs son (Rostom A, 2003; Koch M, 1996): n Pacientes de 65 años o más. n Historia de úlcera péptica o sangrado digestivo alto. n Uso concomitante de corticoides orales. n Uso concomitante de anticoagulantes. n Comorbilidad. n Posiblemente consumo de alcohol y tabaco. Al elegir un AINE también debemos tener en cuenta características del propio fármaco, por ejemplo, el uso de indometacina debe evitarse por su efecto condrolesivo. También hay que tener en cuenta los factores de riesgo individuales (Conhaghan PG, 2008). Los AINE tienen más probabilidad de producir eventos gastrointestinales, que son dosis dependiente. En las situaciones en las que debemos iniciar tratamiento con AINEs y el paciente tiene riesgo de desarrollar eventos graves gastrointestinales altos, el fármaco seleccionado debe ser un AINE inhibidor selectivo de la isoenzima 2 de la ciclooxigenasa (COXIB) (distinto del etoricoxib 60 mg) (Conhaghan PG, 2008) o el uso conjunto de un AINE no selectivo con agentes gastroprotectores: inhibidores de la bomba de protones (IBP), misoprostol o dosis dobles de antagonistas del receptor H2. 52 Artrosis Los COXIBs (Celecoxib y etoricoxib) tienen una eficacia similar a los AINE tradicionales pero con menos toxicidad gastrointestinal (Silverstein FE, 2000; Wall R, 2007; Laine L, 2007). Sin embargo la guía NICE recomienda el uso concomitante de inhibidores de la bomba de protones con AINEs o COXIBs (distinto del etoricoxib 60 mg) y, en el caso de precisar tratamiento con dosis bajas de aspirina desaconseja el uso de AINEs/COXIBs. La American Heart Association (AHA) publicó en 2007 que los COXIB tienen importantes efectos adversos cardiovasculares por lo que deberían utilizarse con precaución en pacientes con factores de riesgo cardiovascular (RCV) (Antman EM, 2007). Las críticas a esta revisión de la AHA se basaron en la dificultad de diferenciar el RCV entre AINE clásicos y selectivos (Towheed TE, 2005). Varios estudios se han llevado a cabo para determinar el RCV asociado con AINEs clásicos y selectivos, encontrándose que ambos se asocian con incremento moderado del RCV excepto el naproxeno (Curtis SP, 2006; White WB, 2007; Combe B, 2009). Los AINEs también tienen efectos secundarios cardiorrenales, producen alteraciones de la tensión arterial (TA), hepatopatías y empeoramiento de la Insuficiencia Cardíaca Congestiva (ICC). Se ha visto que los COXIBs pueden alterar las cifras de TA (Krum H, 2009; Baraf HS, 2007), tienen menos efectos secundarios hepaticos (Combe B, 2009; Laine L, 2009) y se ha sugerido una tendencia a producir ICC dosis-dependiente (Krum H, 2009). n Glucocorticoides intraarticulares Hay evidencia de que los glucocorticoides intraarticulares son eficaces en el alivio del dolor y de la función articular pero sus beneficios son a corto plazo (Saffie F, 1989; Ravaud P, 1999; Kullenberg B, 2004; Stahl S, 2005). La evidencia de predictores de respuesta está poco clara y se precisan más estudios para resolver esta cuestión (Chao J, 2010). No se ha demostrado que dañen el cartílago articular (Kullenberg B, 2004; Raynauld JP, 2003). La mayoría de guías recomienda su uso en pacientes con OA con dolor moderado-severo, con exacerbación del dolor y/o signos de derrame articular (Hochberg MC, 1995; ACR, 2000), y cuando no responden a tratamiento analgésico o antiinflamatorio (Pendleton A, 2003; Conhaghan PG, 2008; Zhang W, 2005; Zhang W, 2007), pudiendo administrarse en monoterapia o asociados a estos tratamientos. La aplicación guiada por ultrasonidos obtiene mejores resultados clínicos (Sibbitt WL, 2009) y la guía EULAR de cadera recomienda el empleo de dicha técnica o Rx (Zhang W, 2005). Se aconseja una inyección a intervalos no inferiores a 2 semanas, con un máximo de 3-4 inyecciones al año (Tejedor Varillas A, 2009). n Sulfato de glucosamina, Condroitín Sulfato y Diacereína Estos fármacos tienen en común su acción lenta sobre los síntomas de la artrosis. En algunos países están clasificados como suplementos nutricionales y no como fármacos de prescripción. Son ampliamente autoadministrados y seguros, con pocos efectos secundarios, sobre todo gastrointestinales y generalmente reversibles. Su uso es controvertido en la artrosis, a pesar de la publicación de algunos estudios que mostraron una respuesta terapéutica de inicio lento pero que persiste hasta 3 meses después de finalizado el tratamiento (Rintelen B, 2006; Poolsup N, 2005). Un metanálisis de la Cochrane (Reichenbach S, 2007) desaconseja el uso del condroitin sulfato de forma rutinaria. Otra revisión Cochrane reciente concluyó que la glucosamina (preparación Rotta) se mostró más eficaz que placebo en el alivio del dolor y de la mejoría funcional. Las presentaciones no-Rotta no demostraron ningún beneficio (Towheed T, 2005). La heterogenicidad entre los estudios publicados puede sobreestimar los resultados (Reichenbach S, 2007), también las diferencias metodológicas en los metanálisis pueden influir en los mismos (Bruyere O, 2008). Se han publicado estudios (Reginster JY, 2001; Pavelka K, 2002; Dougados M, 2001) que demostraron la capacidad la glucosamina y diacereína de regenerar el cartílago articular. Sin embargo hay escasa evidencia que avale esto a día de hoy, por lo que son necesarios nuevos estudios de investigación en esta línea (Poolsup N, 2005; Fidelix TS, 2006). La guía NICE no recomienda el uso de glucosamina ni de condroitín sulfato en el tratamiento de la artrosis (NICE, 2008). Tratamiento quirúrgico Cuando el paciente con OA sintomática presenta un dolor que no responde a tratamiento médico o una limitación progresiva para la realización de las actividades de la vida diaria deben valorarse las opciones quirúrgicas. La derivación al hospital es recomendable antes de que la limitación funcional sea prolongada y el dolor severo (Conhaghan PG, 2008). El recambio articular se indica en pacientes con evidencia radiológica de OA que tienen dolor y una importante discapacidad y, en los que otras modalidades terapéuticas han fracasado. En la rodilla se realiza con frecuencia desbridamiento artroscópico, porque la artroscopia tiene menos complicaciones que otra técnicas quirúrgicas utilizadas en el tratamiento de la artritis degenerativa de rodilla, y no afecta a la realización posterior de otras técnicas, como la artroplastia, sin embargo, hasta la fecha no se ha demostrado su utilidad, es más, los últimos estudios publicados, con mayor nivel de evidencia, confirman que su utilidad es menor de lo que se presumía. 53 Reumatología Las osteotomías pueden aliviar el dolor y prevenir la progresión de la enfermedad en pacientes adecuadamente seleccionados. La artroplastia total de rodilla proporciona un gran alivio del dolor y una gran mejoría funcional en la mayoría de los pacientes, y ha demostrado ser coste-efectiva en pacientes seleccionados (Hawker G, 1998; Wai EK, 2002). Se considera indicada cuando hay dolor severo y evidencia radiológica de disminución del espacio articular. En la cadera la artroplastia total es la intervención indicada para la artritis degenerativa primaria. La indicación de artroplastia total de cadera es: evidencia radiológica de daño articular y dolor persistente moderado a severo, o incapacidad, o ambos, que no muestra alivio sustancial tras un periodo significativo de tratamiento no quirúrgico (Total Hip Replacement, 1994; Faulkner A, 1998). Se ha visto que el recambio articular es más coste efectivo en mujeres jóvenes. La cirugía de la OA severa de la base del pulgar (artroplastia, osteotomía o artrodesis) es un tratamiento efectivo. Se indica en pacientes con dolor severo y/o discapacidad cuando los tratamientos conservadores fracasaran. La combinación de dos procedimientos quirúrgicos no ofrece ventajas pero sí más complicaciones, por lo que deberían ser evitados (Zhang W, 2007). En cuanto a otras localizaciones articulares, la experiencia es menor que en las arriba mencionadas, porque también es menor la frecuencia de presentación. En líneas generales, en el hombro la indicación sería artroplastia, en el codo artrodesis vs artroplastia (que ha obtenido buenos resultados en artritis reumatoide, pero no tan buenos en artrosis), y en muñeca, tobillo y columna vertebral artrodesis. El resultado de la cirugía depende del momento en que se realiza (edad del paciente y tiempo de evolución de la enfermedad), de la experiencia del cirujano y del hospital con el procedimiento a realizar, del estado preoperatorio del paciente (antecedentes) y de los cuidados peri y postoperatorios (Hanssen AD, 2001). A lgoritmo . Tr atamiento 54 de l a artrosis Artrosis B ibliogr afía Altman RD, Dreiser RL, Fisher CL, Chase WF, Dreher DS, Zacher J. Diclofenac sodium gel in patients with primary hand osteoarthritis: a randomized double-blind, placebo-controlled trial. J Rheumatol 2009 Sep;36(9):1991-9. [PubMed] Antman EM, Bennett JS, Daugherty A, Furberg C, Roberts H, Taubert KA. Use of nonsteroidal antiinflammatory drugs: an update for clinicians: a scientific statement from the American Heart Association. Circulation 2007;115;1634-1642 [PubMed] [Texto completo] Bagga H, Burkhardt D, Sambrook P, March L. Longterm effects of intraarticular hyaluronan on synovial fluid in osteoarthritis of the knee. J Rheumatol 2006 May;33(5):946-50. [PubMed] Bannuru RR, Natov NS, Obadan IE, Price LL, Schmid CH, McAlindon TE. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum 2009 Dec 15;61(12):1704-11 [PubMed] Baraf HS, Fuentealba C, Greenwald M, Brzezicki J, et al; EDGE Study Group. Gastrointestinal side effects of etoricoxib in patients with osteoarthritis. Results of the Etoricoxib versus Diclofenac Sodium Gastrointestinal Tolerability and Effectiveness (EDGE) trial. J Rheumatol 2007 Feb;34(2):408-20 [PubMed] Barlow JH, Turner AP, Wright CC. A randomized controlled study of the Arthritis Self-Management Programme in the UK. Health Educ Res 2000;15:665–680 [PubMed] Barthel HR, Haselwood D, Longley S, Gold MS, Altman RD. Randomized controlled trial of diclofenac sodium gel in knee osteoarthritis. Sem Arthritis Rheum 2009 Dec;39(3):203-12 [PubMed] Bellamy N, Campbell J, Robinson V, Gee T, Bourne R, Wells G. Intraarticular corticosteroid for treatment of osteoarthritis of the knee. Cochrane Database Syst Rev 2006 Apr 19;(2):CD005328 [PubMed] Berenbaum F. New horizons and perspectives in the treatment of osteoarthritis. Arthritis Res Ther 2008,10(suppl2):S1 [PubMed] Biswal S, Medhi B, Pandhi P. Longterm efficacy of topical nonsteroidal antiinflammatory drugs in knee osteoarthritis: metaanalysis of randomized placebo controlled clinical trials. J Rheumatol 2006 Sep;33(9):1841-4 [PubMed] Brooks PM, Day Ro. Non-steroidal anti-inflammatory drugs differences and similarities. N Eng J Med 1991;324:1716-25. [PubMed] [Texto completo] Bruyere O, Burlet N, Delmas PD, Rizzoli R, Cooper C, Reginster JY. Evaluation of symptomatic slow-acting drugs in osteoarthritis using the GRADE system. BMC Musculoskelet Disord 2008;9:165 [PubMed] [Texto completo] Caborn D, Rush J, Lanzer W, Parenti D, Murray C, Synvisc 901 Study Group. A randomized, single-blind comparison of the efficacy and tolerability of hylan G-F 20 and triamcinolone hexacetonide in patients with osteoarthritis of the knee. J Rheumatol 2004 Feb;3182):333-43 [PubMed] Chao J, Wu C, Sun B, Hose MK, Quan A, Hughes TH, Boyle D, Kalunian KC. Inflammatory characteristics on ultrasound predict poorer longterm response to intraarticular corticosteroid injections in knee osteoarthritis. J Rheumatol 2010 Mar;37(3):650-5. [PubMed] Choquette D, McCarthy TG, Rodrigues JF, Kelly AJ, Camacho F, Horbay GL, Husein-Bhabha FA. Transdermal fentanyl improves pain control and functionality in patients with osteoarthritis: an open-label Canadian trial. Clin Rheumatol 2008 May;27(5):587-95. [PubMed] Combe B, Swegold G, McLay J, McCarthy T, et al. Cardiovascular safety and gastrointestinal tolerability of etoricoxib vs diclofenac in a randomized controlled clinical trial (The MEDAL Study). Rheumatology (Oxford) 2009 Apr;48(4):425-32. [PubMed] Conhaghan PG, Dikson J, Grant RL. Guideline Development Group. Care and management of osteoarthritis in adults: summary of NICE guidance. BMJ 2008 Mar 1;336(7642):502-3. [PubMed] Curtis SP, Ko AT, Bolognese JA, Cavanaugh PF, Reicin AS. Pooled analysis of thrombotic cardiovascular events in clinical trials of the cox-2 selective inhibitor etoricoxib. Curr Med Res Opin 2006 Dec;22(12):2365-74 [PubMed] Diagnosis and treatment of adult degenerative joint disease (DJD) of the knee. [Internet]. Bloomington (MN): Institute for Clinical Systems Improvement (ICSI). Ninth Edition; 2007. [Acceso 4/10/2010]. Disponible en: [acceso] Dougados M, Nguyen M, Berdah L, Maziéres B, Vignon E, Lequesne M. ECHODIAH Investigators Study Group.Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the Chondromodulating Effect of Diacerein in OA of the Hip. Arthritis Rheum. 2001 Nov;44(11):2539-47. [PubMed] Faulkner A, Kennedy LG, Baxter K, et al. Effectiveness of hip prostheses in primary total hip replacement: a critical review of evidence and an economic model. Health Technol Assess 1998;2:1–33. [Texto completo] Fidelix TS, Soares BG, Trevisani VF. Diacerin for osteoarthritis. Cochrane Database Sys Rev 2006 Jan 25;(1):CD005117. Fransen M, McConnell S, Bell M. Ejercicio para la osteoartritis de cadera o rodilla (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2005 Número 2. Oxford: Update Software Ltd. [Resumen] [Texto completo en español en: Cochrane Plus] García Rodríguez LA, Hernández-Diaz S. Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti-inflammatory drugs. Epidemiology. 2001 Sep;12(5):570-6. [PubMed] Garret WJr. Evaluation and treatment of the arthritic knee. J Bone Joint Surg Am. 2003 Jan;85-A(1):156-7. [PubMed] Gonzalez-Perez A, Rodriguez LA. Upper gastrointestinal complications among users of paracetamol. Basic Clin Pharmacol Toxicol. 2006 Mar;98(3):297-303 [PubMed] Guidolin DD, Ronchetti IP, Lini E, Guerra D, Frizziero L. Morphological analysis of articular cartilage biopsias from a randomized, clinical study comparing the effects of 500-700 KDa sodium hyaluronate (Hyalgan) and methylprednisolone acetate on primary osteoarthritis of the knee. Osteoarthritis Cartilage 2001 May;9(4):371-81 [PubMed] Hanssen AD, Stuart MJ, Scott RD, Scuderi GR. Surgical options for the middle-aged patient with osteoarthritis of the knee joint. Instr Course Lect. 2001;50:499-511 [PubMed] Hawker G, Wright J, Coyte P, Paul J, Dittus R, Croxford R et al. Health related quality of life after knee replacement. J Bone Joint Surg 1998;80:163–173. [PubMed] Hochberg MC, Altman RD, Brandt KD, Clark BM, Dieppe PA, Griffin MR, Moskowitz RW, Schnitzer TJ. Guidelines for the medical Management of osteoarthritis. Part II. Osteoarthritis of the knee. American College of Rheumatology. Arthritis Rheum 1995 Nov;38(11):1541-6 [PubMed] Hochberg MC, Altman RD, Brandt KD, Clak BM, Dieppe PA, Griffin MR, et al. Guidelines for the medical management of osteoarthritis. Part I. Osteoarthritis of the hip. Arthritis Rheum 1995;38:1535-40 [PubMed] Hochberg MC, Altman RD, Brandt KD, Clak BM, Dieppe PA, Griffin MR, et al. Guidelines for the medical management of osteoarthritis. Part II. Osteoarthritis of the knee. Arthritis Rheum 1995;38:1541-6 [PubMed] 55 Reumatología Kalunian KK, Tugwell P, Greene JM. Classification and diagnosis of osteoarthritis [Internet]. version 18.2 Mayo 2010. [Acceso 4/10/2010]. Disponible en: http://www.uptodate.com Koch M, Dezi A, Ferrario F, Capurso I. Prevention of nonsteroidal anti-inflammatory drug-induced gastrointestinal mucosal injury: a meta-analysis of randomized controlled clinical trials. Arch Intern Med 1996; 156:2321-32. [PubMed] Kroenke K, Krebs E, Bair MJ. Pharmacotherapy of chronic pain: a synthesis of recommendations from systematic reviews. General Hospital Psychiatry 3182009) 206-219 [PubMed] Krum H, Swergold G, Curtis SP, Kaur A, et al. Factors associated with blood pressure changes in patients receiving diclofenac or etoricoxib: results from the MEDAL study. J Hypertens 2009 Apr;27(4):886-93 [PubMed] Krum H, Curtis SP, Kaur A, Wang H, et al. Baseline factors associated with congestive heart failure in patients receiving etoricoxib or diclofenac: multivariate analysis of the MEDAL program. Eur J Heart Fail 2009 Jun;11(6):542-50. [PubMed] Kullenberg B, Runesson R, Tuvhag R, Olsson C, Resch S. Intraarticular corticosteroid injection: pain relief in osteoarthritis of the hip? J Rheumatol 2004 Nov;31(11):2265-8 [PubMed] Laffon A, Carmona L, Ballina FJ, Gabriel R, Garrido G. Prevalencia e impacto de las enfermedades reumáticas en la población adulta española. Estudio EPISER. MSD y Sociedad Española de Reumatología. Madrid; 2001. [Resumen] Laine L, Curtis SP, Cryer B, Kaur A, Cannon CP; MEDAL Steering Commitee. Assessment of upper gastrointestinal safety of etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Long-term (MEDAL) programme: a randomised comparison. Lancet 2007 Feb 10;369(9560):465-73 [PubMed] Laine L, Godlkind L, Curtis SP, Connors LG, Yanqiong Z, Cannon CP. How common is diclofenac-associated liver injury? Analysis of 17,289 arthritis patients in a long-term prospective clinical trial. Am J Gastroenterol 2009 Feb;104(2):356-62. [PubMed] Langford R, McKenna F, Ratcliffe S, Vojtassák J, Richarz U. Transdermal fentanyl for improvement of pain and functioning in osteoarthritis: a randomized, placebo-controlled trial. Arthritis Rheum 2006 Jun;54(6):1829-37 [PubMed] [Texto completo] Lin J, Zhang W, Jones A, Doherty M. Efficacy of topical non-steroidal anti-inflammatory drugs in the treatment of osteoarthritis: metaanalysis of randomised controlled trials. BMJ. 2004 Aug 7;329(7461):324. [PubMed] [Texto completo] Manek NJ. Medical management of osteoarthritis. Mayo Clin Proc 2001;76:533-9. [PubMed] Martín Lascuevas P, Paredes Ojanguren B, Fernández Fernández C, Herández Mejía R, Ballina García FJ. Los reumatismos en la comunidad. Aten Primaria 1992; 10:567-70 [PubMed] Miguel de E. Clínica y tratamiento de la artrosis periférica. En: Manual SER de las enfermedades reumáticas. 3ª ed. Madrid: Editorial Médica Panamericana 2000:p.476-82. Moore RA, Tramer D, Carroll D, Wiffen PJ, McQuay HJ. Quantitative systematic review of topically applied non-steroidal antiinflammatory drugs. BMJ 1998;316:333-8 [PubMed] [Texto completo] Nüesch E, Rutjes AW, Husni E, Welch V, Jüni P. Oral o transdermal opioids for osteoarthritis of the knee or hip. Cochrane Database Syst Rev. 2009 oct 7;(4): CD003115 [PubMed] National Institute for Health and Clinical Excellence (NICE). National Collaborating Centre for Chronic Conditions. Osteoarthritis. The care and management of osteoarthritis in adults. London (UK): NICE; Clinical guideline; no. 59. 2008 [Texto Completo] [NCG] Noble M, Treadwell JR, Tregear SJ, Coates VH, Wiffen PJ, Akafomo C, Schoelles KM. Long-term opioid management for chronic noncancer pain. Cochrane Database Syst Rev 2010 Jan 20;(1): CD00660536106485-G [PubMed] Ozturk C, Atamaz F, Hepguler S, Argin M, Arkun R. The safety and efficacy of intraarticular hyaluronan with/without corticosteroide in knee osteoarthritis: 1-year, single-blind, randomized study. Rheumatol Int 2006 Feb;26(4):314-9. [PubMed] Pavelka K, Gatterova J, Olejarova M, Machacek S, Giacovelli G, Rovati LC. Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study. Arch Intern Med. 2002 Oct 14;162(18):2113-23. [PubMed] Pendleton A, Arden N, Dougados M, Doherty M, Bannwarth B, Bijlsma JW et al. EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis. 2003 Dec;62(12):1145-55 [PubMed] [Texto completo] Petrella RJ, Petrella M. A prospective, randomized, double-blind, placebo controlled study to evaluate the efficacy of intraarticular hyaluronic acid for osteoartritis of the knee. J Rheumatol 2006 May;33(5):951-6 [PubMed] Poolsup N, Suthisisang C, Channark P, Kittikulsuth W. Glucosamine long-term treatment and the progresión of knee osteoarthritis: systematic review of randomized controled trials. Ann Pharmacother 2005 Jun;39(6):1080-7. [PubMed] Rahme E, Pettitt D, LeLorier J. Determinants and sequelae associated with utilization of acetaminophen versus traditional nonsteroidal antiinflammatory drugs in an elderly population. Arthritis Rheum. 2002 ;46(11):3046-54 [PubMed] Ravaud P, Moulinier L, Giraudeau B, Ayral X, et al. Effects of Joint lavage and steroid injection in patients with osteoarthritis of the knee: results of a multicenter, randomized, controlled trial. Arthritis Rheum 1999 Mar;42(3):475-82 [PubMed] [Texto completo] Raynauld JP, Buckland-Wright C, Ward R, Choquette D, et al. Safety and efficacy of long-term intraarticular steroid injections in osteoarthritis of the knee: a randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2003 Feb;48(2):370-7 [PubMed] [Texto completo] Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines. Arthritis Rheum 2000; 43(9):1905-15 [PubMed] Reginster JY, Deroisy R, Rovati LC, Lee RL, Lejeune E, Bruyere O, Giacovelli G, Henrotin Y, Dacre JE, Gossett C. Long-term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet. 2001 Jan 27;357(9252):251-6. [PubMed] Reichenbach S, Sterchi R, Scherer M, Trelle S, Bürgi E, Bürgi U, Dieppe PA, Jüni P. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med 2007 Apr 17;146(8):580-90. [PubMed] Richy F, Bruyere O, Ethgen O, Cucherat M, Henrotin Y, Reginster JY. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta-analysis. Arch Intern Med 2003 Jul 14;163(13):1514-22 [PubMed] Riemsma RP,Kirwan JR,Taal E,Rasker JJ. Educación para pacientes adultos con artritis reumatoide (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2005 Número 2. Oxford: Update Software Ltd. [PubMed] Rintelen B, Neumann K, Leeb BF. A meta-analysis of controlled clinical studies with diacerein in the treatment of osteoarthritis. Arch Intern Med 2006 Sep 25;166(17):1899-906 [PubMed] 56 Artrosis Rostom A, Dube C, Wells G, Tugwell P, Welch V, Jolicoeur E, McGowan J. Prevention of NSAID-induced gastroduodenal ulcers (Cochrane Review). En: The Cochrane Library, Issue 2 2002. Oxford: Update Software. [PubMed] Saffie F, Gordillo H, Gordillo E, Ballesteros F. Intra-articular treatment of osteoarthritis of the knee with betamethasone dipropionate and disodium phosphate. Non-controlled, open 5 years´experience. Rev Med Chil 1989 Nov;117(11):1261-6 [PubMed] Sibbitt WL Jr, Peisajovich A, Michael AA, Park KS, Sibbitt RR, Band PA, Bankhurst AD. Does sonographic needle guidance affect the clinical outcome of intraarticular injections?. J Rheumatol 2009 Sep;36(9):1892-902. [PubMed] Silverstein FE, Faich G, Goldstein JL, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid artritis: the CLASS Study: a randomized controlled trial. JAMA 2000;284(10):1247-55 [PubMed] Stahl S, Karhs-Zafrir I, Ratzon N, Rosenberg N. Comparison of intraarticular injection of depot corticosteroid and hyaluronic acid for treatment of degenerative trapeziometacarpal joints. J Clin Rheumatol 2005 Dec;11(6):299-302 [PubMed] Svensson O, Malmenäs M, Fajutrao L, Roos EM, Lohmander LS. Greater reduction of knee than hip pain in osteoarthritis treated with naproxen, as evaluated by WOMAC and SF-36. Ann Rheum Dis 2006 Jun;65(6):781-4. [PubMed] [Texto completo] Tejedor Varillas A, et al. Tengo artrosis ¿Qué puedo hacer?. Barcelona: semfyc ediciones 2009 Total Hip Replacement. [Internet]. NIH Consens Statement Online 1994 September 12-14 [Acceso 4/10/2010];12(5):1-31. Disponible en: http://consensus.nih.gov/1994/1994HipReplacement098html.htm Towheed TE, Shea B, Wells G, Hochberg M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database Syst Rev. 2000;(2):CD000517. Review. Update in: Cochrane Database Syst Rev. 2007;(1):CD000517 [PubMed] Towheed TE, Judd MJ, Hochberg MC, Wells G. Acetaminophen for osteoarthritis. En: La Biblioteca Cochrane Plus, 2003 Número 2. Oxford: Update Software Ltd. [PubMed] Towheed TE, Maxwell L, Anastassiades T, Shea B, Houpt J, Robinson V, Hochberg M, Wells G. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst Rev. 2005 Apr 18;(2):CD002946.[PubMed] Underwood M, Ashby D, Carnes D, Castelnuovo E, Cross P, Harding G, et al. Topical or oral ibuprofeno for chronic knee pain in older people. The TOIB study. Health Technol Assess 2008 May;12(22):iii-iv, ix-155 [PubMed] Wai EK, Kreder HJ, Williams JI. Arthroscopic Debridement of the knee for osteoarthritis in patients fifty years of age or older: utilization and outcomes in the province of Ontario. J Bone Joint Surg Am 2002;84:17-22 [PubMed] Wall R, Strickland C, Jamieson B, Lo V. Clinical inquiries. Do Cox-2 inhibitors worsen renal function? J Fam Pract 2007 Nov;56(11):957-8 Watson MC, Brookes ST, Kirwan JR, Faulkner A. Non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the knee. En: La Biblioteca Cochrane Plus, 2000 Número 2. Oxford: Update Software Ltd. Disponible en: [PubMed] Wegman A, van der Windt D, van Tulder M, Stalman W, de Vries T. Nonsteroidal antiinflammatory drugs or acetaminophen for osteoarthritis of the hip or knee? A systematic review of evidence and guidelines. J Rheumatol. 2004 Feb;31(2):344-54. [PubMed] White WB, West CR, Borer JS, Gorelick PB, Lavange L, Pan SX, Weiner E, Verburg KM. Risk of cardiovascular events in patients receiving celecoxib: a meta-analysis of randomized clinical trials. Am J Cardiol 2007 Jan 1;99(1):91-8. [PubMed] Zhang W, Doherty M, Leeb BF, Alekseeva L, et al. EULAR evidence based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2007 Mar;66(3):377-88. [PubMed] [Texto completo] Zhang W, Jones A, Doherty M. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis?: a meta-analysis of randomized controlled trials. Ann Rheum Dis 2004;63:901-907 [PubMed] [Texto completo] Zhang W, Doherty M, Arden N, Bannwarth B, et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis. 2005;64:669-681 [PubMed] [Texto completo] 57