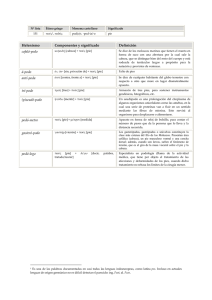
TESIS FINAL
Anuncio

TITULACIÓN DE INGENIERA EN GESTIÓN AMBIENTAL Patrones de diversidad de la fauna de moluscos (Gastrópoda) en un bosque tropical de montaña (Estación Científica San Francisco) al sur de Ecuador. Trabajo final de titulación. AUTORA Imaicela Ordóñez, María Augusta DIRECTOR. Saa, Luis Rodrigo, Ph.D. Loja - Ecuador 2013 CERTIFICACIÓN Doctor Luis Rodrigo Saa DIRECTOR DEL TRABAJO DE FIN DE TITULACIÓN CERTIFICA. Que el presente trabajo de investigación denominado “Patrones de diversidad de la fauna de moluscos (Gastrópoda) en un bosque tropical de montaña (Estación Científica San Francisco) al sur de Ecuador” realizado por la profesional en formación: María Augusta Imaicela Ordóñez; cumple con todos los requisitos establecidos por las normas generales para la graduación en la Universidad Técnica Particular de Loja, tanto en el aspecto de forma como de contenido, por lo cual me permito autorizar su presentación para los fines pertinentes. Loja, marzo de 2013 C.I. 1102902291 II CESIÓN DE DERECHOS “Yo, María Augusta Imaicela Ordóñez declaro ser autora del presente trabajo y eximo expresamente a la Universidad Técnica Particular de Loja, y a sus representantes legales de posibles reclamos o acciones legales. Adicionalmente declaro conocer y aceptar la disposición del Art. 67 del Estatuto Orgánico de la Universidad Técnica Particular de Loja que en su parte pertinente textualmente dice: “Forman parte del patrimonio de la Universidad la propiedad intelectual de investigaciones, trabajos científicos o técnicos de tesis de grado que se realicen a través, o con el apoyo financiero, académico o institucional (operativo) de la Universidad”. Imaicela Ordoñez María Augusta C.I. 1104748023 III DECLARACIÓN DE AUTORÍA Las ideas, conceptos, procedimientos y resultados vertidos en el presente trabajo de fin de carrera, son de exclusiva responsabilidad de su autor. Imaicela Ordoñez María Augusta IV DEDICATORIA De una manera muy especial le dedico el presente trabajo a Dios, por darme la fuerza día a día para desarrollarlo. A mi familia, a mis padres y hermanos, que son los pilares fundamentales en mi vida, sin su paciencia, confianza y sobre todo apoyo no hubiera podido realizar este trabajo. A todos con cariño y afecto. María Augusta Imaicela Ordóñez V AGRADECIMIENTO A la Universidad Técnica Particular de Loja que por medio del Laboratorio de Sanidad Animal y Zoonosis (LABSA) del Departamento de Ciencias Agropecuarias y de Alimentos y a la Titulación de Gestión Ambiental que me ha dado la oportunidad de formarme y capacitarme para la elaboración del presente trabajo de investigación. A mis padres y hermanos por su apoyo incondicional y sobre todo por la confianza depositada en mí, durante todo el proceso de mi carrera universitaria. A mi director de tesis el Dr. Luis Rodrigo Saa, Ph.D. por el apoyo brindado a lo largo de la consecución del presente trabajo. Al Ing. Carlos Iñiguez e Ing. Diana Maldonado que me ayudaron y guiaron a la elaboración de este proyecto. Al Dr. Modesto Correoso, importante malacólogo en Ecuador, por su valiosa contribución y ayuda en la elaboración del presente trabajo. Gracias de todo corazón. VI ÍNDICE DE CONTENIDOS CERTIFICACIÓN DEL DIRECTOR DE TESIS ............................................................ II CESIÓN DE DERECHOS ............................................................................................ III DECLARACIÓN DE AUTORIA .................................................................................. IV DEDICATORIA ............................................................................................................ V AGRADECIMIENTO ................................................................................................... VI ÍNDICE DE CONTENIDOS ........................................................................................ VII ÍNDICE DE TABLAS ................................................................................................... IX ÍNDICE DE FIGURAS .................................................................................................. X ÍNDICE DE GRÁFICOS .............................................................................................. XI RESUMEN EJECUTIVO ............................................................................................ XII 1. INTRODUCCIÓN ..................................................................................................... 1 2. OBJETIVOS ............................................................................................................. 3 2.1. GENERAL ..................................................................................................... 3 2.2. ESPECÍFICOS .............................................................................................. 3 3. MARCO TEÓRICO....................................................................................................................4 3.1. PHYLUM MOLLUSCA .................................................................................. 4 3.2. CLASE GASTRÓPODA ................................................................................ 6 3.2.1. ORIGEN EVOLUTIVO DE LOS GASTRÓPODOS ................................. 8 3.2.2. ALIMENTACIÓN DE LOS GASTROPÓDOS .......................................... 9 3.2.3. EXCRECIÓN ......................................................................................... 10 3.2.4. SISTEMA CIRCULATORIO .................................................................. 10 3.2.5. SISEMA NERVIOSO ............................................................................. 10 3.2.6. REPRODUCCIÓN ................................................................................. 11 3.3. GASTRÓPODOS TERRESTRES .............................................................. 13 VII 3.4. GASTRÓPODOS EN ECUADOR ............................................................... 14 3.5. IMPORTANCIA DE LOS GASTRÓPODOS ............................................... 16 3.6. PROTECCIÓN AMBIENTAL DE LOS MOLUSCOS EN ECUADOR ......... 17 3.7. GASTRÓPODOS COMO PLAGAS ............................................................ 17 3.8. CARACOLES Y ENFERMEDADES QUE TRANSMITEN A LAS PERSONAS ................................................................................................ 19 3.9. LOS MOLUSCOS Y EL CAMBIO CLIMÁTICO .......................................... 19 3.10. DECLIVE DE GASTRÓPODOS TERRESTRES ........................................ 21 4. ÁREA DE ESTUDIO .............................................................................................. 22 5. METODOLOGÍA .................................................................................................... 24 5.1. MUESTREO DE GASTRÓPODOS TERRESTRES ................................... 24 5.2. ANÁLISIS DE DATOS ................................................................................ 25 5.2.1. ÍNDICES DE RIQUEZA Y DIVERSIDAD .............................................. 25 5.2.2. COMPOSICIÓN DE GASTRÓPODOS ................................................. 26 6. RESULTADOS ...................................................................................................... 27 6.1. RIQUEZA Y DIVERSIDAD.......................................................................... 27 6.2. COMPOSICIÓN DE ESPECIES ................................................................. 30 7. DISCUSIÓN........................................................................................................... 32 8. CONCLUSIONES .................................................................................................. 34 9. RECOMENDACIONES ......................................................................................... 35 10. BIBLIOGRAFÍA...................................................................................................... 36 11. GLOSARIO ............................................................................................................ 44 12. ANEXOS ................................................................................................................ 47 VIII ÍNDICE DE TABLAS Tabla 1. Clasificación de la clase Gastrópoda en Ecuador ....................................... 16 Tabla 2. Visión general de los gastrópodos encontrados en el BI y BNI ................... 27 Tabla 3. Índices de diversidad calculados para BI y BNI ........................................... 28 IX ÍNDICE DE FIGURAS Figura 1. Phylum Mollusca, Systrophia heligmoida (Orbigny, 1835) ........................... 4 Figura 2. Terminología descriptiva de la concha de los gastrópodos ......................... 6 Figura 3. a) Fósil de gastrópodo, b) Fósil de ammonite .............................................. 7 Figura 4. Partes principales de un gastrópodo............................................................. 8 Figura 5. Gastrópodo alimentándose ........................................................................... 9 Figura 6. Anatomía de un gastrópodo ........................................................................ 11 Figura 7. Cortejo, penetración, apareamiento, puesta, huevos, crías de gastrópodos terrestres .................................................................................................... 12 Figura 8. Gastrópodo terrestre ................................................................................... 14 Figura 9. Achatina fulica ............................................................................................ 18 Figura 10. Mapa del área de estudio.......................................................................... 22 Figura 11. Tipos de bosque ........................................................................................ 23 Figura 12. Esquema de muestreo de gastrópodos terrestres en el área de estudio. 24 X ÍNDICE DE GRÁFICOS Gráfico 1. Curva de acumulación de especies para el total del área muestreada .... 28 Gráfico 2. Comparación de los índices de riqueza y diversidad para BI y BNI ......... 29 Gráfico 3. Ordenamiento multidimensional no métrico (NMDS) para BI y BNI ......... 30 Gráfico 4. Análisis de similitudes (ANOSIM) para BI y BNI ....................................... 31 XI RESUMEN EJECUTIVO La biodiversidad es la variedad total de vida que existe sobre la tierra; como parte de esta se encuentran los moluscos terrestres (Gastrópoda), ha sido considerado como un fuerte indicador del estado de los ecosistemas naturales. En el bosque tropical de montaña ubicado en la Estación Científica San Francisco en Zamora Chinchipe (Ecuador) durante julio - septiembre de 2012, se determinó los patrones de diversidad y composición de especies en dos zonas correspondientes a bosque intervenido y no intervenido. Se colectó 1 898 gastrópodos correspondientes a 9 especies, Systrophia heligmoida fue la más abundante con 1 767 especímenes. El esfuerzo de muestreo fue óptimo, la diversidad fue mayor para el bosque no intervenido. A través del Análisis de Escalamiento Multidimensional no Métrico (NMDS) y del Análisis de similitudes (ANOSIM) se pudo distinguir en los tipos de bosque estudiados, composición de especies diferentes, el bosque intervenido desorganizada y dispersa, mientras que el bosque no intervenido homogénea. Palabras clave: Diversidad de especies, gastrópodos terrestres, riqueza de especies, abundancia de especies, Análisis de Escalamiento Multidimensional no Métrico (NMDS) y Análisis de similitudes (ANOSIM). XII 1. INTRODUCCIÓN En el transcurso del tiempo el clima global ha venido sufriendo un sinnúmero de cambios, asociados principalmente al incremento de los gases que causan el efecto invernadero, se calcula que la temperatura mundial de la superficie ha aumentado en 0,6 °C (IPCC, 2001). La atmósfera responde a este incremento de gases con un aumento de temperatura (Aalst, 2006). Estos cambios tienen efectos sobre especies vegetales y animales incluidos los moluscos, en diferentes vías como su distribución, tamaño poblacional, estructura física, metabolismo y comportamiento (IPCC 2001; IPCC 2002; Parmesan et al., 2003; Parmesan et al., 2004; Cumming et al., 2006), alterando los procesos naturales de los ecosistemas (Aalst, 2006). La variedad total de vida existente en la tierra se denomina biodiversidad, la cual ofrece grandes beneficios directos como alimento, medicina, madera, energía primaria, materia prima, lugares de esparcimiento, entretenimiento, modelos de ingeniería y medicina, sustancias de uso agrícola, entre otros. Como parte de esta biodiversidad se encuentran los moluscos, los cuales hacen referencia al nombre común de los miembros de un filo de animales de cuerpo blando que suelen tener una envoltura externa dura de naturaleza calcárea, “Mollusca” (Camarda & Suarez, 2004). El filo Mollusca está formado por unas 50 000 especies vivientes y unos 35 000 fósiles, su reproducción es sexual pero pueden ser dioicas o monoicas; siempre vinculadas a medios acuáticos o húmedos. La mayoría son marinos, algunos dulciacuícolas y unos pocos viven en ambientes terrestres pero siempre limitados por su necesidad de agua y humedad (Aycaguer, 2006). Los moluscos, se han extendido sobre la tierra con tanto éxito, que su distribución solo puede ser comparada con la que tienen los artrópodos (crustáceos, arácnidos e insectos). Los marinos son los más numerosos, se encuentran en aguas superficiales y también en profundidades mayores a los 5 000 m. Se han adaptado a todos los climas, pero la región que más les favorece es la tropical, donde los colores y ornamentaciones de sus conchas son espectaculares, las especies que se distribuyen lejos de la zona tropical no son tan coloridas y a medida que se van alejando, van perdiendo algo de su belleza (López & Urcuyo, 2009). 1 Los moluscos terrestres tipifican desde el punto de vista biogeográfico a un país por sus especies endémicas, pues el genuino endemismo ocurre en especies con poca locomoción. Muchos moluscos pueden ser endémicos de algunas regiones y localidades del país, en general en Ecuador existen muchas especies de moluscos difíciles de encontrar y recolectar en su territorio, lo que contribuye a su baja presencia en colecciones de museos locales (Correoso, 2008). El papel de los moluscos, en la dinámica ecológica de los ecosistemas donde habitan, es amplio, contribuyen a la formación del suelo tropical, cumplen funciones tróficas básicas en los ecosistemas y constituyen una parte importante de la biomasa de los invertebrados tropicales (Martínez & Piñango, 2008). Se los considera bioindicadores ecológicos confiables del suelo y agua, por ser sensibles a cambios producidos en los ecosistemas y por ser susceptibles al monitoreo con diferentes técnicas como el sistema de información geográfica (SIG). Una particularidad significativa de los gastrópodos terrestres, es que intervienen en la dieta de algunos grupos de especies, por su alto contenido proteico, además de ellos se puede extraer sustancias que son utilizadas con fines medicinales como fármacos, drogas y con fines estéticos como cosméticos (Correoso, 2005, 2008). 2 2. OBJETIVOS 2.1. GENERAL: Conocer la diversidad de moluscos terrestres en un bosque tropical de montaña al sur de Ecuador. 2.2. ESPECÍFICOS: Determinar la variación en los patrones de diversidad de moluscos (gastrópodos), en relación a dos tipos de bosques en un bosque tropical de montaña al sur de Ecuador. Determinar diferencias en la composición de moluscos (gastrópodos) en dos tipos de bosques en un bosque tropical de montaña. 3 3. MARCO TEÓRICO 3.1. PHYLUM MOLLUSCA El nombre del Phylum Mollusca deriva del latin “mollis” que significa suave o blando; se refiere al hecho de presentar un cuerpo suave el cual está protegido por una concha dura de naturaleza calcárea (Mille & Pérez, 2003). Figura 1. Phylum Mollusca, Systrophia heligmoida (Orbigny, 1835) Elaboración: Autora Los primeros moluscos fósiles aparecieron en rocas del periodo cámbrico hace unos 600 millones de años; este es uno de los taxa más abundantes entre los invertebrados, tanto por el número de especies como por el número de individuos. Se encuentran en diversos hábitats terrestres y acuáticos y conforman aproximadamente 110 000 especies vivientes. Todas las clases vivientes son predominantemente marinas, solamente los caracoles y almejas han llegado a los hábitats terrestres. Especies comensales solo se observan entre los caracoles y las almejas y tan solo una familia de caracoles tiene representantes parásitos, estos últimos solo se reconocen por la larva, dadas las modificaciones que han sufrido los adultos como adaptación al parasitismo. La mayoría de especies vivientes de moluscos pertenecen a las clases Gastropoda, Pelecypoda y Cephalopoda (Russel, 1968). El cuerpo de los miembros del filo Mollusca se distinguen frecuentemente cabeza, pie y una masa visceral. La cabeza contiene el ganglio cerebral, está provisto de los órganos sensoriales (tentáculos, ojos) y lleva la boca. El pie es la parte ventral de la unidad funcional del tubo músculo-cutáneo, dotado de una especialmente poderosa musculatura y el saco visceral es una joroba del lado dorsal, envuelta por una fina piel. La mayoría de las veces, aquella región de la pared del cuerpo que segrega la 4 concha se denomina manto o palio. El epitelio del manto forma, desde la base del saco visceral, un doblez de la piel, el pliegue del manto (a menudo denominado simplemente manto). En el interior de los espacios cubiertos por el manto, el surco del manto o la cavidad del manto, se localizan los órganos respiratorios, el osfradio (órganos sensoriales) y la glándula hipobranquial. En la cavidad del manto se abre el ano y los conductos del órgano excretor y reproductor (Storch & Welsch, 2001). La piel presenta, siempre y cuando no esté cubierta por la concha, a menudo cilios, a veces espinas o escamas, carece casi siempre de cutícula y es rica en células glandulares grandes, y por eso es resbaladiza y blanda. La concha está formada al menos por tres capas: por el periostraco orgánico y externo y por dos capas calcáreas. Entre el manto y la concha se encuentran, además de las inserciones musculares, una estrecha cavidad extrapaleal, rellena de líquido. La reducción de la concha y su desplazamiento al interior del cuerpo no son fenómenos raros (Storch & Welsch, 2001). El celoma de los moluscos se limita generalmente a una cavidad que comprende las gónadas y el corazón a veces también a un trozo de intestino. La mayoría de las veces solamente pertenece la parte que rodea el corazón como cavidad pericárdica. (Storch & Welsch, 2001). Los moluscos son ecológicamente muy importantes en el ambiente marino y terrestre, y generalmente ocupan posiciones intermedias en las cadenas alimentarias (herbívoros, o carnívoros primarios) (Aycaguer, 2006). En cuanto a la importancia económica de los moluscos, es cardinal en un país que tiene en sus hábitos alimentarios el consumo de importantes cantidades y variedades de moluscos marinos y terrestres, de alto valor proteico y digestibilidad reconocidos (Sánchez et al., 1991); destacándose algunas familias terrestres de caracoles que son parte importante de la dieta de grupos indígenas de la amazonía y de la sierra ecuatoriana (Patzelt, 2000). Se estima que las 3/4 partes del total de especies de moluscos corresponden a la clase Gastrópoda, las cuales presentan una sola concha, llevan los ojos en los extremos de los tentáculos, si son terrestres respiran por medios de pulmones y si son marinos por medio de branquias. Siguen en importancia numérica las clases Bivalvia (15 000 especies), Polyplacophora, Monoplacophora, Caudofoveata, 5 Solenogastres, Scaphopoda y Cephalopoda con alrededor de 2 000 especies. Desde el punto de vista económico y alimentario, los taxa más importantes de moluscos son: Bivalvia, Cephalopoda y Gastrópoda. En particular, algunos representantes de la clase Gastrópoda son de especial interés médico; destacan entre ellos ciertos miembros de la familia Planorbidae y Melanidae, involucrados como intermediarios en ciclos de transmisión de enfermedades parasitarias. En la acuariofilia también se encuentran representantes de los moluscos, principalmente gastrópodos y bivalvos (Martínez & Piñango, 2008). 3.2. CLASE GASTRÓPODA La clase gastrópoda constituye un grupo muy diverso con la concha de una sola pieza, la cual puede ser enrollada, formando un caracol elíptico, helicoidal o turbinado, puede tener la forma de una espiral aplanada o de un cono corto, o incluso perderse secundariamente. Esta clase abarca aproximadamente 50 000 especies vivientes, la mayoría son marinos. Sin embargo, el grupo de moluscos más ampliamente desarrollados. La concha de algunas especies es muy apreciada por los coleccionistas del mundo, lo que ha propiciado que se vean en peligro de extinción (Mille & Pérez, 2003). Figura 2. Terminología descriptiva de la concha de los gastrópodos Elaboración: Autor: Luis Ruiz. [En línea] http://upload.wikimedia.org/wikipedia/commons/archive/a/a0/2012012 6165243!Moluscos_del_Estado_Falcon_000.jpg. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. 6 La clase presenta un registro fósil ininterrumpido y ha tenido la radiación adaptativa más notable de todos los moluscos. Si tenemos en cuenta la enorme diversidad de hábitat que los gastrópodos han invadido, hemos de considerarlos como la clase con mayor éxito evolutivo de todos los moluscos. Las especies marinas se han adaptado a vivir sobre cualquier tipo de sustrato, así como también a la vida pelágica. Han invadido las aguas dulces, los pulmonados y otros grupos han conquistado el medio terrestre tras perder las branquias y convertir la cavidad peleal en un pulmón (Barnes, 1996). Figura 3. a) Fósil de gastrópodo, b) Fósil ammonite Elaboración: Autora Los gastrópodos son principalmente marinos, pero también los hay terrestres y de aguas dulces. Abundan en aguas someras del litoral marino, en aguas profundas y también hay algunas especies pelágicas, las características fundamentales de los gastrópodos son la torsión y la espiralización. La torsión consiste en un giro de la cavidad paleal de 180° en sentido antihorario, respecto a su posición inicial sobre el complejo cabeza–pie, esta torsión afecta en algún grado de su desarrollo a todos los órganos, la espiralización es una modificación de la concha, se produce un arrollamiento asimétrico de la misma, la concha acaba desplazándose oblicuamente a la derecha, este desplazamiento determina una parcial oclusión del lado derecho de la cavidad del manto, permitiendo una reducción del mismo, acabando por desaparecer también los órganos paleales: un ctenidio, una aurícula y un órgano renal (Scarabino, 2004). 7 Este mecanismo contribuye a la solución de los problemas de saneamiento implicados por la torsión, ya que el ano quedaba por encima de la cabeza y de la abertura con la corriente inhalante (Scarabino, 2004). Figura 4. Partes principales de un gastrópodo. Elaboración: Autor: Jürgen Schoner. [En línea] http://commons.wikimedia.org/wiki/File:Grapevinesnail_01.jpg. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. 3.2.1. ORIGEN EVOLUTIVO DE LOS GASTRÓPODOS Antiguamente todos los gastrópodos eran acuáticos, pero posteriormente, en el curso de la evolución una parte de ellos se han adoptado a vivir en tierra, son los denominados gastrópodos terrestres. El cambio a la vida terrestre tenía como problema principal el de la deshidratación. Los caracoles terrestres adoptan diversas soluciones para resolver este problema (Barnes, 1996). La evolución de los gastrópodos implicó cuatro cambios principales con respecto a la organización del molusco: (1) el desarrollo de una cabeza; (2) el alargamiento del cuerpo en sentido dorso ventral; (3) la conversión de la concha desde una en forma de escudo, a otra en forma de refugio protector; y (4) la torsión. Aunque los gastrópodos conservan el pie reptante aplanado y primitivo, la mayoría son animales bastante activos y móviles, presentan una mayor cefalización que otros moluscos como los quitones o bivalvos (Barnes, 1996). 8 3.2.2. ALIMENTACIÓN DE LOS GASTRÓPODOS Los gastrópodos terrestres siguen una dieta muy variada, alimentándose de plantas en descomposición, hongos, líquenes, algas y de plantas verdes, algunas especies son carnívoras, suelen ser dañinos para las plantas hortícolas ya que estas suelen ser más tiernas que las plantas silvestres, a este filo pertenecen las ostras, calamares, pulpos y caracoles, son animales acuáticos que se alimentan al mismo tiempo que se desplazan sobre un sustrato sólido por medio de un pie. (Forcelli, 2000). Figura 5. Gastrópodo alimentándose Elaboración: Autor: Tarquin. [En línea] http://commons.wikimedia.org/wiki/File:Iberus_gualterian us_alonensis2.JPG. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported Aparato venenoso: Entre los moluscos, los carnívoros han desarrollado diferentes estrategias para atacar a sus presas. En el caso de los conos (superfamilia Conacea), cuentan con una probóscide muy larga que tiene en la punta un diente por medio del cual inyectan veneno neurotóxico. En el hombre pueden llegar a causar la muerte pocas horas después de ocurrido el accidente. (López & Urcuyo, 2009). Los hábitos alimentarios de los gastrópodos son tan variados como su morfología y ambientes colonizados. Sin embargo es posible entresacar una serie de generalizaciones sobre estos hábitos y la estructura de su sistema digestivo: Todos emplean la rádula, más o menos modificada, para recoger su alimento. Parte de la digestión es extracelular, produciendo las glándulas salivales, bolsas esofágicas y divertículos gástricos una serie de enzimas que digieren el alimento en el estómago. La absorción y la digestión intracelular ocurren en los divertículos gástricos, la torsión hace que el esófago se abra al estómago en su parte posterior y en ano en la anterior, al contrario de lo normal, pero en gastrópodos más evolucionados se 9 observa una migración de la apertura del esófago a la zona anterior y el ano a la posterior. Existen especies de gastrópodos herbívoros, carnívoros, detritívoros y carroñeros. Hay gastrópodos parásitos, ecto o endoparásitos, que presentan el cuerpo modificado para alimentarse de la especie parasitada. Los más modificados son de tipo vermiformes y viven en el interior de holoturoideos. (Forcelli, 2000). 3.2.3. EXCRECIÓN En gastrópodos primitivos la excreción se realiza a través de los nefridios. Estos en uno de sus extremos desemboca en la cavidad pericárdica de la que recibe desperdicios que luego reduce a orina; el otro extremo se conecta a la cavidad paleal a donde envía la orina para que sea expulsada. En épocas secas o frías cierran su concha produciendo un moco que forma una capa dura al secarse para protegerse del ambiente y evitar la pérdida de agua en condiciones desfavorables; aun así, este tipo de especies, como las babosas comunes, pueden sobrevivir tras la pérdida de hasta un 80% de agua (López & Urcuyo, 2009). 3.2.4. SISTEMA CIRCULATORIO Como resultado de la torsión el corazón se encuentra delante de la masa visceral. Está formado por dos aurículas en las formas primitivas, pero como consecuencia del enrollamiento de la concha y la desaparición de la branquia derecha, la aurícula derecha desaparece, ya que era la encargada de irrigar la estructura respiratoria. Desde el ventrículo salen dos aortas, una anterior y una posterior o una única que rápidamente se ramifica en dos. La rama anterior irriga la cabeza y el pie; debido al papel hidrostático que juega la sangre en el desplazamiento y movilidad del animal el sistema arterial desaparece para formar unos senos en los que se encuentra la sangre; esto no ocurre en la zona de la masa visceral, donde la sangre únicamente tiene función de transporte de sustancias. Antes de pasar por las branquias de retorno al corazón atraviesa el nefridio para eliminar las impurezas (Forcelli, 2000). 3.2.5. SISTEMA NERVIOSO El sistema nervioso consiste en un anillo de nervios que rodea la parte anterior del aparato digestivo, con un par de troncos nerviosos, uno dirigido al pie y otro a las vísceras. 10 Normalmente los ganglios que rodean el aparato digestivo han desarrollado un cerebro con varios órganos sensoriales. De hecho el sistema nervioso de los cefalópodos es tan complejo y está tan altamente organizado como el de los peces. El corazón se localiza en el extremo posterior del cuerpo y envía la sangre hacia un sistema circulatorio abierto que forma parte de la cavidad principal del cuerpo. Asociado al corazón existe un conjunto de órganos en el que se encuentran los riñones, las gónadas y a veces otras estructuras reproductoras. (Camarda & Suarez, 2004). Figura 6. Anatomía de un gastrópodo Elaboración: Autor: Vázquez. [En línea] http://commons.wikimedia.org/wiki/File:Scheme_snail_anatom y-numbers.svg. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. 3.2.6. REPRODUCCIÓN Los gastrópodos terrestres son monoicos o de sexos separados o bien son hermafroditas pero no son capaces de llevar a cabo la autofecundación, por lo que necesitan aparearse dos individuos maduros sexualmente para que se produzca la fecundación. En general, los gastrópodos terrestres hermafroditas no presentan ambos sexos al mismo tiempo, sino que son protándricos, es decir, que de jóvenes son machos, pero que al cabo de un año o dos se transforman en hembras. Cuando dos caracoles se encuentran entre ellos en la época de la reproducción, se produce un cortejo que consiste en rozamientos con los tentáculos, con el pie y con la cabeza, con los cuales el macho va estimulando a la hembra y comprueba su estado reproductivo. Si la hembra es receptiva y está activa sexualmente, entonces comienza el proceso de apareamiento (Barnes, 1996). En primer lugar, el macho contacta con la hembra por el pie, en donde tiene un abultamiento que tiene la función de pene. Este órgano copulador lo introduce en el interior del oviducto de la hembra. Luego se produce el apareamiento de ambos caracoles, que puede durar dos o tres horas. Durante este periodo se enrollan uno 11 con otro, produciéndose el intercambio de fluido seminal desde el macho a la hembra con lo cual se produce la fecundación interna de los huevos. Tras el apareamiento, los dos caracoles se separan y la hembra busca un lugar adecuado para depositar los huevos. En algunos casos, la hembra excava un hoyo en la tierra húmeda donde depositará los huevos, de uno en uno por lo que tarda mucho tiempo en este proceso de puesta de los huevos. En otras ocasiones, la hembra deposita sus huevos en agujeros del terreno, hendiduras en la madera podrida o bajo las piedras. La mayoría de las especies ponen de 20 a 25 huevos, si bien algunas pueden poner hasta 100 huevos o más. Los huevos tienen normalmente forma esférica, son blandos, transparentes y en algunos casos están protegidos por una cubierta dura y opaca. El periodo de desarrollo embrionario depende exclusivamente de la temperatura, siendo por lo general seis semanas. Los nuevos caracoles tienen el aspecto de adultos en miniatura y alcanzan la madurez sexual en un año aproximadamente, aunque las especies de grandes dimensiones tardan de 2 a 4 años (Camarda & Suarez, 2004). El índice de mortalidad durante el primer periodo de vida es muy alto. Los huevos no están al cuidado de los progenitores, pueden secarse, ser devorados por otros animales o ser parasitados. Los pequeños, además, son muy vulnerables, sufren más las condiciones climáticas y son fáciles de cazar. Generalmente, sólo el 5% de los huevos depositados alcanza la edad adulta (Fernández, 2007). Figura 7. a) Cortejo, b) Penetración, c) Apareamiento, d) Puesta, e) Huevos y f) Crías de gastrópodos terrestres. Elaboración: Autor: Benutzer Janekpfeifer. [En línea] http://commons.wikimedia.org/wiki/File:Napfschnecken_Galizien2005.jpg. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. 12 En algunos casos, los adultos mueren después de la puesta de los huevos, pero en otros casos, pueden vivir varios años (hasta 8 o 10). Sin embargo, a lo largo de su vida, los caracoles terrestres corren numerosos peligros, ya que son muchos sus depredadores. El más conocido enemigo de los caracoles terrestres es el zorzal (Turdus philomelos). Otros enemigos son la musaraña (Crocidura russula), el puerco espín (Coendou prehensilis), muchos roedores y las larvas de la luciérnaga. Además, existen muchos parásitos que pueden atacar tanto a los huevos como a los individuos adultos. Incluso, los caracoles terrestres son portadores de muchos parásitos peligrosos para el hombre (Fernández, 2007). 3.3. GASTRÓPODOS TERRESTRES Los gastrópodos se hallan representados entre 40 000 a 150 000 especies, mientras que la riqueza global de grupos terrestres se estima entre 30 000 y 35 000 especies de ese total (Aktipis et al. 2008). A pesar de la importancia en términos de riqueza y diversidad que tienen los gastrópodos terrestres, estudios de este tipo son escasos. Antiguamente, todos los gastrópodos eran acuáticos, pero posteriormente, en el curso de la evolución, un parte de ellos se ha adaptado a vivir en tierra, son los denominados gastrópodos terrestres. El cambio a la vida terrestre tenía como problema principal el de la deshidratación. Los caracoles terrestres adoptan diversas soluciones para resolver este problema. En primer lugar, la mayoría de ellos vive en ambientes húmedos y lleva una vida activa principalmente nocturna, resolviendo de esta forma, al mismo tiempo, el problema añadido que suponen los posibles depredadores, ya que, en la oscuridad, las conchas resultan mucho menos visibles y por lo tanto, están más protegidas (Naranjo, 2003). Muchos caracoles terrestres, poseen una concha gruesa e impermeable. En ocasiones críticas, otros pueden retraerse por completo hacia su interior, cerrando la abertura con una fina película que ellos mismo secretan. De esta manera, pueden aislarse por completo del ambiente externo y, al mismo tiempo, protegerse de una excesiva pérdida de humedad, hay casos en que pueden permanecer en esta situación durante meses, periodo que se denomina estivación. Muchos caracoles también pueden aislarse de esta manera para protegerse del frío excesivo, llamándose entonces hibernación a tal proceso (Fernández, 2007). 13 Un factor que condiciona en gran medida a los caracoles terrestres es el tipo de terreno. La mayoría de ellos prefiere terrenos calcáreos, ya que el calcio resulta muy importante para estos animales, que lo utilizan en la formación de sus conchas. Por lo tanto, en los terrenos calcáreos siempre existe un mayor número de especies que en los ácidos. Las especies de caracoles que viven en terrenos ácidos se caracterizan por presentar conchas delgadas y frágiles. Un segundo factor importante que condiciona la presencia de los gastrópodos terrestres es el clima, en general, la humedad ambiental resulta importante para los caracoles terrestres, así como el calor, comparativamente, la diversidad de especies de caracoles terrestres aumenta progresivamente desde los polos hasta las zonas ecuatoriales; sin embargo, hay grandes zonas abiertas, secas y desprovistas de suficiente vegetación y humedad en las que no suelen vivir los caracoles terrestres, estos suelen ser más abundantes en zonas sombrías y húmedas, con abundante vegetación, cobijándose bajo piedras, madera o musgo (Naranjo, 2003). Figura 8. Gastrópodo terrestre. Elaboración: Autor: Stako. [En línea] http://commons.wikimedia.org/wiki/File:Slimaczek.jp g. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. 3.4. GASTRÓPODOS EN ECUADOR La biodiversidad de moluscos terrestres de Ecuador continental es poco conocida pero existe una riqueza relativamente alta de moluscos, con especies típicas y/o endémicas muy interesantes. Esta fauna tiene especies representativas, endémicos y moluscos de tamaños extremos: gigantescos como el caracol de Pope (Strophocheilu spopelairianus), algunos prosobranquios muy interesantes así como minúsculos caracolitos, ejemplo: Systrophiidae, (Correoso, 2008). 14 Euconulidae y Clausiilidae La fauna de moluscos del país abarca desde especies muy pequeñas casi insignificantes y de colores muy apagados hasta especies muy bonitas y llamativas como en los géneros Corona, Sultana y Solaropsidae, de los bosques amazónicos. Es notoria la familia Bulimulidae, la mejor representada en el país con más del 50% de especies; solo en Galápagos hay 65 especies endémicas. No es raro encontrar moluscos del género Bulimulus que viven en los fríos páramos a más de 4 000 m.s.n.m., entre las especies de moluscos, que viven a mayor altitud, además de especies de zonas áridas como Machalilla en la costa y otras de bosques nublados y del oriente (Correoso, 2008). Los moluscos terrestres en general tienen en los trópicos, condiciones ideales de humedad vegetación y temperatura; del suelo que aporta el calcio para formar la concha: el carbonato de calcio es un gran factor limitante. Esto es tan importante que los caracoles tienen limitado su grado de dispersión, debido a la presencia de sales cálcicas del suelo, por eso hábitats como ríos y lagos pobres en esta sal pueden llegar hasta carecer de moluscos o presentar baja diversidad-densidad; o tener conchas pequeñas y frágiles (Correoso, 2008). Los moluscos terrestres tipifican desde el punto de vista biogeográfico a un país por sus especies endémicas, pues el genuino endemismo ocurre en especies con poca locomoción. Muchos moluscos pueden ser endémicos de algunas regiones y localidades del país, por lo cual se han clasificado y nombrado con nombres locales (topónimos) Bulimulus antizanensis, Bulimulus cotopaxense. En general en Ecuador existen muchas especies de caracoles pero algo difícil de encontrar o recolectar en su variado territorio, aspecto acorde con un postulado de la ecología tropical, presencia de alta biodiversidad y baja cantidad de individuos, lo que contribuye a su baja presencia en colecciones de museos locales. Se distribuyen desde los páramos andinos a 4 000 msnm, pasando por bosques nublados, selvas y zonas áridas hasta la costa (Correoso, 2008). 15 Tabla1. Clasificación de la clase gastrópoda en Ecuador Clase Subclase Prosobranchia Orden Achaeogastropoda Architaenioglossa Superfamilia Helicinoidea Cyclophoroidea Orthalicoidea Achatioidea Stylommatophora Pulmonata Oleacinoidea Streptaxoidea Strophocheiloidea Camaenoidea Gastropoda Succionoidea Polygyroidea Limacoidea Gymnomorpha Achaeogastropoda Prosobranchia Mesogastropoda Pulmonata Basommatophora Soleolifera Neritaceae Ampullaroidea Cerithiacea Truncatelloidea Lymnaeoidea Ancyloidea Unioboidea Muteloidea Familia Helicinidae Poteriidae Bulimulidae Orthalicidae Amphibulimulidae Subulinidae Clausilidae Oleacinoidea Streptaxoidea Systrophiidae Strophocheilidae Camaenidae Systrophiidae Succineidae Polygyridae Limacidae Ariolimacidae Veronicellidae Neritidae Ampullaridae Melaniidae Hydrobiidae Limneidae Planorbidae Physidae Ancylidae Ellobidae Fuente: Correoso. M, 2008. 3.5. IMPORTANCIA DE LOS GASTRÓPODOS La mayoría de especies comestibles marinas y terrestres tiene alto valor proteico y digestibilidad. Son fuente de fármacos, drogas, cosméticos y nuevas sustancias. Son parte de la dieta de grupos indígenas de la amazonía y la sierra. Intervienen en la dinámica ecológica de los ecosistemas mediante funciones alimentarías como: herbívoros, ficófagos y descomponedores o detritívoros. Contribuyen a la formación del suelo tropical. Son la dieta de muchos vertebrados como mamíferos, aves y reptiles. Son elemento importante de la biomasa de invertebrados tropicales. La mayoría de grupos de moluscos son indicadores del estado de los ecosistemas, ante alteraciones por lo que son ideales bioindicadores ecológicos (Correoso, 2008). 16 3.6. PROTECCIÓN AMBIENTAL DE LOS MOLUSCOS EN ECUADOR En Ecuador está la segunda especie de caracol terrestre de mayor tamaño del mundo, Strophocheilus popeleiranus, (solo superado por el caracol centroafricano Achatina) vive en los bosques húmedos tropicales a ambos lados de los Andes, sirve de alimento a las comunidades indígenas amazónicas, pero son cada vez más raros, y poco estudiados aunque tiene potencialidades de crianza y manejo en cautiverio, por su carne, rojiza y agradable que no tiene nada que envidiar a los conocidos Scargots que se importan de Francia e Italia. Actualmente ningún molusco terrestre del Ecuador continental aparece en las listas rojas de especies amenazadas de la UICN y desafortunadamente hemos comprobado una marcada disminución de moluscos terrestres en el Ecuador, debido a acciones humanas como la deforestación incontrolada, la construcción de ciudades y represas en algunas zonas, la quema de los páramos y bosque secos, además de causas naturales como inundaciones, erupciones volcánicas u otras que extinguirán muchas especies de moluscos y otras especies incluso antes de poder llegar a conocerlas (Correoso, 2008). Desde los primeros estudios a finales del siglo de XIX hasta la fecha, se hace notoria la falta de información precisa sobre moluscos terrestres y fluviales en los diversos textos de fauna de Ecuador, además en universidades y museos nacionales. Ecuador presenta cifras sobre las 300 especies lo que lo ubica comparativamente entre Colombia y Perú (Correoso, 2008). 3.7. GASTRÓPODOS COMO PLAGAS La introducción de especies exóticas representa un peligro para la biodiversidad, si bien algunas pueden ser controladas otras han significado una amenaza de muerte, para la fauna y flora endémicas y además se constituyen plagas agrícolas, problemas para la salud, económicos y medio ambientales en los países afectados (Correoso, 2006). Una gran parte de los moluscos terrestres y fluviales son portadores de parásitos, enfermedades humanas y a los animales domésticos. Constituyen el segundo grupo más numeroso de especies después de los insectos dentro de los animales invertebrados. Entre otras funciones ecológicas un marcado papel en la historia cultural humana relacionado con diversos factores socioeconómicos, alimentación, 17 valor estético y mítico religioso con marcada influencia sobre el hombre desde sus orígenes hasta nuestros días (Correoso, 2008). Correoso (2005) reportó el principal molusco plaga para Ecuador, así como también es una de las plagas más importantes de invertebrados a nivel mundial, el caracol gigante africano Achatina fulica (Bowdich, 1822); considerada una de las 100 plagas más importantes por su peligrosidad. Achatina fulica es una plaga a nivel continental, está presente en los países andinos, y en un reciente diagnóstico de especies exóticas en Venezuela se reveló su presencia junto a otras especies de moluscos. Los moluscos aunque lentos y aparentemente frágiles son plagas frecuentes a escala mundial y a menudo figuran entre los invasores más agresivos (Ojasti, 2001). Figura 9. Achatina fulica Elaboración: Autor: Ahoerstemeier. [En línea] http://commons.wikimedia.org/wiki/File:Achatina_fulica_T hailand.jpg. Este archivo bajo licencia: Creative Commons Attribution/Share-Alike License 3.0 Unported. Achatina fulica (Bowdich, 1822), es una especie introducida y esta presente principalmente en Esmeraldas; esta introducción surge a raíz de haber realizado campañas publicitarias televisivas a nivel nacional de un cosmético denominado genéricamente baba de caracol; es originaria de África Oriental y de algunos países del sur de Sahara y centro del continente, donde lo utilizan como alimento. Son moluscos terrestres tropicales y subtropicales. Aunque son especies de zonas cálidas algo áridas, pueden adaptarse a cualquier tipo de hábitat, desde las zonas intervenidas hasta pantanos y zonas urbanas donde exista vegetación (Correoso, 2008). 18 3.8. LOS CARACOLES Y LAS ENFERMEDADES QUE TRANSMITEN A LAS PERSONAS El caracol africano Achatina fulica (Bowdich, 1822), habría llegado a varios países de manera ilegal para comercializar su carne; ahora se han convertido en la causa de proliferación de enfermedades que afectan de manera significativa a la salud humana. Este caracol puede cobijar parásitos que se alojan en tejidos fibromusculares y secreciones de moco del animal, causando diversas afecciones desde enfermedades de tipo respiratorio, hasta meningoencefalitis eosinofílica, angiostrongiliasis abdominal en los seres humanos, transmitida por la Angiostrongylus cantonensis, lombriz que parasita los pulmones de las ratas, también es vector de la bacteria gramnegativa, Aeromonas hydrophila, que causa diversos tipos de síntomas, principalmente en las personas con sistemas inmunológicos delicados, el contagio se produce a través del contacto de ojos, nariz, o boca con la mucosidad del caracol, o por el consumo de su carne si ésta no es adecuadamente lavada (UAB, 2011). Estos caracoles son hospederos de parásitos que causan enfermedades graves a humanos, y animales domésticos, lo que ocasiona muertes por problemas intestinales (reportada para Brasil). El caracol puede trasmitir el parásito a los roedores domésticos, lo que contribuye a mantener el ciclo biológico del nematodo; de esta forma puede llegar a constituir graves epidemias de muy difícil diagnóstico, como indican médicos y parasitólogos, donde los roedores desempeñan un papel muy importante en su epidemiología. Siendo sus vectores más frecuentes rata doméstica (Rattus rattus), rata arrocera pigmea (Oryzomys fulvescens) y ratón de campo (Oryzomys caliginosus). Los síntomas en estos animales son poco manifiestos (Correoso, 2006). 3.9. LOS MOLUSCOS Y EL CAMBIO CLIMÁTICO Durante las últimas dos décadas, se ha evidenciado que el clima global está cambiando y los gases que causan el efecto invernadero siguen incrementándose alarmantemente, se calcula que la temperatura mundial de la superficie ha aumentado en 0,6 °C (IPCC, 2001). La atmósfera responde a este incremento de gases con un aumento de la temperatura (Aalst, 2006). Estos cambios tienen efectos secundarios en los sistemas hidrológicos, ecosistemas terrestres y marinos (Midgley et al., 2002; Aalst, 2006; Durance et al., 2007). Las implicaciones de estos cambios 19 son sobre especies de plantas (Scholze et al., 2006); y animales en diferentes vías como su distribución, tamaño poblacional, estructura física, metabolismo y comportamiento (IPCC 2001; Parmesan et al., 2003; Parmesan et al., 2004; Cumming et al., 2006; Aalst, 2006). La biodiversidad es continuamente transformada por el cambio climático. Las condiciones de cambio a través de la superficie del planeta, algunas veces rápidas, algunas veces lentas, en grandes o pequeños incrementos, resultan en la reacomodación de las asociaciones biológicas. Es importante resaltar que el efecto del cambio global, al influir en procesos ecológicos y funcionales, también influye en los servicios ecosistémicos que aportan los bosques al bienestar humano, alterando procesos naturales de los ecosistemas (IPCC, 2002). Desde sus inicios la civilización humana ha inducido en el ambiente cambios que afectan la biodiversidad, esto incluye la de los moluscos terrestres (Preece, 1998). Desde el punto de vista biológico, las variaciones ambientales llevan a sucesos de expansión, dispersión, invasión, migración, extinción, surgimiento de nuevas especies y alteraciones de los ámbitos de distribución de las especies (Monge, 2006), alterando y marcando los patrones biogeográficos naturales de las especies. En la actualidad las variaciones más dramáticas las producen la expansión de las fronteras agrícola y urbana y el cambio climático mundial. La deforestación asociada a la expansión de las actividades humanas ha producido espacios abiertos, con ámbitos de temperaturas y humedad más amplios (Nebel, 1999; Smith & Smith, 2001), lo que favorece a unas especies y desfavorecen a otras (Lundholm, 2006, Clergeau et al., 2006, Shochat et al., 2006). Los moluscos terrestres son un grupo muy susceptible a variaciones en la humedad por lo que también son afectados por la deforestación (Hyman, 1967; South, 1992; Cook, 2001). Varios casos de especies de moluscos terrestres han expandido su hábitat, están más asociadas con intervenciones humanas que con cambio climático. En la mayoría de los casos, el cambio climático y el cambio de uso de la tierra está provocando que las especies se extingan (Barrientos, 2003; Lydeard et al., 2004). 20 3.10. DECLIVE DE GASTERÓPODOS TERRESTRES Actualmente, la tasa de extinción de especies es una de las mayores en la historia de la Tierra (Lawton & May, 1995). Ésta pérdida de diversidad biológica es preocupante, ya que la biodiversidad tiene importantes beneficios para la humanidad (Costanza et al., 1997; Chapin et al., 2000; Balmford et al., 2002). Por este motivo, se están desarrollando actuaciones encaminadas a evitar la progresiva pérdida de especies (Margules & Pressey, 2000). Sin embargo, aún son relativamente escasos los esfuerzos de conservación sobre la fauna invertebrada, a pesar de que supone aproximadamente el 97% de la diversidad de especies conocidas y cumple un importante papel en los ecosistemas (Ponder & Lunney, 1999; Nee, 2004). De hecho, menos del 0,3% de los invertebrados han sido evaluados en las listas de la UICN (Baillie et al., 2004). Precisamente, los moluscos son el grupo animal que registra el mayor número de extinciones documentadas, con los moluscos terrestres mostrando el mayor descenso poblacional en los últimos años (Lydeard et al., 2004). Es posible que la influencia humana esté condicionando el empobrecimiento de la diversidad malacológica; en general, se ha detectado una declinación a nivel mundial en la diversidad de especies de moluscos no marinos (Lydeard et al., 2004), que en algunos casos están asociados a la destrucción del hábitat y al impacto de especies invasoras y en otros se relacionan con la agricultura, la tala, los incendios y extracción de rocas (Cowie & Robinson, 2003). 21 4. ÁREA DE ESTUDIO El estudio se lo llevó a cabo en la Estación Científica San Francisco (ECSF), ubicada al sur de Ecuador, 3 ° 58'18'' S, 79 ° 4 '45'' E (Fig. 10), comprende bosques de montaña de la cordillera oriental de los Andes (Göttlicher et al., 2009 & Thies et al., 2012); se encuentra entre un rango altitudinal que va desde los 1 800 a 3 140 m s.n.m. con un régimen climático que se divide en dos épocas, la época seca de octubre a abril y la época lluviosa de mayo a septiembre, con precipitaciones anuales de 2 180 mm, con un máximo en los meses de junio, julio y agosto (Bendix et al., 2008). Figura 10. Mapa del área de estudio Elaboración: Autora El bosque de montaña de la ECSF posee las siguientes formaciones vegetales de acuerdo a Göttlicher et al. (2009), bosque siempreverde montano y bosque nublado montano y dentro de estos distingue algunas clases de cubierta vegetal terrestre: 1) bosque pre – montano; 2) bosque tipo I, barrancos 1 900 – 2 100 m; 3) bosque tipo II, crestas y laderas superiores 1 900 – 2 100 m; 4) bosque tipo III, crestas y laderas superiores 2 100 – 2 250 m; 5) bosque tipo IV, crestas y laderas superiores 2 250 – 2700 m; 6) bosque tipo V, barrancos 2 100 – 2 700 m; 7) sub-páramo tipo VI superior 22 a 2 700 m; 8) helechos; 9) pastos; 10) arbustos y 11) áreas sin vegetación (laderas y deslizamientos de tierra). Además constituye área de distribución de algunas especies de mamíferos, entre ellos, oso de anteojos (Tremarctos ornatus), puma (Puma concolor), tigrillo (Leopardus pardalis). Más de 600 especies de aves representan alrededor del 37.5% de las especies de aves endémicas de Ecuador, en las que distinguen la torcaza (Zenaida auriculata), el águila (Stephanoaetus coronatus), pava barbada (Penelope barbata), lorito (Amazona autumnalis), gaviota andina (Larus serranus) y mirlo (Turdus merula) (Emck, 1999). El muestreo de moluscos se llevó a cabo en dos coberturas diferentes, bosque: intervenido (BI) y bosque no intervenido (BNI) (Fig. 11), el primero localizado en los alrededores de las instalaciones de la ECSF, caracterizado por la escasa cobertura vegetal, presencia de pastizales, helechos y malezas; el segundo se caracteriza por albergar abundante flora y fauna nativa intacta, y el uso que se le da a este bosque es exclusivamente para la investigación por parte del Consorcio Alemán de Investigaciones (DFG, Deutsche Forschungsgemeinschaft). Figura 11. Tipos de bosque Elaboración: Autora 23 5. METODOLOGÍA 5.1. MUESTREO DE GASTRÓPODOS TERRESTRES En los meses de julio, agosto y septiembre de 2012, se realizó 8 muestreos por mes en cada tipo de bosque, dando un total de 48 muestreos. Se ubicó 10 cuadrantes de 1 m2 con una secuencia diagonal (Fig. 12), en los cuales se realizó el muestreo durante 15 minutos tanto en la hojarasca, suelo superficial (explorando hasta 5 cm de profundidad), sotobosque, como en otros elementos del entorno (rocas, troncos), para disminuir el margen de error o sesgo se realizó una réplica para cada cuadrante (Rangel & Gamboa, 2006). Figura 12. Esquema de muestreo de gastrópodos terrestres en el área de estudio. A la izquierda se presenta la secuencia diagonal y disposición de los cuadrantes de muestreo. A la derecha una fotografía de los cuadrantes de muestreo en el campo. Se determinó los cuadrantes según las preferencias de los gastrópodos tales como ambientes relativamente húmedos, sombríos y con un alto contenido de materia orgánica (Pérez, 1999). Todos los especímenes recolectados fueron depositados en tubos plásticos, se los conservó en alcohol al 70%, luego fueron transportados al Laboratorio de Sanidad Animal y Zoonosis (LABSA) de la Universidad Técnica Particular de Loja, en donde posteriormente fueron separados y contabilizados de acuerdo a sus rasgos o características morfológicas. La identificación se la realizó hasta nivel taxonómico de familia en un caso, para género en tres casos y a nivel de especie en 5 casos. Se utilizó las claves taxonómicas para identificar moluscos terrestres y fluviales de Ecuador continental (Correoso, 2005), así como un experto, en este caso el Dr. Modesto Correoso. 24 5.2. ANÁLISIS DE DATOS Como atributos para realizar los análisis de la diversidad de gastrópodos en el BI y BNI se determinó varios índices que se detallan más adelante. Además, se analizó la composición de especies de gastrópodos para ambos tipos de bosque. 5.2.1. INDICES DE RIQUEZA Y DIVERSIDAD Se utilizó el programa EstimateS® versión 8.2 (Colwell, 2009) para determinar los siguientes índices en la estimación de la riqueza de especies: Curva de acumulación de especies: Evalúa la representatividad de especies con el esfuerzo de muestreo (Gotelli & Colwell, 2001; Jiménez y Hortal, 2003). Ace: (Abundance – Based Coverage Estimator), se basa en datos de abundancia que superestiman la riqueza de especies cuando el número de muestras es bajo (Colwell & Coddington, 1994). Ice: (Incidence – Based Coverage Estimator) está basado en el concepto estadístico de cobertura de muestreo, que se refiere a la suma de las probabilidades de encontrar especies observadas dentro del total de especies presentes (Colwell, 2006). Chao 1: Estima el número de especies esperadas considerando la relación entre el número de especies representada por un individuo y el número de especies representadas por dos individuos en las muestras (Colwell & Coddington, 1994). Chao 2: Requiere solo datos de presencia y ausencia y es el que presenta menor sesgo cuando las muestras son pequeñas (Colwell & Coddington, 1994). Jacknife 1: Que al tener en cuenta las especies únicas tiende a reducir el sesgo de los valores estimados (Colwell & Coddington, 1994). Jacknife 2: Se basa en el número de especies que ocurren solamente en una muestra y en el número de especies que ocurren exactamente en dos muestras (Colwell & Coddington, 1994). Bootstrap: Calcula la proporción de unidades de muestreo que contienen a cada especie (Colwell & Coddington, 1994). 25 Se utilizó el programa estadístico R-Project (Ihaka & Gentleman, 1996) para determinar: Índice de Diversidad de Simpson, el cual muestra la probabilidad de que dos individuos sacados al azar de una muestra correspondan a la misma especie. Todos estos índices fueron calculados separadamente para cada cuadrante y luego fueron promediados para cada muestreo (n= 24 para cada tipo de bosque, i.e. 8 muestreos por 3 meses). Una vez obtenidos los índices, se aplicó una prueba tStudent para evaluar la significancia de los valores promedios de los índices entre ambos tipos de bosque (p= 0.05). 5.2.2. COMPOSICIÓN DE GASTRÓPODOS Varios métodos estadísticos han sido utilizados para evaluar las relaciones entre el uso del suelo y biodiversidad (ej. Análisis multivariados o regresiones lineales). En este estudio se utilizó la función „metaMDS‟ del paquete „vegan‟ del programa estadístico R-Project (Ihaka & Gentleman, 1996) para aplicar un Escalamiento Multidimensional no Métrico (NMDS por sus siglas en inglés) que permita identificar comunidades de gastrópodos asociadas a ambos tipos de bosque. El NMDS es un método que crea una matriz de distancia (Bray – Curtis) entre los objetos investigados, creando un espacio que es cada vez mayor cuando aumenta las diferencias entre estos objetos. En otras palabras, esa matriz de distancia permite crear una separación que facilita detectar grupos asociados, en este caso, a diferentes tipos de bosque. Además, el NMDS es comúnmente considerado como el método de ordenación sin restricciones más robusto en el análisis de la ecología de comunidades (Minchin 1987). Finalmente, se aplicó un análisis de similitudes (ANOSIM) utilizando la función „anosim‟ del paquete „vegan‟, a los grupos asociados a cada tipo de bosque identificados en el NMDS. El ANOSIM es un procedimiento no paramétrico que proporciona una forma de probar estadísticamente si hay una diferencia significativa entre dos o más grupos de unidades de muestreo, en este caso comunidades de gastrópodos. 26 6. RESULTADOS 6.1. RIQUEZA Y DIVERSIDAD En general, se registraron 1898 individuos, pertenecientes a 7 familias, 8 géneros y 5 especies, 4 taxones (taxón 1= Streptaxidae, taxón 2= Opeas, taxón 3= Leptinaria, taxón 4= Euconulus) no fueron identificados hasta el nivel de especie. El BNI presenta el mayor número de individuos capturados (1706) así como también el mayor número de especies (9) (ver Tabla 2). Independientemente, tanto en el bosque no intervenido como en el bosque intervenido S. heligmoida es la especie de mayor abundancia con 1 596 individuos para el BNI y con 171 para el BI; por otro lado Euconulus sp1 y E. striata registran el menor número de individuos, con 1 individuo cada una, exclusivamente para el BNI. Tabla 2. Visión general de los gastrópodos encontrados en el BI y BNI durante todo el muestreo. FAMILIA Systrophidae Streptaxidae Subulinidae Subulinidae Subulinidae Scolodotidae Helicinidae Eucunulidae Spiraxidae GÉNERO Systrophia Opeas Obeliscus Leptinaria Happia Helicina Euconulus Euglandina ESPECIE Systrophia heligmoida Taxón 1 Taxón 2 Obeliscus cuneus riparius Taxón 3 Happia guayaquilensis Helicina rhynchostoma Taxón 4 Euglandina striata TOTAL TIPOS DE BOSQUE BNI BI 1596 171 45 11 21 5 17 3 13 1 7 0 5 1 1 0 1 0 1706 192 TOTAL 1767 56 26 20 14 7 6 1 1 1898 En la curva de acumulación de especies representada para el total del área muestreada, se puede observar un esfuerzo de muestreo óptimo, dado que las especies observadas coinciden con la asíntota de referencia de las especies esperadas (Gráfico 1). 27 10 # ESPECIES 8 6 4 Especies observadas 2 Asintota 1 30 59 88 117 146 175 204 233 262 291 320 349 378 407 436 465 0 # INDIVIDUOS Gráfico 1. Curva de acumulación de especies para el total del área muestreada. La diversidad de especies de gastrópodos en ambos tipos de bosque fue baja. Sin embargo en promedio el BNI presenta mayor diversidad que el BI (Tabla 3), excepto para la diversidad de Simpson. Los resultados de la t de Student demuestran que existe diferencia altamente significativa (p > 0,001) entre BNI y BI, corroborando los resultados en la mayoría de los índices de riqueza y diversidad; adjudicando mayor riqueza y diversidad de especies al BNI, a excepción de la diversidad de Simpson. (Gráfico 2). Tabla 3. Índices de diversidad calculados para BI y BNI. Índices Ace Ice Chao1 Chao2 Jacknife1 Jacknife2 Bootstrap Simpson Bosque No Intervenido Mínimo Media Máximo 2.0 5.0 11.0 2.2 7.4 21.6 2.0 4.1 11.0 2.0 4.3 10.4 2.9 5.2 10.6 3.7 6.3 13.8 1.2 4.0 8.5 0.0 0.1 0.4 28 Bosque Intervenido Mínimo Media Máximo 1.0 2.4 7.5 1.0 2.6 12.6 1.0 1.8 4.5 1.0 2.0 6.7 1.0 2.3 6.7 0.3 2.8 9.1 1.0 1.9 5.1 0.0 0.2 0.6 Gráfico 2. Comparación de los índices de riqueza y diversidad para bosque intervenido (BI) y bosque no intervenido (BNI). La diferencia estadística fue p > 0.001 (t-Student) para casi todos los índices calculados. Únicamente el índice de Simpson no presentó diferencia entre ambos tipos de bosque (p = 0.5) 29 6.2. COMPOSICIÓN DE ESPECIES En la ordenación NMDS, con un stress que indica alta calidad en la ordenación (0.03), en la comparación de los tipos de bosque se distinguen claramente 2 grupos, un grupo bastante desorganizado y disperso correspondiente al BI y otro grupo homogéneo correspondiente al BNI (Gráfico 3). Gráfico 3. Ordenamiento Multidimensional no Métrico (NMDS, stress 0,03) para BI y BNI. Izq: muestreos del BI. Der: muestreos del BNI 30 El análisis de similitud ANOSIM con un R global =0,916 y p=0,001 indica alta significancia estadística en los resultados del análisis, con una marcada diferencia entre las comunidades de gastrópodos de BI y BNI, baja diferencia en las muestras del BI y mínima diferencia en las muestras del BNI, siguiendo un patrón totalmente similar al análisis multivariante (NMDS) anteriormente aplicado (Gráfico 4). Gráfico 4. Análisis de similitudes (ANOSIM) entre BI y BNI, altamente significantes (p=0,001). 31 7. DISCUSIÓN Considerando que diferentes características del hábitat determinan la distribución de moluscos terrestres (Correa, 2007), el BNI registró el mayor número de especies de gastrópodos terrestres, debido a que proporcionan una considerable cobertura vegetal sobre el suelo, protección contra la desecación, abundante hojarasca y alimento, lo que favorece la presencia de estos organismos (Boycott, 1934; Berazain, 1981; Álvarez et al., 2003; Correa, 2007). Por el contrario, el menor número de especies de moluscos terrestres hallados en el BI, se explica principalmente por la escasa cobertura vegetal, y más iluminación sobre el suelo (Hunter, 1964; INEGI, 1980; INEGI 1981; Correa et al., 2007). Destacando el trabajo de Álvarez et al., (2003) el cual encuentra la mayor parte de especies de moluscos terrestres en hojarasca, en esta investigación las especies registradas estuvieron también presentes en hojarasca y humus. Esto se debe a que esta proporciona un clima adecuado, refugios y alimento a diversas especies, por lo que incide en su distribución (Petersen & Luxton, 1982; Solem & Climo, 1985; Locasciulli & Boag, 1987; Thompson & Correa, 1994; Correa, 2007). Las curvas de acumulación de especies es un método importante en los estudios sobre biodiversidad, por la facilidad en la interpretación de resultados y por el uso de este método en numerosos trabajos sobre inventarios biológicos (Jiménez, 2003). En el caso de gastrópodos terrestres este método se ajustó eficazmente, mostrando un esfuerzo de muestreo óptimo, alcanzando la asíntota de especies esperadas. Las zonas con algún grado de perturbación, soportan una menor riqueza y abundancia de especies en relación a los bosques nativos (Gasca & Ospina, 2000; Connell, 1978); enunciado que coincide con el presente estudio, el BI registra el menor número de especies y abundancia con respecto al BNI. Con base en la diversidad de especies, tal como sugiere Pérez et al., (2006) en el trabajo de Gonzales et al., (2010) las zonas conservadas de bosque poseen mayor diversidad de especies en relación a las zonas con algún grado de perturbación, la mayor diversidad de especies en este estudio la registra en BNI en relación al BI. Las técnicas de análisis multivariado (NMDS), (ANOSIM) describen una marcada diferencia en la composición de gastrópodos terrestres entre tipos de bosque estudiados, coincidiendo con el trabajo Gonzales et al. (2010) en el cual presenta 32 métodos multivariantes que diferencian la composición de gastrópodos terrestres de acuerdo a la perturbación de hábitats. Asumiendo que las especies del género Systrophia se distribuyen principalmente en América del Sur hasta los 4 400 m de altitud (Romero & Ramírez, 2011), desempeñan una función ecológica como depredadores de otros moluscos, y son abundantes en ambientes húmedos, como el suelo de los bosque y zonas tropicales (Correoso, 2008). En esta investigación la especie Systrophia heligmoida (Orbigny, 1835) registra el mayor número de individuos tanto para el BNI como para el BI. Existen relativamente pocos estudios que traten sobre moluscos terrestres (Gonzales et al., 2010; Pérez et al., 1996; Barrientos, 2003; Vera & Linares, 2005; Pérez et al., 2008), especialmente de aquellos de la región neotropical, y menos aún sobre sus patrones de distribución y abundancia que pueden ser afectados por las actividades de origen antrópico y el uso del suelo (Correa, 2003). 33 8. CONCLUSIONES El esfuerzo y la temporalidad del muestreo utilizado en este estudio fue el adecuado registrando un número considerable de especies presentes según las curvas de acumulación de especies. La diversidad de especies fue mayor para el BNI con respecto al BI presentado una variación en los patrones de diversidad. La composición de especies es diferente entre los dos tipos de bosque estudiados, además es heterogénea en el BI y más homogénea en el BNI. Ecológicamente el bosque tropical de montaña presenta una gran variedad de hábitats y condiciones climáticas únicas, que en conjunto hacen que albergue una mayor cantidad de organismos o formas de vida con respecto a otros ambientes. Los gastrópodos terrestres reflejan los niveles de perturbación, manifestando un descenso de individuos y especies de acuerdo al tipo de bosque, lo cual corrobora su uso como indicadores de calidad ambiental. Systrophia heligmoida, es una especie característica del bosque tropical, en este ambiente encuentra las condiciones adecuadas para su desarrollo. El conocimiento actual de la malacofauna terrestre en Sudamérica, específicamente en Ecuador, tanto en la taxonomía, ecología y biogeografía es aún precario y fragmentado. 34 9. RECOMENDACIONES Realizar investigaciones con monitoreos en diferentes escalas tanto espaciales como temporales para conocer más acerca de la composición de especies, en este tipo de ambiente. Proponer la implementación de buenas prácticas ambientales, en el área de bosque intervenido, que causen el menor daño ambiental posible. Incentivar y proponer temas de investigación relacionados con gastrópodos terrestres en diferentes tipos de ecosistemas y regiones, con el fin de incrementar los niveles de conocimiento tanto en taxonomía, ecología, biogeografía y su uso como bioindicadores. 35 10. BIBLIOGRAFÍA Aalst, M. 2006. The impacts of climate change on the risk of natural disasters. Disasters 30: 5 – 18. Aktipis, S.; Giribet, R.; Lindberg, R. & Ponder, W. 2008. Gastropoda: An overview and analysis, p. 201- 237. In W.F. Ponder & D.R. Lindberg (eds.). Phylogeny and Evolution of the Mollusca.Universidad de California, Berkeley, EEUU. Álvarez, J.; Naranjo, E. & Guevara, S. 2003. Perspectivas de estudios de acumulación de hojarasca en el subdosel y animales asociados. El caso de los moluscos. Pp. 80-87. Instituto de Ecología. Universidad Nacional Autónoma de México. Xalapa, México. Aycaguer, C. 2006. Tecnología de los productos dela pesca, Malacología. Área de Ciencias del Mar. Uruguay. Aycaguer, C. 2006. Elementos de Malacología, Aplicada a la Tecnología de Productos Pesqueros. Baillie, M.; Hilton, C. & Stuart, N. 2004 IUCN red list of threatened species: A global species assessment. Gland y Cambridge. Balmford, A.; Bruner, A.; Cooper, P.; Costanza, R.; Farber, S.; Green, E.; Jenkins, M.; Jefferiss, P.; Jessamy, V.; Madden, J.; Munro, K.; Myers, N.; Naeem, S.;Paavola, J.; Rayment, M.; Rosendo, S.; Roughgarden, J.;Trumper, K. & Turner, K. 2002. Economic reasons for conserving wild nature. Science, 297: 950-953. Barnes, R. 1996. Zoología de los invertebrados, 6ª ed. Cap. 10: Moluscos (pp. 335494). Barrientos, Z. 2003. Lista de especies de moluscos terrestres (Archaeogastropoda, Mosogastropoda, Archaeopulmonata, Stylommatophora, Soleolifera) informadas para Costa Rica. Revista Biológica Tropical. 51(3): 293-304. Bendix, J.; Rollenbeck, R.; Richter, M.; Fabian, P. & Emck, P. 2008. Climate. – In: Beck, E.; Bendix, J.; Kottke, I.; Makeschin, F. & Mosandl, R. (eds). Gradients in a tropical mountain ecosystem of Ecuador. – Ecol. Stud. 198: 63-74. 36 Berazain, R. 1981. La Zona de Vegetación Serpentinícola del Jardín Botánico Nacional. Revista del Jardín Botánico Nacional 2: 151-181. Boycott, A.1934. The habitat of land mollusca in Brittain. Journal of Ecology 22: 1-38. Bücker, A., Sondermann, M.; Frede, H. & Breuer, L. 2010. The influence of land - use on macroinvertebrate communities in montane tropical streams – a case study from Ecuador. Camarda, C. & Suarez, L. 2004. Ecología Acuática, Estudio avanzado de Moluscos. Chapin, S.; Zavaleta, S.; Einer, T.; Naylor, L.; Vitousek, M.; Reynolds, L.; Hooper, V.;Lavorel, S.; Sala, E.; Hobbie, E.; Mack, C. & Díaz, S. 2000. Consequences of changing biodiversity. Nature, 405: 234-242. Clergeau, P.; Jokimäki, J. & Snep, R. 2006. Using hierarchical levels for urban ecology. Trends Ecol. Evol. 21: 660-661. Connel, J. 1978. Diversity in Tropical Rain Forest and Coral Reefs. Science. New Series. 199: 4335: 1302-1310. Colwell, R. & Coddington, J. 1994. Estimating terrestrial biodiversity through extrapolation. Philos. Trans. R. Soc. Lond. B 345, 101-118. Colwell, R. 2006. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8. Available at: http://www.purl.oclc.org/estimates. Colwell, R. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application published at: http://purl.oclc.org/estimates. Cook, A. 2001. Behavioural ecology: on doing the right thing, in the right place at the right time, p. 447- 488. InG.M. Barker (ed.). The biology of terrestrial mollusks. Nueva York, EEUU. Correa, A. 2003. Gastrópodos terrestres del Noreste de México. Revista Biológica Tropical 51: 507-522. Correa, A.; Strenth, N. & Salazar, M. 2007. Gastrópodos Terrestres del Sur del Nuevo León. México. Acta Zool. Mex. 23: 143-162. 37 Correoso, M. 2005. Los moluscos esos interesantes y valiosos invertebrados. Revista Clubing Magazín. Edición Sierra. Año 6.No 65. Ecuador. Correoso, M. 2005. Lineamientos generales de la introducción de especies ¿enriquecimiento de la biodiversidad o problemas ecológicos?” Revista Geoespacial. No. 2. Escuela Politécnica del Ejército. Ecuador. Correoso, M. 2006. Estrategia preliminar para evaluar y erradicar Achatinafulica (Gastropoda: Achatinaceae) en Ecuador. Sangolquí. Ecuador. Correoso, M. 2008. Los Moluscos terrestres y fluviales del Ecuador. La biodiversidad desconocida. SIMBIOE. Quito Ecuador. Costanza, R.; D‟Arge, R.; De Groot, R.; Farber, S.; Grasso, M.; Hannon, B.; Limburg, K.; Naeem, S.; O‟Neill, V.; Paruelo, J.; Raskin, G., Sutton, P. & Van Den Belt, M. 1997. The value of the world‟s ecosystems services and natural capital. Nature, 387: 253-260. Cowie, R. & Robinson, A. 2003. The decline of native Pacific island faunas: changes in status of the land snails of Samoa through the 20th century. Biol. Conserv. 1: 5565. Cumming, G. & Vann, D. 2006. Will climate change affect ectoparasite species ranges? Global Ecology and Biogeography 15: 486 – 497. Durance, I. & Ormerod, S. 2007. Climate change effects upland stream macroinvertebrates over a 25 – year period. Global Change Biology 13: 942 – 947. Emck, P. 1999. Climatic conditions in the Cordillera de Numbala (Podocarpus National Park), Southern Ecuador. Fernández, P. 2007. Características Generales de los Gastrópodos Marinos y Terrestres. Forcelli, D. 2000. Moluscos Magallanicos Guía de Moluscos de Patagonia y Sur de Chile parte 1. Gasca, H. & Ospina, J. 2000. Estudio Preliminar de la Composición de la Comunidad de Escarabajos de un Bosque Altoandino en Albán (Cundinamarca, Colombia.) Acta Biológica Colombiana. 5 (2): 19-22. 38 Gonzalez, N.; Ochoa, S.; Cambranis, E.; Lara, O.; Perez, I. & Ponce, A. 2010. Gasterópodos terrestres asociados a un paisaje agropecuario y a un referente ecológico en el sureste de México. Gotelli, N. & Colwell, R. 2001. La cuantificación de la biodiversidad: Procedimientos y dificultades en la medición y comparación de la riqueza de especies Ecology Letters 4379-391. Göttlicher, D.; Obregón, A.; Homeier, J.; Rollenbeck, R.; Nauss, T.; & Bendix, J. 2009. Land-cover classification in the Andes of southern Ecuador using Landsat ETM+ data as a basis for SVAT modeling. Department of Geography, Laboratory for Climatology and Remote Sensing, University of Marburg, 35032 Marburg, Germany. Plant Ecology, Albrecht-von-Haller-Institute for Plant Sciences, University of Göttingen, 37073 Göttingen, Germany. Hunter, W.1964. Physiological aspect of ecology in non marine molluscs. Pp. 83-126. In: K. M. Wilbour & C. M. Yonge (Eds.). Physiology of Mollusca. Vol. 1. Academic Press. New York. Hyman, L. 1967. The invertebrates: Mollusca 1(Vol VI). McGraw-Hill, Nueva York, EEUU. Ihaka, R. & Gentleman, R. 1996. R: a language for data analysis and graphics. Journal of Computational and Graphical Statistics 5: 299–314. Instituto Nacional de Estadística, Geografía e Informática. 1980. Carta de precipitación total anual. Esc. 1: 1000,000. Secretaría de Programación y Presupuesto. México. Instituto Nacional de Estadística, Geografía e Informática.1981. Carta de humedad de suelo. Esc. 1: 1000,000. Secretaría de Programación y Presupuesto. México. Jiménez, A. & Hortal, J. 2003. Las curvas de acumulación de especies y la necesidad de evaluar la calidad de los inventarios biológicos. Revista Ibérica de Aracnología 8: 151 – 161. Lawton, J. & May, R. 1995. Extinction rates. Oxford University Press. Oxford. Locasciulli, O. & Boag, D.1987. Microdistribution of terrestrial (Stylommatophora) in forestlitter. Canadian Field-Naturalist 10(1): 76-81. 39 snails López, A. & Urcuyo J. 2009. Moluscos de Nicaragua. II Gastropodos Centro de Malacología/Biodiversidad Universidad Centroamericana-UCA. Nicaragua. Lundholm, J. 2006. How novel are urban ecosystems. Trends Ecol. Evol. 21: 659660. Lydeard, C.; Cowie, W.; Ponder, A.; Bogan, P.; Bouchet, S.; Clark, K.; Cummings, T.; Frest, O.; Gargominy, D.; Herbert, R.; Hersheler, K.; Perez, B.; Roth, M.; Seddon, E.; Strong, E. & Thompson, F. 2004. The Global decline of nonmarine mollusks. BioScience 54: 321-330. Margules, C. & Pressey, R. 2000. Systematic Conservation Planning. Nature, 405: 243-253. Martínez, R. & Piñango, H. 2008. Aspectos y Características Generales del Filo Mollusca. Midgley, F.; Hannah, L.; Millar, D.; Rutherford, M. & Powrie, L. 2002.Assessing the vulnerability of species richness to anthropogenic climate change in a biodiversity hotspot.Global Ecology & Biogeography 11: 445 – 451. Mille, S. & Pérez A. 2003.Géneros más Comunes de Moluscos Gasterópoda y Pelecycopoda en México. México. Minchin, P. 1987. An evaluation of the relative robustness of techniques for ecological ordination. Vegetatio 69:89–107 Miranda, M. & Cuezzo, M. 2010. Biodiversidad de gasterópodos terrestres (Mollusca) en el Parque Biológico Sierra de San Javier, Tucumán, Argentina. Revista Biológica Tropical 58: 3. Monge, J. 2006. Ecological biogeography: a review with emphasis on conservation and the neutral model. Gayana 72: 102-112. Moreno, C. & Halffter, G. 2000. Assessing the completeness of bat biodiversity inventories using species accumulation curves. J. Appl. Ecol., 37: 149-158. Naranjo, E. 2003. Moluscos Continentales de México: Terrestres. Universidad de Costa Rica. Costa Rica. 40 Nebel, B. 1999. Ciencias Ambientales. Ecología y desarrollo sostenible. Prentice Hall, México D.F., México. Nee, S. 2004. More than meets the eyes. Earth‟s real biodiversity is invisible, whether we like it or not. Nature, 429: 804-805. Ojasti, J. 2001. Especies exóticas invasoras. Estrategia regional de biodiversidad para los países del trópico andino convenio de cooperación técnica no rembolsable. Caracas – Venezuela. Panel Intergubernamental de Expertos sobre el Cambio Climático. 2001. Cambio Climático: Informe de síntesis. Evaluación del Grupo Intergubernamental de Expertos Sobre Cambio Climático. Panel Intergubernamental de Expertos sobre el Cambio Climático. 2002. Cambio climático y biodiversidad. Gitay, H; Suárez, A; Watson, RT; Dokken, DJ. eds. 85 p. (Documento técnico V del IPCC). Consultado 11 dic. 2007. Disponible en: http://www.ipcc.ch/pub/tpbiodiv_s.pd. Parmesan, C. & Yohe, G. 2003. A globally coherent fingerprint of climate change impacts across natural systems. Nature 421: 37 – 42. Parmesan, C. & Galbraith, H. 2004. Observed impacts of global climate change in the U.S. Pew Center on Global Climate Change. Patzelt, E. 2000. Fauna del Ecuador. 2 edición. Quito, Ecuador. Pérez, A.; Vilaseca, J. & Zione, N. 1996. Sinecología básica de moluscos terrestres en cuatro formaciones vegetales de Cuba. Revista Biológica Tropical 44(1): 133-146. Pérez, A. 1999. Estudio Taxonómico y biogeográfico preliminar de la malacofauna continental (Mollusca: Gastropoda) del Pacífico de Nicaragua. Tesis Doctoral, Universidad del País Vasco/Euskal Herriko Unibertsitatea, País Vasco, España. Pérez, A.; Sotelo, M., Ramírez.; López, A. & Siria, I. 2006. Conservación de la biodiversidad en sistemas silvopastoriles de Matiguás y Rio Blanco (Matagalpa, Nicaragua). Ecosistemas. 2006(3). 41 Pérez, A.; Sotelo, M.; Arana, I. & López, A. 2008. Diversidad de moluscos gastrópodos terrestres en la región del Pacífico de Nicaragua y sus preferencias de hábitat. Revista Biológica Tropical 56(1): 317- 332. Pfeiffer, L. 1855. Versuch einer Anordnung der Heliceen nach natürlichen Gruppen. Malakozoologische Blätter. 1: 221 – 223. Petersen, H. & Luxton, M. 1982. A comparative analysis of soil fauna populations and their role in de composition processes. Oikos 39(3): 287-388. Ponder, W. & Lunney, D. 1999. The other 99%. The conservation and biodiversity of invertebrates. Royal Zoological Society of New South Wales.Mosman. Preece, R. 1998. Impact of early Polynesian occupation on the land snail fauna of Henderson Islands, Pitcairn group (South Pacific). Phil. Trans. R. Soc. Lond. B 353: 347-368. Rangel, L. & Gamboa, J. 2006. Listado preliminar de Gasterópodos terrestres de “Boca del Cerro”, Tenosique, Tabasco, México. Kuxulkab´, 11(22): 51-57. Romero, P. & Ramírez, R. 2011. Divergencia intraespecífica y código de barras de ADN en Systrophia helicycloides (Gastropoda, Scolodontidae). Russell, W. 1968. Biology of Lower Invertebrates. Macmillan Pub.Co. New York, USA. X + 181 pp. Sanchez, A. & Berovides, V. 1991. Densidad y variación morfológica de Zachry siaguanensis (Gastropoda: Camaenidae), en Pinar del Rio, Cuba. Revista Biológica, Vol. V. Nos. 2-3 1991 Cuba. Pp.97-105. Scarabino, F. 2004. Lista sistemática de los Gastrópoda marinos y estuarinos vivientes de Uruguay. Comunicaciones de la Sociedad Malacológica del Uruguay 8(8485): 305346. Shochat, E.; Warren, P. & Faeth, S. 2006. Future directions in urban ecology. Trends Ecol. Evol. 21: 661-662. Sholze, M.; Knorr, W.; Arnel, N. & Prentice, C. 2006. A climate – change risk analyzes for world ecosystems. Proceedings of the National Academy of Science 103: 13116 – 13120. 42 Smith, R. & Smith, T. 2001.Ecología. Pearson, Madrid, España. Solem, A. & Climo, F.1985. Structure and habitat correlations of sympatric New Zealandland snails species. Malacology 26(1-2): 1-30. South, A. 1992. Terrestrial Slugs: Biology, ecology and control. Chapman & Hall, Londres, Inglaterra. Storch, V. & Welsch, U. 2001. Curso Práctico de Zoología de Kukenthal. Ariel Practikun. 23 ed. Thies, B.; Meyer, H,; Nauss, T. & Bendix, J.. 2012. Projecting land-use and landcover changes in a tropical mountain forest of Southern Ecuador. Laboratory for Climatology and Remote Sensing, Faculty of Geography, Philipps-Universität. Environmental Informatics, Faculty of Geography, Philipps- Universität Marburg, Marburg, Germany Thompson, F. & Correa, A. 1994. Landsnails of thegenus Coelocentrum from northeastern México. Bulletin of Florida Museum of Natural History, Biological Sciences 36(5): 141-173. Universidad Autónoma de Bucaramanga (UAB). 2011. El peligroso caracol gigante africano: Un visitante Indeseable. Colombia. Vera, M. & Linares, E. 2005. Gastrópodos de la región subxerofítica de La Herrera, Mosquera, Cundinamarca, Colombia. Revista de la Academia Colombiana de la Ciencia 29(112): 439-456. Willott, S. 2001. Species accumulation curves and the measure of sampling effort. J. Appl. Ecol., 38: 484-486. 43 11. GLOSARIO Abundancia de especies.- Número de individuos de determinada especie que se encuentran presentes en lugar determinado. Achatina fulica.- Especie de caracol terrestre, su concha puede medir hasta 25-30 cm de longitud y 8 de alto. Está incluida en la lista 100 de las especies exóticas invasoras más dañinas del mundo. Artrópoda.- Animales invertebrados dotados de un esqueleto externo y apéndices articulados, incluye, entre otros, insectos, arácnidos, crustáceos y miriápodos. Biodiversidad.- Variedad de especies animales y vegetales en su medio ambiente. Biogeografía.- Ciencia que estudia la distribución de los seres vivos sobre la Tierra, así como los procesos que la han originado, que la modifican y que la pueden hacer desaparecer. Bioindicadores.- Especie vegetal, hongo o animal; o formado por un grupo de especies o agrupación vegetal, cuya presencia informa sobre ciertas características ecológicas,, del medio ambiente, o sobre el impacto de ciertas prácticas. Bosque nativo (BNI).- Bosque intacto (u original), y con un alto grado de naturalidad que nunca ha sido explotado, fragmentado, o influenciado directa o indirectamente por el hombre. Bosque perturbado (BI).- Bosque nominado por tierras dedicadas a la agricultura, donde predominan pastos, helechos, malezas y son poco frecuentes los árboles. Clima.- Estado promedio de la atmósfera en lapsos de tiempo muy grandes y es modulado por un conjunto de fenómenos que caracterizan el estado medio atmosférico de un lugar. Curva de acumulación de especies.- La curva de acumulación de especies se utiliza para estimar el número de especies esperadas a partir de un muestreo. Esta curva muestra cómo el número de especies se va acumulando en función del número de muestras colectadas y permite además, estimar la eficiencia de muestreo. 44 Depredadores.- Interacción biológica en la que un individuo de una especie animal (el predador o depredador) caza a otro individuo (la presa) para subsistir. Diversidad de especies.- La diversidad de especies se refiere esencialmente al número de diferentes especies, así como su abundancia, presentes en un área determinada. Edafología.- Ciencia que estudia la composición y naturaleza del suelo en su relación con las plantas y el entorno que le rodea. Dentro de la edafología aparecen varias ramas teóricas y aplicadas que se relacionan en especial con la física, la química y la biología. Especies endémicas.- Especie o taxón que está restringido a una ubicación geográfica muy concreta y fuera de esta ubicación no se encuentra en otra parte. Espiralización.- Modificación de la concha. Se produce un arrollamiento asimétrico de la misma. La concha acaba desplazándose oblicuamente a la derecha. Este desplazamiento determina una parcial oclusión del lado derecho de la cavidad del manto, permitiendo una reducción del mismo. Estimadores de riqueza.- Métodos no paramétricos utilizados para estimar la riqueza o número de especies que se espera tenga determinada área. Hábitat.- Espacio que reúne las condiciones adecuadas para que una o un grupo de especies pueda residir y reproducirse, perpetuando su presencia. Índice de diversidad de Simpson.- Permite medir la riqueza de organismos. En ecología, es también usado para cuantificar la biodiversidad de un hábitat. Toma un determinado número de especies presentes en el hábitat y su abundancia relativa. El índice de Simpson representa la probabilidad de que dos individuos, dentro de un hábitat, seleccionados al azar pertenezcan a la misma especie. Invertebrados.- Animales que carecen de columna vertebral o notocorda y de esqueleto interno articulado, agrupa al 95% de todas las especies animales. Locomoción.- Proceso por el cual se desplazan los animales hacia un determinado recurso o actividad necesaria. 45 Mollusca.- Son invertebrados protóstomos celomados, triblásticos con simetría bilateral (aunque algunos pueden tener una asimetría secundaria) y no segmentados, de cuerpo blando, desnudo o protegido por una concha. Sistemas de información geográfica (SIG).- Integración organizada de hardware, software y datos geográficos diseñada para capturar, almacenar, manipular, analizar y desplegar en todas sus formas la información geográficamente referenciada con el fin de resolver problemas complejos de planificación y gestión geográfica. Región.- Porción de territorio que forma una unidad por tener unas características geográficas, políticas, climáticas, sociales o de otro tipo comunes. Riqueza de especies.- número de especies de una determinada región, siendo una unidad fundamental para la evaluación de la homogeneidad de un ambiente. Taxa.- Grupo de organismos emparentados, que en una clasificación dada han sido agrupados, asignándole al grupo un nombre en latín, una descripción, y un tipo. Torsión.- Consiste en un giro de la cavidad paleal de 180° en sentido antihorario, respecto a su posición inicial sobre el complejo cabeza - pie. Vegetación.- Conjunto de plantas que determinan aspectos importantes del paisaje en la naturaleza. 46 12. ANEXOS Anexo 1. Número total de individuos por especie. ESPECIE Systrophia heligmoida (Orbigny, 1835) Streptaxoidea sp1. Opeas sp1. Obeliscus cuneus riparius (Pfeiffer,1852) Leptinaria sp1. Happia guayaquilensis (Pf,1852) Helicina rhynchostoma (Pfeiffer,1865) Euconulus sp1. Euglandina striata (Müller, 1774) # INDIVIDUOS 1767 56 26 20 14 7 6 1 1 Anexo 2. Porcentaje de abundancia de individuos para cada estación (%). ESPECIE Systrophia heligmoida (Orbigny, 1835) Obeliscuscuneusriparius (Pfeiffer,1852) Streptaxoidea SP1. Helicinarhynchostoma (Pfeiffer,1865) Euconulus sp1. Leptinaria sp1. Happiaguayaquilensis (Pfeiffer,1852) Euglandinastriata (Müller, 1774) Opeas sp1. TOTAL 47 % INDIVIDUOS BNI BI 84,08 9,00 0,89 0,15 2,37 0,57 0,26 0,05 0,05 0 0,68 0,05 0,36 0 0,05 0 1,10 0,26 89,88 10,11 Anexo 3. Características generales de la familia de las especies registradas. Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Especie Características Hábitat y sustrato Datos de interés Importancia ecológica y científica Experiencia en cautiverio Distribución geográfica Localidades Animalia Mollusca Gastrópoda Rhytidoidea Systrophidae Systrophia (Entodina) Systrophia heligmoida (Orbigny, 1835) Caracoles terrestres con conchas achatadas y transparentes o translucidas. Las formas oscilan entre helicoidal o discoidal. Peristoma simple o emarginado. En Ecuador, conchas muy pequeñas. Habitan ambientes húmedos, como el suelo de los bosques y zonas tropicales. Se reportan algunos caracoles carnívoros de esta familia algo comunes en zonas boscosas de Brasil. Como su papel como depredadores de oros moluscos. Mueren muy rápido en cautiverio por falta o exceso de humedad y alimentación adecuada. La familia es de distribución neotropical. Se encuentra en Centroamérica y Sudamérica, donde posiblemente esta su origen. Son abundantes en países como Perú, Colombia Brasil, Chile y Argentina. Se han encontrado ejemplares en Pichincha fundamentalmente y en Napo y varias partes del Ecuador. Fuente: Correoso. M, 2008. 48 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Especie Animalia Mollusca Gastrópoda Achatinoidea Subulinidae Obeliscus cuneus Obeliscus cuneus riparius (Pfeiffer,1852) Características Conchas turrituladas (forma de torre u obelisco). Generalmente tamaño muy pequeño, menor a 1 cm, y especies de tamaño mediano de hasta 7 cm. Suelen tener muchas espiras, generalmente ocho. Color córneo o pajizo en la mayoría de los casos, que pueden presentar líneas espirales de color claro hasta blanco. Hábitat y sustrato Vive en el suelo, en zonas bajas de sabanas, potreros, campos con abundante materia orgánica y suelos ácidos. De forma general muy pocos géneros se encuentran en zonas boscosas. Importancia Son herbívoros, micófagos y detritívoros, además de formar parte importante ecológica y de la biomasa de invertebrados del suelo. Por ser tan dependientes del sustrato científica y de las sales del suelo son buenos indicadores del suelo ácidos. Datos de interés Tienen cierto parecido por la concha alargada con los urocoptidos, pero raras excepciones (Rumina sp), estos presentan ápice o protoconcha, siempre. Experiencia en De forma general se crían bien en cautiverio, con abundante suelo y hojarasca. Las especies de Obeliscus se reproducen en cautiverio fácilmente con un cautiverio crecimiento bastante rápido. Por el día son fáciles de observar, aunque su actividad es básicamente nocturna. Poseen escasa capacidad de trepar, salvo cuando se inunda el terreno. Distribución La distribución es mundial, en América se distribuyen en los trópicos y geográfica fundamentalmente las Antillas. Existen varias especies sudamericanas de Perú y Brasil. Es una familia con medias y altas densidades poblacionales en las localidades donde se encuentran. Predominan en los jardines, sobre todo las ciudades del oriente ecuatoriano. Localidades Esmeraldas, Los Ríos, Manabí, Napo, Pichincha, Sucumbíos, y Guayaquil en Guayas. Fuente: Correoso. M, 2008. 49 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Especie Características Animalia Mollusca Gastrópoda Helicinoidea Helicinidae Helicina Helicina rhynchostoma (Pfeiffer,1865) Son de tamaño pequeño, mayormente de concha helicoidal muy sólida, pulida y brillante, en muchos casos con colores pálidos y algo transparentes. Con formas que oscilan entre cónicas, globosa a deprimida. Pueden tener pocas vueltas espirales, desde cuatro hasta seis. Las especies de estos moluscos tienen formas de conchas muy variadas, desde especies de forma delicada y tamaño pequeño de bosques húmedos, hojarasca paredones, hasta forma curiosa de algunas especies endémicas del Caribe y Asia, y otras de tamaños medianos y formas menos llamativas como las encontradas en Ecuador. Hábitat y sustrato Sobre tierra, hojarasca, hierbas, arbustos o adheridos a piedras o paredones rocosos. En Ecuador los hemos colectado pegados a troncos de árboles sobre líquenes y musgos de bosques de neblina. Intervienen en las cadenas alimentarias de bosques húmedos. Importancia ecológica y científica Datos de interés Se considera la familia más primitiva de los moluscos terrestres. Soportan muy poco la desecación por ser prosobranquios, lo que corresponde con su hábitat restringido a zonas muy húmedas y boscosas de las estribaciones de los Andes. Experiencia en No se ha podido mantener en cautiverio por más de cuatro semanas, pudiera cautiverio deberse a las condiciones de su microhábitat o a problemas específicos de su nutrición. Distribución Son un grupo de gran distribución, ya que están en América, el Caribe, este de geográfica Asia, Australia, Madagascar, pero muy raros en el Ecuador, por la poca presencia en colecciones y reportes para el país. Fuente: Correoso. M, 2008. 50 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Características Animalia Mollusca Gastrópoda Achatinoidea Subulinidae Leptinaria sp1 Conchas turrituladas (forma de torre u obelisco). Generalmente tamaño muy pequeño, menor a 1 cm, y especies de tamaño mediano de hasta 7 cm. Suelen tener muchas espiras, generalmente ocho. Color córneo o pajizo en la mayoría de los casos, que pueden presentar líneas espirales de color claro hasta blanco. Hábitat y Vive en el suelo, en zonas bajas de sabanas, potreros, campos con abundante sustrato materia orgánica y suelos ácidos. De forma general muy pocos géneros se encuentran en zonas boscosas. Importancia Son herbívoros, micófagos y detritívoros, además de formar parte importante de la ecológica y biomasa de invertebrados del suelo. Por ser tan dependientes del sustrato y de las científica sales del suelo son buenos indicadores del suelo ácidos. Datos de Tienen cierto parecido por la concha alargada con los urocoptidos, pero raras excepciones (Rumina sp), estos presentan ápice o protoconcha, siempre. interés Experiencia en De forma general se crían bien en cautiverio, con abundante suelo y hojarasca. Las especies de Obeliscus se reproducen en cautiverio fácilmente con un crecimiento cautiverio bastante rápido. Por el dia son fáciles de observar, aunque su actividad es básicamente nocturna. Poseen escasa capacidad de trepar, salvo cuando se inunda el terreno. Distribución La distribución es mundial, en América se distribuyen en los trópicos y geográfica fundamentalmente las Antillas. Existen varias especies sudamericanas de Perú y Brasil. Es una familia con medias y altas densidades poblacionales en las localidades donde se encuentran. Predominan en los jardines, sobre todo las ciudades del oriente ecuatoriano. Localidades Esmeraldas, Los Ríos, Manabí, Napo, Pichincha, Sucumbíos, y Guayaquil en Guayas. Fuente: Correoso. M, 2008. 51 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Características Animalia Mollusca Gastrópoda Achatinoidea Subulinidae Opeas sp1 Conchas turrituladas (forma de torre u obelisco). Generalmente tamaño muy pequeño, menor a 1 cm, y especies de tamaño mediano de hasta 7 cm. Suelen tener muchas espiras, generalmente ocho. Color córneo o pajizo en la mayoría de los casos, que pueden presentar líneas espirales de color claro hasta blanco. Hábitat y sustrato Vive en el suelo, en zonas bajas de sabanas, potreros, campos con abundante materia orgánica y suelos ácidos. De forma general muy pocos géneros se encuentran en zonas boscosas. Importancia Son herbívoros, micófagos y detritívoros, además de formar parte importante ecológica y de la biomasa de invertebrados del suelo. Por ser tan dependientes del sustrato científica: y de las sales del suelo son buenos indicadores del suelo ácidos. Datos de interés Tienen cierto parecido por la concha alargada con los urocoptidos, pero raras excepciones (Rumina sp), estos presentan ápice o protoconcha, siempre. Experiencia en De forma general se crían bien en cautiverio, con abundante suelo y hojarasca. Las especies de Obeliscus se reproducen en cautiverio fácilmente con un cautiverio crecimiento bastante rápido. Por el día son fáciles de observar, aunque su actividad es básicamente nocturna. Poseen escasa capacidad de trepar, salvo cuando se inunda el terreno. Distribución La distribución es mundial, en América se distribuyen en los trópicos y geográfica fundamentalmente las Antillas. Existen varias especies sudamericanas de Perú y Brasil. Es una familia con medias y altas densidades poblacionales en las localidades donde se encuentran. Predominan en los jardines, sobre todo las ciudades del oriente ecuatoriano. Localidades Esmeraldas, Los Ríos, Manabí, Napo, Pichincha, Sucumbíos, y Guayaquil en Guayas. Fuente: Correoso. M, 2008. 52 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Especie Características Animalia Mollusca Gastrópoda Testacelloidea Spiraxidae Euglandina Euglandina striata (Müller, 1774) Concha de forma muy variada, heliciforme, pupiforme, ovoide a cónica. Umbilicada, lisa o con costillas; ápice obtuso o poco saliente, abertura fina con dientes y laminillas o sin ellas. Conchas de pequeñas a medianas, algo deprimidas, ligeramente transparentes, brillantes, con bastantes vueltas y bastantes convexas. Abertura grande con peristoma simple. Sus huevos son usualmente anchos y se empollan dentro del oviducto, por lo que las crías salen preformadas. Hábitat y Son mayormente nocturnos y se conoce poco sus hábitos, hábitat y sustrato, sustrato aunque algunos son terrestres y otros viven en microhábitats de hojas y de musgos. Datos de interés La mayoría de especies son carnívoros muy voraces, sobre otros moluscos, por lo que constituyen plagas cuando se introducen en otras áreas, y devoran a especies nativas o endémicas. Importancia El comportamiento alimenticio de estos caracoles depredadores de otros ecológica y moluscos ha sido estudiado por su potencialidad para controlar plagas de científica caracoles y babosas. Son utilizados como controladores biológicos de acuerdo a la especie de que se trate. Experiencia en El Ecuador ninguna, solo se ha colectado pocos ejemplares de conchas cautiverio desgastadas. Distribución Son casi todas tropicales de Sudamérica, África y sudeste de Asia y América geográfica tropical, mayormente. Localidades Santo Domingo de los Colorados, provincia de Pichincha, y se reportó en Sayausi, provincia de Azuay. Por ser depredadores de molusco, se piensa que no son numerosos en localidades existentes. Fuente: Correoso. M, 2008. 53 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Especie Características Hábitat y sustrato Datos de interés Importancia ecológica y científica Experiencia en cautiverio Distribución geográfica Localidades Animalia Mollusca Gastrópoda Rhytidoidea Scolodontidae Happia Cf H.guayaquilensis (Pf,1852) Caracoles terrestres con conchas achatadas y transparentes o translucidas. Las formas oscilan entre helicoidal o discoidal. Peristoma simple o emarginado. En Ecuador, conchas muy pequeñas. Habitan ambientes húmedos, como el suelo de los bosques y zonas tropicales. Se reportan algunos caracoles carnívoros de esta familia algo comunes en zonas boscosas de Brasil. Como su papel como depredadores de oros moluscos. Mueren muy rápido en cautiverio por falta o exceso de humedad y alimentación adecuada. La familia es de distribución neotropical. Se encuentra en Centroamérica y Sudamérica, donde posiblemente esta su origen. Son abundantes en países como Perú, Colombia Brasil, Chile y Argentina. Se han encontrado ejemplares en Pichincha, fundamentalmente, y en Napo y varias partes del Ecuador. Fuente: Correoso. M, 2008. 54 Elaboración: Autora Reino Filo Clase Superfamilia Familia Características Animalia Mollusca Gastrópoda Streptaxoidea Streptaxidae Concha de forma muy variada, heliciforme, pupiforme, ovoide a cónica. Umbilicada, lisa o con costillas; ápice obtuso o poco saliente, abertura fina con dientes y laminillas o sin ellas. Conchas de pequeñas a medianas, algo deprimidas, ligeramente transparentes, brillantes, con bastantes vueltas y bastantes convexas. Abertura grande con peristoma simple. Sus huevos son usualmente anchos y se empollan dentro del oviducto, por lo que las crías salen preformadas. Hábitat y Son mayormente nocturnos y se conoce poco sus hábitos, hábitat y sustrato, sustrato aunque algunos son terrestres y otros viven en microhábitats de hojas y de musgos. Datos de La mayoría de especies son carnívoros muy voraces, sobre otros moluscos, por lo interés que constituyen plagas cuando se introducen en otras áreas, y devoran a especies nativas o endémicas. Importancia El comportamiento alimenticio de estos caracoles depredadores de otros ecológica y moluscos ha sido estudiado por su potencialidad para controlar plagas de científica caracoles y babosas. Son utilizados como controladores biológicos de acuerdo a la especie de que se trate. Experiencia en El Ecuador ninguna, solo se ha colectado pocos ejemplares de conchas cautiverio desgastadas. Distribución Son casi todas tropicales de Sudamérica, África y sudeste de Asia y América geográfica tropical, mayormente. Localidades Santo Domingo de los Colorados, provincia de Pichincha, y se reportó en Sayausi, provincia de Azuay. Por ser depredadores de molusco, se piensa que no son numerosos en localidades existentes. Fuente: Correoso. M, 2008. 55 Elaboración: Autora Reino Filo Clase Superfamilia Familia Género Características Hábitat y sustrato Datos de interés Importancia ecológica y científica Experiencia en cautiverio Distribución geográfica Localidades Animalia Mollusca Gastrópoda Gastrodontoidea Euconulidae Euconulus sp Familia con representantes que viven muy cerca del agua, además de especies, marcadas terrestremente. Conchas pequeñas, muy frágiles, finas espiras muy pequeñas, con la vuelta corporal grande. Colores córneos y manchitas pardas en algunas especies. Mayormente suelos y hierbas bajas, y en vegetación acuática emergente de las orillas de ríos y lagunas. Pueden encontrarse asociados a cultivos y a fuente de antropización. Pueden confundirse en las colecciones con acuáticos, de ahí se deriva que no se han reportado mucho en el país. Son Bioindicadores Soportan bien el cautiverio, en condiciones de pequeños terrarios. Distribución mundial. Son básicamente subtropicales y tropicales, aunque la familia es de distribución amplia por toda América. Son muy raros en Ecuador actualmente, según experiencia de campo y colecciones de museo. Santo Domingo de los Colorados entre las localidades más importantes. Fuente: Correoso. M, 2008. 56