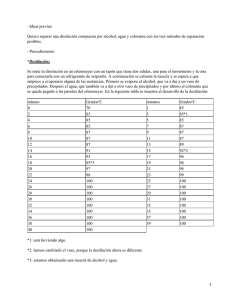
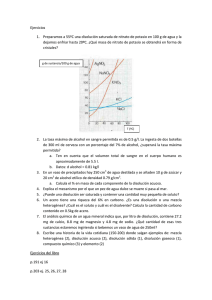
Descripción Prácticas Curso Secundaria
Anuncio

CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA CIENCIA RECREATIVA PARA ENSEÑANZA SECUNDARIA (EL HECHIZO DE LA CIENCIA EXPERIMENTAL) LA CIENCIA FÁCIL Mª Julia Arcos Martínez Universidad de Burgos. 10/02/2011 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ 2 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ Documentación: Experimentos de Química Clásica, The Royal Society of Chemistry, Ted Lister Ed. Sintesis, Madrid, 2008 Prácticas de Química basadas en procesos y productos cotidianos, Jose Antonio Pulgarín et al.. Lozano artes gráficas, S.L.,2008 Recursos de INTERNET http://www.jpimentel.com/ciencias_experimentales/pagwebciencias/PAGWEB/la_ciencia_a _tu_alcance_II/fisica/Exp_fis_romper_tension_superficial.htm http://www.google.es/search?q=como+hacer+funcionar+un+reloj+con+zumo&rls=com.mic rosoft:es-es&ie=UTF-8&oe=UTF-8&startIndex=&startPage=1&rlz=1I7GGLL_es http://fq-experimentos.blogspot.com/search/label/experimentos%20con%20huevo http://www.youtube.com/watch?v=6Dc-rU6O_CY&feature=related http://www.youtube.com/watch?v=W_UhffALE08&feature=related http://www.scribd.com/doc/6941561/100-experimentos-sencillos-de-fisica-y-quimica http://docs.google.com/viewer?a=v&q=cache:MEdL8U3GRLoJ:www.aeap.es/ficheros/3a5a 5eb3f6e557eb4d555802ebd1cd9d.pdf+cola+blanca+a+partir+de+caseina+de+la+leche&hl= es&gl=es&pid=bl&srcid=ADGEESilkVXDklba-E94tGo3uoR4EvHagqQ1iC_fl5gNN841o8XJrUeZZzJa9guYxdu0qzoc0roUn7OMDdqnZ9RKGJGNC3kNSgAkPLkdPpiREp6DkR7qyLSVOMhueLIx iEtasfoDVi&sig=AHIEtbSX6SZO0nx21V8hJCD1JXKhYjVjbQ 3 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ 4 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ GOTAS A LA FUGA Descripción En este experimento, la tensión superficial de la leche inicialmente sostiene las gotas de colorante. Materiales: • 1 vaso de leche • Colorantes alimentarios • Detergente líquido Método 1.- Llenar el plato con leche y dejar asentar hasta que la superficie sea completamente lisa. 2.- Con cuidado, depositar unas gotas de colorante o unas cerillas en el agua, en forma de estrella. 3.- Usando el cuentagotas, añadir una gota de detergente líquido a la leche en el centro del plato. Ésta romperá la tensión, y las gotas o cerillas saldrán impulsadas hacia el borde del plato. Teoría Al añadir el detergente a las gotas de colorante se rompe la piel flexible de la leche en los puntos donde cayeron las gotas de detergente. La tensión superficial es más fuerte en los extremos del plato y atrae la leche y los colorantes hacia fuera. 5 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ LA PIEL DEL AGUA Descripción Experiencias para poner en evidencia la tensión superficial Materiales • Agua en un vaso de vidrio • Un gotero • Jabón Método Tomar un vaso seco, llenar con agua casi hasta arriba. Con el gotero añadir tantas gotitas como se pueda, sin que se derrame. Verás que el agua llegará más arriba del borde (aprox. 0,25 cms.) y esto se debe a la tensión del agua que mantiene las moléculas unidas. A esto le llamamos la "piel" del agua. Teoría Por supuesto, el agua no tiene "piel" de verdad, pero tiene una tensión superficial, como se observa en este experimento. Flotar diferentes objetos sobre esta piel. 6 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ PECECILLO FLOTADOR Descripción Un pequeño pececillo de cartón flotará en el agua. Sin embargo, se moverá al poner otro líquido en el agua Materiales: • Una cartulina o cartón delgado de 6 X 12 cm. • Lápiz y regla • Tijeras • Una palangana con agua • Aceite de bisagras. Método Recortar una figura de pececillo con un canal central quede recto, así como el orificio central bien definido. Con mucho cuidado, poner el pececillo sobre el agua, de manera que quede flotando en ella. Añadir una gota de aceite en el orificio central del pez. Resultado: El aceite tiende a expandirse por el agua, por lo que sale inmediatamente por el canal, y el pececillo ¡sale disparado hacia adelante! Teoría Algunos objetos pueden flotar sobre el agua, a pesar de que son más densos que ella. Por ejemplo, el acero, o nuestro pez. Al añadir el aceite, y por ser éste menos denso que el agua, flota sobre ella, y se aplana en su superficie. Encerrado el aceite en el orificio del pececillo, éste se escapa hacia afuera del canal, sirviendo de impulso a chorro para moverlo por el agua. 7 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ BARCO NAVEGANDO Descripción Un papel de aluminio puede navegar en el agua. Sin embargo, se moverá al poner otro líquido en el agua. Materiales: • Una papel de aluminio • Lápiz y regla • Tijeras • Una bolita de alcanfor • Un palillo. Método 1.- Forma una base plana con forma de flecha con el papel aluminio o el plástico, para simular un barquito. 2.- Recorta y un triángulo de papel en color para formar la vela. 3.- Pega el palillo sobre la hoja de papel aluminio para formar el mástil. 4.- Coloca la bolita de alcanfor en la parte posterior del barquito (en la base de la flecha). 5.- Coloque el barquito sobre la superficie del agua del recipiente y observarás el movimiento del mismo. 8 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL ACUEDUCTO Tema Tensión superficial, interés general. Descripción Valorar la tensión superficial frente a la fuerza de la gravedad. Material y Reactivos • 1 recipiente • Agua • 1 varilla larga • Soporte y pinzas Método 1. Dejar caer agua a través del embudo por la varilla de cristal 2. Observar cómo el agua resbala por la parte inferior de la varilla, mientras la parte superior permanece seca, hasta alcanzar el cristalizador. . Teoría La tensión superficial del agua hace que las moléculas se adhieran al vidrio, venciendo así la fuerza de gravedad que las haría caer al suelo. 9 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ EL JABÓN TIENE PODERES MÁGICOS – MEZCLANDO ACEITE Y AGUA Tema Tensión superficial, interés general. Descripción Estudiar las propiedades surfactantes del jabón. Material y Reactivos • Dos vasos • Agua • Colorante alimentario o tinta • Aceite • Jabón o detergente líquidos Método 3. Llenar los vasos con agua hasta la mitad. 4. Añadir un poco de colorante o tinte en los vasos, mezclar con la cuchara. Esperar unos minutos hasta que el agua esté en calma. 5. Añadir una cucharada de aceite en cada uno de los vasos y observar lo que pasa. 6. Añadir 1-2 gotas de jabón en uno de los vasos, mezclar con la cuchara. 7. ¿Qué crees que pasará? Observar cuidadosamente y dibujar lo que se observa. Teoría El agua y el aceite normalmente no se mezclan bien. La razón es que las moléculas de agua pueden formar puentes de hidrógeno entre sí y con moléculas hidrofílicas (“amigas del agua”), pero no con las hidrofóbicas (“enemigas del agua”) como las del aceite. Además, el aceite es más liviano y tiene una menor densidad, por lo que si se intenta mezclarlos, la capa de aceite permanecerá sobre la de agua. Si se añade jabón y se remueve durante unos minutos, al aceite y el agua pueden ser mezclados. Si se espera lo suficiente el aceite y el agua se separarán. ¿Por qué? El jabón contiene ingredientes especiales llamados surfactantes, que reducen la tensión superficial del agua y facilitan que el aceite y el agua se mezclen. Esto convierte al jabón en un magnífico agente limpiador: no solo las manchas solubles en agua, sino, además, las manchas de aceite pueden disolverse en el agua. Las moléculas surfactantes tienen dos terminaciones diferentes, como se muestra en el diagrama (izquierda). Un extremo (la cabeza) es hidrofílica, el otro extremo (la cola) es hidrofóbica. El jabón contiene muchas moléculas surfactantes, y cada una se engancha por un lado al agua y por el otro al aceite, que es lo que hace que el agua y el aceite se mezclen, y también a las manchas de aceite. Al cabo de un rato, el aceite y el agua se separan de nuevo, porque las uniones entre las moléculas de agua son más estables que las que se dan entre las moléculas de surfactantes y las de aceite o agua. 10 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ BURBUJAS RESISTENTES Descripción Formación de burbujas con jabón Materiales: • • • • • Papel Detergente líquido Agua destilada Glicerina Pajillas Método Tomar unos 6 vasos de agua destilada. Si no se dispone de agua destilada, colocar el agua en un contenedor abierto durante la noche, para que pierda los gases que ha atrapado en su traslado y potabilización. Utilizar 6 vasos de agua, por 1 de detergente y 1 de glicerina. Mezclar bien, dejar reposar una hora. Utilizar las manos, pajillas y otros elementos con huecos para hacer burbujas. Mojar la superficie de una mesa y construya una ciudad de burbujas. Mojar la pajilla totalmente con la fórmula. Observar cómo puede traspasar la burbuja sin reventarla y soplar burbujas dentro de otras. 11 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ COLORES A LA CARTA Descripción Dar el color que nos apetezca a los pétalos de algunas flores Materiales: • Matraces erlenmeyer • Flores (claveles y narcisos) • Tintas de diversos colores Método Se preparan primero los colorantes que deseemos a partir de tintas y de sus mezclas (interesa que las tintas utilizadas sean solubles en el agua). Se vierte cada tinte preparado en un erlenmeyer y se introduce cada flor a colorear, cortándoles a cada una el tallo de forma oblicua para que la absorción del líquido sea más rápida. El resultado obtenido es... Poco a poco los pétalos irán adoptando el color del tinte elegido. Teoría Lo que tiene lugar es un proceso de transporte de líquido por efecto de la capilaridad de los vasos vegetales. 12 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ UN BILLETE DE 5 € QUE NO ARDE Tema Combustión, pero ésta es, esencialmente, una demostración divertida. Descripción Un pedazo de papel o un billete de 5 euros (o cualquier otro de curso legal) se empapa en una mezcla de etanol y agua. El alcohol se quema pero el papel no. Material • Un mechero Bunsen. • Un par de tenazas. • Una superficie refractaria resistente al calor. • Tres vasos de precipitados de 250 cm3. Reactivos Las cantidades dadas son para realizar una demostración. • 75 cm3 de etanol. • Unos gramos de cloruro de sodio (sal común). Método Prepare unos pedazos de papel del tamaño aproximado de un billete de 5 euros. Prepare tres vasos de precipitados: uno conteniendo unos 50 cm3 de agua; el segundo conteniendo 50 cm3 de etanol; y el tercero conteniendo una mezcla de 25 cm3 de agua mezclada con 25 cm3 de etanol y con un poco de cloruro de sodio disuelto en la mezcla. Empape un pedazo de papel en agua e intente encenderlo, sujetándolo con las tenazas, en la llama amarilla del mechero Bunsen. No arderá. Empape un segundo pedazo en etanol. Éste arderá fácilmente. El alcohol se quemará y encenderá el papel que se quemará. Empape un tercer pedazo en la mezcla de alcohol y agua y sosténgalo en la llama del mechero Bunsen. En este tiempo el alcohol arderá y se quemará, pero el papel no. La llama del alcohol puro es fácilmente visible, pero la de la mezcla alcohol y agua es casi invisible. La sal se añade para dar color a la llama y para que pueda verse. Algunos profesores pueden desear explicar esto a los alumnos, otros prefieren no menciónalo. Por otra parte la presencia de una llama incolora puede mostrarse encendiendo una cerilla con ella. La demostración parecerá más impresionante con una iluminación tenue. Teoría El agua en la mezcla de alcohol y agua se evapora y deja la temperatura por debajo de la temperatura de ignición del papel (aproximadamente 230 ºC. El papel estará todavía mojado con agua después de que el alcohol se haya quemado. El cloruro de sodio da a la llama un color anaranjado característico del sodio, que se parece a la clásica amarilla Se pueden probar proporciones diferentes de agua y alcohol así como otros alcoholes. 13 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ HERVIR AGUA EN UN VASO DE PAPEL Tema Puntos de ebullición. Descripción Cuando el agua se calienta comienza a evaporarse rápidamente hasta llegar a un punto donde se inicia la ebullición. Material y Reactivos Vasos de papel o globos de caucho Método Colocar el vaso de papel dentro de un aro unido a un soporte Adicionar agua al vaso Calentar suavemente el vaso con su contenido empleando una vela o un mechero con la llama adecuada y teniendo la precaución de no quemarse Continuar el calentamiento. ¿Se puede lograr que el agua hierva? Remover la fuente de calentamiento y permitir que el agua se enfríe La llama no debe ser muy intensa para que el calor tenga el tiempo suficiente para ser absorbido por el sistema sin que se rebase el punto de ebullición del agua. Teoría El agua absorbe la energía calorífica antes que el papel, y la temperatura del vaso no aumenta por encima de la temperatura del agua. El agua es un líquido con una gran capacidad de absorber calor antes que ella misma se caliente, gracias a la estructura y ordenamiento de sus moléculas. Las moléculas de agua en los estados sólido y líquido están unidas por enlaces de hidrógeno y por ello gran cantidad de la energía calórica se gasta en romper dichos enlaces; ¿Por qué el agua es el líquido ideal para apagar incendios? Si se calienta agua en un vaso de vidrio, ¿por qué el vidrio se vuelve más caliente que el agua mientras que el papel no? El agua es un buen agente extintor porque es incombustible, no puede arder. Cuando se la acerca al fuego absorbe rápidamente el calor que éste desprende, la energía cinética de sus moléculas aumenta y se mueven cada vez más rápido distanciándose unas de otras, de tal manera que se transforma en un gas llamado vapor de agua: ha pasado del estado líquido al estado gaseoso. En este proceso absorbe gran cantidad de calor y, en consecuencia, disminuye la temperatura del fuego, lo enfría; evitando así la reacción entre el combustible y el oxígeno. 14 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ UN HIELO QUE NO SE FUNDE EN AGUA HIRVIENDO Tema Cambios de estado Descripción Cuando el agua se calienta comienza a evaporarse rápidamente hasta llegar a un punto donde se inicia la ebullición. Materiales y Reactivos 1 tubo largo y grande (puede utilizarse una probeta) 1 cubo de hielo Método Tomar una probeta llena de agua y echar en ella un trocito de hielo. Para evitar que el hielo flote, poner encima una bola de plomo, una pesita de cobre u otro objeto análogo, pero procurando que el agua tenga libre acceso al hielo. Acercar ahora la probeta a un mechero de alcohol, de tal forma, que la llama toque solamente la parte superior del tubo. El agua no tardará en hervir y comenzará a desprender vapor. Pero, he aquí un hecho extraño: el hielo que hay en el fondo de la probeta... ¡no se funde! Parece que ante nuestros ojos se realiza un prodigio: ¡Un hielo que no se derrite en agua hirviendo! Teoría La explicación se reduce a que, en el fondo de la probeta el agua, no sólo no hierve, sino que permanece fría. Hierve exclusivamente el agua que está arriba. Lo que tenemos no es, pues, «hielo en agua hirviendo», sino «hielo debajo de agua hirviendo». El agua cuando se calienta, se dilata y se hace más ligera, por lo cual, no baja hacia el fondo, sino que se queda en la parte superior de la probeta. Las corrientes de agua y la remoción de las capas líquidas sólo se producen en la parte alta de la probeta, sin que sean afectadas las capas bajas más densas. El calentamiento puede trasmitiese hacia abajo por conductividad térmica, pero la conductividad térmica del agua es muy pequeña. Cuando queremos calentar agua, colocamos la vasija que la contiene encima del fuego y no junto a él. Esta manera de proceder es justa, ya que el aire calentado por las llamas se hace más ligero y al ser desplazado hacia arriba envuelve por todos lados nuestra vasija. Por lo tanto, para aprovechar lo mejor posible el calor de un foco cualquiera, hay que colocar sobre las llamas el cuerpo que se calienta. Pero, ¿qué hacer si queremos enfriar un cuerpo cualquiera con hielo? Muchos, por costumbre, ponen el cuerpo encima del hielo; ponen, por ejemplo, la jarra de la leche sobre el hielo. Esto no es lo más conveniente, porque el aire que hay sobre el hielo desciende al enfriarse y es sustituido por el aire caliente que lo rodea. De aquí se puede hacer una deducción práctica: si queremos enfriar una bebida o alimento deberemos ponerlos, no sobre el hielo, sino debajo de él. Si se coloca una vasija con agua sobre el hielo, se enfría únicamente la capa inferior del líquido, ya que la parte restante estará rodeada de aire no enfriado. Por el contrario, si colocamos un trozo de hielo encima de la tapadera de una vasija, el enfriamiento de su contenido será más rápido. En este caso, las capas superiores de líquido enfriado, descenderán para ocupar el sitio de las inferiores más calientes, las cuales se elevarán renovándose constantemente, hasta que se enfríe todo el líquido. Por otra parte, el aire frío que rodea al hielo, también descenderá envolviendo a la vasija. 15 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ FUEGOS ARTIFICIALES Tema Combustión, pero ésta es, esencialmente, una demostración divertida. Descripción Limaduras de metales provocan pequeñas explosiones Material • Una vela • Un par de tenazas. • Limaduras de hierro Método Si encendemos la vela y dejamos caer limaduras de hierro directamente sobre la llama vemos unas chispas que salen de la llama en todas direcciones. Teoría El hierro en forma de limaduras presenta una superficie de contacto con el aire muy grande y puede arder si suministramos el calor suficiente. La llama de la vela, por ejemplo, proporcionará la energía inicial que desencadenará la reacción de combustión entre el hierro y el oxígeno del aire. En la fabricación de fuegos artificiales se emplean ciertos metales que, al quemarse, producen chispas de diferentes colores. Al dejar caer limaduras de hierro sobre la llama de la vela el metal alcanza temperaturas muy altas (del orden de los 1500 ºC), reacciona con el oxígeno del aire y produce la emisión de chispas. En los fuegos artificiales se emplean metales en forma de óxidos y sales para obtener colores muy brillantes 16 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ FUEGO VERDE Descripción Conseguir que un material arda... al añadirle agua Materiales: • Mortero y espátula • Tapa de hojalata • Cuentagotas • Cinc en polvo • Nitrato amónico • Cloruro amónico • Nitrato de bario • Agua destilada Método En primer lugar prepararemos en el mortero –ayudándonos de la espátula- una mezcla formada por el cinc, el cloruro y los dos nitratos. Cuando ya tengamos preparada esa mezcla, se toma una porción de ella con la espátula y se deposita en la tapa de hojalata dándole la forma de una pequeña montaña. A continuación –y separándonos prudentemente- se añaden unas gotas de agua destilada, se retira el brazo y.... Una bonita –aunque inofensiva, si se utilizan pequeñas cantidades- llamarada verde surgirá de la mezcla al explosionar ésta al contactar con el agua. Teoría El agua lo único que ha producido es el medio acuoso necesario para que las sustancias de la mezcla puedan reaccionar químicamente. Lo hacen y lo hacen violentamente al tratarse de una fuerte reacción de oxidación del cinc por parte de los nitratos de bario y amónico. Estos nitratos se caracterizan por su facilidad para descomponerse y provocar reacciones rápidas de oxidación Todas las precauciones son pocas cuando “jugamos” con el fuego. Es recomendable realizar la experiencia en una campana de gases. Una experiencia similar a ésta es la que puede hacerse con ayuda de glicerina: echando unas gotas de este líquido en una tapa de hojalata, se producirá un fuego de color violeta tras espolvorearlo con una pizca de permanganato potásico. 17 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ EXTINTOR CASERO Tema Combustión, reacciones químicas Descripción El CO2 que se produce en una reacción casera de bicarbonato con vinagre puede servir para apagar una pequeña llama. Materiales: • Bicarbonato de sodio colocado en una servilleta de papel • Un tapón de corcho perforado o plastilina • Una pajilla para beber • Una botella para agua pequeña (seca) • Vinagre • Un poco de hilo de coser Método Ponga 4 cucharaditas de bicarbonato en la servilleta, cierre y amarre con un hilo en forma de bolsita (tiene que quedar bien sujeto). Introduzca 5 cucharadas de vinagre en la botella. Suspenda la bolsita de bicarbonato dentro de la botella de forma que cuelgue (con una parte del hilo fuera) y no toque el vinagre. Tome el corcho o plastilina y coloque la pajilla en la boca de la botella. Funcionamiento: Agite la botella, tapando con el dedo la pajilla y sujetando la botella al mismo tiempo, para mezclar el bicarbonato con el vinagre (sin destapar la pajilla). Quite el dedo y proyecte el gas que sale de la botella sobre una vela encendida. Teoría La reacción química entre el bicarbonato (una base) y el vinagre (ácido débil) forma dióxido de carbono que llena el recipiente y sale por la pajilla. Como es más pesado que el aire, al enfrentar la vela encendida expulsa el oxígeno. Sin oxígeno la llama se apaga. 18 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL EFECTO DE LA PRESIÓN ATMOSFÉRICA Tema Combustión, reacciones químicas Descripción La falta de O2 provoca que la llama se apague. Materiales: • Una velita • Una botella de vidrio de cuello ancho • Un plato hondo con agua Método Poner suficiente agua en el plato hondo. Colocar la velita sobre el agua. Encender la velita con cuidado. Cuando la llama se vea estable, cúbrala con la botella boca abajo. ¿Qué está pasando? La candela seguirá encendida por unos segundos, porque tiene poca disponibilidad de oxígeno, atrapado en el aire dentro de la botella. Ese gas es necesario para la combustión, la cual produce otros gases. Teoría Simultáneamente, la vela encendida calienta el gas atrapado a una temperatura cercana a los 800°C, lo que provoca que el gas se expanda. Al apagarse la vela por falta de oxígeno, la temperatura baja rápidamente y el volumen de gases y la presión de los mismos se reduce, esto provoca que la presión atmosférica externa empuje el agua del plato y esta suba de nivel hasta que se igualen las presiones. 19 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ DENSIDAD DE LIMONES Descripción Estudiar efectos curiosos provocados por cambios en la densidad. Materiales: Vaso de precipitados 1 Limón Método Llenar el recipiente de cristal con agua. Sumergir el limón entero en el agua. Observar que el limón flota. Ahora, añadir el limón pelado al agua. Observar que ahora el limón se hunde. Teoría Sobre el limón actúan dos fuerzas, su peso (la fuerza con que lo atrae la Tierra) y el empuje (la fuerza que hace hacia arriba el agua). Cualquier sustancia más densa que el agua se hundirá porque el peso es mayor que el empuje. Si el empuje es mayor que el peso, en este caso, flotará y si son iguales, queda entre dos aguas. El empuje que sufre un cuerpo en un líquido equivalente al peso del líquido desalojado, depende de tres factores: la densidad del líquido en que está sumergido, el volumen del cuerpo que se encuentra sumergido y la gravedad. El limón entero flota porque en la piel tiene zonas huecas llenas de aire. Su densidad es, pues, inferior a la del agua. Pero si eliminamos la piel, el volumen disminuye y su densidad aumenta, por lo que el limón pelado se hunde. 20 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ LA DENSIDAD DEL HIELO Tema Agua, enlaces de hidrógeno y también interesante ejercicio de técnicas de observación. Nivel de segundo ciclo de enseñanza secundaria, o alumnos de Bachillerato como trabajo de introducción a los enlaces de hidrógeno y a la estructura del hielo. Descripción Los cubitos de hielo flotan en aceite de cocina, pero cuando se derriten, el agua que producen se va al fondo. Material • Una probeta de 1 dm3. Reactivos Las cantidades dadas son para una demostración. • Agua • Unos cubitos de hielo. Pueden prepararse añadiéndoles un poco de colorante alimenticio (el azul es bueno) para que el efecto se vea mejor. • 400 cm3 de aceite vegetal puro. Método Preparar los cubitos de hielo con unas gotas de colorante alimenticio por cubito. Asegurar que están completamente congelados. En ocasiones, los cubitos congelados pueden tener agua líquida atrapada en su interior lo que afectará a su densidad. Comprobar que los cubitos de hielo realmente flotan sobre el aceite utilizado. Colocar unos 400 cm3 de agua y 400cm3 de aceite en una probeta. Deje que las dos capas se separen completamente; el aceite quedará arriba. Eche un cubito de hielo en la probeta. Flotará (exactamente) encima del aceite. Observe el cubito. Mientras se derrite, el agua que se forma crea gotitas pegadas al cubito. Al final éstas se separan del cubito y se hunden, juntándose con el agua de la capa de abajo. Esto ilustra la anormalmente elevada densidad del agua comparada con la del hielo. Se pueden realizar otras observaciones interesantes: • Después de que la mayoría del cubito se haya derretido el peso de las gotas de agua es suficiente para arrastrar el cubito de hielo hacia abajo con ellas, esto es, la densidad media del cubito y de la gota es mayor que la del aceite. A veces, mientras el cubito y las gotas están hundiéndose, las gotas se separan del cubito retrocediendo este último hacia la superficie. • De vez en cuando, se desprenden pequeñas gotitas de la principal observándose el efecto de una “cadena de perlas”. • Las gotitas de agua pueden distribuirse durante algún tiempo en la interfaz agua-aceite sin coalescer con el conjunto de agua. • Cuando las gotitas de agua coloreada empiezan a coalescer con el agua, se puede ver cómo el agua coloreada se hunde mientras se mezcla, a causa de su mayor densidad. • Hay interesantes cambios de forma en las gotitas de agua mientras se forman, se separan del cubito y mientras se hunden. Teoría La densidad del hielo es aproximadamente 0,92 g.cm-3, mientras que la del agua es aproximadamente 1,00 g·cm-3 a 0º C. El aceite de cocina tiene una densidad comprendida entre 21 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ estos dos valores y por tanto el hielo flota en el aceite mientras que el agua se hundirá. La mayor parte de los sólidos son más densos que los líquidos. La baja densidad del hielo se debe a su estructura, la red tetraédrica de enlaces de hidrógeno es parecida a la del diamante. Figuras tomadas de 22 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ DENSIDAD DE HUEVOS Descripción Estudiar efectos curiosos provocados por cambios en la densidad. Materiales: Vaso de precipitados Huevos Sal común Método 1.- Preparar una disolución de sal (70 g) en agua (400 ml). 2.- Colocar el huevo en el vaso que tiene solo agua: se irá al fondo. 3.- Echar parte de la disolución preparada anteriormente en un vaso y añadir el huevo observarás como queda flotando. 4.- En el tercer vaso poner un poco de agua y añadir el huevo que se hundirá. Añadir agua con sal preparada, hasta conseguir que el huevo quede entre dos aguas (ni flota ni se hunde). 5.- Si se añade en este momento un poco de agua, observarás que se hunde. Si a continuación se añade un poco del agua salada, flotará de nuevo. Si vuelves añadir agua, otra vez se hundirá y así sucesivamente. Teoría El agua salada tiene diferente densidad que el agua pura por eso es más fácil la flotación en dicho medio. 23 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ EL ARCO IRIS Descripción La densidad es una propiedad característica de cada sustancia y se define como la cantidad de masa en un volumen determinado. En términos sencillos, un objeto pequeño y pesado, como una piedra o un trozo de plomo, es más denso que un objeto grande y liviano, como un corcho o un poco de espuma. Los objetos sólidos y líquidos menos densos que el agua flotan en ella siempre que no se mezclen. Un líquido menos denso flotará encima de otro más denso. Vamos a comprobar entonces que los líquidos de distintas densidades flotan uno encima de otro formando capas que no se mezclan entre sí. Material y Reactivos Glicerina Alcohol Aceite Miel . Método 1.- Empezar por el líquido más denso, la miel, vertiéndolo en el fondo del vaso. 2.- Después añadir la glicerina, dejando caer poco a poco dentro del vaso para que no se alteren las capas. 3.- Cuando esta capa se haya aposentado, añadir con cuidado el agua y después el aceite 4.- Finalmente dejar caer poco a poco el líquido más ligero, el alcohol de 90º 5.- Dejar caer distintos objetos y ver que pasa. Teoría Un líquido ligero (menos denso) flotará encima de otro más pesado (más denso). No hay más que comparar una sustancia que tenga moléculas grandes y compactas con una segunda de moléculas pequeñas y espaciadas. La primera sustancia tendrá una masa mayor por volumen y por eso será más densa que la segunda. Como resultado final obtenemos una serie de bandas o capas en el vaso. Cada líquido forma una capa porque es menos denso que el líquido inferior y más que el superior. Si ahora se introduce un pequeño objeto, como una chincheta o una bolita, se hundirán hasta que encuentran un líquido de mayor densidad que la suya. Densidad (kg/m3) Alcohol 96º Aceite Agua Glicerina Miel 810 870 a 970 1000 1260 1300 - 1400 24 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL ARCO IRIS DULCE Descripción La densidad es una propiedad característica de cada sustancia y se define como la cantidad de masa en un volumen determinado. En términos sencillos, un objeto pequeño y pesado, como una piedra o un trozo de plomo, es más denso que un objeto grande y liviano, como un corcho o un poco de espuma. Los objetos sólidos y líquidos menos densos que el agua flotan en ella siempre que no se mezclen. Un líquido menos denso flotará encima de otro más denso. Vamos a comprobar entonces que los líquidos de distintas densidades flotan uno encima de otro formando capas que no se mezclan entre si. Material y Reactivos • 5 vasos de 250 mL. • 1 vaso de 500 mL. • 150 g de azúcar. • 300 mL de agua. • Colorantes: amarillo, azul, rojo, verde, morado. . Método 1º.- Colocar en fila los vasos más pequeños. Añadir una cucharada de azúcar (15 g) en el primer vaso, 2 cucharadas (30 g) en el segundo, 3 cucharadas (45 g) en el tercero y 4 cucharadas (60 g) en el cuarto. El quinto vaso queda vacío. 2º.- Añadir 45 mL de agua en cada uno de los vasos y remover con la varilla de vidrio hasta que todo el azúcar quede disuelto. Si ves que no se disuelve añade 15 mL más de agua en cada uno de los vasos. 3º- Añadir 2-3 gotitas de colorante en cada uno de los vasos: rojo en el primer vaso, amarillo en el segundo, verde en el tercero, azul en el cuarto y morado en el quinto y vuelve a remover. 4º- Hacer el arco iris en el vaso más grande. Colocar el embudo dentro del vaso de esta manera: 5º- Verter en el vaso a través del embudo la disolución morada, luego la roja, la amarilla, la verde y por último la azul. Si te das cuenta empezamos añadiendo la disolución con menor contenido de azúcar y continuamos con las que tienen más contenido de azúcar. 6º-. Las disoluciones de mayor cantidad de azúcar se irán depositando en el fondo del vaso, mientras que las que tienen menor cantidad, flotarán sobre las demás. Teoría Un líquido ligero (menos denso) flotará encima de otro más pesado (más denso). No hay más que comparar una sustancia que tenga moléculas grandes y compactas con una segunda de moléculas pequeñas y espaciadas. La primera sustancia tendrá una masa mayor por volumen y por eso será más densa que la segunda. Como resultado final obtenemos una serie de bandas o capas en el vaso. Cada líquido forma una capa porque es menos denso que el líquido inferior y más que el superior. Si ahora introducimos un pequeño objeto, como una chincheta o una bolita, se hundirá hasta que encuentran un líquido de mayor densidad que la suya. 25 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ VINO Y AGUA Descripción Experiencia de densidad y flujo laminar. Reactivos 1 vaso de vino 1 vaso de agua 1 cartulina Método 1.- Llenar un vaso con agua y otro con vino hasta el borde. 2.- Cubrir el vaso de agua con la tarjeta, invertir el mismo con cuidado y colocarlo sobre el vaso de vino. Retirar un poco la tarjeta de modo que pase una fina vena de vino y se produce el trasvase. Si se retira demasiado la tarjeta el flujo se hace turbulento y se produce la mezcla. 4.- Observar lo que ocurre :Vino y agua empezando a intercambiándose Se debe elegir vino tinto en vez de vino blanco simplemente porque así se ve mejor lo que ocurre. La tarjeta se debe retirar lentamente y solo un poquito porque si se retira demasiado el flujo se hace turbulento y se produce la mezcla entre el agua y el vino. Teoría En el experimento intervienen dos hechos físicos, por un parte la diferencia de densidades entre el agua y el vino, que como es sabido es esencialmente una disolución de etanol en agua, por el principio de Arquímedes debe flotar, pero esta explicación no es suficiente puesto que como es bien sabido el vino se mezcla fácilmente con el agua. Es preciso recurrir a otro fenómeno este está relacionado con el flujo de los fluidos. Cuando un flujo fluye lo puede hacer de dos maneras, en una el flujo se desliza como si se tratara de láminas yuxtapuestas, esta especie de láminas o venas de corriente, deslizan sin mezclarse, se dice entonces que el flujo es laminar. Sin embargo en otras circunstancias las líneas de corriente se entremezclan, se dice que el flujo es turbulento. Precisamente el cambio de régimen laminar a turbulento fue estudiado por el físico británico Osborne Reynolds (1842-1912) quien observó que este paso dependía de la densidad, viscosidad y velocidad del líquido y del diámetro del tubo por el que circulaba, estableció un número adimensional, hoy conocido como número de Reynolds igual al producto de la velocidad del líquido por la densidad y por el diámetro del tubo dividido por la viscosidad del líquido. Cuando este número tiene valores pequeños (R<2400) el régimen es laminar, cuando toma valores grandes, entonces el régimen es turbulento. 26 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL BUZO CARTESIANO Tema Densidad, presión, interés general. Descripción Efecto de la presión sobre un cuerpo Material y Reactivos • • • 1 sobre de salsa de tomate de un restaurante 1 botella de 1 ó 2 litros de capacidad agua Método 1. Colocar el sobre de salsa de tomate en una taza de agua para determinar si flotar. Para este experimento, se necesita un paquete que flote apenas. 2. Tomar un paquete que apenas flote y ponerlo en la botella de plástico (puede que tengas que doblar el paquete para que ingrese por el pico de la botella). 3. Llenar la botella con el agua hasta el borde y enrosca firmemente la tapa. 4. Apretar los lados de la botella. Teoría El sobre de salsa de tomate contiene una pequeña burbuja de aire dentro de él. Cuando aprietas el exterior de la botella, aumenta la presión en el interior de la botella. Esto comprime el aire al interior del paquete, lo que cambia la densidad general de la bolsa. Cuando el aire se comprime lo suficiente, la densidad de la bolsa se vuelve mayor que la densidad del agua en la botella y el paquete se hundirá. Al soltar la presión sobre la parte exterior de la botella, el aire en el paquete se expande, flota y regresa a la superficie. 27 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ OSCILADOR SALINO Tema Observar las oscilaciones periódicas debidas al flujo de la solución salina hacia el agua pura y de ésta hacia la solución salina. Material y Reactivos Jeringa plástica de 60 o 100 cm3, con aguja larga Probeta grande o un recipiente cilíndrico (sirve la sección recta de un envase de gaseosa de 1.65 L) Soporte metálico Pinza para condensador, con nuez Soluciones de cloruro de sodio, NaCl 5.5 M y 3.5 M Descripción Preparar 200 mL de NaCl 5.5 M (disuelve 64.0 g de sal de cocina en agua y completar hasta un volumen de 200 mL) Preparar 200 mL de NaCl 3.5 M (disuelve 35.5 gramos de sal de cocina en agua y completar hasta un volumen de 200 mL) Llena hasta el borde la probeta o el recipiente con agua Posicionar la jeringa dentro del recipiente Llenar rápidamente la jeringa con la solución salina 5.5 M Repitir el procedimiento empleando la solución de NaCl 3.5 M Teoría Cuando una solución concentrada de cloruro de sodio dentro de una jeringa se pone en contacto con agua pura, la solución comienza a fluir hacia el agua y después de un periodo de tiempo el fenómeno se invierte, es decir empieza a fluir agua hacia la solución salina dentro de la jeringa. Estos ciclos se repiten periódicamente de una manera autorregulada y rítmica. Los sistemas oscilatorios son complejos y obedecen a situaciones alejadas del equilibrio. Aunque en el presente experimento el sistema es muy simple y sólo consta de dos componentes, su explicación no es tan sencilla ya que pertenece al campo de la termodinámica no lineal de los fenómenos caóticos. Una explicación sencilla es aquella en la que se considera que el sistema solución salina-agua inicialmente está muy lejos del equilibrio y para llegar a él se requiere que la solución concentrada de cloruro de sodio se mezcle íntimamente con el agua pura del recipiente. Este proceso se lleva a efecto de una manera autónoma, autoregulada y divertida a los ojos del experimentador, hasta que el movimiento llega a su final cuando el sistema logra su equilibrio y cesan las oscilaciones. 28 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EXTRACCIÓN DE HIERRO EN CEREALES DE DESAYUNO Tema Ciencia de los alimentos, metales de la transición, interés general. Descripción Se usa un agitador magnético para extraer algo del hierro que se añade a los cereales del desayuno. Material • Un vaso de precipitados de 1 dm3. • Un agitador magnético y su núcleo (el ideal es uno forrado de teflón blanco). • Pinzas. Reactivos • Cereales del desayuno que contienen hierro como los “Especial K”. Método Pese aproximadamente 50 g de cereal en un vaso de precipitados. Aplaste el cereal con un mortero de mano y añada unos 500 cm3 de agua. Agite la mezcla con un agitador magnético durante unos minutos. Quite el núcleo usando unas pinzas. Una pequeña pero evidente cantidad de hierro en polvo se pegará al núcleo. La cantidad de hierro depositada es pequeña por lo que será necesario pasar el núcleo por la clase, por ejemplo, en un pesa sustancias de plástico. Teoría Los fabricantes añaden hierro a algunos cereales, y a otros productos de alimentación como la harina, en forma de polvo finamente dividido. Éste se disolverá en un medio ácido del estómago antes de ser absorbido por el organismo. Se añade de esta forma porque no produce ningún sabor ni actúa químicamente con otros componentes del producto. Los paquetes “Especial K” dan 20 mg de hierro por cada 100 g de cereal. Los productos como los “cornflakes” (copos de maíz) que están enriquecidos a un nivel más bajo, tienen unos 6,7 mg de hierro por cada 100 g de cereal, mientras que los cereales de desayuno no enriquecidos en hierro tienen entre 1 – 2 mg por cada 100 g de cereal. 29 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ FABRICACIÓN DE NAILON: “EL TRUCO DE LA CUERDA DE NAILON” Tema Polimerización.Alumnos de Bachillerato o de segundo ciclo de enseñanza secundaria, dependiendo de la sofisticación del tratamiento teórico. Descripción Se prepara una suspensión de una disolución de bicloruro de decanodioilo en ciclohexano en una disolución acuosa de 1,6- diaminohexano. En la interfaz de ambas disoluciones se forma nailon que puede sacarse tan rápidamente como se produce, formando un hilo largo: “la cuerda de nailon”. Material • Un vaso de precipitados de 25 cm3. • Unas pinzas. • Un soporte con peana y abrazadera. Reactivos Las cantidades dadas son suficientes para una demostración. • 2,2 g de 1,6- diaminohexano [hexametilen diamina o hexano, 1, 6 diamina, H2N(CH2)6NH2 ]. • 1,5 g de bicloruro de decanodioilo [cloruro de sebacilo, ClOC(CH2)8COCl]. • 50 cm3 de ciclohexano. • 50 cm3 de agua desionizada. Método Antes de la demostración Preparar una disolución de 2,2 g de 1,6- diaminohexano en 50 cm3 de agua desionizada. Esta disolución es aproximadamente 0,4 mol/dm3. Preparar una disolución de 1,5 g de bicloruro de decanodioilo en 50 cm3 de ciclohexano. Esta disolución es aproximadamente de 0,15 mol/dm3. Añadir 5 cm3 de la disolución acuosa de la diamina en el vaso de precipitados de 25 cm3. Añadir con cuidado 5 cm3 de la disolución del cloruro de ácido en ciclohexano encima de la primera disolución para que se mezclen mínimamente. Realizar esta operación vertiendo la segunda disolución por la pared del vaso de precipitados o a través de una varilla de vidrio. El ciclohexano flotará en la parte superior del agua sin mezclarse. Colocar el vaso de precipitados encima del soporte como muestra la figura. Se formará en el interfaz una película grisácea de nailon. Coger un poco de esta interfaz de nailon con las pinzas y levántela despacio y suavemente desde el vaso de precipitados. Se debe formar un hilo de nailon detrás de las pinzas. Tirar de éste pasándolo por encima de una barra colocada en el soporte que actuará como polea. Continuar tirando del hilo de nailon a una velocidad de aproximadamente medio metro por segundo. Debe ser posible producir varios metros. Tener cuidado, ya que el hilo formado se cubrirá con el monómero que no ha reaccionado e incluso puede convertirse en un tubo hueco estrecho lleno con la disolución del monómero. Llevar guantes desechables como medida de precaución. Teoría La reacción es una polimerización por condensación. n H2N(CH2)6N2H + n ClOC(CH2)8COCl → H2N[(CH2)6NH CO(CH2)8] nCOCl + n HCl 30 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ El nailon formado es 6-10 llamado así por las longitudes de las cadenas carbonadas de los monómeros. El nailon 6-6 puede hacerse utilizando bicloruro de hexanodioilo (cloruro de adipoilo). La diamina está presente en exceso para que reacciones con el cloruro de hidrógeno que se produce. Un procedimiento alternativo es usar una cantidad estequiométrica de diamina disuelta en un exceso de disolución de hidróxido de sodio. Hay diferentes formas de enrollar convenientemente el hilo de nailon, por ejemplo, utilizando un torno improvisado con una bobina de algodón o con un trozo corto de tubo de vidrio que deslice sobre una varilla hecha de una grapa. Más detalles Esta demostración ha sido descrita de varías formas usando disolventes clorados para el cloruro de ácido. Pero no se consideran tan seguros y se estropearían pronto. El ciclohexano es menos denso que el agua, mientras que los disolventes clorados son más densos. Las capas están por lo tanto invertidas comparas con las del viejo método. El ciclohexano es preferible al hexano ya que es menos perjudicial. El dicloruro de hexanodioilo (cloruro de adipoilo) puede ser utilizado como una alternativa al dicloruro de decanodioilo, pero no se conserva tan bien como el primero. El dicloruro de decanodioilo reacciona con la humedad del aire y produce ácido decanodioico que forma nailon mucho más lentamente que el cloruro de ácido. Asegúrese de que la botella se cierra cuidadosamente después de abierta y si puede, almacénela en un desecador. El dicloruro está también disponible en ampollas selladas de 5 cm3. la disolución de ciclohexano formará todavía nailon un par de días después de comenzar a hacerlo, incluso si se deja la botella destapada. Si la disolución se guarda en una botella tapada se podrá utilizar después de dos semanas. La disolución puede almacenarse sobre sulfato de sodio anhidro o cloruro de calcio para mantenerla seca. El 1,6-diaminohexano sólido puede ser difícil de sacar de la botella. La manera más sencilla de manipularlo es calentar la botella suavemente con agua caliente hasta que se ablande a unos 42 ºC y se obtenga un líquido que podrá secarse con la ayuda de una pipeta. 31 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ FABRICACIÓN DE UN POLÍMERO Tema Fabricación de un polímero. Tiempo Aproximadamente 10 minutos. Nivel Cualquiera. Material y Reactivos • • • • Solución de alcohol vinílico al 4% Solución de borato de sodio al 4% Vasos de cartón y un palillo Colorante de alimentos (color verde) Descripción Mezclar las dos soluciones para formar un polímero. Añadir un colorante verde para darle la apariencia de un material baboso Colocar 20 mL de alcohol vinílico en un vaso de cartón Añadir 3 mL de solución de borato de sodio Adicionar un poco de colorante Agitar vigorosamente, en movimientos circulares, con el palillo Cuando se haya formado el gel, retirarlo del vaso y continuar amasando con las manos Teoría Los polímeros son moléculas de gran tamaño que se forman cuando moléculas, pequeñas e idénticas, se enlazan entre sí como los eslabones de una cadena. Cuando la solución de borato de sodio, Na2B4O5(OH)4.8H2O, se añade al alcohol vinílico, CH2CHOH, se forma un polímero. Este consta de miles de moléculas de alcohol vinílico formando cadenas lineales conectadas entre sí por moléculas de borato de sodio: -------CH2CHOH ------- CH2CHOH ------CH2CHOH --------| Na2B4O5(OH)4 | | Na2B4O5(OH)4 | | Na2B4O5(OH)4 | -------CH2CHOH ------- CH2CHOH ------CH2CHOH --------- 32 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ FABRICACIÓN DE COLA BLANCA Tema Ciencia de los alimentos, polímeros, interés general. Descripción Cola blanca el pegamento que se utiliza para pegar madera o cualquier otro elemento se puede preparar a partir dela caseína de la leche. Reactivos y Material • Leche desnatada • Vinagre • Bicarbonato de sodio • Vaso de 250 mL • Agitador de vidrio • Embudo y papel de filtro • Probeta graduada Método Colocar 125 mL de leche en el vaso de 250 mL Adicionar 25 mL de vinagre (es una solución ácida) Calentar la mezcla suavemente y agitar constantemente hasta que se empiecen a formar pequeños grumos. Retirar el calentamiento y continuar la agitación hasta que aparezcan más grumos. Esperar a que los grumos se asienten. Filtrar por gravedad. Presionar suavemente el papel de filtro para escurrir el líquido. Poner el material sólido en el vaso vacío. Añadir 30 mL de agua y agitar. Adicionar ½ cucharadita de bicarbonato de sodio para neutralizar el vinagre sobrante. Observar las burbujas de gas que aparecen. Si es necesario, adiciona más bicarbonato hasta que no se formen más burbujas ¡Ahora tienes un pegamento casero! Teoría La proteína de la leche se cuaja por efecto de la acidez y el calentamiento. La caseína se presenta en forma de grumos o precipitado. El vinagre sobrante, CH3COOH (ac), se neutraliza por acción del bicarbonato de sodio, NaHCO3, produciendo burbujas de dióxido de carbono, CO2: CH3COOH (ac) + NaHCO3 (ac) → CH3COONa (ac) + CO2 (g) + H2 . Los sólidos de leche fueron separados del líquido. Éstos sólidos, las cuajadas cuando están secas forman un plástico duro llamado caseína que también actúa como pegamento. 33 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ NUBES BLANCAS Descripción Provocar que en el seno del aire surjan “de la nada” unas nubes en forma de anillos Materiales: • Tubo ancho y hueco de vidrio • Soportes para el tubo • Algodones • Disolución de ácido clorhídrico • Disolución de amoniaco Método Disponer horizontalmente el tubo de vidrio. Empapar sendos algodones con cada una de las disoluciones. Con los algodones empapados cerraremos –a modo de tapones- ambas bocas del tubo. Al cabo de un minuto aproximadamente observar como se forman unos anillos blancos en el interior del tubo. Conforme pasa el tiempo, los anillos van aumentando y acaban por llenar todo el espacio. Teoría Se ha producido la síntesis de cloruro amónico a partir, lógicamente, de cloruro de hidrógeno y de amoniaco. Como la nueva sustancia es sólida a temperatura ambiente forma en primer lugar una suspensión en el aire interno del tubo que es la que aparece en forma de nubes anulares. Finalmente el cloruro amónico precipitará en las paredes del tubo formando una capa blanca en el mismo. Es una reacción llamativa, ya que sorprende tanto que de la “nada” se forme algo – ya que el cloruro de hidrógeno y el amoniaco son gases incoloros- como que se produzca no inmediatamente sino al cabo de un cierto tiempo, que es el que tardan ambos gases en encontrarse. Es una reacción que conviene hacerla con los reactivos diluidos y tomando las típicas y necesarias precauciones que exigen esos reactivos. Hay que tener mucho cuidado con ellos, por su olor picante de uno e irritante del otro. 34 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ TURBIDEZ MISTERIOSA Descripción Comprobar los “mágicos” poderes del aire, que es capaz de enturbiar un incoloro y transparente líquido para volverlo a transformar en incoloro y nítido nuevamente. Materiales y Reactivos: • Vasos de precipitados • Espátula y agitador • Varilla hueca de vidrio • Papel de filtro • Embudo • Agua destilada • Hidróxido cálcico • Aire... de nuestros pulmones Método Es necesario preparar, en primer lugar, una disolución saturada de hidróxido cálcico, sustancia poco soluble en el agua. Para ello se prepara inicialmente una disolución sobresaturada –basta echar unas pocas porciones de hidróxido en nuestro vaso de precipitado con agua y remover- y luego filtrarla. Sobre esa disolución se sopla –ayudándonos de la varilla hueca- durante unos minutos.... Al inicio observaremos que la incolora disolución de hidróxido cálcico se enturbia al someterse al burbujeo del aire. Al continuar soplando volveremos a obtener una disolución nuevamente incolora y transparente. Teoría Lo que ha sucedido es una reacción entre el hidróxido cálcico disuelto y el dióxido de carbono procedente de nuestros pulmones formándose carbonato cálcico: esta sustancia es prácticamente insoluble en el agua y por eso precipita provocando la turbidez comentada. Si continuamos soplando se produce la redisolución de precipitado al formarse bicarbonato cálcico, que sí es soluble. Es una reacción rápida y llamativa. La turbidez inicial se produce con bastante rapidez. Cuesta más tiempo la segunda fase cuando se pretende obtener nuevamente un líquido transparente. Otros efectos “poderosos” del aire de nuestros pulmones se pueden conseguir con ayuda de algún indicador ácido-base en alguna disolución acuosa básica: al ir insuflando aire se neutralizará la disolución y se acidificará, con lo que se podrá observar el cambio de color correspondiente al indicador utilizado. 35 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ QUIMILUMINISCENCIA – OXIDACIÓN DEL LUMINOL Tema Cambios de energía; esta demostración enseña que la energía de una reacción química puede ser emitida en forma de luz o de calor. Adecuada para grupos de alumnos tanto de Bachillerato como de primeros cursos de facultades de Ciencias como utilidad docente; cualquiera otra edad para interés general. Descripción Una disolución acuosa de luminol (3- aminoftalhidracida) se oxida por una reacción con una disolución de hipoclorito de sodio (lejía comercial), emitiendo una luz azul y sin aumento de temperatura. Material y Reactivos • Dos erlenmeyers de 1 dm3 con tapones. • Un vaso de precitados de 2 dm3 . • Un termómetro de 0 – 100 ºC. Las cantidades dadas son válidas para realizar una demostración. • 0,4 g de luminol (3- aminoftalihidracida). • 4,0 g de hidróxido de sodio. • 100 cm3 de lejía de uso doméstico (aproximadamente de 5% NaOCl) Método Mezcle 100 cm3 de lejía y 900 cm3 de agua en uno de los erlenmeyers y tápelo. En el otro erlenmeyer coloque 0,4 g de luminol, 1 dm3 de agua y 4 g de hidróxido de sodio. Agite para disolver los reactivos y entonces ponga el tapón. Se puede utilizar agua del grifo para preparar disoluciones. El luminol no se disuelve completamente, formando una fina suspensión verdosa. Baje la intensidad de luz del laboratorio y vierta las dos disoluciones en la misma proporción en el vaso de precipitados para que se mezclen. Se verá una luz pálida al mezclarlas que persiste durante unos pocos segundos. Anote las temperaturas de las disoluciones y de la mezcla resultante. Ambas serán idénticas. Cuanto más oscuro esté el laboratorio mejor resultará, siempre y cuando el profesor pueda ver mezclar las dos disoluciones. Las lecturas de temperatura se verán mejor si se dispone de un termómetro tipo termopar que tenga, bien un visualizador grande, o que esté conectado mediante una interfaz a un ordenador. Las disoluciones son estables durante más de 12 horas, así que pueden prepararse bien antes de la demostración. Teoría El luminol se oxida al ion aminoftalato que se produce en un estado excitado y emite luz al volver al estado fundamental. 36 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ Las disoluciones pueden verterse por un embudo unido a un tubo de plástico transparente que pueda doblarse en formas diferentes. Esto puede reforzar la visibilidad de la demostración. Se pueden comprar “palos de luz” quimiluminiscentes en tiendas de equipos para aire libre. Éstos contienen una ampolla de vidrio que lleva una disolución dentro de un tubo de plástico que contiene la otra disolución. La reacción empieza rompiendo la ampolla de vidrio y la luz continúa durante algunas horas. 37 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ UNA REACCIÓN SÓLIDO – SÓLIDO Tema Reacciones químicas y velocidades de reacción. Teoría cinética: el movimiento de las partículas en sólidos y líquidos. Nivel de segundo ciclo de enseñanza secundaria. Descripción Se mezclan y agitan juntos nitrato de plomo sólido y yoduro de potasio sólido, formándose yoduro de plomo amarillo. Material • Un pequeño tarro con tapa de rosca. Reactivos Las cantidades dadas son para una demostración. • Aproximadamente 20 g de nitrato de plomo (II), Pb(NO3)2, y unos 20 g de yoduro de potasio (KI). Método La demostración Pese masas iguales de ambos compuestos. Éstas son aproximadamente las cantidades estequiométricas. Es aconsejable entre 10 y 20 g de cada compuesto. Mezcle los sólidos en un tarro, ponga la tapa y muévalo durante algunos segundos. Se verá el color amarillo del yoduro de plomo. Prepare un poco más de la mezcla y colóquela rápidamente dentro de un vaso de precipitados que contenga un poco de agua. La reacción se producirá mucho más rápidamente. Recomendaciones visuales La demostración puede tener más impacto si el tarro es opaco y el producto amarillo se vierte fuera y se muestra a la confiada audiencia. Tenga disponible un fondo blanco. Consejos docentes Haga notar que para que la reacción se produzca, las partículas de los reactivos deben encontrarse. Esto es más fácil en disolución (donde las partículas son libre para moverse) que en estado sólido. Teoría La reacción es: Pb(NO3)2 (s) + 2 KI (s) → 2 KNO3 (s) + PbI2 (s) Todos estos compuestos son blancos excepto el yoduro de plomo, que es amarillo. Ampliaciones El etanoato de plomo puede sustituir al nitrato de plomo, pero la reacción es mucho más lenta. ¿Hay otros ejemplos de reacciones sólido – sólido lo bastante rápidas? 38 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL BOSQUE CRISTALINO Descripción Construir un auténtico “bosque” formado por figuras verticales formadas por la precipitación de sales minerales Materiales: • Un recipiente transparente de vidrio • Silicato sódico (“vidrio líquido”) • Agua • Arena • Sales minerales, como por ejemplo: sulfato ferroso, sulfato cúprico, cloruro de cobalto, sulfato de níquel, nitrato cálcico, sulfato de manganeso, cloruro férrico. Método La primera fase es la preparación del “habitat” de nuestro bosque. Se echa arena al recipiente – que hará el papel de suelo-, agua y vidrio líquido. Se deja reposar el tiempo suficiente para que la arena sedimente bien y aparezca sin turbidez la mezcla formada por el silicato sódico y el agua. En ese momento ya se podrá esparcir –con cuidado y casi de uno en uno- los cristalitos de las sales minerales. El resultado obtenido es... Al cabo de un tiempo –casi un día aproximadamente- se habrá formado una cristalización lineal, formándose estructuras verticales simulando árboles, de silicatos de los metales que constituían las sales añadidas. Dado los distintos coloridos de esos silicatos, la apariencia es de un pequeño bosque de múltiples colores. Teoría Los silicatos metálicos son sustancias insolubles en el agua y ello provoca que al interaccionar el anión silicato presente en el vidrio líquido con los diversos cationes metálicos de las sales, se produzca esa precipitación que –dado el lento proceso de formación de los cristales- da lugar a las formas verticales. Es una experiencia sencilla. Basta con tener un poco de paciencia para, antes de añadir las sales, conseguir que el líquido que se posa sobre la arena esté perfectamente incoloro y transparente. No hay que extrañarse –no obstante- si, una vez formado el bosque, se va “derrumbando” al cabo de unos días. 39 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ BOLAS SALTARINAS/MOVIMIENTO MISTERIOSO Descripción Contemplar el movimiento de ascenso y descenso de unas bolitas de naftalina en el seno de un líquido. Materiales:: • Un recipiente • Una lija • Naftalina • Bicarbonato • Vinagre Método En un recipiente profundo con agua se ponen unas bolas de naftalina y dos o tres cucharadas de bicarbonato. Se añade agua hasta llenar las tres cuartas partes del recipiente y a continuación, lentamente, se agrega vinagre. A continuación, se prepara una mezcla de agua y vinagre. Se añaden unas cucharaditas de bicarbonato sódico, se agita la mezcla y se vierten las bolas de naftalina. Las bolas caerán inicialmente al fondo del vaso pero al cabo de un tiempo ascenderán a la superficie del líquido para volver a caer y así sucesivamente Teoría Al reaccionar el vinagre con el bicarbonato se forma dióxido de carbono gaseoso, cuyas burbujas dan un aspecto efervescente al líquido. Esas burbujas se adhieren a la superficie de las bolitas y –haciendo el papel de flotadores- provocan su ascenso. Cuando llegan a la superficie, las burbujas pasan al aire y las bolitas –desprovistas ya de sus flotadores de anhídrido carbónico- vuelven a caer hasta que nuevamente sean rodeadas por otras burbujas. Es una visión simpática y curiosa de un movimiento aparentemente sin explicación. La duración del proceso depende, lógicamente, de las cantidades que hayamos utilizado de los reactivos vinagre y bicarbonato sódico. La experiencia se puede hacer también con uvas pasas sumergidas en una bebida gaseosa como Coca-Cola. Alternativamente se puede generar burbujas de CO2 mezclando un ácido con carbonato. 40 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ LA MATERIA ¿DESAPARECE? Descripción Comprobar como al juntar dos líquidos, el volumen finalmente obtenido es inferior a la suma de los volúmenes iniciales Materiales: • Dos probetas • Agua destilada • Etanol Método Verteremos una cantidad de agua en una probeta y otra cantidad igual de etanol en la otra. Para que el resultado sea lo suficientemente cuantificable es necesario utilizar unas cantidades de líquidos no pequeñas (por ejemplo, unos 50 ml de cada líquido). Anotaremos cada volumen y mezclaremos ambos. El volumen final de la mezcla es inferior a la suma de los volúmenes parciales. Teoría Ha tenido lugar no una pérdida de masa –comprobable ello si utilizamos la balanza- sino una contracción de volumen. La razón de esta contracción radica en las intensas fuerzas de cohesión existentes entre las moléculas de agua y las de etanol, que provocan un mayor acercamiento de las mismas y, por tanto, un menor volumen a nivel macroscópico. Es una sencilla, pero ilustrativa experiencia que apoya la Teoría de la discontinuidad de la materia. El mismo objetivo puede conseguirse al comparar el volumen de una cierta cantidad de agua antes y después de disolver en ella una cucharada de sal o azúcar. Si la cantidad utilizada de agua es bastante grande en comparación a la del soluto, se observa que no hay diferencias entre ambos volúmenes. 41 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ LOS COLORES CAMBIAN DE ROJO A AZUL Descripción Comprobar cómo determinadas sustancias cambian su color al elevar su temperatura. Materiales: Tubo de ensayo Espátula Mechero bunsen, butano y cerillas Cloruro cobaltoso Método Teoría Introduciremos un poco de cloruro de cobalto (que es un sólido de color rosáceo- magenta) en un tubo de ensayo y, cogiendo el tubo con una pinza de madera, aplicaremos la llama del mechero a la parte inferior. Tendremos cuidado de mantener el tubo con cierto ángulo de inclinación y dirigido a una zona en donde no haya ninguna persona. Introduciremos un poco de cloruro de cobalto (que es un sólido de color rosáceo- magenta) en un tubo de ensayo y, cogiendo el tubo con una pinza de madera, aplicaremos la llama del mechero a la parte inferior. Tendremos cuidado de mantener el tubo con cierto ángulo de inclinación y dirigido a una zona en donde no haya ninguna persona. Poco a poco observaremos que las paredes internas del tubo se van empañando y que el color del sólido va cambiando a azul. Teoría Lo que ha sucedido es que el cloruro de cobalto se presenta en su modalidad hidratada y al elevar su temperatura desaparece esa agua de hidratación, quedando como sólido la sal sin hidratar, que es de color azul. Esta particularidad no sólo la tienen las sales de este metal, sino también de otros que, como el cobalto, pertenecen a los metales de transición y pueden efectuar enlaces dativos con átomos (como es el caso del oxígeno del agua) que posean pares de electrones sin compartir. 42 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ ESCRITURA “MÁGICA” Tema Esta demostración puede realizarse como entretenimiento o de interés general. Como tal puede ser una excelente introducción o final para un programa de clases prácticas, si se escribe el mensaje adecuado. Sin embargo, hay mucha química interesante en el camino, especialmente de metales de transición. Los alumnos de Bachillerato deben ser capaces de apreciar la química que hay detrás de las reacciones. Descripción Se escriben mensajes en papel de filtro con distintas disoluciones acuosa incoloras y diluidas. Pulverizando con otras disoluciones, se obtienen unos productos coloreados y se revelan los mensajes en diferentes colores. Material • Hojas grandes de papel de filtro blanco, papel de cromatografía o papel secante. • Pinceles pequeños, del tamaño utilizado para pintar maquetas ( pueden ser astillas de madera si no se dispone de pinceles ) . • Botellas con pulverizador como las que se usan para rociar las plantas. Se pueden comprar en los centros de jardinería. Se necesita uno para cada disolución de pulverizado, y por tanto se necesitan al menos tres para el método básico que aquí se describe. • Un secador de pelo ( opcional ). Reactivos Las cantidades dadas son suficientes para varias demostraciones. • 5 g de hexaciano ferrato (II) de potasio trihidratado [ ferrocianuro potásico, K4Fe(CN)6 . 3H2O] . • 5 g de sulfato de cobre (II) pentahidratado ( CuSO4 . 5H2O ) . • 5 g de tiocianato amónico ( NH4SCN ). • 5 g de nitrato de hierro (III) nonahidratado [ Fe(NO3)3 . 9 H2O ] . • 5 g de nitrato de plomo (II) [ Pb(NO3)2 ]. • 5 g de yoduro potásico (KI). • 100 cm3 de una disolución de amoníaco de aproximadamente 2 mol. L-1 [NH3 (aq)]. • Unos cm3 de disolución de fenolftaleína. • Aproximadamente 1 dm3 de agua desionizada. Método Antes de la demostración Prepare las disoluciones como sigue. • • • Fenolftaleína: disuelva 0,1 g en 60 cm3 de etanol y complete hasta 100 cm3 con agua desionizada. Ésta es la concentración usual. Amoníaco: aproximadamente 10 cm3 de amoníaco concentrado se completan con 100 cm3 de agua desionizada. Todos los demás sólidos: disuelva 5 g de cada sólido en 100 cm3 de agua. Ponga las disoluciones de nitrato de hierro (III), nitrato de plomo y amoníaco en botellas pulverizadoras separadas. Ajuste las boquillas de las botellas para dar una fina llovizna y 43 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ pulse varias veces los sprays para asegurarse de que no salga agua de lavado cuando pulverice con la botella. Utilice los pinceles o las astillas de madera para escribir los mensajes indicados en el papel de filtro usando las disoluciones de yoduro de potasio, de hexaciano ferrato (II) de potasio, de tiocianato de amonio, fenolftaleína y sulfato de cobre. Séquelos con un secador de pelo. Trabaje con un trozo de periódico limpio para evitar encontrar productos químicos en la superficie de la meseta. Todas las disoluciones, una vez secas son incoloras excepto la del sulfato de cobre que será azul muy pálido, no detectable excepto para una audiencia muy aguda. Clave el papel en la pared donde pueda ser visto fácilmente. Rociar el papel con la disolución de nitrato de plomo. El mensaje escrito con yoduro de potasio se verá como yoduro de plomo amarillo brillante. Ahora rocíe con nitrato de hierro (III). El mensaje escrito con hexaciano ferrato (II) de potasio se volverá azul oscuro (azul de Prusia) y el mensaje escrito con tiocianato de amonio se volverá marrón rojizo [Fe(H2O)5SCN2+]. Ahora rocíe con la disolución de amoníaco. La fenolftaleína se volverá rosácea, el sulfato de cobre azul [Cu(NH3) 62+] y el color del tiocianato de hierro complejado desaparecerá debido a la formación del hidróxido de hierro (III) que es mucho menos coloreado. No se debe rociar demasiado el papel con los reactivos porque los colores se pueden correr. 44 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ LA DESCOMPOSICIÓN TÉRMICA DE NITRATOS: “ESCRITURA MÁGICA” Tema Descomposición térmica de nitratos, de interés general. Primer y segundo ciclo de enseñanza secundaria. Descripción Se escribe un mensaje en un papel de filtro con una disolución de nitrato de sodio y se deja secar. Se revela con llama. Esta demostración puede ser utilizada para introducir el triángulo de fuego: combustible, calor y oxígeno. Con alumnos mayores se puede utilizar para revisar las ecuaciones de descomposición de nitratos. Material • Hojas de papel de filtro o papel secante, tan grandes como sea posible. • Cerillas de madera. • Un mechero Bunsen o un secador de pelo. • Un pequeño pincel. Reactivos Las cantidades dadas son suficientes para una demostración. • Unos 10 g de nitrato de sodio (NaNO3). Método Prepare una disolución saturada de nitrato de sodio añadiendo 10 g del sólido a 10 cm3 de agua y agitando a continuación la mezcla. Utilizando un pequeño pincel (o una cerilla de madera larga), escriba un mensaje en el papel de filtro. ¡ Use una letra junta! Seque el mensaje utilizando un secador de pelo o calentando el papel muy por encima de la llama del mechero Bunsen. El mensaje se hará prácticamente invisible, señale el inicio del mensaje con una marca de un lápiz óptico. Sujete con alfileres el papel de filtro a la vista de la audiencia. Aplique una cerilla encendida en el comienzo del mensaje hasta que el papel tratado comience a brillar ya carbonizarse. Quite la cerilla y mire cómo el brillo y las palabras se carbonizan a lo largo del mensaje, dejando el papel no tratado intacto. Teoría Aplicando una cerilla encendida en el comienzo del mensaje hace que el papel tratado arda sin llama que se revele el mensaje, mientras la luminosidad se propaga por el camino solamente a través del papel tratado. La reacción que ocurre es: 2 NaNO3 (s) → NaNO2 (s)+ O2 (g) El oxígeno producido es suficiente para mantener el papel tratado ardiendo sin llama mientras el papel no tratado no debe arder. Inténtelo con otros nitratos metálicos. ¿Qué efecto debe tener la concentración de nitrato? 45 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ El nitrato de potasio funciona de forma similar al nitrato de sodio. El nitrado de litio también funciona aunque se descompone de forma diferente debido a la elevada densidad de carga en el ion litio. 4 LiNO3 (s) → 2 Li2O (s)+ 4 NO2 (g) + O2 (g) El nitrato de plomo también funcionará: 2 PbNO3 (s) → 2 PbO (s)+ 4 NO2 (g) + O2 (g) El nitrato de amonio no funciona porque no se desprende oxígeno mientras se descompone: NO4NO3 (s) → N2O (g) + H2O(l) Aunque el óxido de nitrógeno (I) (N2O) si se descompondrá dando oxígeno, se supone que o bien no hay una cantidad suficiente de N2O para mantener el papel ardiendo sin llama o que la temperatura e demasiado baja para dar lugar a la descomposición. 46 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ LOS COLORES CAMBIAN, AZÚCAR EN CARBÓN Descripción Convertir la agradable y blanca azúcar en una masa esponjosa de color negro que surge y se eleva como si fuera un churro a partir del recipiente en que se produce la reacción. Materiales: Espátula Agitador Vaso de precipitados Ácido sulfúrico concentrado Azúcar (sacarosa) Método Se vierte azúcar en un vaso de precipitados (aproximadamente un cuarto de su capacidad). Se añade ácido sulfúrico hasta formar una pasta espesa. Se revuelve bien la mezcla y... a esperar Al cabo de un minuto aproximadamente veremos como la pasta –que poco a poco su color cambia de blanco a amarillento- se ennegrece y adopta un aspecto esponjoso ascendiendo por el vaso de precipitados como si fuera un auténtico churro. Teoría Lo que ha sucedido es una reacción de deshidratación del azúcar provocada por el ácido sulfúrico. La sacarosa se convierte en un residuo negro de carbono, mientras que el agua se desprende en forma de vapor provocando ese ascenso de la masa y esa textura esponjosa. Es una reacción muy vistosa, pero con la que hay que tener muchísimo cuidado, tanto por el manejo del ácido sulfúrico concentrado, como por el desprendimiento de gases tóxicos y, también, por el fuerte carácter exotérmico de la reacción. Es aconsejable hacerla en la campana de gases, guardando una prudente distancia de los gases que emana la reacción. 47 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ LOS COLORES CAMBIAN; BLANCO MÁS BLANCO, AMARILLO Descripción En dos morteros echaremos por separado unas porciones de yoduro de potasio y de nitrato de plomo en cada uno. Majaremos suavemente con la mano de mortero cada sustancia. Cuando cada sustancia ya esté finamente pulverizada las mezclaremos en el tercer mortero. Para que la mezcla sea rápida nos podemos ayudar de la mano del tercer mortero Conforme entran en contacto, el polvo de la mezcla se va tornando amarillo. La rapidez del cambio de color depende si aceleramos o no la mezcla con una espátula o con la mano del mortero. Ante nuestros ojos, la blanca mezcla inicial irá cambiando “espontáneamente” de color hasta llegar a una tonalidad amarilla intensa. Teoría Lo que ha sucedido no es una simple mezcla, sino una reacción química entre las dos sustancias de modo que se ha formado, además de nitrato potásico, una nueva sustancia, el yoduro de plomo, de color amarillo. Es un proceso rápido y vistoso. Se puede comprobar que se ha obtenido una sustancia con propiedades diferentes ya que tanto el yoduro potásico como el nitrato de plomo se disuelven fácilmente en el agua, mientras que eso no le sucede al polvo amarillo que se ha formado. Esta reacción puede efectuarse también en medio acuoso utilizando disoluciones de los reactivos. Estas disoluciones son incoloras y al mezclarlas aparece instantáneamente un precipitado amarillo de yoduro de plomo. 48 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL “IMÁN” PARA MADERA Descripción Comprobar el efecto que produce una reacción fuertemente endotérmica. Material • Vaso de precipitados de 250 mL • Varilla de vidrio • Trozo de madera • Termómetro Reactivos • Hidróxido de bario octahidratado • Cloruro de amonio Método Pesar en un vaso de precipitado de 250 mL perfectamente seco, 31.5 g de hidróxido de bario octahidratado y medir la temperatura del sólido. Pesar en un vidrio de reloj 5.3 g de cloruro de amonio (proporciones estequíometricas). Colocar el vaso de precipitado encima de una pequeña cantidad de agua que se ha puesto sobre una madera o aglomerado de unos 20 x 20 cm. Mezclar los dos sólidos en el vaso de precipitado y agitar con una varilla de vidrio hasta que se hayan mezclado íntimamente ambos sólidos. Se forma una suspensión blanca de cloruro de bario en el agua procedente de la reacción. La presencia de amoniaco se detecta por el olor característico o por la formación de una nube blanca si se coloca una botella de ácido clorhídrico concentrado cerca de la boca del vaso (se forman pequeñas partículas sólidas de cloruro de amonio). Medir la temperatura de la suspensión comprobándose que la temperatura ha descendido por debajo de cero grados lo que hace que la película de agua entre el vaso de precipitado y la madera se haya congelado. Si levantamos ahora el vaso de precipitado observaremos como la madera permanece unida a la base del vaso debido al hielo formado (“imán” de madera). Teoría En muchas reacciones químicas el calor es un producto más del proceso que tiene lugar, mientras que en otras, solamente es posible que la reacción se lleve a cabo si a los reactivos se les suministra calor. Del primer tipo de reacciones se dice que es un proceso o una reacción exotérmica y, cuando en el transcurso de un cambio químico se absorbe calor, se dice que es un proceso o reacción endotérmica. Puede parecer que sólo los procesos exotérmicos podrían realizarse espontáneamente. Sin embargo, existen reacciones endotérmicas que son espontáneas a temperatura ordinaria. Muchos procesos físicos endotérmicos ocurren espontáneamente en la vida ordinaria, por ejemplo, la fusión del hielo, la evaporación de un líquido, la disolución de muchas sales en agua, …. Entonces, la espontaneidad de un proceso o bien no depende del incremento de entalpía (∆H), o bien es función también de otra magnitud llamada entropía. Puede afirmarse que todo sistema tiende a pasar espontáneamente a un estado de energía mínima (o mejor de entalpía mínima) y máximo desorden o entropía máxima. Así por ejemplo, al mezclar cantidades equimoleculares de hidróxido de bario octahidratado con cloruro de amonio, produciendo amoniaco y cloruro de bario, tiene lugar una reacción endotérmica, observándose un descenso de temperatura a veces incluso por debajo de -20 ºC. 49 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ DECOMPOSICIÓN DEL AGUA OXIGENADA Descripción Comprobar el efecto de catalizadores inorgánicos y enzimas en la velocidad de una reacción química. Material • Tres probetas de 100 mL • Varilla de vidrio Reactivos • Agua oxigenada comercial • Lavavajillas • Dióxido de manganeso ( puede ser una pila salina) • Hígado de un animal Método Añadir 30 mL de agua oxigenada comercial y dos gotas de lavavajillas concentrado a las tres probetas agitando para que se mezclen bien. Abrir con mucha precaución una pila de petaca con un cuchillo que no vaya a ser utilizado en alimentación, sacar un poco de la pasta negra que contiene dióxido de manganeso o, directamente, usar dióxido de manganeso comercial. Añadir a la primera probeta una pequeña cantidad de dióxido de manganeso. Atar con un poco de hilo a un extremo de una varilla de vidrio una pequeña porción de hígado de cerdo o de ternera. Introducir en la segunda probeta una varilla de vidrio con el trozo de hígado. Al agua oxigenada de la tercera probeta no se añade nada. Agitar todas las probetas para que se produzca el contacto entre en catalizador y el agua oxigenada. Teoría El agua oxigenada (H2O2) es una sustancia inestable, oxidante y muy tóxica. Su poder desinfectante y decolorante se debe a que oxida componentes de los microorganismos y colorantes. Se utiliza para desinfectar heridas o decolorar el pelo, entre otros usos, y se descompone espontáneamente liberando oxígeno en burbujas; esta descomposición es muy lenta a temperatura ambiente y presión ambiental. La reacción es catalizada por numerosos compuestos inorgánicos y orgánicos, desprendiéndose oxígeno, que se pone de manifiesto por la formación de espuma si se ha añadido detergente. El higado contiene peroxidasas unas enzimas que catalizan esta reacción 50 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ HIELO CALIENTE Tema Reacciones químicas. Cambios de estado. Descripción El acetato de sodio o hielo caliente es un producto químico interesante que se puede preparar con bicarbonato de sodio y vinagre. Reactivos • 1 litro de vinagre claro (ácido acético débil) • 4 cucharadas de bicarbonato de sodio Método 1.-Añadir el bicarbonato de sodio y el vinagre, poco a poco, mezclando los ingredientes en un vaso. El bicarbonato de sodio y el vinagre reaccionan para formar un acetato de sodio y un gas de dióxido de carbono. Si no se mezclan estos ingredientes lentamente, lo que se obtendrá será un volcán de bicarbonato de sodio y vinagre, que se puede derramar. Así se obtiene un acetato de sodio, pero está demasiado diluido para ser útil, por lo que hay que eliminar la mayor parte del agua de la mezcla. 2.- Hervir la solución para concentrar el acetato de sodio. Seguir calentando la solución hasta que se forme una capa delgada de cristal, o se forme una película en la superficie. Este proceso toma aproximadamente una hora. Si se nota una descoloración, está bien. 3.- Pasar la solución a otro contenedor y cubrirla con plástico. La solución no debe tener ningún cristal. Si hay algunos cristales, mezclar un poco de agua o vinagre con la solución, lo suficiente para disolver los cristales. 4.-Poner la mezcla en el refrigerador para que se enfríe. Después se verá cómo se cristaliza con sólo tocar la superficie. También puedes servir la mezcla y hacer esculturas. Teoría Enfriando una solución de acetato de sodio por debajo de su punto de fusión la solidificación sucede tan rápido que se pueden formar esculturas al momento. La cristalización es un proceso exotérmico, que resulta en un hielo... que es caliente 51 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ APARECE Y DESAPARECE Descripción Provocar el precipitado de una sustancia por la acción de un reactivo y, posteriormente al seguir añadiendo el mismo reactivo, conseguir que el precipitado desaparezca. Materiales: • • • • Tubos de ensayo Cuentagotas Disolución de sulfato cúprico Disolución amoniacal (amoniaco en agua) Método Se echan un par de dedos de disolución acuosa de sulfato cúprico en un tubo de ensayo. A continuación se vierte una gota de disolución amoniacal. Se observa lo que sucede. Se siguen añadiendo gotas de la misma disolución amoniacal. ¿Y entonces? El resultado obtenido es... Al iniciar la adición de la disolución amoniacal se producirá un precipitado azul intenso en el fondo del tubo. Pero al continuar añadiendo gotas de dicha disolución el precipitado desaparece y todo vuelve a formar una disolución nítida y transparente. Teoría Con las primeras gotas de reactivo se produce la precipitación de hidróxido cúprico, que es lo que se observa al inicio del proceso. Al añadir el mismo reactivo se observa la redisolución del precipitado ya que se produce la formación, mediante enlaces coordinados, del complejo catiónico tetraminocúprico que es soluble, a diferencia del hidróxido cúprico formado anteriormente. Hay que tener algo de cuidado para que sea perfectamente visible la primera etapa, es decir la formación del precipitado. La mayoría de los hidróxidos metálicos son insolubles, por lo que es relativamente fácil provocar su precipitación creando un pH básico en la disolución de las sales metálicas. La redisolución de los precipitados también puede hacerse con otras sustancias, como son los casos de los hidróxidos de cinc o de aluminio que precipitan al añadir hidróxido sódico a disoluciones de sulfato de cinc y de sulfato de aluminio respectivamente. Al seguir añadiendo álcali se redisuelven. En estos casos, la redisolución se debe a la formación de los aniones complejos cincato y aluminato, dado el carácter anfótero de los hidróxidos de cinc y de aluminio. 52 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ FENOLFTALEÍNA COMO INDICADOR Tema Indicadores, ácidos y bases, equilibrio. Alumnos de Bachillerato y de primeros cursos de facultades de Ciencias. Descripción Lo mismo que el muy conocido “rojo en medio alcalino e incoloro en medio ácido”, la fenolftaleína puede pasar a incolora en disoluciones alcalinas más concentradas. Material • Un vaso de precipitados de 100 cm3. • Tres tubos de ensayo y gradilla. • Una pipeta o cuentagotas. Reactivos Las cantidades dadas son válidas para una demostración. • Indicador fenolftaleína en disolución (0,1 g del sólido se disuelven en 60 cm3 de etanol y 40 cm3de agua). • Unas lentejas de hidróxido de sodio sólido. • Aproximadamente 100 cm3 de una disolución 0,5 mol· dm-3de hidróxido de sodio. • Unos cm3de una disolución aproximadamente 2 mol· dm-3de ácido clorhídrico. Método La demostración Añada unas gotas de disolución de fenolftaleína sobre 100 cm3 de una disolución 0,5 mol· dm3 de hidróxido de sodio, hasta que se vea el intenso color rosa. Divida esta disolución entre los tres tubos de ensayo. Deje un tubo como control, añada ácido clorhídrico gota a gota a uno de los otros dos tubos de ensayo hasta que el color desaparezca. Éste es el comportamiento “normal” de la fonolftaleína. Al tercer tubo, añádale dos o tres lentejas de hidróxido de sodio sólido agitando la disolución para disolverlas. El color rosa también desaparecerá de este tubo. Los cambios pueden ser invertidos por la adición apropiada de ácido o álcali. La demostración se podrá presentar empezando con la disolución incolora de la fenolftaleína en medio alcalino concentrado y agregando ácido para dar un cambio de color inesperado. Teoría En disolución ácida, la fenolftaleína se presenta bajo la forma (I), la cual es incolora. La adición de hidróxido de sodio quita dos protones para producir el dianión de color rojo (II), mientras que la posterior adición de álcali da (III) que también es incoloro. 53 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ SOLUBILIDAD DEL YODO Descripción Estudiar la diferente solubilidad del I2 en diferentes medios. Materiales: • • • • • • Tubos de ensayo Agitador Espátula Yodo Agua destilada Tetracloruro de carbono Método En dos tubos de ensayo verteremos unos dedos de agua destilada y de tetracloruro de carbono respectivamente. Añadiremos una pequeñísima pizca de yodo (sólido de color gris) a cada uno de ellos. Agitaremos ambos tubos y puede observarse que el tubo con agua adoptará un color amarillento (de más o menos intensidad según la cantidad de yodo añadida). El tubo con tetracloruro de carbono (que también es un líquido incoloro como el agua) adoptará un color rosáceo-morado. Teoría La diferencia de color se debe a la naturaleza del disolvente: mientras que el tetracloruro de carbono es apolar, la molécula de agua es polar y posee una débil, pero real, ionización. Esto provoca unas interacciones y fuerzas intermoleculares con el yodo, que explican las diferencias obtenidas. La experiencia puede completarse si –con cuidado- vertemos el contenido del tubo que contenía yodo y agua en otro tubo que contenga solamente tetracloruro de carbono. Inicialmente, y dada la mayor densidad del tetracloruro y su inmiscibilidad con el agua, aparecerán dos fases líquidas diferenciadas en el tubo, amarilla la superior e incolora la inferior. Si ahora agitamos durante par de minutos y dejamos reposar seguiremos observando dos fases líquidas, pero ahora la superior será incolora y la inferior rosácea: el tetracloruro habrá extraído el yodo del agua, dado su mejor poder disolvente 54 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ RELOJ DE YODO Descripción Observar cómo hay sustancias que al mezclarlas no actúan, aparentemente, entre sí y sí lo hacen al cabo de un cierto tiempo. Materiales: • • • • • • Tubos de ensayo Vasos de precipitados Agitadores y espátulas Yodato potásico Sulfito sódico Agua destilada Método Se preparan sendas disoluciones acuosas de yodato potásico y de sulfito sódico. A ésta última se añade ácido sulfúrico y una disolución de almidón en agua. Mezclar las disoluciones. Aunque no ocurre nada cuando se mezclan las disoluciones, a los pocos segundos la mezcla se oscurece adoptando finalmente un color azul negruzco Teoría Inicialmente se produce una reacción redox entre los aniones yodato y sulfito, formándose yoduro y sulfato. El anión yoduro formado reacciona con el anión yodato no consumido con el sulfito y, catalizado por el medio ácido que proporciona el ácido sulfúrico, se forma yodo, el cual -con el almidón- forma un complejo de color azul negruzco. Es un ejemplo típico para estudiar la cinética de las reacciones químicas. El tiempo que tarda en aparecer el color depende de las concentraciones utilizadas. Parecidos efectos pueden conseguirse si se sustituye el yodato por hipoyodito y el sulfito por persulfito. 55 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ ELECTROLISIS DEL AGUA Tema Reacciones REDOX Descripción La electrolisis del agua origina en uno de los electrodos iones hidroxilo capaces de hacer virar la fenoftaleína. Materiales: 2 minas de grafito 1 cartoncito pequeño para sujetar los electrodos 1 vasos Na2SO4 Fenoftaleina 1pila alcalina Método Se prepara una disolución de sal en agua y se le añaden unas gotas de fenolftaleína. Se efectúan las conexiones a la pila y a los electrodos (que pueden ser dos barras de grafito o de un metal). Se introduce cada electrodo en la disolución. Inmediatamente observaremos que alrededor del electrodo conectado al polo negativo de la pila el líquido adquiere un color morado/magenta. Teoría Lo que ha sucedido es la electrolisis de la sal disuelta de modo que, en el electrodo negativo, se forman hidrógeno gaseoso e iones OH- que –al generar un pH básico en esa zona- provocan que la fenolftaleína adopte su color correspondiente a pH básico. Es una reacción rápida y curiosa pues llama la atención que sólo se “noten” los efectos en un electrodo (en el otro se estarán formando burbujas de oxígeno gaseoso). Si no se utiliza fenoftaleína y si los electrodos utilizados son de hierro, observaremos que la disolución va tomando un color verdoso conforme avanza la electrolisis. 56 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ UNA PILA CON FRUTAS Tema Reacciones REDOX Descripción Teniendo en cuenta que en una pila una sustancia puede oxidar a otra, podemos conseguir hacer funcionar un reloj con limones, manzana, refresco de cola, zumo de naranja… Material y Reactivos Electrodos de cobre y cinc. Diferentes frutas: limón, manzana, naranja, kiwi, etc. Vinagre. Electrodos de cobre y cinc. Diferentes frutas: limón, manzana, naranja, kiwi, etc. Vinagre. Refrescos variados. Reloj de 1,8 V. Voltímetro. Cables y pinzas de cocodrilo Refrescos variados. Reloj de 1,8 V. Voltímetro. Cables y pinzas de cocodrilo Método Nosotros utilizamos electrodos de cobre y cinc. En el cinc se produce la oxidación: es el polo negativo de nuestra pila; en el cobre se produce la reducción: es el polo positivo. Al elaborar una pila con un solo limón u otra fruta o refresco obtenemos un voltaje que varía entre 0,8 V y 1 V, según la sustancia utilizada. Este voltaje es insuficiente para hacer funcionar un reloj. Para ello, debemos conectar en serie tres frutas, que pueden ser iguales o no. La única precaución que hay que tener es que los cables vayan del cobre al cinc, y que el polo negativo del reloj se conecte al cinc, y el positivo, al cobre. Los electrodos no deben estar en contacto. Teoría En una pila se produce una reacción química, una reacción redox en la cual las cargas eléctricas circulan, van de un electrodo a otro. 57 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ MÁS LENTO Y MÁS RÁPIDO Descripción Hacer que una reacción química se produzca más lentamente que en circunstancias normales. Materiales: Una manzana Un cuchillo Una cuchara Zumo de limón Método Cortaremos, sin pelar, una manzana en sus dos mitades. A una de las dos mitades la rociaremos, por su parte cortada y desprotegida ya de la piel, con el zumo de limón. Esperaremos y... Al cabo de no mucho tiempo la mitad de la manzana que ha sido rociada con limón mantiene su color característico, mientras que la otra aparecerá ya de color amarronado. Teoría Al entrar en contacto con el oxígeno atmosférico comienzan a oxidarse ciertas sustancias presentes en la manzana, formándose productos de color marrón. En el caso de la manzana “protegida” por el limón, el ácido cítrico de éste actúa de 58 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL FAKIR QUÍMICO Tema Análisis cualitativo de la luz por diferentes lámparas comerciales. Descripción Observar la emisión atómica (colores) y relacionarla con los espectros atómicos de algunos elementos. Material y Reactivos • • • • • Pulverizadores Mechero Disoluciones de sales (preferiblemente cloruros) de : o Litio o Estroncio o Calcio o Sodio o Bario o Cobre (II) Método Espectros de los elementos Se enciende el gas del mechero y, una vez oscurecido el aula o el laboratorio, se pulverizan las disoluciones por encima de la llama. Teoría El espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas electromagnéticas emitidas por átomos de ese mismo elemento. Cuando un elemento químico en forma gaseosa o de vapor recibe energía, bien por calentamiento a alta temperatura, bien por una descarga eléctrica de alta tensión, emite luz que puede ser analizada mediante un espectroscopio. Cuando a las sales se les suministra una gran cantidad de energía térmica se descomponen en sus átomos y esa energía suministrada produce transiciones electrónicas dando lugar a especies en estado excitado. Estos átomos vuelven a su estado fundamental perdiendo el exceso de energía en forma de radiación electromagnética, que si se encuentra en la zona del espectro visible, se apreciará un color característico del elemento. Por ejemplo, cuando un alambre de platino es bañado en una solución nitrato de estroncio e introducido en una llama, los átomos de estroncio emiten color rojo. De manera similar, cuando sales de cobre se introducen en una llama aparece una coloración verde. Estas características permiten identificar los elementos mediante un espectro de emisión atómica, e incluso, en qué cantidad están presentes. La emisión se produce por la transición electrónica de un estado excitado al estado fundamental de forma que como los estados electrónicos están cuantizados se obtienen los llamados espectros de emisión atómica formados por un conjunto de líneas características de cada elemento. 59 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ EL GLOBO MISTERIOSO Tema Expansión de gases por efecto de la temperatura. Descripción Observar como puede hincharse un globo calentado con agua hirviendo Material y Reactivos • • • • 1 recipiente para hervir agua Mechero Globos o • Método Llenar un globo con 5-10 ml de metanol. Hacer un nudo para cerrarlo herméticamente. Introducir en un vaso con agua. Calentar el agua hasta hervir. Se podrá observar como se va hinchando el globo. Teoría El metanol se expande por efecto de la temperatura. 60 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ HUEVO DURO Y HUEVO CRUDO Descripción Observar las distintas propiedades de un huevo crudo y uno cocido Materiales: Un huevo crudo Un huevo hervido (por 10 minutos). Método Mezcla los huevos bien, hasta que no sepas cuál está crudo y cuál duro. Ahora, ponlos a girar en una superficie grande, o sobre el suelo. Observa cómo se mueven, cuál gira con más facilidad, más rápido, o más tiempo. Ahora pon los dos a girar al mismo tiempo. Detenlos y suéltalos inmediatamente. El huevo crudo empezará a girar nuevamente, porque aunque su superficie se detuvo, el líquido adentro siguió girando. Ahora puedes hacer otro truco con el huevo duro. Ponlo a girar muy rápidamente y notarás el mismo fenómeno que sucede con los trompos tradicionales. Si adquiere suficiente velocidad, en vez de girar acostado, se levantará. 61 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ FREIR UN HUEVO SIN ACEITE Descripción Observar cómo un huevo se “fríe” sin necesidad de fuego, aceite ni sartén. Materiales: • • • Plato Huevo crudo Alcohol de farmacia Método Cascaremos el huevo sobre el plato y seguidamente lo rociaremos con alcohol. Poco a poco veremos (el efecto comienza a notarse casi inmediatamente, aunque el resultado completo se observa al cabo de una hora aproximadamente) como la clara adopta el color y textura sólida de un huevo realmente frito. La yema permanecerá líquida debajo de la capa blanca protectora de la clara. Teoría La transformación que conocemos al freír habitualmente un huevo consiste en el cambio estructural de las proteínas. Ese cambio. –la desnaturalización- se puede producir no sólo por acción del calor sino también por el contacto con ciertas sustancias como el etanol. Esta reacción y curioso efecto también se consigue si previamente a la adición del alcohol batimos el huevo. En este caso obtendremos algo parecido a un huevo “revuelto” que adoptará la forma del recipiente, como si de un flan se tratase. 62 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL HUEVO VACIO Descripción Provocar que se vacíe el interior de un huevo por un extremo al entrar en contacto con el agua su otro extremo Materiales: • • • • Vaso Aguja Huevo crudo Agua Método Con ayuda de una aguja (o cualquier otro objeto punzante) haremos una pequeña incisión en la cáscara del huevo (en su extremo más achatado) de forma que sólo se rompa ésta y no la “telilla” interior. Con nuestros dedos aumentaremos el tamaño de la abertura de la cáscara. A continuación haremos un agujero –incluida esa telilla o membrana- en el otro extremo del huevo. Finalmente se deposita el huevo dentro de un vaso en posición vertical y apoyándolo por el extremo en el que la membrana no ha sido perforada, se vierte agua corriente en el vaso de forma que no cubra el huevo. Al cabo de cierto tiempo –en unos minutos se comienza a ver, aunque hay que esperar unas horas hasta ver bien el fenómeno- se observa como va saliendo la clara del huevo por la abertura superior en forma de un globo perfectamente cerrado. Teoría El fenómeno observado se debe a un proceso de ósmosis a través de la membrana de la parte inferior del huevo. El agua del vaso va atravesando la membrana, dado que ésta es semipermeable y permite el paso del disolvente, el agua. El agua pasa hacia el interior del huevo ya que su concentración es menor, lógicamente, en el líquido interno de la clara que en el agua corriente del vaso No deja de resultar curiosa la salida del contenido del huevo por el agujero superior. Al final del proceso se puede comprobar como lo que queda en el interior del huevo tiene una textura “aguada” y menos viscosa que la clara original. 63 CURSO DE FORMACIÓN PROFESORES DE SECUNDARIA. UBU 2011 ____________________________________________________________________________ UN HUEVO TRANSPARENTE Descripción Ver el interior de un huevo sin necesidad de romper la cáscara. Materiales: Vaso de precipitados Un huevo crudo Vinagre Método Introduciremos, con cuidado, el huevo en el vaso de precipitados y verteremos vinagre hasta cubrir el huevo. Esperaremos unos días y... El resultado obtenido es... Veremos el huevo sin cáscara, apreciando tanto su clara como la yema. Teoría Se ha producido la típica reacción de un ácido (el acético) sobre el carbonato cálcico, que constituye básicamente la estructura de la cáscara del huevo. El calcio se deposita en el fondo en forma de sal insoluble y, además, se produce un burbujeo de dióxido de carbono. Llama la atención que la frágil membrana que protege al huevo sea más resistente al ácido que la dura cáscara. Es aconsejable, aunque no imprescindible, que el vinagre sea de vino blanco lo cual nos facilitará ver mucho mejor la estructura interna del huevo. También es aconsejable cambiar varias veces el vinagre conforme se vaya enturbiando el líquido o depositando el calcio en el vaso. Una experiencia similar puede hacerse con vinagre y con huesos de pollo: al cabo de unos días aparecerán flexibles al haber perdido el calcio que les daba la rigidez característica. 64 Mª JULIA ARCOS MARTÍNEZ . LA CIENCIA FÁCIL. _____________________________________________________________________________ EL HUEVO Y LA BOTELLA Tema Presiones. Interés general. Los alumnos de Bachillerato deben ser capaces de apreciar la ciencia que hay detrás de las reacciones. Descripción Provocar que un huevo se introduzca en una botella cuya boca es de menor tamaño que el diámetro menor del huevo. Material • Botella o frasco de vidrio • Algodón • Cerillas • Pinza metálica • Huevo duro sin cáscara Método En primer lugar habrá que buscar un frasco o botella cuya boca sea de tamaño similar al de la sección transversal del huevo, pero un poquito menor para que impida que el huevo se introduzca en ella. Es imprescindible que el borde del frasco no tenga ninguna raspadura o rotura que pudiera permitir el paso de aire al taparlo. Con el frasco y el huevo preparados, se coge el algodón (se le puede empapar con algo de alcohol) con las pinzas, se prende fuego y rápidamente se introduce dentro del frasco. A continuación se coloca el huevo en la boca del frasco ajustándolo bien. El huevo se introducirá en la botella. Si el movimiento de entrada no es excesivamente rápido veremos que la elasticidad del huevo cocido permite que éste se “adelgace” al pasar por el cuello del frasco y que recupere después su tamaño original. Por contra, si la entrada es muy rápida es muy probable que el huevo quede parcialmente destrozado. Teoría La combustión del algodón provoca la emisión de gases calientes. Conforme desciende la temperatura de éstos al entrar en contacto con el vidrio, desciende su presión. Al hacerse ésta inferior a la atmosférica exterior, el huevo se ve impelido hacia el interior a causa de esa diferencia de presiones. Otra experiencia sencilla, y muy conocida, en que también hay un efecto de succión por diferencia de presiones puede hacerse con un plato de agua en el que flote un trocito de corcho al que hayamos pegado –como si fuera un mástil- una cerilla. Encendemos ésta y acto seguido la cubrimos con un vaso vacío boca abajo. La cerilla se apagará a los pocos instantes, pero observaremos que entra agua desde el plato al interior de la cámara formada por el vaso invertido. 65