TEMA 10. METABOLISMO CELULAR. ENZIMAS • 1
Anuncio

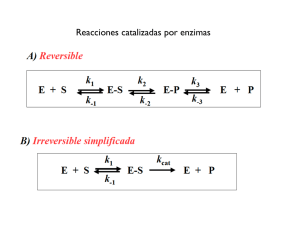
TEMA 10. METABOLISMO CELULAR. ENZIMAS • • • 1. Características del metabolismo celular. • ATP • Tipos de metabolismo 2. El control del metabolismo • Biocatalizadores y hormonas • Actividad de los catalizadores 3. Enzimas 1. Definición. 2. Características 3. Tipos según su estructura 4. Nomenclatura (clasificación) 5. Reacción enzimática. Centro activo 6. Actividad enzimática. 7. Especificidad de los enzimas 8. Vitaminas 1. CARACTERÍSTICAS DEL METABOLISMO CELULAR • • • • • • • • Definición: El metabolismo es el conjunto de reacciones químicas que se producen en el interior de las células y que conducen a la transformación de unas biomoléculas en otras. Las distintas reacciones químicas del metabolismo se denominan vías metabólicas y las moléculas que intervienen se llaman metabolitos. Todas las reacciones del metabolismo están reguladas por enzimas, que son específicas para cada metabolito inicial o sustrato y para cada tipo de transformación. Las sustancias finales de una vía metabólica se denominan productos. Las conexiones existentes entre diferentes vías metabólicas reciben el nombre de metabolismo intermediario. Se pueden considerar tres fases en el metabolismo: Catabolismo: Transformación de moléculas orgánicas complejas en otras más sencillas, con liberación de energía que se almacena en ATP. Anabolismo: Síntesis de moléculas orgánicas complejas a partir de otras más sencillas. Se necesita suministrar energía, en forma de ATP Anfibolismo: (una fase intermedia). Procesos en los que se almacena gran cantidad de energía (para los posteriores procesos anabólicos) ¿Qué se necesita para el metabolismo? El ATP Puede actuar como molécula energética, al ser capaz de almacenar o ceder energía gracias a sus dos enlaces éster-fosfóricos que son capaces de almacenar cada uno de ellos, 7,3 kcal/mol. ATP + H2O ADP + Pi + energía (7,3 kcal/mol) ADP + H2O AMP + Pi + energía (7,3 kcal/mol) También se pueden dar las reacciones inversas (almacén de energía) La síntesis de ATP puede realizarse por dos vías: 1. Fosforilación a nivel de sustrato. Síntesis de ATP gracias a la energía que se libera de una biomolécula al romperse uno de sus enlaces ricos en energía, (ocurre en algunas reacciones de la glucólisis y del ciclo de Krebs). Las enzimas que regulan estos procesos se denominan quinasas. 2. Fosforilación en el transporte de electrones. Mediante enzimas del grupo de las ATP-sintetasas existentes en las crestas de las mitocondrias (fosforilación oxidativa) o en los tilacoides de los cloroplastos (fotofosforilación), cuando dichas enzimas son atravesadas por un flujo de protones (H+ ). Tipos de metabolismo Las células se encuentran siempre en un proceso constante de autodestrucción y autoregeneración. • El metabolismo forma una unidad, aunque se estudia fragmentado en rutas o vías metabólicas. • Las rutas metabólicas no son independientes entre si , poseen encrucijadas comunes. • Un mismo metabolito común a dos rutas podrá seguir por una o por otra en función de las condiciones celulares. TIPO DE ORGANISMO FUENTE DE ENERGÍA FUENTE DE C ORGANISMOS Fotolitótrofo Luz solar CO2 Vegetales. Bact. fotosintéticas Fotoorganótrofo Luz solar Comp. orgánicos Bacterias purpúreas Quimiolitótrofo Reacciones redox CO2 Bacterias desnitrificantes Quimioorganótrofo Reacciones redox Comp. orgánicos Animales y Hongos 2. CONTROL DEL METABOLISMO En las células se producen constantemente numerosos tipos de reacciones químicas: unas están encaminadas a sintetizar nuevas moléculas, y otras, a degradar las ya existentes. En todas las reacciones químicas, en la que los sustratos son transformados en productos, se debe alcanzar un estado intermedio para que se dé la reacción. Este paso intermedio, que requiere un aporte de energía, recibe el nombre de estado de transición, y en él hay tantas posibilidades de que las moléculas acaben formando el producto como de que retrocedan. En el metabolismo existe un fuerte control de las reacciones químicas, en el cual se regula el tipo de reacción a activar y el momento adecuado. Para ello: 1. Control bioquímico. Las enzimas (o biocatalizadores), son las responsables de acelerar las reacciones (disminuyendo la energía de activación). 2. Control hormonal . Las hormonas segregadas por las glándulas , actúan como mensajeros químicos en la estructura diana , regulando el metabolismo 3. ENZIMAS Para acelerar una reacción química también hay dos soluciones: 1. Calentar los reactivos. 2. Añadir un catalizador, En los seres vivos, un aumento de temperatura podría provocar la muerte, por lo que se sigue el segundo mecanismo, es decir, el concurso de catalizadores biológicos o biocatalizadores. Las moléculas que desempeñan esta función son las enzimas 1. Definición. • • • • Las enzimas son los catalizadores de las reacciones biológicas. Actúan rebajando la energía de activación, y por tanto acelerando la velocidad de la reacción, la cual se puede medir por la cantidad de producto que se forma por unidad de tiempo. Exceptuando las ribozimas, son proteínas globulares, solubles en agua, que se difunden bien en los líquidos orgánicos, y que pueden actuar a nivel intracelular, es decir, en el interior de la célula donde se han formado, o a nivel extracelular, en la zona donde se segregan, como sucede con las enzimas digestivas. Las ribozimas son unos ARN capaces de catalizar a otros ARN, quitándoles o añadiéndoles nucleótidos, sin consumirse ellos mismos. Se considera que en la primera materia viva la función catalítica la realizaba el ARN, luego aparecieron las proteínas, en las que se delegó la función enzimática, y los ADN, en los que se delegó, por su mayor estabilidad, la función de almacenar la información 2. Características • Incluso en cantidades muy pequeñas, aceleran la reacción. No se obtiene más producto, sino la misma cantidad en menos tiempo. • No se consumen durante la reacción biológica. • Son muy específicas. Pueden actuar en una reacción determinada sin alterar otras. • Actúan siempre a temperatura ambiente, la temperatura del ser vivo. • Son muy activas. Algunas consiguen aumentar la velocidad de reacción más de un millón de veces, muy superior a los catalizadores no biológicos. • Presentan un peso molecular muy elevado. • Dada su naturaleza proteica, su síntesis implica una codificación genética. 3. Estructura de las enzimas. Son proteínas globulares con tres tipos de aminoácidos: estructurales (no enlaces con sustrato) , fijación y catalizadores (sí enlaces con sustrato) . Dependiendo de la naturaleza de la enzima tenemos 4. Nomenclatura 1. NOMENCLATURA ANTIGUA: SUFIJO -asa • Nombre de la fuente u origen del enzima: Pancreasa • Nombre del sustrato: Proteasa • Tipo de reacción catalizada: Hidrolasa 2. NOMENCLATURA ACTUAL: Enzyme Commission [E.C.] de la IUBMB • Clasificación de enzimas (6 clases) • Asignación de código E.C.: 1.1.1.1 • Nombre sistemático: Sustrato:Cosustrato Tipo de Reacción -asa Etanol:NAD+ Oxidorreductasa Clases de enzimas (clasificación actual) CLASE TIPO DE REACCION CATALIZADA 1. OXIDO-REDUCTASAS Transferencia de electrones 20 subclases Sred + S’ox Sox + S’red 2. TRANSFERASAS Transferencia de grupos 9 subclases S-grupo + S’ S’-grupo + S 3. HIDROLASAS Rotura hidrolítica de enlaces 11 subclases A-B + H2O A-H + B-OH 4. LIASAS Rotura de enlaces A-B A+B 7 subclases Salida de grupos CX-CY C=C + X-Y Adición a dobles enlaces C=C + XY CX-CY 5. ISOMERASAS Cambios internos 6 subclases Transferencias internas de grupos 6. LIGASAS Formación de enlaces mediante reacciones de 5 subclases condensación con gasto de energía (ATP) 5. Reacción enzimática 1. La enzima (E) actúa fijando al sustrato en su superficie (adsorción) mediante enlaces débiles 2. Se forma el complejo enzíma-sustrato (ES). Se generan tensiones que debilitan los enlaces del sustrato, por lo que para llegar al estado de transición del complejo enzima-sustrato, (complejo activado) se requiere mucha menos energía que para llegar al estado de transición del sustrato solo. 3. Se liberan la enzima intacta (E) y el producto (P) El centro activo de los enzimas • La actividad enzimática se inicia con la formación del complejo ES. • • Esta unión se realiza gracias a los radicales de algunos pocos aminoácidos que establecen enlaces con el sustrato (y con el grupo prostético si lo hay), fijándolo y luego rompiendo alguno de sus enlaces. La región de la enzima que se une al sustrato recibe el nombre de centro activo. Características del centro activo • Es una parte muy pequeña del volumen total de la enzima. • Tienen una estructura tridimensional en forma de hueco que facilita encajar al sustrato. • Están formados por aminoácidos lejanos en la secuencia polipeptídica, que debido a los repliegues de ésta, quedan próximos. • Los radicales de estos aminoácidos presentan afinidad por el sustrato, lo atraen y establecen enlaces débiles con él. • Esto facilita que, una vez roto alguno de sus enlaces, los productos resultantes se puedan separar con facilidad del centro activo. 6. Actividad enzimática Los factores que pueden influir en la actividad enzimática son los siguientes: 1. Influencia de la temperatura. • Si a una reacción enzimática se le suministra energía calorífica, las moléculas aumentan su movilidad y el número de encuentros moleculares, por lo que aumenta la velocidad en que se forma el producto. • Existe una temperatura óptima para la cual la actividad enzimática es máxima. Si la temperatura aumenta, se dificulta la unión enzima-sustrato y a partir de cierta temperatura la enzima se desnaturaliza, pierde su estructura terciaria y cuaternaria si la tiene y, por tanto, pierde su actividad enzimática 2. Influencia del pH. • Las enzimas presentan dos valores límite de pH entre los cuales son eficaces; traspasados estos valores, las enzimas se desnaturalizan y dejan de actuar. • Entre los dos límites existe un pH óptimo en el que la enzima presenta su máxima eficacia. • El pH óptimo está condicionado por el tipo de enzima y de sustrato, debido a que el pH influye en el grado de ionización de los radicales del centro activo de la enzima y también de los radicales del sustrato. • Las variaciones de pH provocan cambios en las cargas eléctricas, alterando la estructura terciaria del enzima y por tanto, su actividad. 3. Inhibidores. • Los inhibidores son sustancias que disminuyen la actividad de una enzima o bien impiden completamente la actuación de la misma. • Pueden ser perjudiciales o beneficiosos como, por ejemplo, la penicilina, que es un inhibidor de las enzimas que regulan la síntesis de la pared bacteriana, por lo que es útil contra las infecciones bacterianas, y el AZT, que es un inhibidor de la transcriptasa inversa, por lo que retrasa el desarrollo del SIDA. 4. Concentración del sustrato • A mayor concentración del sustrato, a una concentración fija de la enzima se obtiene la velocidad máxima. Después de que se alcanza esta velocidad, un aumento en la concentración del sustrato no tiene efecto en la velocidad de la reacción. 5. Concentración de la enzima • Siempre y cuando haya sustrato disponible, un aumento en la concentración de la enzima aumenta la velocidad enzimática hacia cierto límite. 7. Especificidad de los enzimas Entre la enzima y el sustrato existe una alta especificidad. Solo se unen a la enzima los sustratos que puedan establecer algún tipo de enlace entre ellos. Esta especificidad se representa por distintos modelos: - 1. Modelo de complementariedad «llave (sustrato) - cerradura (enzima)» - 2. Ajuste inducido. En la actualidad se ha visto que algunas enzimas, al establecer los enlaces con el sustrato, modifican la forma de sus centros activos para adaptarse mejor al sustrato, es decir, solamente son complementarias después de haberse unido a él, es el llamado acoplamiento inducido (como el guante (enzima) se adapta a la mano (sustrato)). • • • • • • • La especificidad puede darse en varios grados. Especificidad absoluta. Se da cuando la enzima sólo actúa sobre un sustrato, por ejemplo, la ureasa sólo actúa sobre la urea. Especificidad de grupo. Se da cuando la enzima reconoce un determinado grupo de moléculas, por ejemplo, la β-glucosidasa que actúa sobre todos los β-glucósidos Especificidad de clase. Es la menos específica, dado que la actuación de la enzima no depende del tipo de molécula, sino del tipo de enlace Por ejemplo, las fosfatasas separan los grupos fosfato de cualquier tipo de molécula. 8. Vitaminas Son moléculas muy variadas que pueden pertenecer a distintos grupos de principios inmediatos. Algunas son indispensables en la dieta, ya que no pueden ser sintetizadas por el organismo (excepto la B5). Otras vitaminas son necesarias para la actuación de determinados enzimas, ya que funcionan como coenzimas que intervienen en distintas rutas metabólicas y , por ello, una deficiencia en una vitamina puede originar importantes defectos metabólicos. Las cantidades necesarias son mínimas (una dieta variada garantiza las necesidades del organismo) Las vitaminas se clasifican según su solubilidad en agua: 1. Vitaminas hidrosolubles. • Actúan como coenzimas o precursores de coenzimas. • Son las del complejo B o la vitamina C 2. Vitaminas liposolubles. • No son solubles en agua y si en disolventes no polares. • Son lípidos insaponificables. • No suelen ser cofactores o precursores. • Son las vitaminas A,D,E y K FUNCIONES Enfermedades carenciales C (ácido ascórbico) Coenzima de algunas peptidasas. Interviene en la síntesis de colágeno Escorbuto B1 (tiamina) Coenzima de las descarboxilasas y de las enzima que transfieren grupos aldehidos Beriberi B2 (riboflavina) Constituyente de los coenzimas FAD y FMN Dermatitis y lesiones en las mucosas B3 (ácido pantoténico) Constituyente de la CoA Fatiga y trastornos del sueño B5 (niacina) Constituyente de las coenzimas NAD y NADP Pelagra B6 ( piridoxina) Interviene en las reacciones de transferencia de grupos aminos. Depresión, anemia B12 (cobalamina) Coenzima en la transferencia de grupos metilo. Anemia perniciosa Biotina Coenzima de las enzimas que transfieren grupos carboxilo, en metabolismo de aminoácidos. Fatiga, dermatitis... A (retinol) Ciclo visual, crecimiento, protección y mantenimiento del tejido epitelial Ceguera nocturna, xeroftalmia, desecación epitelial D Metabolismo del Ca2+, esencial en el crecimiento y mantenimiento de los huesos Raquitismo, deformidades oseas VITAMINAS