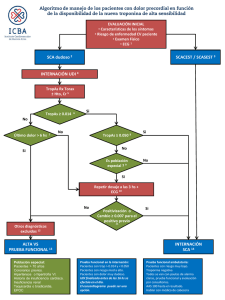
Español
Anuncio

Med Intensiva. 2010;34(6):397–417 www.elsevier.es/medintensiva ARTÍCULO ESPECIAL Indicadores de calidad en el sı́ndrome coronario agudo para el análisis del proceso asistencial pre e intrahospitalario F. Felices-Abada,, J. Latour-Pérezb, M.P. Fuset-Cabanesc, M. Ruano-Marcoc, J. Cuñat-de la Hozc, F. del Nogal-Sáezd y Grupo Ariam~ a Servicio de Medicina Intensiva, Hospital Universitario Reina Sofı́a, Murcia, España Servicio de Medicina Intensiva, Hospital General Universitario, Elche, Alicante, España c Servicio de Medicina Intensiva, Hospital Universitario La Fe, Valencia, España d Servicio de Medicina Intensiva, Hospital Universitario Severo Ochoa, Madrid, España b Recibido el 12 de febrero de 2010; aceptado el 25 de febrero de 2010 Disponible en Internet el 6 de mayo de 2010 PALABRAS CLAVE Indicadores de calidad; Sı́ndrome coronario agudo; Enfermo coronario crı́tico KEYWORDS Quality indicators; Acute coronary syndrome; Critically ill coronary patient Resumen Se presenta un mapa de 27 indicadores para medir la calidad de la asistencia prestada a los pacientes con sı́ndrome coronario agudo (SCA) que son atendidos en el ámbito pre e intrahospitalario. Se incluyen indicadores de proceso técnicos (registro de los intervalos asistenciales, realización del ECG, monitorización y acceso venoso, evaluación de los riesgos pronóstico, hemorrágico y de mortalidad intrahospitalaria, empleo de técnicas de reperfusión y realización de ecocardiografı́a), indicadores de proceso farmacológicos (antiagregación plaquetaria, anticoagulación, trombolisis, administración de beta-bloqueantes, inhibidores de conversión de la angiotensina e hipolipemiantes) e indicadores de resultado (escalas de calidad de la atención prestada y mortalidad). & 2010 Elsevier España, S.L. y SEMICYUC. Todos los derechos reservados. Quality indicators in the acute coronary syndrome for the analysis of the pre- and inhospital care process Abstract We present a map of 27 indicators to measure the care quality given to patients with acute coronary syndrome attended in the pre- and hospital area. This includes technical process indicators (registration of care intervals, performance of electrocardiogram, monitoring and vein access, assessment of prognostic risk, hemorrhage and in-hospital mortality, use of reperfusion techniques and performance of echocardiograph), pharmacological process indicators (platelet receptors inhibition, anticoagulation, thrombolysis, beta-blockers, Autor para correspondencia. Correo electrónico: [email protected] (F. Felices-Abad). El listado de miembros de Grupo Ariam se presenta en el Anexo. ~ 0210-5691/$ - see front matter & 2010 Elsevier España, S.L. y SEMICYUC. Todos los derechos reservados. doi:10.1016/j.medin.2010.02.009 398 F. Felices-Abad et al angiotensin converting inhibitors and lipid lowering drugs) and outcomes indicators (quality scales of the care given and mortality). & 2010 Elsevier España, S.L. and SEMICYUC. All rights reserved. Introducción El uso de indicadores de calidad (IC) ha demostrado su utilidad como herramienta para medir la práctica asistencial y la efectividad de medidas establecidas para la mejora de la misma, permitiendo identificar y diseminar las mejores prácticas1–6. Existen antecedentes, en nuestro paı́s y en el ámbito internacional, del uso de IC como herramienta para la mejora. La Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC) elaboró IC en el enfermo crı́tico7 y la Joint Commission on Accreditation of Healthcare Organizations (JCAHO) los ha desarrollado para evaluar la acreditación de centros sanitarios mediante el cumplimiento de estándares de calidad preestablecidos. Estudios recientes manifiestan que la monitorización de estos indicadores en determinadas áreas, tales como el infarto agudo de miocardio, la insuficiencia cardiaca o la neumonı́a, sirve para demostrar una mejora de la calidad asistencial a lo largo del tiempo en diferentes hospitales, especialmente en aquellos con peores resultados basales5,6,8. Otros estudios ponen de manifiesto la exactitud de los indicadores como elemento para la evaluación y mejora de la calidad en determinados ámbitos9–12. Al elaborar los IC en el sı́ndrome coronario agudo (SCA), el objetivo primario del Proyecto ARIAM, del Grupo de Trabajo de Cuidados Intensivos Cardiológicos de la SEMICYUC, ha sido el desarrollo consensuado de indicadores clave en la atención del enfermo crı́tico con enfermedad coronaria aguda, cuestión importante si se recuerda que esta patologı́a representa alrededor del 50% de los ingresos en un Servicio de Medicina Intensiva (SMI) polivalente. Como objetivo secundario nos planteamos el facilitar a todo el sistema sanitario que interviene en la atención (prehospitalario, urgencias, SMI y Tabla 1 planta de hospitalización) un instrumento potente y fiable para la evaluación y desde aquı́ sentar las bases para abordar objetivamente el problema de la variabilidad en la atención al SCA, tan frecuente y de tanta transcendencia, en términos de morbimortalidad. Se estima que solamente entre el 10–20% de todas las prácticas médicas están basadas en la evidencia cientı́fica13 y además, con frecuencia, la adherencia a las guı́as de práctica clı́nica es escasa14. Como valores añadidos a lo anteriormente expresado, consideramos que el análisis con IC introduce métodos de evaluación comunes que permiten unificar la medida, evaluar comparativamente (benchmarking), ası́ como disponer de información que permita el desarrollo de planes de calidad (datos cuantitativos, objetivos, fiables y válidos) y disponer de un sistema que garantice la calidad total de la asistencia del enfermo crı́tico con SCA. En definitiva, este paso dado por el Proyecto ARIAM, pretende conformar un sistema básico de trabajo en evaluación y mejora de la calidad asistencial, que nos permitirá medir y evaluar de forma periódica y planificada (cortes anuales), los aspectos más relevantes en la asistencia al SCA. Caracterı́sticas de los IC Las caracterı́sticas de un sistema de monitorización basado en IC, se expresan de forma resumida en la tabla 1. Apartados y definición de los indicadores Según Donabedian la evaluación de la calidad asistencial puede basarse en el análisis de la estructura (análisis de Caracterı́sticas de un sistema de monitorización de la calidad asistencial Sistema de monitorización Caracterı́sticas Indicadores de calidad Finalidad de la monitorización Constituyen la unidad básica de un sistema de monitorización Son instrumentos de medida que indican la presencia de un fenómeno o suceso y su intensidad Actúan como señales de alarma Deben ser medibles, fiables (reproducibles), objetivos, aceptables, relevantes y basados en la evidencia Han de reflejar la realidad Han de ser útiles para que puedan permitir mejorar la calidad Han de ser válidos para cumplir el objetivo de identificar situaciones en las que se podrı́a mejorar la calidad Han de ser sensibles para detectar todos los casos en que se produce una situación o problema real de calidad Han de ser especı́ficos para detectar sólo aquellos casos en que existen problemas de calidad Deben ser compatibles con los indicadores de referencia internacionales Identificar desviaciones de la práctica estandarizada Identificar problemas u oportunidades de mejora potencial Indicadores de calidad en el SCA para el análisis del proceso asistencial calidad de los medios), el proceso (análisis de la calidad de los métodos) o los resultados (análisis de la calidad de los resultados)15. Las variaciones en la calidad de la estructura o del proceso revertirán en los resultados, de la misma manera que variaciones en los resultados deben reflejar una variabilidad en la calidad de la estructura y del proceso. Generalmente se asume que los datos relacionados con la evaluación del proceso son más sensibles como IC que los que se relacionan directamente con los resultados, ya que un resultado adverso no siempre se produce cuando existen errores en el proceso. Los indicadores de estructura miden cómo está organizado y equipado el sistema de salud, observando si los recursos están disponibles y en condiciones para facilitar la atención al usuario. Evalúan los recursos (humanos, materiales, tecnológicos y financieros), la estructura organizativa y cómo diferentes servicios o unidades funcionales se integran en el hospital16. Los indicadores de proceso hacen referencia a qué hacemos o dejamos de hacer, fundamentalmente en el ámbito clı́nico, pero también pueden enfocarse a otros aspectos asistenciales relacionados con el paciente o con sus familiares. El seguimiento de la evidencia cientı́fica debe guiar nuestras actuaciones tanto por acción como por omisión. Ası́, la mayorı́a de los indicadores elaborados evaluarı́an el proceso. A este respecto es importante destacar que no todo lo que hacemos tiene suficiente evidencia cientı́fica, y que además esta es variable en el tiempo. Organizaciones como la Joint Commission on Accreditation of Healthcare Organizations (JCAHO) y el Institute for Healthcare Improvement han establecido que la manera de mejorar la calidad en la atención del paciente crı́tico debe basarse en asegurar la calidad del proceso estableciendo medidas que permitan valorar de forma directa aquello que hacemos17. Los indicadores de resultados tienen limitaciones, por la influencia de muchos factores, no siempre modificables por los profesionales, planteando algunos problemas en la valoración de la calidad. Los resultados tras un SCA dependen de factores propios de los pacientes (edad, sexo, factores de riesgo previo, comorbilidades), ası́ como del tiempo de atención, gravedad, tratamientos instaurados, etc. Por tanto, los resultados en ocasiones pueden ser fruto del azar o de la naturaleza, más que de la asistencia proporcionada18. Por otro lado se plantea en qué momento medirlos para que reflejen con mayor precisión el valor de la asistencia prestada. La medición precoz puede adolecer de tiempo para percibir el valor de lo realizado. En una medición tardı́a, el resultado puede no depender de la asistencia, sino de otros aspectos y en todo caso, hay que contar con las posibilidades reales que tenemos de seguimiento de los pacientes. Con una visión integradora y realista, los indicadores de resultados propuestos son de mortalidad (precoz en el SMI y hospitalaria). La monitorización de indicadores relacionados con la seguridad del enfermo facilita el reconocimiento y permite identificar muchas de las condiciones latentes y efectos adversos de los fármacos administrados, tanto por comisión como por omisión, que pueden ocurrir en los SMI. Además puede 399 identificar las causas y factores responsables mediante el registro de los mismos, la comparación de resultados y el desarrollo de estrategias encaminadas a disminuir el riesgo y mejorar la calidad en la atención de nuestros pacientes1,19–21. Metodologı́a de trabajo Para diseñar un mapa de IC en la asistencia urgente al SCA, se formó un grupo de trabajo integrado por los autores del presente documento, que empezaron a trabajar a partir de una propuesta que uno de ellos habı́a realizado un año antes. Se manejaron diversos documentos relativos al control de la calidad asistencial mediante indicadores, redactados por otras sociedades o expertos en el tema, se revisaron guı́as clı́nicas, protocolos y consensos en el ámbito del SCA, documentos que han quedado reflejados en la bibliografı́a. El diseño de cada indicador contempló la descripción de los diferentes apartados que aseguran su validez y fiabilidad siguiendo una plantilla de uso habitual para expresar los IC, y que es el modelo que se ha seguido para desarrollar los 27 indicadores propuestos. Estos apartados se definen en la tabla 2. En el grupo de trabajo se intercambiaron documentos y se fueron construyendo borradores sucesivos que se enviaron, discutieron, corrigieron y ampliaron progresivamente por correo electrónico y se celebraron 2 reuniones presenciales. Conseguido un manuscrito provisional, se remitió a finales de septiembre de 2009 a 4 consultores, expertos en el campo de la medicina intensiva, que realizaron sus enmiendas y las discutieron entre ellos y los autores, para luego incorporar al documento las correcciones que se consideraron oportunas. Asimismo, se eliminaron por consenso algunos de los indicadores. Resultados De acuerdo con las bases expuestas previamente, se han elaborado 25 indicadores de proceso para evaluar la calidad de la asistencia prestada a los pacientes con SCA atendidos en los servicios de urgencias (extrahospitalarios y hospitalarios), en el propio SMI y en la planta de hospitalización y 2 indicadores de resultado. Los indicadores de proceso se han clasificado en 2 grupos (técnicos y farmacológicos) para diferenciar con claridad los procedimientos no farmacológicos de la administración de fármacos. Estos indicadores se enuncian en la tabla 3. Atención prehospitalaria Es aquella que se realiza fuera del hospital y en el intervalo de tiempo trascurrido desde el contacto presencial del paciente con el sistema sanitario (médico de familia, centro de salud o SEM 112) y la llegada al hospital. 400 F. Felices-Abad et al Tabla 2 Plantilla utilizada para los indicadores de calidad, con revisión de términos que se utilizan al estructurar los indicadores Apartado Definición Nombre Dimensión o área de aplicación Descriptivo breve Aspecto relevante de la atención prestada. Caracterı́stica o atributo de la atención asistencial que se quiere destacar, para que ésta sea considerada de calidad. Riesgo, efectividad, eficacia, eficiencia, adecuación, continuidad asistencial, accesibilidad Justificación Causa o motivo fundamental por el cual se define el indicador Explica el sentido de la medida que se va a realizar o la utilidad del indicador como medida de calidad. Se relaciona con la validez, si lo que vamos a medir tiene sentido y servirá para identificar áreas de mejora asistenciales Fórmula/formato Expresión matemática que refleja la forma de realizar la medición. Generalmente se medirá en forma de porcentaje, pero también puede ser una media, mediana o un número absoluto Explicación de términos Definición de términos de la fórmula que pueden estar sujetos a diversas interpretaciones, para evitar interpretaciones ambiguas que fueran consideradas de manera diferente por quienes tienen que aplicarlos Población Identificación de la unidad de estudio que va a ser objeto de medida (enfermos, exploraciones complementarias o tratamientos). En algunos casos puede ser necesario introducir criterios de exclusión en la población definida. No siempre será necesario, ni quizá factible, medir sobre el total de la población definida, por lo que se puede recurrir a la revisión de una muestra Tipo Se refiere a la clasificación de indicadores De estructura: aspectos relacionados con recursos tecnológicos, humanos y organizativos De proceso: evalúan la manera en que se desarrolla la práctica asistencial, realizada con los recursos disponibles, protocolos y evidencia cientı́fica De resultado: miden las consecuencias del proceso asistencial, en términos de complicaciones, mortalidad, ocasiones perdidas, fallos de circuitos, calidad de vida, etc. Fuente de datos Estándar Comentarios Define el origen y la secuencia de la información necesaria para obtener los datos a evaluar Define el nivel deseado para el cumplimiento del indicador. Representa el nivel de buena práctica exigible dada la evidencia cientı́fica y por ello se basa en guı́as clı́nicas, consensos u opinión de expertos. Habitualmente se expresa en porcentaje Son reflexiones sobre la validez del indicador o sobre posibles factores de confusión que se han de tener en cuenta a la hora de interpretar los resultados. También incluye referencias bibliográficas Indicador N.1 1. Registro del intervalo del tiempo de acceso a la asistencia. Tiempo desde el comienzo del dolor/sı́ntomas hasta el primer contacto con el sistema sanitario Dimensión/área. Adecuación, efectividad, eficacia, accesibilidad. Justificación. El diagnóstico y el tratamiento precoz en el SCA son fundamentales para la disminución de la morbimortalidad. Existe un elevado riesgo de muerte durante la fase aguda del SCA y ası́, aproximadamente un 33% de los pacientes con infarto de miocardio en curso fallecen antes de llegar al hospital22. Este indicador mide el tiempo desde inicio de sı́ntomas (dolor torácico/sı́ntomas que movilizan al paciente) hasta la primera atención sanitaria por el médico de familia, centro de salud o por el sistema de emergencias (SEM 112). Formato. Tiempo (minutos) en media, mediana y p 25 y 75. Explicación de términos. El intervalo dolor/sı́ntomas hasta el primer contacto con el sistema sanitario es independiente de la bondad de la estructura asistencial. Podrı́a modularlo la educación sanitaria pero, como es obvio, depende fundamentalmente del paciente y su entorno. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA sin exclusiones y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de cabecera, Centro de Salud o SEM 112). Exclusiones. Pacientes que acuden al hospital por medios propios y los que procedan de planta de hospitalización del propio centro. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (se debe medir en todos los casos). Indicador N.1 2. Demora en la realización del ECG Dimensión/área. Riesgo, efectividad, eficacia, adecuación, accesibilidad, continuidad. Indicadores de calidad en el SCA para el análisis del proceso asistencial Tabla 3 401 Indicadores de calidad asistencial de proceso y resultados en pacientes con SCA ATENCION PREHOSPITALARIA Indicadores de proceso (técnicos) 1. Registro del intervalo del tiempo de acceso a la asistencia 2. Demora en la realización del electrocardiograma (ECG) 3. Monitorización 4. Colocación de un acceso venos 5. Registro de los intervalos de asistencia hasta la llegada a Urgencias hospitalarias Indicadores de proceso (farmacológicos) 6. Antiagregación plaquetaria con ácido acetil salicı́lico (AAS) 7. Administración de vasodilatadores coronarios: nitroglicerina sublingual (NTG sl) 8. SCACEST. Trombolisis realizada por el SEM 112 en las primeras 2 h de evolucion del infarto Indicadores de resultado 9. Escala de calidad de la atención prehospitalaria prestada ATENCION EN URGENCIAS HOSPITALARIAS Indicadores de proceso (técnicos) Indicadores n.1 2 a 4, 5 a 7 y 9, evaluados en esta área asistencial para pacientes que acceden al hospital por medios propios Indicadores de proceso (farmacológicos) 10. Realización de trombolisis precoz en Urgencias a pacientes con SCACEST cono2 h evolución del IAM ATENCIÓN EN EL SERVICIO DE MEDICINA INTENSIVA (SMI) Indicadores de proceso (técnicos) 11. Evaluación del riesgo pronóstico del proceso SCACEST y SCASEST 12. Evaluación del riesgo hemorrágico 13. Evaluación del riesgo de mortalidad intrahospitalaria (Escala GRACE) 14. Empleo de técnicas de reperfusión en pacientes con SCACEST 15. Tiempo puerta -aguja para pacientes trombolisados 16. ACTP primaria. Registro de los tiempos de demora hasta la realización de la técnica 17. Realización de coronariografı́a en pacientes inestables graves con SCASEST 18. Realización de Ecocardiografı́a Indicadores de proceso (farmacológicos) Indicador n1 6 re-evaluado en el SMI para todos los pacientes con SCA 19. Administración de tienopiridinas 20. Antiagregación plaquetaria con inhibidores del receptor de la glicoproteina IIb/IIIa en pacientes con SCASEST de alto riesgo 21. Anticoagulación 22. Administración de Beta-bloqueantes (BB) en pacientes con SCA 23. Administración de inhibidores de la enzima de conversión de la angiotensina (IECA) 24. Administración de hipolipemiantes ATENCIÓN EN PLANTA DE HOSPITALIZACIÓN Indicadores de proceso (técnicos) 25. Realización de coronariografı́a electiva en el SCASEST de alto riesgo estabilizado con tratamiento farmacológico 26. Realización de coronariografı́a electiva en el SCACEST tratado con trombolisis y reperfundido Indicadores de proceso (farmacológicos) Indicadores n.1 6,18, 19 y 21 a 24 re-evaluados en esta área asistencial INDICADORES DE RESULTADO 27. Mortalidad intrahospitalaria: en SCASEST y en SCACEST SCA: sı́ndrome coronario agudo; SCACEST: sı́ndrome coronario agudo con elevación del segmento ST; SCASEST: sı́ndrome coronario agudo sin elevación del segmento ST; SEM: servicio de emergencias médicas. Justificación. El ECG es )el centro del diagnóstico y el primer paso en el proceso de toma de decisiones*, por lo que debe de realizarse a todo paciente con sospecha clı́nica de padecer un dolor torácico de origen isquémico (SCA) en menos de 10 min desde el contacto del paciente con la primera asistencia sanitaria18. Esta prueba es esencial para clasificar a los pacientes como SCA con elevación del segmento ST persistente (SCACEST) o sin elevación de ST (SCASEST). Esta clasificación tiene una importante implicación terapéutica: en el primer caso la eficacia del tratamiento de reperfusión es muy dependiente de la 402 F. Felices-Abad et al rapidez de inicio (eficacia tiempodependiente), mientras que en el SCASEST es necesario iniciar precozmente el tratamiento antiplaquetario y antitrombótico23,28,29,86. Formato. Los tiempos de demora o retraso se miden en minutos como media y mediana (con p 25 y 75). Explicación de términos. La demora en la realización del ECG se contabiliza desde el contacto del sistema sanitario con el paciente hasta la realización del ECG. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA sin exclusiones y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (a todos los pacientes se le debe realizar en menos de 10 min desde el primer contacto médico). Comentarios. El ECG proporciona una indicación directa del estado cardiaco del paciente. Indicador N.1 3. Monitorización Dimensión/área. Adecuación, continuidad, seguridad (sin riesgo), efectividad, eficacia. Justificación. Esta actuación queda enmarcada en )el primer paso en el proceso de toma de decisiones*, por lo que debe realizarse a todo paciente con sospecha clı́nica de padecer un dolor torácico de origen isquémico (SCA), con ECG patológico. La monitorización se iniciará lo antes posible en todos los pacientes para detectar arritmias graves y potencialmente mortales. Formula : realizada en atencion prehospitalaria 100 N:o de pacientes con SCA y monitorizacion o N: de pacientes con SCA Explicación de términos. La monitorización consiste en la colocación de electrodos en el pecho y conexión a un desfibrilador/monitor de cabecera. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA sin exclusiones y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Comentarios. Aproximadamente un tercio de la mortalidad global del SCA ocurre en el ámbito prehospitalario22 y en más del 90% de los casos esta mortalidad precoz es producida por una fibrilación ventricular (FV). Indicador N.1 4. Colocación de un acceso venoso Dimensión/área. Adecuación, continuidad, seguridad (sin riesgo), efectividad, eficacia. Justificación. Esta actuación queda enmarcada en )el primer paso en el proceso de toma de decisiones*, por lo que debe realizarse a todo paciente con sospecha clı́nica de padecer un dolor torácico de origen isquémico (SCA), con ECG patológico ya que frecuentemente es necesario administrar analgesia y/o fármacos intravenosos18. Formula ðbÞ : prehospitalaria 100 N:o de pacientes con SCA y acceso venoso colocado en atencion N:o de pacientes con SCA Explicación de términos. El acceso venoso puede ser periférico o central. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA sin exclusiones y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Indicador N.1 5. Registro de los intervalos de asistencia hasta la llegada a urgencias hospitalarias 5.1. Intervalo dolor/sı́ntomas; llegada a urgencias hospitalarias en pacientes cuyo modo de acceso sea a través del sistema sanitario. 5.2. Intervalo contacto con el sistema sanitario; llegada a urgencias hospitalarias (mismo grupo de pacientes). 5.3. Intervalo dolor/sı́ntomas; llegada a urgencias hospitalarias en pacientes que acceden por medios propios. Dimensión/área. Adecuación, seguridad (sin riesgo), efectividad, eficacia, accesibilidad, continuidad asistencial. Justificación. El diagnóstico y el tratamiento precoz en el SCA son fundamentales para la disminución de la morbimortalidad. El primer indicador mide el tiempo desde el inicio del dolor/sı́ntomas por los que el paciente decide solicitar ayuda hasta la llegada a urgencias del hospital en pacientes que son transportados por ambulancia convencional o por Indicadores de calidad en el SCA para el análisis del proceso asistencial 403 el SEM 112. El segundo mide el tiempo desde el contacto con el sistema sanitario hasta la llegada a urgencias del hospital en el mismo grupo de pacientes. Formato. Tiempo en media, mediana y p 25 y 75. Explicación de términos. Ambulancia convencional: realiza únicamente soporte vital básico (SVB). SEM 112: sistema de emergencias médicas 112 (realiza SVB y soporte vital avanzado-SVA). Medios propios: coche o vehı́culo privado; taxi, autobús y otros. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA. Exclusiones. Ninguna. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (se debe medir en todos los casos). Indicador N.1 6. Antiagregación plaquetaria con AAS Dimensión/área. Riesgo, efectividad. Justificación. Cuatro estudios clı́nicos han demostrado de forma consistente que el AAS reduce la muerte o el IM en pacientes con angina inestable25,47–49. Dos metaanálisis han puesto de manifiesto una reducción desde el 46 hasta el 53% en la tasa de episodios vasculares50 y se ha señalado que una dosis de 75–150 mg de AAS es tan efectiva como dosis mayores. Además, el coste del fármaco es del todo asumible7. Formula : N:o de pacientes con SCA que reciben AAS 100 N:o de pacientes con SCA Explicación de términos. Tras la dosis inicial de carga se continúa con dosis de mantenimiento (100–300 mg/d) durante toda la fase aguda. No se ha demostrado una relación firme entre la dosis y la eficacia. Se recomiendan dosis iniciales de 160–325 mg de AAS sin cubierta entérica para minimizar el retraso en la inhibición de la COX-150. Las hemorragias gastrointestinales aumentan con dosis más altas. En el estudio CAPRIE, la tasa de hemorragias gastrointestinales que condujo a la interrupción del tratamiento con AAS fue del 0,93%51. La hipersensibilidad ()alergia*) al AAS es rara (0,2–0,7%) y más aún las reacciones más graves como el shock anafiláctico28. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Exclusiones. Pacientes con contraindicación por alergia al fármaco. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Indicador N.1 7. Administración de vasodilatadores coronarios: nitroglicerina sublingual (NTG SL) Dimensión/área. Riesgo, efectividad, adecuación. Justificación. El uso de nitratos se basa en consideraciones fisiopatológicas y en la experiencia clı́nica26–28, aunque se carece de ensayos clı́nicos de entidad que sustenten la indicación. Su uso i.v. solo se recomienda si dolor persistente, insuficiencia cardiaca izquierda o HTA, en ausencia de contraindicaciones. Además, el coste de la NTG es del todo asumible7. Formula : prehospitalaria 100 N:o de pacientes con sospecha de SCA que reciben NTG sublingual en atencion N:o de pacientes con SCA Explicación de términos. Administración sublingual (0,4 mg cada 5 min, hasta 3 dosis). Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Exclusiones. Pacientes con contraindicación por hipotensión (PA sistólicao de 90 mmHg); bradicardiao50 l/m; taquicardia 4100 l/m; infarto inferior con afectación del ventrı́culo derecho y aquellos enfermos que han tomado recientemente inhibidores selectivos de la fosfodiesterasa –PDE-5, tales como sildenafilo, vardenafilo o tadalafilo debido al riesgo de vasodilatación profunda y caı́da de la presión arterial en los casos de administración concomitante. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Indicador N.1 8. SCACEST. Trombolisis prehospitalaria realizada por el SEM 112 en las primeras 2 h de evolución del infarto Dimensión/área. Riesgo, efectividad. 404 F. Felices-Abad et al Justificación. La administración precoz de tratamiento trombolı́tico en el SCACEST disminuye el tamaño del infarto, mejora la función ventricular residual y reduce la morbimortalidad29. Durante las 2 primeras horas de evolución, el tiempo hasta la revascularización es crı́tico para salvar miocardio: en ausencia de contraindicaciones, si no se puede realizar precozmente una angioplastia primaria, se debe realizar una trombolisis. Formula : N:o de pacientes con SCACEST; tiempo inicio sı́ntomascontacto SEM 112r2 horas y trombolisis realizada 100 N:o de pacientes con SCACEST Explicación de términos. Tiempo inicio sı́ntomas contacto con el SEM 112. Intervalo de tiempo transcurrido desde el comienzo del dolor hasta la llegada del SEM 112. Trombolisis: administración i.v. de un agente activador tisular del plasminógeno (t-PA), mediante alguna de las pautas establecidas (doble bolo, infusión acelerada o bolo único de TNK-tPA ajustado a peso). Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCACEST (elevación persistente del segmento ST superior a 2 mm en 2 o más derivaciones) atendidos por el SEM 112 y en los que se prevea un tiempo de transporte alto (mayor de 90 min). Exclusiones. Pacientes con contraindicación absoluta o relativa para la trombolisis. Pacientes a quienes se decida ingresar o derivar para realizar angioplastia coronaria transluminal percutánea primaria (ACTP-P). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 70%. Comentarios. Las contraindicaciones absolutas y relativas para la trombolisis se expresan en la tabla 4 29. Indicador N.1 9. Escala de calidad de la atención prehospitalaria prestada Dimensión/área. Efectividad, adecuación, riesgo, continuidad de la asistencia. Justificación. Es una escala de puntuación elaborada por consenso en el Grupo ARIAM24 que recoge las posibles actuaciones básicas en este tipo de pacientes (tabla 5), tanto para IC no farmacológicos (realización de ECG, monitorización, acceso venoso y transporte urgente al hospital), como farmacológicos [administración de antiagregación con AAS, vasodilatadores (NTG sublingual), otra medicación intravenosa como analgésicos opiáceos, oxı́geno si disnea o signos de insuficiencia cardiaca y tranquilizantes en pacientes muy ansiosos]. Formato. Se contabilizan el número de actuaciones básicas en la atención prehospitalaria y se clasifica como atención óptima o inadecuada en función del valor alcanzado. Población. Todos los enfermos con dolor torácico y diagnóstico de sospecha de SCA y cuyo modo de acceso al hospital sea a través del sistema sanitario (médico de familia, centro de salud o SEM 112). Exclusiones. Ninguna. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. Zde 5 puntos. Comentarios. Como todas las actuaciones relacionadas con medidas básicas no son necesarias en todos los pacientes (por ejemplo los tranquilizantes no son necesarios siempre porque en la mayorı́a de los casos los opiáceos son suficientes, o el oxı́geno solo está realmente indicado si hay disnea o signos de insuficiencia cardiaca), hemos considerado que la asistencia es óptima con una puntuación de 5 o superior (indicaciones IA) y como atención inadecuada a aquella que no alcanza la puntuación referida. Tabla 4 Contraindicaciones para la trombolisis Contraindicaciones absolutas ACV hemorrágico o ACV de origen desconocido en cualquier momento ACV isquémico en los 6 meses precedentes Traumatismo o neoplasia en el sistema nervioso central Traumatismo/cirugı́a/daño encefálico reciente importante (durante las 3 semanas precedentes) Sangrado gastrointestinal durante el último mes Alteración hemorrágica conocida Disección aórtica Punciones no compresibles (como biopsia hepática, punción lumbar) Contraindicaciones relativas Ataque isquémico transitorio en los 6 meses precedentes Tratamiento con anticoagulantes orales Embarazo o la primera semana posterior al parto Hipertensión refractaria (presión sistólica 4180 mmHg y/ o presión diastólica 4110 mmHg) Enfermedad hepática avanzada Endocarditis infecciosa Úlcera péptica activa Resucitación refractaria Indicadores de calidad en el SCA para el análisis del proceso asistencial Tabla 5 405 Medidas básicas en la atención al SCA Medidas básicas Descripción Clasea Nivelb Puntos ECG Monitorización Acceso venoso AAS Nitroglicerina sublingual Analgésicos opiáceos i.v. Oxı́geno si disnea o signos de insufi-ciencia cardiaca Tranquilizantes Transporte urgente al hospital Realización (12 derivaciones) Realización Realización Administración Administración Administración Administración (2–4 l/min con mascarilla o cánulas nasales) Administración oral (sublingual) Realización I I I I I I I A A A A C C C 1 1 1 1 1 1 1 IIa I C A 1 1 a b Clase de recomendación. Nivel de recomendación. Atención óptima: Z5puntos. Atención inadecuada: puntuaciónode 5 puntos. Atención en urgencias hospitalarias Es aquella que se realiza en las urgencias del centro sanitario y en el intervalo de tiempo transcurrido desde el ingreso del paciente hasta su transferencia e ingreso en el SMI. Se evalúan en esta área asistencial los indicadores números 2–4, 6, 7 y 9, para pacientes que acceden por medios propios, ya que urgencias es el primer contacto de este grupo de enfermos con el sistema sanitario. Se mide también el intervalo de asistencia del indicador 5,3 (dolor llegada a urgencias). La exclusión común para todos los indicadores en urgencias es que el enfermo sea dado de alta a otro centro o solicite el alta voluntaria. Indicador N.1 10. Realización de trombolisis precoz intrahospitalaria a pacientes con SCACEST de menos de 2 h de evolución del infarto Dimensión/área. Riesgo, efectividad, eficacia. Justificación. La administración precoz del trombolı́tico en el SCACEST disminuye el tamaño del infarto, mejora la función ventricular residual y reduce la morbimortalidad29. Durante las 2 primeras horas de evolución, el tiempo hasta la revascularización es crı́tico para salvar miocardio: en ausencia de contraindicaciones, si no se puede realizar precozmente una angioplastia primaria, se debe realizar una trombolisis (en Urgencias o en el SMI) con un tiempo puerta-aguja inferior a 30 minutos. Formula : N:o de pacientes con SCACEST; tiempo inicio sı́ntomasingreso Urgenciasr2 horas y trombolisis realizada 100 N:o de pacientes ingresados con SCACEST Explicación de términos. Tiempo inicio sı́ntomas-ingreso en urgencias. Intervalo de tiempo transcurrido desde el comienzo del dolor hasta el ingreso en urgencias del hospital. Trombolisis: administración intravenosa de un agente activador tisular del plasminógeno (t-PA), mediante alguna de las pautas establecidas (doble bolo, infusión acelerada o bolo único de TNK-tPA ajustado a peso). Población. Todos los enfermos con dolor torácico y diagnóstico de SCACEST (elevación persistente del segmento ST superior a 2 mm en 2 o más derivaciones) de menos de 2 horas de evolución. Exclusiones. Pacientes con contraindicación absoluta o relativa para la trombolisis. Pacientes a quienes se decida ingresar o derivar para realizar ACTP primaria. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Comentarios. Ver contraindicaciones absolutas y relativas en la tabla 4. Atención en el servicio de medicina intensiva (SMI) Es aquella que se realiza en el SMI en el intervalo de tiempo transcurrido desde el ingreso del paciente hasta el fallecimiento o el alta a la planta de hospitalización. La exclusión común para todos los indicadores es que el enfermo sea dado de alta a otro centro o solicite el alta voluntaria. 406 F. Felices-Abad et al Indicador N.1 11. Evaluación del riesgo pronóstico del proceso SCACEST y SCASEST Dimensión/área. Riesgo, efectividad. Justificación. Hecho el diagnóstico, es el segundo paso de importancia crucial en proceso de toma de decisiones para la terapia30. En general, se ha aceptado ampliamente para los pacientes con SCASEST, pero también se va asumiendo en el SCACEST y ası́ se señala claramente en las guı́as de práctica clı́nica28,29. Las razones fundamentales para la valoración del riesgo son las siguientes: a) facilita la toma de decisiones y permite un adecuado análisis de la mortalidad al posibilitar la homogeneización para el tratamiento en grupos de alto y bajo riesgo; b) es una herramienta de análisis e interpretación de resultados con la posibilidad de detectar la infrautilización de ciertos tratamientos en grupos de alto riesgo (por ejemplo, la utilización de inhibidores de la glicoproteı́na IIb/IIIa); c) la no utilización de la estratificación del riesgo es uno de los motivos que genera la disociación entre ensayos clı́nicos y la práctica clı́nica. A pesar de que no existen dudas sobre la utilidad y necesidad de esta evaluación, sı́ puede ser un punto de controversia el emplear una u otra escala de las validadas, ya que la escala TIMI ha recibido crı́ticas metodológicas (las 7 variables de riesgo fueron seleccionadas por análisis de regresión logı́stica multivariante, asignando 1 punto a cada factor de riesgo) y además infravalora la diabetes como variable predictiva independiente, cuando los diabéticos se configuran como los pacientes que más se benefician, en términos de mortalidad, del empleo de los anti IIb/IIIa31. Hemos optado por una escala mixta a la que llamamos )escala de riesgo TIMI ampliada*32 que subsana los defectos de la escala TIMI clásica al registrar los patrones ECG de alto riesgo que identifican lesiones proximales de la arteria culpable (y por tanto, mayor o menor )área en riesgo*) y las arritmias graves como la FV; además, valora la presencia de insuficiencia cardiaca, muy relacionada con la mortalidad hospitalaria y da importancia a la presencia de diabetes como variable predictiva independiente. También contempla la positividad del biomarcador troponina, indicativa de lesión celular miocárdica. Los criterios de alto riesgo que se proponen son la presencia de uno o más de los siguientes: SCACEST: Escala TIMI igual o mayor de 4 puntos. Presencia de algún patrón ECG de alto riesgo sugestivo de afectación proximal de la arteria responsable: a) Descendente anterior (DA) proximal a 1.a septal/1.a diagonal; b) DA distal a la 1.a diagonal; c) coronaria derecha (CD); d) bloqueo completo de rama izquierda (BCRI) nuevo; e) FV primaria. Bloqueo auriculoventricular (A-V) de alto grado. Existencia de insuficiencia cardiaca (Killip II a IV). SCASEST: Escala TIMI igual o mayor de 4 puntos. Presencia de algún patrón ECG de alto riesgo: a) Descenso del ST 4 2 mm en más de 2 derivaciones; b) Descenso de generalizado de STþ ascenso en aVR (afectación de tronco); c) ascenso de ST transitorio )sugestivo* de afectación proximal de la arteria responsable; d) bloqueo A-V de alto grado; e) FV primaria. Existencia de insuficiencia cardiaca (Killip II a IV). Diabetes o elevación del biomarcador troponina. Formula : del riesgo pronostico N:o de pacientes con estratificacion realizada 100 N:o de pacientes ingresados con SCA Población. Todos los enfermos con el diagnóstico de SCA ingresados en el SMI, sin exclusiones. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (la evaluación del riesgo debe hacerse en todos los casos). Indicador N.1 12. Evaluación del riesgo hemorrágico Dimensión/área. Riesgo, efectividad. Justificación. La prevención de las hemorragias se ha convertido en un objetivo tan importante como la prevención de los episodios isquémicos, ya que las hemorragias son las complicaciones no isquémicas más frecuentemente observadas en el manejo de los SCA y se relacionan con mayor mortalidad28. Los predictores independientes de hemorragias mayores del registro GRACE (edad avanzada, sexo femenino, antecedentes de hemorragias, valores basales de hemoglobina/hematocrito, presión arterial media y la disfunción renal medida por la concentración de creatinina sérica o bien por la tasa de filtración Indicadores de calidad en el SCA para el análisis del proceso asistencial 407 glomerular, calculada por la ecuación de Cockcroft-Gault) clasifican a los pacientes como de alto o bajo riesgo hemorrágico33. Formula : del riesgo hemorragico N:o de pacientes con evaluacion realizada 100 o N: de pacientes ingresados con SCA Población. Todos los enfermos con el diagnóstico de SCA ingresados en el SMI, sin exclusiones. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (la evaluación del riesgo hemorrágico debe hacerse en todos los casos). Indicador N.1 13. Evaluación del riesgo de mortalidad intrahospitalaria (escala GRACE) Dimensión/área. Riesgo, efectividad. Justificación. La clasificación de riesgo GRACE se basa en una población grande no seleccionada de un registro internacional del espectro completo de pacientes con SCA. Los factores de riesgo se derivaron con un factor predictor independiente para las muertes intrahospitalarias y muertes después del alta a los 6 meses34–36. En el cálculo se incluyen variables clı́nicas, de ECG y de laboratorio, fáciles de evaluar, como la edad FC, PAS, la concentración sérica de creatinina, la clase Killip al ingreso, la depresión del segmento ST y la elevación de los biomarcadores cardiacos. Fórmula/formato. Porcentaje de pacientes en los que se mide la escala de factores GRACE modificada a criterio cualitativo (bajo/intermedio/alto). Población. Todos los enfermos con el diagnóstico de SCASEST ingresados en el SIM, sin exclusiones. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% (la evaluación del riesgo de mortalidad hospitalaria debe hacerse en todos los casos). Comentarios. Los modelos del estudio GRACE tienen muy buen poder discriminativo, pero su complejidad requiere de herramientas informáticas especiales que realicen el cálculo automáticamente al introducir las variables. En la tabla 6 se exponen las 3 categorı́as de riesgo GRACE (bajo, intermedio y alto) para mortalidad hospitalaria y a los 6 meses. Indicador N.1 14. Empleo de técnicas de reperfusión en pacientes con SCACEST Dimensión/área. Riesgo. Efectividad. Adecuación. Justificación. La reperfusión utilizando un tratamiento trombolı́tico o ACTP primaria, disminuye el tamaño del infarto, mejora la función ventricular y reduce la morbimortalidad de los pacientes con SCACEST29. Representa el tercer paso en el proceso de toma de decisiones. Formula : 100 N:o de pacientes con SCACEST en los que se emplea una tecnica de reperfusion o N: de pacientes ingresados con SCACEST Explicación de términos. Reperfusión es la apertura de )la arteria culpable* del SCACEST, mediante un medio farmacológico o mecánico. Población. Todos los enfermos con el diagnóstico de SCACEST con indicación de revascularización, ingresados en el SMI. Exclusiones. Pacientes con SCACEST evolucionado (412 h desde el inicio del cuadro) y aquellos en los que se decida limitación del esfuerzo terapéutico (LET). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 70%. Tabla 6 Mortalidad hospitalaria y a los 6 meses tras el alta, en las categorı́as de riesgo bajo, intermedio y alto de los registros poblacionales según la clasificación de riesgo GRACE Nivel de riesgo SCASEST Mortalidad hospitalaria (%) Bajo Intermedio Alto r108 109–140 4140 o1 1–3 43 Nivel de riesgo Bajo Intermedio Alto SCASEST r88 89–118 4118 Mortalidad a los 6 meses (%) o3 3–8 48 408 F. Felices-Abad et al Indicador N.1 15. Tiempo puerta aguja para pacientes trombolisados Dimensión/área. Riesgo. Efectividad. Adecuación. Justificación. La administración de un tratamiento trombolı́tico en el SCACEST cuando está indicado, disminuye el tamaño del infarto, mejora la función ventricular y reduce la morbimortalidad29. Representa el tercer paso en el proceso de toma de decisiones. La entidad de la reducción del área necrótica y el éxito de la lisis del trombo se ven favorecidas por la administración precoz del fármaco. Formula : N:o de pacientes con SCACEST trombolisados con tiempo puertaagujao30 min 100 N:o de pacientes trombolisados Explicación de términos. Tiempo puerta aguja: intervalo de tiempo desde el ingreso del paciente en el centro sanitario (puerta) hasta que se inicia el tratamiento trombolı́tico (aguja). Los tiempos se miden en minutos y se expresan como media, mediana y p 25 y 75. Población. Todos los enfermos con el diagnóstico de SCACEST en los que se realiza trombolisis. Exclusiones. Pacientes en los que se decida limitación del esfuerzo terapéutico (LET). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 90%. Indicador N.1 16. ACTP primaria precozmente realizada. Registro de los tiempos de demora hasta la realización de la técnica a. Tiempo primer contacto médico balón. b. Tiempo puerta balón. Dimensión/área. Riesgo. Efectividad. Adecuación. Justificación. La ACTP primaria representa el tercer paso en el proceso de toma de decisiones. Tratamiento de elección (IA) si lo realiza un equipo experimentado y precozmente tras el primer contacto médico (PCM) ya que la entidad de la reducción del área necrótica es tanto mayor cuanto antes se logre la reperfusión29. Los criterios de la SEC29 señalan un intervalo desde el PCM hasta la dilatación del balóno2 h, en todos los casos, y un tiempo puerta balóno90 min, sobre todo para aquellos pacientes que llegan pronto al hospital con un infarto extenso. Formula ðaÞ : N:o de pacientes con SCACEST y ACTP primaria con tiempo PCM-balono2 h 100 o N: de pacientes revascularizados con ACTP primaria Formula ðbÞ : N:o de pacientes con SCACEST y ACTP primaria con tiempo puerta-balono90 min 100 N:o de pacientes revascularizados con ACTP primaria Explicación de términos. ACTP primaria. Requiere enviar al paciente a la sala de hemodinámica, la realización de CNG y la aplicación de la técnica en función de los hallazgos. Tiempo PCM balón: tiempo desde el primer contacto médico y el inflado del balón durante la angioplastia. Tiempo puerta balón: tiempo desde la llegada del paciente al hospital y el inflado del balón durante la angioplastia. Los tiempos se miden en media, mediana y p 25 y 75. Población. Todos los enfermos con diagnóstico de SCACEST a quienes se realice ACTP primaria. Exclusión. Pacientes en quienes se decida LET. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar (para ambas fórmulas). 100% de los casos. Comentarios. El papel de la ACTP durante las primeras horas del SCACEST puede dividirse en primaria, combinada o facilitada y de rescate (que se realiza si ha habido fracaso en la reperfusión farmacológica). La Sociedad Europea de Cardiologı́a (ESC) ha publicado una guı́a de práctica clı́nica que cubre todas las indicaciones de la angioplastia37. Indicador N.1 17. Realización de coronariografı́a en pacientes inestables graves con SCASEST Dimensión/área. Riesgo. Efectividad. Adecuación. Justificación. La angiografı́a coronaria debe planificarse lo antes posible (estrategia invasiva urgente) en pacientes inestables graves en el momento del ingreso o después cuando se presenta la complicación. Estos pacientes son un 2–15% de Indicadores de calidad en el SCA para el análisis del proceso asistencial 409 los ingresados con SCASEST38–40. Formula : N:o de pacientes con SCASEST inestables a quienes se realice CNG 100 N:o de pacientes ingresados con SCASEST inestables Explicación de términos. Indicación de CNG en pacientes inestables graves y no estabilizados con el tratamiento farmacológico actual: angina recurrente y grave, cambios importantes en el ECG o dinámicos, arritmias mayores o insuficiencia cardiaca. Población. Todos los enfermos con diagnóstico de SCASEST inestables. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% de los casos. Comentarios. Diversos estudios41–43 han comparado la estrategia invasiva sistemática precoz frente a la estrategia invasiva selectiva para pacientes inestables graves, con resultados que muestran un mayor riesgo precoz durante la hospitalización con la primera estrategia (muerte e infarto de miocardio), aunque se produce un efecto beneficioso significativo a largo plazo (2–5 años de seguimiento) en angina recurrente, rehospitalización, muerte e infarto de miocardio. Más recientemente44 una revisión de los estudios clı́nicos más contemporáneos por la Cochrane Collaboration ha confirmado las observaciones iniciales obtenidas por Mehta et al43. Los resultados del estudio ICTUS45 ponen en entredicho el paradigma de un mejor resultado clı́nico con la estrategia invasiva sistemática precoz. De acuerdo con estos resultados, la evidencia disponible actualmente no exige un enfoque sistemático de angiografı́a inmediata en los pacientes con SCASEST estabilizados con el tratamiento farmacológico contemporáneo. Indicador N.1 18. Realización de ecocardiografı́a Dimensión. Riesgo. Efectividad. Adecuación. Justificación. La ecografı́a transtorácica (ET) es una técnica no invasiva, de rápida realización y total fiabilidad, que se realiza a la cabecera del enfermo y que ha supuesto una auténtica revolución como método diagnóstico en múltiples especialidades médicas y también en Medicina Intensiva, especialmente en los pacientes coronarios. La ET es una herramienta diagnóstica fundamental y debe ser realizada para valorar el alcance del daño miocárdico. La función sistólica ventricular izquierda, evaluada mediante la medición de la FE es una variable pronóstica muy importante en pacientes con SCA que se puede determinar de forma fácil y precisa mediante esta técnica. En manos experimentadas la ET puede además detectar durante la fase aguda de isquemia, una posible hipocinesia transitoria localizada o acinesia en segmentos de la pared ventricular izquierda, con motilidad normal de la pared cuando se resuelve la isquemia. Además se puede realizar el diagnóstico de insuficiencia cardiaca mediante la determinación del flujo transmitral y el diagnóstico diferencial con pericarditis, estenosis aórtica, disección aórtica, embolia pulmonar, miocardiopatı́a hipertrófica y complicaciones mecánicas asociadas al SCA como la regurgitación mitral, la comunicación interventricular y el taponamiento cardiaco29,46. Por lo tanto, la ET debe realizarse de forma sistemática en la UCI y es un importante complemento en la toma de decisiones terapéuticas. Además tiene, como ventaja adicional, el disponer de documento objetivo de la fase aguda muy útil como parámetro de control. Formula : N:o de pacientes con SCA y ecocardiografıa realizada 100 N:o de pacientes ingresados con SCA Explicación de términos. Determinación de la fracción de eyección (FE en porcentaje), utilizando un ecocardiógrafo con sonda transtorácica. Población. Todos los enfermos con el diagnóstico de SCA ingresados en el SMI. Exclusiones. Pacientes con infarto de miocardio evolucionado sin insuficiencia cardiaca y aquellos en los que se decida LET. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% de los casos. Indicador N.1 19. Administración de tienopiridinas Dimensión. Riesgo. Efectividad. Adecuación. Justificación. La administración de inhibidores de la agregación plaquetaria mediada por difosfato de adenosina (ADP) disminuye la morbimortalidad de los enfermos con SCA al evitar la progresión del proceso, reduciendo el riesgo isquémico o de eventos vasculares (isquemia persistente, infarto de miocardio, muerte de origen cardiovascular o ACV). El beneficio se produce precozmente y es constante en todos los grupos de riesgo (bajo y alto). Tras la dosis inicial, se debe continuar con 410 F. Felices-Abad et al dosis de mantenimiento durante toda la fase aguda. Además, el coste de los antiagregantes plaquetarios es del todo asumible7,52,53,87. Formula : N:o de pacientes con SCA que reciben clopidogrel en dosis de carga y mantenimiento 100 N:o de pacientes ingresados con SCA Explicación de términos. Dosis de carga inicial: 300 mg (600 mg cuando se quiere conseguir un efecto más rápido de la acción). Dosis de mantenimiento: 75 mg/d. Población. Enfermos con diagnóstico de SCA (SCASEST y SCACEST) ingresados en el SMI. Exclusiones. Pacientes con riesgo hemorrágico alto. Pacientes tratados con Prasugrel en la sala de hemodinámica. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% de los casos. Indicador N.1 20. Antiagregación plaquetaria con inhibidores del receptor de la glicoproteina IIb/IIIa en pacientes con SCASEST de alto riesgo Dimensión. Riesgo. Efectividad. Justificación. Los inhibidores del receptor de la glicoproteina IIb/IIIa actúan bloqueando la vı́a final común de la activación plaquetaria uniéndose al receptor del fibrinógeno y, en condiciones de estrés por cizallamiento, al factor de Von Willebrand, con lo que inhiben la formación de puentes de unión entre las plaquetas activadas. Los 3 inhibidores del receptor de GP IIb/ IIIa disponibles (tirofibán, eptifibatida y abciximab), se han probado en estudios clı́nicos en los que no estaba recomendada una estrategia invasiva, demostrándose una reducción significativa del 9% del riesgo de muerte e IM a los 30 dı́as con el tratamiento54. Esta reducción del riesgo tuvo concordancia entre los múltiples subgrupos y fue particularmente evidente en los pacientes de alto riesgo (depresión del segmento ST, diabéticos y con troponinas elevadas) y en los sometidos a intervencionismo coronario percutáneo (ICP) durante la hospitalización inicial. Formula : N:o de pacientes con SCASEST de alto riesgo que reciben anti IIb=IIIa ðantes o durante el cateterismoÞ 100 N:o depacientes ingresados con SCASEST de alto riesgo pronostico y bajo riesgo hemorragico Explicación de términos. Alto riesgo definido por uno o más de los siguientes criterios: 1. Escala TIMI igual o mayor de 4 puntos. 2. Presencia de algún patrón ECG de alto riesgo: a) descenso del ST 42 mm en más de 2 derivaciones; b) Descenso de generalizado de STþascenso en aVR (afectación de tronco); c) ascenso de ST transitorio )sugestivo* de afectación proximal de la arteria responsable; d) bloqueo A-V de alto grado; e) FV primaria. 3. Presencia de insuficiencia cardiaca (Killip II a IV). 4. Diabetes o elevación del biomarcador troponina. Población. Enfermos con diagnóstico de SCASEST ingresados en el SMI. Exclusiones. Pacientes de bajo riesgo y con troponinas negativas, en donde se ha demostrado que no tienen efecto. Pacientes de alto riesgo hemorrágico tratados con doble antiagregación (donde el riesgo/beneficio es custionable). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100% de los casos. Comentarios. El uso de inhibidores del receptor de GP IIb/IIIa se asoció a un aumento de las complicaciones hemorrágicas mayores, aunque no se produjo un aumento significativo en las hemorragias intracraneales54. Los pacientes que reciban un tratamiento inicial con eptifibatida o tirofibán previo a la angiografı́a deben mantener el mismo tratamiento durante y después de la ICP (IIa-B). En pacientes de alto riesgo no pretratados con inhibidores del receptor de GP IIb/IIIa que vayan a someterse a ICP, se recomienda administrar abciximab inmediatamente después de la angiografı́a (I-A). El uso de eptifibatida y tirofibán en este contexto está menos establecido (IIa-B)28. Indicador N.1 21. Anticoagulación Dimensión. Riesgo. Efectividad. Justificación. Los anticoagulantes se utilizan para inhibir la generación o actividad de la trombina y, de esta forma, reducir los episodios relacionados con la formación de trombos. Se trata de un tratamiento coadyuvante en el SCASEST, cuyo objetivo es evitar la progresión del proceso, reduciendo el riesgo isquémico o de eventos vasculares (isquemia persistente, infarto de miocardio, muerte de origen cardiovascular o ACV). Hay evidencias que demuestran que la anticoagulación como estrategia combinada con la antiagregación plaquetaria, es más efectiva que cualquiera de ellas por separado55,56. Además, el coste de los anticoagulantes es del todo asumible7. En el SCACEST el uso sistemático de la anticoagulación solo puede exigirse en Indicadores de calidad en el SCA para el análisis del proceso asistencial 411 aquellos pacientes a quienes se ha administrado un trombolı́tico con t-PA y derivados o presentan alto riesgo tromboembólico, como FE baja, fibrilación auricular, etc29,30. Formula ðaÞ : N:o pacientes ingresados con SCASEST que reciben anticoagulantes 100 N:o de pacientes ingresados con SCASEST Formula ðbÞ : N:o pacientes ingresados con SCACEST trombolisados y que reciben anticoagulantes 100 N:o de pacientes ingresados con SCACEST trombolisados Explicación de términos. Anticoagulantes: como existen varios regı́menes utilizados para la anticoagulación y su elección depende de la estrategia inicial (invasiva o conservadora), la anticoagulación se considera realizada si los pacientes reciben alguno de los regı́menes recomendados, bien sea una antitrombina indirecta [heparina sódica o no fraccionada, HNF (en infusión i.v.) o un anti-factor X activado (heparina de bajo peso molecular, HBPM) o fondaparinux, con inyección subcutánea]. Población. Enfermos ingresados en el SMI con diagnóstico de SCASEST y SCACEST tratados con trombolisis. Exclusiones. Pacientes en tratamiento activo con antivitaminas K. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Indicador N.1 22. Administración de betabloqueantes (BB) en pacientes con SCA Dimensión. Riesgo. Efectividad. Justificación. Los BB son fármacos antiisquémicos que actúan fundamentalmente sobre los receptores beta 1 e inhiben de forma competitiva los efectos que sobre el miocardio ejercen las catecolaminas circulantes, disminuyendo ası́ el consumo de oxı́geno. Se ha demostrado que el tratamiento con BB se asocia a un 13% de reducción relativa en el riesgo de progresión del SCASEST hacia infarto de miocardio, aunque sin efecto significativo sobre la mortalidad57,58. El beneficio del tratamiento indefinido con bloqueadores beta tras el SCACEST está bien establecido29. El coste de los BB es del todo asumible7. Formula : N:o de pacientes ingresados con SCA que reciben BB 100 de BB N:o de pacientes ingresados con SCA e indicacion Población. Enfermos con diagnóstico de SCA ingresados en el SMI. Exclusiones. Pacientes que no presenten contraindicaciones para los BB en la fase aguda: a) alergia al fármaco; b) historia de asma bronquial; c) insuficiencia cardiaca congestiva (Killip II–IV); d) )aturdimiento miocárdico* (FEo45%, medida por ecocardiografı́a, con signos de insuficiencia cardiaca); e) hipotensión arterial (PASo90 mmHg); f) bradicardia (FCode 55 l/m); g) cualquier alteración de la conducción aurı́culo ventricular. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 90%. Indicador N.1 23. Administración de inhibidores de la enzima de conversión de la angiotensina (IECA) Dimensión. Riesgo. Efectividad. Justificación. Los IECA son beneficiosos para reducir el remodelado ventricular y mejorar la supervivencia de los pacientes con función sistólica ventricular izquierda reducida (FE:o40%, con o sin insuficiencia cardiaca clı́nica), diabetes o HTA59–61. Estudios posteriores a esta primera indicación, mostraron que los IECA tenı́an efecto antiaterogénico en pacientes con factores de riesgo de aterosclerosis o enfermedad arterioesclerótica establecida, independientemente de la función ventricular izquierda y más allá de su efecto sobre la presión arterial62–64. En este contexto los IECA han demostrado una reducción del riesgo de muerte a los 4 años de hasta un 14%65–67. El coste de los IECA es del todo asumible7. Formula : N:o de pacientes ingresados con SCA que reciben IECA 100 de IECA N:o de pacientes ingresados con SCA e indicacion Explicación de términos. Indicaciones en la fase aguda: a) función sistólica ventricular izquierda reducida (40%), con o sin insuficiencia cardiaca clı́nica y b) pacientes con diabetes, hipertensión o enfermedad renal crónica. Población. Enfermos con diagnóstico de SCA ingresados en el SMI que presenten indicación para los IECA. Exclusiones. Pacientes en los que los IECA están contraindicados por PAS menor de 100 mmHg o caı́da de más de 30 mmHg respecto a la basal, angioedema o estenosis bilateral de la arteria renal. Tipo. Proceso. Fuente de datos. Documentación clı́nica. 412 F. Felices-Abad et al Estándar. 100%. Comentarios. Las dosis de los IECA pueden ser muy variables, dependiendo de la respuesta del paciente e incluso del tipo de IECA administrado. Indicador N.1 24. Administración de hipolipemiantes Dimensión. Riesgo. Efectividad. Adecuación. Continuidad de la asistencia. Justificación. Los inhibidores de la HMG CoA-reductasa (estatinas) tienen beneficios demostrados en el SCA (descenso del cLDL; propiedades antioxidantes, mejora de la función endotelial, reducción del componente inflamatorio y efecto antiplaquetario), con mı́nimos efectos adversos68,69,72. La administración de hipolipemiantes reduce el riesgo de muerte o evento cardiovascular relevante en un 16% y consigue el objetivo de reducir los niveles de cLDLode 70 mg/dl28,29. Además, el coste de los hipolipemiantes es del todo asumible7. Dos estudios REVERSAL y PROVE-IT TIMI 2270,71 han comparado el tratamiento hipolipemiante convencional (pravastatina 40 mg/dı́a) frente al intensivo (atorvastatina 80 mg/d) con resultados concluyentes a favor de este último. Se recomienda iniciar la terapia durante la fase aguda (primeros 1–4 dı́as), por la ventaja añadida de que, con el uso muy precoz es más probable que el paciente siga tomando estatinas, si se inician en la UCI30. El tratamiento hipolipemiante de mantenimiento es de 20–40 mg/d de cualquier hipolipemiante. Formula : N:o de pacientes ingresados con SCA que reciben trat1 hipolipemiante intensivo 100 N:o de pacientes ingresados con SCA Explicación de términos. Tratamiento hipolipemiante intensivo. Objetivo LDLco70 mg/dl. Población. Todos los enfermos con diagnóstico de SCA ingresados en el SMI. Exclusiones. Pacientes con intolerancia a las estatinas (erupciones cutáneas, debilidad y dolor muscular, dolor abdominal o diarreas) o contraindicaciones (elevación de las transaminasas, rabdomiolisis). Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Atención en planta de hospitalización Es aquella que se realiza en planta del hospital en el intervalo de tiempo transcurrido desde el ingreso del paciente desde el SMI hasta el alta a su domicilio. La exclusión común para todos los indicadores en planta es que el enfermo sea dado de alta a otro centro. Indicador N.1 25. Realización de coronariografı́a electiva en el SCASEST de alto riesgo estabilizado con tratamiento farmacológico Dimensión. Riesgo. Efectividad. Justificación. El momento más apropiado de la intervención invasiva en el SCASEST de alto riesgo para valorar el estado del árbol coronario sigue siendo controvertido28, excepto en los casos de estrategia invasiva urgente (pacientes inestables por angina grave, cambios importantes en el ECG o dinámicos, arritmias mayores o insuficiencia cardiaca en el momento del ingreso o después). Para aquellos pacientes sometidos a una estrategia conservadora y estabilizados, el momento de la angiografı́a coronaria hay que situarlo antes del alta del hospital para valorar el estado del árbol coronario. Formula : N:o de pacientes con SCASEST de alto riesgo estabilizados con tratamiento farmacologico a quienes se realiza CNG en planta 100 N:o de pacientes con SCASESTde alto riesgo Explicación de términos. Ingresados en planta de hospitalización después de recibir en el SMI un tratamiento farmacológico actual (antiplaquetario, antiisquémico y anticoagulante) que los estabiliza. Alto riesgo: todos los pacientes que cumplen criterios de alto riesgo, evaluado por la escala de riesgo TIMI ampliada. Población. Todos los pacientes con diagnóstico de SCASEST de alto riesgo, dados de alta desde el SMI sin ser sometidos a angiografı́a coronaria e ingresados en planta de hospitalización. Exclusiones. Pacientes inestables graves a quienes se haya realizado angiografı́a de urgencia durante la fase aguda (estancia en el SMI) por angina grave, cambios importantes en el ECG o dinámicos, arritmias de alto riesgo y potencialmente mortales (fibrilación o taquicardia ventricular) o insuficiencia cardiaca. Pacientes dados de alta a otro centro o que solicitan alta voluntaria. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 90%. Comentarios. De acuerdo con los resultados de los estudios FRISC-2, GRACE Y CRUSADE adelantar el cateterismo se asoció a un peor resultado clı́nico inicial ya que implicó un riesgo precoz significativo73–75. Más recientemente el estudio ICTUS Indicadores de calidad en el SCA para el análisis del proceso asistencial 413 demostró que el tratamiento invasivo precoz y sistemático aumentó la tasa de infarto de miocardio en el 56% de los casos en las primeras 48 h de aleatorización y en el 76% durante la hospitalización inicial. De acuerdo con estos resultados, la evidencia disponible actualmente no exige un enfoque sistemático de angiografı́a inmediata en los pacientes con SCASEST estabilizados con el tratamiento farmacológico actual o contemporáneo28. Indicador N.1 26. Realización de coronariografı́a electiva en el SCACEST tratado con trombolisis asociada a criterios de reperfusión Dimensión. Riesgo. Efectividad. Justificación. Los criterios de reperfusión para la trombolisis son clı́nicos, analı́ticos y electrocardiográficos. El primero de ellos, el clı́nico (cese del dolor) es poco valorable debido al uso concomitante de un analgésico potente (morfina). El segundo (la ratio mioglobina 60 min/basal 44) es poco práctico por las dificultades de laboratorio para realizar el biomarcador. El tercero (ECG) es el más práctico, asequible y además proporciona la menor tasa de falsos positivos (o10%). Se exige para establecer el diagnóstico de reperfusión con éxito, una resolución de la elevación del ST 450% si el infarto de miocardio es anterior y una resolución mayor del 70% si es inferior, a los 60–90 min. La presencia de arritmia tı́pica de reperfusión apoya el probable éxito de la trombolisis. Al objeto de evitar la realización de CNG/ACTP durante la fase protrombótica tras la trombolisis y minimizar el riesgo de reoclusión, se recomienda una ventana de, al menos, 12–24 h tras el éxito de la trombolisis29,76–79. Formula : N:o de pacientes con SCACEST a quienes se realiza CNG 100 N:o de pacientes con SCACEST trombolisados Explicación de términos. Trombolisis: administración i.v. de un agente activador tisular del plasminógeno (t-PA), mediante alguna de las pautas establecidas (doble bolo, infusión acelerada o bolo único de TNK-tPA ajustado a peso). Población. Todos los pacientes con diagnóstico de SCACEST de alto riesgo trombolisados en el SMI con o sin criterios de reperfusión. Exclusiones. Pacientes con SCACEST de alto riesgo trombolisados sin criterios de reperfusión y a quienes se realiza una ACTP de rescate. SCACEST de bajo riesgo no trombolisados. Pacientes estables post-IAM a quienes se realiza la valoración de la reserva coronaria por técnicas no invasivas. Pacientes dados de alta a otro centro. Tipo. Proceso. Fuente de datos. Documentación clı́nica. Estándar. 100%. Indicador N.1 27. Mortalidad intrahospitalaria Dimensión. Efectividad, adecuación. Justificación. Ver indicador n1 25. Formula ðaÞ : N:o de pacientes con SCASEST que fallecen durante la estancia en el hospital 100 N:o de pacientes con SCASEST ingresados Formula ðbÞ : N:o de pacientes con SCACEST que fallecen durante la estancia en el hospital 100 N:o de pacientes con SCACEST ingresados Población. Todos los enfermos con SCASEST y SCACEST como diagnóstico principal. Exclusiones. Pacientes que fallecen por causa no cardiaca. Pacientes dados de alta a otro centro y aquellos en que se decide LET. Tipo. Resultados. Fuente de datos. Documentación clı́nica. Estándar. r11% para el SCACEST y r5% para el SCASEST80–85. Consideraciones finales 1. Los IC no deben ser considerados un fin en sı́ mismos. Decidir cuáles queremos medir, la frecuencia de la medición y otras variables, es necesario e imprescindible para determinar el nivel de calidad de la práctica asistencial en el SCA. 2. Los IC son solo la herramienta que nos permitirá aplicar las mejoras en los puntos débiles y seleccionar las acciones más efectivas, pero nunca debe constituir una meta. Finalizada la etapa de elaboración es imprescindible poner en marcha las siguientes etapas del proceso e iniciar las actividades sistemáticas de medida con la recogida y tabulación de resultados que 414 nos permitirá estimar el nivel de cumplimiento del indicador. 3. Los IC nos permiten comparar los resultados con los estándares previamente establecidos (el estándar de referencia), con lo que se puede: a) identificar situaciones subóptimas o por debajo del nivel requerido; b) con los resultados de mediciones anteriores permiten valorar la evolución en el tiempo y el comportamiento del indicador; c) con los resultados de otros SMI, posibilitan la evaluación comparativa o benchmarking. 4. La última etapa es la interpretación de los resultados. Cuando el resultado de la comparación es una situación subóptima o existe un empeoramiento, el indicador sirve como señal de alarma. En este caso debe valorarse si es una situación debida al azar (causa sistémica) o estamos ante un problema o una situación mejorable, en cuyo caso se debe actuar. En algunas ocasiones la causa es clara y evidente, pero en otras es necesario iniciar los pasos del ciclo de evaluación. Una vez identificada la causa deben proponerse acciones de mejora, implantarlas y volver a realizar una medición sistemática del indicador, observando si se han producido las mejoras deseadas. 5. Por último, creemos que los IC elaborados pueden constituir una oportunidad de mejora para el Proyecto ARIAM y en este sentido, con el análisis de las primeras mediciones efectuadas durante el corte del año 2009, ya se han detectado una serie de acciones a emprender para mejorar la calidad de la recogida de datos del año próximo. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Anexo. GRUPO ARIAM ANDALUCIA. ALMERÍA. Hospital Torrecárdenas: J.A. Ramos, A. Calderón, C. Carbayo, J.C. Martı́n, D.M. Mayor, R. Rodrı́guez. Hospital Inmaculada: F. Barredo, J. Córdoba, D. Ocaña, F.J. Rodrı́guez, D. Sánchez. Hospital del Poniente: A. Cárdenas, J. Fierro, S. Garcı́a E. Robles-Musso. CÁDIZ. Hospital de Algeciras: P. Cobo. Hospital Puerta del Mar: M. Celaya, J.M. Jiménez, R. Monterosso, J.J. Ravina, J. Rubio, A. Sánchez, A.C. Sánchez. Hospital de la Lı́nea: L. Vallejo. Hospital de Puerto Real: J.C. Rodrı́guez, F.J. Romero, J.M. Sánchez. Hospital de Jerez: J.J. Arias, M. Gracia. Hospital San Fernando: J.L. Garcı́a. CÓRDOBA. Hospital Reina Sofı́a: R. León. M. Parias. Hospital de Pozoblanco: M.J. Fernández, J.C. Llamas, J.C. Luque, M. Luque, J.A. Panadero. Hospital de Montilla: R. Artacho, F. Caballero, E. del Campo, F.J. Garcı́a, J.A. Guzmán, M. López, M. López. Hospital de Cabra: E. Aguilar, M.C. de la Fuente, P. Lara, E. Morán, F. Soriano. GRANADA. Hospital Virgen de las Nieves: E. Aguayo, M. Colmenero, R. de la Chica, R. Dı́az, M. Garcı́a, F. Manzano, R. Melgares, A. Reina, A. Sánchez. Hospital San Cecilio: J.L. Ballesteros, F. Barranco, A. Fernández, R. Fernández, J.C. Frı́as, F. González, S. Narbona, L. Olivencia, A. Rallo, R. Ramı́rez, S. Schiaffino, M.E. Yuste. Hospital de Baza: J.L. Bellot. Hospital de Motril: M. Árias, M.A. Dı́az, A. Estivill, R. Garcı́a del Moral, J.I. Martı́n. Clı́nica Inmaculada: A. Estivill. HUELVA. Hospital Juan Ramón Jiménez: M. Castillo, P. Domı́nguez, H. González, A. Hierro, M. Márquez, M.P. Ponce, M. Sánchez, A. Tristancho. Hospital Infanta Elena: J.C. F. Felices-Abad et al Martı́nez. Hospital Riotinto: A. Álvarez, O. Barakat, J. Carbajal, P. Ortega, E. Pino, I.Romero. JAEN. Hospital Sanjuán de la Cruz: A. Bartolomé. Complejo hospitalario de Jaen: M. Expósito, J. F. Machado, A. Morante, JA. Rodrı́guez, M. Ruiz. Hospital San Agustı́n: J.A. Camacho, A. de Molina, B. Jurado. Hospital Alto Guadalquivir. A.J. Bayona, M.A. Fernández, S. Galindo. MÁLAGA. Hospital Virgen de la Victoria: D. Daga, M.V. de la Torre, J. del Rı́o, M.A. Estecha, A. Garcı́a, A. Hernández, J. Vidal, M. Nieto, M.C. Reina. L. Ruiz, J.M. Ruiz, C. Salazar, N. Zamboschi. Hospital Costa del Sol: J.A. Arboleda, Y. Fernández, F.J. Garcı́a, F.J. Lobato. J.F. Prieto, B. Zayas. Hospital de Antequera: A. Varela. Hospital de la Axarquı́a: M. Delange, C. Martos, J. Merino. SEVILLA. Hospital de la Merced: D. del Toro, L.R. Enamorado. Hospital Valme: T. Contreras, D. Herrera, M. Marı́n, A. Úbeda. Clı́nica Santa Isabel: J. Fajardo. Hospital Nisa Aljarafe: E. Fernández, M. Pérez, M.J. Román, J.I. Sánchez. ARAGÓN. ZARAGOZA. Hospital clı́nico Universitario: E. Civeira, L. Mariano. L. Martı́n, E. Oliveira, N. Sánchez. Hospital Maz: I. Yuste. PRINCIPADO DE ASTURIAS. Hospital San Agustı́n Aviles: M. Rengell. ISLAS BALEARES. Hospital Can Misses: E. Bartual, J. Gonzalez. Clı́nica Palma Planas: R. Vicho. ISLAS CANARIAS. LAS PALMAS. Hospital Insular de Las Palmas: J.V. Galván, J. Huidrobo, A. Pérez, N. Rivero. SANTA CRUZ DE TENERIFE. Hospital Nuestra señora de la Candelaria: J. Martı́n. A. Servando. CASTILLA Y LEÓN. BURGOS. Hospital General Yagüe: J.M. Durán, A.J. Montón. LEÓN. Hospital de León: C. Cuellas. PALENCIA. Hospital de Palencia: A. Álvarez, J.M. Ası́n, J. López, J. Soques. SALAMANCA. Clı́nico de Salamanca: P. Pabón, I. Santos. SEGOVIA. Hospital General de Segovia. P. Ancillo. VALLADOLID. Hospital del Rı́o Hortera. R. Herrán, M. Lara, M.J. Rollán, J.J. Sanz. Hospital Universitario Valladolid. C. Hernández. ZAMORA. Hospital Virgen de la Concha: A. Álvarez, A. Caballero, J.A. Ortiz. CASTILLA – LA MANCHA. GUADALAJARA. Hospital Universitario Guadalajara: E. Yáñez. CATALUÑA. BARCELONA. Hospital Althaia Xarxa Manresa: J.M. Alcoverro Hospital de Hospitalet: J. Berrade, Hospital Parc Taulı́: X. Garcı́a, C. Guı́a, A. Ochagavı́a. Hospital General de Catalunya: A. Fernández, C. Fortia. Hospital General de Granollers: P. Velasco. Hospital de Terrasa: J. Amador, F. Jara. LERIDA. Hospital Arnau de Vilanova: M. Piqué. Clı́nica Ponent: C. Barbera. TARRAGONA. Hospital de Tortosa Verge de la Cinta: R. Claramonte. G.Sirgo. COMUNIDAD VALENCIANA. ALICANTE. Hospital General Universitario de Elche: F. Coves, E. de Miguel, J. Latour. Hospital General Universitario de Alicante: J. Cánovas, M. Delgado, M. Dı́az, F.A. Jaime. Hospital Universitari Sant Joan: C. Molla. Hospital de Levante: V. Ortola. Hospital Marina Baixa: J. Vaya, MC. Zazo. CASTELLÓN. Hospital Comarcal de Vinarós: F. Barrachina, C. Lorente, A. Oliva, R. Peña, G. Salinas, M.C. Santarrufina. Hospital de la Plana: C. Moragues, E.Porcar. Hospital General de Castellón: A. Ferrandis, A. Berenguer, S. Altaba, P. Casero, B. Vidal. VALENCIA. Hospital Universitario La Fe: R. Clemente, J. Cuñat, MP. Fuset, l. Madrid, M. Palomo, K. Vacacela, E. Villareal, Hospital de Sagunto: R. Calvo. Hospital Francesc de Borja: J. Minyana, J. Torres. Hospital Arnau de Vilanova: M. Garcı́a. Hospital General de Requena: C. Folgado. Casa de Salud: M. Talavera. EXTREMADURA. CACERES. Hospital San Pedro de Alcántara: A. Arana E. Corchero M. C. Corcobado. Hospital Virgen del Puerto: E. Guerra. GALICIA. LUGO. Complejo Hospitalario Xeral-Calde: R. Álvarez, M. L. Martı́nez, M. V. Nespereira. OURENSE. Complejo Ourense: M. J. de la Torre, R. Rodrı́guez. COMUNIDAD DE MADRID. MADRID. Hospital Severo Indicadores de calidad en el SCA para el análisis del proceso asistencial Ochoa: F. del Nogal, Hospital de Móstoles: F. J. Goizueta, T. Honrubia. Hospital del Henares: I. Torrejón. Hospital Universitario Prı́ncipe de Asturias: C. Martı́nez. Hospital Infanta Leonor: P. Rico. Hospital del Sureste: A. de Pablo. REGIÓN DE MURCIA. MURCIA. Hospital Universitario Reina Sofı́a: F. Felices-Abad. I. Cremades-Navalón, J. L. Espinosa-Berenguel, M. J. Gómez-Ramos, Á. López-Ferrer, F. Martı́nez-Lozano, L. Ortin-Katnich, C. Palazón-Sánchez, C. Susarte_Juliá, M. VigilVelis. LORCA. Hospital Rafael Méndez: C. L. Albacete, S. Nicolás. MELILLA. Hospital comarcal de Melilla: F. Rı́os. Bibliografı́a 1. Martı́n MC, Cabré Ll, Ruiz J, Blanch Ll, Blanco J, Castillo F, et al. Indicadores de calidad en el enfermo crı́tico. Med Intensiva. 2008;32:23–32. 2. Ballard DJ. Indicators to improve clinical quality across an integrated health care system. Int J Qual Health Care. 2003;15(Suppl 1):i13–23. 3. Mainz J. Defining and classifying clinical indicators for quality improvement. Int J Qual Health Care. 2003;15:523–30. 4. Mainz J. Developing evidence-based clinical indicators: A state of the art methods primer. Int J Qual Health Care. 2003;15: i5–i11. 5. Chen J, Sharon-Lise T. Normand. Myocardial infarction and quality of care. CMAJ. 2008;179:875–6. 6. Tu JV, Khalid L, Donovan LR, Ko DT. Indicators of quality of care for patients with acute myocardial infarction. CMAJ. 2008;179: 909–915. 7. SEMICYUC. Indicadores de calidad en el enfermo crı́tico.1st ed. 2005; p. 1–165. 8. Williams SC, Schmaltz SP, Morton DJ, Koss RG, Loeb JM. Quality of care in US hospitals as reflected by standardized measures, 2002–2004. N Engl J Med. 2005;353:255–64. 9. Williams SC, Watt A, Schmaltz SP, Koss RG, Loeb JM. Assessing the reliability of standardized performance indicators. Int J Qual Health Care. 2006;18:246–55. 10. Sánchez del Rı́o A, Baudet JS, Naranjo A, Campo R, Salces I, Aparicio JR, et al. Desarrollo y validación de indicadores y estándares de calidad en colonoscopias. Med Clin 2009 (en prensa). 11. Boix J, Lorenzo-Zúñiga V. A la búsqueda de la calidad en la colonoscopia. Med Clin (Barc). 2009, doi: 10.1016/ j.medcli.2009.09.022. 12. Nogué S, Puiguriguer J, Amigó M. Indicadores de calidad para la asistencia urgente de pacientes con intoxicaciones agudas (Calitox-2006). Rev Calidad Asistencial. 2008;23:173–91. 13. Garland A. Improving the ICU. Chest. 2005;127:2165–79. 14. Morris AH. Rational use of computerized protocols in the intensive care unit. Crit Care. 2001;5:249–54. 15. Donabedian A. Evaluating the quality of medical care. 1966. Milbank Q. 2005;83:691–729. 16. Carrasco G, Cabré L. Gestión de la calidad en medicina intensiva. En: Roca J, Ruiz J, editores. Gestión estratégica en medicina intensiva. Medicina Crı́tica Práctica, 1st ed. Barcelona: EdikaMed; 2006. p. 29–51. 17. Levy MM. Finding out what we do in the ICU. Crit Care Med. 2006;34:227–8. 18. Marco P, Zavala E. La calidad en la atención del SCA. En: López Messa JB, editores. Sı́ndrome coronario agudo. Nuevas perspectivas diagnósticas y terapéuticas. Medicina Crı́tica Práctica. EdikaMed, Barcelona, 2007. p. 111–29. 19. Bracco D, Favre JB, Bissonnette B, Wasserfallen JB, Revelly JP, Ravussin P, et al. Human errors in a multidisciplinary intensive care unit: a 1-year prospective study. Intensive Care Med. 2001;27:137–45. 415 20. Leape LL, Berwick DM. Safe health care: are we up to it? BMJ. 2000;320:725–6. 21. Chassin MR, Galvin RW. The urgent need to improve health care quality: Institute of Medicine National Roundtable on Health Care Quality. JAMA. 1998;280:1000–5. 22. Boersma E, Mercado N, Poldermans D, Gardien M, Vos J, Simoons ML. Acute miocardial infarction. Lancet. 2003;361: 847–858. 23. Sı́ndrome coronario agudo, emedicine, agosto 2007. Disponible en URL: http://emedicine.com/EMERG/topic31.htm. 24. Disponible en: http://www.Ariam.org. 25. ISIS-2. Randomised trial of intravenous streptokinase, oral aspirain, both, or neither among 17.187 cases of suspected acute myocardial infarction. Lancet. 1988;2:349–60. 26. Kaplan K, Davison R, Parker M, Przybylek J, Teagarden JR, Lesch M. Intravenous nitroglycerin for the treatment of angina at rest unresponsive to standard nitrate therapy. Am J Cardiol. 1983;51:694–8. 27. DePace NL, Herling IM, Kotler MN, Hakki AH, Spielman SR, Segal BL. Intravenous nitroglycerin for rest angina. Potential pathophysiologic mechanisms of action. Arch Intern Med. 1982;142: 1806–9. 28. Bassand JP, Hamm CW, Ardissino D, Boersma E, Budaj A, Fernández-Avilés F, et al. Guı́a de Práctica Clı́nica para el diagnóstico y tratamiento del sı́ndrome coronario agudo sin elevación del segmento ST. Rev Esp Cardiol. 2007;60: 1070.e1–1070.e80. 29. Van de Werf F, Bax J, Betriu A, Blomstrom-Lundqvist C, Crea F, Falk V, et al. Guı́as de Práctica Clı́nica de la Sociedad Europea de Cardiologı́a (ESC). Manejo del infarto agudo de miocardio en pacientes con elevación persistente del segmento ST. Rev Esp Cardiol. 2009;62:e1–47. 30. Yang EH, Brilakis ES, Reeder GS, Gersh BJ. Modern Management of Acute Myocardial Infarction. Curr Probl Cardiol. 2006;31: 769–817. 31. Roffi M, Chew DP, Mukherjee D, Bhatt D, White JA, Heeschen C, et al. Platelet glycoprotein IIb/IIIa inhibitors reduce mortality in diabetic patients with non-ST segment elevation acute coronary syndrome. Circulation. 2001;104:2767–71. 32. Vera A, Garcı́a T, Escudero JC. Modelos de estratificación del riesgo en el SCA. En: Sı́ndrome Coronario Agudo. Nuevas perspectivas diagnósticas y terapéuticas. Edika Med, Barcelona 2007. p. 31–46. 33. The GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med. 1993;329:673–82. 34. Eagle KA, Lim MJ, Dabbous OH, Pieper KS, Goldberg RJ, Van de Werf F, et al. A validated prediction model for all forms of acute coronary syndrome: estimating the risk of 6-month postdischarge death in an international registry. JAMA. 2004;291: 2727–2733. 35. Fox KA, Dabbous OH, Goldberg RJ, Pieper KS, Eagle KA, De Werf FV, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ. 2006;333:1091–6. 36. Granger CB, Goldberg RJ, Dabbous O, Pieper KS, Eagle KA, Cannon CP, et al. Predictors of hospital mortality in the global registry of acute coronary events. Arch Intern Med. 2003;163: 2345–2353. 37. Silber S, Albertsson P, Avilés FF, Camici PG, Colombo A, Hamm C, et al. Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J. 2005;26:804–47. 38. Al-Khatib SM, Granger CB, Huang Y, Lee KL, Califf RM, Simoons ML, et al. Sustained ventricular arrhythmias among patients 416 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. 52. 53. F. Felices-Abad et al with acute coronary syndromes with no ST-segment elevation: incidence, predictors, and outcomes. Circulation. 2002;106: 309–12. Srichai MB, Jaber WA, Prior DL, Marso SP, Houghtaling PL, Menon V, et al. Evaluating the benefits of glycoprotein IIb/IIIa inhibitors in heart failure at baseline in acute coronary syndromes. Am Heart J. 2004;147:84–90. Yan AT, Yan RT, Tan M, Chow CM, Fitchett DH, Georgescu AA, et al. ST-segment depression in non-ST elevation acute coronary syndromes: quantitative analysis may not provide incremental prognostic value beyond comprehensive risk stratification. Am Heart J. 2006;152:270–6. Lagerqvist B, Husted S, Kontny F, Naslund U, Stahle E, Swahn E, et al. A long-term perspective on the protective effects of an early invasive strategy in unstable coronary artery disease: two year follow-up of the FRISC-II invasive study. J Am Coll Cardiol. 2002;40:1902–14. Fox KA, Poole-Wilson P, Clayton TC, Henderson RA, Shaw TR, Wheatley DJ, et al. 5-year outcome of an interventional strategy in non-ST-elevation acute coronary syndrome: the British Heart Foundation RITA 3 randomised trial. Lancet. 2005;366:914–20. Mehta SR, Cannon CP, Fox KA, Wallentin L, Boden WE, Spacek R, et al. Routine vs. selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomized trials. JAMA. 2005;293:2908–17. Hoenig MR, Doust JA, Aroney CN, Scott IA. Early invasive versus conservative strategies for unstable angina & non-ST-elevation myocardial infarction in the stent era. Cochrane Database Syst Rev. 2006;3:CD004815. De Winter RJ, Windhausen F, Cornel JH, Dunselman PH, Janus CL, Bendermacher PE, et al. Early invasive versus selectively invasive management for acute coronary syndromes. N Engl J Med. 2005;353:1095–104. Cheitlin MD, Armstrong WF, Aurigemma GP, Beller GA, Bierman FZ, Davis JL, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). Circulation. 2003;108: 1146–62. Theroux P, Ouimet H, McCans J, Latour JG, Joly P, Levy G, et al. Aspirin, heparin, or both to treat acute unstable angina. N Engl J Med. 1988;319:1105–11. Theroux P, Waters D, Qiu S, McCans J, De Guise P, Juneau M. Aspirin versus heparin to prevent myocardial infarction during the acute phase of unstable angina. Circulation. 1993;88:2045–8. Cairns JA, Singer J, Gent M, Holder DA, Rogers D, Sackett DL, et al. One year mortality outcomes of all coronary and intensive care unit patients with acute myocardial infarction, unstable angina or other chest pain in Hamilton, Ontario, a city of 375,000 people. Can J Cardiol. 1989;5:239–46. Antithrombotic Trialists Collaboration. Collaborative metaanalysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002;324:71–86. CAPRIE Steering Committee. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet. 1996;348: 1329–39. Yusuf S, Zhao F, Mehta SR, Chrolavicius S, Tognoni G, Fox KK. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med. 2001;345:494–502. Budaj A, Yusuf S, Mehta SR, Fox KA, Tognoni G, Zhao F, et al. Benefit of clopidogrel in patients with acute coronary 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. syndromes without ST-segment elevation in various risk groups. Circulation. 2002;106:1622–6. Boersma E, Harrington RA, Moliterno DJ, White H, Theroux P, Van de Werf F, et al. Platelet glycoprotein IIb/IIIa inhibitors in acute coronary syndromes: a meta-analysis of all major randomised clinical trials. Lancet. 2002;359:189–98. Harrington RA, Becker RC, Ezekowitz M, Meade TW, O’Connor CM, Vorchheimer DA, et al. Antithrombotic therapy for coronary artery disease: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126:S513–48. Hirsh J, Raschke R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126:188S–203S. Yusuf S, Wittes J, Friedman L. Overview of results of randomized clinical trials in heart disease. II. Unstable angina, heart failure, primary prevention with aspirin, and risk factor modification. JAMA. 1988;260:2259–63. The MIAMI Trial Research Group. Metoprolol in acute myocardial infarction (MIAMI). A randomised placebo-controlled international trial. Eur Heart J. 1985;6:199–226. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet. 1993;342:821–8. Pfeffer MA, Braunwald E, Moye LA, Basta L, Brown Jr EJ, Cuddy TE, et al, on behalf of the SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med. 1992; 327:669–77. Torp-Pedersen C, Kober L. Effect of ACE inhibitor trandolapril on life expectancy of patients with reduced left-ventricular function after acute myocardial infarction. TRACE Study Group. Trandolapril Cardiac Evaluation. Lancet. 1999;354:9–12. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med. 2000;342:145–53. Braunwald E, Domanski MJ, Fowler SE, Geller NL, Gersh BJ, Hsia J, et al. Angiotensin-converting-enzyme inhibition in stable coronary artery disease. N Engl J Med. 2004;351:2058–68. Fox KM. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet. 2003;362:782–8. Dagenais GR, Pogue J, Fox K, Simoons ML, Yusuf S. Angiotensinconverting-enzyme inhibitors in stable vascular disease without left ventricular systolic dysfunction or heart failure: a combined analysis of three trials. Lancet. 2006;368:581–8. Danchin N, Cucherat M, Thuillez C, Durand E, Kadri Z, Steg PG. Angiotensin-converting enzyme inhibitors in patients with coronary artery disease and absence of heart failure or left ventricular systolic dysfunction: an overview of long-term randomized controlled trials. Arch Intern Med. 2006;166: 787–96. Yusuf S, Pogue J. ACE inhibition in stable coronary artery disease. N Engl J Med. 2005;352:937–9 author reply 937–9. LaRosa JC, He J, Vupputuri S. Effect of statins on risk of coronary disease. A meta-analysis of randomized controlled trials. JAMA. 1999;282:2340–6. LaRosa JC, Grundy SM, Waters DD, Shear C, Barter P, Fruchart JC, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352:425–35. Nissen SE, Tuzcu E, Murat E, Schoenhagen P, Brown BG, Ganz P, et al. Effect or intensive compared with moderate lipidlowering therapy on progression of coronary atherosclerosis. A randomized controlled trial. JAMA. 2004;291:1071–80. Indicadores de calidad en el SCA para el análisis del proceso asistencial 71. Cannon CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, et al. editores. El tratamiento hipolipemiante intensivo frente al moderado con estatinas tras sı́ndromes coronarios agudos. N Engl J Med (ed esp). 2004; 350:396–402. 72. Ridker PM, Cannon CP, Morrow D, Rifai N, Rose LM, McCabe CH, et al. C-reactive protein levels and outcomes after statin therapy. N Engl J Med. 2005;352:20–8. 73. Fox KA, Anderson FA, Dabbous OH, Steg PG, Lopez-Sendon JL, Van de Werf F, et al. Intervention in acute coronary syndromes: do patients undergo intervention on the basis of their risk characteristics? The global registry of acute coronary events (GRACE) Heart. 2007;93:177–82. 74. Mehta RH, Roe MT, Chen AY, Lytle BL, Pollack Jr CV, Brindis RG, et al. Recent trends in the care of patients with non-Stsegment elevation acute coronary syndromes: insights from the CRUSADE initiative. Arch Intern Med. 2006;166:2027–34. 75. Van de Werf F, Gore JM, Avezum A, Gulba DC, Goodman SG, Budaj A, et al. Access to catheterisation facilities in patients admitted with acute coronary syndrome: multinational registry study. BMJ. 2005;330:441. 76. Primary versus tenecteplase-facilitated percutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet. 2006;367:569–78. 77. Fernández-Avilés F, Alonso JJ, Pena G, Blanco J, Alonso-Briales J, López-Mesa J, et al. Primary angioplasty vs. early routine post-fibrinolysis angioplasty for acute myocardial infarction with ST-segment elevation: the GRACIA-2 non-inferiority, randomized, controlled trial. Eur Heart J. 2007;28:949–60. 78. Le May MR, Wells GA, Labinaz M, Davies RF, Turek M, Leddy D, et al. Combined angioplasty and pharmacological intervention versus thrombolysis alone in acute myocardial infarction (CAPITAL AMI study). J Am Coll Cardiol. 2005;46:417–24. 79. Fernández-Avilés F, Alonso JJ, Castro-Beiras A, Vázquez N, Blanco J, Alonso-Briales J, et al. Routine invasive strategy within 24 hours of thrombolysis versus ischaemia-guided conservative approach for acute myocardial infarction with ST-segment elevation (GRACIA-1): a randomised controlled trial. Lancet. 2004;364:1045–53. 417 80. Mandelzweig L, Battler A, Boyko V, Bueno H, Danchin N, Fillipatos G, et al. The second Euro Heart Survey on acute coronary syndromes: characteristics, treatment, and outcome of patients with ACS in Europe and the Mediterranean Basin in 2004. Eur Heart J. 2006;27:2285–93. 81. Heras M, Marrugat J, Arós F, Bosch X, Enero J, Suárez MA, et al, en representación de los investigadores del estudio PRIAMHO. Reducción de la mortalidad por infarto agudo de miocardio en un perı́odo de 5 años. Rev Esp Cardiol. 2006;59:200–8. 82. Rogers WJ, Canto JG, Lambrew CT, Tiefenbrunn AJ, Kinkaid B, Shoultz DA, et al. Temporal trends in the treatment of over 1.5 million patients with myocardial infarction in the US from 1990 through 1999: The National Registry of Myocardial Infarction 1, 2 and 3. J Am Coll Cardiol. 2000;36:2056–63. 83. Carruthers KF, Dabbous OH, Flather MD, Starkey I, Jacob A, MacLeod D, et al., on behalf of the GRACE Investigators. Contemporary management of acute coronary syndromes: does the practice match the evidence? The global registry of acute coronary events (GRACE). Heart 2005;91:290–8. 84. Figueras J, Heras M, Baigorri F, Elosua R, Ferreira I, Santaló M. Resultados del III registro IAM CAT de pacientes con infarto de miocardio con elevación del segmento ST en Cataluña. Comparación con los registros IAM CAT I y II. Med Clin (Barc). 2009;133:694–701. 85. Bueno H, Bardaji A, Fernandez A, Marrugat J, Martı́ H, Heras M. Manejo del sı́ndrome coronario agudo sin elevación del segmento ST en España. Estudio DESCARTES (Descripción del Estado de los Sı́ndromes Coronarios Agudos en un Registro Temporal Español). Rev Esp Cardiol. 2005;58:244–52. 86. Civeira E, Del Nogal F, Alvarez AP, Ferrero J, Alcántara AG, Aguado GH, et al, Grupo de Trabajo de Cuidados Intensivos Cardiológicos y RCP. Recomendaciones para el diagnóstico y tratamiento del sı́ndrome coronario agudo sin elevación del segmento ST. Med Intensiva. 2010;34:22–45. 87. Latour-Pérez J, Navarro-Ruiz A, Ridao-López M, Cervera-Montes M. Using clopidogrel in non-ST-segment elevation acute coronary syndrome patients: a cost-utility analysis in Spain. Value Health. 2004;7:52–60.