HIDRUROS METÁLICOS
Anuncio

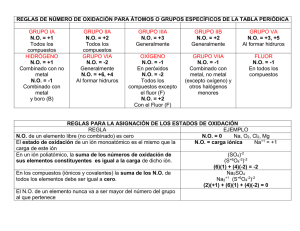
Dpto. de Física y Química 3º ESO Apuntes: SUSTANCIAS QUÍMICAS 1. NOCIONES PREVIAS 1.1. NÚMERO DE OXIDACIÓN Los compuestos son eléctricamente neutros, excepto los iones cuando los formulemos separadamente. Es decir, la carga que aporten todos los átomos de un compuesto tiene que ser globalmente nula, debemos tener en un compuesto tantas cargas positivas como negativas. Pero para saber cuál es la carga que aporta cada átomo vamos a emplear un concepto muy útil que se llama número de oxidación. El número de oxidación es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos. Las reglas prácticas pueden sintetizarse de la siguiente manera: En las sustancias simples, es decir las formadas por un solo elemento, el número de oxidación es 0. Por ejemplo: Auo, Cl2o, S8o. El 0xígeno, cuando está combinado, actúa frecuentemente con -2, a excepción de los peróxidos, en cuyo caso actúa con número de oxidación -1. El Hidrógeno actúa con número de oxidación +1 cuando está combinado con un no metal, por ser éstos más electronegativos; y con -1 cuando está combinado con un metal, por ser éstos más electropositivos. En los iones monoatómicos, el número de oxidación coincide con la carga del ión. Por ejemplo: Na+1 (Carga del ión) +1 (Número de oxidación) S-2 -2 (Número de oxidación) +3 Al +3 (Número de oxidación) Recordemos que los elementos de los grupos IA (1) y IIA (2) forman iones de carga +1 y +2 respectivamente, y los del VIIA (17) y VIA(16), de carga –1 y –2 cuando son monoatómicos. La suma de los números de oxidación es igual a la carga de la especie; es decir, que si se trata de sustancias, la suma será 0, mientras que si se trata de iones, será igual a la carga de éstos. Los no metales, usan los números de oxidación múltiples cuando se combinan con el oxígeno, de resto, usan el que está en el recuadro 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 1.2. SUSTANCIAS SIMPLES MONOATÓMICAS Y POLIATÓMICAS Los átomos se denominan con el nombre del elemento al que corresponden, sin terminación específica alguna. Cuando por necesidades de estequiometría sea necesario especificar el número de ellos que configuran el estado, se les pondrá el prefijo correspondiente. Ejemplos: H Monohidrógeno ; H2 Dihidrógeno (Hidrógeno) ; O2 Dioxígeno (oxígeno) ; O3 Trioxígeno (ozono) ; P4 Tetrafósforo ; S8 Octaazufre ; Sn Poliazufre. Su formulación es simplemente el símbolo del elemento al que representan, con el subíndice correspondiente en caso de que se trate de un elemento cuya representación común implique varios átomos. 1.3. IONES Cationes Monoatómicos Deben ser nombrados como elemento, sin cambio alguno. Es frecuente que se anteponga la palabra ión o catión. En caso de que puedan presentar más de un estado de oxidación, éste se indica después del nombre, mediante la notación de Stock; es decir, con números romanos entre paréntesis. Ejemplos: Cu 2+ Ión cobre (II) Cu +Ión cobre (I) I +Catión Iodo (I) Aniones Monoatómicos Se denominan, excepto para el oxígeno, con el nombre del elemento (a veces abreviado) con la terminación -uro. 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química Ejemplos: H- Ión Hidruro O 2- Ión óxido F- Ión Fluoruro (Cl, Br, I) S 2- Ión sulfuro (Se, Te ) N 3- Ión nitruro (P, As, Sb) Poliatómicos a) Algunos tienen nombres específicos. Ejemplos: OH - Ión hidróxido O2 2- Ión Peróxido b) En caso de no tener nombres específicos. Se nombran cada uno de los átomos que lo integran, con los prefijos griegos correspondientes cuando es más de uno, y se cambia la terminación del átomo central por -ato, indicando a continuación su estado de oxidación mediante la notación de Stock. Ejemplos: SO42CO32- Tetraoxosulfato (VI) Trioxocarbonato (IV) NO3- Trioxonitrato (V) ClO3- Trioxoclorato (V) 2. ÓXIDOS Son compuestos formados por un elemento cualquiera y el oxígeno. El oxígeno actúa con valencia -2. Se coloca primero el símbolo del elemento distinto del oxígeno y a continuación el del oxígeno. ÓXIDOS METÁLICOS: oxígeno + metal ÓXIDOS NO METÁLICOS: oxígeno + no metal Nomenclatura Sistemática: Óxido de nombre del elemento (colocando delante de cada uno el prefijo griego correspondientes) Ejemplos: Hg2O: óxido de dimercurio Fe2O3: trióxido de dihierro Cl2O5: pentaóxido de dicloro CO2: dióxido de carbono 3. HIDRUROS 3.1. Hidruros metálicos Son compuestos formados por un metal cualquiera y el hidrógeno. El hidrógeno actúa con número de oxidación -1. Se coloca primero el símbolo del elemento distinto del hidrógeno y a continuación el del hidrógeno. HIDRUROS METÁLICOS: hidrógeno + metal Nomenclatura Sistemática: Hidruro de nombre del metal (colocando delante de cada uno el prefijo griego correspondientes) Ejemplos: HgH: hidruro de mercurio FeH3: trihidruro de hierro 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 3.2. Hidruros no metálicos (hidrácidos) Son compuestos formados por un no metal de los grupos anfígenos o halógenos y el hidrógeno. El hidrógeno actúa con número de oxidación +1. Se coloca primero el símbolo del hidrógeno y a continuación el del elemento distinto del hidrógeno.El no metal siempre actuará con la valencia más pequeña. HIDRUROS NO METÁLICOS: hidrógeno + no metal Nomenclatura Sistemática: Nombre del ión no metálico (-uro) de hidrógeno (colocando delante de cada uno el prefijo griego correspondientes) Ejemplos: H2S: Sulfuro de dihidrógeno HCl: Cloruro de hidrógeno 3.3. Hidruros volátiles Son compuestos formados por un no metal de los grupos nitrogenoideos o carbonoideos o el boro y el hidrógeno. El hidrógeno actúa con número de oxidación -1. Se coloca primero el símbolo del elemento distinto del hidrógeno y a continuación el del hidrógeno. HIDRUROS VOLÁTILES: no metal + hidrógeno Estos compuestos son más conocidos por sus nombres vulgares: NH3 : Amoníaco CH4 : Metano PH3 : Fosfina SiH4 : Silano AsH3 : Arsina BH4 : Borano SbH3 : Estibina 4. SALES BINARIAS Dadas sus respectivas electronegatividades, es evidente que el metal constituye la parte electropositiva de la molécula y el no metal será la parte electronegativa. Se formulan, por tanto, colocando primero el metal y luego el no metal. SALES BINARIAS: metal + no metal Nomenclatura Sistemática: Nombre del ión no metálico (-uro) de nombre del metal (colocando delante de cada uno el prefijo griego correspondientes) Ejemplos: HgCl2: dicloruro de mercurio Fe2S3: trisulfuro de dihierro 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 5. HIDRÓXIDOS Son compuestos ternarios, formados por la combinación del grupo “OH” (como parte electronegativa) con cualquier metal o grupo electropositivo. El grupo OH (grupo hidróxido), actúa siempre con número de oxidación –1. HIDRÓXIDOS: metal + grupo (OH) Nomenclatura Sistemática: Hidróxido de nombre del metal (colocando delante de cada uno el prefijo griego correspondientes) Ejemplos: sodio. Fe(OH)2 : dihidróxido de hierro NaOH : Hidróxido de 6. ELEMENTOS QUÍMICOS BÁSICOS DE LOS SERES VIVOS Toda esta infinita variedad de compuestos la podemos encontrar en la naturaleza, unas forman parte de la materia que hay en el universo, incluido el planeta y otros forman parte de la materia de los seres vivos. 6.1. ALGUNAS SUSTANCIAS DE INTERÉS BILÓGICO En los seres vivos, el 98 % de su materia lo constituyen sólo 6 elementos. El oxígeno es también el elemento más abundante, seguido del carbono, el hidrógeno, el nitrógeno, el calcio y el fósforo. Estos dos últimos son constituyentes del esqueleto de los animales. El 2% restante está constituido por cloro, potasio, azufre, sodio, magnesio, hierro y yodo, así como por unos elementos que se hallan en cantidades ínfimas, pero que son indispensables para la vida; son los llamados oligoelementos(del griego oligos, ‘poco’). Los principales son el cobre, el cobalto, el flúor, el boro, el manganeso, el molibdeno y el cinc. Por ello, para mantenernos sanos necesitamos una dieta equilibrada. Así, el pescado azul es rico en yodo y calcio. Las verduras son ricas en sodio, calcio y hierro. Las almendras y avellanas contienen calcio y la yema del huevo contiene azufre, sodio, cinc, etc. 2% 1% 0.2% 3% oxígeno carbono 10% hidrógeno nitrógeno 20% 62% calcio fósforo otros 5 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 7. EL PETRÓLEO Y SUS DERIVADOS El petróleo es un hidrocarburo de color negruzco y de apariencia aceitosa. Se originó a partir del plancton y de los restos vegetales y animales acumulados en el fondo de los mares, mezclados con sedimentos. Posteriormente, se vieron sometidos a grandes presiones y temperaturas elevadas en condiciones anaerobias. La mayor parte del petróleo se encuentra acumulada en yacimientos subterráneos en bolsas a miles de metros de profundidad, por lo que es necesario hacer perforaciones en la corteza terrestre para su extracción. El petróleo es una mezcla de hidrocarburos, y en temas anteriores se estudió el método de la destilación fraccionada para la separación de todos sus componentes. Todos sus derivados tienen aplicaciones en diferentes actividades que son vitales para el funcionamiento de la sociedad, entre las más importantes destacan: Alquitrán y asfaltos Parafinas Queroseno Gasoil Gasolina Gas Obras públicas Industria química Combustible para la aviación Combustible diesel Combustible de coches y motores Combustible doméstico La industria química derivada del petróleo, la petroquímica, es actualmente la más importante del mundo, ya que mueve un enorme volumen de recursos humanos y económicos. Al ritmo del consumo actual, y previendo un desarrollo tecnológico como el actual o más importante, la explotación de los yacimientos en funcionamiento no cubre más allá de 45 años. Optimizando todos los recursos actuales y contando con el descubrimiento de posibles yacimientos en el futuro, las previsiones alcanzan sólo para los próximos 90 años, un horizonte demasiado inmediato en la historia de la humanidad. La problemática asociada a la extracción, transporte y consumo del petróleo es diversa. Por un lado se tienen los efectos contaminantes, por otro los efectos amibentales y por último los efectos sociopolíticos. Efectos contaminantes: La combustión de estos combustibles fósiles produce la emisión de grandes cantidades de gases como el CO2, el SO2 y diversos óxidos de nitrógeno que son los principales causantes del efecto invernadero y de la lluvia ácida. El uso del petróleo está contribuyendo por tanto al calentamiento global del planeta y drásticos cambios en el clima mundial, cuyas consecuencias son imprevisibles. Efectos medioambientales: El transporte del petróleo crudo por vía marítima no está exento de accidentes que producen las mareas negras. Estas catástrofes ecológicas tiene gran impacto tanto en la diversidad ecológica como en la actividad comercial y turística de donde se producen, como ejemplos más claros tenemos las mareas negras causadas por el Prestige en Galicia y el Exxon Valdez en Alaska. Efectos sociopolíticos: La dependencia absoluta que tiene la sociedad actual dl petróleo y sus derivados hace que disponer de él sea una cuestión de interés nacional para todos los países. El problema reside en que los principales productores de petróleo so países del 3er mundo, y esto provoca, desigualdades sociales en dichos países, injerencias de las grandes potencias mundiales en la política de estos países, que incluso pueden desembocar en guerras por el control del petróleo. 6 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 1. Indica los números de oxidación de los átomos presentes en los siguientes compuestos: CaO H2Se Cd(OH)2 Na2O H2O2 H2SO4 SO3 HCl HClO N2O5 NiCl3 CaSO4 SO2 CCl4 CaCO3 CO2 AlCl3 H2SO3 CuO NiS HNO3 SeO3 K2S Na3PO4 PbO2 LiOH AgNO3 NaH Cu(OH)2 FeH3 Al(OH)3 CH4 HgOH 2. Nombra los siguientes compuestos según la nomenclatura Stock: CaO Na2O SO3 N2O5 SO2 CO2 CuO SeO3 PbO2 NaH FeH3 CH4 H2Se HCl NiCl3 CCl4 AlCl3 NiS K2S LiOH Cu(OH)2 Al(OH)3 Cd(OH)2 HgOH 3. Formula los siguientes compuestos según la nomenclatura Stock: Óxido de manganeso (VII) Cloruro de sodio Dióxido de carbono Sulfuro de mercurio (I) Óxido de mercurio (I) Yoduro de potasio Óxido de hierro (III) Cloruro de Carbono (IV) Óxido de iodo (V) Fluoruro de calcio Hidruro de Oro (III) Hidróxido de níquel (II) Amoníaco Hidróxido de plata Seleniuro de hidrógeno Hidróxido de bismuto (III) Hidruro de cobre (II) Hidróxido de magnesio Metano Hidróxido de berilio 7 3º ESO Apuntes: SUSTANCIAS QUÍMICAS Dpto. de Física y Química 4. Nombra los siguientes compuestos según la nomenclatura sistemática: MgO Rb2O TeO3 As2O3 IO3 CoO Cu2O SeO PbO2 SrH2 AlH3 NH3 H2S HBr NiF3 PtCl4 AuCl3 Ag2S KI LiOH MgOH)2 Al(OH)3 Zn(OH)2 Sn(OH)2 5. Formula los siguientes compuestos según la nomenclatura sistemática: Óxido de mercurio Óxido de dilitio Monóxido de magnesio Trióxido de diselenio Pentaóxido de dicloro Trihidruro de hierro Hidruro de cesio Dihidruro de cobalto Arsina Bromuro de hidrógeno Telururo de dihidrógeno Tricloruro de fósforo Difluoruro de estroncio Dinitruro de trimanganeso Tetrabromuro de estaño Triyoduro de aluminio Dihidróxido de mercurio Hidróxido de oro Trihidróxido de hierro Hidróxido de rubidio Dihidróxido de estaño Hidróxido de sodio 6. Indica los iones en los que se separarían los siguientes compuestos: TeO3 PbO2 As2O3 NaH FeH3 H2Se NiCl2 AlFl3 CaS Cd(OH)2 HgOH KOH 8