clasificación, micromanipulación y congelado de embriones
Anuncio

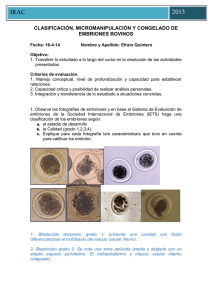
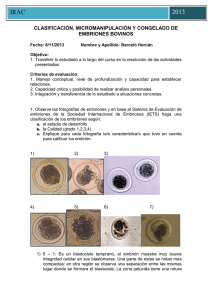
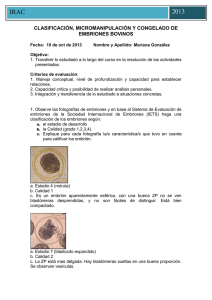
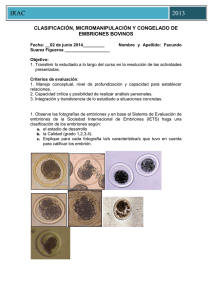
IRAC Espec [Año] CLASIFICACIÓN, MICROMANIPULACIÓN Y CONGELADO DE EMBRIONES BOVINOS Fecha: ___________ Nombre y Apellido: ___________________ Objetivo: 1. Transferir lo estudiado a lo largo del curso en la resolución de las actividades presentadas. Criterios de evaluación: 1. Manejo conceptual, nivel de profundización y capacidad para establecer relaciones. 2. Capacidad crítica y posibilidad de realizar análisis personales. 3. Integración y transferencia de lo estudiado a situaciones concretas. 1. Observe las fotografías de embriones y en base al Sistema de Evaluación de embriones de la Sociedad Internacional de Embriones (IETS) haga una clasificación de los embriones según: a. el estadio de desarrollo b. la Calidad (grado 1,2,3,4). c. Explique para cada fotografía la/s característica/s que tuvo en cuenta para calificar los embrión. IRAC Espec [Año] Foto N°1: Estadio: 4, 7 días. Calidad: 1 excelente, embrión ideal, esférico, simetrico, con células de tamaño, color y textura uniformes Foto N°2: Estadío: 7. 7,5 días. Calidad: bueno, pequeñas imperfecciones como algunas blastomeras sueltas, tamaño irregular o algunas vesículas. Foto N°3: Estadío: 7. 7,5 días. Clara diferencia entre el trofoblasto y el macizo celular interno. El embrión se identifica claramente y ocupa casi todo el espacio perivitelino. Calidad: Excelente, embrión esférico, simétrico, con células de tamaño, color y textura uniformes Foto N°4: Estadio 5 ó Blastocito temprano, cavidad con fluído ó blastocele, apariencia sello como anillo, se puede diferenciar el trofoblasto del macizo celular interno. Día 7-7,5.Calidad: bueno pequeñas imperfecciones como blastómeras sueltas, tamaño irregular o algunas vesículas Foto N°5: Estadio: 5. 7 días. Calidad: 2 Bueno: pequeñas imperfecciones, blastómeras sueltas, tamaño irregular y vesículas. Foto N°6: Estadio 4 Mórula. Dia 6 Calidad: 2 bueno, hay blastómeras sueltas, tamaño irregular, vesículas. Foto N°7: Estadio 6 o Blastocito. Calidad: degenerado, células de apariencia vesicular, granular y blastómeras sueltas y desorganizadas Foto N°8: Calidad: Infertilizado, puede ser confundido con una mórula compacta o con un blastocito expandido. Apariencia granular (puntillado) rodeado por una membrana vitelina lisa. IRAC Espec [Año] 2. Realice una comparación entre el método de congelado de embriones con etilenglicol y la vitrificación teniendo en cuenta: medios de congelado, toxicidad, curva de congelado, método de descongelado y practicidad (costos, entrenamiento, etc.). Etilenglicol (EG) -crioprotector intracelular -previene formación de cristales de hielo -evitan daños tóxicos u osmóticos a nivel celular Congelado de Embriones con Etilenglicol - Reemplaza el agua intracelular en las células de los embriones antes de la congelación. - Combinado con tasas lentas de congelamiento reduce los cambios de volumen celular y minimizan la formación de cristales de hielo dentro de las células. - Descongelación: debe realizarse rápidamente para evitar la recristalización ( aprox. a 250 ° C/min) Vitrificación - Involucra el uso de mezclas de crioprotectores como glicerol y etilenglicol, glicerol y propanediol o etilenglicol y propanediol con sacarosa, tetralosa o galactosa - Proceso de enfriamiento que permite la formación del estado vítreo de una solución, por medio de la extrema elevación de la viscosidad sin la presencia de cristalización. - El estado vítreo promueve la distribución iónica del líquido , impidiendo la formación de cristales de hielo en espacios intra y extracelulares - Reduce la ocurrencia de daños químicos y mecánicos que ocurren durante el enfriamiento y que si existen con el congelamiento - Las curvas de enfriamiento son más rápidas en comparación con el congelamiento, asociadas a mayores concentraciones de crioprotectores. - Lesiones tóxicas por el uso de altas concentraciones de crioprotectores - Lesiones osmóticas por alteraciones en el volumen celular durante la adición y dilución de las soluciones de crioprotectores dentro de las células embrionarias - Para disminuir la toxicidad y sus efectos existen estrategias, entre las cuales están : - uso de crioprotectores de baja toxicidad usando crioprotectores de bajo peso molecular y así reducir la concentración y tiempo de exposición dentro de las soluciones crioprotectoras, previniendo de igual forma los daños de tipo osmóticos causados en las células -asociación de uno ó más crioprotectores aminoran la toxicidad de las soluciones de vitrificación, al aumentar la permeabilidad de sus agentes y reducir la toxicidad específica de cada uno de los componentes por medio de la combinación de estructuras químicamente compatibles. La asociación más común es DMSO con EG. También soluciones hipertónicas compuestas por crioprotectores extracelulares IRAC Espec [Año] como proteínas , sacáridos o polímeros. Estas soluciones permiten disminuir los daños osmóticos al disminuir la velocidad de entrada de agua a las células, el más usado es la sacarosa. -la manipulación en la exposición de embriones a las soluciones crioprotectoras, puede determinar una mayor o una menos taza de sobrevivencia durante la vitrificación - al controlar por medio del tiempo y la temperatura de exposición son las principales variables porque son las que determinan los efectos osmóticos y tóxicos sobre las células embrionarias. La exposición de los embriones por etapas de la concentración final de la crioprotectora, disminuye el estrés osmótico , permitiendo que las células embrionarias tengan un mejor intercambio de líquidos a través de las membranas. Este principio es válido también durante el descongelamiento, al prevenir la velocidad de retirada del crioprotector de las células durante la dilución. - Las curvas de enfriamiento son fundamentales en el proporcionamiento del estado amorfo, al moento de la vitrificación. La vitrificación se logra con una concentración de de 1,5 M de cualquier crioproector, mientras que la tasa de enfriamiento que se emplee sea de 15000°C/min. Método de Congelado de Embriones 1° Exposición de los embriones a temperatura ambiente (22°C) a concentraciones molares de un crioprotector permeable de bajo peso molecular como EG, hasta que se alcanza el equilibrio entre la solución crioprotectora y el embrión 2° Inducción de la formación de cristales de hielo ( seeding) entre -5 y 7°C. 3° Descenso lento y controlado de la temperatura (0,33 a 11,0 °C/min) hasta los -30°C ó -35°C. 4° Colocación en nitrógeno líquido (N2; -196°C) donde puede permanecer almacenado indefinidamente 5° Descongelación controlad-2 6° Remoción del crioprotector a temperatura ambiente. 7° Transferencia del embrión a una receptora. La congelación de embriones se aplica en programas de transferencia de embriones, facilita el comercio internacional de genética. La criopreservación con etilenglicol tiene una gran ventaja porque permite la transferencia directa de embriones bovinos sin retirar el crioprotector luego del descongelado. La pajuela con el embrión se descongela en agua y una vez en útero, el crioprotector sale del embrión y este se hidrata con los fluidos del tracto reproductivo obteniendo una tasa de preñez del 58% IRAC Espec [Año] Curva de Congelado Método de Vitrificación - Exponer los embriones durante 1-3 min. A temperatura ambiente (20 °C) en una solución de equilibrio compuesta por: 10% DMSO + 10% EG en PBSm. - Pasar los embriones a una segunda solución, llamada solución de vitrificación, cuyo volumen no debe ser mayor a 5 ul. - Depositar los embriones en una tercera gota no mayor a 1 ul, para evitar el aumento de volumen, sin sobrepasar los 25 segundos, entre las dos gotas. Estas dos gotas de la solución de vitrificación tendrán una mayor concentración, compuestas por: 20% DMSO + 20% EG en PBSm. - Colocar posteriormente el extremo más fino de la OPS en la última gota, para que por medio de capilaridad, los embriones sean almacenados en el extremo inferior del envase, con el mínimo de volumen posible. - Sumergir inmediatamente la OPS en el nitrógeno líquido (-196°C) - Guardar las OPS dentro de gobelets, para poder ser almacenados dentro de los termos de nitrógeno Proceso de descongelamiento: Se realiza a través de la exposición de las OPS en gotas de 0,25 M de sacarosa, lo que permitirá el descongelamiento gradual y el control de la entrada de agua a las células.