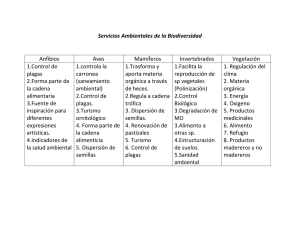
MÓDULO DE TRABAJO MÉTODOS BIOTECNOLÓGICOS
Anuncio

UNIVERSIDAD PRIVADA JOSE CARLOS MARIATEGUI FACULTAD DE INGENIERIA AGRONÓMICA MÓDULO DE TRABAJO MÉTODOS BIOTECNOLÓGICOS CONSULTOR ING. HERNÁN ALBARRACIN MORE CIP 69179 MOQUEGUA - PERÚ INDICE I. INTRODUCCIÓN 1.1. COMPETENCIAS 1.2. PRINCIPALES DEASAFÍOS 1.3. ÁREAS RELEVANTES 1.4. DIAGNOSTICO DE ENFERMEDADES 1.5. GLOSARIO APLICADO EN BIOTECNOLOGIA II. INTRODUCCIÓN AL CULTIVO IN VITRO 2.1. GENERALIDADES 2.2. CULTIVO IN VITRO DE MATERIAL VEGETAL 2.3. BASES BIOLOGICAS DEL CULTIVO DE TEJIDOS, TOTIPOTENCIALIDAD CELULAR 2.4. PASOS PARA GENERAR PLANTAS A PARTIR DE EXPLANTOS AISLADOS 2.5. ELEMENTOS NECESARIOS PARA HACER CULTIVO DE TEJIDOS VEGETALES 2.6. RELACIÓN DEL CULTIVO IN VITRO CON LA BIOTECNOLOGIA 2.6.1. La micropropagación 2.6.2. Ventajas de la micropropagación 2.6.3. Cultivo de meristemos 2.7. CULTIVO DE CÉLULAS Y ORGÁNOS VEGETALES EN BIORREACTORES 2.8. ASPECTOS RELEVANTES EN EL CULTIVO IN VITRO 2.8.1. Aplicaciones prácticas en el cultivo in vitro 2.8.2. Equipo y material necesario empleado en el cultivo in vitro 2.8.3. Condiciones del cultivo in vitro 2.8.4. Subcultivos o replicado 2.8.5. Fases del cultivo de meristemos 2.8.6. Fases del cultivo de embriones 2.8.7. Micropropagación 2.8.8. Cultivo de callo in vitro 2.8.9. Obtención de plantas haploides 2.8.10. Problemas en el cultivo in vitro 2.9. CONSIDERACIONES METODOLÓGICAS III. OBTENCION DE SEMILLA CERTIFICADA 3.1. INTRODUCCIÓN 3.2. OBTENCIÓN DE EMBRIONES SOMÁTICOS PARA PRODUCCIÓN DE SEMILLAS CERTIFICADAS 3.3. MULTIPLICACIÓN Y MANTENIMIENTO DE SEMILLAS 3.4. CONTROL DE CALIDAD DE SEMILLAS 3.5. ELEMENTOS DE UN PROGRAMA DE SEMILLAS 3.6. PRODUCCIÓN DE SEMILLA CERTIFICADA DE PAPA 3.6.1. Producción de semilla prebásica 3.6.2. Técnicas para la multiplicación de semilla de papa 3.6.3. Uso de semilla de papa 3.7. PRODUCCIÓN DE SEMILLA CERTIFICADA DE ARROZ 3.7.1. Importancia del uso de semilla certificada de arroz 3.7.2. Fases de producción para la obtención de semilla de arroz 3.8. MICROPROPAGACIÓN DE LA YUCA 3.8.1. Producción de estacas a partir de plantas obtenidas de embriones somáticos 3.8.2. Sistema de inmersión temporal, una alternativa para la producción de estacas IV. EMASCULACIÓN MASCULINA 4.1. INTRODUCCIÓN 4.2. EMASCULACIÓN 4.3. EMASCULACIÓN E HIBRIDACIÓN 4.4. TÉCNICAS DE EMASCULACIÓN Y POLINIZACIÓN 4.4.1. Técnicas de emasculación 4.4.2. Prácticas de polinización 4.5. EXPERIENCIAS EN EMASCULACIÓN 4.5.1. Experiencias en tomate 4.5.2. La construcción del promotor del gen end1 barnasa produce plantas transgénicas androestériles de tomate. 4.5.3. Potencial biotecnológico del promotor del gen end1 se extiende a la producción de frutos partenocárpicos en tomate. V. CONTROL DE VIRUS, HONGOS Y BACTERIAS 5.1. NUEVOS CONCEPTOS EN EL MANEJO INTEGRADO DE PLAGAS 5.1.1. Generalidades 5.1.2. Medidas de control convencional contra los virus 5.1.3. Enfermedades causadas por hongos 5.2. BIOTECNOLOGIA EN EL MANEJO INTEGRADO DE PLAGAS 5.2.1. Introducción 5.2.2. Los plaguicidas químicos 5.2.3. El manejo integrado de plagas como una opción para la agricultura sustentable. 5.2.4. Manejo integrado de plagas y biotecnología 5.2.5. Uso de agentes de control biológico en el MIP 5.2.6. Control químico (bioderivados) 5.2.7. Variedades resistentes 5.3. BACTERIAS PROMOTORAS DEL CRECIMIENTO DE PLANTAS 5.3.1. Biocontrol 5.3.2. Biofungicidas en el cultivo de papa 5.3.3. Prueba critica 5.3.4. Probacil 5.4. PRINCIPALES BACTERIAS Y HONGOS PATOGENOS PARA EL HOMBRE ASOCIADOS A LOS ALIMENTOS 5.4.1. Bacterias 5.4.2. Hongos I. INTRODUCCIÓN Las actividades de mejoramiento genético vegetal y animal se han basado tradicionalmente en el acceso a los recursos genéticos como fuente inicial de diversidad para el desarrollo de variedades y razas de plantas y animales adecuadas a las cambiantes necesidades del hombre. Numerosos materiales genéticos son evaluados para la selección de progenitores a ser utilizados en cruzamientos dirigidos para incorporar en el genoma de las variedades modernas, genes de diferentes fuentes y orígenes. En este contexto, la biotecnología y los recursos genéticos como áreas estratégicas complementarias tienen una importante aplicación en la producción primaria (el mejoramiento genético, la sanidad vegetal y la salud animal), en la agroindustria (el desarrollo de productos y protección de alimentos y la trazabilidad), y en la diversidad biológica y el ambiente (prospección de genes en recursos genéticos, bioremediación y bioseguridad). El gran avance alcanzado por la biología molecular y celular en los últimos años ha permitido el desarrollo de nuevas metodologías que se han ido integrando al mejoramiento tradicional. Al mismo tiempo estas herramientas de análisis molecular han permitido aumentar el conocimiento de los mecanismos genéticos básicos, los que aún son poco comprendidos. El desarrollo de estas tecnologías iniciadas en los 70 con el fenómeno tecnológico del ADN recombinante, avanza en los 80 con el desarrollo de la PCR y en los 90 con el diseño de numerosas e ingeniosas metodologías de análisis genómico, conocidas como los marcadores moleculares, estrechamente asociados a la genética molecular. Más recientemente el quiebre tecnológico ha sido el establecimiento de sistemas de secuenciación de genomas, que combinado al desarrollo de métodos de análisis de la información de secuencias (bioinformática), microtecnologías de análisis de ARN mensajeros (genómica funcional) y sus complementos proteicos (proteómica), constituye un panel que ha acelerado tremendamente el conocimiento del genoma completo de numerosas especies. Este desarrollo se ha traducido en la existencia de numerosos proyectos de genómica estructural y funcional, observándose un interés creciente en la aplicación de esos conocimientos para la descripción sistemática de la diversidad genética, aplicable tanto para los programas de mejoramiento como para la caracterización minuciosa de patógenos y plagas. La utilización de los nuevos recursos y herramientas biotecnológicas será clave para el estudio de los mecanismos biológicos y el establecimiento de las relaciones entre estructuras (genes) y función biológica (caracteres), en el contexto de estudios de genómica funcional, proteómica y el manejo de la información mediante avanzados protocolos de bioinformática. La intensa competencia en el campo de la biotecnología ha dado un gran impulso a la búsqueda, aislamiento, caracterización y manipulación de genes. Este desarrollo ha ido aparejado con un aumento de las iniciativas de patentamiento y otras formas de protección de propiedad intelectual asociadas a estos genes y procesos que se vinculan a los más diversos mecanismos biológicos. 1.1. COMPETENCIAS Con la excepción del caso de Brasil, con su iniciativa genómica en el estado de San Paulo, hay escasos ejemplos en estudios de genómica. Por ejemplo, en Argentina se ha trabajado últimamente en la secuenciación de “Brucella abortus”, agente causal de la brucelosis bovina. En Argentina se ha utilizado el desarrollo de marcadores de microsatélites de diversas variedades vegetales, como girasol (colaboración de INTA-Argentina con empresas semilleras locales). En varios países se han secuenciado fragmentos de genomas de virus y viroides (Argentina, Chile, Uruguay), contando con alguna capacidad de secuenciadores automáticos del tipo capilar. En Brasil se ha establecido una red de cooperación (ONSA) que inicialmente secuenció completamente la bacteria “Xylella fastidiosa” y posteriormente ha incursionado en el estudio de genómica funcional de células cancerosas, a la vez que se ha abocado a la caracterización del genoma de “Sacharum oficinales”. Es evidente que frente al estado del desarrollo de estas áreas en el mundo, en Sudamérica – exceptuando a Brasil - existen serias carencias, tanto de recursos humanos bien entrenados, como de una particular infraestructura y equipamientos cuyo costo no es despreciable. 1.2. PRINCIPALES DESAFÍOS La situación indicada anteriormente plantea la necesidad de integrar las capacidades científicas existentes, alcanzando economías de escala que hagan redituable la asociación entre los sectores público y privado e inserten el avance tecnológico. La integración de los esfuerzos, a través del fortalecimiento de redes cooperativas, permitirá resolver problemas de productividad, sanidad, trazabilidad, sustentabilidad y agregación de valor en productos agroindustriales de importancia estratégica para mejorar la competitividad e inserción del MERCOSUR ampliado en los mercados mundiales. Los desafíos específicos se centran en aumentar la productividad (por ejemplo, identificando QTLquantitative trait loci- asociados a rendimiento o tamaño de plantas), mejorar la calidad de productos (por ejemplo, analizando la diversidad de poblaciones de patógenos e identificando genes de plantas o animales que aporten resistencia/tolerancia a ellos), así como, en disminuir la dependencia de variedades y genes desarrollados y aislados por países del primer mundo. Se deberían desarrollar las capacidades para identificar genes propios del germoplasma poseído, identificados por metodologías de análisis genómico. Además, se deberían concretar soluciones para problemas propios de nuestra zona, que difícilmente pueden ser enfrentados por programas de mejoramiento genético ajenos a la misma. Otro aspecto estrechamente relacionado a la comercialización y competitividad de los productos es la disponibilidad de sistemas de identificación genética y de trazabilidad que aseguren detectar el origen de problemas específicos, a lo largo de las distintas fases de la cadena de valor. El desarrollo de las capacidades específicas deberá ser complementado por el fortalecimiento del sector de insumos y servicios que viabilicen el uso de los productos biotecnológicos, acompañado por el establecimiento de apropiados mecanismos de bioseguridad y claras reglas de propiedad intelectual. 1.3. ÁREAS RELEVANTES Las áreas de trabajo que debería orientar la organización de una plataforma de cooperación entre los países del MERCOSUR en Biotecnología podrían ser las siguientes: • Análisis genómico funcional de plantas, animales y microorganismos de interés. • Prospección génica de patógenos, plagas y malezas para desarrollar métodos de diagnóstico y control en plantas y animales. • Desarrollo de reactivos biológicos para la prevención de enfermedades de animales. • Identificación o diferenciación genética de cultivares o razas. • Identificación de genes o formas alélicas asociados a caracteres de interés agropecuario y agroindustrial que puedan ser incorporados en programas de mejoramiento genético. • Caracterización molecular de la diversidad biológica de colecciones de germoplasma de la zona que (i) faciliten su conservación y utilización, (ii) apoyen el establecimiento de colecciones núcleo, y (iii) posibiliten la ampliación del abanico de genes disponibles. • Desarrollo del área de la bioinformática que respalde el proceso de identificación y selección de genes de interés. Se sugiere que el eje de la propuesta sea preparar y consensuar una estrategia regional para la aplicación de información genómica, generada por sistemas de alta productividad disponibles a nivel local e internacional, en procesos productivos basados en la expresión funcional de diferentes recursos genéticos (vegetales, animales y microbianos) en los agro-ecosistemas existentes. La armonización de procedimientos bioinformáticos que faciliten la integración de múltiples fuentes de información para la integración de emprendimientos conjuntos con la participación de socios de diferentes países (de Sudamérica y del mundo) y origen sectorial (empresas, institutos públicos de investigación, universidades y centros de excelencia), articulados en una estructura de tipo consorcio. Se podrán definir proyectos específicos de genómica funcional, pero a la par establecer un proyecto de bioinformática y otro de insumos para ingeniería genética que vincularán transversalmente a cada proyecto. Los expertos en bioinformática deberán definir la naturaleza y operatividad de las posibles bases de datos que se construyan para cada proyecto (es decir, para cada especie). Por tanto, hay dos planos que se deben desarrollar paralelamente. Por un lado, los sistemas de secuenciamiento, microarreglos y proteómica y por el otro, la bioinformática y los insumos para ingeniería genética dedicados a desarrollar herramientas comunes que sirvan a los intereses de cada grupo o proyecto. 1.4. DIAGNÓSTICO DE ENFERMEDADES Actualmente, las pruebas de diagnóstico se han mejorado con el desarrollo de la biología molecular. Los métodos basados en la amplificación del ADN mediante la PCR, la identificación de secuencias de ADN específicas dentro del genoma, las técnicas de purificación de ADN y el establecimiento de mapas de restricción, permiten la detección sensible y específica de microorganismos patógenos prácticamente a partir de cualquier muestra biológica. Este tipo de diagnóstico está siendo utilizado en enfermedades de gran impacto económico como la tuberculosis, la brucelosis, la babesiosis, la leptospirosis en los bovinos, la fiebre porcina clásica, la ileítis, el síndrome respiratorio y reproductivo de los cerdos (PRRS) o la influenza aviar. La técnica utilizada fue una variante conocida como "anidada" (nested PCR), la cual permite detectar el equivalente del ADN de una micobacteria. Los resultados obtenidos mostraron que la PCR puede ser de gran utilidad en el diagnóstico de la tuberculosis bovina y debería utilizarse junto con la prueba de la tuberculina, la observación de lesiones y el cultivo para lograr un diagnóstico más preciso de la enfermedad. Por otra parte, los estudios epidemiológicos de las enfermedades infecciosas han tenido gran avance en los últimos años gracias al desarrollo de técnicas de biología molecular que permiten diferenciar entre sí cepas o aislados de los distintos microorganismos. Una de estas técnicas es el análisis del polimorfismo de la longitud de los fragmentos de restricción (RFLP), basado en la presencia en el genoma de secuencias específicas, las cuales pueden repetirse varias veces y localizarse en distintas regiones, lo que da origen al polimorfismo. La identificación de estas regiones se realiza mediante la hibridación con sondas específicas que las reconocen. La diferenciación de cepas también puede hacerse mediante la secuenciación de regiones específicas del genoma. Estas técnicas han sido utilizadas para establecer árboles genéticos de aislados de distintos microorganismos lo que facilita el realizar seguimientos epidemiológicos. 1.5. GLOSARIO APLICADO EN BIOTECNOLOGIA ADN (ácido desoxirribonucleico): Material genético de todas las células y de muchos virus; la molécula que codifica la información genética. El ADN es una molécula de cadena doble unida por enlaces débiles entre pares de bases de nucleótidos. Los cuatro nucleótidos del ADN contienen las bases adenina (A), guanina (G), citosina © y tiamina (T). En estado natural, los pares de bases se forman sólo entre A y T, y G y C, por tanto, la secuencia de las bases de una de las dos cadenas se puede deducir de la otra. Aminoácidos: Los bloques más básicos de construcción de todas las formas de vida. Los aminoácidos son moléculas que contienen grupos funcionales de amino y carboxilo. Anticuerpo monoclonal: Anticuerpo que se produce en masa en el laboratorio a partir de un solo clon y que reconoce sólo un antígeno. Los anticuerpos monoclonales se suelen producir mediante la fusión de una célula B, de corta vida, productora de anticuerpos, con una célula de crecimiento rápido, como una célula cancerosa. La célula híbrida resultante, o hibridoma, se multiplica rápidamente y crea un clon que produce gran cantidad de anticuerpos. Antígeno: En general, proteína que se halla en la superficie del virus y que estimula la respuesta inmunitaria, en particular, la producción de anticuerpos. Autoensamblaje molecular: Ensamblaje de moléculas sin dirección o intervención externa. El autoensamblaje puede producirse espontáneamente en la naturaleza, por ejemplo en células (como el de la membrana de doble capa lipídica) y otros sistemas biológicos, así como en sistemas modificados con intervención humana. Muchos sistemas biológicos se valen de este procedimiento para ensamblar varias moléculas y estructuras. La imitación de estas estrategias y la creación de nuevas moléculas capaces de autoensamblaje supramolecular, es una importante técnica de la nanotecnología. Bioinformática: El uso de las matemáticas aplicadas, la estadística y la ciencia de la informática para estudiar sistemas biológicos. Importantes sectores de investigación incluyen alineación de secuencias, búsqueda de genes, ensamblaje del genoma, alineación de la estructura de las proteínas, predicción de la estructura de las proteínas, predicción de la expresión de genes e interacciones entre las proteínas. Bioplaguicidas: Determinados tipos de plaguicidas derivados de materiales naturales, como animales, plantas, bacterias, y algunos minerales. Por ejemplo, el aceite de canola y el bicarbonato sódico se consideran bioplaguicidas. Biotecnología: Serie de técnicas biológicas obtenidas mediante la investigación básica y aplicadas a la investigación y elaboración de productos. La biotecnología se refiere al uso de ADN recombinante, la fusión de células y nuevas técnicas de bioelaboración. Cartografía genética: Proceso para determinar el lugar que ocupan los genes en un cromosoma. Célula: Unidad estructural y funcional básica de todos los organismos. Las células contienen ADN y otros muchos elementos que permiten su funcionamiento. Célula pluripotencial: Célula indiferenciada capaz de replicarse indefinidamente. Una célula pluripotencial puede también producir células especializadas para diversos tejidos del cuerpo, como músculo cardíaco, tejido cerebral y tejido hepático. Los científicos pueden mantener indefinidamente células pluripotenciales al convertirlas en las células especializadas que necesiten. Existen dos tipos básicos de células pluripotenciales. El primero es la célula pluripotencial embrionaria, que se obtiene de fetos abortados o de óvulos fertilizados sobrantes de la fertilización in vitro. Las células pluripotenciales embrionarias se usan para fines médicos y de investigación porque pueden producir células para casi todos los tejidos del cuerpo. El segundo tipo es la célula pluripotencial adulta, que no es tan versátil para fines de investigación porque sólo puede producir células para determinados tipos de material somático, como la sangre, los intestinos, la piel y los músculos. Celulasa: Complejo de enzimas que descompone la celulosa en beta glucosa. Se produce principalmente gracias a la acción de bacterias simbióticas presentes en el aparato digestivo de los herbívoros. Con excepción de los rumiantes, la mayor parte de los animales (incluidos los seres humanos) no produce celulasa, por lo que no pueden aprovechar gran parte de la energía contenida en el material vegetal. Colágeno: La proteína principal del tejido conjuntivo y la más abundante en los mamíferos. Es el componente principal de ligamentos y tendones. Corte y empalme de genes: Aislamiento de un gen de un organismo y su introducción posterior en otro organismo mediante técnicas de biotecnología. Cosecha tolerante a los herbicidas: Plantas de cosecha creadas para sobrevivir a las aplicaciones de uno o más herbicidas comerciales mediante la incorporación de determinados genes por medios biotecnológicos, tales como la ingeniería genética o métodos tradicionales de selección, como la mutación natural, química o por radiación. Cromosomas: Estructura genética de las células que contiene el ADN celular capaz de replicarse a sí misma. Los seres humanos tienen 23 pares de cromosomas. Cry1A: Proteína derivada de la bacteria Bacillus Thuringiensis, tóxica para algunos insectos cuando la ingieren. Esta bacteria es muy común en la naturaleza y se ha usado durante decenios como insecticida, aunque constituye menos de dos por ciento del total de los insecticidas usados. Cultivar: En botánica, planta obtenida o seleccionada deliberadamente y mantenida mediante cultivo. Cultivo de tejidos: Proceso de obtención de una planta en el laboratorio a partir de células en vez de semillas. Esta técnica se utiliza en el cultivo tradicional de plantas y en la biotecnología agrícola. Derivado de la biotecnología: El uso de la biología molecular o tecnología de ADN recombinante, o transferencia de genes in vitro, para elaborar productos o dotar de características concretas a plantas u otros organismos vivos. Doble hélice: Estructura en forma de escalera helicoidal que adoptan dos cadenas de ADN cuando nucleótidos complementarios en cadenas opuestas se enlazan. Estudio del perfil de la expresión genética: Método de análisis de la expresión de miles de genes simultáneamente en una placa de cristal llamada micromatriz. Expresión genética: Proceso por el cual la información de un gen se convierte en las estructuras y funciones de una célula. Flujo de genes: Transferencia de genes de una población a otra de la misma especie, por migración o dispersión de semillas y polen. Gen: Unidad física y funcional fundamental de la herencia. Un gen es una secuencia ordenada de nucleótidos que ocupan una posición determinada en un cromosoma que codifica un producto funcional concreto, como una proteína o una molécula de ARN. Genética: Estudio de las leyes de la herencia de determinadas características. Genoma: Todo el material genético de los cromosomas de un organismo determinado. Gestión de la resistencia: Estrategias que se pueden emplear para retrasar la aparición de la resistencia. En el caso de los insectos, estas estrategias incluyen el uso de un "refugio" en el que el insecto no está sometido a los efectos del pesticida usado en el resto del campo. Hélice alfa: Estructura común de proteína que se encuentra, en particular, en el pelo, la lana, las uñas y los cuernos de los animales, y que se caracteriza por una cadena espiral única de aminoácidos estabilizados por enlaces de hidrógeno. Híbrido: Semilla o planta producida como resultado de polinización cruzada controlada, a diferencia de la resultante de la polinización natural. Las semillas híbridas se seleccionan para que tengan características de mejor calidad (por ejemplo, mayor rendimiento o tolerancia a las plagas). Ingeniería genética: Técnica para eliminar, modificar o agregar genes a una molécula de ADN con objeto de cambiar la información que contiene. Al cambiar esta información, la ingeniería genética cambia el tipo o la cantidad de proteínas que puede producir un organismo, y de este modo le permite hacer nuevas sustancias o realizar nuevas funciones. Línea germinal: Línea (secuencia) de células germinales que contienen material genético que se puede transmitir a un hijo. Maíz Bt: Planta de maíz obtenida mediante biotecnología para que sus tejidos expresen una proteína tóxica para algunos insectos, pero inocua para los seres humanos y otros mamíferos. Máquina molecular: Ensamblaje de un número diferenciado de componentes moleculares destinados a realizar una función concreta. Cada componente molecular realiza un solo acto, mientras que la estructura supramolecular total realiza una función más compleja, resultante de la cooperación de diversos componentes moleculares. Mejora genética tradicional: Modificación de plantas y animales mediante la mejora selectiva. Las prácticas usadas en la mejora genética tradicional de plantas pueden incluir aspectos de biotecnología tales como cultivo de tejidos y mejora por mutación. Mejora selectiva: El cruce o apareamiento deliberado de organismos con objeto de que la progenie tenga una característica deseada derivada de uno de los progenitores. Moléculas de ADN recombinante (ADNr): Combinación de moléculas de ADN de origen diverso, enlazadas mediante tecnologías de ADN recombinante. Mutación: Todo cambio en la secuencia del ADN que se pueda heredar. Nanomedicina: Campo médico que está avanzando rápidamente, en el que los científicos elaboran una gran variedad de nanopartículas y nanodispositivos, de apenas una millonésima de pulgada de diámetro, para mejorar la detección del cáncer, fortalecer las respuestas inmunitarias, reparar tejidos dañados y evitar la arteriosclerosis. A principios del 2005, la Administración de Alimentos y Fármacos de Estados Unidos aprobó una nanopartícula fusionada al medicamento contra el cáncer Taxol, para el tratamiento del cáncer de mama avanzado. En Estados Unidos se está usando con carácter experimental otra nanopartícula en pacientes cardíacos, para mantener abiertas las arterias coronarias después de una operación de angioplastia. Nanómetro: Milmillonésima parte de un metro. Nanotecnología: Sistema para transformar la materia, la energía y la información, basado en componentes a escala nanométrica, con características moleculares definidas con precisión. También, las técnicas que producen o miden características de menos de 100 nanómetros de tamaño. Nucleótido: Componente celular que es uno de los bloques fundamentales de los ácidos ribonucleico (ARN) y desoxirribonucleico (ADN). En los sistemas biológicos, los nucleótidos se enlazan mediante enzimas para formar largos polinucleótidos semejantes a cadenas de secuencia definida. Organismo modificado genéticamente (OMG): Con frecuencia, la etiqueta OMG y el término "transgénico" se emplean para referirse a organismos que han adquirido genes nuevos de otros organismos mediante métodos de transferencia genética en laboratorios. Patógeno: Agente causante de enfermedades, en particular un microorganismo vivo, como una bacteria o un hongo. Péptido: Fragmentos de una proteína, de dos o más aminoácidos en una cadena, semejante a brazaletes de cuentas. Cuando se digieren las proteínas de la carne animal, se descomponen primero en péptidos y luego en sus aminoácidos constitutivos. Plaguicidas microbianos: Plaguicidas cuyo ingrediente activo es un microorganismo, por ejemplo una bacteria, un hongo o un protozoo. Los plaguicidas microbianos pueden controlar muchos tipos de plagas distintas, aunque cada ingrediente activo está relativamente dirigido contra una plaga concreta. Por ejemplo, algunos hongos controlan determinados tipos de malas hierbas y otros matan a determinados insectos. Los plaguicidas bacterianos más usados son subespecies y cepas del Bacillus thuringiensis, o Bt. Polen: Células portadoras del ADN masculino de una planta de simiente. Polimorfismos de nucleótido único (SNP): Relaciones entre genes y poblaciones de prueba para conseguir variaciones en el código genético que puedan aumentar el riesgo de una enfermedad o respuesta determinada a un medicamento. Productos basados en la biología: Combustibles, productos químicos, materiales de construcción, energía eléctrica o térmica, derivados de materiales biológicos. El término puede incluir cualquier producto energético, comercial o industrial, distinto de alimentos o piensos, que utilice material biológico o materiales agrícolas (vegetales, animales y marinos) o forestales, domésticos renovables. Protectores para las plantas (PIP): Anteriormente conocidas como plaguicidas vegetales, son sustancias que actúan como plaguicidas producidos o usados por una planta para protegerse de plagas tales como insectos, virus y hongos. Proteína de la membrana celular: Molécula proteínica adherida o asociada a la membrana de una célula. Proteína: Molécula de gran tamaño, compuesta por una o más cadenas de aminoácidos en un orden concreto. El orden está determinado por la secuencia de bases de nucleótidos en el gen que codifica la proteína. Las proteínas son necesarias para la estructura, función y regulación de las células, los tejidos y los órganos del cuerpo, y cada proteína desempeña una función singular. Ejemplos de proteínas son las hormonas, las enzimas y los anticuerpos. Proteómica: Uso de tecnologías como la espectrometría en masa para detectar marcadores biológicos proteínicos en la sangre que pueden indicar señales tempranas de enfermedades, incluso antes de que aparezcan los síntomas. Uno de estos marcadores es la proteína C reactiva, indicadora de cambios inflamatorios en las paredes de los vasos sanguíneos que presagian arteriosclerosis. Reacción en cadena de polimerasa (PCR): Técnica para copiar y ampliar las cadenas complementarias de una molécula determinada de ADN. Es un método in vitro que amplía en alto grado o hace millones de copias de secuencias de ADN que, de otro modo, no podrían ser detectadas o estudiadas. Recombinación: Proceso por el cual la progenie hereda una combinación de genes distinta de la de sus progenitores. Resistencia a los plaguicidas: Cambio genético en respuesta a la selección por un plaguicida que da por resultado la formación de cadenas capaces de sobrevivir a una dosis letal a una mayoría de individuos en una población normal. La resistencia se puede producir en insectos, malas hierbas y patógenos. Selección natural: Concepto ideado por Charles Darwin, según el cual, los genes que producen las características más favorables en un entorno determinado serán más abundantes en la generación siguiente. Tecnología de ADN recombinante: Procedimiento usado para unir segmentos de ADN en un sistema acelular (entorno situado fuera de una célula u organismo). En condiciones apropiadas, una molécula de ADN recombinante puede entrar en una célula y replicarse allí, bien sea de manera autónoma o después de haberse integrado en un cromosoma celular. Terapia genética: Técnica médica experimental consistente en la inserción de genes en las células y los tejidos de un individuo para tratar una enfermedad. Normalmente, un gen defectuoso se reemplaza por otro que funciona normalmente. En la mayoría de los casos, el gen normal se introduce en los tejidos mediante un adenovirus alterado genéticamente para asegurar su inocuidad. Transferencia de genes: Técnica común en biología molecular para provocar un cambio genético mediante la toma y recombinación de ADN. Transgénico: Organismo que contiene genes modificados por la inserción de ADN de un organismo extraño. Se produce cuando genes extraídos de una especie se insertan en otra especie para obtener una característica determinada expresada en la progenie. Variedad: Subdivisión de una especie para su clasificación taxonómica. Usado como sinónimo del término "cultivar", designa a un grupo de individuos genéticamente distinto de otros grupos de individuos de la misma especie. Una variedad agrícola es un grupo de plantas similares que, por sus características estructurales y comportamiento, pueden distinguirse de otras variedades de la misma especie. Virus: Entidad biológica no celular que sólo puede reproducirse dentro de una célula huésped. Los virus consisten en ácido nucleico recubierto de proteína. Algunos virus animales también están recubiertos de una membrana. Dentro de la célula infectada, el virus se vale de la capacidad sintética del huésped para su replicación. II. INTRODUCCIÓN AL CULTIVO IN VITRO 2.1. GENERALIDADES El cultivo de tejidos vegetales o cultivo in vitro de tejidos vegetales, es una técnica de reproducción en condiciones totalmente asépticas, en la que a partir de un pequeño segmento inicial de tejido es posible regenerar en poco tiempo miles o millones de plantas genéticamente iguales a la planta madre, cuando a este tejido le es aplicado un estímulo por medio de variables físicas y químicas controladas en un medio de cultivo. A diferencia de las técnicas tradicionales de cultivo, esta poderosa herramienta permite la propagación de grandes volúmenes de plantas en menor tiempo; así como el manejo de las mismas en espacios reducidos. Por otro lado, la técnica es de gran utilidad en la obtención de plantas libres de patógenos; plantas homocigotos, en la producción de plantas en peligro de extinción, en estudios de ingeniería genética, etc. El enorme potencial que posee esta metodología ha propiciado que en los últimos 25 años se haya incrementado el número de laboratorios de cultivo de tejidos en el país para la producción comercial de plantas ornamentales y frutales al lo que ha motivado que algunos floricultores la estén utilizando como una alternativa viable en sus programas de producción. El cultivo in vitro (término que literalmente significa en vidrio), incluye muchas técnicas destinadas a introducir, multiplicar y regenerar, entre otros recursos, material vegetal o animal en condiciones controladas y asépticas. El cultivo in vitro, constituye un paso fundamental en la obtención y regeneración de plantas genéticamente modificadas o transgénicas, mediante técnicas de ingeniería genética. Es decir que existe una estrecha relación entre el cultivo de tejidos vegetales y la biotecnología moderna. Normalmente se utilizan cultivos de tejidos, seguido de la regeneración de la planta completa, y la subsiguiente expresión de los genes introducidos o transgenes. 2.2. CULTIVO IN VITRO DE MATERIAL VEGETAL Cultivo de tejidos vegetales, es una descripción genérica que involucra diferentes técnicas de cultivo de material vegetal diverso, incluyendo las de protoplastos (células desprovistas de su pared celular), células, tejidos, órganos y plantas completas. Mediante éstas y otras técnicas de cultivo es posible obtener plantas libres de microbios en un medio nutritivo aséptico (estéril) en condiciones ambientales controladas. Las primeras experiencias relacionadas al cultivo de tejidos vegetales se remontan a 1902, pero recién en 1922 se logró el primer experimento exitoso: germinación in vitro de semillas de orquídeas. Luego de la germinación, las plántulas obtenidas se transfirieron a un medio de cultivo en condiciones asépticas y así se mantuvieron protegidas del ataque de patógenos (hongos, virus y bacterias). Esta técnica tiene numerosas aplicaciones: - Propagación masiva de plantas, especialmente beneficiosa para especies de difícil propagación por otros métodos, o en vías de extinción. - Clonación de individuos de características agronómicas muy deseables durante todo el año - Obtención de plantas libres de virus. - Producción de semillas sintéticas. - Conservación de germoplasma: material de un conjunto de individuos que representa la variabilidad genética de una población vegetal. - Obtención de metabolitos secundarios. - Producción de nuevos híbridos. - Mejora genética de plantas, incluyendo obtención de plantas transgénicas. - Germinación de semillas. - Producción de haploides. - Estudios fisiológicos diversos. Algunas de estas aplicaciones se ilustran en la Figura 1. Figura 1. Aplicaciones del cultivo de tejidos en plantas. A la izquierda, micropropagación de violeta africana a partir de trozos de hojas desinfectados e introducidos en condiciones de esterilidad. A la derecha, semillas sintéticas formadas por embriones somáticos, obtenidos por cultivo de células, encapsulados en una matriz inerte (como alginato de calcio). Fotografía tomada de http://www.sp.edu.sg/schools/cls/bioline_08.htm 2.3. BASES BIOLÓGICAS DEL CULTIVO DE TEJIDOS, TOTIPOTENCIALIDAD CELULAR Antes de comenzar con la descripción del cultivo de tejidos vegetales y sus aplicaciones, se muestra la anatomía de una planta en la figura 2. Figura 2: las partes de una planta angiosperma. Adaptado del Libro “Biotecnología”, UNQ 2006. Respecto del proceso de transformación vegetal, existen distintas técnicas para la transferencia de genes a las células vegetales, siendo las principales la interacción con bacterias del género Agrobacterium y el método de Biobalística. Una vez realizada la transformación genética por alguno de estos dos métodos, el paso siguiente es el cultivo in vitro, con el fin de regenerar plántulas a partir del explanto inicial transformado, proceso que se sustenta en el principio de “totipotencialidad celular”. De aquí la importancia del cultivo in vitro como paso fundamental para la obtención y regeneración de plantas genéticamente modificadas (ver figura 3). Figura 3. Cultivo de tejidos y transformación vegetal. En la figura se observan explantos que luego del proceso de selección han perdido coloración y aquellas células transformadas exitosamente se han desdiferenciado y rediferenciado para dar origen a un brote. La reproducción asexual de plantas por cultivo de tejidos es posible gracias a que, en general, las células de un individuo vegetal poseen la capacidad necesaria para permitir el crecimiento y el desarrollo de un nuevo individuo, sin que medie ningún tipo de fusión de células sexuales o gametos. Esta capacidad se denomina totipotencialidad celular y es característica de un grupo de células vegetales conocidas como células meristemáticas, presentes en distintos órganos de la planta. Básicamente, la reproducción asexual se puede realizar debido a que las células vegetales poseen un mecanismo de división mitótico, al igual que las células animales, mediante el cual cumplen sucesivas etapas de crecimiento y desarrollo. La división celular mitótica implica una replicación de los cromosomas de las células hijas, por lo que las mismas poseen un genotipo idéntico al de la célula madre. La potencialidad de una célula diferenciada (una célula de conducción, epidérmica, etc.) para generar tejidos nuevos y eventualmente un organismo completo, disminuye con el grado de diferenciación alcanzado por esa célula, pero puede revertirse parcial o completamente según las condiciones de cultivo a las que se la someta. Así, las células vegetales crecidas en condiciones asépticas sobre medios de cultivo adicionados con hormonas vegetales, pueden dividirse dando dos tipos de respuesta: - Una desdiferenciación celular acompañada de crecimiento tumoral, que da lugar a una masa de células indiferenciadas denominada callo, la cual bajo las condiciones adecuadas es capaz de generar órganos o embriones somáticos (llamados así porque son estructuras similares a un embrión pero que no se originaron por unión de gametos). - Una respuesta morfogenética por la cual se forman directamente órganos (organogénesis) o embriones (embriones somáticos). La primera respuesta se conoce como órgano génesis o embriogénesis indirecta (mediada por un estado de callo), mientras que la segunda respuesta se considera órgano génesis o embriogénesis directa. Como se comentó previamente, el cultivo in vitro consiste en tomar una porción de una planta (a la que se denomina explanto, como por ejemplo el ápice, una hoja o segmento de ella, segmento de tallo, meristemo, embrión, nudo, semilla, antera, etc.) y colocarla en un medio nutritivo estéril (usualmente gelificado, semisólido) donde se regenerará una o muchas plantas. La formulación del medio cambia según se quiera obtener un tejido desdiferenciado (callo), crecer yemas y raíces u obtener embriones somáticos para producir semillas artificiales. El éxito en la propagación de una planta dependerá de lograr la expresión de la potencialidad celular total, es decir, que algunas células recuperen su condición meristemática. Para lograrlo debe inducirse primero la desdiferenciación y luego la rediferenciación celular. Un proceso de este carácter sucede durante la formación de las raíces adventicias en el enraizamiento de estacas, la formación de yemas adventicias o cuando se busca la propagación de begonias, violeta africana (ver figura 1) o peperonias mediante porciones de hojas. Entre los factores más importantes a tener en cuenta para lograr la respuesta morfogenética deseada, es la composición del medio de cultivo. En todo intento de propagación vegetal, ya sea in vitro o in vivo, el carácter del proceso de diferenciación depende del genoma de la especie y está regulado por el balance hormonal propio y por el estado fisiológico del órgano, tejido o célula puesta en cultivo. Sin embargo, también se sabe que ese balance puede ser modificado por el agregado de compuestos que imiten la acción de las hormonas vegetales. Esos compuestos, denominados reguladores del crecimiento, son los que se emplean en los medios de cultivo para conseguir la micropropagación de una planta. 2.4. PASOS PARA GENERAR PLANTAS A PARTIR DE EXPLANTOS AISLADOS En los protocolos utilizados durante el cultivo in vitro se pueden distinguir las siguientes etapas, sintetizadas en la figura 4: - Elección de la planta y/o tejido donante de explantos. - Establecimiento: desinfección de los explantos (generalmente con hipoclorito de sodio) y su posterior adaptación al medio artificial de modo de inducir callo, brote, raíz o embrión somático, según se desee. - Multiplicación: generar una masa vegetal suficiente para la regeneración del número de plantas necesarias. - Enraizamiento: formación de raíces con el fin de convertir los brotes o embriones somáticos en plántulas completas. - Rusticación: aclimatación de las plántulas obtenidas in vitro a las condiciones medioambientales ex vitro (suelo o algún sustrato inerte) Figura 4. Etapas de la regeneración in vitro de maíz. Fuentes: http://www.cid.csic.es/departaments/genetica/torne/indexC.html y http://www.biologie.unihamburg.de/b-online/e28_2/maize.html El éxito de la técnica depende de muchos factores, entre ellos la edad de la planta (a mayor edad, menor potencial de regeneración), el genotipo y las condiciones medioambientales. Entre las ventajas del cultivo in vitro de material vegetal se pueden incluir los tiempos más cortos y la posibilidad de ocupar un espacio mucho más pequeño que si se desea propagar material in vivo. 2.5. ELEMENTOS NECESARIOS PARA HACER CULTIVO DE TEJIDOS VEGETALES Para llevar adelante este trabajo se necesitan equipamientos que generen las condiciones necesarias de esterilidad como los flujos laminares, que son estaciones de trabajo que hacen circular aire filtrado y estéril, protegiendo así a la muestra con la que se desea trabajar (figura 5). Figura 5. Flujos laminares para el cultivo de tejidos. Se observa uno de los modelos de flujo laminar que puede usarse para preservar la esterilidad de las muestras. Imagen: www.jaelsa.com/laboratorio4.html Además, se necesita un soporte para el explanto, que puede ser sólido o líquido y que está conformado por algún agente gelificante inerte (agar, gelrite, etc.), macro y micronutrientes esenciales para la supervivencia de la planta, nutrientes (hidratos de carbono, vitaminas), agentes reguladores del crecimiento y hormonas vegetales (ver Tabla 1), que ayudarán a obtener una planta completa o un órgano vegetal en particular, a partir del explanto elegido (en condiciones de esterilidad). Algunos de los elementos mencionados pueden ser reemplazados por mezclas poco definidas en su composición (jugo de tomate, agua de coco, etc.), que pueden dar buenos resultados y generalmente resultan más económicas. La acidez de los medios de cultivo para plantas suele variar entre pH de 5 y 6,5. Luego, se regulan las condiciones de temperatura y de fotoperíodo (relación de horas luz y horas oscuridad). Según sea el balance hormonal y otras condiciones de cultivo se puede propiciar la regeneración de distintos órganos o formaciones vegetales. Por ejemplo, si el balance de citoquininas/auxinas (ver Tabla 1) es mayor a 1, se favorece la generación de brotes, si es menor a 1, la generación de raíces, si es igual a 1, la formación de callos. Tabla 1. Composición de medios de cultivo para células vegetales. COMPONENTES Agua destilada CARACTERÍSTICAS Y EJEMPLOS Representa el 95% del medio nutriente Fuente de carbono Generalmente se usa sacarosa. La fuente de carbono se necesita porque los explantos no son completamente autótrofos y no pueden cubrir sus necesidades con la fotosíntesis que pueden realizar in vitro. Sustancias inorgánicas Macroelementos (N, P, K, Ca, Mg, S) y microelementos (Fe, Co, zn, Ni, B, Al, Mn, Mo, Cu, I), en una proporción adecuada para la planta elegida. Vitaminas Vitaminas B1, B2, B6, vitamina H, vitamina E, ácido fólico, ácido nicotínico, entre otras. Hormonas y reguladores del crecimiento Auxinas: promueven la elongación celular, la formación de callos y raíces adventicias, inhiben la formación de brotes axilares adventicios y, a veces, inhiben la embriogénesis. Citoquininas: promueven la división celular, regulan el crecimiento y el desarrollo de los tejidos vegetales Otras: giberalinas, ácido absícico, etileno. Mezclas de sustancias poco definidas Materiales inertes Ejemplos: extracto de levadura, extractos vegetales. Usados como soporte. Incluyen agar, azarosa, otros polisacáridos, lana de vidrio, papel de filtro, arena. Adaptada del Libro Biotecnología, UNQ 2006. 2.6. RELACIÓN DEL CULTIVO IN VITRO CON LA BIOTECNOLOGÍA 2.6.1. La Micropropagación La propagación de plantas in vitro es una técnica de la biotecnología muy utilizada en cultivos de importancia económica. Como fue mencionado anteriormente permite cultivar células, tejidos, órganos, semillas, embriones y obtener individuos selectos en forma rápida. Los cultivos son realizados por personal especializado, con agentes específicos (hormonas, minerales, vitaminas, fuente de carbono, agente gelificante, agua, etc.) y en condiciones ambientales controladas (temperatura, humedad y luz) (figura 6). Una vez ajustados los protocolos para la especie o cultivo de interés, es posible automatizar el proceso de modo de llevarlo a escala industrial. La micropropagación (propagación clonal por cultivo in vitro) constituye uno de los métodos biotecnológicos que mayores logros ha aportado al desarrollo de la agricultura. Se aplica en la producción masiva de especies hortícolas, aromáticas, medicinales, frutícolas, ornamentales y forestales. 2.6.2. Ventajas de la micropropagación - Posibilita incrementar rápidamente nuevos materiales. - Permite controlar las condiciones ambientales. - Permite estudiar diversos procesos fisiológicos. - Evita el riesgo de que proliferen agentes patógenos (se realiza en medios esterilizados). - Se pueden obtener gran cantidad de individuos en espacios reducidos. - Permite la obtención de individuos uniformes. - Facilita el transporte del material. Figura 6. La micropropagación vegetal. A partir de una planta madre se obtienen numerosos explantos que sujetos a condiciones y medios de cultivo adecuados, darán lugar a nuevas plantas iguales o similares a la planta original, permitiendo su multiplicación. Adaptado de “Biotecnología”, UNQ 2006. 2.6.3. Cultivo de meristemos En la yema apical se encuentra un grupo de células que conforman el meristemo apical (con un tamaño entre 0,01 y 0,3 mm). Es un tejido embrionario que tiene la capacidad de formar todos los tejidos de la planta y regenerar plantas completas (figura 7). Figura 7. Cultivo de meristemos. A partir de un meristemo aislado se puede obtener una planta completa. Adaptado de “Biotecnología”, UNQ 2006. El cultivo de meristemos tiene numerosas aplicaciones. Una de las más importantes es la obtención de plantas libres de virus, ya que esta pequeña zona de tejido generalmente no está afectada por estos patógenos vegetales. Otra aplicación es la multiplicación vegetal de enorme potencial. A partir de una yema apical se pueden obtener 4 millones de claveles en un año. La técnica permite multiplicar especies de plantas con reproducción lenta o dificultosa (como las orquídeas) o acelerar la producción de plantas bianuales. 2.7. CULTIVO DE CÉLULAS Y ÓRGANOS VEGETALES EN BIORREACTORES Una vez obtenidos los callos a partir de algún explanto, los mismos pueden disgregarse para obtener una suspensión de células. La misma puede utilizarse para generar embriones somáticos (la base de las semillas sintéticas) o puede directamente cultivarse para producir metabolitos secundarios, que son compuestos químicos sintetizados por las células vegetales en determinadas condiciones, con gran utilidad para las industrias farmacéutica y alimenticia, entre otras. Por ejemplo, son metabolitos secundarios el mentol y las drogas anticancerígenos vincristina y taxol, algunos edulcorantes, entre otros. Los cultivos celulares se llevan a cabo en biorreactores, que son recipientes de distinta capacidad (de unos pocos a miles de litros) diseñados para propiciar el crecimiento y/o la multiplicación de distinto tipo de células y/u órganos (figura 8). . Figura 8. Cultivo de células y órganos vegetales. A partir de un explanto se pueden establecer cultivos de células para producir compuestos de interés o para obtener embriones somáticos y semillas artificiales, entre múltiples aplicaciones. Adaptado de Biotecnología-UNQ, 2006. Las raíces vegetales también pueden ser cultivadas en biorreactores, especialmente aquellas transformadas por Agrobacterium rhizogenes, que producen un aumento abrupto en el tamaño y ramificación de la raíz, aumentando así la biomasa, y por ende la cantidad de producto deseado. Un ejemplo de compuesto farmacológico producido por cultivo de raíces es el paclitaxel o taxol, que es utilizado como anticancerígeno. 2.8. ASPECTOS RELEVANTES EN EL CULTIVO IN VITRO El cultivo in vitro es muy costoso, entre otros detalles porque no se puede mecanizar. Sólo son rentables aquellos laboratorios grandes y con mercado. La planta ya desarrollada en el cultivo in vitro necesita una primera aclimatación en el laboratorio; en el invernadero y después una segunda aclimatación en el campo. Los viveros grandes realizan ambas operaciones; otros sólo se encargan del primer paso. Figura 9. Fase de aclimatación en invernadero 2.8.1. Aplicaciones prácticas en el cultivo in vitro • Propagación vegetativa. Esto es lo más práctico. Dos técnicas: - Micropropagación de estaquillas - Organogénesis de callos • Producción de plantas libres de virus mediante dos técnicas: - Cultivo de meristemos - Microinjerto in vitro • Permite hacer germinar semillas que son muy difícil de hacer en condiciones normales. Ejemplo: algunas Orquídeas tienen en los campos unos parásitos obligados y en viveros no se pueden reproducir; se inoculan esos parásitos o in vitro. • Eliminar la inhibición de germinación de las semillas. El cultivo in vitro es lo más eficaz porque tiene determinados inhibidores y algunos huesos de frutales no son capaces de germinar ya que no tiene desarrollado el embrión. • Prevención del aborto embrionario como resultado de incompatibilidad. Se da en cruces de interés científico o intergenéticos, sobre todo en plantas herbáceas. Los cruces incompatibles dan abortos. • Aplicación en mejora genética para obtener híbridos, para introducir material genético, etc. • Acortar los ciclos de mejora genética. No hay que esperar que pase el periodo juvenil del árbol para ver resultados. • Producción de haploides. Cruzamientos o cultivo de polen (anteras). Teniendo ventajas como la obtención rápida de homocigotos y producción de híbridos. 2.8.2. Equipo y material necesario empleado en el cultivo in vitro - Autoclave - Cámara de flujo laminar - Medio de cultivo - Planta - Cámara de cultivo Figura 10. Autoclave Para esterilizar todo lo que vamos a utilizar: agua, algunos nutrientes, material, etc. se utiliza la cámara de flujo laminar. No se pueden meter proteinas. Es como una olla a presión, pero de mayor tamaño, donde se controla la presión y la temperatura (hasta 120º). Figura 11. Cámara de flujo laminar. El medio de cultivo es donde se realizan todas las manipulaciones con la planta. Es un habitáculo con un operario en un ambiente estéril. Se usan rayos ultravioletas para esterilizar el aire. Figura 12. Medio de cultivo. Se verte agua y nutrientes (hormonas) en un tubo de ensayo, que se tapa con un tapón. Dependiendo del material que se va a propagar, el tubo se pone vertical o un poco inclinado. Figura 13. Planta. El material vegetal de partida puede ser del campo, pero esto conlleva un alto riesgo de enfermedades y contaminación, aunque se lave mucho y bien. Lo más corriente es utilizar brotes que crecen en condiciones controlada para que halla menos infecciones. La cámara de cultivo es una habitación de dimensiones muy variables, en la que se controlan las condiciones de luz, temperatura, humedad, variación día-noche, etc. Figura 14. Cámara de cultivo. 2.8.3. Condiciones del cultivo in vitro • En la cámara de flujo laminar no puede entrar material contaminado. El problema más importante en todo el proceso del cultivo in vitro son las contaminaciones. • En el autoclave no se pueden meter determinadas sustancias, como vitaminas, antibióticos, ácido giberélico, sacarosa, encimas, extractos vegetales, etc., ni tampoco recipientes que no soporten altas temperaturas. • El vidrio ha de ser de muy buena calidad para que no suministre al medio sustancias contaminantes para la planta. Normalmente se prepara el medio y se filtra directamente. El problema es que se absorben en el filtro determinadas sustancias. • Los reguladores de crecimiento (hormonas) son imprescindibles, ya que sin ellos no se puede hacer el medio de cultivo. • El pH ideal es 6, pero puede oscilar entre 5,5 y 6,5. • Se necesita agar y medio sólido 0,6-0,9%. • El medio de cultivo realmente sólo tiene que llevar agua, fuente de energía (azúcares) y reguladores de crecimiento. • El medio de cultivo es secreto, y se pueden tardar dos años en prepararlo. • En la cámara de cultivo se aplican cantidades variables de luz (16-20 horas). También existen plantas que se desarrollan en la oscuridad. Las temperaturas también varían. Lo normal son 22-26ºC, aunque en ocasiones se exigen fríos de 4ºC y también 28-30ºC para plantas tropicales. • Igualmente, en el éxito de esta técnica de propagación también influyen determinadas características de la planta, como el tipo, genética e incluso el tipo de implante, parte más juvenil o más adulta. • En cuanto a los recipientes, deben permitir el intercambio de gases, pero evitar la pérdida de agua, lo que provocaría un aumento de la concentración de sales, y por tanto la muerte de la planta. De ahí la importancia del cierre. 2.8.4. Subcultivos o replicado Cuando sembramos microestaquillas en cultivo in vitro, no nos interesa que se emitan raíces ni hojas, sino que se produzca una proliferación (crecimiento) para obtener nuevas microestaquillas. Son lo que se denominan subcultivos. No se pueden hacer infinitamente ya que se agota el material vegetal; tan sólo se hace 8-10 veces. Ocurre entonces lo siguiente: - El medio nutritivo se agota y se seca. - El material vegetal ocupa todo el tubo. - Se produce un cambio de olor en el medio (sustancias tóxicas). - El medio se hace líquido. 2.8.5. Fases del cultivo de meristemos 1. Toma un ápice meristemático (0,2-1 mm). 2. Siembra en el medio del tubo. 3. Fase de proliferación: crecimiento de brotes. Subcultivos. 4. Fase de enraizamiento (cambiar el medio). 5. Primera fase de aclimatación. Es muy importante el que la planta pueda llegar o no al campo. Invernaderos, bolsas de plástico, bandejas de vidrio, etc. 6. Segunda fase de aclimatación. Siempre en invernadero. 7. Plantación en el campo. 2.8.6. Fases del cultivo de embriones Se utiliza mucho en manzano. 1. Se desinfecta el fruto en alcohol. Se flamea. 2. Se coge el embrión de la semilla. 3. Se inocula en el tubo. 4. A las 1-2 semanas, la planta está más o menos reconocible. 5. Se deja crecer y se pasa por las fases de aclimatación. 2.8.7. Micropropagación Figura 15. Se parte de una yema, bráctea o axilar y se empieza a desarrollar en el medio de cultivo Entre la fase de proliferación y de enraizamiento hay muchos subcultivos (para obtener más plantas). El número de subcultivos depende del material vegetal. Ejemplo de micropropagación de Kiwi: - Se parte de un trozo de tallo. - Al cabo de 4 semanas se obtiene una yema y crece un brote. - En la fase de proliferación intentamos obtener gran cantidad de brotes. - Sacamos microestaquillas del primer brote, haciendo subcultivos cada 6-8 semanas vidrio. hasta llenar el - Al aumentar la concentración de auxinas se obtienen plantas enraizadas. - Puede hacerse de forma industrial y la fase de enraizamiento se hace en vivo. 2.8.8. Cultivo de callo in vitro Se parte de un trozo de hoja o de tallo, bien de una planta madre de maceta o de una planta que viene de cultivo in vitro. El medio puede ser sólido o líquido. Se forma entonces una estructura de callo, de la que parten brotes, o también proembriones, que al unirse forman una estructura similar al embrión. A partir de entonces se desarrolla normalmente. 2.8.9. Obtención de plantas haploides Normalmente se trabaja con la antera en su totalidad, no con granos de polen en particular. No se riega nunca por aspersión (riesgo de patógenos), siempre con regadera. De una yema de flor se coge una antera antes de que se abra y se hace un cultivo; bien por embriogénesis u organogénesis. - Embriogénesis: se forman células (poliembriones). - Organogénesis: se forma una estructura de callo que puede venir o bien de tejidos de la antera (diploide), o bien del grano de polen (haploide). 2.8.10. Problemas en el cultivo in vitro Figura 16. Contaminación grave. La vitrificación, es una reacción de las plantas que las hace adquirir apariencia de vidrio. La única solución es hacer un subcultivo de material sano, es decir, se saca y se cortan los trocitos que estén bien. 2.9. CONSIDERACIONES METODOLÓGICAS El tema desarrollado en este módulo se vincula con conceptos previos que los alumnos poseen, probablemente de la vida cotidiana, como es la multiplicación de plantas que pueden realizar en su propio jardín o huerta. Es importante retomar en clase estas ideas previas y trabajarlas a partir de los conceptos teóricos que se presentan en el módulo. Esto se verá favorecido con el análisis de textos y con la realización de un trabajo práctico, el cual puede llevarse a cabo en la Universidad con materiales cotidianos y en forma sencilla. Si estos temas se incluyen al trabajar el tema reproducción, es interesante que los alumnos puedan establecer similitudes y diferencias entre los diferentes tipos y mecanismos de reproducción que presentan las plantas y los animales. Se pueden incluir conceptos tales como: órganos reproductivos, células sexuales, meiosis, mitosis, fecundación, gestación, semilla, útero, etc. Los temas vinculados con las plantas y su crecimiento se abordan habitualmente desde los niveles básicos de la enseñanza universitaria, particularmente a partir de experiencias de germinación de semillas o del estudio de la fotosíntesis. Sin embargo, los conceptos vinculados con el ciclo de vida de las plantas suelen ser temas complejos y que en ocasiones llevan a errores conceptuales. Entre ellos uno de los más frecuentes entre los alumnos es la confusión entre los procesos de fotosíntesis y respiración en las plantas, o la poca claridad en cuanto a la relación entre la flor, el fruto y la semilla. Si bien este módulo no está destinado específicamente a trabajar esos conceptos, es importante clarificarlos, y se pueden incorporar al estudiar la reproducción en animales, en el ser humano, y comparar las estructuras y procesos que involucran. La comprensión de estos procesos permite interpretar cómo la biotecnología podría intervenir en su modificación. Otro aspecto que es posible trabajar con los alumnos es el concepto mismo de la clonación. Habitualmente se considera la clonación una técnica nueva debido fundamentalmente a la difusión que recibió en los medios de comunicación la clonación de la oveja dolly. Es interesante interpretar la clonación de plantas como un procedimiento antiguo (que de hecho realizan en sus casas al cortar un gajo de una planta) y a su vez plantear las diferencias que presenta con la clonación de animales, cuyas células difieren en cuanto a su totipotencialidad. Este módulo, a su vez, resulta una fuente interesante de información que se puede adaptar al aula en trabajos más simples destinados a comprender cómo trabajan los investigadores, cómo se realiza un cultivo de células y cómo es posible observar células. Se sugiere introducir estas ideas a partir de conocimientos más cotidianos que tienen los alumnos. Por ejemplo, es posible que a muchos alumnos se les haya practicado en alguna oportunidad un exudado de fauces, como consecuencia de una infección o dolor de garganta. Se puede utilizar este caso para explicar, qué hace luego el médico con esa muestra, cómo se hace el cultivo de células en el laboratorio de análisis, la detección de bacterias y la realización de un antibiograma para determinar el antibiótico a recetar. Esta sería una aplicación práctica y más próxima a los alumnos que podría acercar el concepto de cultivo de células y su utilidad, más allá de su uso en la investigación básica. Para trabajar estas ideas se sugiere realizar una experiencia simple de cultivo de microorganismos. Si se cuenta con microscopios se puede intentar hacer un preparado a partir de esas colonias y verlo al microscopio con la idea de detectar células individuales, y si en la escuela cuentan con preparados de células, vegetales o animales, es interesante realizar la observación al microscopio, el registro de lo observado y su interpretación. III. OBTENCIÓN DE SEMILLA CERTIFICADA 3.1. INTRODUCCIÓN Después de la tierra, el clima y el hombre, el factor de mayor importancia para la producción agropecuaria lo constituyen las semillas de las diferentes especies vegetales ya que, la semilla es el medio por el cual se lleva al agricultor todo el potencial genético de un cultivar con características superiores. Por ello para que una semilla realmente tenga impacto en la agricultura, es necesario que, además de ser de alta calidad y de una variedad mejorada, sea usada largamente por los agricultores, de esta manera aumentará la producción y productividad, ayudará a una utilización más eficiente de insumos debido a una mayor uniformidad de emergencia y vigor de plantas. Si bien es cierto la forma de multiplicación vegetativa es ventajosa por que permite mantener las características propias de la variedad por generaciones, no es menos cierto también que es una fuente eficaz para la diseminación de plagas y enfermedades que afectan grandemente a los cultivos. 3.2. OBTENCIÓN DE EMBRIONES SOMÁTICOS PARA PRODUCCIÓN DE SEMILLAS CERTIFICADAS Las averiguaciones que se realizan en diversos centros de investigación, se orientan a obtener variedades con resistencia a determinadas enfermedades, utilizando suspensiones celulares que regeneran embriones somáticos y sobre este material se aplican distintos métodos de selección conteniendo extractos crudos de los patógenos responsables de dichas enfermedades. Las plantas inicialmente seleccionadas fueron inoculadas adicionalmente a nivel de vivero, siendo los primeros desarrollos muy promisorios. Muy poco se ha hecho en embriogénesis somática en relación con plantas ornamentales, debido a que el producto es costoso y el requisito de homogeneidad en la población es alto. Estas especies preferentemente son propagadas por métodos menos costosos, como la proliferación de brotes axilares, microesquejes, yemas, meristemos, etc. Por otra parte, la embriogénesis somática tiene poco uso actualmente en plantas arbóreas importantes en la agricultura, ya que se requieren estudios básicos, pruebas de largo plazo para verificar la estabilidad genética y la necesidad de optimizar los protocolos de germinación de los embriones somáticos. 3.3. MULTIPLICACIÓN Y MANTENIMIENTO DE SEMILLAS Cuando un fitomejorador desarrolla una variedad puede asegurar que las características que ha mejorado son genéticamente estables. Sin embargo, mantener las características genéticas de la variedad mejorada mientras se multiplica la semilla, es una obligación adicional de cualquier programa de semillas bien estructurado. Durante la producción de semilla, el control de calidad es la base central de la actividad. En todas las fases, desde la multiplicación, acondicionamiento y almacenamiento hasta la distribución y mercadeo, se deben realizar periódicamente pruebas e inspecciones que garanticen un control adecuado del proceso. Este control se realiza bajo dos esquemas: el primero consiste en un sistema de multiplicación de generaciones y el segundo en la verificación cualitativa de esas semillas. En el primer esquema, el control de la pureza varietal se alcanza mediante la multiplicación de un número limitado de generaciones, en el cual la semilla es incrementada a partir de la clase genética, que luego pasa al Programa de Certificación de Semilla para producir semilla de fundación, preservando así la pureza. Posteriormente, esta semilla se entrega a los productores autorizados para su multiplicación y obtención de semilla registrada y certificada. Bajo este sistema, la tercera generación o semilla certificada es usualmente la semilla destinada a la producción del cultivo comercial. El segundo esquema se rige por dos fases sucesivas; la primera mediante inspecciones de campo y la segunda por verificaciones en el laboratorio, a través de pruebas de análisis de semillas, en donde las evaluaciones básicas, certifican la idoneidad del material en cuanto a su pureza genética o varietal, la humedad, la germinación y la pureza física. 3.4. CONTROL DE CALIDAD DE SEMILLAS La calidad de la semilla está determinada por la combinación de diferentes indicadores: genéticos (identidad varietal), físicos (aspecto de la semilla), fisiológicos (vigor, germinación y longevidad) y sanitarios (libre de plagas y enfermedades) que pueden afectar de una u otra forma el desarrollo normal de la planta en el campo. La determinación de la calidad mediante la utilización de diferentes técnicas es importante en la producción de cualquiera de las cuatro clases de semillas, evitando los efectos adversos que pueden presentarse en la introducción de nuevos materiales que no cumplen con todos los requisitos. La pureza varietal es la característica que garantiza el alcance de la uniformidad comercial del producto, utilizando para ello plantas con el mismo grado de maduración y resistencia a las situaciones desfavorables parasitarias y climáticas. Por lo tanto, cualquier grado de contaminación varietal presente en las semillas, puede ser debido a la mezcla ocasional con semillas de otras variedades, presencia de granos rojos, cariópsides procedentes de fenotipos cuyas características morfofisiológicas no son estables, y/o plantas que estén segregando. Esto es consecuencia de cruzamientos entre individuos genéticamente diferentes o por mutaciones, que pueden ser verificadas en las fases reproductivas precedentes. Las empresas de semillas deben chequear rutinariamente la pureza de sus variedades para evitar vender lotes de semillas con niveles inaceptables de contaminación, usando un control de calidad estricto para las dos primeras clases, genética y fundación, donde cualquier falla en la obtención de mezclas varietales o malezas, puede traer graves consecuencias en los pasos siguientes de multiplicación. Cuando la semilla es multiplicada pueden ocurrir algunos cambios, bien sea debido a la contaminación con polen de otras variedades, o por contaminación física o mecánicas debido a un manejo inadecuado durante las labores de campo, cosecha, procesamiento y almacenamiento. Es prácticamente imposible identificar una variedad con solo mirar la semilla o la plántula; para ello, se requerirá una descripción verdaderamente efectiva a través de la observación del crecimiento y desarrollo de la planta desde el estado de semilla hasta la maduración. Sin embargo, la mayoría de los métodos comunes basados en el fenotipo requieren algunos meses para la obtención de resultados y espacio para su ejecución. Esto ha llevado a que, durante los últimos 10 años, se hayan desarrollado como alternativas ventajosas, diversos métodos bioquímicos para la evaluación de la pureza genética, como parte de un programa de aseguramiento de la calidad de la semilla, las cuales son usados extensivamente por numerosas organizaciones en algunas hortalizas, maíz, arroz, caraota, trigo, algodón y girasol. 3.5. ELEMENTOS DE UN PROGRAMA DE SEMILLAS En un programa de semillas debidamente organizado desde la investigación, hasta que el producto final sea consumido, la semilla tiene que pasar por la producción de diferentes categorías, es decir, semilla prebásica, semilla básica, semilla registrada, semilla certificada para finalmente llegar al agricultor quien producirá y entregará el producto al consumidor final. Siguiendo esta cadena, es misión del ente creador de las variedades producir las categorías altas, es decir prebásico, básicas y registradas, y las empresas productoras de semillas son las encargadas de multiplicar la categoría certificada. La fiscalización del comercio de semilla, la hace el Ministerio de Agricultura en las categorías básica, registrada y certificada y, en el caso de que exista déficit de semillas certificadas la ley como en todos los países, contempla que los productores autorizados puedan multiplicar la categoría seleccionada o fiscalizada. Un programa de semillas debidamente organizado proporcionará las semillas de las variedades mejoradas es decir aquellas que tienen características superiores de rendimiento, resistencia a plagas y enfermedades, precocidad, etc., y que estén a disposición de los agricultores para sean ampliamente utilizadas por ellos. Como se puede apreciar, los componentes de un programa de semillas están íntimamente ligados, de tal forma que si uno de ellos no funciona el programa se tornará ineficiente. La ínter ligación armoniosa entre los diversos componentes requiere principalmente que exista un esfuerzo a todo nivel con la participación del sector público y privado; que exista una efectiva coordinación, colaboración y confianza entre los participantes y, es claro que no habrá una industria fuerte de semillas sin un eficiente mejoramiento vegetal ya que la semilla es el medio por el cual se lleva al agricultor todo el potencial genético de una variedad con características superiores. 3.6. PRODUCCIÓN DE SEMILLA CERTIFICADA DE PAPA En general, la papa se propaga en forma asexual, mediante la multiplicación de los tubérculos o secciones de los mismos, que favorecen la diseminación de ciertas enfermedades sistémicas, ocasionando disminución de los rendimientos en las parcelas de los agricultores y de la calidad del producto ofertado a los consumidores. Los tubérculos-semilla constituyen el insumo estratégico para la producción comercial de papa, cuyo rol se refuerza con la percepción por parte de pequeños agricultores sobre su importancia en la determinación de los niveles de rendimiento. Es así como en muchos países de América Latina se definen los rendimientos en relación con la cantidad de semilla plantada, constituyendo en muchos casos el factor restrictivo más importante para la producción de papa. Cuando la semilla se importa desde países productores, se genera y desarrolla circunstancias poco beneficiosas para el país importador, como son: - Introducción de nuevas plagas y diseminación de enfermedades en forma latente, con el consecuente impacto ambiental. - Subsidio a una agricultura extranjera por la fuga de divisas. - Aumento del costo de producción por incremento de la devaluación del bolívar y por el combate de plagas y enfermedades de importancia económica. - Deterioro de la calidad de vida en las áreas agrícolas por el desaprovechamiento de una fuente de trabajo y un campo de desarrollo hacia donde pueden dirigir su actividad nuestros agricultores. 3.6.1. Producción de semilla prebásica MULTIPLICACIÓN DE PLANTAS IN VITRO. La técnica del cultivo in vitro entre otras aplicaciones, está siendo usada para la producción de plantas genéticamente idénticas, multiplicación rápida y para la obtención y mantenimiento de material libre de virus y de otros patógenos. Las plantas in vitro se multiplican en un laboratorio o unidad de replicación, donde se aplican normas de bioseguridad "A", donde está prohibido almacenar alimentos, beber, comer y fumar, y es obligatorio el uso de batas limpias. Las plantas in vitro deben ser producto de un material in vitro procedente del CIP (Centro Internacional de la Papa). Se utiliza el medio de cultivo desarrollado y modificado por el CIP, el cual contiene sales minerales de diferentes nutrientes, vitaminas y hormonas. A cada tubo de vidrio se le añaden 5 mI del medio de cultivo mencionado y se esteriliza en autoclave a 15 libras de presión, a 121°C, por 15 minutos. Las plantas se multiplican bajo una cámara de flujo laminar en condiciones estrictas de asepsia, seccionando esquejes de tallos de aproximadamente 0,5 mm de largo y provistos de una yema axilar con su respectiva hoja. En cada tubo de vidrio con medio de cultivo fresco se colocan de dos a tres esquejes, dependiendo del cultivar, de tal manera que la parte basal quede introducida en el medio. Posteriormente los tubos son sellados con tapones de algodón y gasa para evitar la penetración de esporas de hongos presentes en el aire y que contaminan el medio de cultivo. El material vegetal se coloca en cámara de crecimiento con temperatura entre 20 y 40°C, humedad relativa entre 60 y 80%, fotoperíodo largo de 16 horas de luz y una intensidad luminosa de 2.000 a 3.000 lux. Este material puede ser conservado por un tiempo indefinido, cuando se toman suficientes precauciones para evitar contaminaciones y la transferencia a medio fresco es realizada a intervalos apropiados. Las plantas in vitro probadas contra patógenos se mantienen como colecciones bases para la propagación de los programas de semillas. PRODUCCIÓN DE MINITUBÉRCULOS. La obtención de los tubérculos de semilla prebásica se realiza en invernaderos protegidos con una malla especial para evitar la introducción de insectos, especialmente áfidos. Estos invernáculos constan de una primera área' para asepsia general, y la segunda donde están ubicados los canteros. En la primera área se aplican normas de bioseguridad 118, donde el personal no autorizado no puede ingresar a los invernáculos; las superficies de trabajo se descontaminan con jabón y alcohol al menos dos veces por semana y donde es obligatorio para el personal utilizar ropa y bata de laboratorio limpias y lavarse las manos frecuentemente con solución jabonosa y con solución de hipoclorito de sodio. Los zapatos se desinfectan con cal viva cada vez que el personal ingrese a los invernáculos. La mezcla o substrato de siembra se prepara con pulpa de café, previamente descompuesta, tierra de campo y arena de río lavada, aproximadamente 2 m m de diámetro, en proporciones de 2:1:1. La misma se desinfecta en un área diseñada para tal fin, en capas de 20 cm de profundidad por 12-14 días, se airea completamente y luego se coloca en los canteros. Las plantas in vitro de aproximadamente 7 cm de altura se transfieren a los canteros, Para ello se extrae cuidadosamente del tubo de vidrio, su raíces se lavan con agua para eliminar el medio nutritivo y se colocan individualmente en hoyos de aproximadamente 5 cm de profundidad, tratando de cubrir dos o tres nudos. Las distancias de siembra utilizadas para la obtención de minitubérculos de diferentes diámetros son: 10 x 10 cm; 10 x 15 cm y 10 x 20 centímetros. La fertilización se realiza a los dos o tres días des pues de la siembra con 5 g de la fórmula 12-24-12 (NPK) por litro de agua, aplicando unos 100 cc/ planta. Sobre los canteros se coloca una cubierta de tela blanca durante diez días para proyectar sombra a las plantas y evitar su deshidratación, dada las condiciones de temperatura dentro de los invernáculos que alcanza hasta 29°C en días normales soleados. La frecuencia de riego inicial es diaria y se aplica dos veces durante los primeros diez días, utilizando después una frecuencia de acuerdo con las necesidades de las plantas. El aporque se realiza entre los 20 y 25 días después de la siembra para permitir un buen anclaje a la planta, para un buen almacenaje de agua alrededor de la misma y evitar que los futuros tubérculos queden expuestos al sol. Diariamente se realiza una inspección en los invernáculos y en condiciones normales de producción, semanal o quincenalmente se realiza un control fitosanitario para cumplir con las normas establecidas, tanto al cultivo como al área interna del invernáculo, usando los siguientes productos en forma individual o en mezclas apropiadas: manco- zeb (Manzate 200), metalaxil + mancozeb (Ridomil), benomilo (Benlate), como fungicidas y metomilo (Lannate), metamidofos (Tamaron), deltametrina (Decis) o pirimicarb (Pirimor) como insecticidas, no excluyendo a otros productos que resulten eficaces. Además, se colocan trampas amarillas para capturar áfidos alados y otras con feromonas específicas para atraer machos de palomilla (Phthorimaea operculella), previendo la posible entrada de estas plagas. Estas trampas también son colocadas en las áreas alrededor de los invernáculos. Aproximadamente 30 a 40 días después de la siembra se realiza un chequeo serológico para la detección de enfermedades virales, utilizando la técnica biotecnológica de conjugados enzimáticos, denominada ELISA, con la finalidad de garantizar la calidad fitosanitaria de las plantas. De ser necesario, se realiza otro chequeo serológico en otro período del cultivo. La técnica de ELISA permite normalmente detectar, en un máximo de 30 horas, con gran confiabilidad y especificidad pequeñas cantidades de virus en las plantas y en los tubérculos, en un número grande de muestras, donde las que estén infectadas se diferencian claramente de las sanas y el costo por muestra probada es significativamente menor que el obtenido por otras pruebas serológicas y biológicas. La cosecha se realiza a los 80 - 85 días después de la siembra, previo quemado del follaje y se esperan 7 a 10 días para el ruberizado total de la piel, antes de iniciar el arranque manual. Los tubérculos son seleccionados y clasificados en tres categorías de peso: menores de 6 g, entre 6 y 20 g, y mayores de 20 g. Luego se desinfectan y almacenan por cada categoría. Los tubérculos más pequeños se utilizan nuevamente para su multiplicación en los invernáculos para el incremento de semilla prebásica y los otros se llevan al campo para la obtención de la semilla prebásica. 3.6.2. Técnicas para la multiplicación de semilla de papa A pesar que el tubérculo-semilla de papa es un tipo de propagación vegetativa, es un factor fundamental para garantizar la calidad y la productividad de un cultivo, la siembra de tubérculos de mala calidad puede perjudicar una siembra, aún cuando las demás condiciones sean favorables al cultivo. Así, la obtención de tubérculos-semilla de calidad está directamente relacionada con la mejor aplicación de las técnicas de producción. La producción de semillas de papa de alta calidad, solo es posible mediante la implementación de técnicas especializadas de producción inicial como: termoterapia, cultivo de meristemas, multiplicación de plántulas in-vitro, producción de plántulas en el sistema autotrófico hidropónico (S.A.H) y, producción de tubérculos prebásicos bajo condiciones ambientales controladas e inspeccionadas con estrictas normas técnicas y de calidad. Definitivamente la Biotecnología, ha aportado grandemente a la producción de semilla de papa de alta calidad, pues ésta se ha insertado dentro de un gran proceso de producción, que termina con la provisión de semillas categoría certificada en beneficio de los agricultores. Por las características de multiplicación asexual, la papa puede considerarse como una planta “modelo” para la investigación y producción mediante métodos biotecnológicos, por su excelente respuesta a una serie de técnicas in vitro, ya que por ser un cultivo de propagación vegetativa, ha sido uno de los pocos cultivos en que realmente se ha llegado a resultados relevantes y prácticos. Los mejores tubérculos de las variedades mejoradas, son puestos a brotar, luego de que el brote tiene aproximadamente 3 cm de longitud, éste es separado del tubérculo madre y desinfectado en una solución de alcohol al 70% por un minuto y luego en una solución de cloro comercial al 75% por 15 minutos. El brote desinfectado es colocado en un medio de cultivo más 3% de sucrosa y 0,6% de agar. Posteriormente es llevado a una cámara de termoterapia. El tratamiento de aire caliente en esta cámara alterna temperaturas de 35ºC por 16 horas y 25ºC por 8 horas durante 6 semanas, tiempo que puede disminuir o aumentar dependiendo del grado de infección y de la variedad. Se a comprobado que las plantas tratadas con calor dan mejor respuesta si están provistas con luz artificial con una intensidad luminosa de aproximadamente 10.000 luz. Con esta tecnología se han eliminado principalmente virus de contacto como el Virus PVX y PVS. A pesar de que una cantidad de métodos han sido usados para eliminar patógenos de plantas propagadas asexualmente, la terapia de calor o termoterapia es la más importante, incluso para virus que son estables a altas temperaturas, la técnica de eliminación de patógenos, combina termoterapia y cultivo de meristemas o yema apical. Por la importancia que tiene éste material inicial en el proceso de producción de tubérculo-semilla de papa, posterior a la termoterapia, se realiza cultivo de meristemos pues basados en que la mayoría de patógenos vegetales como por ejemplo virus, hongos, nemátodos y bacterias, pueden ser transmitidos de plantas enfermas a plantas sanas, muchos estudios se han centrado en este tema y se ha determinado que no todas las células de las plantas se encuentran infectadas, observándose que los tejidos meristemáticos por su gran actividad metabólica, algunas veces se encuentran libres de enfermedades por lo que es posible recuperar plántulas sanas mediante técnicas de cultivo de meristemas a partir de plántulas infectadas, esto asociado con la termoterapia se obtiene el 100% del material totalmente libre de cualquier agente contaminante, sin embrago es necesario descartar cualquier posibilidad y para verificación se realiza el control de calidad incluido una prueba serológica. Con ésta combinación se eliminan virus sistémicos como el PVY y el PLRV. En la actualidad mediante micropropagación, se genera cada seis semanas diez nuevas plantas por cada planta micropropagada, las mismas que son reforzadas por un método mejorado de producción acelerada de plantas llamado sistema autotrófico hidropónico (SAH), que consiste en utilizar contenedores desechables, turba y soluciones hidropónicas, sin agregar sucrosa ni reguladores de crecimiento, de esta manera se logra obtener plántulas autotróficas que tienen gran capacidad de adaptación a condiciones de invernadero. Esta técnica de multiplicación se la realiza porque en la producción in vitro a gran escala, el material vegetal obtenido siempre se ha considerado como plántulas con baja capacidad fotosintética, ya que para su producción se utiliza sucrosa como fuente de carbono, dando lugar a un crecimiento heteromixotrófico, además el uso de sucrosa eventualmente conlleva a desarrollar contaminación. Mediante la técnica de multiplicación autotrófica hidropónica se ha establecido que las plántulas in vitro tienen habilidad sintética y que se pueden desarrollar autotróficamente, si se les provee de factores físicos adecuados como CO2, luz y recipientes amplios, con esto se logra bajar los costos y mantener alta calidad de plántulas que pasarán a la fase de multiplicación en invernadero, reduciendo la mortalidad y contaminación. En el invernadero las plántulas provenientes de los recipientes, son colocadas en camas, que contienen sustrato estéril y son alimentadas con fertirrigación, el manejo del cultivo sigue un estrilo sistema de producción y asepsia. Merece especial cuidado la preparación de camas, preparación de los sustratos, transplante, aporques, tutores y controles fitosanitarios. En cada una de las labores el control interno de calidad, juega un rol importantísimo para verificación y corrección del proceso, para finalmente obtener tubérculos–semilla categoría pre-básica de altísima calidad, que será el insumo fundamental con el que se inicia el proceso de multiplicación de las categorías siguientes, es decir básica, registrada y certificada. La fase y procesos de un programa organizado de producción de semillas de semillas de papa, se detalla en la siguiente figura: Figura 1. Flujograma de un programa organizado de producción de semillas de papa. FASES PROCESSOS INIAP Investigación y Desarrollo de Variedades Germoplasma: CIP Quito, CIP Lima, CNP. Laboratorio y Campos Invernadero Lotes de Producción ____________________ C . I . C. (INIAP) ___________________ Experimentales Limpeza: Termoterapia/Meristemas/Serologia Multiplicación y propagación in vitro INIAP Minitubérculos INIAP Multiplicación de Minitubérculos (< de 5 gramos) INIAP Semilla pré-básica INIAP _______________ C . E . C. (MAG) Semilla básica (I) INIAP Semilla básica (II) INIAP Semilla registrada PRODUTORES DE SEMENTE CERTIFICADA 3.6.3. Uso de semillas de papa Actualmente el uso de semillas certificadas en el país es bajo, como ejemplo podemos mencionar que aproximadamente del 1.5% del área sembrada con papa, está cubierta con semilla certificada, Sin embargo de este bajo índice de utilización de semilla, se ha podido observar en varias regiones que existe una reacción positiva de los agricultores al uso de semilla de calidad, porque han comprendido que la utilización de semilla de variedades mejoradas, conjuntamente con una aplicación adecuada de tecnología, les permite elevar los rendimientos por unidad de superficie, logrando consecuentemente una mayor rentabilidad. Con el propósito de avanzar en un proceso concertado que fortalezca el sector semillerista y permita la modernización de la Legislación, los servicios de certificación y producción de semillas en el país se proponen una serie de acciones prioritarias que han sido identificadas por los sectores público y privado, entre los que se destacan fuertes programas de información y difusión del uso de semillas. Se ha logrado la formación de la Asociación de Productores de Semilla de Papa (ASEPAE). El objeto es generar una nueva imagen del sector semillerista con la participación de las empresas productoras de semillas, mejorando sus áreas de comercialización, estableciendo sistemas adecuados de transporte, almacenamiento y distribución. 3.7. PRODUCCIÓN DE SEMILLA CERTIFICADA DE ARROZ Durante la última década los avances tecnológicos en el cultivo de arroz han permitido que este cereal se establezca como un producto básico de la economía del país, representando la base principal de alimentación de los grupos de menos recursos y materia prima para la agroindustria, requerida de ofertar productos de alta calidad. En consecuencia, la utilización por parte del productor de semilla de variedades que posean tales atributos es de imperativa necesidad. Una vez obtenidos los cultivares de arroz a través de los programas de mejoramiento, por parte de organizaciones públicas y privadas, éstos son evaluados por las entidades competentes durante tres ciclos de siembra en las principales zonas de producción del cultivo en el país. El objetivo es determinar su comportamiento en cuanto a tres características fundamentales: rendimiento, enfermedades y calidad del grano. Los cultivares que aprueban los tres ciclos de prueba en estos ensayos son declarados elegibles y pueden ser utilizados para la producción y comercialización de semilla. La certificación de semillas de arroz es un proceso que tiene como objetivo multiplicar la variedad mejorada, manteniendo su identidad genética y pureza varietal mediante un sistema integral de calidad, basado en normas establecidas. La semilla Certificada es actualmente producida por agricultores independientes, sin embargo, a pesar de las recomendaciones para su uso, existe un porcentaje importante de productores, entre 30 y 40% que no la emplean, debido a la poca confianza en el producto que no satisface adecuadamente las exigencias de calidad. Por lo tanto, para que las semillas constituyan un elemento básico de prosperidad, la agricultura moderna debe contar con un sistema de certificación de semillas que garantice el mantenimiento de la pureza e identidad genética de las variedades mejoradas, así como también de estrategias que permitan hacer llegar esas semillas a los agricultores con una alta calidad, en las cantidades necesarias y en forma oportuna. En años recientes, los métodos de mejoramiento genético han tenido una marcada evolución, incluyendo las herramientas biotecnológicas como los marcadores moleculares, de uso progresivamente generalizado. Su empleo aporta información valiosa a los programas de mejoramiento varietal y certificación de semillas, ya que asocia características fenotípicas con regiones específicas del ADN, que permiten establecer la identidad genética de los cultivares y determinar el nivel de pureza de las semillas. Tal identificación tradicionalmente se ha basado en la caracterización agronómica y morfológica de las semillas y plantas obtenidas de ellas, proceso altamente laborioso. En la última década, se ha incluido el uso de diversos tipos de marcadores moleculares, tales como isoenzimas, microsatélites, RAPDs, entre otros, los cuales permiten identificar polimorfismos a nivel de secuencias de ADN, y la comparación de clones, cultivares, razas, especies, o cualquier nivel de organización taxonómica tanto en plantas como en animales y microorganismos. El conocimiento y seguimiento del proceso de producción de semilla de arroz certificada representa una parte primordial del sistema arrocero, ya que la obtención de semilla de alta calidad permite disminuir riesgos en campo, y garantiza la disminución de malezas nocivas como el arroz rojo, el principal problema en los campos de producción de arroz. 3.7.1. Importancia del uso de semilla certificada de arroz Para los grupos de menores recursos, el arroz es la base de la dieta diaria y representa la principal fuente de calorías y proteínas. Uno de los factores más exigidos por el consumidor es la calidad del grano (uniformidad del tamaño, grano largo, color translúcido y excelente calidad culinaria). Para ofertar productos de alta calidad la agroindustria debe procesar granos con un contenido de amilosa aceptable (que no se peguen) y bajo valor de granos partidos. El productor debe utilizar semilla de variedades que posean dichos atributos. Para ello, el fitomejorador tiene la responsabilidad de mantener el abastecimiento de la semilla de clase genética por el tiempo que dicho cultivar se mantenga vigente. La semilla que produce el fitomejorador se conoce con el nombre de semilla genética, la cual es derivada por el programa de mejoramiento varietal con total pureza genética y física. Puede decirse que es el producto final del proceso de selección, que luego pasa al programa de certificación de semillas para producir semilla de fundación, bajo la supervisión del programa de mejoramiento genético y bajo la vigilancia del servicio de certificación de semillas; de tal manera que su pureza sea preservada. Posteriormente, dicha semilla se entrega a los productores autorizados para su multiplicación. Esta es la fuente de las categorías comerciales de semilla registrada y certificada. La obtención de una población adecuada de plantas es requisito para lograr una buena cosecha y sólo se logra con la utilización de semillas de alta calidad, obtenidas mediante la multiplicación de semillas genéticamente puras, en lotes apropiados y siguiendo estrictamente las normas establecidas. Cuando los productores usan semilla no certificada, corren el riesgo de obtener semillas con presencia de contaminantes y malezas incorporadas. De acuerdo con lo anterior, se considera prioritario el uso de semilla certificada como requisito indispensable en los planes de siembra de arroz establecidos por el gobierno. Uno de los problemas actuales en los campos de arroz es la alta incidencia de arroz rojo, maleza muy perjudicial que pertenece al mismo género del arroz cultivado, y tiene alta capacidad de cruzamiento con las variedades comerciales, originando ecotipos varietales de difícil identificación en campo, con la posibilidad de contaminar la semilla de fundación, registrada y certificada, lo que normalmente pasa desapercibido en los controles de calidad. El cultivar mejorado seleccionado por el fitomejorador por su rendimiento, resistencia a estrés biótico, tolerancia a estrés abiótico y alta calidad de grano pasa a etapas de multiplicación de semillas, con el fin de garantizar la pureza genética y física del mismo. Todas las etapas del proceso llevan implícito el control de calidad. Es aquí donde el uso de herramientas moleculares ofrecidas por la biotecnología aumenta la eficiencia del proceso. 3.7.2. Fases de producción para la obtención de semilla de arroz Las inversiones para desarrollar cultivos de arroz de alta producción, nos obliga a obtención de semilla por medios biotecnológicos, lo cual es una solución para certificación, pureza adecuada, resistencia a plagas y enfermedades. El proceso de la producción de semilla en los cultivos de tejidos consta de varias fases: 1. Selección del material. 2. Establecimiento y saneamiento “in vitro”. 3. Multiplicación. 4. Enraizamiento. 5. Adaptación. establecer la su registro, En el desarrollo de estas fases se establece: a) La velocidad de multiplicación b) La conservación de la pureza genética de la variedad c) El saneamiento de enfermedades como la hoja Blanca, pyricularia oryzae, raquitismo, carbón etc. El hecho de que salgan las plántulas libres de las enfermedades mencionadas, no quiere decir que son inmunes a las mismas, dependiendo esto del medio ambiental y la resistencia genética de cada una de las variedades. Recordemos de qué se trata de semillas registradas y certificadas que no están fitomejoradas. La obtención de ésta semilla registrada y certificada garantiza la producción del agricultor arrocero por encontrarse en un buen estado fitosanitario. Figura 2. Campo de arroz 3.8. MICROPROPAGACIÓN DE LA YUCA Se estableció una metodología eficiente y repetitiva para la micropropagación a partir de meristemos de los clones comerciales de este cultivo. Se logran obtener vitroplantas saneadas, mediante la combinación del cultivo de meristemos y el tratamiento de termoterapia, incrementándose considerablemente los rendimientos, con relación a las propagadas tradicionalmente. Se aplica la metodología con excelentes resultados de forma rutinaria para producir las vitroplantas necesarias, que son utilizadas como material original en el Programa Nacional de Producción de “semillas” certificadas. 3.8.1. Producción de estacas a partir de plantas obtenidas de embriones somáticos Se logró optimizar un sistema de regeneración por embriogénesis somática para la producción masiva de plantas y transgénesis. Se determinó un protocolo eficiente y repetitivo que garantiza la germinación y conversión a plantas de los embriones somáticos con más del 85% de eficiencia, mediante el uso del Sistema de Inmersión Temporal. Como aspectos novedosos además, se utilizan meristemos axilares como explante inicial para obtener, de forma más eficiente, callos con estructuras embriogénicas. Las vitroplantas que se regeneran son enraízadas y aclimatadas con más del 85% de sobrevivencia y bajo determinadas condiciones de riego, tipo de sustrato y contenedor con orificios de 120 cm3, permitiendo que las vitroplantas estén listas para el transplante al campo a los 45 días, aproximadamente. 3.8.2. Sistema de inmersión temporal, una alternativa para la producción de estacas La puesta a punto de un protocolo para la multiplicación in vitro de la yuca en Sistemas de Inmersión Temporal, donde los coeficientes de multiplicación para un mismo clon se triplican o más, según el genotipo respecto del sistema tradicional in vitro. Este sistema consiste en baterías de recipientes o frascos traslúcidos, mangueras de silicona esterilizables en autoclaves, filtros hidrofóbicos de 0.2 mm, electroválvulas, un compresor de aire y un timer programable. Las baterías están formadas por dos frascos, de los cuales uno es utilizado para el cultivo de los explantes y el otro como reservorio del medio de cultivo. El tiempo y la frecuencia de inmersión son establecidos según el genotipo, proceso en que el flujo de aire permite un burbujeo del medio de cultivo que provoca un movimiento desordenado de los explantes y renueva la atmósfera dentro del frasco que contiene el material biológico, evitando la acumulación de gases tóxicos. El retorno del medio al frasco reservorio evita la muerte de los explantes por asfixia. Además, garantiza la utilización económica y eficiente del medio de cultivo en estado líquido y se logra una producción de vitroplantas de alta calidad y vigor, donde los coeficientes de multiplicación se incrementan de forma significativa. Por las vías, anteriormente mencionadas, se producen las vitroplantas necesarias con alta calidad genética y excelente vigor, que permiten establecer la Estrategia Nacional de Producción de Semillas. A partir de 1998, en áreas de entidades productivas, las estacas procedentes de plantas obtenidas por estos métodos son sembradas y multiplicadas, hasta obtener la “semilla” de categoría certificada. Durante el proceso se realiza el seguimiento del material por parte de los productores e investigadores, lo que ha demostrado la relevancia de la biotecnología sobre el incremento de la calidad de la “semilla” y su influencia en los rendimientos en yuca. Con la introducción de estos métodos, además de garantizarse los aspectos cualitativos y cuantitativos del material de plantación, se logra que el tiempo entre la obtención de un clon y su utilización por parte de los productores, disminuya entre dos y tres años como mínimo, dependiendo de las condiciones de la región. IV. EMASCULACIÓN MASCULINA 4.1. INTRODUCCIÓN La mejora de las plantas pasó del empirismo a lo científico. Al principio fue la polinización cruzada (hibridación), luego vino la mecanización agrícola junto con la aplicación de productos químicos, después aparece la revolución verde con nuevas variedades híbridas. Hoy surge la biotecnología con la biología vegetal y la aplicación de técnicas de ingeniería genética, la cual seguirá avanzando en tanto no haya riesgos ambientales, que los cultivos sean seguros, nutritivos y a precios razonables, y que promuevan prácticas agrícolas ecológicamente correctas. Si bien es cierto la manipulación genética de plantas abre grandes perspectivas, también crea interrogantes y peligros, entre ellas: 1. Posibilidad de que las plantas transgénicas modifiquen sus hábitos ecológicos y se dispersen, invadiendo ecosistemas como las malas hiervas. 2. Posibilidad de transferencia horizontal del gen introducido (por medio del polen) y que se produzcan híbridos con efectos indeseados como que sean invasivos, con resistencia a plagas, impacto en ecosistemas, etc. Esto preocupa para los países tropicales porque pueden amenazarse los ricos recursos genéticos (erosión genética). 3. Posibilidad de que se generen recombinaciones genéticas, productoras de nuevas versiones de virus patógenos para las plantas que pueden afectar poblaciones silvestres o la epidemiología de ciertas enfermedades. Por eso se busca una ética biotecnológica y que haya seguridad en los experimentos. Aunque Europa ha establecido restricciones a la investigación y a los organismos modificados genéticamente, puede que se abran ante el temor de perder la carrera tecnológica y comercial ante Estados Unidos y Japón. Se buscaría entonces evaluar los productos y no los procesos de producción. Ante las preocupaciones por la manipulación genética de plantas se plantean las siguientes medidas: 1. LA ESTERILIDAD MASCULINA (EMASCULACIÓN) de las plantas de la prueba o cultivo comercial. Por ejemplo en plantas manipuladas para mejorar la nutrición de sus raíces, se han diseñado mecanismos suicidas para evitar su propagación una vez cumplida la misión. Son sistemas de contención o confinamiento para controlar la vida y la muerte de agentes vivos liberados, pero no son efectivos cien por ciento. 2. Técnicas de rastreo de organismos transgénicos en el ambiente, para poder seguir la pista del material genético liberado. 3. Que los cultivos se realicen en parcelas de mezcla entre plantas modificadas genéticamente y no modificadas. Las últimas mantendrían una reserva de insectos no sometidos a la presión selectiva, para que no predominen los mutantes resistentes a un insecticida. 4. La utilización de artrópodos (insectos, ácaros) genéticamente manipulados en programas de control integrado de plagas. A pesar de estas propuestas la discusión sigue sobre la seguridad de la biotecnología. La preocupación de los ecólogos es sobre los impactos a largo plazo que puedan causar los organismos modificados genéticamente y sobre la erosión genética de la biodiversidad tropical. 4.2. EMASCULACIÓN Hay emasculación o androesterilidad o esterilidad masculina cuando los órganos reproductores masculinos (gametos) de las plantas se encuentran mal desarrollados o abortados de tal manera que no se forma polen viable. Los gametos masculinos no son funcionales. Este mecanismo que puede ser determinado por genes nucleares, factores citoplásmicos o por interacción génico-citoplásmica, impide también la autofecundación. Los mutantes de androesterilidad aparecen con frecuencia y regularmente en las especies autógamas; en algunos casos ciertos caracteres que les acompañan impiden su utilización práctica. Virtualmente, todas las especies diploides de plantas, domesticadas y silvestres, han mostrado (si se estudia cuidadosamente) que poseen por lo menos un locus para esterilidad masculina y por lo tanto, es heredable. La androesterilidad aparece en las plantas esporádicamente tanto en especies alógamas como en autógamas, como consecuencia de: a. Genes mutantes (generalmente recesivos) b. Factores citoplásmicos (citoplasma). c. Efectos combinados de ambos (genes - citoplasma). Lo anterior ocasiona aborto del polen, que las anteras no abran, aborto de las anteras, anteras pistiloides (anteras transformadas en pistilos), etc. La androesterilidad es muy útil e interesante para los mejoradores de plantas, porque proporciona un medio muy eficaz para simplificar la formación de híbridos, y elimina así el proceso tan laborioso de la emasculación manual. En las líneas androestériles las flores no producen anteras funcionales y por lo tanto, no puede haber autopolinización; serán polinizadas solamente por la línea o líneas que se usen como progenitor masculino. La primera referencia que se tiene acerca de la utilización de la androesterilidad para la producción de semilla híbrida, fue hecha por Jones y Davis en 1944, cuando descubrieron la androesterilidad genética citoplásmica en la cebolla. En la actualidad, la androesterilidad se ha utilizado para eliminar la emasculación artificial en la producción de semilla híbrida (sorgo, principalmente) en escala comercial y en el mejoramiento de plantas. En el caso de microorganismos destinados a ser liberados (por ejemplo, los usados como inóculos con los que se impregnan semillas, con los que se pretende mejorar la nutrición por las raíces) se han diseñado varios mecanismos de inactivación génica o sistemas "suicidas" que tienden a evitar la multiplicación una vez que el microorganismo ha cumplido su misión. Estos sistemas de "contención o confinamiento" biológico que intentan controlar tecnológicamente la vida y la muerte de los agentes vivos liberados en ambientes complejos no son sin embargo efectivos al cien por ciento. 4.3. EMASCULACIÓN E HIBRIDACIÓN La producción de híbridos, de forma que sea económicamente rentable, requiere a ser posible la existencia de técnicas que eliminen la necesidad de realizar la emasculación manual. Existen para ello diferentes sustancias gametocidas químicas. En los casos en que se ha encontrado androesterilidad genética, es importante para ser utilizada con éxito, que sea dependiente de alguna condición externa, ya que es necesario también autoperpetuar la línea pura. En el caso de que la polinización y la emasculación haya de ser manual, es también necesario poner a punto la metodología para cada cultivo. En este caso sólo unos pocos cultivos son candidatos a la obtención de este tipo de variedades. Es decir podría ser económicamente rentable en los casos en los que se de un elevado tamaño de sus flores y/o la alta producción de semilla por fruto, o bien en especies donde exista un alto valor unitario del cultivo, incluso en estos casos la producción de materiales híbridos, sólo es rentable si se realiza en países donde el costo de la mano de obra no sea excesivamente elevado. 4.4. TÉCNICAS DE EMASCULACIÓN Y POLINIZACIÓN 4.4.1. Técnicas de emasculación EI problema fundamental en el control de la polinización ya sea para la formación de híbridos o de líneas puras, consiste en colocar el polen funcional sobre los estigmas receptivos en el momento oportuno. Generalmente, y según el caso, dentro de un programa de mejoramiento se debe evitar las posibles autofecundaciones y los cruzamientos indeseables. Las autofecundaciones se evitan por medio de la emasculación (eliminación de las anteras de las plantas femeninas antes de que maduren). Los cruzamientos indeseables se evitan utilizando bolsas u otros materiales apropiados para aislarlos de polen extraño. Por lo general, el equipo utilizado en las técnicas de emasculación y polinización no es complicado; por ejemplo, en plantas autógamas se utilizan pinzas, tijeras, pincel, bolsas de papel encerado (glassines), etiquetas, lápiz, clipes, lentes de aumento o lupa, etc. En alógamas se emplean bolsas, engrapadora, lápiz, mandil, etc. El éxito de la polinización depende del grado de dificultad que se presente para realizar la emasculación, en los diversos tipos de flores, y del momento oportuno para llevar el polen viable a los estigmas receptivos. La emasculación consiste en la remoción de los órganos masculinos, anteras, de la flor de la planta que se utilizará como hembra. En las especies que poseen flores hermafroditas es muy importante la emasculación para hacer hibridación, debido a que cuando las anteras maduran, el polen cae sobre sus estigmas y ocurre la autofecundación. Los procedimientos de emasculación comúnmente usados en el mejoramiento son los siguientes: 1. Remoción de anteras: El más común se efectúa mediante pinzas, succión u otros medios, antes de que se derrame el polen; se aplica principalmente en autógamas. 2. Destrucción del polen por medio de calor, frío o alcohol: - Agua caliente a temperaturas de 45 a 48 ºC durante 10 minutos; se aplica en sorgo, arroz y algunas gramíneas forrajeras. - Temperaturas bajas (cercanas al punto de congelación); se recomiendan para trigo y arroz. - Alcohol etílico a 57%, durante 10 minutos, se aplica en alfalfa. 3. Polinización sin emasculación: procedimiento efectivo en plantas incompatibles (muchas forrajeras) y en autoestériles, las cuales no necesitan emascularse para producir plantas híbridas. Se usa en investigación y en producción de híbridos comerciales (por ejemplo, cebada). 4. Esterilidad masculina genética y citoplasmática. Se usa en investigación y en producción de híbridos comerciales (maíz, sorgo, etc.). Al fin de realizar con éxito la emasculación es importante conocer el momento adecuado, ya que si se retrasa, se derrama el polen y puede causar autofecundación. Si se adelanta, se tienen problemas para eliminar las anteras y se puede mutilar el pistilo. Después de la emasculación, las, flores se cubren con bolsas de papel encerado (glassines) para protegerlas del polen extraño. 4.4.2. Prácticas de polinización La polinización debe efectuarse cuando el estigma sea receptivo, esto puede reconocerse por la apertura de las flores y el completo desarrollo del estigma. En algunas especies las polinizaciones pueden hacerse el mismo día de la emasculación de la flor (por ejemplo, soya, tabaco, algodón, etc.), en otras, se retrasa de 1 a 3 días; esto depende de los fenómenos de protandria (maduración de las anteras antes que los pistilos) y protoginia (maduración de los estigmas antes que las anteras). La polinización se efectúa colectando anteras maduras y esparciendo el polen sobre el estigma receptivo. El tiempo que el polen permanece viable es muy variable; depende de la especie de que se trate, del ambiente y de otros factores. Por ejemplo: - En altas temperaturas, el polen permanece viable sólo unos minutos (trigo y avena) o unas cuantas horas (de 3 a 4 para el maíz). - En óptimas condiciones el polen puede durar de 6 a 10 días (maíz y caña de azúcar). - El polen de la palma datilera ha permanecido viable hasta por 10 años. En general, la viabilidad del polen puede conservarse a bajas temperaturas y humedad relativa alta. Por otra parte, como la floración de la mayoría de las plantas ocurre por la mañana, se procede a recolectar polen y a efectuar las polinizaciones inmediatamente (maíz) a fin de lograr mayores éxitos; sin embargo, en otras plantas (avena) es mejor por las tardes; en días calurosos y brillantes se tiene también mayor éxito. En forma experimental, las polinizaciones de la mayoría de las especies se realizan a mano, pero hay algunas en las que se utilizan insectos como polinizadores; por ejemplo, en alfalfa y trébol rojo. Para la formación de híbridos comerciales en grandes volúmenes se usan lotes aislados donde no haya contaminación de otro polen; tal es el caso del maíz y sorgo, donde se usa el desespigamiento o las líneas androestériles. 4.5. EXPERIENCIAS DE EMASCULACIÓN 4.5.1. Experiencia en tomate Se realizo un estudio en plantas de tomate para la producción de semilla hibrida sobre las cuales se aplico diferentes tratamientos de macho esterilidad química con el objeto de sustituir la emasculación manual. El estudio consistió en la aplicación de tres productos con dos dosis cada uno: ethrel 500 y 1000 ppm, nitrato de plata 2000 y 3000 ppm y acido giberélico 100 y 200 ppm. Los resultados obtenidos señalan que ninguno de los productos causo esterilidad masculina completa. El producto que mayor efecto gametocida produjo fue acido giberélico, lo que se reflejo en un menor numero de semillas obtenidas por fruto por planta en relación con el testigo. Además se observo un efecto acumulativo de producto en los últimos tres racimos dando como resultado frutos mas pequeños y con menor numero de semillas. También se comprobó mediante una prueba de germinación de semillas obtenidas de las plantas tratadas, que no se afecto ni su vigor ni su viabilidad. Por ultimo, el único producto que causo severos trastornos a la planta fue ethrel, el que provoco enanismo, abocetamiento y abscisión de estructuras florales con ambas dosis. Al realizar el estudio en plantas de pensamiento de dos variedades Viola x witrockiana y Viola sp. Trabajadas en forma independiente, para la producción de semilla hibrida, sobre las cuales se aplicaron diferentes tratamientos de macho esterilidad química con el objeto de sustituir la emasculación manual. El estudio consistió en la aplicación de tres productos con dos dosis cada uno: ethrel 400 y 500 ppm, nitrato de plata 1500 y 2000 ppm y acido giberélico 100 y 200 ppm. Los resultados obtenidos en ambas variedades señalan que el producto que mejor actuó como agente gametocida fue acido giberélico en ambas concentraciones, no llegando este a producir un 100% de esterilidad. Esto se confirmo al efectuar diferentes evaluaciones: se evaluó numero promedio de frutos obtenidos al trabajar con polen tratado, no encontrándose diferencias con respecto al testigo por lo que se evaluó numero promedio de semillas obtenidas de estos frutos, donde esta vez si se obtuvo diferencias significativas en relación con el testigo, en ambas variedades, con lo que se verifico la acción gametocida del producto. Por otro lado, se evaluó promedio de frutos y de semillas obtenidas al polinizar plantas tratadas con polen fresco para confirmar que no se produjo daño sobre el gineceo, dando en ambas variedades resultados parecidos para el caso del acido giberélico donde no se obtuvo diferencias significativas en relación con el testigo en cuanto al numero de frutos, pero si se obtuvo diferencias en cuanto al numero de semillas, lo que indica un cierto daño del gineceo o bien la producción de frutos partenocarpicos. En cuanto al nitrato de plata 1500 ppm (viola x witrockiana) y ethrel 400 ppm (viola sp.) no se obtuvo diferencias en relación con el testigo correspondiente para cada variedad en ninguno de los dos parámetros evaluados 4.5.2. La construcción del promotor del gen end1 barnasa produce plantas transgénicas androestériles de tomate La expresión del gen de la barnasa dirigida por el promotor del gen end1 de guisante en plantas de arabidopsis, tiene como consecuencia la producción de plantas androestériles, siendo posible aislar líneas con 100% de androesterilidad. No se producen otros efectos fenotipicos, excepto que las plantas son más longevas y producen un mayor número de flores. De hecho se puede observar que los estambres de las plantas transgénicas son mas cortos que los silvestres, ya que sus filamentos solo alcanzan una longitud de la tercera parte de la esperada. Además las anteras presentan malformaciones evidentes y los tipos celulares de la superficie recuerdan más a los tipos del filamento que a las células estrelladas de la superficie de las anteras. Para comprobar la posibilidad de restaurar la fertilidad de la descendencia hibrida, se generaron plantas transgénicas de arabidopsis y se seleccionaron plantas homocigotas para el transgén barstar. Se realizó un cruce entre una planta de una línea hemicigota end1 barnasa y una planta de una línea homocigota end1 barstar y se estudio su descendencia. Se pudo observar el efecto esperado si el inhibidor es capaz de impedir la acción de la barnasa. La descendencia mostraba estambres normales y fertilidad restaurada, por tanto se concluye que es posible utilizar un abordaje de ingeniería genetica basado en las características del promotor del gen end1 de guisante para producir semillas hibridas. Las plantas transgénicas de tomate del promotor del gen end1 barnasa, muestran malformaciones en las anteras ya que no forman correctamente el cono estaminal capaz de mantener encerrado al carpelo. Las plantas con los fenotipos más extremos permiten observar a simple vista el ovario con el estilo y el estigma. En secciones transversales de tomate se puede comprobar como la construcción del promotor del gen end1 gus es capaz de expresar gus en la epidermis, endotecio y tejido conectivo de las anteras de plantas transgénicas, mientras que la construcción del promotor del gen end1 barnasa produce malformaciones severas que impiden el correcto desarrollo de los sacos polínicos. 4.5.3. Potencial biotecnológico del promotor del gen end1 se extiende a la producción de frutos partenocárpicos en tomate La ablación de las anteras en plantas trasgénicas de tomate induce el desarrollo de frutos Partenocárpicos. Hasta ahora, la partenocarpia en tomate se había observado en algunas mutaciones homeóticas como las de pérdida de función B, es decir, en flores en las que los pétalos se han transformado en sépalos y los estambres se han transformado en carpelo, por lo que se había planteado la posibilidad de que la ausencia de estambres estuviera relacionada con el desarrollo de frutos partenocárpicos. Sin embargo, la emasculación o eliminación manual de los estambres no induce partenocarpia en los frutos. Estos experimentos constituyen la primera prueba inequívoca de que la eliminación de los estambres en los estadios iniciales de su desarrollo es suficiente para provocar la partenocarpia. Probablemente, los estambres producen un inhibidor del desarrollo del fruto que se formaría por defecto en ausencia del mismo. En la actualidad, estamos llevando a cabo el análisis genético molecular de los frutos partenocárpicos con objeto de desvelar el gen o los genes implicados en el desarrollo partenocárpico de frutos. Este procedimiento de ingeniería genética ha sido objeto de patente, cuyos derechos han sido adquiridos por la empresa NewBiotechnic. Por un lado, la producción de frutos sin semillas es de mucho interés para los agricultores puesto que permite cultivar el tomate y producir frutos fuera del margen de temperaturas en el que la formación de granos de polen es viable. Asimismo, estos frutos también son de interés para los industriales de producción de sopas, pastas y salsas de tomate porque les permite suprimir la etapa de filtrado de la pulpa para eliminar las semillas ya que su presencia termina por transmitir sustancias que perjudican el sabor y el valor nutritivo de los productos. Los frutos sin semillas también son apreciados en tecnología culinaria al tiempo que son preferidos por un sector de los consumidores. Si observamos el interior de los frutos de tomate podemos comprobar el correcto desarrollo de los frutos transgénicos cuya única diferencia con los frutos silvestres es la ausencia de semillas. La maduración de los tomates partenocárpicos es normal y culminan su desarrollo presentando sus lóbulos rellenos de pulpa de un color rojo intenso. En la actualidad, estamos realizando experimentos con cultivares comerciales de tomate con objeto de valorar la productividad de las plantas transgénicas y las características y composición nutricional de los frutos. V. CONTROL DE VIRUS, HONGOS Y BACTERIAS 5.1. NUEVOS CONCEPTOS EN EL MANEJO INTEGRADO DE PLAGAS 5.1.1. Generalidades ¿Qué es el manejo integrado de plagas? Las plagas-insectos, gusanos, ácaros, etc. están en todas partes en la naturaleza, pero en nuestro caso nos referimos sólo a las que afectan a la agricultura. El manejo integrado de plagas puede definirse como un medio de regulación eficaz de las especies perjudiciales, que hace hincapié en la salvaguardia del ser humano y del medio ambiente. El método integrado de control de plagas implica usar los pesticidas con moderación y considerar métodos alternativos para controlar las plagas causantes de daños graves a la agricultura. Las medidas de protección de plantas son imprescindibles para alcanzar altos niveles de producción en la agricultura, lo cual no puede lograrse en la práctica y a una escala comercial, sin utilizar agroquímicos. Muchas bocas en el mundo entero quedarían sin alimento si se dejara por completo de usar agroquímicos. Ahora bien, los productos químicos matan no sólo a las plagas sino también a sus enemigos naturales, o sea los predadores que destruyen las plagas dañinas para nuestros cultivos. En los últimos decenios, los científicos han desarrollado métodos que permiten reducir el uso de agroquímicos al nivel más bajo posible para obtener un suministro abundante de alimentos saludables, esforzándose así por mantener un medio ambiente sano para el ser humano y también para otras especies. El tomate es una de las hortalizas más difundidas de gran importancia agronómica en todo el mundo. La forma usual de superar los problemas fitosanitarios consiste en aplicar agroquímicos caros y peligrosos, que elevan el costo de los insumos, dejando poca o ninguna utilidad al productor. Además, pueden inducir en los insectos resistencia a los plaguicidas, afectar a los enemigos naturales, crear peligro para el ser humano y contaminar el medio ambiente. En algunos países aún no se ha desarrollado el manejo integrado de plagas (MIP) para este cultivo, por ello, la elaboración de un plan para las distintas plagas y enfermedades es necesario desarrollarlas bajo condiciones de dichos países, considerando los siguientes aspectos: 1. USO DE VARIEDADES RESISTENTES, el mejor método preventivo. 2. CULTIVO LIMPIO/ASEPSIA, eliminación de las partes infectadas de las plantas de tomate y otros residuos y control de malezas adecuado para reducir las fuentes de inoculación. 3. ROTACIÓN DE CULTIVOS, el cultivo de tomate se debe alternar con otros cultivos que no sean afectados por las plagas comunes de este. 4. MONITOREO CONSTANTE, las plagas principales del tomate son varias y se multiplican con facilidad, lo que exige una inspección constante de los campos. Se debe determinar regularmente el nivel de las plagas y de sus enemigos naturales, como base para recomendar los tratamientos requeridos. Se pueden usar tres métodos: inspección visual, trampas y barrido con redes para capturar los insectos móviles presentes en el campo. 5. CONTROL BIOLÓGICO, es el fundamento del MIP en todo país donde se aplica. En los campos de tomate existen bastantes enemigos naturales, pero el uso intensivo de pesticidas les impide multiplicarse. La aplicación selectiva de pesticidas y la liberación de enemigos naturales, criados artificialmente para este fin, pueden mejorar la situación. 6. USO SEGURO Y EFECTIVO DE INSECTICIDAS, El uso de insecticidas sintéticos debe ser el último recurso, debiendo evitarse la aplicación según calendario. Es imperativo aplicar insecticidas selectivos y sólo cuando se rebasan niveles mínimos de insectos dañinos. La aplicación debe supeditarse también a un umbral económico. 5.1.2. Medidas de control convencional contra los virus Los virus son transmitidos a las plantas por insectos, debiendo adoptarse las siguientes medidas - Fitosanidad: eliminación de huéspedes alternativos y residuos de cultivos. - Remoción y destrucción de las plantas afectadas. - Tratamiento de las semillas y uso de plántulas sanas. - Plantación en fechas de baja infestación de mosca blanca (vector de los virus). - Uso de trampas amarillas y azules. - Uso de obstáculos físicos como láminas y redes para impedir el contacto de los insectos vectores con las plántulas y plantas, a fin de evitar la contaminación. - Uso de variedades resistentes. - Desarrollo por métodos biotecnológicos de plantas transgénicas genéticamente resistente a los virus. 5.1.3. Enfermedades causadas por hongos Todos los métodos anteriores son eficaces también para las enfermedades causadas por hongos: uso de variedades resistentes, tratamiento de las semillas, desinfección del suelo, uso controlado de pesticidas y control biológico. 5.2. BIOTECNOLOGIA EN EL MANEJO INTEGRADO DE PLAGAS 5.2.1. Introducción La necesidad de encontrar mecanismos que eleven la productividad del campo ha impulsado la búsqueda de estrategias de control de plagas agrícolas que sean alternativas eficientes al control químico y que además impliquen un bajo riesgo ambiental y sanitario. De esta necesidad surge un nuevo enfoque denominado Manejo Integrado de Plagas (MIP) que retoma prácticas agrícolas antiguas y, al mismo tiempo, incorpora tecnologías ambientalmente seguras. El MIP se ha consolidado como una opción eficiente para el control de plagas por ser una estrategia que introduce una nueva filosofía basada en un amplio conocimiento de los ecosistemas. El MIP es, además, una práctica flexible que puede adaptarse a diversos sistemas productivos con necesidades y carencias particulares. Los desarrollos recientes de la biotecnología se han incorporado al MIP en tres áreas principales: el control químico, el control biológico y el empleo de variedades vegetales resistentes, proporcionando resultados muy positivos a la agricultura sin embargo, aunque las aplicaciones biotecnológicas, dentro de los programas de MIP, son ya una realidad, su utilización amplia no se ha dado por completo, pues ésta depende de la existencia de regulaciones completas de bioseguridad en el país que proporcionen garantías a los consumidores, así como a la preservación de la diversidad biológica. Figura 1. Aplicación de control químico. 5.2.2. Los plaguicidas químicos La práctica agrícola ha provocado pérdida de biodiversidad, gran consumo de agua dulce, contaminación de suelo, aire y agua, y erosión de suelos. En particular, el manejo de plagas agrícolas mediante el uso de agroquímicos, ha tenido un costo ambiental muy alto por lo que es indispensable buscar alternativas viables para disminuir el deterioro del medio ambiente. En el medio agrícola, plaga es cualquier organismo que perturba o afecta el desarrollo y el crecimiento de un cultivo. Son plagas las plantas silvestres que compiten con el cultivo por luz y nutrientes (malezas), los microorganismos (hongos, bacterias y virus) que lo infectan provocando enfermedades, así como los artrópodos (insectos, arañas y ácaros) que lo atacan. Durante milenios, el hombre controló los insectos dañinos con métodos manuales y herramientas naturales. En este esquema, el control ejercido por elementos vivos de los ecosistemas y otras prácticas de saneamiento, tuvieron un papel importante para minimizar el daño causado por plagas. Pero el desarrollo de plaguicidas químicos cambió las formas de control de las plagas de importancia agrícola y forestal. El control químico se convirtió, por varias décadas, en la forma preponderante de control, siendo uno de los elementos clave de un nuevo modelo de producción agrícola extensiva, basado en el uso abundante de agroquímicos. Tras el descubrimiento del DDT, los compuestos inorgánicos fueron desplazados por los hidrocarburos clorados. Estos compuestos tuvieron una amplia aceptación porque eran económicos, efectivos, fáciles de usar y podían emplearse contra una gran cantidad de especies. Los compuestos órgano-clorados fueron reemplazados poco a poco por los insecticidas órgano-fosforados, carbamatos y piretroides. Estos compuestos son biodegradables y más selectivos que los primeros insecticidas orgánicos, sin embargo se han utilizado de manera constante por muchas décadas, lo que ha traído como consecuencia el incremento de especies nocivas resistentes y la necesidad de aplicar cada vez mayores dosis en un ciclo agrícola. El empleo intensivo, irracional e indiscriminado de productos químicos, ha tenido un impacto muy fuerte en el ambiente y la calidad de vida de las poblaciones humanas, los efectos principales son los siguientes: - Acumulación persistente de las sustancias en tejidos de animales silvestres, animales domésticos, que provoca efectos nocivos en dichos organismos. - Acumulación de sustancias tóxicas en sangre humana, tejidos y leche materna, e incluso envenenamiento de personas. De acuerdo con la Organización Mundial de la Salud, cada año más de 3 millones de personas enferman por la exposición a los insecticidas y 220 mil mueren. - Polución de ríos, lagos y otros cuerpos acuíferos, e infiltración hasta alcanzar mantos freáticos que abastecen de agua a las - Contaminación de alimentos derivados de las plantas tratadas con plaguicidas químicos. ciudades. - Reducción de la fertilidad de los suelos debido a la disminución de las poblaciones de bacterias y otros microorganismos involucrados en los procesos de reciclamiento de la materia orgánica y liberación de nutrientes. - Afectación de los enemigos naturales de las plagas e inducción de la aparición de plagas secundarias resistentes a los compuestos químicos disponibles en el mercado. Figura 2. Empleo intensivo de productos químicos. A pesar del uso continuo de plaguicidas químicos las enfermedades y plagas siguen causando las mayores pérdidas en la producción agrícola mundial. La FAO estima que se pierde, durante el almacenaje entre 5 y 10% de todos los granos alimenticios cosechados, a causa de los insectos, ácaros, roedores y hongos. En América Latina las pérdidas varían entre el 25 y el 50% en la cosecha de cereales; en la India y ciertos países africanos, las pérdidas son del 30% y en algunas zonas del Suroeste de África se pierde hasta el 50% de algunos cultivos. Lo anterior hace evidente que el modelo de producción extensiva basado en el empleo de grandes dosis de agroquímicos, se encuentra agotado. En las próximas décadas se espera reducir al mínimo el empleo de sustancias químicas para controlar plagas y enfermedades, y adoptar un modelo alternativo, menos costoso, socialmente aceptable, ambientalmente adecuado y útil a largo plazo. 5.2.3. El manejo integrado de plagas como una opción para la agricultura sustentable La mejor alternativa para el control de enfermedades y plagas de los cultivos, se encuentra en un sistema conocido desde la década de los 50s: el Manejo Integrado de Plagas (MIP), éste no había sido considerado una alternativa viable debido a la eficiencia mostrada por los plaguicidas químicos. El MIP es, estrictamente hablando, una metodología para la toma de decisiones, que introduce una nueva filosofía para el combate de plagas agrícolas. Filosofía que puede resumirse en los siguientes principios: - La estrategia de manejo de plagas debe ser ambiental, económica y socialmente adecuado. - Las acciones se toman para restaurar, preservar y afianzar el balance del agro-ecosistema. - No se considera la erradicación del organismo plaga. En algunos casos, ciertos niveles de infestación resultan deseables para el desarrollo de poblaciones de organismos benéficos. - Se hace un manejo de poblaciones completas y no de poblaciones localizadas, basado en el conocimiento de los patrones de migración y movimiento de la plaga y en el comportamiento de éstas en los diferentes cultivos que atacan. - La posible potencialidad de un organismo plaga debe ser probada antes de tomar cualquier acción. - La utilización coordinada de varias estrategias de control aumenta la probabilidad de mantener a largo plazo la eficacia de la protección sanitaria de los cultivos. - Es importante reducir al máximo el uso de plaguicidas sintéticos para disminuir su impacto en el ambiente y la salud humana. - La mejor forma de reducir el empleo de agroquímicos es incrementar la utilización de controles naturales de plagas. - Las decisiones deben tomarse con base en información amplia de cuestiones biológicas, ecológicas y económicas de los agro-ecosistemas. - Se intenta hacer compatibles la rentabilidad económica con la calidad de vida de los agricultores y el consumidor. Figura 3. Manejo de plagas ambiental, economica y socialmente adecuado. El MIP implica, en primera instancia, la aplicación de técnicas y procedimientos para la adquisición y análisis de datos. El desarrollo e implementación de componentes de esta estrategia involucra los siguientes aspectos: - Medición de los factores físicos (elementos del clima) y biológicos más relevantes. - Identificación y clasificación de los fitoparásitos presentes en el campo de cultivo e identificación de las plagas principales y las secundarias. - Definición para cada plaga de las etapas fenológicas en las que el cultivo es más sensible y establecer etapas críticas de protección. - Determinación de la eficacia regulatoria de los enemigos naturales de la plaga (predadores o parásitos) presentes en el campo de cultivo. - Relación de la densidad de la plaga con el potencial de daño físico y económico. - Determinación de la densidad de la plaga en la cual hay que aplicar las medidas de control para evitar daño económico. - Establecimiento de modelos de predicción. El segundo gran paso del MIP es implementar medidas de control, para ello se selecciona la combinación de técnicas más adecuada a cada situación. El manejo integrado de plagas utiliza, de forma simultánea y coordinada, distintas formas de control, clasificadas en cuatro categorías: - PRÁCTICAS CULTURALES, estas modifican el agro-sistema de tal forma que resulte menos propicio para el desarrollo del organismo patógeno. Una posibilidad de control se encuentra en la rotación de los cultivos. - CONTROL BIOLÓGICO, consiste en la introducción en los agros ecosistemas de organismos que son enemigos naturales del patógeno. Con este enfoque no se pretende matar al organismo problema, sino mantener su población hasta un nivel tal que no interfiera con la producción. - CONTROL QUÍMICO, su filosofía es muy distinta a la empleada durante la revolución verde pues están comprendidas opciones tecnológicas de bajo impacto ambiental y alta aceptación en agricultura orgánica (por ejemplo sustancias químicas de origen biológico como feromonas, jabones insecticidas e insecticidas botánicos). - VARIEDADES RESISTENTES, la utilización de genotipos que resisten en cierto grado el ataque de plagas y patógenos representa uno de los métodos preventivos básicos de control. Figura 4. Enemigos naturales. Otra forma de control que no está comprendida dentro de los programas de MIP, pero tiene sin duda un efecto importante en la sanidad de los cultivos, es el control legal. Así se conoce al conjunto de disposiciones existentes en un país para regular el intercambio comercial de productos agrícolas, con la intención de evitar el movimiento y la introducción de fitoparásitos. 5.2.4. Manejo integrado de plagas y biotecnología La biotecnología tiene injerencia en tres ámbitos principales: el control biológico, la utilización de variedades resistentes y el control químico. En el control biológico puede contribuir en la producción a gran escala de organismos benéficos; en variedades resistentes, puede ofrecer todas las posibilidades de la ingeniería genética; y en el desarrollo de productos químicos puede ofrecer plaguicidas, específicos y biodegradables derivados de extractos biológicos homogenizados, así como de sustancias obtenidas en cultivos de tejidos. CONTROL BIOLÓGICO, el principal problema a atacar es producir de forma rápida, eficiente y económica grandes cantidades de los microorganismos que resulten ser el enemigo natural de las plagas. El cultivo de microorganismos en grandes reactores es la disciplina biotecnológica que cuenta con la mayor experiencia por lo que, en general, se puede decir que las tecnologías para el control biológico están disponibles. VARIEDADES RESISTENTES, la biotecnología agrícola ofrece las potencialidades del cultivo de tejidos e ingeniería genética para producir, por un lado, semillas libres de virus y patógenos, y por otro, variedades vegetales con resistencia intrínseca a patógenos y enfermedades (virus, hongos y bacterias), de forma mucho más rápida y eficiente que el mejoramiento tradicional. CONTROL QUÍMICO, la biotecnología contribuye a la producción, purificación y caracterización de sustancias naturales bioactivas contra depredadores y parásitos. También la ingeniería genética puede aumentar la producción de sustancias de interés o transferir la capacidad de síntesis a otros organismos. Una opción muy prometedora se encuentra en el empleo conjunto de química sintética y cultivos vegetales o microbianos, mediante la utilización de las bacterias enzimáticas de los microorganismos, o de las células vegetales o animales para completar alguno o varios de los pasos de síntesis de sustancias químicas. Las tendencias en cada uno de estos ámbitos de control se describen a continuación: 5.2.5. Uso de agentes de control biológico en el MIP En principio, cualquier organismo plaga es susceptible al control biológico, porque hay siempre algún antagonista biológico que puede controlar su población por alguno de los mecanismos conocidos (matar al organismo, inhibir su desarrollo, reducir su capacidad reproductiva o competitiva). El control biológico se ha utilizado con éxito en: insectos, ácaros, caracoles, algunos vertebrados, algas, hongos, hierbas y malezas. Los agentes de control más usados son virus, bacterias y sus toxinas, hongos, nemátodos, insectos y ácaros. Además de los organismos clásicos empleados en el control biológico de plagas, los agentes de control conocidos como bio-plaguicidas son cada vez más importantes. Los plaguicidas biológicos son productos derivados de animales, plantas y microorganismos, que pueden emplearse aislados, o bien, aplicarse en formulaciones que contienen a los microorganismos (bacterias, hongos, virus o protozoarios) productores de dichas sustancias, como ingrediente activo (bioplaguicidas microbianos). TIPOLOGÍA DE LOS ORGANISMOS EMPLEADOS EN EL CONTROL BIOLOGICO DE PLAGAS. DEPREDADORES, son individuos que consumen varios organismos durante su vida, y activamente buscan su alimento. Algunos consumen un rango amplio de especies (polífagos), otros un rango más estrecho (oligófagos) y otros más son altamente específicos (monófagos). PARASITOIDES, se desarrollan dentro o sobre un organismo, el cual casi siempre muere al ser invadido. PATÓGENOS, son microorganismos parasíticos que frecuentemente matan a su hospedero. PARÁSITOS, los organismos parásitos tienden a debilitar, más que a matar a sus huéspedes y son muchos más pequeños que éstos. Con excepción de algunos nemátodos parásitos de insectos, los parásitos no son buenos agentes de control. BIOPLAGUICIDAS, los formulados a base de la bacteria Bacillus thuringiensis (Bt), han sido los más utilizados. Este microorganismo ha sido aplicado a diferentes cultivos durante años, y ha formado parte fundamental de diversos programas internacionales de MIP, debido a que su efectividad se acerca a la de algunos insecticidas sintéticos. BACTERIAS, consideradas adecuadas para control de insectos, son las siguientes: B. popilliae, B. subtilis y B. sphaericus. El interés por usar bacterias como plaguicidas se atribuye a que pueden producirse con bajos costos, almacenarse por tiempos largos y aplicarse con equipo estándar. VIRUS, otro ejemplo de bioplaguicida exitoso son los Baculovirus, pues al ser aplicados éstos infectan y matan larvas que parasitan los cultivos agrícolas. Se han reportado siete familias de virus que presentan actividad en insectos y únicamente los Baculovirus y los Rhabdovirus han sido considerados seriamente como agentes de control debido a su acción sobre insectos y a sus marcadas diferencias con los virus humanos. HONGOS, con respecto a los hongos entomopatógenos, existen alrededor de 500 hongos con actividad reconocida; los más utilizados son hongos de los géneros Metarhizium, Beauveria, Verticillum, Hirsutella y Nomuraea. Casi todos los hongos entomopatógenos poseen un rango limitado de hospederos, lo cual les confiere cierta especificidad. Los mico insecticidas están siendo ampliamente usados para el control de locústidos y chapulines en varias regiones. LOS NEMÁTODOS, son bien apreciados debido a su capacidad de búsqueda del insecto blanco, ya que matan a sus hospederos en tiempos cortos. Recientemente se empezó a comercializar un producto bioplaguicida formulado con nemátodos entomopatógenos, cuyo uso actual está limitado a plagas de jardines, aunque tal aplicación tiene un gran potencial de uso en campos de cultivo de hortalizas y frutales principalmente. El control biológico puede ser más redituable y efectivo que el químico, en cuatro nichos de mercado. - Cuando los insecticidas sintéticos tienen poca acción reguladora o los patógenos han adquirido resistencia contra ellos. - En ambientes sensibles al uso de insecticidas sintéticos. En particular lugares cerrados como invernaderos y sitios con presencia constante de personas. - Cuando los agentes de control son simbiontes mutualistas de los cultivos y les proporcionan mayor vigor o activan los mecanismos de defensa del vegetal. - En cultivos orgánicos. 5.2.6. Control químico (bioderivados) Dentro de los bioderivados los insecticidas botánicos son los más importantes. Éstos ocuparon una posición importante dentro de las estrategias de protección vegetal, pero fueron sustituidos por los insecticidas sintéticos, sin embargo ha resurgido el interés por estos productos dentro del MIP, aunque hay pocos de ellos disponibles en el mercado. Las piretinas y las rotenonas son los únicos insecticidas derivados de plantas con amplio espectro de acción y de importancia comercial. Esto se puede explicar por dos razones: los compuestos vegetales secundarios rara vez muestran una respuesta cien por ciento tóxica o repelente a los insectos. Las piretrinas se aíslan de una planta compuesta Chrysanthemum cinerariaefolium, éstas matan a los insectos al entrar en contacto con ellos y no tienen un efecto tóxico en los animales de sangre caliente, incluyendo al ser humano. Las rotenonas habitan en raíces de dos géneros: Leguminosae y Papilionoideae, de las cuales se hacen extractos utilizados en jardinería y agricultura. Estos productos no se emplean extensivamente en los sistemas tradicionales de producción agrícola, pero han sido bien aceptados por los productores orgánicos. Otro ejemplo de una planta con compuestos insecticidas es el tabaco (Nicotiana tabacum). Los compuestos activos son la nicotina y los alcaloides relacionados, cuyos extractos se utilizan en invernaderos para combatir herbívoros. Entre todas las posibilidades en estudio, merecen mención especial los derivados del árbol del neem (Azadirachta indica), los cuales tienen importancia particular por su eficacia en campo. Esta meliácea, posee propiedades insecticidas bien conocidas y las investigaciones realizadas indican que presenta numerosos compuestos activos que no tienen un efecto neurotóxico. Algunos de ellos inhiben el desarrollo larval y reducen la fertilidad de las hembras en varias especies de insectos, mientras que otros actúan como repelentes o antifagocíticos. Los compuestos activos son más efectivos contra coleópteros, lepidópteros y ortópteros y se ha probado su inocuidad para vertebrados y polinizadores. Una de las principales aplicaciones de este producto es el tratamiento de granos y semillas almacenadas. Un desarrollo importante en los bioderivados son las feromonas, éstas son producidas por insectos y poseen múltiples funciones biológicas, entre las que destaca su papel como atrayentes para el apareamiento. En el control de plagas las feromonas se usan para atraer insectos y alejarlos de los cultivos; en fechas recientes, las trampas con feromonas se han empleado para controlar moscas de la fruta, entre otras plagas. 5.2.7. Variedades resistentes La biotecnología a través del cultivo de tejidos, facilita la producción de materiales de siembra no infestados que evitan la difusión de enfermedades. El cultivo de células y tejidos vegetales es una tecnología madura, que se emplea de forma rutinaria por numerosas empresas públicas y privadas para reproducir, prácticamente cualquier especie vegetal. Otra aplicación clara de la biotecnología al MIP es la generación de plantas resistentes a plagas a través de la ingeniería genética, ésta permite la transferencia de genes de manera más precisa y específica. Mediante esta herramienta se han generado sistemas de transformación eficiente para todos los cultivos de importancia agronómica. Los procedimientos para introducir genes de diversos orígenes son muy eficientes a nivel experimental y las plantas transgénicas con nuevas resistencias a plagas son sujetas a certificación en el campo de acuerdo con las regulaciones vigentes y están siendo producidas y comercializadas intensamente en Estados Unidos, Canadá, Argentina y China. Se han incorporado por ingeniería genética, un buen número de características agronómicas a los cultivos, todas ellas, codificadas por un solo gen. La única posibilidad de incorporar características de herencia compleja es la transformación secuencial de plantas para incorporar varias características en eventos de transformación independientes. Los avances futuros en el mejoramiento de vegetales por ingeniería genética, estarán limitados por la disponibilidad de genes de importancia agronómica. Por eso, una de las principales prioridades de investigación de la tecnología del ADN recombinante, es la conducción de estudios genéticos y moleculares de plantas cultivadas. Las diversas instituciones de investigación agrícola están trabajando intensamente en la elaboración de mapas genéticos, la determinación de los componentes de las características multigénicas, el aislamiento de secuencias de ADN que regulan expresión genética y de genes útiles de tres tipos principales: genes para mejorar calidad del producto, genes de resistencia a enfermedades y plagas (incluidas las malezas) y genes que confieren resistencia a agentes selectivos. Pero el futuro de la ingeniería genética de plantas no depende sólo de retos científicos y tecnológicos, las principales barreras de aplicación son culturales y sociales. La manipulación genética de vegetales por ingeniería genética tiene casi dos décadas, pero su liberación al ambiente es tan reciente, que no acaba de generar los consensos sociales necesarios para su utilización. Los beneficios de esta tecnología dependerán de tres factores: que demuestre su seguridad y superioridad a otras opciones de mejoramiento, que contribuya a la creación de un sistema de agricultura sustentable y la aceptación del público. Figura 5. Variedades resistentes 5.3. BACTERIAS PROMOTORAS DEL CRECIMIENTO DE PLANTAS La biotecnología ofrece herramientas para el desarrollo sostenible de la agricultura cuando se integra debidamente con otras tecnologías para la producción de alimentos y productos agrícolas, contribuyendo en gran medida a satisfacer en el nuevo milenio las necesidades de una población en crecimiento. La biotecnología puede ser definida como el uso integrado de bioquímica, microbiología, genética molecular y procesos tecnológicos, y desarrollada por microorganismos, genes, células y tejidos de organismos superiores para obtener un beneficio. La FAO reconoce que la biotecnología agrícola puede contribuir a elevar la producción en este sector. Las principales técnicas de la agro-biotecnología incluyen fermentación, cultivo de tejidos, procesos enzimáticos, producción de anticuerpos, técnicas donde se emplean marcadores moleculares y la aplicación de inoculantes biológicos. De acuerdo a esto último, el uso de inoculantes incluye la selección y multiplicación de microorganismos benéficos para las plantas, tanto de aquellos que protegen a la planta contra el ataque de patógenos, plagas y malezas, como de aquellos que le proporcionan nutrimentos. 5.3.1. Biocontrol Los microorganismos con efecto benéfico en la planta pueden tener un potencial considerable como agentes de biocontrol y biofertilizantes. Se distinguen tres grandes grupos: (a) Microorganismos fijadores de nitrógeno (b) hongos micorrízicos (c) bacterias promotoras del crecimiento de plantas. Este último grupo de bacterias es conocido como PGPR (promoting growth plant rhizobacteria) y fue definido por Kloepper como bacterias habitantes de la raíz que estimulan significativamente el crecimiento de plantas. En años recientes se ha caído en cierta controversia, ya que no se sabe hasta qué punto se puede considerar a una rizobacteria como PGPR, por lo que se han establecido cuatro características que definen este grupo: - Que no requieran de la invasión interna de tejidos en plantas, como ocurre en hongos micorrízicos con la formación de arbúsculos o nódulos en el caso de Rhizobium. - Que tengan una elevada densidad poblacional en la rizósfera después de su inoculación, ya que una población que declina rápidamente tiene una baja capacidad competitiva con la microflora nativa del suelo. - Que presenten capacidad de colonización efectiva en la superficie de la raíz y, como consecuencia, puedan influir positivamente en el crecimiento de la planta. - Que no produzcan daño en el hombre ni a otros microorganismos. En cuanto al efecto positivo sobre el crecimiento de las plantas, las PGPR pueden actuar de manera indirecta o directa: MECANISMOS INDIRECTOS, los metabolitos producidos por las PGPR pueden funcionar como determinantes antagónicos, involucran aspectos de control biológico, suprimen o inhiben el crecimiento de microorganismos perjudiciales para el desarrollo de la planta, vía producción de sideróforos, antibióticos, acción de enzimas líticas (glucanasas, quitinasas) o inducción de mecanismos de resistencia. MECANISMOS DIRECTOS, ocurren cuando los metabolitos producidos por algunas cepas de rizobacterias son utilizados como reguladores de crecimiento o precursores de éstos por parte de la planta. La conjunción de ambos mecanismos de acción ha dado como resultado la promoción evidente del crecimiento en plantas; se ha observado un incremento en la emergencia, el vigor y el peso de plántulas, un mayor desarrollo en sistemas radiculares y un incremento hasta de 30% en la producción de cultivos de interés comercial, tales como papa, rábano, trigo y soya. La mayoría de las investigaciones realizadas en este ámbito se han enfocado a la elucidación de mecanismos involucrados en el control biológico y relativamente poco en el conocimiento relacionado con la promoción directa. Esto ha dado pauta para realizar estudios que consideren principalmente la densidad del inóculo, fisiología de la cepa promotora, temperatura, propiedades del suelo, cultivo y genotipo de la planta; el objetivo es entender de manera clara los mecanismos de promoción de crecimiento de plantas inducido por cepas PGPR, con el propósito de aislar y seleccionar nuevas cepas que representen una fuente exitosa de inoculantes biológicos en la agricultura, así como en la elaboración de productos comerciales. Cabe mencionar que en la actualidad el uso de microorganismos representa sólo el 1.4% (380 millones de dólares) del mercado global para el control de plagas y enfermedades. Los productos generados a partir de Bacillus thuringiensis para el control de plagas son los más abundantes en el mercado. Una de las causas de su éxito es su facilidad para formularse, a diferencia de los biofungicidas donde el producto requiere del manejo del microorganismo vivo para tener un efecto benéfico. Lo anterior muestra que este tipo de productos no está bien establecido en la agricultura comercial en el ámbito mundial. Para que un microorganismo antagónico se pueda utilizar en el desarrollo comercial de un biofungicida se deben cumplir con los siguientes criterios: - Efectiva supresión del patógeno antes de que cause un importante daño económico. - Consistencia en los resultados en condiciones de campo. - Adaptación a un sistema de manejo integrado para el control de plagas y enfermedades. - Precio competitivo con otras medidas de combate. - Compatibilidad con otros tratamientos para el control de otras plagas o enfermedades. - Adaptación al uso cotidiano de las prácticas agrícolas. - Inocuidad a otras especies, al hombre y al ambiente. 5.3.2. Biofungicidas en el cultivo de papa Para llegar a tener un biofungicida con estas características es fundamental entender la interacción entre el patógeno y el organismo antagónico. Teniendo esto presente, se desarrolló un biofungicida en contra de Rhizoctonia solani. El desarrollo de este producto involucró convencer a los productores de papa que el uso de microorganismos era una buena alternativa. Se comenzó a trabajar en el aislamiento de uno de los hongos que mayor importancia tienen para este cultivo: Rizhoctonia solani. En principio se encontró una gran diversidad de cepas del hongo, lo que nos hizo comprender porqué los productos químicos no siempre eran efectivos. Como era fundamental conocer al enemigo a vencer, se realizó el estudio del comportamiento en suelo de las diferentes cepas de hongos. Al mismo tiempo se aislaron los organismos antagónicos de este patógeno. De unos 30 aislados bacterianos que tenían capacidad antagónica in vitro, se seleccionó uno que podía inhibir el desarrollo de los diferentes tipos de rizhoctonias. Es reconocido que muchos organismos son capaces de antagonizar a otro en medios de cultivo bacterianos pero cuando se prueban en suelo esta capacidad no se expresa. Por ello el siguiente paso fue realizar los ensayos en invernadero con suelos contaminados con este hongo; los resultados mostraron una reducción significativa de la enfermedad. Ensayos adicionales en laboratorio permitieron identificar que esta bacteria era capaz de inhibir a prácticamente todos los grupos de anastomosis de Rizhoctonia solani, algunas cepas de Fusarium sp. y de Phytophthora infestans. Esto representa una ventaja y es posible utilizarla en el manejo integrado de plagas y enfermedades. Convencidos que tenía buena perspectiva, identificamos esta bacteria y comenzamos a realizar estudios fisiológicos para optimizar sus condiciones de crecimiento, en medios de cultivo baratos y sin menoscabo de su actividad antagónica; estos requisitos son fundamentales para su aplicación a nivel industrial. Los resultados indicaron que se trataba de un Bacillus subtilis (bacteria esporulada), con capacidad para crecer en medios muy simples. Continuamos estudiando a la bacteria; para los siguientes años se sabía que su actividad antagónica era debida a tres péptidos que se producían a finales de la fase de crecimiento exponencial. Asimismo, se reconoció que la estabilidad de su capacidad antagónica era de más de 6 meses sin refrigeración, lo que era más atractivo para su comercialización pues indicaba una vida de anaquel larga, comparada con otros productos existentes en el mercado internacional. 5.3.3. Prueba crítica Con los avances logrados, la prueba crítica era ante los productores; para esto, algunos agricultores interesados prestaron sus campos para probar el producto. Lo iban a comparar con otro producto biológico que existe en el mercado y con los agroquímicos que ellos utilizan. Al final del primer ensayo el producto fue muy recomendable, se había logrado controlar la enfermedad y los rendimientos eran muy superiores; adicionalmente, se obtenían papas de mejor calidad, lo que repercute en el precio. No obstante esos resultados, se repitieron en varios ciclos de cultivo y en otros sitios, donde la incidencia de la enfermedad es alta; los resultados fueron similares, la bacteria sí funcionaba en campo, y en muchas de las ocasiones se incrementaron los rendimientos hasta en 10 TN por hectárea. La dosis a aplicar que se requiere es un litro por hectárea de una suspensión bacteriana de al menos 106 ufc por ml y que se podían aplicar con una aspersora sobre la semilla y el surco, al momento de la siembra. A raíz de esos ensayos, en uno de los terrenos no se presentó la enfermedad, pero sorprendentemente las plantas a las que se les había adicionado el B. subtillis produjeron más Kg por hectárea y las papas fueron de mejor calidad. Estábamos ante una bacteria promotora de crecimiento que tiene como mecanismos de promoción la inhibición de patógenos y la estimulación directa del crecimiento de las plantas. 5.3.4. Probacil Se llegó a definir que la bacteria para su comercialización debería tener color y consistencia atractiva. Se ensayo diferentes colores y dispersantes que no inhibieran a la bacteria ni su poder antagónico, mientras tanto, la entidad encargada del registro de productos llegó a la conclusión que el nombre más adecuado, pues no existía alguno parecido en el mercado, era Probacil. Ya en el mercado, otro problema fuerte que se tuvo que resolver fue la densidad del microorganismo, debido a que en el mercado existe un producto donde su etiqueta marca una concentración de 109 ufc por ml y Probacil llevaba 107 ufc por ml, suficientes para dar excelentes resultados en el campo, pero que desde el punto de vista mercantil daba una desventaja comercial al Probacil. Sin embargo, Probacil es un producto biológico que ofrece las siguientes ventajas: - Permite un control prolongado de enfermedades del suelo producidas por Rhizoctonia y Fusarium. - Promueve el desarrollo radicular y vegetativo que se refleja en incrementos en producción. - Es de aplicación sencilla y versátil, en semilla, planteras, fondo del surco y riego por goteo. - La cepa posee una alta adaptación a diferentes condiciones de pH, temperatura y humedad. - Es un producto orgánico natural, no tóxico y su uso no implica riesgo alguno para la salud y el medio ambiente. Las promesas de la biotecnología agrícola residen en aumentar la productividad y reducir costos, generar innovaciones, mejoras en los alimentos y conducir a prácticas agrícolas más ecológicas; contribuir, en suma, a la agricultura sustentable que utiliza los recursos con respeto al ambiente y sin comprometer a las generaciones futuras. 5.4. PRINCIPALES BACTERIAS Y HONGOS PATOGENOS PARA EL HOMBRE ASOCIADOS A LOS ALIMENTOS 5.4.1. Bacterias Proteobacterias: Alfa proteobacteria: brucela Proteobacterias: Gamma proteobacteria: Escherichia, Salmonella. Aeromonas. Proteobacterias: Gamma proteobacteria: Shigella. Enterobacter. Serratia. Yersinia. Pleisomonas Proteobacterias: Gammaproteobacteria: Campylobacter. Vibrio. Gram-positivas de bajo G+C. Clostridium. Bacillus Gram-positivas de bajo G+C. Listeria. Staphylococcus. . 5.4.2. Hongos Hongos micotoxigénicos. Aspergillus. Penicillium. Hongos micotoxigénicos. Fusarium. Claviceps. Otros géneros.