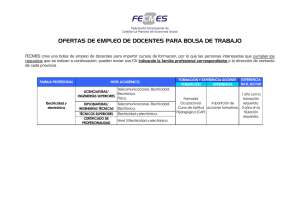
ORGANIZACION Y METODOS
Anuncio

FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL SÍLABO I. DATOS GENERALES: II. CARRERA PROFESIONAL : CÓDIGO CARRERA PROFESIONAL ASIGNATURA CÓDIGO DE ASIGNATURA CÓDIGO DE SÍLABO Nº DE HORAS TOTALES Nº DE HORAS TEÓRICAS Nº DE HORAS PRÁCTICA Nº DE CRÉDITOS CICLO PRE – REQUISITOS TIPO DE CURSO DURACIÓN DEL CURSO CURSO REGULAR EXAMEN SUSTITUTORIO DURACIÓN DEL CURSO EN LA MODALIDAD A DISTANCIA CURSO REGULAR EXAMEN SUSTITUTORIO : : : : : : : : : : : : : : : INGENIERÍA ELECTRONICA Y TELECOMUNICACIONES 29 QUÍMICA GENERAL 29-111 2911131012014 5 HORAS SEMANALES 3 HORAS SEMANALES 2 HORAS SEMANALES 4 CRÉDITOS POR CICLO II CICLO NINGUNO OBLIGATORIO 18 SEMANAS EN TOTAL 17 SEMANAS 1 SEMANA 9 SEMANAS EN TOTAL : : 8 SEMANAS 1 SEMANA DESCRIPCIÓN DE LA ASIGNATURA: El curso, presenta el desarrollo y evolución de la Química como ciencia, y de las teorías desarrolladas en torno a la idea del átomo. Asimismo el alumno irá poniendo en práctica cada uno de los temas desarrollados en clase, en el laboratorio, de tal forma que pueda corroborar la veracidad de la teoría presentada en clase. El curso está dirigido a los alumnos de los primeros ciclos, los que inician sus estudios en la Escuela Profesional de Ingeniería Industrial, por lo que los temas del sílabo dan los fundamentos científicos y prácticos de la carrera, la cual al ser una ciencia tiene su origen en el experimentar e investigar. Como complemento a la formación humanística – tecnológica, el curso tendrá sesiones teórico prácticas donde el alumno podrá experimentar, criticar, reflexionar y predecir situaciones y reacciones que no sólo ocurren en el CICLO II QUÍMICA GENERAL Página 1 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL laboratorio sino también en la vida diaria, de tal forma que sea consciente de su papel en el cuidado del medio ambiente. III. OBJETIVOS GENERALES: Al finalizar el curso los alumnos serán capaces de: a. Comprender las diferentes teorías acerca de la estructura de la materia y la conservación de la misma. b. Comprender y emitir juicios de opinión de los principales conceptos y teorías empleadas en la Química Inorgánica y Orgánica. c. Desarrollar habilidades para comunicarse adecuadamente con lenguaje químico y rigor científico, tanto en forma oral como escrita. d. Aplicar comprensivamente expresiones matemáticas en la resolución de ejercicios relacionados con estequiometría. e. Desarrollar la capacidad de análisis y síntesis a través del estudio de las reacciones químicas. f. Afianzar la autoestima y la seguridad en sí mismo, en la medida en que se obtengan los logros positivos y éxitos académicos. g. Desarrollar habilidades intelectuales para interpretar ejercicios o problemas numéricos, y plantear su solución de una forma sistemática y ordenada. OBJETIVOS ESPECÍFICOS: CICLO II Comparar algunas características de los gases, los líquidos y los sólidos. Explicar el cambio de volumen de los gases frente a las variaciones de presión y temperatura, can base en las leyes establecidas. Aplicar las leyes establecidas de presiones parciales para resolver ejercicios acerca de los gases. Explicar el comportamiento de los gases basado en principios de la teoría cinética molecular. Valorar el agua como una de las sustancias más abundantes en la naturaleza y como un recurso que merece un uso racional. QUÍMICA GENERAL Página 2 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL IV. Explicar el proceso de solubilidad y sus relaciones con los factores que la determinan. Diferenciar y aplicar las unidades físicas y químicas, más usadas para expresar la concentración de las soluciones. Diferenciar entre rendimiento real y rendimiento teórico y rendimiento teórico en una reacción química. Relacionar los procesos endotérmicos y exotérmicos con la pérdida y ganancia de calor. Aplicar la ley de Hess para calcular el calor de una reacción. Relacionar la corriente eléctrica con algunas reacciones químicas, diferenciando una celda voltaica de una celda electrolítica. Expresar correctamente la velocidad de una reacción química, diferenciando las reacciones endotérmicas de las exotérmicas, y precisando los factores que afectan la velocidad de una reacción. Explicar los conceptos de ácido y base, según la teoría de Arrhenius. Expresar correctamente la constante de equilibrio para algunos ácidos y bases débiles. Establecer interrelaciones entre los conceptos de pH y [H+]; pH y pOH, neutralización y formación de sales. Aplicar los conceptos de pH y pOH para la identificación de soluciones ácidas y básicas. METODOLOGÍA: El profesor hará la presentación introductoria del curso y del sílabo propiamente dicho. Promoverá el diálogo y la investigación constante de los alumnos y su participación en las clases teórico – prácticas. En las clases teóricas se presentará el fundamento de los temas señalados en el programa analítico y se complementará con la resolución de ejercicios, problemas y prácticas en el laboratorio con el objeto de complementar el aprendizaje, de tal manera que confronte y prediga algunos acontecimientos a suceder. a. Métodos: Inductivo – deductivo. CICLO II QUÍMICA GENERAL Página 3 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL Analítico – Sintético. Hermenéutico. Crítico. b. Técnicas: Debates, simposio, mesa redonda. Exposiciones individuales y grupales. Participación en talleres. Investigación: Libros, revistas, páginas Webs. Comentarios individuales de temas del curso (actualidad científica y tecnológica) V. EVALUACIÓN: El reglamento vigente de la Universidad exige la asistencia obligatoria a clases. La evaluación es continua y permanente. El docente tendrá en cuenta que el alumno se exprese claramente en forma escrita y oral, utilizando lenguaje científica, con el rigor que esta exige. La modalidad de evaluación será la siguiente: EXAMENES ESCRITOS: Examen Parcial (EP) 30% Examen Final (EF) 30% TRABAJO ACADÉMICO Y PRACTICAS CALIFICADAS: 40% CICLO II Dos prácticas calificadas: a. Primera parte del semestre b. Segunda parte del semestre Prácticas dirigidas a desarrollarse en clase en cada semana (pueden ser en forma escrita u oral, tomando en cuenta el equilibrio que debe haber entre ambas). Intervenciones orales. Exposiciones. a. Individuales. b. Escritas QUÍMICA GENERAL Página 4 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL Lecturas referentes a los temas desarrollados en clase. El examen sustitutorio (ES), será tomado en el semana 18 del ciclo y consiste en la evaluación teórico – práctica de conocimientos de todo el curso. La evaluación será escrita. La nota obtenida en el examen sustitutorio, podrá reemplazar la nota más baja que el alumno haya obtenido en su examen parcial o en el examen final y proceder el reemplazo, se recalculará la nueva nota final. En el caso de que la nota del examen sustitutorio sea menor que la nota del examen parcial o del examen final, no se reemplazará ninguna de ellas, quedando el alumno con la nota obtenida hasta antes del examen sustitutorio. Es de total aplicación el Reglamento Transitorio de Evaluación de la Universidad entregado al alumno. La asistencia a clases y prácticas es obligatoria. No podrán sobrepasarse del 30% de inasistencias, para tener derecho de evaluación. RECURSOS MATERIALES: VI. Pizarra y tizas. Material audio visual a. Data Show b. Internet, extranet e intranet. Asistencia obligatoria a eventos relacionados a la carrera. Lecturas semanales de índoles científico. El alumno deberá presentarse a clases con los materiales necesarios para efectuar su trabajo. CONTENIDO DEL CURSO: SEMANA 1: Epistemología. Método científico. Etapas del método científico. El proceso decisional. El informe científico: Modelo de informe científico. Magnitudes fundamentales y derivadas. Sistema Internacional de unidades. Ejercicios y problemas CICLO II QUÍMICA GENERAL Página 5 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL SEMANA 2: Carácter aproximado de la medida. Sensibilidad, exactitud y precisión. Cualidades de un aparato de medida. Precisión y sensibilidad. Cifras significativas. Reglas para interpretar el número de cifras significativas. Análisis de datos en tablas y gráficos. Representación gráfica de una función. El trabajo en el laboratorio. Ejercicios y problemas. SEMANA 3: Formulación y Nomenclatura Inorgánica. Óxidos metálicos y no metálicos. Hidróxidos. Hidruros metálicos y no metálicos. Hidrácidos. Oxácidos. Sales Binarias y ternarias. Ejercicios y problemas con nomenclatura Tradicional, Stock y Iupac. SEMANA 4: Átomo y elemento químico. Número atómico. La masa de los átomos: concepto de número másico. Alteraciones en los átomos: iones e isótopos. El mol: unidad de sustancia. Razones molares. Reactivo límite. Rendimiento porcentual. Rendimiento de las reacciones químicas. Ejercicios y problemas SEMANA 5: Transformaciones físicas y químicas. Reacciones química. Ecuaciones químicas. Conservación de la masa en las reacciones químicas. Ajuste de las reacciones químicas. Relaciones de volumen en las reacciones químicas. Ley de Avogadro. Relaciones de masa en las reacciones químicas. Velocidad de reacción. Ejercicios y problemas. SEMANA 6: Leyes de los Gases. Ley de Boyle. Ley de Avogadro. Ley de Charles-Gay Lussac. Ley del Gas Ideal. Masa Molar. Dalton y la ley de las presiones parciales. Fracción molar. Estequiometria. Ejercicios y problemas. SEMANA 7: Teoría cinético-molecular. Distribución de la velocidad Molecular. Velocidad cuadrática media. Difusión de los gases. Desviación del Comportamiento ideal . Ejercicios y problemas. SEMANA 8: Examen parcial CICLO II QUÍMICA GENERAL Página 6 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL SEMANA 9: Sólidos amorfos y sólidos cristalinos. Estructura de los cristales. Enlaces en sólidos. Teoría de bandas de los metales. Semicondutores. Ejercicios y problemas. SEMANA 10: Química de los metales. Teoría de la banda de conductividad. Conductores. Semiconductores. Ejercicios y problemas. SEMANA 11: Termoquimica. Primera de la termodinámica. Cambio de entalpía. Ejercicios y problemas. SEMANA 12: Segunda y tercera ley de la termodinámica Cambios de energía. Calorimetría. Entropía. Ejercicios y problemas. SEMANA 13: Química Industrial. Materia primas para la industria química. Productos de la Industria química inorgánica. Procesos químicos. SEMANA 14: Fundamentos de la Química Nuclear. Radiactividad natural. Transmutación natural. Radiación de fondo. Radiactividad inducida. Usos prácticos de algunos radioisótopos. SEMANA 15: Química Orgánica. Propiedades generales. Alcanos. Formulas estructurales. Alquenos y alquinos. Hidrocarburos Aromáticos. Alcoholes. Fenoles. Nomenclatura. Ejercicios y problemas SEMANA 16: Éteres. Aldehídos y cetonas. Ácidos carboxílicos y ésteres. Aminas y Amidas. Nomenclatura. Ejercicios y problemas. SEMANA 17: Examen final CICLO II QUÍMICA GENERAL Página 7 de 8 FACULTAD DE INGENIERÍAS Y ARQUITECTURA ESCUELA ACADÉMICO PROFESIONAL DE INGENIERÍA ELECTRÓNICA Y TELECOMUNICACIONES QUÍMICA GENERAL SEMANA 18: Examen sustitutorio. VII. BIBLIOGRAFÍA: Además de la bibliografía básica, la complementaria y la electrónica, el alumno tendrá acceso al uso del Internet para ampliar los temas de investigación y consulta que requiera. A. BIBLIOGRAFIA BÁSICA: 1. Chang Raymond. Quimica. Septima Edicion. Colombia, Mc Graw Hill, 2007, 1020 pag. B. BIBLIOGRAFIA COMPLEMENTARIA 1. Petruci Ralph. Química General. Octava Edición, Madrid, Prentice Hall, 2003, 1178 pag. 2. Kotz J.- Treichel P. Chimica e Reattivita Chimica. Septima Edizione. Napoli, Edises 2009, 1250 pag. 3. Spencer J.- Bodner J. Química estructura y Dinámica. 2da Edición. México, Continental, 2000, 1000 pág. 4. Silbelberg M. Química General. Segunda Edición México, Mc Graw Hill, 2002, 1256 pag. 5. Cruz J.- Osuna M. Química Orgánica Nomenclatura, reacciones y aplicaciones. Segunda Edición. México, Universidad Autónoma de Sinaloa 2006, 305 pag. C. BIBLIOGRAFIA ELECTRÓNICA 1. https://dued.uap.edu.pe/biblioteca_virtual.htm 2. Rodontomano. Chimica Generale . www.rodontomano.it . Milan, 2010, 568 pag. 3. Malfi P. Note di Nomenclatura per Composti Inorganici. Liceo Mario Foscarini di. http://takimika.liceofoscarini.it . Venezia ,2008, 200 pag. 4. E-learning. Material didáctico. www.uninsubria.it. Milán, 2010 CICLO II QUÍMICA GENERAL Página 8 de 8