ECA QUÍM 2 1er parcial ESTEQUIOMETRÍA 04-03-15-17
Anuncio
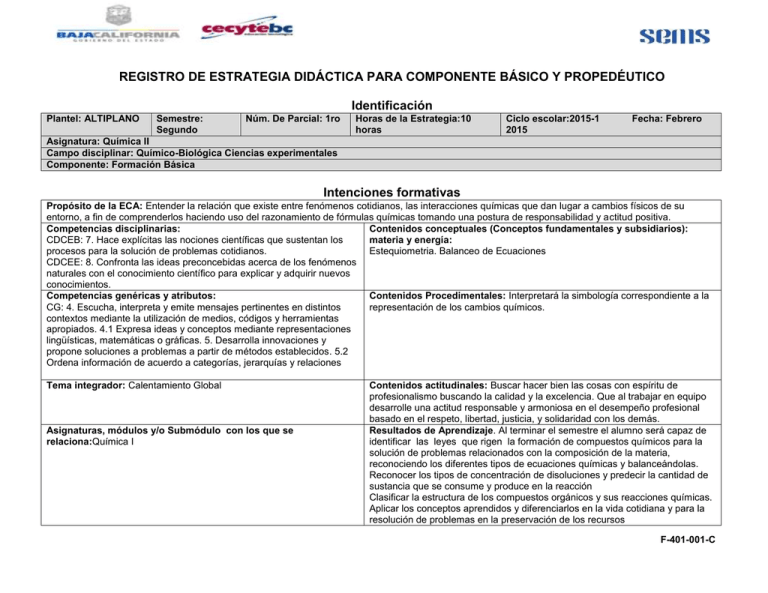
REGISTRO DE ESTRATEGIA DIDÁCTICA PARA COMPONENTE BÁSICO Y PROPEDÉUTICO Identificación Plantel: ALTIPLANO Semestre: Segundo Núm. De Parcial: 1ro Horas de la Estrategia:10 horas Ciclo escolar:2015-1 2015 Fecha: Febrero Asignatura: Química II Campo disciplinar: Químico-Biológica Ciencias experimentales Componente: Formación Básica Intenciones formativas Propósito de la ECA: Entender la relación que existe entre fenómenos cotidianos, las interacciones químicas que dan lugar a cambios físicos de su entorno, a fin de comprenderlos haciendo uso del razonamiento de fórmulas químicas tomando una postura de responsabilidad y actitud positiva. Competencias disciplinarias: Contenidos conceptuales (Conceptos fundamentales y subsidiarios): materia y energía: CDCEB: 7. Hace explícitas las nociones científicas que sustentan los procesos para la solución de problemas cotidianos. Estequiometria. Balanceo de Ecuaciones CDCEE: 8. Confronta las ideas preconcebidas acerca de los fenómenos naturales con el conocimiento científico para explicar y adquirir nuevos conocimientos. Competencias genéricas y atributos: Contenidos Procedimentales: Interpretará la simbología correspondiente a la CG: 4. Escucha, interpreta y emite mensajes pertinentes en distintos representación de los cambios químicos. contextos mediante la utilización de medios, códigos y herramientas apropiados. 4.1 Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o gráficas. 5. Desarrolla innovaciones y propone soluciones a problemas a partir de métodos establecidos. 5.2 Ordena información de acuerdo a categorías, jerarquías y relaciones Tema integrador: Calentamiento Global Asignaturas, módulos y/o Submódulo con los que se relaciona:Química I Contenidos actitudinales: Buscar hacer bien las cosas con espíritu de profesionalismo buscando la calidad y la excelencia. Que al trabajar en equipo desarrolle una actitud responsable y armoniosa en el desempeño profesional basado en el respeto, libertad, justicia, y solidaridad con los demás. Resultados de Aprendizaje. Al terminar el semestre el alumno será capaz de identificar las leyes que rigen la formación de compuestos químicos para la solución de problemas relacionados con la composición de la materia, reconociendo los diferentes tipos de ecuaciones químicas y balanceándolas. Reconocer los tipos de concentración de disoluciones y predecir la cantidad de sustancia que se consume y produce en la reacción Clasificar la estructura de los compuestos orgánicos y sus reacciones químicas. Aplicar los conceptos aprendidos y diferenciarlos en la vida cotidiana y para la resolución de problemas en la preservación de los recursos F-401-001-C naturales.Reconocer la contribución de los conocimientos científicos aportados por la Química a la resolución de problemas del entorno natural. Desarrollar una actitud responsable y predisposición al uso de conocimientos de la química como una herramienta interpretativa de los fenómenos naturales, buscando la calidad y excelencia en su desempeño. ECAS Estrategias Centradas en el Aprendizaje APERTURA ACTIVIDADES Y PRÁCTICAS Nivel Básico Actividad de aprendizaje 1. El docente hará una evaluación diagnostica, la cual permitirá conocer que tanto conocen los alumnos del tema de Estequiometria, Actividad 1. Recursos, equipo y material Computadora, cañón y proyector Pizarrón Marcadores Material y Equipo de Laboratorio Lecturas, cuestionarios Laboratorio de Prácticas con instalaciones de agua, gas, etc. Tabla periódica Producto de aprendizaje/Evidencia de desempeño Hoja impresa y/o cuaderno del alumno Evaluación (instrumentos y ponderación) Cuestionario diagnostico Autoevaluación Anexo 1 – Actividad 1 CG: 4. Fuentes de información (Bibliografía, págs. Web, otras) Fuentes de información (Bibliografía, págs. Web, otras): Fundamentos de química, By Burns, Ralph A. Burns, Héctor Javier Escalona y García Fundamentos de QUÍMICA GENERAL. Rosemberg-Shaun Editorial Mc Graw-Hill., Ed. 7a. 1995. Fundamentos de Química Inorgánica, Hector Ignacio Flores Álvarez, Editorial Minerva, México 2004. Fundamentos de Química, Redmore F. Prentice Hall. Ed. 1a., 1981. Programa del Curso de Formación de Multiplicadores Estatales, Química, Cecyte Plantel Mexicali Baja California, 2008 Química II Esperanza Cisneros Montes de Oca. Edit. DGETI, SEP, México 2002. DESARROLLO ACTIVIDADES Y PRÁCTICAS QUE PROMUEVEN UN APRENDIZAJE SITUADO. Nivel básico a intermedio Producto de Evaluación (instrumentos y ponderación) Actividad de aprendizaje aprendizaje/Evidencia de desempeño 2. Fórmulas de compuestos. Co-evaluación. 2. El docente pedirá a los alumnos realizar una actividad con 2. Cuaderno Anexo 2 - Actividad 2 ejercicios propuestos en clase. Actividad 2. 3. Exposición por parte del docente 3. El docente presentara a través de una tecnología que 3. Apunte en el cuaderno del representa a una ecuación química, sus partes y símbolos alumno más comunes. Actividad 3 4. Tipos de reacciones. Heteroevaluación. 4. El docente explicará cómo se desarrolla una fórmula química 4. Copia y/o cuaderno del Anexo 4 – Actividad 4 y los diferentes tipos de reacciones químicas que existen. alumno F-401-001-C Actividad 4 5. Mediante ejercicios de tarea el alumno identifica el tipo de reacción que se lleva a cabo y el nombre del compuesto que se obtuvo como producto.Actividad 4 Recursos, equipo y material Computadora, cañón y proyector Pizarrón Marcadores Material y Equipo de Laboratorio Lecturas, cuestionarios Laboratorio de Prácticas con instalaciones de agua, gas, etc. Tabla periódica 5. Copia y/o cuaderno del alumno 5. Tipos de reacciones. Heteroevaluación. Anexo 4 – Actividad 4 Fuentes de información (Bibliografía, págs. Web, otras): Fundamentos de química, By Burns, Ralph A. Burns, Héctor Javier Escalona y García Fundamentos de QUÍMICA GENERAL. Rosemberg-Shaun Editorial Mc Graw-Hill., Ed. 7a. 1995. Fundamentos de Química Inorgánica, Hector Ignacio Flores Álvarez, Editorial Minerva, México 2004. Fundamentos de Química, Redmore F. Prentice Hall. Ed. 1a., 1981. Programa del Curso de Formación de Multiplicadores Estatales, Química, Cecyte Plantel Mexicali Baja California, 2008 Química II Esperanza Cisneros Montes de Oca. Edit. DGETI, SEP, México 2002. CIERRE ACTIVIDADES Y PRÁCTICAS QUE PROMUEVEN INTEGRACIÓN DE SABERES, CONCLUSIONES. Nivel intermedio a experto. Producto de Evaluación (instrumentos y ponderación) Actividad de aprendizaje aprendizaje/Evidencia de desempeño Mapa conceptual. Heteroevaluación 1. Realizar de manera individual un mapa Conceptual sobre Cuaderno del alumno los diferentes tipos de reacciones aprendidas. Recursos, equipo y material Fuentes de información (Bibliografía, págs. Web, otras) Computadora, cañón y proyector Fuentes de información (Bibliografía, págs. Web, otras): Pizarrón Fundamentos de química, By Burns, Ralph A. Burns, Héctor Javier Escalona y García Marcadores Fundamentos de QUÍMICA GENERAL. Rosemberg-Shaun Editorial Mc Graw-Hill., Ed. Material y Equipo de Laboratorio 7a. 1995. Lecturas, cuestionarios Fundamentos de Química Inorgánica, Hector Ignacio Flores Álvarez, Editorial Minerva, Laboratorio de Prácticas con instalaciones de agua, gas, etc. México 2004. Fundamentos de Química, Redmore F. Prentice Hall. Ed. 1a., 1981. Tabla periódica Programa del Curso de Formación de Multiplicadores Estatales, Química, Cecyte Plantel Mexicali Baja California, 2008 Química II Esperanza Cisneros Montes de Oca. Edit. DGETI, SEP, México 2002. Elabora: Profesor (es) ING. ANA GUADALUPE CARRILLO VELARDE VALIDACIÓN Recibe: docente que utiliza la estrategia didáctica Avala: Coordinador académico MC. JESUS ERNESTO OSUNA AGUIRRE F-401-001-C Actividad 1. Conceptos y Definiciones Instrucciones: Coloca una X en el espacio que consideres pertinente ¿Qué es? No sé Lo sé Lo sé muy poco Lo se mas o menos Debo repasar Átomo Iones Moléculas Elementos Compuestos Formula Mol Ecuación química Reacción química Masa molecular Masa atómica Reactivo limitante Estequiometria F-401-001-C Actividad 2. Fórmulas de Compuestos Instrucciones: En parejas dar el nombre a este listado de compuestos Valor: 0.55 puntos cada uno/Co-evaluación 1. P2O5___________________________ 10. NH3____________________________ 2. CuBr2___________________________ 11. V2O5__________________________ 3. SO3_____________________________ 12. MgCl2__________________________ 4. Cl2O7___________________________ 13. CO_____________________________ 5. NaCl____________________________ 14. ZnS_____________________________ 6. FeO_____________________________ 15. CrCl3___________________________ 7. Cr2S3___________________________ 16. AuBr___________________________ 8. H2O2___________________________ 17. HgO____________________________ 9. PCl3____________________________ 18. LiH_____________________________ F-401-001-C COLEGIO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS DEL ESTADO DE BAJA CALIFORNIA Actividad 3. Reacciones químicas, sus partes y símbolos Instrucciones: Exposición por parte del docente. NaClac + AgNO3 ac → AgCl↓ + NaNO3 ac REACTIVOS O REACTANTES PRODUCTOS FINALES Ecuaciones químicas (simbología) s λ g → ← ↑ ↓ → Hf I uv ∆ ac ó aq A,b,c,d Sólidos Líquidos Gaseosas Reacciones reversibles Gas que se desprende Sustancia precipitada Origina a. reacción irreversible Energía electromagnética. Corriente léctrica Energía ultravioleta Incremento de calor Medio acuoso Coeficientes estequiométricos F-401-01-C COLEGIO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS DEL ESTADO DE BAJA CALIFORNIA Actividad 4. Tipos de Reacciones Instrucciones: Exposición por parte del docente. REACCIÓN DE SÍNTESIS 2H2+O2 2H2O REACCIÓN DE DESCOMPOSICIÓN CaCO3CaO+CO2 REACCIÓN DE SIMPLE DESPLAZAMIENTO O SIMPLE SUSTITUCION 2NaI + Br22NaBr + I2 REACCIÓN DE DOBLE DESPLAZAMIENTO O DOBLE SUSTITUCION HCl + NaOHNaCl + H2O Instrucciones: Analiza y menciona que tipo de reacción se presenta a continuación colocando dentro del paréntesis según corresponda. Valor: 1.25 punto por reactivo, total 10 puntos. ( A ) Reacción de síntesis: A + B AB ( B ) Reacción de descomposición: AB A + B ( C ) Reacción de simple sustitución o simple desplazamiento: A+BC AC+B ( D ) Reacción de doble sustitución o doble desplazamiento: AB+CD AD+CB 1. 2H2O 2H2 + O2: ----------------------------------------------------------( ) 2. 2Na + 2HNO3 2NaNO3+ H2: -----------------------------------------( ) 3. MgO + H2O Mg(OH)2: --------------------------------------------------( ) 4. BaCl2 + Na2SO4 BaSO4 +2NaCl: ---------------------------------( ) 5. Zn+ HCl ZnCl + H:------------------------------------------------------( ) 6. Cu + 2AgNO3 Cu(NO3)2 + 2Ag:-----------------------------------( ) 7. 2CH4 + 3O2 2CO + 4H2O :-----------------------------------------( ) 8. Mg + H2SO4 MgSO4 + H2 :----------------------------------------( ) F-401-01-C COLEGIO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS DEL ESTADO DE BAJA CALIFORNIA Anexo 2 LISTA DE COTEJO Evaluación de un mapa conceptual de las actividades anteriores Grupo: __________________ Tema: ____________________Fecha: _________________ Profesor que Evalúa: ___________________________________________________________ Asignatura: ___________________________________________________________________ Parcial: ______________________________________________________________________ CRITERIOS DE EVALUACIÓN Escala de valores Calificación 4 10=Excelente 3 9=Muy bien 2 8=Bien 1 7=Necesita mejorar 0 5=Mal Alumno Conoce el desarrollo de un mapa conceptual La información descrita es coherente con el tema. Sigue una relación contextualizada Creatividad. Puntaje 1. 2. 3. 4. 5. 6. OBSERVACIONES: _________________________________________________________________________________________________________________ _____________________________________________________________________________________________________________ F-401-01-C COLEGIO DE ESTUDIOS CIENTIFICOS Y TECNOLOGICOS DEL ESTADO DE BAJA CALIFORNIA LISTA DE COTEJO Grupo: Asignatura : QUIMICA II Actividad Numero: 1 Criterio de Evaluación Nombre del Alumno: Profesor que Evalúa: Parcial: 1 Tema: Evaluación Diagnóstica Firma del Cumplió Profesor SI NO Tomo en cuenta las instrucciones Identifica los conceptos Participo en clase Trabajo en Equipo Termino a tiempo las actividades Contesto correctamente Aprendió TOTAL Actividad Numero:2 Criterio de Evaluación Tema: Formulas de compuestos Firma del Cumplió Profesor SI NO Tomo en cuenta las instrucciones Identifica los conceptos Participo en clase Trabajo en Equipo Termino a tiempo las actividades Contesto correctamente Aprendió TOTAL Actividad Numero: 4 Criterio de Evaluación Tema: Tipos de reacciones Firma del Cumplió Profesor SI NO Tomo en cuenta las instrucciones Identifica los conceptos Participo en clase Trabajo en Equipo Termino a tiempo las actividades Contesto correctamente Aprendió TOTAL F-401-01-C