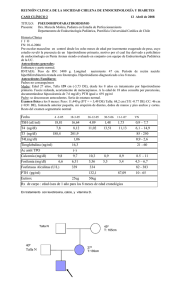
Volumen 2 - Número 4 - Asociación Colombiana de Endocrinología
Anuncio

ISSN 2389-9786 Revista colombiana Volumen 2, número 4, Noviembre de 2015 de Endocrinología Diabetes&Metabolismo www.endocrino.org.co Bogotá D.C., Colombia EN ESTA EDICIÓN La endocrinología y los médicos generales ¿Qué podemos esperar de las guías ATA 2014 en el manejo de cáncer temprano de tiroides? Visita al renaciente, antes casi olvidado, tejido graso pardo Valores de pruebas tiroideas (TSH y T4 libre) en una población adulta de la ciudad de Medellín, Colombia Pseudomalabsorción como causa de altos requerimientos de levotiroxina: Experiencia en el Hospital Universitario San Vicente Fundación Impacto de los hábitos sobre la mineralización ósea durante la etapa de la juventud Gigantes en la Historia Tormenta tiroidea: revisión de dos casos en el Hospital de San José, Bogotá Parestesia lingual: Un síntoma poco común de hipoglucemia Hipotiroidismo primario, déficit de vitamina B12 y tiroiditis subaguda sobre agregada: informe de caso Hipopituitarismo postraumático: Reporte de un caso Una publicación de la de Endocrinología Seguridad Cardiovascular Diabetes&Metabolismo Revista colombiana Volumen 2, número 4, noviembre de 2015 a largo plazo para sus pacientes 1,2 La Insulina Basal con estudio El Agonista de GLP-1 con estudio de riesgo cardiovascular de riesgo cardiovascular 1 Outcome Reduction with Initial Glargine Intervention Objetivo Primario: Muerte Cardiovascular, Infarto de Miocardio, evento cerebro-vascular, proceso de revascularización coronaria u hospitalización por falla cardiaca. El estudio ORIGIN se realizó en 12.537 participantes (de 40 países), con alto riesgo cardiovascular (CV), con ITG o AGA (12% de los participantes) o diabetes tipo 2 (DT2) tratados con ≤1 medicamento antidiabético oral, (OAD) [88% de los participantes] asignados al azar para recibir ya sea Lantus® (n = 6264) o tratamiento estándar (n=6.273), con un promedio de seguimiento de 6,2 años. Los principales criterios de valoración fueron: el compuesto de muerte cardiovascular o infarto de miocardio no mortal (IM) o infarto no mortal o procedimiento de revascularización u hospitalización por insuficiencia cardíaca. 2 Evaluation of LIXisenatide in Acute coronary syndrome Objetivo Primario: Muerte Cardiovascular, Infarto de Miocardio no fatal, evento cerebro-vascular no fatal, hospitalización por angina inestable. El estudio ELIXA se realizó en 6.068 participantes (de 49 paises). Fue un estudio clínico doble ciego, de grupos paralelos aleatorizado y controlado con placebo, multicéntrico de fase III para evaluar los efectos de lixisenatida añadido a la terapia estándar en DMT2 en morbilidad cardiovascular y mortalidad en pacientes con SCA reciente. El estudio fue diseñado para demostrar la seguridad CV de lixisenatida de acuerdo con la orientación de la FDA de 2008 para la evaluación de nuevas terapias para la diabetes. 1. Gerstein H, et al. Insulina basal y resultados clínicos cardiovasculares y de otro tipo en la disglucemia. The New England Journal of Medicine. 2012; 367: 319-328. 2 Revista de Endocrinología, Diabetescharacteristics y Metabolismoin Evaluation of LIXisenatide in Acute Coronary Syndrome, a long-term cardiovascular 2. Bentley-Lewis R,Colombiana et al. Rationale, design, and baseline end point trial of lixisenatide versus placebo. American Heart Journal 2015; 169: 631-638. Material dirigido al cuerpo médico. Información prescriptiva completa a disposición del cuerpo médico en la Dirección Médica de sanofi-aventis de Colombia S.A. Transversal 23 Nº 97-73 Edificio City Business-Piso 8. Bogotá D.C. Teléfono: 621 4400 - Fax: 744 4237. COLYX151001 Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Créditos Editor General Enrique Ardila Ardila, MD. (Bogotá, Colombia) Comité Editorial Luz Ángela Casas Figueroa, MD. (Cali, Colombia) Roberto Franco Vega, MD. (Bogotá, Colombia) Alfredo Federico Jácome Roca, MD. (Bogotá, Colombia) William Rojas García, MD. (Bogotá, Colombia) Comité Científico Consultor Ernesto Bernal-Mizrachi, MD. (Ann Arbor, Estados Unidos) Jorge Eduardo Caminos Pinzón, MSC. PhD. (Bogotá, Colombia) Marco Danon, MD. (Miami, Estados Unidos) Gustavo Duque Naranjo, MD. PhD. FRACP. (Sydney, Australia) Camilo Jiménez Vásquez, MD. (Houston, Estados Unidos) Guido Lastra González, MD. (Columbia, Estados Unidos) Fernando Lizcano Losada, MD. PhD. (Bogotá, Colombia) Carlos Olimpo Mendivil Anaya, MD. PhD. (Bogotá, Colombia) Andrés Julián Muñoz Muñoz, MD. (Ann Arbor, Estados Unidos) Alexia Peña Vargas, MD. PhD. FRACP. (Adelaide, Australia) Myriam Sánchez de Gómez, MSC. (Bogotá, Colombia) Índice Editorial La endocrinología y los médicos generales Enrique Ardila Artículo de Revisión ¿Qué podemos esperar de las guías ATA 2014 en el manejo de cáncer temprano de tiroides? Alvaro Sanabria Visita al renaciente, antes casi olvidado, tejido graso pardo Arturo Orrego Artículo Original Valores de pruebas tiroideas (TSH y T4 libre) en una población adulta de la ciudad de Medellín, Colombia Carlos Alfonso Builes Barrera Pseudomalabsorción como causa de altos requerimientos de levotiroxina: Experiencia en el Hospital Universitario San Vicente Fundación Carlos Alfonso Builes Barrera Coordinación Editorial Natalia Andrea Arcila Murcia [email protected] Impacto de los hábitos sobre la mineralización ósea durante la etapa de la juventud Junta Directiva 2015 – 2017 Historia de la Endocrinología Asociación Colombiana de Endocrinología, Diabetes y Metabolismo Presidente: Dr. Pedro Nel Rueda Plata, MD. (Bogotá, Colombia) Vicepresidente: Dr. John Jairo Duque Ossman, MD. (Armenia, Colombia). Secretaria: Dra. Amanda Páez Talero, MD. (Bogotá, Colombia) Fiscal Médico: Dr. William Rojas García, MD. (Bogotá, Colombia) Presidente Capítulo Bolívar Grande: Dr. Lácides Rafael Maza Villadiego, MD. (Cartagena, Colombia) Presidente Capítulo Caribe: Dr. Tulio Florentino Juárez Romero, MD. (Barranquilla, Colombia) Presidente Capítulo Central: Dr. Henry Tovar Cortés, MD. (Bogotá, Colombia) Presidente Capítulo Eje Cafetero: Dr. Humberto Ignacio Franco Betancur, MD. (Manizales, Colombia) Presidente Capítulo Noroccidente: Dr. José Luis Torres Grajales, MD. (Medellín, Colombia) Presidenta Capítulo Nororiente: Dra. Lina Patricia Pradilla Suárez, MD. (Bucaramanga, Colombia) Presidenta Capítulo Suroccidente: Dra. Katherine Restrepo Erazo, MD. (Cali, Colombia) Gigantes en la Historia Producción e impresión Producciones Científicas LTDA. Revisión médica: Dr. Carlos Eduardo Rodríguez L, MD. Diseño y diagramación: Óscar E. Agudelo, José V. Casallas Corrección de estilo: Nancy Farfán Barreto Comercialización: Marcela Martínez ([email protected]), Vannesa Flórez (vannesa.florez@produccionescientificas. com). Paola Orozco Santos William Rojas G Página del Residente Tormenta tiroidea: Revisión de dos casos en el hospital de San José Bogotá William Rojas et al. Casos Clínicos Parestesia lingual: Un síntoma poco común de hipoglucemia Alvaro Muriel Hipotiroidismo primario, déficit de vitamina B12 y tiroiditis subaguda sobre agregada: informe de caso Carlos Alfonso Builes Barrera Hipopituitarismo postraumático: reporte de un caso Carlos Alfonso Builes Barrera Recomendaciones a los Autores Revista Colombiana de Endocrinología, Diabetes y Metabolismo ÍNDICE DE MATERIAS Y AUTORES Volumen 2, números 1 al 4 del 2015 Congresos y Eventos Revista Colombiana de Endocrinología, Diabetes y Metabolismo 4 5 11 19 24 32 37 42 47 49 53 58 62 65 3 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Editorial La endocrinología y los médicos generales L os programas de posgrado en endocrinología en Colombia son relativamente recientes. El primero que se creó fue en la Universidad Nacional de Colombia en el año de 1982, seguido de otros en Bogotá en las universidades Javeriana, Militar, Rosario, FUCS, y los establecidos en Medellin en la Universidad de Antioquia, siendo el último el de la Pontificia Universidad Bolivariana. Además, se creó el de endocrinología pediátrica de la Universidad de Antioquia. Estos posgrados forman en general dos endocrinólogos por año. Antes de esa época, los que ejercíamos como endocrinólogos nos habíamos formado en escuelas fuera del país. El total de endocrinólogos que pertenecemos a nuestra asociación es de 146 miembros de número, que corresponden prácticamente al número total de endocrinólogos con formación académica en Colombia. Ejerciendo a lo largo del país, la mayoría estamos localizados en las grandes capitales como Bogotá, Medellín, Cali, Barranquilla, Cartagena, entre otras, con unos pocos en ciudades intermedias como Bucaramanga, Pereira, Ibagué, Pasto, Manizales, Cúcuta, Neiva y Villavicencio; pero existen poblaciones de cierta importancia en las cuales no hay endocrinólogos y los pacientes se ven obligados a ser tratados por otros especialistas o por médicos generales o a ser remitidos, con todo lo que eso implica, bajo el punto de vista médico, psicológico y económico. La consulta del especialista en endocrinología está centrada en orden de frecuencia en diabetes, obesidad y trastornos tiroideos, siendo el resto de las patologías en ocasiones raras y muchas veces podríamos decir hasta “exóticas”. Si consideramos que en Colombia el número de diabéticos puede llegar a más de cinco millones (no existen estudios epidemiológicos que abarquen todo el país, pero se considera por los que existen que el porcentaje podría llegar casi al 10% de nuestra población), pretender que con este número de especialistas se trate a esta población podría rayar en el delirio. La frecuencia de pacientes con diagnóstico de hipotiroidismo no la conocemos pero inferimos que podría ser muy similar o inclusive mayor. La oportunidad para que un paciente “logre” poder “agendar” una cita con un endocrinólogo puede requerir en ocasiones hasta más de un mes, además de que hay colegas que ya no reciben pacientes de primera vez. Entonces, ¿qué se podría hacer?, ¿admitir más médicos para realizar la especialidad?, ¿crear más programas de especialidad en endocrinología? O ¿capacitar a los médicos generales y a los internistas para manejar este tipo de patología? Esta última premisa a mi parecer podría ser la más lógica y realista. A la consulta del endocrinólogo llega un buen número de pacientes diabéticos o hipotiroideos que podrían ser manejados en forma racional y científica por el médico general (glucemias basales de no más de 150 mg y TSH menores de 10, para poner un ejemplo), siempre y cuando en las diferentes facultades formen a sus estudiantes en estos temas y, sobre todo, les enseñen hasta dónde pueden actuar y cuándo deberán remitir. Además, los casos de cierta complejidad podrían ser manejados perfectamente por el médico internista que tiene una formación de tres años de posgrado y remitir al endocrinólogo casos más complejos, sea en diabetes, tiroides, suprarrenales, hipófisis, etc. Estamos copando nuestra consulta de endocrinología con casos que podrían ser manejados perfectamente por otros colegas y les estamos quitando a nuestros pacientes complicados y difíciles la oportunidad de ser vistos por el endocrinólogo. El cambio deberá venir primero en mejorar la formación de pregrado en endocrinología. En algunas facultades se considera una rotación opcional y, por supuesto, hay muchos médicos que no han visto ni recibido formación en esta disciplina. El segundo punto importante es el de la atención, tenemos que hacer un llamado a las EPS para que racionalicen el envío de los pacientes al endocrinólogo, debería hacerse una especie de “triage” para determinar qué pacientes deberán visitar al endocrinólogo y, por último, educar a los pacientes para que aprendan cuándo deben pedir cita con el endocrinólogo. La labor no es sencilla y, por supuesto, necesitaría un tiempo para poder concientizar tanto a las universidades como a los colegas y a los pacientes. Quiero, por intermedio de esta columna, abrir un debate y una reflexión sobre el tema, en unión con las diferentes facultades de medicina, las EPS, las sociedades científicas, bajo el liderazgo de nuestra Asociación Colombiana de Endocrinología, Diabetes y Metabolismo, pero a la larga serán ustedes, todos los médicos, los que tendrán la última palabra. Espero sus comentarios, aportes y críticas a esta propuesta. Enrique Ardila Editor Revista Colombiana de Endocrinología, Diabetes y Metabolismo 4 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Artículo de Revisión ¿Qué podemos esperar de las guías ATA 2014 en el manejo de cáncer temprano de tiroides? Alvaro Sanabria MD, MSc, PhD, FACS 1; Alejandro Román-González MD 2 1 Cirujano de Cabeza y Cuello. Hospital Pablo Tobón Uribe. Profesor Asociado. Departamento de Cirugía. Facultad de Medicina. Universidad de Antioquia. Medellin, Colombia 2 Internista Hospital Universitario San Vicente Fundación. Residente de Endocrinología. Grupo Endocrinología y Metabolismo. Universidad de Antioquia. Medellin, Colombia Correspondencia: Alvaro Sanabria Correo electrónico: [email protected] Fecha de recepción: 18/09/2015 Fecha de aceptación: 28/09/2015 Resumen E l carcinoma papilar de tiroides es un tumor frecuente en mujeres y el número de casos nuevos viene en crecimiento. La mayoría de estos casos de novo son tumo- res menores de 2 centímetros. Parte de la responsabilidad de este aumento es explicable por un uso mayor de ayudas diagnósticas. Esto ha permitido detectar el cáncer de tiroides temprano o clínicamente silente. En esta población, el manejo ha sido típicamente agresivo, incluyendo cirugías extensas (ti- roidectomía total) seguidas por terapia con yodo radiactivo y supresión de TSH. Las próximas guías plantearán cuatro grandes modificaciones: 1. Estadificación dinámica del riesgo (res- puesta completa, respuesta bioquímica incompleta, respuesta estructural incompleta e indeterminada) 2. Disminución de las indicaciones y de la dosis de ablación con yodo radiactivo, específicamente el uso de esta terapia debe estar ajustado al riesgo basal de recurrencia (bajo, intermedio, alto) del pacien- te y debe tenerse en cuenta el número de ganglios linfáticos afectados, el tamaño de las metástasis ganglionares, la histo- logía y el tamaño del tumor. Una dosis de 30 mCi de 131yodo es igual de eficaz para negativizar la tiroglobulina que una dosis de 100 mCi. 3. Extensión de la cirugía (cirugía parcial en tumo- res menores de 4 cm con histología favorable) y 4. Terapia de supresión con levotiroxina con metas más laxas de TSH, dado el riesgo de osteoporosis y arritmias con una supresión exagerada de TSH, especialmente en la población de edad avanzada. Palabras clave: carcinoma de tiroides, yodo radiactivo, ti- roidectomía, TSH, levotiroxina. Abstract Papillary thyroid carcinoma is a frequent cancer in women. An increase in the number of new cases has been detected in the last years. However, tumors smaller than 2 cms represent the largest sample in those new detected cancers. The cause of this increment is partially responsibility of an increased use of diagnostic aids such as ultrasound, even in asymptomatic patients. The management of these clinically silent tumors has been quite aggressive with extensive surgery (total thyroidectomy) followed by radioactive iodine therapy and TSH suppression. The next papillary thyroid carcinoma guidelines will address 4 important modifications: 1. Dynamic approach to risk stratification (Complete response, incomplete biochemical response, incomplete structural response and indeterminate response) 2. Decrease in the indication and dose of radioactive iodine. The use of this therapy must be adjusted to the basal risk of recurrence with consideration of the number of lymph node metastases, the size of the lymph node metastases, the histopathologic variant and the size of the primary tumor. A dose of 30mCi of 131I is as effective as a dose of 100 mCi for thyroid ablation. 3. Extension of the thyroidectomy (partial surgery in tumors smaller than 4 cms without unfavorable histopathology and 4. Higher TSH goal with levothyroxine suppression therapy. A strict TSH suppression has been associated with increased risk of osteoporosis and cardiac arrhythmias, especially in older population Keywords: thyroid carcinoma, radioactive iodine, thyroidectomy, TSH, levothyroxine. Por qué hacerlo simple, cuando se puede hacer complicado. Proverbios Shadoks Desde hace algunos años, el cáncer de tiroides se ha convertido en el tumor de mayor incidencia en las mujeres(1). Utilizando la base de datos SEER, que recoge información de aproximadamente el 10% de todos los pacientes con cáncer en los Estados Unidos, Davis en 2014(2) demostró que desde 1995, el crecimiento de los casos nuevos de cáncer de tiroides viene aumentando de forma exponencial. De estos cánceres, los que tienen una mayor incidencia son los papilares, que son los de mejor pronóstico, mientras que los demás tipos histológicos, como folicular y anaplásico, permanecen con Revista Colombiana de Endocrinología, Diabetes y Metabolismo 5 Revista colombiana Volumen 2, número 4, noviembre de 2015 una incidencia estable. Además, los tumores que han tenido mayor aumento en la incidencia son los menores de 1 cm que son clínicamente indetectables, seguidos por los que miden entre 1 y 2 cm. Los tumores mayores de 2 cm, que se consideran clínicamente detectables, han tenido un leve aumento que no es comparable con el crecimiento de los primeros. Un análisis enfocado en los tamaños de los tumores demostró, además, que aquellos tumores menores de 5 mm de diámetro pasaron en una década de ser el 14% al 21% de todos los casos y los de 6-10 mm pasaron de 11% a 18% del total. Este crecimiento de los tumores de tamaños imposibles de detectar por los métodos clínicos tradicionales (“incidentalomas”), sólo puede explicarse por el aumento indiscriminado en el uso de la ultrasonografía diagnóstica(3). Sin embargo, a pesar del aumento de su detección y de su correspondiente tratamiento quirúrgico y con yodo radiactivo, no se ha podido demostrar un cambio en la mortalidad. Esto hace manifiesto que existe una explosión diagnóstica previa a la manifestación clínica de la enfermedad, lo que algunos han dado en llamar una “epidemia”. Este aumento en realidad puede considerarse una detección preclínica de una condición que aparece cuando métodos diagnósticos de alta resolución se hacen fácilmente asequibles, pero cuyo efecto positivo sobre los desenlaces importantes como mortalidad o recurrencia, no ha podido ser demostrada. Así, nos enfrentamos a una “epidemia” de cáncer de tiroides “temprano” clínicamente silente. Esta revisión pretende analizar el impacto que pueden tener el diagnóstico y tratamiento de estos tumores tempranos y la propuesta que desde la Asociación Americana de Tiroides (ATA, por sus siglas en inglés) viene siendo impulsada para modificar el paradigma actual de tratamiento. Como preámbulo, es necesario abordar la definición de cáncer temprano de tiroides. Se ha extrapolado la definición patológica de microcarcinoma (tumor que mide menos de 1 cm en su diámetro mayor) a la definición clínica y oncológica de cáncer temprano, que correspondería a tumores en etapas evolutivas con mínima invasión local y sin invasión ganglionar o a la estadificación de estadio I de la AJCC. Esta extrapolación no está exenta de dificultades. La definición de microcarcinoma expuesta por los patólogos durante muchos años corresponde en realidad a la medición del diámetro del tumor primario dentro de la tiroides y no se ocupa de las demás características histopatológicas y de comportamiento biológico de la enfermedad. Esto contradice el conocimiento actual en relación a que el factor más importante para determinar el curso futuro de un tumor es su comportamiento biológico (el cual hoy en día se busca en los marcadores genéticos y los productos proteínicos del tumor)(4). Así, un paciente puede tener un tumor tiroideo de 8 mm pero debutar clínicamente con una metástasis ganglionar de 2 cm en el compartimiento lateral del cuello, lo que permitiría definirlo como microcarcinoma pero que no correspondería a un tumor temprano, ya que la enfermedad se ha extendido por fuera de los límites del órgano de origen. Igualmente ocurriría 6 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo con un tumor del mismo tamaño, pero el cual demostró en el intraoperatorio su extensión local por fuera de los límites de la tiroides o se encontraron ganglios metastásicos con extensión extracapsular en el compartimiento central. Por el contrario, asumir que los tumores de más 1 cm corresponden a tumores avanzados, adolece de las mismas dificultades. Un tumor de 2 cm dentro de un bocio de 7 cm y sin ningún factor pronóstico adverso, debe considerarse temprano independientemente de su tamaño, afirmación que ha sido ampliamente demostrada en estudios clínicos cuando se ha evaluado su desenlace futuro(5). Un asunto particular que pone de manifiesto la debilidad de la definición anatómica (basada en el tamaño) de los tumores de tiroides, se refiere a la presencia de micrometástasis en el compartimiento central. Varios estudios han demostrado que tumores con diámetros hasta 1 cm pueden llegar a tener un 60% de micrometástasis ganglionares centrales que, sin embargo, no tienen impacto en la recurrencia o la supervivencia(6-9). ¿Si este tumor mide menos de 1 cm y tiene micrometástasis como debería clasificarse? ¿Sería avanzado en razón de unas metástasis sin importancia clínica? ¿O sería aún temprano basado en el mismo argumento? Los estudios que evalúan microcarcinomas casi nunca hacen estas salvedades y en muchos casos se crea un grupo heterogéneo donde más que el comportamiento biológico, el tamaño y sólo el tamaño determina lo avanzado del tumor, pero no se define con claridad cuántos de estos microcarcinomas son realmente tumores tempranos. En segundo lugar, es importante saber de dónde se originaron las conductas actuales en el manejo de los tumores tempranos de la tiroides, que se encuentran ampliamente difundidas en guías y recomendaciones(10). Inicialmente, se reconoce que el tratamiento del cáncer de tiroides se soporta en cuatro principios: la estadificación inicial de la enfermedad que define la estrategia terapéutica que se va a escoger; la resección quirúrgica de la enfermedad, incluyendo la glándula y los ganglios con metástasis en los casos necesarios; la ablación posoperatoria con yodo radiactivo y la supresión con hormona tiroidea. Desde mediados de la década de los ochenta, Ernst Mazzaferri(11,12), endocrinólogo de la Universidad de Ohio, logró convencer a la comunidad científica de que el manejo de todos los tumores de tiroides, independiente de su estadio, requería de dos intervenciones terapéuticas: la primera, una cirugía más extensa, contrario a la práctica habitual de la época de realizar tiroidectomías parciales(13,14) que, en términos quirúrgicos se llama tiroidectomía total y, la segunda, un complemento de la cirugía, que corresponde a la ablación con yodo radiactivo. Esto obedeció a la aparición de la tiroglobulina como marcador de la actividad de la enfermedad tiroidea maligna(15). En su momento, la consecución de una tiroglobulina negativa se convirtió en el objetivo último de los médicos que trataban el cáncer de tiroides y para poder alcanzarlo era necesario eliminar, a como diera lugar, todo rastro de tejido tiroideo, ya fuera por métodos quirúrgicos exclusivos o acompañados de una dosis elevada posoperatoria Revista colombiana de Endocrinología Diabetes&Metabolismo de yodo radiactivo. Simultáneamente, a unos pocos kilómetros de distancia, Ian Hay(14,16,17), endocrinólogo de la Clínica Mayo en Minnesota, demostraba que los tumores tempranos tratados con tiroidectomías parciales y sin aplicación rutinaria de yodo radiactivo tenían similar pronóstico a los reportados por Mazzaferri, pero con una menor intervención médica, con menos riesgos para los pacientes y con menores costos para el sistema de salud. Desafortunadamente, en su momento, los resultados de los estudios de Mazzaferri fueron más fácilmente aceptados por la comunidad médica en razón a la “cancerofobia” que merodeaba por los corredores de los hospitales y las facultades de medicina (de los cuales hay ejemplos palpables como el del cáncer de mama o de próstata), a costa de unos resultados mucho más alentadores y menos agresivos propuestos por Hay. Hoy en día es fácil reconocer importantes fallas metodológicas de los estudios originales de Mazzaferri. Finalmente, la idea equivocada que se ha tenido en la lucha contra el cáncer de “más es mejor” era ampliamente aceptada en esta época, a pesar de que la historia demuestra lo equivocados que solemos estar cuando aplicamos esta máxima. No obstante, en los últimos años, ha sido Michael Tuttle, endocrinólogo del Memorial Sloan Kettering Cancer Center, en Nueva York, el que ha liderado una revaluación de los criterios actuales de manejo, tendiendo a disminuir las intervenciones exageradas que hoy se practican sin mayor evidencia de su efectividad(18-22). Este movimiento es el que ha dado lugar a las recomendaciones próximas de la ATA, sobre las cuales se han ofrecido algunos avances en los congresos relacionados. Se esperan por tanto cuatro grandes modificaciones: 1. Estadificación dinámica del riesgo Como se esbozó antes, tradicionalmente la determinación del estadio y, por tanto, del riesgo de los pacientes con cáncer de tiroides se ha centrado en la mortalidad a cinco años, asumiendo como en los demás tumores, que el pronóstico del paciente depende del estadio inicial con el cual consulta por primera vez. Sobre este paradigma han surgido varias informaciones que permiten determinar que en primer caso la mortalidad es un desenlace menos relevante que en otros tumores y que el estadio inicial no necesariamente es el mejor predictor pronóstico. Las clasificaciones surgidas en los años 80 como AMES, AGES, MACIS, MSKCC, TNM (que consideraban el tamaño del tumor, la presencia de metástasis regionales y/o a distancia, la extensión por fuera del órgano, la edad, el grado tumoral, etc.) centraban su predicción en el factor mortalidad(14,23-35). Sin embargo, los estudios con seguimientos a largo plazo han demostrado que la mortalidad en la mayoría de los tumores tempranos no supera el 3-5% y que el desenlace más importante para un paciente con cáncer de tiroides es la recurrencia, la cual no se consideró en el diseño de estos índices. La razón para considerar la recurrencia como el verdadero desenlace centrado en el paciente, es que las intervenciones Volumen 2, número 4, noviembre de 2015 propuestas para su control pueden derivar en complicaciones, eventos adversos y secuelas a largo plazo como disfonía severa, traqueostomía, hipoparatiroidismo definitivo, lesión de nervio espinal, fístulas linfáticas además del componente estético y funcional de las múltiples cirugías en el cuello con limitación de su movilidad y las asociadas a la carga emocional que se relaciona con cada nueva recurrencia. La propuesta actual esta englobada en el término “estadificación dinámica” y se enfoca preferencialmente en el riesgo de recurrencia de la enfermedad, además que da a entender que el estadio inicial con el que se presenta el paciente puede ser modificado con las intervenciones médicas que se realicen para tratarlo y que sólo el seguimiento puede establecer con certeza la evolución de la enfermedad(26). Desde las guías de 2009, este concepto ya se había sugerido, promoviendo la estadificación de los pacientes en bajo, mediano y alto riesgo de recurrencia. Los pacientes de bajo riesgo serían aquellos con tumores menores de 1 cm de diámetro sin compromiso extracapsular, de histología favorable y sin evidencia clínica de metástasis ganglionares y en quienes se hubiera practicado una resección completa de la lesión. Estos tendrían una frecuencia de recurrencia menor a 3%. Por el contrario, los pacientes de alto riesgo corresponderían a pacientes en los extremos de la edad con tumores mayores de 4 cm, con invasión extracapsular e histología desfavorable (variantes agresivas, invasión linfovascular) y con evidencia clínica de metástasis ganglionares. Estos pacientes tendrían una frecuencia de recurrencia superior al 60%. Finalmente, los demás pacientes que no pueden ser ubicados en alguno de estos extremos quedarían clasificados como riesgo intermedio con una recurrencia esperada del 16%(10). El primer cambio se centra en el tamaño. Se espera que las nuevas guías disminuyan la fuerza que se le da al tamaño y relajen este criterio, considerando como bajo riesgo incluso los tumores de menos de 4 cm que cumplan las demás condiciones de la categoría de bajo riesgo. El segundo cambio, y que parece ser el más significativo en el manejo del cáncer de tiroides en las últimas décadas, se refiere a dejar de considerar el riesgo de recurrencia como un fenómeno fijo y convertirlo en un estadio de transición, donde el tratamiento recibido y el seguimiento pueden ofrecer modificaciones y determinar el consecuente escalamiento o desescalamiento del tratamiento. Así, además de definir el riesgo inicial del paciente, se debe considerar la respuesta que el paciente ha tenido al tratamiento en cada visita y ésta debe categorizarse en excelente respuesta-remisión, respuesta bioquímica incompleta, respuesta estructural incompleta y respuesta indeterminada. La respuesta completa implica una ausencia de actividad bioquímica (tiroglobulina negativa) y estructural (ecografía cervical sin evidencia de enfermedad) de la enfermedad, que representa un riesgo de recurrencia cercano al 3% y permite el desescalamiento en el uso de las intervenciones posoperaRevista Colombiana de Endocrinología, Diabetes y Metabolismo 7 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo torias (ablación con yodo radiactivo) y de Tabla 1. Propuesta de manejo según la estadificación dinámica del riesgo seguimiento (rastreos anuales, exámenes paraclínicos cada tres meses, etc.). Las Bioquímica Estructural Indeterminada Excelente nuevas guías desestimularán el uso de la incompleta incompleta tiroglobulina anual liberada/estimulada Tg suprimida 12 meses 6 meses 6 meses 6-12 meses y exámenes de imágenes como la tomoCada 2-3 años No es Puede reclasificar grafía, resonancia e incluso el PET-CT. Tg estimulada No es necesaria si la TG<0,6 necesaria al paciente La respuesta bioquímica incompleta, que corresponde a la recurrencia 6-12 meses Ecografía 3-5 años 1-5 años 1-5 años bioquímica o “tiroglobulinitis” de antaño, por 5 años implica el seguimiento más cercano pero TSH 0,3-2 mU/L <0,1 mU/L <0,1 mU/L <0,1 mU/L incluso se reconoce que el tiempo puede negativizar los niveles de tiroglobulina hasta en una cuarta parte de los pacientes y que sólo una sexta Además, la nueva propuesta devuelve al comportamiento parte de estos pacientes evolucionarán a una enfermedad esbiológico del tumor su importancia real y alivia la carga que tructural que requiere tratamiento específico sea quirúrgico recae sobre el médico y el sistema de salud, asumiendo que ino con yodo. Esto también contribuye al desescalamiento teracluso la detección y tratamiento precoz de tumores agresivos, péutico para estos pacientes que suelen ser bombardeados con no es una garantía de curación y que aun cumpliendo con todosis de yodo radiactivo “a ciegas”, buscando negativizar los dos los estándares conocidos de seguimiento y disponiendo de niveles de tiroglobulina sin ningún impacto en la frecuencia de todos los recursos, el destino de la enfermedad es desconocido recurrencia de la enfermedad o la realización de exámenes seen muchos casos (tabla 1). mestrales de tiroglobulina liberada, con los efectos conocidos en la calidad de vida derivados del hipotiroidismo inducido. 2. Disminución de las indicaciones y de la dosis de ablaLa respuesta estructural incompleta que se corresción con yodo radiactivo ponde con la persistencia o recurrencia tumoral propiamenComo se mencionó previamente, la indicación actual de te dicha, corresponde a hallazgos imaginológicos o clínicos ablación en tumores tempranos de tiroides está relacionada de enfermedad activa que pueden o no corresponderse con la necesidad de negativizar los niveles de tiroglobulina. con elevaciones de la tiroglobulina. Estos pacientes sufren Desde las guías de 2009(10) también se había propuesto que el en realidad de una enfermedad activa y requieren todo el uso de la ablación se restringiera para los pacientes que realarmamentario terapéutico disponible, incluyendo nuevas mente obtuvieran un beneficio de la terapia. En el caso de los reintervenciones quirúrgicas, dosis repetidas de yodo ratumores tempranos, la sugerencia era clara en contraindicar el diactivo e incluso las nuevas terapias blanco para su adeuso de ablación para tumores intratiroideos menores de 1 cm y cuado control. clasificados N0 (esto significa vaciamiento central sin ganglios Finalmente, la categoría indeterminada termina recibienmetastásicos) o Nx (aquellos a quienes no se les realiza vaciado a todos los pacientes que no pueden ubicarse en alguna de miento central y no tienen evidencia clínica de compromiso las categorías anteriores y que pueden pasar a tener evidencia ganglionar) y usarlo para pacientes con hallazgos histológicos clínica de actividad tumoral hasta en una quinta parte, pero adversos cuando el tumor estaba entre 1 y 4 cm. Pero ha sido donde la mayoría disminuyen de categoría o permanecen inMartin Schlumberger, médico nucleólogo del Instituto Gustav definidamente en esta categoría sin que se logre identificar un Roussy, quien ha producido las modificaciones más importanfoco activo de tumor. tes en este aspecto en los últimos años(27,28). La publicación Así las cosas, un paciente que debuta con un tumor de bajo del ensayo francés dirigido por él(28) y las del ensayo británico riesgo (entiéndase temprano en todo el sentido de la palabra) dirigido por Ujjal Mallick(29), donde se buscaba evaluar la efecy en el seguimiento demuestra una respuesta completa, es tividad de la TSH recombinante humana, mostró con claridad altamente improbable que presente una recurrencia o mueque al momento de la ablación 23-59% de los pacientes con ra de la enfermedad, ayudando a los médicos, a los pacientes tumores tempranos tenían valores de tiroglobulina menores y a los sistemas a mantener la sana prudencia y evitar el uso de 2 ng/ml, demostrando que en estos pacientes la ablación indiscriminado de exámenes paraclínicos y la ansiedad que no tendría ningún efecto clínico importante. De otro lado, los se produce en cada control. Por otro lado, puede ofrecer un dos ensayos demostraron que cuando la ablación es necesaria, panorama esperanzador para los pacientes que consultan con dosis menores (30 mci) son igualmente efectivas para obtener tumores de alto riesgo y que muestran respuesta completa en el seguimiento, pues disminuyen de algún modo la insistencia una negativización de la tiroglobulina, lo que se traduce en la en buscar enfermedad en donde no la hay. posibilidad de realizar ablaciones en condiciones ambulato8 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Revista colombiana de Endocrinología Diabetes&Metabolismo rias sin riesgo para la sociedad, con mayor comodidad para el paciente que no requiere las condiciones de aislamiento necesarias cuando se usan dosis más altas y en un uso racional de las ya escasas unidades de aislamiento para terapia con yodo radiactivo disponibles en el mundo(30). Se espera entonces que las guías mantengan las recomendaciones de 2009 y las extiendan a los pacientes con tumores de hasta 4 cm e incluso que sugieran el uso restringido en pacientes clasificados como de riesgo intermedio y consideren su uso sólo para casos de ganglios centrales positivos pero con invasión extracapsular. 3. Extensión de la cirugía Actualmente, la cirugía mínima en el manejo del cáncer temprano de tiroides es la tiroidectomía total, y las guías 2009 sólo consideraban como candidatos a hemitiroidectomía los tumores menores de 1 cm clasificados como de bajo riesgo(10). Esta recomendación era en realidad difícil de seguir, dado que es imposible determinar preoperatoriamente si la histología era favorable o no y si el tumor era realmente unifocal. Además, para aquellos casos que se operaban con una BACAF indeterminada o que en el posoperatorio de una cirugía aparentemente benigna se descubría un tumor de más de 1 cm, aun con histología favorable, la recomendación era practicar una tiroidectomía de complementación. Además, se recomendaba el uso de vaciamiento ganglionar central de carácter profiláctico en casos de tumores T3/4 pero ciertas escuelas incluso lo recomiendan de forma rutinaria. Con la aparición y redescubrimiento de los estudios que demuestran que la hemitiroidectomía es suficiente cirugía para un tumor de bajo riesgo(13,14,17,31-33), las nuevas guías ampliarán la recomendación de cirugía parcial a tumores menores de 4 cm con histología favorable, lo que de alguna manera también se traducirá en menos tiroidectomías de complementación. Como la indicación de yodo quedó limitada a metástasis ganglionares macroscópicamente evidentes con extensión extracapsular, es probable que las indicaciones de vaciamiento central profiláctico dejen de ser consideradas. Algunas posturas en contra de este manejo conservador argumentan que los tumores pequeños pueden presentarse con compromiso metastásico al diagnóstico o durante su evolución, lo que justificaría más intervenciones tempranas. Como bien se expone al principio, estos pacientes que debutan con enfermedad metastásica no tienen tumores tempranos en el sentido estricto de la definición, pero muchos médicos pueden sugerir que en la práctica clínica el diagnóstico preoperatorio es difícil, debido a que las características histológicas adversas que aparecen en la patología definitiva posoperatoria cambiarían el riesgo, haciendo necesaria, una nueva intervención para completar la tiroidectomía. Los estudios que evaluaron la presencia de carcinoma en el lóbulo contralateral después de tiroidectomía de complementación para todos los casos de cáncer de tiroides y donde no se con- Volumen 2, número 4, noviembre de 2015 sideraba la presencia de histología adversa como indicación, muestran que menos del 30% de los especímenes tienen carcinoma, por lo que se espera que la indicación de reoperación sea aún menor con las nuevas recomendaciones(34-36). Las series con hemitiroidectomía han demostrado que el pronóstico en cuanto a recurrencia y mortalidad es idéntico, lo que no hace justificable continuar reoperando de rutina 70-80% de pacientes sanos. Finalmente, hacer cirugías menos extensas no implica una restricción en el juicio que como clínicos hacemos con el paciente, pero que sí evitará en muchos casos complicaciones innecesarias para él. Terapia de supresión de TSH. El objetivo de la supresión es disminuir al mínimo la TSH, evitando así el estímulo que esta hormona trófica pueda tener sobre las potenciales células tumorales que no hayan sido retiradas por la cirugía o destruidas por el yodo(37,38). Las guías de 2009(10) sugerían la supresión en pacientes de riesgo bajo a niveles de TSH entre 0,1 y 0,5. Como resultado de todas las razones anteriormente expuestas relacionadas con la baja frecuencia de recurrencia de los tumores de bajo riesgo tratados exclusivamente con cirugía, las nuevas recomendaciones han suavizado los niveles de supresión de TSH, poniendo como tope el límite inferior del valor normal de TSH. Esto además se soporta en los efectos adversos relacionados con una dosis suprafisiológica de tiroxina durante un largo plazo (osteoporosis y cardiopatía)(39-40). Conclusiones Estamos viviendo una época de cambios. Estos cambios suelen ser imperceptibles en la mayoría de las intervenciones médicas actuales y pocas veces se ven cambios de paradigma tan drásticos como los que se espera ocurran en el tratamiento del cáncer temprano de tiroides. Las nuevas guías rescatan conocimientos que se tenían y redescubren otros como los relacionados con la extensión de la cirugía pero aportan información nueva sobre temas que hasta el día de hoy eran considerados dogmas, como los relacionados con la propuesta de estadiamiento dinámico. La rápida adopción de las recomendaciones seguramente ha de redundar en la calidad de vida de los pacientes que podrán llevar la carga que implica el diagnóstico con más tranquilidad y seguridad, en la conducta de los médicos que dejaremos de perseguir fantasmas y de angustiar los pacientes y angustiarnos nosotros mismos ante las recurrencias inevitables y en la viabilidad de los sistemas de salud, que recibirán el alivio necesario al poner a la “epidemia” de cáncer de tiroides en sus justas proporciones. Sólo falta al final que nuestra función pedagógica con los pacientes y con nosotros mismos se haga de manera juiciosa y que los sesgos cognitivos, tan ampliamente discutidos en la literatura psicológica(41,42), no impidan llevar a la práctica lo que la evidencia viene demostrando de manera tan firme. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 9 Revista colombiana Volumen 2, número 4, noviembre de 2015 Referencias 1. Kweon SS, Shin MH, Chung IJ, Kim YJ, Choi JS. Thyroid cancer is the most common cancer in women, based on the data from population-based cancer registries, South Korea. Japanese journal of clinical oncology. Oct 2013;43(10):1039-1046. 2. Davies L, Welch HG. Current thyroid cancer trends in the United States. JAMA otolaryngology-- head & neck surgery. Apr 2014;140(4):317-322. 3. Ezzat S, Sarti DA, Cain DR, Braunstein GD. Thyroid incidentalomas. Prevalence by palpation and ultrasonography. Archives of internal medicine. Aug 22 1994;154(16):1838-1840. 4. Riesco-Eizaguirre G, Santisteban P. New insights in thyroid follicular cell biology and its impact in thyroid cancer therapy. Endocrine-related cancer. Dec 2007;14(4):957-977. 5. Mehanna H, Al-Maqbili T, Carter B, et al. Differences in the recurrence and mortality outcomes rates of incidental and nonincidental papillary thyroid microcarcinoma: a systematic review and meta-analysis of 21 329 personyears of follow-up. The Journal of clinical endocrinology and metabolism. Aug 2014;99(8):2834-2843. 6. Roh JL, Kim JM, Park CI. Central cervical nodal metastasis from papillary thyroid microcarcinoma: pattern and factors predictive of nodal metastasis. Annals of surgical oncology. Sep 2008;15(9):2482-2486. 7. Shindo M, Wu JC, Park EE, Tanzella F. The importance of central compartment elective lymph node excision in the staging and treatment of papillary thyroid cancer. Archives of otolaryngology--head & neck surgery. Jun 2006;132(6):650-654. 8. So YK, Son YI, Hong SD, et al. Subclinical lymph node metastasis in papillary thyroid microcarcinoma: a study of 551 resections. Surgery. Sep 2010;148(3):526-531. 9. Wada N, Duh QY, Sugino K, et al. Lymph node metastasis from 259 papillary thyroid microcarcinomas: frequency, pattern of occurrence and recurrence, and optimal strategy for neck dissection. Annals of surgery. Mar 2003;237(3):399-407. 10. American Thyroid Association Guidelines Taskforce on Thyroid N, Differentiated Thyroid C, Cooper DS, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid : official journal of the American Thyroid Association. Nov 2009;19(11):1167-1214. 11. Mazzaferri EL, Young RL. Papillary thyroid carcinoma: a 10 year follow-up report of the impact of therapy in 576 patients. The American journal of medicine. Mar 1981;70(3):511-518. 12. Mazzaferri EL, Young RL, Oertel JE, Kemmerer WT, Page CP. Papillary thyroid carcinoma: the impact of therapy in 576 patients. Medicine. May 1977;56(3):171-196. 13. Farrar WB, Cooperman M, James AG. Surgical management of papillary and follicular carcinoma of the thyroid. Annals of surgery. Dec 1980;192(6):701704. 14. Hay ID, Grant CS, Taylor WF, McConahey WM. Ipsilateral lobectomy versus bilateral lobar resection in papillary thyroid carcinoma: a retrospective analysis of surgical outcome using a novel prognostic scoring system. Surgery. Dec 1987;102(6):1088-1095. 15. Shlossberg AH, Jacobson JC, Ibbertson HK. Serum thyroglobulin in the diagnosis and management of thyroid carcinoma. Clinical endocrinology. Jan 1979;10(1):17-27. 16. Hay ID, Grant CS, van Heerden JA, Goellner JR, Ebersold JR, Bergstralh EJ. Papillary thyroid microcarcinoma: a study of 535 cases observed in a 50year period. Surgery. Dec 1992;112(6):1139-1146; discussion 1146-1137. 17. Hay ID, Grant CS, Bergstralh EJ, Thompson GB, van Heerden JA, Goellner JR. Unilateral total lobectomy: is it sufficient surgical treatment for patients with AMES low-risk papillary thyroid carcinoma? Surgery. Dec 1998;124(6):958-964; discussion 964-956. 18. Tuttle RM, Leboeuf R, Martorella AJ. Papillary thyroid cancer: monitoring and therapy. Endocrinology and metabolism clinics of North America. Sep 2007;36(3):753-778, vii. 19. Vaisman F, Tala H, Grewal R, Tuttle RM. In differentiated thyroid cancer, an incomplete structural response to therapy is associated with significantly worse clinical outcomes than only an incomplete thyroglobulin response. Thyroid : official journal of the American Thyroid Association. Dec 2011;21(12):1317-1322. 20. Ibrahimpasic T, Nixon IJ, Palmer FL, et al. Undetectable thyroglobulin after total thyroidectomy in patients with low- and intermediate-risk papillary thyroid cancer--is there a need for radioactive iodine therapy? Surgery. Dec 2012;152(6):1096-1105. 21. Nixon IJ, Ganly I, Patel SG, et al. The results of selective use of radioactive iodine on survival and on recurrence in the management of papillary thyroid cancer, based on Memorial Sloan-Kettering Cancer Center risk group stratification. Thyroid : official journal of the American Thyroid Association. Jun 2013;23(6):683-694. 10 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo 22. Ghossein R, Ganly I, Biagini A, Robenshtok E, Rivera M, Tuttle RM. Prognostic factors in papillary microcarcinoma with emphasis on histologic subtyping: a clinicopathologic study of 148 cases. Thyroid : official journal of the American Thyroid Association. Feb 2014;24(2):245-253. 23. Cady B. Hayes Martin Lecture. Our AMES is true: how an old concept still hits the mark: or, risk group assignment points the arrow to rational therapy selection in differentiated thyroid cancer. American journal of surgery. Nov 1997;174(5):462-468. 24. Hay ID, Bergstralh EJ, Goellner JR, Ebersold JR, Grant CS. Predicting outcome in papillary thyroid carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients surgically treated at one institution during 1940 through 1989. Surgery. Dec 1993;114(6):1050-1057; discussion 1057-1058. 25. Shah JP, Loree TR, Dharker D, Strong EW, Begg C, Vlamis V. Prognostic factors in differentiated carcinoma of the thyroid gland. American journal of surgery. Dec 1992;164(6):658-661. 26. Tuttle RM, Tala H, Shah J, et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new American Thyroid Association staging system. Thyroid : official journal of the American Thyroid Association. Dec 2010;20(12):1341-1349. 27. Schlumberger M, Borget I, Nascimento C, Brassard M, Leboulleux S. Treatment and follow-up of low-risk patients with thyroid cancer. Nature reviews. Endocrinology. Oct 2011;7(10):625-628. 28. Schlumberger M, Catargi B, Borget I, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. The New England journal of medicine. May 3 2012;366(18):1663-1673. 29. Mallick U, Harmer C, Yap B, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. The New England journal of medicine. May 3 2012;366(18):1674-1685. 30. Remy H, Coulot J, Borget I, et al. Thyroid cancer patients treated with 131I: radiation dose to relatives after discharge from the hospital. Thyroid : official journal of the American Thyroid Association. Jan 2012;22(1):59-63. 31. Christensen SB, Ljungberg O, Tibblin S. Surgical treatment of thyroid carcinoma in a defined population: 1960 to 1977. Evaluation of the results after a conservative surgical approach. American journal of surgery. Sep 1983;146(3):349-354. 32. Wanebo H, Coburn M, Teates D, Cole B. Total thyroidectomy does not enhance disease control or survival even in high-risk patients with differentiated thyroid cancer. Annals of surgery. Jun 1998;227(6):912-921. 33. Haigh PI, Urbach DR, Rotstein LE. Extent of thyroidectomy is not a major determinant of survival in low- or high-risk papillary thyroid cancer. Annals of surgical oncology. Jan 2005;12(1):81-89. 34. Lefevre JH, Tresallet C, Leenhardt L, Jublanc C, Chigot JP, Menegaux F. Reoperative surgery for thyroid disease. Langenbeck’s archives of surgery / Deutsche Gesellschaft fur Chirurgie. Nov 2007;392(6):685-691. 35. Alzahrani AS, Al Mandil M, Chaudhary MA, Ahmed M, Mohammed GE. Frequency and predictive factors of malignancy in residual thyroid tissue and cervical lymph nodes after partial thyroidectomy for differentiated thyroid cancer. Surgery. Apr 2002;131(4):443-449. 36. Pacini F, Elisei R, Capezzone M, et al. Contralateral papillary thyroid cancer is frequent at completion thyroidectomy with no difference in low- and high-risk patients. Thyroid : official journal of the American Thyroid Association. Sep 2001;11(9):877-881. 37. Cooper DS, Specker B, Ho M, et al. Thyrotropin suppression and disease progression in patients with differentiated thyroid cancer: results from the National Thyroid Cancer Treatment Cooperative Registry. Thyroid : official journal of the American Thyroid Association. Sep 1998;8(9):737-744. 38. Pujol P, Daures JP, Nsakala N, Baldet L, Bringer J, Jaffiol C. Degree of thyrotropin suppression as a prognostic determinant in differentiated thyroid cancer. The Journal of clinical endocrinology and metabolism. Dec 1996;81(12):4318-4323. 39. Klein Hesselink EN, Klein Hesselink MS, de Bock GH, et al. Long-term cardiovascular mortality in patients with differentiated thyroid carcinoma: an observational study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Nov 10 2013;31(32):4046-4053. 40. Wang LY, Smith AW, Palmer FL, et al. Thyrotropin Suppression Increases the Risk of Osteoporosis Without Decreasing Recurrence in ATA Low- and Intermediate-Risk Patients with Differentiated Thyroid Carcinoma. Thyroid : official journal of the American Thyroid Association. Nov 11 2014. 41. Roswarski TE, Murray MD. Supervision of students may protect academic physicians from cognitive bias: a study of decision making and multiple treatment alternatives in medicine. Medical decision making : an international journal of the Society for Medical Decision Making. Mar-Apr 2006;26(2):154-161. 42. Fandel TM, Pfnur M, Schafer SC, et al. Do we truly see what we think we see? The role of cognitive bias in pathological interpretation. The Journal of pathology. Oct 2008;216(2):193-200. Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Artículo de Revisión Visita al renaciente, antes casi olvidado, tejido graso pardo Arturo Orrego M, MD. Médico Internista Endocrinólogo, Miembro Honorario de la Asociación Colombiana de Endocrinología, Diabetes y Metabolismo. Fecha de recepción: 05/02/2015 Fecha de aceptación: 23/09/2015 E l tejido adiposo juega un papel central en la nutrición, el balance energético y la salud en los humanos. Existen dos tipos de tejido adiposo: el blanco (TAB) y el pardo (TAP). El TAB conserva la energía, mientras que el TAP la utiliza. El exceso de nutrición y la inactividad física dan origen a un incremento del TAB y a la obesidad. En cambio el TAP es termogénico, debido a una proteína única desacopladora (UCP1). Esta proteína localizada en la parte interna de la membrana mitocondrial desacopla la respiración mitocondrial, produciendo tanto energía como calor. Esta propiedad esencial protege a los animales de la hipotermia(1). La creencia tradicional de que el TAP sólo existe en infantes y no en adultos retrasó la investigación en humanos. Pero el descubrimiento de que la grasa del adulto presentaba una alta actividad metabólica como lo demostraba la tomografía por emisión de positrones (TEP) hizo que los investigadores se interesaran nuevamente en el TAP y que se reiniciara la investigación sobre este tejido, su identificación, la prevalencia, regulación, localización, abundancia y su importancia en el humano(2-9). 1. Abreviaturas utilizadas: RA, receptores adrenérgicos ; TAP, tejido adiposo pardo; IMC, índice de masa corporal; C/EBP,CCAAT, activadores de proteína unidoras; TIF, termogénesis inducida por el frio; TC, tomografía computarizada; TID, termogénesis inducida por dieta; EU, energía utilizada; 18 FDG, 18 Fluordeoxyglucosa; FGF21, factor 21 de crecimiento de los fibroblastos; TIR termografía infrarroja; RM, resonancia magnética; TEP, tomografía por emisión de positrones; PGC- 1α, PPAR-γ coactivadora 1α; PPAR-γ, receptor proliferador activado peroxisome gamma; PRMD16, PRD1-BF-RiZ1 dominios homólogos que contienen proteínas-16; SNS, sistema nervioso simpático; HT, hormonas tiroideas; UCP1, proteínas no acopladas 1; TAB tejido adiposo blanco. A pesar de que en 1551, Gessner identificó la grasa parda en animales que hibernaban, sólo en 1960 se inició la era dorada de la investigación de esta grasa(10-18) que alcanzó su máximo éxito después de la década de los 80, cuando se obtuvo la evidencia inequívoca de que el TAP aún existía en adultos, lo que desbordó el interés en la investigación sobre este tejido graso. Lee y colaboradores detallaron las investigaciones más importantes realizadas y sus resultados en humanos sobre el TAP, desde 1902(19). En 1960 se descubrió que el TAP era regulador de la termogénesis(13-18). Se propuso que el TAP era un tejido productor de calor en animales y en infantes humanos, capaz de defender a los recién nacidos de la hipotermia. El TAP es histológica y funcionalmente distinto al TAB, y la presencia de un transportador facultativo de protones UCP1 en este último tejido le confiere la habilidad única de generar calor a través del desacoplamiento respiratorio(20). Heaton encontró que el TAP persistía hasta la octava década de la vida. Estos hallazgos sugirieron la hipótesis que la falta del TAP podría contribuir a la presentación de la obesidad en el adulto(21-25), lo que originó un incremento de tres veces más publicaciones sobre este tejido adiposo, entre 1980 y 1982. Durante este periodo temprano, la investigación sobre el TAP se limitó a examinar depósitos de grasa alrededor de la adrenal, una localización accesible durante la cirugía electiva abdominal. Este acercamiento menospreció el TAP extrabdominal, olvidando la abundancia y frecuencia en adultos de esta grasa en estas regiones. Hasta este momento no existía un consenso para soportar un papel definitivo de la grasa parda en la homeostasis de la energía en adultos(26,27), lo que llevó a Rothwell y Stock a dudar de la existencia de la grasa parda en humanos(28). Se reconoció que había serias dificultades para identificar depósitos del TAP en humanos y que la controversia continuaría hasta que se descubrieran métodos no invasivos para cuantificar esta grasa y estar en capacidad de calcular la capacidad termogénica de estos tejidos(26,28). Se necesitaron dos décadas más para que aparecieran los instrumentos no invasivos para detectar y cuantificar el TAP como la tomografía de emisión de positrones (TEP)(29), método que hizo renacer el entusiasmo en la investigación metabólica del TAP(29). Revista Colombiana de Endocrinología, Diabetes y Metabolismo 11 Revista colombiana Volumen 2, número 4, noviembre de 2015 Características de ambos tejidos grasos La célula adiposa blanca se caracteriza por su apariencia redonda con una sola vacuola de grasa que desplaza el núcleo hacia la periferia. En cambio, la célula de grasa parda se identifica por su forma poligonal, de tamaño menor, un núcleo central y numerosas vacuolas de grasa, pequeñas, dando apariencia de ser multiloculares, presentan una alta densidad de mitocondrias, comparable a la de los cardiomiocitos. En cambio, en las células grasas blancas, las mitocondrias existen en menos cantidad. El TAP es abundante en vasos y nervios y con una rica suplencia de células mesenquimales perivasculares que son la fuente de los preadipocitos. La abundancia de mitocondrias que contienen enzimas de la cadena de los citocromos compuestos de hierro como cofactor, aunado a la rica vascularización son la causa del color rojo oscuro (pardo), típico del TAP que contrasta con el color pálido del TAB. Origen Debido a que ambos tejidos grasos el TAB y el TAP se caracterizan por la presencia de vacuolas de lípidos, se ha creído que ambos tejidos grasos tienen un origen común. Con estudios en roedores se ha demostrado que el TAB y el TAP se originan en células madres mesenquimatosas, las cuales pueden diferenciarse en adipocitos, osteoblastos, condrocitos y mioblastos(30). La diferenciación de las células grasas, pardas y blancas, comienza con la adipogénesis, un proceso que culmina con la acumulación intracelular de lípidos, controlado por varios factores, entre los cuales, PPAR-γ es el más crítico, factor esencial para la adipogénesis de ambos tejidos grasos, el TAB y el TAP. Tanto las células adiposas adultas, las blancas y las pardas expresan altos niveles de PPAR-γ(31,32). Aunque se han identificado muchos activadores y represores de la adipogénesis, la mayoría modulan la expresión de la actividad del PPAR-γ(33,34). Aislados de los depósitos de células pardas y blancas, los precursores de los fibroblastos se diferencian en adipocitos pardos o blancos, respectivamente, en la ausencia de sustancias inductoras(35). En humanos, tal diferenciación espontánea no ocurre sin inducción con agentes adipocinéticos como la dexametasona (figura 1). posición al frío y por los agentes beta adrenérgicos(37). Existen evidencias recientes de que PGC-1α es un factor clave en la regulación de la adipogénesis de las células pardas(38,39). Origen de las células pardas Aunque PGC-1α juega un papel central en la formación de las células pardas, su ablación no produce la reducción de la masa de estas células, lo que sugiere que existen otros factores que son indispensables en la diferenciación de las células pardas. Se ha sugerido durante muchos años que los adipocitos pardos y blancos son derivados de una célula madre común. Sin embargo, evidencias recientes demostraron que ambas células se originan en precursores diferentes(40). Últimamente existe evidencia de que los adipocitos pardos se originan en una célula madre tripotente que da origen a la dermis, los adipocitos pardos y el músculo esquelético(19). Consistente con este hallazgo, los adipocitos pardos de la región interescapular y el tejido muscular expresaron Mγf5, gen que se ha asumido se expresa únicamente en los precursores de las células musculares(19). Los adipocitos pardos están presentes en los músculos esqueléticos de roedores y humanos(40) (figura 1). Tabla 1. Hallazgos metabólicos del TAP, en humanos adultos Autor (ref) Año n Hallazgos metabólicos Magnitud Virtanen(5) 2009 5 Captación de glucosa por el TAP estimulado con frío 12,2 µmol/100/min 13 Deficiencias en la energía utilizada con la exposición al frío en individuos con TAP+ y negativo + 368 Kcal/d Con la exposición al frío hubo Incremento en la captación de glucosa por el TAP + 8,0 µmol/100 g Diferencia en la energía utilizada Con exposición al frío en individuos TAP positivos y negativos + 286 kcal/d Captación de la glucosa por el TAP estimulado por el frío 10,8 µmol/min Diferencias en la energía utilizada por el TAP expuesto al frío y en ambiente cálido + 2001 Kcal/d Yoneshiro(19) Orava(19) 2011 2011 27 Adipogénesis de las células pardas PPAR-γ y el coativador-1α (PGC-1α) son los reguladores más importantes de la biogénesis mitocondrial. Los niveles de PGC-1α en los adipocitos pardos están ampliamente en relación con la producción de energía(36). En humanos, el ARN mensajero de PGC-1α se expresa de 2 a 15 veces más frecuentemente en las células pardas que en los adipocitos blancos (tabla 1). PGC-1α no solamente está aumentando en el TAP sino que decide la riqueza del TAP dentro del TAB. Aunque la expresión de PGC-1α es baja en el TAB puede ser estimulado por la ex12 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo Quellet(19) 6 Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Adipocitos brite Evidencia creciente ha demostrado que los adipocitos pardos tienen diferentes orígenes. Esta evidencia deriva de los estudios que informaron de la adipogénesis parda dentro de los adipocitos blancos. Los adipocitos pardos encontrados dentro el TAB se conocen como brite (brown-in-white)(19) o adipocitos beige(19). En humanos, las células madres (stem cell) pluripotentes y los agonistas PPAR-γ activaron un programa de grasa parda(19). En, los adipocitos blancos de humanos la expresión PGC-1α mediada por adenovirus aumentó la presencia de UCP1(19). Los preadipocitos obtenidos por biopsia de la grasa supraclavicular humana y cultivados muestran abundancia de expresión de UCP1 durante la adipogénesis parda(19). Estos adipocitos diferenciados pueden exhibir una sola vacuola de grasa rodeada por varias vacuolas más pequeñas o estar repleta de vacuolas de grasa multilobuladas, como se aprecia en las células clásicas pardas(19) (figura 1). Figura 1. Origen de los tejidos adiposo blanco, beige/brite y pardo. Las “células madre” mesenquinales son multipotentes que dan origen a diferentes tipos de adipocitos, además a condrocitos, osteoblastos y miocitos; las células que expresan Mγf5, considerado antes como marcador miogénico, pueden diferenciarse para producir adipocitos pardos o miocitos. Alternativamente las células privadas del marcador Mγf5 pueden dar origen a adipocitos blancos o beige/brite. Las etapas finales en la diferenciación de los tres tipos de adipocitos están controladas por una serie de factores de transcripción que incluyen PPARy y C/EBPα,-β y δ. Los adipocitos pardos también son enriquecidos por el factor coactivador de transcripción PGC1-α, que dirige la expresión de moléculas claves regulatorias en la biogénesis mitocondrial, en respuesta a estímulos externos tales como la exposición al frío. Así PPAR- γ y PGC-1α parecen jugar un papel importante en la adición de componentes de la grasa parda a las células adiposas blancas humanas. El estudio de la aclimatización de roedores en temperaturas frías no mostró variaciones en la cantidad de células adiposas, ni del ADN, lo que sugiere una directa trasformación (trasdiferenciación) de las células adiposas blancas a pardas(19). No está claro si todo el tejido adiposo blanco tiene el potencial de trasformación en tejido adiposo pardo. Se encontró que el UCP1 se expresaba solamente en la grasa parda de los depósitos situados en las regiones interescapulares, cervical, axial y mediastinal, sitios clásicos de localización del TAP(19). Se cree que este hallazgo está en relación con el sistema nervioso simpático, canal aferente de la exposición al frío; el incremento de las células adiposas brite también se manifestó después de la administración crónica de agonistas beta(19). Los adipocitos pardos están presentes en los músculos de roedores y humanos. Las células multipotentes, que expresaron en las superficies marcadores CD34, aisladas de músculos esqueléticos humanos, se diferenciaron en adipocitos pardos(19). Preguntas no resueltas Se ha propuesto que el TAP es más parecido durante su desarrollo al músculo esquelético que el TAB. Los adipocitos pardos clásicos expresan más Mγf5, en cambio los adipocitos blancos y los brite, no. Este tópico es más difícil de contestar, ya que existen evidencias que sugieren que los adipocitos pardos y brite pueden originarse en células hematopoyéticas dentro de la médula ósea y que es posible encontrar el marcador Mγf5 en el TAB(19). Fisiología de los adipocitos pardos Células madre Mesenquimatosas Osteoblastos Condrocitos Precursores de los adipocitos blancos Mγf5 Grasa parda/precursores del músculo esquelético Preadipocitos blancos Preadipocitos Beige-Brite Preadipocitos pardos Mioblasto Adipocitos blancos Adipocitos Beige-Brite Adipocitos pardos Miocito Localización Los mayores depósitos de adipocitos pardos, en roedores, están localizados en la región interescapular. Otros depósitos están situados cerca a los vasos, en la región cervical, axilar y paravertebral y en la proximidad de las vísceras torácicas y abdominales. En contraste, los adipocitos pardos del humano están localizados en la nuca, tórax, abdomen y yuxtapuestos a las vísceras profundas (corazón, pulmones, riñones, adrenales e intestinos) y a lo largo de los grandes vasos (carótidas, aorta, pulmonar y mesentéricos) (figura 2). A pesar de la evidencia de que en humanos el TAP cervical, paravertebral, paraórtico, perirrenal y periadrenal existía durante toda la vida, la ausencia del TAP interescapular con la edad hizo suponer que el TAP desaparecía en la edad adulta(19). Imaginogía por TEP La tomografía por la emisión de positrones (TEP) fue introducida en los años 80. La TEP, unida a la TAC (tomografía axial computarizada), localizaron los depósitos de tejido adiRevista Colombiana de Endocrinología, Diabetes y Metabolismo 13 Revista colombiana Volumen 2, número 4, noviembre de 2015 Figura 2. TAP en humanos, distribución del TAP revelado por TEP y por histología Dx por histología y PET 8 1 Dx sólo por histología 2 3 4 5 6" 9 7 1. 2. 3. 4. 5. Cervical Supraclavicular Paravertebral Axial Mediastinal 10 6. 7. 8. 9. 10. Pericárdico Perirrenal / adrenal Traqueoesofágico Intercostal Mesenterio poso pardo en mayor proporción en las zonas supraclaviculares y mediastinales en humanos(2,3). Depósitos más pequeños se encontraron en la axila, epicardio, en regiones paravertebral, perirrenal y periadrenal(25). Ciertas zonas positivas para adipocitos pardos son detectables por biopsia, pero no por la TEP, intercostales, tráquea, esófago y mesentéricas. Se sugiere que las regiones no detectadas por la TEP, pero sí por biopsia son fisiológicamente inactivas(19). Avidez de la grasa parda La evidencia de que la grasa que capta el 18 fluordeoxiglucosa (18FDG) es TAP la confirma la histología y los estudios moleculares de genes responsables del desacoplamiento respiratorio celular (UCP1) por un incremento de la actividad de la deyodasa (DIO2), y por una mayor inervación adrenérgica(3-5,7). Por diferentes estudios en humanos, que no detallamos, se comprobó la presencia mixta de TAP, TAB y posiblemente grasa brite en ciertos depósitos evaluados(19). La prevalencia de la grasa parda en humanos puede ser estudiada indirectamente por TEP-TAC o por análisis histológico de los depósitos de grasa. Algunos estudios han demostrado que el diagnóstico convencional de adipocitos pardos mediante TEP-TAC tiene una reproducibilidad subóptima, por lo cual la evaluación de la prevalencia basada en un solo TEP-TAC puede llevar a conclusiones falsas(19). Más recientemente, entre 2.934 pacientes estudiados con TEP-TAC para detectar grasa parda(3), se encontraron 250 pacientes con TAP, dando una aparente prevalencia de 8,5%. Entre los pacientes con TAP, 145 fueron escaneados más de una vez. En estos pacientes, mientras más gammagrafías con TEPTAC se obtenían, mayores eran los casos positivos, 8% para 2 gammagrafías y 65% para 4. En otras palabras, únicamente 1 14 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo de cada 8 pacientes con TAP tendrá una gammagrafía positiva si es estudiado una vez más. Esta probabilidad da origen a una prevalencia del 64%, 8 veces más alta que la previamente publicada basada en estudios únicos en cohortes similares(3). El análisis anterior subestima la insensibilidad del TEPTAC convencional y sugiere dos preguntas 1) ¿Cuáles factores determinan la positividad del TEP-TAC? 2) ¿Puede existir TAP en individuos negativos?. La primera pregunta ha sido contestada indirectamente con la TEP, previa estimulación con el frío, la última pregunta se ha tratado de resolver con la biopsia del tejido graso negativo con TEP. TEP estimulado con el frío La exposición a temperaturas entre 16°C y 19°C a individuos durante 1 a 2 horas convierte la TEP en positiva entre el 34% y el 96%(7, 6, 18,19), positividad que disminuye significativamente con la edad(19) (tabla 1). Aunque la exposición al frío durante cierta temperatura sensibiliza la TEP-TAC para la detección del tejido adiposo pardo, dicha combinación es incapaz de determinar la verdadera prevalencia de este tejido adiposo. Esto es debido a que a esta técnica le falta sensibilidad o especificidad para discriminar el TAP de otros tejidos metabólicamente activos. Únicamente un examen directo de la grasa puede definir la duda. Examen tisular Dos estudios han definido la prevalencia de tejido adiposo pardo utilizando la biopsia mediante cirugía(4,6). La localización de los depósitos de grasa influenciará los resultados, debido a que la grasa parda se distribuye en áreas anatómicas específicas(4,6). Zingaretti y colegas(6) hallaron que el 33% de las muestras fueron positivas para tejido adiposo pardo, obtenidas de la grasa peritiroidea. La región supraclavicular es donde más frecuentemente se encuentra tejido adiposo pardo(4). Hubo una enorme variabilidad biológica en la abundancia de TAP entre los individuos. La TEP-TAC fue positiva únicamente en 3 de 17 pacientes y se encontraron ocasionalmente pacientes positivos para TAP, a pesar de gammagrafía negativa(4). La exposición al frío convierte más del 80% de las TEP-TAC negativas a positivas, en presencia de grasa parda. Debido a que la existencia de TAP es 20 veces más frecuente en la TEP positiva que en la negativa, es probable que la exposición al frío estimule la actividad de la grasa parda, pero es improbable que se deba a hiperplasia del TAP en tan corto tiempo de exposición(4,19). De acuerdo con la reproducibilidad de los estudios gamagráficos, el hecho de que los pacientes puedan ser TEP positivo como negativos para TAP tan rápidamente, bajo ciertas condiciones ambientales, sugiere que deben existir otros factores reguladores distintos, diferentes al frío, capaces de cambiar el estado metabólico de la grasa parda(4,19). Revista colombiana de Endocrinología Diabetes&Metabolismo Factores reguladores Exposición al frío Estudios en animales demostraron que la exposición al frío aumenta agudamente la actividad de la grasa parda(4,19), mientras que la exposición crónica produce hiperplasia de este tejido adiposo(19). La exposición al frío también induce trasformaciones morfológicas en el TAB. Unos autores(19) identificaron la presencia de UCP1 inmunorreactiva propia de los adipocitos pardos después de la aclimatación al frío. Estos adipocitos pardos, en ausencia del incremento del número de adipocitos blancos, hizo pensar a los investigadores que estaban observando la trasformación de adipocitos blancos a pardos(19). En la práctica se ha utilizado la exposición al frío para tratar de activar metabólicamente los adipocitos pardos y hacerlos más sensibles a la detección con la TEP-TAC. Los métodos consisten en mantener los pacientes durante1 o 2 horas a temperaturas de 16 a 20 °C, antes de la inyección de la 18-fluordeoxiglucosa, después de lo cual los individuos se mantienen una hora adicional en el cuarto frío, antes de hacer la gammagrafía. Estos protocolos en ambiente frío aumentan hasta un 100% la detección del tejido adiposo pardo y la captación de la 18-fluordeoxiglucosa hasta 15 veces(5, 7,19). En cambio, la gammagrafía con este isótopo a temperatura ambiente disminuye significativamente la detección del tejido graso pardo(19). Otros protocolos, para descender la temperatura en el paciente utilizan la inmersión del individuo en agua fría o con contacto de las manos y pies con bloques de hielo, con resultados casi similares al enfriamiento del medio ambiente; como es de esperar, la identificación del tejido adiposo pardo es mayor durante el invierno(2,19) pero no siempre(3,19). En dos estudios con observaciones longitudinales realizados en los mismos individuos durante el verano y el invierno se sacó la conclusión de que la temperatura relacionada con las estaciones ejerce un efecto importante en la actividad de los adipocitos pardos(19). Sistema nervioso simpático El sistema nervioso simpático aumenta la actividad del TAP. El frío incrementa la actividad del simpático, aumentando la noradrenalina circulante dos veces(19). El TAP está densamente inervado por el simpático. El grado de termogénesis es controlado por vías iniciadas en el hipotálamo, el cual coordina la información termorreguladora e integra la respuesta reguladora del calor. Se ha hipotetizado que circuitos neurales en el hipotálamo controlan la producción de calor, regulando la actividad simpática en el tejido adiposo pardo(19). Estudios recientes con neuroimágenes en humanos mostraron que los individuos con el TAP activado mostraban la región parietal derecha inferior (que gobierna la sensación de frío), hiperactiva; en cambio la ínsula izquierda (relacionada con el simpático) y el cerebelo derecho, que gobierna las funciones autonómicas, estaban hipometabólicos(19) (tablas 1 y 2). Volumen 2, número 4, noviembre de 2015 Tabla 2. Moléculas y agentes conocidos que Estimulan el Tejido Adiposo Blanco y el Tejido Adiposo Pardo Aumenta el tejido blanco y el pardo • FG,F21 • El péptido cardíaco natriurético Tbx15 • Péptidos similares al glucagón (GLP), PRDM16 Aumentan sólo la masa del TAB • Proteína morfogenética 7 del hueso • Miostatina • Twist-1 Únicamente aumenta la grasa blanca • Inrisina • Factor neurotrópico derivado del cerebro • Cicloxigenasa-2 • VEGF-A • Sirt • Dbc 1 Aumentan sólo la actividad de la grasa blanca • Proteína morfogenética del hueso 8B Abreviaciones: Sirt, sirtuina 1, Tbx15,T-box proteína 15, VEGF,factor de crecimiento endotelial vascular. Sistema beta adrenérgico La noradrenalina estimula la proliferación y la diferenciación de los adipocitos pardos en roedores. La administración crónica de noradrenalina aumenta la celularidad y la masa total(19); al mismo tiempo aumenta la expresión de UCP1(19). Los receptores beta adrenérgicos son tres diferentes: b1, b2, b3. Los b1 y los b3 regulan la proliferación y la diferenciación de los adipocitos pardos, mientras los receptores b2 situados en los vasos, median el flujo vascular del TAP(19). En los humanos, el papel de los receptores adrenérgicos no se ha estudiado extensamente, pero algunas investigaciones sugieren que los receptores b1 y b2 pueden regular la actividad de los adipocitos pardos en humanos(18,19). En síntesis, los diferentes subtipos de receptores adrenérgicos parecen tener papeles en común, sobrepuestos sobre el TAP y permanece sin definir si la proliferación, la diferenciación y la activación son dependientes de ciertos subtipos de receptores específicos(19). Catecolaminas La noradrenalina tiene un efecto poderoso sobre el TAP, en adición a su efecto local como neurotransmisor. En los pacientes con feocromocitoma aperados, en la grasa periadrenal se detectó abundante tejido adiposo pardo, en comparación con controles sanos(19). El TEP con FDG, antes positivo, desapareció después de cirugía exitosa del feocromocitoma(19). Hormonas tiroideas Las hormonas tiroideas regulan el TAP por vía endocrina y paracrina. Este tejido y los preadipocitos expresan altos niveles de DIO2, que convierten la T4 en la activa T3. La T3 aumenRevista Colombiana de Endocrinología, Diabetes y Metabolismo 15 Revista colombiana Volumen 2, número 4, noviembre de 2015 ta la expresión de la UCP1 y el consumo de oxígeno en cultivo primario y en cultivo de preadipocitos derivados de células madres multipotentes(19). En vivo la administración periférica de hormonas tiroideas es menos clara, por lo que se necesitan más estudios. Hasta el momento no se han publicado estudios que aclaren el papel jugado por las hormonas tiroideas sobre los adipocitos pardos. Esteroides sexuales En humanos, varias series han informado una mayor prevalencia de TAP en mujeres que en hombres(2,3). La diferencia por sexo puede deberse a mayor sensibilidad de la mujer al frío y a una mayor capacidad de la mujer de activar los adipocitos pardos; se duda de esta explicación(19) y se deben hacer estudios más profundos(19). Nutrición En humanos, la relación entre el TAP y la nutrición es confusa(19), existe alguna evidencia que sugiere la relación del TAP con la ingestión alimenticia, pero se necesitan más estudios en humanos para definir esta relación(19). Otros factores endocrinos Recientemente, se identificaron el factor de crecimiento de los fibroblastos 21 (FGF21) y la irisina, dos hormonas que modulan la composición del TAP y del TAB. La administración farmacológica de estas dos hormonas regula la expresión genética del TAP en el TAB. El resultado de la adquisición de componentes de la grasa parda en la grasa blanca (TAB) aumenta el consumo de energía y activa la pérdida de peso en roedores(19). Se sugirió la importancia de estas hormonas en humanos porque en un estudio reciente se demostró incremento de la secreción del FGF21, después de la exposición al frío en algunos voluntarios(19). El FGF21 es una adipocina, secretada por el tejido adiposo pardo, mediada por la exposición al frío, lo cual identifica al TAP como un órgano endocrino(19). Importancia metabólica del TAP en humanos Los hallazgos recientes de que la grasa parda se encuentra en la gran mayoría de los humanos, si no en todos, sustenta el papel metabólico invaluable del TAP en la vida adulta(4,7) (tabla 2). La significación metabólica del TAP puede deberse a su contribución a la pérdida de energía, determinante del balance energético(19). TAP en relación con la adiposidad En humanos se ha evaluado la relación entre el peso corporal y la presencia del TAP en varios trabajos retrospectivos 16 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo realizados con TEP. En estos estudios hubo una relación negativa entre la actividad de TAP y el índice de masa corporal(2,3,19). El índice de masa corporal fue en promedio 2 a 3 kg/m2 más bajo en los TAP positivos que en los negativos. En un estudio, 162 individuos sanos, TAP positivo, con edades entre los 2 y 73 años presentaron un índice de masa corporal, una grasa total, y una grasa abdominal más bajas, comparadas con aquellos con TAP negativos(19). En un estudio longitudinal de 145 pacientes, con tumores malignos; el peso corporal fue aproximadamente de 3 Kg menor en los pacientes con TAP positivo. La diferencia en peso no se relacionó con el estado de malignidad. Otras experiencias han repetido estos resultados(3,4,6). No se conoce si la actividad del TAP es un efecto o causa de la pérdida de peso. Se sugiere que las obesidades mayores podrían actuar como protección térmica, reduciendo así la necesidad de la termogénesis producida por el TAP, por lo tanto se disminuiría la actividad de esta grasa. Existe evidencia de que la deprivación alimenticia aumenta la actividad del TAP(36). TAP y la salud humana La inducción de la actividad del TAP en un ambiente frío puede tener implicaciones predecibles en la salud humana. La dependencia del balance nutritivo de la temperatura sugiere que la actividad termogénica del TAP es mayor en ambientes fríos que en calientes. El cambio de un ambiente frío a un termoneutral se ha calculado que puede llevar a un aumento anual hasta 4 kg de peso(19). La evidencia del impacto del ambiente térmico sobre el peso corporal viene indirectamente de un estudio en roedores(19). Estos animales se situaron en un ambiente a 22°C, menor a la temperatura de 30°C a la que están acostumbrados, en un ambiente confortable. En estas condiciones, la actividad simpática aumentó con el fin de defender a estos roedores de la hipotermia. Se activó el metabolismo en respuesta a las condiciones subtérmicas ambientales. Después de un mes de convivir en este ambiente la grasa blanca adquirió algunas características de la grasa parda, lo que produjo la pérdida de un 70% de la masa adiposa, independiente de la actividad física y la dieta. En el humano, para desgracia, es imposible repetir estas condiciones experimentables, ya que la raza humana moderna, excepcionalmente está expuesta continuamente a un ambiente por debajo de la termoneutralidad(19). Dentro de las casas, la temperatura ha aumentado un 10%, en algunos países, en los últimos 40 años, temperatura cercana a la termoneutralidad(19). A esta temperatura ambiental, en menos del 10% de los pacientes a quienes se les practica un TEP se detecta grasa parda. La civilización actual con las comodidades que las rodean raramente está expuesta a temperaturas frías durante largos períodos. Revista colombiana de Endocrinología Diabetes&Metabolismo Posibilidades futuras El uso del TEP-TAC para estudiar la grasa parda en humanos es costoso y expone a la radiación. La irradiación combinada de TEP-TAC estándar excede las guías aceptadas de seguridad en voluntarios normales. Las gammagrafías TEP-TAC para estudios prolongados están restringidas para personas normales. Además porque la interpretación de las TEP-TAC es difícil de definir, ya que las imágenes obtenidas con esta técnica radiológica no diferencian el volumen de la activación de la grasa parda. Serían deseables métodos que fueran capaces de diferenciar el volumen y la actividad metabólica separadamente. Resonancia magnética Existen estudios que demuestran la posibilidad de obtener imágenes del volumen, la distribución y la actividad metabólica de la grasa parda en estados de reposo y en funcionamiento con imaginología obtenida con la resonancia magnética. La validación de este método podría aportar en humanos importantes datos sobre el estudio del adipocito pardo y su actividad(19). Se necesita mayor estudio del TAP con este método. Imágenes térmicas El principio de las imágenes térmicas está basado en que el adipocito pardo es capaz de producir calor en la piel que cubre el tejido, por encima del obtenido en las zonas circundantes. Los dispositivos actuales para obtener imágenes térmicas son muy sensibles, capaces de captar diferencias de temperatura de 0,1 °C. La experiencia en humanos con esta termografía ha sido alentadora(19). Se necesita mayor investigación al respecto. Estimuladores de la masa del TAP Se espera en un futuro que los conocimientos obtenidos sobre el TAP y su poder termogenético puedan utilizarse en beneficios terapéuticos, especialmente en los pacientes obesos, para lo cual se necesitarían estímulos apropiados para aumentar la masa y la actividad de los adipocitos pardos, lo cual se podría obtener incrementando el desacoplamiento respiratorio, la fundamental y única acción del TAP. A este respecto, el reclutamiento del adipocito brite dentro de los adipocitos blanco (TAB) sería una estrategia factible. Con este fin se han ensayado diferentes métodos con resultados desiguales. Se ha sugerido que la activación de los agonistas beta adrenérgicos podría estimular la proliferación Volumen 2, número 4, noviembre de 2015 o activación de los adipocitos pardos, tales como la efedrina o el isoproterenol(19). Estas dos drogas, con la exposición al frío, aumentaron el consumo de energía, pero no se presentaron efectos sobre la actividad de la grasa parda, como lo demostraron las imágenes negativas con el TEP-TAC. Sin mediar el mecanismo, es improbable que la terapia adrenérgica pueda activar el TAP en la misma proporción que la exposición al frío. Al mismo tiempo, las dosis altas que se necesitan en humanos para obtener una imagen adecuada del TAP, presentan aumento de la presión arterial basal(19), lo que limita su utilización como ayuda diagnóstica del TAP. Como experimental se ha encontrado de utilidad para activar indirectamente el adipocito pardo una proteína ósea 8B y los compuestos capsinoides que aumentan discretamente el gasto de energía en pacientes con presencia de adipocitos pardos(19). Grasa parda Estudios en animales sugieren que las células brite tiene un potencial completo para desarrollarse en adipocitos pardos maduros. En el momento actual se conoce poco sobre el mecanismo de la conversión de la grasa blanca a parda. Entre los factores probables de esta trasformación en humanos están el FGF21 y la irisina, ya que actúan como hormonas y por la posibilidad potencial de ser producidas por el método del ADN recombinante. Si se comprueban estos hallazgos en humanos se abrirían serias posibilidades como terapia en ciertas condiciones como la obesidad(19). Conclusiones Contrario a lo que se creía hasta ahora, la grasa parda está presente en el humano adulto y juega un papel regulador en el metabolismo energético. La comprensión parcial de la contribución del TAP en la termogénesis y su capacidad de ser inducida in vitro ha abierto la posibilidad de iniciar la investigación con proyectos bien dirigidos en la terapia de la obesidad. La clasificación tradicional de los adipocitos, en blancos y pardos es una excesiva simplificación. Dentro del adipocito blanco se han identificado características histológicas y funcionales del adipocito pardo. La adipogénesis no solamente se refiere a un depósito específico sino a unas células específicas dentro de un depósito. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 17 Revista colombiana Volumen 2, número 4, noviembre de 2015 Referencias 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 18 Cannon B, Nedergaard J, Brown adipose tissue: function and physiological significance. Physio Rev. 2004;84:277-359. Cypess AM, Lehman S, Williams G, et al. Identification and importance of brown adipose tissue in adult humans. N Engl J Med. 2009; 360:1059-1517. Lee P, Greenfield JR, Ho KK, et al. A critical appraisal of the prevalence and metabolic significance of brown adipose tissue in adults humans. Am Physiol Endocrinol Metab. 200;299: E601- E 606. Lee P, Zhas JT, Swarbrick MM, et al. High prevalence of brown adipose tissue in adults humans. J Clin En Endocrinol Metab. 2011;96:2450-2455. Virtaner KA, Lindell ME, Orava J, et al. Functional brown adipose tissue in healthy adults. N Engl J MEd. 2009:360:1518-1525. Zingaretti Mc, Crosta F,Vitali A, et al. The presence of UCP1 demostrates that active adipose tissue in the neck of adult humans truly represents brown adipose tissue. Faseb. 2009; 23: 3113-3120. vanMarker Lichtenbelt WD, Vanhommerig JW,Smulders NM, et al. Cold activated brown adipose in healthy men. N Engl J Med. 2009;360: 1500-1508. Bouillaud F, Villarroya F, Hentz E, et al. Detection of brown adipose tissue uncoupling protein mRNA in adults patients by a human genomic prole. Clin Sci(Lond) 1988; 75: 21-27. Bouillaud F, Combes- George M, Ricquier D. Mitondria of adult human brown adipose tissue contains a 32.00.Mr uncoupling protein. Biosci Rep. 1983; 3: 775-780. Hatai S. On the presence in human embroys of an interscapular gland corresponding to the so- called hibernating gland in the lower animals. Anatomischer Anzeiger. 1902; xxi: 369. Bonnot E. The Interscapular gland. J Anat Physiol. 1908; 43:43-58. Rasmussen A. The glandular status of brown multilocular adipose tissue. Endocrinology. 1922;6:760-770. Smith RE, Hock RJ. Brown fat : thermogenic effector of arousal in hibernators. Science. 1963; 140: 199-200. Dawkins MJ, Scopes JW. Non_ shiverning thermogenesis and brown adipose tissue in the human new- born infant. Nature. 1965;206:201-202. Dawkins MJ, Hull D. Brown adipose tissue and the response of new-born rabbits to cold. J Physiol. 1964; 172:216-238. Hull D. Th estructure and function of brown adipose tissue. Br Med Bull. 1966; 22: 92- 96. Aherne W, Hull D. Brown adipose tissue and heat production in the newborn infant. J Pathol Bacteriol. 1966;91:223-234. Silverman WA;Zamelis A, Sinclair JC, et al. Warm nap of the newborn. Pediatrics. 1964;33:984-987. Lee p, Swarbrick MM, Ken K Y. HO. Brown adipose tissue in adults humans: A metabolic renaissance. Endocrine Review. 2013;34:413-438. Smalley RL, Dryer RL. Brown fat : thermogenic effect during arousal from hibernation in the bat. Science. 1963;140:1333-1334. Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo 21. Heaton JM. The distribution of brown adipose tissue in the human. J Anat. 1972;122:35-39. 22. Himms- Hagen J. Obesity may be due to a malfunctioning of brown fat. Can Med Assoc J. 1979; 121: 1361-1364. 23. Do the lucky ones burn off their dietary excess? Lancet 1979;2: 115-116. 24. Elliot J. Blame It all on brown fat now. JAMA. 1980; 243: 1983-1985. 25. Lindley M. Nutrition and metabolism. Nature. 1980; 287:579-580. 26. Rothwell Nj, Stock MJ. Brown adipose tissue: does it play a role in the development of obesity? Diabetes Metab Rev. 1988;4: 595- 601. 27. Astrup A, Bulow J. Christensen NJ, et al. Ephedrine- induced thermogenesis in man: no role for interscapular brown adipose tissue. Clin Sci (Lond). 1984; 66: 179-186. 28. Himms-Hagen J. Brown adipose tissue thermogenesis and obesity. Prog Lipid Res. 1989; 28: 67-115. 29. Ravussin E, Kozak LP. Have we entered the brown adipose tissue renaissence? Obese Rev. 2009;10: 265-268. 30. Gesta S, Tseng YH, Kahn CR.Developmental origen of fat: tracking obesity to its source. Cell. 2007;131:242-256. 31. Rousseau V, Becker DJ, Ongemba LN, et al. Developmental and nutritional changes of ob and PPARγ 2 gene expressions in rat white adipose peroxisone tissue. Biochem J. 1997;321:451-456. 32. Braissant O, Wahli W. Differential expression of peroxisome proliferator activated receptor-α,-β and -γ during rat embrionic development. Endocrinology. 1998;139:2748-2754. 33. Hansen JB, Kristiansen K. Regulatory circuits controling White versus brown adipocyte differentiation. Biochem J. 2006; 398; 153- 168. 34. Rosen ED. MacDougald OA. Adipocyte differentiation from the inside out. Nat Rev Moll Cell Biol. 2006;7:885-896. 35. Néchad M, Kuusela P, Carneheim C, et al. Development of brown fat cells in monolayer culture. Morphological and biochemical distinction from White fat cells in culture. Exp Cell Res. 1983;149:105-118. 36. Hu E, Tontonoz P, Spiegelman BM. Transdifferentiation of mioblast by the adipogenic transcription factors PPARγ and C/EBPα. Proc Natl Acad Sci U S A.1995;92:9856-9860. 37. Puigserver P, Wu Z, Park CW, et al. A cold imducible coactivador of nuclear receptors linked to adaptive thermogenesis. Cell. 1998;92:829-839. 38.Kleiner S, Mepani RJ,Laznik D, et al. Development of insulin resistance in mice lacking PGC-1α in adipose tissue. Proc Natl Acad Sci USA. 2012;109:9635-9640. 39. Pardo R,Enguix N, Lasheras J, et al. Rosiglitazone- induced mitocondrial biogenesis in White adipose is independent of peroxisome proliferator- activated receptor γ coactivator-1α. PLoS One. 2011;6: e 269 89. 40. Seale P, Kajimura S, Spiegelman BM. Transcriptional control of brown adipocyte development and physiological function: of mice and men.Genes Dev.2009;23:788-797. Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Artículo Original Valores de pruebas tiroideas (TSH y T4 libre) en una población adulta de la ciudad de Medellín, Colombia Carlos Alfonso Builes-Barrera1, Joanna Milena Márquez-Fernández2, Rosa María Gómez Baena3, Magda Liliana Cárdenas Gómez4 Endocrinólogo de Adultos Hospital Universitario San Vicente Fundación. Docente en la Sección de Endocrinología y Metabolismo Universidad de Antioquia. Medellín, Colombia. Asesor Científico: Sección de Endocrinología, Laboratorio Dinámica IPS. 2 Residente de Endocrinología y Metabolismo y Especialista en Medicina Interna Universidad de Antioquia. 3 Asesora Técnica Laboratorio Dinámica IPS. 4 Bacterióloga. Jefe de Laboratorio Clínico Regional. Dinámica IPS. Correspondencia: Carlos Alfonso Builes Barrera [email protected] Fuentes de financiación y conflicto de intereses Todos los datos se obtuvieron del laboratorio Dinámica IPS, no se recibió apoyo financiero de terceros. Fecha de recepción: 18/09/2015 Fecha de aceptación: 28/09/2015 1 Resumen Contexto: Los valores de referencia para pruebas tiroideas deben estandarizarse en la población local. En Colombia no tenemos datos propios. Objetivo: Describir los niveles de hormonas tiroideas (TSH y T4 libre) en adultos de Medellín, Colombia. Métodos: Estudio retrospectivo, con información obtenida de la base de datos electrónica de Dinámica IPS. Criterios de inclusión: Adultos (18-50 años), con medición simultánea de TSH y T4 libre (T4L), ambos dentro del valor de referencia suministrado por el proveedor de la prueba (Abbott). Criterios de exclusión: mujeres embarazadas, hipotiroidismo primario conocido y anticuerpos anti-TPO o antitiroglobulina positivos. Los datos se compararon con una curva normal. Se realizó un análisis de regresión lineal entre T4L y TSH o LogTSH. Resultados: Se obtuvieron datos desde febrero 1 hasta abril 30 de 2015, n = 2.438 personas, el 80,5% eran mujeres, el promedio de edad 35,74±8,4 años. El promedio de TSH fue 2,19±1,10 mUI/L y el de T4L 1,00±0,11 ng/dl. Los valores de T4L se distribuyen de forma normal, pero los de TSH se distribuyeron como una curva asintótica hacia la izquierda. El 95% de los valores de T4L fueron entre 0,74-1,26 ng/dl y de TSH entre 0,36 y 4,55 mUI/L. No hubo diferencias entre TSH y T4 libre por sexo o por edad. El análisis de regresión lineal no mostró relación entre la T4L y TSH o LogTSH. Conclusiones: En adultos entre 18 a 50 años, el 95% de los valores de TSH oscilan entre 0,36-4,55 mUI/ L y para T4 L entre 0,74-1,26 ng/dl. No hubo diferencias por sexo o décadas de edad. Tampoco entre valores de TSH y T4L. Palabras clave: TSH, tiroxina, tirotropina, hormonas tiroideas, pruebas de función tiroidea, función tiroidea. Abstract Context: Reference values for thyroid tests should be standardized in local adult people. In Colombia we do not have own data. Objective: To describe serum levels of thyroid hormones (TSH and free T4) in adults from Medellin, Colombia. Methods: Retrospective study based in information from an electronic database. Inclusion criteria: Adults 18-50 years-old adults with simultaneous measurement of TSH and free T4 (FT4), both values within the reference value supplied by Abbot. Exclusion criteria: pregnant women, primary hypothyroidism and positive TPO or thyroglobulin antibodies. Data were compared with a normal curve. Linear regression analysis between FT4 and TSH and between FT4 and LogTSH was performed. Results: Data from February 1 to April 30 2015 were obtained, n=2.438 individuals, 80.5% were women, age mean±SD 35.74±8.4 years. TSH values were mean±SD 2.19±1.10 mUI/L and FT4 1.00±0.11 ng/dl. FT4 were distributed as a normal curve, meanwhile TSH showed an asymptotic curve to the left. Ninety five percent of FT4 values were between 0.74-1.26 ng/dl and TSH 0.36-4.55 mUI/L. There was no difference between TSH and FT4 by gender or by age. Linear regression analysis do not showed any relationship between TSH and FT4. Conclusions: In adult population 95% of serum TSH and FT4 ranging between 0.36-4.55 uUI/L and 0.74-1.26 ng/dl respectively. There were no differences by gender or age groups, or relationship between TSH and FT4. Key words: serum TSH levels, thyroxine, thyrotropin, thyroid hormones, thyroid function tests, thyroid function. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 19 Revista colombiana Volumen 2, número 4, noviembre de 2015 Introducción Las enfermedades tiroideas son altamente prevalentes, sin embargo, las manifestaciones clínicas tempranas son inespecíficas y se requiere de pruebas hormonales confiables y validadas en laboratorios con experiencia en el uso de técnicas estándar para establecer un adecuado diagnóstico(1). Según la Federación Internacional de Química Clínica (IFCC por su sigla en inglés) el valor de referencia de una prueba de laboratorio debería ser validado en la población donde se va a usar. Esto requiere de un estudio poblacional con un tamaño de muestra representativo(2) y selección de los individuos de forma estratificada para garantizar igual proporción de individuos según sexo, estrato socioeconómico y grupos etáreos. Debido a la falta de esta información en la población colombiana, en nuestro país se usan valores de referencia validados y suministrados por el fabricante de la prueba, basados en población extranjera(3). La aproximación inicial al problema es realizar un estudio retrospectivo, con la base de datos disponible de un laboratorio de la ciudad con el objetivo de describir los valores de Hormona Estimulante de la Tiroides (TSH) y T4 libre (T4L) tomados de forma simultánea, en individuos adultos a quienes el médico tratante durante la consulta solicitó estas dos pruebas. El objetivo del estudio es describir el comportamiento de los valores de TSH y T4L, medidos en forma simultánea y dentro de los rangos normales de referencia del proveedor de la prueba, en adultos entre 18 a 50 años de la ciudad de Medellín y su área metropolitana. Materiales y métodos Se revisó una base de datos electrónica, donde se encuentran los resultados de pruebas diagnósticas de función tiroidea realizadas en el laboratorio clínico Dinámica IPS, de la ciudad de Medellín, entre 1 de febrero y 30 abril del año 2015. Se identificaron resultados de TSH y T4L tomados simultáneamente en individuos con edades entre 18 y 50 años. Para incluirse en el estudio, el individuo debería tener los valores de TSH y T4L dentro del rango de referencia considerado como normal por el proveedor de la prueba. Fueron excluidos del análisis 649 individuos: por evidencia de hipotiroidismo según el histórico del laboratorio al tener al menos una TSH mayor de 10 mUI/L (n = 435), la presencia de anticuerpos antimicrosomales o antitiroglobulina positivos (n = 202) o tener registro de una prueba positiva de embarazo durante el periodo de estudio (n = 12). La TSH ultrasensible y la T4L fueron procesadas por la técnica de quimioluminiscencia a través del equipo Architect de la casa comercial Abbott. El intervalo de referencia suministrado por el proveedor para la TSH es de 0,35 a 4,9 mUI/L (intervalo de confianza del 99%, n = 549 sujetos) y para T4L 0,70 a 1,48 ng/dl (intervalo de confianza del 99%, n = 411 sujetos). La sensibilidad funcional del ensayo TSH es ≤0,01 mUI/L, cum- 20 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo pliendo los requisitos de un ensayo de tercera generación. El desempeño técnico de la prueba de TSH para el laboratorio, de acuerdo con el informe RIQAS (Randox International Quality Assessment Scheme) con dos eventos mensuales en el periodo de estudio, evidenció una calificación excelente dentro de las metas analíticas contempladas (índice de desviación estándar, porcentaje de desviación frente a la media de comparación y puntaje de exactitud). Las muestras de sangre (5 ml) fueron tomadas en ayunas, en tubos de tapa roja, sin anticoagulante y con gel separador, para obtener suero. Se sometieron a centrifugación para eliminar fibrina, eritrocitos o partículas en suspensión para garantizar reproducibilidad de los resultados y fueron procesadas el mismo día de la toma. La población de Medellín y su área metropolitana corresponde a 3.700.000 habitantes, la prevalencia del hipotiroidismo subclínico correspondería a un 5% de la población y con un intervalo de confianza del 95% y un margen de error del 2% se calculó el tamaño de muestra de 457 individuos para que la muestra fuera representativa de la población general. Análisis estadístico: para el análisis de los resultados se utilizó el programa SPSS 22. Las variables categóricas se expresaron como porcentajes. Las variables continuas se expresaron como media más una desviación estándar y se definieron percentiles para identificar los valores para el 95% de la población analizada. Se calculó una diferencia de medias con el estadístico t de Student para valores de TSH y T4L, con respecto a sexo y grupos de edad. Se realizó una regresión lineal simple entre TSH y T4L y entre T4L y Log10 TSH. Se consideró un valor estadísticamente significativo con una p<0,05. Resultados Se incluyeron 2.438 individuos entre 18 y 50 años que cumplían los criterios de inclusión con la medición simultánea de TSH y T4L dentro del rango normal. El 80,5% (n= 1.959) de la muestra seleccionada fueron mujeres. Los valores promedio para TSH fueron de 2,1±1,1 mUI/L y para T4L 1±0,11 ng/dl (tabla 1). Los valores de TSH en mujeres fueron de 2,17 ±1,08 y en hombres 2,17±1,1, sin alcanzar diferencias estadísticamente significativas entre ambos sexos (tabla 2), ni cuando se comparaban los individuos por décadas de edad entre 18 y 50 años (figura 1). Tabla 1. Pruebas tiroideas en 2.438 adultos en Medellín, Colombia Variable Sexo Media±DS Rango Mujeres n=1.959 (80,5%) Edad (años) 35,7 ± 8,4 (18-50) TSH (mUI/L) 2,1 ± 1,1 (0,35-4,9) T4L (ng/dl) 1 ± 0,11 (0,72-1,46) Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Tabla 2. Percentiles de TSH según el sexo Figura 2. Distribución de frecuencia de valores de TSH en 2.438 adultos Percentiles de valores de TSH mUI/L P10 P25 P50 P75 P90 P95 Mujer 0,67 0,89 1,34 1,97 2,93 3,82 4,21 Hombre 0,69 0,86 1,30 1,96 2,93 3,78 4,42 Figura 1. Valores de TSH según grupos de edad en población adulta 5,00 TSH mUI/mL 4,00 120 Frecuencia (No. individuos) P5 100 80 60 40 20 0 3,00 00 1,00 2,00 3,00 4,00 5,00 TSH mUI/mL 2,00 Figura 3. Distribución de frecuencia de T4L en 2.438 adultos 1,00 200 0,00 31-40 41-50 Edad (años) La distribución de la TSH fue una curva asintótica hacia la izquierda, estando el 95% de los valores de esta población entre 0,36-4,55 mUI/L, y el total de la población con un rango entre 0,35-4,9 mUI/L (figura 2). La distribución en los diferentes percentiles se observa en la tabla 2. La T4L se distribuyó según la curva normal, estando el 95% de la población entre valores de 0,74-1,26 ng/dl, con un rango de 0,72-1,46 (figura 3). Al realizar un análisis de regresión simple entre los valores de T4L y TSH o Log TSH, no se encontró relación estadísticamente significativa entre las variables (figura 4). Discusión Este es el primer estudio en población colombiana que describe el comportamiento de los niveles de TSH y T4L en 2.438 adultos eutiroideos desde el punto de vista bioquímico, con edades entre 18 y 50 años. En este estudio, el 95% de los individuos presenta valores séricos de TSH entre 0,36 y 4,55 mUI/L. Este rango tiene un límite superior que es menor al reportado por el fabricante: 4,55 vs 4,9 mUI/L y es mayor que el reportado en población joven normal sin patología tiroidea, ni evidencia ecográfica de disfunción tiroidea que es de 3,63 mUI/L(4) o del valor ajustado por edad (percentil 97,5 del grupo entre 20 y 29 años (3,56 mUI/L)(5), pero muy similar al estudio NHANES III en la población reportada como libre de enfermedad (4,5 mUI/L) y el estudio Finlandés (4,4 mUI/L(6,3). Es necesario entender que los valores de TSH deben ser interpretados de acuerdo con los rangos de referencia de la pobla- Frecuencia (No. individuos) 18-30 150 100 50 0 0,60 0,80 1,00 1,20 1,40 1,60 T4L (ng/dL) ción local y específicamente por grupos de edad para así evitar clasificaciones erróneas que lleven a sobretratamientos(20,21). Similar a lo reportado en estudios previos realizados hace cerca de una década, para establecer rangos de referencia en población general(4,12), en el presente reporte encontramos que los valores de TSH no se ajustan a una distribución normal y se comportan como una curva asintótica hacia la izquierda, agrupando la mayoría de los valores menores de 2,9 mUI/L (percentil 75) tanto para hombres como para mujeres, con un promedio de 2,1± 1,1 mUI/L. Dado que la mayoría de sujetos sanos sin títulos de anticuerpos positivos contra antígenos tiroideos tenían valores de TSH menores 2,5 mUI/L; algunos autores sugirieron que el límite superior normal de TSH debería ser cercano a 2,5 mUI/L(7,8,9,10,11). Sin embargo, el reducir el punto de corte implicaría que se aumentaría la proporción de individuos previamente clasificados como hipotiroideos subRevista Colombiana de Endocrinología, Diabetes y Metabolismo 21 Revista colombiana Volumen 2, número 4, noviembre de 2015 Figura 4. Recta de regresión simple entre T4L y LogTSH 5 r2 = 0,004 Log TSH 4 3 2 1 0 0,8 1,0 1,2 1,4 T4L (ng/dL) clínicos que no reciben tratamiento y que pasarían a recibir tratamiento con levotiroxina, sin que haya evidencia de que esta conducta tenga impacto en la morbilidad o mortalidad(12). Sin embargo, el hallazgo de la desviación hacia la izquierda de la curva de la TSH debe alertar al clínico que la meta de tratamiento del paciente con hipotiroidismo primario será lograr valores de TSH en la mitad inferior del rango de referencia, especialmente cuando el paciente persiste con síntomas de fatiga y de hipotiroidismo descontrolado a pesar de tener una TSH dentro del rango normal. La relación mujer:hombre encontrada en este estudio fue de 4:1, dado que la población no se escogió al azar; esto podría estar explicado por el hecho de que los médicos tratantes tengan una mayor sospecha de enfermedad tiroidea en mujeres y también porque existe una tendencia de las mujeres a consultar con mayor frecuencia a los servicios de salud. En el presente estudio no se encontraron diferencias estadísticamente significativas en los valores de TSH con respecto al sexo, aunque en algunos trabajos se han descrito sutiles diferencias encontrando valores mayores de TSH en mujeres respecto a los hombres(21). Tampoco se encontró relación estadísticamente significativa entre valores de T4L y TSH o LogTSH, cuando estos parámetros se encuentran dentro del rango normal, sugiriendo que hay un comportamiento individual y una regulación compleja entre los valores de TSH y T4L(13). Esto contrasta con estudios previos, donde se ha encontrado una relación inversa y un aumento exponencial de los valores de TSH, ante una reducción lineal de los niveles de T4L en pacientes con hipotiroidismo primario(14). Esta falta de relación de los valores de T4L con la TSH observada en nuestro estudio ayudaría a entender el comportamiento de pacientes con TSH elevada por encima del límite superior y T4L dentro del rango normal de referencia, los cuales estarían cursando con una forma temprana o compensada de hipotiroidismo primario(15). 22 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo Además, explica porqué un paciente que reduce su T4L desde el cuartil superior hasta el cuartil inferior, ambos dentro del rango de referencia normal, sería suficiente para desencadenar una elevación de los valores de TSH por encima del límite superior del rango normal, como un indicador de una regulación individual y sugiere que un subgrupo de pacientes en tratamiento con levotiroxina se beneficiarían de seguimiento con un objetivo de valores de hormonas tiroideas dentro de un rango individual, en vez de usar un rango poblacional. Los valores de TSH sérico no son estáticos en el tiempo, se presenta una variación circadiana, la cual da valores dentro del rango de referencia normal y también una variabilidad intra-individual en la medición hasta de un 12%(16), lo cual refleja la vida media corta de la hormona (60 minutos). La mayoría de los rangos de referencia para TSH que presentan los laboratorios clínicos están entre un límite inferior de 0,35 mUI/L y un límite superior entre 4,5 a 5,5 mUI/L. Se ha propuesto que para establecer rangos de población normal se cuente con la evaluación de al menos 120 individuos normales, sin antecedente de patología tiroidea personal o familiar, con títulos negativos de anticuerpos tiroideos (antitiroperoxidasa o antitiroglobulina), sin la presencia de bocio visible o palpable, ni consumo de medicamentos que afecten la función tiroidea(12). El estudio NHANES III que incluyó 16.533 individuos estadounidenses describió los valores de TSH según grupos de edad, evidenció un desplazamiento de la curva hacia la derecha a medida que aumenta la edad de la población y esa variación persistía al excluir a los pacientes con anticuerpos antitiroideos. El percentil 97,5 para los valores de TSH en sujetos afroamericanos con edades entre 20 a 29 años fue de 3,56 mUI/L y para el grupo mayor de 80 años fue 7,49 mUI/L. Por cada 10 años después de los 30-39 años, el percentil 97,5 de la TSH sérica aumenta en 0,3 mUI/L(17). La cohorte escocesa de 153.127 personas reporta que el percentil 2,5 disminuye con la edad de 0,51 a 0,31 mUI/L y el percentil 97,5 aumenta con la edad de 3,98 a 5,94 mUI/L, cuando se comparan los grupos entre los 30 y 50 años y los mayores de 70 años. Se encontró un aumento significativo en la mediana en la TSH de 1,58 mUI/L en el grupo de 31 a 40 años a 1,86 mUI/L en el grupo de 90 años(5). Otras publicaciones recientes confirman los hallazgos anteriores, sugiriendo influencia de la edad, la etnia, la suplencia de yodo, el sexo y el índice de masa corporal en la distribución de los valores de TSH(18,19,20,21). Se resalta entonces que la interpretación de los valores obtenidos de TSH para un paciente deben realizarse con los valores esperados para la edad, pero siempre conservando en mente la individualidad de la función tiroidea para cada caso particular y su contexto clínico antes de llegar a un diagnóstico definitivo, especialmente con los resultados limítrofes(22,23). Por haber revisado una base de datos electrónica que no disponía de información clínica, el estudio tiene limitaciones acerca del estado clínico y síntomas de los sujetos incluidos, Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 el índice de masa corporal y el consumo de medicamentos. Sin embargo se parte del principio de la regulación estrecha del eje tiroideo y de sólo haber incluido aquellos sujetos que tuvieran ambos parámetros dentro del rango normal y haber excluido aquellos con anticuerpos anti-TPO y antitiroglobulina positivos. Otras limitaciones es que al ser un estudio retrospectivo la solicitud de las pruebas tiroideas fue realizada por el médico tratante, lo cual pudiera significar que este grupo de pacientes tenga una mayor probabilidad de enfermedad tiroidea. Aunque se excluyeron sujetos con valores históricos de TSH elevada o títulos positivos de anticuerpos antitiroglobulina o antiperoxidasa, es posible que se pudieran haber incluido pacientes en tratamiento con hormona tiroidea o antitiroideos, ya que no se dispone de las historias clínicas para confirmar el diagnóstico y el tratamiento actual. Otra limitación es que aunque los individuos de esta aseguradora son en su mayoría personas trabajadoras que consultan a su entidad de salud (EPS o medicina prepagada), no se conoce su estrato socioeconómico, ni se conoce el estado de ingesta o suplencia de yodo. Aunque por las razones enunciadas previamente, la muestra estudiada no debe considerarse representativa de la población general, nos permite una aproximación acerca del comportamiento biológico del par hormonal en una población local de 18 a 50 años, con resultados que concuerdan con lo descrito en la literatura: una distribución normal de la T4L y una curva asintótica hacia la izquierda para los valores de TSH y la falta de relación entre la TSH y T4L para sujetos con valores dentro del rango normal en el análisis de regresión simple, como evidencia de la variabilidad biológica individual que rige el eje hipotálamo-hipófisis-tiroides(20, 21,22). 1. Garber JR, Cobin RH, Gharib H, Hennessey JV, Klein I, Mechanick JI, et al. Clinical practice guidelines for hypothyroidism in adults: cosponsored by The American Association of Clinical Endocrinologist and The American Thyroid Association. Endocr Pract. 2012 Nov-Dec;18(6):988-1028. 2. Baloch Z, Carayon P, Conte-Devolx B, Rasmussen U.F., Henry JF, LiVolsi V et al. Laboratory medicine practice guidelines. Laboratory support for the diagnosis and monitoring of thyroid disease. National Academy of Clinical Biochemistry. Thyroid. 2003 Jan;13(1):3-126. 3. Langén VL, Niiranen TJ, Mäki J, Sundvall J, Jula AM. Thyroid-stimulating hormone reference range and factors affecting it in a nationwide random sample. Clin Chem Lab Med. 2014 Dec; 52(12):1807-13. 4. Kratzsch J, Fiedler GM, Leichtle A, Brügel M, Buchbinder S, Otto L, et al. New reference intervals for thyrotropin and thyroid hormones based on National Academy of Clinical Biochemistry criteria and regular ultrasonography of the thyroid. Clin Chem 2005; 51:1480. 5. Vadiveloo T, Donnan PT, Murphy MJ, Leese GP. Age- and gender-specific TSH reference intervals in people with no obvious thyroid disease in Tayside, Scotland: the Thyroid Epidemiology, Audit, and Research Study (TEARS). J Clin Endocrinol Metab 2013; 98:1147. 6. Vanderpump MPJ, Tunbridge WMG, French JM, Appleton D, Bates D, Rodgers H et al. The incidence of thyroid disorders in the community; a twenty year follow up of the Whickham survey. Clin Endocrinol 1995; 43:55-68. 7. Biondi B. The Normal TSH Reference Range: ¿What Has Changed in the Last Decade? J Clin Endocrinol Metab, 2013 Sep;98(9):3584-7. 8. P. Laurberg, S. Andersen, A. Carl´e, J. Karmisholt, N. Knudsen, and I. B. Pedersen. The TSH upper reference limit: where are we at?. Nat Rev Endocrinol. 2011 Apr;7(4):232-9 9. Brabant G, Beck-Peccoz P, Jarzab B et al. Is there a need to redefine the upper normal limit of TSH? Eur J Endocrinol. 154; 5:633–637, 2006. 10. Wartofsky L, Dickey RA. The evidence for a narrower thyrotropin reference range is compelling. J Clin Endocrinol Metab, 90; 9: 5483–5488, 2005. 11. Dickey RA, Wartofsky L, Feld S. Optimal thyrotropin level: normal ranges and reference intervals are not equivalent. Thyroid. 15; 9: 1035–1039, 2005. 12. Surks MI. TSH reference limits: new concepts and implications for diagnosis of subclinical hypothyroidism. Endocrine Practice 2013, vol 19, No.6. 13. Hoermann R, Eckl W, Hoermann C, Larisch R. Complex relationship between free thyroxine and TSH in the regulation of thyroid function. Eur J Endocrinol, 162; 6: 1123– 1129, 2010. 14. Wardle CA, Fraser WD, Squire CR. Pitfalls in the use of thyrotropin concentration as a first-line thyroid-function test. Lancet 2001; 357:1013-4. 15. C. A. Spencer, J. G. Hollowell, M. Kazarosyan, and L. E. Braverman, National Health and Nutrition Examination Survey III Thyroid-StimulatingHormone (TSH)-thyroperoxidase antibody relationships demonstrate that TSH upper reference limits may be skewed by occult thyroid dysfunction. J Clin Endocrinol Metab, vol. 92, no. 11, pp. 4236–4240, 2007. 16. Andersen S1, Bruun NH, Pedersen KM, Laurberg P. Biologic variation is important for interpretation of thyroid function tests. Thyroid. 2003 Nov; 13 (11):1069-78. 17. Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANESIII). J Clin Endocrinol Metab.2002.87 ;( 2):489–499. 18. Bremner AP, Feddema P, Leedman PJ, et al. Age-related changes in thyroid function: a longitudinal study of a community-based cohort. J Clin Endocrinol Metab 97:1554, 2012. 19. T. E. Hamilton, S. Davis, L. Onstad, and K. J. Kopecky, Thyrotropin levels in a population with no clinical, autoantibody, or ultrasonographic evidence of thyroid disease: implications for the diagnosis of subclinical hypothyroidism, J Clin Endocrinol Metab, vol. 93, no. 4, pp. 1224–1230, 2008. 20. Surks MI, Hollowell JG. Age-specific distribution of serum thyrotropin and antithyroid antibodies in the U.S. population: implications for the prevalence of subclinical hypothyroidism. The Journal of Clinical Endocrinology and Metabolism, 92; 12:4575–4582, 2007. 21. Boucai L, Hollowell JG, Surks MI. An approach for development of age-, gender-, and ethnicity-specific thyrotropin reference limits. Thyroid. 2011; 21: 5-11. 22. Surks M, Boucai L. Age and race- based serum thyrotropin reference limits. J Clin Endocrinol Metab 95: 496-502- 2010. 23. Hoermann R, Midgley J. TSH Measurement and Its Implications for Personalised Clinical Decision-Making. Journal of Thyroid Research. Volume 2012. doi: 10.1155/2012/438037. Referencias Conclusiones Para una población de adultos entre 18 y 50 años, de la ciudad de Medellín, el 95% de los valores de TSH oscilan entre 0,36 y 4,55 mUI/L y para T4L entre 0,74-1,26 ng/dl, sin diferencias estadísticamente significativas por sexo o rango de edad dentro de este grupo. Los valores de TSH tienen una distribución de una curva asintótica hacia la izquierda, mientras que los valores de T4L presentan una distribución normal. En el análisis de regresión, al comparar los valores de TSH con los de T4 libre, no se logra definir una tendencia que permita construir una ecuación para predecir un valor de TSH para un valor dado de T4 libre, cuando ambos están dentro de los rangos de normalidad, lo cual pudiera ser dado por la dinámica individual del eje tiroideo. Conflictos de Interés: Ninguno para declarar Agradecimientos: Dra. Ángela María Loaiza, Heiddy del Valle Arrieta, Diana Milena Londoño Valencia, Sandra María Gallego Osorio, Sandra Marcela Osorno Cataño, Denis Carolina Mozo de León, Yanett Marcela Montoya Jaramillo por hacer posible la realización de este trabajo a través del laboratorio Dinámica. Al Dr. Alejandro Román González por su invaluable ayuda en la corrección y ajustes del manuscrito. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 23 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Artículo Original Pseudomalabsorción como causa de altos requerimientos de levotiroxina: experiencia en el Hospital Universitario San Vicente Fundación Carlos Alfonso Builes Barrera1, Susana Álvarez Pérez2 Alejandro Román-González Médico especialista en Endocrinología. Endocrinólogo de Adultos Hospital Universitario San Vicente Fundación. Docente de la sección de Endocrinología de la Universidad de Antioquia. Miembro de Número Asociación Colombiana de Endocrinología, Diabetes y Metabolismo. Grupo de Endocrinología y Metabolismo U de A. 2 Estudiante de pregrado-Facultad de Medicina. Universidad de Antioquia 3 Médico especialista en Endocrinología. Endocrinólogo de Adultos Hospital Universitario San Vicente Fundación. Miembro Asociado de la Asociación Colombiana de Endocrinología, Diabetes y Metabolismo. Correspondencia: Dr. Carlos Alfonso Builes Barrera Correo electrónico: [email protected] Fecha de recepción: 18/09/2015 Fecha de aceptación: 23/09/2015 1 Resumen S e presentan cinco casos de pacientes con hipotiroidismo primario y altos requerimientos de levotiroxina, que luego de haber tenido un abordaje convencional en el ajuste de las dosis necesarias de levotiroxina por el peso y etiología de hipotiroidismo, recomendación y educación para el consumo adecuado de levotiroxina, optimización de la calidad del medicamento recibido, eliminación de interferencias con la absorción por medicamentos o alimentos, reposición de deficiencia de vitamina B12, desparasitación, descartar enfermedad celíaca y gastritis autoinmune atrófica, persisten con TSH elevada pese al uso de dosis altas de levotiroxina (mayores de 2,5 µg/kg/día). Se les practicó prueba de absorción de levotiroxina con 1.000 µg en dosis única de carga y evaluación de los incrementos de T4 libre a las 2 y 4 horas en cuatro pacientes y en uno con suministro semanal de la dosis de levotiroxina y evaluación semanal de T4 libre. Se confirmó en los cinco pacientes la capacidad de absorción de levotiroxina, constituyendo cinco casos de pseudomalabsorción de levotiroxina. Palabras claves: hipotiroidismo, TSH, pseudomalabsorción, levotiroxina. Abstract Five patients with primary hypothyroidism and high levothyroxine dose requirements (>2.5 µg/kg/day) are presented. 24 Revista Colombiana de Endocrinología, Diabetes y Metabolismo All patients had usual adjustment of the levothyroxine dose according to weight and hypothyroidism etiology. Patients were educated about the appropriate way of drug intake, the quality of the hormone replacement was assessed and withdrawal of all medications potentially interrupting with the levothyroxine absorption was done. All patients had vitamin B12 replacement, were treated for gastrointestinal parasites and celiac disease and autoimmune atrophic gastritis was ruled out. Despite correction of all this factors these patients had elevated TSH. To evaluate a potential mala-absorptive case all patients underwent a levothyroxine absorption test. In 4 cases, 1000 µg of levothyroxine was administered and free T4 was evaluated at 2 and 4 hours after intake of the drug. In 1 case, the levothyroxine was administered weekly with free t4 evaluation. Appropriate levothyroxine absorption was confirmed in all cases and the diagnosis of pseudo mal-absorption of levothyroxine was done. Key words: hypothyroidism, TSH, pseudo mal-absorption, levothyroxine Introducción El hipotiroidismo es, usualmente, una enfermedad fácilmente tratable. La gran mayoría de los pacientes con hipotiroidismo establecido y sin función tiroidea residual se pueden tratar con levotiroxina con dosis cercanas a 1,6 µg/ kg/día(1). Sin embargo, cerca del 1% de los pacientes requieren dosis más altas de lo esperado para lograr un adecuado control. La necesidad de dosis mayores a 2,5 µg/kg/día para mantener una hormona tiroestimulante (TSH) en rango normal se considera como altos requerimientos de levotiroxina. Las principales causas son la mala adherencia al medicamento, interferencias con alimentos, medicamentos que alteran la absorción de la hormona, inducción hepática o modificación de la fracción libre disponible y alteraciones gastrointestinales incluyendo la malabsorción. Algunos de estos pacientes no presentan ninguna de estas alteraciones luego de un estudio completo y requiere la realización de estudios de absorción hormonal. Durante este procedimiento se administra de forma supervisada levotiroxina oral y se evalúan los niveles de T4 libre con el objetivo de demostrar una enfermedad malabsortiva. Revista colombiana de Endocrinología Diabetes&Metabolismo Cuando se demuestra que el paciente presenta una absorción normal debe considerarse el diagnóstico de pseudomalabsorción(2), fenómeno asociado en algunas ocasiones a ganancias secundarias y a trastornos psiquiátricos(3,4). En este reporte se presenta la experiencia del Hospital Universitario San Vicente Fundación con cinco pacientes con altos requerimientos de levotiroxina sin lograr normalización de su TSH en forma ambulatoria, que necesitaron pruebas diagnósticas adicionales para lograr establecer la causa de su hipotiroidismo primario descompensado. Métodos Se revisó la base de datos de interconsultas y pacientes hospitalizados por el servicio de endocrinología del Hospital Universitario San Vicente Fundación. Se identificaron 1.144 pacientes evaluados por el servicio desde el año 2009 hasta el 2015 y se extrajeron los datos de la historia clínica de los pacientes a quienes se les hizo prueba de absorción de levotiroxina. Se diagnosticaron cinco pacientes con pseudomalabsorción de levotiroxina. Se tomaron las variables demográficas, los valores de TSH, T4 libre basal y poscarga de levotiroxina. Prueba de absorción de levotiroxina Se realizó la prueba mediante supervisión directa por personal médico o por personal de enfermería. Se administraron 1.000 µg vía oral de levotiroxina en dosis única y se midió T4 libre en el momento previo de la carga de levotiroxina, a las 2, 4 y 6 horas de administrado el medicamento. Se consideró absorción anormal como la incapacidad de aumentar un 100% el valor de T4 libre con respecto al basal como ha sido descrito previamente(5). Volumen 2, número 4, noviembre de 2015 al consumo de levotiroxina en la presentación comercial de Synthroid® con incrementos progresivos en la dosis hasta 400 µg/día (4,39 µg/kg/día). Además de los estudios para descartar interferencias con la absorción de la medicación, el paciente recibió incrementos progresivos de la dosis de levotiroxina hasta 7 tabletas diarias de la presentación comercial Eutirox® de 150 µg (1.050 µg/ diarios: 11,5 µg/kg/día), persistiendo con hipotiroidismo descontrolado y sintomático. Recibió tratamiento para gastritis crónica, H. pylori, recibió antiparasitarios, se educó para evitar cualquier tipo de interferencias con fibras, laxantes, antiácidos o comida luego del consumo de la medicación, guardando una hora de diferencia entre su consumo y los alimentos. Se descartó la presencia de anticuerpos contra células parietales gástricas, anticuerpos antigliadina y se suplementó con vitamina B12 para alcanzar niveles mayores de 400 pg/ml. Ante las dificultades para lograr un control adecuado, el 16 de septiembre del 2011 se realizó la primera prueba de absorción de levotiroxina con 1.000 µg vía oral que confirmó la absorción normal, alcanzando valores supranormales de T4 libre a las dos horas luego de la carga oral (tabla 1). Como antecedente importante, el paciente, tres años atrás, luego de la muerte de su madre presentó duelo patológico por lo que se solicitó evaluación por psiquiatría y en su concepto se descartó evento depresivo o trastorno de personalidad. Tabla 1. Pruebas tiroideas del paciente 1 Fecha TSH mUI/L Ene 2011 T4 libre (0.9- 1,7 ng/ dl) Dosis de Lt4 0,26 Implicaciones éticas Jun 2011 200 300 La revisión de las historias clínicas para este estudio fue autorizada por el comité de investigaciones del Hospital Universitario San Vicente Fundación. Para la realización intrahospitalaria de la prueba de absorción se dio explicación previa al paciente de forma verbal y se diligenció el consentimiento informado escrito respectivo, al momento de la hospitalización. Ago 2011 223 750 Caso 1 Hombre de 50 años con peso de 91 kg. Con antecedente de hipertiroidismo primario por enfermedad de Graves y nódulo tiroideo frío, con reporte de neoplasia folicular en la biopsia aspirado con aguja fina que fue llevado a tiroidectomía total (2010) con posterior desarrollo de hipotiroidismo posquirúrgico. La patología final reportó tiroiditis linfocítica crónica sin signos de malignidad. Fue referido a la consulta de endocrinología por la dificultad en el control del hipotiroidismo, pese 1,58 (30 minutos) Sept 2011 1,87 (2 horas post lt4) 1.000 µg (carga) 600 Oct 2011 243 0,24 Nov 2011 156 0,41 Dic 2011 89.1 0,57 Mar 2012 236 0,11 Oct 2012 243 0,24 Jul 2014 0,6 1,99 750 400 En noviembre de 2012, pese al consumo de levotiroxina de marca Eutirox®, en dosis de 1.050 µg/día y suplencia con vitamina B12 mensual, el paciente persistía con niveles elevados de TSH y síntomas claros de abotagamiento facial, frío, lentiRevista Colombiana de Endocrinología, Diabetes y Metabolismo 25 Revista colombiana Volumen 2, número 4, noviembre de 2015 tud psicomotora y dolor muscular generalizado por lo que se hospitaliza para supervisión del consumo de levotiroxina y se realiza la segunda prueba de absorción con 1.000 µg de levotiroxina (Eutirox®) demostrando que la T4 libre nuevamente alcanzó niveles supranormales a las dos horas (2,72 ng/dl valor de referencia normal (VR) hasta 1,7 ng/dl) y confirmando la capacidad intacta de absorción intestinal. El paciente tuvo asistencia irregular a los controles médicos con endocrinólogo, reapareciendo a consulta sólo al estar muy sintomático. En julio de 2014 se suministraron en el consultorio 700 µg de levotiroxina, esta dosis se repitió a la semana y se documentó aumento del valor de T4 libre de 0,2 a 1,19 ng/dl a las semana y a 2,1 ng/dl a los 15 días, se continuó en ese momento con 750 µg/día con mejoría sintomática e incluso con desarrollo de palpitaciones, por lo que se hizo reducción de la dosis a 400 µg/día. Pese a que se contactó al paciente y se proporcionaron los medios para la consecución de la cita médica para continuidad del tratamiento y seguimiento, el paciente no volvió a control médico por cerca de diez meses. Regresó en agosto/15 con hipotiroidismo descompensado, TSH en 213 mUI/L, T4 libre 0,37 ng/dl (0,8-1,8) y con la dosis supervisada semanal de 1.000 µg en dos semanas bajo 6 kilos, mejoró su estado general y normalizó los niveles de T4 libre. Caso 2 Mujer de 28 años, con peso 61 Kg. Con hipotiroidismo posquirúrgico posterior a tiroidectomía total y vaciamiento central por cáncer papilar de tiroides estadio 1 (T2 N1 M0) en 2004 más terapia ablativa con yodo radioactivo 120 mci. En el 2011, consumiendo 150 µg de lunes a sábado y 400 µg los domingos presentaba TSH en 0,04 mUI/L. Posteriormente la paciente comienza a necesitar incrementos progresivos de la dosis de levotiroxina para lograr niveles en meta de TSH. En diciembre de 2012, recibiendo 400 µg de lunes a viernes y 350 µg sábado y domingo (2.700 µg/semana – 6,3 µg/ kg/día) tiene TSH en 0,09 con T4 libre en 1,97 ng/ dl (VR 0,7-1,48) por lo que se reduce la dosis a 300 µg/día de la presentación Eutirox® (tabla 2). Durante los ajustes se adicionó suplencia mensual con vitamina B12 a una dosis de 1 mg para asegurar niveles mayores de 400 pg/ml. Durante todo su seguimiento ha tenido valores menores de 0,2 ng/ml de tiroglobulina, aun con valores de TSH mayores de 100 mUI/L y con anticuerpos antitiroglobulina negativos. La paciente tuvo su primera prueba de absorción de levotiroxina que mostró adecuada elevación de los valores de T4 libre en sangre luego de suministrar 1.000 µg de carga de levotiroxina en 2012. Ante el incremento creciente de las dosis de levotiroxina (hasta 600 µg/ día: 9,8 µg/kg/día), pese a dar reposición con vitamina B12 y vitamina C efervescente 1 gramo diario, haber formulado antiparasitarios y descartar 26 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo Tabla 2. Pruebas tiroideas de la paciente 2 Fecha TSH T4 libre (0,4-4 mUI/L) (0,9-1,7 ng/dl) Dosis de LT4 20/11/2012 0,09 1,97 400 µg lun a vie y 350 µg sab y dom 22/02/2013 14,7 1,04 300 µg lun a sab y 400 dom 21/03/2013 100 400 µg lun a sab y 300 dom 06/05/2013 0,1 400 µg / día 05/04/2014 307 400 µg/ día 22/06/2014 0,3 600 µg / día 28/07/2014 149.2 600 µg / día 14/08/2014 263 600 µg / día 30/08/2014 239 <0,4 600 µg / día 02/09/2014 377,8 <0,4 600 µg / día 06/09/2014 1,34 300 µg / día 07/09/2014 1,4 300 µg / día 1,61 300 µg / día 08/09/2014 11,71 presencia de anticuerpos antigliadina, se decidió hospitalizar para nueva prueba de absorción. El día de ingreso al hospital en septiembre del 2014 con niveles de vitamina B12 en 715 pg/ml, la TSH en 377,84 mUI/L (VR 0,4-4) y la T4 libre < 0,40 ng/dl (VR 0,9-1,7). El primer día de su hospitalización recibió 1.000 µg de levotiroxina genérica a primera hora de la mañana, se verificó su consumo por parte del personal de enfermería y tuvo su permanencia con la paciente durante diez minutos. Los resultados de T4 libre no incrementaron en las mediciones (tabla 3) y se planteó la sospecha de que la paciente hubiese podido expulsar las pastillas o la duda de la falta de incremento por calidad del medicamento. Se decide repetir la prueba al día siguiente con el suministro por sonda nasogástrica pero la paciente se negó completamente y se hizo con personal de enfermería acompañándola durante 2 horas y con la presentación de levotiroxina (Eutirox®), logrando demostrar los incrementos de la T4 libre en las siguientes horas. Tabla 3. Resultados de prueba de absorción de carga de 1.000 µg de levotiroxina en la paciente 2 Fecha T4 libre T4 libre T4 libre T4 libre Inicial (ng/dl) 2 horas 4 horas 6 horas Sept 2 de 2014 < 0,40 < 0,40 < 0,40 < 0,40 Sept 3 de 2014 < 0,40 1,72 1,57 1,29 Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 La paciente actualmente no vive en Medellín y pese a que se le ha contactado no ha tenido nuevo control médico hace más de seis meses; sin embargo, refiere estar clínicamente mejor, tomando 300 µg/día de levotiroxina. Caso 3 Paciente femenina de 34 años de edad con 96 Kg de peso, con antecedente de hipotiroidismo primario autoinmune diagnosticado a la edad de 12 años, con dificultad para lograr niveles de TSH en rangos normales de manera continua. (tabla 4). Inicialmente, la dosis de levotiroxina (Eutirox®) fue de 150 µg/día; sin embargo, debido a las variaciones en los niveles de TSH, la paciente requirió incrementos progresivos hasta alcanzar una dosis de 500 µg/día (5,2 µg/kg/día). Tabla 4. Pruebas tiroideas en paciente 3 Fecha TSH (mUI/L) (0,4-4,2) T4 L (ng/ dl) (0,8-1,9) Ago/04 0,12 Oct/ 04 0,1 Dic/ 04 22,17 Feb/ 05 7,81 Ene 31/ 06 42,8 May 9/ 06 44,51 Ago 1/06 53,46 0,0 ng /dl Dic 06/06 2,66 6,3 ug/dl (5,1-14,1) Feb 26/06 86,1 0,76 ng/dl Jun 8/07 1,37 Oct 10/07 4,2 Jul 24/08 23,7 Oct 24/08 0,13 Ene 28/09 17,0 Dic 14 /09 409 Oct/10 0,11 Jun/12 306 Dosis de Levotiroxina Como antecedente personal, la paciente tiene déficit de vitamina B12 y anticuerpos contra células parietales gástricas positivos 1:2.560 en reposición mensual con 1.000 µg de cianocobalamina y consumo de metformina 850 mg/día que fue formulada por signos de resistencia a la insulina/sobrepeso y síndrome de ovarios poliquísticos. Anticuerpos antigliadina negativos. Adicionalmente con obesidad con poca pérdida de peso luego de intervención nutricional y farmacológica (sibutramina en el tiempo que estuvo disponible en Colombia y orlistat hasta 120 mg 3 veces por día). Tomó anticonceptivos orales durante seis meses, cinco años atrás, con suspensión por ganancia de peso en este periodo. Ante la dificultad de lograr un buen control ambulatorio se decide realizar prueba de absorción modificada de levotiroxina. Inició con T4 libre de 0,44 ng/dl, que tras la dosis de carga de 600 µg de levotiroxina ascendió a las dos horas a 0,88 µg/ dL (112% de absorción), interpretándose como una adecuada absorción de la medicación. Posteriormente logró normalización de los niveles de TSH, quedó en embarazo en forma espontánea y mantuvo su TSH en rangos normales durante la gestación, incluso con una dosis menor que la usada previamente al episodio sincopal. Luego de su embarazo, la paciente volvió a presentar descompensación del hipotiroidismo y no ha vuelto a cita médica con endocrinólogo. Caso 4 1,31 ng/dl 1,36 ng/dl 0,4 ng/dl 500 µg/día LT4 300 µg/ d LT4 0,03 ng/ dl 500 µg/ día Fue llevada al servicio de urgencias por episodio de síncope e hipotensión arterial y se encontró TSH en 409 (0,4-4). Al examen físico con reflejo aquiliano lento, piel seca, abotagamiento facial leve, bocio grado 1, sin nódulos por palpación y bradipsiquia. Mujer de 29 años, dos hijos. Antecedente de hipotiroidismo posquirúrgico, tiroidectomía total en dos tiempos (junio y agosto de 2012). Resección inicial de quiste tirogloso de 2 por 3 cm en junio de 2012 con adenopatía local y hallazgos en la inmunohistoquimica: CK7 positivo para células neoplásicas, CK 20 negativo; TTF1 positivo y tiroglobulina positiva. La patología final reportó lóbulo derecho con intersticio con acúmulo de células linfoides en zonas que forman nódulos con centro germinal activo, extensos cambios de células de Hurtle, focalmente fibroso. Lóbulo izquierdo e istmo con características similares, sin criterios de malignidad. Vaciamiento ganglionar: cinco ganglios linfáticos con hiperplasia folicular y sinusal, sin malignidad. El diagnóstico final fue tiroiditis de Hashimoto. En febrero del 2015 trae TSH en 128 mUI/L (0,35-4,8) con T4 libre < 0,04 ng/dl (0,7-1,48), potasio en 3,8 mEq/L, sodio 141 mEq/L, vitamina B12: 2531 pg/ml, albúmina 4,1 g, fósforo 3,3 mg/dl, magnesio 2,1. Los leucocitos en 8.300 con un diferencial normal (N 41%; L 51%), Hb 14,7 g/dl, VCM 75,7; plaquetas 229.000. En enero del 2015 TSH en 57 mUI/L con T4 L 0,93 ng/dl y previamente en noviembre de 2014 con TSH 127 mUI/L, T4L 0,18 ng/dl. Desde final del 2012 y durante dos años estuvo controlada completamente, y desde hacía cerca de tres meses con TSH persistentemente elevada, a pesar de aumento progresivo de la dosis de levotiroxina hasta 200 µg lunes a sábados, 300µg Revista Colombiana de Endocrinología, Diabetes y Metabolismo 27 Revista colombiana Volumen 2, número 4, noviembre de 2015 domingo (Eutirox®) 3 µg/kg/día, por lo que se realizó prueba de absorción de levotiroxina que confirmó la capacidad intacta de su absorción. En septiembre de 2015 ingresa por urgencias por mialgias, parestesias y mareo, tomando levotiroxina 200 µg de lunes a viernes y 300 µg sábado y domingo, hallando T4 libre en 2,16 ng/ dl (0,7-1,48) y calcio sérico en 0,52 mmol/L. Se hizo ajuste en dosis de calcio oral y se envió para continuar manejo ambulatorio por endocrinología. Caso 5 Mujer, 32 años. Antecedente de hipotiroidismo primario diagnosticado hace un año y medio. Sin comorbilidad cardiovascular o neurológica. Presentó síntomas de hipotiroidismo con TSH inicial de 145 mUI/L (0,4-4,2). Sin lograr adecuado control de TSH, pese al consumo de levotiroxina genérica en diferentes dosis, refiriendo que el menor valor logrado fue 34 mUI/L. Previo a la consulta con endocrinología llevaba tres meses tomando 200 µg de lunes a viernes y 300 µg sábado y domingo (3,74 µg/kg/día), con dos horas de diferencia entre la tableta y el desayuno y sin referir interferencia con otros medicamentos. La ecografía de tiroides mostró cambios en la textura sugestivos de tiroiditis crónica, sin nódulo dominante, ni bocio o adenopatías. El informe de resonancia cerebral ordenada por médico tratante sin lesión hipofisiaria. El ECG sólo mostró bradicardia sinusal: 56 por min. En mayo/15. Vitamina B12: 494 pg/ml (200-900). El día de ingreso a consulta con endocrinólogo (20/04/15) se suministró levotiroxina (Eutirox®) 1.000 µg con un vaso completo con agua y se citó a los ocho días con resultado de T4 libre y para hacer de nuevo este suministro supervisado. Luego de dos semanas consecutivas del consumo presencial de 1.000 µg cada lunes, se confirmó la elevación de T4 libre a rangos normales y su adecuada capacidad de absorción de la levotiroxina y se le planteó la opción de consumir semanalmente la levotiroxina y así garantizar una muy buena adherencia. Se diligenció formato de falla terapéutica y se hizo solicitud de levotiroxina, haciendo énfasis en la necesidad de continuar todo el tiempo con el uso de la misma presentación. Tabla 5 Pruebas tiroideas iniciales y luego de suministro semanal de levotiroxina en paciente 5 Fecha de Endocrinología Diabetes&Metabolismo Con el uso semanal de 1.000 µg de levotiroxina (2,3 µg/kg/ día) con presentación comercial, ha tenido excelente control clínico y bioquímico posterior. Discusión La levotiroxina por vía oral es el medicamento de primera elección para el tratamiento del hipotiroidismo, gracias a su muy buena absorción intestinal en yeyuno e íleon, que se calcula es cerca del 65% al 80%(1,6). Para lograr un buen control del hipotiroidismo primario en adultos sin función residual de la tiroides se requieren dosis alrededor de 1,6 µg/kg/día (con un peso ideal) y esto se logra en la gran mayoría de los casos. Aquellos pacientes con requerimientos mayores de 2,5 µg/kg/día se considera que tienen altos requerimientos de levotiroxina y necesitan de la evaluación cuidadosa para determinar si existe un problema de malabsorción del medicamento(1,6,7). Todos los pacientes presentados cumplieron con la definición de altos requerimientos: 11,5, 9,8, 5,2, 3 y 3,74 µg/kg/día, respectivamente. El protocolo tradicional que se sigue con los pacientes con altos requerimientos es evaluar inicialmente la adherencia y forma de consumo de la levotiroxina, además de descartar todas las posibles interferencias con el mismo (alimentos, café, medicamentos, etc). Luego de esto, se hace la búsqueda de las posibles enfermedades o condiciones específicas que puedan interferir con la absorción de la levotiroxina(1,7-10) (tabla 6). Tabla 6. Causas de altos requerimientos de levotiroxina Enfermedades gastrointestinales Interacciones con medicamentos Gastritis atrófica Colestiramina Enfermedad celíaca Sulfato ferroso Intolerancia a la lactosa Sucralfato Enfermedad intestinal inflamatoria Colestipol Infección por H. pylori y Giardia lamblia Hidróxido de aluminio Bypass gástrico Amiodarona Cirrosis hepática Carbonato de calcio Insuficiencia pancreática Propanolol Lovastatina TSH (0,35-4,9 mUI/L) T4 libre (0,9-1,7 ng/dl) 03/03/14 835 ≤ 0,4 Interacciones alimentarias Inhibidores de la bomba de protones 03/04/14 98 0,44 Café, fibra, nueces, soya Carbamazepina --/10/14 120 -- Rifampicina 05/05/15 11,2 (0.35-4.9) 1,77 (0,7-1,48) Fenitoína 28 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Revista colombiana de Endocrinología Diabetes&Metabolismo En los pacientes con hipotiroidismo primario autoinmune se hizo búsqueda intencional de títulos elevados de anticuerpos contra células parietales gástricas, dado que entre 21% y 30% de ellos pueden tenerlos presentes y cursar con déficit de vitamina B12, gastritis atrófica y aumento en los requerimientos de levotiroxina(11). Igualmente, se hizo la solicitud de anticuerpos antigliadina en forma intencional para detectar enfermedad celíaca, una vez descartadas causas más comunes, aun en pacientes sin los síntomas clásicos de diarrea, pérdida de peso y déficit de vitamina D, pues esta podría ser una forma menos común de presentación de la enfermedad y al cambiar por una dieta libre de glúten y permitir la recuperación de la superficie intestinal se logra disminuir los requerimientos de levotiroxina para lograr el control del hipotiroidismo(7-9,11). En los pacientes reportados, aparte de la educación en la toma adecuada del medicamento, se trataron aquellas causas que fueron encontradas: el primero recibió tratamiento para gastritis crónica por H. pylori, además de antiparasitarios y suplemento con vitamina B12 para alcanzar niveles mayores de 400 pg/ml. El paciente 2 también recibió antiparasitarios, suplencia con vitamina B12 y un gramo diario de vitamina C efervescente, para mejorar la absorción de la levotiroxina(16). En el caso 3 se evidenció en la paciente déficit de vitamina B12 y anticuerpos contra células parietales gástricas positivos 1:2.560, para lo cual recibió reposición mensual con 1.000 µg de cianocobalamina. Sin embargo, pese a los ajustes en la dosis y las intervenciones realizadas, los pacientes persistieron con mal control del hipotiroidismo. A pesar de las numerosas variables que interfieren con la eficacia de la levotiroxina, una de las causas más frecuentes del hipotiroidismo de difícil control es la mala adherencia al consumo completo de la dosificación por parte del paciente, que ha sido denominada como pseudomalabsorción(1,2,9) porque se descartan las causas antes mencionadas y se logra demostrar que el paciente tiene intacta la absorción intestinal del medicamento. Esto se hace mediante la realización de una prueba de absorción de levotiroxina, en la cual se administra de forma supervisada una carga de 1.000 µg en dosis única y se verifica el incremento en sangre de los valores de T4 (total o libre) a las 2, 4 y 6 horas posteriores a la ingesta. Esta prueba debe realizarse en pacientes sin evidencia de enfermedad neurológica o cardiovascular(2,9,19). Aunque tradicionalmente se había usado el valor de T4 total para el cálculo de la fórmula de absorción, recientemente se ha validado su uso con las mediciones de T4 libre(12). La fórmula utilizada para calcular la absorción de levotiroxina es: [Delta de T4 libre x 10 x volumen de distribución]/Dosis suministrada de levotiroxina en mg; donde el volumen de distribución es 0,44 x índice de masa corporal(19). Para considerar una absorción normal, debe haber un aumento por encima del 100% sobre el valor inicial de T4 libre(2,9). Volumen 2, número 4, noviembre de 2015 En los tres primeros casos reportados se hicieron pruebas de absorción que, en todos los pacientes, evidenciaron absorción adecuada del medicamento, incluso con niveles suprafisiológicos de T4 libre después de la ingesta (tabla 7), con lo que se confirma el diagnóstico de pseudomalabsorción. Tabla 7. Pruebas de absorción de levotiroxina Fecha T4 libre T4 libre T4 libre T4 libre inicial 2 horas 4 horas 6 horas Septiembre 2011 Paciente 1 Noviembre 1,87 2,72 de 2012 Septiembre Paciente 2 de 2014 2 Septiembre 3 de 2014 Paciente 3 (600 µg) Paciente 4 Febrero de 2015 < 0,40 < 0,40 < 0,40 < 0,40 < 0,40 1,72 1,57 1,29 0,44 0,88 < 0,40 0,66 1,7 1,45 En el caso 1, aunque el médico tratante ha tenido la sospecha de que el paciente tiene depresión por un duelo no superado, la evaluación del psiquiatra no confirmó este diagnóstico. Es necesario un acompañamiento psicológico y psiquiátrico en la evaluación cuidadosa de los pacientes con pseudomalabsorción para garantizar que se adhieran al control médico y terapéutico que garantice un buen control a largo plazo(2). Este paciente logró tener varios controles adecuados luego de comprometer a su familia directa en la verificación del consumo diario de la medicación. Incluso luego de alcanzar niveles normales de TSH con menores dosis de levotiroxina, el paciente sigue negando haber tenido alguna omisión de sus dosis de levotiroxina. En pacientes con pseudomalabsorción se debe considerar el síndrome de Munchausen(13,14), que hace parte de los denominados trastornos ficticios, en los cuales la persona finge o produce intencionadamente signos o síntomas, para asumir el papel de enfermo, únicamente por el beneficio psicológico de la atención y cuidados que reciben(14). Es común que estos pacientes hayan estado consultando en varios hospitales y hayan sido sometidos a numerosos exámenes y tratamientos; resultando en costos considerables al sistema de salud. El paciente ya había tenido una prueba de absorción en otro hospital antes de llegar a nuestra consulta externa y necesitó dos durante nuestro seguimiento. Este haRevista Colombiana de Endocrinología, Diabetes y Metabolismo 29 Revista colombiana Volumen 2, número 4, noviembre de 2015 llazgo debe motivar al clínico a realizar tempranamente pruebas de verificación de absorción de levotiroxina, antes que seguir haciendo incrementos progresivos en pacientes que necesiten más de 2,5 µg/kg/día. Diferentes estudios han encontrado que el hipotiroidismo clínico se asocia con decrementos significativos en el estado de ánimo, con aumento en la incidencia de ansiedad y depresión, junto con la disminución en la función cognitiva, especialmente la memoria. Lo que se evidencia mediante las imágenes es que la estructura y función del cerebro se alteran, encontrándose disminución del volumen del hipocampo, del flujo sanguíneo cerebral y de la función global en las regiones que median la atención, el procesamiento visoespacial, la memoria de trabajo, y la velocidad motora(15). Si a lo anterior se adiciona el hecho de que no se conoce la incidencia de pseudomalabsorción, no está claro si esta condición puede ser un síntoma del déficit de hormonas tiroideas que lleve a olvidos del consumo del medicamento o una forma de presentación del síndrome de Munchausen(13,15). El tratamiento adecuado del hipotiroidismo permite la recuperación de los síntomas del estado de ánimo y déficits cognitivos, mientras que las imágenes por resonancia magnética funcional no muestran los hallazgos anormales después de seis meses de terapia con levotiroxina; sin embargo, es posible que los síntomas referidos no mejoren por completo y no se obtenga un mayor beneficio por aumentar la dosis una vez alcanzados niveles normales de TSH(15). En el caso 2, cuando se realizó la primera prueba de absorción, se administraron 1.000 µg de levotiroxina genérica, de forma supervisada por personal de enfermería, durante la ingesta y hasta diez minutos posterior al consumo; sin embargo, no se evidenció absorción del medicamento. Por lo anterior, se decidió repetir la prueba, esta vez por sonda nasogástrica para garantizar la llegada de la levotiroxina al estómago; pero la paciente se negó al procedimiento, por lo que se administró levotiroxina de presentación Eutirox® y se acompañó a la paciente durante dos horas, logrando confirmar una absorción normal (116%). En este caso, se plantean dos hipótesis que expliquen los resultados opuestos de las pruebas: primero que la paciente pudo haber expulsado el medicamento dado el corto tiempo de supervisión y esto representaría una manifestación de un trastorno ficticio(13). Segundo, varios estudios han demostrado que las diferentes presentaciones de levotiroxina, aunque han sido definidas por la FDA como medicamentos bioequivalentes, no son intercambiables; dado que no presentan la misma biodisponibilidad por variaciones en las propiedades farmacocinéticas, especialmente en la absorción. Lo anterior explica que un paciente pueda presentar síntomas de déficit o exceso de hormonas tiroideas, cuando se le cambia la marca de levotiroxina, consumiendo la misma dosis. Esto generó una clara duda de la calidad del medicamento genérico usado que no lo30 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo gró aumentar los niveles de T4 libre, aun después de ser suministrado en dosis muy por encima de las usuales terapéuticas. En el caso 3, se trata de una paciente con hipotiroidismo de larga data, que había tenido difícil control, pero que logra TSH en metas durante la gestación, momento que se caracterizó por el gran compromiso por su autocuidado y del bebé en formación. Característicamente se ha descrito el incremento en las necesidades de la dosis diaria de levotiroxina entre 30% y 50% durante la gestación; sin embargo, en la paciente se logró un muy buen control con dosis por debajo de las que había señalado como consumidas preconcepcional. La paciente del caso 4 tuvo una prueba que confirmó adecuada absorción y que además se presentó con exceso de hormona circulante con la dosis que previamente no había logrado normalización de los valores de TSH. En el caso 5, no se siguió el protocolo tradicional anteriormente descrito. En esta paciente se descartó durante el interrogatorio la toma inadecuada de la levotiroxina, la interacción con otros medicamentos y los antecedentes de enfermedades que pudieran disminuir la absorción de la levotiroxina; además de síntomas y signos sugestivos de dichas enfermedades que no hubiesen sido diagnosticadas. Dada la experiencia adquirida con los pacientes anteriores y considerando que la primera causa es la falta de adherencia(2), se procedió a la administración supervisada en el consultorio de 1.000 µg de levotiroxina como una dosis semanal y se manejó como un esquema de administración semanal supervisada y posterior llamada semanal durante el primer mes para el recordatorio del consumo del medicamento(18). De esta forma, se logró evidenciar niveles adecuados de hormonas tiroideas con una dosis menor de la previamente formulada, que no había sido efectiva, lo que apoya el diagnóstico de pseudomalabsorción en la paciente. De esta forma, el esquema de administración semanal supervisada de 1.000 µg de levotiroxina y posterior medición de T4 libre semanal, se puede constituir como una alternativa a la prueba de absorción tradicional de la carga de 1.000 µg, para el diagnóstico de pseudomalabsorción(18), dado que ésta conlleva considerables gastos al sistema de salud y demoras en la autorización de los exámenes, por lo que se dificulta el diagnóstico temprano. El esquema semanal es seguro porque se administra una dosis por debajo de la usual para los pacientes con altos requerimientos (<150 µg/día), sólo que en una sola toma cada semana; además es viable para lograr el control del hipotiroidismo dada la vida media de siete días que tiene la levotiroxina y evitar la omisión voluntaria o involuntaria que pueda presentarse de algunas dosis durante la semana en esquemas de dosificación diaria. La practicidad del esquema supervisado permite evaluar precozmente la absorción adecuada de la levotiroxina en el paciente, sin someterlo al exceso de pruebas diagnósticas necesarias para descartar las condiciones que alteran la absor- Revista colombiana de Endocrinología Diabetes&Metabolismo ción del medicamento, como son la enfermedad celíaca o la gastritis atrófica que, si bien tienen mayor incidencia en los pacientes con hipotiroidismo, no son más frecuentes que la mala adherencia de los pacientes en tratamientos crónicos, como es el caso reportado. Tanto en el caso 5 como en la etapa más reciente del caso 1, el régimen supervisado semanal de suministro de levotiroxina nos ha permitido un excelente resultado y recuperación clínica y monitoreo de los pacientes, permitiendo proponerlo cada vez con más frecuencia en la práctica clínica de este tipo de pacientes. Conclusiones Se presenta la experiencia local con cinco pacientes que tuvieron altos requerimientos de hormona tiroidea debido al consumo inadecuado de levotiroxina y que fueron confirmados con absorción exitosa de la medicación luego de prueba de carga oral con 1.000 µg. Se requiere de un manejo interdisciplinario con apoyo del grupo de psicología-psiquiatría(4), soporte familiar y un alto nivel de atención por parte del clínico en la detección temprana de este tipo de trastornos para Volumen 2, número 4, noviembre de 2015 su corrección oportuna que evite morbimortalidad y reduzca los costos de índole personal, familiar y emocional que pueden generarse. Dada nuestra experiencia, se presenta el esquema de dosificación semanal supervisada de levotiroxina como una propuesta sencilla, útil, efectiva y fácil de monitorear ambulatoriamente en el abordaje de pacientes sin comorbilidad cardiovascular y altos requerimientos de levotiroxina. Conflictos de interés: Carlos Alfonso Builes Barrera ha recibido honorarios como conferencista por laboratorios Merck, Abbott, Biotoscana, Eli Lilly, Novartis, Sanofi, Siegfried. No se declaran conflictos de interés en la realización de este artículo. Alejandro Román-González ha recibido honorarios como conferencista por parte de Sanofi, Novartis y Novo Nordisk. No se declaran conflictos de interés en la realización de este artículo. Agradecimientos: Al Dr. Juan David Gómez Corrales, Dra. Diva Cristina Castro Martínez, Dra. Catalina Rúa Marín por el cuidado y atención de los pacientes durante la hospitalización en el Hospital Universitario San Vicente Fundación (HUSVF). Referencias 1. Builes-Barrera CA, Palacios Bayona KL, Jaimes Barragán FA. Dosis de levotiroxina varía según la etiología del hipotiroidismo y el peso corporal. Revista Colombiana de Endocrinología, Diabetes y Metabolismo. 2014;1(1):27-32. 2. Lips DJ, van Reisen MT, Voigt V, Venekamp W. Diagnosis and treatment of levothyroxine pseudomalabsorption. Neth J Med. 2004;62(4):114-8. 3. Ain KB, Refetoff S, Fein HG, Weintraub BD. Pseudomalabsorption of levothyroxine. JAMA. 1991;266(15):2118-20. 4. Kubota S, Fukata S, Matsuzuka F, Kuma K, Miyauchi A. Successful management of a patient with pseudomalabsorption of levothyroxine. Int J Psychiatry Med. 2003;33(2):183-8. 5. Srinivas V, Oyibo SO. Levothyroxine pseudomalabsorption and thyroxine absorption testing with use of high-dose levothyroxine: case report and discussion. Endocr Pract. 2010;16(6):1012-5. 6. Ramadhan A, Tamilia M. Treatment-refractory hypothyroidism. CMAJ. 2012;184(2):205-9. 7. Robertson HM, Narayanaswamy AK, Pereira O, Copland SA, Herriot R, McKinlay AW, et al. Factors contributing to high levothyroxine doses in primary hypothyroidism: an interventional audit of a large community database. Thyroid. 2014;24(12):1765-71. 8. Liwanpo L, Hershman JM. Conditions and drugs interfering with thyroxine absorption. Best Pract Res Clin Endocrinol Metab. 2009;23(6):781-92. 9. Benoit A, Bouquegneau A, Petrossians P, Beckers A. [Malabsorption of thyroid hormones... or simply poor patient compliance?]. Rev Med Liege. 2013;68(3):118-21. 10. Checchi S, Montanaro A, Pasqui L, Ciuoli C, De Palo V, Chiappetta MC, et al. L-thyroxine requirement in patients with autoimmune hypothyroidism and parietal cell antibodies. J Clin Endocrinol Metab. 2008;93(2):465-9. 11. Collins D, Wilcox R, Nathan M, Zubarik R. Celiac disease and hypothyroidism. Am J Med. 2012;125(3):278-82. 12. Sun GE, Pantalone KM, Faiman C, Gupta M, Olansky L, Hatipoglu B. The clinical utility of free thyroxine in oral levothyroxine absorption testing. Endocr Pract. 2014;20(9):925-9. 13. Ogawa D, Otsuka F, Mimura U, Ueno A, Hashimoto H, Kishida M, et al. Pseudomalabsorption of levothyroxine: a case report. Endocr J. 2000;47(1):4550. 14. Pedrosa W, Santana G. [Pseudomalabsorption of levothyroxine: a case report]. Arq Bras Endocrinol Metabol. 2005;49(2):308-13. 15. Samuels MH. Psychiatric and cognitive manifestations of hypothyroidism. Curr Opin Endocrinol Diabetes Obes. 2014;21(5):377-83. 16. Jubiz W, Ramirez M. Effect of vitamin C on the absorption of levothyroxine in patients with hypothyroidism and gastritis. J Clin Endocrinol Metab. 2014;99(6):E1031-4. 17. Green WL. New questions regarding bioequivalence of levothyroxine preparations: a clinician’s response. AAPS J. 2005;7(1):E54-8. 18. Walker JN, Shillo P, Ibbotson V, Vincent A, Karavitaki N, Weetman AP, et al. A thyroxine absorption test followed by weekly thyroxine administration: a method to assess non-adherence to treatment. Eur J Endocrinol. 2013;168(6):913-7. 19. Castellanos R. Altos requerimientos de levotiroxina. Tratado de Tiroides. 2014. Capítulo 9. p 73-77. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 31 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Artículo Original Impacto de los hábitos sobre la mineralización ósea durante la etapa de la juventud Paola Orozco Santos1; John Jairo Duque2; Juan Carlos Lucas3 (Enfermera, MSc Ciencias Biomédicas, Corporación Universitaria Empresarial Alexander von Humboldt) 2 (MD Endocrinólogo, Corporación Universitaria Empresarial Alexander von Humboldt) 3 (Ingeniero Industrial, candidato a Doctor en Ingeniería de Alimentos, Corporación Universitaria Empresarial Alexander von Humboldt) Fecha de recepción: 25/08/2015 Fecha de aceptación: 30/09/2015 1 Resumen L os mayores picos de mineralización se producen en los primeros 2 años de vida y la pubertad, en los que la masa ósea aumenta 40% y 60%; a los 20 años se estabiliza y, luego, se inicia una pérdida progresiva. El volumen de masa ósea es variable según la edad, el sexo y la raza, es afectado por factores ambientales, genéticos, hormonales y nutricionales. El objetivo del estudio fue conocer el impacto de los hábitos relacionados con el proceso de mineralización durante la etapa de la juventud. Los participantes completaron una ficha clínica. La densidad mineral ósea fue valorada por medio de densitometría, se midieron los niveles de calcio en orina para identificar posibles pérdidas, se calculó el índice de masa corporal (IMC) a partir del peso y la talla. El 5% de la población participante presentó un Z-score inferior a -2,0 y los factores relacionados fueron consumo de cafeína, alcohol y poca actividad física. Palabras Clave: mineralización ósea, calcio en huesos, osteoporosis, densidad mineral ósea. Abstract The highest peaks of mineralization is in the first two years of life and puberty, bone mass increases 40% to 60%, at twenty stabilizes and begins a gradual loss. The volume of bone mass varies according to age, sex and race, which affect environmental, genetic, hormonal and nutritional factors. The aim of the study was to determine the impact of the habits related mineralization process during the stage of youth. Participants completed clinical record. BMD was assessed by densitometry; Calcium levels were measured in urine for loss, BMI was calculated from weight and height. 5% of the participating population present a Z-score less than -2,0 and related factors were caffeine, alcohol and little physical activity. Keywords: bone mineralization, calcium in bones, osteoporosis, bone mineral density. 32 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Introducción En condiciones normales, la mineralización del sistema óseo en el humano se inicia durante el tercer trimestre de la gestación y va incrementándose progresivamente durante los primeros 20 años de vida, los mayores picos de mineralización se dan durante los primeros 2 años y en la pubertad, cuando la masa ósea aumenta entre 40% y 60%. A los 20 años el proceso de mineralización se estabiliza y se inicia una pérdida progresiva de masa ósea en los huesos del fémur y la columna lumbar, la cual se estima alrededor de 0,5 y 1% anual; en la mujeres antes y después de la menopausia esta perdida es mayor en comparación con los hombres(1). El volumen de masa ósea es variable según la edad, el sexo y la raza, y puede verse afectado fácilmente por factores ambientales, genéticos, hormonales y nutricionales durante la etapa de formación ósea, ocasionando una baja densidad cuando se llega a la maduración del sistema esquelético aumentando con ello el riesgo de aparición de fracturas osteoporóticas durante la vida adulta(2). La osteoporosis en una enfermedad del sistema óseo generalmente de los adultos, ocasionada por una pérdida progresiva de los depósitos de calcio en los huesos, ocasionando huesos delgados y frágiles, los cuales se fracturan fácilmente y tardan mucho tiempo en repararse(3). Con frecuencia, la osteoporosis se asocia con sarcopenia, una enfermedad que se manifiesta con debilidad muscular, la combinación de sarcopenia y osteoporosis es con frecuencia fatal, ya que aumenta el riesgo de sufrir fracturas de cadera y de columna vertebral, la asociación entre ambas enfermedades se da por factores como el sedentarismo, el poco consumo de proteínas en la dieta y cambios hormonales(4). La osteoporosis también puede ser inducida por consumo de medicamentos como: glucocorticoides, estimulantes de la glándula tiroides y algunos anticoagulantes como la heparina, por enfermedades como: hipertiroidismo, hipotiroidismo, síndrome de Cushing y artritis reumatoide, porque interfieren con el metabolismo del calcio; el consumo de tabaco cafeína y alcohol inducen a pérdida de calcio en orina, y como factor nutricional se asocian a osteoporosis el bajo consumo de alimentos ricos en vitamina D y calcio(3). La importancia clínica de la osteoporosis reside en que, con el tiempo, las fracturas frecuentes causan dolor, limitación física y cambios en el estilo de vida(5). Revista colombiana de Endocrinología Diabetes&Metabolismo La osteoporosis es un problema de salud pública que afecta a 200 millones de personas en el mundo(6), durante el 2012 en Estados Unidos cerca de 4 millones de mujeres y 1 millón de hombres mayores de 50 años fueron diagnosticados con esta enfermedad(3). En México la prevalencia de osteoporosis es de 16% y de densidad mineral ósea (DMO) baja de 57% en mujeres mayores de 50 años(7), de acuerdo con las proyecciones para el año 2050 más del 75% de las fracturas de cadera ocurrirán en Asia y América Latina, como consecuencia del aumento en la esperanza de vida y el mayor número de personas mayores de 65 años(8). La determinación de la DMO mediante densitometría por absorción dual de Rx (DEXA) es la prueba gold estándar para el diagnóstico de la osteoporosis. La Organización Mundial de la Salud (OMS) establece los criterios para interpretar los resultados de densitometría ósea, tomando como base el reporte del T-score o el Z-score (Normal: T-score entre +1 y -1 DE del promedio de población adulta joven, Osteopenia: T-score entre -1 y –2,5 DE del promedio de población adulta joven, Osteoporosis: T-score bajo –2,5 DE del promedio de población adulta joven, Osteoporosis grave: Z-score DMO bajo –2,5 DE del promedio de población adulta joven y una o más fracturas de tipo osteoporótico)(9). Aunque existen dificultades para diagnosticar osteoporosis en mujeres premenopáusicas, niños y hombres menores de 50 años, un dato útil para indicar una baja densidad mineral ósea para edad cronológica es un Z-score inferior a -2,0, porque a este nivel se incrementa el riesgo de fracturas, aunque el pico de masa ósea es alcanzado más temprano en las mujeres que en los hombres, reflejando la temprana complementación de la pubertad, en ambas poblaciones, este pico es alcanzado primero en la cadera, después en la columna y finalmente en el cuerpo total(10,11). En adultos jóvenes que sufren cualquier enfermedad que afecte el metabolismo del calcio, un T-score menor a -2,5 en los huesos de la columna o cadera puede ser considerado para el diagnóstico de la osteoporosis(11). Estudios previos han demostrado que los estilos de vida son una de las principales causas para el desarrollo de osteoporosis en la vida adulta, pero no es muy conocido o no está muy documentado a partir de qué edad puede empezar esa pérdida de masa ósea, antes de la manifestación clínica de la enfermedad, es por esto que el propósito de este estudio fue conocer si los hábitos afectan el proceso de mineralización ósea durante la etapa de la juventud, con el fin de obtener datos objetivos que orienten actividades de promoción de la salud ósea en personas jóvenes y prevención de la osteoporosis durante la vida adulta. Metodología Se realizó un estudio descriptivo-exploratorio, en jóvenes universitarios entre los 18 y 25 años, de la ciudad de Armenia, Volumen 2, número 4, noviembre de 2015 Quindío. El tamaño de la muestra fue calculado de acuerdo con la prevalencia de osteopenia en adultos que es entre 45% y 49% según estudios previos (Clark P, et al., 2009) con un margen de error del 10% y un 95% de confiabilidad n= 98. Los criterios de inclusión fueron: estudiantes universitarios de ambos sexos de 18 a 25 años de edad, sin antecedentes personales de enfermedad sistémica y aceptación voluntaria para participar en el estudio. Los criterios de exclusión fueron: mujeres en estado de embarazo o en periodo de lactancia, índice de masa corporal inferior a 16, antecedentes personales o familiares de enfermedades como hipertiroidismo, hipotiroidismo, cáncer, artritis reumatoide, síndrome de Cushing, insuficiencia renal crónica, diabetes mellitus e hipertensión arterial. La valoración nutricional se hizo a través del IMC, tomando como referencia los parámetros establecidos por la OMS. Los participantes completaron una ficha clínica médica-nutricional con el objeto de evaluar los criterios de inclusión y obtener los datos personales y ginecológicos, antecedentes familiares y personales de enfermedades crónicas, estilos de vida como: fumar, consumo de alcohol, cafeína (café y refrescos de cola) y calcio por medio de un recordatorio de 24 horas, se indagó la realización de actividad física y valoración del IMC a través del peso y la talla, la densidad mineral ósea se obtuvo por medio de densitometría dual de Rx con un densitómetro marca HOLOGIC Explorer QDR*. Para el análisis de los datos se utilizó como referencia el Z-score de columna lumbar L1-L4, se realizó una prueba de tamizaje en orina para identificar pérdidas de calcio. Se realizó un análisis estadístico multivariado, utilizando el paquete estadístico Statgraphics Centurion, se tomaron los datos con p<0,005 para establecer el nivel de significancia. Todos los datos obtenidos quedaron consignados en la ficha, la cual fue guardada y custodiada por los investigadores, cada participante fue identificado por medio de un código, desde el 001 hasta el 100. Esto se hizo con el fin de guardar y respetar la confidencialidad del participante. Resultados Se quiso identificar el estado de la salud ósea de la población en términos de masa ósea, para efectos del análisis la población objetivo se dividió en dos grupos, los cuales se denominaron adultos y pediátricos. El grupo de adultos corresponde a 47 personas entre los 20 y 25 años de edad, cuya ubicación se encuentra en la parte superior de la figura 1 representado por barras de color azul claro; el grupo de pediátricos está conformado por 51 personas con un rango de edad entre los 18 y 20 años y se encuentra ubicado en la parte inferior de la figura 1 representado por las barras de color azul oscuro. El valor mínimo del Z-score para la población adulta fue de -3 y el valor máximo fue de 2; para la población pediátrica el valor mínimo del Z-score fue de -2,6 y el valor máximo de 1,7. La media del Z-score para la población adulta fue de 0,06 y la desviación estándar de 0,97; para la población pediátrica Revista Colombiana de Endocrinología, Diabetes y Metabolismo 33 Revista colombiana Volumen 2, número 4, noviembre de 2015 Figura 1. Representación del Z-score en la población objeto de estudio Figura 3. Secuenciación cronológica del Z-score para población adulta y pediátrica Z-score L1-L4 pediátrico 15 10 Frecuencia 5 0 2,4 1,4 0,4 -0,6 -1,6 -2,6 0 -5 -15 -2,3 -1,3 -0,3 -0,7 Z-score L1-L4 pediátrico -1,7 -2,7 El grupo de adultos corresponde a 47 personas entre los 20 y 25 años de edad, cuya ubicación se encuentra en la parte superior de la figura 1 representado por barras de color azul claro, el grupo de pediátricos está conformado por 51 personas con un rango de edad entre los 18 y 20 años y se encuentra ubicado en la parte inferior de la figura 1 representado por las barras de color azul oscuro. Figura 2. Tendencias de medida central entre las dos categorías de población adulta y pediátrica 10 20 30 40 50 Número de población a estudio 3 2 1 0 -1 -2 -3 0 10 20 30 40 Número de población a estudio 63% Z-score L1-L4 Pediátrico -2 -1 0 1 2 3 Media muestral del Z-score población adulta entre 20 y 25 años y población pediátrica entre 18 y 20 años. Las cifras del Z-score son mayores en la población adulta. la media muestral para el Z-score fue de -0,39 y la desviación estándar de 0,99. Con un intervalo de confianza del 95% y un p-valor inferior a 0,05 se pudo determinar que existe una diferencia estadísticamente significativa entre la media muestral de los dos grupos poblacionales; sin embargo, la diferencia en la desviación estándar no fue estadísticamente significativa (figura 2). En la figura 3 puede observarse que el 5% de la poblacion analizada presentó un Z-Score inferior a – 2,0, de los cuales el 80% fueron hombres entre los 18 y 20 años de edad. Una vez identificados los niveles de masa ósea, se analizaron, en toda la población, los niveles de calcio excretados en orina ocasional, como método de tamizaje para identificar posibles pérdidas. El 63% tuvo niveles de calcio en orina por encima de los valores de referencia, de ellos el 20% correspondió a mujeres (figura 4). Utilizando una regresión lineal simple, esRevista Colombiana de Endocrinología, Diabetes y Metabolismo 50 Población con Z-score inferior a -2,0 distribuidos según edad, población adulta entre 20 y 25 años (1 sujeto) y población pediátrica entre 18 y 20 años (4 sujetos). Aumento de los niveles de calcio en orina -3 60 Figura 4. Pacientes que demuestran aumento de calcio en orina de las dos poblaciones (adulta y pediátrica) Z-score L1L4 34 Z-score L1-L4 -10 -3,3 de Endocrinología Diabetes&Metabolismo SÍ Aumento de los niveles de calcio en orina por género 37% 20% 17% NO Mujeres Hombres Hallazgo de los niveles de calcio elevados en muestra de orina ocasional en gran porcentaje de la población principalmente en mujeres. tadísticamente se logró identificar que no hubo relación entre el Z-score de columna lumbar y los niveles de excreción de calcio en orina ocasional, es decir los niveles de calcio en orina en esta población no afectaron la masa ósea (figura 5). Con el fin de identificar los posibles factores relacionados con la excreción de calcio en orina, se hizo un análisis multivariado, en el que se tuvieron en cuenta variables como edad, sexo y hábitos que pueden interferir con el metabolismo del calcio, encontrándose sólo relación con el sexo, resultado que soporta que la excreción de calcio aumentada fue predominante en las mujeres que hicieron parte de este estudio (figura 6). De acuerdo con los resultados inicialmente descritos, el 5% de la población presentó niveles de densidad mineral ósea por debajo de los parámetros normales. Se hizo un análisis para tratar de identificar si en esta población había relación Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Figura 5. Niveles de calcio en orina espontánea en Z-score ajustado a columna lumbar Gráfico del modelo ajustado Z-score columna lumbar = -0,37936 + 0,012377*Col_19 3 2 Frecuencia 1 0 -1 -2 -3 0 10 20 30 40 50 Niveles de calcio en orina espontánea 60 No se encontró relación directamente proporcional entre el aumento de la excreción de calcio en orina y Z-score de esta población. Figura 6. Correlación entre los niveles de excreción de calcio en orina y factores relacionados con la pérdida de calcio Error Estadístico Estadístico Parámetro Estimación Estándar T Valor-P Constante -11,4588 16,3427 -0,701158 0,4850 Sexo 2,18886 2,35533 0,929323 0,3552 Consume café 1,34651 2,17101 0,620221 0,5367 Fuma 1,74595 2,91714 0,598514 0,5510 Fuma marihuna 4,78368 5,05777 0,945809 0,3468 Consume alcohol -0,845771 2,3355 -0,362137 0,7181 Realiza actividad física 3,59918 2,31478 1,55487 0,1235 Consume vitaminas -0,299213 3,00197 -0,0996722 0,9208 Consume complementos de calcio 3,89024 6,8454 0,5683 0,5713 Gráfico de calcio en orina 60 del consumo de café, consumo de alcohol, realización de actividad física e índice de masa corporal con los niveles de Z-score de columna lumbar inferiores a -2,0. Con respecto al consumo de café se encontró que el 40% de la población con un Z-score inferior a -2,0 manifestaron consumir café regularmente (figura 7). Con respecto al consumo de alcohol se encontró que el 60% de la población con un Z-score inferior a -2,0 manifestaron consumir licor regularmente (figura 8). Con respecto a la realización de actividad física se encontró que el 60% de la población con un Z-score inferior a -2,0 manifestaron no hacer ningún tipo de actividad física regularmente (figura 9), Con respecto al IMC se encontró que el 40% de la población con un Z-score inferior a -2,0 tenía un IMC inferior a 22, un 40% se encontró con un IMC por encima de 25 y el 20% tenía IMC en 23 (figura 10). Figura 7. Consumo de café en los grupos de edad Consumo de café 3,5 3,0 2,5 2,0 1,5 1,0 0,5 0,0 Sí 40% No 60% Relación de la población con niveles de Z-score de columna lumbar inferiores a -2,0 y el consumo de café. Figura 8. Consumo de alcohol en los grupos de edad 4,5 Consumo de alcohol 4,0 50 3,5 40 3,0 30 2,5 20 2,0 1,5 10 1,0 0 0 10 20 30 Producto 40 50 60 Entre ocho factores analizados que pudieran explicar la excreción aumentada de calcio en orina ocasional sólo se encontró relación con el género femenino, análisis explicado por un p-valor inferior a 0,05. 0,5 0,0 Sí 60% No 40% Relación de la población con niveles de Z-score de columna lumbar inferiores a -2,0 y el consumo de Alcohol. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 35 Revista colombiana Volumen 2, número 4, noviembre de 2015 Figura 9. Realización de actividad física en los grupos de edad Actividad física 3,5 3,0 2,5 2,0 1,5 1,0 0,5 0,0 Sí 40% No 60% Relación de la población con niveles de Z-score de columna lumbar inferiores a -2,0 y la realización de actividad física. Figura 10. Relación de la población con niveles de Zscore de columna lumbar inferiores a -2,0 y el índice de masa corporal Gráfico del modelo ajustado Z-score columna lumbar = -0,514883 + 0,0154916* IMC Z-score columna lumbar 3 2 1 0 -1 -2 -3 14 18 22 26 IMC 30 34 38 No hay evidencia en esta población de relación entre niveles de Z-score de columna lumbar inferiores a -2,0 y el índice de masa corporal. de Endocrinología Diabetes&Metabolismo Discusión Para la población participante que presenta un Z-score inferior a -2,0, la densidad mineral ósea baja podría estar relacionada con la edad, el consumo de cafeína, alcohol y la realización de poca actividad física, factores que interfieren con la absorción y el metabolismo del calcio, en ausencia de otros factores de riesgo asociados. Este hallazgo es similar a un estudio realizado en la ciudad de Querétaro, México, el cual fue publicado en el 2013 y que evaluó el impacto de los factores de riesgo en osteoporosis sobre la DMO en mujeres perimenopáusicas(7). Como lo afirma la Bagur Calafat en el artículo “Evolución ontogénica de la masa ósea e influencia de la actividad física sobre el hueso en las diferentes etapas de la vida”, la actividad física es un factor determinante sobre la salud ósea de adultos jóvenes, lo que puede contrastarse con los resultados encontrados en este estudio, donde el 60% de adultos jóvenes con DMO baja manifestaron no realizar ningún tipo de actividad física(1), contrario a lo que reporta el American College of Rheumatology en un artículo de revisión de osteoporosis realizado en el 2012, en este estudio el consumo de cafeína alcohol y tabaco no están relacionados con los altos niveles de calcio en orina(3). Los niveles de calcio en orina de la población sujeto no afectan la densidad mineral ósea, ni producen alteración hemodinámica, lo cual podría explicarse como un hallazgo ocasional y no como una condición patológica(9). Hábitos prevalentes en los estudiantes universitarios como el consumo de alcohol, tabaco, cafeína y la poca actividad física son factores de riesgo para desarrollar osteoporosis en la vida adulta(12). Agradecimientos: A la vicerrectora de investigaciones de la corporación universitaria Alexander von Humboldt.; A la población participante y al semillero de investigación de enfermedades metabólicas del programa de Enfermería CUE AvH. Referencias 1. Caritat Bagur C, Ejercicio físico y masa ósea (I). Evolución ontogénica de la masa ósea e influencia de la actividad física sobre el hueso en las diferentes etapas de la vida. Apunts Med Esport. 2007;42:40-6. - Vol. 42 Núm.153. 2. Heaney RP, Abrams S, Lawson-Hughes B, Looker A, Marcus R, Matkovic V, et al. Peak bone mass. Osteoporos Int. 2000;11: 985-1009. 3. Shreyasee Amin, osteoporosis, 2012 American College of Rheumatology. 4. Balance control in elderly people with osteoporosis Wei-Li Hsu, Chao-Yin Chen, Jau-Yih Tsauo, Rong-Sen Yang Journal of the Formosan Medical Association - 20 March 2014 (10.1016/j.jfma.2014.02.006). 5. Caple C, Schub T, Pravikoff D, Osteoporosis: prevención, CINAHL Nursing Guide, 2011. 6. Schurman L, bagur a, claus-hermberg h, messina o, negri a, mastaglia s, et al. guías 2012 para el diagnóstico, la prevención y el tratamiento de la osteoporosis. (Spanish). Medicina (Buenos Aires) [serial on the Internet]. (2013, Jan), [cited March 28, 2014]; 73(1): 55-74. Available from: MedicLatina. 7. Aguilera-Barreiro M, Rivera-Márquez J, Trujillo-Arriaga H, Ruiz-Acosta J, Rodríguez-García M. Impacto de los factores de riesgo en osteoporosis sobre la densi- 36 Revista Colombiana de Endocrinología, Diabetes y Metabolismo 8. 9. 10. 11. 12. dad mineral ósea en mujeres perimenopáusicas de la Ciudad de Querétaro, México. (Spanish). Archivos Latinoamericanos De Nutrición [serial on the Internet]. (2013, Mar), [cited March 28, 2014]; 63(1): 21-28. Available from: MedicLatina. Strayer DA, Schub T, Pravikoff D, osteoporosis, CINAHL Nursing Guide, November 25, 2011. Kanis JA, Melton LJ III, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res 1994; 9: 1137-1141. Bachrach LK, Hastie T, Wang MC, Narasimhan B, and Hispanick Black and Caucasian youth: a longitudinal study. J Clin Endocrinol Metab 84:4702-4712 2003. S. Ferrari, M. L. Bianchi, J. A. Eisman, Show All (9), Osteoporosis in young adults: pathophysiology, diagnosis, and management, Osteoporosis International, 2012, Page 1. M. Reyes Pérez-Fernández, Raquel Almazán Ortega, José M. Martínez Portela, M. Teresa Alves Pérez, M. Carmen Segura-Iglesias, Román Pérez-Fernández, Hábitos saludables y prevención de la osteoporosis en mujeres perimenopáusicas de un ámbito rural, Gaceta Sanitaria, Volume 28, Issue 2, March–April 2014, Pages 163165, ISSN 0213-9111, http://dx.doi.org/10.1016/j.gaceta.2013.09.006. Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Historia de la Endocrinología Gigantes en la historia William Rojas G. Especialista en Medicina Interna y Endocrinología Universidad del Rosario, Jefe Servicio de Endocrinología Hospital de San José y Profesor Asociado Fundación Universitaria de Ciencias de la Salud L a acromegalia y el gigantismo hipofisiario son entidades de muy baja prevalencia pero a pesar de esto es sorprendente que en la historia de la humanidad hay en todas las épocas, descripciones de casos, sobre todo de gigantismo, que nos muestran que es una entidad que siempre nos ha acompañado. Si revisamos desde cuando existen documentos o relatos sobre la existencia de gigantes, la sorpresa es que están descritos desde los relatos de la Biblia. Según las referencias que aparecen en los libros del Antiguo Testamento, en el Génesis (Génesis 6,1-2) y en el Deuteronomio (Deuteronomio 13,11) se hace referencia a la existencia de gigantes como una raza de seres nacidos de la unión entre hermosas mujeres y ángeles de Dios y se denominan nephilims. Al parecer, parte de la justificación bíblica para el diluvio universal fue que Dios quería acabar con esta raza de gigantes debido a sus orígenes y a sus comportamientos. Posteriormente, otra descripción bíblica que hace referencia a los gigantes es cuando al llegar los israelitas a la tierra de Canaan envían a un grupo por adelantado para observar el tipo de pobladores que había en estas tierras y al regresar estos exploradores relatan la presencia de gigantes que habitan las tierras de Canaan. A pesar de su presencia, los israelitas deciden invadir estos territorios con la convicción de que Dios está con ellos y no permitirá que nada le suceda a su pueblo. Otra referencia de la presencia de gigantes en la Biblia está en la descripción del rey Org, quien al parecer era un gigante debido a que su cama medía 5 metros de largo por 2 metros de ancho. Y más cercano a esto es la descripción de la pelea entre David y el último de los nephilim, Goliath, un guerrero que medía 2,8 metros de alto. Si nos vamos a Oriente, el primer relato en donde se puede asumir la existencia de gigantes se encuentra en la Epopeya de Gilgamesh, escrita en el año 1200 a. C. en la que éste es un rey del cual se decía que medía en codos lo equivalente a 5,6 m de altura, lo que le permitía su arrogancia y comportamiento dominante(1). En la mitología griega son celebres las descripciones de gigantes en La Odisea, con los relatos de los cíclopes dentro de los cuales está Polifemo, y la existencia de los Titanes, dentro de los cuales Prometeo es el más famoso. Con un poco de mezcla entre leyenda y lo que se ha podido encontrar en las excavaciones del antiguo Egipto, el faraón que más se menciona como exponente de acromegalia o gigantismo es Akhenaton I, conocido también como Neferjeperura Amenhotep, Ajenatón, Amenhotep IV o Amenofis IV, fue el décimo faraón de la dinastía XVIII de Egipto. Su reinado fue durante el periodo de 1353-1336 a. C. y perteneció al periodo denominado Nuevo Egipto. A pesar de que Akhenaton tuvo descendencia, todos los libros que hablan sobre acromegalia y gigantismo lo incluyen como un posible caso debido a que las imágenes encontradas sobre él, siempre mostraban una estatura mayor a la de sus congéneres y había desproporción entre su mentón, el tamaño de sus manos y sus pies. Sin embargo, un artículo publicado en la revista Internatiomal Journal of Dermatology describe la enfermedad de Akhenaton como una forma cefalotorácica del síndrome de lipodistrofia progresiva, basándose en la cara alargada con atrofia de la grasa facial, y el patrón corporal de distribución grasa que se ha encontrado en estatuas y bustos de este soberano(2). América no ha sido ajena a estos relatos sobre historias de gigantes. Juan de Torquemada (1615), sostuvo que los primeros habitantes de América habrían sido gigantes y por esto el hallazgo de grandes construcciones y monumentos en la América recién descubierta. También se suman a estos relatos de indígenas gigantes que habitaban lo que hoy corresponde a la Patagonia. En la Nueva Granada también hubo cierto interés por estas historias y se dice que Eloy de Valenzuela, subdirector de la Expedición Botánica tenía en su colección privada múltiples objetos de las culturas indígenas de la Nueva Granada y dentro de estos tenía algunos huesos que provenían del campo de gigantes de Soacha. En 1792 el virrey Ezpeleta, envió a la corte del rey Carlos IV muestras representativas de los pueblos de la Nueva Granada y dentro de lo enviado estaba como emisario el señor Pedro Antonio Cano, un campesino de la jurisdicción de Vélez, Santander, de 21 años, que medía 7 pies 5 pulgadas (aproximadamente 2,20 m). Este hecho generó gran revuelo en España y en América y llegó a ser publicado en los periódicos de la época, Papel Periódico de Santafé de Bogotá y en El Mercurio Peruano y ratificó la creencia de que en América existían gigantes. Su presencia dentro de listados de algunos gigantes famosos es referida en el libro Atlas of CliRevista Colombiana de Endocrinología, Diabetes y Metabolismo 37 Revista colombiana Volumen 2, número 4, noviembre de 2015 Tabla 1. Datos de algunos de los gigantes más antiguos Nombre Año reporte Edad Altura Gigante irlandés (Edmund Malloon) 1698 19 228,5 Gigante irlandés (Gharles Byrne) 1782 21 253 cm Gigante peruano (Pedro A Cani) 1794 21 226 cm Gigante Napolitano 1871 18 215 cm Gigante bávaro (Thomas Hasler) 1878 25 227 cm Gigante de pomerania 1893 19 254 cm Lewis Wilkins 1893 22 245 cm Modificada de Lisser H, Escamilla R, Atlas of Clinical Endocrinology. Ed Mosby Company St Louis 1957, pag 28 (Es de anotar que en la tabla se incluye a Pedro Cani, como el gigante peruano pero cuyo nombre correcto era Pedro Antonio Cano, de Velez, Santander, Colombia) nical Endocrinology en donde se refieren a él como el gigante peruano, Pedro Cani (tabla 1). Posteriores investigaciones particularmente del denominado Campo de Gigantes de Soacha permitieron aclarar que los huesos encontrados no eran humanos sino correspondían a animales prehistóricos de la familia de los mastodontes(3). Lamentablemente, de todos los relatos anteriores no existe ninguna evidencia física de la presencia del gigantismo o la acromegalia en la historia del hombre. Las primeras evidencias sobre la existencia de humanos con gigantismo o acromegalia nos vienen de hallazgos arqueológicos en Grecia y Roma. En Grecia, hacia 1985, unas excavaciones en la meseta central de la acrópolis de Eleutherna permitieron el hallazgo de unos restos óseos de una persona de sexo no determinado, de aproximadamente entre 25 y 35 años, correspondientes al siglo VII a. C. en los que se pudo evidenciar, por el grosor de la corteza de los huesos y los cambios en los fragmentos de huesos del cráneo, silla turca parcial, la presencia de erosión y ensanchamiento sugestivos de un tumor hipofisiario y que sumados a los cambios óseos en otros huesos largos sugieren la presencia de acromegalia(4). Otro hallazgo, esta vez en Roma, fue publicado en la revista Journal of Clinical Endocrinology and Metabolism de 2012, indica que durante excavaciones en la acrópolis de la torre serpentana, correspondiente a la Roma Imperial, siglo III a. C. se encontró un esqueleto completo correspondiente a un hombre de aproximadamente 16 a 20 años de edad, cuya estatura calculada fue de 202 cm. Algunos huesos mostraban aún la evidencia de la existencia de cartílago de crecimiento al momento de la muerte, lo que hace pensar además que este 38 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo hombre sufría de hipogonadismo o, al menos, tenía retardo en el cierre de los cartílagos de crecimiento(5). Con este hallazgo se pudo, por lo tanto, evidenciar que era posible la presencia de acromegalia o gigantismo en la Roma Antigua, lo que da más validez a los relatos sobre Maximus Trax, emperador 235 años a. C. descrito en la literatura como una montaña humana, y las descripciones del emperador Ptolomeo I Soter, quien por las imágenes en las monedas acuñadas en la época presentaba un prognatismo y cambios faciales sugestivos de acromegalia, que se observaron posteriormente en algunos de sus descendientes, lo que haría pensar en una acromegalia familiar. Si nos mantenemos por la línea de figuras del gobierno, encontramos ya en época más reciente la descripción de un soberano desproporcionadamente más alto que los restantes miembros de la corte española, con prognatismo, mala implantación dental, manos y pies grandes, e infertilidad. Gobernó entre 1454 y 1474 y murió de una hemorragia digestiva. Para dar más crédito a los relatos, sus restos fueron analizados por el Dr. Gregorio Marañón, quien llegó a la conclusión de que pertenecían a un eunucoide acromegálico. Se trataba de Enrique IV, conocido como El Impotente(6). Del mismo modo, en la corte francesa de finales del siglo XV se encuentra la descripción de Francisco I como un soberano que medía más de 2 metros, tenía extremidades desproporcionadamente largas que terminaban en manos y pies grandes, nariz larga y mentón prominente, rasgos que eran difíciles de disimular por los pintores de la época(7). Más cerca a nuestros días, encontramos una publicación de Pituitary de 2010 en donde se describe el proceso de cambios en su fisonomía que tuvo el gobernador de Baja California Pío de Jesús Pico, último gobernador mexicano de estos territorios a finales del siglo XVIII. La foto (figura 1) muestra que, durante una época de su vida, tuvo cambios característicos de acromegalia, y que al parecer asociado a un cuadro de cefalea intensa, dichos cambios se estabilizaron y se resolvieron, llegando a fallecer a los 89 años de causas naturales(8). En el arte, una forma indirecta de expresar las vivencias cotidianas, también vemos la presencia de figuras humanas con acromegalia y gigantismo. En el lejano Oriente se encuentra un bajorrelieve indio del siglo II a. C. que muestra la imagen de un hombre con acromegalia a quien le están quitando un diente con la ayuda y fuerza de un elefante(9). Entre las ruinas de los mayas se encontró un bajorrelieve en el que se muestra la imagen de un hombre que está vestido con atuendos típicos y a quien en su fisonomía resaltan los arcos superciliares prominentes, dientes separados y prognatismo, aspectos que no son vistos en la mayoría de las imágenes y pinturas de estos pueblos(10). Tal vez las obras de arte más famosas sobre la fisonomía en la acromegalia están trabajadas por Michelangelo Caravaggio, quien en tres pinturas diferentes sobre la victoria de David Revista colombiana de Endocrinología Diabetes&Metabolismo Figura 1. Cambiso evidentes de acromegalia en manos y cara de Pío de Jesús Pico, gobernador de Baja California Volumen 2, número 4, noviembre de 2015 Figura 2. Nótese el tamaño de las manos y el mentón prominente en esta pintura de Paul Serusier Tomado de Login I., Login J., Governor Pio Pico, the monster of California… no more: lessons in neuroendocrinology. Pituitary 2010;13: 80-86 sobre Goliath (1599, 1607 y 1610) plasmó en la cabeza de Goliath las características típicas del paciente acromegálico. Lo interesante de su obra es que se supone que el personaje que sirvió de modelo para pintar la imagen de David era Francesco Boneri, posiblemente su amante, y se cree que la imagen correspondiente a Goliath era un autorretrato, de donde surge entonces la idea de que Caravaggio tenía acromegalia(11). El pintor Paul Serousier, de la corriente posimpresionista plasmó en su obra Louise ou la servante Bretonne (figura 2) todas las características de una mujer con acromegalia, cuatro años después de la descripción de la enfermedad por Pierre Marie(12). Y en época más reciente, Pablo Picasso, creador del movimiento pictórico Cubismo, pintó la obra Mujer sentada, en 1920 y sorprende ver todos los rasgos de acromegalia que tenía esta mujer, manos y pies grandes, atribuibles al movimiento pictórico, pero además su cara también mostraba prognatismo(13). Finalmente, es importante resaltar las publicaciones que sobre acromegalia han salido de la experiencia médica colombiana. La primera descripción en la época moderna sobre una paciente con acromegalia fue publicada en 1935 en la revista del Instituto Nacional de Radium, posterior Instituto Nacional de Cancerología (figura 3). En este reporte se presenta el caso de una mujer de 25 años con todo el cuadro clínico de acromegalia, quien fue sometida a una trepanación de cráneo para extirpación de hipófisis, pero lamentablemente falleció en el posoperatorio(14). Siete años después encontramos la publicación en la revista Re- Tomado de Pozzilli P Leslie D, Endocrinology and Art, Louise Ou La servante Bretonne J. Endocrinol. Invest. 2003; 26: 1051 Figura 3. Características fenotípicas de acromegalia en la paciente del Instituto Nacional de Radium Tomado de Barbosa G, Wiesner C., Garavito G., Un Caso de acromegalia en el Instituto Nacional de Radium (1935) Revista Colombiana de Cancerologia 2004; 8(2): 52-56. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 39 Revista colombiana Volumen 2, número 4, noviembre de 2015 pertorios de Medicina y Cirugía del Hospital de San José donde el Dr. Laurentino Muñoz hace la descripción de un paciente con acromegalia procedente de Zipaquirá (figura 4)(15). Hay en el mundo personas que se han dedicado a la búsqueda de información sobre la presencia de gigantes y dentro del cuerpo médico posiblemente el Dr. Wouter W. de Herder es una de ellas. Ha escrito múltiples artículos sobre los gigantes en la literatura médica y es quien hace las mejores descripciones de los gigantes importantes en la literatura médica, incluyendo a Robert Pershing Wadlow, conocido como el gigante de Alton, quien nació en 1918 y murió en 1940, con su estatura de 272 cm era, posiblemente, el ser humano más alto de la historia reciente (figura 7)(16). Con la colaboración de Jean Périé y Arjen Figura 4. Paciente con acromegalia presentado por el Dr. Laurentino Muñoz en el Hospital de San José Tomado de Muñoz L., Un caso de acromegalia en Zipaquirá, Repertorios de Medicina y Cirugía 1942;2(12):150-156 Referencias 1. Mitchell S, Conversations, Return of Gilgamesh, Archaeology 2005;58 (3):128. 2. Hoedl S, The disease of Akhenaton . Int J Dermatology 1989; 28(3):201-203. 3. Langebaeck Carl Henrick, Los Herederos del Pasado, Indigenas y pendamiento criollo en Colombia y Venezuela Tomo 1 Ediciones Uniandes Bogota DC., 2009 pags 105-112. 4. Charlier P, Tsigonaki C, A case of acromegaly (Greece, 7th century AD), European Journal of Endocrinology 2011; 165: 819–821. 5. Minozzi S et al, Pituitary Disease from the Past: A Rare Case of Gigantism in Skeletal Remains from the Roman Imperial Age J Clin Endocrinol Metab, 2012;97 (12):4302–4303. 6. Restrepo G, Memoria de la Historia. Historias Clínicas de la Corte de España, Ed Planeta 2000 pags 21-26. 7. Restrepo G. Memoria de la Historia. Historias Clinicas de la Corte de Francia Ed Planeta 1997 pags 94-100. 8. Login I., Login J., Governor Pio Pico, the monster of California…no more: lessons in neuroendocrinology. Pituitary 2010;13: 80-86. 9. Martino E. Endocrinology and Art Drawing of a tooth to a giant.acromegalic 40 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Gnodde editaron un libro, Gigantism & Acromegaly in the 20th Century(17) en donde podemos encontrar fascinantes historias sobre pacientes con estas patologías durante el último siglo. Para los interesados en el tema, Arjen Gnodde tiene una página web (http:www. thetallestman.com) en donde se puede encontrar bastante información sobre la presencia de gigantes en otras actividades como deportes y cine, las cuales, por espacio, no se trataron en este relato. Por ejemplo, en esta página se cita al joven Asdrubal Herrera Mora(18), el colombiano más alto en el momento, que mide 2,28 m (figura 5) y vive en Armenia y a quien conocí personalmente, ya que su médico tratante durante un tiempo fue el Dr. John Jairo Duque, quien lo presentó en una reunión médica sobre acromegalia hace ya algunos años. de Endocrinología Diabetes&Metabolismo Figura 5. Tomado de internet: http// www.thetallestman.com/asdrubalherreramora el día 29 de sep 2015 man J. Endocrinol. Invest. 32: 293, 2009. 10. Toni R et al Endocrinology and Art. Acromegaly and Goiter in the precolumbian mesoamerican population J. Endocrinol. Invest. 2007; 30: 169-170. 11. Faglia G., Endocrinology and Art Was Caravaggio affected with y acromegaly?.J Endocrinol Invest 2011; 34:85. 12. Pozzilli P Leslie D, Endocrinology and Art, Louise Ou La servante Bretonne J. Endocrinol. Invest. 2003; 26: 1051. 13. Guaraldi F, Vannini F., Endocrinology and Art Cubist Portrait of acromegalic woman. J Endocrinol Invest 2013; 36:544. 14. Barbosa G, Wiesner C., Garavito G., Un Caso de acromegalia en el Instituto Nacional de Radium (1935) Revista Colombiana de Cancerologia 2004; 8(2): 52-56. 15. Muñoz L., Un caso de acromegalia en Zipaquira, Repertorios de Medicina y Cirugia 1942;2(12):150-156. 16. W de Herder W Acromegaly and gigantism in the medical literature. Case descriptions in the era before and the early years after the initial publication of Pierre Marie (1886) Pituitary (2009) 12:236–244. 17. De Herder W, Perie J Gnodde A Gigantism and Acromegaly in the 20th century, Published by Ipsen Pharma Boulogne-Billacourt, France. 18. http://www.thetallestman.com/asdrubalherreramora.htm Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 PUBLICIDAD Revista Colombiana de Endocrinología, Diabetes y Metabolismo 41 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Página del Residente Tormenta tiroidea: revisión de dos casos en Hospital de San José, Bogotá William Rojas1 Henry Tovar2 Alejandra Rivera3 Médico Internista, Endocrinólogo, Profesor y Jefe de posgrado de Endocrinología de la Fundación Universitaria de Ciencias de la Salud. 2 Médico Internista, Endocrinólogo, Profesor de Endocrinología Fundación Universitaria de Ciencias de la Salud. 3 Residente de Medicina Interna, Fundación Universitaria de Ciencias de la Salud. 1 Fecha de recepción: 17/07/2015 Fecha de aceptación: 01/10/2015 Introducción L a tormenta tiroidea es una exacerbación aguda de hipertiroidismo que se presenta por una repentina liberación de hormonas tiroideas hacia la circulación sistémica(1). Es una afección potencialmente mortal que requiere tratamiento de emergencia. Se manifiesta por la descompensación de múltiples órganos, que a menudo se desencadena por estrés severo. Es una entidad poco común, con una incidencia reportada de 0,2 casos/100.000 habitantes y tasas de mortalidad alta de 10% a 30%(2). No obstante, el diagnóstico y el tratamiento oportunos pueden modificar ese desenlace al mejorar la supervivencia en los pacientes. Se ha descrito que la intervención temprana puede disminuir la mortalidad al 10% de los casos(3). En ese orden de ideas, es importante dar a conocer dicha patología, su presentación, el enfoque diagnóstico y el manejo oportuno para modificar el desenlace de los pacientes en nuestras instituciones, es el motivo de la presentación de dos casos de tormenta tiroidea en el Hospital de San José en Bogotá. Palabras clave: tormenta tiroidea, tormenta tirotóxica, hipertiroidismo. Caso 1 Paciente de 39 años quien asiste a consulta externa de endocrinología por cuadro clínico de 18 meses de evolución caracterizado por insomnio, caída del cabello, cejas y pestañas, asociado a temblor distal, palpitaciones, diaforesis, pérdida de peso y episodios de diarrea frecuente, además irregularidades del ciclo menstrual y síntomas de depresión con ideación suicida. Presenta exacerbación de los síntomas hace 20 días con aumento de los episodios de palpitaciones. Tiene antecedente de hipertiroidismo hace dos años, manejada inicialmente con metimazol 25 mg/día, propranolol 40 mg cada 12 horas, pero fue cambiado por propiltiouracilo 500 mg/día por exantema 42 Revista Colombiana de Endocrinología, Diabetes y Metabolismo cutáneo. En el momento de la consulta se encontraba taquicárdica con frecuencia cardiaca 149 latidos por minuto, temperatura de 37,6 °C, a la inspección se evidencia aumento de tamaño de glándula tiroides, mucosas húmedas, presenta edema de miembros inferiores sin fóvea y al examen neurológico con taquilalia, taquipsiquia, nerviosismo y agitación. Se tomó hemograma, el cual estaba normal, transaminasas normales, TSH: 0,005, T4 libre: 5,97, por lo que se considera que cursa con tormenta tiroidea con escala de Burch y Wartofsky de 50 puntos (temperatura de 37,6°C: 5 puntos, agitación: 10 puntos, diarrea: 10 puntos, frecuencia cardiaca de 149 lpm: 25 puntos), motivo por el cual se decide hospitalizarla, se inicia manejo con propiltiouracilo 500 mg dosis inicial y continuar a 200 mg cada 4 horas por vía oral, propranolol 80 mg vía oral cada 12 horas y dexametasona 2 mg intravenosos cada 6 horas. Paciente con adecuada evolución clínica, con disminución de la frecuencia cardiaca posterior a siete días de tratamiento, además con mejoría de síntomas neurológicos y normalización de la temperatura. Dada la adecuada respuesta clínica, se dio de alta a la paciente con orden para tratamiento con yodo radiactivo de manera ambulatoria. Caso 2 Paciente de 22 años en estado de embarazo de 37 semanas con antecedente de enfermedad de Graves en manejo con metimazol 5 mg cada 12 horas y propranolol 40 mg día, quien consulta por cuadro clínico de 15 días de evolución caracterizado por diaforesis, diarrea en múltiples ocasiones, nerviosismo, caída del pelo, palpitaciones y disnea. Familiares refieren que ella ha presentado letargia por lo cual consulta al servicio de urgencias de ginecología. Paciente que ingresa con taquicardia de 140 latidos por minuto, temperatura de 37,5 °C, con exoftalmos bilateral de predominio derecho, bocio grado III, piel húmeda y temblor distal, además de letargia. Se toman niveles de TSH: <0,015, T4L: 66,2, con escala de Burch y Wartofsky de 60 puntos (temperatura de 37,5°C: 5 puntos, letargia: 20 puntos, diarrea: 10 puntos, frecuencia cardiaca 140 lpm: 25 puntos), por lo que se confirma diagnóstico de tormenta tiroidea. Se hospitaliza, se confirma bienestar fetal y dado el riesgo actual y el riesgo de efectos deletéreos hacia el feto se decide continuar medicación antitiroidea con metimazol en dosis Revista colombiana de Endocrinología Diabetes&Metabolismo de 1 mg/kg/día. Además se indicó inicio de dexametasona 8 mg intramuscular cada 8 horas durante 3 días para bloquear la conversión de T4 a T3 y mejorar los síntomas de la oftalmopatía, propranolol 40 mg vía oral cada 12 horas. Paciente que durante la hospitalización no evidencia causa aparente de descompensación, tiene adecuada respuesta al tratamiento al cabo de ocho días, con mejoría de sintomatología dada por disminución de episodios de diarrea, mejoría de letargo y disminución de la temperatura. La paciente no inicia trabajo de parto durante la atención, por lo que se decide continuar controles ambulatorios estrictos por endocrinología y ginecología de alto riesgo, quienes programan parto a las 40 semanas y se decide terapia con yodo posterior a periodo de lactancia. Discusión La tormenta tiroidea es una complicación poco frecuente de un trastorno muy común como lo es la tirotoxicosis, la cual puede ser desencadenada por estrés severo y está asociada a una elevada morbimortalidad, con falla multiorgánica potencialmente mortal(2,4). La prevalencia de la enfermedad se ha reportado en 1% en los pacientes hospitalizados por hipertiroidismo, con una incidencia de 0,2/100.000 personas-año representando el 0,22% de todos los pacientes con tirotoxicosis y el 5,4% de los pacientes con tirotoxicosis hospitalizados. Se presenta con mayor frecuencia en las mujeres que en los hombres con una relación 3:1. El pronóstico es desfavorable con una mortalidad del 10%-30% por falla multiorgánica y falla cardiaca principalmente, la cual se reduce con una terapia adecuada si se instaura rápidamente(2,3,5). En Colombia no hay estudios para determinar la frecuencia de esta entidad que, aunque es una complicación rara, es muy importante tenerla en cuenta para dar manejo oportuno a estos pacientes y evitar complicaciones con desenlaces fatales. En la mayoría de los casos, la tormenta tiroidea se produce después de un evento desencadenante. El hipertiroidismo sin tratamiento o con mal control junto con otros factores puede llegar a precipitar una tormenta tiroidea(2,6,7). Los factores desencadenantes se enumeran en la tabla 1. El cuadro clínico característico de tormenta tiroidea no está relacionado con los niveles de hormonas tiroideas. Los pacientes con tormenta tiroidea tienen una mayor cantidad de sitios de unión de catecolaminas que los sujetos con hipertiroidismo que no la desarrollan, al parecer existe una mayor disponibilidad de los receptores adrenérgicos y una reducción del enlace de hormona tiroidea a la globulina de unión a la hormona tiroidea, de tal suerte que la filtración de catecolaminas provocada por un evento agudo o factor desencadenante precipita tormenta tiroidea(3). La tormenta tiroidea se desencadena cuando la capacidad de los mecanismos de compensación termorreguladores, car- Volumen 2, número 4, noviembre de 2015 Tabla 1. Factores precipitantes para tormenta tiroidea • Uso irregular o la interrupción de los fármacos antitiroideos • Infección • Enfermedad cerebrovascular • Cetoacidosis diabética • Ejercicio intenso • Estrés emocional severo • Cardiopatía isquémica • Trauma • Insuficiencia adrenocortical • Cirugía no tiroidea • Administración de medio de contraste yodado • La terapia con yodo radioactivo • Hipertiroidismo facticio • Asociado a interferón o amiodarona • La extracción de los dientes • Otros diovasculares y metabólicos del paciente son superados por el exceso de hormona tiroidea para mantener una situación de equilibrio. Esto puede aparecer con mayor frecuencia en hipertiroidismos de cualquier etiología, entre ellos: la enfermedad de Graves-Basedow, el adenoma tóxico y el bocio multinodular tóxico y con menor frecuencia en carcinomas tiroideos secretores, adenomas hipofisiarios productores de TSH y con el estroma ovárico, además en hipertiroidismo facticio, medicamentos como amiodarona, interferón y tras administración exógena de yodo(8). El diagnóstico clínico es fundamental, ya que los exámenes de laboratorio no muestran diferencias notorias con el resto de pacientes con hipertiroidismo. La presentación clínica consiste en fiebre, taquicardia sinusal con o sin falla cardiaca, incluso fibrilación auricular, síntomas gastrointestinales como náusea, vómito, diarrea y síntomas neurológicos que varían desde confusión hasta coma. Se encuentra TSH suprimida con T4 y T3 elevados(9). Los síntomas de la tormenta tiroidea no son diferentes de un hipertiroidismo no controlado; sin embargo, en un estudio de cohorte Angell T. et al. en EE.UU., 2015, compararon el diagnóstico, las diferencias en la clasificación y otras características clínicas de los pacientes hospitalizados con hipertiroidismo y tormenta tiroidea, y encontraron que la alteración del estado mental fue la única característica clínica significativamente diferente entre las dos entidades y que estos pacientes tenían peores desenlaces en cuanto a mortalidad, mayor estancia hospitalaria y en UCI, además de mayores requerimienRevista Colombiana de Endocrinología, Diabetes y Metabolismo 43 Revista colombiana Volumen 2, número 4, noviembre de 2015 tos de ventilación mecánica, de tal manera que los pacientes con disfunción del sistema nervioso central se benefician de tratamientos más agresivos(10). Los criterios más utilizados para el diagnóstico de tormenta tiroidea son los propuestos por Burch and Wartofsky en 1993 e incluyen: disfunción termorreguladora, compromiso del sistema nervioso central que involucra agitación, delirio, psicosis, estupor y coma, compromiso gastrointestinal, disfunción cardiovascular: taquicardia, arritmias, insuficiencia cardiaca congestiva y factor desencadenante(7,9,11). Los criterios de Burch and Wartofsky, 1993 se encuentran en la tabla 2. Es importante tener en cuenta el diagnóstico clínico, ya que muchos de los pacientes que ingresan a un servicio de urgencias, por cualquiera de las alteraciones mencionadas, no se estudian debidamente, aumentando la morbilidad y mortalidad. En los dos casos presentados, las pacientes tenían puntuaciones en la escala diagnóstica por encima de 45, lo cual confirma la tormenta tiroidea, de manera que se instauró un tratamiento rápido y oportuno con adecuados resultados en ambas pacientes. Los principios del tratamiento van encaminados a reducir el exceso de hormona tiroidea en la sangre y sus efectos nocivos a nivel periférico y se basan en la experiencia clínica y estudios de casos, ya que no existen estudios prospectivos. El tratamiento inicial es la reanimación. Se debe iniciar oxígeno de bajo o alto flujo e incluso ventilación mecánica en caso de hipoxemia severa, además, infusión de cristaloides y corrección hidroelectrolítica tan pronto como sea posible, ya que el estado de hipermetabolismo puede llevar a hipertermia con deshidratación e incluso inestabilidad hemodinámica. Se pueden iniciar antipiréticos con medios físicos pero los salicilatos (por ejemplo aspirina) deben ser evitados, ya que compiten con las hormonas tiroideas por sus transportadores(8). Es muy importante la terapia de apoyo y el tratamiento de los factores precipitantes. Los bloqueadores beta: propranolol 1 - 2 mg intravenoso o 40 a 80 mg por vía oral cada cuatro a seis horas, ajustado según la frecuencia cardiaca y la tensión arterial, bloquea la unión de las catecolaminas a los receptores betaadrenérgicos y, por otro lado, reduce la conversión periférica de T4 a T3(11,12). El esmolol, otra alternativa de tratamiento, es un betabloqueador cardioselectivo de acción corta. Se utiliza dosis de carga de 250 a 500 mcg/kg, seguida de infusión de 50 a 100 mcg/kg por minuto, permitiendo una rápida acción y reducción de efectos adversos sobre todo en pacientes con asma y EPOC(11,13). Para el bloqueo de la síntesis de hormona tiroidea se utilizan las tionamidas con propiltiouracilo a dosis de carga 500 a 1.000 mg y continuar a 250 mg cada 4 horas, este fármaco no sólo bloquea la síntesis de la hormona sino que también bloquea la conversión de T4 a T3. Otro fármaco utilizado es el metimazol en dosis de 60 a 80 mg al día(11). Estos medicamentos también se pueden administrar en forma de supositorio 44 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo Tabla 2. Criterios diagnósticos para tormenta tiroidea Parámetro diagnóstico Puntos Disfunción termorreguladora Temperatura 37,2-37,7 5 37,8-38,3 10 38,4-38,8 15 38,9-39,3 20 39,4-39,9 25 >39,9 30 Compromiso del sistema nervioso central Ausente 0 Leve: agitación 10 Moderado: delirium, psicosis, letargia extrema 20 Severo: convulsiones, coma 30 Compromiso gastrointestinal Ausente 0 Moderado: diarrea, náuseas, vómito, dolor abdominal 10 Severo: ictericia 20 Disfunción cardiovascular Taquicardia 90-109 5 110-119 10 120-129 15 130-139 20 >140 25 Fibrilación auricular Ausente 0 Presente 10 Falla cardiaca congestiva Ausente 0 Leve 5 Moderada 10 Severa 20 Evento precipitante Ausente 0 Presente 10 > 45: Tormenta tiroidea 25 – 44: Sugestivo de tormenta tiroidea < 25: Tormenta tiroidea poco probable Adaptado de Burch and Wartofsky, 1993 Revista colombiana de Endocrinología Diabetes&Metabolismo o enema con preparaciones especiales o preparaciones para administración intravenosa en casos seleccionados. Las soluciones de yodo bloquean la síntesis de hormona y bloquean su liberación, éstas deben ser administradas una hora después de tomar la primera dosis de tionamida con el fin de reducir los niveles de hormona tiroidea causada por la ingesta de gran cantidad de yodo, fenómeno de Wolff - Chaikoff. El más utilizado es yoduro de potasio (Lugol) 5 gotas (0,25 ml o 250 mg) vía oral cada 6 horas, aunque existen otras alternativas, como la presentación endovenosa de yoduro de sodio 500 - 1000 mg al día e intrarrectal. Esto puede ser útil durante las primeras 72 horas, ya que posteriormente puede presentarse un fenómeno de escape o fenómeno de Jod-Basedow en donde ocurre síntesis y liberación de hormonas tiroideas tras su administración, que agravaría el hipertiroidismo(3,4,8,11). El ácido Iopanoico es un agente de contraste yodado que podría llegar a ser útil en el manejo, con una dosis de 1 g endovenoso cada 8 horas durante las primeras 24 horas y continuar a 500 mg dos veces al día(12). Como alternativa al yodo inorgánico se puede utilizar carbonato de litio 300 mg cada 6 u 8 horas, el cual inhibe la proteólisis de coloide, limitando la liberación de hormona tiroidea preformada al torrente sanguíneo(3). Los glucocorticoides son utilizados para bloquear la conversión de T4 a T3 y como profilaxis para la insuficiencia adrenal relativa que coexiste con la tirotoxicosis. El más utilizado es la hidrocortisona dosis de carga 300 mg intravenosa y continuar a 100 mg cada 8 horas y como medicamento alternativo la dexametasona 2 mg IV cada 6 horas(8,11,12). La colestiramina 4 g vía oral cada 6 a 12 horas puede ser útil debido a la reducción de la reabsorción de la hormona tiroidea metabolizada desde la circulación enterohepática(12). La tiroidectomía se realiza en aquellos pacientes con disfunción de órganos, refractaria al tratamiento o cuando se presenta toxicidad con las tionamidas; sin embargo, los criterios para decidir la cirugía y el momento en el cual se debe realizar no se han estudiado con detalle. A pesar de esto, se han encontrado tasas de mortalidad global para pacientes sometidos a tiroidectomía en tormenta tiroidea con enfermedad de Graves del 10%, asociadas con un riesgo de exacerbación de la tormenta si los niveles de hormonas tiroideas preoperatoria son altos(14). El yodo radiactivo no es un tratamiento recomendado en tormenta tiroidea, ya que puede agravar la situación con exacerbación de los síntomas e incluso puede ser un desencadenante de tormenta tiroidea, esto se debe a una tiroiditis por radiación con destrucción de folículos tiroideos y liberación de cantidades elevadas de hormonas tiroideas y tiroglobulina a la circulación(15,16). Volumen 2, número 4, noviembre de 2015 Otras terapias alternativas como la plasmaféresis se han utilizado cuando el tratamiento tradicional no ha tenido éxito y como preparación para tiroidectomía. La plasmaféresis elimina citocinas, anticuerpos y hormonas tiroideas del plasma. Es el método más rápido para mejorar la condición clínica del paciente y puede ser empleado cuando hay síntomas neurológicos o cardiovasculares que amenacen la vida sin esperar el efecto de los medicamentos antitiroideos(17). El segundo caso presentado se trata de una mujer en estado de embarazo a quien se le inicia manejo para tormenta tiroidea con adecuada respuesta clínica y sin complicaciones obstétricas. La tormenta tiroidea se presenta con baja frecuencia, constituyendo un riesgo para la madre y el feto con efectos deletéreos como: hipertensión, falla cardiaca y preeclampsia en mujeres embarazadas, además abortos, parto pretérmino, desprendimiento de la placenta y efectos en el feto como: taquicardia fetal, cardiomegalia, hidropesía, edad ósea avanzada, restricción del crecimiento intrauterino y mortinato. No se ha asociado el embarazo como factor desencadenante de tormenta tiroidea, por lo que es necesario buscar factores precipitantes. Se debe iniciar terapia con antitiroideos de los cuales se recomienda en el primer trimestre propiltiouracilo, ya que su uso no está asociado con anomalías congénitas o metimazol en el caso de la alergia a propiltiouracilo. En el segundo y tercer trimestre se prefiere el uso de metimazol debido a la posible hepatotoxicidad que se puede presentar con propiltiouracilo. La cirugía está indicada en el segundo trimestre en el caso de reacciones adversas severas a los antitiroideos, cuando no hay respuesta al manejo. La terapia con yodo radiactivo está prohibida en el embarazo(18). Las mujeres que requieren tratamiento antitiroideo después del parto pueden continuar, incluso durante la lactancia, con las dosis más bajas toleradas (hasta 30 mg metimazol o 150 mg propiltiouracilo)(19,20). Conclusión La tormenta tiroidea es una complicación rara de una enfermedad relativamente frecuente como es el hipertiroidismo, con altas tasas de mortalidad y cuyo diagnóstico se basa en el juicio clínico, por lo que se deben aplicar los criterios diagnósticos para hacer un tratamiento oportuno basado en el bloqueo inmediato de la síntesis de la hormona, evitar la liberación y tratamiento de los efectos periféricos, así como la búsqueda y tratamiento de los factores desencadenantes, de manera que se pueda llegar a reducir los desenlaces mortales y disminuir la estancia hospitalaria en piso y en UCI. En Colombia faltan estudios para determinar la verdadera frecuencia de la enfermedad que, aunque es rara, debe ser tenida en cuenta en los servicios de urgencias para evitar efectos deletéreos en los pacientes. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 45 Revista colombiana Volumen 2, número 4, noviembre de 2015 Referencias 1. Parasa M, Chinthakunta BK, Vemuri NN, Shaik MS. Out of the blue! Thyroid crisis. Anesthesia, essays and researches. 2015;9(1):130-2. 2. Akamizu T, Satoh T, Isozaki O, Suzuki A, Wakino S, Iburi T, et al. Diagnostic criteria, clinical features, and incidence of thyroid storm based on nationwide surveys. Thyroid : official journal of the American Thyroid Association. 2012;22(7):661-79. 3. Papi G, Corsello SM, Pontecorvi A. Clinical concepts on thyroid emergencies. Frontiers in endocrinology. 2014;5:102. 4. Rojas G W. Urgencias en tiroides: tormenta tiroidea y coma mixedematoso. En: Ardila A E, Barbosa M J, Dorado P L, et al, editores. Fascículo alteraciones endocrinas en urgencias. Bogotá: Producciones Científicas Ltda; 2012. p. 53 - 62. 5. Almanzar A., Mora L, Valderrama L, Barón G. Serie de casos: tirotoxicosis y tormenta tiroidea. Dovela científica (internet). 2011 (citado 09 Jul 2015); 1 (4): 1-8. Disponible en: http://www.hospitaloccidentekennedy.gov.co/ archivos/File/Dovela_Vol_1_No_/Casos_clinicos.html. 6. Hampton J. Thyroid gland disorder emergencies: thyroid storm and myxedema coma. AACN advanced critical care. 2013;24(3):325-32. 7. Burch HB, Wartofsky L. Life-threatening thyrotoxicosis. Thyroid storm. Endocrinology and metabolism clinics of North America. 1993;22(2):263-77. 8. Rámiz M., Gutiérrez A., De la Guerra C. et al. Crisis tirotóxica (tormenta tiroidea). A propósito de dos observaciones. Gac Med Bilbao. 2010;107(2):6467. 9. Klubo-Gwiezdzinska J, Wartofsky L. Thyroid emergencies. The Medical clinics of North America. 2012;96(2):385-403. 10. Angell TE, Lechner MG, Nguyen CT, Salvato VL, Nicoloff JT, LoPresti JS. Clinical features and hospital outcomes in thyroid storm: a retrospective cohort study. The Journal of clinical endocrinology and metabolism. 2015;100(2):451-9. 46 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo 11. Bahn Chair RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Thyroid : official journal of the American Thyroid Association. 2011;21(6):593-646. 12. Carroll R, Matfin G. Endocrine and metabolic emergencies: thyroid storm. Therapeutic advances in endocrinology and metabolism. 2010;1(3):139-45. 13. Duggal J, Singh S, Kuchinic P, Butler P, Arora R. Utility of esmolol in thyroid crisis. The Canadian journal of clinical pharmacology = Journal canadien de pharmacologie clinique. 2006;13(3):e292-5. 14. Uchida N, Suda T, Ishiguro K. Thyroidectomy in a patient with thyroid storm: report of a case. Surgery today. 2015;45(1):110-4. 15. Aulet RM, Wein RO, Siegel RD. Surgical management of an atypical presentation of a thyroid storm. International journal of endocrinology and metabolism. 2014;12(2):e13539. 16. Ahumada J.J. Terapia del hipertiroidismo. Acta Medica Colombiana Vol. 13 No. 1 (Enero-Febrero) 1988. 17. Muller C, Perrin P, Faller B, Richter S, Chantrel F. Role of plasma exchange in the thyroid storm. Therapeutic apheresis and dialysis : official peer-reviewed journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 2011;15(6):522-31. 18. Yoshihara A, Noh J, Yamaguchi T, Ohye H, Sato S, Sekiya K, et al. Treatment of graves’ disease with antithyroid drugs in the first trimester of pregnancy and the prevalence of congenital malformation. The Journal of clinical endocrinology and metabolism. 2012;97(7):2396-403. 19. Glinoer D. The systematic screening and management of hypothyroidism and hyperthyroidism during pregnancy. Trends in endocrinology and metabolism: TEM. 1998;9(10):403-11. 20. Restrepo O. Hipertiroidismo durante el embarazo: enfoque y manejo. Revista Colombiana de Obstetricia y Ginecología Vol. 52 No. 3 - 2001. Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Casos Clínicos Parestesia lingual: un síntoma poco común de hipoglucemia Alvaro Muriel1, Nicole Chamorro2, Alin Abreu3, William Jubiz H4. Residente de Medicina Interna, Universidad Libre, Codirector del grupo de investigación GIMI1 (grupo interinstitucional de medicina interna 1) 2 Estudiante de pregrado, Universidad Libre, Semillero de investigación, grupo de investigación GIMI1 (grupo interinstitucional de medicina interna 1) 3 Profesor de Medicina Interna, Universidad Libre. 4 Profesor de Medicina Interna, Universidad Libre y Director, Centro de Endocrinología, Metabolismo y Diabetes, Cali Fecha de recepción: 01/05/2015 Fecha de aceptación: 25/06/2015 1 Resumen Presentamos una mujer de 42 años quien consultó por parestesia lingual y ganancia de 10 Kg de peso, sin síntomas clásicos de hipoglucemia, a quién se le encontró una glucemia en ayunas de 46 mg/dl (2,6 mmol/L) con insulina y péptido C concomitantes de 10,2 µU/ml (73,2 pmol/L) y 2,14 ng/dl (79,2 nmol/L) respectivamente. Hallazgos similares fueron encontrados en una segunda ocasión. La resonancia magnética del páncreas mostró una lesión de 1,7 x 1,3 cm dependiente del reborde superior del cuerpo, la cual fue extirpada vía laparoscopia. Patología reveló un tumor neuroendocrino con inmunohistoquímica positiva para insulina, cromogranina y sinaptofisina. La parestesia lingual desapareció y la glucosa se normalizó. La tríada de Whipple no siempre está presente en pacientes con hipoglucemia, mientras que la parestesia lingual debe considerarse para la evaluación de estos pacientes. Palabras clave: parestesia lingual, hipoglucemia, insulinoma. Abstract We report on a 42 years old female who consulted because of lingual paresthesia and 10 kg weight gain but without classic symptoms of hypoglycemia, who had a fasting blood glucose of 46 mg/dl (2.6 mmol/L) with a concomitant insulin a C-peptide of 10.2 µU/ml (73.2 pmol/L) and 2.14 ng/dl (79.2 nmol/L) respectively. Similar findings were obtained on a second occasion. Magnetic resonance of the pancreas revealed a 1.7 x 1.3 cm lesion dependent of the superior border of the body which was removed by laparoscopy. Pathology showed a neuroendocrine tumor with positive immmu- nohistochemistry for insulin, chromogranin and synaptophysin. Lingual paresthesia disappeared and blood glucose was normalized. Patients with lingual paresthesia should be evaluated for hypoglycemia even in the absent of a classic Whipple triad. Introducción La triada propuesta por Whipple en 1938(1) está constituida por síntomas adrenérgicos o neuroglucopénicos, asociados a un descenso en la glucosa sanguínea por debajo de lo normal y normalización de los anteriores con la administración de glucosa. Se ha sugerido que la triada esté presente para sospechar la presencia de hipoglucemia. Presentamos una paciente en quien la parestesia lingual como causa de consulta fue la clave para el diagnóstico de insulinoma, extirpación de la lesión y desaparición de los síntomas. Presentación del caso Se trata de una mujer de 42 años quien consultó por parestesia lingual y en la región peribucal, parestesias de manos, somnolencia y ganancia de 10 Kg de peso. El índice de masa corporal (IMC) era de 30 y una glucemia ocasional estaba en 61 mg/dl (3,4 mmol/L). El examen físico, incluyendo signos vitales, no mostraba alteraciones. Fue hospitalizada para evaluación de posible hipoglucemia. La prueba de ayuno fue suspendida a las 14 horas por la aparición de los síntomas antes mencionados y las mediciones en sangre mostraron una glucosa de 46 mg/dl (2,6 mmol/L), insulina 10,2 µU/ml (73,2 pmol/L), péptido C de 2,14 ng/dl (79,2 nmol/L) y relación insulina/glucosa de 0,22. La prueba fue repetida con hallazgos similares: Glucosa 47 mg/dl (2,6 mmol/L), insulina 14,1 µU/ml (101,2 mmol/L), péptido C 2,14 ng/dl (79,2 nmol/L) y relación insulina/glucosa de 0,3. La resonancia magnética nuclear de abdomen mostró una lesión de 1,7 x 1,3 cm dependiente del borde superior del cuerpo del páncreas con las características de insulinoma (figura 1). La exploración pancreática por vía laparoscopia reveló un tumor de 2,0 cm, el cual fue extirpado (figura 2). La inmunohistoquímica del tumor fue positiva para insulina, cromogranina y sinaptofisina (figura 3). Los síntomas que motivaron la consulta de la paciente desaparecieron el día siguiente de la cirugía y la glucosa se mantuvo en 85 mg/dl (4,7mmol/L). Revista Colombiana de Endocrinología, Diabetes y Metabolismo 47 Revista colombiana Volumen 2, número 4, noviembre de 2015 Figura 1. Resonancia magnética de la lesión pancreática demostrada por la flecha Figura 2. Tumor de 2,0 cm, el cual fue extirpado Figura 3. Inmunohistoquímica del tumor pancreático demostrando reacción para insulina de Endocrinología Diabetes&Metabolismo Discusión Nuestra paciente representa una de las dificultades que se encuentra en el diagnóstico de hipoglucemia. No es común pensar en hipoglucemia cuando un paciente consulta por parestesia lingual. En la serie más grande de casos de la Clínica Mayo ni siquiera se menciona como una manifestación de hipoglucemia(2,3). Cabe destacar que, aunque las parestesias linguales no son patognomónicas de la hipoglucemia, se ha evidenciado en otros reportes de casos precisamente en pacientes de sexo femenino quienes refirieron días antes de su consulta esta manifestación(4). Lo que sí es común es la ganancia de peso como lo demuestra nuestra paciente. El insulinoma es una verdadera causa de obesidad endocrina, la cual se debe al aumento en el consumo de alimentos para aliviar los síntomas de hipoglucemia en presencia del exceso de insulina, la cual promueve la lipogénesis. Es difícil decidir cuándo evaluar pacientes para diagnosticar la presencia de tumores pancreáticos secretores de insulina. En primer lugar hay dudas sobre la definición de hipoglucemia ya que niveles de hasta 30 mg/dl han sido informados en personas normales(5). Por otro lado, no hay acuerdo en cuanto a los criterios para sospechar hipoglucemia. Placzkowski y colaboradores(3) han sugerido valores de glucosa de 40 mg/ dl con insulina plasmática > 6 µU/ml y péptido C > 6 ng/dl para establecer el diagnóstico, mientras que la guía de práctica clínica de la Sociedad de Endocrinología de los Estados Unidos sugiere una glucosa < 55 mg/dl (3,0 nmol/L) con insulina >3,0 µU/ml (18 pmol/L) y péptido C >0,9 ng/ml (0,2 nmol/L) para establecer el diagnóstico de insulinoma6. Utilizando los criterios de la Clínica Mayo en nuestro paciente no hubiéramos hecho el diagnóstico correcto, mientras que con los criterios de la Sociedad de Endocrinología de EE.UU. sí hubiéramos acertado. La relación de glucosa/insulina mayor de 0,3 ha sido sugerida como característica de insulinoma(2) pero en nuestro paciente los valores estuvieron por debajo de esa cifra. Agradecimientos: Los autores agradecen a los doctores María Victoria Pérez por su participación en la extirpación del tumor y Harold Cuello quién realizó la inmunohistoquímica del tumor. Referencias 1. Whipple. J InternatChir. 1938; 3: 237-276. 2. Cryer P 2001. The prevention and correction of hypoglycemia. In: Jefferson L, Cherrington A, Goodman H eds Handbook of Physiology ; Section7, the endocrine system. Volume 2. The endocrine pancreas and regulation of metabolism. New York : Oxford University Press; 1057-1092. 3. Service FJ, Dale AJ, Elveback LR et al. Insulinoma. Clinical and diagnostic features of 60 consecutive cases. Mayo Clinic proc 1976 Jul; 51(7): 417-429. 4. Jácome Roca A, Espinosa H, Echeverry G, Escallón A, Baena M. Insulinoma, demostración de hiperinsulinismo y localización preoperatoria: Manejo Quirurgico. Univmed 1983; 25 (1): 28-35. 5. Placzkowski KA, Vella A, Thompson GB et al. Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 19872007. J ClinEndocrinolMetab 2009 Apr; 94(4): 1069-1073. 6. Cryer PE, Axelrod L, Grossman AB et al. Evaluation and management of adult hypoglycemic disorders: an Endocrine Society Clinical Practice Guideline. J ClinEndocrinolMetab 2009 Mar; 94(3): 709-728. 48 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Casos Clínicos Hipotiroidismo primario, déficit de vitamina B12 y tiroiditis subaguda sobreagregada: informe de caso Carlos Alfonso Builes Barrera1, María Gabriela García Orjuela2 Médico especialista en Endocrinología. Endocrinólogo de Adultos Hospital Universitario San Vicente Fundación. Docente de la sección de Endocrinología de la Universidad de Antioquia. Miembro de Número Asociación Colombiana de Endocrinología. 2 Residente de Toxicología. Universidad de Antioquia Contacto: [email protected] Fecha de recepción: 30/07/2015 Fecha de aceptación: 31/08/2015 1 Resumen El hipotiroidismo primario es la patología tiroidea más frecuente. El manejo estándar de esta enfermedad es con levotiroxina, cuya absorción puede verse afectada por distintas condiciones médicas, medicamentos e incluso la dieta del paciente. Los requerimientos de levotiroxina podrían variar debido a factores sobre agregados como la tiroiditis subaguda, la deficiencia de vitamina B12 y el uso de medicamentos, elementos que afectan el control del hipotiroidismo. Se presenta el caso de una paciente con hipotiroidismo primario con necesidad de ajuste en la dosis de levotiroxina a través del tiempo debido a comorbilidades agregadas. Se presentan claves para la evaluación del paciente con dificultad para lograr una TSH dentro del rango normal. Palabras clave: levotiroxina, tiroiditis, hipotiroidismo, interacciones de comida y medicamentos. Abstract Hypothyroidism is the most common thyroid disease. This disease is managed with hormonal replacement therapy using levothyroxine, whose absorption can be affected by various medical conditions, drugs and even patient´s diet. Levothyroxine requirements could vary according to co-morbidities such as subacute thyroiditis, vitamin B12 deficiency and the use of drugs, factors that can affect the control of hypothyroidism. The case of a patient with primary hypothyroidism who required dose adjustments of levothyroxine over time due to added comorbidities is presented. Clues are given for evaluation of the patient with difficulty in achieving maintenance of TSH within the normal range. Key words: levothyroxine, thyroiditis, hypothyroidism, fooddrug interactions. Caso clínico Paciente de 26 años, sexo femenino, con diagnóstico de hipotiroidismo primario desde los 8 años de edad, desde entonces recibe suplencia con levotiroxina sódica. Fue evaluada por primera vez en nuestro servicio en el año 2008, con TSH en ese momento de 0,54 mUI/L (0,25 – 5) y T4 libre 13,39 ng/ dL (9 – 20), pero con niveles siete meses antes de TSH en 60 UI/L, T4 libre 3,37 ng/dL (9 - 20) (tabla 1), con ecografía de tiroides que reportó lóbulo derecho de 33x16x15 mm (volumen de 4,11 cc), lóbulo izquierdo de 33x14x16 mm (volumen de 3,84 cc), ecogenicidad heterogénea, de predominio hipoecoica, y contornos irregulares. La paciente en ese momento refería que recientemente su aseguradora le había modificado la marca de la levotiroxina que venía recibiendo, por lo que se decidió ordenar tratamiento con Eutirox®, insistiendo en la importancia de continuar su control con la misma presentación todo el tiempo. En la revisión posterior, nueve meses después a la inicial, se encontró una TSH aún más baja (TSH 0,08 UI/mL (0,4 – 4,6), T4 libre 1,79 ng/dL) asociada a niveles disminuidos de ferritina y vitamina B12 (ferritina 5,37 ng/mL (30 – 300), vitamina B12 192 pg/mL (240 – 900)) (tabla 2), con pobre consumo en la dieta debido a que la paciente refiere ser vegetariana. Además, se documentó presencia de anticuerpos positivos contra la células parietales (niveles 1:20). Por esta razón se redujo la dosis de la levotiroxina (Eutirox®), y se inició reposición de hierro con sulfato ferroso y con esquema semanal, y posteriormente, mensual de 1 mg muscular de vitamina B12 (cianocobalamina), con lo cual se logró normalización de los niveles (tabla 2). Durante el 2014, luego de haber mantenido previamente dos controles con TSH dentro del rango normal recibiendo 600 µg/semana de levotiroxina y sin modificar la dosis o iniciar alguna medicina se documentó TSH de 0,016 UI/mL (0,35 – 5,5) y T4 libre de 1,99 ng/dL (0,89 – 1.76), asociado a la presencia de dolor en el cuello, irradiado a oídos y dientes en las semanas previas, por lo que el médico general le redujo la dosis a 50 µg/día, pasando de una dosis semanal de 600 µg a 350 µg (tabla 1). En su control con endocrinólogo, luego de más de 12 semanas con la dosis de 50 µg/día presenta TSH en 72,3 UI/mL (0,35 – 5,5) y T4 libre 0,82 ng/dL (0,89 – 1,7), por lo que se consideró tiroiditis subaguda sobreagregada en fase Revista Colombiana de Endocrinología, Diabetes y Metabolismo 49 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Tabla 1. Evolución de la función tiroidea y dosis de levotiroxina TSH (UI/mL) Valores referencia (UI/mL) T4 libre Valores de referencia Dosis levotiroxina diaria Dosis acumulada semanal Junio 2007 60 0,25 – 5,0 3,37 pmol/L 9 – 20 pmol/L Dosis de 100 µg/día y 50 µg/día intercaladas (levotiroxina) 550 µg Enero 2008 0,54 0,25 – 5,0 13,39 pmol/L 9 – 20 pmol/L 100 µg/día (levotiroxina) 700 µg Octubre 2008 0,08 0,4 – 4,6 1,79 ng/dL 0,9 – 1,7 ng/dL 100 µg/día lunes a sábado (Eutirox®) 600 µg Junio 2013 0,75 0,27 – 4,2 100 µg/día lunes a sábado (Eutirox®) 600 µg Noviembre 2013 4,51 0,27 – 4,2 100 µg/día lunes a sábado (Eutirox®) 600 µg Septiembre 2014 0,016 0,35 – 5,5 1,99 ng/dL 0,89 – 1,76 ng/dL 100 µg/día lunes a sábado (Eutirox®) 600 µg Noviembre 2014 72,3 0,35 – 5,5 0,82 ng/dL 0,89 – 1,7 ng/dL 50 µg/día (Eutirox®) 350 µg Junio 2015 0,87 0,35 – 5,5 1,36 ng/dL 0,89 – 1,7 ng/dL 100 µg/día lunes a viernes, 50 µg sábado (Eutirox®) 550 µg Fecha Tabla 2. Valores vitamina B12 y ferritina Fecha Vitamina B12 (Pg/ml) Valores referencia Ferritina (ng/dL) Valores referencia (ng/dL) Octubre 2008 192 240 – 900 5.37 30 – 300 Enero 2013 544 240 – 900 37 30 – 300 Noviembre 2013 897 240 – 900 29 30 – 300 Septiembre 2014 564 240 – 900 de recuperación o de hipotiroidismo sobre hipotiroidismo primario conocido desde los 8 años y con necesidades claras de suplencia con levotiroxina que tuvo reducción en su dosis cercana al 45%. Durante la última evaluación de la paciente, en julio del 2015, se encontró eutiroidea con TSH de 0,87 UI/mL (0,35 – 5,5) y T4 libre 1,36 ng/dL (0,8 – 1,7) de junio 2015, consumiendo levotiroxina (Eutirox®) 100 µg de lunes a viernes y 50 µg los sábados, descansando domingos, en ayunas, con un vaso completo con agua y una hora antes de desayunar. Discusión El hipotiroidismo es una condición frecuente, secundaria a la escasa producción de hormonas tiroideas o a la inadecuada acción de dichas hormonas en sus tejidos blanco. Se encuentra con mayor frecuencia en mujeres, ancianos y ciertos grupos raciales, presentándose como hipotiroidismo clínico o subclí50 Revista Colombiana de Endocrinología, Diabetes y Metabolismo nico. Se habla de hipotiroidismo clínico al encontrar niveles de TSH elevados asociados a niveles de T4 libre disminuido en pacientes con los signos y síntomas de la hipofunción tiroidea. El hipotiroidismo subclínico es considerado básicamente una alteración bioquímica en la cual la TSH está elevada pero los niveles de T4 libre permanecen en rango normal en pacientes asintomáticos(1) . En pacientes con hipotiroidismo primario el tratamiento es el remplazo de la hormona tiroidea vía oral con levo tiroxina sintética(1). La principal causa de hipotiroidismo es la tiroiditis de Hashimoto o tiroiditis linfocítica crónica, la cual afecta principalmente a mujeres de edad media, y que típicamente es no dolorosa y que puede ser con forma bociógena o atrófica. Excepcionalmente se han descrito casos de tiroiditis de Hashimoto dolorosas con presentación semejante a una tiroiditis subaguda(2,3). En pacientes con hipotiroidismo y algo de producción residual de hormona tiroidea puede sobreagregarse un evento Revista colombiana de Endocrinología Diabetes&Metabolismo de tiroiditis que puede ser silente, como sucede en el periodo posparto, o subaguda en pacientes con hipotiroidismo primario en cualquier momento del curso de la enfermedad. Los síntomas de la forma subaguda son la presencia de bocio o formación nodular tiroidea de rápida aparición, dolor en la región anterior del cuello localizado o irradiado al oído y dientes y síntomas sistémicos de la tirotoxicosis. La tiroiditis subaguda suele estar precedida por infecciones virales, principalmente del tracto respiratorio superior, considerándose la ocurrencia posterior de reacciones autoinmunes, asociada frecuentemente a HLA-Bw35(4). Los síntomas generalmente se deben a la liberación inicial por parte del tejido inflamado de hormonas tiroideas preformadas, lo que genera una fase de tirotoxicosis, con una disminución posterior en la circulación de dichas hormonas, generando la fase hipotiroidea con posterior recuperación en la gran mayoría de los casos(4). Su diagnóstico es principalmente clínico, con TSH suprimida y elevación de las hormonas circulantes, especialmente de la T4, con elevación de marcadores inflamatorios como la velocidad de sedimentación. Aunque puede presentar anticuerpos antiperoxidasa y antitiroglobulina positivos, ellos están en títulos bajos, lo que contrasta con los títulos elevados de la enfermedad autoinmune tiroidea tipo Hashimoto. En la tiroiditis subaguda, la ecografía tiroidea típicamente muestra un patrón hipoecoico heterogéneo con disminución del flujo sanguíneo(4), opuesto al patrón de hiperflujo vascular generalizado de los pacientes con hipertiroidismo primario por enfermedad de Graves. Generalmente los pacientes con tiroiditis subaguda sólo requieren uso de betabloqueadores para el manejo sintomático de las manifestaciones adrenérgicas de tirotoxicosis. En casos de formas dolorosas pueden requerir uso de antinflamatorios por vía oral durante periodos cortos, generalmente menos de una semana. En caso de no haber mejoría con estos, puede recurrirse a ciclos cortos de esteroides, tipo prednisolona en dosis de 0,5 mg/kg/día con descenso lento entre 4 a 6 semanas. Se considera que hay una mejoría espontánea en el 90% de los pacientes con tiroiditis subaguda, mientras que el 10% restante desarrolla hipotiroidismo definitivo(4). Nuestra paciente presentaba desde el inicio bocio difuso, asintomático, con cambios en la ecogenicidad y ecoestructura y TSH elevada, hallazgos característicos de tiroiditis crónica autoinmune (tiroiditis de Hashimoto). El evento que presentó de dolor en cuello irradiado a oídos y dientes, asociado a síntomas sistémicos, supresión de TSH y elevación de niveles circulantes de T4 libre sin haber incrementado la dosis consumida de levotiroxina apoyan el diagnóstico de tiroiditis subaguda asociada a hipotiroidismo primario preexistente. El reconocimiento de esto es esencial para los ajustes de la suplencia de la hormona tiroidea, pues la reducción o suspensión de la levotiroxina por varias semanas producirá un rápido viraje hacia hipotiroidismo como sucedió con la paciente. Se recomienda Volumen 2, número 4, noviembre de 2015 suspender la suplencia de levotiroxina durante una semana y reiniciar con un 80% a 85% de la dosis previa usada y control de TSH y T4 libre entre 6 a 8 semanas después para evaluar el comportamiento de las pruebas de función tiroidea. Dentro del tratamiento del hipotiroidismo se encuentra como principal terapia la suplencia con levotiroxina sódica, que es una preparación sintética de sales sódicas de isómeros naturales de hormonas tiroideas, siendo bioquímica y fisiológicamente idéntica a la hormona natural, la cual se encuentra disponible tanto en tabletas como polvo liofilizado, para administración oral e intravenosa, respectivamente(5,6). La dosis promedio de sustitución requerida es de aproximadamente 1,6 µg/kg/día; sin embargo, esta es variable, requiriendo en ocasiones dosis más elevadas o dosis más bajas, dependiendo de distintos factores como edad, peso, causa subyacente del trastorno tiroideo, entre otros(7). Su absorción oral es cercana al 62% - 80%, ocurriendo el 21% en el duodeno, 45% en yeyuno y el 34% en el íleon, viéndose afectada por ciertas condiciones médicas así como por la ingesta concomitante de alimentos y medicamentos. Su concentración sérica máxima se alcanza en aproximadamente 2 a 4 horas después de su ingesta, con una semivida plasmática de cerca de siete días, lo que explica el porqué la medición y control de la TSH debe hacerse alrededor de seis semanas después de su inicio o ajuste de la dosis(5,8). La levotiroxina tiene una unión a proteínas plasmáticas de cerca del 99%. Su metabolismo es principalmente hepático, dado el 80% por desyodación, 15% por glucuronidación y 5% por descarboxilación, y la excreción es renal pero un porcentaje, cerca del 20%, es eliminado por materia fecal(9). Las condiciones que pueden afectar la absorción de la levotiroxina, que tienen repercusión en su biodisponibilidad y, por lo tanto, en su efecto farmacológico, pueden ser divididas en tres categorías, incluyendo comidas (duración de ayuno, ingesta concomitante de alimentos, fibra, café, papaya, soya, uvas), condiciones médicas (enfermedad celíaca, intolerancia a la lactosa, infección por Helicobacter pylori, gastritis crónica, enfermedad inflamatoria intestinal, puente yeyunoileal, resección intestinal), y medicamentos (colestiramina, sulfato ferroso, sucralfate, carbonato de calcio, hidróxido de aluminio, inhibidores de bomba de protones, lovastatina, orlistat)(6,8). El caso reportado es muy ilustrativo en cuanto muestra cómo puede verse afectada la absorción y el efecto de la levotiroxina por distintas condiciones y factores, encontrándose distintas situaciones en esta paciente. En primer lugar, esta paciente recibió inicialmente levotiroxina sódica en presentación genérica, con pobre control de los niveles de TSH. Esta fue posteriormente cambiada a un medicamento original, observándose una mejoría significativa y rápida de sus niveles de TSH e incluso requiriendo reducción de la dosis necesaria para mantener TSH dentro del rango normal. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 51 Revista colombiana Volumen 2, número 4, noviembre de 2015 Mundialmente existen distintas marcas de levotiroxina sódica con contenido variable del ingrediente activo y con distintas bioequivalencias, lo que no permite que sean intercambiables entre sí, por lo que una vez se logre el control del paciente, se recomienda mantener la marca o la presentación del medicamento con el que se logró dicho control. En caso de no poderse evitar esto y haber un cambio en la marca de la levotiroxina, se recomienda realizar un nuevo control de función tiroidea en 6 a 8 semanas(1). Se sugiere que los ajustes de la dosis de levotiroxina sean entre un 15% al 20% de la dosis semanal para evitar grandes cambios en una medicación que se considera con margen terapéutico estrecho(9). La reducción cercana al 45% de la dosis llevó a la rápida elevación de la TSH, aun estando precedida por una supresión reciente. En segundo lugar, se documentó deficiencia de vitamina B12, la cual puede estar asociada a la presencia de gastritis atrófica, probablemente con coinfección por H. pylori, así como a enfermedades autoinmunes como la anemia perniciosa. Este tipo de condiciones lleva a alteraciones en la absorción del medicamento, con aumento de los requerimientos de levotiroxina. La anemia puede cursar con volumen corpuscular dentro del rango normal por la combinación del déficit de hierro que da volúmenes bajos y del déficit de vitamina B12 que da volúmenes altos. La anemia mejora al tratarse la causa subyacente y al dar suplementos vitamínicos como hierro y cianocobalamina(1,6). El suministro de hierro oral debe separarse al menos cuatro horas del consumo de la levotiroxina para evitar interferencias con la absorción de la hormona. La paciente de nuestro caso presentaba anticuerpos positivos contra las cé- de Endocrinología Diabetes&Metabolismo lulas parietales y niveles bajos de vitamina B12, apoyando la presencia de un síndrome poliglandular autoinmune, por lo que requiere estar atentos en el tiempo al desarrollo de otros déficits hormonales o aparición de enfermedades de naturaleza autoinmune(10). Conclusiones El hipotiroidismo es una entidad muy frecuente, considerada como el principal trastorno tiroideo. Sin embargo, a pesar de que su tratamiento es relativamente sencillo, al requerir sólo suplencia con levotiroxina sódica en la mayoría de los casos, existen distintos factores que pueden alterar el curso de la respuesta al tratamiento, como es el caso de las tiroiditis subagudas o condiciones inflamatorias sobreagregadas, así como factores asociados con la alteración en la absorción del medicamento, como son las condiciones propias de las distintas presentaciones y concentraciones del fármaco, alimentos, enfermedades, medicamentos concomitantes y condiciones propias del paciente. Se requiere de una gran agudeza mental para la evaluación conjunta de estas posibilidades para así lograr hacer ajustes adecuados en la dosis de levotiroxina y mantener los valores de TSH dentro del rango normal para el paciente. Conflictos de interés: No se declaran conflictos de interés por parte de los autores. Agradecimientos: Al Dr. Alejandro Román González y al Dr. Henry Mauricio Arenas Quintero por sus aportes y correcciones al manuscrito. Referencias 1. Almandoz JP, Gharib H. Hypothyroidism: Etiology, Diagnosis, and Management. Med Clin North Am. 2012;96(2):203–21. 2. Seo HM, Kim M, Bae J, Kim J-H, Lee JW, Lee SA, et al. A Case of Painful Hashimoto Thyroiditis that Mimicked Subacute Thyroiditis. Chonnam Med J. 2012;48(1):69. 3. Umut M, Alptekin G, Cuneyd A. Should neck pain in a patient with Hashimoto′s thyroiditis be underestimated? A case and review of the literature. Indian J Endocrinol Metab. 2012;16(3):444. 4. Lazarus J, Hennesey J. Subacute thyroiditis. In: De Groot L, Beck-Peccoz P, Chrousos G, editors. Endotext. South Darmouth, MA: MDText.com, Inc; 2012. 5. Brunton L, Chabner B, Knollman B. Goodman & Gilman: Las Bases Farmacológicas de la Terapéutica. 12 Ed. México: McGraw-Hill Interamericana Editores S.A.; 2011. 2035 p. 52 Revista Colombiana de Endocrinología, Diabetes y Metabolismo 6. Ianiro G, Mangiola F, Di Rienzo T a., Bibbò S, Franceschi F, Greco a. V., et al. Levothyroxine absorption in health and disease, and new therapeutic perspectives. Eur Rev Med Pharmacol Sci. 2014;18(4):451–6. 7. Builes Barrera CA, Palacios K, Barragán F. Dosis de levotiroxina varía según la etiología del hipotiroidismo y el peso corporal.Revista Colombiana de Endocrinología y Metabolismo. 2014;27–32. 8. Liwanpo L, Hershman JM. Conditions and drugs interfering with thyroxine absorption. Best Pract Res Clin Endocrinol Metab. 2009;23(6):781–92. 9. Biondi B, Wartofsky L. Treatment with thyroid hormone. Endocr Rev. 2014;35(3):433–512. 10. Cutolo M. Autoimmune polyendocrine syndromes. Autoimmunity reviews. 2014. 13:85-89. Revista colombiana de Endocrinología Diabetes&Metabolismo Volumen 2, número 4, noviembre de 2015 Casos Clínicos Hipopituitarismo postraumático: reporte de un caso Carlos Alfonso Builes Barrera1, Juliana Sierra Zuluaga2 Endocrinólogo de Adultos. Hospital Universitario San Vicente Fundación. Docente de la Universidad de Antioquia-sección de Endocrinología. Grupo de Endocrinología y Metabolismo. 2 Especialista en Medicina Interna. Médica Residente de Endocrinología y Metabolismo, Universidad de Antioquia. Correspondencia: [email protected] Hospital Universitario San Vicente Fundación Bloque 6. Oficina de Endocrinología y Diabetes Fecha de recepción: 18/09/2015 Fecha de aceptación: 30/09/2015 1 Resumen Se presenta el caso de un paciente con diagnóstico de novo de hipopituitarismo, cuya manifestación inicial fue con hiponatremia grave, secundaria a una insuficiencia suprarrenal central. Adicionalmente se documentó hipotiroidismo e hipogonadismo centrales. El paciente tuvo una lesión cerebral traumática cuatro décadas atrás y se encontraron en la resonancia nuclear de hipófisis hallazgos de hipoplasia hipofisaria y aracnoidocele selar, apoyando el diagnóstico de hipopituitarismo anterior. El caso resalta la presentación de hipopituitarismo diagnosticado décadas después de una lesión cerebral traumática. Se propone un enfoque para el diagnóstico, tratamiento y seguimiento de estos pacientes en nuestro medio. Palabras claves: lesión cerebral traumática, hipopituitarismo, hiponatremia, disfunción neuroendocrina. Abstract We present the case of a patient with previously undiagnosed hypopituitarism, it presents whose initial manifestation was a severe hyponatremia secondary to a central adrenal insufficiency, and besides this deficit he had central hypothyroidism and hypogonadism. In his past medical history he had a moderate traumatic brain injury almost 40 years before. The case highlights the presentation of hypopituitarism decades after a traumatic brain injury. An approach to the diagnosis, treatment and follow-up of these patients in our environment is proposed. Keywords: traumatic brain injury, hypopituitarism, hyponatremia, neuroendocrine dysfunction. Introducción La lesión cerebral traumática (LCT) es un problema de salud pública reconocido en todo el mundo, y es una causa de mortalidad y discapacidad a largo plazo. Las principales causas de LCT son los accidentes de tránsito (50% de todos los casos), caídas, incidentes relacionados con violencia, trauma de cabeza relacionados con el deporte (hockey, fútbol, boxeo, clavados y kickboxing) y los accidentes relacionados con la guerra, incluyendo lesiones por explosión(1). La LCT se había considerado previamente como una causa rara de hipopituitarismo; sin embargo, en los últimos 15 años se ha reportado un aumento en la prevalencia de la disfunción neuroendocrina, siendo tan frecuente como del 31% a un año(2-9). La frecuencia de hipopituitarismo crónico (definido como una duración de al menos tres meses) después de LCT varía ampliamente entre los estudios, con rangos entre 15% y 50%. Esta variación en la disfunción de la hipófisis podría explicarse por diferentes factores como la gravedad, tipo y tiempo transcurrido del trauma, la población estudiada, el diseño del estudio, las pruebas endocrinas y los criterios utilizados para el diagnóstico de las deficiencias de hormonas de la hipófisis. La Escala de Coma de Glasgow es la herramienta clínica más utilizada para evaluar la gravedad de la lesión cerebral(10). La probabilidad de desarrollar hipopituitarismo se incrementa entre más severa es la LCT, pero puede presentarse aún en formas leves. La deficiencia hormonal postraumática puede ser aislada o múltiple, y parcial o completa. Las hormonas más frecuentemente comprometidas en su orden son hormona del crecimiento (GH), gonadotropinas (FSH/LH), hormona adrenocorticotropa (ACTH) y hormona estimulante de tiroides (TSH)(4,8). Presentación del caso Hombre de 69 años de edad, con cuadro clínico de un mes de evolución de debilidad generalizada, vértigo, vómito y dolor abdominal difuso. En los últimos días, los síntomas se habían empeorado por lo que consultó al servicio de urgencias. Como antecedentes personales conocidos tenía hipertensión arterial y dislipidemia, sin consumo de medicación regular, ni de diuréticos tiazídicos al momento de la consulta. Sin antecedentes familiares relevantes de hipotiroidismo primario, diabetes o enfermedad endocrina. Al examen físico se encontró presión arterial (PA) de 132/61 mmHg, pulso de 78 lpm, pérdida de la cola de las cejas, edema bipalpebral, escaso vello facial y axilar, tiroides de tamaño y consistencia normal. Ginecomastia bilateral sin seRevista Colombiana de Endocrinología, Diabetes y Metabolismo 53 Revista colombiana Volumen 2, número 4, noviembre de 2015 creción al exprimir. Abdomen blando sin dolor a la palpación. Testículos blandos, de tamaño normal y vello púbico con distribución normal. Piel sin hiperpigmentación. Edema blando, hasta tercio distal de las extremidades inferiores. Inestabilidad para la marcha, reflejos osteotendinosos disminuidos en forma bilateral. Ante el predominio de los síntomas vertiginosos e inestabilidad para la marcha, se enfoca el cuadro clínico como un síndrome de fosa posterior y se solicitan paraclínicos, incluyendo una angiorresonancia cerebral contrastada. Se documenta hiponatremia grave, con TSH dentro de rangos normales y atrofia cerebral de predominio frontotemporal y hallazgos sugestivos de leucoencefalopatía microangiopática moderada, sin alteraciones en la circulación en la angiorresonancia. En el estudio de la hiponatremia se documentó el valor bajo de cortisol sérico, en un paciente sin antecedente conocido reciente de uso de esteroides tópicos, orales, inhalados o musculares. Se obtuvo un valor bajo de ACTH y de T4 libre, lo que orientó al diagnóstico de hipopituitarismo anterior (tabla 1). Tabla 1. Exámenes de laboratorio iniciales Potasio mEq/L 3,65 Sodio mEq/L 118 Calcio mg/dl 8,8 Albúmina gr/dl 3,97 Fósforo mg/dl 2,5 Creatinina mg/dL 1,44 BUN mg/dL 10 TSH mUI/L 2,52 Se solicitó valoración por endocrinología por las deficiencias hormonales documentadas. Al reinterrogar, el paciente refirió somnolencia excesiva, disminución de la libido, disminución en la frecuencia de la necesidad de afeitarse, intolerancia al frio e intolerancia al ejercicio. En términos generales el paciente había presentado una disminución global progresiva en su funcionalidad. Se confirmó el diagnóstico de hipopituitarismo anterior con el perfil hormonal completo (tabla 2) y la resonancia de silla turca mostró marcado adelgazamiento de la hipófisis y aracnoidocele selar (figura 1). Cuarenta años atrás, el paciente había sufrido una lesión traumática cerebral moderada con un elemento contundente en un hecho violento. Presentó pérdida del conocimiento por unos minutos y cefalea posterior, sin requerir asistencia médica en ese momento. En los años posteriores al trauma no refiere haber percibido algún cambio en su vida. Se casó y tuvo hijos. Se inició tratamiento intrahospitalario con hidrocortisona 50 miligramos intravenosos cada seis horas y posteriormen- 54 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo Tabla 2. Perfil hormonal completo y perfil lipídico Laboratorio Valor Rango Cortisol µg/dL 0,7 5-20 Prolactina ng/mL 13,7 3,4-19 ACTH pg/ml <5 0- 46 Testosterona total ng/mL 1,19 1,56-5,63 FSH IU/L 3,59 1-12 LH IU/L 5,81 2-12 Somatomedina C ng/mL 103,7 64-188 TSH mUI/L 2,52 0,35-4,9 T4L ng/dL 0,48 0,7-1,48 LDL mg/dL 148 Triglicéridos mg/dL 324 µg: microgramos, dL: decilitro, ng: nanogramos, mg: miligramos, pg: picogramos, FSH: hormona folículo estimulante, LH: hormona luteinizante, TSH: hormona estimulante de la tiroides, T4: tetrayodotiroxina, L: litro, UI: unidades internacionales LDL: colesterol de baja densidad. Figura 1. RMN de silla turca. Corte sagital secuencia SE T1. Silla turca de diámetro AP normal. Aracnoidocele selar (flecha horizontal). Parénquima hipofisiario que no supera los 2 mm de diámetro (flecha vertical) te se adicionó levotiroxina 25 microgramos vía oral cada día con franca mejoría de sus síntomas neurológicos. La hiponatremia se corrigió completamente y en forma ambulatoria se Revista colombiana de Endocrinología Diabetes&Metabolismo inició suplencia con enantato de testosterona con muy buena evolución clínica y mejoría notoria en su calidad de vida. Actualmente recibe prednisolona 5 miligramos vía oral al día, levotiroxina 50 microgramos vía oral al día, enantato de testosterona 250 miligramos intramuscular cada tres semanas y atorvastatina 20 mg vía oral cada noche, con muy buena adherencia y tolerancia a los medicamentos. Discusión El hipopituitarismo postraumático o hipopituitarismo inducido luego de una LCT fue descrito por primera vez en 1918(11), pero sólo ha cobrado importancia en la comunidad médica en los últimos 15 años, dados los resultados de estudios retrospectivos y prospectivos que muestran una mayor prevalencia entre el 15%-50%, y una mayor asociación con discapacidad física y psicológica, con cambios cognitivos, comportamentales y sociales a largo plazo(2-9). La falta de asociación clínica con el antecedente traumático craneano, la poca familiarización del médico familiar con el diagnóstico de hipopituitarismo y los increíbles mecanismos de adaptación corporal al déficit hormonal crónico puede explicar el tiempo de latencia tan prolongado para el diagnóstico del paciente. La frecuencia de la disfunción de la hipófisis varía de acuerdo con múltiples factores, la mayoría de los estudios establecen la gravedad de la LTC según la Escala de Coma de Glasgow(10) y permiten clasificarla como leve (puntaje de 13-15), moderada (puntaje de 9-12) o grave (puntaje de 3-8), siendo la variable más determinante. En una revisión sistemática de 14 estudios(2) que agrupó 1.014 pacientes, la prevalencia del hipopituitarismo fue del 35%, 10,9% y 16,8% para pacientes con LCT severa, moderada y leve, respectivamente. Entre 809 pacientes que fueron evaluados cinco meses después de la lesión, las deficiencias de la hormona del crecimiento y de gonadotropinas fueron las más prevalentes, afectando cerca del 12% de los pacientes cada una, seguida por el déficit de ACTH y de TSH en 8% y 4%, respectivamente. En otra revisión sistemática de 66 estudios con 5.386 pacientes adultos la prevalencia de hipopituitarismo a un año fue del 31,6%, siendo los grupos de más alto riesgo aquellos que sufrieron fracturas de la base del cráneo y LCT severa. Sin embargo, esta revisión tiene alto grado de heterogeneidad en los estudios(9). Aunque la LCT reportada por el paciente fue leve, en el paciente se documentó déficit de los ejes tirotropo, corticotropo y gonadotropo, para los cuales recibió suplencia. Los datos sobre la historia natural del hipopituitarismo inducido por LCT son limitados. La mayoría de los estudios incluyen periodos de seguimiento variables entre tres meses y cinco años. Se estima que la frecuencia de hipopituitarismo se reduce con el tiempo y que muchos de los pacientes recuperan su función hormonal. Sin embargo, un gran número de pacientes presentan persistencia de la disfunción de la hipófisis, Volumen 2, número 4, noviembre de 2015 empeoramiento del déficit, o incluso desarrollan nuevas deficiencias(6-8). Esto ha sido reportado con periodos de latencia tan largos como 30 años después de la LCT(12). La fisiopatología de la disfunción pituitaria después de la LTC aún no se entiende completamente. Factores como el traumatismo mecánico directo, el insulto vascular, el daño hipotalámico, los cambios inflamatorios, la compresión por la hemorragia, el edema o aumento de la presión intracraneal, la predisposición genética y la autoinmunidad pueden jugar un papel en el desarrollo de anormalidades neuroendocrinas. Por su localización anatómica, el hipotálamo, el tallo y la hipófisis son estructuras vulnerables a estos fenómenos. Los vasos portales largos pasan a través del diafragma de la silla turca y pueden dañarse después de un trauma en la cabeza con más facilidad(13). Estudios recientes revelaron que la autoinmunidad puede tener algún papel en el desarrollo y/o empeoramiento del hipopituitarismo. Se han reportado anticuerpos antihipófisis y anticuerpos antihipotalámicos en títulos altos en pacientes con hipopituitarismo luego de LCT(8-13). Todo paciente con LCT moderada o grave debe ser evaluado durante la fase aguda y en el curso crónico de su recuperación. Hay pacientes con LCT leve que cumplen criterios de riesgo para desarrollar hipopituitarismo y deben ser estudiados de igual forma. Se incluyen pacientes con necesidad de hospitalización durante más de 24 horas, necesidad de vigilancia en unidad de cuidados intensivos, necesidad de procedimientos neuroquirúrgicos, amnesia mayor a 30 minutos, y cambios anatómicos en las neuroimagenes iniciales. Independientemente de la gravedad de la lesión, si un paciente presenta signos y síntomas de hipopituitarismo en cualquier momento luego del evento, debe ser evaluado. En los pacientes que luego del trauma quedan en estado crónico vegetativo con poca expectativa de vida no se requieren estudios complementarios hormonales(14). En las dos primeras semanas posteriores a la LCT, la atención debe centrarse en el eje corticosuprarrenal (comprometido hasta en el 50% de pacientes) y la función de la hipófisis posterior. En los meses siguientes se hará énfasis en todos los ejes de la hipófisis anterior y posterior(15). Los valores de cortisol sérico menores de 3 µg/dL en ayunas apoyan fuertemente el diagnóstico de insuficiencia suprarrenal, mientras que los valores de cortisol sérico mayores a 18 µg/dL descartan disfunción del eje hipotálamo-hipófisissuprarrenal. Pacientes con valores intermedios (3,1-17,9 µg/ dL) también pueden tener hipocortisolismo y deben ser considerados como candidatos para terapia con sustitución con glucocorticoides en presencia de hallazgos clínicos sugestivos. Estos pacientes requieren pruebas dinámicas para evaluar completamente la función del eje en la fase crónica. En la fase aguda es poco práctico realizar estas pruebas dinámicas dada la variación fisiológica que sufre este eje por enfermedad graRevista Colombiana de Endocrinología, Diabetes y Metabolismo 55 Revista colombiana Volumen 2, número 4, noviembre de 2015 ve, además de no contar con puntos de corte definidos para el cortisol sérico. Se ha propuesto que todos los pacientes hospitalizados con LCT moderada o severa y cortisol sérico menor de 10 µg/dL podrían suplementarse con glucocorticoides durante la fase aguda(14,15) y posteriormente realizar prueba de estimulación con ACTH para definir necesidad de suplencia continua en forma crónica. La diabetes insípida central (DIC) debe sospecharse ante la presencia de poliuria (producción de orina > 200 mL/ hora durante al menos dos horas o de 40 ml/kg/24 horas (> 3 litros/ 24 horas en pacientes de peso promedio) y/o hipernatremia. Estos pacientes están en riesgo de deshidratación si su sensorio está alterado, y carecen de acceso al agua. Entre los pacientes con hipernatremia que no reciben diuréticos o manitol la presencia de una orina inapropiadamente diluida (<700 mOsm/kg) es coherente con el diagnóstico de DI. La prueba de deshidratación puede ayudar a establecer el diagnóstico de la DIC y diferenciarla de la DI nefrogénica o polidipsia primaria de acuerdo con la respuesta en la osmolaridad urinaria luego de aplicación de desmopresina. Esta prueba sólo debe realizarse en pacientes estables en un entorno supervisado y que no tengan hipernatremia. La medición de otros parámetros como arginina vasopresina o copeptina en plasma tiene utilidad diagnóstica pero con dificultades técnicas en entornos clínicos habituales y su uso no está recomendado. En la resonancia magnética de hipófisis, la ausencia de la “mancha brillante posterior” en las secuencias de T1 sin contraste apoya el diagnóstico de DIC(15). La evaluación hormonal durante la fase crónica se deberá realizar entre 3 a 6 meses de la LCT, y en cualquier momento ante la aparición de clínica sugestiva de hipofunción(14-15). Los pacientes con hipocortisolismo de origen hipofisiario se presentan con fatiga, pérdida de peso, anorexia, mareo, dolor articular varias semanas a meses después de la LCT. A diferencia de la enfermedad de Addison, no cursan con hiperpigmentación ni con hipercaliemia, pues carecen de ACTH y la secreción de aldosterona está preservada. La hiponatremia se atribuye a una secreción inapropiada de hormona antidiurética y al déficit de cortisol. La prueba de estímulo con ACTH para aclarar la respuesta de producción suprarrenal puede verse alterada hasta las 6 u 8 semanas después de la LCT, cuando se va presentando la atrofia cortical por falta de estímulo apropiado de la ACTH. El paciente de este caso presentaba los síntomas descritos y cursaba con hiponatremia grave, hipocortisolismo, ACTH baja, potasio normal, sin hiperpigmentación, apoyando el origen central. El hipotiroidismo central no se manifiesta durante la fase más aguda de la enfermedad (debido a que la vida media de la tiroxina es cercana a siete días). El perfil tiroideo muestra una T4 libre baja y una TSH inapropiadamente normal o discretamente elevada para el valor bajo de T4 libre como se identificó en el paciente, esto refuerza la necesidad de medir la T4 libre 56 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo para aclarar la función tiroidea en pacientes con alta sospecha de enfermedad hipofisiaria en los que el valor aislado de la TSH puede causar falsos negativos y omisión del diagnóstico correcto. En los pacientes con enfermedad aguda y grave, el diagnóstico diferencial más importante es con el síndrome de eutiroideo enfermo, también conocido como el síndrome del T3 bajo. En nuestro medio no se dispone de la medición de T3 reversa que apoyaría este diagnóstico en caso de hallarse elevada. En general, se recomienda hacer la evaluación del eje tiroideo sólo 4 a 6 semanas después del evento agudo para evitar confusiones. La evaluación del eje hipofisiario gonadal debe realizarse en pacientes estables durante la fase de rehabilitación después de la LCT, pues en la fase aguda generalmente está suprimida. El desarrollo de amenorrea secundaria en la mujer o de disminución de la libido y de caracteres sexuales secundarios masculinos junto con un valor repetido de testosterona total bajo, y valores inapropiadamente normales de FSH y LH apoyan el diagnóstico de hipogonadismo central como se hizo con el paciente. Adicionalmente, el perfil de hipogonadismo hipogonadotrófico puede producirse por hiperprolactinemia, que se reporta en cerca del 11% de los casos(3). La evaluación de la secreción de hormona del crecimiento (HC) debe realizarse varios meses después de la LCT y sólo en aquellos pacientes cuyas otras deficiencias hormonales han sido corregidas. En pacientes adultos, la deficiencia de HC puede producir poca energía y capacidad para el ejercicio, alteración en la calidad de vida, adiposidad central, dislipidemia, resistencia a la insulina, baja masa ósea, alteración de la memoria y concentración. No se recomienda realizar mediciones aleatorias de HC para evaluar la secreción hormonal, pues muchas personas sanas tienen niveles de HC indetectables a lo largo del día. Los niveles del factor de crecimiento similar a la insulina tipo 1 (IGF-1) carecen de sensibilidad en el diagnóstico. Sin embargo, en pacientes con antecedente de LCT y niveles bajos de IGF-1 para la edad y sexo y presencia de deficiencias hormonales hipofisiarias (≥3) es muy probable que tengan déficit de HC y no necesitarían una prueba formal con inducción de hipoglucemia o estímulo con arginina o glucagón. En todos los otros casos se necesitaría de una prueba de estímulo para hacer el diagnóstico de deficiencia de HC. Los pacientes con hipopituitarismo deben tener una resonancia magnética nuclear para descartar la presencia de una lesión selar(15). En el caso, el hallazgo de aracnoidocele y tamaño hipofisiario menor de 2 mm, confirma la falta de tejido hipofisiario, acorde con el diagnóstico de hipopituitarismo y posible falta de irrigación sanguínea de la hipófisis anterior posterior a la LCT. En pacientes críticamente enfermos con hipocortisolismo se recomienda dar dosis de estrés de hidrocortisona entre 50 a 100 miligramos intravenosos cada ocho horas. En pacientes estables debe suplementarse con hidrocortisona oral 15 a 25 Revista colombiana de Endocrinología Diabetes&Metabolismo miligramos vía oral al día fraccionado en 2 a 3 dosis o prednisolona 2,5 a 5 miligramos al día; no es necesario dar suplencia mineralocorticoide porque la secreción de aldosterona está preservada. Los pacientes con hipotiroidismo central pueden necesitar cerca de 1,3 a 1,6 microgramos por kilogramo al día de levotiroxina, aunque en pacientes ancianos o con larga evolución de los síntomas podría usarse inicialmente una dosis menor. En caso de insuficiencia adrenal asociada, debe suplementarse inicialmente el esteroide y luego la levotiroxina para evitar desencadenar una crisis de insuficiencia suprarrenal. Esta recomendación se realizó con el paciente con buena respuesta. El seguimiento debe hacerse con T4 libre, buscando que se encuentre en la mitad del rango de referencia y titulando según la evolución clínica. Los pacientes con hipogonadismo pueden recibir remplazo con esteroides sexuales si no está contraindicado. Se debe tener especial consideración al remplazar la testosterona en los hombres con enfermedad cardiovascular por los posibles efectos adversos en este sistema. Algunos estudios han mostrado un posible efecto benéfico al dar remplazo en dosis bajas de hormona del crecimiento en la cognición, calidad de vida, composición corporal con aumento de la masa ósea y muscular y disminución de la grasa visceral, mejoría en el perfil de lípidos y capacidad del ejer- Volumen 2, número 4, noviembre de 2015 cicio. Se recomienda usar dosis bajas 0,2 miligramos al día y 0,3 miligramos al día, subcutáneos, para hombres y mujeres, respectivamente, para lograr niveles de IGF-1 entre 0 a +1 desviación estándar para el sexo y edad(15). La LCT es una causa frecuente de hipopituitarismo crónico. Los pacientes se presentan con las mismas manifestaciones que aquellos con hipopituitarismo atribuible a otras causas; sin embargo, dado que la clínica puede ser muy sutil y fácilmente atribuible a la misma LCT, es probable que la mayoría de los pacientes con hipopituitarismo permanezcan sin diagnosticar y, por lo tanto, no se traten. Se recomienda medir luego de 3 a 6 meses y al año de la LCT (especialmente en aquellos con TEC moderado a severo por escala de Glasgow): TSH, T4 libre, sodio sérico, cortisol sérico, somatomedina C (IGF-1) y niveles de FSH/estradiol para mujeres o LH/testosterona total en hombres en la búsqueda intencionada de hipopituitarismo. La sospecha clínica y especialmente el interrogatorio dirigido al antecedente de LCT y la búsqueda intencional de hipopituitarismo en pacientes con LCT moderada o severa tienen un papel crítico en el diagnóstico oportuno para de esta manera poder ofrecer el tratamiento adecuado con el fin de mejorar los resultados en estos pacientes. Conflictos de interés: Ninguno que declarar para la escritura del texto. Referencias 1. Coronado VG, Xu L, Basavaraju SV, et al. Surveillance for traumatic brain injury-related deaths--United States, 1997-2007. MMWR SurveillSumm. 2011; 60:1-32. 2. Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A. Hypothalamus pituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review. JAMA. 2007; 298: 1429-1438. 3. Agha A, Rogers B, Sherlock M, et al. Anterior pituitary dysfunction in survivors of traumatic brain injury. J ClinEndocrinolMetab. 2004; 89(10):4929–4936. 4. Aimaretti G, Ambrosio MR, Di Somma C, et al. Residual pituitary function after brain injury-induced hypopituitarism: a prospective 12-month study. J ClinEndocrinolMetab. 2005; 90(11):6085–6092. 5. Schneider HJ, Schneider M, Saller B, et al. Prevalence of anterior pituitary insufficiency 3 and 12 months after traumatic brain injury. Eur J Endocrinol. 2006; 154(2):259–265. 6. Tanriverdi F, Senyurek H, Unluhizarci K, Selcuklu A, Casanueva FF, Kelestimur F. High risk of hypopituitarism after traumatic brain injury: a prospective investigation of anterior pituitary function in the acute phase and 12 months after trauma. J ClinEndocrinolMetab. 2006;91(6): 2105–2111. 7. Tanriverdi F, Ulutabanca H, Unluhizarci K, Selcuklu A, Casanueva FF, Kelestimur F. Three years prospective investigation of anterior pituitary function after traumatic brain injury: a pilot study. ClinEndocrinol (Oxf). 2008; 68(4):573–579. 8. Tanriverdi F, De Bellis A, Ulutabanca H, et al. A five year prospective investigation of anterior pituitary function after traumatic brain injury: is hypopituitarism long-term after head trauma associated with autoimmunity? J Neurotrauma. 2013; 30(16):1426–1433. 9. Lauzier F, Turgeon AF, Boutin A, et al. Clinical outcomes, predictors, and prevalence of anterior pituitary disorders following traumatic brain injury: a systematic review. CritCareMed. 2014;42:712-721. 10. Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet. 1974; 2(7872):81–84. 11. Cryan E. Pituitary damage due to skull base fracture. DtschMedWochenschr. 1918; 44:1261. 12. Streetz-van der Werf C, Karges W, Blaum M, ..Kreitschmann-Andermahr. Addisonian Crisis after Missed Diagnosis of Posttraumatic Hypopituitarism. J Clin Med. 2015 May; 4(5): 965–969. 13. Tanriverdi F, Schneider HJ, Aimaretti G, Masel BE, Casanueva FF, Kelestimur F. Pituitary dysfunction after traumatic brain injury: a clinical and pathophysiological approach. Endocr Rev. 2015 Jun;36(3):305-42. 14. Tanriverdi F,Kelestimur F. Pituitary dysfunction following traumatic brain injury: clinical perspectives Neuropsychiatr Dis Treat. 2015; 11: 1835– 1843. 15. Tritos N, Yuen K, Kelly D. A neuroendocrine approach to patients with traumatic brain injury. EndocrPract. 2015;21: 823-831. Revista Colombiana de Endocrinología, Diabetes y Metabolismo 57 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo Recomendaciones a los Autores Revista Colombiana de Endocrinología, Diabetes y Metabolismo Instrucciones a los autores 1. Aspectos generales La revista de la Asociación Colombiana de Endocrinología, Diabetes y Metabolismo es una publicación científica periódica creada para publicar artículos científicos relacionados con endocrinología, diabetes y metabolismo, previa aprobación del Comité Editorial y luego de un proceso de evaluación independiente por pares académicos. La revista de la Asociación, comprometida con la calidad y con su crecimiento para que en el futuro sea conocida e indexada en las bases de datos internacionales, está comprometida y seguirá los Requisitos uniformes para trabajos presentados a revistas biomédicas del Comité Internacional de Editores de Revistas Médicas (International Committee of Medical Journal Editors: ICMJE), como modelo de orientación para la publicación de los artículos. El Comité Editorial de la revista de la Asociación asume y exige que toda investigación original cumpla de manera estricta con los Principios Éticos para las Investigaciones Médicas en Seres Humanos establecidos por la Asociación Médica Mundial en su Declaración de Helsinki y en los casos que considere exigirá la certificación del Comité de Ética en Investigaciones que autorizó la ejecución de la investigación. 2. Estudios con animales Al presentar investigaciones sobre estudios realizados con animales de experimentación, los autores deben informar de manera clara cuál guía, institucional o nacional, se siguió para el cuidado, la protección y la utilización de los animales de laboratorio. Dicha guía sobre investigación con animales debe concordar con los principios establecidos en el documento International Guiding Principles for Biomedical Research Involving Animals) del Consejo para las Organizaciones Internacionales de Ciencias Médicas (Council for International Organizations of Medical Sciences: CIOMS), organización conjunta de la OMS y de la UNESCO. De todas maneras, los investigadores colombianos deben recordar que en la República de Colombia están vigentes la Ley 84 del 27 de diciembre de 1989, en la que el Congreso Nacional adopta el Estatuto Nacional de Protección de los Animales, que en su capítulo VI se refiere al uso de animales vivos en experimentos e investigación (disponible en http://190.253.108.242/ leyes/ley084.pdf), y la Resolución Nº 008430 del 4 de octubre de 1993 del Ministerio de Salud mediante la cual se establecen las Normas Científicas, Técnicas y Administrativas para la Investigación en Salud, en cuyo Título V hace referencia explícita a la Investigación Biomédica con Animales (disponible enhttp://www.dib.unal.edu. co/promocion/etica_res_8430_1993.pdf). 3. Autoría de los trabajos Siguiendo las recomendaciones de los Requisitos uniformes para trabajos presentados a revistas biomédicas sólo puede ser considerado autor de un trabajo quien haya realizado contribuciones sustanciales a su concepción y diseño, al análisis e interpretación de los datos o a la revisión crítica de una parte esencial del contenido intelectual. 58 Revista Colombiana de Endocrinología, Diabetes y Metabolismo La “autoría por cortesía” es inaceptable. El aporte de muestras o el reclutamiento de pacientes, por ejemplo, aunque esenciales para la investigación, no constituyen por sí mismos autoría y una mención en los agradecimientos es suficiente para este tipo de contribución (ver adelante). El manuscrito debe venir acompañado de una carta (en adelante Documento de Garantías y Cesión de Derechos), firmada por todos los autores, en donde expresen claramente que el texto completo, tablas y figuras, han sido producto de su trabajo, que dicho trabajo ha tenido lugar tal y como se describe en el manuscrito y que todos han leído y aprobado el manuscrito final y, en consecuencia, todos se hacen responsables de su contenido (al final de estas Indicaciones a los autores se puede ver un modelo del Documento de Garantías y Cesión de Derechos). 4. Responsabilidad El autor o autores son los únicos responsables del contenido del manuscrito. La revista de la ACE no asume ninguna responsabilidad con respecto a las ideas expuestas por los autores e, igualmente, no se hace responsable de las indicaciones o esquemas de dosificación propuestas por ellos con respecto a medicamentos o dispositivos terapéuticos, ni de las reacciones adversas que puedan derivarse de su empleo. 5. Evaluación por pares La revista de la ACE garantiza que la evaluación por pares es un proceso absolutamente confidencial: ni los pares conocen el nombre de los autores del manuscrito ni los autores podrán saber quiénes fueron sus pares. 6. Tipos de manuscrito La revista de la ACE publicará los siguientes formatos de artículo: 6.1 Editoriales: serán escritos por miembros del Comité Editorial o por algún colaborador previamente designado por dicho comité. 6.2 Trabajos originales: informes científicos de los resultados de investigaciones clínicas originales. 6.3 Revisiones de tema: revisiones de la literatura con la metolodología propia de las mismas, ya sea revisión de la literatura, actualización o metaanálisis 6.4 Presentaciones de casos: trabajos destinados a describir uno o más casos que el autor considere de interés especial. Se diferenciarán en presentación de casos hechos por residentes o médicos en entrenamiento de endocrinología y que surgirán de las presentaciones que se hacen en la reunión mensual de residentes y presentación de casos originales, hechos por especialistas, que por sus características o importancia clínica pueden ser publicados. 6.5 Historia de la endocrinología: manuscrito en el que se muestra la historia de la endocrinología ya sea en nuestro país o en el mundo. 6.6 Cartas al editor: comentarios breves sobre algún trabajo publicado en la revista. Revista colombiana de Endocrinología Diabetes&Metabolismo 7. Presentación del manuscrito Los manuscritos deben ser remitidos a la revista de la ACE a través del correo de la revista, [email protected]. El autor debe conservar copia de todo el material enviado. Es indispensable que los autores se ciñan de manera estricta a estas Indicaciones para los autores, pues de lo contrario se les devolverá el material como rechazado para su envío como si fuera por primera vez. Los manuscritos deben enviarse en formatos Word, tamaño carta, a doble espacio, con márgenes superior e izquierdo de 4 cm e inferior y derecho de 3 cm, con el texto alineado a la izquierda y con las páginas numeradas de manera consecutiva desde la página del título. Por ningún motivo se deben mencionar los nombres de los pacientes, sus iniciales o números de historia clínica ni, en general, datos que permitan su identificación. No se aconseja el empleo de acrónimos ni de abreviaturas (excepto para unidades de medida). En caso de utilizar abreviaturas, siglas o acrónimos, la primera vez que se mencionen en el texto deben ir precedidas por las palabras completas que las originan, a excepción de algunos nombres de moléculas, genes u oncogenes cuyas abreviaturas o iniciales son los nombres con los que se identifican. Siempre que se nombren sustancias con efectos farmacológicos se debe utilizar su nombre genérico. Sólo en aquellos casos en los que la investigación sea precisamente sobre diferencias entre diversas marcas registradas de una misma sustancia o entre sustancias con marca registrada y sus genéricos, se podrá utilizar el nombre de marca. En tal caso, al mencionar la sustancia por primera vez en materiales y métodos se debe utilizar primero el nombre genérico y a continuación entre paréntesis el nombre de marca y el nombre del fabricante. En la presentación del manuscrito se debe respetar la siguiente secuencia: 1. Página del título 2. Posibles conflictos de interés 3. Resumen estructurado 4. Abstract 5. Palabras clave 6. Texto del trabajo 7.Agradecimientos 8.Referencias 9.Tablas 10.Figuras 11. Leyendas para las figuras 12. Carta de los autores 13. Carta de Comité de Ética en Investigaciones sobre aprobación de la investigaciones en los casos en que sea necesario 7.1 Título La página del título debe incluir: Un título para el artículo científico que, en un máximo de 75 caracteres, refleje su contenido. Los nombres de los autores con sus títulos académicos y el nombre de la institución o instituciones a las que pertenece cada uno. El nombre, la dirección postal, el número telefónico y el correo electrónico del autor responsable de la correspondencia con la revista ACE. 7.2 Declaración de fuentes de financiación y posibles conflictos de interés En esta página se deben describir las fuentes de financiación de la investigación (bien sea en forma de becas, subvenciones, asistencia administrativa, equipos, programas de computación, Volumen 2, número 4, noviembre de 2015 reactivos, medicamentos, etc.), junto con los nombres de las universidades, instituciones y empresas aportantes (tanto públicas como privadas). En cuanto a los conflictos de interés, en la revista de la ACE se entiende como tales aquellas situaciones en las cuales la capacidad de juzgar sobre un cierto asunto de nuestro interés resulta influenciada por nuestro interés en otros asuntos. Cada autor debe también declarar por separado actividades financieras relacionadas con compañías farmacéuticas o con otras empresas que, aunque no tengan que ver directamente con el manuscrito enviado, podrían constituir conflictos de interés: empleos, consultorías, pertenencia a juntas directivas, participación en testimonios de expertos, honorarios por conferencias (incluyendo servicios a agencias de conferencistas), honorarios por preparación de manuscritos, honorarios por el desarrollo de programas de educación continuada, becas, patentes (incluso planeadas o pendientes), acciones bursátiles, viajes, hoteles y gastos de reuniones académicas o de otra índole (en la declaración de posibles conflictos de interés siempre es mejor pecar por exceso). 7.3 Resumen Si se trata de un artículo de investigación, el resumen estructurado debe incluir: objetivo, diseño, marco de referencia, pacientes o participantes, intervenciones, mediciones, resultados y conclusiones. Si se trata de un artículo de revisión de la literatura o de un metaanálisis, el resumen estructurado debe incluir: propósito de la revisión, fuente de obtención de los datos, selección de los estudios, extracción y síntesis de los datos y conclusiones. Si se trata de un artículo de Presentación de casos, el resumen puede ser no estructurado con un máximo de 150 palabras. 7.4. Abstract El Abstract es una versión en idioma inglés del resumen estructurado, no una traducción literal y mucho menos una traducción realizada mediante programas de traducción automatizada. 7.5. Palabras clave Las palabras clave son al menos cinco términos en inglés, con su correspondiente traducción al español, basados en el Medical Subject Headings (MeSH) de la National Library of Medicine (http://www.nlm.nih.gov/mesh/MBrowser.html), que reflejen el contenido del trabajo y sean de utilidad para su posterior indización y para su fácil hallazgo mediante buscadores electrónicos. 7.6. Texto 7.6.1. Trabajos originales Cuando se trate de un Trabajo original el texto del manuscrito, claro y conciso, debe incluir: introducción, material y métodos, resultados y discusión. 7.6.1.1. La Introducción debe darle al lector una idea clara pero resumida sobre los antecedentes y sobre la importancia del problema que se va a tratar: ¿Qué se sabe? ¿Qué no se sabe? ¿Qué se pretende indagar en la presente investigación? En respuesta a esta última pregunta deben quedar claramente establecidos tanto el objetivo principal como los objetivos secundarios de la investigación, sin incluir datos ni conclusiones de la investigación. 7.6.1.2. En la sección de Material y métodos se describe aquella información que estaba disponible en el momento en que se dieron por consolidados el protocolo de la investigación y el plan de trabajo, sin incluir ninguno de los datos obtenidos durante el desarrollo de la investigación (estos datos forman parte de la sección de resultados). Revista Colombiana de Endocrinología, Diabetes y Metabolismo 59 Revista colombiana Volumen 2, número 4, noviembre de 2015 Se deben describir claramente los sujetos de estudio: una población determinada observada de tal manera, una muestra de la población obtenida de tal manera con un grupo control obtenido de tal otra, unas colonias bacterianas cultivadas bajo tales condiciones, etc. describiendo siempre los criterios de inclusión y de exclusión. Se deben describir también los instrumentos utilizados para estudiar dichos sujetos o para intervenir en los mismos adjuntando las referencias bibliográficas indispensables para que cualquiera que desee hacerlo pueda replicar el estudio. Los instrumentos pueden ser tecnológicos (equipos imagenológicos, aparatos de medición, dispositivos terapéuticos, etc. con el nombre del fabricante y la dirección entre paréntesis), sustancias químicas (bien sea utilizadas como reactivos o como fármacos, identificándolos de manera precisa con el nombre genérico, dosis y vía de administración) o instrumentos teóricos (métodos estadísticos, algoritmos de tratamiento, cuestionarios de evaluación cualitativa, etc.). Los métodos estadísticos deben describirse con el detalle suficiente para que el lector que lo desee y tenga acceso a los datos pueda verificar los resultados. 7.6.1.3. En la sección de Resultados se describen los hallazgos de la investigación de manera secuencial y lógica, con la ayuda de tablas e ilustraciones, con énfasis en los resultados más importantes y sin repetir en las tablas o ilustraciones lo que ya se dijo en el texto. 7.6.1.4. La sección Discusión debe responder las siguientes preguntas: ¿Qué nuevos conocimientos se derivan de la presente investigación? ¿Cómo se correlacionan estos hallazgos con la mejor evidencia disponible a partir de otras investigaciones de características similares? ¿Cómo explicar las divergencias entre esta y otras investigaciones similares? ¿Qué limitaciones puede tener esta investigación? ¿Qué puntos deja sin resolver? ¿Qué nuevas investigaciones podrían arrojar luz sobre los problemas planteados por la presente? 7.6.2. Presentación de casos Si se trata de una Presentación de casos, el manuscrito debe incluir: Introducción, Presentación del Caso y Discusión. 7.6.2.1. En la Introducción se debe hacer un resumen breve sobre la importancia del caso que se va a tratar, bien sea desde el punto de vista diagnóstico, terapéutico, epidemiológico, etc. 7.6.2.2. En la Presentación del caso se debe resumir la historia clínica del paciente o los pacientes, con énfasis en los puntos del proceso de diagnóstico o del enfoque terapéutico que se quieran destacar. 7.6.2.3. La Discusión no debe convertirse, de ninguna manera, en una Revisión de Tema sino que debe responder a las siguientes preguntas: ¿Qué podemos aprender de este caso? ¿Cómo se correlacionan los hallazgos de este caso con la mejor evidencia disponible en la literatura en casos de características similares? ¿Cómo explicar las divergencias entre este caso y otras descripciones de casos similares? ¿Qué limitaciones puede haber tenido el estudio diagnóstico o la intervención terapéutica en este caso? ¿Qué puntos quedaron sin resolver? ¿Qué nuevas investigaciones podrían arrojar luz sobre los problemas planteados por este caso? 7.6.3. Revisión de tema, Metaanálisis o Actualización Si se trata de una Revisión de tema o de un Metaanálisis, el manuscrito debe incluir: Introducción, Obtención de los datos, Resultados y Discusión. 60 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo 7.6.3.1. En la Introducción se debe establecer el objetivo primario del artículo de revisión o del metaanálisis: ¿Qué se sabe sobre el tema?, ¿Qué no se sabe?, ¿Qué se pretende indagar en el presente estudio? En respuesta a esta última pregunta deben quedar claramente establecidos tanto el objetivo principal como los objetivos secundarios de la indagación. 7.6.3.2. En la Obtención de los datos se deben describir las fuentes de datos que fueron investigadas (archivos de investigaciones, bases de datos electrónicas, etc.), incluyendo las palabras clave utilizadas para hacer las búsquedas, las fechas de inclusión y las restricciones. Se debe declarar también el número total de estudios obtenidos en la búsqueda y los criterios utilizados para seleccionar entre ellos los que finalmente se incluyeron en la revisión o en el metaanálisis. Finalmente, se deben establecer los utilizadas para resumir los datos obtenidos de los estudios seleccionados y métodos para la aplicación de dichas guías. 7.6.3.3. En los Resultados se deben describir los principales datos arrojados por la revisión o el metaanálisis. 7.6.3.4. Las Conclusiones deben responder las siguientes preguntas: ¿Qué nuevos conocimientos o qué aplicaciones clínicas se derivan de la presente investigación? ¿Cómo se correlacionan estos hallazgos con la mejor evidencia disponible a partir de otras investigaciones de características similares? ¿Cómo explicar las divergencias entre esta y otras investigaciones similares? ¿Qué limitaciones puede tener esta investigación? ¿Qué puntos deja sin resolver? ¿Qué nuevas investigaciones podrían arrojar luz sobre los problemas planteados por la presente? 7.6.4. Historia de la endocrinología. Artículo o manuscrito que puede ser presentado en formato libre aunque deberá incluir un resumen y un cuerpo del artículo. 7.6.5. Cartas al editor Si se trata de Cartas al editor, el manuscrito debe ser un texto de no más de 400 palabras con cinco referencias, incluida la del artículo de la revista de la ACE que se quiere comentar. 7.7. Agradecimientos En los Agradecimientos se pueden consignar los nombres de personas o instituciones que hayan contribuido a la producción del trabajo sin que su aporte pueda considerarse parte de la autoría del mismo (por ejemplo el aporte de muestras o el reclutamiento de pacientes o alguna forma de asesoría en el análisis estadístico o en el empleo de equipos o dispositivos electrónicos). 7.8. Referencias bibliográficas Las Referencias Bibliográficas deben ir numeradas de acuerdo con el orden de aparición de las citas en el texto. Las referencias citadas por primera vez en tablas o leyendas de figuras deben conservar la secuencia de las citadas en el texto. Todo manuscrito deberá incluir al menos dos referencias de un artículo colombiano o latinoamericano sobre el tema. No se aceptan como referencias comunicaciones personales ni artículos en preparación o remitidos para publicación. El estilo de citación de las referencias debe ser el recomendado en los Requisitos uniformes para trabajos presentados a revistas biomédicas,, que en la actualidad corresponde al adoptado por la National Library of Medicine de los Estados Unidos de América y que, en caso de duda, se puede consultar de manera gratuita en el libro electrónico Citing Medicine en http://www.ncbi.nlm. nih.gov/bookshelf/br.fcgi?book=citmed. Revista colombiana de Endocrinología Diabetes&Metabolismo Cuando los autores son seis o menos se deben citar todos, pero si son siete o más se deben citar sólo los seis primeros y a continuación “et al”. Si el autor es un grupo, al menos una persona debe acompañar el nombre del grupo, citando primero la persona. El nombre de la revista debe ir abreviado según estilo del Index Medicus (List of Journals Indexed for MEDLINE) (ftp:// ftp.ncbi.nih.gov/pubmed/J_Medline.txt). La abreviatura de la revista de la ACE es: Rev ACE. 7. 8.1. Artículos de revistas Para el caso de artículos de revistas se deben citar: apellidos e iniciales del nombre de los autores, título completo del artículo, nombre abreviado de la revista, año de publicación, volumen, páginas inicial y final. Para el uso de mayúsculas y puntuación, sígase el ejemplo: Davidoff F, for the Council of Science Editors Task Force on Authorship. Who’s the author? Problems with biomedical authorship, and some possible solutions. Science Editor. 2000;23:111-9. 7.8.2. Libros y capítulos de libros Para el caso de libros se deben citar: apellidos e iniciales del nombre de los autores, título del libro, edición (si es una edición diferente a la primera), traductor (si se trata de una edición en un idioma diferente al del manuscrito original), ciudad, casa editorial, año, número total de páginas del libro. Para el uso de mayúsculas y puntuación, sígase el ejemplo: Hippocrates. On Ancient Medicine. Schiefsky MJ, traductor. Leiden: Brill Academic Publishers; 2005. 418 p. 7.8.3. Capítulos de libros Para el caso de capítulos de libros se deben citar: apellidos e iniciales del nombre de los autores del capítulo, título del capítulo, autores o editores del libro, título del libro, edición (si es una edición diferente a la primera), ciudad, casa editorial, año, páginas inicial y final del capítulo citado. Para el uso de mayúsculas y puntuación, sígase el ejemplo: Van der Eijk PJ. Galen’s use of the concept of ‹qualified experience› in his dietetic and pharmacological works. In: Debru A, editor. Galen on pharmacology: Phylosphy, History and Medicine. Leiden: Brill Academic Publishers; 1997. p. 35-58 . 7.8.4. Artículos de revistas en formato electrónico Para el caso de artículos de revistas en formato electrónico se deben citar: apellidos e iniciales de los autores, título, nombre abreviado de la revista en línea, año, fecha de la consulta electrónica, dirección de la página de la red en la que se realizó la consulta. Para el uso de mayúsculas y puntuación, sígase el ejemplo: Davidoff F, for the Council of Science Editors Task Force on Authorship. Who’s the author? Problems with biomedical authorship, and some possible solutions. Science Editor [Internet]. 2000 [consultado el 3 de junio de 2011];23:111-9. Disponible en: http://www.councilscienceeditors.org/files/scienceeditor/ v23n4p111-119.pdf En caso de dudas sobre cómo citar otro tipo de documentos (disertaciones, tesis, patentes, mapas, leyes, sentencias judiciales y otros documentos legales, videos, películas, audio, noticias en la prensa, programas de computador, etc.) recomendamos consul- Volumen 2, número 4, noviembre de 2015 tar el libro electrónico Citing Medicine (http://www.ncbi.nlm.nih. gov/books/NBK7256/). 7.9. Tablas Las tablas y cuadros se denominan Tablas y deben llevar numeración arábiga de acuerdo con el orden de aparición en el texto. Cada tabla debe ir en una hoja separada, numerada con el número de orden de aparición secuencial en el texto (Tabla 1, Tabla 2, etc.). El título de la tabla debe ir en la parte superior de la misma y las notas explicativas en la parte inferior. En los encabezamientos de las columnas se deben anotar los símbolos de las unidades utilizadas. Si una tabla ha sido previamente publicada, debe venir acompañada del correspondiente permiso del editor original para la reproducción en la revista de la ACE y se debe dar crédito a la publicación original. 7.10. Figuras Los diagramas de flujo, algoritmos, histogramas, curvas y gráficas estadísticas, esquemas, dibujos, fotografías, microfotografías, infografías y los segmentos de trazos de electrocardiogramas, electroencefalogramas, electromiogramas, etc. se denominan Figuras. Cada figura debe ir en una hoja separada, numerada con el número de orden de aparición secuencial en el texto (Figura 1, Figura 2, etc.), con indicaciones sobre su orientación correcta (por ejemplo: este lado arriba) y, para el caso de las microfotografías, incluir siempre escalas de medición interna. Sólo se admiten figuras en formato electrónico (PDF, DOC, PPT, JPG, GIF o TIF) con una resolución mínima de 300 dpi y un tamaño mínimo de 1.2 MB. Las figuras deben ser originales y se da por sobreentendido que, al formar parte integral del manuscrito, el autor cede los derechos sobre las figuras a la revista de la ACE . Si una figura ha sido publicada previamente o si se trata de una modificación de una figura ya publicada, no sólo se debe dar crédito a la publicación original en el texto del manuscrito sino que, además, debe venir acompañada del correspondiente permiso del editor original para reproducirla en la revista de la ACE. Si se utilizan fotografías de personas identificables, estas deben venir acompañadas del correspondiente permiso para su publicación. 7.11. Leyendas para las figuras Las leyendas para las figuras deben ir en hojas separadas, una para cada figura, numeradas con el número de la figura correspondiente (Figura 1, Figura 2, etc.). Al final de las leyendas de microfotografías se deben indicar las técnicas, coloraciones y aumentos empleados. *Este documento está basado en: Indicaciones a los autores, (s.f), consultado el 01 de octubre de 2014. http://www.actamedicacolombiana.com/info_autores.php?d=Indicaciones%20para%20autores#req Requisitos de uniformidad para los manuscritos enviados a revistas biomédicas: escritura y proceso editorial para la publicación de trabajos biomédicos (s.f.), consultado el 03 de octubre de 2014. http:// www.revespcardiol.org/es/requisitos-uniformidad-los-manuscritosenviados/articulo/13062920/ Revista Colombiana de Endocrinología, Diabetes y Metabolismo 61 Revista colombiana Volumen 2, número 4, noviembre de 2015 de Endocrinología Diabetes&Metabolismo ÍNDICE DE MATERIAS Y AUTORES Volumen 2, números 1 al 4 del 2015 Editoriales Las publicaciones en endocrinología Enrique Ardila Vol. 2 No. 1 Pág. 4 13 Congreso Colombiano de Endocrinología, Diabetes y Metabolismo John Jairo Duque Ossman Vol. 2 No. 2 Pág. 4 Editorial Pedro Nel Rueda Plata Vol. 2 No. 3 Pág. 4 La endocrinología y los médicos generales Enrique Ardila Vol. 2 No. 4 Pág. 4 Artículos de Revisión Disfunción tiroidea posexposición a medio de contraste yodado Cristian Iván García Rincón, Luz Yaneth Becerra Salazar, Germán Alberto Moreno Gómez, Henry Mauricio arenas Quintero. Vol. 2 No. 1 Pág. 5 - 9 Autoinmunidad tiroidea. Nuevos conceptos en la fisiopatología Arturo Orrego Monsalve. Vol. 2 No. 1 Pág. 10 - 13 Vitamina D y salud ósea en la mujer posmenopáusica. Revisión Oscar Rosero Olarte Vol. 2 No. 1 Pág. 14 - 19 Presente y futuro del trasplante de islotes pancreáticos, un tratamiento innovador para la diabetes tipo 1 Angie Sabogal, Luz A. Casas, Luis G. Arango, Karen Feriz, Guillermo Guzmán, 62 Oscar Gutiérrez, Carlos Durán, Alejandra Jeréz, Oscar serrano, Luis Caicedo, Gabriel J. Echeverri. Vol. 2 No. 1 Pág. 20 - 30 Controversias actuales en el diagnóstico de la diabetes mellitus gestacional José Fernando Botero Arango, Claudia Monsalve Arango, Alex Ramírez Rincón, Natalia Aristizábal Henao, José Luis Torres Grajales, Esdras Martín Vásquez Mejía, Alberto Villegas Perrase, Andrés Felipe Palacio Barrientos. Vol. 2 No. 3 Pág. 5 - 13 Interacción de la leptina y el hueso en sujetos obesos Protección vs. Fragilidad Ricardo Rosero, Ariana Sierra, Adriana Medina. Vol. 2 No. 3 Pág. 14 - 21 ¿Qué podemos esperar de las guías ATA 2014 en el manejo de cáncer temprano de tiroides? Alvaro Sanabria Vol. 2 No. 4 Pág. 5 - 10 Visita al renaciente, antes casi olvidado, tejido graso pardo Arturo Orrego Vol. 2 No. 4 Pág. 11 - 18 Artículos Originales Primer trasplante de islotes realizado en Colombia, experiencia Fundación Valle del Lili Gabriel J. Echeverri, Angie N. Sabogal, Luis A. Caicedo, Luz A. Casas, Liliana Mesa, Johanna Schweineberg, Carlos Durán, Juan G. Posada, Luis G. Arango, Karen M. Fériz, Alfonso J. Holguín, Oscar Gutiérrez, Alejandra Jeréz, Jorge I. Villegas, Oscar J. Serrano. Vol. 2 No. 1 Pág. 33 - 39 Revista Colombiana de Endocrinología, Diabetes y Metabolismo Descripción de los hallazgos histopatológicos en la terapia inicial del cáncer de tiroides en un centro de referencia en Bucaramanga, Colombia Juan Carlos Rojas Castillo, Daniela Camila Niño, Edwin Antonio Wandurraga Sánchez, María Emma García, Paul Anthony Camacho, Jairo A. Roa, Juan Guillermo Sarmiento. Vol. 2 No. 1 Pág. 40 - 43 ¿Es necesaria la medición de la T3 para el diagnóstico de hipotiroidismo primario? Carlos Alfonso Builes Barrera Vol. 2 No. 3 Pág. 22 - 24 Descompresión orbitaria endoscópica transnasal en orbitopatía por enfermedad de Graves Martín Alonso Pinzón Navarro, Perla Villamayor Rojas. Vol. 2 No. 3 Pág. 25 - 29 Análisis crítico de la literatura. ¿En pacientes adultos con cáncer diferenciado de tiroides y progresión en los últimos 14 meses, el tratamiento con sorafenib comparado con placebo mejora la supervivencia? Estudio DECISION Alejandro Román-González, Alvaro Sanabria Vol. 2 No. 3 Pág. 30 - 34 ¿Es mandatoria la tamización de disfunción tiroidea en toda mujer en la consulta reconcepcional?: Aportes de un estudio local Luis Felipe Fierro Maya, Angelica María González Clavijo, María Fernanda Garcés, María Teresa Pérez, Ariel Iván Ruíz, José Alexander Carreño, Jorge Caminos. Vol. 2 No. 3 Pág. 35 - 43 Revista colombiana de Endocrinología Diabetes&Metabolismo Niveles de vitamina D en pacientes con osteoporosis en la ciudad de Neiva – Huila, Colombia Alejandro Pinzón Tovar, Nelson Vásquez, Carlos Celemin. Vol. 2 No. 3 Pág. 44 - 50 Valores de pruebas tiroideas (TSH y T4 libre) en una población adulta de la ciudad de Medellín, Colombia Carlos Alfonso Builes Barrera Vol. 2 No. 4 Pág. 19 - 23 Pseudomalabsorción como causa de altos requerimientos de levotiroxina: Experiencia en el Hospital Universitario San Vicente Fundación Carlos Alfonso Builes Barrera Vol. 2 No. 4 Pág. 24 - 31 Impacto de los hábitos sobre la mineralización ósea durante la etapa de la juventud Paola Orozco Santos Vol. 2 No. 4 Pág. 32 - 36 Historia de la Endocrinología Hans Selye y la endocrinología social Alfredo Jácome Roca Vol. 2 No. 1 Pág. 44 - 47 Claude Bernard y la medicina experimental Enrique Ardila Vol. 2 No. 3 Pág. 51 -55 Gigantes en la historia JoWilliam Rojas G Vol. 2 No. 4 Pág. 37 - 41 Volumen 2, número 4, noviembre de 2015 Página del Residente Adenoma hipofisiario en una paciente embarazada, evolución y manejo: Reporte de caso y revisión de la literatura María Gimena Mejía López, Viviana Carolina Filizzola Montero, Henry Tovar Cortés, William Rojas. Vol. 2 No. 1 Pág. 54 - 57 Diagnóstico y manejo de la hiponatremia en adultos. Énfasis en síndrome de secreción inadecuada de hormona antidiurética William Rojas Vol. 2 No. 3 Pág. 56 - 62 Tormenta tiroidea: Revisión de dos casos en Hospital de San José, Bogotá William Rojas et al. Vol. 2 No. 4 Pág. 42 - 46 Casos Clínicos Gómez, Alejandro Román González. Vol. 2 No. 3 Pág. 72 - 75 Parestesia lingual: Un síntoma poco común de hipoglucemia Alvaro Muriel Vol. 2 No. 4 Pág. 47 - 48 Hipotiroidismo primario, déficit de vitamina B12 y tiroiditis subaguda sobreagregada: informe de caso Carlos Alfonso Builes Barrera Vol. 2 No. 4 Pág. 49 - 52 Hipopituitarismo postraumático: reporte de un caso Carlos Alfonso Builes Barrera Vol. 2 No. 4 Pág. 53 - 57 Carta al Editor Interferencia en la absorción de Sarcoidosis muscular en una paciente con hipercalcemia no mediada por PTH, reporte de un caso Fernando Rivera Toquica, Henry Mauricio Arenas Quintero. Vol. 2 No. 1 Pág. 48 - 53 Nuevos casos de feocromocitoma en el hospital universitario de Neiva Alejandro Pinzón Tovar, Eduard Mauricio Díaz, Orfa Yaneth Motta, Marcela Castro. Vol. 2 No. 3 Pág. 63 - 70 Tiroiditis por trauma en cuello luego de intento de suicidio. Reporte de caso y revisión de la literatura Carlos Alfonso Builes Barrera, Juan David levotiroxina asociada al uso de orlistat Carlos Esteban Builes Montaño, Carlos Alfonso Builes Barrera Vol. 2 No. 1 Pág. 43 Novedades Bibliográficas Tratado de tiroides Alfredo Jácome Roca Vol. 2 No. 1 Pág. 58 Obituario Álvaro Duque García (1926 – 2015) Eric Hernández Triana Vol. 2 No. 3 Pág. 76 Revista Colombiana de Endocrinología, Diabetes y Metabolismo 63 Revista colombiana Volumen 2, número 4, noviembre de 2015 64 Revista Colombiana de Endocrinología, Diabetes y Metabolismo de Endocrinología Diabetes&Metabolismo AGENDA Académica ACE 2016 Enero D L M M J V S Febrero D L M M J V S Marzo D L M M J V S 1. Simposio Osteoporosis más allá de los Bisfosfonatos. Sábado 13 de Febrero de 2016. Cali. 2. Simposio Urgencias Endocrinológicas. Viernes 11 y sábado 12 de Marzo de 2016. Bogotá. Abril D L M M J V S Mayo D L M M J V S Junio D L M M J V S 3. Jornada “Evaluación del Riesgo Cardiovascular en Diabetes: Más Allá de la Glucemia”. Viernes 15 de abril de 2016. Pamplona. 4. Simposio Diabetes, Que Hay de Nuevo. Sábado 16 de Abril de 2016. Cartagena. 5. Simposio Urgencias Endocrino - Metabólicas. Sábado 30 de Abril de 2016. Santa Marta. 6. VI Curso Internacional de Endocrinología, Diabetes y Metabolismo. Jueves 12 al domingo 15 de Mayo de 2016. Cartagena. 12 al 15 de Mayo de 2016 Cartagena de Endocrinología, Diabetes y Metabolismo Endocrinología del Siglo XXI: Actualizaciones y Retos Julio D L M M J V S Agosto D L M M J V S Septiembre D L M M J V S 7. Simposio ¿Qué hay de Nuevo en la Endocrinología Global? Sábado 18 de Junio de 2016. Medellín. 8. Simposio Endocrinología de la Niñez a la Adultez. Sábado 25 de Junio de 2016. Pereira. 9. Jornada “Evaluación del Riesgo Cardiovascular en Diabetes: Más Allá de la Glucemia”. Sábado 16 de julio de 2016. Barrancabermeja. 10. Simposio Fitness: Mito vs Evidencia Científica. Sábado 06 de agosto de 2016. Cartagena. 11. Simposio Motivos de Consulta Frecuente en Endocrinología. Sábado 13 de Agosto de 2016. Tunja. 12. Simposio Hábitos de Vida Saludable. Sábado 20 de Agosto de 2016. Bucaramanga. 13. Simposio Enfermedades Endocrinas como factor de Riesgo Cardiovascular. Sábado 03 de septiembre de 2016. Neiva. Octubre D L M M J V S Noviembre D L M M J V S Diciembre D L M M J V S 14. Simposio Complicaciones Sistémicas de la Diabetes Mellitus. Viernes 07 y sábado 08 de octubre de 2016. Bogotá. 15. Simposio Endocrinología Interdisciplinaria. Sábado 08 de octubre de 2016. Cúcuta. 16. Simposio Tiroides. Sábado 29 de octubre de 2016. Medellín. Festivo Día ACE 17. Simposio Urgencias de Endocrinología. Sábado 19 de Noviembre de 2016. Cali. 18. Simposio Tiroides. Sábado 26 de Noviembre de 2016. Barranquilla. EndocrinoColombia @ENDOCRINO_COL Línea Gratuita Nacional: 01 8000 110 113 Teléfonos: (00571) 6420243 – 6420245 e-mail: [email protected] w w w . e n d o c r i n o . o r g . c o