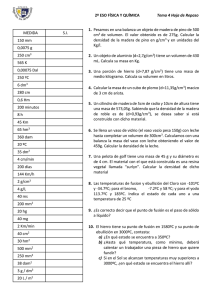
PROFESORADO DE EDUCACIÓN SECUNDARIA EN QUIMICA El
Anuncio

PROFESORADO DE EDUCACIÓN SECUNDARIA EN QUIMICA El título que otorga es Profesor de Educación Secundaria en Química. Y su duración es de 4 años. Uno de los desafíos que plantea el Diseño Curricular es la necesidad de resignificar la profesión docente, o sea volver a pensarla y concebirla, revisarla de manera de garantizar desempeños adecuados en diferentes contextos y en atención a sujetos singulares y prácticas sociales y culturales diversas que nos presenta el próximo decenio. Se aspira a formar un/a profesor/a en Química para la Educación Secundaria que sea a la vez persona comprometida con la disciplina y su enseñanza, mediador intercultural, animador de una comunidad educativa, promotor del respeto a la vida y a la ley en una sociedad democrática y que desde una comprensión real de la disciplina, logre contribuir a formar ciudadanos científicamente alfabetizados. A través del currículo se pretende formar un docente con capacidad de: Desempeñarse profesionalmente en diversas estructuras organizacionales, orientaciones y modalidades de la Educación Secundaria. Reconocer el sentido socialmente significativo de los contenidos de la Química propios de este nivel, y asegurar su enseñanza, con el fin de ampliar y profundizar las experiencias sociales extraescolares y fomentar nuevos aprendizajes. Dominar la Química, en tanto disciplina a enseñar, y actualizar su propio marco de referencia teórico, reconociendo el valor de esta ciencia para la construcción de propuestas de enseñanza, atendiendo a la especificidad del nivel y a las características de los sujetos que atiende. Contextualizar los contenidos de Química en relación a aspectos de la vida cotidiana, necesidades sociales tales como alimentación, vestimenta, salud y temas medioambientales Mediar los procesos de enseñanza y aprendizaje de la Química, a partir de propuestas didácticas integradora, tendientes a lograr significatividad y funcionalidad en el aprendizaje de las Ciencias Naturales, en toda su relevancia y complejidad. Seleccionar y utilizar nuevas tecnologías de manera contextualizada, como una alternativa válida para la apropiación de saberes actualizados y como potenciadoras de la enseñanza y de la participación activa del alumnos/a en su propio proceso de aprendizaje. POSTERGAN DISCUSION DE PROYECTO MINERO POR INVENTARIO DE GLACIARES El Pregón Minero 16/10/2014 Diario Digital Mendoza. Las comisiones de Ambiente y de Hidrocarburos del Senado mendocino postergaron este miércoles el análisis del proyecto minero Cerro Amarillo hasta tanto se concrete el inventario de glaciares sobre la cuenca del río Grande. El ministro de Ambiente de la provincia, Guillermo Elizalde, señaló que la solicitud fue formulada al gobierno nacional para que de manera "urgente" realice el inventario. "Personalmente hablé con el secretario de Ambiente de la Nación, Omar Judis, luego de enviarle el pedido formal desde el ministerio, para que se instruya al IANIGLA y que se inicien los estudios sobre el ambiente glaciar y periglacial de la cuenca del río Grande", expresó el ministro. La cuenca del Grande es la única que falta en el diagnóstico realizado por el Instituto dependiente del Conicet sobre todos los glaciares de la provincia de Mendoza, explicaron los legisladores. Por eso, consideraron que no podían avanzar en el estudio del proyecto Cerro Amarillo -que prevé extraer cobre de Malargüe- hasta tanto no esté ese inventario culminado. "Considero importante el hecho de que hayamos podido consensuar entre todos la necesidad de esperar. No es un freno al proyecto, sino avanzar fundamentalmente con el relevamiento de glaciares en el impacto de este emprendimiento Cerro Amarillo", dijo Ricardo Villalba, presidente del IANIGLA. "Vemos como muy positivo esperar un tiempo pero contar con esa información precisa de los glaciares en la zona, para seguir en otra etapa del emprendimiento", acotó. Mientras, los legisladores continuarán con el análisis del segundo de los proyectos mineros que ingresaron al Senado, el Hierro Indio, que pretende extraer hierro de "alta pureza". (Agencia DyN, Los Andes, Diario Uno, El Sol on line, MDzol, Mendoza, 16/10/14) Un proyecto minero avanza, el otro debe esperar 6 meses La Declaración de Impacto Ambiental (DIA) del proyecto minero Hierro Indio sigue avanzando; la de Cerro Amarillo quedó fuera de carrera hasta que el Instituto Argentino de Nivología, Glaciología y Ciencias Ambientales (Ianigla) termine el inventario de glaciares en la cuenca de los ríos Grande y Malargüe. El plazo legal para concluir esa tarea es de 180 días, pero el jefe del organismo científico, Ricardo Villalba, dice que podría ser antes. Ayer se realizó la segunda sesión conjunta de las comisiones de Energía y de Ambiente del Senado provincial, las que están analizando las DIA de los proyectos mineros Hierro Indio (hierro) y Cerro Amarillo (cobre). Lo que se analiza es la viabilidad ambiental para realizar tareas de exploración para determinar lugar y cantidad de minerales a explotar. Una vez cuantificado y determinado si es rentable extraer, vendrá otra declaración de impacto ambiental para la explotación. En esta segunda jornada se dilucidaron aspectos técnicos clave respecto del agua y de la ubicación en zona de glaciares, ya que estaban presentes técnicos de organismos oficiales: Mario Salomón (secretario de Gestión Hídrica) por Irrigación y Villalba y Alberto Ripalta por el Ianigla. Fueron cuatro horas de deliberaciones, pero la palabra de Villalba fue la que prácticamente dio las claves de la reunión. Bajo imperio de la Ley 26.639, conocida como ley de Glaciares, el instituto científico está encargado de hacer el inventario de glaciares en todo el país. En Mendoza ha culminado casi toda la tarea, sólo le falta concluir en el Río Grande y Malargüe y justamente por esto y por la cercanía del yacimiento Cerro Amarillo a lo que supuestamente sería zona periglaciar, se estimó conveniente suspender todo tratamiento sobre este proyecto hasta que se concluya esa tarea. Antes, cuanto se terminaba de discutir el proyecto Hierro Indio, Villalba había demolido las objeciones. Ese yacimiento está en la cuenca del Atuel, zona en la que el inventario ya está concluido. La zona de periglaciar llega a los 2.832 metros sobre el nivel del mar y la cota máxima del yacimiento Hierro Indio está a 2.400 metros; es decir, la labor no afectará las reservas estratégicas de agua de esa cuenca. Antes de Villalba, Salomón había dicho que “no hay ningún tipo de afectación para esta etapa”. Salomón remarcó en varios pasajes de su explicación que en la exploración no habrá afectación en el recurso hídrico, porque el cauce del río Atuel está a 2,3 kilómetros y no hay acuífero de aguas subterráneas y que sólo se usará agua para consumo humano, es decir, la que tomarán los trabajadores que tomen las muestras de mineral. Con estas dos afirmaciones el oficialismo respiró. El proyecto minero parece avanzar sin demasiadas objeciones técnicas y sólo queda escuchar a las entidades ambientalistas, que darán su parecer el miércoles próximo a las 9. De todos modos, Hierro Indio no es el proyecto que más interesa. Un legislador del oficialismo se sinceró en voz baja: “Hierro Indio es una ripiera que, cuando esté operando, requerirá 20 empleados”. Apenas se trata de un tester para ver hasta dónde se puede hablar de minería o no. El proyecto jugoso es Cerro Amarillo. Sólo en la etapa de exploración requiere cinco veces más de inversión que Hierro Indio (100 millones de pesos contra 20 millones). Hay cobre y se estima que hay mucho, porque sería la continuidad del yacimiento El Teniente de Chile, pero también hay molibdeno y, en menor medida, oro. (Los Andes, Mendoza) Voces a favor y en contra, la nota de color en el debate minero El debate sobre minería en Mendoza, clausurado durante 3 años después de que el ahora gobernador Francisco Pérez ordenara bajar el proyecto San Jorge, está abierto nuevamente. Los distintos sectores de la sociedad lo saben y por eso, tanto las personas que están a favor como en contra, muestran sus argumentos. Así, mientras en el anexo de la Legislatura de calle Gutiérrez y 9 de Julio los senadores debaten sobre los proyectos mineros (de los cuales uno tiene luz verde, y el otro roja), en la puerta se escuchan bombos, cánticos y gritos a favor y en contra. Por un lado desde distintos sindicatos y sectores de trabajadores metalúrgicos y mineros están muy interesados en que las iniciativas mineras puedan avanzar. Aseguran que eso traerá “trabajo genuino” para miles de mendocinos y conseguirá financiamiento para obras públicas y privadas en zonas postergadas de la provincia. “Esperamos que se aprueben los proyectos mineros con todos los controles necesarios. Pensamos que el ambiente y el desarrollo pueden vivir en una misma provincia, no son palabras contrapuestas. Lo importante es no clausurar los debates por que sí”, resaltó Diego, uno de los manifestantes a favor de la minería. Cabe resaltar que en la calle Gutiérrez, la cual permaneció cortada por más de 2 horas durante el debate, también se hicieron presentes geólogos de San Juan y mostraron los equipos con que se realizarían las exploraciones mineras. “Son magnéticos y, en algunos casos, se saca una muestra del suelo. No se contamina más de lo que puede contaminar una persona que camina por el lugar”, indicaron. Del otro lado de la vereda se ubicaron los militantes de la asamblea popular por el agua, en especial de Malargüe, quienes mostraron su rechazo a proyectos megamineros y apuntaron directamente contra Cerro Amarillo. “Aunque nos digan lo contrario, la realidad es que ese proyecto busca oro y no cobre”, aclararon. Cabe resaltar que minutos después, en el interior de la Legislatura, se decidió trabar esa iniciativa hasta marzo, fecha en la que el Ianigla tendría listo el inventario de glaciares de la zona. Cabe resaltar que durante las manifestaciones a favor y en contra se vivieron algunos momentos de tensión con insultos cruzados y gestos inapropiados. Afortunadamente la situación se tranquilizó y no pasó a mayores. (Sitio Andino, Mendoza) ACTIVIDADES Primera clase 1. 2. 3. 4. 5. 6. Leemos el texto, lo releemos si es necesario. Buscamos en el diccionario las palabras que no entendemos ¿Qué clase de texto es? ¿quién es el autor? ¿De qué trata el artículo? ¿Cuáles son las posiciones que se enfrentan? ¿qué argumenta cada una? Buscamos bibliografía relacionada con el tema, experiencias de otras provincias donde estén empresas mineras trabajando 7. Pueden aportar videos también Segunda clase 1. Leemos la bibliografía traída por los alumnos 2. Argumentamos a favor y en contra de la minería 3. Elaboramos un texto en conjunto donde quedan expuestas los pros y contras de la minería. CONSIDERACIONES EN TORNO AL ACTO DE ESTUDIAR "Estudiar es, realmente un trabajo difícil. Exige de quien lo hace una postura crítica, sistemática. Exige una disciplina intelectual que no se adquiere sino practicándola. Esto es, precisamente, lo que la "educación bancaria" no estimula. Por el contrario, su tónica reside fundamentalmente en matar en los educandos la curiosidad, el espíritu investigador, la creatividad. Su "disciplina" es la disciplina para la ingenuidad frente al texto, no para la posición crítica indispensable. Este procedimiento ingenuo al cual se somete al educando, junto con otros factores, puede explicar las fugas del texto que hacen los estudiantes, cuya lectura se torna puramente mecánica, mientras que con la imaginación se desplazan hacia otras situaciones. Por último, lo que se les pide no es la comprensión del contenido, sino su memorización. En lugar de ser el texto y su comprensión, el desafío pasa a ser la memorización. Si el estudiante consigue memorizarlo, habrá respondido al desafío. En una visión crítica las cosas ocurren de otro modo. Quien estudia se siente desafiado por el texto en su totalidad y su objetivo es apropiarse de su significación profunda. Esta postura crítica, fundamental, indispensable al acto de estudiar, requiere de quien a eso se dedica: a) Que asuma el papel de sujeto en ese acto [...] b) Que el acto de estudiar, en el fondo es una actitud frente al mundo [...] c) Que el estudio de un tema específico exige del estudiante que se ponga, hasta donde sea posible, al tanto de la bibliografía referente al tema u objeto de su inquietud. d) Que el acto de estudiar es asumir una relación de díalogo con el autor del texto, cuya mediación se encuentra en los temas que se trata. Esa relación dialógica da como resultado la percepción del condicionamiento histórico-sociológico e ideológico del autor, que no siempre es el mismo del lector. e) Que el acto de estudiar exige humildad. Si quien estudia asume realmente una posición humilde, coherente con la actitud crítica no se siente disminuido si encuentra dificultades, a veces grandes, para penetrar en la significación más profunda del texto. Humilde y crítico, sabe que el texto, en la medida misma en que es un desafío, puede estar más allá de su capacidad de respuesta. No siempre el texto se entrega fácilmente al lector [...] El estudio no se mide por el número de páginas leídas en una noche, no por la cantidad de libros leídos en un semestre. Estudiar no es un acto de consumir ideas, sino de crearlas y recrearlas." Tomado de FREIRE, Paulo. "La importancia de leer y el proceso de liberación". México. Siglo XXI Editores Después de haber leído este texto en clase Responde: 1) ¿A qué tipo de educación llama Freire Educación bancaria? caracterizala 2) De las condiciones que dice Freire que hay que tener para estudiar ¿cuál te parece o parecen más importante y por qué? 3) Explica el método que utilizas para estudiar y recuerda: siempre debes tener un diccionario para consultar cuando estés estudiando QUÍMICA GENERAL E INORGÁNICA MATERIA, ENERGÍA Y TRANSFORMACIONES Desde la Antigüedad el hombre intentó conocer las razones de los fenómenos que se producción a su alrededor. Así, en búsqueda constante de conocimiento, descubrió que el Universo está compuesto por materia y energía. El Sol, fuente de la vida, nos provee la luz y el calor necesarios para nuestra existencia. Al quemar combustible obtenemos calor. Cuando usamos una pila, las sustancias químicas que se encuentran en su interior producen electricidad. El intercambio de materia y energía es constante. Los Primeros Materiales El hombre primitivo utilizaba instrumentos naturales tal como los encontraba. Una rama podía ser un excelente garrote y una piedra, un inmejorable proyectil. Con el tiempo, descubrió nuevos materiales y aprendió a tallarlos y a pulirlos. Sin embargo, las piedras y maderas no modificaban su composición. Por otra parte, observando aprendió que en la naturaleza se producían cambios profundos: un rayo era capaz de incendiar un bosque, la carne obtenida durante la caza se pudría, el jugo de frutas se fermentaba, convirtiéndose en una bebida estimulante. La posibilidad de beneficiarse con estos fenómenos se hizo realidad cuando el hombre fue capaz de producir y mantener el fuego. Así, y sin quererlo, se convirtió en un químico apto para quemar la madera y producir con el calor generado nuevos cambios: hornear el barro para hacer vasijas o cocinar la comida. Los primeros materiales que usó el hombre eran universales, en el sentido de que se encontraban en cualquier parte: maderas, huesos, pieles, piedras…De todos ellos, la piedra era el más duradero, por eso los instrumentos de piedra tallada son los documentos más claros de que se dispone en la actualidad para conocer aquel período llamado, precisamente, Edad de la Piedra. Hacia el año 8000 a. C se produjeron otros cambios: el hombre aprendió a criar animales y a cultivar las plantas, dejó de ser nómade y se hizo sedentario, considerándose este hecho el comienzo de la civilización. El hombre aprendió a preparar cerveza y vino y a salar y ahumar las carnes para conservarlas. También, atraído poer el color y el brillo que tenían, y a pesar de que buscarlos y obtenerlos resultaba complicado, el hombre descubrió los primeros metales. Las ventajas de estos materiales fueron aprovechadas con rapidez: el cobre, que fue el primer metal explotado, resultaba un material maleable y resistente. El hombre advirtió que podía obtenerlo a partir de unas piedras azuladas. Mayor aún fue su asombro cuando, al calentarlo con otro metal, el estaño, obtuvo una mezcla sorprendente: el bronce, que le dio nombre a la etapa siguiente: Edad del Bronce. Pero la historia no quedó allí: fue descubierto un nuevo metal, el hierro, que aunque escaso resultaba más duro que el cobre. Se inicia así la Edad del Hierro: en esta etapa el desafío fue el perfeccionamiento de las técnicas de fundición, a través de las cuales se pudo extraer hierro de las “piedras” que lo contenían. Una de las teorías acerca del origen de la palabra Química evoca este momento: la palabra griega Khemeia deriva de Kummus que significa jugo de una planta. La khemeia es, entonces, “el arte de extraer jugos” y así se sustituye el jugo por el metal fundido que se obtiene de los minerales, la palabra vendría a significar “arte de fundir metales” o “arte de la metalurgia”. La historia prosigue y, desde el hombre primitivo a nuestros días, se han sucedido numerosos cambios. Los materiales no sólo se obtienen de la naturaleza sino que también se sintetizan de manera artificial. Algo no se ha modificado en tanto tiempo: la capacidad de asombro del hombre frente a tantos cambios de la materia y de la energía. Fuente; Breve historia de la química, de Isaac Asimov. Ed. Alianza, 1991 Análisis del Texto: 1. ¿Qué materiales se mencionan en el texto? 2. ¿Qué cambios pueden sufrir esos materiales? ¿Reconocen algún cambio físico? ¿Y algún cambio químico? 3. Cuando funde un metal, ¿qué operación se realiza desde el punto de vista químico? ¿Se conserva la cantidad de masa? 4. ¿Sigue empleándose el hierro como material? ¿Qué otros metales se descubrieron? 5. En el texto se habla, además, de la fermentación, de la cocción y del horneado. ¿Pueden señalar si estos procedimientos involucran cambios químicos o físicos? ¿Cuáles? CONTENIDOS IMPORTANCIA DE LA QUÍMICA. FENÓMENOS: Fenómenos Físico Fenómeno Químico Fenómeno Biológico MATERIA Y ENERGÍA: PROPIEDADES DE LA MATERIA: ESTADOS DE LA MATERIA CAMBIOS DE ESTADO GRADOS DE DIVISIÓN DE LA MATERIA: Partícula Molécula Átomo ACTIVIDAD: 1. Ejemplifique al menos 2 (dos) fenómenos físicos, 2 (dos) fenómenos químicos y 2 (dos) fenómenos biológicos. 2. Dé 2 (dos) ejemplos de la vida real donde esté involucrada la energía en cualquiera de sus formas. 3. Dé un ejemplo concreto donde pueda determinar propiedades de la materia. Indíquelas. 4. Ejemplifique todos los estados de la materia que conozca. 5. Esquematice el átomo e indique sus partes. RESOLUCIÓN DE PROBLEMAS 1. ¿Cuál será la masa de 10 ml de benceno a 20 °C, si su densidad es de 0,88 g/ ml? 2. Una muestra de líquido de 47,3 ml pesa 53,74 g. ¿Cuál será su densidad? 3. Si se precisan 100g de líquido del ejemplo anterior, para una reacción química ¿qué volumen de líquido deberá tomarse? 4. Una pieza de cromo de 13,5 cc pesa 97,2 g ¿Cuál es su densidad? 5. ¿Cuánto pesan 13,5 cc de mercurio si su densidad es 13,6 g/ml? 6. Un trozo de cobre sumergido en una probeta de agua dulce produce un aumento de 7,43 ml ¿Cuánto pesará dicha pieza si su densidad es de 8,92 g/ml? SISTEMAS MATERIALES CLASIFICACIÓN: Sistemas Homogéneos Sistemas Heterogéneos SOLUCIONES Y SUSTANCIAS PURAS MEZCLAS FASE COMPONENTE SUSTANCIA SIMPLE SUSTANCIA COMPUESTA ELEMENTO QUÍMICO MÉTODOS DE SEPARACIÓN DE FASES Y COMPONENTES ACTIVIDADES CON RESOLUCIÓN DE PROBLEMAS 1) Un recipiente contiene: 1 litro de agua, 10 gramos de arena, 100 gramos de hielo y 0,5 litros de alcohol. 1-1) ¿cuántas fases hay en el sistema dado? a) Más de 5 1-2) b)5 c) 4 d)3 e)2 ¿cuántos componentes tiene el sistema dado? a)6 b)4 c)3 e)2 1-3) Escribe los nombres de los sistemas componentes de la fase líquida: 1-4) ¿Qué ocurre si extraemos los 100gramos de hielo? a) aumenta el número de fases b) disminuye el número de componentes c) disminuye el número de fases d) no varía el número de fases ni de componentes 2) Dé un ejemplo de: a) Un sistema formado por 3 fases y 2 componentes b) Un sistema formado por 1 fase y 3 componentes 3) Cuáles de los siguientes sistemas son homogéneos y cuáles heterogéneos: a) Arena y agua b)oxígeno y nitrógeno c)aceite d)agua destilada e)agua potable f) aire que respiramos g) carbonato de sodio h) trozo de hierro 4) Indica cuales de los siguientes sistemas son soluciones y cuáles sustancias puras simples o compuestas: a) mercurio filtrado b) agua salada c) agua y alcohol d) óxido de plata e) vino 5) ¿cuáles de los siguientes sistemas homogéneos son soluciones y cuales sustancias puras? a) Hierro b) agua de mar filtrada c) ácido sulfúrico d) ozono e) dióxido de carbono en agua (soda) f) mercurio en oro g) niebla h) agua potable 6) Para cada uno de los sistemas descriptos indica cuantas fases lo constituyen e identifícalas. Explica brevemente como podrías separarlas. a) Agua y arena b) aceite y agua d) agua, arena y limaduras de hierro c)agua, azúcar y carbón e) sal, hielo y agua 7) Explica en qué consisten los métodos de seleccionados, realiza un esquema de los mismos. separación 8) Clasifica los siguientes sistemas en: compuestos o mezclas: Cal Lavandina Miel Nafta Bronce Amoniaco Vinagre Tintura de yodo Carbonato de sodio anteriormente ESTRUCTURA ATÓMICA Y RADIACTIVIDAD A comienzos del siglo XIX, sólo se conocían veintiséis elementos químicos y poco se sabía acerca de la estructura atómica. Sin embargo, diversas técnicas permitieron analizar a composición y estructura del átomo y detectar las partículas que lo forman. Mientras se estudiaba la estructura atómica se descubrió la radiactividad, una propiedad de algunos núcleos atómicos. A partir de allí, los elementos radiactivos, llamados radioisótopos, cobraron importancia para el hombre, no solo porque han contribuido a mejorar las condiciones de vida sino por su comprobado poder de destrucción. ¿Átomos para la paz? La química y física Marie Sklodowska de Curie (1867-1934) fue la única mujer galardonada con dos premios Nobel. El primero, de Física fue otorgado en 1903 y compartido con su esposo Pierre Curie (1859-1906) y con Antoine – Henri Becquerel (1852-1908), por haber descubierto la radiactividad (es decir, la emisión de radiaciones por parte de algunos núcleos atómicos). El segundo, de Química, le fue concedido en 1911 por el hallazgo de dos elementos radiactivos de gran importancia: el polonio y el radio. El radio resultó ser de vital importancia en las primeras terapias radiantes aplicadas para la lucha contra el cáncer. Lamentablemente, Marie muere de leucemia, una enfermedad cuyo origen probablemente haya sido la exposición excesiva a las radiaciones. La paradoja ocurrida en la vida de esta mujer, sencilla y trabajadora, se repite aun hoy con el uso de los radioisótopos: estos han mejorado notablemente la calidad de vida del hombre, pero a su vez han producido terribles tragedias. Los radioisótopos se usan con múltiples fines pacíficos, entre ellos, obtener energía eléctrica en las centrales nucleares, o bien, en medicina, para mejorar las técnicas de diagnóstico por imágenes y de laboratorio; también se aplican en el tratamiento de enfermedades cancerosas y en la esterilización de material descartable (jeringas, agujas, cánulas, etc. Además, nuevos proyectos han permitido que la radiactividad se emplee también en otras áreas: por ejemplo, para tratar los residuos cloacales y en el caso de las técnicas de radiopreservación (usadas a veces para irradiar alimentos y así evitar su putrefacción). Cabe recordar que en nuestro país, la Comisión nacional de Energía Atómica (CNEA) instaló en 1970 una planta de irradiación en el Centro Atómico Ezeiza. Técnicamente, la irradiación de alimentos consiste en un proceso en el que el alimento absorbe radiaciones ionizantes, es decir que producen iones, de esta manera se inhibe el crecimiento de brotes en bulbos, tubérculos y raíces y se eliminan parásitos, bacterias y toxinas. Si la cantidad de irradiación es lo suficientemente alta, se puede lograr la esterilización del alimento. Mediante esta técnica es posible conservar alimentos frescos 8frutas, verduras, carnes) y también aquellos desecados, como huevos en polvo, cacao soluble y vegetales deshidratados. Aunque estas prácticas están autorizadas por varios países, entre ellos el nuestro, no todos aprueban el uso de la irradiación de alimentos, en particular, y el uso de los radioisótopos, en general. Este desacuerdo responde, tal vez, a los perjuicios ocasionados por la radiactividad a través de la historia. Prueba de ello son las bombas de neutrones, lanzadas en 1945 sobre las poblaciones japonesas de Hiroshima y Nagasaki, o el terrible accidente nuclear ocurrido en la central energética de Chernobyl, Ucrania, en 1986. Análisis del texto: 1. ¿Qué radioisótopos se mencionan en el texto? ¿Conocen otros elementos radiactivos? ¿Cuáles? 2. ¿Con que fines pacíficos pueden emplearse los radioisótopos? 3. ¿Existen en nuestro país, centrales nucleares? ¿Saben cuáles son? 4. ¿Qué aplicaciones tienen los radioisótopos en el campo de la medicina? 5. ¿En qué consiste la técnica de radiopreservación de alimentos? 6. En la mayoría de los países la radiactividad se utiliza de uno u otro modo. Sin embargo, algunos organismos defensores de la naturaleza, como Greempeace, cuestionan ciertas aplicaciones y consecuencias delos radioisótopos. Analicen el porqué de esta actitud 7. Analicen las dos situaciones desafortunadas planteadas en el texto. ¿Encuentran alguna diferencia entre ellas? ¿Se podrían haber evitado? Lectura y ejercitación complementaria con resolución de problemas: http://www.edu.xunta.es/centros/iespolitecnicovigo/system/files/TEMA%205%20 MODELOS%20AT%C3%93MICOS.pdf QUÍMICA ORGÁNICA La Química orgánica es la química de las sustancias que contienen carbono (a excepción de los óxidos de carbono, los carbonatos y los cianuros). Muchos compuestos orgánicos como las proteínas, los hidratos de carbono y los ácidos nucleicos, son los principales constituyentes de los organismos vivos. Por otra parte, treinta de los productos químicos de mayor uso se obtienen por síntesis orgánica a partir de los hidrocarburos presentes en el petróleo y en el gas natural. El desarrollo de este campo se incrementó gracias a la primera síntesis artificial de uno de ellos: la urea. La “fuerza vital”: una larga discusión: A principios del siglo XIX, los científicos comenzaron a usar los términos de Química Orgánica para referirse al estudio de las sustancias presentes en los seres vivos. Estas sustancias diferían considerablemente de las que formaban a los objetos inanimados t, además, poseían cualidades especiales que no podían ser reproducidas en los laboratorios. Ningún científico lograba sintetizarlas, aunque sus componentes eran conocidos en muchos casos. Surgieron así los postulados del vitalismo, teoría que afirmaba que las sustancias orgánicas sólo podían se generadas por los seres vivos en presencia de una “fuerza vital”, de origen misterioso, pero nunca a partir de compuestos inorgánicos. Uno de los más fervientes defensores de esta teoría fue el famoso químico sueco John Jacob Berzelius (1779-1848). Este científico era una autoridad reconocida en esa época, ya que realizó importantes contribuciones a la química, como la creación del sistema de representación de los elementos mediante símbolos y de las sustancias por medio de fórmulas químicas. Berzelius fue el creador del término “isómero” y descubrió varios elementos químicos. Paradójicamente, fue un discípulo de Berzelius, el químico alemán Friedrich Wöhler (1800-1882), quién derribó la teoría vitalista. Wöhler era un joven muy entusiasta y algo rebelde, que no estaba convencido de la presencia de la “fuerza vital”. En 1824 concluyó sus estudios en Estocolmo con Berzelius y 4 años después, en Berlín, logró sisntetizar en el laboratorio un producto elaborado por organismos vivos, la urea. Esta sustancia, también llamada carbamida (NH2-CO-NH2 ), aparece en la orina humana y de muchos animales, aunque también se encuentra en algunas especies vegetales. Con esta síntesis, Wöhler derrumbó los principales argumentos de los vitalistas, y en particular los de su profesor, que en un principio se negó a admitir el hecho científico. Este descubrimiento dio gran impulso al avance de la Química. A partir de entonces, comenzaron a sintetizarse una gran cantidad de sustancias orgánicas más complejas. En 1838 Wöhler y su amigo Justus Von Liebig (1803-1873), otro químico alemán, escribierosn otro artículo científico donde sostenían que todos los compuestos orgánicos pueden elaborarse en forma artificial. La concepción vitalista de la Química Orgánica se desechó definitivamente en 1863, cuando Berthelot publicó su célebre libro “La chimie organique fondée sur la synthese, en el que describía la síntesis efectuada en el laboratorio de varios compuestos orgánicos, como el acetileno, el alcohol etílico y el ácido fórmico. El mecanicismo (que sostiene que las mismas leyes se aplican por igual a las biomoléculas y a las moléculas inorgánicas) había derrotado a la concepción vitalista. La química orgánica pasó a ser la química de los compuestos del Carbono y no más la química de las moléculas presentes en los seres vivos. Análisis del Texto: 1. Ubíquense a principio del siglo XIX y piensen una breve justificación para la teoría vitalista. 2. ¿Conocen otros ejemplos en el campo de la química o de la biología en donde se halla tratado de explicar con teorías”mágicas” lo que no se podía comprobar científicamente? 3. ¿Cuáles fueron los logros y los errores más notorios de la carrera científica de Berzelius? 4. ¿Qué posturas antagónicas representaban Berzelius y Wöhler? 5. ¿Qué cambios produjo en la Química la experiencia de Wöhler? 6. ¿Por qué creen que los científicos tardaron tanto en aceptar que la teoría de la “fuerza vital” estaba errada? 7. ¿Qué otros trabajos científicos realizó Wölher? 8. ¿Dónde se encuentra la urea en la naturaleza? ¿Para qué fines industriales se utiliza? 9. En la actualidad, numerosas sustancias se obtienen por síntesis orgánica en el laboratorio. Mencionen algunos ejemplos y su aplicación. Actividades con resolución de problemas: 1- Marque con una X la respuesta correcta. En el control de insectos las feromonas son muy importantes. Las más importantes suelen ser los atractores sexuales, liberadas por las hembras para atraer a los machos. Se sintetizan en el laboratorio para colocarlas en trampas y diseminarlas con el fin de atraer machos y eliminarlos ( mosca de la fruta), o para confundirlos. El atractor sexual de la mosca doméstica es un hidrocarburo insaturado sencillo que corresponde a los: CH3CH2CH2CH2CH2CH2CH2CH2CH = CHCH2CH2CH2CH2CH2CH2CH2CH2CH2CH2 CH2CH2CH2CH3 ........a- Alquenos ........b- Alquinos ........c- Alcanos 2- Marque con una X la respuesta correcta y realice la formula general. La fórmula general de la feromona del punto 1, responde a la del siguiente hidrocarburo: ......a- Alcano ......b- Alqueno ......c- Alquino 3- Marque con una X la respuesta correcta. El propano es utilizado en sopletes y arde con llama de alta temperatura. La fórmula correcta del propano es: ......a- C 5 H 12 ......b- C 3 H 8 ......c- C 5 H 5 ......d- C 2 H 5 4- Marque con una X la respuesta correcta. El acetileno se usa en los sopletes oxiacetilénicos para cortar y soldar metales. Se obtiene como producto de la reacción química entre el carburo de calcio y agua. Es un gas que genera muy alta temperatura. La fórmula del acetileno, que es el más sencillo de los alquinos es: ......a- C 5 H 12 ......b- C 3 H 8 ......c- C 5 H 5 ......d- C 2 H 2 5- Marque con una X la respuesta correcta. El etileno es el compuesto orgánico comercial más importante. Cerca de 10.000 millones de Kg se destinan a la producción de polietileno, uno de los plásticos mas conocidos. El 15 % se transforma en etilenglicol, el componente principal de casi todas las marcas de anticongelante para radiadores de automóviles. La fórmula desarrollada del etileno o eteno es la siguiente: a...... b....... c....... C – C-OH C = C C- C 6-Complete con H uniéndolos a los C correspondientes en la siguiente formula: Es un veneno organofosforado, llamado Somán GD y es moderadamente persistente. Utilizado en la guerra química. Matan por inhalación y por contacto con la piel, en un tiempo de 2 a 10 minutos, produciendo pérdida total de coordinación muscular y paro cardiorrespiratorio. O C P O C C C C F C C 7- Complete con H uniéndolos a los C correspondientes en la siguiente formula: Los químicos han sintetizado análogos de las hormonas juveniles. Uno de ellos, el metopreno, fue aprobado por la agencia ambiental de los Estados Unidos, para usarse contra los mosquitos y pulgas. C O C C C C C C C C C C C C C C O C O C C C FÍSICA ¿Qué estudia la Física? La Física es, entre todas las ciencias naturales, la más general y ambiciosa: intenta explicar, sobre la base de la menor cantidad de principios, todos los fenómenos del Universo. Un físico intenta descubrir las leyes básicas que siguen la materia y la energía en cualquiera de sus formas. Se ocupa de su composición, forma, estructura, creación, aniquilación, interacción, movimiento. Trata con estrellas, átomos, luz, posición, tiempo, sonido, máquinas, gases, campos, núcleos, partículas elementales indivisibles. Día a día se logran nuevos descubrimientos. En muchas áreas de investigación, hay un gran traslape entre la Física, la Química y la Biología, también con la ingeniería. Algunos de los desarrollos más notables son numerosas misiones espaciales y la llegada de astronautas a la Luna, el desarrollo de microcircuitos y computadoras de alta velocidad, desarrollo de técnicas de diagnóstico por imágenes utilizadas en la investigación científica y la medicina. Toda la materia y energía del Universo y su interacción es objeto de estudio de la Física La Física como ciencia experimental: El fabuloso desarrollo de la ciencia moderna y sus asombrosos resultados se produjeron a partir de los trabajos de Galileo Galilei, en el siglo XVI. La contribución fundamental de Galileo, fue la creación de un método de trabajo que permitió acercarse al ideal pretendido para el conocimiento: ser independiente de la persona que se observa. Este método científico está basado en la observación, la elaboración de hipótesis y conclusiones y la comprobación experimental de las mismas. El físico siempre hace una abstracción de la realidad, seleccionando, con cierto grado de arbitrariedad, sólo algunas de sus propiedades que considera relevantes. Construye así los llamados sistemas físicos, que pueden resultar una buena interpretación de la realidad, pero no deben ser confundidos con la realidad misma. La Física y las otras disciplinas de las Ciencias Naturales El físico piensa a los complejos sistemas de la Naturaleza como un agregado de sistemas más simples (partículas), que interactúan entre sí. Las leyes deducidas para el comportamiento de las partículas permiten reconstruir y entender los fenómenos que se dan en los sistemas más complejos. Las leyes de la Física constituyen una excelente herramienta para la descripción y explicación de numerosos aspectos de los seres vivos, por ejemplo: los conocimientos de la mecánica son utilizados para explicar el sostén y movimiento en los órganos; la física de los fluidos permiten interpretar ciertos aspectos del funcionamiento de los sistemas de conducción de los animales y plantas; y el potencial eléctrico y conductibilidad son conceptos involucrados en la formación y transmisión del impulso nervioso. Las principales áreas fronteras de este nivel son la biofísica y la biónica. El descubrimiento de la estructura atómica y la elaboración de la tabla periódica de los elementos químicos han surgido de un estudio conjunto permanente entre físicos y químicos. Mediante la utilización de numerosos y complejos métodos de análisis como la espectrografía, resonancia magnética, cristalografía, etc. Esta frontera la aborda la fisicoquímica. Por otra parte, muchos fenómenos meteorológicos y climáticos no son otra cosa que el análisis multidimensional de los efectos de la temperatura, la presión, etc. Sobre los subsistemas terrestres, áreas estas asumidas por la geofísica. Actividades con Resolución de Problemas 1.- Señalar cuál de las siguientes propiedades atribuibles a una persona es una magnitud? a) Belleza b) Sociabilidad c) Inteligencia d) Altura e) Sinceridad 2.- Señalar cuál de las siguientes propiedades atribuibles a un árbol es una magnitud? a) Desarrollo b) Crecimiento c) Especie d) Variedad e) Ninguna de las anteriores 3.- Efectúa las siguientes conversiones de unidades a) 15 yd a pulg ( 1yd= 3 pie 1 pie = 12 pulg) b) 20 cm/año a km/siglo c) 80 km/h a m/s d) 5 kg/cm² a mg/ mm² e) 70 gr/cm³ a kg/m³ f) 0,285 Ha a m2. g) 0,023 Hl a ml 4) Completa el siguiente cuadro: CANTIDAD UNIDAD MEDIDA dm 44,5 hs. 14 dm3 0,97 g 2350 MAGNITUD 7,4 Ha 46,5 m2 8,9 Hl. 43,2 Dam. 144 dl. 5) Resolver las siguientes situaciones problemas: a) Una persona tiene un terreno de 2600 a., y vende una parte de la siguiente manera: 4/5 partes para un barrio y 1/8 para parque. Calcular: i) ¿Cuántas Ha. y m2. ocupará el barrio? ii) ¿y el espacio verde? (en Ha. y m2.) iii) ¿Cuántas Ha. o m2. quedan sin vender? iv) si el valor del m2. es de $ 4,00, ¿cuánto dinero obtuvo por la venta? b) Un productor de manzanas obtiene en la cosecha 354 toneladas (1t= 1000kg). y vende la tercera parte a una sidrera, las 2/5 partes para exportación y el resto para consumo interno. i) ¿Cuántos Kg. vendió para hacer sidra, para exportación y para consumo interno? ii) Si a la sidrera le vendió el Kg. a $0.25, la de exportación a $ 1.20 y la de consumo interno $0.50, ¿cuánto dinero recaudó en total? c) Una viña tiene 80 hileras y cada hilera tiene 130 m. de longitud. Calcular: i) la cantidad, en Km., de alambre si cada hilera tiene 4 riendas. ii) si el costo por Kg. de alambre es de $ 3,20, ¿cuánto dinero costó el alambre? (1Kg. = 20 m.) d) A un tanque se le echan, el primer día 75,5 m3, el segundo día, 0,02998 Dam3. y el tercero, 175000 dm3. quedando llena la 4/5 partes. Calcula la capacidad total del tanque en Kl. y l. e) Una bodega tiene un depósito donde hay 2418 m3 de vino Malbec. i) ¿Cuántas botellas de 750 cm3. se podrán envasar? ii) Si el costo total (producción, mano de obra, botella y etiqueta) por botella es de $ 0,95 y el valor de venta es de $2,45, ¿cuánto es la ganancia de la bodega? f) Una empresa productora de agua mineral (Eco de los Andes) tiene la siguiente producción: 11300 b/h (botellas por hora) de botellas de 1500 cm3., 9500 b/h de botellas de 2 dm3. y 1400 b/h de bidones de 5000 cm3. Calcula: i) la cantidad de botellas de 1500 cm3. y volumen, en m3 y Hm3., de agua diario, si la máquina embotelladora trabaja las 24 hs. ¿y en la semana? ii) ídem para la botella de 2 dm3. ¿y en la semana? iii) ídem para los bidones de 5000 cm3. en 18 horas diarias. ¿y en la semana? iv) si el valor de venta es de $ 1,90 cada botella de 1500 cm3., $ 2,20 la de 2 dm3., y $ 2;90 el bidón de 5000 cm3., ¿cuánto será el valor de venta diario? ¿y el semanal? INTERPRETACIÓN DE GRÁFICOS GRÁFICOS CARTESIANOS: Para interpretar un gráfico cartesiano primero debemos conocer qué es y cuáles son sus principales elementos: El plano cartesiano consta en primer lugar de dos ejes ortogonales (perpendiculares) entre sí, en los cuales se colocarán los valores de las variables a relacionar; estas variables pueden corresponder a diversas magnitudes. Por lo general la variable que se representa en el eje horizontal (llamado eje “x” o de abscisas) es la variable independiente; como su nombre lo indica, varía independientemente de la otra variable, llamada dependiente, que varía en función de la primera y se representa en el eje vertical (llamado eje “y” o eje de ordenadas). En todo plano cartesiano un punto se puede caracterizar a través de sus coordenadas (x;y); a ese par de números que representa las coordenadas del punto se le llama par ordenado. Al punto donde una gráfica corta al eje y se le llama ordenada al origen, y representará el valor de la variable dependiente cuando la variable independiente vale cero. Al punto donde una gráfica corta al eje x se le llama raíz, y representará el valor de la variable independiente cuando la dependiente vale cero. A la hora de interpretar un gráfico, es muy importante observar, antes de hacer Al punto donde una gráfica corta al eje y se le llama ordenada al origen, y representará el valor de la variable dependiente cuando la variable independiente vale cero. Al punto donde una gráfica corta al eje x se le llama raíz, y representará el valor de la variable independiente cuando la dependiente vale cero. A la hora de interpretar un gráfico, es muy importante observar, antes de hacer ninguna lectura, cuáles son las magnitudes intervinientes, qué tipo de variable representa cada una y en qué unidades están medidas. Una vez que determinamos estas características, estamos en condiciones de hacer lecturas del gráfico... PRÁCTICA DE APRENDIZAJE: INTERPRETACIÓN DE GRÁFICOS A continuación, le proponemos realizar las lecturas de las gráficas propuestas: Veamos un ejemplo: El siguiente gráfico muestra la evolución de las ventas de algunos productos de una casa de electrodomésticos, en los últimos 50 años: Si observamos el mismo podemos sacar varias conclusiones: En este gráfico, la variable independiente es el tiempo y está medido en años; la variable dependiente está representada por las unidades vendidas. En 1985, los productos más vendidos fueron las heladeras, y los que menos se vendieron fueron las computadoras personales. Los lavarropas empezaron a venderse a partir de 1960, y sus ventas fueron siempre crecientes. La venta de televisores blanco y negro creció hasta ..............., y a partir de ese momento comenzó a decrecer hasta que estos aparatos desaparecieron del mercado en ..............., a causa de la aparición de .................................., que es el producto más vendido en 1997. La cantidad máxima de tv blanco y negro que llegó a vender ese negocio es de ............. unidades. En 1987 se vendieron tantas videocaseteras como computadoras personales: ................. unidades. Desde 1990 hasta 1997, la venta de videocaseteras se mantuvo constante en .................. unidades. 1) Responda: a) b) c) d) e) ¿A qué hora empezó a sentirse mal el enfermo? De las 12 hs a las 20 hs ¿mejoró o empeoró? ¿Cómo varió su temperatura entre las 16 y las 18 hs.? ¿En qué período aumentó más rapidamente la temperatura? ¿En qué períodos se mantuvo constante la temperatura? 2) El siguiente gráfico muestra la temperatura de una habitación durante una noche de invierno, en Ushuaia: Responda: a) b) c) d) e) 3) ¿Durante cuánto tiempo estuvo apagada la calefacción? ¿Cuál es la temperatura de la habitación durante el día? ¿Cuándo la temperatura es de 5ºC? ¿Cuándo la temperatura es menor que 16 ºC? ¿Cuál es la temperatura entre la 1 y las 3 de la mañana? El siguiente gráfico muestra las curvas de ingresos y gastos de una empresa: Responda: a) ¿En qué períodos hubo beneficios? b) ¿En qué períodos hubo pérdidas? c) Señale un período en el que el gasto haya sido decreciente. d) Señale un período en el que el ingreso haya sido creciente. e) ¿Cuáles son las variables que se relacionan? ¿en qué están medidas? 4) A un paciente de un centro médico se le han efectuado una serie de estudios, entre ellos la evolución de su peso a lo largo de un año. El resultado obtenido fue el siguiente: Responda: a) b) c) d) e) ¿En qué períodos el peso fue creciente? ¿Cuándo fue decreciente? ¿Cuál fue el máximo peso y cuándo lo alcanzó? ¿Cuál fue el mínimo? ¿Cuáles son las variables que se relacionan? ¿en qué están medidas? 5) El siguiente gráfico representa la variación de precios de la carne vacuna en el transcurso de un año: Responda: a) b) c) d) 6) ¿Cuánto aumentó el precio de la carne durante Octubre del `95? ¿Hubo algún mes en el cual el precio se haya mantenido estable? ¿En algún momento descendió el precio? ¿Qué otras conclusiones puede extraer? Esta curva muestra la afluencia de público en un hospital un día de otoño: a) Indique qué representa el gráfico. b) Interprete y describa el movimiento del público a lo largo del día. 7) Lea, interprete y responda: a) ¿Cuántas calorías necesita un niño de cinco años? b) ¿A qué edad necesitamos 40 calorías? c) ¿Qué ocurre con los requerimientos calóricos durante los primeros cinco años de vida?¿Y en los cinco años siguientes? d) ¿Puede hacer algunas otras observaciones al respecto?¿Cuáles? 8) “Los conductores y el alcohol” El gráfico muestra la alcoholemia (medida en g/l) que alcanza una persona con la ingestión de ¾ litros de vino (dos vasos y medio) en función del tiempo, a partir de la ingestión. El límite permitido por la ley de tránsito es de 0,5 gr por litro de sangre: Responda: a) ¿Qué curva cree que representa la ingesta en ayunas?¿Y en medio de las comidas? b) ¿Qué curva representa el límite permitido? c) ¿En que momento, bajo qué circunstancias, se alcanza la mayor alcoholemia? d) ¿Cuántas horas transcurren a partir de la ingestión en medio de las comidas, hasta lograr el límite permitido? 9) Intente representar los datos de la tabla en un gráfico cartesiano. 10) Notación Científica La energía que llega a la parte superior de la atmósfera, proveniente del sol, es de 172.000.000.000.000.000 Joule por segundo. La energía que tiene un electrón que choca con la pantalla del televisor para producir uno de los puntos luminosos que forman la imagen tiene un valor de 0,000000000000003 joule. El trabajo con cifras tan grandes o tan pequeñas resulta engorroso y, dificulta la lectura. Para mejorar estos inconvenientes, se utiliza la notación científica, en la que se coloca una sola cifra entera y se expresa el orden de magnitud mediante potencias de diez. Para potencias de 10 positivas se tiene en cuenta que: 10 = 101; 100 = 102; 1.000.000 = 106. En general, un número seguido de n ceros se expresa como 10n. Así la energía proveniente del sol por segundo se expresa 1,72 . 1017 joules. Para potencias negativas de 10: 0,1 = 10-1; 0,01 = 10-2; 0,00001 = 10-5. En general, 10n indica que hay n ceros antes de la primera cifra. De esa manera la energía del electrón dentro del tubo del televisor será de 3 . 10-15 joules. La notación científica es de uso habitual, ya que permite una comunicación sencilla de lo que se denomina orden de magnitud. Ejercitación 1. Actividades de repaso I. La dimensión de una cantidad física es:…………………………………………….. II. La unidad de una cantidad física es:………………………………………………….. III. La notación científica es:……………………………………………………………………… IV. Indicar en caso son posibles las siguientes operaciones. Justificar a) 3,5 cm. + 3m = b) 2,4 dm2 + 7m = c) 32 Kg. + 27 dam = d) 7,2 m2 – 760 m3 = e) 3 l + 0,35 cm3 = f) 32 m. 45 m = 2. Expresar en notación científica a. Masa de la tierra: 5 980 000 000 000 000 000 000 000 Kg. = b. Masa del electrón: 0,000 000 000 000 000 000 000 000 000 000 911 Kg. = c. Velocidad de la luz: 299 790 000 m/s = d. Radio de la luna: 1138 Km.: e. 0,0003 m3 + 3. 10-3 m3 = BIOLOGÍA ACTIVIDAD N°1 Reviven bacterias congeladas hace 32.000 años en Alaska Se durmieron hace 32.000 años en un mundo helado poblado de mamuts, y en donde los seres humanos estaban aún muy lejos de abandonar su vida nómade para consolidar alguna forma de civilización. Entonces, nadie se dio cuenta de que un puñado de bacterias había quedado aprisionado en una mezcla de hielo, tierra y roca que resultó ser una perfecta máquina del tiempo. Esas mismas bacterias son las que, luego de ser extraídas de las profundidades de la tundra de Alaska, Estados Unidos, ahora nadan en tubos de ensayo delante de la mirada de científicos que no pueden creer estar delante de organismos de 32.000 años de antigüedad, a los que nadie dudaría en calificar como la forma de vida viva más antigua del planeta. "En el instante en que se derritió el hielo, las bacterias comenzaron a nadar. Estaban vivas, aunque habían estado congeladas por más de 30.000 años", relató el doctor Richard Hoover, astrobiólogo de la NASA que dirigió el grupo de investigadores que desenterró las bacterias ahora apodadas Carnobacterium pleistocenium, cuya descripción acaba de publicar la revista International Journal of Systematic and Evolutionary Microbiology. "Esta es la primera descripción taxonómica completa de un microbio extraído del permafrost [mezcla permanente de hielo, tierra y roca] del pleistoceno [período que comenzó hace 1.8 millones de años y finalizó hace 11.000 años]", escribió a LA NACION por e-mail la doctora Elena Pikuta, microbióloga de la Universidad de Alabama, Estados Unidos, a quien Hoover le encargó el estudio minucioso de las bacterias prehistóricas. Para Hoover, que se dedica desde hace años a la búsqueda de microorganismos capaces de sobrevivir en condiciones extremas, el hallazgo sugiere la posibilidad de encontrar en los hielos subterráneos de Marte formas microscópicas de vida que permanecen dormidas desde tiempos 1. Formar grupos (máx. 4 personas) 2. Analicemos entre los integrantes del grupo el artículo. Como ayuda, nos podemos plantear distintas preguntas, por ejemplo: ¿Qué les llevo a sobrevivir tanto tiempo? ¿Qué características presentan para poder permanecer en esos ambientes?, etc. 3. A continuación veremos un video, sobre el origen de Vida. 4. Por último, realizar una puesta en común, con los demás grupos sobre el artículo y el video observado. Experiencia: observación de levaduras al microscopio Materiales: • • • • • levaduras (bloques o sobres que se compran en comercios) agua tibia azúcar portaobjetos y cubreobjetos microscopio Procedimiento: 1. Preparar una mezcla con una pizca de levaduras, una cucharada de agua tibia y una pizca de azúcar. 2. Dejar reposar 5-10 minutos. 3. Colocar sobre el portaobjetos y cubrir con el cubreobjetos. 4. Observar bajo el microscopio con un objetivo de fuerte aumento. 5. Dibujar lo que se observa. LABORATORIO DE QUÍMICA MEDIDAS DE SEGURIDAD EN EL LABORATORIO NORMAS DE SEGURIDAD EN EL LABORATORIO RECONOCIMIENTO DE MATERIALES DE LABORATORIO SISTEMAS MATERIALES: Sistemas abiertos Sistemas cerrados Sistemas aislados S. Homogéneos S.Heterogéneos FASES SEPARACIÓN DE FASES FRACCIONAMIENTO DE FASES