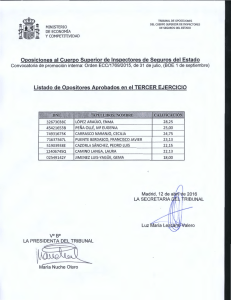
INSPECCIÓN DE LA OBTENCIÓN DE CÉLULAS Y
Anuncio

COMISIÓN EUROPEA DIRECCIÓN GENERAL DE SALUD Y CONSUMIDORES Salud Pública y Evaluación de Riesgos Legislación Sanitaria y Cuestiones Internacionales INSPECCIÓN DE LA OBTENCIÓN DE CÉLULAS Y TEJIDOS Y DE LOS ESTABLECIMIENTOS DE TEJIDOS Manual operativo para las autoridades competentes Versión 1.0 Este manual operativo para las autoridades competentes ha sido elaborado únicamente con fines informativos. No ha sido adoptado ni aprobado en modo alguno por la Comisión Europea, ni es legalmente vinculante. Comisión Europea, 1049 Bruselas - Bélgica. Teléfono: +32 22991111. ÍNDICE Página 1.0 Introducción 2.0 Responsabilidades de los inspectores 3.0 Cualificaciones y formación 3.1 Formación y experiencia 3.2 Cualidades personales 3.3 Formación introductoria 3.4 Formación especializada 3.5 Formación interna 3.6 Autorización 4.0 Tipos de inspección 5.0 Programación de inspecciones 5.1 Priorización de las inspecciones 5.2 Inspecciones sin previo aviso 6.0 Procedimientos de inspección 6.1 Procedimientos de inspección: antes de la inspección 6.2 Procedimientos de inspección: durante de la inspección 6.2.1 Reunión inicial 6.2.2 Inspección de las instalaciones 6.2.3 Revisión de la documentación 6.2.4 Reunión final 6.2.5 Notas de la inspección 6.3 Procedimientos de inspección: después de la inspección 6.3.1 Informe de inspección y acción correctiva 6.3.2 Acreditación, designación, autorización o aprobación de los establecimientos de tejidos 2 7.0 Gestión de la calidad de la inspección 7.1 Resultados del sistema 7.2 Resultados de los inspectores 7.3 Habilidades de los inspectores Anexo 1 Obtención y evaluación de donantes Anexo 2 Recepción, procesamiento, almacenamiento y distribución Anexo 3 Evaluación de los métodos de preparación Anexo 4 Evaluación de los informes de evaluación del riesgo Anexo 5 Importación/exportación: verificación de los requisitos técnicos Anexo 6 Modelo (propuesto) de expediente de establecimiento de tejidos Anexo 7 Modelo (propuesto) de formulario de conclusiones de inspección Anexo 8 Modelo (propuesto) de informe de inspección de un establecimiento de tejidos Anexo 9 Modelo (propuesto) de expediente del método de preparación Anexo 10 Modelo (propuesto) de certificado de autorización Anexo 11 Documentos consultados para elaborar estas directrices Anexo 12 Abreviaturas y glosario 3 1.0 Introducción El artículo 7 de la Directiva 2004/23/CE1 establece la necesidad de realizar inspecciones y de adoptar medidas de control. El apartado 5 dispone que, de conformidad con el procedimiento de comitología, «se establecerán directrices relativas a las condiciones de las inspecciones y las medidas de control, así como sobre la formación y la cualificación de los funcionarios encargados de ellas, con el fin de lograr un nivel uniforme de competencia y de resultados». Este manual operativo pretende orientar a los Estados miembros de la UE en relación con la implementación de una serie de tareas reguladoras para cumplir las Directivas 2004/23/CE, 2006/17/CE2 y 2006/86/CE3, y abarca las siguientes acciones: • inspección, acreditación, designación y autorización o aprobación de los establecimientos de tejidos; • inspección y autorización de las condiciones para la obtención de células y tejidos; • inspección y autorización de los métodos de preparación para tejidos y células; e • inspección y autorización de actividades de importación y exportación. El manual operativo tiene como objeto asistir a los Estados miembros que están poniendo en funcionamiento dichos sistemas reguladores por vez primera. Debería asimismo promover la normalización de los sistemas reguladores que ya están consolidados en la Unión Europea. El presente manual refleja las disposiciones que recogen las tres Directivas relacionadas sobre la calidad y la seguridad de las células y tejidos humanos empleados para transplantes o tratamientos de fertilidad. Determinadas secciones de este manual son pertinentes para las células y los tejidos humanos utilizados, por ejemplo, como material de partida para fabricar medicamentos de terapia avanzada (es decir, terapia génica, terapia celular somática o ingeniería tisular). En estos casos se aplican los requisitos reglamentarios establecidos por las Directivas arriba indicadas para la donación, la obtención y la evaluación. El Reglamento 1 Directiva 2004/23/CE del Parlamento Europeo y del Consejo, de 31 de marzo de 2004, relativa al establecimiento de normas de calidad y de seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos (DO L 102 de 7.4.2008, p. 48). 2 Directiva 2006/17/CE de la Comisión, de 8 de febrero de 2006, por la que se aplica la Directiva 2004/23/CE del Parlamento Europeo y del Consejo en lo relativo a determinados requisitos técnicos para la donación, la obtención y la evaluación de células y tejidos humanos (DO L 38 de 9.2.2006, p. 40). 3 Directiva 2006/86/CE de la Comisión, de 24 de octubre de 2006, por la que se aplica la Directiva 2004/23/CE del Parlamento Europeo y del Consejo en lo que se refiere a los requisitos de trazabilidad, la notificación de las reacciones y los efectos adversos graves y determinados requisitos técnicos para la codificación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos (DO L 294 de 25.10.2006, p. 32). 4 1394/2007 sobre medicamentos de terapia avanzada4 está en vigor desde el 30 de diciembre de 2008. Se insta a los Estados miembros a que preparen un sistema integrado para gestionar sus responsabilidades reguladoras en su papel de punto de contacto entre los sectores médicos y los relacionados con los tejidos o células (es decir, estatus del centro, prácticas de inspección, acreditación, designación, proceso de autorización o aprobación, trazabilidad de materiales y sistemas de codificación). 2.0 Responsabilidades de los inspectores Los inspectores recibirán de la autoridad competente un mandato claro por escrito para la tarea específica, y llevarán una identificación oficial. Recopilarán la información detallada que hayan de proporcionar a la autoridad competente conforme al mandato específico de la inspección. Una inspección es un ejercicio de muestreo, ya que no permite examinar todos los ámbitos y la totalidad de la documentación. Los inspectores no serán responsables de las deficiencias que no hayan podido detectarse durante la inspección debido a limitaciones de tiempo o de alcance, o en el caso de procesos que no hayan podido observarse durante la inspección. 3.0 Cualificaciones y formación 3.1 Formación y experiencia Como mínimo, el personal de inspección: a) poseerá un título, certificado u otra prueba de cualificación formal en el ámbito de la medicina o la biología expedido tras cursar estudios universitarios completos o unos estudios reconocidos como equivalentes por el Estado miembro de que se trate, así como b) tendrá una experiencia práctica en los ámbitos pertinentes de un centro de obtención de tejidos, células o sangre. Podrán considerarse también pertinentes otras experiencias previas. Las autoridades competentes podrán, en casos excepcionales, considerar que determinada persona posee una experiencia considerable y pertinente que la exime del requisito a). Los inspectores tendrán una experiencia práctica posterior a la titulación en ámbitos pertinentes en un centro de tejidos, células o sangre. Podrán considerarse también pertinentes otras experiencias previas, como haber trabajado en la industria farmacéutica, en el ámbito sanitario o en algún organismo de regulación, como una autoridad competente que inspeccione establecimientos de tejidos o bancos de sangre de hospitales, establecimientos de tejidos y células o medicamentos. 4 Reglamento (CE) no 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) no 726/200 (DO L 324, 10.12.2007, p. 121). 5 3.2 Cualidades personales Los inspectores deberán poseer buenas habilidades interpersonales. Deberán ser buenos comunicadores, ser capaces de analizar y debatir con eficacia, comprender con rapidez temas complicados y actuar asertivamente manteniendo al mismo tiempo un nivel adecuado de tacto y conducta profesional. Deberán presentar un alto nivel de madurez e integridad personal, una mentalidad abierta, una gran capacidad de comprensión de temas complejos, un juicio sólido, firmeza, capacidad analítica y tenacidad, así como la habilidad de ver las situaciones desde una óptica realista. 3.3 Formación introductoria A fin de obtener un puesto en un cuerpo de inspectores, los nuevos inspectores deberán probar que poseen las cualificaciones o la experiencia necesarias para llevar a cabo las funciones que se les asignen. Por otra parte, hay que reconocer que las habilidades que se requieren de un inspector son especializadas, por lo que la formación introductoria será facilitada por el cuerpo de inspectores, al margen de las cualificaciones o de la experiencia previa. Esta formación abarcará, al menos, los siguientes temas: • • • • • • • • • Actividades relacionadas en los establecimientos de tejidos (donación, obtención, evaluación, procesamiento, preservación, almacenamiento y distribución); Sistemas de acreditación, designación, autorización o aprobación en los Estados miembros; Directivas comunitarias relativas a células y tejidos; Técnicas y procedimientos de inspección, con ejercicios prácticos; Sistemas internacionales de gestión de la calidad (ISO y EN); Sistemas nacionales de salud y organizaciones de células y tejidos en los Estados miembros; Legislación nacional vigente en los Estados miembros; Organización de las autoridades reguladoras nacionales; Instrumentos internacionales de inspección y otros organismos pertinentes. Los inspectores recibirán asimismo formación continua en los temas arriba indicados para mantenerse al día de los cambios técnicos y jurídicos. 3.4 Formación especializada Tal y como se ha indicado, los inspectores, en general, poseerán numerosas habilidades procedentes de su educación, cualificaciones, experiencia de trabajo previa o formación adicional. No obstante, es poco probable que tengan el mismo nivel de conocimientos en cada uno de los temas relacionados con los tejidos y células. Deberá existir un procedimiento que permita realizar un análisis de las necesidades de formación de los nuevos empleados y del personal contratado a fin de garantizar que los inspectores puedan realizar inspecciones de conformidad con los requisitos exigidos. Entre los temas importantes en los que los inspectores deberán contar con formación especializada destacan: 6 • • • • • • • • • • • • • • • Principios generales del transplante de tejidos y células; Conocimientos básicos de los procesos y equipos usados en los establecimientos de tejidos; Principios básicos de las técnicas de reproducción asistida; Conocimientos básicos de los reglamentos aplicables a los equipos médicos; Conocimientos básicos de la legislación farmacéutica (en concreto, del Reglamento relativo a los medicamentos de terapia avanzada); Diseño, validación y mantenimiento de instalaciones y principales equipos; Sistemas de procesamiento y protección de datos; Comunicación eficaz, incluida la gestión de conflictos; Higiene general; Identificación de actividades ilegales o fraudulentas, y posterior acción para combatirlas; Técnicas de laboratorio, pruebas de diagnóstico in vitro (pruebas de cribado y técnicas de amplificación de ácidos nucleicos); Gestión de riesgos; Directrices o requisitos nacionales específicos; Enfermedades transmisibles; Vigilancia Los inspectores recibirán asimismo formación continua en los temas arriba indicados para mantenerse al día de los cambios técnicos y jurídicos. 3.5 Formación interna El programa de formación interna incluirá una serie de inspecciones con supervisión (el cuerpo de inspectores decidirá cuántas). Los inspectores en prácticas observarán, en primer lugar, a un inspector autorizado realizando una serie de inspecciones, a continuación participarán en algunas y, por último, dirigirán varias inspecciones bajo la supervisión de un inspector autorizado. 3.6 Autorización La competencia de los inspectores en prácticas deberá ser verificada y documentada por parte de la autoridad competente antes de que se les autorice a dirigir inspecciones. La competencia y los resultados de los inspectores deberán ser revisados periódicamente con arreglo a los requisitos del sistema de calidad aplicado por la autoridad competente o el cuerpo de inspectores. 4.0 Tipos de inspección Pueden realizarse distintos tipos de inspección en función de las actividades del establecimiento de tejidos y de las terceras partes que participan. Pueden ser documentales o in situ. Pueden abarcar el sistema entero o centrarse en uno o más temas específicos (sistemas de calidad, procesamiento de células o tejidos concretos, método de preparación específico o un problema concreto, etc.). Las inspecciones generales de los sistemas deberán ser realizadas in situ y abarcar todos los procesos y actividades, incluida la estructura organizativa, políticas, 7 responsabilidades, gestión de la calidad, personal, documentación, instalaciones, equipo, contratos, reclamaciones, retiradas, auditorías, etc. • • • • Se efectuarán, al menos, una vez cada cuatro años de actividad. Se realizarán antes de acreditar, designar, autorizar o aprobar un establecimiento de tejidos. (No obstante, la acreditación, designación, autorización y aprobación pueden necesitar basarse en un historial de las revisiones.) Podrían ser necesarias para cualquier variación significativa de la acreditación, designación, autorización o aprobación iniciales (por ejemplo, un cambio en la actividad o en los métodos de preparación). También podrían ser necesarias si hay un historial de deficiencias (por ejemplo, efectos adversos graves o reacciones adversas graves). Las inspecciones temáticas se realizarán in situ y se centrarán en un tema específico o varios, como los sistemas de gestión de la calidad, el procesamiento de células o tejidos específicos, métodos de preparación específicos, etc. Deberán realizarse: • • • • En el momento de realizar una evaluación intermedia, entre dos inspecciones generales de los sistemas; Cuando los métodos de preparación sean nuevos, complejos, innovadores o únicos para un establecimiento de tejidos; Siempre que se informe de un cambio considerable en uno de los temas específicos; También podrían ser necesarias en caso de (antecedentes de) una deficiencia específica, como efectos o reacciones adversas graves. Las revisiones documentales no se realizan in situ, sino a distancia. Pueden abarcar todos los procesos y actividades o centrarse en un tema específico o varios. Estarán basadas en un expediente actualizado del establecimiento de tejidos. Podrían utilizarse en las siguientes situaciones: • • • Para efectuar una evaluación inicial de las actividades del establecimiento de tejidos; Como preparación para las inspecciones in situ; En el momento de realizar una evaluación intermedia, entre inspecciones generales de los sistemas, si no se han producido cambios significativos. Las repeticiones de inspecciones pueden ser necesarias para realizar un seguimiento o una nueva evaluación a fin de controlar la acción correctiva requerida en respuesta a la inspección previa. También pueden efectuarse otras inspecciones específicas: Inspecciones de laboratorios de evaluaciones de donantes: Estas inspecciones incluyen normalmente la evaluación in situ del cumplimiento de las buenas prácticas de control de la calidad en los laboratorios. Pueden ser realizadas por una autoridad competente distinta de la autoridad competente responsable de la inspección del establecimiento de tejidos, dependiendo de la situación en cada Estado miembro. Sin embargo, podrían formar parte de una inspección general de los sistemas o de una 8 inspección temática si el laboratorio de evaluaciones es parte de un establecimiento de tejidos. Inspecciones de terceras partes: Las autoridades competentes deberán realizar inspecciones in situ de terceras partes, especialmente cuando una evaluación del riesgo así lo aconseje. Deberá considerarse la posibilidad de efectuar una inspección de terceras partes en las siguientes situaciones, entre otras: • • • Cuando las terceras partes actúan como proveedoras de servicios críticos para un número considerable de establecimientos de tejidos, por ejemplo, instalaciones comerciales de procesamiento de tejidos, una organización centralizada de obtención o selección de donantes de tejidos o una empresa contratada de esterilización. Cuando las terceras partes actúan como proveedoras de servicios críticos para un único establecimiento de tejidos, pero dicho establecimiento suministra un gran volumen de tejidos o células. Cuando en la inspección del establecimiento de tejidos se detecta un alto nivel de incumplimiento con el acuerdo escrito de una tercera parte. Inspecciones conjuntas: Determinadas circunstancias específicas (como el hecho de que los conocimientos técnicos o recursos disponibles sean limitados) podrían hacer que un Estado miembro solicite a otra autoridad competente de la UE la realización de inspecciones conjuntas en su territorio en colaboración con funcionarios del Estado miembro solicitante. 5.0 Programación de inspecciones Las autoridades competentes programarán con antelación la secuencia de inspecciones. Diseñarán un programa y garantizarán que se puede cumplir la frecuencia de las inspecciones de los establecimientos de tejidos individuales según la planificación. Deberán habilitarse los recursos suficientes para llevar a cabo adecuadamente el programa de inspecciones. Con arreglo a la Directiva 2004/23/CE, los establecimientos de tejidos tienen que inspeccionarse en intervalos de dos años como mínimo. Se recomienda realizar una inspección general de los sistemas (al menos cada cuatro años) que abarque todos los sectores de actividad. Durante el intervalo entre dos inspecciones generales de los sistemas, se puede efectuar una inspección temática centrada en un proceso o en un tema concreto (quizás relacionado con las deficiencias detectadas previamente o nuevas actividades). Como alternativa, si no se han producido cambios considerables desde la última inspección in situ, se puede efectuar una revisión documental. 5.1 Priorización de las inspecciones Las inspecciones se programarán de conformidad con criterios documentados basados en una evaluación del riesgo. En el caso de las inspecciones sistemáticas, los criterios para programarlas se basan en los siguientes indicadores: • • Complejidad de las operaciones de la planta; Cumplimiento de los reglamentos existentes (tal y como se indica en el expediente del establecimiento de tejidos cumplimentado); 9 • • • 5.2 Datos de los resultados anteriores (por ejemplo, número de deficiencias detectadas en una inspección anterior); Número de reacciones o efectos adversos comunicados, o de retiradas ordenadas; Volumen de actividad, incluidos cambios considerables. Inspecciones sin previo aviso Las inspecciones pueden organizarse sin avisar previamente al establecimiento de tejidos, siempre y cuando haya pruebas o información que las justifique. Entre los motivos para realizar inspecciones sin previo aviso se encuentran los siguientes: sospechas de actividades ilegales o fraudulentas, incumplimientos graves de los requisitos legales que podrían exponer a los donantes o a los receptores a un riesgo, una reacción adversa grave que tenga como consecuencia el fallecimiento de un paciente o una retirada de un producto importante, etc. 6.0 Procedimientos de inspección En esta sección se ofrecen directrices generales sobre los procedimientos para cualquier tipo de inspección. En los anexos del 1 al 5 se facilitan directrices técnicas sobre cómo verificar el cumplimiento de los requisitos técnicos específicos para: la obtención de células y tejidos y la evaluación de donantes (anexo 1); la recepción, el procesamiento, el almacenamiento y la distribución (anexo 2); la evaluación de los métodos de preparación (anexo 3); la evaluación de los informes de valoración de los riesgos (anexo 4) y la importación/exportación (anexo 5). 6.1 Procedimientos de inspección: antes de la inspección Deberá decidirse la constitución del equipo, teniendo en cuenta el tipo de inspección que va a llevarse a cabo. La inspección podrá ser realizada por un único inspector siempre y cuando las evaluaciones del riesgo realizadas por las autoridades competentes antes de la inspección hayan determinado que una sola persona es suficiente para inspeccionar el establecimiento de tejidos. No obstante y en general, debe evitarse que un único inspector lleve a cabo la inspección. Si los recursos lo permiten, el equipo estará formado por miembros con conocimientos técnicos en diferentes ámbitos. Al menos uno de los inspectores deberá tener el nivel de competencia o educación exigido con arreglo al artículo 17 de la Directiva 2004/23/CE a la persona responsable del establecimiento de tejidos o bien, contar con el nivel de educación y formación necesario para inspeccionar el lugar. En caso necesario, los inspectores podrán requerir la ayuda de un experto técnico (por ejemplo, en tecnología de células embrionarias o de reproducción asistida) o de expertos en otras materias (por ejemplo, temas jurídicos o médicos) para una inspección específica. Los expertos deberán tener conocimientos especializados en el ámbito de la inspección. La función de los expertos no es inspeccionar sino asesorar a los inspectores en asuntos técnicos. La función de los expertos dentro del equipo deberá estar claramente definida en documentos formales, el acuerdo de confidencialidad firmado por los expertos y su declaración de inexistencia de conflicto de intereses. Los expertos deberán estar informados de la política del cuerpo de inspectores cuando realizan las inspecciones. 10 Antes de realizar la inspección, el equipo deberá familiarizarse con la organización que se va a inspeccionar, lo que incluye, al menos, los siguientes aspectos: • • • • • • • • • • Examen del expediente del establecimiento de tejidos, para revisar el estado actual con respecto a las Directivas comunitarias relativas a tejidos y células y cualquier normativa nacional pertinente; Examen del expediente del método de preparación; Una revisión de los informes de las inspecciones previas, en su caso; Una revisión de las variaciones (cambios) para la autorización del establecimiento de tejidos, en su caso; Cualquier requisito específico relativo a prendas o a vacunas exigido para acceder al establecimiento de tejidos; Una revisión de la acción de seguimiento (en su caso) en respuesta a inspecciones previas; Una revisión de las retiradas de células o tejidos iniciadas a partir de la última inspección, en su caso; Un examen de los efectos adversos graves o las reacciones adversas graves pertinentes notificadas desde la última inspección, en su caso; Una revisión de las orientaciones o directrices nacionales aplicables al lugar que se va a inspeccionar; Volumen de actividad, incluidos cambios considerables. Se puede preparar un plan de inspección específico para la inspección que se va a realizar, que deberá abordar cualquier tema que surja desde la revisión previa a la inspección que requiera una investigación específica durante la inspección y pondrá de relieve cualquier cuestión pertinente detectada al estudiar el expediente del establecimiento de tejidos a fin de garantizar que se analiza y se evalúa durante la inspección. Se recomienda informar con antelación a la organización que va a ser inspeccionada de los siguientes aspectos: • • • • • • • • • • Los objetivos y el alcance de la inspección, a la luz de las inspecciones anteriores, incluida la de los establecimientos de obtención, de ser el caso; Las personas que han de estar presentes durante la inspección; en los casos de inspección de procesos concretos, deberán estar presentes las personas directamente responsables; La identidad de los miembros del equipo de inspección y sus funciones individuales; Cuándo y dónde se va a llevar a cabo la inspección (fecha, hora y lugar); Las unidades organizativas que se van a inspeccionar; La hora y la duración estimadas para cada actividad principal de la inspección (instalaciones, procesos, etc.); Un esbozo de la documentación principal que deberá estar disponible para su revisión durante la inspección; La programación de las reuniones inicial y final; La programación aproximada para la transmisión del informe de inspección escrito; La posibilidad de que, si son pertinentes, se compartan los resultados de la inspección con otros reguladores de la misma autoridad competente u otra. 11 6.2 Procedimientos de inspección: durante la inspección Los inspectores se esforzarán por crear un ambiente constructivo durante la inspección. Deberán ser conscientes de su influencia en los procesos de toma de decisiones. Responderán a las preguntas que se les formule pero evitarán asumir el papel de consultores. No obstante, las tareas de los inspectores no están limitadas exclusivamente a detectar fallos, deficiencias y discrepancias: deberán acompañar cualquier conclusión con comentarios instructivos y motivadores. Las inspecciones podrían ser una molestia en el desarrollo normal del trabajo de la organización inspeccionada, por lo que los inspectores prestarán mucha atención para no poner en peligro los tejidos o las células y trabajarán con cuidado y orden. Tendrán acceso a información confidencial, que tratarán con integridad y gran cuidado y cumpliendo con los requisitos legales relativos a la protección de la confidencialidad y la divulgación a fin de proteger la salud pública. En algunos casos, los inspectores podrán realizar copias de los documentos que puedan ser útiles para elaborar el informe inicial de la inspección o como documentos de prueba de posibles conclusiones. En algunos Estados miembros, los inspectores pueden realizar fotografías o vídeos que servirán como pruebas documentales en los centros, siempre y cuando no interfieran con el proceso o con la calidad y la seguridad de los tejidos o células. 6.2.1 Reunión inicial Las inspecciones empezarán con una reunión inicial en la que el equipo encargado de la inspección se reunirá con la dirección y el personal a cargo de la organización, incluida la persona responsable. El propósito de esta reunión es presentar al equipo y a los funcionarios acompañantes o especialistas y analizar el plan de inspección (que puede estar sujeto a cambios sin previo aviso). Durante esta reunión, el equipo de inspección deberá realizar las siguientes tareas: • • • • • Describir el propósito y el alcance de la inspección; Revisar la estructura de la dirección de la organización (organigrama); A pesar de que en esta fase todos los documentos deberían estar disponibles, identificar los documentos que puedan ser requeridos durante la inspección, en función de las actividades o ámbitos en los que los inspectores decidan centrarse; Confirmar que toda la información se va a tratar como confidencial; Explicar si se van a notificar las deficiencias a medida que se identifican o en reuniones al final del día para resumir los resultados, o bien, en la última reunión de cierre. Si se le solicita, el equipo del establecimiento de tejidos deberá ser capaz de realizar las siguientes actividades: • • • • Describir el sistema de gestión de la calidad; Explicar la estructura organizativa y los procedimientos operativos; Explicar cada paso desde la obtención al procesamiento y la distribución; Explicar los cambios significativos realizados en las instalaciones, equipo, procesos y personal producidos desde la última inspección; 12 • • • Explicar cómo se han resuelto las deficiencias si esta información no ha sido ya trasladada a la autoridad competente; Designar a las personas que han de acompañar al equipo responsable de la inspección mientras esta tiene lugar; Acomodar una sala para los inspectores, en caso necesario; si la inspección es realizada por un equipo, se necesitará una sala independiente para la sesión informativa final del equipo. Realizar una visita rápida al centro inmediatamente después de la reunión inicial podría resultar muy útil para familiarizarse con él y apreciar cualquier cambio significativo producido desde la última inspección, pero no sustituirá a una visita exhaustiva de las instalaciones que se realizará en un momento posterior de la inspección. En algunos casos, puede ser necesario en esta fase observar ciertas actividades que no van a estar realizándose cuando se visite la zona más tarde durante la inspección. 6.2.2 Inspección de las instalaciones Deberá incluir una visita detallada para ver si la disposición y el diseño de las instalaciones y los equipos son aptos, tal y como se describe en el expediente del establecimiento de tejidos, y si el modo en que se utilizan se ajusta a las operaciones que se llevan a cabo en su interior. Deberá analizarse cualquier cambio producido desde la última revisión. Por norma general, los inspectores siguen el flujo del proceso de las actividades para las que el establecimiento de tejidos está autorizado o va a estarlo, teniendo en cuenta las disposiciones detalladas de las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE. A veces resulta conveniente concentrarse en un departamento de la organización si hay problemas o requisitos especiales. Deberán tenerse en cuenta las áreas de servicios importantes, por ejemplo, los sistemas de ventilación, vapor o agua, así como los de apoyo técnico. Durante la visita a las instalaciones, los inspectores deberán comentar en todo momento las observaciones que vayan surgiendo con el personal responsable, supervisores y operadores, a fin de aclarar hechos, indicar puntos de preocupación y valorar los conocimientos y la competencia del personal. 6.2.3 Revisión de la documentación El sistema de documentación (incluidas las especificaciones, métodos de preparación, transporte e instrucciones de acondicionamiento, procedimientos y registros de los diferentes procesos, control de la calidad y operaciones de distribución) deberá revisarse examinando ejemplos seleccionados, tanto durante el uso como tras la recopilación en registros completos. Una inspección general de los sistemas incluirá por norma general un examen del sistema de gestión de la calidad documentado para las actividades para las que se ha concedido o solicitado autorización, incluida la siguiente lista, que no es exhaustiva: • 5 Descripciones de tareas, organigrama, función de la persona responsable y el médico autorizado5; Cada establecimiento de tejidos debe tener acceso a un médico autorizado que aconseje sobre las actividades médicas del establecimiento y las supervise, como por ejemplo la selección de donantes, la 13 • • • • • • • • • • • • • Formación del personal, incluida formación inicial o introductoria, planes de readaptación y evaluación de la competencia; Control de los documentos, incluido el mantenimiento (por ejemplo, control de cambios) de los procedimientos normalizados de trabajo; (Procesos de) validación y cualificación (equipos e instalaciones); Programas de mantenimiento preventivo (equipos e instalaciones); Seguimiento y análisis de las pruebas de esterilidad, de las condiciones de la calidad del aire y de sus tendencias; Criterios de selección de los proveedores, en su caso; Contratación de terceras partes y proveedores; Sistema de auditoría interna, autoinspección y acciones correctivas y preventivas; Gestión del rechazo, almacenamiento y destrucción del material de los donantes en los casos en que no sea apto para la aplicación en el ser humano; Gestión de las reclamaciones, incumplimientos, reacciones adversas graves, efectos adversos graves, retiradas y planes de contingencia para la finalización de las actividades; Trazabilidad, tratamiento de la información y confidencialidad; Importación/exportación; Registros: informe anual de actividades e informe anual de vigilancia. Deberá entrevistarse a la persona responsable y efectuar una evaluación crítica del papel que desempeña. Deberán identificarse claramente las operaciones subcontratadas y las responsabilidades de las diferentes partes. Deberá examinarse si los contratos cumplen las disposiciones nacionales para la transposición de las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE. Durante la inspección deberá examinarse el procedimiento para registrar y revisar las reacciones y los efectos adversos graves y el sistema para retirar células y tejidos distribuidos desde dentro y fuera de los Estados miembros. Se examinarán y se comentarán todos los informes sobre efectos y reacciones adversas graves. Deberá examinarse el sistema para efectuar autoinspecciones en la organización. A pesar de que normalmente los inspectores no leen los informes, puede resultar útil revisar la programación de la auditoría o autoinspección del año anterior para confirmar que las auditorías han resultado satisfactorias. A continuación se puede comprobar el registro de acciones correctivas y preventivas adoptadas en el momento en que se realizaron las auditorías o autoinspecciones a fin de garantizar que se ha puesto en práctica la acción correcta. Deberán revisarse los procedimientos para controlar las exportaciones o importaciones de tejidos y células (si son pertinentes) y examinarse la documentación relativa a los casos individuales. En el anexo 5 se facilitan directrices técnicas sobre la inspección de importaciones y exportaciones. revisión de los resultados clínicos de las células y los tejidos aplicados o la interacción, en su caso, con los usuarios clínicos. 14 Las inspecciones temáticas incluirán la evaluación de la documentación relacionada con el tema en cuestión. En las inspecciones de procesos se examinará la documentación específica relativa a un proceso finalizado o no finalizado (o varios) para la preparación de células o tejidos, incluidos los siguientes aspectos: • • • • • • • • 6.2.4 Cumplimiento del expediente del método de preparación (véase el anexo 9); Trazabilidad y seguimiento (incluido el donante y el sistema de codificación de los tejidos o células utilizado); Validación del proceso; Instrucciones de procesamiento (procedimientos normalizados de trabajo) y registros; Procedimientos de puesta en circulación; Especificaciones y datos sobre el control de la calidad de los materiales de partida, intermedios y células y tejidos tratados, otros materiales, reactivos y equipos técnicos; Acondicionamiento y etiquetado; Distribución. Reunión final Una vez finalizada la inspección, los inspectores deberán resumir las conclusiones en la reunión final con los representantes de la organización, normalmente la persona responsable, la persona encargada del sistema de gestión de la calidad (si procede) y cualquier miembro del personal invitado por la persona responsable. La reunión final es una parte importante de la inspección. Las deficiencias observadas durante la inspección deberán describirse con claridad y, si el procedimiento normalizado de trabajo de la autoridad competente así lo establece, deberán ser notificadas por escrito a la organización. En el anexo 7 se propone un modelo de formulario estándar. Deberá comentarse oralmente la gravedad de las deficiencias detectadas. En esta reunión se describirán los hechos y las pruebas objetivas que apoyan las observaciones, en especial, en relación con las conclusiones más importantes o críticas. La organización, si lo desea, puede debatir propuestas iniciales para la aplicación de la medida paliativa. En la medida de lo posible, en esta reunión se comentarán todas las observaciones importantes, a fin de que la organización pueda poner en práctica la acción correctiva necesaria a la mayor brevedad posible. Las deficiencias se comunicarán teniendo en cuenta la legislación nacional que transpone las tres Directivas comunitarias sobre tejidos y células. En el caso de detectar deficiencias críticas que impliquen un riesgo inmediato para la salud y la seguridad de los donantes y receptores de tejidos y células, el cuerpo de inspectores delegará competencias a los inspectores para solicitar la cuarentena inmediata o el cese del suministro y, si procede, la retirada de las células o tejidos humanos afectados. En estas circunstancias especiales se cumplirán los procedimientos normalizados de trabajo de la autoridad competente que correspondan. 6.2.5 Notas de la inspección Los informes de la inspección deberán estar basados en las notas tomadas durante la misma. Estas notas se gestionarán de conformidad con las prácticas especificadas por la autoridad competente. En el anexo 7 se facilita un formulario de conclusiones de la inspección que puede emplearse para anotar las conclusiones. 15 6.3 Procedimientos de inspección: después de la inspección 6.3.1 Informe de inspección y acción correctiva El informe escrito de la inspección incluirá información general sobre el establecimiento de tejidos, una descripción de la inspección y las observaciones y conclusiones extraídas de la misma. El informe incluirá asimismo una referencia al expediente del establecimiento de tejidos, junto con cualquier corrección de dicho expediente realizada a raíz de la inspección. En el anexo 8 se recoge una propuesta de formato estándar para el informe. Incluye una clasificación estándar de las deficiencias. Dependiendo de los procedimientos internos de la autoridad competente, se extraerán de este informe las conclusiones de la inspección que se enviarán por carta al establecimiento de tejidos o bien, se enviará el informe completo al establecimiento de tejidos. Las conclusiones del informe deberán identificar claramente las deficiencias, clasificarlas como críticas, importantes u otros con arreglo a las definiciones del anexo 8 (esta clasificación se realiza normalmente en el cuerpo de inspectores para garantizar la coherencia con otras inspecciones). Deberá fijarse una fecha límite para que el establecimiento de tejidos presente propuestas y una planificación para rectificar las deficiencias descritas en el informe (plan de acción). Los inspectores evaluarán el plan de acción propuesto y, sobre esta base, realizarán una recomendación a la autoridad competente encargada de conceder la autorización con arreglo al mandato específico de la inspección, detallando claramente si el establecimiento de tejidos cumple o no las leyes nacionales para la transposición de las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE. El establecimiento de tejidos será informado de la decisión por escrito. En algunos casos, el equipo encargado de realizar la inspección puede considerar necesario realizar una segunda visita al centro (repetición de la inspección) o solicitar información adicional sobre la acción correctiva antes de efectuar una recomendación. La medida tomada por la autoridad competente dependerá de la naturaleza y el alcance de las deficiencias y de la adecuación del plan de acción correctiva, de conformidad con las Directivas comunitarias y los amplios conocimientos de la autoridad competente sobre las prácticas existentes en relación con todos los tipos de establecimientos de tejidos. 6.3.2 Acreditación, designación, autorización o aprobación de los establecimientos de tejidos De conformidad con el artículo 6 de la Directiva 2004/23/CE, los establecimientos de tejidos deberán ser acreditados, designados, autorizados o aprobados por una autoridad competente para las actividades que realizan. En el anexo 10 se propone un formato para un certificado de autorización basado en las disposiciones de las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE. Este formato podría facilitar la creación del registro público de la autoridad competente para los establecimientos de tejidos exigido en virtud de la Directiva 2004/23/CE (artículo 10) y la creación de una red que conecte los registros nacionales de establecimientos de tejidos, tal y como se exige en virtud del apartado 3 del artículo 10. El formato propuesto incluye sólo la información mínima que ha de aparecer siempre en el certificado y en el registro 16 de la autoridad competente de los establecimientos de tejidos autorizados. No obstante, se puede añadir más información para cumplir los requisitos específicos de la autoridad competente. No se publicará en el registro general, pero sería parte del registro nacional mantenido por la autoridad competente. Este formato puede utilizarse independientemente de si la acreditación, designación, autorización o aprobación iniciales de la autoridad competente están basadas o no en inspecciones in situ. Cualquier autoridad competente deberá, a petición de otra, facilitar una copia del certificado de autorización de un establecimiento de tejidos. 17 Figura 1: Proceso de inspección Inicio de la inspección • • • • • Nombrar al director del equipo de inspección Definir los objetivos, alcance y criterios de la inspección Determinar la viabilidad de la inspección Seleccionar al equipo de la inspección Notificar al establecimiento que se va a inspeccionar Revisión de los documentos • • Revisar el expediente del establecimiento de tejidos Determinar la idoneidad con respecto a los criterios de la inspección Preparación para la -inspección in situ • • • Preparar el plan de inspección Asignar trabajo al equipo de inspección Preparar los documentos de trabajo Ejecución de la inspección in situ • • • • • • • Celebrar la reunión inicial Informar durante la inspección Decidir las funciones y responsabilidades de guías y observadores Recoger y verificar la información Elaborar las conclusiones de la inspección Preparar las conclusions de la inspección Celebrar la reunión final Preparación, aprobación y distribución del informe de la inspección • • • • • Preparar el informe de la inspección Aprobar y distribuir el informe de la inspección con deficiencies clasificadas Proponer un plan de acción (por parte del establecimiento inspeccionado) Evaluar el plan de acción Realizar recomendaciones a la autoridad competente en relación con la autorización, acreditación y aprobación Seguimiento de la inspección 18 7.0 Sistema de gestión de la calidad del cuerpo de inspectores Cada autoridad competente dispondrá de un sistema de gestión de la calidad con los correspondientes procedimientos normalizados de trabajo y un sistema apropiado de auditoría interna. Estas autoridades efectuarán una evaluación periódica de sus sistemas de inspección atendiendo a los procedimientos especificados. A continuación se recoge información que podría ser de utilidad para desarrollar el sistema de gestión de la calidad. 7.1 Resultados del sistema Cada autoridad competente establecerá su propia lista a título indicativo. Como mínimo, deberán evaluarse periódicamente los siguientes indicadores de resultados: • • • • • • • 7.2 Número de visitas de inspección al año; Número de centros acreditados, designados, autorizados o aprobados al año; Intervalo de tiempo medio desde la inspección hasta el informe final; Número de procesos evaluados al año; Número de procesos autorizados al año; Intervalo medio de tiempo transcurrido entre la solicitud de autorización del proceso y el informe final; Comparación de los resultados de inspecciones posteriores. Resultados de los inspectores Los inspectores y expertos (cuando proceda) se someterán a una revisión anual de sus resultados que incluirá la identificación de necesidades de formación. Entre los indicadores clave de los resultados que deberán revisarse periódicamente se encuentran los siguientes: • • • • • 7.3 Número de inspecciones realizadas al año por cada inspector; Número de centros acreditados, designados, autorizados o aprobados por cada inspector al año (en su caso); Intervalo de tiempo medio que cada inspector emplea desde la inspección al informe final; Número de procesos evaluados (si procede) por cada inspector al año; Número de procesos autorizados (si procede) por cada inspector al año. Habilidades de los inspectores El sistema deberá incluir una evaluación periódica realizada, por ejemplo, por inspectores especialistas o con dilatada experiencia, cuya función sea la de observadores de las visitas de inspección a fin de valorar las habilidades de los inspectores en los siguientes ámbitos: • • • • El alcance y profundidad de la inspección; La habilidad para reconocer deficiencias; La evaluación de la gravedad de las deficiencias; La acción recomendada; 19 • La eficacia con la que la acción decidida se lleva a cabo. Nota: Estos indicadores deberán adaptarse al tipo, tamaño y complejidad de los establecimientos de tejidos inspeccionados. Anexo 1: Obtención y evaluación de donantes Obtención Los inspectores deberán comprobar si el organismo de obtención cumple los requisitos establecidos con arreglo a la Directiva 2006/17/CE y con las medidas de aplicación en los Estados miembros. Se podrán verificar las prácticas de donación y obtención: • • indirectamente auditando estos servicios en el establecimiento de tejidos; o bien, directamente realizando una inspección específica de las instalaciones de la organización donde estas actividades tienen lugar. Se recomiendan los siguientes métodos para verificar el cumplimiento con estos requisitos: Revisión de los documentos • • • • • • • • • • • Organigrama: descripción de los trabajos, cualificaciones y competencia del médico autorizado y cualificaciones y formación de la plantilla; Autorización y acreditación de las condiciones de la obtención (si la autoridad competente no es responsable de la autorización); Datos relativos al donante: procedimientos normalizados de trabajo y registros; Proceso de obtención: procedimientos normalizados de trabajo y registros; Procedimientos normalizados de trabajo para la verificación de la identidad de los donantes; Procedimientos normalizados de trabajo para la evaluación de los criterios de selección de los donantes fallecidos (muerte cerebral y cardiaca) y donantes vivos; Procedimientos normalizados de trabajo para obtener muestras de sangre para pruebas serológicas o de amplificación de ácidos nucleicos de los donantes, identificación y manipulación de las muestras y validación y evaluación de las pruebas de laboratorio; Procedimientos normalizados de trabajo para el acondicionamiento, el etiquetado y el transporte, en su caso; Sistema de trazabilidad (como por ejemplo, codificación de las células o tejidos obtenidos); Documentación presentada junto con los tejidos o células al establecimiento de tejidos; Procedimientos normalizados de trabajo para reacciones y efectos adversos graves. Entrevistas con el personal 20 • Entrevistas con el personal seleccionado para evaluar sus conocimientos y comprensión de los procedimientos así como la adecuación de la formación facilitada. Observaciones y exámenes • • • • • • • Los inspectores comprobarán que la evaluación y la selección de los donantes han sido realizadas por personal formado de conformidad con los procedimientos normalizados de trabajo y que se han descrito en detalle en los registros. Los inspectores revisarán los registros de cribado y selección de los donantes prestando atención a los requisitos relativos a la identidad de los donantes, los datos de consentimiento, la información facilitada, el historial médico, la evaluación de los criterios de selección y riesgos relacionados con el comportamiento, el examen físico exhaustivo y la evaluación de los resultados de las pruebas del laboratorio. Los inspectores buscarán pruebas de que, en el caso de donantes vivos, las entrevistas directas se realizan cumpliendo con los requisitos especificados en el anexo I de la Directiva 2006/17/CE. Los inspectores comprobarán que, en el caso de donantes fallecidos, se ha registrado la causa, la hora y las circunstancias de la muerte. Deberán confirmar asimismo que antes de que se iniciase la obtención de los tejidos se habían cumplido los requisitos nacionales y locales relativos a la confirmación del fallecimiento. Los inspectores seleccionarán varios registros de donantes al azar para confirmar que el establecimiento de tejidos cumple los criterios de exclusión de donantes establecido en virtud del anexo I de la Directiva 2006/17/CE. Esta revisión garantizará que se han revisado los antecedentes personales relativos al comportamiento del donante (pertinentes en caso de riesgo importante de transmisión de enfermedades). Deberá prestarse especial atención a los tumores, infecciones y factores de riesgo para enfermedades transmisibles. Los inspectores verificarán que se han realizado todas las pruebas biológicas obligatorias de conformidad con la legislación aplicable. En el caso de donantes fallecidos, las muestras de sangre deberán haberse obtenido antes de la muerte o, de no ser posible, en un plazo de 24 horas desde el momento del fallecimiento. En el caso de donantes vivos, las muestras de sangre deberán obtenerse en el momento de la donación o, si no es posible, en un plazo de siete días desde el momento de la donación. Los inspectores deberán comprobar que las muestras de sangre utilizadas para la evaluación no están diluidas por infusiones o transfusiones previas que pudiesen invalidar el resultado de la prueba. Condiciones de la obtención: Los inspectores comprobarán que la obtención de tejidos y células se efectúa en locales adecuados por personal formado y que se emplean equipos cualificados y métodos descritos detalladamente en los procedimientos normalizados de trabajo. Las instalaciones deberán tener una zona exclusiva para donantes fallecidos. Los inspectores comprobarán que se emplean técnicas asépticas y procedimientos adecuados para la descontaminación y la limpieza a fin de evitar la contaminación cruzada o un nivel más elevado de contaminación. Siempre que sea posible deberán emplearse instrumentos estériles de un solo uso. El equipo y los instrumentos utilizados deberán ser cualificados y deberán esterilizarse entre obtenciones, siguiendo un método validado. 21 • • • En el caso de donantes vivos, la obtención deberá producirse en un ambiente que garantice su salud, seguridad y privacidad. Transporte: Los inspectores examinarán la adecuación de la zona donde se almacenan temporalmente los tejidos o células antes de su expedición y transporte al establecimiento de tejidos (incluido el control de la temperatura). Examinarán algunos contendores y sus etiquetas y evaluarán su idoneidad. Comprobarán la esterilidad del envase primario en el momento del uso y verificarán si se mantiene la integridad y las condiciones de almacenamiento o transporte exigidas para los tejidos o las células. Si la inspección del establecimiento de tejidos donde se procesan y distribuyen los tejidos o células se produjo con anterioridad a la inspección de la organización o del establecimiento de obtención, los inspectores pueden realizar una comprobación cruzada al azar de los datos biológicos y clínicos o cualquier otro dato pertinente de los donantes comparándolos con los registros de los donantes del establecimiento de tejidos. Datos relativos al donante Deberá existir un registro por cada donante, que contenga la siguiente información: a) El nombre y apellidos del donante y su fecha de nacimiento; si en la donación participan madre e hijo (por ejemplo, placenta o sangre del cordón umbilical), deberá indicarse el nombre y la fecha de nacimiento de la madre y el nombre, si se sabe, y la fecha de nacimiento del niño; b) Edad, sexo, antecedentes médicos y personales (la información recogida deberá bastar para permitir la aplicación de los criterios de exclusión, en su caso); c) En su caso, el resultado de la exploración física; d) En su caso, la fórmula empleada para calcular la hemodilución; e) En su caso, el formulario de consentimiento o autorización; f) Los datos clínicos, los resultados de los análisis de laboratorio y demás pruebas realizadas; g) Si se llevó a cabo una autopsia en un donante fallecido, los resultados tienen que figurar en el expediente (en el caso de células y tejidos que no pueden almacenarse mucho tiempo, se registrará un informe preliminar de la autopsia); h) En el caso de donantes de células progenitoras hematopoyéticas, estará documentada la compatibilidad del donante con el receptor. En caso de donaciones sin vínculo de parentesco, cuando la organización responsable de la obtención tiene acceso limitado a los datos del receptor, la organización que realiza el trasplante recibirá los datos del donante necesarios para confirmar la compatibilidad; i) En el caso de donaciones de gametos que no son de la pareja, se realizará un cribado genético de genes autosómicos recesivos prevalentes en la etnia del donante según datos científicos internacionales. Se evaluará asimismo el riesgo de transmisión de enfermedades hereditarias presentes en su familia. El donante deberá dar su consentimiento para realizar todas estas pruebas; 22 j) En el caso de donantes vivos, se evaluará cualquier riesgo potencial para la propia salud (por ejemplo, la capacidad de un donante de médula ósea para someterse a una anestesia general o superovulación, sedación o los riesgos asociados al procedimiento de recogida de óvulos). Los expedientes deberán cumplir la legislación relativa a la protección de datos y serán legibles y permanentes. Deberán estar en vigor las medidas de protección de datos y confidencialidad de conformidad con el artículo 14 de la Directiva 2004/23/CE. Informe de la obtención Para cada obtención de célula o tejido deberá trasladarse un informe de obtención al establecimiento de tejidos. En dicho informe figurarán, como mínimo los datos siguientes: a) El nombre y la dirección del establecimiento de tejidos que recibirá las células o los tejidos; b) Los datos de identificación del donante (también quién ha identificado al donante y de qué modo), de conformidad con la legislación aplicable relativa a la protección de datos; c) Una descripción e identificación de las células y tejidos obtenidos (con inclusión de las muestras que deban someterse a prueba, si procede); d) La identidad de la persona responsable de esta obtención y su firma; e) La fecha, la hora (si procede, principio y fin), el lugar de la obtención, el procedimiento normalizado de trabajo utilizado, así como posibles incidentes sobrevenidos. Si procede, las condiciones ambientales de las instalaciones (descripción de los locales en que se realizó la obtención); f) La fecha, la hora y la persona que ha obtenido las muestras para los ensayos biológicos; g) En el caso de donantes fallecidos, las condiciones de conservación del cadáver: refrigerado (o no) y la hora de comienzo y de finalización de la refrigeración; h) Números de identificación o de lote de los reactivos y de las disoluciones empleadas en el transporte (si procede); i) En el caso de donantes fallecidos, el informe deberá indicar asimismo la hora y la fecha del fallecimiento. Cuando el esperma se haya obtenido en el domicilio, este particular figurará en el «informe de obtención», que sólo contendrá: a) El nombre y la dirección del establecimiento de tejidos que recibirá las células o los tejidos; b) La identificación del donante (si procede); c) La firma del donante mediante la que confirma que el esperma es suyo. 23 Evaluación de donantes Deberá verificarse el cumplimiento de los requisitos para la evaluación establecidos en virtud de la Directiva 2006/17/CE a través de los siguientes mecanismos: • Inspecciones de los laboratorios para la evaluación de donantes: Cuando la evaluación se realice fuera del establecimiento de tejidos o el organismo de obtención, y la autoridad no sea competente para realizar inspecciones en un laboratorio de tales características, los inspectores deberán, durante la inspección general de los sistemas, solicitar pruebas de que el laboratorio externo ha sido acreditado, designado, autorizado o aprobado para realizar dichas pruebas por las autoridades competentes adecuadas. Los inspectores que realicen las inspecciones en los establecimientos de tejidos deberán: o Solicitar una copia del certificado de autorización o verificar con las demás autoridades competentes que se ha concedido la autorización adecuada para realizar el cribado de donantes de células y tejidos; o Solicitar a los establecimientos de tejidos que confirmen el modo en que comprueban que los laboratorios que realizan las evaluaciones cumplen los requisitos; o Solicitar a los establecimientos de tejido que confirmen el modo en que comprueban el cumplimiento continuado de los requisitos. Durante la inspección del establecimiento de tejidos se revisarán los medios para realizar dichas confirmaciones. • O como parte de la inspección general de los sistemas del organismo de obtención o del establecimiento de tejidos: Cuando el laboratorio forma parte de un establecimiento de tejidos, el inspector deberá: o Comprobar si la evaluación descrita en los procedimientos cumple los requisitos de las normativas nacionales para la transposición de la Directiva 2006/17/CE; o Examinar la evaluación realizada en la práctica y analizar un número representativo de expedientes a fin de verificar que cumplen las normativas nacionales para la transposición de la Directiva 2006/17/CE; o Revisar los procedimientos normalizados de trabajo. Anexo 2: Recepción, procesamiento, almacenamiento y distribución Recepción: Verificación del control de las células y los tejidos recibidos Los inspectores comprobarán si el establecimiento de tejidos verifica que las células y los tejidos recibidos cumplen los requisitos establecidos con arreglo a la Directiva 2006/17/CE y las medidas de aplicación en los Estados miembros. El sistema deberá revisarse en su totalidad, prestando especial atención a los aspectos que se mencionan a continuación. Se recomienda emplear los siguientes métodos para verificar el cumplimiento con estos requisitos: 24 Revisión de los documentos • • • • • • • • • • Autorización o consentimiento del donante o su familia; Documentación de los antecedentes personales y médicos del donante; Evaluación de donantes; Identificación del donante y examen físico; Revisión del historial del donante y de la aceptación o el rechazo; Documentación de la obtención; Etiquetado, acondicionamiento y transporte de las células o tejidos obtenidos; Procedimiento de obtención de células y tejidos; El proceso de interconsulta para potenciales donantes; El sistema para garantizar la trazabilidad al tiempo que se protege la confidencialidad. Entrevistas con el personal Se entrevistará a la persona responsable de realizar la selección de los donantes. Si dicha persona no es el médico autorizado, sería muy recomendable que éste estuviese también presente. Si hay otra organización que desempeñe un papel importante (por ejemplo, una oficina de coordinación de trasplantes), también debería invitársele a asistir. Observaciones y exámenes En ciertos casos, puede resultar útil para los inspectores realizar una comprobación cruzada de la información sobre la obtención recogida durante la inspección de un establecimiento de tejidos inspeccionando un establecimiento de obtención. Procesamiento Los inspectores comprobarán si el establecimiento de tejidos cumple los requisitos establecidos con arreglo al anexo II de la Directiva 2006/86/CE y con las medidas de aplicación en los Estados miembros. Los inspectores comprobarán la exactitud de la información facilitada en el expediente del establecimiento de tejidos y el expediente del método de preparación y determinarán si los procesos aplicados son compatibles con los equipos y las instalaciones utilizadas por el establecimiento de tejidos. Se recomienda emplear los siguientes métodos para verificar el cumplimiento con estos requisitos: Revisión de documentos • • • • Procedimientos normalizados de trabajo; Registros de procesamiento; Resultados de la clasificación de las áreas de procesamiento (incluida una revisión de las pruebas documentadas en las que se base la clasificación comunicada); Procedimientos y datos para garantizar y demostrar el cumplimiento continuado de la clasificación (incluido el recuento de partículas, muestras microbianas del ambiente y procedimientos para acceder a la zona, incluidos procedimientos relativos a la ropa); 25 • • • Procedimientos para evitar la contaminación cruzada; Procedimientos para garantizar un acceso restringido adecuado y la protección de los datos confidenciales; Procedimientos para la comunicación de reacciones y efectos adversos graves. Entrevistas con el personal Entrevistas con el personal seleccionado para evaluar sus conocimientos y su nivel de comprensión de los procedimientos. Observaciones y exámenes • • • Inspección del área de procesamiento (controlada). Deberá prestarse especial atención a los siguientes elementos: o Flujo de personal, células y tejidos recibidos, productos finales y residuos en la zona; o Disposición, tamaño y funcionamiento de los vestuarios entre zonas clasificadas; o Procedimientos para cambiarse, vestirse, lavarse las manos, etc.; o Idoneidad de las superficies, equipos, etc.; Observación del procesamiento en el momento en que se lleva a cabo, si es posible; Revisión de los informes de reacciones o efectos adversos graves relacionados con el procesamiento y la acción correctiva asociada. Almacenamiento y distribución Los inspectores comprobarán si el establecimiento de tejidos cumple los requisitos establecidos con arreglo al anexo II de la Directiva 2006/86/CE y las medidas de aplicación en los Estados miembros. Los inspectores comprobarán si la información facilitada en el expediente del establecimiento de tejidos es exacta. Se recomienda emplear los siguientes métodos para verificar el cumplimiento con estos requisitos: Revisión de documentos • • • • • • Procedimientos normalizados de trabajo para el almacenamiento; Procedimientos normalizados de trabajo para la distribución; Procedimientos normalizados de trabajo para la trazabilidad; Procedimientos normalizados de trabajo para la retirada; Procedimientos normalizados de trabajo para el etiquetado (del contenedor primario y del de envío); Acuerdos con terceras partes que pueden distribuir tejidos o células en nombre del establecimiento de tejidos. Entrevistas con el personal Entrevistas con el personal seleccionado responsable del almacenamiento y la distribución. 26 Observaciones y exámenes • • • • • • • • • • Inspección de la zona de almacenamiento. Deberá prestarse especial atención a los siguientes elementos: o Control de las condiciones físicas pertinentes (por ejemplo, la temperatura y la humedad); o Clara separación entre tejidos o células en cuarentena y de «distribución autorizada»; o El sistema para autorizar y ejecutar la transferencia de tejidos o células de cuarentena a «distribución autorizada»; o El sistema empleado para la identificación de tejidos y células y la trazabilidad en cada paso del proceso (por ejemplo, codificación, etiquetado y sistema TI); o Residuos que suponen un peligro biológico (zona restringida, seguridad, manipulación, acondicionamiento y etiquetado, etc.). Examen de las etiquetas, incluida la etiqueta del último paquete de tejidos o células; Examen de los registros de la temperatura de almacenamiento; Examen de la trazabilidad, seleccionando células y tejidos tratados listos para su distribución y solicitando información sobre los siguientes aspectos: o El historial del donante; o El día y la hora en que se han procesado; o La identidad de la persona que ha realizado el procesamiento; o Qué números de lotes de reactivos o aditivos se han utilizado, con las fechas de caducidad; o El equipo utilizado y, en su caso, su mantenimiento y su cualificación; o Especificaciones para cada paso de los procesos; o A qué condiciones ambientales se han expuesto los tejidos o células (también los lugares de almacenamiento); o Qué tipo de prueba microbiológica se ha realizado y cuáles han sido sus resultados (también los resultados del control microbiológico de los productos a base de células, de conformidad con la Farmacopea Europea o controles alternativos aceptables para la autoridad competente); o Quién ha puesto en circulación los tejidos o células y sobre qué base. Revisión de la documentación sobre las solicitudes particulares de tejidos y células y de los tejidos o células distribuidos; Examen de la información de la etiqueta del paquete distribuido con tejidos o células; Revisión de los informes de reacciones o eventos adversos graves y la acción correctiva asociada. Revisión de, al menos, un registro de mantenimiento y calibración de cada pieza crítica del equipo de almacenamiento seleccionado por el equipo de inspección; Revisión de un ejemplo de un documento que confirme la autorización de transferencia de los tejidos o células de la cuarentena a la distribución. Los inspectores revisarán ejemplos representativos de la documentación del donante sobre tejidos o células disponibles para la distribución o distribuidos durante el año pasado y sobre tejidos o células en cuarentena o que han sido importados/exportados. Siempre que sea posible, los expediente deberán ser seleccionados por el equipo de inspección y deberán incluir expedientes de los tejidos observados en el inventario del establecimiento de tejidos. En algunas 27 ocasiones puede ser necesario examinar los expedientes en busca de tejidos o células que hayan caducado. Anexo 3: Evaluación de los métodos de preparación Los inspectores comprobarán si el establecimiento de tejidos cumple los requisitos establecidos con arreglo al anexo II de la Directiva 2006/86/CE y las medidas de aplicación en los Estados miembros. Los procesos simples, consolidados y ampliamente extendidos pueden evaluarse adecuadamente durante una inspección general de los sistemas (véase el anexo 2). Si se va a evaluar un método de preparación complejo, innovador o específico de un establecimiento de tejidos concreto, se recomienda que se haga por separado durante una inspección temática. Antes de la inspección • • El establecimiento de tejidos presentará un expediente revisado del método de preparación (véase el anexo 9) (o un nuevo apéndice del expediente) para autorizar el nuevo método. El expediente del método de preparación se evaluará sobre la base de una revisión exhaustiva de la documentación efectuada antes o después de la inspección. Las conclusiones de dichas revisiones se pueden confirmar durante una posterior inspección in situ. Durante la inspección La inspección deberá ser realizada, como mínimo, por un evaluador o inspector y, si es posible (a menos que el evaluador o el inspector sean expertos técnicos en las correspondientes fases del proceso), por uno o más expertos de un ámbito pertinente al método que se está analizando. Los expertos consultarán a otros especialistas siempre que sea necesario (véase el punto 6.1). Deberán verificarse los siguientes aspectos durante la inspección: 1. Evaluación de los informes de validación Los establecimientos de tejidos deberán demostrar que el procesamiento de células y tejidos críticos ha sido validado y que no provoca que los tejidos o las células sean clínicamente ineficaces o dañinos para el receptor o el paciente. No hay requisito alguno para la aprobación centralizada de un proceso de procesamiento concreto o para estudios que demuestren la eficacia clínica. La Directiva 2006/86/CE permite que los estudios de validación se basen en alguno de los que se enumeran a continuación: Estudios realizados por el propio establecimiento Los informes deberán incluir, al menos: • Un plan de validación que especifique los parámetros críticos que se van a evaluar y los umbrales de resultado aceptables para dichos parámetros; 28 • • • Un metodología documentada; Todos los resultados obtenidos, expuestos con claridad y con una interpretación pertinente; Una declaración firmada de la aceptación o rechazo de la validación por parte del director de calidad o la persona responsable. Datos de los estudios publicados Las publicaciones estarán disponibles para su revisión. En este caso, los establecimientos de tejidos deberán demostrar que pueden reproducir de forma eficaz el método publicado con los mismos resultados en su centro (validación operativa). Se facilitarán copias de los procedimientos normalizados de trabajo pertinentes y los resultados de la validación operativa a fin de demostrar que el método es equivalente al aplicado en el estudio publicado. Si se han cambiado o adaptado pasos específicos, la validación independiente deberá confirmar que dichos cambios no han invalidado el método. Deberá incluirse una incluirse una declaración firmada de la aceptación o rechazo de la validación por parte del director de calidad o la persona responsable. En el caso de procedimientos de procesamiento ya consolidados, se puede utilizar la evaluación retrospectiva de los resultados clínicos para tejidos y células facilitados por el establecimiento. Se facilitarán pruebas del número de injertos de células o tejidos implantados siguiendo el procesamiento realizado con el método que se está analizando y el período durante el cual se produjeron dichas implantaciones. En los casos en los que existía un sistema de vigilancia en ese momento, deberá demostrarse que los usuarios clínicos conocían el proceso para comunicar reacciones adversas. Deberá incluirse una declaración firmada de la aceptación o rechazo de la validación por parte de la persona responsable. 2. Evaluación de los informes de evaluación del riesgo Cuando se introducen nuevos métodos de preparación, por norma general se habrán realizado evaluaciones del riesgo en el marco del proceso de transición. En el anexo 4 se recogen directrices para la revisión de las valoraciones de los riesgos durante la inspección o durante la evaluación de los métodos de preparación. Medicamentos de terapia avanzada Las células y tejidos sustancialmente manipulados cuya función o funciones esenciales difieran entre el recipiente y el donante se consideran «manipulados por ingeniería» y están regulados por el Reglamento relativo a medicamentos de terapia avanzada6. Los procesos que se mencionan en la lista del anexo I del Reglamento sobre medicamentos de terapia avanzada se consideran no «manipulados sustancialmente» por lo que corresponden a las Directivas relativas a células y tejidos, es decir, corte, trituración, moldeo, centrifugación, imbibición en disoluciones antibióticas o 6 Reglamento (CE) nº 1394/2007 del Parlamento Europeo y del Consejo, de 13 de noviembre de 2007, sobre medicamentos de terapia avanzada y por el que se modifican la Directiva 2001/83/CE y el Reglamento (CE) nº 726/200 (DO L 324 de 10.12.2007, p. 121). 29 antimicrobianas, esterilización, irradiación, separación, concentración o purificación celular, filtrado, liofilización, congelación, criopreservación y vitrificación. Esta lista no es exhaustiva; los procesos empleados en la tecnología de reproducción asistida no se consideran «sustancialmente manipulados». Los límites entre los medicamentos de terapia avanzada y las células y tejidos pueden no estar claros en algunas ocasiones. En este sentido, en virtud del artículo 17 del Reglamento 1394/2007, los fabricantes de productos a base de genes, células o tejidos podrán solicitar una recomendación científica de la Agencia7 para determinar si hay fundamento científico para clasificar su producto como medicamento de terapia avanzada. (Para más información y valoración, véase: [email protected]). Cuando se haya emitido un dictamen a este respecto, tanto por parte del Comité de terapias avanzadas como por parte de las autoridades competentes del Estado miembro, deberá guardarse junto con el expediente del establecimiento de tejidos o el del método de preparación. Anexo 4: Evaluación de los informes de evaluación del riesgo Las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE establecen varios requisitos legales para valorar los riesgos cuando se manipulan tejidos o células para uso en seres humanos. El transplante a pacientes humanos conlleva un riesgo de transmisión de enfermedades que puede reducirse considerablemente si se adoptan medidas científicas y prácticas en el establecimiento de tejidos. Con este fin pueden aplicarse nuevas técnicas o procedimientos revisados que se actualizan para adaptarlos a las mejores recomendaciones científicas. Los programas de inspección deberán verificar que todos los establecimientos de tejidos cumplen su tarea de realizar evaluaciones del riesgo para determinar el destino de las células y tejidos almacenados cuando se introducen nuevos criterios de evaluación o de selección de donantes o alguna fase del procesamiento considerablemente modificada que mejore la calidad o la seguridad (anexo II, punto C del apartado 5 de la Directiva 2006/86/CE). Este enfoque cobra aún más importancia cuando el proceso de inspección identifica células o tejidos donados, evaluados y almacenados con anterioridad, siguiendo los reglamentos nacionales existentes o las prácticas profesionales que podrían no cumplir en su totalidad las normativas vigentes. Por ejemplo, los requisitos de la prueba biológica, las prácticas de cribado de donantes o los sistemas de trazabilidad son posiblemente más estrictos en la actualidad que en el pasado. De manera excepcional, en los casos de disponibilidad limitada y en los que se espera obtener un beneficio clínico, las células y los tejidos almacenados podrían utilizarse siempre y cuando las partes interesadas estén totalmente informadas de su estado y las opciones terapéuticas alternativas. Con arreglo al anexo I de la Directiva 2006/17/CE de la Comisión deberá realizarse una valoración de los riesgos justificada documentalmente y aprobada por la persona responsable, tal y como se recoge en el artículo 17 de la Directiva 2004/23/CE, para justificar la aceptación de una donación aun cuando exista uno de los criterios de 7 Agencia Europea de Medicamentos. 30 exclusión mencionados. También será obligatorio realizar una evaluación del riesgo en los casos en los que los antecedentes de viajes y de exposición del donante impliquen un riesgo de infección por el cual no se suele realizar la prueba. Con arreglo al anexo II de la misma Directiva deberá efectuarse una valoración de los riesgos justificada documentalmente a fin de determinar la admisibilidad para uso clínico si las pruebas anti HBc dan positivo o las pruebas HBsAg dan negativo o si la prueba específica para el treponema da reactivo en las muestras de un donante. Los inspectores verificarán que la valoración de los riesgos efectuada en el correspondiente establecimiento de tejidos se llevó a cabo aplicando un enfoque metódico en términos de la evaluación científica de los aspectos relacionados a fin de permitir la adopción de una decisión adecuada. Todos los planes de valoración de los riesgos incluirán documentación sobre los siguientes aspectos: • • • • • • • • El alcance y las circunstancias de la evaluación; Las personas asignadas al programa de trabajo; La identificación de los peligros asociados con el alcance o las circunstancias; Una estimación de su gravedad (impacto) y probabilidad de incidencia; El análisis de riesgos, evaluación y medidas de control para estos peligros; Los motivos científicos para la aceptación o el rechazo de la decisión; Una justificación para la aceptabilidad del riesgo residual; Una declaración de aceptación del riesgo residual por parte de la persona responsable o de las partes. También se puede aplicar un enfoque similar para otras valoraciones de los riesgos a fin de evaluar y apoyar las actividades de obtención o de terceras partes y las prácticas o los sistemas adoptados para minimizar el riesgo de infección de pacientes. Por ejemplo, puede ser pertinente para: • • • • • • • Gestión de los protocolos y las prácticas de selección de donantes; Recepción de tejidos o células en el establecimiento de tejidos; Almacenamiento intermedio de donaciones a la espera de los resultados de las pruebas biológicas; Política de los sistemas de almacenamiento para tejidos y células que se sospecha o se sabe que son positivas; Puesta en circulación formal de las células y los tejidos procesados para almacenamiento o distribución; Justificación para el uso del paciente en casos excepcionales de distribución directa; Aplicación de procesos nuevos o considerablemente modificados. Los planes de gestión deberán identificar y describir las actividades principales del establecimiento de tejidos (por ejemplo, mediante un organigrama) y las circunstancias en las que se aplican las diferentes fases del plan. Todos los componentes del proceso de gestión de los riesgos deberán estar vinculados a las actividades autorizadas o aprobadas del establecimiento de tejidos. Su nivel de detalle deberá corresponder a los riesgos percibidos y conocidos asociados con los diferentes tipos de tejidos o células y estarán integrados en el sistema de calidad. 31 La norma ISO sobre la aplicación de la gestión de los riesgos de los equipos médicos (EN ISO 14971) y el anexo 20 de la Guía europea de prácticas correctas de fabricación8 recogen directrices informativas sobre la aplicación y las herramientas para realizar valoraciones de riesgos. Anexo 5: Importación/exportación: verificación de los requisitos técnicos En el artículo 9 de la Directiva 2004/23/CE se pueden consultar más detalles. 1. Importaciones de tejidos establecimientos de tejidos y células por parte de los Sólo los establecimientos de tejidos autorizados para este fin podrán actuar de importadores de terceros países. La inspección de esta actividad deberá abordar: • • La razón para decidir importar; El tipo de acuerdo adoptado con la parte exportadora, es decir, si se trata de un acuerdo de suministro sistemático o excepcional. Importación sistemática La inspección incluirá el análisis de la documentación relativa a la revisión realizada por el establecimiento de tejidos importador de la equivalencia de los sistemas de calidad y seguridad en el establecimiento exportador. Este análisis abarcará: • • La documentación con la descripción del sistema general de calidad y seguridad en el establecimiento exportador: organigrama, formación del personal, instalaciones, métodos de procesamiento, estudios de validación, sistema de trazabilidad, licencias y acreditación, etc.; La documentación relativa a la revisión de la seguridad y la calidad de las expediciones individuales de tejidos o células: confirmación del tipo de pruebas efectuadas y los resultados, idoneidad del donante, descripción de los tejidos o células, modos de transporte, etc. Importación excepcional En este caso, durante la inspección se examinará la evaluación documentada del establecimiento de tejidos importador sobre la calidad y la seguridad de los tejidos o células importadas. Inspecciones de terceros países por parte de las autoridades competentes de la UE De conformidad con las Directivas comunitarias, los establecimientos de tejidos son responsables de verificar que las organizaciones de las que importan tejidos o células trabajan con normas de calidad y seguridad equivalentes a las especificadas en las Directivas. No obstante, en algunos casos, las autoridades competentes pueden considerar necesario visitar a un proveedor de tejidos o células de un tercer país y 8 http://ec.europa.eu/health/files/eudralex/vol-4/pdfs-en/2008_02_12_gmp_annex20_en.pdf 32 realizar una inspección. Entre las razones para realizar dichas inspecciones cabe citar las siguientes: • • • • • Múltiples establecimientos de tejidos importan de un único establecimiento de un tercer país; Un gran volumen de tejidos o células se importan de un único establecimiento de un tercer país; Se demuestra que el rendimiento de un establecimiento de un tercer país que exporta a un establecimiento de tejidos de la UE es bajo; Se ha asociado una reacción o efecto adverso grave con las células o tejidos en cuestión; Los tejidos y las células se utilizan como material inicial para fabricar un medicamento de terapia avanzada y la Agencia Europea de Medicamentos exige una inspección o visita de las instalaciones a las autoridades competentes en materia de tejidos y células en relación con una solicitud de autorización de comercialización o certificación de los datos de calidad o preclínicos. Procedimientos de inspección Las inspecciones en terceros países se realizarán de conformidad con las directrices recogidas en la sección general de este documento. El cuerpo de inspectores del país en cuestión deberá ser notificado sobre la inspección, se le invitará a acompañar al inspector y recibirá una copia del informe. Si un Estado miembro no es capaz de reunir los suficientes expertos para realizar inspecciones en terceros países o si el establecimiento de tejidos del tercer país que se va a inspeccionar distribuye tejidos y células a varios Estados miembros, éstos podrán organizar inspecciones conjuntas. Intercambio de información Si una autoridad competente de un Estado miembro aprueba la importación desde un establecimiento concreto de un tercer país, se recomienda que el proceso en el que se ha basado la aprobación y el informe se pongan en común con las autoridades competentes de otros Estados miembros (especialmente si algún establecimiento de tejidos de otro Estado miembro está importando tejidos y células desde el establecimiento en dicho tercer país). Para las inspecciones o visitas realizadas a petición de la Agencia Europea de Medicamentos, se facilitará el informe a la Agencia, que lo pondrá a disposición de las autoridades competentes de otros Estados miembro a petición de éstos. 2. Exportaciones de tejidos establecimientos de tejidos y células por parte de los Sólo podrán exportar a terceros países los establecimientos de tejidos autorizados a tal fin. Las inspecciones de esta actividad abarcarán los siguientes puntos: • Verificación de que sólo los tejidos o células que cumplen los requisitos para la aplicación en el ser humano dentro de la UE se exportan con tal fin fuera de la 33 • • UE, a no ser que existan circunstancias especiales tales como la exportación para el uso en un ensayo clínico aprobado con requisitos de seguridad y calidad específicos que difieran de los establecidos por las Directivas relativas a tejidos y células. Se revisará un número representativo de expedientes de donantes y obtenciones a fin de garantizar que se aplican normas de seguridad y calidad equivalentes a los tejidos o células en cuestión. Si los tejidos o células que no cumplen los requisitos normales se exportan sobre la base de una valoración de los riesgos, ésta deberá revisarse para garantizar que ha sido realizada de forma adecuada y que todas las partes involucradas conocían las deficiencias y se mostraron conformes con el análisis del riesgo/beneficio. Para más información sobre la gestión de la valoración de los riesgos, véase el anexo 4. 3. Autorización de la importación/exportación con distribución directa En la Directiva 2004/23/CE se contempla la distribución de tejidos o células en caso de emergencia directamente desde un centro de recogida a un centro clínico. Dado que normalmente no participa en ella ningún establecimiento de tejidos, en el caso de la distribución directa desde un tercer país, la autoridad competente es responsable de autorizar la importación/exportación y puede aplicar criterios más estrictos que los especificados en las Directivas. La distribución directa se aplica principalmente a células progenitoras hematopoyéticas y, en algunos casos, a tejidos y células para tratamientos de fertilidad. En términos generales, la importación/exportación y entrega al centro clínico se permitirán aun en espera de la autorización por la autoridad competente; la autorización deberá concederse con celeridad, teniendo en cuenta la corta vida y la naturaleza única de los tejidos o células así como el estado del receptor. Esto no debería evitar que las autoridades competentes tomen las medidas adecuadas para garantizar que las exportaciones e importaciones directas de tejidos y células cumplan los estándares de calidad y seguridad equivalentes a los establecidos en las Directivas. La solicitud de autorización será realizada por el centro clínico que va a solicitar el material y, en algunos casos, por el registro de trasplantes regional o nacional. Los inspectores deberán asegurarse de que la revisión efectuada por el médico o por el registro nacional o regional de trasplantes incluye: • Los motivos de la importación/exportación; • La documentación del registro o del centro clínico sobre la equivalencia de los sistemas de seguridad y calidad (también cualquier certificado o autorización vigente); • Si faltase información o no se pudiese demostrar el cumplimiento de la totalidad de los requisitos que establecen las Directivas comunitarias, pero el centro clínico desease continuar, deberá revisarse la valoración documentada de los riesgos efectuada por el centro clínico (o registro). Anexo 6: Modelo (propuesto) de expediente de establecimiento de tejidos 34 Expediente de establecimiento de tejidos Cumplimente un expediente para cada centro si el establecimiento de tejidos tiene más de uno Sección A: Información general Nombre completo del establecimiento de tejidos: Nombre y apellidos de la persona responsable, de conformidad con la definición recogida en la Directiva 2004/23/EC: (Adjunte un CV) Nombre y apellidos del director del sistema de calidad (si procede): (Adjunte un CV) Dirección postal del establecimiento de tejidos: Número de teléfono: Número fax: de Dirección electrónica: Resumen de actividades Tipo de tejidos o células Actividad prescrita (AP) Métodos de preparación (MP) aplicados (Introduzca los códigos de los MP indicados 35 (Introduzca los códigos de las AP indicados más abajo) Óseo Cutáneo Vascular Oftálmico Membrana amniótica Ovárico Testicular Otros tejidos …………………............................ Médula ósea Células progenitoras de médula ósea Sangre umbilical Oocitos Espermatozoides Otras células 36 más abajo) ……………………………... Embriones Zigotos Otros …………………...........……… CÓDIGOS DE LAS ACTIVIDADES PRESCRITAS Donación: AP1 Obtención: AP2 Almacenamiento: AP5 Evaluación: AP3 Distribución: AP6 Procesamiento: AP4 Importación: AP7 Exportación: AP8 CÓDIGOS DE LOS MÉTODOS DE PREPARACIÓN Corte/trituración/moldeo MP1 Desmineralización MP13 Centrifugación MP2 Almacenamiento en un medio de cultivo orgánico MP14 MP3 Almacenamiento a 4 ºC MP15 Esterilización (no mediante irradiación) MP4 Glicerolización (alta concentración) MP16 Esterilización por irradiación MP5 Descongelación MP17 Separación, concentración y purificación celular MP6 Fertilización in vitro MP18 Filtrado MP7 Inyección de esperma intracitoplasmático MP19 Liofilización MP8 Preparación del esperma MP20 Congelación MP9 Eclosión asistida MP21 Criopreservación MP10 Cultivo de blastocito MP22 Vitrificación MP11 Maduración in vitro MP23 Secado MP12 Embrión/biopsia del corpúsculo polar MP24 Imbibición en antimicrobianas disoluciones antibióticas o Código/Número de referencia de la autorización de procesamiento de la autoridad competente (si está disponible): 37 Sección B: Actividad – Detalles Incluya un organigrama que describa toda la actividad del establecimiento de tejidos. ¿El establecimiento de tejidos realiza la obtención? SÍ/NO ¿El establecimiento de tejidos obtiene tejidos y células de organismos de obtención externos? En caso afirmativo, indique qué organismos de obtención: ¿El establecimiento de tejidos realiza la evaluación de donantes? SÍ/NO SÍ/NO En caso negativo, indique qué organismos realizan las evaluaciones de tejidos o células de los donantes: Tipos de tejidos, células o sustancias de origen humano recibidas por el establecimiento de tejidos (de obtención propia o externa): Enumérelos aquí o adjunte una lista: Número de donantes de los cuales se han recibido tejidos o células en el establecimiento de tejidos en el año anterior (deberá ser igual al número indicado en el informe anual): Vivos alogénicos (sin vínculo de parentesco, no pareja): Vivos alogénicos (con vínculo de parentesco o pareja): Vivos autólogos: Fallecidos: Tipos de tejidos o células procesados por el establecimiento de tejidos: ¿Cómo se han validado los métodos de procesamiento (para demostrar que no Enumérelos aquí o adjunte una lista: a) ¿Mediante estudios realizados en su establecimiento de tejidos? b) ¿Mediante estudios publicados? 38 provocan la pérdida de eficacia clínica de los tejidos o las células ni resultan tóxicos para el receptor)? c) ¿Mediante un análisis retrospectivo de los resultados clínicos? d) Otros (especifique): …………………………………………………………… (no es necesario cumplimentar esta sección si se usa el expediente del método de preparación) …………………………………………………………… Métodos de evaluación del control de la calidad definitivos y en curso aplicados a tejidos o células: Enumérelos aquí o adjunte una lista: Tipos de sustancias, células o tejidos tratados de origen humano distribuidos por el establecimiento de tejidos: Enumérelos aquí o adjunte una lista: ¿El establecimiento de tejidos recibe células o tejidos tratados de otros establecimientos en el mismo Estado miembro de la UE para su distribución? SÍ/NO ¿El establecimiento de tejidos recibe células o tejidos de otros establecimientos en otro Estado miembro de la UE para su distribución? SÍ/NO ¿El establecimiento de tejidos importa tejidos o células de fuera de la UE SÍ/NO En caso afirmativo, indique qué tipo de tejidos o células y facilite los nombres de los establecimientos de tejidos: En caso afirmativo, indique el tipo de tejidos o células y el país o países de origen de los establecimientos de tejidos: En caso afirmativo, indique el tipo de tejidos o células y el país o países de 39 para su distribución? origen de los establecimientos de tejidos: Número de unidades de células o tejidos (paquetes individuales, bolsas, tubos o viales) distribuidos por el establecimiento de tejidos para aplicación humana durante el pasado año (deberá ser igual al número indicado en el informe anual): Sección C: Personal Nombre y apellidos del director del establecimiento de tejidos (si no coincide con el de la persona responsable) (adjunte un breve CV): Nombre y apellidos del director médico (si no coincide con el anterior) (adjunte un breve CV): Nombre y apellidos del director de procesamiento (si procede) (adjunte un breve CV): Número total de personas en plantilla: Facilite un organigrama indicando las funciones y la jerarquía (insertar en el espacio previsto o adjuntar por separado) Indique en el organigrama cuántas personas están trabajando en la selección de donantes, obtención, procesamiento, control de la calidad, garantía de la calidad, administración, almacenamiento y transporte. 40 Sección D: Instalaciones Describa las instalaciones de almacenamiento y procesamiento. Indique el número de salas, sus medidas y su clasificación medioambiental, si es relevante. (Adjunte un plano de la zona y facilite detalles de las salas (numeradas), su función y personal, así como de los tejidos o células y del personal, material y flujo de residuos.) Sección E: Equipamiento Enumere los principales equipos empleados para el procesamiento y la evaluación. Describa el sistema utilizado para garantizar la trazabilidad (en caso relevante). Sección F: Contratos o acuerdos con otras organizaciones ¿Realiza una tercera parte alguna de las actividades autorizadas (desde la obtención a la distribución)? SÍ/NO En caso afirmativo, indique qué actividades y el nombre la organización que actúa como tercera parte. Facilite copias de los acuerdos pertinentes. Sección G: Transporte y distribución Describa los acuerdos vigentes para transportar cada tipo de tejidos o células desde la 41 obtención al establecimiento de tejidos. Describa los acuerdos vigentes para transportar cada tipo de tejidos o células desde la obtención al establecimiento de tejidos. Sección H: Notificación de reacciones adversas y efectos adversos Describa los acuerdos vigentes para comunicar y gestionar las reacciones y los efectos adversos graves. Sección I: Sistema de gestión de la calidad Facilite una breve descripción del sistema de calidad aplicado al establecimiento de tejidos. Adjunte una lista de los procedimientos normalizados de trabajo en vigor. ¿El establecimiento de tejidos ha sido certificado por algún organismo externo o sociedad profesional? SÍ/NO En caso afirmativo, detalle el organismo y la fecha y añada el número de certificación. Sección J: Firma y fecha 42 Firma de la persona responsable: Fecha: Sección K: Instrucciones para la presentación de este formulario Este formulario se presentará como solicitud inicial para la acreditación, designación, autorización o aprobación por parte de la autoridad competente en materia de tejidos y células. Deberá presentarse nuevamente antes de una inspección a petición del cuerpo de inspectores y siempre que se hayan producido cambios considerables en las actividades, el personal o los procesos o siempre que se haya realizado algún cambio importante en alguno de los documentos adjuntos. Entre los cambios que se consideran importantes se encuentran: - cambio de la persona responsable; cambio en las actividades; uso de nuevo equipo para un proceso autorizado; firma de un nuevo contrato con nuevos subcontratistas o un nuevo acuerdo con un centro de recogida; transferencia de una actividad o más a nuevas instalaciones; cese de las actividades o cierre del centro; introducción de un nuevo sistema de tecnología de la información. Cada autoridad competente incluirá las instrucciones de presentación pertinentes. Anexo 7: Formato propuesto para un formulario de conclusiones de inspección FORMULARIO DE CONCLUSIONES DE LA INSPECCIÓN AUTORIDAD COMPETENTE: «Nombre de la autoridad competente» Nombre y apellidos del inspector jefe: «Nombre y apellidos» Unidad o departamento correspondiente: «Unidad o departamento correspondiente» Nombre y apellidos de los inspectores: «Nombre y apellidos» Unidad o departamento correspondiente: «Unidad o departamento correspondiente» Nombre y apellidos del experto técnico (si es pertinente): «Nombre y apellidos» Unidad o departamento correspondiente: «Unidad o departamento correspondiente» ESTABLECIMIENTO DE TEJIDOS INSPECCIONADO: «Dirección1» 43 «Dirección2» «Nº de teléfono» «Nº de fax» «Nombre y apellidos» Nombre y dirección de la persona responsable: «Nº de teléfono» «Nº de fax» Fecha de la inspección: /___/___/ /___/___/ /___/___/___/___/ Personal Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Instalaciones Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Materiales y equipos Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios 44 Sistema de gestión de la calidad Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Selección de donantes, evaluación de donantes y obtención Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Procesamiento, almacenamiento y distribución No evaluado durante esta inspección Evaluado durante esta inspección Nº Observación Comentarios Control de la calidad No evaluado durante esta inspección Evaluado durante esta inspección Nº Observación Comentarios Distribución fuera de los Estados miembros, importación y exportación Evaluado durante esta inspección No evaluado durante esta inspección 45 Nº Observación Comentarios Trazabilidad Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Acuerdos con terceras partes Evaluado durante esta inspección Nº No evaluado durante esta inspección Observación Comentarios Observación Comentarios Otros Nº 46 Anexo 8: Modelo (propuesto) de informe de inspección de un establecimiento de tejidos INFORME DE INSPECCIÓN DEL ESTABLECIMIENTO DE TEJIDOS Cumplimente este formulario sustituyendo el texto en cursiva Información general Nº de referencia del informe: Nombre y dirección completa del centro inspeccionado. Centros inspeccionados: Resumen de actividades: Tipo de tejidos o células Actividad prescrita (AP) Métodos de preparación (MP) aplicados (Introduzca los códigos de los MP indicados más abajo) (Introduzca los códigos de las AP indicados más abajo Óseo Cutáneo Vascular Oftálmico Membrana amniótica Ovárico Testicular 47 Otros tejidos …………………........ Médula ósea Células progenitoras de médula ósea Sangre umbilical Oocitos Espermatozoides Otras células Embriones Zigotos Otros …………………...……… CÓDIGOS DE LAS ACTIVIDADES PRESCRITAS Donación: AP1 Almacenamiento: AP5 AP8 Obtención: AP2 Evaluación: AP3 Distribución: AP6 Procesamiento: AP4 Importación: AP7 CÓDIGOS DE MÉTODOS DE PREPARACIÓN 48 Exportación: Corte/trituración/moldeo MP1 Desmineralización Centrifugación MP2 Almacenamiento cultivo orgánico Imbibición en disoluciones antibióticas o antimicrobianas MP3 Almacenamiento a 4 ºC MP15 Esterilización (no mediante irradiación) MP4 Glicerolización (alta concentración) MP16 Esterilización por irradiación MP5 Descongelación MP17 Separación, concentración y purificación celular MP6 Fertilización in vitro MP18 Filtrado MP7 Inyección de intracitoplasmático Liofilización MP8 Preparación del esperma MP20 Congelación MP9 Eclosión asistida MP21 Criopreservación MP10 Cultivo de blastocito MP22 Vitrificación MP11 Maduración in vitro MP23 Secado MP12 Embrión/biopsia del corpúsculo polar MP24 MP13 en un medio Fecha de la inspección: Día, mes, año Inspectores: Nombre y apellidos de los inspectores de esperma MP14 MP19 Nombre y apellidos de los evaluadores expertos (si procede) Nombre de la autoridad competente Dirección electrónica: Reglamentos en los que se ha basado la inspección: Breve informe sobre las actividades de inspección realizadas 49 Introducción: Breve descripción del centro de obtención o del establecimiento de tejidos y las actividades realizadas en el centro (o referencia a un expediente de establecimiento de tejidos adjunto). En el caso de inspecciones realizadas en países de fuera del EEE, indique si la autoridad competente del país donde se ha realizado la inspección estaba informada y participó en la inspección. Fecha de la inspección anterior. Nombre y apellidos de los inspectores de la inspección anterior. Principales cambios desde la inspección anterior. Ámbito de la inspección: Breve descripción de la inspección (inspección de procesos o inspección general del sistema de calidad, con referencia a células o tejidos específicos en su caso). Deberá especificarse el motivo de la inspección (por ejemplo, solicitud de un nuevo proceso, inspección sistemática, investigación de un defecto en un producto, etc.). Actividades o áreas inspeccionadas: Breve descripción del área o de las actividades. Especifique cada área o actividad inspeccionada. Actividades o áreas no inspeccionadas: En caso necesario, deberá prestarse atención a las áreas o actividades no inspeccionadas en esta ocasión. Personal entrevistado durante la inspección: Especifique los nombres y títulos del personal clave que ha conocido o adjunte una lista. Resumen de las conclusiones desde la Resuma las conclusiones previas y la medida correctiva adoptada. última inspección y medida correctiva adoptada: Principales conclusiones del inspector, incluidas las deficiencias Esta sección puede vincular las conclusiones con las deficiencias y explicar la clasificación. Requisitos para la obtención y la evaluación de donantes, según se especifica en la Directiva 2006/17/CE 50 Criterios de selección del donante de tejidos o células: Describa las conclusiones de cada tipo de donante [fallecido, vivo, pareja (uso directo o indirecto) o no pareja]. Pruebas de laboratorio necesarias para los donantes: Procedimientos de obtención y donación de tejidos o células: Datos relativos al donante: Informe de la obtención: Recepción en el establecimiento de tejidos: Requisitos para la acreditación, designación, autorización o aprobación de los establecimientos de tejidos, de conformidad con lo dispuesto en la Directiva 2006/86/CE Organización y dirección: Personal: Equipos y materiales: Instalaciones: Documentación y registros: Contratos con terceros: Revisión de la calidad: Procesamiento: 51 Almacenamiento y puesta en circulación de tejidos o células: Etiquetado definitivo para la distribución y etiquetado externo del contenedor de envío: Transporte: Distribución y retirada: Gestión de reacciones adversas y efectos adversos graves: Información sobre los datos mínimos del receptor y el donante que el establecimiento de tejidos y las organizaciones responsables de la aplicación en el ser humano han de guardar: Sistema de codificación: Importación/exportación: Otros temas específicos identificados: Por ejemplo, futuros cambios relevantes anunciados por el establecimiento de tejidos. Conclusiones Expediente del establecimiento de Valoración y fecha del expediente del establecimiento de tejidos. tejidos: Anexos adjuntos: Enumere todos los anexos adjuntos. 52 Lista de las deficiencias clasificadas en críticas, importantes y otras (véanse las definiciones al final de este formulario): Deberán enumerarse todas las deficiencias y mencionar la legislación nacional pertinente que transpone las Directivas comunitarias. Deberán indicarse todas las deficiencias encontradas, aun cuando se hayan subsanado de forma inmediata. El establecimiento de tejidos deberá informar al cuerpo de inspectores del calendario propuesto para las correcciones y su progreso. Las deficiencias se clasificarán sobre la base de las definiciones recogidas al final de este documento. Recomendaciones para la autoridad competente o de ejecución para el centro inspeccionado: Resumen y conclusiones: Los inspectores deberán indicar si, en el transcurso de la inspección, el establecimiento de tejidos estaba funcionando de conformidad con la legislación nacional que transpone las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE, facilitar, en su caso, las medidas correctivas adecuadas y mencionar cualquier otro elemento para alertar a la autoridad solicitante. Deberá prestarse atención a la expresión. Se recomienda utilizar el condicional cuando el establecimiento de tejidos necesite cumplir requisitos críticos antes de recibir la aprobación definitiva del cuerpo de inspectores. Se puede hacer alusión a las conclusiones recogidas en otros documentos, como la carta de cierre, en función de los procedimientos nacionales. Nombre y apellidos: En el informe de inspección deberá figurar la fecha y la firma de los inspectores o evaluadores que hayan participado en la inspección. Firma: Organización: Fecha: Distribución del informe: Esta estructura puede tener que adaptarse al uso local en algunos Estados miembros en los que la evaluación de las deficiencias es un ejercicio independiente del informe de la inspección. Definición de las deficiencias: 1. DEFICIENCIA CRÍTICA: 53 Una deficiencia que representa un riesgo directo considerable de provocar daño a un paciente receptor o a un donante vivo. 2. DEFICIENCIA IMPORTANTE: Una deficiencia que no es crítica: que representa un riesgo indirecto para la seguridad de un donante o un receptor debido a que la obtención o distribución de tejidos o células no cumple con los requisitos de la autorización del establecimiento de tejidos, de la autorización de procesos o con los procedimientos de seguridad y calidad propios del establecimiento de tejidos; o que indica una deficiencia importante respecto de las Directivas 2004/23/CE, 2006/17/CE y 2006/86/CE o cualquier normativa nacional pertinente; o que indica un fallo en el cumplimiento satisfactorio de procedimientos para la puesta en circulación de tejidos o células o un incumplimiento por parte de la persona responsable de sus obligaciones legales; o que es una combinación de varias «otras» deficiencias, ninguna de las cuales es importante por sí misma, pero que, juntas, podrían constituir una deficiencia importante y que deberían explicarse y comunicarse como tal. 3. OTRA DEFICIENCIA: Una deficiencia que no se puede clasificar ni como crítica o importante, pero que indica una desviación de una buena práctica. 54 Anexo 9: Modelo (propuesto) de expediente del método de preparación Expediente del método de preparación Sección A: Información sobre el establecimiento de tejidos Nombre completo del establecimiento de tejidos: Nombre y apellidos de la persona responsable: Dirección postal del establecimiento de tejidos: Número de teléfono: Número fax: de Dirección electrónica: Sección B: Método de preparación - Información general Nombre del método de preparación: Descripción de los tejidos o células a los que se aplica este método de preparación: Detalles de cualquier requisito específico adicional para la evaluación 55 o la selección de donantes que haya que aplicar a los donantes de células o tejidos procesados de este modo. Detalles de cualquier requisito específico que haya que aplicar a la obtención de células o tejidos procesados de este modo. Breve descripción del método de preparación. (Adjunte un diagrama que ilustre el proceso.) Sección C: Materiales y equipos Enumere todos los materiales y los equipos utilizados en este proceso, facilitando detalles del proveedor en cada caso. Reactivos o materiales que entran en contacto con los tejidos o células Especificación Proveedor 56 Equipo Especificación Proveedor Sección D – Evaluación del control de la calidad (incluidos análisis microbiológicos) Prueba Descripción de la muestra (análito) Criterios de puesta en circulación 57 Sección E: Validación del proceso ¿Cómo se han validado los métodos de procesamiento para demostrar que no provocan la pérdida de eficacia clínica de los tejidos o las células ni resultan tóxicos para el receptor? a) ¿Mediante estudios realizados en su establecimiento de tejidos? SÍ NO En caso afirmativo, adjunte una copia del informe de validación. b) ¿Mediante estudios publicados por otros? SÍ NO En caso afirmativo, adjunte copias de las publicaciones más importantes. c) ¿Mediante un análisis retrospectivo de los resultados clínicos? SÍ NO En caso afirmativo, adjunte una copia de los datos recogidos. d) Otros (especifique): ………………………………………………….. e) Si el proceso es objeto de una solicitud de patente, facilite el número de patente. Si el proceso incluye un paso de esterilización o inactivación vírica, facilite una breve descripción de la validación y copias de los estudios sobre la inactivación del virus en los que se basa la validación. Adjunte una copia del informe de validación. Sección F: Etiquetado final y ficha de información Adjunte una copia de la etiqueta definitiva pegada al envase primario de tejidos o células que se han procesado utilizando este método. Adjunte una copia de la ficha de información facilitada a los usuarios clínicos con los tejidos o células. 58 Instrucciones de presentación que cada autoridad competente deberá incluir. Anexo 10: Modelo (propuesto) de certificado de autorización CERTIFICADO DE AUTORIZACIÓN DE ESTABLECIMIENTO DE TEJIDOS Detalles del establecimiento de tejidos Número del registro o la autorización: Nombre y apellidos del titular del registro o la autorización: Nombre y apellidos del establecimiento de tejidos: Dirección de las sedes del establecimiento de tejidos (todas las sedes autorizadas deberán ser enumeradas si no tienen licencias independientes): Domicilio social del titular del registro o la autorización: Ámbito de la autorización Fundamento jurídico de la autorización: Fecha de expiración autorización del registro o la (si procede con arreglo a las normativas nacionales): Actividades autorizadas Tipo de tejidos o células Actividad prescrita (AP) (Introduzca los códigos de la AP que se indican más abajo) Óseo 59 Cutáneo Vascular Oftálmico Membrana amniótica Ovárico Testicular Otros tejidos …………………....................... Médula ósea Células progenitoras de médula ósea Sangre umbilical Oocitos Espermatozoides Otras células ……………………………... Embriones 60 Zigotos Otros CÓDIGOS DE LAS ACTIVIDADES PRESCRITAS Donación: AP1 Obtención: AP2 Almacenamiento: AP5 Exportación: AP8 Evaluación: AP3 Distribución: AP6 Procesamiento: AP4 Importación: AP7 ¿Alguna restricción o aclaración respecto del alcance de estas actividades? Nombre y Firma del funcionario de la Fecha: apellidos del autoridad competente: funcionario de la autoridad competente: Sello de la competente: Anexo 11: Documentos consultados para la elaboración de estas directrices Documentos redactados por los organismos reguladores Agence de la Biomédecine (ABM), Guidance on inspection of centres for assisted conception (borrador) AFSSAPS, Guidance for tissue and cell bank inspection (Aide-Mémoire for Inspection of Tissue and Cell Banks, 2004; Inspection Guidelines Relating to Procurement of HSC and Mononuclear Blood Cells; Sub-Guidelines Relating to Inspection of Procurement of Cells from Umbilical Cord Blood, 2007) Documentos de la Autoridad competente belga: - Aide-mémoire for tissue bank inspection, abril 2006 Site master file for tissue and cell banks Centro Nacional de Trasplantes, Italia (CNT): Guidance for tissue bank inspection (Guidelines on the Conduct of Inspections, 2005: el formulario previo a la inspección y la lista de control de la inspección de bancos de piel a modo de ejemplo) 61 autoridad Documentos de orientación para las inspecciones GMP de la EMEA: CoCP (Compilation of Community Procedures) Inspection Conduct (EMEA/INS/GMP/313513/2006) and report writing EMEA/INS/GMP/313539/2006) EN ISO 14971:2007 Equipos médicos – Aplicación de la gestión de riesgos a los equipos médicos FDA Compliance Programme Guidance Manual, 2005 Human Fertilisation and Embryology Authority (HFEA), Reino Unido – Tejidos y células para la reproducción asistida (www.hfea.gov.uk) - Información sobre el sistema Cuestionario previo a la inspección Human Tissue Authority (HTA), Reino Unido. Inspection Site Visits: Manual for Specialist Assessors (2006) y Guidance for Designated Individuals (2006) Irish Medicines Board, Aide-Mémoire for Tissue Establishments Irish Medicines Board, Authorisation of Prescribed Activities carried out in Relation to Human Tissues and Cells (Certificate) Irish Medicines Board, Points to Note for the Inspection of Reproductive Cells Directrices ISO para la auditoría de los sistemas de gestión ambiental o de la calidad (ISO 19011) Medicines Control Council, Department of Health, RSA, Guidelines for Preparation of Site Master File Medicines and Healthcare Products Regulatory Agency (MHRA), Reino Unido. Consultation on a risk-based inspection programme for good practice inspections PIC/S Guidance for Blood Establishments, 2004 PIC/S Standard Operating Procedure (pi 026-1 octubre 2006): Qualification and training of inspectors in the field of human blood, tissues and cells Documentos elaborados por proyectos o sociedades profesionales AABB Quality System Assessment Tool, 2006 AATB Tissue Bank Self-Assessment Tool and Audit Report (Star), 2006 EBAA, Inspection Manual of the Eye Bank Association of America, 2005 EQSTB (European Quality System for Tissue Banks, Sistema de calidad europeo para bancos de tejidos – proyecto DG SANCO) – Tissue Bank Audit Guidelines, 2007 JACIE Inspection Manual, 2004 Tissue Bank Evaluation Guidance Directrices empleadas por la Agencia Internacional de Energía Atómica en sus análisis de bancos de tejidos en todo el mundo respaldados por su programa Anexo 12: Abreviaturas y glosario AP Actividad prescrita EMEA Agencia Europea de Medicamentos 62 GMP Normas de correcta fabricación ISO Organización Internacional de Normalización MP Métodos de preparación UE Unión Europea Auditoría Definición Fuente Estudio documentado de los procedimientos, registros, funciones del personal, equipo, material, instalaciones o proveedores a fin de evaluar el grado de cumplimiento de los procedimientos de trabajo normalizados escritos, normas o leyes y reglamentos nacionales, realizado por pares profesionales, auditores de sistema de calidad internos o auditores de organismos de certificación Adaptado de la Guía sobre seguridad y garantía de calidad de órganos, tejidos y células para transplantes publicada por el Consejo de Europa, 3ª edición Publicación del Consejo de Europa, enero 2007 Células Células individuales de origen humano o una colección de células de origen humano cuando no estén unidas por ninguna forma de tejido conjuntivo Crítico Que posee un efecto potencial en la calidad o Directiva 2006/86/CE la seguridad de las células y los tejidos, o está en contacto con las células y los tejidos Distribución Transporte y entrega de tejidos o células Directiva 2004/23/CE destinadas a aplicaciones en el ser humano Donación El hecho de donar tejidos o células humanos Directiva 2004/23/CE destinados a su aplicación en el ser humano Donante Toda fuente humana, viva o muerta, de Directiva 2004/23/CE células o tejidos humanos Experto Persona con la adecuada cualificación y Grupo de elaboración experiencia para ofrecer asesoramiento de directrices técnico a un inspector de la autoridad competente Aplicación en el ser humano Uso de tejidos y células en un receptor Directiva 2004/23/CE humano y en aplicaciones extracorporales Organización responsable de la aplicación en el ser humano de tejidos y células Centro de asistencia sanitaria o unidad Directiva 2006/86/CE hospitalaria u organismo que desarrolla actividades de aplicación en el ser humano de células y tejidos humanos 63 Directiva 2004/23/CE Donación por la pareja Donación de células reproductoras entre un Directiva 2006/86/CE hombre y una mujer que declaran tener una relación física íntima Preservación Utilización de agentes químicos, alteraciones Directiva 2004/23/CE de las condiciones medioambientales u otros medios durante el procesamiento a fin de impedir o retrasar el deterioro biológico o físico de las células o los tejidos Procesamiento Todas las operaciones que implica la Directiva 2004/23/CE preparación, manipulación, preservación y acondicionamiento de los tejidos y las células destinados a su aplicación en el ser humano Obtención Proceso por el que se dispone de tejidos o Directiva 2004/23/CE células Organismo de obtención Centro de asistencia sanitaria, unidad Directiva 2006/86/CE hospitalaria u organismo que desarrolla actividades de obtención de células y tejidos humanos, y que no ha de estar necesariamente acreditado, designado, autorizado o aprobado como centro de tejidos Sistema de calidad Estructura organizativa, definición de Directiva 2006/86/CE responsabilidades, procedimientos, procesos y recursos para aplicar la gestión de la calidad; incluye todas las actividades que directa o indirectamente contribuyen a la calidad Células reproductivas Todas las células y los tejidos destinados a su Directiva 2006/86/CE utilización con fines de reproducción asistida Persona responsable Cada establecimiento de tejidos designará a Directiva 2004/23/CE un responsable de: velar por que en el ámbito del establecimiento del que esta persona es responsable, las células y los tejidos humanos destinados a la aplicación humana se obtengan, evalúen, procesen, almacenen y se distribuyan de conformidad con las Directivas y la legislación vigente en el Estado miembro en cuestión, facilitar información a la autoridad o autoridades competentes y aplicar en el establecimiento de tejidos los requisitos establecidos en las Directivas Efecto adverso grave Cualquier hecho desfavorable vinculado con Directiva 2004/23/CE la obtención, evaluación, procesamiento, almacenamiento y distribución de tejidos y células que pueda conducir a la transmisión de una enfermedad transmisible o la muerte del paciente, o a estados que hagan peligrar su vida, a minusvalías o incapacidades, o que pueda dar lugar a hospitalización o 64 enfermedad, o las pueda prolongar Reacción adversa grave Una respuesta inesperada del donante o del Directiva 2004/23/CE receptor, incluida una enfermedad transmisible, asociada a la obtención o la aplicación en el ser humano de tejidos y células que resulte mortal, potencialmente mortal, discapacitante, que produzca invalidez o incapacidad o que dé lugar a hospitalización o enfermedad, o las prolongue Procedimientos normalizados de trabajo Instrucciones escritas en las que se describen Adaptado de la los pasos de un proceso específico, los Directiva 2006/86/CE materiales y métodos que deberán utilizarse y las propiedades que se espera obtener de las células o tejidos que se van a distribuir Almacenamiento Mantenimiento de las células o tejidos bajo Directiva 2004/23/CE condiciones controladas y apropiadas hasta su distribución Tercer país Cualquier país que no sea un Estado miembro Comisión Europea: de la Unión Europea ec.europa.eu Tercera parte Cualquier organización que ofrezca un Grupo de elaboración servicio a un organismo de obtención o un del manual operativo establecimiento de tejidos sobre la base de un contrato o acuerdo escrito. Incluye laboratorios de evaluación de tejidos o donantes, contratos con esterilizadores y hospitales usuarios que almacenan tejidos o células en espera de una aplicación en el ser humano Tejido Todas las partes constituyentes del cuerpo Directiva 2004/23/CE humano formadas por células Establecimiento de tejidos Un banco de tejidos o una unidad de un Directiva 2004/23/CE hospital o cualquier otro centro en el que se lleven a cabo actividades de procesamiento, preservación, almacenamiento o distribución de células y tejidos humanos. El establecimiento de tejidos podrá encargarse también de la obtención o la evaluación de tejidos y células Trazabilidad La capacidad de localizar e identificar la Directiva 2006/86/CE célula o el tejido en cualquiera de las fases desde su obtención hasta su destino, ya sea a un receptor o para su eliminación, pasando por la evaluación, el procesamiento y el almacenamiento; conlleva la capacidad de 65 identificar al donante, el establecimiento de tejidos o el de procesamiento que recibe, procesa o almacena las células o el tejido; en los centros médicos en los que se aplica el tejido o las células a los receptores, conlleva también la capacidad de identificar a éstos; la trazabilidad también abarca la capacidad de localizar e identificar todos los datos pertinentes sobre los productos y materiales que entren en contacto con dichos tejidos y células Validación (o «cualificación» si se trata de equipos o instalaciones) Establecimiento de pruebas documentales Directiva 2006/86/CE que ofrezcan un alto nivel de garantía de que con un proceso, un equipo o una instalación dados se llegará invariablemente a un producto que cumpla los requisitos y los atributos de calidad que se le hayan predeterminado; un proceso se valida para evaluar el rendimiento de un sistema en cuanto a su eficacia real con respecto al uso que se le pretende dar 66