1 FICHA TECNICA 1. NOMBRE DEL
Anuncio

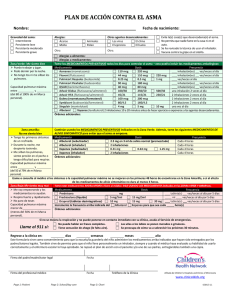
1 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO PULMICORT® TURBUHALER® 100 µg/dosis PULMICORT® TURBUHALER® 200 µg/dosis PULMICORT® TURBUHALER® 400 µg/dosis 2. COMPOSICION CUALITATIVA Y CUANTITATIVA PULMICORT TURBUHALER 100 µg/dosis: Cada dosis contiene: budesonida 100 µg. PULMICORT TURBUHALER 200 µg/dosis: Cada dosis contiene: budesonida 200 µg. PULMICORT TURBUHALER 400 µg/dosis: Cada dosis contiene: budesonida 400 µg. 3. FORMA FARMACEUTICA Inhalador multidosis de polvo seco. 4. DATOS CLINICOS 4.1 Indicaciones terapéuticas Asma bronquial que requiere tratamiento de mantenimiento con glucocorticosteroides para el control de la inflamación subyacente de las vías respiratorias. PULMICORT TURBUHALER está también indicado en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) en los que se ha identificado una respuesta beneficiosa durante los primeros 3-6 meses de tratamiento. 4.2 Posología y forma de administración Asma bronquial La dosis de PULMICORT TURBUHALER ha de ser individualizada. La dosis inicial recomendada y la dosis máxima recomendada de PULMICORT TURBUHALER, teniendo en cuenta la terapia previa para el asma se detallan en la siguiente tabla: 2 Terapia previa Dosis inicial recomendada No tratados con esteroides 200 a 400 µg una vez al día ó 100 a 400 µg dos veces al día Glucocorticosteroides inhalados 200 a 400 µg una vez al día ó 100 a 400 µg dos veces al día 800 µg dos veces al día Glucocorticosteroides orales Niños a partir No tratados con de 6 años esteroides 400 a 800 µg dos veces al día 800 µg dos veces al día 200 a 400 µg una vez al día ó 100 a 200 µg dos veces al día 400 µg dos veces al día Glucocorticosteroides inhalados 200 a 400 µg una vez al día ó 100 a 200 µg dos veces al día 400 µg dos veces al día Glucocorticosteroides orales 200 a 400 µg dos veces al día 400 µg dos veces al día Adultos Dosis máxima recomendada 800 µg dos veces al día En caso de asma severo y durante la exacerbación, algunos pacientes pueden conseguir una mejoría al dividir la dosis diaria en 3-4 administraciones por día. Dosis de mantenimiento: Una vez obtenidos los efectos clínicos deseados, la dosis de mantenimiento debe ser gradualmente reducida hasta la cantidad mínima necesaria para el control de los síntomas. Rango de dosis para mantenimiento: Adultos: 100-1600 µg diarios Niños: 100-800 µg diarios Puede observarse mejoría en el control del asma 24 horas después del inicio del tratamiento con PULMICORT TURBUHALER, aunque puede requerirse de 1 a 2 semanas o un periodo superior para observar el efecto beneficioso máximo. Dosis una vez al día: La dosis diaria se divide habitualmente en 1-2 administraciones. La administración una vez al día puede considerarse en adultos y en pacientes pediátricos a partir de 6 años de edad, que requieran una dosis de mantenimiento de 100 a 400 µg de budesonida al día. La administración una vez al día puede instaurarse tanto en pacientes no tratados con esteroides como en pacientes controlados con glucocorticosteroides inhalados. La dosis 3 puede administrarse por la mañana o por la noche. Si se produce un empeoramiento del asma, deberá aumentarse la dosis diaria y la frecuencia de administración. Inicio del efecto: La mejoría en el control del asma tras la administración inhalada de PULMICORT TURBUHALER puede producirse en el plazo de 24 horas tras el inicio del tratamiento, aunque puede que no se alcance el beneficio máximo durante 1 ó 2 semanas o más tras el inicio del tratamiento. Instrucciones de uso y manipulación (Ver apartado 6.6): El fármaco se libera a los pulmones cuando el paciente inhala a través del TURBUHALER. Por ello, es importante instruir al paciente para que respire fuerte y profundamente a través de la boquilla. Con objeto de reducir la aparición de candidiasis orofaríngea, el paciente debe enjuagarse la boca con agua después de la administración de la dosis. Pacientes no tratados con glucocorticosteroides Los pacientes que requieran una terapia de mantenimiento pueden emplear PULMICORT TURBUHALER a las dosis recomendadas en la tabla anterior. Aquellos pacientes que no respondan adecuadamente a la dosis inicial, pueden requerir dosis superiores para controlar los síntomas del asma. Pacientes bajo tratamiento con glucocorticosteroides inhalados Los estudios clínic os realizados en el hombre han demostrado una mejor eficacia para la misma cantidad de budesonida administrada mediante TURBUHALER, en comparación con el aerosol. Por ello, al pasar de un tratamiento con Pulmicort Aerosol a PULMICORT TURBUHALER, es posible reducir la dosis hasta la mitad cuando el paciente está en una fase estable. Asimismo, en aquellos pacientes previamente tratados con otros glucocorticosteroides inhalados, puede considerarse una reducción de la dosis de PULMICORT TURBUHALER, una vez que hayan sido tratados inicialmente con una dosis similar a la administrada con el fármaco anterior. Pacientes bajo tratamiento con glucocorticosteroides orales PULMICORT TURBUHALER permite una sustitución o reducción significativa en la dosis de glucocorticosteroides orales manteniendo o mejorando el control de los síntomas del asma. Inicialmente, PULMICORT TURBUHALER se empleará conjuntamente con la dosis de mantenimiento habitual del glucocorticosteroide oral. Después de aproximadamente una semana, la dosis oral se reducirá gradualmente hasta la cantidad mínima necesaria. Se recomienda encarecidamente una tasa lenta de retirada. En muchos casos, puede retirarse por completo el corticoide oral y dejar al paciente únicamente bajo tratamiento con PULMICORT TURBUHALER. Durante el paso de un tratamiento a otro, algunos pacientes pueden experimentar síntomas debidos a la retirada del glucocorticosteroide sistémico, por ej. dolor muscular y/o en las articulaciones, lasitud y depresión, aunque se mantenga o mejore la función pulmonar. Estos pacientes deben ser alentados a continuar el tratamiento con PULMICORT TURBUHALER pero deberán monitorizarse por si se observan signos objetivos de insuficiencia 4 adrenal. En el caso de que se observara insuficiencia adrenal, deberán incrementarse temporalmente las dosis de corticosteroides sistémicos iniciando de nuevo la reducción de los mismos de forma más lenta. Durante las fases de estrés o ataques severos de asma, estos pacientes pueden requerir un tratamiento adicional con corticosteroides sistémicos. 5 No se ha establecido la eficacia y seguridad de PULMICORT TURBUHALER a dosis superiores a las recomendadas. EPOC La dosis recomendada de PULMICORT TURBUHALER es 400 µg dos veces al día. Los pacientes con EPOC bajo tratamiento con glucocorticosteroides orales que pasen a recibir un tratamiento con PULMICORT TURBUHALER deberán seguir las mismas recomendaciones detalladas anteriormente para asma bronquial, en caso de que se reduzca la dosis oral. 4.3 Contraindicaciones Hipersensibilidad a la budesonida. 4.4 Advertencias y precauciones especiales de empleo PULMICORT TURBUHALER no está indicado para el alivio rápido de los episodios agudos de asma donde se requiere la administración de un broncodilatador de acción corta. En el caso de que el broncodilatador de acción corta no proporcione la eficacia deseada, o necesite una dosis inhalada mayor a la habitual, el paciente deberá solicitar atención médica. En este caso, se considerará la necesidad de aumentar la terapia antiinflamatoria, por ej. dosis superiores de budesonida inhalada o un periodo de tratamiento con corticosteroides orales. La exacerbación de la EPOC deberá tratarse con terapia adicional según el juicio del médico responsable. Deberá tenerse especial precaución cuando los pacientes pasen de una terapia de glucocorticosteroides sistémicos a glucocorticosteroides inhalados. Durante este periodo de supresión del eje hipotalámico-hipofisario-adrenal, los pacientes pueden mostrar signos y síntomas de insuficiencia adrenal en el caso de traumatismos, cirugía o infección (particularmente gastroenteritis) u otras condiciones asociadas con una pérdida importante de electrolitos. A pesar de que PULMICORT TURBUHALER puede controlar los síntomas asmáticos o de la EPOC durante estos episodios, a las dosis recomendadas proporciona cantidades inferiores a las fisiológicas normales de glucocorticosteroides sistémicos y por lo tanto, no proporcionarán la actividad mineralocorticoide necesaria para hacer frente a estas situaciones de emergencia. Algunos pacientes pueden sentirse mal de forma no específica durante la fase de retirada de los corticosteroides sistémicos, por ej. mialgias y artralgias. En casos excepcionales puede sospecharse un efecto glucocorticosteroide insuficiente si aparecen síntomas tales como cansancio, cefaleas, nauseas y vómitos. En estos casos puede ser necesario un incremento temporal de la dosis de corticosteroides orales. El paso de un tratamiento con esteroides sistémicos a un tratamiento con terapia inhalada puede desenmascarar alergias, por ej. rinitis y eczema, que previamente habían sido controlados con el fármaco sistémico. Estas alergias deberán controlarse sintomáticamente con antihistamínicos y/o preparaciones tópicas. 6 Una función hepática reducida puede afectar la eliminación de corticosteroides. Sin embargo, la farmacocinética intravenosa de la budesonida es similar en pacientes con cirrosis y en sujetos sanos. La farmacocinética después de la administración oral puede verse afectada por una función hepática comprometida, evidenciándose por una disponibilidad sistémica incrementada. Para PULMICORT TURBUHALER, este problema resulta de poca importancia ya que su disponibilidad sistémica es muy pequeña. Los estudios in vivo han mostrado que la administración oral de ketoconazol (un inhibidor conocido de la actividad CYP3A en el hígado y mucosa interna, ver también apartado 4.5 Interacciones) puede causar un aumento de la exposición sistémica a budesonida. Esto es de relevancia clínica limitada en el tratamiento a corto plazo (1-2 semanas) con ketoconazol, pero deberá tenerse en cuenta durante el tratamiento a largo plazo. Se prestará especial precaución en pacientes con tuberculosis pulmonar. No se conocen completamente los efectos locales y sistémicos a largo plazo de PULMICORT TURBUHALER en humanos. La dosis deberá ajustarse a la menor dosis de mantenimiento efectiva una vez que se ha alcanzado el control del asma. Los médicos deberán monitorizar estrechamente el crecimiento de los niños que estén siendo tratados con corticosteroides mediante cualquier ruta de administración y contrapesar el beneficio de la terapia con corticosteroides y el control asmático frente a la posibilidad de retraso del crecimiento. Deberá informarse a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico de control de dopaje como positivo. 4.5 Interacción con otros medicamentos y otras formas de interacción No se ha observado interacción entre la budesonida y otros fármacos empleados para el tratamiento del asma o de la EPOC. El metabolismo de budesonida está mediado principalmente por CYP3A, una sub-familia del citocromo p450. Los inhibidores de esta enzima, por ejemplo, ketoconazol, pueden, en consecuencia, aumentar la exposición sistémica a budesonida (ver apartado 4.4 Advertencias y precauciones especiales de empleo). 4.6 Embarazo y lactancia Los estudios en animales preñadas han demostrado que la budesonida, al igual que otros glucocorticosteroides, puede producir distintos tipos de malformaciones fetales, aunque se desconoce la relevancia que este hecho puede tener en el hombre. Al igual que con otros fármacos, la administración de budesonida durante el embarazo requiere la valoración de los posibles beneficios para la madre frente a los riesgos para el feto. Los glucocorticosteroides se emplearán preferentemente por vía inhalatoria para el tratamiento del asma, debido a sus menores efectos secundarios comparado con dosis equipotentes de glucocorticosteroides orales. No existen datos demostrativos de un posible paso de la budesonida a la leche materna. 4.7 Efectos sobre la capacidad para conducir y utilizar maquinaria PULMICORT TURBUHALER no afecta la capacidad de conducir ni utilizar maquinaria. 7 4.8 Reacciones adversas Los ensayos clínicos, publicaciones y la experiencia post-comercialización sugieren que se pueden producir las siguientes reacciones adversas: - Leve irritación de la garganta, tos y ronquera Candidiasis en la cavidad orofaríngea Reacciones de hipersensibilidad inmediata y retardada incluyendo, rash, dermatitis de contacto, urticaria, angioedema, y broncoespasmo Síntomas sobre el sistema nervioso central tales como nerviosismo, inquietud y depresión, así como alteraciones del comportamiento En casos muy excepcionales se han producido ulceraciones de la piel tras el uso de glucocorticosteroides inhalados. En casos excepcionales, a través de mecanismos de acción no específicos, los fármacos por vía inhalatoria pueden producir broncoespasmo. En raras ocasiones, con glucocorticosteroides inhalados, se pueden producir signos o síntomas del efecto sistémico de los glucocorticosteroides, incluyendo hipofunción de la glándula adrenal y reducción de la velocidad de crecimiento, dependiendo probablemente de la dosis, tiempo de la exposición, exposición concomitante y previa a glucocorticosteroides y sensibilidad individual. 4.9 Sobredosificación La intoxicación aguda con PULMICORT TURBUHALER, incluso con dosis muy elevadas, no ocasiona problemas de carácter clínico. Cuando se utilizan de forma crónica dosis muy elevadas pueden aparecer efectos propios de la administración de glucocorticosteroides sistémicos tales como hiperadrenocorticismo y supresión adrenal. 5. PROPIEDADES FARMACOLOGICAS 5.1 Propiedades farmacodinámicas La budesonida es un glucocorticosteroide con un elevado efecto antiinflamatorio local. No se conoce completamente el mecanismo de acción exacto de los glucocorticosteroides en el tratamiento del asma y de la EPOC. Las acciones antiinflamatorias tales como la inhibición de la liberación del mediador inflamatorio y la inhibición de las respuestas inmunes mediadas por la citoquina, son probablemente importantes. La potencia intrínseca de la budesonida, medida como la afinidad por el receptor glucocorticosteroide, es aproximadamente 15 veces superior a la presentada por la prednisolona. Un estudio clínico en pacientes asmáticos en el que se comparó la administración de la budesonida por vía oral y por inhalación, evidenció de forma estadísticamente significativa la eficacia de la budesonida por inhalación al comparar 8 con placebo mientras que comparándola con la budesonida administrada por vía oral no se hallaron diferencias significativas. Así pues, el efecto terapéutico de dosis convencionales de budesonida inhalada puede explicarse ampliamente por su acción directa sobre el tracto respiratorio. La budesonida ha demostrado producir efectos anti-anafilácticos y antiinflamatorios en estudios de provocación realizados tanto en animales como en pacientes, que se manifiestan como una disminución de la obstrucción bronquial producida por las reacciones alérgicas, tanto inmediatas como retardadas. Budesonida también ha demostrado disminuir la reactividad de las vías aéreas en pacientes hiperreactivos tras provocación directa o indirecta. El tratamiento con budesonida inhalada, administrada en una o dos tomas diarias, se ha empleado satisfactoriamente en la prevención del asma inducido por ejercicio. En pacientes con EPOC leve a moderada, el tratamiento con PULMICORT TURBUHALER 400 µg dos veces al día originó una mejoría en FEV1 tras 3-6 meses de tratamiento en comparación con placebo. El nivel de FEV1 alcanzado dependió de la mejoría inicial del FEV1, es decir, los pacientes con mejoría inicial mantuvieron sus valores en un nivel superior durante 3 años de tratamiento. A las dosis recomendadas, PULMICORT TURBUHALER causa un efecto significativamente menor sobre la función adrenal que 10 mg de prednisolona, tal y como se demuestra en las pruebas de estimulación por ACTH. No se observaron cambios clínicamente importantes en los niveles de cortisol plasmático y la respuesta a la estimulación por ACTH se produjo cuando la budesonida se administró a dosis de hasta 1600 µg al día durante 3 meses en adultos y de hasta 800 µg al día en niños. El seguimiento a largo plazo por un periodo de 52 semanas confirmó la falta de supresión sobre el eje hipotalámico-hipofisario-adrenal. Los estudios realizados en voluntarios sanos con PULMICORT TURBUHALER han evidenciado un efecto relacionado con la dosis sobre el cortisol plasmático y urinario. En niños de edad comprendida entre 2 y 6 años tratados con budesonida vía TURBUHALER con dosis diarias de hasta 400 µg, no se observó un efecto sobre el crecimiento al comparar con un tratamiento no esteroideo. 5.2 Propiedades farmacocinéticas Después de la inhalación a través del TURBUHALER alrededor de un 25-35% de la dosis liberada se deposita en los pulmones, lo que corresponde aproximadamente al doble de la depositada con el aerosol. La concentración plasmática máxima al cabo de 30 minutos de la inhalación oral de una dosis única de 800 µg de budesonida es de aproximadamente 4 nmol/l. Se ha estimado que la disponibilidad sistémica de la budesonida inhalada a través de TURBUHALER es de un 38% de la cantidad dosificada con el aerosol, de la cual 1/6 provenía del fármaco deglutido. A dosis clínicamente relevantes, la cinética de la budesonida es proporcional a la dosis. El volumen de distribución de la budesonida es de 3 l/kg y la unión a proteínas plasmáticas de 85-90%. La budesonida sufre un alto grado de biotransformación (aprox. 90%) de primer paso en el hígado a metabolitos de baja actividad glucocorticosteroide. La actividad glucocorticosteroide de los metabolitos principales, 6βhidroxibudesonida y 16 α-hidroxiprednisolona, es inferior a un 1% de la presentada por la budesonida. 9 Los metabolitos de la budesonida se excretan como tales o en su forma conjugada a través de los riñones. No se detectó budesonida inalterada en la orina. La budesonida presenta un aclaramiento sistémico elevado (aproximadamente 1,2 l/min) y la vida media tras la administración intravenosa oscila entre las 2 y 3 horas. 5.3 Datos preclínicos sobre seguridad Los resultados de los estudios de toxicidad aguda, subaguda y crónica mostraron que los efectos sistémicos de la budesonida son menos graves o similares a los observados con otros glucocorticosteroides, por ej. ganancia de peso disminuida y atrofia de los tejidos linfoides y de la corteza adrenal. La budesonida evaluada en 6 pruebas analíticas diferentes no mostró ningún efecto mutagénico o clastogénico. En un estudio de carcinogénesis en ratas macho se ha observado una incidencia incrementada de gliomas cerebrales que no se pudo verificar en un segundo estudio repetido en el que la incidencia de gliomas no se diferenció en ninguno de los grupos de tratamiento activo (budesonida, prednisolona, acetónido de triamcinolona) y los grupos control. Las anomalías hepáticas (principalmente neoplasmas hepatocelulares) halladas en ratas macho en el estudio de carcinogénesis inicial se observaron en el segundo estudio con la budesonida al igual que con los otros glucocorticosteroides de referencia. Estos efectos están probablemente relacionados con un efecto sobre el receptor y ello represente un efecto de clase. La experiencia clínica hasta la fecha no indica que la budesonida u otros glucocorticosteroides induzcan a la aparición de gliomas cerebrales o neoplasmas hepatocelulares en el hombre. 6. DATOS FARMACEUTICOS 6.1 Relación de excipientes PULMICORT TURBUHALER no contiene propelentes ni otro tipo de excipientes. 6.2 Incompatibilidades No se le conocen. 6.3 Periodo de validez El periodo de validez de la especialidad es de 2 años. 10 6.4 Precauciones especiales de conservación Conservar con la tapa puesta. No almacenar por encima de 30ºC. 6.5 Naturaleza y contenido del recipiente PULMICORT TURBUHALER es un inhalador multidosis de polvo seco que libera la dosis por simple inspiración. El inhalador está formado por piezas de plástico. Un inhalador contiene 50, 100 ó 200 dosis. PULMICORT® TURBUHALER® 100 µg/dosis: 200 dosis PULMICORT® TURBUHALER® 200 µg/dosis: 100 dosis PULMICORT® TURBUHALER® 400 µg/dosis: 100 dosis 6.6 Instrucciones de uso/manipulación TURBUHALER es un inhalador sin propelentes, lo cual significa que la budesonida alcanza los pulmones sólo si se aspira a través del mismo. Es importante que el paciente respire fuerte y profundamente a través de la boquilla. Para la correcta administración deberán seguirse las siguientes instrucciones: 1.- Desenroscar y levantar la tapa 2.- Sostener el inhalador en posición vertical con la rosca hacia abajo. Cargar el inhalador con una dosis haciendo girar la rosca hasta lo permitido y a continuación, devolverla a su posición original 3.- Espire. No espire a través de la boquilla. 4.- Situar la boquilla suavemente entre los dientes, cerrar los labios e inspire fuerte y profundamente a través de la boca. No masticar ni morder la boquilla. 5.- Antes de espirar, retirar el inhalador de la boca. Si se ha prescrito más de una dosis, repetir las etapas 2 a 5. 6. Volver a poner la tapa. 7.- Enjuagar la boca con agua tras haber inhalado la dosis prescrita Fig. 1 Fig. 2 Importante: Fig. 3 11 Nunca soplar a través de la boquilla. Volver a poner la tapa tras su uso. Debido a la pequeña cantidad de fármaco liberada por este sistema de dispensación, probablemente el paciente no notará ningún sabor del producto inhalado. Fig. 4 Limpieza: La boquilla debe limpiarse regularmente (1 vez a la semana) por su parte externa con un paño seco. Nunca debe lavarse. Indicador de dosis Cuando se observe por primera vez una marca roja en la ventana indicadora, todavía quedan aproximadamente 20 dosis. Cuando la marca roja ha llegado al extremo inferior de la ventana, el inhalador ya no administrará la cantidad correcta de medicamento y debe ser desechado. El ruido producido cuando se agita el inhalador no está producido por el medicamento sino por el agente desecante. 7. NOMBRE Y DOMICILIO DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN AstraZeneca Farmacéutica Spain, S.A. C/ Serrano Galvache, 56 - Edifico Roble 28033 Madrid 8. NUMERO DE LA AUTORIZACION DE COMERCIALIZACION PULMICORT® TURBUHALER® 100 µg/dosis: 62.046 PULMICORT® TURBUHALER® 200 µg/dosis: 59.254 PULMICORT® TURBUHALER® 400 µg/dosis: 59.255 8. FECHA DE LA APROBACION/REVISION Octubre, 2000 FT-PUTUR-EPOC-c.doc 23 de diciembre de 1999/IDS 9 diciembre 99\AZ Fig. 5 12