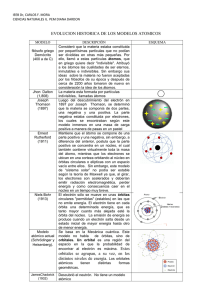
unidad i teoría cuántica y estructura atómica.
Anuncio

1 SUBDIRECCIÓN ACADÉMICA Tecnológico de Estudios Superiores del Oriente del Estado de México. (TESOEM) INGENIERÍA AMBIENTAL. QUÍMICA INORGÁNICA. AEF-1060 Realizó: Miriam Vega Loyola. EDO. MÉXICO. MARZO, 2012. 2 UNIDAD I TEORÍA CUÁNTICA Y ESTRUCTURA ATÓMICA. COMPETENCIA ESPECÍFICA A DESARROLLAR. Comprender los conceptos de la teoría cuántica y de la estructura atómica, tomando como referencia las bases experimentales y los descubrimientos más significativos que contribuyeron a la construcción de la estructura electrónica de los átomos. 3 Introducción. Los humanos han estado vagando por la Tierra durante cientos de miles de años. Sin embargo, en los últimos 100 años ha ocurrido la vasta explosión del conocimiento científico y de la tecnología (la aplicación práctica de la ciencia). Después de todo ese tiempo, ¿por qué hasta ahora? Probablemente la mejor explicación para los grandes avances es la manera en que los científicos han aprendido a interpretar los datos a partir de observaciones y experimentos. En lo que se conoce como método científico. La química es una ciencia activa y en continuo crecimiento; tiene una importancia fundamental para nuestro mundo, tanto en el ámbito de la naturaleza como de la sociedad. Sus orígenes son muy antiguos, pero también es una ciencia moderna. La química es el estudio de la materia y de los cambios que experimenta, es muy frecuente que a la química se le considere la ciencia central, ya que para los estudiantes de biología, física, geología, ecología, ambiental y otras disciplinas, es esencial tener un conocimiento básico de la química. En efecto la química es fundamental para nuestro estilo de vida; sin ella se tendría una vida más efímera en el sentido de vivir en condiciones primitivas: sin automóviles, electricidad, computadoras, discos compactos y muchos otros satisfactores cotidianos. Recuerda que… la química abarca el conocimiento de todo el Universo en cuanto a constitución, composición, propiedades y sus transformaciones, gracias a ella el ser humano, con su ingenio y curiosidad, ha logrado desarrollar proceso químicos para obtener productos que le son útiles, algunos métodos que tuvieron su origen en la prehistoria han evolucionado y mejorado hasta llegar a la tecnología actual. 4 Aunque la química es una ciencia ancestral, sus fundamentos modernos se instituyeron en el siglo XIX, cuando los avances tecnológicos e intelectuales permitieron a los científicos separar sustancias aún más pequeños y, por consiguiente, explicar muchas de sus características físicas y químicas. El rápido desarrollo de una tecnología cada más sofisticada a lo largo del siglo XX, ha proporcionado incluso más medios para estudiar cosas que no pueden verse a simple vista. Mediante el uso de computadoras y microscopios electrónicos, los químicos pueden analizar, por ejemplo, la estructura de los átomos y las moléculas unidades fundamentales en las que se basa el estudio de la química, así como diseñar nuevas sustancias con propiedades específicas, como fármacos y productos que hagan más agradable el ambiente del consumidor. A medida que avanza el siglo XX, es conveniente preguntarse qué parte de ciencia fundamental tendrá la química en este siglo. Es casi seguro que conservará una función fundamental en todas las áreas de la ciencia y la tecnología Recuerda que… gracias a la química se estableció la estrecha relación entre la materia y la energía, relación que ha permitido establecer teorías y leyes importantes. Todo el organismo del hombre, incluidas las partículas que conforman cada una de sus células, están constituidas por sustancias químicas. Así pues, la química es una ciencia fundamental que permite conocer y entender lo infinitamente pequeño y lo infinitamente grande, es decir el microcosmos y el macrocosmos. 5 1.1 Base experimental de la teoría cuántica. En septiembre de 1924 la revista inglesa de física “philosophical Magazine” publicó un artículo firmado con su nombre poco conocido Louis Victor De Broglie, quien fundamentaba la posible existencia de ondas de materia. Las ondas a las que se refería no son las ondas ordinarias como las sonoras o las del agua, sino a otro tipo de ondas. De Broglie afirmaba en su trabajo que estas ondas son generadas por el movimiento de cualquier objeto. Un planeta, una persona, una partícula de polvo, un electrón. La idea de Broglie sirvió de base a la mecánica cuántica moderna. La onda de De Broglie existe en la teoría, pero no había ningún aparato que pudiera captarla. Veinte años después los científicos norteamericanos, Davison y Germer y el soviético Tartakowski, comprobaron la existencia de las ondas de De Broglie, haciendo ensayos de difracción de electrones en un cristal. En las placas de difracción los electrones ponen de manifiesto además de sus propiedades de partículas, sus propiedades de ondas. Todos los objetos al desplazarse llevan una onda asociadas. Ésta es muy pequeña proporcionalmente para cuerpos muy grandes y aumenta al disminuir el tamaño del cuerpo. Tal es la onda de De Broglie. La mecánica cuántica nació en 1925. En ella colaboraron grandemente los jóvenes alemanes Werner Heisenberg y Erwin Schrödinger. Werner Heisenberg en 1924 expreso, que es imposible conocer simultáneamente con mucha exactitud la posición exacta del electrón en un cierto momento, este proceso de medición alteraría la velocidad del mismo introduciendo una incertidumbre. Este enunciado se llama principio de incertidumbre de Heisenberg. 6 Erwin Schördinger en 1926, estableció un modelo matemático llamado ecuación de onda, que permite predecir las zonas de probabilidad donde es posible encontrar a los electrones moviéndose. Para cada electrón en un átomo existe una ecuación de onda que describe su movimiento. Para resolver esta ecuación matemática, es necesario introducir tres parámetros conocidos como números cuánticos (al introducir las consideraciones relativas surge el cuarto número cuántico). Cada electrón de un átomo queda descrito con cuatro valores numéricos que corresponden a cada número cuántico. Modelo Cuántico. Los números cuánticos se denominan: 1. n. Número cuántico principal 2. l. Número cuántico secundario, azimutal o de forma 3. m. Número cuántico magnético, o por orientación. 4. s. Número cuántico de spin. 1. Número cuántico principal (n). Indica el nivel energético donde se puede encontrar un electrón. Tiene relación con la distancia media del electrón al núcleo y nos da una idea del tamaño del orbital (nube electrónica). El número cuántico principal adquiere valores positivos enteros. n= 1, 2, 3, 4, 5, 6, 7, …, etcétera o también K, L, M, N, O, P, Q (en desuso). Únicamente se llenan hasta el nivel energético 7, en lo que se conoce como estado basal, debido a que en la Tabla Periódica de los Elementos Químicos (TPEQ) sólo ocupan 7 periodos. (Figura 1). 2. Número cuántico secundario, azimutal o de forma (l). Nos da idea de la forma que tiene la “ zona de probabilidad donde se puede encontrar un electrón”. Adquiere valores desde 0 hasta n-1. 7 l = 0, 1, 2, 3, 4, …, n-1 En cada nivel hay un número de subniveles de energía igual al nivel correspondiente. Los tipos de subniveles en el átomo son: s, p, d y f. Figura 1. Número cuántico n. Los valores que adquieren los subniveles de energía son: s= 0 p= 1 d=2 f=3 (figura 1) En cada subnivel de energía se tiene un número determinado de orbitales: 1 orbital s 3 orbitales p 5 orbitales d 7 orbitales f Hay que recordar que un orbital se define como: la zona de mayor probabilidad donde se puede encontrar un electrón. Número de electrones por subnivel. Se determinan de 2 (2l + 1), esto es: 8 l = 0 ; 2(2(0) + 1) = 2(0 + 1) = 2(1) = 2 l = 1 ; 2(2(1) + 1) = 2(2 + 1) = 2(3) = 6 l = 2 ; 2(2(2) + 1) = 2(4 + 1) = 2(5) = 10 l = 3 ; 2(2(3) + 1) = 2(6 + 1) = 2(7) = 14 3. Número cuántico magnético (m). Representa la orientación de los orbitales, adquiere los valores de – l pasando por cero hasta + l, si: m=0 Hay un solo valor numérico, que identifica a los orbitales s. Un soló orbital por nivel m = -1, 0, 1 Hay 3 valores numéricos, que identifican a los orbitales p. 3 orbitales por nivel m = -2, -1, 0, 1, 2 Hay 5 valores numéricos, que identifican a los orbitales d. 5 orbitales por nivel m = -3, -2, -1, 0, 1, 2, 3 Hay 7 valores numéricos, que identifican a los orbitales f. 7 orbitales por nivel 4. Número cuántico de spin (s). Indica el sentido en el cual se asocia físicamente al electrón como un cuerpo que gira sobre su propio eje. Adquiere valores de + 1/2 y - 1/2, la diferencia de signos indica que un electrón “gira” en un sentido y el otro en sentido contrario. Los electrones se representan mediante flechas, una flecha en un sentido , indica un electrón desapareado (significa que se encuentra solo en un orbital; dos flechas con dirección opuesta apareado en el orbital. indica que hay un par electrónico 9 Las bases de la teoría fueron sentadas por el físico alemán Max Planck, que en 1900 postuló que la materia sólo puede emitir o absorber energía en pequeñas unidades discretas llamadas cuantos. Otra contribución fundamental al desarrollo de la teoría fue el principio de incertidumbre, formulado por el físico alemán Werner Heisenberg en 1927, y que afirma que no es posible especificar con exactitud simultáneamente la posición y el momento lineal de una partícula subatómica. Esa nueva física, basada en nociones probabilísticas y en el principio de incertidumbre, es heredera de los viejos cuantos de Planck. Por ello se le conoce como mecánica cuántica. Con la teoría cuántica se han podido explicar las propiedades de los átomos y moléculas, las reacciones entre ellos y sus consecuencias químicas. En particular, se puede entender las regularidades que Mendelev plasmó en su tabla periódica de los elementos químicos. La teoría cuántica ha servido para demostrar los fenómenos que no se pudieron explicar con la teoría ondulatoria de la luz, pero hay fenómenos que no pueden ser explicados con la teoría cuántica, y además hay ciertos fenómenos que pueden ser explicados por ambas teorías. Por último, la teoría cuántica predice y ayuda a entender la función que desempeñan los electrones (e) en la química. 10 1.1.1 Teorías de la luz, cuerpo negro y efecto fotoeléctrico, Teoría de Max Planck. Antes de 1900 se aceptaba que la luz era “una forma de energía propagándose por el espacio en forma de una onda electromagnética”. Entendiéndose por luz cualquier radiación electromagnética desde los rayos gamma a las ondas de radio. La onda electromagnética está formada por un campo eléctrico, E, y otro magnético, B, variables mutuamente perpendiculares. La velocidad de propagación de las ondas es muy grande y en el vacío tiene un valor constante de 2 998 E10 cm s-1, representándose por C. De esta forma la historia de la mecánica cuántica entrelazada con la historia de la química cuántica comienza esencialmente con el descubrimiento de los rayos catódicos en 1838 realizado por Michael Faraday, la introducción del término cuerpo negro por Gustav Kirchhoff en el invierno de 1859-1860, la sugerencia hecha por Ludwig Boltzman en 1877 sobre que los estados de energía de un sistema físico deberían ser discretos, y la hipótesis cuántica de Max Planck en el 1900, quien decía que cualquier sistema de radiación de energía atómica podía teóricamente ser dividido en un número de elementos de energía discretos , tal que cada uno de estos elementos de energía sea proporcional a la frecuencia , con las que cada uno podía de manera individual irradiar energía, como lo muestra la siguiente fórmula: Dónde: E= Energía o cuanto o fotón = Constante de Planck (6.6256 E-34 J s) ν = Frecuencia (s-1 o Hz) 11 Cada onda viene caracterizada por su longitud de onda λ (distancia que separa dos puntos consecutivos de igual fase), y su frecuencia ν (número de las longitudes de onda en la unidad de tiempo. (Figura 2). Figura 2. Onda electromagnética Ambas relacionadas por: ν=C/λ Dónde: ν = Frecuencia (Hz o s-1) C= constante de la velocidad de la luz (3E8 m/s) λ = Longitud de onda (nm) Entonces, en 1905, para explicar el efecto fotoeléctrico (1839), esto es, que la luz brillante en ciertos materiales puede funcionar para expulsar electrones del material, Albert Einstein postuló basado en la hipótesis cuántica de Planck, que la luz en sí está compuesta de partículas cuánticas individuales, las cuales más tarde fueron llamadas fotones (1926). La frase "mecánica cuántica" fue usada por primera vez en el paper de Max Born llamado Zur Quantenmechanik. En los 12 años que siguen, esta base teórica lentamente comenzó a ser aplicada a estructuras, reacciones y enlaces químicos. Hipótesis de Planck La solución al problema fue dada en 1900 por Planck, apartándose en sus razonamientos de las leyes usuales de la física. “La energía que proviene de los sistemas materiales no puede ser radiada de forma arbitraria, sino en forma discreta”. Se supone que la energía proviene de la oscilación de grupos de átomos. Las ideas de Planck encontraron inicialmente cierto reparo pues suponían introducir el concepto de cuantización de la energía, que aparecía en contradicción con la experiencia sobre los sistemas macroscópicos. Sea como fuere lo cierto es que se llegó a explicar la forma experimental de las curvas y asimismo surgía una pregunta: ¿Si la emisión de la luz sólo se puede hacer en forma discreta no será que porque la propia radiación consiste en entidades discretas de energía? Planck retomó la teoría defendida hace tiempo por Newton, la cual en ese entonces ya no tenía validez alguna. Newton consideraba a la luz como un haz de corpúsculos que se propagaban en línea recta, al aparecer la teoría ondulatoria de Huygens (1678), la teoría de los corpúsculos de Newton se vio destruida, pero era retomada nuevamente por Planck. La teoría cuántica básicamente nos dice que la luz no llega de una manera continua, sino que está compuesta por pequeños paquetes de energía, a los que llamamos cuantos. Estos cuantos de energía se llaman fotones. Toda luz que nos llega viene por pequeños paquetes, no es continua. Los fotones son las partículas “fundamentales” de la luz, así como los electrones son las partículas fundamentales de la materia, esta analogía es la que sirvió para realizar el descubrimiento del carácter cuántico de la luz. Por esta misma analogía, años después, De Broglie desarrolló la teoría que formula 13 que la materia también tiene un carácter ondulatorio. La carga eléctrica y la energía tienen una estructura granular (está formada por cuantos), al igual que la materia. Según Planck, la energía emitida o captada por un cuerpo en forma de radiación electromagnética es siempre un múltiplo (n) de la constante h, llamada posteriormente constante de Planck por la frecuencia ν de la radiación. Se supone que la energía proviene de la oscilación de grupos de átomos, pero en forma tal que: “La energía solo puede tener valores dados por”: E =nhν n = Número entero. h= Constante de Planck 6.62 10-34 J•s ν = Frecuencia de la radiación o del oscilador. A hν le llamó cuanto de energía. Que un cuanto sea más energético que otro dependerá de su frecuencia. Cuerpo Negro Se sabe que los objetos calientes emiten luz de diferentes colores, como el rojo mate de una resistencia de un horno eléctrico o el blanco brillante del filamento de un foco de tungsteno. A un objeto que absorbe y emite toda la radiación que le llega se le conoce como cuerpo negro. Una buena aproximación a un cuerpo negro es el de una cavidad con un pequeño orificio. La física clásica (física de principios del siglo XX) no podía dar una explicación completa de la emisión de luz por los sólidos calientes, a estas emisiones se les conoce como radiación del cuerpo negro. En 1900, Max Planck, al explicar los aspectos de dicha radiación, hizo una propuesta revolucionaria: 14 La energía, como la materia, es discontinua. En otras palabras, Planck propuso que la energía de la radiación del cuerpo negro esta cuantizada. Se dice que una cantidad se encuentra cuantizada cuando ésta varía como múltiplo entero de una unidad fundamental llamada cuanto o quantum. De acuerdo a la ecuación de Planck, la energía de la radiación emitida por el cuerpo negro es un múltiplo entero de hν, es decir, sus valores sólo pueden ser hν, 2hν, 3hν, 4hν…, etcétera. (Figura 3). Figura 3. Espectro de un cuerpo negro Por ejemplo, si se supone que el cuanto de energía hν es igual a 1.5 Joule, los únicos valores permitidos para ellos son: (1) hν = 1.5 J (2) hν = 3.0 J (3) hν = 4.5 J (4) hν = 6.0 J, etcétera. La cuantización de la energía propuesta por Planck para explicar la radiación del cuerpo negro marca el nacimiento de la mecánica cuántica. 15 Efecto Fotoeléctrico En el efecto fotoeléctrico se produce un haz de luz de electrones, por la acción de la luz, sobre la superficie de algunos metales. La cantidad de electrones emitidos depende de la intensidad o brillo de la luz utilizada. Es decir, depende de la energía de la radiación electromagnética con que se ilumina el metal. Si sobre la superficie de un metal, incide una radiación de frecuencia apropiada, se pueden arrancar electrones (fotoelectrones). La teoría clásica de la luz explica este fenómeno (efecto fotoeléctrico) suponiendo que se produce un intercambio de energía entre la radiación y el metal, pero no aclara cómo se verifica el intercambio. En el estudio experimental del efecto fotoeléctrico se observa lo siguiente: 1. Para cada metal existe una frecuencia mínima (ν o ) por debajo de la cual el efecto no se produce. Se le llama “frecuencia umbral” 2. La energía de los fotoelectrones es proporcional a la frecuencia de la radiación; no dependiendo de la energía o la intensidad de dicha radiación. 3. Al aumentar la intensidad de radiación se aumenta el número de fotoelectrones, pero no su energía cinética. Se observa que el punto 2 está en clara contradicción con la teoría clásica de la radiación. Einstein en 1905 da la siguiente interpretación del fenómeno; la luz consiste en cuantos de luz (fotones) de energía hν; al incidir los fotones sobre el metal, parte de su energía se invierte en sacar los electrones a la superficie, trabajo de extracción (T e ) de valor hν o , y el resto se convierte en energía cinética E c . El balance energético se puede representar como: Ec = hν − hν ο 16 La importancia de la explicación de Einstein del efecto fotoeléctrico radica en el hecho de proponer que cualquier radiación electromagnética está formada por partículas llamadas fotones, es decir, Einstein le confiere un comportamiento corpuscular (como partículas) a algo que hasta ese momento se consideraba una onda. (Figura 4). Metal Figura 4. Efecto fotoeléctrico Ejemplo, una placa de zinc recién pulida, cargada negativamente, pierde su carga si se la expone a la luz ultravioleta. Este fenómeno se llama efecto fotoeléctrico. Investigaciones cuidadosas, hacia finales del siglo diecinueve, prueban que el efecto fotoeléctrico sucede también con otros materiales, pero sólo si la longitud de onda es suficientemente pequeña. Se puede resumir que el proceso por el cual se liberan electrones de un material por la acción de la radiación se denomina efecto fotoeléctrico o emisión fotoeléctrica. 17 1.1.2 Espectro y series espectrales. La luz es en realidad un conjunto de luces de distinto color. La experiencia demuestra que la luz puede interactuar con los átomos y moléculas. Siempre que la luz pasa a través de un prisma o de una rejilla de difracción se separa en un intervalo de colores, lo mismo ocurre cuando la luz del Sol atraviesa las gotas de lluvia, se separa en los colores del arcoíris. El espectro de luz blanca, como la del sol o la que emite un foco, contiene luz de todas las frecuencias, por lo que se le denomina espectro continuo. (Figura 5). Figura 5. Espectro electromagnético Los átomos al ser excitados también emiten luz, por ejemplo en los anuncios luminosos de gas neón. Cuando la luz que emiten los átomos pasa a través de un prisma e inciden sobre una pantalla, sólo se observa un fondo oscuro y sobre éste unas cuantas líneas brillantes de colores; tal espectro se llama espectro de emisión. Eso es lo que ocurre cuando un elemento es calentado. En términos del modelo de Bohr, el calentar los átomos proporciona una cierta energía extra, así que algunos electrones pueden saltar a niveles superiores de 18 energía. Entonces, cuando uno de estos electrones vuelve al nivel inferior, emite un fotón, en una de las frecuencias especiales de ese elemento, por supuesto. Y esos fotones crean las líneas brillantes en el espectro. Los espectros de emisión de átomos en fase gaseosa muestran que los átomos emiten luz sólo de ciertas longitudes de onda. A estos espectros se les llama espectros de líneas, porque la radiación emitida se presenta como líneas brillantes y definidas en el espectro. Cada elemento químico tiene un espectro de emisión particular. Las líneas características de los espectros atómicos son útiles en el análisis químico para la identificación de átomos desconocidos. Cuando las líneas del espectro de emisión de un elemento conocido concuerdan en su totalidad con las líneas de un espectro de emisión de una muestra desconocida, se puede afirmar que la sustancia desconocida es, en realidad, una que ya se había descubierto. De la misma manera, si se hace pasar luz a través de un gas y se analiza el haz que sale se obtiene una banda continua de colores con unas delgada líneas oscuras, estas líneas corresponden a la luz que fue absorbida por el gas; a este espectro se le nombra espectro de absorción. Suponga que en lugar de una muestra calentada de un elemento, se tiene ese mismo elemento en forma de un gas relativamente frío. Ahora, digamos que una fuente de luz blanca conteniendo todas las longitudes de onda visibles es dirigida al gas. Cuando los fotones de la luz blanca pasan a través del gas, algunos de ellos pueden interactuar con los átomos siempre que tengan la frecuencia apropiada para empujar un electrón de ese elemento hasta un nivel superior de energía. Los fotones en esas frecuencias particulares son absorbidos por el gas Hacia la mitad del siglo XIX, los espectrógrafos se habían mejorado hasta el punto de que se consiguió mejorar otra característica del espectro solar. Superpuestas sobre el fondo del espectro visible se podían ver cientos de líneas oscuras que indicaban que las longitudes de onda correspondientes desaparecían con respecto al espectro solar. Los científicos comprobaron que 19 muchas de las longitudes de onda de estas líneas oscuras correspondían a las longitudes de onda de emisión de determinados elementos. (Figura 6) Figura 6. Espectros de emisión y absorción Sin embargo, los elementos químicos en estado gaseoso y sometido a temperaturas elevadas producen espectros discontinuos en los que se aprecia un conjunto de líneas que corresponden a emisiones de sólo algunas longitudes de onda. La figura 7, muestra el espectro de emisión del sodio. Figura 7. Espectro discontinuo del sodio La regularidad encontrada en los espectros discontinuos supone un apoyo muy importante para comprender la estructura de los átomos. Las técnicas espectroscópicas se empezaron a utilizar en el siglo XIX y no tardaron en dar sus primeros frutos. Así en 1868 el astrónomo francés P.J.C. 20 Janssen se trasladó a la India con el objeto de observar un eclipse de sol y utilizar el espectroscopio, desarrollado ocho años antes, para hacer un estudio de la cromosfera solar. Como resultado de sus observaciones anunció que había detectado una nueva línea espectroscópica, de tono amarillo, que no pertenecía a ninguno de los elementos conocidos hasta ese momento. En el mismo año, el químico Frankland y el astrónomo Lockyer dedujeron que la citada línea correspondía a un nuevo elemento al que llamaron Helio (del griego helios que significa Sol) por encontrarse en el espectro solar. Concluyendo, el espectro refleja un sistema de organización, y en consecuencia se utilizara como información sobre la estructura de átomos y moléculas. Series espectrales. Las diferentes líneas que aparecieron en el espectro del hidrógeno (Figura 8) se agrupan en diferentes series cuya longitud de onda es más parecida: Serie Lyman: zona ultravioleta del espectro. Serie Balmer: zona visible del espectro. (1885) Serie Paschen: zona infrarroja cercana del espectro. (1908) Serie Bracket: zona infrarroja intermedia del espectro. (1922) Serie Pfund: zona infrarroja lejana del espectro. (1924) (1906-1914) Ley de Rydberg. La relación entre las longitudes de onda de las distintas rayas del espectro del hidrógeno viene dada por la expresión: 1/l = R H · [(1/n 1 2) - (1/n 2 2)] Dónde: 21 n 1 y n 2 = Son números naturales, cumpliéndose siempre que n 2 > n 1 , con lo que el paréntesis queda positivo. R= Es una constante llamada constante de Rydberg cuyo valor es: R = 1.0968 E7 m–1. Si n 1 = 1; n 2 = 2, 3, 4, 5, ... Serie Lyman Si n 1 = 2; n 2 = 3, 4, 5, 6, ... Serie Balmer Si n 1 = 3; n 2 = 4, 5, 6, 7, ... Serie Paschen Si n 1 = 4; n 2 = 5, 6, 7, 8, ... Serie Bracket Si n 1 = 5; n 2 = 6, 7, 8, 9, ... Serie Pfund . Figura 8. Series espectrales del hidrógeno 22 1.2 Átomo de Bohr. En el año 1913, Niels Bohr, al estudiar los espectros de emisión del hidrógeno, elaboró la primera teoría cuántica de la estructura atómica. Su modelo le permitió explicar el espectro de emisión del átomo de hidrógeno. Sus postulados son: 1. El electrón en el átomo sólo puede ocupar ciertos estados. Estos estados se caracterizan por una energía fija y definida. Los electrones en un átomo se mueven en regiones específicas a ciertas distancias del núcleo, llamados niveles de energía los cuales tienen un valor de energía cuantizado. 2. Bohr le asignó un número interno a cada nivel de energía y lo represento como n. A este número que indica el nivel de energía en un átomo se le llama número cuántico principal. Los valores que n puede tomar son: 1, 2, 3, 4, 5… etcétera. De esta manera si n=1 se está hablando del primer nivel de energía, si n=2 del segundo nivel y así sucesivamente. En un estado determinado no se absorbe ni emite energía. El salto de un electrón desde un estado a otro de energía inferior se manifiesta en forma de un fotón de energía, hν, igual a la diferencias entre los dos estados. 3. El número máximo de electrones en un nivel de energía se calcula usando la ecuación 2 n2. En cualquier estado el electrón se mueve en una órbita circular alrededor del núcleo. 4. Al moverse un electrón en cierto nivel de energía, éste no gana ni pierde energía; tales niveles estables de energía son llamados estados estacionarios del átomo. Los estados de movimiento permitidos son aquellos en los cuales el momento angular del electrón es un múltiplo entero de h/2π. 23 Un hecho sobresaliente en el modelo de Bohr es que los electrones solo pueden estar en los niveles en los que su energía esta cuantizada, esto se puede entender con la siguiente analogía: Los niveles de energía del modelo de Bohr son como escalones de una escalera y los electrones son como una persona. De esta manera una persona solo puede pararse donde exista escalón, pues de intentarlo en cualquier otro lugar se caería. De igual manera los electrones solo pueden estar en niveles de energía, no podrían estar en otro lugar porque allí no existe el nivel de energía. (Figura 9). Para los radios de los estados (niveles) permitidos, Bohr obtiene la expresión: h2 r=n 2 4 π me ; (n = 1, 2, 3, …) 2 Para explicar el espectro de emisión del hidrógeno, Bohr supuso lo siguiente: los electrones al ser excitados (absorber energía), “saltan” a niveles de energía superiores, cuando regresan a su nivel de energía original (estado basal) emiten energía en forma de fotones. Por cada salto de un electrón –de un nivel de energía superior a uno inferior– se emite un fotón, pero como los electrones no tienen solo una manera de regresar a su estado basal, en realidad se están emitiendo varios fotones simultáneamente. De esta forma, por cada salto de un electrón se obtiene una línea en el espectro de emisión correspondiente, es decir, cada línea representa la transición electrónica de los electrones entre dos niveles de energía diferentes. El modelo de Bohr explicaba muy bien las líneas espectrales observadas experimentalmente para el átomo de hidrógeno; sin embargo, los métodos de cálculo de Bohr no tuvieron éxito para átomo con mayor número de electrones. De hecho, este modelo sólo resultó adecuado para explicar iones y átomos con 24 un solo electrón, como H, He1+ y Li 1+ , pero no podía explicar los espectros atómicos de otros átomos o iones con más de un electrón. Figura 9. Modelo de Bohr 25 1.2.2 Teoría atómica de Sommerfeld. El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético tenían distinta energía, mostrando que algo andaba mal en el modelo. Su conclusión fue que dentro de un mismo nivel energético existían subniveles, es decir, energías ligeramente diferentes para un nivel energético dado. Además desde el punto de vista teórico, Sommerfeld había encontrado que en ciertos átomos las velocidades de los electrones alcanzaban una fracción apreciable de la velocidad de la luz. Sommerfeld estudió la cuestión para electrones relativistas En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando atenuar los dos principales defectos de éste. Para eso introdujo dos modificaciones básicas: 1. Órbitas casi- elípticas para los electrones y, 2. Velocidades relativistas. En el modelo de Bohr los electrones sólo giraban en órbitas circulares. La excentricidad de la órbita dio lugar a un nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se representa con la letra l y toma valores que van desde 0 hasta n-1. Las órbitas con: • l = 0 se denominarían posteriormente orbitales s o sharp • l = 1 se denominarían p o principal. • l = 2 se denominarían d o diffuse. • l = 3 se denominarían f o fundamental. Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postuló que el núcleo del átomo no permanece inmóvil, sino que 26 tanto el núcleo como el electrón se mueven alrededor del centro de masas del sistema, que estará situado muy próximo al núcleo al tener este una masa varios miles de veces superior a la masa del electrón. Para explicar el desdoblamiento de las líneas espectrales, observadas al emplear espectroscopios de mejor calidad, Sommerfeld supone que las órbitas del electrón pueden ser circulares y elípticas, e indica el momento angular del electrón en la órbita en unidades de h/2π, determinando los subniveles de energía en cada nivel cuántico y la excentricidad de la órbita. Al perfeccionarse los espectroscopios (aparatos que muestran los espectros) se observó que las líneas del espectro del hidrógeno eran en realidad varias líneas muy juntas. Y lo que Bohr creyó que eran estados únicos de energía eran varios estados muy próximos entre sí. Con Sommerfield, para determinar la posición del electrón en el átomo de hidrógeno hay que dar 2 números cuánticos l y m Con la ayuda de la relatividad de Albert Einstein, hizo las siguientes modificaciones al modelo de Bohr: 1. Los electrones se mueven alrededor del núcleo en órbitas circulares o elípticas. 2. A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel. 3. El electrón es una corriente eléctrica minúscula. En consecuencia el modelo atómico de Sommerfeld es una generalización del modelo atómico de Bohr desde el punto de vista relativista, aunque no pudo demostrar las formas de emisión de las órbitas elípticas, solo descartó su forma circular. 27 1.3 Estructura atómica. Hasta finales del siglo XIX los conocimientos fisicoquímicos se explican con base en los postulados de la teoría atómica de Dalton. Los átomos son esferas de masa y naturaleza distinta según el elemento de que se trate. Las ideas de Dalton son suficientes para entender las propiedades observables; pero las manifestaciones de los fenómenos a escala microscópica, el caso de la electrolisis, sugerían que era preciso aceptar una mayor complejidad de la materia. Algunas experiencias clásicas que fueron clave en descifrar la estructura atómica son: 1. El descubrimiento del electrón y de la naturaleza de la electricidad (1897). 2. Las experiencias de Rutherford (1911) en que se puso de manifiesto que existía un núcleo y una envuelta electrónica. 3. El descubrimiento de las leyes que gobiernan los electrones en los átomos (1925). La ordenación de los electrones se refleja en la estructura de la tabla periódica de los elementos, ésta es un sucinto dispositivo que ayuda a recordar y/o a predecir tendencias y similitudes en las propiedades físicas y químicas de los elementos. La interpretación de esta propiedad está basada en la estructura de los átomos (comportamiento de los electrones en los átomos). Los primeros modelos de tablas periódicas fueron diseñados y utilizados antes de que se conocieran los electrones y los núcleos; además sólo se conocían 60 elementos. Fue la búsqueda de este conocimiento lo que provocó el gran esfuerzo científico para relacionar los espectros de los átomos, tan útiles para determinar presencia y abundancia de elementos en las estrellas y en todo el universo, pero, también son útiles para determinar la estructura atómica. 28 1.3.1 Principio de incertidumbre de Heinsenberg. La dualidad onda-partícula de la materia de De Broglie impone una limitación fundamental a la precisión con que se puede conocer simultáneamente el momento y la posición de una partícula. Esta limitación es sumamente importante cuando se trata de partículas microscópicas, como el electrón. En 1928, el físico alemán Werner Karl Heisenberg enunció esta limitación en un principio que en la actualidad se conoce como principio de incertidumbre de Heisenberg, el cual dice: “Es imposible conocer en forma exacta y simultanea la posición y el momento del electrón”. Supóngase que se desea medir la posición de un electrón. Es preciso hacer chocar con él un fotón, hν, parte de cuyo momento es transferido al electrón. La incertidumbre en el conocimiento de la posición del electrón “∆x” está limitada por la longitud de onda, λ, del fotón. ∆x ≈ ± λ Pero ello implica necesariamente una incertidumbre en el momento, ∆p, pues; ∆p = h/ λ Con lo que: ∆x∆p ≈ ± h λ/ λ = h Que es una de las expresiones matemáticas del principio de incertidumbre, enunciado por Heisenberg. 29 Este principio de incertidumbre muestra de manera contundente que es totalmente incorrecto hablar de “electrones moviéndose en orbitas definidas” alrededor del núcleo, lo cual prepara el terreno para un modelo atómico mucho más elaborado, el modelo cuántico del átomo. 30 1.3.2 Principio de dualidad, postulado de De Broglie. Al igual que el átomo, la luz ha sido motivo de estudio del hombre desde hace mucho tiempo, debido a su afán de comprender mejor las cosas que le rodean. Ya 500 años antes de Jesucristo, Pitágoras afirmaba que la luz está formada por partículas que fluyen en línea recta y a gran velocidad del propio cuerpo luminoso que captan nuestros ojos. Más tarde, Aristóteles sostuvo que la luz se propaga desde el cuerpo hasta el ojo, análogamente al sonido. Newton, se opuso tenazmente a la teoría ondulatoria y fue partidario de la teoría corpuscular, cuya idea coincidía con la de Pitágoras. Esta teoría explica bien la reflexión (la luz se refleja en un espejo de modo análogo como una bola de billar rebota en la banda de la mesa). La refracción de la luz, aunque con más dificultades es también explicada, pero otros fenómenos como la polarización y la difracción no encuentran respuestas. Para otros, partidarios de la teoría ondulatoria de Huyghens, la luz está formada por vibraciones del éter. Sin embargo, pese a que esta explica perfectamente fenómenos como la polarización y la difracción, el gran prestigio de Newton, hizo que la teoría corpuscular prevaleciera durante todo el siglo XVIII. Hasta el siglo XIX los físicos estaban divididos sobre la naturaleza de la luz. En 1815 Maxwell dedujo teóricamente que la velocidad de las ondas electromagnéticas era la misma que la de la luz. Este hecho le sugirió la idea de que la luz debía estar formada por vibraciones electromagnéticas de frecuencia elevada que no necesitan ningún medio material para propagarse. Según esta teoría no era necesaria la existencia del hipotético éter y la luz entraba a formar parte de las radiaciones electromagnéticas. Esto supuso un golpe de muerte para la teoría corpuscular. Cuando parecía que el modelo ondulatorio de Huygens había logrado dar una explicación exacta sobre la naturaleza de la luz, los experimentos de Hertz en 31 1887 vienen a introducir un nuevo problema el “efecto fotoeléctrico” cuando se ilumina una superficie metálica con una radiación de frecuencia adecuada se produce una emisión de electrones. La teoría ondulatoria no da explicación suficiente del efecto fotoeléctrico, ya que según la misma la energía transportada por una onda es independiente de su frecuencia, mientras que la experiencia demuestra que por debajo de cierta frecuencia el efecto fotoeléctrico no se produce. La explicación del efecto fotoeléctrico fue dada por A. Einstein, basándose en la teoría de Planck. Para Einstein, si la energía es emitida o absorbida de manera discontinua mediante cuantos de energía (como sostenía Planck) es porque la misma naturaleza de la luz (la energía radiante) es discontinua y está formada por paquetes de energía a los que llamó fotones, de modo que actúan de manera similar a los corpúsculos de Newton. Se permaneció así, con un doble carácter corpuscular y ondulatorio, que prevalecía uno sobre otro según el fenómeno que se tratase, hasta que en 1923 Luis de Broglie acabó con las discrepancias y estableció la dualidad ondacorpúsculo. Según Broglie, el fotón puede ser considerado como un corpúsculo que parte del cuerpo luminoso y que en su rápido movimiento origina una onda electromagnética (cuya longitud de onda dedujo: l =h/mv), convirtiéndose así en un corpúsculo-onda, del mismo modo que al avanzar rápido un proyectil origina un movimiento periódico que nosotros percibimos como sonido. Del mismo modo que electrón transporta su campo eléctrico, cada cuanto de radiación transporta consigo un fenómeno periódico que se extiende por el espacio circundante. Por consiguiente, la aparente contradicción sobre la doble naturaleza de la luz cesa desde el momento en que la energía radiante constituida a la vez por ondas y corpúsculos, indisolublemente asociados. Porque entonces se concibe sin dificultad que el carácter ondulatorio se manifiesta especialmente en ciertos fenómenos, mientras que en otros prevalece el carácter corpuscular. 32 1.3.3 Ecuación de onda de Schrödinger. En 1926 Schrödinger generalizó la expresión de De Broglie para los electrones. El físico-matemático austriaco Erwin Schrödinger basó su razonamiento en que si el electrón se comporta como una onda, se le puede aplicar una ecuación de onda; y como está sometido a la acción del núcleo, la ecuación escogida es análoga a la que se emplea para describir un sistema de ondas estacionarias. Para una dirección (X) d2ϕ = dx2 4 π2 λ2 y, para las tres direcciones: ∂2ϕ + ∂2ϕ + ∂2ϕ ∂x2 ∂ y2 ∂z2 Resolviendo queda de la siguiente forma: = 4 π2 λ2 Cuando se trata de resolver la ecuación anterior se encuentra que es sólo posible para aquellos casos en que la energía toma valores que están relacionados con números enteros. Lo anterior dice que la cuantización aparece como una necesidad de la teoría de Schrödinger. No tiene que ser postulada como en el caso de Bohr. El significado de “ϕ” es tal que “ϕ2 dv” nos da la probabilidad de que una partícula se encuentre en el elemento de volumen, dv. 33 La ecuación matemática contiene la información necesaria sobre el estado energético de los electrones en un átomo. Al resolverla se obtienen funciones matemáticas que se llaman orbitales. “Un orbital es una función matemática que describe el estado de un electrón en un átomo” La mecánica cuántica establece además que, asociados a cada orbital, se encuentran tres a números cuánticos. Estos números derivan de la solución matemática de la ecuación de Schrödinger, sus nombres son: a. Número cuántico principal (n). b. Número cuántico azimutal (l) y, c. Número cuántico magnético (m). Número cuántico principal (n). Indica el nivel de energía en el que se encuentra el electrón. Sus valores son cualquier entero positivo, es decir: n = 1, 2, 3, 4, … Número cuántico azimutal (l). Indica el subnivel que puede ocupar el electrón. Sus valores son números enteros que siempre comienzan en cero y terminan en el valor (n-1), es decir: l = 0, 1, 2, 3, 4, … (n-1) A cada valor de l se le asigna una letra, siendo siempre las primeras cuatro letras s, p, d, f, luego de estas se van asignando letras en orden alfabético, tal como se muestra: l = 0, 1, 2, 3, 4, 5….. l = 0, 1, 2, 3, 4, 5….. s, p, d, f, g, h…. 34 Cada subnivel puede tener un número definido de electrones, por ejemplo, el subnivel s puede tener como máximo dos electrones, el p 6, y así sucesivamente. Número cuántico magnético o de orientación (m). Indica la orientación de un orbital atómico. Sus valores son números enteros que empiezan en el valor de – l pasan por cero y terminan en el valor de +l. Existe un valor de m, para cada orbital atómico de ahí que el número de valores de m corresponderá al número de orbitales atómicos. Los valores permitidos para los tres números cuánticos permiten entender la distribución de los electrones en un átomo. Los orbitales, al ser funciones matemáticas, pueden representarse gráficamente. Las gráficas de los orbitales atómicos representan las zonas de más alta probabilidad para encontrar un electrón. Es importante señalar que las gráficas de los orbitales no son las formas de estos, en realidad, nadie ha visto nunca un orbital. Para los orbitales 1s, 2s y 3s se tiene que al representarlos gráficamente se obtiene lo siguiente. (Figura 10). Figura 10. Orbitales s 35 Como se observa en la figura, todas la gráficas de los orbitales s tienen la forma esférica, pero diferente tamaño; éste se incrementa conforme aumenta el valor de n. En el caso de los orbitales p, se tienen las gráficas como (Figura 11), las cuales son similares entre sí en la forma, pero diferentes en la orientación espacial de cada orbital. Figura 11. Orbitales p. Se observa que cada orbital se orienta preferentemente sobre un eje, esto es fácil de entender si se recuerda que los tres orbitales p tienen valores distintos de m, y este número cuántico indica la orientación espacial del orbital. Se observa que los tres orbitales p tienen el mismo valor de n, n=2, lo que indica que están en el mismo nivel de energía. A los orbitales que tienen la misma energía se les llama orbitales degenerados. Los tres orbitales p son degenerados entre sí. Al igual que sucede con los orbitales p, los cinco orbitales d se orientan en forma distinta en el espacio. En este caso, la orientación de los orbitales d es con respecto a los planos (Figura 12), a diferencia de los p, que es con respecto a los ejes. 36 Los cinco orbitales d también son degenerados entre sí. En el caso de los siete orbitales f sus gráficas son aún más complicadas, estos siete orbitales también son degenerados entre sí. Figura 12. Orbitales d Al resolver la ecuación de Schrödinger se obtienen las funciones matemáticas que se llaman orbitales, sus valores de energía y sólo tres números cuánticos. Esto permite tener una primera aproximación a la distribución de los electrones en un átomo. Es importante señalar que la ecuación de Schördinger sólo tiene una solución exacta para átomos monoelectrónicos (H, He1+, Li2+); para átomos polielectrónicos es necesario hacer aproximaciones de cálculo para la solución de ésta. Figura 13. Orbitales f 37 1.3.3.3 Principio de exclusión de Pauli. Este principio cuántico fue enunciado por Wolfgang Ernest Pauli en 1925 y establece que dos partículas similares no pueden existir en el mismo estado, es decir, que no pueden tener ambas la misma posición y la misma velocidad, dentro de los límites fijados por el principio de incertidumbre. Por otra parte, a través del principio de exclusión se puede explicar por qué las partículas materiales no colapsan en un estado de casi extrema densidad, bajo la influencia de las fuerzas producidas por las partículas de spin 1, 1½ y 2: si las partículas materiales están casi en la misma posición, deben tener entonces velocidades diferentes, lo que significa que no estarán en la misma posición durante mucho tiempo. Generalmente este principio establece que dos electrones de un mismo átomo no pueden tener sus cuatro números cuánticos respectivamente iguales. El principio de exclusión de Pauli sólo se aplica a fermiones (protones, neutrones y electrones), esto es, partículas que forman estados cuánticos antisimétricos y que tienen spin. "Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos". El principio de exclusión de Pauli interpreta un papel importante en un vasto número de fenómenos físicos. Uno de los más importantes es la configuración electrónica de los átomos. Un átomo eléctricamente neutro aloja a un número de electrones igual al número de protones en su núcleo. Como los electrones son fermiones, el principio de exclusión les prohíbe ocupar el mismo estado cuántico, así que tienen que ir ocupando sucesivas capas electrónicas. Como ejemplo, es ilustrativo considerar un átomo neutro de helio, que tiene dos electrones ligados. Estos dos electrones pueden ocupar los estados de mínima 38 energía (1s), si presentan diferente espín. Esto no viola el principio de Pauli, porque el espín es parte del estado cuántico del electrón, así que los dos electrones están ocupando diferentes estados cuánticos. Sin embargo, el espín sólo puede tomar dos valores propios diferentes o dicho de otra forma, la función que describe al sistema sólo puede tener dos estados diferentes que sean propios del operador espín s. En un átomo de litio, que contiene tres electrones ligados, el tercer electrón no puede entrar en un estado 1s, y tiene que ocupar uno de los estados 2s (de energía superior). De forma análoga, elementos sucesivos producen capas de energías más y más altas. Las propiedades químicas de un elemento dependen decisivamente del número de electrones en su capa externa, lo que lleva a la tabla periódica de los elementos. El principio de Pauli también es responsable de la estabilidad a gran escala de la materia. Las moléculas no pueden aproximarse arbitrariamente entre sí, porque los electrones ligados a cada molécula no pueden entrar en el mismo estado que los electrones de las moléculas vecinas. Resumiendo, este principio establece que por cada espacio o tipo de orbital, puede contener únicamente 2 electrones, y con spin contrario. El par de electrones, tienen 3 números cuánticos iguales y difiere en el número cuántico de spin. Por ejemplo al distribuir los electrones por niveles, un mismo espacio de orbital tiene una flecha hacia arriba y hacia abajo. La representación se llama configuración electrónica desarrollada (Figura 13), donde cada flecha indica un electrón, (+1/2) y (-1/2). Cuando se realiza el llenado electrónico primero se llena el orbital "s" y se continúa con el siguiente orbital del mismo nivel. Los electrones se acomodan de uno en uno hasta llenar todos los espacios de ese orbital, colocando el electrón con el mismo spin (flecha hacia arriba) y se regresa con el primer 39 espacio colocando la flecha en sentido contrario para empezar a llenar en el mismo orden todos los espacios. Figura 14. Orden de llenado de orbitales. En un mismo orbital pueden quedar espacios vacíos o espacios semi-llenos. Por ejemplo el Flúor con Z = 9, acomoda sus nueve electrones entre el primer y el segundo nivel, eso se representa en una configuración condensada. 9F 1s2 2s22p5 Donde: Z = Número atómico. 40 1.4 Distribución electrónica en sistemas polielectrónicos. Cuando un átomo contiene más de un electrón, la resolución de la adecuada ecuación de ondas es complicada. No obstante, la aplicación de distintos métodos aproximados ha conducido a la obtención de descripciones teóricas de acuerdo con los resultados experimentales. El problema de la distribución de electrones entre los distintos orbitales se resuelve por la aplicación del principio de exclusión de Pauli, según el cual “en un átomo no puede existir dos electrones que tengan el mismo conjunto de números cuánticos”. Así pues cada orbital sólo puede estar ocupado por dos electrones. Dentro de un valor dado del número cuántico “n”, cuanto mayor sea el valor del número cuántico “l” mayor será la probabilidad de que el electrón se encuentre a gran distancia del núcleo. La forma en que se encuentran acomodados los electrones en un átomo se representa de manera adecuada por medio de las configuraciones electrónicas Una configuración electrónica es una sucesión de términos del tipo: n lx Donde: n = Número cuántico principal l = Número cuántico azimutal nl = La combinación representa un orbital x = Es el número de electrones presentes en éste. 41 Para hacer la configuración electrónica de un átomo, los electrones tienen que acomodarse de los orbitales de menor a los de mayor energía, de acuerdo al orden que se muestra en la figura 15. Figura 15. Distribución electrónica. Este acomodo de los electrones a partir de los orbitales de menor energía a los de mayor energía, se conoce con el nombre de principio de Aufbau o de edificación progresiva, y establece que: En un átomo, cuando los electrones se introducen dentro de los orbitales atómicos, ellos ocuparan el orbital con menor energía. Este principio proporciona las configuraciones de la mayoría de los elementos químicos en su estado basal. Se hace necesaria otra regla que fije el número máximo de electrones que puede ocupar un mismo orbital. El estado de un electrón en un átomo está determinado por medio de los custro números cuánticos (n, l, m, s), de ahí que esta nueva regla esté relacionada con ellos. 42 1.4.1 Configuración electrónica de los elementos. Ciertas propiedades de los átomos dependen principalmente de sus distribuciones electrónicas y más aún de la situación en los distintos orbitales de los electrones más externos, “electrones de valencia”. Por lo tanto es interesante conocer tales distribuciones, que se establecen suponiendo que el núcleo atómico con la carga apropiada está rodeado por orbitales vacíos y que éstos se van llenando según el orden de energías crecientes, cumpliéndose en cualquier caso el principio de exclusión de Pauli. Existe influencia del factor llamado “carga nuclear Z”. Estos cambios ocasionan que las posiciones relativas de las energías en los distintos orbitales, pertenecientes a distintos valores de “n”, pueden variar. El resultado combinado de los factores n, l y Z, hace que la distribución de energías de los distintos orbitales sea con gran aproximación a la figura 14. Figura 16. Diagrama de energías para los orbitales 43 En el diagrama se puede observar que los orbitales “3d” tienen mayor energía que los “4s”, con la consecuencia de que los electrones se situaran antes en “3d”, y lo mismo ocurre con los “4d” y “5s”, los “5d” y "6s”, etc. Así mismo que hay orbitales: “4f” y “5d”, “5f” y “6d”, “6f” y “7d” con aproximadamente la misma energía. Esta circunstancia se reflejará en pequeñas variaciones del orden de llenado. Para establecer las configuraciones electrónicas de los átomos se tomaran como base dos importantes reglas: 1. El principio de la energía mínima, según el cual los electrones ocuparan el orbital de energía más baja. 2. El principio de exclusión de Pauli, que señala la imposibilidad de que dos electrones tengan el mismo conjunto de números cuánticos. Con la ayuda de la figura 13, el principio de Aufbau y el principio de exclusión de Pauli es posible escribir las configuraciones electrónicas de los elementos en su estado basal. Otra forma de visualizar el acomodo de los electrones en un átomo es por medio de la representación gráfica de la configuración electrónica. En esta representación, en lugar de escribir a los electrones como exponentes, se dibuja una línea horizontal arriba del símbolo de cada orbital y se representa a cada electrón por medio de una flecha, en donde una flecha que apunta hacia arriba significa spin positivo y una flecha hacia abajo significa spin negativo. Por ejemplo para el átomo de hidrógeno, se tendría: 1s Para poder escribir de forma correcta la representación electrónica es necesario aplicar el principio de máxima multiplicidad o regla de Hund, el cual afirma que: 44 “El acomodo de electrones en orbitales degenerados será de tal forma que su multiplicidad sea máxima”. La máxima multiplicidad corresponde al número máximo de electrones con espines paralelos. Dicho de una manera más simple, en el caso de orbitales degenerados primero se colocará un electrón en cada uno de los orbitales y después se procederá a aparearlos (formar parejas). En el caso del nitrógeno, su configuración electrónica es: 1s2 2s2 2p3 Como los últimos tres electrones se encuentran en orbitales degenerados se aplica la regla de Hund, por lo que se coloca un electrón en cada orbital 2p, como ya no hay más electrones que acomodar no se forman parejas de ellos, por lo que la representación gráfica queda: 1s 2s 2p 2p 2p La representación gráfica de la configuración electrónica (a menudo llamado diagrama orbital) resulta muy útil en la asignación de los cuatro números cuánticos de un electrón. Por ejemplo si se necesitara conocer el valor de los cuatro números cuánticos del último electrón del átomo del de níquel, se usa la parte final de la configuración electrónica para determinar los valores n y l de los electrones: 1s2 2s2 2p6 3p6 4s2 3d8 n=3 d (l =2) En seguida, partiendo del valor de l, que en este caso es 2, se determinan los valores de m, que para l =2, son -2, -1, 0, 1, y 2. y se colocan debajo de la 45 representación gráfica de la parte final de la configuración electrónica de izquierda a derecha: 3d 3d 3d 3d 3d m=- 2 m=-1 m=0 m=1 m=2 Finalmente, se observa en que orbital está el último electrón y que valor de m le corresponde, en este caso el último electrón está en el orbital con m=0. Como la flecha apunta hacia abajo, el valor del spin de este electrón es – ½. Los valores para los cuatro números cuánticos de este electrón se escriben de la siguiente manera (n, l, m. s), y resultan quedando para este ejemplo (3, 2, 0, ½ ). Las propiedades magnéticas de un átomo dependen de la distribución de sus electrones en los orbitales. De esta manera si un átomo tiene todos sus electrones apareados, el efecto de un campo magnético externo sobre él será muy débil o prácticamente nulo. Un átomo es diamagnético si tiene todos sus electrones apareados y paramagnético si tiene electrones desapareados. La mecánica cuántica fundamenta el ordenamiento de los elementos en la tabla como manifestación de la Ley periódica. La misma mecánica cuántica también fundamenta el principio de construcción progresiva mediante la regla de las diagonales como base del ordenamiento de los electrones en sus orbitales y por ello hay una estrecha relación entre el acomodo de los electrones y sus orbitales. 46 1.4.1.3 Ubicación periódica de acuerdo al electrón. Las configuraciones electrónicas de los elementos químicos están íntimamente relacionadas con la posición que éstos guardan en la tabla periódica. Si se hicieran todas las configuraciones electrónicas para los elementos del grupo 1, se observaría que todas ellas terminan en ns1; las del grupo 2 terminan en ns2. Se pueden obtener relaciones de este tipo para cada grupo de elementos de la tabla periódica. Estas relaciones en la parte final de la configuración electrónica de los elementos permiten agruparlos por bloques en la tabla periódica. Las dos primeras columnas de la izquierda de la tabla periódica corresponden a los metales alcalinos y alcalinotérreo, respectivamente, en estos elementos se están llenando los orbitales s de la última capa, por lo cual se le llama bloque s. De lado derecho de la tabla se encuentra un bloque de seis columnas, el cual incluye a los gases nobles, los no metales y parte de los metales. En este bloque se están llenando los orbitales p de la última capa por esta razón recibe el nombre de bloque p. (Figura 17). Figura 17. Bloques s, p, d, f, en la Tabla Periódica 47 En la parte intermedia de la tabla hay un bloque de diez columnas que contiene a los metales de transición. En este bloque se están llenando los orbitales d, por lo que se le llama bloque d. Finalmente debajo de la tabla hay un bloque de dos filas y catorce columnas que contiene a los elementos en los cuales se están llenando los orbitales f, de ahí que se le llame bloque f. (figura 17). 48 UNIDAD II PERIODICIDAD Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS. COMPETENCIA A DESARROLLAR. Organizar las propiedades de los elementos químicos como funciones periódicas. Utilizar las reglas de la nomenclatura química para los compuestos inorgánicos, atendiendo las reglas de la IUPAC (Unión Internacional de Química Pura y Aplicada. 49 2.1 Elementos químicos, su clasificación y propiedades periódicas. Alrededor de 1860, los científicos ya habían descubierto 60 elementos y habían determinado sus masas atómicas. Notaron que algunos elementos tenían propiedades similares, por lo cual le dieron nombre a cada grupo de elementos parecidos. Al cobre, a la plata y al oro les llamaron metales de acuñar; al litio, sodio y potasio se les conocía como metales alcalinos; al cloro, bromo y yodo se les llamó halógenos. El nombre de los elementos expresa la propiedad física o química más característica del mismo, tal como un olor (bromo; fetidez), un color (cloro; del griego chloros, verde amarillento), o su reactividad química (argón; inerte); o el compuesto del cual fue obtenido (potasio; de la potasa). Algunos nombres de elementos honran a algún personaje real o mitológico (einstenio, en honor a Albert Einstein; o prometio, en honor a Prometeo); a algún lugar (californio, en honor a california) o a un cuerpo celeste (uranio, en honor al planeta Urano). Los químicos también observaron diferencias entre grupos de elementos y elementos entre sí, por lo cual se propusieron a organizarlos en un sistema que mostrara las semejanzas y también reconociera las diferencias. Era lógico utilizar la masa atómica como la base para estos primeros intentos. En la tabla periódica moderna, los elementos se organizan por el número atómico (indica el número de electrones que tiene un átomo). Si los elementos se ubican en la tabla de acuerdo con su número atómico, entonces también están ordenados según el número de electrones que tienen. La alineación empieza con el hidrógeno, que tiene un electrón, después sigue el helio en la primera fila, porque tiene dos electrones. El litio tiene tres electrones y comienza un nuevo periodo en el extremo izquierdo de la tabla y se convierte en el primer elemento de un grupo. Un grupo también conocido como familia, consta de los elementos de una columna. Los grupos se enumeran de izquierda a derecha. 50 El número de electrones de valencia cambia de uno a ocho cuando se recorre un periodo de izquierda a derecha, cuando se llega al grupo 18, el patrón se repite. Para los elementos del grupo principal, el número del grupo se relaciona con el número de electrones de valencia. Los grupos 1,2, 13, 14, 15, 16, 17 y 18. Para los elementos de los grupos 1 y 2, el número de grupo es igual al número de electrones de valencia. Debido a que los elementos que conforman un grupo tienen el mismo número de electrones de valencia, sus propiedades son similares. El sodio está en el grupo 1 porque tiene un electrón de valencia. Como los otros elementos de este grupo también tienen un electrón de valencia, tienen propiedades químicas similares. En toda la tabla periódica, los elementos de un mismo grupo tienen propiedades químicas semejantes porque poseen el mismo número de electrones de valencia. En la tabla hay cuatro grupos con nombres comunes: 1. Los metales alcalinos del grupo 1. 2. Los metales alcalinotérreos del grupo 2. 3. Los halógenos del grupo 17, y los 4. Gases nobles del grupo 18. En griego, la palabra halógeno, significa “el que forma sal”, porque los compuestos que forman con los metales son como la sal. A los elementos del grupo 18 se les conoce como gases nobles porque son mucho menos reactivos que la mayoría de los demás elementos. Como la tabla periódica relaciona números de grupo y de periodo con los electrones de valencia, ayuda a predecir la estructura atómica y, por lo tanto, las propiedades químicas. Por ejemplo, el oxígeno está en el grupo 16, en el periodo 2, y tiene seis electrones de valencia (los mismos que el segundo dígito 51 del número del grupo); estos electrones están en el segundo nivel de energía (porque el oxígeno está en el segundo periodo). El oxígeno tiene el mismo número de electrones que los demás elementos del grupo 16, por lo cual tiene propiedades químicas similares. Los estados físicos y el tipo de elementos (sintético o natural), si es metal, no metal o metaloide, es otra información práctica que se puede obtener a partir de la tabla periódica. (Figura 18). Figura 18. Tabla periódica de los elementos químicos. La mayoría de los elementos son sólidos, ya que sólo dos son líquidos y, excepto el hidrógeno, los elementos gaseosos se localizan en la esquina superior derecha de la tabla. Algunos elementos no se encuentran en la naturaleza, sino que se producen artificialmente en aceleradores de partículas. Los elementos sintéticos, producidos por medio de reacciones nucleares, se señalan en la tabla periódica, entre ellos está el tecnecio y todos los elementos después del uranio. Clasificación de los elementos. Los códigos de color de los elementos de la tabla periódica los identifican como: 52 1. Metales (azul) 2. No metales (amarillo) y, 3. Metaloides (verde) La mayor parte de los elementos son metales, éstos ocupan todo el lado izquierdo y el centro de la tabla periódica. Los no metales se encuentran en la esquina superior derecha y los metaloides se localizan entre los límites del sitio de los metales y no metales. Cada uno de estos tipos de elementos tiene propiedades físicas y químicas características, de tal forma que si se sabe que un elemento es un metal, no metal o metaloide, Se puede predecir su comportamiento. Metales. Los metales están casi en todas partes. Constituyen muchas de las cosas que se usan todos los días: automóviles, bicicletas, joyas, monedas, alambres eléctricos, aparatos domésticos y computadoras. Por su resistencia y durabilidad, se utilizan en las construcciones y en los puentes, y también para reemplazar huesos. Los metales son elementos que: Tienen brillo Conducen calor y la electricidad Comúnmente se doblan sin romperse, con excepción del estaño, plomo y bismuto. Tienen uno, dos o tres electrones de valencia. Todos los metales con excepción del mercurio, son sólidos a temperatura ambiente. La mayoría posee puntos de fusión muy altos. La tabla periódica muestra que la mayoría de los metales (código azul) no son elementos del grupo principal. Una gran parte se localiza en los grupos 3 a 12 que son llamados elementos de transición, muchos de estos son comunes, como el cromo, hierro, níquel, cobre, zinc, plata y oro. Otros son menos 53 comunes, pero importantes como el titanio, manganeso, platino y uranio. Algunos elementos de transición del periodo 7 son sintéticos y radiactivos. En tanto que la química de los metales del grupo principal es bastante predecible, lo es menos la de los elementos de transición. La dificultad para predecir las propiedades y el comportamiento de los metales de transición se debe a que la estructura atómica de estos elementos es más complicada. No metales. Aunque lo mayoría de los elementos de la tabla periódica son metales, en la naturaleza abundan más los no metales. El oxígeno y el nitrógeno son no metales que constituyen 99% de la atmósfera en la Tierra. El carbono, otro no metal se encuentra en más compuestos que todos los otros elementos combinados. La mayor parte de los no metales: No conducen electricidad. Conducen escasamente el calor. Son quebradizos en estado sólido. Son de varios colores no lustrosos. Muchos son gases a temperatura ambiente. Sus puntos de fusión tienden a ser más bajos que los de los metales, con excepción del carbono. Tienen cinco, seis, siete u ocho electrones de valencia. Los electrones de valencia están fuertemente unidos. Metaloides. Tienen algunas de las propiedades físicas y químicas de los metales y otras de los no metales. Los metaloides se ubican en la tabla periódica a lo largo del límite entre los metales y los no metales. El silicio es tal vez el metaloide mejor conocido. Algunos metaloides como el silicio, germanio y el arsénico son 54 semiconductores (es un elemento que no conduce la electricidad tan bien como un metal, pero lo hace algo mejor que un no metal). Estructura atómica de los metales, metaloides y no metales. La diferencia entre las propiedades de los tres tipos de elementos se debe a las distintas maneras en que los electrones se distribuyen en los átomos. El número y la distribución de los electrones de valencia y la fuerza en que se sostienen en un átomo son factores importantes que determinan el comportamiento de un elemento. En general, los electrones de valencia de un metal se atraen con menos fuerza por el núcleo positivo, se mueven con libertad en el metal sólido y se sueltan con facilidad. Esta libertad de movimiento es lo que les confiere a los metales la capacidad de conducir electricidad. Por otra parte, los electrones de valencia de los átomos de los no metales y metaloides están sostenidos con más fuerza y no se sueltan con facilidad. Cuando los metales experimentan reacciones químicas, tienden a perder los electrones de valencia, mientras que los no metales tienden a compartir electrones o ganar los de otros átomos. 55 2.1.2 Variación de las propiedades periódicas de los elementos. La mayoría de las propiedades de los elementos varían de manera regular en ciertas direcciones en la tabla periódica. Estas variaciones se explican en función de la variación de la estructura electrónica de los átomos. Se consideran a continuación, la variación de las siguientes propiedades: a. Radio atómico b. Energía de ionización c. Afinidad electrónica d. Electronegatividad a. Radio atómico. Existen algunas consideraciones importantes al hablar del tamaño de los átomos, la primera es que estos son extremadamente pequeños y la segunda es que su tamaño es difícil de definir. De acuerdo al modelo de la mecánica cuántica del átomo, los electrones se encuentran distribuidos en orbitales de diferente energía y estos no tienen un tamaño definido, por lo tanto el tamaño de un átomo no puede ser determinado con precisión. Los orbitales atómicos representan una probabilidad de encontrar a los electrones en un átomo y no tienen, por tanto, una frontera definida. Cuando los átomos se unen para formar moléculas diatómicas como Cl 2 , O 2 , N 2 , etc. es posible medir con toda precisión la distancia entre los núcleos de los dos átomos enlazados, de esta manera se puede definir: El radio atómico es la mitad de la distancia internuclear entre dos átomos entrelazados. 56 Por ejemplo, la distancia internuclear en la molécula de Cl 2 es de 200pm (picometros, 1pm=1E-12 m); al dividir entre dos esta distancia se obtiene el radio atómico del cloro que es de 100pm. En el caso del diamante, la distancia internuclear entre dos átomos de carbono es de 154pm, por lo que el radio atómico del carbono es de 77pm. La tendencia periódica del radio atómico de los elementos químicos es que aumenta al incrementarse el número atómico en un grupo de la tabla periódica y aumenta al disminuir el número atómico en un periodo, esta tendencia se observa claramente en la figura 19. Tabla 19. Tendencia del radio atómico Al aumentar el número atómico en un grupo de la tabla periódica se va cambiando de periodo, por lo que los electrones cada vez en un nivel de energía más alejado del núcleo; el resultado de esto es que el radio atómico aumenta. 57 En un periodo al disminuir el número atómico, disminuye el número de protones en el núcleo, por lo que también disminuye la atracción electrostática de éstos hacia los electrones, lo que ocasiona que el tamaño del átomo aumente. b. Energía de Ionización. Cuando un átomo pierde por completo uno de sus electrones se dice que se ioniza. En este proceso se dice que se ioniza. En este proceso se forma un catión, por ejemplo el hidrógeno forma el ión H1+. Para que este proceso se lleve a cabo es necesario suministrarle energía al átomo por medio de calor, por tanto el proceso de ionización es endotérmico. De esta manera se puede definir: La energía de ionización es la energía necesaria para arrancar por completo un electrón a un átomo aislado en fase gaseosa. Esta energía de ionización corresponde a la diferencia de energía que existe entre el nivel donde se encuentra el último electrón y un nivel con n igual a infinito, que correspondería a la eliminación total del electrón. En un átomo polielectrónico pueden separase de él varios electrones, las subsecuentes energías involucradas en estos procesos son la segunda, tercera, cuarta, etc, energías de ionización. Las unidades para todas estas energías de ionización son electrón-volts (eV) o joules (J). Pero en la mayoría de las tablas aparecen reportadas en J/mol, esto se debe a que se está reportando la energía de ionización, no la de un solo átomo aislado, sino la de un mol de átomos. La tendencia periódica de la energía de ionización es que en un periodo se incrementa al aumentar el número atómico y en un grupo aumenta al disminuir el número atómico. (Figura 20). 58 Esto se debe a que en un periodo al aumentar el número atómico aumenta también la atracción electrostática del núcleo hacia el último electrón, por lo que se necesita de más energía para arrancarlo completamente del átomo. Figura 20. Tendencia de energía de ionización Esto se debe a que en un periodo al aumentar el número atómico aumenta también la atracción electrostática del núcleo hacia el último electrón, por lo que se necesita de más energía para arrancarlo completamente del átomo. En el caso de un grupo, al ir disminuyendo el número atómico disminuye también la distancia entre el núcleo y el último electrón, por lo que al estar más cerca el electrón del núcleo es atraído con mayor fuerza hacia éste, lo que ocasiona que se requiera más energía para arrancarlo del átomo. c. Afinidad electrónica. Un átomo neutro puede incorporar a su estructura un electrón y convertirse en un anón; por ejemplo, el átomo de flúor forma el anión fluoruro, Al llevarse a cabo este proceso libera energía por medio de calor, es un proceso exotérmico. Por lo que se define así: La afinidad electrónica es la energía liberada en la formación de un anión a partir de un átomo neutro y aislado en estado gaseoso. 59 A diferencia de la energía de ionización, la afinidad electrónica es difícil de medir en forma experimental, pero muestra un comportamiento periódico similar Aumenta al de la energía de ionización. (Figura 21). Figura 21. Tendencia de afinidad electrónica La afinidad electrónica aumenta en un periodo al aumentar el número atómico y aumenta en un grupo al disminuir el número atómico. En un periodo, al aumentar el número atómico se incrementa el número de protones en el núcleo, lo cual origina un aumento progresivo de la atracción del núcleo hacia el electrón exterior que se incorpora al átomo. En un grupo, conforme disminuye el número atómico disminuye la distancia entre el núcleo y el electrón que se incorpora al átomo, por lo que aumenta la atracción del núcleo atómico hacia este y por tanto se incorpora con más facilidad. d. Electronegatividad. La afinidad electrónica y la energía de ionización son propiedades que se refieren a átomos aislados. Existe una propiedad creada por los químicos que explica la capacidad de los átomos de atraer electrones hacia sí cuando éstos están enlazados. Dicha propiedad es la electronegatividad. 60 La electronegatividad es la capacidad que tiene un átomo de atraer electrones hacia él en un enlace químico. La electronegatividad es un concepto que sólo tiene sentido cuando se habla de átomos enlazados. Esta propiedad aumenta en un periodo al aumentar el número atómico y aumenta en un grupo al disminuir el número atómico. (Figura Aumenta 22). Aumenta Figura 22. Tendencia de la electronegatividad. La electronegatividad es un número adimensional y se representa por el símbolo χ. Existen varias escalas de electronegatividad siendo la más usada la escala de creada por Linus Pauling. 61 2.1.3 Usos e impacto económico y ambiental de los elementos. El medio ambiente terrestre está compuesto por cuatro regiones. La litosfera, formada por la corteza terrestre y montañosa del planeta; la atmósfera formada por las capas de gases que rodean el planeta; la hidrosfera, que incluye al agua de ríos, mares, lagunas y depósitos subterráneos, y la biosfera, que es la región en donde habitan los vegetales y animales del planeta. A través de siglos el hombre ha obtenido del medio ambiente materiales útiles, que son los recursos naturales. Actualmente se cuenta con la tecnología que permite, con cierta facilidad, localizar y extraer dichos recursos. Se cree que los elementos químicos son resultado de la síntesis por procesos de fusión a muy altas temperaturas (en el orden de los 100 000 000ºC y superiores). La fusión de las partículas nucleares simples (protones y neutrones) lleva primero a núcleos atómicos como el helio y luego a los núcleos más pesados y complejos de los elementos ligeros (litio, boro, berilio y así sucesivamente). Los átomos de helio bombardean a los átomos de elementos ligeros y producen neutrones. Los neutrones son capturados por los núcleos de los elementos y producen otros más pesados. Estos dos procesos -fusión de protones y captura de neutrones- son los procesos principales con que se forman los elementos químicos. La abundancia de los elementos en las rocas de la Tierra, la Tierra en general, los meteoritos, el sistema solar, las galaxias o todo el universo, corresponde al promedio de las cantidades relativas de los elementos químicos presentes. Los elementos más abundantes en la superficie de la Tierra son: oxígeno, silicio, magnesio, calcio, aluminio, así como el hierro. En el universo, el hidrógeno y el helio constituyen más del 95% de la materia total. Algunas de las aplicaciones que tienen estos elementos químicos se observan en la tabla 1. 62 Elemento Químico Aplicaciones Hierro Fundición, acero, metalurgia Sodio (1) Sal, reactores nucleares Potasio Aluminio Abonos, química (2) Cobre Electricidad y mecánica, envases Electricidad y mecánica Acero inoxidable, química, materiales refractarios, Cromo metalurgia Zinc Construcción, revestimientos anticorrosión Bario (3) Química, pinturas, insonorización, vidrio Plomo Acumuladores, química Níquel Metalurgia Magnesio Industria aeronáutica, farmacia Estaño Soldadura, química Litio Industria nuclear, vidrio, cerámica Molibdeno Electricidad, materiales refractarios, pigmentos Vanadio Metalurgia, industria nuclear Uranio Combustible nuclear Volframio Industria eléctrica, metalurgia Torio Materiales refractarios, revestimiento de cátodos Cobalto Metalurgia, química Cadmio Acumuladores, pigmentos, estabilizantes Plata Fotografía, electricidad, joyería, monedas Titanio (4) Pinturas, materiales compuestos, aeronáutica Oro Joyería, monedas, electrónica Mercurio Equipos eléctricos, física Platino Convertidores catalíticos, joyería Rodio (1) (2) (3) (4) (2) Convertidores catalíticos, química En forma de sal (cloruro de sodio) Metal primario Producción de baritina (mineral de bario) Oxido de titanio Tabla 1. Usos de los elementos químicos. 63 Por otro lado, debe recordarse que los desechos de una sociedad se presentan en forma de gases, líquidos y sólidos, los que finalmente van a dar al medio ambiente. Asimismo la productividad y la creatividad han permitido a los habitantes de los países industrializados disponer de una enorme variedad de materiales, los que para producirse requieren del gasto exagerado de recursos naturales, y a la vez generan enormes cantidades de desechos. Algunos elementos que han causado impacto ambiental son: Carbono. Se le conoce como el asesino invisible. Es incoloro, inodoro y no irritante, y penetra fácilmente por vía respiratoria sin provocar signos de alarma. Es un gas muy tóxico que puede causar la muerte si se respira a niveles elevados”. Se le conoce como monóxido de carbono, uno de los enemigos públicos más peligrosos para el medio ambiente y la salud humana. El CO se produce por la combustión incompleta del carbón y otros materiales carbonados, gases y resinas petroleras como gasolina, madera, carbón, propano, petróleo, metano o queroseno. Las chimeneas, calefacciones, cocinas, calderas o vehículos en marcha son posibles fuentes de CO. “Es un gas menos denso que el aire, por lo que en una atmósfera tranquila sin corrientes de aire tiende a acumularse en las capas altas y supone uno de los contaminantes atmosféricos tóxicos más comunes”. Culpable de dolencias: mareos, cefaleas, vértigos, nauseas, obnubilación o taquicardias, entre otros efectos. Azufre. Los óxidos de azufre se forman al quemar carbón mineral, petróleo crudo, diesel y combustóleo que contienen azufre. Todos ellos combustibles que se utilizan en las industrias y algunos vehículos de carga. Al mezclarse con agua producen lluvia ácida. El bióxido de azufre es un compuesto gaseoso constituido de azufre y oxígeno, y es producido por centrales termoeléctricas y refinerías. También se genera por combustión del carbón diesel, combustóleo y 64 gasolina, fundición de vetas ricas en azufre, procesos industriales y por erupciones volcánicas. Algunos de los efectos importantes en la salud de la población son las alteraciones en la ventilación, anomalías en la defensa pulmonar, agravación de enfermedades respiratorias, cardiovasculares. Plomo. Se encuentra en la naturaleza en forma de carbonato, y de sulfato, casi todo el plomo del comercio se obtiene del sulfuro que constituye el mineral galena. Se trata de un metal color gris, pesado, blando y poco resistente a la tracción. Los compuestos solubles de plomo son venenosos, y por lo tanto, los tubos de plomo para conducir agua potable solo pueden utilizarse con seguridad si el agua es algo dura. El plomo se usa para fabricar tubos de cañerías y revestir cables eléctricos. Los vapores de plomo son los causantes de una gran enfermedad llamada saturnismo, caracterizada entre otros síntomas por anorexia, constipación pertinaz, anemia parálisis muscular, insomnio, angustia. Otras de las fuentes alternativas de energía desarrollada es la radioactiva que genera muchos desechos o contaminantes radioactivos, provenientes de las reacciones nucleares, o de yacimientos de minerales radioactivos, de las plantas donde se refinan o transforman estos minerales, y de las generadoras de electricidad que funcionan con materia radiactiva. Todavía no se conoce un método para eliminar estos desechos sin riesgo para el hombre. Otro de los impactos que genera la explotación de los recursos energéticos es la contaminación acústica, pues el ruido producido por la industria, disminuye la capacidad auditiva y puede afectar el sistema circulatorio, y aún, cuando los trabajadores de estas industrias ya están acostumbrados al ruido por escucharlos en forma prolongada, les genera daños mentales. La minería y el procesamiento de minerales a menudo producen impactos ambientales negativos sobre el aire, suelos, aguas, cultivos, flora y fauna, y 65 salud humana. Además pueden impactar, tanto positiva como negativamente, en varios aspectos de la economía local, tales como el turismo, la radicación de nuevas poblaciones, la inflación, etc. En el pasado, las empresas no siempre fueron obligadas a remediar los impactos de estos recursos. Como resultado, mucho de los costos de limpieza han debido ser subsidiados por los contribuyentes y los ciudadanos locales. Este papel presenta los costos representativos de numerosas actividades de remediación. Con frecuencia, lo más costoso a largo plazo es el tratamiento del agua. El uso de garantías financieras o seguros ambientales puede asegurar que el que contamina, paga por la mayoría de los costos. Otra cuestión a tener en cuenta con respecto al impacto medioambiental de la obtención y consumo energéticos es la emisión de gases de efecto invernadero, como el CO 2 , que están provocando el Cambio Climático. Se trata no sólo de las emisiones producidas por la combustión durante el consumo, como por ejemplo al quemar gasolina al utilizar un coche para el transporte de personas y mercancías, sino también de la obtención de energía en centrales térmicas en las que se genera electricidad por la combustión fundamentalmente de carbón. El uso cada vez más generalizado de energías renovables sustitutivas es la mejor forma de reducir este impacto negativo. Lo anterior lleva a reflexionar que los recursos de la Tierra están disminuyendo y la contaminación crece exageradamente. 66 2.2 Compuestos inorgánicos elementos. Desde sus orígenes el hombre ha sentido la necesidad de comunicarse. Los antepasados de los actuales químicos tuvieron que darles un nombre especial y una representación escrita a toda la serie de sustancias que identificaban en su estudio de las propiedades de la materia y de los fenómenos que causan cambios en ella. Así los alquimistas inventaron nuevos términos como álcali, bórax, alcohol, etc., que eran representados por dibujos. Esta representación con algunas variantes perduró hasta 1803, cuando el químico inglés John Dalton publicó la ley de las proporciones múltiples. Dalton ideo una nueva forma de identificar las sustancias. Empleo símbolos en forma de círculos con rayas, puntos o letras en su interior. En 1928 Berzelius creo los símbolos modernos en los que una o dos letras representan el nombre en latín de los elementos: natrium (sodio), argentum (plata), aurum (oro). Conforme se descubren más elementos se les asigna nombres en otros idiomas, según el deseo del descubridor. Los compuestos se representan con la combinación de los símbolos de los elementos que los forman, los cual facilita el lenguaje de la química. En la actualidad se conocen cerca de nueve millones de compuestos orgánicos e inorgánicos, por lo que es necesario utilizar un sistema de nomenclatura para distinguirlos entre sí. Se denomina compuesto inorgánico a todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participan casi la totalidad de elementos conocidos. La nomenclatura es el conjunto sistematizado de reglas que regulan la designación de fórmulas y nombres para las sustancias químicas. 67 Los compuestos inorgánicos a pesar de que constituyen casi la totalidad de los elementos químicos conocidos, solo han sido descubiertos y sintetizados aproximadamente un millón y medio. Existen nombres comunes con los que se identifica a los compuestos, basado algunas veces en sus características físicas, químicas, organolépticas, toxicológicas o algunas de sus diferentes aplicaciones. Los nombres comunes o triviales son arbitrarios y no toman en cuenta la composición química de las sustancias, por lo que fue necesario asignarle a cada compuesto un nombre característico que lo diferenciara de los demás y que indicara su composición química. Aunque algunos nombres comunes se utilizan con frecuencia, en química se prefiere utilizar nombres sistemáticos para identificar con precisión la composición química de las sustancias. Puesto que la nomenclatura química es un tema de primordial importancia fue necesaria la fundación de un organismo internacional que se abocara a elaborar normas de nomenclatura. Con este fin, en 1921 se fundó la Unión Internacional de Química Pura y Aplicada (IUPAC, International Union of Pure and Applied Chemestry), organismo internacional que tiene a su cargo la elaboración de los métodos y reglas para nombrar a los compuestos y escribir sus fórmulas. Para poder utilizar adecuadamente la nomenclatura oficial y aplicar mejor sus reglas se requieren algunos conceptos como: estructura atómica y el número de oxidación. Número de oxidación. El estado de oxidación, también conocido como número de oxidación de un elemento, es el número de cargas que adquiere un átomo al reaccionar con otro u otros átomos por una transferencia real de electrones entre ellos para formar un compuesto. Los números de oxidación se asignan mediante el siguiente conjunto de reglas: 68 1. Cualquier elemento solo (sin combinar con otro distinto), sea molécula monoatómica o poliatómica, tiene un número de oxidación igual a cero, por ejemplo: Na0, Mg0, H 2 0, O 2 0, Cl 2 0, O 3 0, S 8 0, P 4 0. 2. Los metales tienen estado de oxidación positivos. Los del grupo I siempre tienen estado de oxidación +1 y los del grupo II, +2. 3. El número de oxidación del hidrógeno en un compuesto o en un ión generalmente es +1. A excepción de los hidruros metálicos, en los cuales el hidrógeno es el segundo de la formula y tiene un número de oxidación de -1; por ejemplo, en NaH, el H es -1. 4. El número de oxidación del oxígeno en un compuesto o en un ión es generalmente -2, con la excepción de los peróxidos, en donde es -1, porque hay un enlace entre los dos átomos de oxígeno. 5. El número de oxidación de un ión monoatómico es el mismo que la carga del ión; por ejemplo Cl-1, Mg+2. 6. La suma algebraica de los números de oxidación de todos los átomos en un compuesto debe ser igual a cero. 7. La suma algebraica de los números de oxidación de todos los átomos en ión poliatómico (iones que contienen más de un átomo) debe ser igual a la carga del ión. 8. Los halógenos (F, Cl, Br, I) tienen estado de oxidación -1 en compuestos binarios; por ejemplo: KF, NaCl Escritura de fórmulas. Para escribir la fórmula de un compuesto se anota primero el símbolo del catión y a continuación el anión o el radical que posee carga negativa; en seguida se cruzan estos números sin tomar en cuenta los signos (regla de la cruz). Ejemplo, cloruro de sodio Na+1 Cl-1 Como los números de oxidación de ambos elementos son iguales se puede simplificar, entonces la formula queda como: 69 Na Cl Nomenclatura de los óxidos. Los óxidos son compuestos binarios, es decir, formados sólo por dos elementos, uno de los cuales es oxígeno actuando con número de oxidación –2. Estos se clasifican en: a) Óxidos metálicos o básicos: Los óxidos básicos o metálicos están formados por un metal y oxígeno. El nombre se forma con la palabra “óxido” seguida de la específica del elemento que va unida al oxígeno. Cuando el número de oxidación del metal es igual al número de oxidación del oxígeno se puede simplificar, ejemplo: Ca+2 O-2 Con la regla de la cruz se tiene: Ca 2 O 2 Simplificando: CaO (óxido de calcio) Recorriendo la tabla periódica de izquierda a derecha, encontramos en primer término el grupo IA o (1) de los alcalinos, los que por tener un solo electrón por encima de la estructura de gas noble actúan con carga +1. Para obtener la fórmula química, se debe recordar que la sumatoria de los números de oxidación debe ser cero. En este caso se necesitarán dos iones del metal para 70 neutralizar la carga del oxígeno. En otras palabras la fórmula de estos óxidos será: Li 2 O, Na 2 O, K 2 O, etc., y en general, será M 2 O siempre que el metal actúe como +1. Para nombrar estos óxidos, se sigue la siguiente regla: Óxido de (nombre del metal) Si un mismo elemento aporta más de un óxido, el nombre del que contiene el metal en menor estado de oxidación termina en –oso y el de mayor estado de oxidación en –ico, ejemplo: Cu 2 O, óxido cuproso (cobre en estado de oxidación +1) CuO, óxido cúprico (cobre en estado de oxidación +2) Otra forma de nombrarlos es empleando números romanos después del nombre del compuesto para indicar el número o estado de oxidación del metal, en lugar de las terminaciones –oso e –ico; ejemplo: Cu 2 O, óxido de cobre I. CuO, óxido de cobre II. A esta nomenclatura se le denomina de Stock o sistemática. Los metales alcalinotérreos o del grupo II A (2), por poseer dos electrones en el último nivel, actúan con número de oxidación +2 por lo que la fórmula de su óxido será: MgO, CaO, BaO, etc., y en general, será MO. 71 b) Óxidos no metálicos o ácidos: Para ellos seguimos las mismas reglas de escritura, pero la nomenclatura más frecuente es la de los prefijos griegos; éstos indican el número de átomos de cada elemento y los más usados son: Prefijo Número de átomos Mono 1 Di 2 Tri 3 Tetra 4 Penta 5 Hexa 6 Hepta 7 Octa 8 Nona 9 Deca 10 La regla para nombrarlos es: (prefijo) óxido de (prefijo)(nombre del no metal) El primer prefijo indica el número de átomos de oxígeno, y cuando termina con las letras a u o, se elimina antes de la palabra óxido: así, no se dice heptaóxido, sino, heptóxido. El segundo prefijo indica el número de átomos del no metal y no se usa cuando tiene un solo átomo: así, el CO 2 se nombra dióxido de carbono y no dióxido de monocarbono. Por ejemplo: N2O Monóxido de dinitrógeno P 4 O 10 Decóxido de tetrafósforo 72 Nota: Es correcto utilizar ambas formas de nomenclatura para metales y no metales. Lo que se explicó anteriormente, es la utilizada con preferencia y no con exclusión. Así, Cu 2 O se denomina óxido de cobre (I) (más común) o monóxido de dicobre y CO se denomina monóxido de carbono (más común) u óxido de carbono (II). Anteriormente se utilizaba la llamada nomenclatura clásica que utiliza el sufijo oso cuando el elemento que tiene número de oxidación positivo actúa con su menor estado de oxidación, y el sufijo ico cuando actúa con el mayor. Volviendo a ejemplos ya citados el FeO se denomina óxido ferroso, y el Fe 2 O 3, óxido férrico, igualmente el SO 2 se denomina óxido sulfuroso y el SO 3 , óxido sulfúrico. El inconveniente de esta nomenclatura estriba en que exige el conocimiento de los estados de oxidación del elemento, puesto que sólo nos indica que es el mayor o el menor, pero no cuál es su valor. Además, no sirve para especies que presentan más de dos números de oxidación. Nomenclatura de los hidróxidos. También llamados bases inorgánicas, contienen al ion hidroxilo OH- combinado con un ión metálico (catión). Se nombran empleando la palabra “hidróxido” seguida de la específica que corresponde a la del metal. Igual que en el caso de los óxidos, en su nomenclatura también se emplean las terminaciones –oso e – ico para diferentes números de oxidación. Ejemplo: NaOH, Hidróxido de sodio. En el caso de la nomenclatura de Stock: NaOH, Hidróxido de sodio. CuOH, Hidróxido de cobre I Cu(OH) 2 , Hidróxido cúprico. Cu(OH) 2 , Hidróxido de cobre II Si simbolizamos a un catión metálico como M+n, la fórmula general será: M(OH) n . La regla para nombrar a los hidróxidos es: Hidróxido de (nombre del metal) (número de oxidación si es necesario) 73 Nomenclatura de los hidrácidos. Los hidrácidos están compuestos por hidrógeno y un elemento no metálico en estado iónico o un ión poliatómico. Para nombrarlos se aplica la palabra “ácido” y después la específica derivada del nombre del elemento, con la terminación hídrico: HCl, Ácido clorhídrico HI, Ácido iodhídrico HF, Ácido fluorhídrico H 2 S, Ácido sulfhídrico HBr, Ácido bromhídrico HCN, Ácido cianhídrico Cuando los compuestos hidrogenados derivados de elementos de los grupos VIA (16) y VIIA (17) se disuelven en agua, originan iones Hidrógeno y pasan a denominarse Hidrácidos (ácidos sin oxígeno). Para nombrarlos debemos decir así: Ácido (nombre del no metal) hídrico Nótese que no se incluyen en este grupo los derivados de no metales de los Grupos IVA (14) y VA (15). Nomenclatura de las sales binarias. En su mayor parte, estos compuestos están formados por un metal y un no metal. Se consideran derivadas de los hidrácidos. El nombre se forma al añadir a la raíz del no metal el sufijo –uro y a continuación el nombre del elemento metálico o añadiendo el sufijo –oso (para el número de oxidación menor) o –ico (para el número de oxidación mayor) al nombre del metal. NaBr, Bromuro de sodio CuCl 2 , Cloruro cúprico AgCl, Cloruro de plata Sb 2 S 3 , Sulfuro de antimonio CuCl, Cloruro cuproso CS 2 , Disulfuro de carbono 74 Nomenclatura de los oxiácidos y las sales ternarias. Oxiácidos. Los oxiácidos son compuestos inorgánicos ternarios que contienen hidrógeno, un no metal y oxígeno. Se nombra empleando la palabra “ácido” y el sufijo –oso o –ico. Según el número de oxidación del elemento diferente al hidrógeno y al oxígeno, se le asigna el prefijo hipo- o per-, para lo cual se emplea la tabla 2. Ácido Sal Prefijo Sufijo Sufijo -1 hipo- -oso -ito XO 3,4 -oso -ito 5,6 -ico -ico Número de oxidación 1,2 7,8 per- Oxoanión -2 -3 XO 2 XO 2 XO 3 -ato XO 3 XO 4 XO 4 -ato XO 4 S P Elementos F,Cl,Br,I,N Tabla 2. Nomenclatura de oxiácidos y sales ternarias. Pueden representarse por la fórmula general H x A O y donde A representa a un no metal, actuando con número de oxidación positivo (a veces, puede tratarse de un metal de transición). Existen dos nomenclaturas: a. La clásica o funcional es la misma que se utiliza en los óxidos ácidos; así, si un elemento es capaz de formar 2 oxácidos, el construido con el elemento actuando con su mayor estado de oxidación llevará el nombre del elemento seguido de la terminación ico y si está actuando con el menor llevará el nombre del elemento seguido de la terminación oso anteponiendo en ambos casos el término ácido. Los oxácidos más frecuentes con los que se trabajan se encuentran en la tabla3. 75 Grupo IV A (14) Grupo V A (15) Grupo VI A (16) H 2 CO 3 ácido carbónico HNO 2 , ácido nitroso H 2 SO 3 , ácido sulfuroso HNO 3 , ácido nítrico H 2 SO 4 , ácido sulfúrico H 3 PO 3 , ácido fosforoso H 3 PO 4 , ácido fosfórico Tabla 3. Oxácidos. En el caso del Grupo VII A (17) los oxácidos formados responden a la fórmula general H X O n donde n puede variar entre 1 y 4, y X representa al Cl, Br o I. En general: ácido (prefijo) (nombre del halógeno) (sufijo) Ejemplo: HBrO, Ácido hipobromoso HIO 3 , Ácido yódico HClO 2 , Ácido cloroso HClO 4 , Ácido perclórico b. La nomenclatura sistemática indica el número de átomos de oxígeno mediante el uso de los prefijos griegos (a excepción de mono) seguido del sufijo oxo y luego se agrega el nombre del elemento siempre terminado en ico, y su estado de oxidación en números romanos. En general: Ácido (prefijo) oxo (nombre del no metal) ico (estado de oxidación) Ejemplo: H 2 SO 3 , Ácido trioxosulfúrico (IV) H 2 SO 4 , Ácido tetraoxosulfúrico (VI) 76 Utilizando esta nomenclatura, no es necesario conocer si el elemento tiene o no diferentes estados de oxidación. Lamentablemente su uso no es lo suficientemente habitual. Sales ternarias. Las sales ternarias se forman cuando el hidrógeno de un ácido es sustituido por un metal. Se consideran así a las que se derivan o pueden considerarse derivadas de los oxoácidos. Para denominarlas se emplea la tabla 2 de la misma manera que los oxoácidos. Nomenclatura de las sales cuaternarias. Las sales cuaternarias están formadas por un catión hidrógeno, un no metal y oxígeno. Se antepone el nombre del polianión, con su respectiva terminación – ato o –ito. A continuación la palabra “ácido” que puede tener el prefijo mono-, ditri-, según el número de hidrógenos, y después el nombre del metal; de ser necesario, el sufijo –oso o –ico, según el número de oxidación con el que se trabaje. También se puede utilizar la nomenclatura stock, ejemplo: NaHCO 3 , Carbonato ácido de sodio FeHPO 4 , Fosfato ácido ferroso o (Bicarbonato de sodio) fosfato monoácido de hierro II Ca(HSO 3 ) 2 , Sulfito ácido de calcio NaHS, Sulfuro ácido de sodio (Bisulfito de calcio) NaH 2 PO 4 , Fosfato diácido de sodio (Fosfato monobásico de sodio) Nomenclatura de los anhídridos Los anhídridos están formados por un no metal y oxígeno. Generalmente, el nombre se forma con la palabra “anhídrido” y el nombre del elemento específico, terminando en –ico. Ejemplo: SO 2 , Anhídrido sulfúrico SiO 2 , Anhídrido sílicico 77 Si un mismo elemento forma más de un anhídrido, al que contiene menor cantidad relativa de oxígeno se le añade el sufijo –oso y al de mayor cantidad el sufijo –ico. De igual manera al de menor número de oxidación se le añade el sufijo –oso y al de mayor el sufijo –ico, según la regla anterior: SO 2 , Anhídrido sulfuroso SO 3 , Anhídrido sulfhídrico Si tienen más de dos anhídridos, se recurre a los prefijos hipo- y per-, esto dependerá de los ácidos que formen al reaccionar con el agua. (Tabla 4). Anhídridos + H 2 O Oxiácidos SO 2 + H 2 O Anhídrido sulfuroso + Agua H 2 SO 3 Ácido sulfuroso SO 3 + H 2 O Anhídrido sulfúrico + Agua Ácido sulfúrico Ácido fosforoso Ácido fosfórico Fosfatos y fosfatos ácidos 2HNO 2 Ácido nitroso N2O5 + H2O Anhídrido nítrico + Agua Fosfitos y fosfitos ácidos H 3 PO 4 N2O3 + H2O Anhídrido nitroso + Agua Sulfatos y bisulfatos H 3 PO 3 P2O5 + H2O Anhídrido fosfórico + Agua Sulfitos y bisulfitos H 2 SO 4 P2O3 + H2O Anhídrido fosforoso + Agua Oxiácidos + Sales Nitritos 2HNO 3 Ácido nítrico Tabla 4. Formación de oxiácidos. Nitratos 78 Nomenclatura de hidruros. Los hidruros se forman con hidrógeno y cualquier otro elemento. En los hidruros metálicos, el hidrógeno actúa con estado de oxidación -1; su nombre se forma la palabra genérica hidruro seguida del nombre del metal. En los hidruros no metálicos, el hidrógeno tiene estado de oxidación +1, y los no metales poseen estados de oxidación negativos; su nombre se forma al añadir el sufijo –uro al no metal. La fórmula general para un metal con estado de oxidación +n será MH n , denominándose igual que los óxidos metálicos sólo que sustituyendo el término óxido por hidruro: Hidruro de (nombre del metal) (número de oxidación si es necesario) Ejemplo: LiH, Hidruro de litio AuH 3 , Hidruro de oro III CaH 2 , Hidruro de calcio BH 3 , Hidruro de boro III El hidrógeno también forma compuestos con los no metales. En este caso el hidrógeno actúa con número de oxidación +1 y se denominan: (nombre del no metal) uro de hidrógeno Los elementos del grupo VIIA (17) forman con el hidrógeno sustancias de fórmula HX, donde X es F, Cl, Br o I y sus nombres serán Fluoruro de Hidrógeno, Cloruro de Hidrógeno, etc. El S por pertenecer al grupo VIA (16) formará H 2 S, cuyo nombre es Sulfuro de Hidrógeno. Los elementos N y P, que pertenecen al grupo VA (15), forman con el hidrógeno NH 3 y PH 3, que se nombran frecuentemente en forma trivial amoníaco y fosfina respectivamente. (Nótese la excepción en la forma de escritura de la fórmula ya mencionada anteriormente). 79 Nomenclatura de peróxidos. Los peróxidos están formados por un metal y un puente de oxígeno; cada oxígeno tiene un número de oxidación de -1. Por ejemplo: H 2 O 2 , Na 2 O 2 , BaO 2 , etc. El nombre se forma con la palabra “peróxido”, que sustituye a la palabra óxido, seguida del nombre del metal o, en caso de tener dos o más números de oxidación. La terminación –oso o –ico. Ejemplo: Na 2 O 2 , Peróxido de sodio H 2 O 2 , Peróxido de hidrógeno (más conocido por su nombre trivial de agua oxigenada). BaO 2 , Peróxido de bario Aniones. Los ácidos, como hemos visto, generan H+ en solución acuosa, originando simultáneamente un anión que posee tantas cargas negativas como hidrógenos se hayan cedido. Se denominan con los siguientes sufijos: a. Anión de hidrácido: (nombre del no metal) uro Por ejemplo: F- Fluoruro, S= Sulfuro. Como el ácido sulfhídrico posee más de un H, podrá perder un solo protón, originando el anión HS-, y para denominarlo hay que añadir el término hidrógeno. Este ion se denominará por lo tanto, ion hidrógeno sulfuro. b. Los oxoácidos originan aniones que sustituyen la terminación ico por ato tanto en la nomenclatura funcional como en la sistemática, y se sustituye la de oso por ito si se trabaja con la funcional. 80 Anión Nomenclatura funcional Nomenclatura sistemática NO 3 - Nitrato Trioxonitrato (V) NO 2 - Nitrito Dioxonitrato (III) ClO- Hipoclorito Oxoclorato (I) Clorito Dioxoclorato (III) ClO 2 - En resumen: Ácido Anión Sin oxígeno - hídrico - uro Con oxígeno - ico - ato - oso - ito Las celdas sombreadas no existen en la nomenclatura sistemática. Cuando los oxácidos poseen más de dos hidrógenos originan diferentes aniones hidrogenados y deben diferenciarse usando los prefijos griegos para indicar el número de hidrógenos que aún contienen. Anión H 2 PO 4 HPO 4 - -2 HSO 4 - Nomenclatura funcional Nomenclatura sistemática Dihidrógenofosfato Dihidrógenotetraoxofosfato (V) Hidrógenofosfato Hidrógenotetraoxofosfato (V) Hidrógenosulfato Hidrógenotetraoxosulfato (VI) Sales Estas sustancias se componen de un anión proveniente de un ácido y de un catión generalmente metálico. Se denominan: (nombre del anión) de (nombre del catión) Durante el curso utilizaremos frecuentemente un catión no metálico: NH 4 + denominado amonio, y sus compuestos se denominan siguiendo las mismas reglas dadas. 81 Veamos algunos ejemplos usando la nomenclatura funcional, dejando la sistemática como ejercicios. Sal Nomenclatura funcional K 2 SO 4 Sulfato de Potasio FePO 4 Fosfato Férrico NH 4 NO 3 Nitrato de amonio Al 2 (CO 3 ) 3 Carbonato de aluminio HgI 2 Ioduro mercúrico Cr(H 2 PO 4 ) 3 Dihidrógenofosfato de Nomenclatura sistemática cromo(III) NH 4 (HCO 3 ) Hidrógenocarbonato de amonio Ca(HS) 2 Hidrógenosulfuro de calcio Otros aniones utilizados frecuentemente: Anión Nomenclatura funcional MnO 4 - Permanganato CrO 4 -2 Cromato Cr 2 O 7 -2 Dicromato CN- Cianuro SCN- Sulfocianuro 82 Resumen de reacciones típicas: Figura 23. Mapa conceptual. En la tabla 5 se muestran los principales aniones y cationes 83 Cationes (+) Monovalentes H+ Hidrógeno Aniones (-) Monovalentes Radical Nombre que llevan solos o al formar ácidos. Li+ Na+ K+ Cu+ Ag+ Au+ Hg+ NH 4 + Divalentes Mg2+ Ca2+ Litio Sodio Potasio Cobre (I) Plata Oro (I) Mercurio (I) (radical) Amonio Magnesio Calcio FClBrIOHCNNO 2 NO 3 HSHSO 3 HSO 4 - Fluorhídrico (HF) Clorhídrico (HCl) Bromhídrico (HBr) Yodhídrico (HI) Hidroxilo Cianhídrico (HCN) Nitroso (HNO 2 ) Nítrico (HNO 3 ) Sulfhídrico Sulfuroso Sulfúrico Nombre que tienen cuando forman sales o compuestos Fluoruro Cloruro Bromuro Yoduro Hidróxido Cianuro Nitrito Nitrato Sulfuro ácido Sulfito ácido Sulfato ácido Sr2+ Estroncio ClO- Hipocloroso Hipoclorito Bario ClO 2 - Cloroso Clorito Zinc ClO 3 - Clórico Clorato Ba2+ Zn2+ Cd2+ Cadmio ClO 4 - Perclórico Perclorato Hg2+ Mercurio (II) H 2 PO 3 - Fosforoso Fosfito diácido Cu2+ Cobre (II) H 2 PO 4 - Fosfórico Fosfato diácido Fe2+ Hierro (II) IO 3 - Yódico Yodato Sn2+ Estaño (II) MnO 4 - Permangánico Permanganato Pb2+ Plomo (II) Divalentes Ni2+ Níquel (II) S2- Sulfhídrico Sulfuro Cromo (II) O2- Óxido Óxido CO 3 2- Carbónico (H 2 CO 3 ) Sulfuroso Carbonato Sulfito SO 4 2HPO 3 2HPO 4 2CrO 4 2Cr 2 O 7 2MnO 3 2Trivalente Sulfúrico Fosforoso Fosfórico Crómico Dicrómico Manganoso Sulfato Fosfito ácido Fosfato ácido Cromato Dicromato Manganito Cr2+ Trivalentes Al3+ Aluminio As3+ Arsénico Sb3+ Antimonio 3+ Fe Hierro (III) Cr3+ Cromo (III) 3+ Ni Níquel (III) Au3+ Oro (III) Valencia especial tetravalente catión-anión C4+ Carbono C4Carburo Si4+ Silicio Si4Siluro Pb4+ Plomo (IV) SO 3 2- PO 3 3PO 4 3BO 3 3AsO 3 3AsO 4 3- Tabla 5. Principales aniones y cationes. Fosforoso Fosfórico Bórico Arsenioso Arsénico Fosfito Fosfato Borato Arsenito Arseniato 84 UNIDAD III ENLACES QUÍMICOS. COMPETENCIA A DESARROLLAR. Comprender los diferentes tipos de enlaces, su origen e influencia en las propiedades físicas y químicas de los compuestos, atendiendo a las fuerzas que intervienen para que los elementos reaccionen y se mantegan unidos, así como a las formas que adoptan. 85 3.1 Tipos de enlace, origen y propiedades físicas y químicas. “¿A caso crees que una gota de agua que para una persona común no es más que eso, es igual que para el científico que sabe que sus elementos se mantienen unidos gracias a una fuerza que si fuera repentinamente liberada produciría un relámpago? La verdad es que aquellos que nunca se han ocupado de cuestiones científicas conocen solo una pequeña fracción de la poesía que los rodea”. En efecto, el conocimiento de la estructura interna de la materia así como de la fuerza y forma en que se unen sus partículas para mantenerla cohesionada es de gran importancia para poder explicar su comportamiento y así poder determinar sus aplicaciones y lograr su mejor aprovechamiento. Desde la época de los alquimistas medievales, quienes idearon técnicas especiales e instrumentos adecuados para investigar las propiedades fundamentales de la materia, se han realizado una serie de estudios para tratar de explicar la fuerza que mantiene unidos a los átomos y constituir todo tipo de sustancias, es decir, determinar el enlace químico. El concepto de enlace químico fue empírico durante mucho tiempo, Descartes suponía que algunos átomos tenían ganchos y otros poseían una serie de arillos, de esta manera el gancho estaba en el arillo y los dos átomos se unían. No fue sino hasta el siglo XIX que con los experimentos sobre la electrolisis del agua realizados por Nicholson y Carlisle se empezó a sospechar que el enlace químico era de naturaleza eléctrica. El mismo tipo de experimentos llevaron a Berzelius en 1812 a hablar de la atracción electrostática entre iones de carga opuesta y finalmente, en el siglo XX con el descubrimiento del electrón se comprendió que los responsables del enlace químico son justamente los electrones. De esta manera de concluyó que: 86 El enlace químico es un fenómeno esencialmente electrónico. En la actualidad este concepto es aceptado. En un átomo los electrones se mueven alrededor del núcleo, mientras que en una molécula son atraídos por varios núcleos. El enlace químico está relacionado con el desplazamiento de los electrones y de acuerdo con que tan pequeño o grande sea éste, los compuestos presentan sus propiedades. Con esta nueva idea sobre la naturaleza del enlace químico, se comprendió que para la formación de los compuestos, los átomos deben ceder o compartir electrones pero, independientemente de la forma en que lo hagan, el resultado final debe ser la unión de los átomos. Cuando un electrón se mueve entre dos o más núcleos está sujeto a varios tipos de interacciones, por ejemplo, es atraído por los núcleos de carga positiva y repelido por los demás electrones. Para que haya un enlace químico el balance final de todas las interacciones que se producen entre los núcleos y los electrones de los átomos involucrados debe ser atractivo. De ahí que: Un enlace químico es la interacción atractiva total entre dos o más átomos. El enlace químico es de naturaleza eléctrica. La fuerza que une a los átomos es electrostática. Los modelos de enlace son: 1. Modelo iónico. 2. Modelo metálico, y 3. Modelo covalente En seguida se describe las generalidades de cada uno de ellos 87 3.1.1 Enlaces iónicos. Cuando se combina un elemento metálico con un no metal se obtiene un sólido cristalino que al igual que los metales puros presenta altos puntos de fusión y además forma una red cristalina semejante a la red metálica. Estos compuestos conducen la corriente eléctrica cuando se encuentran en solución acuosa o están fundidos; al someterse al proceso electrolítico se demuestra que se disocian en iones, por lo que se utiliza el modelo de enlace iónico para explicar sus propiedades. Se ha visto que los metales y los no metales forman compuestos iónicos. ¿Por qué el sodio (Na) y el cloro (Cl) pueden formar cloruro de sodio (NaCl)? Para que dos átomos se unan mediante enlace iónico se deben cumplir 2 requisitos: 1. La energía de ionización para formar el ión positivo (catión) debe ser baja. 2. La afinidad electrónica para formar el ión negativo (anión) debe estar favorecida (el átomo debe liberar energía). Lo anterior significa que los átomos de un elemento deben ser capaces de perder 1, 2 o hasta 3 electrones de valencia sin un gran costo energético y, los átomos del otro elemento deben ser capaces de aceptar 1, 2 o hasta 3 electrones de valencia sin un gran costo energético. De todos los elementos de la tabla los únicos que cumplen estos requisitos son los metales más activos (familia IA, IIA, parte de la IIIA y algunos metales de transición) y los no metales más activos (familias VIIA, VIA y el nitrógeno). Únicamente en estos casos el proceso de formar el catión a partir del metal (energía de ionización) y el anión a partir del no metal (afinidad electrónica) están favorecidos. 88 El sodio (Na), es un metal muy activo de baja energía de ionización y el cloro (Cl), un no metal muy activo de gran afinidad electrónica ambos pueden formar los iones correspondientes mediante la transferencia de un electrón de valencia y al atraerse electrostáticamente originan el enlace iónico del compuesto, NaCl. (Figura 24). Figura 24. Enlace iónico. El sodio pierde un electrón por su baja energía de ionización y el cloro gana un electrón. El enlace iónico se forma entre dos átomos siendo uno de ellos elevadamente electropositivo (muy metálico) y el otro elevadamente electronegativo (muy no metálico) de tal forma que hay una trasferencia electrónica del átomo metálico hacia el no metálico generándose iones que se acomodan en un arreglo cristalino. La diferencia en propiedades de un material por el enlace químico de los átomos, depende de la estructura del cristal. Las estructuras cristalinas conocidas se agrupan en siete sistemas: 89 1. Cúbico 2. Tetragonal 3. Hexagonal 5. Otorrómbico 6. Monoclínico 7. Triclínico 4. Romboédrico La disposición de cada átomo o ión en el sistema se basa en la celda unitaria, la estructura más pequeña que, repetida a distancia considerable en 3 dimensiones, produce el cristal. Hay 14 celdas unitarias o redes de Bravais. El sistema cubico tiene tres tipos de celdas unitarias (Tabla 6). 1. La simple, con los 8 vértices ocupados. 2. Cubica centrada en las caras (fcc) con los vértices y el centro de cada cara del cubo ocupados, y 3. Cubica centrada en el cuerpo (bcc), se ocupan los vértices y el centro del cubo. Celda unitaria Empaquetamiento Cubica Centrada en las Empaquetamiento compacto cubico. caras (fcc) (26% hueco). Familias: 8 A, 3 A, 1B. Rh, Ir, Ni, Cu, Pb (16 metales) Haxagonal (hcp) (26% hueco) Empaquetamiento compacto hexagonal Familias: 2 A, 2B, 3B, 4B, 7B. Ru, Os, Zn (32 metales) Cubica centrada en el cuerpo (bcc) (32% hueco) Tabla 6. Sistema cubico Familias: 1 A, 5B, 6B Na, Ba, Fe (17 metales) Propiedad Muy maleable Mayor densidad y punto de fusión Menos tendencia quebradizo. maleable, a ser Mayor densidad y punto de fusión Muy maleable Menor densidad y punto de fusión 90 La estructura de un cristal metálico o iónico resulta de ordenar los átomos o iones como canicas en el mínimo espacio. El metal es el más sencillo porque todos los átomos son iguales y se acomodan mejor en una disposición hexagonal compacta, cubica compacta (fcc) o cubica centrada en el cuerpo (bcc). El polonio es el único elemento que cristaliza en una celda cubica simple, los demás metales pueden tener una, dos o las tres celdas (presentan alotropía). Finalmente, se mencionan algunas características de los compuestos iónicos: 1. Son sólidos cristalinos. 2. Se forman por la combinación de un metal con un no metal. 3. conducen la corriente eléctrica en solución acuosa y fundidos. 4. Son sólidos duros y quebradizos. 5. Generalmente son sales con puntos de fusión y ebullición muy grandes. 6. La mayoría de las sales iónicas son solubles en disolventes polares como el agua. 7. En soluciones acuosas conducen la corriente eléctrica 8. Su densidad es mayor que la del agua. Los enlaces iónicos usualmente son fuertes y se distribuyen igualmente en el espacio que rodea al ión. Por eso se dice que son omnidireccionales (todas las direcciones). El punto de fusión alto de los sólidos iónicos se debe a su estructura cristalina. Si se recuerda el caso del NaCl se sabe que cada catión Na+ rodea y es rodeado por 6 de Cl-. Así para pasar del estado sólido al líquido no basta romper un enlace, sino deben romperse 6. Este costo extra de energía se traduce en una temperatura de fusión alta. 91 3.1.2 Enlaces covalentes. Se sabe que los metales son los únicos que conducen la corriente eléctrica en estado sólido; los compuestos iónicos no conducen corriente eléctrica en estado sólido, pero si lo hacen en solución acuosa o fundidos. En el caso de los compuestos covalentes, éstos no conducen la corriente eléctrica en ninguna forma, por lo que es necesario utilizar otro modelo de enlace para explicar las propiedades del enlace covalente. En el modelo de enlace covalente los electrones se comparten entre dos átomos de manera equitativa, quedando éstos en medio de los dos núcleos de los átomos. Para entender la naturaleza de este modelo, se describirá como ocurre el proceso de formación del enlace, se usaran los conceptos de mecánica cuántica. Imagínese que se acercan dos átomos de hidrogeno desde una distancia infinita, hasta enlazarse, mientras permanezcan bastante distantes su energía de interacción es casi nula. Conforme los átomos se acercan, los orbitales 1s de cada átomo empiezan a traslaparse (interpenetrarse uno con otro) y los electrones comienzan a ser atraídos por el núcleo del otro átomo, con lo que aumenta el traslape de orbitales. Finalmente, los dos orbitales atómicos 1s se mezclan para dar una zona con alta densidad electrónica, en la que los electrones de ambos átomos se encuentran fuertemente atraídos por ambos núcleos, así los átomos de hidrógeno se han enlazado para dar las moléculas de hidrogeno. La descripción anterior, resultado de la mecánica cuántica, muestra que en el modelo de enlace covalente, éste se da por un aumento de la densidad electrónica entre los núcleos y no únicamente por compartir un par de electrones (Figura 25). 92 A la región de alta densidad electrónica en la que existe una alta probabilidad de encontrar a los electrones que participan en el enlace químico se llama “orbital molecular”. Figura 25. Enlace covalente Los dos átomos de hidrógeno se encuentran enlazados uno con respecto al otro a una distancia de equilibrio entre ellos, a la cual se le conoce como longitud de enlace. Por otro lado, si se quisiera realizar el proceso contrario, es decir, separar los átomos de hidrógeno sería necesario gastar energía. A la energía necesaria para separar completamente a los átomos de hidrogeno se le llama energía de enlace. Tanto la energía como la longitud de enlace son parámetros específicos del enlace químico que dependen del tipo de átomos que se enlazan y del número de enlaces formados. El modelo del enlace covalente es la compartición de pares electrónicos entre átomos muy electronegativos quedando el par de enlace entre ambos. 93 Enlace covalente no polar o puro. Se forma entre dos átomos que comparten uno o varios pares electrónicos. La característica de dichos átomos es que son de igual electronegatividad, por lo tanto cada par que comparten queda a la misma distancia de los dos. Ejemplo: H* •H El enlace covalente no polar es característico de moléculas formadas de átomos iguales y que por lo mismo la diferencia de electronegatividad es cero. Enlace covalente polar. Se genera entre dos átomos que comparten uno o varios pares de electrónicos, siendo uno de ellos el más electronegativo. Los pares electrónicos están más cerca del elemento más electronegativo y se forma un dipolo. Ejemplo: H* •F Electronegatividad y enlace químico. Se sabe que la electronegatividad es la capacidad que tiene un átomo para atraer electrones hacía él en un enlace químico. Esta propiedad es muy útil en el estudio del enlace químico, ya que si se calcula la diferencia de electronegatividad entre dos átomos se puede predecir el modelo de enlace químico más adecuado para él. De esta manera, se consideran los siguientes modelos de enlace en términos de la diferencia de electronegatividad. Electronegatividad ≥ 1.7 Iónico Electronegatividad < 1.7 Covalente polar Electronegatividad = 0.0 Covalente puro o covalente no polar En las moléculas diatómicas formadas por el mismo tipo de átomos, como la molécula de hidrógeno H 2 , la diferencia de electronegatvidad es cero, por lo que se dice que el enlace es covalente puro. Esto significa que cada átomo 94 atrae con la misma fuerza a los electrones del enlace, por lo que la densidad electrónica es la misma en ambos extremos del enlace. Sin embargo, cuando los átomos son diferentes como en la molécula del cloruro de hidrógeno (HCl), uno de los átomos, en este caso el cloro que es el más electronegativo, atrae con más fuerza hacia él a los electrones del enlace. Enlace covalente coordinado. Se genera cuando dos átomos comparten un par electrónico pero uno aporta dicho par y el otro lo acepta. Ejemplo: H 2 SO 4 . Que uno de los elementos aporte el par no lo hace diferente de los otros enlaces covalentes y no modifica las propiedades del compuesto. Propiedades del modelo covalente. a. Compuestos covalentes polares. Son solubles en disolventes polares como el agua. En estado sólido su punto de fusión es mayor que los no polares, pero mucho menor que los iónicos. En estado líquido su punto de ebullición es menor que el del agua (100 °C a nivel del mar), pero mayor al de los compuestos polares. No conducen el calor y la electricidad. En disolución acuosa la conducen poco. En estado líquido su densidad normalmente es menor que la del agua. b. Compuestos Covalentes no polares. Son insolubles en agua. En estado líquido normalmente tienen muy bajos puntos de ebullición (con excepción de algunos líquidos como los aceites). En estado sólido tienen muy bajos puntos de fusión. No conducen la corriente eléctrica. 95 Es muy común decir que los compuestos iónicos tienen altas temperaturas de fusión, por ejemplo el cloruro de sodio con 800°C, pero no son los únicos ya que los metales poseen también elevados puntos de fusión, como el hierro que tiene una temperatura de fusión de 1535 °C. Era de esperase entonces que el punto de fusión de un compuesto covalente fuera de una temperatura más baja; sin embargo el diamante, constituido por átomos de carbono en forma de una red, tiene una temperatura de fusión de 3500 °C, mucho mayor que la del hierro y el cloruro de sodio. El punto de fusión y ebullición de los compuestos covalentes depende, en la mayoría de los casos, de la fuerza de atracción que une a las moléculas. Estas fuerzas de atracción se llaman interacciones intermoleculares. Estas interacciones son dos principalmente: 1. El puente d hidrógeno. 2. Las fuerzas de cohesión de moléculas con enlace covalente. Las moléculas polares cohesionan por la atracción entre dipolos permanentes. Las no polares, como los gases nobles (monoatómicos), cohesionan exclusivamente por fuerzas de van der Waals (dipolo inducido). Las moléculas diatómicas y las poliatómicas (no polares como CH 4 , BF 3 , SF 6 ) cohesionan por fuerzas de van der Waals, debido a que estas fuerzas son débiles las moléculas unidas mediante enlace covalente no polar tienen puntos de fusión y ebullición muy bajos y se evaporan fácilmente. Estructura de las moléculas La característica fundamental del enlace covalente es su dirección: se manifiesta principalmente a lo largo del eje que une a los núcleos que comparten el par electrónico. 96 Esta característica conduce a que los átomos de un compuesto covalente adopten en el espacio un arreglo definido. La geometría molecular de las moléculas covalentes se explica mediante la Teoría de Repulsión de Pares Electrónicos de la Capa de Valencia (RPECV). Este modelo surgió de las ideas de Nevil V. Sidgwick y H.E.Powell en 1940 desarrolladas por Ronald J. Guillespie y Nyholm en 1957. La base de este modelo es la distribución espacial de los pares electrónicos una vez que ya se ha formado el enlace. Estos pares electrónicos debido a su repulsión natural por tratarse de cargas iguales, se acomodan lo más lejos posible uno de otro en la molécula. Una manera más sencilla de visualizar la repulsión de pares electrónicos y predecir la forma de las moléculas es imaginar los pares electrónicos en sus orbitales como globos inflados al mismo tamaño en están unidos en el núcleo (Figura 26). Figura 26. Estructura de las moléculas. 97 En todos los casos se observa que todos los pares electrónicos del átomo central lo unen con algún otro átomo de la molécula. La forma de la molécula influye en las propiedades físicas y químicas de las sustancias. El modelo de RPCEV es muy útil para moléculas con enlaces covalentes. Las propiedades de los compuestos covalentes dependen además de si la molécula es polar o no. Limitaciones del modelo RPECV. Las más importantes son: 1. No debe aplicarse a moléculas y cristales cuyo enlace es predominantemente iónico. 2. Si los pares electrónicos se deslocalizan en varios átomos el modelo puede no ser útil. En estos casos conviene ignorar los pares deslocalizados y centrar la atención en los localizados. Por ejemplo, la forma plana hexagonal del benceno se predice con base en el arreglo de los tres pares electrónicos fijos (enlaces sigma) sin considerar el par deslocalizado (enlace pi) de cada carbono. 3. Si los átomos enlazados son muy grandes, en comparación con el central, deben hacerse consideraciones por su gran tamaño (efecto estérico) 4. El “Kernel” se supuso esférico, cualquier deformación que sufra debe considerarse. 5. Se aplica a moléculas libres y aisladas, como un gas o un cristal unido por interacciones lo suficientemente débiles para ignorarse. Aunque los cálculos teóricos de la mecánica cuántica muestran que, en general, los electrones no se localizan en pares discretos como supone el modelo, las distribuciones de densidad electrónica muestran concentraciones locales de densidad que tienen el mismo tamaño y posición predicho por el RPECV. Esto 98 significa que el modelo es el más simple y cualitativamente da los mismos resultados que otros modelos más complejos y sofisticados. La teoría de RPECV explica la naturaleza polar de la molécula de agua. La repulsión de los pares electrónicos de valencia del oxígeno le confiere a la molécula del agua una estructura tetraédrica. 99 3.1.3 Enlace metálico. Las propiedades de los metales no se explican suponiéndolos como esferas de cargas opuestas. Los compuestos iónicos en estado sólido no conducen la electricidad y son coloridos por su parte los metales en estado sólido si conducen la electricidad y la mayoría son grises. El modelo que explica las propiedades de los metales es diferente del iónico y covalente. Este modelo explica que, aunque el hierro de la construcción está formado por el mismo tipo de átomos que el de la sangre, las propiedades derivadas de su modo de enlace los hace muy diferentes. Por ejemplo, los átomos del hierro de la construcción son eléctricamente neutros, son ferromagnéticos (son atraídos por un imán), y exhiben color gris metálico. En el caso de la sangre estos mismos átomos tienen carga positiva (+2), no son ferromagnéticos y son los responsables del color característico de la sangre. Los metales presentan ciertas propiedades características como son: alta conductividad eléctrica y térmica, baja energía de ionización, brillo metálico y maleabilidad; estas propiedades son el resultado de su estructura interna, ya que tienden a perder electrones. La estructura d un metal puede ser representada por un conjunto de esferas que simbolizan a sus átomos. Si se acomodan y se van apilando las esferas, unas sobre otras, se observaran que se colocan en forma compacta. (Figura 27). Este tipo de estructura conduce a la formación de una red infinita llamada red metálica, que para romperse necesita de mucha energía; debido a ello los metales tienen altas temperaturas de fusión. Para explicar la conductividad eléctrica y térmica de los metales se utiliza el modelo propuesto por Drude, el modelo del gas de electrones el cual considera 100 que los electrones más alejados del núcleo se mueven libremente por toda la red metálica. Como ya se dijo este fenómeno se llama deslocalización de electrones. Figura 27. Modelo metálico. De esta manera, al estar los electrones en libertad pueden moverse con rapidez a través del metal, lo que produce la conductividad eléctrica. De manera similar, cuando se calienta un metal se incrementa rápidamente la energía cinética y con ello el movimiento de los electrones, lo que explica su conductividad térmica. Una de las propiedades que tienen los metales es el ser maleables, lo cual se debe a que las distancias que existen entre los átomos metálicos son grandes; como consecuencia, al martillar un metal las capas de átomos se deslizan fácilmente permitiendo la deformación del material. La meleabilidad de los metales se debe a que pueden deformarse fácilmente debido al reacomodo de sus átomos. El modelo de Drude para el enlace metálico permite explicar de manera sencilla muchas de sus propiedades y puede resumirse de la siguiente manera: 101 En el enlace metálico los electrones más alejados del núcleo se mueven libremente por toda la estructura del metal. En la actualidad, con los avances de la mecánica cuántica se han propuesto nuevos modelos para el enlace metálico, entre los que destaca la teoría de bandas. Esta teoría considera que los n orbitales de todos los átomos del metal se combinan entre sí produciendo bandas de conductividad. Resumiendo: El enlace metálico se considera como la deslocalización de electrones de valencia en un cristal metálico. Propiedades de los metales Conducen calor y electricidad Sólidos con puntos de fusión elevados (excepto el mercurio, que a temperatura ambiente es un ,metal líquido) Son dúctiles (se pueden transformar en hilos delgados ) Son maleables (se pueden laminar fácilmente). Son más maleables los de estructura cúbica y menos los hexagonales. Presentan brillo. Son grises (excepto oro, cobre y plata) Se mezclan entre sí para formar metales impuros denominados “aleaciones”. Los metales brillan porque sus electrones deslocalizados en la banda de conducción funcionan como pantalla que absorbe la luz que llega a la superficie y la remiten. Al absorber la luz saltan y ocupan la mayoría de los niveles de energía disponibles dentro de la misma banda. Cuando regresan a niveles de menor energía emiten en conjunto radiaciones electromagnéticas que caen en el espectro visible. Esta luz emitida no es un solo tipo de radiación como ocurre con átomos aislados, incluso de los mismos metales, que en forma de gas al ser excitados emiten espectros de líneas características. 102 La maleabilidad y ductibilidad se explican con el modelo de electrones deslocalizados alrededor de los “kernels” y la estructura del cristal. Los “kernels” de un metal son estables porque los electrones deslocalizados balancean la repulsión entre “kernels” y funcionan como pegamento. Cuando se aplica sobre el metal una fuerza que tiende a deformarlo, los “kernels” resbalan, una capa sobre otra, sin juntarse porque los electrones deslocalizados se acomodan fácilmente entre ellos. Este proceso se puede repetir las veces que sea necesarias hasta que el metal toma la forma deseada. Figura 28. Enlace metálico (maleabilidad) Los metales con estructura cubica (bcc, fcc) son más maleables que los hexagonales, porque un arreglo de cubo presenta más planos para que “resbalen” las capas que un arreglo hexagonal. 103 UNIDAD IV ESTEQUIOMETRÍA. COMPETENCIA A DESARROLLAR. Aplicar los conceptos de la estequiometria para resolver problemas de reacciones químicas , con base en la ley de la conservación de la masa. 104 4.1 Reacciones químicas. El ser humano ha sido testigo de fenómenos naturales: relámpagos, erupciones volcánicas e incendios forestales, por mencionar algunos. Además, día a día está en contacto con otros fenómenos no tan impresionantes como quemar papel, encender una vela o tomar una medicina. En estos ejemplos hay algo en común: la materia se transforma de una clase a otra distinta. Los cambios en los que la materia se transforma de una forma a otra se les conoce como cambios químicos, es decir: Un cambio químico es aquel en el cual se modifica la estructura interna de la materia transformándose de un tipo a otro distinto. Los cambios químicos son resultado de reacciones químicas, las cuales se representan mediante un conjunto de símbolos que indican las sustancias participantes en el cambio químico, así como su estado físico. A esta representación de las reacciones químicas se le denomina ecuaciones químicas, por ejemplo: C (s) + O 2(g) CO 2(g) Esta ecuación química se debe interpretar de la siguiente manera: una mol de carbono sólido reacciona con una mol de oxígeno gas para obtener dióxido de carbono gas. En general, a las sustancias que aparecen antes de la flecha se les denomina reactivos, mientras que a las sustancias que aparecen después de la flecha, se les llama productos. Tipos de reacciones químicas. Para facilitar su estudio, las reacciones químicas se han clasificado de la siguiente manera: 105 1. Síntesis. En estas reacciones, dos sustancias se combinan para formar un solo producto; por ejemplo: 2H 2(g) + O 2(g) 2H 2 O (l) En esta reacción, el hidrógeno y el oxígeno reaccionan entre sí para formar agua. Los subíndices (g), (l) y (s) representan gas, líquido y sólido, respectivamente. 2. Descomposición. En ellas una sustancia se descompone en dos o mas productos: H2CO 3(s) H2O (l) + CO2 (g) El ácido carbónico se descompone en agua y dióxido de carbono. 3. Sustitución simple. En esta clase de reacciones un átomo de un compuesto se sustituye npor un átomo de otro compuesto; por ejemplo: 2Na (s) + 2HCl (g) 2 NaCl (s) + H 2 4. Doble sustitución. En estas hay intercambio de átomos, uno de cada sustancia. HCl (l) + NaOH (l) NaCl (ac) + H2O (l) Es difícil encontrar reacciones inorgánicas comunes que puedan clasificarse correctamente como de doble sustitución. 106 4.2 Balanceo de ecuaciones químicas. El balanceo de ecuaciones químicas está basado en la ley de conservación de la materia. Así, en una reacción química el número de átomos debe un elemento debe ser igual tanto en los reactivos como en los productos. Al proceso por medio del cual se igualara el número de átomos en una ecuación se llamara balanceo. Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción. A+BC Reactivos D Productos Cuando la reacción química se expresa como ecuación, además de escribir correctamente todas las especies participantes (nomenclatura), se debe ajustar el número de átomos de reactivos y productos, colocando un coeficiente a la izquierda de los reactivos o de los productos. El balanceo de ecuaciones busca igualar el de átomos en ambos lados de la ecuación, para mantener la Ley de Lavoisier. Por ejemplo en la siguiente reacción (síntesis de agua), el número de átomos de oxígenos de reactivos, es mayor al de productos. H2 + O2 → H2O Para igualar los átomos en ambos lados es necesario colocar coeficientes y de esta forma queda una ecuación balanceada. 2 H2 + O2 → 2 H2O 107 Nota: Para calcular el número de átomos, el coeficiente multiplica a los subíndices y cuando el cuando el coeficiente es igual a 1 "se omite" por lo que el número de átomos es igual al subíndice. Método de Tanteo Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos ellos, el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia. El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en: H 2 SO 4 hay 2 Hidrógenos 1 Azufre y 4 Oxígenos 5H 2 SO 4 hay 10 Hidrógenos 5 azufres y 20 Oxígenos Para equilibrar ecuaciones, solo se agregan coeficientes a las formulas que lo necesiten, pero no se cambian los subíndices. Para el balanceo de ecuaciones por el método de tanteo es importante conocer la Ley de la conservación de la masa que se enuncia del siguiente modo: En una reacción química, la suma de las masa de las sustancias reaccionantes es igual a la suma de las masas de los productos de la reacción. Para igualar ecuaciones por este método han de compararse uno a uno los distintos elementos que figuran en la reacción. Si un elemento cualquiera, X, por ejemplo, en el primer miembro con el subíndice 2 y en el segundo con 1, entonces, en principio, se ha de colocar el coeficiente 2 a la izquierda de la formula de segundo miembro que contiene el elemento X. Tal proceder se sigue sistemáticamente con los restantes elementos lo que obliga a veces a modificar alguno de los coeficientes ya escritos. 108 Igualase, por ejemplo, la reacción: H2 + O2 H2O El hidrogeno ya está igualado, para ajustar el oxigeno es necesario colocar el coeficiente 2 a la molécula de H 2 O. H2 + O2 2H 2 O El balance, puesto que el coeficiente 2 afecta tanto al H como al O del agua, se deberá añadir el coeficiente 2 al H 2 del primer miembro. 2H 2 + O 2 2H 2 O Al establecer la misma cantidad de masa de los reactivos como en los productos se dice que la ecuación esta balanceada. Otros ejemplos. CaF 2 + H 2 SO 4 → CaSO 4 + HF Ecuación no balanceada El número de F y de H esta desbalanceado, por lo que se asignará (al azar) un coeficiente en la especie del flúor de la derecha. CaF 2 + H 2 SO 4 → CaSO 4 + 2 HF Ecuación balanceada Ejemplo: K + H 2 O → KOH + H 2 Ecuación no balanceada El número de H esta desbalanceado, por lo que se asignará (al azar) un coeficiente en la especie del hidrógeno de la izquierda. 109 K + 2 H 2 O → KOH + H 2 Ecuación no balanceada Quedarían 4 H en reactivos y 3 en productos, además la cantidad de oxígenos quedó desbalanceada, por lo que ahora se ajustará el hidrógeno y el oxígeno. K + 2 H 2 O → 2 KOH + H 2 Ecuación no balanceada El número de K es de 1 en reactivos y 2 en productos, por lo que el balanceo se termina ajustando el número de potasios. 2 K + 2 H 2 O → 2 KOH + H 2 Ecuación balanceada Método Algebraico. Este método es un proceso matemático que consistente en asignar literales a cada una de las especies, crear ecuaciones en función de los átomos y al resolver las ecuaciones, determinar el valor de los coeficientes. Ecuación a balancear: FeS + O 2 → Fe 2 O 3 + SO 2 Los pasos a seguir son los siguientes: 1. Escribir una letra, empezando por A, sobre las especies de la ecuación: A +B → C + D FeS + O 2 → Fe 2 O 3 + SO 2 110 2. Escribir los elementos y para cada uno de ellos establecer cuántos hay en reactivos y en productos, con respecto a la variable. Por ejemplo hay un Fe en reactivos y dos en productos, pero en función de las literales donde se localizan las especies (A y C) se establece la ecuación A = 2C. El símbolo produce (→) equivale al signo igual a (=). Fe A = 2C S A=D O 2B = 3C + 2D 3. Utilizando esas ecuaciones, dar un valor a cualquier letra que nos permita resolver una ecuación (obtener el valor de una literal o variable) y obtener después el valor de las demás variables. Es decir se asigna un valor al azar (generalmente se le asigna el 2) a alguna variable en una ecuación, en este caso C = 2, de tal forma que al sustituir el valor en la primera ecuación se encontrará el valor de A. Sustituyendo el valor de A en la segunda ecuación se encuentra el valor de D y finalmente en la tercera ecuación se sustituyen los valores de C y D para encontrar el valor de B. A FeS Fe A = 2C S A=D O 2B = 3C + 2D B + O2 Sí C = 2 A = 2C C → Fe 2 O 3 D + SO 2 A= D 2B = 3C + 2D D=4 2B = (3) (2) + (2) (4) A= 2(2) 2B = 14 A=4 B = 14/2 B=7 4. Asignar a cada una de las especies el valor encontrado para cada una de las variables: 111 A B 4 FeS + 7 O2 C ® 2Fe 2 O 3 D + 4SO 2 Ecuación Balanceada Método Óxido Reducción (Redox). Se conoce como estado elemental la forma en que se encuentra un elemento en estado puro (sin combinarse con otro elemento), puede ser atómico como el metal (Al), diatómico como los gases o halógenos (O 2 ) y poliatómicos (S 6 ). Como los elementos puros no están combinados se dicen que no tienen valencia, por lo que se creó el concepto "número de oxidación”, que para los átomos de los elementos tiene el valor de cero. Es decir cuando se trata de una reacción de Redox, el número de oxidación de los átomos de los compuestos equivale a su valencia, mientras que los átomos de los elementos tienen número de oxidación cero, por ejemplo: Na + H 2 O → NaOH + H 2 Na0 + H+1 2 O-2 → Na+1O-2H+1 + H0 2 Método Ión Electrón. Para entender este método se debe tener claro las disociaciones de ácidos, bases y sales (electrolitos). Se tiene que los ácidos se disocian en H + y el anión negativo. Ejemplo: HNO 3 se disocia en H +NO 3 H 2 SO 4 se disocia en H 2 +SO-² 4 H 3 PO 4 se disocia en H 3 +PO-³ 4 – 112 Energía de Reacciones Químicas. La humanidad ha utilizado desde el principio de su existencia reacciones químicas para producir energía. En primer lugar mediante la combustión de madera o de carbón, pasando por las que tienen lugar en los motores de explosión de los coches y llegando hasta las más sofisticadas, que tienen lugar en los motores de propulsión de las naves espaciales. Las reacciones químicas van acompañadas en unos casos de un desprendimiento y en otros de una absorción de energía, pero ¿de dónde procede esta energía? Cada átomo y cada molécula de una sustancia posee una determinada energía química o energía interna característica, que depende de las energías cinética y potencial de las partículas constituyentes: átomos, electrones y núcleos. Por tanto, se puede afirmar que los reactivos de una reacción química poseen un determinado contenido energético propio (energía interna) y los productos otro diferente. Si en una reacción química disminuye la energía interna del sistema, se desprende energía. Si, por el contrario, aumenta la energía interna, se absorbe energía. La energía de una reacción es la energía que se pone en juego en la reacción y, por tanto, es igual al balance de energía interna entre los productos y los reactivos. Si existe desprendimiento de energía, la reacción se denomina exoenergética y, por el contrario, si para que se efectúe la reacción, se requiere el aporte de energía, la reacción se llama endoenergética. 113 La energía desprendida o absorbida puede ser en forma de energía luminosa, eléctrica, etc., pero habitualmente se manifiesta en forma de calor, por lo que el calor desprendido o absorbido en una reacción química, se llama calor de reacción y tiene un valor característico para cada reacción, en unas determinadas condiciones da presión y temperatura. Las reacciones químicas pueden entonces clasificarse en: exotérmicas o endotérmicas, según se dé desprendimiento o absorción de calor. Reacciones de Combinación. En las reacciones de combinación, dos o más sustancias reaccionan para formar un producto. Existen numerosos ejemplos de tales reacciones, en especial aquellas en las que diferentes elementos se combinan para formar compuestos. Por ejemplo, el metal magnesio arde en el aire con un brillo deslumbrante para producir óxido de magnesio, como puede verse a continuación: 2Mg (s) + O 2(g) ---> 2MgO (s) Reacciones de descomposición. Dentro de estas reacciones existen dos clases de descomposiciones: a. Descomposición simple Este es un tipo de reacción química inverso al de síntesis, en donde una sustancia reaccionante se descompone en dos o más Genéricamente estas reacciones se pueden representar mediante: A -> B ± C Donde la sustancia A da origen a los productos B y C. productos. 114 b. Descomposición mediante un reactivo En este caso, para que se efectúe la descomposición de una sustancia, se requiere el concurso de otro reactivo, y se pueden representar mediante: AB + C —* AC + BC Donde la sustancia AB es transformada mediante C en otras dos distintas, AC y BC. Reacciones de Sustitución. En este tipo de reacciones un elemento o grupo de elementos que forman parte de un compuesto son desplazados por otro compuesto, y se pueden representar por: AB + C —> AC + B Que indica que el compuesto de fórmula AB reacciona con C para formar el compuesto AC y dejar libre B. Mediante este tipo de reacción, los elementos más reactivos toman el puesto de los que son menos. Reacciones de doble sustitución. En estas reacciones se da un intercambio entre los elementos o grupos de elementos de las sustancias que intervienen en la reacción, y se pueden representar mediante: AB + CD —> * AC ± BD 115 Reacciones de neutralización. La reacción de un ácido con una base se denomina reacción de neutralización, y es una reacción de transferencia de protones. Por ejemplo: 2HCl ± Ca (OH) 2 —> CaCl 2 + 2H 2 O Y se afirma que la reacción de neutralización entre un ácido y una base es una reacción de formación de sal más agua. Reacciones de Óxido- Reducción. En un principio se definió oxidación como toda reacción de combinación de cualquier sustancia con el oxígeno, y reducción como la reacción inversa, de pérdida de oxígeno de una sustancia. Actualmente se considera que Oxidación es un proceso de pérdida de electrones y Reducción es el proceso inverso de ganancia de electrones. De forma que: Cu —> Cu2+ - 2 e es una oxidación 2 Ag + 2 e —> 2 Ag es una reducción Ambos procesos no existen de forma independiente, de forma que todo proceso de oxidación va unido necesariamente a otro de reducción. Una reacción de oxidación-reducción es una reacción en la que hay transferencia de electrones desde la sustancia que se oxida a la que se reduce. 116 4.3 Concepto de estequiometria y leyes estequiométricas. Estequiometría. En química, la estequiometria (del griego στοιχειον, stoicheion, 'elemento' y μετρον, metrón, 'medida') es el cálculo de las relaciones cuantitativas entre reactantes (o también conocidos como reactivos) y productos en el transcurso de una reacción química. Estas relaciones se pueden deducir a partir de la teoría atómica, aunque históricamente se enunciaron sin hacer referencia a la composición de la materia, según distintas leyes y principios. El primero que enunció los principios de la estequiometria fue Jeremías Benjamín Richter (1762-1807), en 1792, quien describió la estequiometria de la siguiente manera: “La estequiometria es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados”. Principio En una reacción química se observa una modificación de las sustancias presentes: los reactivos se consumen para dar lugar a los productos. A escala microscópica, la reacción química es una modificación de los enlaces entre átomos, por desplazamientos de electrones: unos enlaces se rompen y otros se forman, pero los átomos implicados se conservan. Esto es lo que se llama la “ley de conservación de la masa”, que implica las dos leyes siguientes: 1. La conservación del número de átomos de cada elemento químico 2. La conservación de la carga total 117 Las relaciones estequiometrias entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y están determinadas por la ecuación (ajustada) de la reacción. Balance de materia Una ecuación química es la representación escrita de una reacción química. Se dice que está ajustada o equilibrada cuando respeta la ley de conservación de la materia, según la cual la suma de los átomos de cada elemento debe ser igual en los reactivos y en los productos de la reacción. Para respetar estas reglas, se pone delante de cada especie química un número denominado coeficiente estequiométrico, que indica la proporción de cada especie involucrada. Por ejemplo, en la reacción de combustión de metano (CH 4 ), éste se combina con oxígeno molecular(O 2 ) del aire para formar dióxido de carbono (CO 2 ) y agua. (H 2 O). La reacción sin ajustar será: En esta ecuación, las incógnitas son a, b, c y d, que son los denominados coeficientes estequiométrico. Para calcularlos, debe tenerse en cuenta la ley de conservación de la materia, por lo que la suma de los átomos de cada elemento debe ser igual en los reactivos y en los productos de la reacción. En el ejemplo, para el elemento hidrógeno (H) hay 4·a átomos en los reactivos y 2·d átomos en los productos. De esta manera se obtiene un sistema de ecuaciones: Hidrógeno: 4·a = 2·d Oxígeno: 2·b = 2·c + d Carbono: a=c Obteniendo en este caso es un sistema de ecuaciones indeterminado, con tres ecuaciones y cuatro incógnitas. Para resolverlo, se asigna un valor a una de las 118 variables, obteniendo así una cuarta ecuación, que no debe ser combinación lineal de las demás. Por ejemplo: a=1. • Sustituyendo a=1 en la primera ecuación del sistema de ecuaciones, se obtiene d=2. • Sustituyendo a=1 en la tercera ecuación, se obtiene c=1. • Sustituyendo c=1 y d=2 en la segunda ecuación, se obtiene b=2. Sustituyendo los coeficientes estequiométricos en la ecuación de la reacción, se obtiene la ecuación ajustada de la reacción: Ésta dice que 1 molécula de metano reacciona con 2 moléculas de oxígeno para dar 1 molécula de dióxido de carbono y 2 moléculas de agua. Al fijar arbitrariamente un coeficiente e ir deduciendo los demás pueden obtenerse valores racionales no enteros. En este caso, se multiplican todos los coeficientes por el mínimo común múltiplo de los denominadores. En reacciones más complejas, como es el caso de las reacciones Redox, se emplea el método del ion-electrón. Coeficiente estequiométrico Es el coeficiente de una especie química que le corresponde en una ecuación química dada. En el ejemplo anterior: El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2. 119 Los coeficientes estequiométrico son en principio números enteros, aunque para ajustar ciertas reacciones alguna vez se emplean números fraccionarios. Es el número de moles de cada sustancia. Cuando el coeficiente estequiométrico es igual a 1, no se escribe. Por eso, en el ejemplo CH 4 y CO 2 no llevan ningún coeficiente delante. Mezcla, proporciones y condiciones estequiométricas Cuando los reactivos de una reacción están en cantidades proporcionales a sus coeficientes estequiométrico se dice: La mezcla es estequiométrica; Los reactivos están en proporciones estequiométrica; La reacción tiene lugar en condiciones estequiométrica; Las tres expresiones tienen el mismo significado. En estas condiciones, si la reacción es completa, todos los reactivos se consumirán dando las cantidades estequiométrica de productos correspondientes. Si no en esta forma, existirá el reactivo limitante que es el que está en menor proporción y que con base en él se trabajan todos los cálculos. Ejemplo ¿Qué cantidad de oxígeno es necesaria para reaccionar con 100 gramos de carbono produciendo dióxido de carbono? Masa atómica del oxígeno = 15,9994. Masa atómica del carbono = 12,0107. La reacción es: 120 Para formar una molécula de dióxido de carbono, hacen falta un átomo de carbono y dos de oxígeno, o lo que es lo mismo, un mol de carbono y dos mol de oxígeno. Despejando x: Realizadas las operaciones: Ley de la conservación de la materia. Cuando se enunció la ley de la conservación de la materia no se conocía el átomo, pero con los conocimientos actuales es obvio: puesto que en la reacción química no aparecen ni destruyen átomos, sino que sólo se forman o rompen enlaces, la masa no puede variar. La ley de conservación de la masa o ley de conservación de la materia o ley de Lomonósov-Lavoisier es una de las leyes fundamentales en todas las ciencias naturales. Fue elaborada independientemente por Mijaíl Lomonósov en 1745 y por Antoine Lavoisier en 1785. Se puede enunciar como «En una reacción química ordinaria la masa permanece constante, es decir, la masa consumida de los reactivos es igual a la masa obtenida de los productos». Hay que tener en cuenta que la existencia de las reacciones nucleares, en las que la masa sí se modifica de forma sutil, en estos casos en la suma de masas hay que tener 121 en cuenta la equivalencia entre masa y energía. Esta ley es fundamental para una adecuada comprensión de la química. Está detrás de la descripción habitual de las reacciones químicas mediante la ecuación química, y de los métodos gravimétricos de la química analítica. Ley de las Proporciones Constantes. La ley de las proporciones constantes o ley de las proporciones definidas es una de las leyes estequiométrica, según la cual «Cuando se combinan dos o más elementos para dar un determinado compuesto, siempre lo hacen en una relación de masas constantes». Fue enunciada por Louis Proust, basándose en experimentos que llevó a cabo a principios del siglo XIX por lo que también se conoce como Ley de Proust. Para los compuestos que la siguen, por tanto, la proporción de masas entre los elementos que los forman es constante. En términos más modernos de la fórmula química, esta ley implica que siempre se van a poder asignar subíndices fijos a cada compuesto. Hay que notar que existe una clase de compuestos, denominados compuestos no estequiométricos, no siguen esta ley. Para estos compuestos, la razón entre los elementos puede variar continuamente entre ciertos límites. Naturalmente, otras sustancias como las aleaciones o los coloides, que no son propiamente compuestos sino mezclas, tampoco siguen esta ley. 122 Ley de proporciones múltiples. La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, es una de las leyes estequiométrica más básicas. Fue demostrada por el químico y físico francés Louis Joseph Gay-Lussac. Enunciado. "Cuando un elemento se combina con otro para dar más de un compuesto, las masas de uno de ellos que se unen a una masa fija del otro están en relación de números enteros y sencillos". Explicación. Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos. Es decir, que cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números enteros sencillos. Esta fue la última de las leyes ponderales en postularse. Dalton trabajó en un fenómeno del que Proust no se había percatado, y es el hecho de que existen algunos elementos que pueden relacionarse entre sí en distintas proporciones para formar distintos compuestos. Así, por ejemplo, hay dos óxidos de cobre que tienen un 79.89% de cobre el CuO y el Cu 2 O que tiene un 88,82% de cobre, que equivalen a 3.973 gramos de cobre por gramo de oxígeno en el primer caso y 7945 gramos de cobre por gramo de oxígeno en el segundo. La relación entre ambas cantidades es de 1:2 como se expresa actualmente con las fórmulas de los compuestos derivados de la teoría atómica. 123 Bibliografía 1. Chang Raymond (2007). Química. (9° Ed.). México: Mc Graw Hill. 2. Phillips, Strozak & Cheryl ( 2007). Química. (2° Ed.). México: Mc Graw Hill. 3. Zumdahl Steven & Zumdahl Susan (2007). Química. (7° Ed). México: Patria. 4. Andrés Espriella (2008). Química moderna: de lo cuantitativo a lo significativo. (2° Ed.). México: Espriella-Magdaleno. 5. Andrés Espriella & Leopoldo Ramírez (2008). Química: del átomo a las macromoléculas. (2° Ed.). México: Espriella-Magdaleno. 6. Andrés Espriella & Leopoldo Ramírez (2005). Química: esencia molecular de la química. (2° Ed.). México: Espriella-Magdaleno. 7. Zárraga, Velázquez, Rojero & Castells (2004). Química. México: Mc Graw Hill. 8. Andrés Espriella & Leopoldo Ramírez (2007). Lenguaje Químico Inorgánico. (2° Ed.). México: Espriella-Magdaleno. 9. David Nahón Vázquez (2010). Química II: la química en el ambiente. México: Esfinge. 10. José Mariano Bravo Trejo (2002). Química II: cálculos químicos. México: Éxodo. 11. José Luis Santillán Márquez (2003). Cálculos químicos para la preparación de soluciones. México: Trillas. 12. José López Cancio (2003). Química General. México: Iberoamericana. 124 13. American Chemical Society (2005). Química: un proyecto de la American Chemical Society. México: Reverté. 14. José Mariano Bravo Trejo (2001). Principios de Química I; conceptos básicos. México: Éxodo. 15. Hugo E. Solís Correa (2009). Nomenclatura química. México: Patria. 16. Sidney W. Benson (2009). Cálculos químicos: una introducción al uso de las matemáticas en la química. México: Limusa. Cationes (+) Monovalentes H+ Hidrógeno Aniones (-) Monovalentes Radical Nombre que llevan solos o al formar ácidos. Li+ Na+ K+ Cu+ Ag+ Au+ Hg+ NH 4 + Divalentes Mg2+ Ca2+ Litio Sodio Potasio Cobre (I) Plata Oro (I) Mercurio (I) (radical) Amonio Magnesio Calcio FClBrIOHCNNO 2 NO 3 HSHSO 3 HSO 4 - Fluorhídrico (HF) Clorhídrico (HCl) Bromhídrico (HBr) Yodhídrico (HI) Hidroxilo Cianhídrico (HCN) Nitroso (HNO 2 ) Nítrico (HNO 3 ) Sulfhídrico Sulfuroso Sulfúrico Nombre que tienen cuando forman sales o compuestos Fluoruro Cloruro Bromuro Yoduro Hidróxido Cianuro Nitrito Nitrato Sulfuro ácido Sulfito ácido Sulfato ácido Sr2+ Estroncio ClO- Hipocloroso Hipoclorito Ba2+ Bario ClO 2 - Cloroso Clorito Zn2+ Zinc ClO 3 - Clórico Clorato Cd2+ Cadmio ClO 4 - Perclórico Perclorato Hg2+ Mercurio (II) H 2 PO 3 - Fosforoso Fosfito diácido Cu2+ Cobre (II) H 2 PO 4 - Fosfórico Fosfato diácido Fe2+ Hierro (II) IO 3 - Yódico Yodato Sn2+ Estaño (II) MnO 4 - Permangánico Permanganato Pb2+ Plomo (II) Divalentes Ni2+ Níquel (II) S2- Sulfhídrico Sulfuro Cromo (II) O2- Óxido Óxido Aluminio CO 3 2SO 3 2- Carbónico (H 2 CO 3 ) Sulfuroso Carbonato Sulfito SO 4 2HPO 3 2HPO 4 2CrO 4 2Cr 2 O 7 2MnO 3 2Trivalente Sulfúrico Fosforoso Fosfórico Crómico Dicrómico Manganoso Sulfato Fosfito ácido Fosfato ácido Cromato Dicromato Manganito Cr2+ Trivalentes Al3+ As3+ Arsénico Sb3+ Antimonio 3+ Fe Hierro (III) Cr3+ Cromo (III) 3+ Ni Níquel (III) Au3+ Oro (III) Valencia especial tetravalente catión-anión C4+ Carbono C4Carburo Si4+ Silicio Si4Siluro Pb4+ Plomo (IV) PO 3 3PO 4 3BO 3 3AsO 3 3AsO 4 3- Fosforoso Fosfórico Bórico Arsenioso Arsénico Fosfito Fosfato Borato Arsenito Arseniato