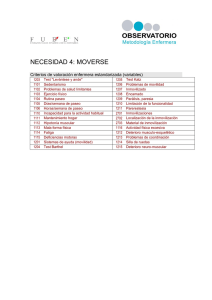
TFG Kobiashvili_Zurab - TAuja
Anuncio

Grado en Fisioterapia Facultad de Ciencias de la Salud UNIVERSIDAD DE JAÉN Facultad de Ciencias de la Salud Trabajo Fin de Grado Tiempo de inmovilización en el tratamiento de las lesiones musculares: revisión bibliográfica Alumno: Kobiashvili, Zurab Tutor: Prof. D. Martínez-Amat, Antonio Dpto: Ciencias de la Salud Junio, 2015 1. Resumen Contexto: las lesiones musculares son una de las principales complicaciones en el deporte. Su tratamiento inmediato es la inmovilización, crioterapia, compresión y elevación. El tiempo de inmovilización depende del grado de la lesión y no existe consenso sobre su óptima duración. Objetivos: determinar objetivamente el tiempo de inmovilización necesario para el tratamiento de las lesiones musculares, evaluar su influencia en la duración de la recuperación y el índice de recidivas Método: se ha llevado a cabo una búsqueda en las bases de datos electrónicas PEDro y PubMed, para identificar las publicaciones sobre las lesiones musculares tratadas con inmovilización inmediata y/o movilización precoz. La búsqueda se realizó entre febrero y abril de 2015. Resultados: tras la búsqueda inicial se identificaron un total 321 publicaciones, de las cuales 8 artículos de texto completo fueron seleccionados en función de los criterios de inclusión y exclusión. Conclusión: la inmovilización inmediata ayuda a mejorar el proceso de cicatrización, pero su exceso influye en la atrofia muscular. La inmovilización dura entre 2 y 5 días según el grado de la lesión. La movilización empieza inmediatamente después de ese periodo. El tiempo de recuperación y la incidencia de recidivas dependen del programa de rehabilitación escogido, su nivel de exigencia y su frecuencia, pero no ha sido posible determinar la relación de estos parámetros con el tiempo de inmovilización. Palabras clave: lesiones musculares, inmovilización, movilización precoz 2. Abstract Context: muscle injuries are the most common complications in sports activities. Initial treatment consists of immobilization, application of ice, compression and elevation. The timing of the immobilization depends on the severity of the injury and there is no agreement about its optimal duration. Objectives: to determine the duration of immobilization required for the treatment of muscle injuries and to evaluate its influence on the time of recovery and the rate of reinjury. Method: the search was performed in PEDro and PubMed online databases between April and May 2015. All publications concerning muscle injuries that were treated with immediate immobilization and early mobilization were identified. Results: initially 321 citations were assed for eligibility. Eventually 8 full text articles were selected according to selection and exclusion criteria. Conclusions: immediate immobilization improves the healing process, but if exceeded, it may result in muscle atrophy. The duration of the immobilization is between 2 and 5 days, depending on the severity of the injury. The early mobilization starts immediately after. The time required to return to physical activity and the rate of reinjuries, depend on the rehabilitation program followed, on its level of demand and frequency. However, it was impossible to determine the relationship between the duration of the immobilization, the recovery time and the rate of reinjuries. Keywords: muscle injuries, immobilization, early mobilization Índice de contenido: 1. Resumen .................................................................................................................................... 2 2. Abstract ..................................................................................................................................... 3 3. Introducción .............................................................................................................................. 5 3.1. Consideraciones previas .................................................................................................... 5 3.2. La patología: lesiones musculares ..................................................................................... 6 3.2.1. Clasificación de las lesiones musculares..................................................................... 6 3.2.3. Tratamiento de las lesiones musculares .................................................................. 10 4. Objetivos del estudio............................................................................................................... 12 5. Método .................................................................................................................................... 12 5.1. Definición ......................................................................................................................... 12 5.2. La búsqueda ..................................................................................................................... 13 5.3. Criterios de inclusión ....................................................................................................... 14 5.4. Criterios de exclusión ....................................................................................................... 15 5.5. Selección de las publicaciones ......................................................................................... 15 5.6. Extracción de los datos .................................................................................................... 16 5.7. Valoración de la calidad ................................................................................................... 16 6. Resultados ............................................................................................................................... 17 6.1. Propiedades histológicas del tejido muscular lesionado ................................................. 17 6.2. Tiempo de inmovilización e inicio de movilización ......................................................... 18 6.3. Vuelta a la actividad física ................................................................................................ 20 6.4. Recidivas y complicaciones a largo plazo......................................................................... 21 7. Discusión ................................................................................................................................. 21 7.1. Tiempo óptimo de inmovilización e inicio de la movilización ........................................ 21 7.2. Tiempo de recuperación .................................................................................................. 23 7.3. Incidencias de recidivas ................................................................................................... 24 7.4. Limitaciones del estudio ................................................................................................ 24 8. Conclusiones............................................................................................................................ 25 9. Referencias .............................................................................................................................. 26 10. Anexos ................................................................................................................................... 29 Tabla 1: Clasificación de las lesiones musculares desde el punto de vista clínico.................. 29 Tabla 2: Términos de búsqueda en PEDro .............................................................................. 29 Tabla 3: Términos de búsqueda en PubMed .......................................................................... 30 Tabla 4: Estudios seleccionados.............................................................................................. 31 Tabla 5: Datos extraídos ......................................................................................................... 32 Tabla 6: Resumen de estudios seleccionados......................................................................... 33 Tabla 7: Valoración de calidad, escala PEDro ......................................................................... 40 Tabla 8: Niveles de evidencia y grados de recomendación .................................................... 41 Tabla 9: Resumen del estudio de Lehto et al .......................................................................... 42 Abreviaturas............................................................................................................................ 44 3. Introducción 3.1. Consideraciones previas Las lesiones musculares representan una de las mayores complicaciones de la práctica deportiva, tanto entre los deportistas profesionales, como los aficionados. Su frecuencia varía entre el 10 y el 55% de todas las lesiones sufridas (20) en el deporte. El tipo de las lesiones musculares sufridas también varía según el tipo de la actividad deportiva. Así en deportes de contacto, como, por ejemplo, rugby (18), es de esperar que la lesión muscular más frecuente sea de tipo contusión; mientras, en los deportes en los que se exige una gran fuerza excéntrica a los músculos, o se realiza un cambio brusco de la función excéntrica a la concéntrica, son más frecuentes las lesiones musculares por distensión. Así, en el fútbol las distensiones musculares de la musculatura isquiotibial generalmente ocurren cuando el deportista está corriendo o realizando un sprint (15). Por localización, las lesiones deportivas con mayor frecuencia afectan a los miembros inferiores, con un 71.9%, en comparación con los miembros superiores cuya incidencias es del 10.9% (22). Según Moreno Pascual et al (22) las lesiones musculares representan entre el 20 y 30% de las lesiones deportivas, ocupando así el segundo lugar por frecuencia de las complicaciones deportiva, ligeramente por debajo de las de tipo capsuloligamentosas, con una frecuencia de entre 20 y 40%. Además estás cifras también dependen del tipo de deporte practicado; así en el fútbol las lesiones musculares llegan al 40% (22). Tras una lesión muscular el atleta se somete a un tratamiento que, en teoría, le garantizará una completa recuperación a las condiciones previas a la lesión y sobre todo, le prevendrá de volver a sufrir la misma lesión, teniendo en cuenta que el haber sufrido una lesión muscular es uno de los mayores factores de riesgo para volver a sufrirla (25,7). Así, por ejemplo, en el fútbol australiano el riesgo de recidiva de una lesión de la musculatura isquiotibial permanece durante los 3 primeros meses después de la vuelta a la actividad deportiva, con un riesgo acumulado del 30.6% para el resto de la temporada (25). Es aquí donde el personal sanitario y rehabilitador se puede cuestionar el éxito del tratamiento administrado, poniendo en duda si el programa de rehabilitación ha sido el adecuado, si el tiempo de tratamiento, de la inmovilización o la vuelta a la actividad deportiva han sido los acertados. En el caso de las lesiones ligamentosas, la evidencia científica sugiere, que la aplicación del protocolo RICE, que consiste en la inmediata inmovilización (Rest), aplicación del hielo (Ice), compresión (Compression) y elevación (Elevation) y algún tipo de movilización tras el traumatismo es beneficioso para el tratamiento de los esguinces de tobillo (30). Eiff et al (5) concluyen que en el tratamiento de los esguinces laterales de tobillo tanto la inmovilización, como la actividad precoz previenen de la aparición de los síntomas residuales y la inestabilidad de tobillo, aunque la movilización precoz permite una temprana vuelta a las actividades habituales y es más cómoda para el paciente (5). El uso inmediato de movilización pasiva continua en el postoperatorio de la reconstrucción del tendón patelar facilita el proceso de rehabilitación, disminuyendo el dolor en la fase inflamatoria de la regeneración del tejido blando (20). En el tratamiento de las lesiones musculares y de otras partes blandas se acepta, de una forma generalizada, la aplicación del protocolo RICE como primera medida de abordaje. Además the Chartered Society of Physiotherapy in Sports Medicine, en sus recomendaciones de manejo de las lesiones deportivas de los tejidos blandos, aboga por el tratamiento RICE al menos en las primeras 72 horas tras la lesión (29). Durante y transcurrido este tiempo, el fisioterapeuta se enfrenta al dilema de si es seguro iniciar la movilización de la parte del cuerpo lesionada y cuáles han de ser los límites de seguridad de ese programa de rehabilitación, sin que éste provoque un mayor daño y fallo del mecanismo reparador. Por otra parte, una inmovilización prolongada conlleva el riesgo de la atrofia muscular (10, 9), que complica el proceso de recuperación aún más. La aplicación de un programa de rehabilitación también dependerá, en mayor o menor medida, del tipo de la lesión muscular, de su mecanismo de producción, la extensión, las condiciones tróficas de la musculatura lesionada, etc. La prevención de una recidiva dependerá, además, del tipo tratamiento seguido y de la duración de éste. Por esas razones, consideramos que es muy importante determinar el tiempo óptimo que nos proporcione una mayor seguridad a la hora de inmovilizar o iniciar un tratamiento y como resultado, garantizar una completa recuperación del deportista y una menor tasa de recidivas. Para poder ahondar en todas estas y otras cuestiones, es importante, primero, comprender el mecanismo de una lesión muscular y su proceso de regeneración, conocer los tratamientos aplicados en la actualidad y la base biológica de su elección, que se exponen a continuación: 3.2. La patología: lesiones musculares 3.2.1. Clasificación de las lesiones musculares Las lesiones musculares, según el mecanismo de su producción, se pueden diferenciar en contusiones, distensiones o laceraciones. La contusión ocurre cuando el músculo sufre una repentina, excesiva y extrínseca fuerza de compresión por traumatismo directo. Este tipo de lesiones se suelen producir en los deportes de contacto y no se deben a la excesiva fuerza intrínseca de la propia actividad física (11, 14). En una distensión, el músculo se somete a un excesivo estiramiento; la fuerza tensil de carácter intrínseco sobrepasa los límites de su capacidad elásticas y se produce una ruptura de las fibras musculares, sobre todo, cerca de la unión miotendinosa (11). Estas lesiones son más frecuentes en aquellos deportes en los que se producen cambios bruscos de aceleración y desaceleración, sobre todo en los músculos biarticulares (11, 13, 14). Las contusiones y las distensiones representan más del 90% de todas las lesiones deportivas (14), por lo que las laceraciones, desgarros fibrilares por fuerza de torsión, son menos frecuentes en el deporte (12,14). Cualquiera que sea el mecanismo de producción de la lesión muscular, en todos se producirá una rotura de los vasos sanguíneos intramusculares, con la consiguiente formación del hematoma. En función de la localización del hematoma, podemos distinguir entre lesiones intramusculares (14) y lesiones intermusculares, dependiendo de si la fascia se ha mantenido íntegra o no. Así en las lesiones musculares en las que la fascia se mantiene intacta y el hematoma no excede de los límites del músculo dañado, podemos hablar de lesiones intramusculares. Por el contrario, si la fascia se rompe y la hemorragia se extiende entre los planos musculares, hablaríamos de una lesión intermuscular. Clínicamente, en función del grado de incapacidad funcional producida, las lesiones musculares se clasifican como leves, moderadas y graves. Las lesiones leves (grado I) son aquellas que se presentan con menor desgarro de fibras musculares, inflamación y malestar, con nula o mínima pérdida de la fuerza y capacidad de movimiento. En las moderadas (grado II), se produce un mayor daño de las fibras musculares y una mayor pérdida de la capacidad contráctil. En las lesiones graves (grado III) se produce un desgarro muscular que se extiende por toda la sección transversal del músculo, con, prácticamente, completa pérdida de la función muscular (11, 13, 14) (tabla 1). Por último, la utilización de las modernas técnicas de imagen, tales como la resonancia magnética y el ultrasonido, facilitan una mayor precisión en la detección de la localización exacta de la lesión dentro del músculo. Así, en función de su localización, las lesiones musculares se pueden clasificar en proximales y distales, cercanas a la unión miotendinosa, y las medias, presentes en el vientre muscular (11). Cabe también señalar, que el dolor muscular tardío, conocido como agujetas, con frecuencia es considerado como una forma moderada de lesión muscular por distensión. Pero teniendo en cuenta la aparición de su sintomatología al día siguiente o a los 2 días tras la práctica deportiva, con su pico máximo al segundo o tercer día (11, 14), su tratamiento habitual no consiste en la aplicación del protocolo RICE, por tanto no se va a analizar en el presente trabajo. 3.2.2. Biología de las lesiones musculares Al final de un proceso de regeneración de un tejido óseo, tras una fractura, el nuevo tejido formado es idéntico al que existía antes de la lesión. En cambio, el proceso reparador del tejido muscular se produce por su cicatrización, y consecuentemente, el nuevo tejido muscular nunca es idéntico al que existía antes de la lesión (12). El procesos de regeneración y cicatrización del músculo esquelético sigue un patrón fijo, independientemente del tipo de la lesión muscular, sea ésta una contusión, distensión o laceración (12). En la reparación del tejido muscular compiten al mismo tiempo dos procesos simultáneos: el de formación de una cicatriz de tejido conectivo y la regeneración de miofibrillas y de las terminaciones nerviosas lesionadas. Tras la lesión el hueco entre los dos extremos de una fibra muscular rota es ocupado por un hematoma. En los días iniciales el hematoma es invadido por células inflamatorias, incluidos los fagocitos, que empiezan a eliminar el coagulo. La fibrina y fibronectina procedente de la sangre empiezan a formar una matriz primaria, que sirve de armadura para los fibroblastos y le da fuerza inicial a la cicatriz para soportar las fuerzas tensiles. En fase inicial es abundante la producción del colágeno de tipo III. La producción de colágeno de tipo I, más resistente, se produce más tarde (13). Es en esa fase inicial, cuando más débil y vulnerable es la cicatriz a las fuerzas tensiles (13). El proceso reparador de las fibras musculares generalmente se divide en tres fases: la fase de destrucción, la fase de reparación y la fase de remodelación, ocurriendo las dos últimas casi simultáneamente. La fase de destrucción: o fase inflamatoria se caracteriza por la formación del hematoma, necrosis de las fibras musculares y una reacción inflamatoria (13). Ésta última no se debe considerar como un proceso perjudicial, sino como un suceso necesario para la curación; es una reacción natural del cuerpo que intenta minimizar el daño y establecer las condiciones necesarias para las dos fases siguientes (8). Se produce una necrosis de las fibras musculares cerca de la región lesionada. La propagación de la necrosis a lo largo de toda la fibra muscular es detenida por una banda contraída que se forma en un par de horas entre los dos extremos dañados y es sellado por el sarcolema. Las fibras rotas se contraen y el espacio entre los extremos es ocupado por el hematoma (11), que posteriormente se sustituirá por el tejido cicatricial (13). La rotura de los vasos sanguíneos produce una extravasación de las células inflamatorias. Además las sustancias vertidas desde las partes necrosadas de las miofibrillas sirven de señal quimiotáxica para la extravasación de más células inflamatorias. Los macrófagos y fibroblastos presentes dentro de la miofibrilla lesionada también sirven de quimiotáxis para las células inflamatorias circulantes. En esta fase aguda predominan los leucocitos polimorfonucleares, pero en breve son sustituidos por los monocitos, que se transforman en macrófagos, encargados de la proteolsis y fagocitosis del material necrótico. Hay que destacar que la lámina basal que envuelve la parte necrosada de la miofibrilla lesionada es resistente a la actividad de los macrófagos, se mantiene intacta y sirve de estructura en la que las células satélite empiezan a forman nuevas células musculares (13). Esta fase puede durar de 72 horas (16) hasta una semana (4), dependiendo de la gravedad de la lesión, caracterizada por la presencia de los signos clásicos de la inflamación; hinchazón, rojez, calor y dolor (16). El edema, la rojez y el aumento de temperatura en la zona se debe al exudado vertido al espacio extracelular como resultado de la vasodilatación, al aumento de la permeabilidad vascular y la extravasación desde el tejido dañada. El dolor se debe tanto al aumento de la presión en la zona, como a la sensibilidad de los receptores del dolor a las sustancia químicas, tales como prostaglandinas, histamina o bradicinina. La pérdida de la función se debe al propio daño de las unidades contráctiles, al reflejo inhibitorio debido al dolor y a la restricción mecánica del propio edema (8). En esta fase todas las acciones terapéuticas tienen como objetivo minimizar y controlar los síntomas y se verán más adelante. La fase de reparación: en esta fase, de hasta 6 semanas desde la lesión (4), al mismo tiempo que empieza la fagocitosis del tejido necrosado por los monocitos sanguíneos (11) se activan los fibroblastos, miofibroblastos y células endoletiales, cuya migración y proliferación es estimulada por la presencia de factores de crecimiento producidos de las plaquetas y macrófagos (18). Las células miogénicas de reserva, células satélite, se activan y empiezan la reparación de la mifibrilla lesionada a los 24 horas tras la lesión. Los mioblastos procedentes de las células sátelite y las células madre se fusionan para formar miotubos a los dos días. Entre el quinto y el sexto día la parte necrosada de la miofibrilla es reemplazada por la miofibrilla regenerativa, que empieza a penetrar en la cicatriz de tejido conectivo entre los extremos lesionados (11) formando un tejido similar a la unión miotendinosa (13). Con el tiempo el tejido cicatricial disminuye de tamaño y la distancia entre los extremos se acorta (13). A los tres días también se empieza a producir la revascularización de la zona lesionada con el crecimiento de las capilares nuevos (11). La combinación del nuevo sistema capilar, los fibroblastos y los miofibroblastos es conocido como tejido granular. A medida que la formación del tejido granular aumenta, empieza a disminuir el tapón de fibrina. Es un proceso simultáneo de construcción y destrucción, durante el cual la resistencia del tejido es vulnerable a las fuerzas tensiles (8). El grado de la recuperación muscular dependerá del equilibrio existente entre el proceso de regeneración y la fibrosis (4). Al séptimo día el aumento significativo del colágeno confiere al tejido cicatricial un mayor fuerza tensil, mejorando posteriormente con sustitución del colágeno III por el colágeno I (8). La fase de remodelación: esta es la fase final, que puede durar desde varios meses (4) hasta un año (8). Durante esta fase se produce la maduración de las miofibrillas regenerativas y formación de las unidades contráctiles. La retracción de la cicatriz acerca los extremos, aunque una fusión completa, aparentemente, nunca se produce quedando los extremos separados por una fina capa de tejido conectivo (cicatriz) (11). En definitiva, los principales factores necesarios para la correcta regeneración del músculo son: a) una fuente de mioblastos, b) una vascularización adecuada, c) un número y distribución adecuados de terminaciones nerviosas motoras y sensoriales, d) un apropiado medio mecánico, y e) una matriz que estimule la migración, proliferación y diferenciación de mioblastos, la vascularización, innervación y la carga mecánica óptima del músculo en reparación. 3.2.3. Tratamiento de las lesiones musculares El objetivo principal en el tratamiento de las lesiones musculares es minimizar la propagación del daño, aliviar el dolor y el espasmo postraumático, reducir la hemorragia y el edema, y facilitar la recuperación (3). El tratamiento inmediato de la lesiones musculares consisten en la aplicación del protocolo RICE (12, 21). El objetivo de esas cuatro acciones es minimizar la hemorragia en la zona lesionada, que prevendrá de la formación de un hematoma excesivo, que tiene un impacto directo en el tamaño del tejido fibroso cicatricial al final del proceso de regeneración (3, 12, 13). Además la minimización del hematoma y del edema disminuye la isquemia en el tejido granular, acelerando el proceso de regeneración (13, 21). La compresión reduce el tamaño del hematoma intramuscular y se debe aplicar inmediatamente, en el momento de la lesión, incluso si el diagnóstico aún no ha sido confirmado (13). Lo mismo se aplica a la utilización de crioterapia inmediata, por intervalos de 15 a 20 minutos, cada 30 o 60 minutos (3, 12, 13) por un periodo mínimo de 6 horas (12). Estas dos medidas ayudan a prevenir la formación de un hematoma excesivo, disminuyen la inflamación y en aceleran el proceso de regeneración (13). La elevación del miembro lesionado por encima del nivel del corazón disminuye la presión hidrostática (12) y el aporte sanguíneo a la zona lesionada, y por tanto, limita el tamaño del hematoma (13) y del edema (12). El periodo de inmovilización puede durar de 1 a 5 días, dependiendo de la gravedad de la lesión (13). Una inactividad continuada puede llevar a la atrofia muscular (3, 9), una excesiva formación de la cicatriz y un retardo en la recuperación del músculo (3), por lo que el periodo de inmovilización ha de ser el óptimo. El uso de muletas es recomendable en lesiones grave, o en las que la inmovilización no es posible por su localización, por ejemplo en la zona inguinal. Unos días después del inicio del tratamiento se debe realizar una revaloración del músculo lesionado. Si no se observa mejoría del estado inicial, se debe sospechar de un gran hematoma intramuscular o la ruptura total del músculo. En esos casos es aconsejable realizar una reexaminación con pruebas complementarias, tales como ultrasonografía o resonancia magnética, para descartar la necesidad de una intervención quirúrgica (13). El uso de las AINEs también es recomendable en la fase inicial del tratamiento, inmediatamente (13) o 48 hora después de la lesión (3), para disminuir le reacción inflamatoria. A diferencia de los glucocorticoides, la utilización de los AINEs parece no tener efectos adversos en el proceso de cicatrización y en las propiedades contráctiles y tensiles del músculo lesionado (12, 13), si su uso se limita a un corto periodo de tiempo (12). De forma general se recomienda también el uso del ultrasonido terapéutico (12, 13), por sus efecto analgésico (12), aunque su efecto sobre los resultados finales del proceso de regeneración son dudosos (13). Entre otros tratamiento podemos mencionar el uso terapias hiperbárica de oxígeno (12, 13), el uso de factores de crecimiento (3, 18), plasma rico en plaquetas , células madre (18) etc. El tratamiento quirúrgico se aplica en casos de lesiones muy graves, cuando el tratamiento conservador ha fallado. Su uso es indicado en casos de a) un gran hematoma intramuscular, b) distensiones musculares de III grado, c) distensiones de II grado, cuando más de la mitad del vientre muscular está desgarrada, y d) la distancia entre los extremos lesionados es muy grande y es preciso acercarlos para evitar la formación de una cicatriz excesiva (12, 13). Otras situaciones en las que es recomendable una intervención quirúrgica es cuando el paciente se queja de un dolor persistente más allá de 4-6 meses después de la lesión, sobre todo si el dolor se acompaña con un claro déficit de extensión. En esos casos se debe sospechar de una cicatrización adherente que limita el movimiento y necesita de una liberación quirúrgica (12). En lesiones musculares de menor grado a los pocos días tras la lesión, una vez que haya pasado la fase inflamatoria, la inmovilización y la compresión son sustituidas por un vendaje elástico y se inicia la movilización precoz (13). La actividad precoz en la fase inicial de la rehabilitación puede consistir en a) ejercicios isométricos sin carga, con posterior aumento de ésta en los límites del dolor, b) entrenamiento isotónico controlado sin carga y/o ejercicios isocinéticos dinámicos con carga mínima, c) aplicación de calor o tratamiento de contraste de frío y calor, acompañado de estiramientos pasivos y activos dentro de los límites del dolor (13). En esta fase también se inician otras actividades físicas dirigidas al mantenimiento de la capacidad cardiovascular del atleta, como natación o bicicleta estática, protegiéndolo en cada momento del riesgo de la rerruptura fibrilar (12). En la fase final del programa de rehabilitación, la decisión de si el atleta está preparado para la vuelta paulatina al entrenamiento específico se puede basar en dos medidas: 1) la capacidad de estirar el músculo lesionado igual que el músculo contralateral; 2) la capacidad de realizar movimientos básicos sin dolor. Si el atleta refiere que ha alcanzado ese punto de rehabilitación, se puede autorizar un entrenamiento específico de su modalidad deportiva, aunque siempre bajo la supervisión profesional (12). 4. Objetivos del estudio El objetivo de la presente revisión bibliográfica es determinar, en base a la evidencia científica actual, el tiempo de inmovilización necesario para el tratamiento de las lesiones musculares, asimismo de evaluar la influencia de éste sobre la duración de recuperación y el índice de recidivas. 5. Método 5.1. Definición Esta revisión bibliográfica se ha llevado acabo para determinar el tiempo óptimo necesario de inmovilización en el tratamiento de las lesiones musculares y la relación de ésta con los resultados de recuperación finales y las recidivas. La inmovilización es una de las medidas inmediatas aplicadas al tratamiento de las lesiones musculares, conjuntamente con la aplicación del hielo, la compresión y la elevación (protocolo RICE). La inmovilización es necesaria para la reducción de las demandas metabólicas y del flujo sanguíneo en la región dañada. Se aplica selectivamente, permitiendo una moderada actividad general, pero el paciente debe evitar cualquier tipo de movilidad que pueda comprometer el proceso de cicatrización de la zona lesionada. La inmovilización es imprescindible, también, para evitar la puesta bajo la carga excesiva de los tejidos dañados que pueda romper los frágiles enlaces de fibrina que se forman al inicio del proceso reparador (29). Se ha definido como movilización toda actividad producido en el músculo lesionado, tanto de forma pasiva, como activa. Bien podrían ser estiramientos, contracciones involuntarias producidas por medio de electroestimulación y contracciones voluntarias en todas sus modalidades de isometría, isotonía o isocinecia. Por otra parte, la movilización o la actividad precoz, se ha definido como todo movimiento producido en el músculo en la fase temprana de su proceso de curación. 5.2. La búsqueda La búsqueda bibliográfica para el presente estudio se ha realizado en las siguientes bases de datos electrónicas: PEDro y PubMed, para identificar todas aquellas publicaciones sobre la aplicación del protocolo RICE en el tratamiento de las lesiones musculares, la inmovilización y la movilización precoz. La búsqueda se ha realizado entre febrero y abril de 2015 y no se ha establecido ningún límite de fecha de publicación de los artículos. Los términos de búsqueda utilizados, en todas sus posibles variantes (Tabla 2 y 3), han sido: muscle rice, rest ice compression elevation, muscle injury mobilization, muscle injury immobilization, muscle damage rest, muscle injury immobilization, muscle injury rest, muscle strain, muscle tear, muscle rupture, pulled muscle, ice rest compression elevation muscle, early mobilization muscle injury. Además las referencias incluidas en los estudios encontrados han sido examinadas para su inclusión en los resultados de búsqueda. Sólo se han tenido en cuenta las publicaciones en los idiomas inglés y castellano. Figura 1: Diagrama de flujo de la estrategia de búsqueda Criterios de exclusión: Resultados de la búsqueda inicial en las bases de datos n=321 - Otras lesiones musculares: dolor muscular tardío, compartimental, síndrome patologías por sobreuso, síndrome miofascial y puntos Publicaciones preseleccionadas tras el cribado en función del título n=79 gatillo, otras lesiones musculares no agudas. - Los efectos de otras intervenciones: en sujetos sanos, en otros Publicaciones preseleccionadas tras el cribado en función del abstract n=31 Publicaciones identificadas en otras fuentes o extraídas de las referencias n=32 tejidos, intervenciones quirúrgicas, farmacológicas, administración de proteínas sanguíneas. - Otras patologías: enfermedades Publicaciones incluidas tras la lectura del texto completo n=6 Publicaciones incluidas tras la lectura del texto completo n=2 degenerativas, daños musculares inducidos por sustancias químicas. - Otros criterios de exclusión: publicaciones en otro idioma distinto al inglés o castellano. Publicaciones incluidas n=8 - Artículos incompletos: falta de texto completo o abstract no disponible o insuficiente. 5.3. Criterios de inclusión Publicaciones: en la fase inicial de la búsqueda bibliográfica los resultados se limitaron sólo a los ensayos clínicos. Con el fin de ampliar el número de citaciones en PEDro para algunos términos se eliminaron los criterios de limitación según el tipo de publicación (ver Tabla 2). En PubMed no se ha establecido ninguna limitación de resultado según el tipo de publicación, pudiendo estos ser tanto ensayos clínicos, como revisiones sistemáticas. Participantes: se incluyeron artículos que contemplaran tratamiento de lesiones musculares agudas tanto en sujetos humanos, como animales. Intervenciones: se incluyeron publicaciones que aplicaran cualquier tipo de tratamiento conservador de las lesiones musculares siempre y cuando estuviera especificado o bien, que el tratamiento inicial consistiera en la inmovilización y su duración, o el tiempo de inicio de la movilización tras la lesión. Medidas de resultados: se ha extraído la siguiente información: 1) tiempo de inmovilización, 2) momento de inicio de la movilización, 3) vuelta a la actividad deportiva, 4) índice de recidivas, 5) propiedades histológicas y biomecánicas del tejido muscular lesionado. 5.4. Criterios de exclusión Se han excluido todas aquellas publicaciones cuyo objeto de estudio fuera: dolor muscular tardío, síndrome compartimental, patologías por sobreuso, síndrome miofascial y puntos gatillo, otras lesiones musculares no agudas. Por tipo de intervención se han excluido estudios que evaluaran los efectos de inmovilización en sujetos sanos, los efectos de inmovilización de otros tejidos, aunque contemplaran sus efectos en el tejido muscular (fracturas, esguinces, etc.), las intervenciones quirúrgicas, farmacoterapia o la suministración de hormonas o proteínas sanguíneas (factores de crecimiento, plasma rico en plaquetas, células madre, etc.). Además se han excluido estudios sobre enfermedades degenerativas, daños musculares inducidos por sustancias químicas, publicaciones en otro idioma que no fuera en inglés o castellano, artículos incompletos cuyo abstract no estuviera disponible o fuera insuficiente para extraer información necesaria para el análisis. 5.5. Selección de las publicaciones Las citaciones obtenidas en las dos bases de datos fueron preseleccionadas para su elegibilidad en función del título, si éste se ajustaba a los criterios de inclusión. Posteriormente se ha analizado el abstract, o el texto completo, en caso de disponibilidad, para identificar los estudios potencialmente relevantes que dispusieran de alguna de las medidas de resultados requeridas para el estudio. Por último, se han seleccionados solo los estudios disponibles en texto completo. Los resultados de la estrategia de búsqueda están resumidos en la Figura 1. 321 publicaciones obtenidas en la búsqueda fueron identificadas para la potencial inclusión. De éstos, 242 fueron excluidos según el título, quedando 79 para una lectura del abstract. Tras la lectura del abstract, 31 publicaciones fueron seleccionadas para una lectura más amplia del texto completo, de éstos, finalmente, se han seleccionado 6 artículos. Por otra parte, se han preseleccionado 32 publicaciones identificadas en otras fuentes, tales como citaciones en las referencias de las publicaciones encontradas. De éstos finalmente se han seleccionado 2 artículos. De los 8 artículos seleccionados, 3 eran ensayos clínicos aleatorizados (ECAs) realizados en humanos, en los cuales los participantes fueron asignados a uno de los dos protocolos de tratamiento de forma aleatoria; 3 eran series de casos (SC) que describían un tipo de intervención concreta en humanos; y 2 eran de caso y controles (CC) realizados en animales (Tabla 4). 5.6. Extracción de los datos Se ha extraído la siguiente información de los artículos seleccionados: tiempo de inmovilización, inicio de la movilización o del ejercicio, tiempo necesario para la vuelta a la actividad física igual a la previa a la lesión, incidencia de recidivas o complicaciones detectadas en los seguimientos sucesivos (Tablas 5 y 6). Además en las publicaciones de Kääriäinen et al (15) y Lehto et al (17) se ha extraído la información sobre las propiedades histológicas y biomecánicas del tejido muscular en proceso de regeneración. 5.7. Valoración de la calidad La calidad metodológica de los artículos seleccionados se ha valorado según la Escala PEDro (The Physiotherapy Evidence Database Scale) (27) (versión de 30 de diciembre de 2012). La escala PEDro se elabora asignando 1 punto a cada uno de los siguientes ítems: 1) criterios de selección, 2) asignación al azar, 3) ocultación de la asignación, 4) similitud de los grupos, 5) sujetos ciegos, 6) terapeutas ciegos, 7) evaluadores ciegos, 8) medida de los resultados, 9) análisis de “intención de tratar”, 10) comparaciones estadísticas y 11) medidas de variabilidad. La puntuación máxima es de 10 puntos, ya que el criterio 1, generalmente, no se tiene en cuenta. La tabla 7 resume los puntos obtenidos en escala PEDro de los artículos seleccionados. De las 8 publicaciones, 3 eran ensayos clínicos aleatorizados con una puntuación de 3, 4 y 5 cada una. Los dos estudios de casos y controles obtuvieron una puntuación de 3 y 4 cada uno, y los 3 estudios de series de casos se puntuaron con 2, 3 y 4 puntos respectivamente (Tablas 7 y 8). Por otra parte, los niveles de evidencia y recomendación se evaluaron según los criterios de Oxford Centre for Evidence-based Medicine (CEBM) (32) (versión de marzo 2009). A los tres ECAs se les asignó una valoración de 2b de nivel de evidencia; a los tres estudios de series de casos, nivel 4; y a los dos estudios de casos y controles, nivel 3b (Tabla 8). 6. Resultados Los estudios seleccionados están resumidos en la tabla 6. Sólo se ha extraído información cualitativa de los resultados de las intervenciones. No se ha realizado metanálisis cuantitativo de los resultados. 6.1. Propiedades histológicas del tejido muscular lesionado Las propiedades histológicas y bioquímicas del tejido muscular lesionado y en proceso de regeneración fueron estudiadas en dos estudios de casos y controles seleccionados (Tablas 6 y 9). Kääriäinen et al (15) practicaron un sección completa del músculo sóleo a 160 ratas con el fin de estudiar el proceso de regeneración y de cicatrización realizando un análisis biomecánico a los 5, 7, 10, 14, 21, 28 y 56. De forma mecánica y controlada se indujeron distensiones pasivas hasta la ruptura completa tanto del músculo lesionado, como del sano (control). Se detectó una ligera disminución del peso de los músculos lesionados entre los días 5 y 14 y más considerable, entre los días 21 y 56, en comparación con los controles. Entre los días 5 y 14 la carga de ruptura, la distensión y la energía específica aumentaron gradualmente, permaneciendo prácticamente inalterados a partir del día 10. Por otra parte, la fuerza de ruptura aumentó desde el día 5 hasta el final del experimento, hasta casi alcanzar el nivel de los controles. En cuanto al lugar de las nuevas rupturas, entre los días 5 y 7 los músculos lesionados se rompieron en la zona de lesión. El día 10 la ruptura ocurrió en las fibras sanas de la zona lesionada o vecina a ella. A partir del día 10 la ruptura de las fibras ocurrió en las miofibrillas intactas proximales a la zona lesionada, o bien vecinas a ella o a la unión miotendinosa (15). Lehto et al (17) practicaron una contusión estandarizada en 135 ratas y posteriormente las dividieron en cuatro grupos: grupo no tratado (NT), grupo inmovilizado hasta un máximo de 21 días (IM), grupos movilizados a los 2 y 5 días respectivamente (IM2-MO y IM5-MO). Las propiedades biológicas de sus tejidos musculares fueron analizadas a los 2, 5, 7, 21 y 56 días. Al principio el peso corporal disminuyó en todos los grupos. Su aumento se observó a partir de la primera semana en el grupo NT, y a partir de la tercera semana en los demás grupos, sobre todo en los dos grupos movilizados (IM2-MO y IM5-MO). El día dos, sobre todo en el grupo NT, se observó la presencia de las células inflamatorias, disrupción de las fibras musculares y necrosis, además la distribución de la fibronectina era más similar en el grupo IM, en comparación con el grupo NT, donde estaba presente a lo largo de los filamentos de fibrina. Los fibroblastos eran presentes en todos los grupos, al igual que el colágeno de tipo I y III. No se detectó la presencia de las células inflamatorias a partir del día 5. Además se detectaron numerosos miotubos, mioblastos y el recién formado tejido granular en todos los grupos, éste último además en el grupo IM2-MO era presente en el centro de la zona lesionada. Ese día también se observó la desaparición del hematoma en el grupo IM, aún presente en los demás grupos. Los fibroblastos y colágeno I eran presentes en toda la zona lesionada, salvo en el hematoma (17). El día 7 Lehto et al (17) detectaron la presencia del hematoma en los grupos NT e IM2MO. La penetración de las miofibrillas nuevas en el tejido granular era mayor en el grupo IM. La fibronectina se detectó en todos los grupos. El colágeno tipo I y tipo III eran presentes en todo el tejido de los grupos IM y IM5-MO y en la zona lesionada del grupo IM2-MO, salvo en el hematoma. La disminución del número de miotubos se observó el día 21, sobre todo en el grupo IM. Las fibras musculares estaban presentes en el tejido lesionado en todos los grupos, pero más ordenado en el grupo IM5-MO. En todos los grupos se detectaron la fibronectina y colágeno tipo III con distribución similar en el tejido cicatricial, igualmente esparcidos en la zona lesionada y cerca de estructuras engrosadas de endomisio y perimisio. En los grupos IM2MO y IM5-MO había ligeramente menos fibronectina que en los grupos NT y IM (17). Al final del experimento, el día 56 Lehto et al (17) constataron un cicatriz fibrosa más prominente en el grupo IM2-MO, pero aún presente en todos los grupos. En los grupos IM y IM2-MO había mayor número de fibras musculares regeneradoras en el tejido cicatricial y una gran parte de ellas de menor diámetro en el la zona sana. La orientación de miofibrillas era más compleja e interenlazada en los grupos IM y NT y más paralela en el grupo IM5-MO. La Fibronectina, más intensa y densa en el grupo IM y más reducida en el grupo IM5-MO, y el colágeno tipo III estaban ampliamente distribuidos en la zona lesionada y en el engrosado endomisio y perimisio adyacente. En los grupos NT, IM2-MO y IM5-MO el colágeno tipo I era más visible en la zona lesionada y menos presente en el endomisio adyacente, pero más presente en la estructura de perimisio, sobretodo en aquel paralelo a las fibras musculares originales (17). 6.2. Tiempo de inmovilización e inicio de movilización En los estudios seleccionados la duración de la inmovilización inmediata tras la lesión varía de entre 24 y 48 horas, en función de la severidad y el tipo de la lesión muscular. La aplicación del programa de rehabilitación fue realizada inmediatamente después de este periodo inicial de inmovilización, al segundo o tercer día. Lamentablemente en los estudios de Askling et al (2) y Sherry y Best (28) no se especifica el tiempo de inmovilización inicial y tampoco ha sido posible obtener esa información directamente de los autores. Los resúmenes de los tiempos de inmovilización y del inicio de la movilización están disponibles en la tabla 5. Así en la comparativa de dos programas de rehabilitación para el tratamiento de las lesiones de la musculatura isquiotibial de segunda grado realizados en atletas griegos por Malliaropoulos et al (19) el tiempo de inmovilización aplicado fue de 48 horas. Al tercer día todos los participantes empezaron uno de los dos programas de rehabilitación asignado, consistentes en: grupo A realizaba 4 repeticiones de estiramientos estáticos de la musculatura lesionada mantenidas durante 30 segundos, una vez al día; el grupo B, en cambio, realizaba el mismo estiramiento, pero 4 veces al día. Askling et al (2) compararon dos programas de rehabilitación en jugadores de fútbol suecos diagnosticados, y confirmados por resonancia magnética, de lesión aguda de la musculatura isquiotibial. Dicho estudio no especifica la duración de la inmovilización inicial practicada. Todos los participantes iniciaron uno de los dos programas de rehabilitación al quinto día. Los dos grupos realizaron tres tipos de ejercicios consistentes en 1) aumento de flexibilidad, 2) ejercicios combinados de fuerza y estabilidad de tronco y pelvis, 3) ejercicio específico de fuerza. La diferencia entre los dos protocolos consistía en que los participantes en el protocolo de elongación (L-protocol) practicaban mayor carga de elongación extensiva de los músculos isquiotibiales. Por otra parte, los participantes de ejercicios más convencionales (C-protocol) realizaban menor énfasis en la elongación muscular. Sherry y Best (28) tampoco especifican el tiempo de inmovilización tras la lesión. Por su parte el tiempo medio de inicio de la rehabilitación fue de 3.4 días (rango 1-10 días) en el PATS Group y 4.1 días (rango 2-10 días) en el STST Group. Se llevó a cabo una comparativa de dos protocolos de tratamiento de distensiones agudas de la musculatura isquiotibial en atletas. Uno de los tratamientos consistía en estiramiento estático, ejercicios progresivos de resistencia y crioterapia (STST Group) y el otro grupo realizó un programa progresivo de agilidad y estabilidad de tronco y crioterapia (PATS Group). A los 47 militares con contusión en el músculo cuádriceps de Aronen et al (1) se les practicó una inmovilización continua de 24 horas. Transcurrido ese tiempo, se permitió a los participantes realizar estiramientos activos varias veces al día y practicar ejercicios isométricos cuando fuera posible, dentro de los límites del dolor. En los dos casos reportados por Grosclaude et al (6) se realizó una inmovilización de 48 horas tras la lesión del músculo redondo menor y la rehabilitación, consistente en estiramientos suaves y submáximo fortalecimiento excéntrico dentro de los límites del dolor, se inició al tercer día. La única atleta del estudio de Natsis et al (23) con una distensión bilateral del recto femoral también fue inmovilizada durante las primeras 48 horas. Al tercer día empezó el tratamiento, consistente en ejercicios isométricos dentro de los límites del dolor y estiramientos activos de 15 minutos al día. A efectos de las diferencias que suponen los distintos tiempos de inmovilización en el proceso de regeneración y cicatrización muscular, hay que destacar los resultados obtenidos por Lehto et al (17), ya descritos en el apartado anterior. De sus resultados se aprecia la importancia de la inmovilización inmediata de al menos 2 días de duración, y el inicio de la actividad muscular como muy tarde a partir del quinto día. Por otra parte, en las ratas estudiadas por Kääriäinen et al (15), que no fueron sometidas a la inmovilización inmediata y fueron dejadas libres en sus jaulas, se observa que las condiciones óptimas de tejido lesionado se alcanzaron a partir del día 10. 6.3. Vuelta a la actividad física Los participantes que recibieron el tratamiento de elongación muscular (L-protocol) en el estudio de Aronen et al (1) tardaron significativamente menos tiempo en volver al entrenamiento habitual, en comparación con aquellos que recibieron un tratamiento más convencional (C-protocol), con una media de 28 días (rango 8-58 días) y 51 días (rango 12-94 días), respectivamente. Esa diferencia no fue tan significativa en los resultados obtenidos por Sherry y Best (28). Los atletas que realizaron rehabilitación de estiramientos estáticos (STST Group) tardaron de media 37.4 días (rango 10-95 días), en comparación con los 22.2 días (rango 10-35) de los que participaron en ejercicios de progresiva agilidad y estabilidad de tronco (PATS Group). El tiempo de vuelta a las actividades deportivas sin restricciones también fueron significativamente diferentes entre los dos grupos de Malliaropoulos et al (19). Así el grupo A, que realizaba la rehabilitación una vez al día, tardó de media 15 días, en comparación con el grupo B, que realizaba los mismos ejercicios 4 veces al día, que tardó 13 días. En el caso 47 militares con contusiones de cuádriceps descritos por Aronen et al (1) el tiempo medio para la vuelta a la actividad física sin restricciones fue de 3.5 días (rango2-5 días). Los dos atletas con la lesión del músculo redondo mayor de Grosclaude et al (6) volvieron a la actividad deportiva a los 5 y 7 días, respectivamente. Ese tiempo fue mayor en el caso descrito por Natsis et al (23). La atleta con la lesión bilateral del músculo recto femoral tardó 8 semanas en volver a sus actividades deportivas habituales. 6.4. Recidivas y complicaciones a largo plazo Los datos de las recidivas y complicaciones detectadas en los seguimientos sucesivos están resumidos en la tabla 5. Así Aronen et al (1) describieron un solo caso de miositis osificante en sus seguimientos de 3 y 6 meses. Askling et al (2) detectaron un caso de recidiva en el seguimiento de 12 meses en el grupo de ejercicios convencionales (C-protocol). Sherry y Best (28) detectaron un 54.5% de casos de recidivas en el grupo de estiramientos estáticos (STST Group) y un 0% en el grupo de agilidad progresiva y estabilidad de tronco (PATS Group) en los primeros 16 días tras la vuelta a la actividad deportiva. En un año esta incidencia fue del 70% y del 7.7% respectivamente. Por el contrario, Natsis et al (23) y Grosclaude et al (6) no observaron complicaciones o recidivas en los seguimientos de 3 y 6 meses, y de 1 y 2 años, respectivamente. 7. Discusión La presente revisión bibliográfica se ha realizado con el fin de determinar el tiempo óptimo de inmovilización en el tratamiento de las lesiones musculares tomando en cuenta tanto los procesos fisiológicos subyacentes a la regeneración tisular, como a la aplicación de éstos a la práctica clínica. Con este objetivo se han seleccionado y analizado cualitativamente 8 estudios; 3 ensayos clínicos aleatorizados, 3 estudios de series de casos y 2 estudios de casos y controles, con unos niveles de recomendación entre favorables y favorables, pero no concluyentes (escala Oxford CEBM (24), tabla 8). En consecuencia, las observaciones, que se presentan a continuación, se deben de interpretan a la luz de estos nivel de evidencias y recomendación. 7.1. Tiempo óptimo de inmovilización e inicio de la movilización Uno de los principales objetivos de la inmediata inmovilización es limitar la propagación del hematoma, favoreciendo así la correcta cicatrización y regeneración de las fibras musculares dañadas (17). Según los resultados obtenido por Lehto et al (17) el tiempo de inmovilización ha de ser como mínimo de 2 días, para que se produzca una óptima reabsorción del hematoma, una temprana penetración de los fibroblastos y del colágeno tipo I. La presencia del colágeno de tipo I le confieren una mayor fuerza tensil al músculo lesionado y su mayor presencia se ha observado en las ratas inmovilizadas durante los 5 primeros días. Además una inmovilización de esta duración también parece favorecer la penetración del colágeno de tipo I y III y de la fibronectina en la zona lesionada (17). Por tanto, basándose en las propiedades histológicas del tejido muscular lesionado, la inmovilización inicial ha de durar de entre 2 y 5 días. En la práctica la duración de la inmovilización varía entre 24(1) y 48(6, 19, 23) horas. Esta variación en los tiempos de inmovilización se puede deber, principalmente, a la severidad y al tipo de las lesiones tratadas. Así, por ejemplo, Grosclaude et al (6), Malliaropoulos et al (19) y Natsis et al (23) trataron las distensiones musculares con una inmovilización de 48 horas. En cambio, Aronen et al (1) aplicaron un inmovilización de tan solo 24 horas, para el tratamiento de las contusiones musculares. Por otra parte la no inmovilización o una inmovilización demasiado prolongada son igualmente perjudiciales para una óptima regeneración muscular. Eso explicaría que en el estudio de Lehto et al (17) la penetración de las miofibrillas en el tejido granular y su orientación más ordenada y fisiológica era mayor tras una inmovilización de 5 días, y más desorganizada en los grupos que se trataron con mayor inmovilización (IM) y grupo no tratado (NT). A la hora de practicar una inmovilización prolongada también hay que tener en cuenta la resultante atrofia muscular. En los resultados obtenidos por Lehto et al (17) una prolongada inmovilización se tradujo en la pérdida de la masa muscular y la consiguiente atrofia. La pérdida de peso observada por Kääriäinen et al (15) se podría atribuir a la relativa inactividad física de las ratas participantes. A pesar de que los animales fueron dejados libres en las jaulas, el músculo sóleo es un músculo de menor actividad, además hay que tener en cuenta la completa denervación en el extremo distal resultante de una sección completa. Por tanto, es aconsejable que el programa de rehabilitación incorpore medidas enfocadas a evitar la atrofia muscular, tales como contracciones isométricas dentro de los límites del dolor, o mediante la electroestimulación. En Kääriäinen et al (15) el tejido lesionado ha alcanzado, prácticamente, su máxima capacidad tensil a partir del día 10. Esto sugeriría que hasta este momento todas las acciones terapéuticas se tendrían que realizar con precaución, para evitar una nueva ruptura fibrilar. Pero hay que destacar, que estos resultados no son extrapolables al tratamientos de sujetos humanos, por dos razones: 1) en la práctica deportiva es poco probable que se produzcan secciones tan limpias y uniformes, y 2) en el caso de que estos se produjera, se aplicaría algún tipo de tratamiento inmediato, consistente, con seguridad, en un tiempo de inmovilización inmediata. Aunque lo que sí podemos deducir es que si se respetan los tiempos de cicatrización adecuados, el riesgo de una nueva ruptura en la zona de la lesión será reducido. Aronen et al (1), Grosclaude et al (6) y Natsis et al (23) utilizan un indicador subjetivo del tiempo de inmovilización necesario tras una lesión. A todos los sujetos participantes en estos estudios se les permitió empezar los ejercicios terapéuticos, siempre y cuando se respetaran los límites del dolor. El dolor puede ser un buen mecanismo de protección y de indicación del momento más seguro para iniciar la movilización. Aunque, teniendo en cuenta las diferencias interpersonales del umbral y la experiencia del dolor y el carácter competitivo de los deportistas profesionales, su utilización como única herramienta para la determinación del momento más seguro para el inicio de la actividad física puede ser peligrosa. 7.2. Tiempo de recuperación ¿Pero qué tipo de movilización sería la más segura para iniciar un programa de rehabilitación, sin correr el riesgo de provocar una nueva lesión? Aunque el responder a esta pregunta no constituye objetivo principal del presente estudio, a la luz de los variados tiempos de recuperación obtenidos en los estudios seleccionados, se puede deducir que el tiempo de vuelta a las actividades deportiva sí depende, en menor o mayor medidas, del tipo de ejercicio físico escogido en el programa de rehabilitación, sin perder de vista otros factores, como el grado de la lesión, la preparación física y el estado trófico previos, la alimentación, etc. Así podemos ver que en el tratamiento de lesiones agudas de la musculatura isquiotibial, sean por distensión o por excesiva aceleración (excéntrica), el tiempo de recuperación es significativamente menor si se aplica un tratamiento de estiramiento extensivo durante la contracción excéntrica (imitando el mecanismo lesional), que ejercicios más convencionales, con menor énfasis en los estiramientos (Askling et at (2)). De los resultados de Askling et al (2) también se deduce que el tiempo de recuperación también depende del tipo de la lesión. Esto explicaría el hecho de que en las lesiones por distensión, el tiempo de vuelta a las actividades deportivas era mayor que en aquellas por excesiva aceleración, independientemente del tipo de protocolo seguido. En el tratamiento de las lesiones del mismo tipo, presentados por Sherry y Best (28) también vemos que el tiempo de recuperación también puede verse reducido si el programa de rehabilitación contempla un abordaje más global, incorporando ejercicios de agilidad y estabilización del tronco, en comparación con los ejercicios de estiramientos estáticos analíticos. Por último, la frecuencia de la aplicación del tratamiento es otro de los factores que influyen en el tiempo de recuperación. Malliaropoulos et al (19) demostraron esa hipótesis realizando el mismo tratamiento en los dos grupos de estudio, una o cuatro veces al día, respectivamente. Como resultado, el tiempo de rehabilitación entre los grupos era diferente, siendo menor en el los atletas que fueron sometidos a estiramientos estáticos 4 veces al día. No ha sido posible determinar la relación que tiene el tiempo de inmovilización practicado en el tiempo de recuperación necesitado, ya que ningún estudio provee esa información en sus resultados. Además para poder extrapolar la relación del tiempo de inmovilización con el tiempo de recuperación y el tipo de tratamiento aplicado haría falta realizar la misma comparativa entre distintos programas de rehabilitación. 7.3. Incidencias de recidivas En los análisis de los estudios seleccionados la incidencia de las recidivas y complicaciones a largo plazo está relacionada con el tipo del programa de rehabilitación seguidos por los atletas. Ninguno de los estudios relaciona esos hallazgos con el tiempo de inmovilización practicado, por tanto harían falta más estudios que analizaran la relación existente entre los índices de recidivas tanto con el tiempo de inmovilización y como el tipo de programa de rehabilitación. No obstante, se observa, que la incidencia de recidivas, al igual que el tiempo de recuperación, está estrechamente relacionada con el tipo de programa de rehabilitación escogido. Esto explicaría que el 54.5% de los atletas que participaron en el programa de estiramientos estáticos de Sherry y Best (28) volvieron a lesionarse en las primeras 2 semanas, en comparación con ningún atleta lesionado del programa de agilidad y estabilidad de tronco. A largo plazo, esos porcentajes fueron del 70% y 7.7%, respectivamente. Además en función de la gravedad de la lesión los análisis estadísticos no mostraron diferencias significativas en el tiempo necesario para la vuelta al deporte. Así se deduce que el alto índice de recidivas no se debe a una precipitada vuelta a la actividad deportiva, o al mayor grado de la lesión sufrida en el grupo de estiramientos estáticos. Lo mismo se puede concluir de los resultados obtenidos por Askling et al (2), con un caso de nueva lesión en el grupo de ejercicios convencionales. 7.4. Limitaciones del estudio El reducido número de los artículos a los que se ha tenido acceso representa una de las principales limitaciones del presente estudio, debido, principalmente, a la exigencia de los criterios de exclusión. Además ha sido imposible determinar la existencia de una relación entre el tiempo de inmovilización, la duración de la recuperación y la incidencia de las recidivas. Esto se debe, principalmente, a dos factores: 1) la no disponibilidad de dicho análisis en los estudios seleccionados, 2) la imposibilidad de llevar a cabo un metanálisis de los resultados de los estudios seleccionados. Entre otras limitaciones del presente trabajo se puede citar: la no disponibilidad de texto completo de otros estudios preseleccionados y la no disponibilidad de más estudios en sujetos humanos. Con respecto a esto último hay que destacar que la realización de una comparativa de dos programas de rehabilitación, o de distintos tiempo de inmovilización tras la lesión en atletas profesionales en sí significa una limitación. Estos profesionales del deporte no están dispuestos a correr el riesgo de recibir un tratamiento de menor efectividad, o someterse a distintos tiempos de inmovilización sin garantías de que el tratamiento recibido sea el que garantice una óptima recuperación. 8. Conclusiones En el tratamiento de las lesiones musculares la inmediata inmovilización ayuda a controlar la inflamación y el tamaño del hematoma, que suponen un obstáculo para una óptima cicatrización y un retraso del proceso de regeneración (17). Una inmovilización prolongada de más de 2 días ayuda a su reabsorción, pero tiene como efecto secundario la atrofia muscular (15, 17). El tiempo máximo de inmovilización y el de inicio de movilización ha de ser como mínimo de 24 horas y máximo de 5 días, en función del grado de la lesión muscular. Estos límites temporales serían suficientes para respetar los plazos de cicatrización y evitar las recidivas (15, 17). A la hora de iniciar un programa de rehabilitación hay que empezar con los ejercicios de menor exigencia tensil, ya que la cicatriz no obtiene capacidad óptima para soportar fuerza de tensión hasta el día 10. A tal respecto también se puede utilizar el dolor como una guía (1, 6, 23) del límite de la capacidad contráctil o de distensión del músculo. El tiempo de recuperación y la incidencia de recidivas dependen del tipo de programa de rehabilitación escogido, de su nivel de exigencia y frecuencia de su práctica (2, 6, 19, 28). Pero no se ha podido determinar en qué medida influye el tiempo de inmovilización en estos factores. Por lo tanto hace falta más investigación para poder determinar la relación existente entre el tiempo de inmovilización y el tiempo de recuperación y las recidivas. 9. Referencias 1. Aronen JG, Garrick JG, Chronister RD, McDevitt ER, Quadriceps contusions: clinical results of immediate immobilization in 120 degrees of knee flexion. Clin J Sport Med. 2006 Sep;16(5):383-7. 2. Askling CM, Tengvar M, Tarassova O, Thorstensson A, Acute hamstring injuries in Swedish elite sprinters and jumpers: a prospective randomised controlled clinical trial comparing two rehabilitation protocols. Br J Sports Med. 2014 Apr;48(7):532-9. 3. Baoge L, Van Den Steen E, Rimbaut S, Philips N, Witvrouw E, Almqvist KF, Vanderstraeten G, Vanden Bossche LC, Treatment of skeletal muscle injury: a review. ISRN Orthop. 2012 Apr 26;2012. 4. Delos D, Maak TG, Rodeo SA, Muscle injuries in athletes: enhancing recovery through scientific understanding and novel therapies. Sports Health. 2013 Jul;5(4):346-52. 5. Eiff MP, Smith AT, Smith GE, Early mobilisation versus immobilisation in the treatment of lateral ankle sprains. Am J Sports Med. 1994 Jan-Feb;22(1):83–88. 6. Grosclaude M, Najihi N, Lädermann A, Menetrey J, Ziltener JL. Teres major muscle tear in two professional ice hockey players: cases study and literature review. Orthop Traumatol Surg Res. 2012 Feb;98(1):122-5. 7. Hoskins W, Pollard H, Hamstring injury management-Part 2: Treatment. Man Ther. 2005 Aug;10(3):180-90. 8. Houglum PA, Soft tissue healing and its impact on rehabilitation. J Sport Rehab. 1992;1:19–39. 9. Ingemann-Hensen T, Halkjaer-Kristensen J, Physical training of the hypotrophic quadriceps muscle in man. Scand J Rehab Med Suppl. 1983; 15(1):23-35. 10. Järvinen MJ, Lehto MU. The effects of early mobilisation and immobilisation on the healing process following muscle injuries. Sports Med. 1993 Feb;15(2):78-89. 11. Järvinen TA, Järvinen M, Kalimo H, Regeneration of injured skeletal muscle after the injury. Muscles Ligaments Tendons J. 2014 Feb 24;3(4):337-45. 12. Järvinen TA, Järvinen TL, Kääriäinen M, Aärimaa V, Vaittinen S, Kalimo H, Järvinen M, Muscle injuries: optimising recovery. Best Pract Res Clin Rheumatol. 2007 Apr;21(2):317-31. 13. Järvinen TA, Kääriäinen M, Järvinen M, Kalimo H, Muscle strain injuries. Curr Opin Rheumatol. 2000 Mar;12(2):155-61. 14. Jiménez Diaz F, Goitz H, Bouffard Antonio, Diagnóstico clínico y ecográfico de las lesiones musculares. Archivos de Medicina del Deporte. 2010 Nov; 140:465-476. 15. Kääriäinen M, Kääriäinen J, Järvinen TL, Sievänen H, Kalimo H, Järvinen M, Correlation between biomechanical and structural changes during the regeneration of skeletal muscle after laceration injury. J Orthop Res. 1998 Mar;16(2):197-206. 16. Kellet J, Acute soft tissue injuries - a review of the literature. Med Sci Sports Exerc. 1986 Oct;18(5):489-500. 17. Lehto M, Duance VC, Restall D, Collagen and fibronectin in a healing skeletal muscle injury. An immunohistological study of the effects of physical activity on the repair of injured gastrocnemius muscle in the rat. J Bone Joint Surg Br. 1985 Nov;67(5):820-8. 18. Longo UG, Loppini M, Berton A, Spiezia F, Maffulli N, Denaro V. Tissue engineered strategies for skeletal muscle injury. Stem Cells Int. 2012;2012. 19. Malliaropoulos N, Papalexandris S, Papalada A, Papacostas E, The role of stretching in rehabilitation of hamstring injuries: 80 athletes follow-up. Med Sci Sports Exerc. 2004 May;36(5):756-9. 20. McCarthy MR, Yates CK, Anderson MA, Yates-McCarthy JL, The effects of immediate continuous passive motion on pain during the inflammatory phase of soft tissue healing following anterior cruciate ligament reconstruction. J Orthop Sports Phys Ther. 1993 Feb;17(2):96-101. 21. Ménétrey J, Current concept: Muscle injuries. Schweizerische Zeitschrift fuer Sportmedizin und Sporttraumatologie. 2000;48(1):44-47. 22. Moreno Pascual C, Rodríguez Pérez V, Seco Calvo J., Epidemiología de las lesiones deportivas. Fiosterapia 2008:30 (1): 40-8. 23. Natsis K, Lyrtzis C, Noussios G, Papathanasiou E, Anastasopoulos N, Totlis T, Bilateral rectus femoris intramuscular haematoma following simultaneous quadriceps strain in an athlete: a case report. J Med Case Rep. 2010 Feb 18;4:56. 24. OCEBM Levels of Evidence Working Group. “The Oxford Levels of Evidence 2″. Oxford Centre for Evidence-Based Medicine. Disponible en: http://www.cebm.net/ocebmlevels-of-evidence/. Acceso Mayo 2015. 25. Orchard J, Best TM, The management of muscle strain injuries: an early return versus the risk of recurrence. Clin J Sport Med. 2002 Jan;12(1):3-5. 26. Petersen J, Hölmich P, Evidence based prevention of hamstring injuries in sport. Br J Sports Med. 2005 Jun;39(6):319-23. 27. Physiotherapy Evidence Database (PEDro). PEDro Scale. Disponible en: http://www.pedro.org.au/spanish/downloads/pedro-scale/. Acceso Mayo 2015. 28. Sherry MA, Best TM, A comparison of 2 rehabilitation programs in the treatment of acute hamstring strains. J Orthop Sports Phys Ther. 2004 Mar;34(3):116-25. 29. The Chartered Society of Physiotherapy. Guidelines for the physiotherapy management of soft tissue (musculoskeletal) injury with protection, rest, ice, compression and elevation (PRICE) during the first 72 hours. London: The Chartered Society of Physiotherapy; 1998. 30. van den Bekerom MP, Struijs PA, Blankevoort L, Welling L, van Dijk CN, Kerkhoffs GM, What is the evidence for rest, ice, compression, and elevation therapy in the treatment of ankle sprains in adults? J Athl Train. 2012 Jul-Aug; 47(4):435-43. 31. Woo SL, Buckwalter JA, AAOS/NIH/ORS workshop. Injury and repair of the musculoskeletal soft tissues. Savannah, Georgia, June 18-20, 1987. J Orthop Res. 1988;6(6):907-31. 10. Anexos Tabla 1: Clasificación de las lesiones musculares desde el punto de vista clínico Datos clínicos Grado I Grado II Grado III Dolor Leve Intensidad media Muy intenso Incapacidad Escasa restricción de Pérdida de capacidad Pérdida completa de movimientos de contracción la función muscular Leve Moderado Grave Pronóstico * tabla elaborada según los datos de Jiménez Díaz et al (14). Tabla 2: Términos de búsqueda en PEDro Término de búsqueda muscle AND rice Rest Ice Compression Elevation muscle injur* mobilisation muscle damage rest muscle injur* immobiliz* muscle injur* rest muscle strain* muscle tear* muscle rupture pulled muscle muscle injur* Parámetros adicionales AND AND AND, Clinical Trial AND, Clinical Trial AND, Clinical Trial AND, AND, Clinical Trial AND, Clinical Trial AND, Clinical Trial AND, Clinical Trial AND, Systematic Review Tabla 3: Términos de búsqueda en PubMed Términos de búsqueda: early mobilization AND Immobilization "early mobilisation"[All Fields] OR ("early"[All Fields] AND "mobilisation"[All Fields]) OR "early mobilization"[All Fields] OR ("early"[All Fields] AND "mobilization"[All Fields]) AND (("muscles"[MeSH Terms] OR "muscles"[All Fields] OR "muscle"[All Fields]) AND ("wounds and injuries"[MeSH Terms] OR ("wounds"[All Fields] AND "injuries"[All Fields]) OR "wounds and injuries"[All Fields] OR "injury"[All Fields])) AND Review[ptyp] Términos de búsqueda: ice AND rest AND compression AND elevation AND muscle ("ice"[MeSH Terms] OR "ice"[All Fields]) AND ("rest"[MeSH Terms] OR "rest"[All Fields]) AND "compression"[All Fields] AND elevation[All Fields] AND ("muscles"[MeSH Terms] OR "muscles"[All Fields] OR "muscle"[All Fields]) Términos de búsqueda: muscle injur* AND immobilization (muscle injured[All Fields] OR muscle injures[All Fields] OR muscle injuries[All Fields] OR muscle injury[All Fields]) AND ("immobilisation"[All Fields] OR "immobilization"[MeSH Terms] OR "immobilization"[All Fields]) Tabla 4: Estudios seleccionados Autor País Año Tipo de Estudio Aronen et al (1) Askling et al (2) EEUU Suecia 2006 2013 Grosclaude et al (6) Kääriäinen et al (15) Lehto et al (17) Suiza 2011 Series de casos Ensayo clínico aleatorizado prospectivo Series de casos Finlandia 1998 Finlandia 1985 Malliaropoulos et al (19) Grecia 2004 Natsis et al (23) Sherry y Best (28) Grecia EEUU 2010 2004 Casos y controles Casos y controles Ensayo clínico aleatorizado prospectivo Series de casos Ensayo clínico aleatorizado Nº de participantes 47 75 Intervención 2 RICE 48 horas, estiramientos suaves, fortalecimiento eccéntrico submaximo Sección completa del músculo sóleo, sin intervención 160 96 80 1 24 Mantenimiento de la rodilla en flexión de 120 grados Ejercicios de estiramiento, ejercicios convencionales Sin intervención, inmovilización, inmovilización inicial y movilización a los 2 y 5 días RICE 48 horas, estiramientos estáticos Estiramiento activo, ejercicios isométricos Estiramientos estáticos, ejercicios de resistencia, crioterapia, ejercicios de agilidad progresivos, ejercicios de estabilidad de tronco Tabla 5: Datos extraídos Autor Tiempo de Inmovilización Inicio de Movilización/Ejercicio Vuelta a la Actividad Física Recidivas/Complicaciones Aronen et al (1) 24 h. 24 h. 3.5 días (rango 2-5 días) 1 caso de miositis osificante a los 3 y 6 meses Askling et al (2) No indicado 5º día 28 días (rango 8-58 ) L-protocol 1 caso de lesión en 12 meses en el grupo de C-protocol 51 días (rango 12-94) C-protocol Grosclaude et al (6) 48 h. 3er día 5 y 7 días Sin recidiva en seguimientos de 1 y 2 años Kääriäinen et al (15) No inmovilizado Inmediata N/A N/A Lehto et al (17) No inmovilizado Inmediata N/A N/A Inmediata 2º día 15,05 días (grupo A) N/D 5º día Malliaropoulos et al (19) 48 h. 3er día Natsis et al (23) 48 h. 3er día 8 semanas Sin complicaciones en seguimientos de 3 y 6 meses Sherry y Best (28) No indicado 4.1 días (STST group) 37.4 días (rango 10-95) STST group 6 atletas (54.5%) del STST Group y ningún atleta (0%) en el PATS group en 16 días tras la vuelta al deporte. 22.2 días (rango 10-35) PATS group 7 atletas (70%) del STST Group y 1 (7.7%) del PATS Group en un años tras la lesión. 13.27 días (grupo B) 3.4 días (PATS group) Tabla 6: Resumen de estudios seleccionados Autor y Tipo de Estudio Aronen et al (1) Series de casos Participantes Grupos Guardias marinas de la naviera de los EEUU con contusiones de cuádriceps que participaban en actividades deportivas Inmovilización inmediata en 120º de flexión de rodilla n=47 (Sin grupo de control) Askling et al (2) Ensayo clínico aleatorizado Jugadores de elite de fútbol de Suecia, hombre y mujeres, con lesión aguda de musculatura isquiotibial (prospectivo) Estiramiento extensivo de la musculatura durante la contracción excéntrica (L-protocol) n=38 Ejercicios convencionales de la musculatura con menor énfasis en estiramiento (Cprotocol) Intervención Medidas Resultados Estiramiento activo de cuádriceps varias veces al día y ejercicios de fortalecimiento isométricos Tiempo medio desde la lesión hasta la vuelta completa a la actividad física. Seguimiento a los 3 y 6 meses para valorar la incidencia de miositis osificante. Tiempo medio de vuelta a la actividad deportiva fue de 3,5 días (rango de 2 a 5 días). No hubo casos de nuevas lesiones y solo 1 caso de miositis osificante 3 ejercicios diferentes: Tiempo de vuelta a la actividad deportiva desde la lesión. 28 días (1SD±15, rango 8-58 días) en L-protocol y 51 días (1SD±21, rango 12-94 días) en Cprotocol. 1. mejora de la flexibilidad, 2. ejercicios combinados de fuerza y estabilización de la pelvis, Casos de nuevas lesiones en el periodo de 12 meses. 1 caso de lesión en 12 meses en el grupo de Cprotocol 3. ejercicios más específicos de fuerza n=38 Grosclaude et al (6) Series de casos Jugadores masculinos de hockey profesional con distensión del músculo redondo mayor, n=2 Caso 1: varón de 28 años Caso 2: varón de 41 años RICE 48 horas, estiramientos suaves, fortalecimiento eccéntrico submaximo Vuelta a la actividad deportiva 5 días (caso 1) 7 días (caso 2) Kääriäinen et al (15) Casos y controles Ratas machos con sección completa del músculo sóleo, n=160 Group 1, sección completa bilateral del músculo sóleo, examen de cambios histológico, n=28 (prospectivo) Group 2, sección completa unilateral del músculo sóleo, examen de propiedades biomecánicas, n=72 Group 3, control, evaluación de la reproducibilidad del modelo de traumatización, examen de propiedades mecánicas n=60 Tras la inducción de la lesión y sutura, los sujetos se quedaron en las jaulas, con posibilidad de moverse libremente A los 5, 7, 10, 14, 21, 28 y 56 días fueron matados (aleatoriamente) y se analizaron las propiedades histológicas de sus tejidos musculares Se infligió una lesión del músculo sóleo por distensión con la ayuda de un aparato, para analizar sus propiedades biomecánicas. Peso muscular Carga de ruptura Fuerza de ruptura Distensión Energía específica Sitio de ruptura Reproducibilidad El peso del músculo lesionado era ligeramente más bajo que el de los controles del día 5 al día 14. Entre los días 21 y 56 el peso de los músculos seccionados disminuyó significativamente en comparación con los controles. La carga de ruptura incrementó gradualmente entre los días 5 y 14, y se mantuvo al 50% hasta el final del experimento. Después del día 10 no ha habido cambios significativos en la carga de ruptura. La fuerza de ruptura aumento desde el día 5 hasta el días 56 casi al nivel de los controles. La distensión aumentó del 35% del valor de control el día 5 al 62% el día 14. Después del día 10 los valores de distensión se mantuvieron virtualmente inalterados. La energía específica aumentó entre los días 5 y 10 de 4,5 a 36% de valores de control y se mantuvo así hasta el día 56. No ha habido cambios significativos de energía específica a partir del día 10. El músculo se rompió en la zona de lesión en los días 5 y 7. El día 10 la ruptura ocurrió en las fibras sanas, o bien de la zona lesionada o vecina a ella. Después del día 10 el fallo ocurrió en las miofibrillas intactas proximales a la zona lesionada, o bien vecinas a ella o a la unión miotendinosa proximal. Se ha obtenido un consenso del 95%. La variabilidad inherente interextremidades, dependiente de la variabilidad, se puede comparar con la variabilidad interanimal observada para las mismas propiedades. En cuanto a la reproducibilidad de la fuerza y la carga de ruptura, la traumatización, aparentemente, introdujo variabilidad adicional (doble). Lehto et al (17) Casos y controles (prospectivo) Ratas macho con contusión aguda de pantorrilla, n=135 Group NT, sin tratamiento específico, libres en la jaula tras la lesión. Group IM, inmovilizados hasta un máximo de 21 días. Group IM2-MO, inmovilizados 2 días. Group IM5-MO, inmovilizados 5 días. Sin tratamiento Inmovilización hasta un máximo de 21 días Ejercicios activos en cinta de correr motorizada Medidas realizadas en los días 2, 5, 7, 21 y 56: Peso corporal Medidas histológicas: células inflamatorias, fibroblástos, hematoma, miotubos, mioblastos, cicatriz fibrosa. Medidas inmunohistológicas: fibronectina, fibrina, colágerno tipo I, III, IV y V, tejido granular. El peso corporal disminuyó inicialmente en todos los grupos. Grupo NT aumentó el peso una semana después. En los grupos IM, IM2-MO y IM5-MO aumentó 3 semanas después. Los dos grupos movilizados ganaron más peso que el inmovilizado (IM). Día 2: disrupción y necrosis de fibras musculares, células inflamatorias, sobre todo en el grupo NT. Fibroblastos en ambos grupos. La distribución fibronectina era más igual en el grupo IM a lo largo de toda la lesión, en comparación con el grupo NT, donde estaba presente a lo largo de los filamentos de fibrina. La distribución de los colágeno I y III fue similar, también presente en estructuras endomisiales de fibras musculares intactas. En algunos grupos, sobre todo IM, presencia de colágeno tipo III en la zona lesionada. Colágeno tipo IV y V solo presente en el endomisio. Días 5: hematoma aún presente en los grupos NT y IM2-MO, pero casi completamente desaparecido del grupo IM. Células inflamatorias casi desaparecidas, numerosos miotubos y mioblastos en todos los grupos. Fibroblastos en toda la zona lesionadas salvo en el hematoma. Tejido granular recién formado en todos los grupos, y en el grupo IM2-MO también en el centro de la zona lesionada a lo largo de los filamentos de fibrina. Colágeno tipo I en el grupo IM presente de forma general salvo en la zona del hematoma. Colágeno tipo III en el tejido granular en todos los grupos. Colágeno tipo IV y V presente en el endomisio y en algunos sitios del tejido granular. Día 7: hematoma aún presente en los grupo NT in IM2-MO, pero menor que en el día 5. No detectado en grupo IM y IM5-MO. Las fibras musculares regeneradoras empezaron la penetración en el tejido granular, más enlazadas en el grupo IM. Fibronectina detectada en todos los grupos. Colágeno tipo I detectado en todo el tejido granulas de los grupos IM y IM5-MO y en la zona lesionada en el grupo IM2-MO excepto en el hematoma. Colágeno tipo III distribuido de forma similar, salvo que no estaba presente en el hematoma del grupo IM2-MO. Colágeno tipo IV y V presente en el endomisio. Día 21: En todos los grupos, sobre todo grupo IM, disminución del número de miotubos. Células musculares gigantes abundantes en el grupo IM, pero menor en otros grupos. Fibras musculares regeneradoras en el tejido lesionado en todos los grupos, pero su organización menos interenlazada en el grupo IM5-MO. En todos los grupos la fibronectina y colágeno tipo III con distribución similar en el tejido cicatricial, igualmente esparcidos en la zona lesionada y cerca de estructuras engrosadas de endomisio y perimisio. Fibronectina además presente en los contornos de fibras musculares. En los grupo IM2-MO y IM5-MO ligeramente menos fibronectina que en los grupos NT y IM. Colágeno tipo IV y V muy presente en el endomisio de las fibras musculares regeneradoras de la zona lesionada. Pero la presencia de este tipo de colágeno era más clara en las fibras no lesionadas. En los grupo IM2MO y IM5-MO el colágeno tipo V era mas numerosos alrededor de fibras musculares regeneradas que en los grupos NT y IM. Día 56: cicatriz fibrosa más prominente en el grupo IM2-MO, pero presente en todos los grupos. Mayor número de fibras musculares regeneradoras en el tejido cicatricial. Gran porcentaje de ellas de menor diámetro en el la zona sana, especialmente en grupo IM y IM2MO. Ausencia de fibras musculares gigantes y miotubos. La orientación de miofibrillas regeneradas compleja e interenlazada en los grupos IM y NT y más paralela en el grupo IM5MO. Fibronectina y colágeno tipo III ampliamente distribuido en la zona lesionada y en el engrosado endomisio y perimisio adyacente. Fibronectina más intensa y densa en el grupo IM y más reducida en el grupo IM5MO. Colágeno tipo I ampliamente distribuido en la cicatriz en el grupo IM y en el engrosado endomisio y perimisio cercano. En los grupo NO, IM5-MO y IM5-MO el colágeno tipo I era más visible en la zona lesionada y menos presente en el endomisio adyacente, pero más presente en la estructura de perimisio, sobretodo en aquel paralelo a las fibras musculares originales. Colágeno tipo IV y V detectado en el endomisio de las fibras sanas y regeneradas. Pocas mifibrillas regeneradoras en el tejido cicatricial, más abundante en los grupos IM y IM2-MO. En todos los grupos algunas estructuras de endomisio en la zona lesionada tenían forma curvada, debido al tejido conectivo cicatricial. Malliaropoulos et al (19) Ensayo clínico aleatorizado Atletas griegos de ambos sexos con lesión de la musculatura isquiotibial por distensión de grado 2, n=80 (prospectivo) Natsis et al (23) Serie de casos Remadora profesional griega, n=1 Grupo A: estiramientos estáticos RICE primeras 48 h Grupo B: estiramientos estáticos RICE primeras 48 h Una atleta con distensión simultánea de ambos rectos femorales RICE 72 h Dolor Estiramientos activos Hematoma muscular medido con resonancia magnética Estiramientos estáticos, 1 sesión/día x 30’’ x 4 Estiramientos estáticos 4 sesiones/día x 30’’ x 4 Ejercicios isométricos Tiempo necesario para igualar la extensión activa con la rodilla sana Tiempo necesario para la completa rehabilitación Vuelta al entrenamiento Reanudación de las actividades deportivas y de competición Extensión activa: 7,3 (±0.525) días grupo A y 5,6 (±0.71) días grupo B. Tiempo de rehabilitación: 15,05 (±0.81) días grupo A y 13,27 (±0.71) días grupo B. 6 semanas después de la lesión función muscular indolora, imagen normal en la resonancia magnética y vuelta al entrenamiento. 8 semanas después reanudación de la actividad de competición. Sherry y Best (28) Atletas femeninos y masculinos con lesión por distensión de musculatura isquiotibial, n=24 STST Group: estiramiento y fuerza, n=11 estiramiento estático, ejercicios de resistencia progresiva y crioterapia Ensayo clínico aleatorizado (prospectivo) PATS Group: agilidad progresiva y estabilidad de tronco, n=13 Ejercicios progresivos de agilidad y estabilidad de tronco y crioterapia. Tiempo necesario para la vuelta al deporte STST group: 37,4 días (SD, 27,6; SE, 8,3; rango 10-95). PATS group: 22,2 días (SD, 8,3; SE, 2,3; rango 1035). Tiempo necesario para la vuelta al deporte en atletas que sufrieron recidiva en 2 semanas (n=6) y los que no la sufrieron (n=18) 35,2 días (SD, 26,7 días) en atletas con recidiva y 25,4 días (SD, 19,5 días) en atletas sin recidiva. Proporción de recidiva durantes las 2 primeras semanas 6 atletas (54.5%) del STST group sufrieron recidiva. Ningún atleta (0%) en el PATS group sufrió recidiva. Proporción de recidiva durantes el primer año primeras semanas 7 (70%) en el STST group. 1 (7,7%) en el PATS group. Número de días de rehabilitación 33,3 días (SD, 26,0; SE, 7,8; rango, 8-88 días) en el STST group. 18,8 días (SD, 9,4; SE, 2,6; rango 5-33 días) in el PATS group. Tabla 7: Valoración de calidad, escala PEDro 1. Los criterios de elección fueron especificados: 2. Los sujetos fueron asignados al azar a los grupos: 3. La asignación fue oculta: 4. Los grupos fueron similares al inicio en relación a los indicadores de pronóstico más importantes: 5. Todos los sujetos fueron cegados: 6. Todos los terapeutas que administraron la terapia fueron cegados: 7. Todos los evaluadores que midieron al menos un resultado clave fueron cegados: 8. Las medidas de al menos uno de los resultados clave fueron obtenidas de más del 85% de los sujetos inicialmente asignados a los grupos 9. Se presentaron resultados de todos los sujetos que recibieron tratamiento o fueron asignados al grupo control, o cuando esto no pudo ser, los datos para al menos un resultado clave fueron analizados por “intención de tratar” 10. Los resultados de comparaciones estadísticas entre grupos fueron informados para al menos un resultado clave 11. El estudio proporciona medidas puntuales y de variabilidad para al menos un resultado: Total sin tener en cuenta el criterio de elegibilidad: Aronen et al (1) 1 0 0 1 Askling et Grosclaude Kääriäinen Lehto et al al (2) et al (6) et al (15) (17) 1 0 0 0 1 0 0 0 0 0 1 1 1 1 1 1 Malliaropoul Natsis et al os et al (19) (23) 1 1 1 0 0 0 0 0 Sherry y Best (28) 1 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 1 1 0 0 0 1 1 1 0 1 1 1 0 1 0 0 1 0 1 0 1 0 1 1 1 0 1 0 1 0 1 4 5 3 5 3 3 2 4 Tabla 8: Niveles de evidencia y grados de recomendación Autor Tipo de estudio Escala PEDro (31) Escala Oxford CEBM (32) Aronen et al (1) Askling et al (2) Grosclaude et al (6) Kääriäinen et al (15) Lehto et al (17) Malliaropoulos et al (19) Natsis et al (23) Sherry y Best (28) SC ECA SC CC CC ECA SC ECA 4 5 3 4 3 3 2 4 4 2b 4 3b 3b 2b 4 2b Grado de Recomendación (CEBM) (32) C B C B B B C B Significado de los grados de recomendación (CEBM) (32) Favorable pero no concluyente Favorable Favorable pero no concluyente Favorable Favorable Favorable Favorable pero no concluyente Favorable Tabla 9: Resumen del estudio de Lehto et al Medición Peso corporal Células inflamatorias Fibronectina Hematoma Fibroblastos Colágeno tipo I Día Grupo NT Grupo IM Aumento a partir de semana 1 Aumento a partir de la semana 3 (+) 2 Presente (+++) Presente (+) Grupo IM2-MO Aumento a partir de la semana 3 (++) Presente (+) Gurpo IM5-MO Aumento a partir de la semana 3 (++) Presente (+) 5 2 Ausente A lo largo de los filamentos de fibrina Ausente N/D Ausente N/D 7 Presente en la zona lesionada Presente en la zona lesionada Presente en la zona lesionada Presente en la zona lesionada y en los contornos de las fibras y en los contornos de las y en los contornos de las y en los contornos de las musculares fibras musculares fibras musculares fibras musculares 21 En la zona lesionada, cerca del endomisio y perimisio, en el contorno de las fibras musculares (++) En la zona lesionada, cerca del endomisio y perimisio, en el contorno de las fibras musculares (++) En la zona lesionada, cerca del endomisio y perimisio, en el contorno de las fibras musculares (+) En la zona lesionada, cerca del endomisio y perimisio, en el contorno de las fibras musculares (+) 56 En el endomisio y perimisio (++) En el endomisio y perimisio (+++) En el endomisio y perimisio (++) En el endomisio y perimisio (+) 5 7 2 5 Presente (++) Presente (+) Presente Presten, salvo en el hematoma 2 5 Presente Presente, salvo en el hematoma Prácticamente desaparecido Ausente Presente Presente, salvo en el hematoma Presente Presente, salvo en el hematoma Presente (++) Presente (+) Presente Presente, salvo en el hematoma Presente Presente, salvo en el hematoma Presente (+) Ausente Presente Presente, salvo en el hematoma Presente Presente, salvo en el hematoma Ausente En toda la lesión Colágeno tipo III 7 N/D Presente en todo el tejido Presente en todo el tejido, salvo en el hematoma Presente en todo el tejido 56 En el tejido cicatricial (++) y cercano edomisio (+) y perimisio (+) En el tejido cicatricial (+) y cercano endomisio (++) y perimisio (++). En el tejido cicatricial (++) y cercano edomisio (+) y perimisio (+) En el tejido cicatricial (++) y cercano edomisio (+) y perimisio (+) 2 7 Presente N/D Presente En todo el tejido Presente En todo el tejido, salvo en el hematoma Presente En todo el tejido 21 En el tejido cicatricial, endomisio y perimisio, la zona lesionada Zona lesionada y en el endomisio y perimisio. En el tejido cicatricial, endomisio y perimisio, la zona lesionada Zona lesionada y en el endomisio y perimisio. En el tejido cicatricial, endomisio y perimisio, la zona lesionada Zona lesionada y en el endomisio y perimisio. En el tejido cicatricial, endomisio y perimisio, la zona lesionada Zona lesionada y en el endomisio y perimisio. 5 Presente Presente Presente Presente 21 7 Disminuido (+) Presente Disminuido (++) Disminuido (+) Presente, además en el tejido Presente granular Disminuido (+) Presente 21 Presente en el tejido lesionado, más desorganizado Presente en el tejido lesionado, más organizado 56 En el tejido cicatricial Presente en el tejido lesionado, más desorganizado En el tejido cicatricial, menor diametro, complejo, interenlazado 56 Miotubos y Mioblastos Miofibrillas (+), (++), (+++) indican el grado de intensidad o la cantidad de los parámetros comparados. Presente en el tejido lesionado, más desorganizado En el tejido cicatricial, menor diametro, complejo, interenlazado En el tejido cicatricial, paralelo Abreviaturas CEBM – Centre for Evidence-based Medicine CC – casos y controles ECAs- ensayos clínicos aleatorizados N/A – no aplicable N/D – no disponible PEDro – The Physiotherapy Evidence Database RICE – rest, ice, compression, elevation SC – series de casos