GUÍA.13EQIV
Anuncio
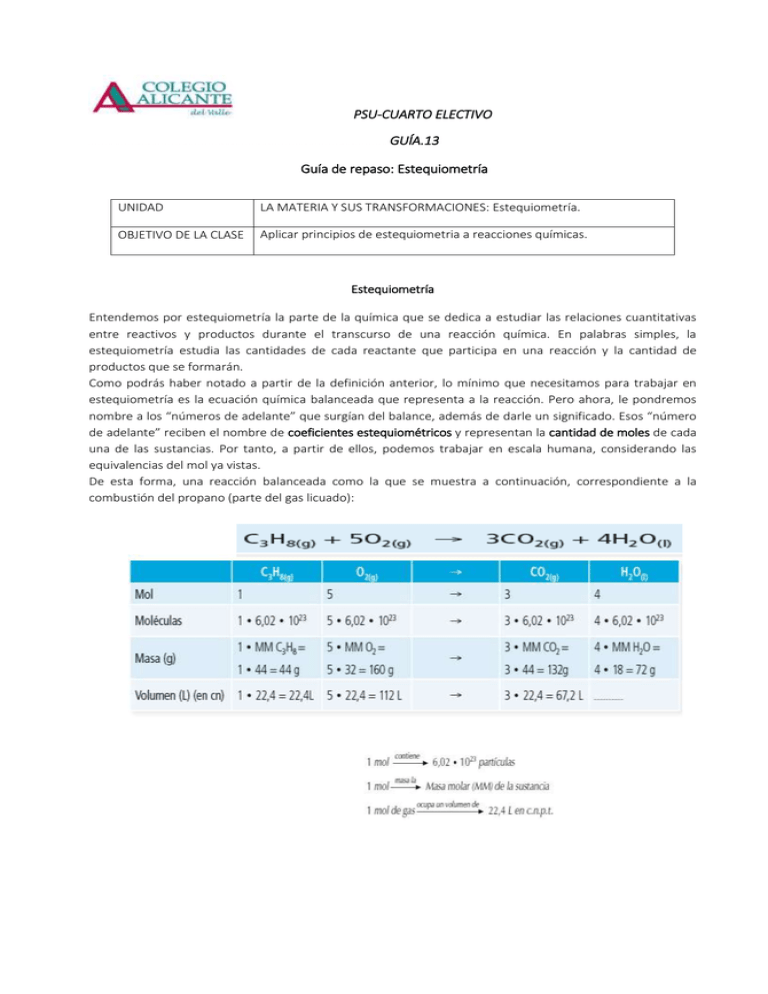
PSU-CUARTO ELECTIVO GUÍA.13 Guía de repaso: Estequiometría UNIDAD LA MATERIA Y SUS TRANSFORMACIONES: Estequiometría. OBJETIVO DE LA CLASE Aplicar principios de estequiometria a reacciones químicas. Estequiometría Entendemos por estequiometría la parte de la química que se dedica a estudiar las relaciones cuantitativas entre reactivos y productos durante el transcurso de una reacción química. En palabras simples, la estequiometría estudia las cantidades de cada reactante que participa en una reacción y la cantidad de productos que se formarán. Como podrás haber notado a partir de la definición anterior, lo mínimo que necesitamos para trabajar en estequiometría es la ecuación química balanceada que representa a la reacción. Pero ahora, le pondremos nombre a los “números de adelante” que surgían del balance, además de darle un significado. Esos “número de adelante” reciben el nombre de coeficientes estequiométricos y representan la cantidad de moles de cada una de las sustancias. Por tanto, a partir de ellos, podemos trabajar en escala humana, considerando las equivalencias del mol ya vistas. De esta forma, una reacción balanceada como la que se muestra a continuación, correspondiente a la combustión del propano (parte del gas licuado): La siguiente ecuación química (no balanceada) muestra la combustión del heptano, un compuesto que de estar presente en la gasolina, favorece el deterioro del motor: Para esta reacción: a) Realiza el balance de la ecuación química. b) A partir de la ecuación balanceada, completa la siguiente tabla: REACTIVOS LIMITANTES En una reacción química la cantidad de productos que se obtenga va a depender de la cantidad de reactivos iniciales con los que se cuente, esto es muy importante de conocer en muchos procesos industriales. Por ejemplo tú quieres formar cajas de galletas y dispones de 10 cajas de cartón, 10 galletas de vino, 6 galletas de limón 15 galletas de tritón, 12 galletas de champaña ¿Cuántas cajas puedes formar que contengan la misma cantidad de galletas? Al calcular te darás cuenta que puedes formar 6 cajas de galletas…por lo tanto van a sobrar 4 cajas de cartón, 4 galletas de vino 6 galletas de champaña y 9 galletas de tritón, que son los reactivos en exceso y un reactivo que limita la cantidad de productos que se pueden obtener durante la reacción que es el reactivo limitante que en nuestro caso son las galletas de limón. El metal sodio (Na) reacciona con agua para dar hidróxido de sodio (NaOH), según la reacción química. Na(s) + H2O(l) → NaOH(ac) + H2(g) 10 g de sodio reaccionan con 8,75 g de agua: a) b) c) d) ¿Cuál es el reactivo limitante? ¿Cuál es el reactivo en exceso? ¿Cuántos g hidróxido de sodio se obtienen? ¿Cuántos g hidrogeno se obtienen? RESPUESTAS a) El reactivo limitante es Na b) El reactivo en exceso es el H2O c) Se pueden obtener 17,2 g de NaOH d) Se pueden obtener 0,86 g de H2 ACTIVIDADES MOLES, MOLÉCULAS Y ÁTOMOS: Calcular la masa de agua que contienen 0,23 moles de agua. ¿Cuántos moles de nitrógeno hay en 1,2 · 1024 moléculas Sol: 4,14 g Sol:1,993 moles FÓRMULAS EMPÍRICAS (Calcula con estos datos la fórmula empírica) Calcula con estos datos la fórmula empírica. A-Disponemos de una muestra de 10 g de un compuesto orgánico cuya masa molecular es 60. Cuando analizamos su contenido obtenemos: 4 g de C; 0,67 g de H y 5,33 g de O. B-Un compuesto tiene la siguiente composición centesimal: 12,78 % de C ; 2,13 % de H y 85,09 % de Br. C- Halla la fórmula de un oxisulfuro de carbono que contiene 53,3 % de S ; 20 % de C y 26,7 % de O, REACTIVO LIMITANTE 1. Un tira de Zinc metálico, que pesa 2 g., se coloca en una solución acuosa con 2.5 g de Nitrato de plata, ocasionando la siguiente reacción: Zn(s) + AgNO3 (ac.) ----> Ag(s) + Zn(NO3) 2 a) ¿Cuál es el reactivo limitante? 2. El cobre reacciona con el ácido sulfúrico según la ecuación: H2SO4 + Cu ---> SO2 + CuSO4 + H2O Si se tienen 30 g de cobre y 200 g de H2SO4, calcular: a) ¿Cuál es el reactivo limitante? 3-En un experimento en el que se obtuvieron 3,43 g de SOCl2 mediante la reacción de 2,50 g de SO2 con 7 g de PCl5, esta reacción tiene un rendimiento teórico de 5,64 g de SOCl2. Considerando que la ecuación química es: SO2(l) + PCl5(l) ------------>SOCl2(l) + POCl3(l) Determina. a. ¿Cuál es el reactivo limitante? 4-¿Qué masa de cloruro de plata se puede preparar a partir de la reacción de 4,22 g de nitrato de plata con 7,73 g de cloruro de aluminio? Considera que esta reacción tiene un rendimiento teórico de 4 g de AgCl. AgNO3(ac) + AlCl3(ac) ------------> Al(NO3)3(ac) + AgCl(s) Calcula además: a. ¿Cuál es el reactivo en exceso? ¿En qué cantidad excede las necesidades de la reacción? TEST 1 El número de Avogadro corresponde al número de partículas por: A) 1 gramo de materia B) 1 litro de materia C) 1 mol de materia D) 1 mililitro de materia E) 22,4 litros materia en cualquier estado 2 La primera sustancia en agotarse en una reacción química recibe el nombre de: A) El producto B) El reactivo limitante C) El reactivo en exceso D) Compuesto limitante E) Compuesto en exceso 3 Un mol de H2 y un mol de O2 en: I. Ocupan el mismo espacio II. Contienen igual cantidad de moléculas III. Masan lo mismo A) Solo I B) Solo II C) Solo III D) I y II E) I, II y III 4 La masa molar del sodio (Na) es 23 gr/mol. Por lo tanto, 5 moles de este elemento corresponden a: A) 23 g B) (23÷5) g C) (5÷23) g D) (23 + 5) g E) (23 · 5) g 5 El nitrógeno reacciona con el oxígeno a altísimas temperaturas formando dióxido de nitrógeno según la ecuación: N2 + 2 O2 → 2 NO2 Entonces, la mayor cantidad de NO2 que se puede obtener a partir de 4 moles de N2 y 4 moles de O2, es: A) 2 moles B) 3 moles C) 4 moles D) 6 moles E) 8 moles 6 Si quisieras comenzar a fabricar un producto comercial mediante una reacción química con el fin de venderlo, antes de comenzar deberías conocer: I. La ecuación química que representa la reacción. II. La ficha de seguridad de todas las sustancias involucradas. III. El rendimiento de la reacción. A) Solo I B) Solo II C) Solo I y II D) Solo I y III E) I, II y III 7 En una reacción química cualquiera siempre se cumplirá que: A) Los moles de producto y de reactivo son iguales. B) La masa de reactantes es mayor que la de productos. C) La cantidad de átomos permanece constante. D) El rendimiento real es dado por la ecuación E) Los coeficientes estequiométricos son todos iguales 8 La ley propuesta por J. Proust sobre la composición de un compuesto se llama: A) Ley de las proporciones múltiples. B) Ley de las proporciones definidas. C) Ley de conservación de la masa. D) Ley de la fórmula empírica. E) Ley de conservación de la energía. 9 Una ecuación química muestra sobre una reacción todo lo siguiente, EXCEPTO: A) Productos de la reacción. B) Reactantes de la reacción. C) Estados de agregación de las especies. D) Cantidades necesarias de las especies. E) Rapidez de la reacción. 10 Una molécula presenta una masa cuya suma depende de: A) Los números atómicos de sus elementos. B) Las masas atómicas de sus átomos. C) Los protones de sus átomos. D) Los números másicos de sus elementos. E) Los números neutrones y electrones. 11 El aporte de un elemento a la masa de la molécula completa recibe el nombre de: A) Ecuación química B) Fórmula empírica C) Fórmula molecular D) Composición porcentual E) Porcentaje peso volumen 12 En la siguiente reacción química: aH3PO4(ac) + bKOH(ac) → cK3PO4(ac) + dH2O(l) Las letras “a”, “b”, “c” y “d” representan los números que permiten balancear la ecuación. Entonces, los valores de “a”, “b”, “c” y “d” son, respectivamente: A) 1, 2, 3, 4 B) 1, 3, 1, 3 C) 1, 3, 2, 3 D) 2, 6, 2, 3 E) 2, 3, 2, 3 13 Un compuesto desconocido se compone de 24% de Carbono (C), 6% de hidrógeno (H) y 70% de cloro (Cl). Sabiendo que H = 1 u.m.a.; C = 12 u.m.a.; Cl = 35,3 u.m.a., la fórmula empírica del compuesto es: A) CH4Cl B) CH3Cl C) CH2Cl D) CHCl E) CHCl2 14 Se tiene un compuesto cualquiera formado por dos elementos, X y Z. Si su fórmula molecular es X2Z4, sin importar los elementos que X y Z representen, siempre se cumplirá que: A) El elemento Z aporta más masa a la molécula que el X. B) El elemento X aporta más masa a la molécula que el Z. C) La composición porcentual de X y Z es siempre la misma. D) La fórmula empírica es diferente de la molecular. E) Ninguna de las anteriores.

