Estimados padres, me dirijo a Vds para comunicarles que soy la
Anuncio

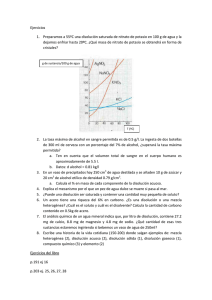
I.E.S BEATRIZ DE SUABIA Dpto. Física y Química UNIDADES 1 a 4: EJERCICIOS GLOBALES DE REPASO UNIDAD 1: MAGNITUDES FÍSICAS Pregunta 1: Realiza las siguientes conversiones de unidades fundamentales: a) Intensidad de corriente = 0,0000586 GA; exprésala en kA. b) Masa = 2,36 · 10−7 Gg; exprésala en g. c) Tiempo = 6,82 · 107 ns; exprésalo en s. Pregunta 2: Escribe en notación científica, o decimal, las equivalencias que correspondan, e indica la magnitud que se está midiendo en cada caso: a) Entre μg y ng. b) Entre mmol y hmol. c) Entre mm y μm. Pregunta 7: Realiza las siguientes conversiones de unidades fundamentales: a) Masa = 0,00025 M; exprésala en g. b) Tiempo = 12 500 μs; exprésalo en s. c) Cantidad de sustancia = 0,038 mmol; exprésala en μmol. Pregunta 8: Realiza las siguientes conversiones de unidades derivadas: a) Velocidad = 20,9 m/s; exprésala en km/h. b) Concentración = 6,3 mg/L; exprésala en g/L. c) Densidad = 1 025 kg/m3; exprésala en g/cm3. UNIDAD 2: ESTADOS DE LA MATERIA Pregunta 3: Ordena de mayor a menor los siguientes resultados: a) Masa: 1 kg; 1 cg; 1Mg; 1Tg; 1 μg; 1mg; 1 hg. b) Cantidad de sustancia: 2 · 102 mmol; 2 · 10−3 kmol; 2 · 10−5 Mmol; 2 · 10−5 Gmol; 2 · 106 nmol. Pregunta 4: Realiza las siguientes conversiones de unidades derivadas: a) Velocidad = 25,6 km/h; exprésala en m/s. b) Concentración = 10,4 g/L; exprésala en mg/mL. c) Densidad = 2,3 g/cm3; exprésala en kg/m3. Pregunta 1: Completa con la palabra o palabras que faltan: a) ............................. y ............................. son propiedades ............................. de la materia. b) El cambio de estado de sólido a líquido se llama ............................. c) El cambio de estado de líquido a sólido se llama ............................. d) Sublimación es el cambio de estado de ............................. a ............................. e) Si el punto de fusión del agua oxigenada es −0,82 ºC y el punto de ebullición 152,1 ºC, a la temperatura de –15 º C estará en estado ............................. y a 150 ºC en estado ............................. Pregunta 5: Ordena de mayor a menor los siguientes resultados: a) Longitud: 1 m; 1 μm; 1 Gm; 1dam; 1mm; 1 nm; 1 Mm. b) Intensidad de corriente: 3 · 102 A; 3 · 10−2 kA; 3 · 10−5 MA; 3 · 107 nA; 3 · 103 μA. Pregunta 6: Escribe en notación científica, o decimal, las equivalencias que correspondan, e indica la magnitud que se está midiendo en cada caso: a) Entre GA y kA. b) Entre dcd y ncd. c) Entre Ts y Ms. Pregunta 2: Comenta los siguientes enunciados, indicando si son correctos o falsos, explicando el porqué de tu respuesta: a) El punto de fusión es el instante en que se produce el cambio de estado de sólido a líquido. b) Una viga de hierro tiene más densidad que un clavo de hierro porque es más grande. c) Si dos sustancias A y B tienen el mismo volumen pero la masa de A es doble que la de B, la densidad de A es la mitad que la de B. d) El punto de fusión será mayor a medida que las partículas están más débilmente unidas. Pendientes de Física y Química 3º ESO - Ejercicios Globales de Repaso 1 I.E.S BEATRIZ DE SUABIA Pregunta 3: Escribe los postulados de la teoría cinética. Pregunta 4: Explica, justificando tu respuesta, qué ocurrirá si mezclamos en el mismo recipiente las siguientes sustancias: a) Una piedra, agua y aceite. b) Una piedra, agua y mercurio. c) Agua, corcho y aire. Pregunta 5: Responde a las siguientes cuestiones: a) ¿Por qué los sólidos tienen forma fija y los líquidos no? b) ¿Por qué decimos que la densidad es una propiedad característica? c) ¿Qué tienen en común, según la teoría cinética, los tres estados de la materia? Pregunta 6: Explica la diferencia entre: a) Volumen y capacidad. b) Evaporación y vaporización. c) Fusión y punto de fusión. Pregunta 7: De acuerdo con la ley de Boyle: a) ¿Cómo es la dependencia entre la presión de un gas y el volumen que ocupa a temperatura constante? b) ¿Qué le ocurre a la presión de un gas si su volumen se reduce a la mitad manteniendo fija la temperatura? c) ¿Cómo cambia el volumen de un gas si su presión disminuye a la mitad a temperatura fija? d) ¿Cómo es el producto p · V si la temperatura se mantiene constante? Pregunta 8: Utiliza la teoría cinética para explicar: a) Por qué los gases se pueden comprimir. b) Por qué al calentar un gas aumenta mucho la presión. Pregunta 9: Explica, indicando algún ejemplo, qué se entiende por: a) Masa. b) Fusión. c) Sublimación. Dpto. Física y Química a) ¿Qué debe ocurrir para que una sustancia pueda pasar al estado gaseoso? b) ¿En qué propiedades nos basamos para afirmar que el aire es una sustancia gaseosa? Pregunta 11: Un trozo de hierro tiene una masa de 0,126 kg y un volumen de 16 cm3. a) Define qué se entiende por densidad. b) Calcula la densidad del trozo de hierro e interpreta el resultado. c) ¿Qué ocurre cuando se echa un trozo de hierro en un recipiente lleno de mercurio? Dato: La densidad del mercurio es 13,6 g/cm3. d) Calcula la masa de un trozo de hierro de 254 cm3. Pregunta 12: El punto de fusión del aluminio es 660 ºC y el punto de ebullición es 2 450 ºC. Contesta a las siguientes preguntas y justifica tus respuestas: a) ¿En qué estado se encontrará una pieza de aluminio calentada hasta 2 475 ºC? b) ¿Hasta qué temperatura se ha de calentar el aluminio para que funda? c) Si observamos un recipiente con trozos de aluminio que hemos calentado hasta 660 ºC, ¿cómo veremos el contenido, en estado sólido, líquido o gaseoso? d) ¿Serías capaz de dibujar la gráfica de calentamiento (cambios de estado) para el aluminio, y explicarla? Pregunta 13: Una sustancia gaseosa tiene una densidad de 1,35 kg/m3. a) Expresa la densidad de esta sustancia en g/cm3. b) Calcula la masa de gas, en kilogramos, que ocupará un volumen de 26,4 m3. c) ¿Qué volumen de gas corresponde a una masa de 12 kg? Pregunta 14: Comenta los siguientes enunciados, indicando si son correctos o falsos, explicando el porqué de tu respuesta: a) Un sólido como el azúcar no se puede diferenciar de un líquido como la leche. b) El aire no tiene densidad. c) Fusión es el cambio de estado de sólido a gas. d) En los líquidos no existen fuerzas de atracción entre sus partículas. Pregunta 10: Responde a las siguientes cuestiones: Pendientes de Física y Química 3º ESO - Ejercicios Globales de Repaso 2 I.E.S BEATRIZ DE SUABIA Dpto. Física y Química Pregunta 15: Pregunta 4: Explica, justificando tu respuesta, qué ocurrirá si mezclamos en el mismo recipiente las siguientes sustancias: a) Agua y mercurio. b) Corcho, agua y mercurio. Diseña un procedimiento para separar los componentes de las siguientes mezclas, explicando con detalle cómo se llevaría a cabo dicho procedimiento: a) Azufre, limaduras de hierro y azúcar. b) Alcohol, agua y mercurio. Pregunta 16: Indica, para las siguientes sustancias, cuál es su estado de agregación, justificando tu respuesta basándote en las propiedades físicas de los sólidos, los líquidos o los gases: a) Agua: es una sustancia ............................. porque ............................. b) Aire: es una sustancia ............................. porque ............................. c) Oxígeno: es una sustancia ............................. porque ............................. UNIDAD 3: SISTEMAS MATERIALES Pregunta 1: Comenta los siguientes enunciados, indicando si son correctos o falsos, y explicando el porqué de tu respuesta: a) El agua mineral es una sustancia pura. b) Un sólido y un líquido en una mezcla homogénea que no se pueden separar. c) Una mezcla de dióxido de carbono y agua es una disolución. d) Cuando no admite más soluto se dice que la disolución está concentrada. Pregunta 2: Explica, indicando algún ejemplo, qué se entiende por: a) Compuesto. b) Filtración. c) Disolución. d) Solubilidad. Pregunta 3: Tenemos en un recipiente una mezcla de sustancias que deseamos separar. Teniendo en cuenta la información que se te proporciona, explica con detalle cuál es el procedimiento más adecuado para lograr dicha separación. Sal + agua + alcohol + cloroformo. Datos: - El cloroformo es un líquido de densidad 2,5 g/cm3. - La sal no se disuelve en cloroformo. - El agua y el alcohol no se mezclan con el cloroformo. Pregunta 5: Completa con la palabra o palabras que faltan: a) Los métodos de separación de mezclas son métodos ............................. porque ............................. ............................. la ............................. de las sustancias. b) Los componentes de una disolución se denominan ............................. y ............................. c) En una disolución, el componente que está en ............................. cantidad es el ............................. d) Las mezclas pueden ser ............................. y ............................. e) La solubilidad de una sustancia ............................. generalmente aumenta al ............................. la ............................. f) En una ............................. ............................. sus componentes no se distinguen a simple vista. g) A partir de un ............................. es posible obtener varias sustancias diferentes mediante procesos ............................. h) Una ............................. produce varias sustancias mediante procesos ............................. Pregunta 6: Explica la diferencia entre: a) Sustancia pura y mezcla. b) Disolución y mezcla. c) Disolución y disolvente. Pregunta 7: Clasifica las siguientes sustancias explicando con claridad por qué les corresponde uno u otro grupo de sustancias materiales: a) Oro. b) Detergente en polvo para lavadora. c) Oxígeno. d) Mármol. Pregunta 8: Hemos preparado una disolución saturada de nitrato de potasio disolviendo 90 g de esta sustancia en 130 g de agua a una determinada temperatura, resultando un volumen final de 200 mL. Pendientes de Física y Química 3º ESO - Ejercicios Globales de Repaso 3 I.E.S BEATRIZ DE SUABIA Dpto. Física y Química a) Calcula la concentración en masa por unidad de volumen (g/L) de esta disolución. b) Si tomamos una porción de 50 mL de la disolución anterior, ¿cuál es su concentración? c) ¿Qué ocurrirá si enfriamos la disolución inicial hasta una temperatura de 45 ºC, a la cual la solubilidad del nitrato de potasio es 60? c) ¿Qué cantidad de la segunda disolución (B) debemos tomar para que lleve disueltos 500 mg de sulfato de cobre? Pregunta 9: Pregunta 1: Tenemos un jarabe para el resfriado que contiene un principio activo en una concentración del 3,5 % en masa. Si el médico me ha dicho que debo tomar una cantidad de principio activo de 0,5 g, ¿qué cantidad de jarabe, expresada en gramos, debo ingerir para tomar dicha cantidad de principio activo? Explica con detalle el átomo en la actualidad. Pregunta 10: Realiza los cambios de unidades necesarios para expresar las siguientes concentraciones en g/L: a) C = 850 mg/L. b) C = 0,025 g/mL. c) C = 3,5 mg/mL. Pregunta 11: Calcula la concentración en porcentaje en masa de una disolución preparada disolviendo 60 g de yoduro de potasio en 540 g de agua. Interpreta el resultado. ¿Qué cantidad de esta sal contendrá una porción de 0,45 kg de la disolución anterior? UNIDAD 4: ESTRUCTURA DE LA MATERIA Pregunta 2: Explica, indicando algunos datos o ejemplos, qué se entiende por: a) Protón. b) Número másico. c) Configuración electrónica. d) Molécula. Pregunta 3: Responde a las siguientes cuestiones: a) ¿Cuál fue el principal acierto que dio validez al modelo de Thomson? b) ¿Qué datos es necesario conocer para calcular el número de neutrones de un átomo? c) ¿Por qué al evaporar agua salada, aparecen pequeños cristales de sal? Pregunta 4: Escribe los postulados de la teoría atómica de Dalton. Pregunta 12: Pregunta 5: Calcula la concentración en g/L de una disolución preparada disolviendo 30 g de sal en agua hasta un volumen final de 250 mL. Interpreta el resultado. Tomamos una porción de esta disolución cuyo volumen es 0,03 L. ¿Qué cantidad de soluto habrá disuelto en esta porción de la disolución? ¿Qué volumen de esta disolución contendrá 2,5 g de soluto disueltos? Relaciona cada aportación autor: • Concepto de • átomo. • • Teoría atómica. • • Inventa el tubo de • rayos catódicos. • • Descubre el • electrón. • • Observa los rayos • canales. • • Determina la • carga del electrón. • Bombardea con partículas alfa. • Descubre el neutrón. • Distribuye los electrones en niveles de energía. • Introduce el concepto de número atómico. científica con su Pendientes de Física y Química 3º ESO - Ejercicios Globales de Repaso 4 Pregunta 13: Disponemos de dos disoluciones A y B. La primera (A) se ha preparado disolviendo 74 g de sulfato de cobre en 0,726 kg de agua. La segunda (B) también es de sulfato de cobre y agua, pero de ella solo sabemos que su concentración es del 15 % en masa. Calcula: a) La concentración en tanto por ciento en masa de la primera disolución (A). b) ¿Cuál de las dos disoluciones es más concentrada? ¿Por qué? Dalton. Chadwick. Demócrito. Goldstein. Thomson. Moseley. Millikan. Croques. Rutherford. Bohr. I.E.S BEATRIZ DE SUABIA Dpto. Física y Química Pregunta 6: Explica la diferencia entre: a) Electrones y neutrones. b) Número atómico y número másico. Pregunta 7: Comenta los siguientes enunciados, indicando si son correctos o falsos, explicando el porqué de tu respuesta: a) El primero en introducir el concepto de átomo fue Dalton. b) El átomo siempre es neutro. c) Dos partículas cargadas de igual signo se atraen. d) Existen diferentes formas de agrupaciones de átomos. Pregunta 8: Un átomo tiene de número atómico 27 y de número másico 59. Sabiendo que es neutro, indica: a) Las partículas subatómicas que posee. b) El valor aproximado de su masa en unidades de masa atómica (u). Pregunta 9: Cuando dos átomos se unen mediante un enlace covalente: a) ¿Qué diferencia hay respecto a la unión iónica? b) ¿Cómo se denomina la agrupación a que dan lugar? c) ¿Es necesario que se unan siempre dos átomos de elementos diferentes? d) ¿El compuesto resultante siempre estará formado por un número muy pequeño de átomos? Pendientes de Física y Química 3º ESO - Ejercicios Globales de Repaso 5 I.E.S BEATRIZ DE SUABIA Dpto. Física y Química UNIDADES 1 a 4: SOLUCIONES A LOS EJERCICIOS GLOBALES DE REPASO UNIDAD 1: MAGNITUDES FÍSICAS UNIDAD 2: ESTADOS DE LA MATERIA Pregunta 1: Pregunta 1: a) I = 58,6 kA. b) m = 236 g. c) t = 0,0682 s. a) Masa y volumen son propiedades generales de la materia. b) El cambio de estado de sólido a líquido se llama fusión. c) El cambio de estado de líquido a sólido se llama solidificación. d) Sublimación es el cambio de estado de sólido a gas. e) Si el punto de fusión del agua oxigenada es –0,82 ºC y el punto de ebullición 152,1 ºC, a la temperatura de −15 ºC estará en estado sólido y a 150 ºC en estado líquido. Pregunta 2: a) Masa: 1 μg = 103 ng o 10−3 μg = 1 ng. b) Cantidad de sustancia: 1 mmol = 10−5 hmol o 105 mmol = 1 hmol. c) Longitud: 1 mm = 103 μm o 10−3 mm = 1 μm. Pregunta 3: a) 1Tg; 1Mg; 1 kg; 1 hg; 1 cg; 1mg; 1 μg. b) 2 · 10−5 Gmol; 2 · 10−5 Mmol; 2 · 10−3 kmol; 2 · 102 mmol; 2 · 106 nmol. Pregunta 4: a) v = 7,11 m/s. b) C = 10,4 mg/mL. c) d = 2 300 kg/m3. Pregunta 5: a) 1 Gm; 1 Mm; 1dam; 1 m; 1mm; 1 μm; 1 nm. b) 3 · 102 A; 3 · 10−5 MA; 3 · 10−2 kA; 3 · 107 nA; 3 · 103 μA. Pregunta 6: a) Intensidad de corriente: 1 GA = 106 kA o 10−6 GA = 1 kA. b) Intensidad luminosa: 1 dcd = 108 ncd o 10−8 dcd = 1 ncd. c) Tiempo: 1 Ts = 106 Ms o 10−6 Ts = 1 Ms. Pregunta 7: a) m = 250 g. b) t = 0,0125 s. c) n = 38 μmol. Pregunta 14: a) v = 75,24 km/h. b) C = 6,3 · 10−3 g/L. c) d = 1,025 g/cm3. Pregunta 2: a) Falso, es el valor de temperatura al que se produce ese cambio de estado, y el de líquido a sólido. b) Falso, ambos tienen la misma densidad, pues se trata de la misma sustancia. c) Falso, la densidad de A será el doble que la de B. d) Falso, a medida que las fuerzas de unión entre las partículas sean menores, también lo será el punto de fusión. Pregunta 3: Los postulados de la teoría cinética son: • Los gases están formados por partículas microscópicas, muy separadas entre sí. • Estas partículas se mueven continuamente en todas direcciones, chocando unas con otras y con las paredes del recipiente que las contiene. • Excepto cuando chocan, las partículas se mueven en línea recta y de forma independiente. • Los choques entre las partículas o con las paredes son elásticos, es decir, no se pierde energía en ellos. • La velocidad de las partículas, que depende de la energía que poseen, determina la temperatura del gas; esta es tanto mayor cuanto más rápido se mueven. Pendientes de Física y Química 3º ESO - Soluciones Ejercicios Globales 1 I.E.S BEATRIZ DE SUABIA Pregunta 4: a) La piedra es la más densa, quedará en el fondo y, el aceite, al ser el menos denso de los tres, quedará sobre el agua. b) El mercurio es el más denso de los tres, y quedará en el fondo. La piedra, al ser más densa que el agua, pero menos que el mercurio, quedará hundida en el agua y flotando sobre el mercurio. c) El corcho flotará sobre el agua, al ser menos denso, y el aire se situará en la parte superior, sobre el agua y el corcho, al ser el menos denso de los tres. Dpto. Física y Química número de colisiones contra las paredes del recipiente, de modo que aumenta la presión. Pregunta 9: a) Es la cantidad de materia que posee un cuerpo. Por ejemplo: masa de una persona = 65 kg. b) Es el cambio de estado de sólido a líquido. Por ejemplo: el hielo se funde. c) Es el cambio de estado de sólido a gas sin pasar por líquido. Por ejemplo: el yodo sólido pasa a un gas violáceo al calentarlo. Pregunta 10: Pregunta 5: a) Porque las partículas del sólido están unidas por fuerzas de atracción que las mantienen en unas posiciones fijas en las cuales solo pueden vibrar; en los líquidos las fuerzas son más débiles y pueden moverse unas sobre otras. b) Porque sirve para identificar una sustancia pura. c) En todos los casos, la sustancia está formada por partículas. Pregunta 6: a) El volumen es el espacio ocupado por un cuerpo y la capacidad es el espacio interior de un recipiente. b) Ambas corresponden al cambio de estado de líquido a gas, pero la evaporación es a temperatura ambiente y la vaporización calentando hasta el punto de ebullición. c) La fusión es el cambio de estado de sólido a líquido y el punto de fusión es el valor de temperatura a la que ocurre. Pregunta 7: a) La presión y el volumen están en una relación de proporcionalidad inversa, lo cual quiere decir, que el producto p · V es constante. b) Como el producto de ambos debe ser constante, la presión debe hacerse el doble. c) Ya que el producto de presión y volumen debe ser constante, el volumen debe hacerse el doble. d) El producto de ambas magnitudes es constante. Pregunta 8: a) Porque entre las partículas del gas no hay nada, espacio vacío, que puede reducirse de modo que las partículas tengan menos espacio para moverse. b) Al calentar el gas aumenta mucho la velocidad de las partículas y, por tanto, el a) Que sus partículas adquieran la energía y velocidad suficiente para moverse con libertad, venciendo las fuerzas de atracción que las mantienen débilmente unidas en el líquido. b) En que fluye con facilidad, se difunde ocupando el volumen del recipiente y se comprime o expande fácilmente. Pregunta 11: a) La densidad es el cociente entre la masa y el volumen de un cuerpo. b) La densidad viene dada por el cociente: d = 126 g/16 cm3 = 7,9 g/cm3 Por tanto, cada centímetro cúbico de hierro tiene una masa de 7,9 g. c) Como el hierro es menos denso que el mercurio, flotará sobre el mercurio. d) Despejando la masa de la expresión de la densidad se obtiene: m = 254 cm3 · 7,9 g/cm3 = 2 007 g Pregunta 12: a) En estado gaseoso porque se ha calentado hasta una temperatura superior a la correspondiente a su punto de ebullición. b) Hasta la temperatura correspondiente a su punto de fusión, que es 660 ºC. c) Veremos que está cambiado de estado sólido a líquido (veremos ambos estados). d) El aluminio presentará en su gráfica de calentamiento dos tramos horizontales; el primero corresponde al cambio de estado entre sólido y líquido y, el segundo, entre líquido y gas. En estos tramos la temperatura no varía porque la energía que se proporciona al calentar se invierte en realizar el cambio de estado. Pregunta 13: a) d = 1,35 · 10−3 g/cm3. b) m = 26,4 m3 · 1,35 kg/m3 = 35,6 kg. c) V = 12 kg/1,35 kg/m3 = 8,9 m3 Pendientes de Física y Química 3º ESO - Soluciones Ejercicios Globales 2 I.E.S BEATRIZ DE SUABIA Pregunta 14: a) Falso, aunque aparentemente toma la forma del recipiente, si observamos con atención el azúcar está formado por pequeños cristales de forma definida. b) Falso, el aire es materia y, por tanto, tiene densidad, pues posee masa y volumen. c) Falso, es el cambio de estado de sólido a líquido. d) Falso, existen fuerzas, pero son más débiles que en los sólidos. Dpto. Física y Química c) Mezcla homogénea de dos o más sustancias. Por ejemplo: agua salada. d) Cantidad máxima de soluto, expresada en gramos, que es posible disolver en 100 g de disolvente a una temperatura dada. Por ejemplo: solubilidad de sal en agua a 25 ºC = 36. Pregunta 3: a) El mercurio, más denso, quedará en el fondo del recipiente. b) El corcho flotará sobre el agua, al ser el menos denso, y el mercurio se hundirá en el agua al ser el más denso. El agua tiene una densidad intermedia entre ambos. La sal está disuelta en el agua, que a su vez disuelve al alcohol formando una mezcla homogénea. Esta fase líquida forma una mezcla heterogénea con el cloroformo, que es un líquido, por lo que se comenzará separando este (más denso) del resto de los componentes mediante una decantación. A continuación, por destilación, se separará el alcohol del agua salada y, se puede finalizar separando la sal del agua mediante una cristalización. Pregunta 16: Pregunta 4: a) Agua: es una sustancia líquida porque toma la forma del recipiente pero no se puede comprimir. b) Aire: es una sustancia gaseosa porque toma la forma del recipiente y se comprime con facilidad. c) Oxígeno: es una sustancia gaseosa porque toma la forma del recipiente y se comprime con facilidad. a) Son tres sólidos, pero uno de ellos, el hierro, tiene la propiedad de ser atraído por un imán, de modo que comenzaremos separándolo mediante una separación magnética. Posteriormente, considerando que el azúcar es soluble en agua pero el azufre no, añadiremos agua para disolver el azúcar, y la mezcla resultante la filtraremos para separar el azufre; finalmente, evaporaremos por cristalización el agua para que quede de nuevo el azúcar, ya separada, depositada en el fondo. b) Se observan dos fases líquidas, que forman una mezcla heterogénea, que se separarán mediante una decantación (el mercurio es más denso que el agua y el alcohol). Después se separará el agua del alcohol mediante una destilación. Pregunta 15: UNIDAD 3: SISTEMAS MATERIALES Pregunta 1: a) Falso, porque además de agua contiene sales disueltas que es posible separar por cristalización. b) Falso, se pueden separar mediante cristalización. c) Verdadero, porque tiene dos componentes que no se distinguen a simple vista. d) Falso, se dice que la disolución está saturada. Pregunta 2: a) Sustancia pura a partir de la cual es posible obtener varias diferentes mediante métodos químicos. Por ejemplo: agua, H2O. b) Método físico que se utiliza para separar una mezcla heterogénea de un sólido y un líquido, en el que se usa un embudo equipado con papel de filtro. Por ejemplo: filtración de partículas de arena mezcladas con agua. Pregunta 5: a) Los métodos de separación de mezclas son métodos físicos porque no alteran la naturaleza de las sustancias. b) Los componentes de una disolución se denominan disolvente y soluto. c) En una disolución, el componente que está en mayor/menor cantidad es el disolvente/soluto. d) Las mezclas pueden ser homogéneas y heterogéneas. e) La solubilidad de una sustancia sólida/gaseosa generalmente aumenta al aumentar/disminuir la temperatura. f) En una mezcla homogénea sus componentes no se distinguen a simple vista. g) A partir de un compuesto es posible obtener varias sustancias diferentes mediante procesos químicos. Pendientes de Física y Química 3º ESO - Soluciones Ejercicios Globales 3 I.E.S BEATRIZ DE SUABIA Dpto. Física y Química h) Una mezcla produce varias sustancias mediante procesos físicos. La masa de soluto será 45 g de yoduro de potasio, disueltos en 450 g de disolución. Pregunta 6: Pregunta 12: a) Una sustancia pura es la que, mediante procesos físicos, no da lugar a otras diferentes, mientras que una mezcla sí. b) Una disolución es una mezcla homogénea, mientras que una mezcla puede ser homogénea o heterogénea. c) Una disolución es una mezcla homogénea de varias sustancias, mientras que el disolvente es el componente mayoritario de una disolución. Pregunta 7: a) Sustancia pura, elemento. Por métodos físicos y químicos siempre se obtiene la misma sustancia. b) Mezcla heterogénea (se distinguen sus componentes a simple vista) formada por partículas de detergente diferentes. c) Sustancia pura, elemento. Por métodos físicos y químicos siempre se obtiene la misma sustancia. d) Mezcla heterogénea (se distinguen sus componentes a simple vista) formada por minerales diferentes fácilmente apreciables. C = 30 g soluto/0,25 L = 120 g/L Por cada litro de disolución hay disueltos 120 g de sal. Habrá disueltos 3,6 g de sal en 0,03 L de disolución. V = 0,021 L de disolución = 21 mL. Pregunta 13: a) % masa = (74 g soluto/800 g disolución) · 100 = 9,25 %. b) La disolución B es más concentrada, porque su concentración es del 15 % en masa y la concentración de la disolución A es 9,25 %. c) La segunda disolución tiene disueltos 15 g por cada 100 g de disolución; si queremos que lleve disueltos 500 mg (0,5 g) de soluto, tomaremos una porción de 3,3 g de disolución. UNIDAD 4: ESTRUCTURA DE LA MATERIA Pregunta 1: Pregunta 8: a) C = 90 g soluto/0,2 L disolución = 450 g/L. b) Su concentración es la misma, pues al tomar una porción no varían las cantidades relativas de soluto y disolvente. c) En 130 g de agua, a esa temperatura, es posible disolver 78 g de nitrato de potasio como máximo. Como en la disolución se han añadido 90 g de esta sal, quedarán depositados en el fondo sin disolver 12 g = 90 g – 78 g de nitrato de potasio. Pregunta 9: Deberé tomar 14,3 g de jarabe. Pregunta 10: a) C = 0,85 g/L. b) C = 25 g/L. c) C = 3,5 g/L. En la actualidad sabemos que el átomo consta de un núcleo positivo y una corteza negativa situada a gran distancia de él. El núcleo concentra casi toda la masa del átomo. En el núcleo del átomo se localizan los protones y los neutrones, unidos mediante poderosas fuerzas de atracción llamadas fuerzas nucleares. Estas fuerzas impiden la repulsión entre ellos. En la corteza se hallan los electrones, en un número igual al de protones, girando a la velocidad de la luz (300000 kilómetros por segundo) en torno al núcleo y, atraídos por fuerzas eléctricas debido a su carga negativa. Los electrones se disponen en capas concéntricas a distintas distancias del núcleo. Esas capas, que pueden albergar un número máximo de electrones, tienen mayor energía cuanto más lejos del núcleo se encuentran. Además, estas capas se van ocupando por orden de proximidad a él. Pregunta 2: Pregunta 11: % masa = (60 g soluto/600 g disolución) · 100 = 10 % Por cada 100 g de disolución hay disueltos 10 g de yoduro de potasio. a) Partícula del átomo que se encuentra en el núcleo, de carga positiva y de masa muy similar al neutrón, y mucho mayor que la de un electrón. b) Número que indica la suma de protones y neutrones que tiene un átomo en el núcleo. Por Pendientes de Física y Química 3º ESO - Soluciones Ejercicios Globales 4 I.E.S BEATRIZ DE SUABIA ejemplo: uno de los isótopos del hidrógeno, el tritio, tiene A = 3 (1 protón + 2 neutrones). c) Forma en que se distribuyen los electrones en diferentes capas o niveles alrededor del núcleo, según unas reglas previamente establecidas. Por ejemplo: en el magnesio, que tiene 12 electrones, se sitúan 2 en el primer nivel, 8 en el segundo y 2 en el tercero. d) Agrupación de dos o más átomos con entidad propia. Por ejemplo: la molécula de oxígeno, O2. a) El modelo de Thomson explicaba un fenómeno experimental conocido desde antiguo, la electrización. b) Es necesario conocer su número atómico (protones) y su número másico (protones + neutrones). c) Porque la sal está disuelta. En el agua hay cationes de sodio (Na+) y aniones cloruro (Cl−). Pero, cuando evaporamos el agua, los cationes y aniones se unen formando una red cristalina y dando lugar a un sólido cristalino: la sal. Pregunta 4: La teoría atómica de Dalton se resume en los siguientes postulados: • Los elementos están formados por pequeñas partículas indivisibles e indestructibles llamadas átomos. • Los átomos de un mismo elemento son idénticos en su masa y propiedades; los átomos de elementos diferentes poseen distintas masas y propiedades. • Los átomos de los elementos se combinan, para formar compuestos, en proporciones dadas por números enteros. Pregunta 5: • • • • • • • Pregunta 6: a) El electrón tiene carga (negativa) mientras que el neutrón no tiene carga. Además, el electrón tiene una masa muy pequeña en comparación con el neutrón, y se encuentra girando en la corteza, mientras que el neutrón está en el núcleo. b) El número atómico es el número de protones mientras que el número másico es la suma de protones y neutrones. Pregunta 7: Pregunta 3: • • • Dpto. Física y Química a) Falso, fue Demócrito, en la Grecia clásica. b) Falso, a veces ganan o pierden electrones formando iones. c) Falso, las cargas de igual signo se repelen, y las de distinto signo se atraen. d) Correcto, existen iones, moléculas y cristales. Pregunta 8: a) Tiene 27 protones, 32 neutrones y 27 electrones. b) Su masa aproximada es 59 u (lo indica su número másico). Pregunta 9: a) En la unión iónica hay que formar un catión y un anión para que se produzca la atracción electrostática y, en la unión covalente, se produce por compartición de electrones entre átomos. b) Se denominan moléculas. c) No, se pueden unir incluso dos átomos del mismo elemento entre sí, como ocurre con el oxígeno atmosférico, por ejemplo, cuya molécula es O2. d) No, puede estar formado por miles de átomos, dando lugar a macromoléculas y polímeros Concepto de átomo. Æ Demócrito. Teoría atómica. Æ Dalton. Inventa el tubo de rayos catódicos. Æ Croques. Descubre el electrón. Æ Thomson. Observa los rayos canales. Æ Goldstein. Determina la carga del electrón. Æ Millikan. Bombardea con partículas alfa. Æ Rutherford. Descubre el neutrón. Æ Chadwick. Distribuye los electrones en niveles de energía. Æ Bohr. Introduce el concepto de número atómico Æ Moseley. Pendientes de Física y Química 3º ESO - Soluciones Ejercicios Globales 5