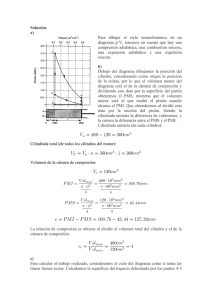
Capitulo 3
Anuncio

Física II: Termodinámica, ondas y fluidos Índice 3 – LA PRIMERA LEY DE LA TERMODINÁMICA ....................................................................................2 3.2 S ISTEMAS Y PROCESOS TERMODINÁMICOS..................................................................................................2 3.3 T RABAJO REALIZADO A CAMBIAR EL VOLUMEN.........................................................................................3 Ejemplo 3.1 Expansión isotérmica de un gas ideal.........................................................................................4 3.4 CAMINOS ENTRE ESTADOS TERMODINÁMICOS ...........................................................................................5 3.5 ENERGÍA INTERNA Y LA PRIMERA LEY DE LA TERMODINÁMICA ..............................................................6 Ejemplo 3.2 – Quemar el postre.......................................................................................................................8 Ejemplo 3.3 – Diagrama pV .............................................................................................................................9 Ejemplo 3.4 Trabajo en diagrama pV..............................................................................................................9 Ejemplo 3.5 Termodinámica del agua hirviendo.......................................................................................... 10 5.6 CLASES DE PROCESOS TERMODINÁMICOS.................................................................................................11 5.7 ENERGÍA INTERNA DE GAS IDEAL................................................................................................................ 13 5.8 CAPACIDAD CALORÍFICA DE UN GAS IDEAL ............................................................................................... 14 Ejemplo 3.6 Enfriamiento de una habitación................................................................................................ 17 3.9 PROCESOS ADIABÁTICOS PARA UN GAS IDEAL........................................................................................... 18 Ejemplo 3.7 Compresión adiabática en un motor diesel .............................................................................. 21 Ejemplo 3.8 Trabajo efectuado en motor diesel............................................................................................ 22 PROBLEMAS ......................................................................................................................................................... 23 1 3 – La primera ley de la termodinámica 3.2 Sistemas y procesos termodinámicos Sistemas termodinámicos – sistema que puede interactuar (o intercambiar energía) con su entorno – 2 formas = trabajo W + calor Q Procesos termodinámicos – cambios de estado del sistema Tanto W que Q puede ser positivo o negativo • Q > 0 flujo de calor hacia el sistema - energía entra en el sistema • W > 0 el sistema hace un trabajo sobre su ambiente – energía sale del sistema 2 3.3 Trabajo realizado a cambiar el volumen Consideramos un gas en un cilindro con un pistón móvil ⇒ ejemplo censillo de un sistema termodinámico Al expandir se en el cilindro elgas empuja la superficie de sus fronteras que se mueven hacia afuera ⇒ W > 0el gas hace un trabajo sobre su ambiente – el principio también se aplica a sólido o líquido • Suponga un área transversal del cilindro A y una presión p , la fuerza del gas sobre el pistón será F = pA • El pistón se mueve de una distancia dx y el gas hace un trabajo W = Fdx = pAdx • De otro lado el incremento de volumen será dV = Adx (3.1) dW = pdV Para un cambio finito de volumen: (3.2) W= V2 ∫ pdV V1 A presión constante: (3.3) W = p (V2 − V1 ) Y a volumen constante W = 0 También W > 0 el gas se expande y W < 0 el gas se contracta Si la presión es variable, se usara un grafico pV - la ecuación 3.2 corresponde al área debajo de la curva de variación de p en función de V 3 Ejemplo 3.1 Expansión isotérmica de un gas ideal El gas cambia de volumen de V1 a V2 a temperatura constante T Usando la ecuación 3.2 V2 W = ∫ pdV V1 Usando la expresión p = nRT tenemos que V W = nRT ∫ V2 V1 dV V = nRT ln 2 V V1 Como el gas se expande V2 > V1 y W > 0 el sistema hace un trabajo sobre su entorno Como T es constante también tenemos la relación siguiente: V p p1V1 = p2V2 o bien 2 = 1 V1 p 2 Por lo tanto: W = nRT ln p1 p2 Como el gas se expande p 2 < p1 y por lo tanto W > 0 4 3.4 Caminos entre estados termodinámicos Camino – cambio de un estado inicial a estado final – puede haber multitud de manera (estados intermediarios continuos) de llegar al mismo estado El trabajo realizado por el sistema depende del camino – no solamente del estado inicial y final Vimos también que Q el cambio de calor es equivalente a un trabajo mecánico – por lo tanto también Q depende del camino Ej. Un gas en expansión libre (b) no hace trabajo – a la diferencia de un gas en expansión a temperatura constante en un cilindro con un pistón (a) – los dos estados final tie ne mismo volumen y temperatura – los dos estado finales son similares – pero llegamos a este con caminos diferentes ⇒ Un Ciclo – estado inicial = estado final, pero esto no quiere decir que W o Q son ceros durante el ciclo 5 3.5 Energía interna y la primera ley de la termodinámica La energía interna ( U ) de un sistema es la suma de las energías cinéticas de todas sus partículas constituyentes, más la suma de todas las energía potenciales de interacciones entre ellas IMPORTANTE – no incluye interacción con entorno Durante un cambió de estado del sistema la energía interna puede cambiar de valor inicial U1 a un valor final U 2 y se denota el cambio como: ∆U = U2 − U1 Si agregamos calor a un sistema, sin realizar trabajo, la energía interna aumenta de ∆U = Q Si el sistema efectúa un trabajo W (expansión sobre entorno) sin agregar calor, sale energía del sistema y el cambio de energía interna es ∆U = −W En general: primera ley de la termodinámica (3.4) ∆U = Q − W (3.5) Q = ∆U + W A agregar calor, parte de la energía permanece en el sistema y otra parte puede efectuar un trabajo La primera ley de la termodinámica = generalización del principio de la conservación de energía ⇒ incluye la transferencia de energía como calor equivalente al trabajo mecánico • En todas las situaciones en que se parecía que la energía total no se conservara ha sido posible identificar nuevas formas de energía tal que la energía total esta conservada (Ej. eléctrica ∝ E 2 , magnética ∝ B 2 , relativista (fusión) E = mc2 Aunque U = ∑ K + ∑ P microscópica, no se puede calcular la energía de este modo ⇒ la descripción no es operativa = no se describe como determinar la energía a partir de cantidades físicas que no podamos medir directamente Pero la definición termodinámica ∆U = Q − W es operativa porque podemos medir Q y W , pero solamente define ∆U no U • No hay problema (similar a potencial) – definimos que la energía interna de un sistema tiene un cierto valor en alguien estado de referencia y luego usamos ∆ U para definir la energía interna en cualquier otro estado 6 Si bien Q y W dependen del camino ∆U no depende del camino ⇒el cambio de energía interna de un sistema durante un proceso termodinámico solamente depende del esta do inicial y final Como U → U ( p, V, T ) el cambio de energía depende solamente de estado del sistema Dos procesos importantes: 1. Cíclico – el estado inicial es igual al estado final ⇒ U2 = U1 y Q = W 2. Sistema aislado – no realiza trabajo ni cambia calor con su entrono Q = W = 0 y ∆U = 0 El ejemplo arriba del cuerpo humano no es realista ⇒ no es proceso cíclico – durante l a vida crecen órganos y músculos (aumenta masa) – también los múltiples procesos físicos-químicos son irreversibles ⇒ el sistema aumenta en entropía = el cuerpo envejece y muera Cambios infinitesimales: (3.6) dU = dQ − dW (3.7) dU = dQ − pdV 7 Ejemplo 3.2 – Quemar el postre ¿Cuantos tramos de escalera debe subir para quemar las 900 calorías que gano comiendo un postre si su masa es de 60 kg? Sistema = Usted + Tierra 1 caloría = 4190 J Asumimos eficiencia de conversión de energía alimentaría de 100% La energía ingerida: Q = 900 kcal ⋅ 4190 J = 3.77 ×10 6 J kcal Para subir a una altura h se necesita hacer un trabajo contra la gravedad de la Tierra: W = mgh = 60 kg ⋅ 9.8 m ⋅ h = 588 N ⋅ h s2 Para que el estado final sea igual al estado inicial se necesita que W = Q h= Q 3.77 × 106 J = = 6410 m o 6.4 km mg 588 N No es tan fácil quemar esta energía 8 Ejemplo 3.3 – Diagrama pV La figura muestra un proceso cíclico – el trabajo total es W = −500 J El trabajo es igual a la superficie debajo del camino – el trabajo en el tramo ab (expansión) es más chico que en el camino ba (compresión) por lo tanto W < 0 - el entorno hace un trabajo sobre el sistema Como el proceso es cíclico ∆U = 0 ⇒ Q = W = −500 J debe salir esta cantidad de calor del sistema Ejemplo 3.4 Trabajo en diagrama pV En el proceso ab se agrega 150 J de calor al sistema – en el proceso bd 600 J Como no hay cambio de volumen en el proceso ab W = 0 ⇒ ∆U = Q = 150J El proceso bd se efectúa a presión constante así que W = p (V2 − V1 ) = ( 8.0 × 10 4 Pa )( 5.0 × 10 −3 m 3 − 2.0 × 10 −3 m 3 ) = 240J Por lo tanto ∆U = Q −W = 600J − 240J = 360J El cambio total de energía durante el proceso abd es: ∆U = 150J + 360J = 510J Como ∆U es independiente del camino durante el proceso acd ∆ U = 510J Pero ahora el trabajo debe ser diferente, sobre el tramo ac: W = p (V2 − V1 ) = (3.0 × 104 Pa )( 5.0 ×10 −3 m 3 − 2.0 ×10 −3 m 3 ) = 90J Por lo tanto el cambio de calor debe ser Q = ∆U +W = 510J + 90J = 600J Siguiendo este camino el trabajo es menor y la cantidad de calor más baja que siguiendo el otro camino 9 Ejemplo 3.5 Termodinámica del agua hirviendo Necesitamos calcular el trabajo efectuado y el aumento de energía interna cuando 1 g de agua (1 cm3) se convierte en 1671 cm 3 de vapor a presión constante de 1 atm ( 1.013 × 10 5 Pa). El calor de vaporización es Lv = 2.256 × 106 ( J kg )( ) El trabajo es W = p (V2 − V1 ) = 1.013× 105 Pa 1671× 10−6 m3 − 1×10−6 m3 = 169J El calor agregado al agua es el de vaporización: Q = mLv = 10−3 kg ⋅ 2.256 × 106 J = 2256J kg El cambio de energía interna esta igual por lo tanto a: ∆U = Q −W = 2256J − 169J = 2087J El aumento de energía interna se asocia por mayor parte a las fuerzas moleculares que mantienen junta a las moléculas en el estado líquido Estas fuerzas son atractivas así que las energías potenciales correspondientes son mayores después de que se hay realizado trabajo para separar las moléculas y formar vapor Es como aumentar la energía potencial gravitatoria de un elevador alejándolo de l centro de la Tierra 10 5.6 Clases de procesos termodinámicos Tiene 4 clases específicos de procesos termodinámicos 1. Adiabáticos – sin transferencia de calor 2. Isobáricos – sin cambio de presión 3. Isotérmico s – sin cambio de temperatura 4. Isocóricos – sin cambio de volumen Proceso adiabático – sistema aislado o donde el cambio es demasiado rápido para permitir cambio de calor (3.8) ∆U = U2 − U1 = −W Expansión W > 0 la energía interna del sistema diminuye – el sistema hace trabajo sobre su entorno Compresión W < 0 la energía interna del sistema aumenta – el entor no hace un trabajo sobre el sistema En general, ∆U > 0 implica que T aumenta – el calor especifico es positivo Ej. motor a explosión – la compresión es casi adiabática - T aumenta a comprimir mezcla aire + combustible – la expansión es también adiabática con descenso de T Proceso isocórico – el trabajo W = pdV = 0 (3.9) ∆U = U2 − U1 = Q Toda la energía agregada en forma de calor se queda dentro del sistema Ej. calentar un volumen cerrado constante de sustancia 11 Proceso isobárico – W ≠ 0 (3.10) W = p (V2 − V1 ) Ej. Hervir agua a presión constante Proceso isotérmico – todo cambio de calor con el entorno debe se producir con lentitud tal que se mantenga el equilibrio térmico Como para un gas ideal U → U ( T ) entonces tenemos que ∆U = 0 o sea Q = W toda la energía que entre en el sistema debe salir con trabajo Para sustancia no ideal U → U ( p, T ) ⇒ ∆U ≠ 0 La figura muestra un diagrama pV para cada uno de los 4 procesos para una cantidad constante de gas ideal Para el proceso adiabático Q = 0 , por lo tanto una aumentación de volumen baja la temperatura Para el isocórico W = 0 y una baja de presión produce una baja de temperatura Para el proceso isotérmico ∆U = 0 y la presión disminuye a medida que se expande el gas Solamente aumenta la temperatura durante la expansión isobárica 12 5.7 Energía interna de gas ideal Par un gas ideal vamos a mostrar que U → U (T ) Consideramos un gas en expans ión libre (ver figura) – no hay agregación de calor y este gas no hace un trabajo por lo tanto Q = 0 , W = 0 y ∆U = 0 Esto también esta correcto para cualquier sustancia – no solamente gas ideal Si durante esta experiencia T cambia, pero no U entonces tenemos que U (T ,V ) o U ( T , p ) , pero si T no cambia, entonces U → U (T ) La experiencia muestra exactamente esto: un gas ideal (gas con baja densidad) en expansión libre no produce cambio de temperatura ⇒ U → U (T ) La energía interna de un gas ideal depende solamente de su temperatura Un gas no ideal (o alta presión y baja temperatura), del otro lado, tiene ∆T ≠ 0 durante su expansión por lo tanto U ( T, p) : las fuerzas intermoleculares cuando se expande el gas aumenta la energía potencial y la energía cinética disminuye ∆T < 0 el gas se resfría 13 5.8 Capacidad calorífica de un gas ideal Ya conocemos dos variantes de la capacidad calorífica molar – a volumen constante CV y a presión constante C p Pero si ni p o V son constante tiene una infinidad de capacidades caloríficas ¿Del otro lado, porque CV es diferente de C p ? La respuesta la da la primera ley de la termodinámica: • En un aumento de temperatura con V constante, el sistema no efectúa trabajo y el cambio de energía interna ∆ U es igual al calor agregado Q • En un aumento de temperatura con p constante, V debe aumentar si no T p = nR no podría ser constante V ⇒ A expandir se, la sustancia hace un trabajo (3.11) Q = ∆U + W Para un aumento de temperatura dado el cambio de energía interna de un gas ideal tiene el mismo valor sin importar el camino – por lo tanto esta ecuación indica que el aporte de calor a presión constante debe ser mayor que para un volumen constante porque se requiere energía adicional para el trabajo Por lo tanto C p > CV del orden de 40% En el caso del agua, el volumen disminuye durante el calentamiento entre 0o C y 4 o C ⇒ W < 0el aporte de calor es menor que en el caso de volumen constante y C p < CV 14 Relación entre C p y CV para los gas es ideales Consideramos un proceso a volumen constante: • colocamos n moles a temperatura T en un recipiente de volumen V y pongamos el recipiente en contacto térmico con un cuerpo más caliente • Una cantidad de calor dQ fluye hacia el gas y su temperatura aumenta dT dQ = nCV dT (3.12) • La presión aumenta, pero el gas no hace trabajo dW = 0 dU = Q = nCV dT (3.13) Consideramos ahora un proceso a presión constante: • Cilindro con pistón movible – el pistón se mueve apenas lo suficiente para guardar la presión constante • Pongamos el sistema en contacto con un cuerpo caliente • A fluir el calor hacia el gas, ele se expande y efectúa un trabajo dW = pdV dQ = nC p dT (3.14) • (3.15) En términos de temperatura dW = pdV = nRdT Substituimos 3.14 y 3.15 en la expresión para la primera ley: dQ = dU + dW (3.16) nC p dT = dU + nRdT Donde el cambio de energía interna es igual al dado por la ecuación 3.13 (porque U ( T ) ): nC p dT = nCV dT + nRdT (3.17) C p = CV + R 15 Resulta que muchos gases reales a presión moderada se ajustan a la relación por gases ideales Vemos en la tabla que las diferencias son muy cerca de R = 8.315 J mol ⋅ K La capacidad calorífica molar de un gas esta relacionada con su estructura molecular – la última columna de la tabla da la relación entre calores específicos γ= (3.18) Cp CV Como C p > CV ⇒ γ > 1 Esta cantidad desempeña un papel importante en los procesos adiabáticos Segundo la teoría cinética CV = Cp 3 3 5 R por lo tanto C p = CV + R ⇒ C p = R + R = R 2 2 2 5 2R = 1.67 muy cerca de las valores medidas para ga ses monoatómicos CV 3 2 R 5 7 Para mayor parte de los gases biatómicos a temperatura constante CV = R ⇒ C p = R 2 2 7 2R yγ= = 1.40 5 2R Así γ = = Recuerda que ∆U = nCV ∆ T que V sea constante o non 16 Ejemplo 3.6 Enfriamiento de una habitación Tiene 2500 moles de aire en una habitación típica Consideramos el aire con un gas ideal (γ = 1.40) y calculamos el cambio de energía a presión constante cuando la temperatura baja de 23.9o C a 11.6 o C (usando un aire acondicionado) Forma más fácil de llegar a la respuesta Para cualquier gas ∆ U = nCV ∆T Implica que solo necesitamos obtener CV De la ecuación 3.17 y 3.18 tenemos que γ = ⇒ CV = Cp CV = CV + R R = 1+ CV CV R 8.315 J J = = 20.79 γ − 1 1.400 − 1mol ⋅ K mol ⋅ K J Entonces ∆U = nCV ∆T = ( 2500 mol ) 20.79 (11.6K − 23.9K ) = − 6.39 × 10 5 J mol ⋅ K Otro método más complejo: Determinar el cambio de volumen y determinar el trabajo W = p∆ V Determinar el cambio de calor a partir de Q = nC p ∆T Usar la primera ley ∆U = Q − W 17 3.9 Procesos adiabáticos para un gas ideal Un proceso es aproximadamente adiabático si el sistema es bien aislado u ocurre con tal rapidez que no hay tiempo para que ocurra un flujo de calor apreciable Durante un proceso adiabático Q = 0 y ∆U = −W En la figura consideramos una expansión de Va a Vb ⇒ W > 0por lo tanto la energía interna diminuye y la temperatura baja Si el punto (a) esta en un isoterma T + dT el punto (b) será en un isoterma con T Por un gas ideal la curva adiabática siempre es más espinada que la isoterma Durante la compresión adiabática la situación invierte y la temperatura aumenta • El aire de tubos de salida de los compresores de aire usados en gasolineras o los equipos para pintar con pistola o para llenar los tanques de buceo siempre es más caliente que el aire que entra el compresor ⇒compresión rápida casi adiabática • Al inversa – enfriamiento adiabático – a abrir una botella gaseosa, el gas que se encuentra justo por encima de la superficie del líquido se expande rápidamente ⇒ expansión rápida casi adiabática – la temperatura baja tanto que el vapor de agua se condensa formando nube 18 IMPORTANTE en todos estos procesos calentar y enfriar implica suba o baja de temperatura ⇒ esto se debe al trabajo no al flujo de calor • Para cualquier proceso adiabático o non tenemos dU = nCV dT • El trabajo dW = pdV nCV dT = − pdV (3.19) Si eliminamos p usando la ley de los gases ideales nRT ⇒ nCV dT = − dV V dT R dV ⇒ + =0 T CV V Pero como (3.20) R C p − CV C p = = − 1 =γ −1 CV CV CV dT dV + ( γ − 1) =0 T V Como γ > 1 ⇒ γ − 1> 0 ⇒ dV y dT siempre tienen signos diferentes • Expansión adiabática dV > 0 produce baja de temperatura dT < 0 • Compresión adiabática dV < 0 produce una aumentación de la temperatura dT > 0 Para cambios finitos de temperatura podemos integrar 3.20 ln T + ( γ − 1) ln V = constante ⇒ ln TV γ −1 = constante (3.21) TV γ −1 = constante Entonces para dos estados inicial T1V1 y final T2V2 (3.22) T1V1γ −1 = T2V2 γ −1 19 También podemos convertir 3.21 en una relación entre p y V pV γ −1 V = constante nR pV γ = constante (3.23) Entonces para dos estados inicial p1V1 y final p 2V2 p1V1γ = p2V2γ (3.24) También podemos calcular el trabajo efectuado por un gas ideal durante un proceso adiabático Q = 0 y W =−∆U usando ∆U = nCV ( T2 − T1 ) W = nCV ( T1 − T2 ) (3.25) Usando pV = nRT (3.26) W= CV 1 ( pV ( pV 1 1 − p 2V2 ) = 1 1 − p 2V2 ) R γ −1 Si el proceso es una expansión la temperatura baja T1 > T2 ⇒ p1V1 > p 2V2 el trabajo es positivo Una compresión produce el inversa W < 0 Las condiciones de validad de las ecuaciones 3.22, 3.24 y 3.26 son 1. que los procesos son bastante rápido como para evitar intercambio de calor apreciable con el entorno Q = 0 2. pero bastante lento como para que el sistema no se aleja mucho del equilibrio térmico y mecánico También ecuaciones son validas de manera aproximativa fuera de estas condiciones 20 Ejemplo 3.7 Compresión adiabática en un motor diesel La relación de compresión de un motor diesel es de 15 – el aire de los cilindros se comprime a 115 de su volumen inicial (V1 V2 = 15 ) Vamos a calcular la presión y temperatura del aire comprimida cuando la presión inicial es 1.01 × 10 5 Pa y T = 300K En su mayor parte el aire es una mezcla de oxígeno y nitrógeno biatómicos (asumimos un gas idea con γ = 1.40 ) Usando la ecuación 3.22: γ −1 V T2 = T1 1 V2 = ( 300K ) (15 ) 0.4 = 886K Usando la ecuación 3.24 γ V 1.40 p 2 = p1 1 = (1.01 × 10 5 Pa ) (15 ) = 44.8 ×10 5 Pa = 44atm V2 Si la compresión hubiera sido isotérm ica la presión final habría sido mucho menor 15atm Pero con la temperatura aumenta durante una compresión adiabática la presión aumenta mucho – esta alta temperatura permite al gas encender se espontáneamente 21 Ejemplo 3.8 Trabajo efectuado en motor diesel Si el volumen del cilindro es inicialmente V1 = 1.00L = 1.00 ×10 −3 m 3 cual es el trabajo efectuado durante la compresión Usando pV = nRT determinamos primero la cantidad de moles n= 5 −3 3 p1V1 (1.01 × 10 Pa )(1.00 × 10 m ) = = 0.0405mol RT1 ( 8.315J mol ⋅ K )( 300K ) NOTA Pa = N Pa 1 y J = N ⋅ m por lo tanto = 2 m J m3 Usando la ecuación 3.25: J W = nCV ( T1 − T2 ) = ( 0.0405mol ) 20.8 ( 300K − 886K ) = −494J mol ⋅ K El trabajo es negativo porque el gas se comprima – el entorno hace un trabajo sobre el gas Otra manera de determinar el trabajo es de usar directamente la formula W= 1 ( p1V1 − p2V2 ) γ −1 22 Problemas 23 24 25 26 27 28