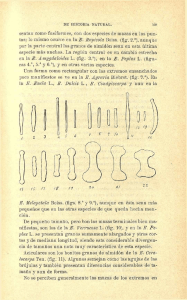
Biotecnología en alimentos en Hidalgo. Líneas de
Anuncio

Biotecnología y alimentos en Hidalgo. Líneas de investigación en desarrollo Luis Díaz Batalla Carlos Alberto Gómez Aldapa Javier Castro Rosas Alejandro Téllez Jurado Coordinadores biotecnología y alimentos en hidalgo Líneas de investigación en desarrollo Biotecnología y alimentos en Hidalgo Líneas de investigación en desarrollo Luis Díaz Batalla Carlos Alberto Gómez Aldapa Javier Castro Rosas Alejandro Téllez Jurado Coordinadores Universidad Politécnica de Francisco I. Madero Universidad Politécnica de Francisco I. Madero Km. 2. Carretera Tepatepec–San Juan Tepa, Francisco I. Madero, Hidalgo, cp 42660 isbn: 978–607–9260–14–9 Presentación El Estado de Hidalgo ha definido las áreas estratégicas en ciencia, tecnología e innovación, en las cuales habrá de establecerse como referente nacional en los próximos años. La agrobiotecnología es una de estas cinco áreas estratégicas seleccionadas. En este contexto se presenta Biotecnología y Alimentos en Hidalgo. Líneas de Investigación en Desarrollo, una muestra de los temas y las líneas de investigación que se desarrollan en las instituciones de educación superior del Estado de Hidalgo. Además de contribuir en la divulgación de las actividades de los grupos de investigación invitados, como colaboradores en el presente trabajo, se pretende permear en la dinámica interinstitucional que favorezca la colaboración y el desarrollo conjunto. La realización del presente trabajo contó con el apoyo del Fondo Mixto conacyt–Gobierno del Estado de Hidalgo a través del proyecto fomix–Hidalgo 2012–01–192649; Fortalecimiento a las líneas innovadoras de investigación aplicada y desarrollo tecnológico (liiadt) del área de biotecnología y alimentos del Estado de Hidalgo. 5 6 AVANCES Y PERSPECTIVAS DE INVESTIGACIÓN LGAC: TECNOFUNCIONALIDAD Y NUTRICIÓN MOLECULAR DE COMPUESTOS BIOACTIVOS Alanís–García E.*, Cruz–Cansino N.S., Manríquez–Torres, J.J., Ariza–Ortega J.A., Delgado–Olivares L., Ramírez–Moreno E. Área Académica de Nutrición/Cuerpo Académico de Nutriología. Instituto de Ciencias de la Salud. Universidad Autónoma del Estado de Hidalgo. Carretera Actopan–Tilcuautla, Ex–Hacienda La Concepción, San Agustín Tlaxiaca, Hidalgo, México. CP 42086. Tel. (01–771) 71–72000. ext. 4312. correo electrónico: ernesto_ [email protected] Resumen Uno de los aspectos importantes de estudio de la línea de investigación Tecnofuncionalidad y Nutrición Molecular de Compuestos Bioactivos, perteneciente al Cuerpo Académico de Nutriología, es evaluar los cambios que sufren los compuestos bioactivos durante el procesamiento de los alimentos, así como el aislamiento y caracterización molecular de estos compuestos. Por lo que a continuación se hace una breve revisión sobre los avances de investigación y perspectivas de estudio. Efecto del ultrasonido sobre los compuestos bioactivos en jugos de frutas Cruz–Cansino N.S. En la actualidad, los métodos más comunes para el procesamiento de alimentos son los tratamientos térmicos, que implican la aplicación de calor, debido a su capacidad para inactivar microorganismos y algunas enzimas responsables del deterioro y descomposición de alimentos [1–3]. Sin embargo, el tratamiento térmico en condiciones severas puede inducir cambios físicos 7 y químicos, tales como la desnaturalización de proteínas, pardeamiento no enzimático, disminución del contenido o la biodisponibilidad de algunos compuestos bioactivos, entre ellos las vitaminas, así como compuestos volátiles, causando efectos no deseados en los alimentos [4]. Existen métodos alternativos a la pasteurización y a la esterilización, los cuales están ganando importancia debido a que tienen un impacto menor sobre el contenido nutricional en los alimentos [5]. Aunado a esto, en los últimos años las modificaciones en el estilo de vida en los países desarrollados han supuesto una serie de nuevas demandas en lo que a calidad, diversidad y aspecto nutricional se refiere. Entre los factores que más han influido se puede destacar la creciente preocupación de los consumidores por la salud y por la relación dieta–salud. Por lo que para dar respuesta a las necesidades y por los factores sociales, se han producido una serie de avances muy importantes tanto en la conservación como en el procesado de alimentos en las últimas décadas [6]. Esto ha generado una gran cantidad de “tecnologías emergentes” que se encuentran disponibles para ser aplicadas; algunas de ellas son conocidas y utilizadas desde hace mucho tiempo y otras desarrolladas solo a nivel experimental de planta piloto o laboratorio, que tienen expectativas promisorias de aplicación industrial. Estas tecnologías emergentes, tales como el procesamiento de ultra–alta presión, campos eléctricos pulsantes, la extracción de fluido supercrítico, microfluidización, tratamiento con luz ultravioleta y tratamiento con ultrasonido se han identificado como tecnologías particularmente prometedoras para el procesamiento de alimentos, las cuales han sido exploradas para mejorar la vida de anaquel, preservar el contenido nutricional y las cualidades sensoriales [7]. Entre todas estas tecnologías, el ultrasonido puede ser una tecnología económica, sencilla, respetuosa con el medio ambiente y eficaz para lograr una disminución de la carga microbiana, sin afectar de manera significativa, las características sensoriales y nutricionales de los jugos procesados [8, 9, 2, 10]. 8 Ultrasonido El ultrasonido se refiere a las ondas de sonido por encima de la frecuencia del oído humano (>20 kHz). Cuando el ultrasonido de alta intensidad pasa a través de un medio, surgen vibraciones que pueden dañar partículas sólidas presentes en el medio. Este efecto es causado por cavitación acústica, que involucra el crecimiento y colapso de microburbujas pre–existentes en líquidos. La coalescencia supone la liberación de toda la energía acumulada, ocasionando incrementos de temperatura instantáneos y focales, que se disipan sin que supongan una elevación sustancial de la temperatura del líquido tratado. Sin embargo, la energía liberada, así como el choque mecánico asociadas al fenómeno de implosión, afectan la estructura de las células situadas en el micro entorno [8, 11, 2, 12]. Estos cambios de presión y temperatura permiten la destrucción de los microorganismos [8, 10]. El mecanismo consiste en que las burbujas al alcanzar un tamaño crítico, se colapsan violentamente. Con este violento colapso se libera energía que depende de la cinética del crecimiento de la burbuja, ocasionando cizallamiento de las paredes celulares que conducen a la muerte celular, inactivando los microorganismos [13, 14]. El ultrasonido puede ser usado para la extracción de compuestos fenólicos desde las estructuras vasculares por la ruptura del tejido vegetal, extracción de betacianinas y betalainas, extracción de lípidos y proteínas a partir de semillas de plantas, tales como la soya, la mejora de la extracción de aceite a partir de semillas oleaginosas; permeabilización de la membrana celular de las frutas, tales como uvas, ciruelas y mango, purés, salsas y productos lácteos mejorando la estabilidad de las dispersiones [14], así como en el procesamiento de jugos de frutas como naranja, sandía, melón, tuna púrpura y verde, toronja, lima y guayaba [12, 15–21]. Fenoles totales En un estudio realizado con jugo de sandía en donde se sometió a tratamiento de termosonicación a 1500 W, con variables de proceso de temperatura (25–45 °C), niveles de amplitud (24.1–60 9 µm) y tiempo (2–10 min) a una frecuencia constante de 20 kHz en 5 segundos encendido y 5 segundos de apagado, se encontró un contenido de compuestos fenólicos de 13.89 mg EAG/100 mL en jugo sin sonicar. La temperatura tuvo un efecto significativo en el contenido de fenoles totales, ya que se presentó una disminución de estos, cuando la temperatura aumentó de 25 a 45 °C, este efecto fue más prominente a tiempos mayores de proceso y la retención del contenido de compuestos fenólicos fue de 83.23%, 63.11%, 41.56% a 45 °C, en tiempos de 2, 6 y 10 min, respectivamente, después de aplicar termosonicación [15]. En jugo de melón, se aplicaron intensidades de 75, 226 y 376 W/cm2 con potencias de 100, 300 y 500 W, con una temperatura inicial de 4 °C por 10 min. Se observó que el tiempo y las intensidades de proceso de ultrasonido no tuvieron efecto significativo sobre el contenido de compuestos fenólicos totales. Así pues, en todos los ensayos, el contenido de compuestos fenólicos del jugo de melón disminuyó hasta un 30%. Esto puede ser debido a la formación de radicales libres OH que pudieron haber afectado a los compuestos fenólicos del jugo [16]. En un estudio de puré de uva, se aplicó la intensidad de 2 W/cm2 con potencia de 360 W, temperatura entre 60 y 80 °C y tiempo de 5 a 15 min. Se encontraron que todas las muestras tratadas tuvieron un alto contenido de compuestos fenólicos (114.3%) [22]. En el jugo de tuna púrpura (Opuntia ficus–indica) se evaluó el efecto a diferentes niveles de amplitud y tiempo de ultrasonicación (40% y 60% por 10, 15 y 25 min; 80% por 3, 5, 8, 10, 15 y 25 min). Los resultados mostraron que el contenido de fenoles totales en la muestra control fue de 1654.6 mg EAG/L. Después de aplicar el tratamiento de ultrasonido a 40% y 60% de amplitud por 15 y 25 minutos, respectivamente, tuvieron entre 1925 a 1950 mg EAG/L, y los tratamientos a 80% de amplitud por 5 a 8 minutos tuvieron una liberación significativa respecto al control de contenido de fenoles totales (2077.4 mg EAG/L y 2160.7 mg EAG/L, respectivamente) [17]. Por otro lado en jugo de tuna blanca aplicando los tratamientos anteriores, se encontró una cantidad apreciable de compuestos bioactivos principalmente en el tratamiento al 80% por 25 min 10 con 1366.2 mg EAG/L, más del 40% con respecto al jugo sin ultrasonicar [18]. La liberación de los compuestos fenólicos fue resultado del rompimiento de la pared celular por el tratamiento de ultrasonido, ya que los compuestos fenólicos se encuentran unidos a polisacáridos o proteínas de la pared celular, resultando este tratamiento más efectivo que el uso de enzimas [22]. Acido ascórbico Aadil y colaboradores [19] evaluaron el efecto de sonicación en el jugo de toronja, en tiempos de 30, 60 y 90 min, con frecuencia de 28 kHz y 600 W de potencia y temperatura de 20 °C. Estos autores reportaron que aunque el calor y el oxígeno son los principales factores responsables de la degradación de la vitamina C, se observó un aumento significativo de 31.81 mg/100 mL, 35.40 mg/100 mL, 35.75 mg/100 mL en los tratamientos de termosonicación con los tiempos de 30, 60 y 90 min, respectivamente comparados con la muestra control, la cual fue de 27.83 mg/100 mL. En jugo de lima sonicado durante 30 y 60 min a 20 °C a 25 kHz de frecuencia, se observó un aumento significativo en el contenido de ácido ascórbico después de los tratamientos de sonicación, en donde se obtuvo 39 mg de ácido ascórbico/100 mL en un tiempo de 30 min, de 40.20 mg de AA/100 mL en un tiempo de 60 min, comparados con la muestra control, el cual fue de 37.68 mg de AA/100 mL [20]. Cheng y colaboradores [21], estudiaron el efecto de la sonicación en la calidad del jugo de guayaba a 35 kHz por 30 min, en un intervalo de temperatura de 15–20 °C. Los resultados indicaron un aumento en el contenido de ácido ascórbico en todas las muestras en comparación con la muestra control. En jugo de naranja se aplicaron condiciones de proceso de 1500 W, con frecuencia constante de 20 kHz, amplitud de 24.4–61.0 µm, a temperatura de 5–30 °C y tiempo de 0–10 min. Los resultados indicaron que el aumento de la temperatura y amplitud, dio lugar a una mayor pérdida de ácido ascórbico. Esto es debido, a que la actividad cavitacional disminuye cuando aumenta la temperatura, además, el gran número de burbujas de cavitación formadas, sirve como una barrera que amortigua 11 la energía ultrasónica, formando radicales hidroxilos y por tanto influye en la degradación del ácido ascórbico, la cual se divide en dos secciones que corresponden a la degradación aeróbica y anaeróbica [12]. Zafra y colaboradores [17] mostraron que los jugos de tuna púrpura tratados por ultrasonido presentaron valores similares a la muestra control, el cual fue de 352.6 mg AA/L, a excepción del jugo tratado a 80% de amplitud por 25 min, el cual fue de 415.6 mg AA/L. Mientras que en jugo de tuna blanca fueron los tratamientos a 80% por 10 min y 60% por 25 min, presentando alta concentración de ácido ascórbico (551 y 544 mg AA/L respectivamente) comparado con el control [18]. El incremento de ácido ascórbico en los estudios se atribuye al efecto causado por la baja temperatura en la sonicación y a la eliminación del oxígeno disuelto, el cual es esencial para la degradación del ácido ascórbico durante la cavitación producida por el tratamiento del ultrasonido [21]. Actividad antioxidante (abts y dpph) Zafra y colaboradores [17] en jugo de tuna púrpura mostraron en actividad antioxidante por abts valores similares a la muestra control (26.3 mg VCEAC/100 mL), en amplitud de 60% por 10 y 15 min y 80% por 15 minutos. Por otro lado, los resultados de DPPH mostraron una baja actividad antioxidante similar a la muestra control (4368.5 µmol ET/L), en amplitud de 40% por 25 min y 60% por 10 min, presentándose la mayor actividad antioxidante de 4812.9 µmol ET/L a amplitud de 80% por 15 min. En jugo de tuna blanca, la conservación de la actividad antioxidante presente en el jugo fue principalmente en tratamientos mayores a 15 min en abts, especialmente el tratamiento a 80% por 15 min (102.60 mg VCEAC/100 mL), mientras que los resultados de actividad antioxidante por dpph, mostraron que la mayoría de los jugos ultrasonicados fueron similares a la muestra control (3340 μmol ET/L), a excepción de los jugos tratados a 40% por 15 min, 80% por 5 min y 8 min, los cuales presentaron altos valores en un intervalo de 4600 a 4800 μmol ET/L [18]. El mayor componente responsable de la actividad antioxidante y de la captación de ra12 dicales libres por DPPH, son los compuestos fenólicos y vitamina C especialmente en frutas cítricas [19]. La estabilidad o incremento de la actividad antioxidante por ABTS y DPPH es debido a la liberación del ácido ascórbico o de los compuestos fenólicos que pueden actuar como aceptores de radicales o interruptores de cadena [1]. Estos componentes tienen el potencial de secuestrar los radicales libres que causan daño al organismo humano y también reducir el riesgo de muchas enfermedades originadas del estrés oxidativo. Implicaciones tecnológicas y fisiológicas de β– glucanos Alanís García E. Los beta–glucanos son fibra soluble que se encuentran localizados en las paredes celulares del endospermo de los cereales. Son polisacáridos lineales compuestos de unidades repetidas de D–glucopiranosil, unidos por una mezcla de enlaces glucosídicos β–(1 3) y β–(1 4). Tanto la avena como la cebada son ricas fuentes de β–glucanos. La cantidad total de estos en avena y cebada está determinada tanto por condiciones ambientales como genéticas [23]. Los β–glucanos de cebada y avena difieren tanto en sus propiedades moleculares como estructurales, tales como peso molecular, solubilidad, proporción de enlaces β–(1 3)/β(1 4), y conformación. Debido a sus propiedades fisicoquímicas, los β– glucanos son usados en la industria de alimentos como sustitutos de grasa, estabilizantes, y agentes espesantes. Los β–glucanos también han obtenido un gran interés en el diseño de alimentos funcionales, debido a sus referencias como ingrediente en alimentos potencialmente promotores de la salud [24]. Las multifuncionales de los β–glucanos en diferentes sistemas de alimentos permiten su incorporación en un amplio rango de productos [25]. Estos pueden incluir helados bajos en grasa, quesos bajos en grasa, quesos blandos, y salchichas bajas en grasa. Hay también algunos reportes que indican que estas molécu13 las pueden tener propiedades funcionales útiles en la estructura de alimentos, por ejemplo en promover el espumado y emulsificación [26]. Otras aplicaciones de los β–glucanos, reportados en las pasadas dos décadas, son las sopas, salsas, bebidas [27]. Cuando fueron incorporados a tales productos tuvo la capacidad de remplazar el uso de espesantes convencionales. Durante cientos de años, los chinos y los japoneses han utilizado extractos de β–glucanos para prevenir enfermedades. Fue en las últimas décadas que se ha identificado al β–glucanos como un ingrediente activo. Los β–glucanos son moléculas que se encuentran en una variedad de sustancias, en especial setas, levaduras, avena y cebada. El tipo específico de β–glucanos viene determinado por el número de moléculas de glucosa que se ramifican de la estructura básica. Las que se extraen de los granos tienden a ser tanto solubles como insolubles [28]. Propiedades funcionales y tecnológicas La vinculación mixta (1g3) (1g4)–β–D–glucanos (β–glucanos) del endospermo de los granos de cereales son apreciables hidrocoloides industriales y han demostrado ser componentes importantes de fibra dietética fisiológicamente activos. Los β–glucanos son polisacáridos lineales, solubles en agua, de alto peso molecular, ellos dan viscosidad que está relacionada con el peso molecular y es fuertemente dependiente de la concentración que presentan. Los β–glucanos de avena han demostrado reducir los niveles de colesterol elevados en la sangre e incluso tener un efecto de equilibrio en la glucemia postprandial y la respuesta de la insulina. La principal diferencia entre los β–glucanos de avena y la cebada es el tamaño de las moléculas, los β–glucanos de granos de cebada es de aproximadamente dos terceras partes del tamaño de β–glucanos de avena [29]. El interés en la producción y el uso de β–glucanos aislados de cereales en los alimentos se debe a sus beneficios potenciales para la salud. Si un producto contiene al menos 0.75 g β–glucanos por porción, la Administración de Alimentos y Medicamentos (fda, por sus siglas en ingles) lo declara con propiedades sa14 ludables sobre el efecto reductor del colesterol y por lo tanto para un riesgo reducido de la enfermedad cardíaca coronaria [29]. La viscosidad de β–glucanos también tiene un efecto sobre la calidad sensorial global del producto al cual se le añade. La elevación de la viscosidad intestinal por alto peso molecular de β–glucanos es importante para su eficacia fisiológica. La alta viscosidad parece ser crucial para lograr el efecto positivo de β–glucanos en el pico de glucosa en la sangre, lo que significa que los β–glucanos de alto peso molecular son fisiológicamente más eficaz que los de bajo peso molecular, ya que se demostró que las propiedades funcionales de los β–glucanos son determinadas por sus características estructurales y de peso molecular. El peso molecular de un trisacárido favorece la formación de gel y su proceso de gelificación es más rápido en comparación con el peso molecular de un tetrasacárido. Los β–glucanos también demuestran un comportamiento inusual mediante la formación de gel más rápido y produciendo geles más fuertes con un menor peso molecular [29]. Congelar y conservar alimentos puede cambiar las propiedades fisiológicas y químicas de los β–glucanos, especialmente el alto peso molecular de los β–glucanos ha demostrado ser sensible a procesamiento; ya que puede afectar la solubilidad y disminuir el peso molecular de los β–glucanos [29]. El uso potencial de β–glucanos como hidrocoloides en la industria de la alimentación se basa principalmente en sus características reológicas, es decir, su capacidad de gelificación que son determinadas por sus características estructurales y su peso molecular ya que a menor peso molecular mayor gelificación, esto debido a las cadenas con peso molecular bajo que tienen mayor movilidad por lo que se promueven interacciones intermoleculares de la cadena que conducirá al proceso de gelificación más rápido y formación de geles más fuertes, por otra parte su capacidad de aumentar la viscosidad de las soluciones acuosas pueden ser utilizados como estabilizadores, sustitutos de la grasa en los productos alimenticios de tipo emulsión [30]. 15 Efectos de los β–glucanos sobre la salud En general los β–glucanos son un componente importante de la fibra alimenticia soluble, con gran influencia en los valores nutricionales y propiedades funcionales de la comida. Los β–glucanos están relacionados con las propiedades hipocolesterolémicas de la avena y la cebada, y de los alimentos que contienen estos granos, a través de la disminución de la absorción intestinal de colesterol y ácido bílico durante la interacción con los β–glucanos; la acción en el hígado, que pasa de sintetizar colesterol a producir ácido bílico; y la fermentación por las bacterias intestinales a ácidos grasos de cadena corta (agcc) que son absorbidos e inhiben la síntesis de colesterol hepático [31]. Es importante mencionar que los β–1,3 glucanos mejoran las defensas del sistema inmunológico humano contra invasores externos optimizando la habilidad de macrófagos, neutrófilos y otras células asesinas para responder y combatir un amplio rango de amenazas tales como bacterias, virus, hongos y parásitos. Se ha reportad que existe un renovado interés en la utilidad potencial de los β–glucanos como droga radioprotectora en quimioterapia, terapia de radiación y emergencias nucleares, sobre todo porque los glucanos pueden usarse no sólo como tratamiento sino también como profiláctico [32]. En el 2005, la fda ha incluido los β–glucanos en la lista de productos que contribuyen a una disminución del colesterol en la sangre, estableciendo también el protocolo de etiquetado de los productos que contienen estos polímeros buscando resaltar sus efectos positivos sobre la salud humana [33]. Por su parte, la Agencia Europea de Seguridad Alimentaria (efsa por sus siglas en ingles) también ha publicado sus propias conclusiones acerca de los efectos beneficiosos de los β–glucanos sobre la salud, que serían el mantenimiento de unos niveles normales de concentración de colesterol–ldl en la sangre, un incremento de la sensación de saciedad que conlleva una reducción en la ingesta de energía, con una reducción de las respuestas glucémicas postprandiales, y con una mejora de la función digestiva [34]. Actualmente se ha realizado estudios sobre extracción y caracterización funcional de β–glucanos de variedades de cebada 16 cultivadas en los estados del centro del país, con las cuales se propone realizar caracterización molecular y funcional de importancia fisiológica y tecnológica. Así como los cambios moleculares que sufren β–glucanos durante el procesamiento del alimento y como repercute en su funcionalidad. Los productos naturales y su importancia como fuente de nutracéuticos Manríquez Torres J.J. La importancia de los productos naturales como fuente para el desarrollo de nuevos fármacos está avalada por datos estadísticos, planteándose en la literatura, que se calcula que la probabilidad de que cada uno de ellos posea actividad farmacológica es treinta veces mayor que la probabilidad de que una sustancia sintética exhiba ese tipo de actividad. Por otro lado existe una fuerte tendencia a nivel mundial en lograr una mayor calidad de vida, por lo que se ha incrementado el consumo de productos dietéticos, nutracéuticos y farmacéuticos obtenidos a partir de fuentes naturales, sobre todo en los grandes mercados internacionales (Europa, Estados Unidos, Japón, entre otros). Los conocimientos tradicionales están estrechamente vinculados a la diversidad biológica de los países en vías de desarrollo, siendo América Latina y en particular la región de centro américa un buen ejemplo de esto. Existen numerosos conocimientos indígenas asociados al uso de productos naturales con fines nutricionales y farmacológicos a lo largo de la historia de estas comunidades. Son numerosos los casos que se citan en la literatura sobre la apropiación y uso de materiales biológicos vinculados a los conocimientos indígenas de estos pueblos, por firmas de países desarrollados. Siempre ha habido un interés público y científico considerable en el uso de los productos naturales para combatir enfermedades humanas tales como el cáncer, la inflamación o la diabetes. A pesar del progreso tecnológico en la química com17 binatoria, hoy en día las drogas derivadas de productos naturales todavía contribuyen grandemente en el descubrimiento de fármacos. Los productos naturales con actividad antioxidante han sido empleados desde tiempos remotos como remedios tradicionales para síntomas relacionados con la inflamación como fiebre, dolor, migraña y artritis. Actualmente, varias sustancias naturales que poseen actividad antioxidante son conocidas, exhibiendo un amplio espectro de acciones que interfieren directa o indirectamente con varios mecanismos y mediadores de la inflamación. Las estructuras de estos compuestos son diversas, encontrándose terpenoides, flavonoides, polifenoles, alcaloides y compuestos conteniendo azufre, entre otros [35]. Así mismo los medicamentos a base de productos naturales aprobados recientemente han sido ampliamente descritos en distintas revisiones, entre los cuales se incluyen compuestos de plantas (elliptinium, galantamina y huperzina), microbios (daptomicina) y animales (exenatida y ziconotida), así como compuestos sintéticos o semi– sintéticos basados en productos naturales (por ejemplo, tigeciclina, everolimus, telitromicina, micafungina y caspofungina) [36]. Aunque el aporte de los productos naturales en el desarrollo de fármacos ha sido excepcional, todavía falta mucho por hacer concerniente a la investigación del uso de plantas superiores como fuentes de nuevas sustancias con actividad biológica relevante. Se ha estimado que sólo una pequeña fracción de las más de 250,000 especies de plantas conocidas ha sido explorada química y farmacológicamente. México cuenta con una flora que se ha estimado entre 18,000 y 30,000 especies [37], de las cuales alrededor de 3,500 son empleadas en medicina tradicional [38]. En el estado de Hidalgo se han registrado al menos unas 2,670 especies vegetales [39], de las cuales 460 se emplean como medicinales. De estas 460 plantas hidalguenses al menos 42 han sido empleadas en medicina tradicional para el tratamiento de síntomas relacionados con la inflamación y el cáncer (Tabla 1). Algunas de estas especies ya han sido exploradas en su composición química y los resultados de estas investigaciones han justificado, en la mayoría de los casos, el uso tradicional de las plantas. 18 Tabla 1A Ejemplos de plantas medicinales del estado de Hidalgo usadas en el tratamiento de enfermedades crónico degenerativas [39]. Especie FaFamilia Acanthaceae Nombre común Justicia spicigera Schidl. Muicle Thumbergia alata Bojer Árnica Alliaceae Milla biflora Cav. Estrellita Anacardiaceae Spondias mombin L. Jobo Spondias purpurea L. Ciruela Apocynaceae Catharanthus roseus (L.) G. Ninfa Don Asteraceae Aphanostephus ramosissimus Manzanilla DC. rrona Artemisia klotzchiana Besser. Cola de zorra Bidens odorata Cav. Rosilla Calendula officinalis L. Mercadela Erigeron pubescens HBK. Manzanilla rrona Heterotheca inuloides Cass. Árnica Matricaria chamomilla L. Manzanilla Parthenium (Ort.) Rollins cima- cima- bipinnatifidum Confitillo Pinaropappus roseus (Less.) Ispul Less. var. roseus Senecio confusus Britten Árnica Senecio platanifolius Benth. Hierba del zopilote Stevia pilosa Lag. Sopita* Stevia Willd. eupatoria (Spreng.) Hierba del borrego* Taraxacum officinale Weber Diente de león Burseraceae Bursera simaruba (L.) Sarg. Chaca Cupressaceae Juniperus deppeana Steud. Tláxcal Euphorbiaceae Jatropa dioica Sessé ex Carv. Sangre de drago var. dioica 19 Geraniaceae Erodium L’Herit. (L.) Alfilerillo cicutarium Pata de león Geranium bellum Rose Gramineae Cymbopogon Stapf. Lamiaceae Prunella vulgaris L. Hierba del cáncer Leguminosae Cassia fistula L. Lluvia de oro Senna occidentalis L. Retama Cuphea aequipetala Cav. Hierba del cáncer Cuphea lanceolata Ait. Hierba del cáncer Cuphea procumbens Ort. Hierba del cáncer Lytrum vulneraria Schrank Hierba del cáncer Malvaceae Malva parvifolia L. Malva Onagraceae Oenothera rosea L’Her. ex Ait. Hierba del golpe Rutaceae Decatropis bicolor (Zucc.) Rad- Aranthó lk. Lythraceae (DC.) Té limón citratus Scrophularia- Mimulus glabratus HBK. ceae Hierba del cáncer de agua Solanaceae Datura stramonium L. Toloache Solanum rostratum Dun. Duraznillo Solanum verbascifolium L. Malabar Verbena elegans HBK. Moradita Verbenaceae Verbena Gal. teucriifolia Mart.& Moradita * [40] Actualmente en nuestro grupo de trabajo se estudian frutos comestibles abundantes en la región de la Huasteca Hidalguense, como lo son tuna (Opuntia ficus–indica), zarzamora (Rubus fruticosus) y granada (Punica granatum) en los cuales se realizan pruebas de actividad antioxidante, primero cuantificando los metabolitos antioxidantes presentes en los jugos (fenoles y ácido ascórbico), así como la capacidad antioxidante de los mismos (dpph, abts y porcentaje de quelación), posteriormente realizando extracciones con disolventes en orden de polaridad creciente (hexano, acetato de etilo y metanol) a los cuáles se medirá la 20 capacidad antioxidante por abts y dpph, los extractos bioactivos se someterán a separación mediante cromatografía en columna, cromatografía rápida y cromatografía en capa fina para obtener fracciones primarias, de las cuales se hará recromatografía, incluyendo hplc cuando sea el caso, para aislar sustancias puras. Las muestras se analizarán mediante métodos físicos, y espectroscópicos, principalmente por rmn de 1H y 13C, incluyendo experimentos apt, cosy, hmqc y hmbc. Estos experimentos son técnicas de rmn en una y en dos dimensiones que permiten observar la naturaleza de los carbonos, el acoplamiento entre protones y entre protones y carbono trece a uno, dos y tres enlaces. Cuando sea el caso, se llevará a cabo un estudio de modelado molecular, simulación espectral y análisis conformacional de las sustancias mediante rmn y cálculos teóricos, para lo cual se empleará software especializado y los programas MestreC, Gaussian y Spartan. Esto complementará el análisis y caracterización de los compuestos y contribuirá a la predicción de la interacción con receptores moleculares objetivos. Una vez concluidos estos estudios, los jugos serán sometidos a prueba de bioaccesibilidad in vitro, en la fracción dializada se realizará el seguimiento del compuesto bioactivo mayoritario por hplc. Lípidos, su importancia en la industria y en la nu- trición Ariza Ortega J.A. En términos generales, se distinguen dos tipos de lípidos que se encuentran en la flora y fauna que son de origen terrestre y marino [42]. Para iniciar el proceso de estudio, se tiene que identificar la fuente potencial de lípidos, una vez establecido el origen y la naturaleza, el primer paso es extraer la muestra de la materia prima, en donde la elección de una técnica de extracción está determinada por la naturaleza de la sustancia, el sustrato sobre el que se adsorbe y los análisis que se realizarán posteriormente. 21 El costo y el trabajo implicado, también puede ser un factor que influye en la selección de la técnica de extracción [43]. A la muestra obtenida se analizan sus propiedades físico–químicas (humedad, densidad, índice de refracción, cenizas, índices de acidez, peróxido, yodo, saponificación, materia insaponificable entre otros). Los métodos físico–químicos permiten clasificar la identidad, composición (pureza, autenticidad) y calidad (vida útil) de la grasa o aceite de forma cuantitativa [44]. Para la identificación y cuantificación de los compuestos químicos con actividad biológica y ácidos grasos simples y compuestos, se utilizan análisis instrumentales por ejemplo, espectroscopias (infrarroja con transformada de Fourier, Raman y Ultravioleta–Visible), cromatografías (en columna, líquida o gases), resonancia magnética nuclear y microscopía electrónica de barrido [45]. Dependiendo de la técnica instrumental elegida la muestra se procesa para su análisis, por ejemplo, si es analizada por espectroscopia de infrarrojo, la preparación es mínima. Sin embargo, no es el caso para otras técnicas como la cromatografía que implican una separación y un paso extra que es la metilación o derivatización de los triacilglicéridos con una mezcla de disolventes [43]. Una vez identificados y cuantificados a los ácidos grasos de la fuente lipídica, se analizan para su aplicación en diversos productos, que depende de la composición de ácidos grasos que influye en la características y sus usos finales de los productos oleoquímicos derivados, por ejemplo, los ácidos grasos de cadena media, como ácido láurico (C12:0), derivado principalmente de almendra de palma y los aceites de coco, son excelentes agentes tenso–activos que se utilizan extensivamente para la producción de jabones y detergentes. Otro ejemplo de ácidos grasos industrialmente importante derivado de las plantas es ácido erúcico (C22:1 ó w–3), que es un ácido graso de cadena muy larga. El ácido erúcico se utiliza para producir eruci–amida, que es un agente de deslizamiento para la producción de polietileno extruido y películas de propileno como es el plástico o bolsas para depositar la basura [46]. 22 Los dobles enlaces presentes en los ácidos grasos también representan excelentes puntos de partida para la modificación de los lípidos, por ejemplo, los lípidos se pueden tratar con una variedad de productos químicos para convertir los dobles enlaces de los ácidos grasos en grupos hidroxilo, y se obtienen polialcoholes que se pueden mezclar con compuestos tales como isocianato para formar poliuretanos (que es degradable en el medio ambiente), el poliuretano derivado del aceite vegetal tienen excelentes características físicas y se pueden realizar varias aplicaciones, como espumas de aislamiento de pulverización, espumas rígidas, espumas flexibles, piezas de automóviles de interiores, revestimientos, selladores, adhesivos y elastómeros [47]. Estos y otros tipos de modificaciones químicas en los aceites pueden crear compuestos nuevos y novedosos con interesantes propiedades, incluyendo di–ácidos de cadena media y larga, ácidos grasos con grupo hidroxi e insaturados [48]. Por otra parte, los aceites para fines industriales tienen que pasar por varias etapas de tratamiento con diversos productos químicos, para originar la estructura química que se requiera y obtener el producto final, estas reacciones y transformaciones químicas aumenta el costo y genera un daño ambiental. Sin embargo, existe una amplia variedad de ácidos grasos estructuralmente diversos, que se producen en las semillas oleaginosas de especies de plantas silvestres [49], y muchos de estos ácidos grasos son poco conocidos, por lo que representan fuentes potenciales para la industria. Entre estos ácidos grasos se encuentran los mono–insaturados de cadena corta, media o larga, ácidos grasos con grupos funcionales adicionales, como un grupo epoxi y grupos hidroxi, o ácidos grasos con enlaces conjugados o enlaces acetilénicos que se encuentran en la naturaleza [50]. Los aceites vegetales pueden ser utilizados cada vez más como lubricantes, debido a que son relativamente inertes, tienen un alto índice de viscosidad, alto punto de inflamación y baja volatilidad [51]. Por otra parte, un éxito reciente respecto al uso industrial de semillas oleaginosas es la tinta de soya, que se produce a partir 23 de aceite de soya que es una mezcla de pigmentos, resinas y ceras para hacer tintas de impresión degradables, de tal manera que casi un tercio de los periódicos de Estados Unidos, cartuchos para impresoras están usando tintas de soya para impresión en color [52]. Con respecto a la nutrición, los ácidos grasos poli–insaturados de cadena muy larga (agpicl) como son docosahexaenoico “C22:6, DHA” y el ácido eicosapentaenoico “C20:5, EPA” por mencionar algunos [53], le confieren flexibilidad, fluidez, permeabilidad selectiva a las membranas celulares, también puede ser metabolizados para producir moléculas de lípidos de señalización tales como eicosanoides, que son vitales para el desarrollo del cerebro, son efectivos en la prevención de enfermedades como el cáncer, cardiovasculares, diabetes y en enfermedades neurodegenerativas como Parkinson y Alzheimer [54]. Los agpicl se encuentran en muchos alimentos, incluyendo aplicaciones para fórmulas infantiles, suplementos dietéticos para adultos, alimentos para animales, aditivos alimentarios, y se utilizan como precursores para la producción de productos farmacéuticos [55] (et al., 2005). Sin embargo, ninguno de los agpicl se producen normalmente en las plantas superiores, algunos se han reportado en musgos [56], pero los principales organismos responsables de la producción de epa y el dha presente en la dieta humana son las algas marinas [57]. Los ácidos grasos producidos en estos organismos hacen su camino hasta la cadena alimentaria, que son acumulados en los aceites de pescado, que es la principal fuente de estos ácidos grasos para la nutrición humana [58]. Por lo anterior, en los últimos años ha habido un creciente uso de estos compuestos para la producción de materias primas alimenticias, cosmetológicas, farmacéuticas y como combustibles. Sin embargo, hay una necesidad de analizar la composición química de variedades y especies que no son aprovechadas, que pueden tener un valor nutricional y un uso potencial para la diversificación de productos. 24 Referencias 1. Ashokkumar, M; Sunartio, D; Kentish, S; Mawson, R; Simons, L; Vilkhu, K; Versteeg, C. 2008. Modification of food ingredients by ultrasound to improve functionality: A preliminary study on a model system. Innovative Food Science and Emerging Technologies. 9:155–160. 2. Soria, A.C; Villamiel, M. 2010. Effect of ultrasound on the technological propierties and bioactivity of food: a review. Trends in Food Science & Technology. 21: 323-331 3. Dubrović, I; Herceg, Z; Jambrak, AR; Badanjak, M; DragovićUzelac. 2011. Effect of high intensity ultrasound and pasteurization on anthocianin content in strawberry juice”. Food Technology Biotechnology. 49(2):196-204. 4. Kuldiloke, J; Naghi Eshtiaghi, M. 2008. Application of nonthermal processing for preservation of orange juice. KMITL Science Technology Journal. 8:64-74. 5. Piyasena, P; Mohareb, E; McKellar, R.C. 2003. Inactivation of microbes using ultrasound: a review. International Journal of Food Microbiology. 87: 207– 216. 6. Blanco, FC; Gómez PM; Ronda, BF; Caballero, C.P. 2006. Tendencias de la industria en el procesado y conservación de alimento. En: Técnicas avanzadas en el procesado y conservación de alimentos. Ed. Universidad de Valladolid. España. 7. Ashokkumar, M; Bhaskaracharya, R; Kentish, S; Lee, J; Palmer, M; Zisu, B. 2010. The ultrasonic processing of dairy products an overview. Dairy Science Technology. 90:147-168. 8. Earnshaw, RG; Appleyard, J; Hurst, RM. 1995. Understanding physical inactivation processes: combined preservation opportunities using heat, ultrasound and pressure. International Journal of Food Microbiology. 28:197-219. 9. Tiwari, B. K; O´Donell, CP; Cullen, PJ. 2009. Effect of sonication on retention of anthocyanins in blackberry juice. Journal of Food Engineering. 93:166–171. 10. Herceg, Z; Lelas, V; Jambrak, A.R; Vukušić, T; Levaj, B. 2013. Influence of thermo-sonication on microbiological safety, 25 color and anthocyanins content of strawberry juice. Journal of Hygienic Engineering and Design. 4:26-37. 11. Tiwari, BK; O´Donell. CP. Cullen, PJ. 2009. Effect of nonthermal processing technologies on the anthocyanin content of fruit juices. Trends in Food Science & Technology. 20:137-145. 12. Valdramidis, VP; Cullen, PJ; Tiwari, BK; O’Donnell , CP. 2010. Quantitative modelling approaches for ascorbic acid degradation and non-enzymatic browning of orange juice during ultrasound processing. Journal of Food Engineering. 96:449–454. 13. Cameron, M; McMaster, LD; Britz, TJ. 2009. Impact of ultrasound on dairy spoilage microbes and milk components. Dairy Science Technology. 89:83–98. 14. Demirdöven, A; Baysal, T. 2009. The use of ultrasound and combined technologies in food preservation. Food Reviews International. 25:1-11. 15. Rawson, A; Tiwari, BK; Patras, A; Brunton, N; Brennan, C; Cullen, PJ; O’Donnell, C. 2011. Effect of thermosonication on bioactive compounds in water-melon juice. Food Research International. 44:1875-1887. 16. Fonteles, VT; Maia-Costa, GM; Tibério de Jesús, AL; Alcântara de Miranda, M. R; Narciso-Fernandes, A. F; Rodrigues, S. 2012. Power ultrasound processing of cantaloupe melon juice: effects on quality parameters. Food Research International. 48:41-48. 17. Zafra-Rojas, Q; Cruz-Cansino, NS; Ramírez-Moreno, E; Delgado- Olivares, L; Sánchez-Villanueva, J; Alanís, E. 2013. Effects of ultrasound treatment in purple cactus pear (opuntia ficus-indica) juice”. Ultrasonics Sonochemistry. 20:1283-1288. 18. Cansino, N.C; Carrera, G.P; Rojas, Q.Z; Delgado-Olivarez L, García, E.A; Ramírez, E. 2013. Ultrasound Processing on Green Cactus pear (Opuntia ficus Indica) Juice: Physical, Microbiological and Antioxidant Properties. Journal Food Process Technology. 4:267. 19. Aadil, R. M; Zeng, X; Han, Z; Sun, D. W. 2013. Effects of ultrasound treatments on quality of grapefruit juice. Food 26 Chemistry. 141:3201-3206. 20. Bhat, R; Che Kamaruddin, N. S; Min-Tze, L; Karim, A.A. 2011. Sonication improves kasturi lime (Citrus microcarpa) juice quality. Ultrasonics sonochemistry. 18:1295-1300. 21. Cheng, L. H; Soh, C. Y; Liew, S. C; Teh, F. F. 2007. Effects of sonication and carbonation on guava juice quality. Food Chemistry. 104:1396-1401. 22. Lieu, LN; Le, MV. 2010. Application of ultrasound in grape mash treatment in juice processing. Ultrasonics Sonochemistry. 17:273-279. 23. Yalçın, E; Çelik, S; Akar, T; Sayim, I; Köksel, H. 2007. Effects of genotype and environment on b-glucan and dietary fiber contents of hull-less barleys grown in Turkey. Food Chem. 101:171-176. 24. Cloetens, L; Ulmius, M; Johansson-Persson, A; Åkesson, B; Önning, G. 2012. Role of dietary beta-glucans in the prevention of the metabolic syndrome. Nutrition Rev. 70(8):444-458. 25. Ahmad, A; Munir, B; Abrar, M; Bashir, S; Adnan, M; Tabassum. T. 2012. Perspective of -glucan as functional ingredient for food industry. J Nutr Food Sci. 2(2):133. 26. Burkus, Z; Temelli, F. 2000. Stabilization of emulsions and foams using barley ß-glucan. Food Res Int. 33:27-33. 27. Lyly, ćM; Roininen, K; Honkapaa, K; Poutanen, K; Lahteenmaki, L. 2007. Factors influencing consumers willingness to use beverages and ready-to-eat frozen soups containing oat [beta]-glucan in Finland, France and Sweden. Food Qual Prefer. 18:242-255. 28. Roberts, J. A., E’Obrien, M., Subak-Sharpe, G. 2003. Suplementos Nutricéuticos. En: Enciclopedia de la Medicina Ortomolécular Nutracéutica. Ed. Robin Book. Barcelona, España. 29. Lyly, M; Salmenkallio-M, M; Autio, K; Lähteenmäki, L. 2004. The sensory characteristics and rheological properties of soup containing oats and barley b-glucan before and after freezing. LWT-Food Scie. and Tech. 37 : 7749- 761. 30. Santipanuchwong, R; Suphantharika, M. 2009. Influence of 27 different b-glucans on the physical and rheological properties of egg yolk stabilized oil-in-water emulsions. Food Hydrocolloids. 23(5):1279-1287. 31. El Khoury, D; Cuda, C; Luhovyy, B.L; Anderson G.H. 2012. Beta Glucan: Health Benefits in Obesity and metabolic syndrome. J Nutr Met. 2012: 1-28. 32. Rondanelli, M; Opizzi, A; Monteferrario, F. 2009. The biological activity of β-glucans. Minerva Medica. 100: 237-245. 33. FDA. 2005. Food labeling: health claims; soluble dietary fiber from certain foods and coronary heart disease. Fed Regist. 70:76150-76162. 34. EFSA Panel on Dietetic Products, Nutrition and Allergies. 2011. Scientific Opinion on the substantiation of health claims related to b-glucans from oats and barley and maintenance of normal blood LDL-cholesterol concentrations (ID 1236, 1299), increase in satiety leading to a reduction in energy intake (ID 851, 852), reduction of post-prandial glycaemic responses (ID 821, 824), and “digestive function” (ID 850) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal. 9(6):21. 35. Wahlqvist, M., He, G., Yang, M., & Li, D. 2006. Natural products and anti-inflammatory activit. Asia Pacific Journal Of Clinical Nutrition. 15(2):143-152. 36. Harvey, A. 2008. Natural products in drug discovery. Drug Discovery Today. 13: 19-20. 37. CONABIO. 2012. CONABIO. (9 de Junio de 2014). http:// www.conabio.gob.mx/. 38. Martínez, M. 1991. Las plantas medicinales de México / The medicinal plants of Mexico. D.F, México, México: Ediciones Botas. 39. Pérez Escandón, B., Villavicencio Nieto, M., & Ramírez Aguirre, A. 2003. Lista de las plantas útiles del estado de Hidalgo. Pachuca de Soto, Hidalgo, México: UAEH. Mexico DF. 40. Argueta, A; Gallardo VM. 1994. Atlas de plantas de la medicina tradicional mexicana. Instituto Nacional Indignista. Mexico DF. 28 41. ButlerM. 2004. The role of natural product chemistry in drug discovery. Journal of Natural Products. 67:2141-2153. 42. Valenzuela, BA; Sanhueza CJ. 2009. Aceites de origen marino: su importancia en la nutrición y en la ciencia de alimentos. Rev Chil Nutr. 36(3):246-258. 43. Stauffer, E. 2005. A Review of the Analysis of Vegetable Oil Residues from Fire Debris Samples: Analytical Scheme, Interpretation of the Results, and Future Needs. J Forensic Sci. 51(5):1016-1032. 44. Allen, RR; Formo, MW; Krishnamurthy, RG; Mcdermott, GN; Norris, AF; Sonntag, OV. 1982. Bailley´s Industrial oil and fat Products. In: Physical properties of fats and fatty acids. Swern D (ed). John Wiley & Sons, New York. 45. Brondz, I. 2002. Development of fatty acid analysis by highperformance liquid chromatography, gas chromatography, and related techniques. Anal Chim Acta. 465:1–37. 46. Wang, YP; Sonntag, K; Rudloff, E. 2003. Development of rapeseed with high erucic acid content by asymmetric somatic hybridization between Brassica napus and Crambe abyssinica. Theor. Appl. Genet. 106: 1147-1155. 47. Mielewski, DF; Flanigan, CM; Perry, C; Zaluzec, MJ; and Killgoar, PC. 2005. Soybean oil auto applications: developing flexible polyurethane foam formulations containing functionalized soybean oil for automotive applications. Ind. Biotechnol. 1:32–34. 48. Metzger, JG; Roessler, P; Facciotti, D. 2001. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes. Science. 293: 290–293. 49. Aitzetmüller, K; Matthäus, B; Friedrich, H. 2003. A new database for seed oil fatty acids - the database SOFA. Eur. J Lipid Sci Technol. 105:92–103. 50. Cuperus, FP; Boswinkel, G; and Derksen, JTP. 1996. The processing of new oilseed crops – an economic evaluation. J Am Oil Chem Soc. 73: 1635–1640. 51. Erhan, SZ; Asadauskas, S. 2000. Lubricant basestocks from vegetable oils. Ind. Crop. Prod. 11:277–282. 29 52. Erhan, SZ; Bagby, MO; Cunningham, HW. 1992. Vegetable oil-based printing inks. J Am Oil Chem Soc. 69:251–256. 53. Kang, JX. 2005. Balance of omega-6/omega-3 essential fatty acids is important for health. World Rev Nutr Diet. 95:93-102. 54. Wall, R; Ross, RP; Fitzgerald, GF; Stanton, C. 2010. Fatty acids from fish: the anti-inflammatory potential of longchain omega-3 fatty acids. Nutr Rev. 68:280-289. 55. Domergue, F; Abbadi, A; Heinz, E. 2005. Relief for fish stocks: oceanic fatty acids in transgenic oilseeds. Trends Plant Sci. 10: 112–116. 56. Kaewsuwan, S; Cahoon, EB; Perroud, PF; Wiwat, C; Panvisavas, N; Quatrano, RS; Cove, D;J; Bunyapraphatsara, N. 2006. Identification and functional characterization of the moss Physcomitrella patens D5-desaturase gene involved in arachidonic and eicosapentaenoic acid biosynthesis. J. Biol. Chem. 281: 21988–21997. 57. Carlsson, A.S; van Beilen, J.B; Möller, R; Clayton, D. 2007. Micro- and Macro-Algae: Utility for Industrial Applications. Outputs from the EPOBIO Project. CPL Press. Newbury, UK. 58. Sargent, JR; Tacon, AGJ. 1999. Development of farmed fish: a nutritionally necessary alternative to meat. Proc. Nutr. Soc. 58:377–383. 30 INVESTIGACIÓN EN BIOPROCESOS AGROALIMENTARIOS Rodríguez–Hernández A. I., Vargas–Torres A., Chavarría–Hernández N. Cuerpo Académico de Biotecnología Agroalimentaria, Universidad Autónoma del Estado de Hidalgo. Av. Universidad km 1, Rancho Universitario, Tulancingo, Hidalgo. CP. 43600. Tel. 771 7172000, ext. 2425, correo electrónico: [email protected] Resumen El cuerpo académico de Biotecnología Agroalimentaria (caba) de la Universidad Autónoma del Estado de Hidalgo (uaeh) lleva a cabo investigaciones sobre biopolímeros, contemplando caracterización y aplicaciones alimentarias, y sobre fermentación sumergida para producir agentes antimicrobianos y bioinsecticidas. Este CA, formado por tres miembros, involucra la participación activa de estudiantes de licenciatura y posgrado que intervienen en el desarrollo de proyectos de investigación financiada, a través de sus trabajos de tesis y/o estadías. Palabras clave: Bioprocesos agroalimentarios, biopolímeros, películas comestibles, bioinsecticidas, bacteriocinas. Introducción El cuerpo académico de Biotecnología Agroalimentaria de la Universidad Autónoma del Estado de Hidalgo fue fundado en 2002, estableciendo sus actividades académicas y de investigación en el Instituto de Ciencias Agropecuarias (icap) de esta Universidad, sito en Tulancingo de Bravo, Hidalgo. El caba desarrolla la Línea de Generación y Aplicación Innovadora del Conocimiento (lgaic) denominada Bioprocesos Agroalimentarios, y con base en los logros y resultados obtenidos, este CA alcanzó las distinción de Consolidado en 2008, otorgada por el Programa de Mejoramiento del Profesorado (promep) dependiente de 31 la sep, refrendando esta distinción en 2012. Actualmente el CA está conformado por tres Profesores Investigadores: Dra. Adriana Inés Rodríguez Hernández, Dr. Apolonio Vargas Torres y Dr. Norberto Chavarría Hernández, quienes cuentan con el Reconocimiento promep al Perfil Deseable, así como forman parte del Sistema Nacional de Investigadores. El caba en su conjunto, entre otras actividades, realiza proyectos de investigación original que conlleva la formación de estudiantes de Licenciatura y de Posgrado, tanto Maestría como Doctorado. Específicamente se investiga en los siguientes aspectos: a) Biopolímeros: extracción, caracterización y aplicación; y b) Fermentaciones: aislamiento, caracterización y producción. Biopolímeros En los últimos años el caba se ha centrado en el estudio y caracterización de biopolímeros de origen microbiano (i.e., gelana [1]), polisacáridos pécticos de tuna (Opuntia albicarpa Scheinvar [2]) y almidones de chayote (Sechium edule Sw. [3]) y de plátano [4] (Fig. 1). Después de utilizar distintas tecnologías de extracción —convencionales [2] y non–thermal technologies [5]­—, los polímeros obtenidos han sido caracterizados en su distribución de pesos moleculares, grupos funcionales distintivos y propiedades funcionales, principalmente propiedades reológicas, térmicas y como agentes tensoactivos. En cuanto a aplicaciones de biopolímeros, en los últimos años el caba ha explorado su uso en mezclas con otros biopolímeros, y otros agentes complementarios, para la elaboración de películas comestibles–biodegradables, con la incorporación de distintas funcionalidades (i.e., actividad antimicrobiana, actividad antioxidante), con el propósito de plantear alternativas en cuanto a materiales de empaque usados en la industria alimentaria [3, 4, 6, 7] (fig. 2 y 3). (Posición fig. 2A, 2B, 2C). 32 Fig. 2A. Opuntia albicarpa Scheinvar “Reyna” de San Martín de las Pirámides, Estado de México. a) Aspecto de las plantaciones en temporada de producción (Julio–Septiembre). Tuna fresca en estado de madurez para extracción de pectinas: b) fruto entero, y c) cáscara, fuente de pectina usada por el caba [2] Fig. 2B. Micrografía de transmisión de electrones de nonopartículas de celulosa utilizadas para formular películas con mezclas de almidones de chayote y papa [3]. 33 Fig. 2C. Aspecto del crecimiento de Listeria monocytogenes en medio Oxford a 35°C, en contacto con películas de caseinato incorporando actividad antimicrobiana (AM) producida por Streptococcus sp. aislado de pozol, bebida tradicional mexicana. Clave: B–SP, placa sin película; B–CP, película sin AM; T3 y T4, películas con distintas concentraciones de AM [7]. Fermentaciones Las investigaciones del caba en aspectos de fermentaciones se han centrado en la producción de bacteriocinas por bacterias ácido lácticas aisladas de alimentos fermentados tradicionales [8, 9], lo cual involucra caracterización genética de especímenes [7] y sus productos, así como optimación de medios de cultivo y procesos de producción. Por otra parte, también se trabaja intensamente en el aislamiento y producción de nemátodos entomopatógenos para el biocontrol de plagas agrícolas, con el fin de desarrollar tecnologías alternas para el sector agrícola y contribuir en la disminución del uso de sustancias químicas perjudiciales para controlar plagas de importancia económica [10, 11] (fig. 4) 34 Fig. 2D. Aspecto del nemátodo entomopatógeno Steinernema carpocapsae CABA01 creciendo en caldo pasteurizado donde previamente se creció Xenorhabdus nematophilus. A) y B) huevos fertilizados inoculados; C) nematodos J2 entre 18 y 30 h; D) nematodos J3 a las 42 h; E) estadios J4 a las 66 h. Vista parcial de nematodos adultos, F) hembras y G) machos a las 100 h [11]. Es importante resaltar el trabajo colaborativo en el que interviene el caba, lo cual permite lograr una sinergia a través de la interacción con distintos grupos de investigación de instituciones como la Facultad de Química de la unam, Instituto Tecnológico de Zacapetec, cinvestav, upfim, cicy, Universidad Nacional de Colombia y Cenicaña, entre otras, a través de la participación en redes como promep “Biotecnologías Basadas en Biomoléculas Funcionales para el Sector Agroalimentario. Diseño y Caracterización de Películas Alimentarias a base de Biopolímeros y Antimicrobianos Naturales” y cyted “Implementación de Enemigos Naturales para el Control de Plagas y Enfermedades en Cultivos Hortícolas de Importancia en Iberoamérica”, donde la participación de estudiantes y empresas es relevante. 35 Perspectivas En el corto y mediano plazo, el caba debe consolidar su papel como grupo de impacto internacional, especialmente en lo referente a investigación en biopolímeros vegetales y fermentaciones para la producción de bacteriocinas y nemátodos bioinsecticidas. Esto debe necesariamente acompañarse de la integración de más grupos de investigación a las redes de las que el caba ya forma parte, así como intensificar la participación del sector privado para lograr el desarrollo y transferencia de procesos de alta intensidad tecnológica que contribuyan a la generación de riqueza y desarrollo sustentable de la región. Referencias 1. Pérez-Campos S.J.; Chavarría-Hernández N.; Tecante A.; Ramírez-Gilly M.; Rodríguez-Hernández A.I. 2012. Gelation and microstructure of dilute gellan solutions with calcium ions. Food Hydrocolloids. 28: 291-300. 2. Lira-Ortiz A.L.; Reséndiz-Vega F.; Ríos-Leal E.; ContrerasEsquivel J.C.; Chavarría-Hernández N.; Vargas-Torres A.; Rodríguez-Hernández A.I. 2014. Pectins from waste of prickly pear fruits (Opuntia albicarpa Scheinvar ‘Reyna’): Chemical and rheological properties. Food Hydrocolloids, 37. 93-99. 3. Aila-Suárez S.; Palma-Rodríguez H.M.; Rodríguez-Hernández A.I.; Hernández-Uribe J.P.; Bello-Pérez L.A.; Vargas-Torres A. 2013. Characterization of films made with chayote tuber and potato starches blending with cellulose nanoparticles. Carbohydrate polymers. 98:102-107. 4. Palma-Rodríguez H.M.; Aguirre-Álvarez G.; ChavarríaHernández N.; Rodríguez-Hernández A.I.; Bello-Pérez L.A.; Vargas-Torres A. 2012. Oxidized banana starch-polyvinyl alcohol film: Partial characterization. Starch – Stärke. 64:882889. 5. Pérez-Campos S.J. 2014. Extracción asistida por ultrasonido de pectinas de cáscara de tuna (Opuntia albicarpa S.): Efecto en las propiedades macromoleculares del polisacárido, in: 36 Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Tulancingo de Bravo, Hidalgo. 6. Aguirre-Loredo R.Y.; Rodríguez-Hernández A.I.; ChavarríaHernández N. 2014. Physical properties of emulsified films based on chitosan and oleic acid. CyTA - Journal of Food. 12:305-312. 7. Mendoza-Mendoza B.; Rodríguez-Hernández A.; Vargas-Torres A.; Díaz-Ruiz G.; Montiel R.; Ramos-Aboites H.; CastroRosas J.; Chavarría-Hernández N. 2013. Characterization of the effects on the growth kinetics of Listeria monocytogenes in solid culture in contact with caseinate base edible films added with antilisterial activity from Streptococcus sp. ABMX isolated from Pozol, an indigenous Mexican beverage. International Food Research Journal. 20:2917-2925. 8. López-Ortega M.A. 2014. Producción de sustancias con actividad antimicrobiana de uso potencial en la industria de alimentos, mediante el cultivo de bacterias ácido lácticas usando medios de cultivo alternativos, in: Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Tulancingo de Bravo, Hidalgo. 9. Sánchez-Reyes W.Y. 2014. “Producción de sustancias con actividad antimicrobiana de uso potencial en la industria alimentaria, mediante el cultivo de la bacteria ácido láctica, Streptococcus infantarius, en medios complejos que contienen melazas”, in: Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Tulancingo de Bravo, Hidalgo. 10.Chavarría-Hernández N.; Maciel-Vergara G.; ChavarríaHernández J.-C.; Castro-Rosas J.; Rodríguez-Pastrana B.R.; De la Torre-Martínez M.; Rodríguez-Hernández A.I. 2011. Mass production of the entomopathogenic nematode, Steinernema carpocapsae CABA01, through the submerged monoxenic culture in two internal-loop airlift bioreactors with some geometric differences. Biochemical Engineering Journal. 55: 145-153. 11. Chavarría-Hernández N.; Pérez-Pérez N.C.; Chavarría37 Hernández J.C.; Barahona-Pérez L.F.; Rodríguez-Hernández A.I. 2014. Specific oxygen uptake of the entomopathogenic nematode, Steinernema carpocapsae CABA01, in submerged culture. Biocontrol Science and Technology. 24: 723-733. 38 Caracterización y Aprovechamiento de Recursos Biológicos en el Valle del Mezquital Díaz–Batalla L., Hernández–Martínez V., Aguilar–Arteaga, K., López–Molina A., Conde–Mejía C. Programa Educativo de Ingeniería Agroindustrial / Cuerpo Académico de Biotecnología Agroindustrial Sustentable, Universidad Politécnica de Francisco I. Madero. Francisco I. Madero, Hidalgo. México 42660, correo electrónico ldiaz@upfim. edu.mx. Resumen El Valle del Mezquital en el Estado de Hidalgo, es una región semiárida en la que históricamente sus habitantes han aprendido a utilizar los recursos biológicos de los que dispone. Algunos de estos recursos son el mezquite, el maguey, el xoconostle y el cempasúchil, los cuales son utilizados en estrecho arraigo a la cultura regional como fuente de alimentos y materiales. En el presente documento se plantean las ideas generales para la generación de valor agregado a partir de estos recursos biológicos, utilizando al cempasúchil como fuente de antioxidantes, teñido del ixtle con pigmentos vegetales, caracterización de la semilla de mezquite para uso alimentario y la utilización integral de xoconostle. Palabras clave: antioxidante, carotenoides, ixtle, mezquite, xoconostle Antioxidantes y compuestos activos Introducción. Durante el metabolismo energético celular y la exposición a infecciones microbianas, contaminantes, productos de combustión, luz uv, pesticidas u ozono, se generan especies químicas reactivas oxidantes o radicales libres. Las células han desarrollado mecanismos de adaptación y control de estas 39 sustancias, utilizando una maquinaria antioxidante endógena, compuesta por una serie de enzimas (superóxido dismutasa, catalasa, glutatión peroxidasa, coenzima Q) con la capacidad de amortiguar la presencia de estos agentes oxidantes y reparar el daño causado por estos. Cuando estos mecanismos antioxidantes internos fallan, el exceso de estas especies químicas puede dañar los componentes celulares y generar la condición fisiológica conocida como “estrés oxidativo”, proceso asociado a la génesis de enfermedades crónicas como la diabetes, cardiovascular, cataratas y cáncer [1]. En estas condiciones el consumo de antioxidantes exógenos de fuentes alimentarias o farmacológicas puede abatir los efectos adversos. Un antioxidante ideal, debe ser de fácil absorción, debe abatir la acción oxidante de las especies reactivas en niveles fisiológicos relevantes en fase acuosa y/o lipídica. Algunos de los antioxidantes exógenos ampliamente descritos pueden ser eficientes en las fases celulares acuosas (citoplasma) como la vitamina C y algunos flavonoides o en fases celulares lipídicas (membranas) como la vitamina E y los carotenoides. Esta actividad biológica de compuestos presentes en alimentos, refuerzan los resultados de estudios epidemiológicos, los cuales sugieren que una dieta alta en frutas y vegetales, puede reducir el riesgo de padecer enfermedades cardiovasculares, diabetes y cáncer. Cuando estos componentes no están presentes en la dieta de los individuos, es posible incluirlos como suplemento alimenticio, el cual es una preparación que tiene el objetivo de proveer compuestos de actividad biológica necesarios para el metabolismo celular (vitaminas, minerales, fibra, aminoácidos o antioxidantes). Las preparaciones o suplementos alimentarios diseñados con este propósito también denominados nutracéuticos, actualmente son de alta demanda y han generado un mercado mundial que rebasa los 30 mil millones de dólares [2]. En el presente trabajo se evalúa la capacidad antioxidante y se describen espectrofotométricamente los extractos etanólicos de cinco especies vegetales reconocidas como fuentes de carotenoides, con el propósito de proponer las condiciones de 40 extracción que permitan obtener extractos con alta actividad antioxidante y alto contenido de carotenoides. Materiales y métodos. Muestras de cinco especies vegetales: Bixa Orellana (fuente de bixina y norbixina), Tagetes erecta (fuente de luteína), Lycopersicon esculentum (fuente de licopeno), Capsicum sp (fuente de xantófilas) y Daucus carota (fuente de β–caroteno) se deshidrataron a 45 oC durante 24 h, se molieron, pesaron (1 gramo) y extrajeron con 3 ml de diferentes porcentajes de etanol (35, 65 y 80%). Los extractos se colectaron, centrifugaron a 2000 rpm durante 15 min y aforaron para su análisis espectrofotométrico con la función de barrido de exploración de 320 a 530 nm. Para cada extracto se estimó la actividad antioxidante in vitro utilizando el método dpph, basado en el abatimiento de la absorbancia a 515 nm [3]. Resultados. El comportamiento de los extractos de zanahoria (Daucus carota) con etanol al 35 y 60%, no evidenció la presencia de carotenoides, solo el extracto con etanol al 80% manifestó el espectro visible de los carotenoides (Fig. 1a) y ningún extracto mostró actividad antioxidante (Fig. 2). El comportamiento de los extractos de jitomate (Lycopersicon esculentum) con etanol al 35 y 60%, no evidenció la presencia de carotenoides, solo el extracto con etanol al 80% manifestó el espectro visible de los carotenoides (Fig. 1b) y ningún extracto mostró actividad antioxidante (Fig. 2). Fig. 1 Espectro de absorción de los extractos analizados. 41 El comportamiento de los extractos de chile (Capsicum sp) con etanol al 35 y 60%, no evidenció la presencia de carotenoides, solo el extracto con etanol al 80% manifestó el espectro visible de los carotenoides (fig. 1c). Los extractos etanólicos de 35 y 60% mostraron una actividad antioxidante importante, que se relacionó con el espectro visible de los flavonoides, mientras que el extracto del 80% no mostró actividad antioxidante (fig. 2). El comportamiento de los extractos de achiote (Bixa orellana) con etanol al 35, 60 y 80%, evidenciaron la presencia de carotenoides (fig. 1d), pero ninguno de los tres extractos mostró actividad antioxidante (fig. 2). El comportamiento de los extractos de cempasúchil (Tagetes erecta) con etanol al 35 y 60%, no evidenció la presencia de carotenoides, pero sí evidenció la presencia de flavonoides, solo el extracto con etanol al 80% manifestó el espectro visible de los carotenoides junto al de flavonoides (fig. 1e) y los tres extractos mostraron una actividad antioxidante importante con un abatimiento superior al 90% del radical dpph (fig. 2). El comportamiento de los extractos de la mezcla de las cinco especies vegetales con etanol al 35 y 60%, mostraron la presencia de bajas cantidades de carotenos y de importantes cantidades de flavonoides, mientras que el extracto con etanol al 80% mostró la presencia de carotenoides, pero no de flavonoides. La actividad antioxidante de los extractos de etanol al 35 y 60% mostró un abatimiento del radical dpph superior al 60% y el extracto con etanol al 80% solo abatió la concentración del radical DPPH en un 10%. Fig. 2 Actividad antioxidante de los extractos analizados 42 Los extractos con etanol a 80%, permiten obtener altas concentraciones de carotenoides, pero que generalmente no presentan actividad antioxidante evaluada con el método dpph, los extractos de cempasúchil y de chile muestran un comportamiento que evidencia la presencia de flavonoides y que se asocia a una importante actividad antioxidante. Dado que el método dpph es eficiente para evidenciar actividad antioxidante de especies hidrosolubles, como los flavonoides del cempasúchil y el chile, el extracto de las cinco especies vegetales que evidenció la presencia de carotenoides y actividad antioxidante, plantea una mezcla de antioxidantes eficientes en fase acuosa y lipídica utilizable en el desarrollo de nutracéuticos. Teñido de ixtle Introducción. Los primeros habitantes del territorio mexicano, llegaron hace más de 35 mil años y se adaptaron a los recursos naturales propios de la región. Algunas especies vegetales del grupo de las agaváceas fueron determinantes como fuente de bienes y servicios, en las agaváceas como el maguey, encontraron una fuente natural para satisfacer sus necesidades de alimento, bebida, medicina, vestido y material de construcción. Fue una planta tan importante para las civilizaciones precolombinas que se le asoció con deidades [4]. El dominio de la elaboración de textiles para vestido y otros utensilios, fue específico de cada cultura, fue sinónimo de su desarrollo socioeconómico, además de representar la complejidad de la relación entre el hombre y la naturaleza. El ixtle como fibra obtenida del maguey y otras agaváceas, fig. 3 entre los primeros materiales utilizados por aquellos pobladores en la elaboración de objetos para un sinnúmero de usos entre las que se encuentra el vestido [4]. En el estado de Hidalgo, la zona de recolección de agaves, maguey o lechuguilla para la extracción de Ixtle, está profundamente ligada a la etnia hñahñú y a la zona alta del Valle del Mezquital, lugar inhóspito semiárido, donde el ixtle ha servido de manera tradicional para fabricar ropa y enseres domésticos para los sectores étnicos más desprotegidos y es una parte fundamen43 tal para el complemento de la economía familiar en la región. La fibra de agave lechuguilla es resistente en extremo, en un tiempo fue desplazada por fibras sintéticas, aunque en la actualidad ha repuntado su venta por ser apreciada por su naturaleza resistente y suave. Actualmente el ixtle es utilizado como sustituto de las fibras sintéticas, utilizándose de manera industrial y artesanal, como materia prima para la elaboración de brochas, cepillos de todo tipo, cordelería, tapetes, carpetas, estropajos, morrales, cestos, bolsas, ayates, bisutería y prendas de vestir [5]. En Hidalgo no existe ninguna empresa que comercialice o adquiera el ixtle para beneficiarlo y darle un valor agregado, solo algunos grupos de artesanos o artesanos independientes lo utilizan para generar productos de mayor valor. Estas iniciativas comúnmente carecen de tecnología y en un intento por innovar utilizan productos químicos que reducen la calidad del material, lo que sugiere la necesidad de asistencia técnica que acompañe a estos productores en el desarrollo de productos de alto valor agregado en favor de los habitantes de la región. Materiales y métodos. La fibra de agave o ixtle crudo o en greña, fue proporcionada por los productores de la región, las semillas de Bixia orellana (axiote), flores de Tagetes erecta (cempasúchil) y hojas de Cynodon dactylon (césped) fueron deshidratadas en estufa a 60 oC durante 6 h, posteriormente se molieron y extrajeron con etanol a 80% con ayuda de un molido de ciclón. Los extractos así obtenidos, fueron utilizados para teñir la fibra de agave por inmersión a 60 oC durante 2 h, posteriormente la fibra se lavó con jabón a pH 9 para el pasto, a pH 5 para el cempasúchil y pH 9 para el axiote, se enjuagó con agua corriente y se secó a la intemperie. El color del teñido de las fibras de agave se caracterizó utilizando las tablas de Munsell. Resultados y discusión. La utilización del extracto de axiote, permitió obtener un tono naranja–amarillo–rojizo 7/8 según la tabla de Munsell. El extracto de césped permitió obtener un tono verde–pálido 7/5G según la tabla de Munsell. El extracto de cempasúchil, permitió obtener un tono amarillo 8/6 según la tabla de Munsell (fig. 3). 44 Fig. 3. Resultados del teñido del Ixtle. Semilla de mezquite (prosopis laevigata) Introducción. Las especies del género Prosopis son árboles que presentan gran resistencia a la sequía y a la salinidad, y tienen alta capacidad de fijar nitrógeno, características que les han colocado como recursos valiosos para los habitantes de zonas áridas actuales y precolombinas, quienes le han utilizado como alimento, material de construcción y forraje [6]. Prosopis laevigata se distribuye en las zonas áridas y semiáridas del continente americano desde el sur de los Estados Unidos y hasta el centro de México, incluyendo al Valle del Mezquital. Su fruto es una vaina de 12–17 cm de longitud de color amarillo, que puede contener hasta 25 semillas elípticas de 5,5–6,5 mm longitud, las cuales actualmente son aprovechadas de forma limitada [7]. En el presente trabajo se analiza la composición proximal de semillas de Prosopis laevigata producidas y colectadas en el Valle del Mezquital y sus respectivos germinados, con el propósito de generar información que facilite y amplíe sus opciones de utilización agroindustrial. Materiales y métodos. Las vainas de mezquite fueron colectadas y las semillas se extrajeron manualmente para formar dos secciones, una sección se molió hasta pasar a través de una malla 45 No. 45 y se utilizó para el análisis proximal, la otra sección se germinó a 27 oC en la oscuridad durante 72 horas. El análisis proximal; humedad, proteína (%N kjeldahl x 6.25), extracto etéreo, fibra cruda y cenizas, se realizó por triplicado utilizando las técnicas analíticas de la aoac [8]. Resultados. En las vainas colectadas, la semilla de mezquite representa el 13.65% del peso total de la vaina, el peso de 100 semillas fue de 5.44 g y la testa representó 43% del peso total de la semilla. Los resultados del análisis proximal de semilla y germinado (ambos sin testa) de mezquite; en la semilla el componente principal fue la proteína con 55.8%, seguido de la humedad con 8.23%, el extracto etéreo con 7.7%, la fibra con 5.26% y la ceniza con 4.8%. En el germinado el componente principal fue la humedad con 77.4%, seguido de la proteína con 8.3%, la fibra con 1.2%, el extracto etéreo con 0.93% y la ceniza con 0.79%. En las muestras analizadas destaca el contenido de proteína. Previos estudios han mostrado niveles de proteína de hasta 40% en el género Prosopis, lo que muestra su alta capacidad de fijar nitrógeno y de acumular proteína de reserva en la semilla en comparación con otras leguminosas. También se ha mostrado, que como otras leguminosas, la semilla de Prosopis también contiene factores antinutrimentales como el acido fítico, inhibidores de tripsina y lectinas, sustancias que han mostrado tener actividad positivas y negativas en la salud humana y algunos de estos compuestos pueden ser eliminados durante el proceso de germinación [9]. Es importante continuar con la caracterización de esta leguminosa como recurso biológico valioso, en busca de compuestos activos de alto valor y de información que permita su adecuado aprovechamiento en beneficio de las comunidades que habitan las regiones áridas y semiáridas, de las cuales el género Prosopis es endémico. Aprovechamiento del xoconostle El interés del ser humano por los nopales data de miles de años. Su origen e historia están íntimamente relacionados con las antiguas civilizaciones mesoamericanas, en particular con la cultura 46 azteca. Existen evidencias arqueológicas que permiten afirmar que fueron las poblaciones indígenas asentadas en las zonas semiáridas de Mesoamérica las que iniciaron su cultivo de modo formal. Es muy probable que ya en los muestrarios de plantas y animales llevados a España por Cristóbal Colón se incluyeran nopales y otras cactáceas como muestra de la exótica flora del nuevo mundo. Los nopales están ligados de modo particular a la historia de México y Mesoamérica, su centro de origen genético; por ejemplo, en el escudo de México un águila posada sobre un nopal, un símbolo que ha llegado hasta nuestros días del jeroglífico de la “Gran Tenochtitlán” y significa “sitio del nopal que crece sobre la piedra” [10]. Se conocen casi trescientas especies del genero Opuntia. Sin embargo, hay solo 12 especies utilizadas por el hombre, ya sea para producción de fruta y nopalitos para alimentación humana, forraje o cochinilla para obtención de colorante. Entre ellas se encuentran, como especies cultivadas para producción de fruta: Opuntia ficus–indica, O. amyclaea, O. xoconostle, O. megacantha y O. streptacantha. Los frutos del género opuntia son “no climatéricos” (no maduran una vez cosechados), por lo que es importante cosecharlos en el punto de madurez óptima de consumo, donde está mejor expresado su potencial [10]. Los xoconostles son para México uno de los recursos de mayor relevancia en los ecosistemas de zonas áridas y semiáridas, presentes en casi 50% de su territorio. Históricamente han sido de gran importancia cultural, medicinal y económica, utilizados desde épocas prehispánicas, pero es reciente el interés en estudiarlas, dado que taxonómicamente nunca se hizo esta diferenciación. Se han reportado más de 20 usos para los xoconostles, entre los que sobresalen alimento y derivados industriales. Actualmente, la producción de tunas y xoconostles en nuestro país se encuentra ampliamente distribuida en una gran variedad de zonas, con condiciones edafológicas y climáticas diversas. Los cladodios juveniles son utilizados como verdura en la alimentación humana y como remedio para muchas afecciones. Las plantas son utilizadas en prácticas agroforestales, asociadas 47 con cultivos de especies agrícolas y/o forrajeras, también como cercos vivos espinosos, barreras vivas para la retención de suelos, protección de taludes contra la erosión y en general, como parte de prácticas de protección de suelos. Las flores son utilizadas en guisos especiales, así como sopas aguadas. Los frutos poseen gran valor nutritivo y medicinal, superior al de otras frutas en varios de sus componentes. Hoy en día se considera al pueblo otomí (parte de ellos ubicados geográficamente en el valle del Mezquital en el Estado de Hidalgo) como el portador y guardián del conocimiento culinario y medicinal de este fruto. Existen diferencias entre especies en las características de los frutos, el del xoconostle no se desprende de los cladodios cuando maduran, persistiendo en condiciones de cultivo durante uno y hasta tres años, a diferencia de las especies productoras de tunas dulces que solo persisten 3 a 4 meses sobre ellos; la pared exterior del fruto es delgada como de una pera, las paredes interiores son gruesas y ácidas, además las semillas están dispuestas en el centro del fruto, el cual no acumula azúcares y en el campo son fácilmente detectados por no ser consumidos por pájaros. El porcentaje de pulpa es mayor en O. xoconostle que en O. ficus– indica; pero sin duda, donde existe una diferencia notable es en el contenido de sólidos solubles, que es mucho menor (cerca de 5 por ciento) y en la acidez, que es muy superior, al igual que en el contenido de acido ascórbico (76,8 mg/100 g). Estas características hacen que el destino industrial difiera entre las especies; es así como el O. xoconostle es considerada en México como una especia o condimento. Los procesos de transformación serán más benignos cuando se aplican a O. xoconostle, cuyo pH es menor a 3,5, que a O. ficus–indica, con pH cercano a 6,0 o superior; el bajo pH de O. xoconostle es un factor protector, que impide el crecimiento de microorganismos perjudiciales, lo que constituye una ventaja respecto a la inocuidad de los productos [10]. Las semillas y la cáscara del fruto del xoconostle han sido descritas como materiales de interés agroindustrial, la cáscara por sus altos contenidos de fibra puede ser utilizada en la fortificación de alimentos y por su parte la semilla por su alto conteni48 do de lípidos y energía puede ser utilizado en la industria de las oleaginosas y de alimentos para animales [11]. En el centro del país el xoconostle más usado para la elaboración de algunos productos y alimentos es el fruto de Opuntia matudae (cuaresmeño), el cual se puede encontrar prácticamente todo el año en centros comerciales. Una característica especial de esta especie es que su cladodio (raqueta) es de color verde– azuloso algo grisáceo, generalmente con manchas purpúreas alrededor de las aréolas. El fruto va de forma elipsoide a piriforme, de 2.5–4.0 cm largo y 1.5–2.5 cm de ancho, externamente verde–purpúreo y pulpa rosa–rojiza; aréolas sin espinas, con lana grisácea y glóquidas castaño–rojizas. El xoconostle se conserva por varios meses en la planta sin sufrir deterioro, e incluso se conserva por varias semanas en lugares frescos y secos, sin perder sus propiedades de sabor, color y humedad. A pesar de estas cualidades, su utilización y producción está restringida a determinadas regiones geográficas. El xoconostle se desarrolla principalmente en zonas áridas y semiáridas, y demanda cantidades muy bajas de agua. Esta planta juega un papel social relevante dado que la comercialización del fruto fresco e industrializado es el medio de subsistencia de un sector importante de la población en las zonas donde crece. En el pasado los frutos de xoconostle en las zonas áridas y semiáridas eran parte de la dieta tradicional de la población por sus propiedades nutrimentales. Desafortunadamente su consumo disminuyó y fue sustituido por otros productos de alto contenido calórico. Conceptualización del proceso El fruto del xoconostle es acopiado de los productores regionales, es llevado al área de procesamiento en donde es transformado en mermelada, licor, salsa, deshidratados y almíbar, además la semilla y la cáscara son separadas y utilizadas para la elaboración de otros productos agroindustriales (fig. 4). 49 Fig. 4. Productos de la transformación del fruto de xoconostle. 50 Referencias 1. Poljsak B.; Suput D.; Milisav, I. 2013. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants. Oxid Med Cell Longev. ID: 956792. 2. Lauretani F.; Semba, R.; Dayhoff Brannigan, M.; Corsi, A. M.; Di Iorio, A.; Buiatti, E.; Bandinelli, S.; Guralnik, J; Ferrucci, L. 2008. Low total plasma carotenoids are independent predictors of mortality among older persons. Eur J Nutr. 47(6): 335–340. 3. Thaipong K.; Boonprakob, U.; Crosby, K.; Cisneros-Zevallos, L,; Hawkins, D. 2006. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts. Journal of Food Composition and Analysis. 19 (2006) 669–675. 4. García-Mendoza A. 2007. Los agaves de México. Ciencias. 87. Julio-Agosto. 5. sagarpa. 2009. Estudio para la oferta de productos de Ixtle con valor agregado. 6. Freyre M.; Bernardi C.; Baigorria C.; Presa M.; Taher H. 2010. Parámetros de interés nutricional en semillas de vinal (Prosopis ruscifolia). Revista FAVE - Ciencias Agrarias. 9 (1-2). 7. Palacios R. 2006. “Los mezquites mexicanos: biodiversidad y sistribución geográfica”. Bol. Soc. Argent. Bot. 41: 99 – 121. 8. aoac. Official methods of analysis of the Association of Official Analytical Chemist. 16th Edition. 1997. Arlington, Virginia, USA. 9. Del Valle F. R.; Escobedo M.; Muñoz M. J.; Ortega R.; Bourges H. 1983. Chemical and nutritional studies on mesquite beans (Prosopis juliflora). J. Food Sci. 48: 914. 10. FAO, 2006. Utilización agroindustrial del nopal. Boletín de servicios agrícolas de la fao 162. 11. Prieto-García F. 2006. Caracterización física y química de semillas de opuntias (Opuntia spp.) cultivadas en el Estado de Hidalgo, México. Bioagro. 18(3): 163-169. 51 Producción y transformación de Cambarellus montezumae y Tenebrio molitor para su uso como ingredientes alternos en alimentos Cerón–Ortiz A.N.,* Ángeles–Monroy M.A., Montufar–Serrano E., Limón–Mendoza M.A. *Ingeniería en Industrias Alimentarias/ Transformación de materias primas en la producción de alimentos de alto valor agregado y seguridad alimentaria. Instituto Tecnológico Superior del Occidente del Estado de Hidalgo. Paseo del Agrarismo 2000. Carr. Mixquiahuala–Tula, Km. 2.5., Mixquiahuala de J., Hgo., México. CP 42700. Tel.: (738) 7 35 40 00, ext. 116 www.itsoeh.edu.mx, correo electrónico: [email protected] Resumen El uso y transformación de materias primas de origen animal durante la formulación de alimentos es una práctica constante en la industria alimentaria, lo cual es relevante desde el punto de vista nutrimental, ya que cada uno de los ingredientes utilizados proveerá un porcentaje específico de biomoléculas de importancia metabólica para los seres vivos que lo consumirán. Por ello, la búsqueda de nuevas alternativas de materias primas a través del método científico que sustente un posible incremento en el valor nutrimental es parte también de esta industria. Por lo cual, el propósito del presente estudio es el difundir los resultados obtenidos hasta el momento por parte del cuerpo académico sobre la generación de productos de consumo humano y animal a partir de diversas materias primas que forma parte de la biodiversidad tanto de la República Mexicana (Cambarellus montezumae) como de especies introducidas de Europa desde épocas de antaño (Tenebrio molitor). La metodología aplicada es sistémica y enfocada en la producción, selección y transformación de las dos especie considerando las buenas prácticas de manufactura y las normas correspondientes. Los valores obtenidos indican una influencia significativa del tipo de sustrato utilizado como alimento en cultivos masivos de T. molitor siendo 52 la harina de trigo junto con el pan molido el tratamiento que generó los mejores crecimientos y un contenido mayor de proteínas en su tejido; además de reducir los tiempos en los cuales se alcanzan las distintas fases de su desarrollo. Resultados similares se obtuvieron en la producción y transformación de C. montezumae, donde se registraron diferencias en las características físicas de los derivados en polvo relacionadas directamente con el tipo de método de secado utilizado. Lo cual permite sustentar las bases que indican que estas dos especies de organismos se pueden considerar como posibles materias primas en la industria alimentaria. Palabras clave: Alimentos, Animales, Procesos, Valor nutrimental y Vegetales. Introducción La industria alimentaria se encarga de la generación, transformación, preparación, conservación y envasado de los alimentos; donde las materias primas que se utilizan son productos de origen vegetal y animal, buscando con ello enriquecer la calidad nutrimental de los productos. Por ello, actualmente la industria alimentaria busca a través de la generación de nuevos productos alimentarios el experimentar con nuevas materias primas y su interacción con las utilizadas tradicionalmente [1]. Al respecto se han probado materias primas derivadas de animales como las lombrices y los insectos comestibles (grillos, chapulines, etc.) que aportan un incremento en el valor nutrimental del producto mediante el aprovechamiento del contenido de proteínas y minerales, [2–4]. Debido a los resultados obtenidos con otros insectos, el cuerpo académico inició el uso del T. molitor en la elaboración de productos de confitería obteniendo resultados positivos en el incremento del valor nutrimental de los mismos [5]. Aunado a lo anterior el uso de organismos acuáticos como los crustáceos también han sido utilizados para incrementar el valor nutrimental en productos de consumo humano y animal con resultados favorables [6]. Por ejemplo, el crustáceo C. montezumae es un organismos de agua dulce que contiene en su tejido un porcentaje 53 de proteínas entre el 40 y 60%, lo que puede ser aprovechado al utilizarlo como materia prima a utilizar por la industria alimentaria [7]. Ante los beneficios que implica a nivel nutrimental y en los costos de producción el uso de materia prima innovadora o de poca aplicación en la elaboración de alimentos, el objetivo de trabajo del cuerpo académico es el de aplicar materia prima animal derivada del crustáceo Cambarellus montezumae y el insecto Tenebrio molitor como ingredientes alternos en el enriquecimiento del valor nutrimental de productos alimentarios mediante técnicas sistemáticas que implica la producción, transformación y uso como ingrediente de las mismas; además de evaluar su factibilidad económica y nutrimental. Al respecto, en el presente manuscrito se expondrán resultados relacionadas a la producción y transformación de estas dos materias primas como primeras fases del trabajo del cuerpo colegiado. Método El proceso experimental en cada una de los trabajos del cuerpo académico parte de un diseño completamente al azar del tipo unifactorial. A los resultados obtenidos en cada uno de ellos se les aplicó las pruebas de normalidad distributiva (Wilk–Shapiro) y homocedasticidad de Bartlett para establecer si podían ser utilizados en pruebas paramétricas o bien si se aplicaban solamente pruebas descriptivas. Los datos que cumplían los supuestos antes mencionados se trabajaban un análisis paramétrico de varianza (Anova) con un α=0.05 para el nivel de confianza. Al registrar diferencias significativas se aplicó una Test HSD (Honestly–significant–difference). El paquete estadístico utilizado en todas las fases es Statistica 07. Materia prima gusano de la harina t. molitor La primera fase del estudio consiste en el desarrollo del cultivo a nivel masivo del insecto en sus diferentes etapas de vida para poder identificar la factibilidad de su producción. La variable independiente en el proceso es el tipo de sustrato utilizado y las dependientes el tiempo en el cual tardan en alcanzar tres de sus 54 fases de desarrollo (larva, pupa y adulto) y su contenido de biomoléculas (proteínas, carbohidratos y lípidos). Los cultivos se realizaron en recipientes de plástico (unidades experimentales) con dimensiones de 60 cm x 50 cm x 30 cm, utilizando únicamente una altura de sustrato de 10 cm. Los sustratos que se evaluaron es la mezcla de cereales a través de 3 tratamientos en proporciones de 1:1 que se identifican como F1: avena y harina de trigo; F2: pan molido y harina de trigo; F3: harina de trigo (tratamiento blanco). Una vez instaladas las unidades experimentales con los sustratos correspondientes por triplicado, se colocaron 50 organismos en la etapa de larva con tallas de 1 cm de longitud en cada una de ellas (la distribución de las mismas fue completamente al azar). Diariamente se monitorearon los cultivos para determinar los cambios físicos en las larvas y adicionar agua a través de una hoja de papel mojado; cada semana se realizaban biometrías en los organismos para obtener la longitud y grosor de los mismos mediante una cinta métrica. Cuando los organismos alcanzaron los 3 cm de longitud el 30% de los organismos de cada unidad experimental se liofilizaron y guardaron al vacío para posteriormente mandar a analizar su contenido bromatológico. El mismo proceso se realizó con los estadios de pupa y adultos, aunque en ellos no se realizaron las mediciones de longitud y ancho, solamente se observaron los cambios en el color y forma. Materia prima acocil de río C. montezumae El presente apartado describe la metodología empleada en las pruebas piloto realizadas con C. montezumae, que consistieron en realizar la producción, captura y selección de individuos. Además de realizar pruebas preliminares sobre la transformación del acocil desde su estado fresco al de un derivado en polvo mediante la evaluación del efecto del tipo de secado como variable independiente (A1: estufa, A2: liofilización y A3: secado al sol, siendo este último el tratamiento blanco) en las características físicas del mismo (variable dependiente). Los cultivos semi–intensivos se realizaron en las piletas de concreto ubicadas en la unidad de producción del Centro de Estudios Tecnológicos en Aguas Conti55 nentales N0. 02 (cetac 02) bajo un sistema de producción a cielo abierto y monitoreo constante de las condiciones de temperatura, oxígeno y amonio. La alimentación proporcionada consistió en alimento vivo e inerte a una tasa de alimentación del 20% del peso seco de los organismos a una ración diaria. Los animales se sembraron en las piletas con una talla de 1.5 ± 0.3 cm de longitud para iniciar el proceso de engorda; cuando alcanzaron los 3.5 cm o un peso húmedo de 1 g se seleccionaron los organismos que no se encontraban mudando el exoesqueleto, su coloración debía de ser café obscuro y no debían presentaran daños mecánicos o indicios de enfermedad. Posteriormente se transportaron al laboratorio de análisis de alimentos de cárnicos del Instituto Tecnológico Superior del Occidente del Estado de hidalgo (itsoeh) de acuerdo a las especificaciones de la norma oficial mexicana nom–027–ssa1– 1993, bienes y servicios, productos de la pesca, pescados frescos– refrigerados y congelados; especificaciones sanitarias a través de hieleras plásticas de 5 kg de capacidad [8]. En el laboratorio se verificó que los organismos mostraran los atributos físicos que marca la norma nmx–ff–042–2001, productos de la pesca – crustáceos comestibles frescos refrigerados – especificaciones, en la cual se indica los grados de calidad del producto [9]. Los organismos se sacrificaron mediante la inserción de agujas en el cefalotórax y se lavaron con agua corriente, el exceso de agua se retiró con papel secante y de manera aleatoria se dividieron en tres partes iguales para aplicarles los tres tratamientos a evaluar (A1, A2 y A3). En todos los tratamientos se obtuvo el peso húmedo (PHum), Peso Seco Total (PST) y el Peso Seco Orgánico (PSO) con el objetivo de definir la cantidad de individuos necesarios para la obtención de un gramo de derivado en polvo. En el secado al sol y estufa para la obtención del PST y PSO se aplicó el método gravimétrico de peso constante [10]. La técnica de secado al sol es considerado el tratamiento blanco y se utilizará un secador de radiación solar indirecta. En los tres tratamientos se observó el tiempo en el cual los organismos registraron una textura frágil y quebradiza que permitió la molienda y tamizado de los mismos hasta obtener un polvo fino. Al final se realizó la caracterización 56 física de los derivados (color bajo la escala pantone, el tamaño de partícula y el olor) y una muestra se guardó envasado al vacío y en un ambiente seco y sin luz para la posterior aplicación de las técnicas de cuantificación bromatológica (aún no realizada). Análisis bromatológicos Los análisis bromatológicos aplicados a las muestras de T. molitor se realizados por el laboratorio certificado RB localizado en la ciudad de Tepeji del Río Ocampo bajo las normas correspondientes [11–15]. En cuanto a las muestras derivadas del estudio con C. montezumae que aún no se realiza, se tiene propuesto utilizar técnicas colorimétricas [16–20]. Participantes Los participantes en los estudios antes referidos son miembros del cuerpo académico, quienes tienen funciones específicas de acuerdo a su perfil profesional y a la experiencia que tienen en cada una de las temáticas que se consideran en los proyectos. Dra. Ana Nallely Cerón Ortiz, Biol. Miguel Ángel Ángeles Monroy, Maestra Estela Montufar Serrano, Ing. Marco Antonio Limón Mendoza. Aunado a este grupo de trabajo se unen alumnos de la carrera de Ingeniería en Industrias Alimentarias (itsoeh) y de la carrera de Técnico Profesional en Aguas Continentales (cetac No. 02), a través de su participación como servicio social, actividades complementarias y tesis profesional. Resultados Materia prima gusano de la harina T. molitor Los resultados referentes al crecimiento (longitud y ancho) de las larvas y al tiempo que tardaron en alcanzar las diferentes etapas de desarrollo de T. molitor registraron diferencias significativas entre tratamientos (P < 0.05). En donde el sustrato que proporcionó las mejores mediciones anatómicas en larvas (Ver. fig. 1) y el menor tiempo entre estadios es F2. Los valores alcanzados en este tratamiento respecto a la longitud final de la larvas es de 3.7 ± 0.3 cm y de 0.5 ± 0.01 cm de ancho; seguido del tratamiento F1 (3.1 ± 0.02 57 cm de longitud y 0.4 ± 0.08 cm de ancho) y por último el F3 (2.7 ± 0.4 cm y 0.4 ± 0.05 respectivamente). En cuanto a los tiempos registrados en los procesos de cambio entre los estadios de larva y adulto se observó que con F2 solamente se necesitaron 12 semanas en alcanzar las tallas referidas anteriormente en larva, nueve días posteriores la de pupa y siete más para la etapa de adulto (Tabla 1). Tabla 1. Tiempo promedio y desviación estándar (entre paréntesis) expresado en días que tardaron en presentarse los cambios morfológicos entre estadios de T. molitor Estadio F1 F2 Larva 90b 84a Pupa Adulto F3 (± 4) 112c (± 3.2) 100b (± 1.5) 93a (± 1) 132c (± 2.6) 110b (± 3) 100a (± 1.7) 147c (± 4.9) (± 2) Letras diferentes en la misma línea indican diferencias significativas (P < 0.05), donde a>b>c. Así mismo, se identificaron diferencias significativas en el contenido de biomoléculas entre los tratamientos y los estadios de desarrollo (P < 0.05) (Tabla 2). Tabla 2. Porcentaje promedio y desviación estándar (±) entre paréntesis del contenido de biomoléculas entre estadios de T. molitor en porción de 100 g con base a su peso húmedo. Proteínas Larva Pupa Adulto Carbohidratos Lípidos F1 F2 F3 F1 F2 F3 F1 F2 F3 41b 47a 35c 30b 24c 37a 3b 4a 2c (4) (1.8) (1.6) (2.1) (0.3) (0.9) (0.1) 52b 60a 45c 33b 1.3b 1.9a 1.0c (1) (2) (1.3) (1.1) (0.3) (0.02) 47b 51a 40c 30b 0.12a 0.02c (3.5) (1.7) (2.2) (1.3) (1.6) (3.2) 26c 38a (2.2) (3.6) (0.06) 29c 35a 0.08b (1.2) (2.3) (0.01) (0.02) (0.01) Letras diferentes en la misma línea y referente a la biomolécula señalada en el encabezado indican diferencias significativas (P < 0.05), donde a>b>c. 58 Materia prima acocil de río C. montezumae El desarrollo del cultivo de C. montezumae bajo la metodología antes descrita permitió obtener cada cinco semanas la materia prima necesaria para la realización del proceso de transformación a un derivado en polvo mediante los tratamientos evaluados. La humedad registrada durante el proceso de secado indicó que este organismo tiene entre el 60 y 70% de agua en su cuerpo incluido el exoesqueleto. Por lo cual, el rendimiento de materia seca por gramo de peso húmedo es el equivalente al intervalo entre el 30 y 40% independientemente del tratamiento utilizado (P > 0.05). Así mismo, se verificó que los atributos establecidos para el proceso de selección de la materia prima permitieron obtener un derivado en polvo en el cual se constató que las diferencias en las características físicas del producto final estaban dadas por la metodología de cada tratamiento. Los valores respecto a la escala de colores pantone refirieron que es el tratamiento de secado al sol el cual registró la menor coloración y el liofilizado la mayor (Tabla 3). En relación al olor que se percibe en los derivados en polvo se identificó el aroma característico al del camarón seco. El tamaño de partícula de los derivados no registró diferencias entre tratamientos, el cual se obtuvo en un tamaño inferior a las 500 micras. Tabla 3. Escala de color obtenida en los derivados en polvo de C. montezumae al aplicar tres tratamientos. A1: estufa, A2: liofilización y A3: secado al sol Tratamiento A1 Escala de color Pantone 137C A2 Pantone 144C A3 Pantone 136C 59 Discusiones Los insectos constituyen una fuente de proteína de alto nivel nutrimental por su contenido de aminoácidos esenciales tanto en ecosistemas acuáticos como terrestres [20]. Los cuales han sido consumidos alrededor del mundo por poblaciones ancestrales, aún sin que se hubiera comprobado la calidad proteica y su contenido de ácidos grasos poliinsaturados (ácido oleico y linoléico) (21, 22). Permitiendo con ello que la industria alimentaria considere su producción, transformación y aplicación en alimentos de consumo humano y animal [2]. Al respecto estudios realizados con T. molitor han permitido visualizar su potencial como fuente de proteínas para incrementar el valor nutrimental en productos de confitería y en alimentos destinados para el cultivo de especies acuícolas. Los valores que refieren esos estudios indican que los valores nutrimentales en el contenido de proteínas se encuentran alrededor del 50% del contenido total de su composición bioquímica y de 0.1 a 3% de lípidos [5, 23]. Resultados similares a los del presente estudio, cuyo valor más alto en contenido proteico es el determinado en el estadio de pupa (60%). Además, también se reafirma que efectivamente el tipo de sustrato tiene una influencia en el contenido de biomoléculas en el tejido de T. molitor. Aunado a lo anterior, se establece que mientras el organismo tenga a su disposición los nutrientes necesarios para crecer y su cultivo se mantenga en condiciones controladas, se puede reducir el tiempo que tarda en alcanzar las diferentes fases de desarrollo independientemente del volumen de cultivo utilizado. Lo anterior, establece un alto potencial de producción de este organismo para su uso como materia prima con alto valor nutrimental. Sin embargo, no solamente los insectos como T. molitor son organismos con potencial uso en la industria alimentaria; también los crustáceos ya han sido aprovechados tanto en su estado fresco o procesado en la dieta de los seres humanos. Al respecto los camarones del género Penaeus se identifican principalmente como el máximo exponente de este rubro de productos [6]. Así mismo, la producción, transformación y aplicación de crustá60 ceos nativos de diferentes zonas del mundo, es un parteaguas que puede ser aplicado para la generación de ingredientes alternos que beneficien el valor nutrimental de los alimentos [7]. Un ejemplo es el crustáceos nativo de la Región Central de México denominado C. montezumae, el cual tiene un alto potencial acuícola y cuyo valor nutrimental refiere contenidos de proteína superiores al 40% de su base seca y la presencia de ácidos grasos poliinstaurados. Aspectos nutrimentales que lo proyectan en la industria alimentaria como un ingrediente alterno en la formulación de alimentos de alto valor agregado [24]. A la fecha el cuerpo de trabajo se ha enfocado al estudio de la producción y transformación de C. montezumae, registrando valores y datos precisos que indican que su inserción en alimentos para otras especies acuáticas e incluso en productos de panificación son posible alternativas de éxito para su uso. Ya que la producción de biomasa se obtiene en un periodo no mayor a tres meses como lo refiere el apartado de resultados del presente estudio y el alimento puede reducirse exclusivamente a invertebrados menores. Así mismo, las pruebas piloto refieren el impacto de los tipos de secado en las características físicas de los derivados en polvo obtenidos, lo cual permitirá definir el tipo de secado que mantenga las mejores características de acuerdo al uso que se le destine a esta materia prima. Proceso que es recomendado en la industria alimentaria para llegar a establecer la estandarización de un producto [25]. Referencias 1. López F.Y.; Goycoolea, F.; Valdez M.; Calderón, A. 2006. “Goma de mezquite una alternativa de uso industrial”. Interciencia. 31 (3):183-189. 2. Herrera-Fuentes M. C. 2003. “Elaboración de tortillas de maíz nixtamalizado enriquecidas con harina de insecto (Tenebrio molitor)” Casa Abierta al Tiempo UAM, Departamento de Biotecnología, Plan de Negocios de Omega Molinos S. A. de C.V. 4. Ángeles S. A.; Roldán C. C. A. 2010. Elaboración de una barra fortificada con harina de lombriz roja californiana (Eisenia 61 foetida). Tesis, Ingeniería en Industrias Alimentarias, Instituto Tecnológico Superior del Occidente del Estado de Hidalgo. Mixquiahuala de Juárez, Hidalgo. 5. Monitor D. 2005. Alimentos elaborados con insectos, síntesis de Nota de Prensa, México. 6. Cerón-Ortiz A. N.; Peña-Hernández J. N.Y.; Peña-Hernández D. R.; Ángeles-Monroy M. Á. 2013. Uso del Tenebrio molitor como ingrediente alterno en la elaboración de un dulce tipo alegría para consumo humano. Memorias del XX Congreso de Ciencias y Tecnología del Mar. San José del Cabo, Baja California. 7. Antonio-Ventura G.; Hermida-Blanco C. E. 2014. Proceso y elaboración de chicharrón de camarón (Pennaeus vanamei) y pescado (Oreochromis niloticus) en el taller industrial de alimentos del Cetmar 01, Alvarado Veracruz. Memorias del XXI Congreso de Ciencias y Tecnología del Mar. Cozumel, Quintana Roo. 8. Cerón-Ortiz A. N.; Ángeles-Monroy M.A.; J.A. León-Escamilla. 2011. Análisis de la calidad nutrimental del acocil de río (Cambarelus montezumae) para ser utilizado como materia prima en la generación de alimentos. Memorias del XVIII Congreso de Ciencias y Tecnología del Mar. San Carlos, Sonora. 9. Secretaria de Salud. 1995. norma oficial mexicana nom027-ssa1-1993, Bienes y Servicios. Productos de la pesca. Pescados frescos-refrigerados y congelados. Especificaciones Sanitarias. 10. Secretaria de Salud. 1999. norma oficial mexicana nmxff-042-2001. Productos de la pesca. crustáceos comestibles frescos refrigerados. especificaciones. 11. Sorokin, C. 1973. Dry weight, packed cell volume and optical density. In Handbook of phycological methods, Culture methods and growth measurement, J. R. Stein (ed.). Cambridge University Press, Cambridge. 11. Secretaría de Salud. 1994. Norma Mexicana NOM-116SSA1-1994, Alimentos - Determinación de Humedad en 62 Alimentos- Método de Prueba. Diario Oficial (DOF). 12. Secretaría de Economía. Segunda Sección. 2002. Norma Mexicana NMX-F-607-NORMEX-2002. AlimentosDeterminación de Cenizas en Alimentos -Métodos De Prueba (Cancela A Las Nmx-F-542-1992 Y Nmx-F-066-S-1978). Diario Oficial (Segunda Sección). 13. Secretaría de Economía. 2011. Norma Mexicana NMX-F-608NORMEX-2011. Alimentos-Determinación de Proteínas en Alimentos-Método de ensayo (Prueba) (Cancela a la NMX-F608-Normex-2002). Diario Oficial. 14. Secretaría de Economía. 2004. Norma Mexicana NMX-F615-NORMEX-2004, Alimentos - Determinación de Grasas en Alimentos- Método De Prueba. Diario Oficial. 15. Secretaría de Economía. 2003. Norma Mexicana NMX-F-613NORMEX-2003, Alimentos – Determinación de fibra cruda en alimentos – Métodos de Prueba.Diario Oficial (DOF). 16. Lowry, H.O.; Rosebrough, N.J.; Lewis, A.; Randall, R.J.; 1951. Protein measurement with the folin phenol reagent. Biological Chemistry. 193:265-275. 17. Dubois M.; Gilles K.A.; Hamilton, J.K.; Rebers P.A.; Smith F. 1956. Colorimetric method for determination of sugar and related substances. Analytical Chemistry. 28:350-356. 18. Pande S.V.; Parvin Khan R.; Venkitasubramanian, T.A. 1963. Microdetermination of lipid and serum total fatty acid. Analyt. Biochem. 6:415-423. 19. Bligh E.G.; Dayer, W.J.. 1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37:911917. 20. Arango-Gutiérrez, G.P. 2005. Los insectos: una materia prima alimenticia promisora contra la hambruna. Revista Lasallista de Investigación. enero-julio. 21. Chávez H. 2007. Propiedades del Tenebrio, complemento alimenticio. Revista electrónica, www.elacuarista.com. 22. Valdez P.C.; Untiveros, G.B. 2000. Extracción y caracterización del aceite de las larvas del Tenebrio molitor. Revista de la Sociedad Química del Perú. 76 (4). 63 23. Cerón-Ortiz A. N.; Falcón-Pacheco S.; González-Pérez J. L.; Ángeles-Monroy, M. Á. 2014. Influencia de dos etapas del desarrollo de Tenebrio molitor en la hidroestabilidad física de un alimento para acocil de río Cambarellus montezumae. Memorias del XXI Congreso de Ciencias y Tecnología del Mar. Cozumel, Quintana Roo. 24. Moctezuma-Resendiz O. 2012. Evaluación del impacto del tipo de alimento y calidad del agua en post-larvas de acocil de río Cambarellus Montezumae. Tesis, Ingeniería en Industrias Alimentarias, Instituto Tecnológico Superior del Occidente del Estado de Hidalgo. Mixquiahuala de Juárez, Hidalgo. 25. Badui D.S. 2006. Química de los Alimentos en “Hemopigmentos” Ed. Pearson Educación. México. 64 caracterización de residuos agrícolas modificados químicamente para su aplicación en biotecnología Castañeda–Cisnero Y. E.,3 Guzmán–Ortiz F. A.,1,2 Téllez–Jurado A.,3 Román–Gutiérrez, A. D.*1 1Área Académica de Químicas, Universidad Autónoma del Estado de Hidalgo, Ciudad del Conocimiento Carretera Pachuca–Tulancingo Km. 4.5. S/n Col. Carboneras, Mineral de la Reforma, Hidalgo. CP 42184. 2Investigador de Cátedras CONACyT en1. 3Universidad Politécnica de Pachuca Carr. Pachuca–Cd. Sahagún Km 20, Rancho Luna, Ex–Hacienda de Santa Bárbara. Municipio de Zempoala, Hidalgo. CP. 42184, México; correo electrónico: [email protected] Resumen En este estudio se emplearon como muestras residuos de cereales de avena, cebada y trigo provenientes del municipio de Apan, Hidalgo. Las muestras se sometieron a caracterización química mediante análisis del contenido de material lignocelulósico y caracterización física por Microscopía Electrónica de Barrido (meb). Posteriormente las muestras fueron tratadas con H2SO4 diluido al 1%, 87°C durante 180 minutos para solubilizar las hemicelulosas y obtener un hidrolizado rico en azúcares fermentables, cuantificados por el método de azúcares reductores (AR) y Cromatografía Liquida de Alta Resolución (hplc). Los datos obtenidos resultaron con diferencias estadísticamente significativas e indican que es factible obtener cantidades importantes de azúcares reductores en los tres sustratos; cebada 75.99%, trigo 64.19% y avena 27.18%. La cuantificación de azúcares que se liberaron durante la hidrólisis fue monitoreada mediante hplc en los tiempos 0, 60, 120 y 180 minutos. La xilosa y arabinosa fueron los azúcares que se detectaron en mayor concentración con 19.08 g/L y 15.77 g/L respectivamente, en el residuo de cebada. Lo cual indica que es factible obtener azúcares fermentables a partir de residuos agrícolas generados en 65 la región centro de México, teniendo como fin incorporarlos como sustratos para procesos biotecnológicos. Palabras clave: Avena, azúcares, cebada, hemicelulosa, trigo. Introducción Los cereales tiene un papel preponderante en la actividad agrícola mundial, entre los principales cultivos se encuentra el maíz, sorgo, trigo, cebada, y avena. Asociado a la producción se da origen a una amplia gama de residuos que oscila alrededor de 34 millones de toneladas en materia seca, los cuales son dispuestos como alimento para ganado o quemados in situ [1]. Los residuos agrícolas de cereales ocasionan serios problemas de contaminación ambiental y pérdidas de fuentes potenciales de alto valor agregado, la biodegradabilidad de estos materiales lignocelulósicos está en función al contenido de biomoléculas fácilmente degradables (azúcares solubles, celulosa y hemicelulosa), y en componentes de lenta degradación (ceras y ligninas) [2]. La celulosa y hemicelulosa son polisacáridos de alto peso molecular que representan entre el 60–80% del total del peso de los materiales lignocelulósicos, mientras que la lignina es un polímero que representa entre el 20–35% del total [3]. La hemicelulosa está formada por un conjunto heterogéneo de polisacáridos, a su vez formados por un solo tipo de monosacáridos unidos por enlaces β (1–4), que forman una cadena lineal ramificada con zonas amorfas [4]. Una conversión eficaz de los materiales lignocelulósicos requiere en primer lugar de un fraccionamiento de los tres componentes principales: celulosa, hemicelulosa y lignina, y en segundo, un método eficiente para procesar estos componentes a productos de mayor valor [5]. Existen diversos procesos para el tratamiento de la lignocelulosa que incluyen químicos, físicos y biológicos, entre ellos trituración, ultrasonido, explosión de vapor, hidrólisis ácida, alcalina y enzima. La hidrólisis ácida alcanza un mayor rendimiento para degradar la hemicelulosa, el resultado de este tratamiento produce una gran cantidad 66 de monosacáridos, los azúcares resultantes tienen potencial de mercado considerable, ya sea como sustratos biotecnológicos o materia prima en la producción de: bioetanol, alimento para animales y biomasa microbiana [6]. En el presente trabajo de investigación se planteó cuantificar los polisacáridos presentes en tres hidrolizados de cereales; avena, cebada y trigo, para determinar la fuente con más altos rendimientos. Materiales y métodos Para la realización del presente proyecto de investigación se utilizaron como muestras las cascarillas de granos de avena, cebada y trigo cosechadas en el 2010 en el municipio de Apan, perteneciente al estado de Hidalgo. Los granos se sometieron a descascarillado mediante una perladora en el caso de la cebada, la avena se obtuvo de forma manual y el trigo por medio de molienda. Posteriormente se realizó un proceso de molienda para disminuir el tamaño de partícula y se tamizaron para obtener un tamaño de partícula homogéneo con la malla número 30; menor <1 mm, se secaron en una estufa a 55°C por 24 horas y se guardaron en bolsas de plástico cerradas herméticamente. Caracterización fisicoquímica: Humedad por termobalanza [7], Cenizas (923.03) [8], Proteínas por combustión de Dumas [9], Fibra Cruda (962.09) [8], Grasas (920.39) [8]. El contenido de carbohidratos totales se obtuvo por cálculo establecido [8]. El material lignocelulósico se determinó por normas TAPPI [10]; Extraíbles (264 om–88), Holocelulosa (método Wise), Alfa, Gama y Beta Celulosa (203 om–88) y Lignina (220 om–88). Microestructura: Se utilizó la técnica de MEB para caracterizar y analizar la superficie de las muestras. Se utilizó un microscopio (JEOL, modelo JSM–G–300) con un flujo de electrones de 30 KV y 18 mm. Las fotografías se tomaron por triplicado a 1500X. Hidrólisis ácida: Las condiciones del proceso fueron H2SO4 al 1%, 87°C durante 180 minutos [11]. Se realizó un blanco sustituyendo el H2SO4 con H2O. Las muestras se colocaron en una relación 1/10 (peso muestra/volumen ácido). 67 Cuantificación de Azúcares Reductores (AR): método Miller [12], se tomó una alícuota de 1 mL del hidrolizado y se le agregaron 0.5 mL del reactivo ácido 3,5–dinitrosalicílico (DNS), se sumergió en agua a ebullición por 5 minutos; se dejó enfriar y por último se le agregó 2 mL de agua destilada. Se procedió a leer a una longitud de onda de 540 nm en un espectrofotómetro (UV–VIS Genesys 10 UV, Thermo Electron, México). Los cálculos de AR se determinaron considerando el% total de carbohidratos en solución (relación 1 g de muestra/10 mL de solución ácida) obtenidos de la caracterización fisicoquímica (carbohidratos totales más fibra) como el 100% de carbohidratos, considerado las características de cada muestra [9]. Finalmente, la curva estándar se preparó con glucosa en concentración 1 mg/mL. Cuantificación por hplc: el hidrolizado de cada muestra se colocó en una centrifuga refrigerada (Hermle Z3K23, Germany), bajo las siguientes condiciones; temperatura 8°C, 5000 rpm durante 25 minutos. Al sobrenadante obtenido se le determinó el pH (Thermo Scientific Orion Star, usa), y se le añadió lentamente carbonato sódico hasta el cese de burbujeo. La muestra neutralizada se sometió a un sistema de microfiltración (mfs, usa) con una membrana (Microfiltration Systems, Dublin) con poros de 22. Los extractos líquidos se analizaron mediante un Cromatógrafo (Pump Model 626, Alltech) acoplado a un detector elsd 800. Se empleó una columna Prevail Carbohydrate ES de 5 μm, 250 X 4.6 mm. La separación isocrática de los azúcares se desarrolló a una temperatura de 30°C, una velocidad de flujo de 1 mL/min, con una fase móvil compuesta por 75% de acetonitrilo grado hplc (Mallinckrodt Chomar) y 25% de agua grado hplc (JT Baker). La caracterización y cuantificación de azúcares simples en cada hidrolizado, se efectuó mediante la comparación de los tiempos de retención y las áreas de los picos de las muestras, con soluciones patrón de xilosa, arabinosa, glucosa, galactosa y manosa [13]. Análisis estadístico: se usó el paquete estadístico statistica versión 7.0, y se estableció para todos los análisis la significancia de p<0.05. Se realizaron análisis de varianza (anova) y comparación múltiple (Tukey y Mann–Whitney U Test). 68 Resultados y discusión Composición fisicoquímica En la Tabla 1 se muestran los resultados obtenidos para la caracterización fisicoquímica, mediante un análisis proximal de los subproductos de cereales de avena, trigo y cebada, expresados en base seca. (Posición Tabla 5A). Tabla 5A. Composición proximal de los residuos agrícolas de cereales: avena, cebada y trigo Cascarilla Humedad* Cenizas Proteínas Grasas Fibra cruda cho´s* Avena 5.94 (0.07)c 3.83 (0.02)c 6.33 (0.03)b 2.08 (0.01)a 25.52 (0.04)b 56.30 Cebada 8.78 (0.05)a 6.76 (0.00)a 5.45 (0.01)b 0.80 (0.01)b 29.11 (0.13)a 49.10 Trigo 7.59 (0.04)a 5.24 (0.01)b 20.24 (0.01)a 1.00 (0.02)b 11.82 (0.00)c 54.14 La letra diferente dentro de la columna indica diferencia significativa de acuerdo al anova (p 0. 05) y la prueba Tukey (p 0.05). * Obtenido por diferencia. Los valores obtenidos para fibra cruda (carbohidratos estructurales insolubles) presentan diferencia significativa (p<0.05) entre las tres muestras, el valor más alto es para cebada con un 29.11%, le sigue avena 25.52% y trigo 11.82%. El alto contenido de fibra en las muestras se debe a que esta se localiza principalmente en la cascarilla y envolturas del grano (lema, palea y pericarpio), a la cantidad de celulosa y hemicelulosa presente y a la variación geográfica y falta de humedad durante la etapa de maduración del grano, que da a lugar a una menor concentración de componentes fibrosos [14]. Los residuos de cereales analizados presentan diferencias estadísticamente significativas (p<0.05) en el contenido de carbohidratos, siendo la avena la que presenta el valor más alto, alrededor del 56.30%, trigo 54.14% y cebada 49.10%. Los carbohidratos son el mayor constituyente de todos los cereales entre un 50% y 87% [11]. El porcentaje de material total hidrolizable que se puede convertir a azúcares simples aplicando el tratamiento de hidrólisis ácida es para avena 81.82%, cebada 78.21% y trigo 65.96%, existiendo diferencia significativa (p<0.05) entre las tres muestras. 69 Composición lignocelulósica De acuerdo al análisis estadístico los subproductos de cereales presentan diferencia estadística significativa (p<0.05) en la composición química de holocelulosa y lignina. Los valores obtenidos para holocelulosa son avena 81.04%, cebada 79.18% y trigo 40.69%, estos representan la fracción total de carbohidratos poliméricos, es decir, celulosa más hemicelulosa presentes [15]. Las variaciones se deben a la cantidad de gluma y cascarillas que existen en cada grano, los residuos agrícolas están constituidos por más del 50% de celulosa del total de su biomasa en peso seco [16]. Los resultados obtenidos para avena y cebada se encuentran por arriba del 50% y cumplen con el porcentaje citado por el autor. La holocelulosa forma un complejo con uniones químicas que no se separan fácilmente sin modificaciones considerables, es decir aun contienen lignina en su estructura, o perdida de hemicelulosas [15] Se deduce que la temperatura es demasiado baja para que exista degradación en la lignina, lo cual es un factor limitante en la cuantificación de los porcentajes de holocelulosa durante el tratamiento ácido. El parámetro de interés es la hemicelulosa que se observa en la figura 1, los resultados obtenidos oscilan alrededor del 15%, la conversión obtenida mediante el tratamiento de hidrólisis ácida es la siguiente: avena 76.38%, trigo 78.49% y cebada 81.86%. Por tanto, la muestra con mayor porcentaje de conversión de hemicelulosas es la cebada. El contenido de hemicelulosas para residuos de cereales es de 20–30% [17]. En un estudio sobre la cascarilla de arroz se obtuvo 13%, así como la paja de avena con un 16%, lo cual indica que dependiendo de la variedad y tipo de cereal, será el contenido de hemicelulosas que este contenga [18]. 70 Fig. 5B. Comportamiento de hemicelulosas en los tratamientos a base de residuos de cereales. Respecto al uso de hidrólisis ácida se observó una mayor remoción de la fracción de hemicelulosas del material y por tanto una mayor conversión. La hemicelulosa es más susceptible al ataque con ácidos diluidos que la celulosa o la lignina [19], lo que justifica los resultados encontrados en este estudio. Valores similares de remoción de hemicelulosa (80–85% p/p) fueron obtenidos durante la hidrólisis de residuos de maíz con H2SO4 al 5% o HCl 5% [20]. Microestructura Los subproductos agrícolas antes y después de aplicar el proceso de hidrólisis ácida fueron evaluados por meb, para comparar su microestructura como se muestra en la fig. 2, (Posición fig. 5C). Los subproductos sin tratamiento se observan en las micrografías (A, C, E), donde en A y C se muestra un filamento fibroso rodeado por la formación de aglomerados proteicos irregulares que se encuentran intercalados en los gránulos de almidón. En las tres micrografías los almidones tienen formas lenticulares y grandes. También puede observarse que la molienda no fue la más adecuada, y que a pesar de haber tamizado las muestras para obtener un tamaño de partícula homogéneo, no se logró el objetivo. En las micrografías (B, D, F) se observan los subpro71 ductos después de haber sido sometidos a hidrólisis ácida. Los filamentos fibrosos se muestran dañados como consecuencia de las altas temperaturas y el contacto con el ácido. El tratamiento causó la degradación de la adhesión estricta que existe entre proteína–almidón, los cuales le confieren al hidrolizado un aumento en la cantidad de azúcares presentes [11]. Fig. 5C. Micrografías tomadas a una amplitud de 1,500X, A, B avena, C, D cebada y E, F trigo. Cuantificación de azúcares reductores En todos los tiempos analizados durante la hidrólisis ácida el ANOVA mostró diferencia significativa (p<0.05) para los azúcares liberados y fue confirmado mediante la prueba de comparaciones múltiples (Tukey). En la fig. 3, se aprecia el comportamiento de los subproductos agrícolas, en donde la cebada es la que obtuvo un mayor porcentaje de conversión a AR de 75.99%, trigo 64.19% y avena 27.18%. La interacción entre la concentración de H2SO4 al 1% y el tiempo tiene un efecto altamente significativo. La tendencia de las muestras tratadas es el aumento en la liberación de los azúcares conforme transcurre el tiempo de digestión. La concentración del ácido es el factor más influyente en el rendimiento obtenido de los azúcares, mientras que la 72 temperatura lo es en la degradación de estos [21]. La incorporación del ácido en conjunto con la extensión del tiempo de reacción favoreció el tratamiento de hidrólisis al permitir la difusión del ácido a través del sustrato y la transferencia de masas (azúcares) del producto de la hidrólisis hacia el medio acuoso. El tiempo de reacción favorece el ataque del ácido hacia la hemicelulosa dentro de la matriz del sustrato y se generan regiones amorfas que facilitan el proceso de hidrólisis con el paso del tiempo [22], Fig. 5D. Porcentaje de carbohidratos hidrolizados en subproductos agrícolas El proceso de hidrólisis ácida del bagazo utilizando H2SO4 al 70%, 50°C y 1 hora de reacción, con la cual obtuvo una conversión de 87.65% de AR. Realizó una dilución del 30% del ácido y obtuvo una conversión del 97.5% de AR [22]. A una mayor dilución del ácido aumenta la liberación de AR, esto se explica porque al añadir agua al proceso se favorece la hidrólisis de los oligosacáridos de bajo peso que se forman y también se evita la repolimerización de los mismos, lo que al final se traduce en un mayor rendimiento de la hidrólisis [23]. Un estudio reportó un 74.98% de conversión a AR para la cascarilla de cebada molida 73 [11], mientras que los resultados obtenidos en este análisis fueron de 75.99% para la cascarilla de cebada sometidas a las mismas condiciones que dicho autor utilizó (H2SO4 al 1% durante 100 minutos a 87°C), las cuales son similares a las obtenidas. Algunos autores han mostrado que el tamaño de partícula influye en la hidrólisis, se ha reportado que a menor tamaño de partícula el proceso es más eficiente [24]. En un estudio a partir de Eucalipto se realizó una hidrólisis ácida con H2SO4 al 6%, variando el tiempo de hidrólisis y obtuvo como rendimiento máximo de AR un 21.87% en muestra molida y 17.61% en muestra desfibrada [25], lo que confirma lo antes mencionado. Un aumento de sólidos conlleva a una disminución del porcentaje de conversión y esto se explica porque a mayor porcentaje de sólidos en un volumen fijo de ácido sulfúrico se dificulta la acción del ácido para penetrar en las fibras [23]. Caracterización de azúcares Para determinar los azúcares presentes en los subproductos agrícolas se realizó una comparación de las áreas de los picos obtenidos en los cromatogramas de los hidrolizados contra las áreas de las soluciones patrón [13]. La fig. 4, corresponde a los monosacáridos detectados en avena, cebada y trigo. Fig. 5E. Cuantificación de monosacáridos de subproductos agrícolas a 180 minutos de hidrólisis ácida. 74 En todas las muestras el anova mostró diferencia significativa (p<0.05) en los picos de los cromatogramas obtenidos, cuyos tiempos de retención promedio son 7.30, 9.55 y 11.33 minutos, los cuales se pueden asignar a xilosa, arabinosa y manosa, respectivamente. La xilosa y la arabinosa fueron los azúcares que se detectaron en mayor concentración con 19.08 g/L y 15.77 g/L, en el residuo de la cebada. La galactosa y glucosa no se detectaron en ninguno de los tres hidrolizados, y la manosa solo fue detectable con 10.46 g/L. El análisis estadístico mostró que las interacciones entre temperatura, ácido y tiempo mejoraron la liberación de azúcares a lo largo del experimento. La xilosa es el monosacárido predominante en la cebada como se observa en el cromatograma de la fig. 5, por tanto es el azúcar que se libera con mayor facilidad debido a la despolimerazación de la hemicelulosa, junto con arabinoxilanos [25]. El trigo obtuvo arabinosa como azúcar predominante con 14.49 g/L, esto puede justificarse por la estructura que tienen los residuos de trigo respecto a las condiciones existentes entre la lignina y los arabinoxilanos. Los residuos de trigo presentan hasta un 50% de arabinoxilanos unidos directamente por un enlace tipo éter de susceptibilidad ácida, a la matriz de la lignina sin intermediarios lignanos (enlaces tipo éster de susceptibilidad básica). Este aspecto explica la liberación de azúcar durante la hidrólisis, debido al tipo de enlaces se permite la liberación inmediata de los azúcares sencillos en estas condiciones [25]. En un estudio para residuos de trigo se realizó una hidrólisis ácida con las siguientes condiciones; 0.75% de H2SO4 por 1 hora a 121°C, y se obtuvo una concentración de arabinosa de 20 g/L [26], en este análisis las condiciones utilizadas fueron semejantes, a excepción del tiempo de exposición y el tamaño de partícula lo cual pudo haber influido en los resultados de 14.49 g/L. En cuanto a la glucosa es la hexosa presente más comúnmente y en mayor proporción entre los azúcares extraídos durante los tratamientos aplicados a residuos lignocelulósicos [27]. La hidrólisis de la glucosa no es esperable en este análisis ya que la celulosa está encapsulada por la hemicelulosa y la lignina, y en este tratamien75 to solo la hemicelulosa es susceptible al ataque ácido [25]. A lo largo del análisis se presentan varios picos en tiempos de 3 a 5 minutos para las tres muestras analizadas que corresponden a hidratos de carbono de peso molecular superior (disacáridos, trisacáridos) puesto que aparecen antes [28], (Posición fig. 5F). Fig. 5F. Cromatograma de subproductos agrícolas de cebada obtenido a los180 minutos de hidrólisis ácida. Conclusión La hidrólisis de residuos agrícolas de cereales usando H2SO4 al 1% es un método eficaz para solubilizar polisacáridos presentes en forma de hemicelulosas. La eficacia del proceso en términos de conversión a AR fue de 75.99% para la cebada, que es el subproducto que obtuvo un mayor porcentaje de remoción de hemicelulosas con 81.86%, respecto a la detección por HPLC se encuentra en mayor cantidad xilosa y arabinosa, lo cual indica que es factible obtener azúcares fermentables partir de residuos agrícolas, teniendo como fin incorporarlos como sustratos en procesos biotecnológicos o materia prima en la producción de: bioetanol, alimento para animales y biomasa microbiana. Se agradece al Fomix–conacyt–Gobierno–Hidalgo, clave: HGO–2010–C01–150905 por el financiamiento. 76 Referencias 1. Servicio de Información Agroalimentaria y Pesquera Agricultura. 2013. Dirección: http://www.siap.gob.mx/index. php?option=com_content&view=article&id=10&Itemid=15. 2. Farré M. 2008. Gestión y tratamiento de residuos agrícolas, Revista info-agro. Universidad Politécnica de Catalunya. 3. Pejó T. 2010. Bioetanol de paja de trigo: estrategias de integración de las etapas del proceso. Tesis de Doctorado. Universidad Complutense de Madrid. 4. Caparrós-Jiménez S. 2009. Fraccionamiento integral de vegetales no alimentarios para la obtención de pastas celulósicas y subproductos. Tesis de doctorado. Universidad de Huelva. 5. Hendriks T.; Zeeman G. 2009. Pretreatments to enhance the digestibility of lignocellulosic biomass. Rev. Bioresource Technology. 100:10-18. 6. Kumar S.; Singh, S.D.; Mishra I.M.; Adhikari D.K. 2009. Recent advances in production of bioetanol from lignocellulosic biomass. Chem. Eng. Technol. 32(4):517-526. 7. Kirk R.; Sawyer R. 1996. Composición y análisis de alimentos de Pearson. Segunda edición. Compañía editorial continental SA de CV, México. 8. aoac. 1990. Association of Official Analytical Chemists. 15th edition. Vol. II. Edited by Kenneth Helrich. 9. Cruz-Lugo A. 2007. Correlación del método Kjeldhal con el método de combustión Dumas automatizado para la determinación de proteínas de alimentos. Tesis de Licenciatura. Universidad Autónoma del Estado de Hidalgo. 10. tappi. 1988. Technical Association of the Pulp and Paper Industry. Traducción por dmcyp. 11. Rodríguez-García M. 2010. Hidrólisis ácida de polisacáridos presentes en cebada y malta. Tesis de Licenciatura. Universidad Autónoma del Estado de Hidalgo. 12. Miller G. L. 1959. Use Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31:426-428. 13. Arenas M.; Marín M.; Castro R.; Sandoval L. 1999. 77 “Determinación por HPLC de los azúcares en los frutos de guayaba (Psidium guajava L.) de una plantación comercial del Municipio Mara”. Rev. Fac. Agron. 12:467-483. 14. Guerra-Rodríguez E.; Portilla-Rivera O.; Jarquín-Enríquez L.; Ramírez J.; Vázquez M. 2012. Acid hydrolysis of wheat straw: A kinetic study. Biomass and bioenergy. 36:346-355. 15. Owen B.; Sosulski F.; Wu K.; Farmer J. 2008. Variation in mineral content of Saskatchewan feed grains. Can J. Anim. Sci. 57(4): 679-687. 16. Guarnizo F.; Martínez Y. 2011. Estudio de la hidrólisis ácida del raquis del banano. Programa de Química. Universidad del Quindío. 17. Chandel A.; Singh O. 2011. Weedy lignocellulosic feedstock and microbial metabolic engineering: advancing the generation of Biofuel. Appl Microbiol Biotechnol. 89:12891303. 18. Kumar, S.; Singh, S.; Mishra, I.; Adhikari D. 2009. Recent advances in production of bioethanol from lignocellulosic biomass. Chem. Eng. Technol. 32(4):517- 526. 19. Mussatto S.; Roberto I. 2005. Acid hydrolysis and fermentation of brewer’s spent grain to produce xylitol. J. Sci. Food. Agric. 85:2453-2460. 20. Varga, E.; Szengyel Z.; Réczey, K. 2002. Chemical pretreatments of corn stover for enhancing enzymatic digestibility. Appl. Biochem. Biotech. 98:73-87. 21. Herazo, I.; Ruiz, D.; Arrazola, G. 2009. Bioconversión de xilosa a xilitol por Candida guilliermondii empleando cascarilla de arroz (Oriza sativa). Revista Temas Agrarios. 14(2):32-39. 22. Sarrouh B.; Jover J.; González E. 2005. Estudio de la hidrólisis del bagazo con ácido sulfúrico concentrado utilizando dos variantes de una sola etapa y una sola etapa modificada para la obtención de etanol. Rev. Ingeniería e Investigación. 24 (3):34-38. 23. Gunasekaran P.; Chandra R. 2002. Ethanol fermentation technology. US Patent, N° US5, 562,777, Arkenol, Inc. (Las Vegas, NV). 24. Marcano E.; Padilla A.; Calderón D. 2009. Obtención de 78 azúcares a partir de celulosa Kraft mediante hidrólisis con ácido sulfúrico diluido. Agricultura Andina. 17:33-42. 25. Buranov A.; Mazza G. 2008. Lignin in straw of herbaceous crops. Industrial Crops and Products. 28:237-259. 26. Pezoa-Conte M. 2010. Estudio de pretratamiento con ácido diluido y líquidos iónicos en residuos agrícolas para la producción de bioetanol de segunda generación. Tesis de maestría. Universidad de Chile. 27. Lu Y.; Moriser N. 2008. Kinetic modeling analysis of maleic acid-catalized hemicellulose hydrolysis in corn stover. Biotechnol Bioeng. 101:1170-1181. 28. Gómez-Tovar F. 2008. Métodos secuenciales de pretratamiento químico y enzimático de residuos agrícolas para la producción de metano. Tesis de maestría. Instituto Potosino de Investigación Científica y Tecnológica A.C. 79 Evaluación física de diez variedades de cebada para la producción de maltas de acuerdo a la Norma NMX–FF–043–SCFI–2003 Barrera–Hernández Ma,1, Guzmán–Ortiz F.A.,1,2 Roldán–Rojas, J.H., 1 Román–Gutiérrez, A. D.1* 1Área Académica de Químicas, Universidad Autónoma del Estado de Hidalgo, Ciudad del Conocimiento, Carretera Pachuca–Tulancingo Km. 4.5. S/n Col. Carboneras, Mineral de la Reforma, Hidalgo, CP 42184,2 Investigador de Cátedras conacyt en1. Correo elctrónico: [email protected] Resumen El cereal de mayor producción e importancia en el Estado de Hidalgo es la cebada, la cual es empleada en la elaboración de bebidas a base de malta como la cerveza y otra proporción se destina para la alimentación animal. Los agricultores prefieren este cultivo a otros granos debido a que su ciclo vegetativo es corto. La calidad de las cebadas cosechadas por temporal en la región centro del país está fuertemente influenciada por los factores climáticos, de sus características depende la calidad de la malta que se produzca. Se evaluó la calidad de diferentes variedades de cebada (Hordeum sativum jess) de los estados de Hidalgo y Tlaxcala producidas en diferentes ciclos agrícolas. Los resultados mostraron que las diez variedades presentaron un olor y color característico del grano en condiciones favorables, la temperatura del grano no presentó variación mayor a 5ºC. Las variedades GEZ 2007, EAP 2007 y GLP 2008 se encuentran dentro del límite de impurezas marcado por la Norma NMX– FF–043–SCFI–2003. EA 2008, mostró la menor cantidad de peso mil granos (36.2 g), GLP 2008 fue la variedad más alta (50.6 g). EA 2007 presentó mayor resistencia a la abrasión y menor pérdida de peso, EAP 2007 mostró un comportamiento contrario. Las variedades que se encuentran dentro del límite permisible de granos dañados de acuerdo a la norma mencionada anteriormente fueron: 80 ACH 2008 (1.9%), ALP 2008 (2.0%), GLP 2008 (4.5%) y GA 2007 (8.5%). Ninguna de las variedades de cebada analizadas cumplen con los tres parámetros establecidos por la norma, sin embargo la variedad GEZ 2007 y EAP 2007 podrían adquirir el grado México. Palabras clave. Calidad, cebada, dureza, densidad. Introducción Los cereales proceden de las formas silvestres de ciertas gramíneas. Son plantas monocotiledóneas cuyo cotiledón, localizado en el germen del grano es denominado botánicamente como escutelo o escudo [1]. En el mundo solo el 5% de los alimentos básicos amiláceos se obtienen de raíces mientras que el resto es obtenido de cereales. Los granos de cereales contienen del 60 al 70% de almidón y son alimentos excelentemente ricos en energía para los humanos [2]. Dentro del grupo de cereales, la cebada es el nombre común de las especies de un género de gramíneas originario de Asia y Etiopía, es una de las plantas agrícolas más antiguas. Su cultivo se cita en la Biblia, y lo practicaban ya las antiguas civilizaciones egipcia, griega, romana y china. [3]. La cebada ocupa el cuarto lugar en la producción mundial después del trigo, arroz y maíz. Este cereal es menos utilizado en términos de consumo humano [4], aunque cada vez está ganando un interés renovado para su utilización alimenticia debido a su efecto hipocolesterolémico y a otras características alimenticias y funcionales deseables [5]. Contiene B–glucanos, tocoferol, y tocotrienoles [5–7], que se cree son los componentes responsables de la reducción del colesterol [8]. Al consumo de cebada también se le ha atribuido los efectos hipoglicémicos y anticarcinogenicos [7]. Aproximadamente el 90% de la cebada crecida se utiliza en la producción de la bebida alcohólica y como alimentación del ganado. Los niveles bajos de aceptación y consumo de la cebada de los seres humanos se relacionan con la cultura y el estado social [5]. En México la cebada es un cultivo de gran importancia económica y social principalmente en los estados de Guanajuato, 81 Hidalgo, Tlaxcala y México [9]. Donde los dos primeros estados son los dos principales productores de cebada en grano de temporal, proporcionando más de la mitad de la producción total nacional . La cebada es una gramínea anual, es decir puede sembrarse en otoño o en primavera, debido a que sus requerimientos de suelo, agua y temperatura son mínimos. Se conocen muchas variedades botánicas de cebada a las que se les ha dado el nombre científico de Hordeum vulgare. En realidad, todas las formas de cebada cultivadas, la silvestre Hordeum spontaneum y las malas hierbas/silvestres H. agriocrithon, H. lagunculiforme y H. paradoxon son variedades infértiles de la especie denominada H. Vulgare [2]. La cariópside o grano maduro de los cereales está compuesta de carbohidratos, compuestos nitrogenados, lípidos, vitaminas y sales minerales. El contenido de humedad de la cebada puede variar de 10 a 14% [10]. La composición química del grano de cebada en porcentaje de base seca se muestra en la Tabla 1, (Posición Tabla 6A). Tabla 6A. Composición química del grano de cebada (%) [2]. Hidratos de carbono • Almidón • Azúcares • Fibra bruta Proteína Materia inorgánica Lípidos Otras sustancias 72.8–82.8 50.0–63.0 1.8–2.0 5.0–6.0 7.5–15.6 2.0–3.1 1.1–3.1 1.0–2.0 Con relación a las condiciones de cultivo de la cebada, los factores ambientales y las prácticas culturales influyen en la tasa de formación de la espiga, también afectan la duración de las fases de desarrollo de cada cultivar [11]. El tiempo transcurrido desde la siembra hasta la emergencia de la primera hoja al nivel del suelo depende del vigor de la semilla y de los factores del me82 dio físico como son temperatura, humedad, textura y estructura del suelo, y la profundidad de la siembra. Las temperaturas idóneas de cultivo en este cereal, para las variedades de primavera, se estiman dentro de un rango comprendido desde los 28 ºC hasta un máximo de 40 ºC, a diferencia de aquellas seleccionadas para la época invernal en las que la temperatura óptima se encontrará entre los 15 ºC y 25 ºC. Los requerimientos de agua de la planta de primavera se ubican aproximadamente en 600 mm de agua. En lugares con insuficiencia de precipitación pluvial o épocas de temperatura desfavorables [12]. Materiales y métodos Se utilizaron como muestras de estudio diez variedades de cebada (Hordeum sativum jess) que fueron recolectadas en los estados de Hidalgo y Puebla. Las variedades analizadas se muestran en la Tabla 6B. Tabla 6B. Variedades de cebada hordeum sativum jess Origen Variedad Año Municipio Estado Código Gabyota 2007 E. Zapata Hidalgo GEZ 2007 Gabyota 2007 Almoloya Hidalgo GA 2007 Esmeralda 2007 Apan Hidalgo EAP 2007 Esmeralda 2007 Almoloya Hidalgo EA 2007 Esmeralda 2008 Libres Puebla ELP 2008 Gabyota 2008 Libres Puebla GLP 2008 Adabella 2008 Libres Puebla ALP 2008 Adabella 2008 Coatlaco Hidalgo ACH 2008 Gabyota 2008 Tecocomulco Hidalgo GTH 2008 Esmeralda 2008 Almoloya Hidalgo EA 2008 83 Muestreo Para llevar a cabo el análisis se realizó un muestreo aleatorio simple en cada saco de cebada de tal manera que todos los elementos de la población tuvieran la misma probabilidad de ser seleccionados. La muestra fue tomada en diferentes puntos del saco a tres niveles (fondo, enmedio y arriba), obteniendo aproximadamente 100 g de cada punto hasta obtener una muestra representativa de 1 kg, con lo cual se trabajó directamente para el análisis físico. Las determinaciones del análisis físico se realizaron por triplicado. Análisis físico Sensorial y temperatura Se tomó una muestra representativa de 1 kg de cada muestra y se colocó en una bolsa de plástico. Se efectuó una inspección visual sin abrir la bolsa para detectar alteraciones o defectos evidentes. Posteriormente se analizó si el aspecto inicial del grano era aceptable, para esto se agitó la muestra durante un min aproximadamente y se abrió la bolsa para percibir el olor. Si se encuentra alguna alteración como hongos o infestación de insectos, se omitirá la detección del olor [13]. La evaluación sensorial del grano se realizó examinando color. Aquellos granos que presenten un color amarillo claro y aquellos que no presenten manchas negras o de otro tipo se considerarán que presentan un color típico [14]. Impurezas y anidad Una vez homogenizado el grano, se tomó 1 kg de cada muestra para el análisis de impurezas y sanidad. Se realizó una separación manual de las impurezas encontradas. Después se registró el peso total de impurezas y se reportado en porcentaje [13]. La determinación de sanidad consiste en identificar la presencia de insectos en sus fases de huevecillos, larva, pupa o adulto, así como su identidad. Se consideró infestado el grano si se encuentran 2 o más gorgojos (insectos perforadores) vivos en 1 kg de grano [14]. 84 Densidad por peso de mil granos De la muestra limpia se tomaron al azar 50 piezas de grano. Las piezas fueron colocadas en un vaso de precipitado previamente pesado. Se registró el peso y por diferencia se calculó el peso de las piezas de grano. El peso correspondiente a las 50 piezas se multiplicará por 20. El resultado se expresará en gramos [14]. Dureza La dureza del grano es la resistencia que posee a la acción mecánica o al quebrado durante la cosecha y la postcosecha, dicha propiedad intrínseca se determinó de acuerdo con el siguiente método: Dureza por abrasión Este parámetro se determinó por resistencia a la abrasión. Fueron tomadas 10 piezas de la muestra, se pesaron y tallaron 5 veces cada uno de los granos sobre tiras de lija No 100 x 23 cm, tratando de aplicar la misma fuerza y asegurándose de recorrerlos en toda la longitud. Al final se pesaron los residuos no desgastados de los granos y será reportado el porcentaje de pérdida por abrasión calculado por diferencia [14]. Análisis selectivo Se tomaron 100 g del grano limpio y fueron separadas las fracciones, apartando los granos para revisarlos. Los daños que se consideraron son los indicados en la NMX–FF–043–SCFI–2003 [13]. Los resultados se expresarán en porcentaje de granos dañados y porcentaje de granos quebrados. Resultados Sensorial y temperatura En la Tabla 3 se muestran los resultados del análisis sensorial y temperatura de las diez variedades de cebada estudiadas. La ausencia de alteraciones de olor y color de los granos es una señal de que no existe contaminación por hongos o insectos [2]. Las diez variedades presentaron un olor y color característico del 85 grano de cebada en buenas condiciones. Respecto a la temperatura del grano ninguna variedad presentó una variación mayor a 5 ºC [14], por lo que todas las variedades se encuentran dentro de la norma, (Posición Tabla 6C). Tabla 6 C. Análisis físicos del grano de cebada (desviación estándar) Variedad Región Color Olor Temp. Temp. del ambiente grano (0C) Gabyota E. Zapata Característico Característico 20.5 19.4 (0.5) Gabyota Almoloya Característico Característico 21 21(0) Esmeralda Apan Característico Característico 19.5 17.6 (0.5) Esmeralda Almoloya Característico Característico 21.9 20.8 (0.4) Esmeralda Libres Característico Característico 21 21 (0) Gabyota Libres Característico Característico 21 21 (0) Adabella Libres Característico Característico 21 20.2 (0.4) Adabella Coatlaco Característico Característico 21 20.4 (0.5) Gabyota Tecoco- Característico Característico 20 18.1 (0.2) Característico Característico 20.5 20.2 (0.4) mulco Esmeralda Almoloya Imurezas y sanidad La determinación de impurezas y sanidad es de gran importancia debido a que está relacionada con el rendimiento de productos, así mismo, entre más impurezas contenga una variedad su costo comercial será menor. En la Tabla 4 se muestra el porcentaje de impurezas de cada una de las variedades analizadas, Tabla 6D. Determinación de impurezas y sanidad Variedad Estado Código Año Impurezas (%) Gabyota Hidalgo Gez 2007 2007 1 86 Gabyota Hidalgo Ga 2007 2007 5 Esmeralda Hidalgo Eap 2007 2007 1.5 Esmeralda Hidalgo Ea 2007 2007 3 Esmeralda Puebla Elp 2008 2008 2.5 Gabyota Puebla Glp 2008 2008 1 Adabella Puebla Alp 2008 2008 8 Adabella Hidalgo Ach 2008 2008 11 Gabyota Hidalgo Gth 2008 2008 4.5 Ea 2008 2008 7 Esmeralda Hidalgo La norma NMX–FF–043–SCFI–2003 establece como límite máximo de impurezas 2%, por lo tanto las variedades que se encuentran dentro del límite son GEZ 2007 (1%), EAP 2007 (1.5%) y GLP 2008 (1%). Por lo tanto dichas variedades tendrán un valor comercial más elevado respecto a las demás. Las variedades ELP 2008 (2.5%) y EA 2007 (3%) poseen un contenido mínimo por arriba del límite permitido, por lo que el costo de estas dos variedades debería ser similar y menor que GEZ 2007 (1%), EAP 2007 (1.5%) y GLP 2008 (1%). Mientras que la variedad que presentó mayor porcentaje de impurezas fue ACH 2008 (11%) por lo que su costo sería mucho menor respecto a las variedades restantes. Densidad La determinación de densidad del grano se realizó por el método peso de mil granos (Tabla 6E), Tabla 6E. densidad del grano de cebada Variedad Código Peso mil granos (G) Gabyota Gez 2007 42.8 (0.00) Gabyota Ga 2007 46.4(0.07) Esmeralda Eap 2007 37.5(0.08) Esmeralda Ea 2007 37.0 (0.09) Esmeralda Elp 2008 38.4(0.05) 87 Gabyota Glp 2008 50.6(0.09) Adabella Alp 2008 43.2(0.06) Adabella Ach 2008 38.0(0.06) Gabyota Gth 2008 39.2(0.01) Esmeralda Ea 2008 36.2 (0.15) El peso de mil granos es un indicador del tamaño del grano. El peso de mil granos en la cebada suele variar de 20–50 g [15]. En las diez variedades analizadas los valores de peso de mil granos oscilan entre 36.2–50.6 g. La variedad que presentó el menor peso de mil granos fue EA 2008 (36.2 g), mientras que GLP 2008 (50.6 g) mostró el mayor peso, lo cual significa que ésta última variedad tiene los granos más grandes respecto a las otras variedades analizadas. Por lo tanto a mayor peso de mil granos hay mayor tamaño de grano y mayor rendimiento. Dureza La dureza del grano es la resistencia que posee a la acción mecánica o al quebrado durante la cosecha y la postcosecha. En la Tabla 6 se muestran los resultados de la determinación de dureza por abrasión. Los valores se encuentran en un rango de 0.5–9.5% en pérdida de peso. Las variedades presentaron valores distintos. La variedad que presentó mayor resistencia a la abrasión fue EA 2007, por lo que tiene mayor dureza y menor pérdida de peso, mientras que la variedad que perdió más peso fue EAP 2007, Tabla 6F. Dureza del grano de cebada Variedad Código % Pérdida de peso Gabyota GEZ 2007 2.9 Gabyota GA 2007 3.5 Esmeralda EAP 2007 9.5 Esmeralda EA 2007 0.5 Esmeralda ELP 2008 2.5 88 Gabyota GLP 2008 6.9 Adabella ALP 2008 5 Adabella ACH 2008 5.5 Gabyota GTH 2008 5.5 Esmeralda EA 2008 3.8 Análisis selectivo Dentro del análisis selectivo se determina la cantidad de granos dañados (Tabla 7). El porcentaje obtenido es de gran importancia ya que podría representar un menor rendimiento en la molienda y obtener menos cantidad de harina (Serna, 2001), (Posición Tabla 6G). Tabla 6G. Análisis selectivo del grano de cebada Variedad Código Granos Daña- Granos Quedos (%) brados (%) Gabyota Gez 2007 10.5 1.9 Gabyota Ga 2007 8.5 7.7 Esmeralda Eap 2007 17 1.7 Esmeralda Ea 2007 17.7 2.0 Esmeralda Elp 2008 33.5 4.5 Gabyota Glp 2008 4.5 7.5 Adabella Alp 2008 2.0 5.5 Adabella Ach 2008 1.9 5.7 Gabyota Gth 2008 21.5 1.9 Esmeralda Ea 2008 15.8 10 La norma NMX–FF–043–SCFI–2003 establece 10% como máximo de granos dañados. Los valores de las diez variedades de cebada analizadas oscilan entre 1.9–33.5%. Las variedades que presentaron mayor porcentaje al establecido por la norma fueron: ELP 2008 (33.5), GTH 2008 (21.5), EA 2007 (17.7), EAP 2007 (17), EA 2008 (15.8) y GEZ 2007 (10.5). Las variedades que 89 se encuentran dentro del límite permisible de granos dañados de acuerdo a la norma mencionada anteriormente fueron: ACH 2008 (1.9), ALP 2008 (2.0), GLP 2008 (4.5) y GA 2007 (8.5). Los granos dañados pueden ser resultado de la falta de condiciones adecuadas durante la maduración de la espiga, falta de agua o nutrientes durante las épocas críticas de crecimiento, estrés térmico, enfermedad y otros aspectos [16]. En cuanto a los granos desnudos y quebrados la NMX–FF– 043–SCFI–2003 establece como máximo de granos quebrados 5%. Los valores de granos quebrados oscilan entre 1.7–10%. Las variedades que sobrepasan el porcentaje máximo son: EA 2008 (10), GA 2007 (7.7), GLP 2008 (7.5), ACH 2008 (5.7) y ALP 2008 (5.5). Las variedades que cumplen con el porcentaje máximo de granos desnudos y quebrados son: EAP 2007 (1.7), GEZ 2007 (1.9), GTH 2008 (1.9), EA 2007 (2.0) y ELP 2008 (4.5). Conclusiones Las determinaciones realizadas muestran que de acuerdo a la norma NMX–FF–043–SCFI–2003 ninguna de las variedades de cebada analizadas cumplen con los tres parámetros establecidos por dicha norma, sin embargo la variedad GEZ 2007 y EAP 2007 podrían adquirir el grado México si se tiene más cuidado durante su cosecha o almacenamiento ya que se obtuvo un porcentaje un poco mayor al establecido de granos dañados, en cuanto a porcentaje de impurezas y granos desnudos se encuentran dentro del límite permisible. El resto de las variedades tienen grado México no clasificado ya que sobrepasan el límite máximo de los parámetros establecidos por la NMX–FF–043–SCFI–2003, pero aun así pueden ser utilizadas para consumo humano siempre que haya un acuerdo entre las partes involucradas pero su valor comercial será menor a las que si cumplen con el grado México. 90 Referencias 1. Harol E; Ronald, S. 1987. Análisis químico de alimentos. Pearson. Continental S.A de C.V. México. 2. Dendy D. A. V.; Dobraszczyk B. J. 2004. “Cereales y productos derivados, Química y tecnología”. Acribia: Zaragoza, España. 3. Dupachak K. 2000. Ministerio de Agricultura. Alimentación de Manitoba. University Crescent. Winnipeg, Manitoba. Canada. 4. Bhatty R. S. 1993. “Nonmalting uses of barley” in: Barley Chemistry and Technology. Cereal Chemistry. A. W. Macgregor and R. S. Bhatty, Eds. 5. Newman R. K.; Newman, C. W. 1991. “Barley as a food grain”. Cereal Foods World. 36:800-805. 6. Wang L.; Xue, Q.; Newman, R. K.; Newman, C. W. 1993. Enrichment of tocopherols, tocotrienols and oil barley in fractions by milling and pearling. Cereal Chemistry. 70:499-501. 7. Bhatty, R. S. 1999. Potential of hull-less barley. Cereal Chemistry. 76:589-599. 8. Newman, R. K.; Newman, C. W.; Graham, H. 1989. The Hypocholesterolemic function of barley b-glucans. Cereal Foods World. 34:883-886. 9. SAGARPA. 2008. Secretaría de Agricultura, ganadería, desarrollo rural, pesca y alimentación. Delegación Hidalgo. http:// www.siap.sagarpa.gob.mx. 10. Callejo, G. M. 2002. Industrias de cereales y derivados. Mundi Prensa:Madrid. 11. Halloran G. M.; Pennell, A. L. 1982. Duration and rate of development phases in wheat in two environments. Ann. Bot. 49:115-121. 12. Terroba, O. 1994. Claridades Agropecuarias· Acerca. No 13, septiembre. México, D. F. 13. Norma Mexicana NMX-FF-043-SCFI-2003. Productos alimenticios no industrializados para consumo humanocereal-cebada maltera (Hordeum vulgare L. y Hordeum distichum L.). Especificaciones y mètodos de prueba. 14. Camacho, R. N.; Dìaz, G. M.; Santillo, H. M.; Velásquez M. O. 91 2001. “Productos de cereales y leguminosas”, en; Manual de prácticas. Facultad de Química. unam. México, D.F. 15. Tscheuschner, H. D. 2001. Fundamentos de tecnología de los alimentos, 2001. Editorial Acribia. Zaragoza, España. 16. Serna- Saldivar, S. R. O. 2001. Química, almacenamiento e industrialización de los cereales. AGT Editor. México, D.F. 92 Producción de hidrÓgeno por métodos biológicos: Revisión Pineda Muñoz F., Lizardi Jiménez M. A., Arana Cuenca A., Medina Moreno S. A. y Jiménez González A. Universidad Politécnica de Pachuca, Ex– Hacienda de Santa Bárbara, Municipio de Zempoala, Departamento de Ingeniería en Biotecnología. Laboratorio de Biotecnología Ambiental. Correo electrónico: [email protected] Resumen En la actualidad, la economía y el abastecimiento energético, dependen en gran medida de los combustibles fósiles, lo que ha ocasionado el consumo excesivo y agotamiento acelerado de estos recursos no renovables (Show et al., 2012). Además el hecho de que existan reservas limitadas y una distribución desigual de estas en el mundo ha provocado conflictos económicos y diplomáticos (Jung et al., 2010). El uso y abuso de los combustibles fósiles (en forma líquida, sólida o gaseosa) ha causado la contaminación de suelo, aire y agua generando cantidades importante de emisiones de dióxido de carbono (CO2), este compuesto se consideran uno de los principales responsables del calentamiento global y del cambio climático (Kapdan & Kargi, 2006, Vázquez & Varaldo, 2009, Show et al., 2012). Los biocombustibles son una alternativa, pues son compuestos que pueden disminuir la dependencia de los combustibles fósiles. El gas hidrógeno (H2) es un biocombustible (Ferreira et al, 2012), el cual puede almacenarse para su posterior uso, además, los sistemas que funcionan a partir de H2 son limpios ya que su combustión produce principalmente vapor de agua como residuo (García et al., 2012), no produce emisiones de CO2 a la atmósfera (Jayasinghearachchiet al., 2012). De los métodos biológicos para producir H2, la fermentación oscura (FO) de un sustrato orgánico ha recibido atención creciente en los últimos años, una de las razones es que se realiza a tem93 peratura ambiente y presión atmosférica (Wang et al., 2012), por lo que no necesita una aportación energética para alcanzar estas condiciones. Este método se caracteriza por poseer una tasa de generación de H2 alta (alrededor de 100 veces más que con procesos fotosintéticos), genera H2 de forma continua a una tasa sostenida (no depende de la energía de la luz), produce metabolitos de interés comercial (ácidos y disolventes orgánicos), es capaz de emplear residuos orgánicos como sustrato en condiciones no estériles (Vázquez y Varaldo, 2009) lo cual implica una reducción en el costo de la materia prima y el aprovechamiento de un desecho orgánico. Además el agua producida puede utilizarse para la irrigación en la agricultura y los componentes con nitrógeno y fósforo pueden utilizarse en la industria de los fertilizantes (Narasu y Urbaniec, 2013). Palabras clave: Producción de hidrógeno, fermentación, digestión anaerobia. Introducción Existen diferentes métodos convencionales en la producción de hidrógeno, la mayoría de estos se obtiene mediante procesos termoquímicos a temperaturas elevadas 200–3000 °C, Entre estos métodos se encuentra el reformado con vapor, la oxidación parcial, el reformado autotérmico y la conversión gas–agua. Estos métodos se caracterizan por transformar combustibles como la gasolina, hidrocarburos, amonio, metanol o etanol en sustancias gaseosas ricas en H2 sin embargo producen una gran cantidad de monóxido de carbono (CO). Además el H2 se obtiene a partir de gas natural, aceites pesados–nafta, carbón y electrólisis del agua con el 40%, 30%, 18% y 4% respectivamente (Das y Veziroglu, 2008). El reformado con vapor es actualmente el método más utilizado, por ser el más económico, el proceso consta de dos etapas, en la primera, la materia prima (previamente desulfurizada) ingresa a un vaporizador (700–830 °C, 3.5 MPa. Fernandes et al., 2010). Posteriormente los productos son enfriados a 360 °C y la concentración de CO2 disminuye a un 0.2–0.3% del volumen, el CO2 remanente es lavado mediante la absorción de etanolamidas. La desventaja del 94 método es la producción de cerca de 7.05 kg de CO2 por 1 kg de H2 producido. Además existen métodos como la pirólisis, co–pirólisis (500–900 °C y 0.1–0.5 MPa) y la electrólisis alcalina, el intercambio de protón, celdas de electrólisis con óxidos sólidos, el cracking termoquímico del agua y la fotoelectrólisis. (Bičaková y Straka, 2012). Producción biológica de hidrógeno (pbh) El H2 se produce biológicamente mediante diferentes rutas metabólicas, las cuales se agruparse a grandes rasgos en dos grupos, los dependientes de la luz y los independientes de ella. Los procesos dependientes incluyen la fotólisis directa, indirecta y fotofermentación mientras que en los independientes, básicamente es la fermentación oscura (Show et al., 2012). Los principales métodos para la PBH son la biofotólisis (directa e indirecta), la conversión biológica de agua a gas, fotofermentación, fermentación oscura, celdas de electrólisis microbiana y los métodos con múlti–etapas integradas. A continuación se presentan cada una. Biofotólisis (directa e indirecta) La biofotólisis directa utiliza los sistemas fotosintéticos de las microalgas y cianobacterias para la transformación de la energía solar en energía química, ocupada para la ruptura de moléculas de agua y la generación de H2 [2H2O + Energía solar a 2H2 + O2]. En condiciones anaerobias, algunos microorganismos liberan el exceso de electrones transfiriéndolos a dos grupos de enzimas (hidrogenasas y nitrogenasas), las cuales convierten los iones de hidrógeno (H+) en H2, la desventaja de este método es la sensibilidad de las hidrogenasas a la presencia de oxigeno (O2) y la baja eficiencia de producción (5–15%) además de la necesidad de superficies significativamente amplias para recolectar la luz. Debido a lo anterior, investigadores buscan identificar o crear microorganismos menos sensibles a la presencia de oxígeno, separar los ciclos de O2 e H2 y cambiar la relación de fotosíntesis a respiración para prevenir la acumulación de O2. Por otro lado la biofotólisis indirecta, es un método donde inicialmente se produce biomasa mediante fotosíntesis (algas verdes) bajo condiciones anaero95 bias y limitantes de azufre, después sucede una fermentación con un rendimiento de 4 y 2 moles de H2 y acetato respectivamente, por mol de glucosa (los moles de acetato se emplean para producir H2). Las ecuaciones son [6CO2 + 6H2O + Energía solar à C6H12O6+ 6O2] posteriormente [C6H12O6 + 6H2O + energía solar à 12H2 + 6CO2] (Bičáková y Straka, 2012, Show et al., 2012). Fotofermentación En este proceso, los microorganismos fermentativos capturan energía directamente de la luz solar y utilizan componentes reducidos (ácidos orgánicos), que funcionan como donador de electrones, para llevar a cabo una fotosíntesis anaerobia. Las bacterias desprenden H2 molecular mediante la acción de nitrogenasas, que en ausencia de nitrógeno, reducen a los protones en H2. La reacción completa es [C6H12O6 + 6H2O + energía luminosa à 12H2 + 6CO2]. Teóricamente se han alcanzado rendimientos de 4 y 6 moles de H2 por mol de sustrato consumido (ácidos grasos como acetato y malato) (Patel et al., 2012). Celdas de electrólisis microbiana (cem) Combina el metabolismo bacteriano y la electroquímica para producir H2. Las bacterias se fijan a un ánodo, donde oxidan componentes orgánicos simples y transfieren los electrones a un conductor sólido. Mediante un circuito eléctrico externo, los electrones son conducidos hasta alcanzar al cátodo, donde reaccionan con agua para producir H2, el cual se desprende del compartimiento del cátodo. Es necesario un abastecimiento de energía para proporcionar el voltaje necesario para conducir a los electrones al cátodo y que estos tengan la energía necesaria para reducir al agua en H2. Ya que el potencial estándar del donador de electrones (E°acetato=–0.28 V) es más positivo que el del H2 (E°H2=–0.41 V), el voltaje necesario para la producción de H2 es de~0.13 V, el cual es 9 veces menor que el voltaje requerido para la electrólisis del agua (Lee et al., 2010). El rendimiento de este método es bajo y existen pérdidas de energía durante varias partes del proceso, 96 además es necesario incrementar la tasa de producción de H2, la máxima reportada es de 0.13 L H2/L h, la cual se considera baja si se compara con las obtenidas en la fermentación oscura de 7.9 L H2/L h. (Bičaková y Straka, 2012). Métodos con multi–etapas integradas Se han propuesto procesos múlti–etapas, los cuales incluyen 3 o hasta 4 procesos distintos, con el propósito de maximizar la producción de H2. Normalmente se propone iniciar con la fotólisis directa, seguida de una etapa de fotofermentación, la tercera etapa propuesta es la fermentación oscura donde las bacterias convierten el sustrato en H2 y ácidos orgánicos. La cuarta etapa es el uso de mec. mec utiliza los ácidos orgánicos producidos en la fermentación oscura. La integración de múltiples procesos representa un gran desafío para la ingeniería de reactores, el diseño del sistema, el control del proceso, la operación y el mantenimiento (Show et al., 2011). Producción de hidrógeno por vía fermentativa (pfh) La obtención de hidrógeno por métodos fermentativos, se encuentra inmersa en el proceso de digestión anaerobia, en este proceso la degradación de la materia orgánica se realiza en ambientes anaerobios por un consorcio microbiano, esto implica la cooperación de poblaciones de microorganismos que generan una fermentación estable y autorregulada. Es un proceso anaerobio mediante el cual casi cualquier residuo orgánico puede ser transformado biológicamente en biogás y en compuestos orgánicos ricos en energía como productos finales (Khalid et al., 2011). El proceso se lleva acabo en diferentes etapas, en la primera etapa, las bacterias hidrolíticas generan monómeros de carbohidratos y aminoácidos a partir de los sustratos complejos como polímeros de proteína y polisacáridos. Posteriormente las bacterias fermentativas generan los ácidos orgánicos, H2 y CO2 a partir de los monómeros generados. En este punto el H2 y el acetato puede ser consumido y/o producido por varios grupos de microorganismos. El acetato es generado en la acetogénesis a partir de la reducción de CO2 y H2 por acetógenos autotróficos por la 97 vía Wood–Ljungdahl (Homoacetogénesis). Finalmente, para una degradación completa de la materia orgánica, se consumenlos ácidos orgánicos e H2 por metanógenosacetoclásticos/hidrogenotróficos produciendo CH4 y CO2. Cuando están presentes el azufre y/o nitrato, las bacterias reductoras de azufre o de nitrato son capaces de utilizar al H2 como donador de electrones, produciendo sulfuros y amonio respectivamente (Valdez y Varaldo, 2009). El esquema general del proceso se muestra en la fig. 1. En el proceso de digestión anaerobia, se observa que el H2 es un intermediario clave, consumido principalmente por metanógenos, sulfato y nitrato reductores, y homoacetógenos. La concentración de H2 y la actividad de los microorganismos consumidores de H2 regulan las rutas fermentativas. Dado al rápido consumo del H2, la concentración es usualmente muy baja y por lo tanto se establece un tipo de consumidor de H2 que depende principalmente del inoculo, la concentración de H2, fuente de carbono, solubilidad del aceptor de electrones y la capacidad de utilizar concentraciones traza de H2. (Valdez y Varaldo 2009). Fig. 7A. Rol del H2 en la degradación anaerobia de materia orgánica por un consorcio microbiano. (Vázquez y Varaldo 2009). 98 Cuando el interés es la producción de H2 será necesario inhibir la actividad de los microorganismos consumidores de H2, favoreciendo o enriqueciendo en el inoculo a los microorganismos productores de H2. Por lo tanto no se lleva a cabo una fermentación completa a la cual se le denomina como fermentación oscura. Fermentación oscura La fermentación oscura (FO) es un proceso en el que los carbohidratos son convertidos, en H2, CO2 y subproductos metabólicos como etanol y ácidos orgánicos. El proceso se lleva acabo en condiciones suaves a temperaturas relativamente bajas (30–80°C), en condiciones anaerobias (Patel et al., 2012, Bičáková y Straka, 2012, Narasu y Urbaniec, 2013). La FO se diferencia de los otros métodos para la PBH en que utiliza sustratos orgánicos como única fuente de energía y de electrones, incluso puede utilizar sustratos orgánicos en formas complejas (Celulosa, residuos de comida, de papel o municipales). Finalmente la operación de dichos sistemas se considera simple en la construcción y presenta bajas demandas energéticas. (Lee et al., 2010, Oh et al., 2011). El H2 es un componente clave en el metabolismo de varios anaerobios y de algunos aerobios. Los microorganismos tienen la capacidad de usar esta molécula rica en energía cuando se encuentra disponible en el ambiente y obtiene electrones de su oxidación para generar energía. En la ausencia de aceptores de electrones externos, algunos microorganismos disponen del exceso de electrones generados durante el metabolismo al reducir protones a H2. Depende principalmente de dos enzimas: las hidrogenasas y las nitrogenasas. Estas enzimas catalizan la reacción química [2H+ + 2e – ↔H2] (Patel et al., 2012, Hallenbeck, 2009). Rutas metabólicas de la fermentación oscura para la producción de hidrógeno Actualmente, se conocen tres rutas bioquímicas que generan H2 en la fermentación oscura, dos suceden en microorganismos anaerobios estrictos donde el género de Clostridium es un buen 99 ejemplo y la tercera en microorganismos anaerobios facultativos principalmente del género de Escherichiacoli y Enterobacteriaceae. Fig. 7B. Diagrama de las rutas metabólicas para la producción fermentativa de H2 (Oh et al., 2011). Las abreviaciones significan lo siguiente: AC, acetato; ACCO, acetil–CoA; ACK, Acetato cinasa; ALD, Alcohol deshidrogenasa; ETH,Etanol; Fdox, Ferredoxina oxidada; Fdred, Ferredoxina reducida; FHL, Formiato: hidrógeno liasa; FOR, Formiato; GLC, Glucosa; G3P, Gliceraldehído–3–fosfato; G6P, Glucosa–6–fosfato; HydA, Hidrogenasa dependiente de ferredoxina; LAC, Lactato; LDH, Lactato deshidrogenasa; PP pathway, Ruta pentosa fosfato; NFOR, NAD(P)H: ferredoxina oxidoreductasa; PDH, Piruvato deshidrogenasa; PFL, Piruvato: formiato liasa; PFOR, Piruvato: ferredoxina oxidoreductasa; PYR, Piruvato (Oh et al., 2011). 100 Fermentación oscura con anaerobios estrictos Estos microorganismos rompen la molécula de glucosa en piruvato y NADH. El piruvato es convertido posteriormente en acetil– CoA y CO2 por medio de la piruvato–ferredoxina oxidoreductasa (PFOR), el acetil–CoA es convertido en acetil–fosfato, lo que da como resultado, la generación de ATP y la expulsión de acetato. La oxidación del piruvato en acetil–CoA requiere la reducción de una molécula de ferredoxina mediante la PFOR. Posteriormente, la ferredoxina es oxidada por una hidrogenasa donde se produce el H2 (Hallenbeck, 2002, Mathews y Wang, 2009, Das y Veziroglu, 2008). Una producción adicional de H2 puede generarse a partir del nadh producido durante la glucólisis. El nadh es oxidado mediante la reducción de la ferredoxina y una nadh–ferredoxina reductasa (nfor), pero sólo a muy bajas presiones parciales de H2 (<60 Pa) (Mathews y Wang, 2009). Posteriormente una hidrogenasa oxida a las moléculas de nadh y a la ferredoxina para producir dos moléculas de H2 (Cai et al., 2011). El rendimiento teórico máximo de H2 con este tipo de microorganismos es de 4 moles de H2 por mol de glucosa y se alcanza cuando el acetato es uno de los productos finales de la fermentación. La formación de butirato genera rendimientos de 2 moles de H2 por mol de glucosa y rendimientos aún menores se reportan con la producción de propianato, alcohol y ácido láctico (Mathews y Wang, 2009). Fermentación oscura con anaerobios facultativos En esta fermentación, típica en Escherichiacoli y Enterobacteriaceae, se emplean principalmente dos tipos de enzimas; 101 la piruvato:formiatoliasa (PFL) y la formiato:hidrógeno liasa (FHL). El piruvato formado por la vía de Embden–Meyerhof– Parnas (EMP) es descompuesto en acetil–CoA y formiato mediante la PFL. Posteriormente el formiato es transformado en H2 y CO2 mediante FHL como se observa en las ecuaciones siguientes (Mathews y Wang, 2009; Oh et al., 2011). la cual es afectada por varios factores (Tiempo de residencia hidráulica (TRH), concentración del sustrato en el influente, config. ción del reactor, tipo de agua residual, pH, temperatura, requeri- miento nutricional y la presencia de productos de fermentación. De los anteriores, el pH, el TRH y la concentración de sustrato del influente se consideran cruciales para la producción de H2, pero de actúan de manera independiente (Zhao et al., 2008) Sustratos empleados en la producción de hidrógeno Una gran variedad de sustratos se han utilizado para la pfh, varios estudios de investigación han empleado azúcares simples tales como la glucosa, la sacarosa y el almidón. Sin embargo, para que un sustrato pueda considerarse potencial para la producción sustentable de H2, no sólo debe de ser abundante y disponible, también debe de ser barato y biodegradable. Algunos residuos empleados para la PFH son: paja–rastrojo y hojas de maíz, hierba ensilada, salvado de arroz, planta de sorgo dulce, bagazo de caña de azúcar, paja–salvado de trigo, melaza, orina y estiércol de vaca, ganado, cerdo, zanahorias, piel de pollo, huevo, carne, residuos de comida, desperdicios de cocina y suero de queso. De los cualesel suero de queso presenta el mayor rendimiento con 290 ml H2/g de SV (Guo et al., 2010). Grandes cantidades de desecho se generan en los sectores de la agricultura y en las industrias donde se procesa comida y frutas. El uso de estos desperdicios permite la generación de energía renovable, la minimización y 102 estabilización de residuos, lo que conlleva su tratamiento y a la consecuente reducción de la contaminación (Patel et al., 2012). Los desechos de comida son la principal fuente de pudrición, olores desagradables en la recolección y transporte debido a la alta concentración de sólidos volátiles (85–95%) y contenido de humedad (75–85%). La mayoría de los residuos de alimentos se han tirado en vertederos junto con otros residuos, lo que ha ocasionado varios problemas como la emanación de olores, propagación de plagas, emisión de gases tóxicos y la contaminación de aguas superficiales (Han et al., 2005). Los residuos orgánicos generan lixiviados, estos son uno de los más graves problemas ambientales presentes en los últimos años (Liu et al., 2011). Presentan una elevada demanda química (dqo) y bioquímica de oxígeno (dbo), un alto contenido de sales inorgánicas y una alta toxicidad (Gotvajn et al., 2009). Sin embargo, los lixiviados frescos contienen una fracción orgánica alta (dbo 5 /dqo < 0.6), lo que los convierte en un sustrato potencial para la producción de hidrógeno a través de procesos de fermentación anaerobia (Hermosilla et al., 2009). Liu et al., 2011 empleo lixiviados de desechos orgánicos como sustrato para la pfh, obtuvo una tasa de producción de H2 máxima de 220 mL/(L día) y una eficiencia de remoción de la dqo de 66.9% en un reactor continuo completamente agitado, con una velocidad de flujo ascendente de 3.7 m/h y un tiempo de residencia hidráulica de 12 h. A continuación se menciona la concentración de sustrato y el pH como dos de los factores que se consideran de mayor importancia en la pfh. Producción de H2 en cultivos puros y mixtos Una gran variedad de cultivos puros de bacterias se han utilizado para producir H2 a partir de diversos sustratos, algunos de los microorganismos más eficientes en la producción de H2 incluyen a Enterobactercloacae, Enterobacteraerogenes, Clostridium sp. y Bacillus sp. (Bičáková y Straka, 2012). Las especies de Enterobacter son gram negativos, con forma de barra y anaerobios facultativos. Las especies del genero Clostridum son gram positivos, 103 anaerobios estrictos, formadores de esporas y poseen forma de barra. La mayoría de los estudios con cepas puras han empleado como sustrato carbohidratos puros (Wang y Wan, 2009; Sinha y Pandey, 2011). Algunos rendimientos en la producción de H2 se muestran en la Tabla 7C. Tabla 7C. Cultivos puros de bacterias para la producción de hidrógeno por fermentación. Microorganismo Glucosa Tipo de reactor Lote Máximo Rendimiento de H2 Clostridiumsp. Fanp2 Sustrato 0.2 mol/l medio Clostridium butyri- Xilosa Lote 0.73 mol/mol xilosa Glucosa Lote 2 mol/mol glucosa Sacarosa Lote 2.07 mol/mol hexosa Residuos Lote 2.2 mol/mol sustrato ficumm–21 de Quitina Clostridium thermoce- B i o m a s a Lote 2.3 mol/mol glucosa cumcgs5 Clostridium acetobutylicum Clostridium pasteurianumch4 Clostridium paraputri- llum27405 Celulósica Clostridium butyri- Almidón Lote 9.95 mmol/g dqo Celulosa Conti- 0.3 mol/mol glucosa Glucosa Conti- 1.08 mol/mol glucosa Lactosa Conti- 3 mol/mol lactosa Lote 0.007 mol/g dqo cumcgs2 Clostridiumsp. Strain no. 2 Clostridium acetobu- nuo tylicumatcc 824 Clostridium thermo- nuo lacticum nuo Pseudomonassp. gz1 Lodo Resi- Enterobacteraeroge- Glucosa Lote 0.05 mol/l medio Glucosa Lote 0.1 ml/l medio dual nesnbrc 13534 Hydrogen–producingbacterial B49 104 Enterobacter aeroge- Glicerol Lote 0.6 mol/mol glicerol Glucosa Lote 1 mol/mol glucosa Almidón Lote 1.09 mol/mol almidón Glucosa Lote 1.2 mol/mol glucosa Escherichiacoli Glucosa Lote 2 mol/mol glucosa Thermoanaerobacte- Glucosa Lote 2.4 mol/mol glucosa Ruminococcusalbus Glucosa Lote 2.52 mol/mol glucosa Enterobactercloa- Celobiosa Lote 5.4 mol/mol celobio- neshu–101 Enterobacter aerogenesho–39 Enterobacteraerogenes Escherichia colimc13–4 rium thermosaccharolyticumku001 caeiit–bt 08 Enterobactercloa- sa Sacarosa Lote 6 mol/mol sacarosa Glucosa Lote 8.7 mol/mol glucosa caeiit–bt 08 Citrobacter amalonaticusy19 Thermotogaelfii Glucosa Lote 84.9 mmol/l medio Ethanoligenens harbi- Glucosa Conti- 1.93 mol/mol glucosa Escherchiacoli Glucosa Conti- 2 mol/mol glucosa Enterobacteraeroge- Melasa Conti- 3.5 mol/mol azúcar nenseyuan–3 nuo nuo nese 82005 nuo Las bacterias capaces de producir H2, existen de manera natural en el ambiente (suelo, lodos de aguas residuales, composta, entre otros). Así que estos compuestos pueden utilizarse como inóculos para la PBH por vía fermentativa y son más prácticos de emplear que aquellos que ocupan cultivos puros, más simples de operar y de controlar, además de que posiblemente puedan emplear fuentes más diversas de materia prima (Wang y Wan, 2009, Sinha y Pandey, 2011). 105 Tabla 7D. Pretratamientos utilizados para el enriquecimiento de bacterias productoras de H2. Bibliografía 1. Show K Y.; Lee D J.; Tay J H.; Lin C Y.; Chang J F. 2012. Biohydrogen production: current perpectives and the way forward. Inoculo Pretratamientos estudiados Sustrato Tipo de reactor Rendimiento máximo de H2 Lodos de digestión ácido, básico, choque térmico, aeración y cloroformo Glucosa Lote 1.80 mol/mol sustrato Choque térmico Lodos de estiercol de ganado Congelado y descongelado, ácido, choque térmico y 2-Bromoetanosulfonato de sodio Glucosa Lote 1.00 mol/mol sustrato Ácido Granulosmetanogénicos Ácido, choque térmico y cloroformo Glucosa Lote 1.20 mol/mol sustrato Cloroformo Lodos de digestión de aguas residuales Choque térmico, aeración, ácido, básico,2-Bromoetano sulfónico e yodopropano Sacarosa Lote 6.12 mol/mol sustrato Básico Lodos anaerobios 2-Bromoetanosulfonato de sodio, ácido, choque térmico Agua residual lácticas Lote 0.0317 mmol/g DQO 2-Bromoetanosulfonato de sodio Método óptimo Fuente: Tabla modificada de Wang y Wan, 2009. International Journal of Hydrogen Energy. 37: 15616-15631. 2. Jung K W.; Kim D H.; Shin H S. 2010. Continuos fermentative hydrogen production from coffee drink manufacturing wastewater by applying uasb reactor. International Journal of Hydrogen Energy. 33: 13370-13378. 3. Kapdan I K.; Kargi F. 2006. Bio-hydrogen production from waste materials. Enzyme and Microbial Technology. 38: 569582. 4. Vazquez V I.; Varaldo P M. 2009. Hydrogen production by fermentaive consortia. Renewable and Sustainable Energy Reviews. 13: 1000-1013. 5. Ferreira A F.; Marques A C.; Batista A P.; Marques P A.; Gouveia L.; Silva C M. 2012. Biological hydrogen production by Anabaena sp.- Yield energy and CO2 analysis including fer106 mentative biomass recovery. International Journal of Hydrogen Energy.37: 179-190. 6. García R E.; Martínez V L.; Franco J I.; Curutchet G. 2012. Selection of natural bacterial communities for the biological production of hydrogen.International Journal of Hydrogen Energy.37: 10095-10100. 7. Jayasinghearachchi H S.; Sarma P M.; Lal B. 2012. Biological hydrogen production by extremely thermophilic novel bacterium Thermoanaero bactermathranii A3N isolated from oil producing well. International Journal of Hydrogen Energy. 37: 5569- 5578. 8. Wang B.; Yongye L.; Yahua Q.; Yang Y.; Qiang S.; Wei W.; Jianlong W. 2012. Technology Research on Bio-hydrogen Production. ProcediaEngineering. 43:53-58. 9. Narasu M L.; Urbaniec K. 2013. International conference on advances in biological hydrogen production and applications ICABHPA 2012.Journal of Cleaner Production. 52: 11-13. 10. Das D.; Veziroglu N J. 2008. Advances in biological hydrogen production processes. International Journal of Hydrogen Energy. 33:6046-6057. 11. Fernandes B S.; Peixoto G.; Albrecht F R. 2010. Potential to produce biohydrogen from various wastewaters. Energy for Sustainable Development. 14: 143-148. 12. Bičaková O.; Straka P. 2012. Production of hydrogen from renewable resources and its effectiveness. International Journal of Hydrogen Energy.37: 11563-11578. 13. Patel S K.; Kumar P.; Kalia V C. 2012. Enhancing biological hydrogen production through complementary microbial metabolisms. International Journal of Hydrogen Energy. 37: 10590-10603. 14. Lee H S.; Vermaas W F.; Rittmann B E. 2010. Biological hydrogen production: prospects and challenges. Trends in Biotechnology. 28: 5. 15. Khalid A.; Arshad M.; Anjum M.; Mahmood T.; Dawson L. 2011. The anaerobic digestion of solid organic waste. Waste Management. 31: 1737-1744. 107 16. Oh Y K.; Raj S M.; Jung G Y.; Park S. 2011. Current status of the metabolic engineering of microorganisms for biohydrogen production. Bioresource technology. 102: 8357-8367. 17. Hallenbeck P C. 2009. Fermentative hydrogen production: Principles, progress and prognosis. International Journal of Hydrogen Energy. 34: 7379-7389. 18. Mathews J; Wang G. 2009. Metabolic pathway engineering for enhanced biohydrogen production. International Journal of Hydrogen Energy. 34: 7404-7416. 19. Zhao B H.; Yue Z B.; Zhao Q B.; Mu Y.; Yu H Q.; Harada H.; Li Y. 2008. Optimization of hydrogen production in a granulebased uasb reactor. International Journal of Hydrogen Energy. 33: 2454-2461. 20. Han S K.; Kim S H.; Shin H S. 2005. uasb treatment of wastewater with VFA an alcohol generated during hydrogen fermentation of food waste. Process Biochemistry. 40: 28972905. 21. Liu Q.; Zhang X.; Yu L.; Zhao A.; Tai J.; Liu J.; Qian G.; Xu P Z. 2011 Fermentative hydrogen production from fresh leachate in batch and continuous bioreactors. Bioresource Technology. 102: 5411-5417. 22. Gotvajn A Z.; Tisler T.; Zagorc K J. 2009 Comparison of different treatment strategies for industrial landfill leachate. Journal of Hazardous Materials. 162: 1446-1456. 23. Hermosilla D.; Cortijo M.; Huang C P. 2009. Optimizing the treatment of landfill leachate by conventional Fenton and photo-Fenton processes. Science of the Total Environment. 407:3473–3481. 24. Sinha P.; Pandey A. 2011. An evaluative report and challenges for fermentative biohydrogen production. International Journal of Hydrogen Energy. 36: 7460-7478. 108 Fermentación sólida: ventajas y aplicaciones biotecnológicas Callejas–Hernández F1, Téllez–Jurado A1, Muro–Urista C2, Arana–Cuenca A1 1Biotecnología/Cuerpo Académico Aprovechamiento Integral de Recursos Bióticos, Universidad Politécnica de Pachuca, Carretera Pachuca–Cd. Sahagún, km 20, Ex–Hacienda de Santa Bárbara, Municipio de Zempoala, Hidalgo, Tel. (01 771) 547 75 10 e–mail: [email protected]. 2 Departamento de Ingeniería Química, Instituto Tecnológico de Toluca, Av. Tecnológico s/n Ex Rancho la Virgen, Toluca, CP 52140 Resumen La fermentación puede ser definida como un proceso de oxidación de azúcares realizada por un microorganismo que tiene como producto final un compuesto orgánico. Ha sido empleada desde hace miles de años por antiguas civilizaciones, principalmente en el lejano oriente para la obtención de alimentos y bebidas, sin embargo en la actualidad ha despertado el interés de diferentes ciencias como la biotecnología debido a su enorme potencial en la industria en la producción de fertilizantes, ácidos orgánicos, enzimas y, en general, en alimentos enriquecidos y bebidas; obtenida de manera sustentable utilizando como fuentes de insumo y energía recursos renovables. Dependiendo de las condiciones físicas en las que se lleva a cabo una fermentación (principalmente el porcentaje de humedad) tiene dos importantes clasificaciones; la fermentación en estado líquido o fermentación sumergida y la fermentación en estado sólido, dos clasificaciones muy diferentes entre sí y el actual punto de partida sobre diversos proyectos de investigación que se llevan a cabo en el Cuerpo Académico Aprovechamiento Integral de Recursos Bióticos. Palabras clave: Fermentación, Fermentación en estado líquido, Fermentación en estado sólido, Biotecnología. 109 Introducción Descubierta por Louis Pasteur, “la vie sans l´air” (la vida sin el aire), es decir, la fermentación puede definirse como un proceso de oxidación de azúcares realizado por un microorganismo en el que el producto final es un compuesto orgánico [1]. El proceso de fermentación más común y que sin duda del que todos hemos escuchado alguna vez es el que realiza la levadura Saccharomyces cerevisiae en malta de cebada para producir la cerveza. En este proceso el producto final es el alcohol, un producto orgánico. Sin embargo, hoy en día, la fermentación se utiliza indistintamente para determinar un proceso realizado por diversos microorganismos, entre ellos los hongos, las bacterias, la levaduras, y otros, con aire o sin aire. El proceso de fermentación ya era utilizado de manera artesanal desde hace miles de años por antiguas civilizaciones en diferentes partes del mundo, principalmente en el lejano oriente, en la elaboración del koji, el vino y el arroz fermentado para producir el popular sake de Japón [2]; los populares quesos fermentados en Francia o simplemente como técnica complementaria para preparar alimentos con aroma. Sin embargo, en la actualidad forma parte de la industria en diferentes sectores económicos: en el sector agrícola como sistema de producción de fertilizantes, hormonas que promueven el crecimiento de las plantas y biofertilizantes, en el sector alimentario en la producción de alimentos enriquecidos con proteínas y la producción de bebidas, en el sector farmacéutico y en el sector industrial en la producción de enzimas (proteínas con actividad catalítica) y algunos ácidos orgánicos, principalmente [3]. Dependiendo del medio en el que se lleve a cabo la fermentación y el producto que se obtenga, puede tener diversas clasificaciones, pero sin duda, la clasificación más importante en la investigación científica con aplicación industrial se basa en el medio físico en el cual se desarrollará el proceso fermentativo, pues en la gran mayoría de los casos de él dependerá el resultado, o sea: la fermentación en estado líquido y la fermentación en estado sólido. 110 Fermentación en estado líquido Actualmente, la técnica de fermentación más utilizada a nivel industrial es la fermentación sumergida o fermentación en estado líquido (fel) por su simplicidad de operación y su fácil escalamiento (puede llevarse a cabo en grandes volúmenes sin afectar la calidad del producto). Los recipientes en los que se lleva a cabo se llaman fermentadores o biorreactores. En este proceso, las células del microorganismo empleado se encuentran dispersas de forma homogénea en un medio de cultivo líquido (los nutrientes son solubles en agua) alimentándose, creciendo y multiplicándose al mismo tiempo que el medio de cultivo se va modificando generando así el producto deseado. Como todos los seres vivos del planeta, los microorganismos tienen un ciclo de vida que cumplen dentro de los biorreactores: una fase lac o latencia (donde el microorganismo se adapta al medio), fase log o exponencial crecimiento (donde los microorganismos se dividen), fase estacionaria (cuando la cantidad de microorganismos que se generan es la misma que la que muere de manera que se genera una población constante) y una fase de muerte. Una de las características más atractivas de fel es que puede garantizar que dicho ciclo de vida se lleve a cabo permitiendo controlar diferentes variables fisicoquímicas indispensables para el crecimiento de los microorganismos, como son; temperatura, pH, oxígeno disuelto y la concentración homogénea de nutrientes dentro del biorreactor, además, diferentes técnicas de biología molecular permiten prolongar la vida de los microorganismos empleados dentro de los reactores para obtener una mayor cantidad de producto modificando su material genético (adn). El desarrollo de nueva tecnología y reingeniería de la fel. con el paso de los años. también ha permitido, además, generar nuevos tipos de reactores que permiten prolongar procesos fermentativos por más tiempo permitiendo tener cantidades de producto constante por más tiempo (fel continua, alimentada, por lote, entre otros). 111 Fermentación en estado sólido La fermentación en estado sólido (fes) por su parte puede definirse como el cultivo de microorganismos adheridos a un soporte sólido o semisólido, en el cual el medio de cultivo se encuentra disperso en una capa fina y se encuentra en contacto con una superficie aérea con cantidades de agua libre bajas. Viniegra–González [4], un pionero mexicano en el uso de la fermentación en la investigación científica plantea a fes como “un proceso microbiológico que ocurre comúnmente en la superficie de materiales sólidos que tienen la propiedad de absorber y contener agua, con o sin nutrientes solubles”. La humedad en un sistema de fermentación sólida puede variar entre el 30 y 80% dependiendo del soporte de crecimiento usado, el producto buscado y el microorganismo empleado. El aumento en la popularidad de esta técnica en los últimos años se debe entre otras cosas a la posibilidad de usar medios de cultivo mucho más baratos que en fel, principalmente residuos agrícolas como el trillado de trigo (Retrice) y obtener una mayor cantidad de producto [5]. Especialmente, la forma de crecimiento de los hongos en fes los hace los más adecuados para esta técnica ya que pueden crecer de manera uniforme sobre todo el soporte. Algunos investigadores sugieren que una posible causa de obtener mejores resultados (en cuanto a producto) en fes se debe a que las condiciones físicas en las que se realiza asemejan más su ambiente natural de crecimiento, sustentados en que el agua no parece ser un ambiente natural de crecimiento para los microorganismos, ni si quiera los microorganismos marinos (en el caso de los hongos) crecen nadando libremente en el agua, aproximadamente el 98% de esos microorganismos que han sido aislados fueron encontrados sobre superficies por debajo del agua o creciendo sobre soportes sólidos, solo menos del 1% han sido aislados de ambientes completamente marinos [1]. El crecimiento en forma de micelio implica una ventaja adicional a los hongos filamentosos sobre los microorganismos unicelulares en la colonización del soporte sólido y en la asimilación 112 de los nutrientes del medio de cultivo [6]. En algunos casos el soporte sólido de crecimiento es también la fuente de energía para el microorganismo (como en su ambiente natural) por lo que debe estar libre de contaminantes e inhibidores del crecimiento y debe ser capaz de absorber o contener los sustratos para el crecimiento como carbohidratos, fuentes de nitrógeno y sales minerales. Estas condiciones se cumplen en la mayoría de los soportes naturales utilizados en la fermentación sólida como son el bagazo de caña, el salvado de trigo, la cebada, arroz, etc. Sin embargo existen también soportes inertes que cumplen con estos requerimientos y que se han utilizado para la fermentación sólida como la amberlita, agrolita, tezontle y especialmente, la espuma de poliuretano, en estos casos dichos materiales solo son el soporte de crecimiento, el medio de cultivo debe ser suministrado y una vez terminado el ciclo de fermentación pueden ser reutilizados. Sin embargo como casi todas las nuevas tecnologías emergentes, no todo son buenas noticias, fes tiene desventajas que al menos a corto plazo le impedirán sustituir de manera definitiva a fel. Diferencias entre fes y fel Como hemos visto anteriormente, la fermentación en estado líquido permite una producción constante y homogénea de producto gracias a que permite el control de las variables fisicoquímicas más importantes que necesita un microorganismo para su crecimiento (Tabla 8A). Sin embargo la cantidad de producto que puede obtenerse se ve limitado por dos situaciones; el producto expulsado al medio de cultivo (es decir, el producto es extracelular) sufre un efecto de dilución por la propia naturaleza del medio y, sin recurrir a la ingeniería genética, la cantidad de producto, aunque constante en la mayoría de los casos, es baja respecto a lo que se produciría a menor cantidad de humedad (existen microorganismos que han sido modificados genéticamente generando resistencia al estrés causado por altos niveles de humedad y agua libre). Por otro lado, en un sistema de fermentación en estado sólido el producto generado no sufre dilución por lo que 113 la concentración es mayor respecto a fel (Tabla 8A) y es producido en mayor cantidad al asemejarse esta condición al ambiente natural del microorganismo sin recurrir a la ingeniería genética. Las diferencias entre ambas condiciones de los sistemas puede alterar la expresión genética de los microorganismos y con ellos la generación del producto buscado [7, 8]. Tabla 8A. Comparación entre los sistemas FES y FEL [9]. Parámetro Fermentación líquida Sustrato em- Sustratos solubles. pleado Fermentación sólida Sustratos económicos de origen agroindustrial y polímeros insolubles (almidón, celulosa, pectina, lignina, etc). Agua Elevado consumo de Consumo limitado y agua. baja actividad de agua en el medio. Temperatura Fácil control, alta Complicado control, tasa de transferencia baja capacidad de transde calor. ferencia calórica en el soporte. Aireación Se requiere la in- Fácil aireación y alto inyección de altos vo- tercambio gaseoso en la lúmenes de aire, el superficie del soporte. oxígeno soluble se ve limitado. Control de pH Fácil control de pH por la homogeneidad que el sistema permite. Difícil control de pH, es común el uso de sustratos con capacidad amortiguadora y buffers. La biotecnología y la fermentación Actualmente diversas disciplinas, entre ellas la biotecnología, desarrollan alternativas tecnológicas que facilitan el aprovecha114 miento de recursos renovables para generar bienes y/o servicios de manera sustentable. El uso de desechos agrícolas como fuente de nutrientes, un menor consumo de energía y productos de mayor calidad (principalmente en el sector agroalimentario) son algunos de los impactos más significativos que busca la biotecnología. El principal objetivo de la biotecnología sobre los dos diferentes sistemas de fermentación es buscar la combinación perfecta, tener las ventajas de cada uno en uno solo, o proponiendo el desarrollo de reactores que permitan escalar a fes, buscando microorganismos capaces de producir mayores concentraciones de producto en fel o recurrir la ingeniería genética y así poder “manipular” el comportamiento de los microorganismos. Investigadores de diferentes países investigan a nivel genético el comportamiento de los microorganismos en fes y fel, ¿Qué pasa a nivel genético? ¿Por qué un mismo microorganismo puede comportarse de manera diferente bajo distintas condiciones químicas y físicas? Son solo algunas de las preguntas que la biotecnología busca responder, actualmente con éxito, si cada gen diferente codifica para una sola proteína, ¿Qué genes se expresan en una condición fermentativa? Si dichos genes, pueden ser identificados, con la ayuda de la biología molecular pueden ser activados y con ello poder generar los productos que se ven silenciados de manera normal. Por todo lo anterior, en la Universidad Politécnica de Pachuca (upp), el grupo de trabajo Aprovechamiento Integral de Recursos Bióticos (airb), gracias al apoyo del Consejo Nacional de Ciencia y Tecnología, a través del financiamiento de un proyecto de Ciencia Básica (clave CB–2011–169354), actualmente desarrolla diversos trabajos de investigación con el objetivo de resolver esas interrogantes. Conclusiones La fermentación ha tenido gran impacto principalmente en la producción de alimentos desde tiempos remotos, y la clasificación de este sistema en líquido y sólido en base a los avances científicos más recientes demuestran claramente la superioridad 115 de fes sobre fel, a nivel laboratorio, en cuanto a productividad, calidad de producto y el bajo costo de los procesos. Sin embargo esa superioridad se ve frenada por la necesidad de diseñar biorreactores y realizar estudios genéticos que nos permitan tener las ventajas de ambos sistemas en un microorganismo genéticamente modificado. Por ello, en la biotecnología estos procesos han despertado gran interés como nuevas tecnologías emergentes productoras de alimentos y enzimas (principalmente) utilizando fuentes de energía baratas y de manera sustentable. Sería injusto concluir que un sistema es más adecuado que otro, no hay una base clara de comparación hasta el momento, sin embargo, la línea de investigación comprometida en encontrar fuentes alternativas y más baratas de energía por la biotecnología es alentadora. Bibliografía 1. Hölker, U.; Höfer, M.; Lenz, J. 2004. Biotechnological advantanges of laboratory-scale solid-state fermentation with fungi. Appl. Microbiol. Biotechnol. 64:175-186. 2. Mitchell, D. A.; Berovic, M.; Krieger N. 2002. Overview of solid state bioprocessing Biotechnology Annual Review 183. Elsevier Science B.V. Volume 8. M.R. El-Gewely, editor. 3. Robinson, T.; Singh, D.; Nigam, P. 2002. Fermentación en estado Sólido; Una tecnología microbiana promisoria para producción metabolitos secundarios. Redalyc, Sistema de Información Científica Vitae. 9:27-36. 4. Viniegra-González G. 1997. Solid State Fermentation: Definition, Characteristics, limitations and monitoring. In Roussos, S.; Lonsane B. K.; Raimbault M. and Viniegra-González, G. Eds. Advances in Solid State Fermentation, Kluwer Acad. Publ., Dordrecht, Chapter 2. 5. Quintanar Gómez, S.; Arana-Cuenca, A.; Mercado Flores, Y.; Gracida Rodríguez, J.N.; Téllez-Jurado, A. 2012. Effect of particle size and aeration on the biological delignification of corn straw using Trametes sp. BioResources. 7(1):327-344. 6. Pandey, A. 1992. Recent Process Developments in Solid State 116 Fermentation. Process Biochemistry. 27: 109-117. 7. Viniegra-González, G.; Favela-Torrez, E.; Aguilar, C.; RomeroGómez, S.; Díaz-Godinez, G.; Augur, C. 2003. Advantages of fungal enzyme production in solid-state over liquid fermentation systems. Biochemical Engineering Journal. 13:157-167. 8. Iwashita, K.; Todoroki, K.; Kimura, H.; Shimoi, H.; Ito, K. 1998. Purification and characterization of extracellular and cell Wall bound b-glucosidase from Aspergillus kawachii. Biosci. Biotech. Biochem. 62:1938-1946. 9. Raimbault, M. 1998. General and microbiological aspects of solid state fermentation. Process Biochemistry. Electronic Journal of Biotechnology. 1(3):26-27. 117 Efecto del almacenamiento a diferentes humedades relativas en la permeabilidad al vapor de agua de películas de harinas adicionadas con montmorillonita–Na+ Rodríguez–Marín M. La., Castro–Rosas,J.b, Gómez–Aldapa C. A. b, Falfán Cortés R. N.a aPrograma de Cátedras Conacyt en: Licenciatura de Química en Alimentos/Cuerpo Académico de Química en Alimentos, Instituto de Ciencias Básicas e Ingenieria, Universidad Autónoma del Estado de Hidalgo (uaeh), Ciudad del Conocimiento, Carretera Pachuca–Tulancingo km. 4.5. 42183, Mineral de la Reforma, Hidalgo, México. Tel. 771 7172000 ext 2516, e–mail: [email protected] Resumen Las películas fueron elaboradas mediante gelatinización térmica, usando harina de plátano y de arroz, glicerol como plastificante y se les adicionó monotmorillonita de sodio como material de reforzamiento. Las películas se vaciaron en cajas de petri, y se secaron a 35 °C durante 24 h. Una vez obtenidas, se les determinó la isoterma de sorción de humedad, y para la permeabilidad al vapor de agua, se almacenaron por 7 días a 40, 75 y 90% de humedad relativa. Las isotermas de sorción mostraron que la presencia de MMT Na+ incrementa la absorción de humedad de las películas de harina de arroz en condiciones de altas humedades relativas (HR >90%). Después del almacenamiento (HR = 40, 75 y 90%) y al evaluar la permeabilidad al vapor de agua; se encontró que la permeabilidad disminuye en función del incremento de la humedad relativa, y este efecto se ve disminuido en presencia de montmorillonita de sodio. Además, las películas elaboradas con harina de arroz mostraron un decremento en la permeabilidad al vapor de agua en comparación con las películas de harina de plátano. Palabras clave: Humedad, Montmorillonita, Permeabilidad al vapor de agua. 118 Introducción Los empaques a base de polímeros sintéticos han contribuido a la contaminación ambiental, debido a su uso intensivo y que sus residuos son resistentes al ataque microbiano y/o degradación ambiental, y por ello se han desarrollado empaques biodegradables [1]. Se utilizan polisacáridos, proteínas y lípidos, así como la mezcla de estas macromoléculas para la elaboración de películas biodegradables. Las películas hechas a base de almidón presentan ciertas desventajas, son frágiles y quebradizas, y no cumplen con las características que se requiere en la industria de los alimentos [2]. La adición de plastificantes dentro de la formulación de las películas de almidón, evita la fragilidad de estas, ya que les proveen flexibilidad y extensibilidad, debido a que reducen las fuerzas intermoleculares e incrementan la movilidad de las cadenas de almidón [3–4]. Por otro lado, las harinas son una mezcla natural de macromoléculas y representan una alternativa para obtener este tipo de materiales. Actualmente, la tendencia para mejorar las características de las películas biodegradables es adicionar nanopartículas, las cuales permiten mejorar sus propiedades mecánicas y de barrera [5]. La montmorillonita de sodio (MMT Na+) es una de las nanopartículas más usada para el mejoramiento de las propiedades de los materiales de empaques. Sus capas de silicatos, tienen un papel importante en las propiedades de barrera de películas de almidón, ya que inhiben la difusión de moléculas permeantes (vapor de agua y oxígeno) [6]. Es importante conocer si factores ambientales, como la humedad relativa afectan la permeabilidad de las películas. Mediante isotermas de sorción es posible analizar el efecto de la humedad relativa del ambiente sobre la higroscopicidad de las películas, así como la permeabilidad al vapor de agua [2]. En este estudio se evaluó el efecto del almacenamiento a diferentes humedades relativas en la permeabilidad al vapor de agua de las películas de harina de arroz y de harina de plátano. 119 Materiales y métodos Materia prima Granos de arroz var. “Morelos A–98”, frutos de plátano macho en madurez fisiológica (madurez de cosecha, el fruto presentaba color verde opaco y costillas pronunciadas), MMT Na+ comercial (Sigma Aldrich # 68259) como material de reforzamiento y glicerol (Fermont 56–81–5) como plastificante se usaron para la elaboración de las películas nanocompuestas. Se utilizó bromuro de sodio (NaBr, Fermont 15902) para acondicionar las películas y cloruro de sodio (NaCl, Fermont 7647–14–5) para la determinación de permeabilidad al vapor de agua. Para isotermas de sorción se usaron soluciones saturadas de: acetato de potasio (CH3 COOK, Fermont 127–08–2), cloruro de potasio (KCl, Fermont 7447–40–7), carbonato de potasio (K2CO3, 584–08–7), Cloruro de estroncio (SrCl2 6H2O, 10025–70–4), cloruro de sodio (NaCl, 7647–14–5) y cloruro de bario (BaCl, 1032– 27–9). Elaboración de la harina de arroz Los granos de arroz enteros se molieron en un molino Ika–Werke, la harina obtenida se pasó por un tamiz conteniendo una malla número 100 (150 mm de abertura), posteriormente se almacenó en un recipiente hermético hasta su análisis. Elaboración de la harina de plátano Los frutos de plátano macho en estado de madurez fisiológica se pelaron y se cortaron en rodajas de aproximadamente un centímetro de espesor. Inmediatamente se vertieron en ácido cítrico (3 g /L), para evitar la oxidación del fruto; posteriormente se colocaron en bandejas y se sometieron a un proceso de secado a 50 ± 1 ºC durante 24 h. Finalmente, una vez secos las rodajas de los frutos se molieron en un molino Cyclotec (1093 Sample Mill), la harina se pasó a través de un tamiz numero 40 (0.038 mm). Se almacenó en un recipiente hermético. 120 Elaboración de películas nanocompuestas a través del método vaciado en placa (casting) Se elaboraron las películas a través de gelatinización térmica o casting, mediante el método propuesto en [2] con modificaciones. Se mezclaron directamente 2 g de harina y con 0.4 g de glicerol (equivalente al 20% del peso de la harina) con 60 mL de agua destilada. Por separado una dispersión de MMT Na+ 0.3 g (equivalente al 15% del peso de la harina) en 40 mL de agua destilada se agitó durante 30 min, después esta dispersión se colocó en un baño sonicador durante 30 min. Posteriormente, se adicionó la dispersión de MMT Na+ a la solución filmogénica. La solución se calentó en una parrilla a 70 °C por 10 min, después se incrementó hasta 85 °C durante 20 min, para finalmente enfriar a temperatura ambiente, manteniéndose en agitación constante (125 rpm) durante 1 h. Las suspensiones gelatinizadas se vaciaron inmediatamente sobre cajas de Petri estériles de poliestireno. Las suspensiones se secaron a 35 °C en una estufa durante 24 h, transcurrido este tiempo, se desprendieron las películas de las cajas de Petri. Estas se almacenaron a 25 ± 2 °C y a una humedad relativa de 57%, provista de una solución saturada de bromuro de sodio (NaBr). Isotermas de sorción Las isotermas de sorción de humedad de las películas fueron medidas a 25 °C, usando soluciones salinas saturadas para obtener diferentes humedades relativas (22, 33, 42, 52, 70, 75, 84 y 90%). Siguiendo la metodología descrita en [7]. Permeabilidad al vapor de agua (PVA) La permeabilidad al vapor de agua de las películas (PVA) se determinó empleando el método gravimétrico estándar de la ASTM [8] conocido como el “método de la copa” o “celda de prueba”. 121 Resultados y discusión Evaluación de las Isotermas de sorción La adsorción de humedad es un índice importante de la sensibilidad de las películas a la humedad del ambiente. Las curvas de sorción de humedad de las películas de harina de plátano y de harina de arroz adicionadas con MMT Na+ se muestran en la fig. 1 puede notarse que la forma de la isoterma es de tipo II (sigmoidal), esta forma corresponde a la clasificación del tipo de isotermas de UIPAC y Brunauer. Las películas muestran un comportamiento similar a un valor de Aw > 0.52 [9]. Estas isotermas tipo II presentan una pendiente leve a baja Aw, formando un punto de inflexión y un incremento exponencial a alta Aw, tal como se observa en la fig.1, este comportamiento es típico en polímeros hidrofílicos sensibles al vapor de agua como lo son las películas de almidón, gluten y celulosa. Al incrementar los valores de Aw (Aw > 0.62) la presencia de MMT Na+ incrementa la absorción de humedad de las películas de harina de arroz, en estas películas existe menos interacción entre la MMT Na+ y los componentes de la harina en comparación con la harina de plátano, por lo tanto, pueden existir sitios disponibles (OH) para la absorción de humedad a altos valores de Aw. De acuerdo en [10] la presencia de MMT Na+, no tiene un efecto significativo en las disminución de absorción de humedad, lo cual se atribuye a la presencia del catión Na+ y su gran habilidad de absorción de moléculas de agua en el espacio intercapa. Se calculó la absorción en la monocapa y se obtuvieron los siguiente valores, HPControl= 0.0128, HPMMT Na+ =0.0126; HAControl =0.0134, HAMMT Na+ = 0.0141. El valor de la monocapa tuvo un decremento cuando se adicionó MMT Na+ en las películas HPMM Na+, indicando que la MMT Na+ puede disminuir la absorción de humedad en la superficie de la película, 122 Fig. 9A. Curvas de isotermas de sorcion de humedad de las películas de harinas de arroz (HA) y de harina de plátano (HP) adicionadas con MMT Na+. Sin embargo, en las películas de harina de arroz el valor de la monocapa incrementa, lo cual puede estar relacionado con la dispersión de la MMT Na+ en la matriz de esta película, y a la existencia de sitios disponibles para enlazar moléculas de agua, el carácter hidrofílico en esta película (HAMMT Na+) aumenta (0.82 de Aw), esto puede ser atribuido a las interacciones entre la MMT Na+ y los componentes no amiláceos de la harina de arroz (proteínas), lo cual provoca una estructura laminada abierta con sitios disponibles para las moléculas de vapor de agua[11]. Efecto de la humedad relativa en la permeabilidad al vapor de agua (PVA) de películas de harina de arroz y de harina de plátano Los valores de permeabilidad de las películas de harina de arroz y harina de plátano adicionadas con montmorillonita de sodio a diferentes humedades relativas (40, 75 y 90%) se muestran en la 123 fig. 2, las películas adicionadas con MMT Na+ presentan un decremento de PVA en comparación con la película control. El almidón puede formar enlaces puente de hidrógeno con los grupos hidroxilos de la MMT Na+ y esta estructura reduce la difusión de las moléculas de vapor de agua a través del material. Un comportamiento similar ya ha sido reportado por diversos autores [12–14], Fig. 9B. Permeabilidad al vapor de agua de las películas nanocompuestas de harina de arroz (HA) y harina de plátano (HP) adicionadas con MMT Na+ y acondicionadas a 40%, 75% y 90% de humedad relativa (HR). §Barras de error estándar con letras iguales (para cada muestra) no son estadísticamente significativas (p>0.05). De acuerdo con la teoría de Nielsen una ruta tortuosa alrededor de las partículas de montmorillonita de sodio hace que las moléculas permeantes sigan un camino de difusión más largo a través de las películas [15]. El modelo de Nielsen supone que cada capa de la arcilla es orientada perpendicularmente a la ruta de la molécula permeante, entonces la reducción de la permeabilidad inicia a partir de la gran ruta de difusión que las moléculas deben seguir debido a la presencia de las capas de silicato de la montmorillonita de sodio [10]. 124 Por otro lado el almacenamiento a humedades relativas de 40 y 75% no tuvo un efecto significativo en la disminución de la pva. Sin embargo a 90% se observa un decremento de la pva en las películas de harina de arroz. Este comportamiento es consistente con lo observado en las isotermas de sorción (fig. 1.) en donde a humedades relativas por encima de 75% hay un incremento en el contenido de agua. Por otro lado, las películas de harina de plátano mostraron un aumento de la pva a 90% de humedad relativa, este comportamiento puede atribuirse a la fibra presente en la harina, que interactúa con la MMT Na+ formando una estructura amorfa con espacios intermoleculares que permite el paso fácil de las moléculas de agua, una estructura abierta representa una gran difusión de moléculas permeantes [16]. El almacenamiento a humedades relativas constantes permite que la película gane un contenido de agua, esto corresponde a los sitios saturados enlazantes, que predominantemente son de las moléculas del almidón, como consecuencia de la saturación de esos sitios corresponde a la combinación de los enlaces puente de hidrógeno del almidón con agua y por otra parte, tanto agua y glicerol unidos al almidón o bien, almidón/MMT Na+/glicerol. En trabajos previos, se ha hipotetizado que el glicerol compite con el agua por los sitios activos en la película, promoviendo la agrupación de agua y el aumento del volumen libre en los polímeros constituyentes de la películas a bajas humedades relativas, y se comprobó que el glicerol tiene efecto significativo en la difusión de vapor de agua en las películas, por lo que, los cambios en el volumen libre aumentan los valores de permeabilidad [17]. Conclusiones A humedades relativas altas (90%) la permeabilidad al vapor de agua de las películas nanocompuestas de harina de arroz y harina de plátano disminuye. El carácter higroscópico de las películas nanocompuestas tanto de harina de arroz como de harina de plátano aumenta a humedades relativas mayores al 75%. 125 Referencias 1. Freile-Pelegrin, Y.; Madera-Santana, T.; Robledo, D. 2007. Degradation of agar films in a humid tropical climate: Thermal, mechanical, morphological and structural changes. Polymer Degradation and Stability. 92:244-252. 2. Wilhelm, H.M.; Sierakowski, M.R.; Souza, G.P.; Wypych, F. 2003. Starch films reinforced with mineral clay. Carbohydrate Polymers. 52:101-110. 3. Mali, S.; Grossmann, M.V.E.; Garcia, M.A.; Martino, M.N.; Zaritzky, N. 2002. Microstructural characterization of yam starch films. Carbohydrate Polymers. 50:379-386. 4. Romero-Bastida, C. A.; Zamudio-Flores, P.B.; Bello-Pérez, L. A. 2011. Antimicrobianos en películas de almidón oxidado de plátano: efecto sobre la actividad antibacteriana, microestructura, propiedades mecánicas y de barrera. Revista Mexicana de Ingeniería Química. 10: 445-453. 5. Tapia-Blacido, D.R; Amaral-Sobral, P.J.; Menegalli, F.C. 2011. Optimization of amaranth flour films plasticized with glycerol and sorbitol by multi-response analysis. LWT-Food Science and Technology. 44: 1731-1738. 6. Adame, D.; Bell, G.W. 2009. Direct measurement of the constrained polymer region in polyamide/clay nanocomposites and the implications for gas diffusion. Applied Clay Science. 42: 545-552. 7. Slavustky, A.M.; Bertuzzi, M.A. 2012. A phenomenological and thermodynamic study of the water permeation process in corn starch /MMT films. Carbohydrate Polymers. 90: 551-557. 8. ASTM E-96-80. 1980. Standard methods of test for water vapor transmission of materials in sheet form. 9. Perdomo, J; Cova, A; Sandoval, A, J; García, L; Laredo, E; Müller, A, J. 2009. Glass transition temperatures and water sorption isotherms of cassava starch. Carbohydrate Polymers. 76: 305-313. 10. Zeppa, C.; Gouanvé-Espuche, E. 2009. Effect of a plasticizer on the structure of biodegradable starch/clay nanocomposites: thermal, water-sorption and oxygen-barrier properties. 126 Journal of Applied Polymer Science. 112: 2044-2056. 11. Gorrasi, G.; Tortora, M.; Vittoria, V.; Pollet, E.; Lepoittevin, B.; Alexandre, M.; Dobbois, P. 2003. Vapor barrier properties of polycaprolactone montmorillonite nanocomposites: effect of clay dispersion. Polymer. 44: 2271-2279. 12. Huang, M-F.; Yu, J-G.; Ma, X-F. 2004. Studies of the properties of Montmorillonite reinforced thermoplastic starch composites. Polymer. 45: 7017-7023. 13. Huang, M.; Yu, J.; Ma, X. 2006. High mechanical performance MMT-urea and formamide-plasticized thermoplastic cornstarch biodegradable nanocomposites. 63: 393-399. 14. Cyras, V.; Manfrendi, L.; Ton-That, M.; Vázquez, A. 2008. Physical and mechanical properties of thermoplastic starch/ montmorillonita nanocomposites films. 73: 55-63. 15. Azeredo, H.M.C. 2009. Nanocomposites for food packaging applications. Food Research International. 42: 1240-1253. 16. Díaz, A.B.; Müller, C.M.O.; Larotonda, F.D.S.; Laurindo, J.B. 2010. Mechanical and barrier properties of composites films based on rice flour and cellulose fibers. LTW Food Science and Technology. 44: 535-542. 17. Godbillot, L.; Dole, P.; Joly, C.; Rogé, B.; Mathlouthi, M. 2006. Analysis of water binding in starch plasticized films. Food Chemistry. 96:380-386. 127 Utilización del Almidón de amaranto (Amaranthus hipochondriacus) en la tecnología de secado por aspersión Falfán–Cortés, RN*., Martínez–Bustos, F**., Gaytán–Martínez, M***., Gómez–Aldapa CA* Licenciatura en Química en Alimentos, Cuerpo Académico de Química en Alimentos, icbi, Universidad Autónoma del Estado de Hidalgo. Ciudad del Conocimiento, carretera Pachuca – Tulancingo, km 4.5, Col. Carboneras, Mineral de la Reforma, Hidalgo, México. CP 42184. Tel, 7717172000 ext. 2518, e–mail: Resumen Recientemente, almidones con propiedades y funcionalidades diferentes han atraído el interés de distintos grupos de investigadores y de la industria, para diversas aplicaciones. El objetivo de este trabajo fue extraer almidón de amaranto nativo y dar una aplicación a dicho polímero modificado en la tecnología alimentaria, utilizándolo como material de pared para evaluarlo como encapsulante de bacterias probióticas. A partir de la extracción húmeda–alcalina, se obtuvo un almidón nativo con un contenido de humedad de 10.1%, un porcentaje de proteína alto (3.2%), un extracto etéreo de 1.7% y 0.8% de cenizas. Dentro de la caracterización química se obtuvo un porcentaje de amilosa de 12.37%, característica peculiar del almidón de amaranto, así como un tamaño de gránulo de aproximadamente 1–3 µ. De acuerdo al perfil de viscosidad del almidón nativo, se obtuvieron los siguientes parámetros: viscosidad máxima de 1771 cP, viscosidad mínima de 1135 cP, viscosidad final (1203.50 cP) y finalmente una viscosidad de retrogradación de 68.50 cP. Las propiedades térmicas del almidón extraído fueron: temperatura de inicio (64.20ºC), temperatura de pico (69.41ºC) y temperatura final de gelatinización (75.26ºC); y una entalpía de gelatinización (ΔH) de 10.49 (J/g). El almidón nativo fue modificado químicamente y por extrusión, los almidones obtenidos (fosfatado, acetilado y succinatado) fueron evaluados como material de 128 pared en el proceso de secado por aspersión, evaluándose como control un almidón comercial, se determinó la sobrevivencia de bacterias probióticas Bifidobacterium breve ATCC 15700 y Lactobacillus casei ATCC 334 después del secado por aspersión, obteniendo excelentes resultados para todos los almidones modificados de amaranto, al igual que el almidón comercial. Las microcápsulas presentaron una actividad de agua entre 0.36 a 0.45, con humedades de 3.8 a 6.2%, resultado de las condiciones de secado, con una forma definida y cavidades típicas sobre la superficie, con un tamaño menor a 50µ. Palabras clave: Almidón, amaranto, encapsulación, probióticos. Introducción Recientemente almidones con propiedades y funcionalidades diferentes han atraído el interés de distintos grupos de investigación y de la industria para diversas aplicaciones. El amaranto es considerada un pseudocereal, la planta crece en condiciones de baja disponibilidad de agua, suelos pobres, altitudes elevadas, y ante la presencia de infinidad de plagas; es decir, es tolerante a condiciones ambientales adversas, bajo las cuales, los cereales tienen pocas opciones, por lo que el amaranto tiene un gran potencial económico [1]. La familia Amaranthaceae comprende más de 60 géneros y 800 especies de plantas herbáceas, anuales y perennes. El género Amaranthus (significa inmortal en griego) tiene tres especies que producen grandes vainas repletas de granos, A. hypochondriacus y A. cruentus, cultivadas en Mesoamérica, y A. caudatus en Perú; diversos materiales genéticos derivados de estas especies son originarios de Mesoamérica y de aquí migraron a otras regiones del mundo [1,2]. Los granos de amaranto contienen aproximadamente 4% de cenizas, 3.1–11.5 de lípidos, 15–22% de proteína, 9–16% de fibra dietaría, y 58– 66% de almidón. Las gluteninas, representan la mayor fracción proteica en el grano de amaranto en un rango de 42–46%, del total de proteína, las cuales son solubles en solución alcalina [3]. Actualmente, el amaranto es considerado un cultivo alternativo 129 e investigadores en muchas partes del mundo se han centrado en la mejora de las características agronómicas de la planta, la calidad nutricional y la tecnología de procesamiento de los granos. El componente más abundante de las granos de amaranto es el almidón, el cual se encuentra localizado en el perispermo, este contenido es reportado en un rango de 48% a 69% (base seca) dependiendo de las especies, y esta reportado que contiene de 92% a 95% de amilopectina [4]. Diferentes investigadores han reportado métodos de extracción para el almidón de amaranto a escala laboratorio, ya que debido al tamaño de su gránulo es un proceso difícil. Los métodos más utilizados son a través de la molienda húmeda–alcalina; sin embargo, altas concentraciones de álcali provocan daños en la calidad del almidón e incrementan costos [3]. El almidón nativo es un buen estabilizador de textura y regulador en sistemas alimentarios, aunque, limitaciones como la baja resistencia al corte, resistencia térmica, descomposición térmica y alta tendencia a la retrogradación, insolubilidad en agua y alta viscosidad, limitan su uso en algunas aplicaciones industriales en alimentos. Sin embargo, estas deficiencias del almidón se han podido superar, por ejemplo, mediante la introducción de pequeñas cantidades de grupos iónicos o hidrofóbicos en las moléculas del polímero. Las modificaciones del almidón alteran las propiedades del polímero, incluyendo viscosidad de la solución, el comportamiento de asociación, y la estabilidad de conservación en la vida de productos finales. Otro propósito de la modificación del almidón es estabilizar los gránulos durante el procesamiento y hace al almidón adecuado para muchos alimentos y aplicaciones industriales [5]. Ésteres de almidón son un grupo de almidones modificados, en los que algunos grupos hidroxilo han sido reemplazados por grupos éster. Los reactivos aprobados por la fda para la preparación de monoésteres de almidón son el anhídrido acético, acetato de vinilo, anhídrido succínico, anhídrido 1–octenil succínico y tripolifosfato de sodio. Los tres tipos de ésteres de almidón más estudiados son: a) almidón acetilado, se prepara principalmente haciendo reaccionar al almidón con anhídrido acético, b) almidón succinatado y 130 alquenilsuccinato, que se producen por la reacción del almidón con anhídrido succínico y anhídrido succínico sustituido con grupos alquenil y c) almidón fosfatado resultante de la reacción del almidón con tripolifosfato y/o trimetafosfato de sodio [6]. Por otro lado, los probióticos son definidos como microorganismos vivos, que cuando son administrados en cantidades adecuadas confieren beneficios a la salud de los consumidores [7]. Estos microorganismos son típicamente miembros del género Bifidobacterium y Lactobacillus, especies comúnmente asociados con el tracto gastrointestinal humano [8]. Para que un microorganismo se considere un probiótico, este debe ser de origen humano, no patógeno, resistente al procedimiento, estable en secreciones ácidas y biliares, adherirse a la pared epitelial, tener la capacidad de persistir en el tracto gastrointestinal y tener influencia en la actividad metabólica local del organismo [9]. El uso de bacterias probióticas como complemento en la dieta, puede proveer varios beneficios en el sistema digestivo. El más frecuente mencionado, es que nos ayuda a controlar los microorganismos patógenos en el tracto gastrointestinal [10], así como ayudar con problemas relacionados con la intolerancia a la lactosa, gastroenteritis aguda, alergia a algún alimento, dermatitis atópica, enfermedad de Crohn, artritis reumatoide y cáncer de colon, entre otros [11]. Sin embargo, para que las bacterias probióticas proporcionen efectos benéficos al huésped, estas deben ser estables y metabólicamente activas en el producto, en el cual han sido incorporadas, además de sobrevivir al paso por la parte superior del aparato digestivo y presentar resistencia a enzimas hidrolíticas y altas concentraciones de sales biliares en el intestino [12]. Por tal razón se ha recurrido a la microencapsulación de probióticos utilizando diferentes materiales de pared y métodos de encapsulación, en los que destaca el secado por aspersión, debido a su bajo costo y alta cantidad de producción de material (polvo seco). Por todo lo anterior, el objetivo de este trabajo fue obtener almidón de amaranto (fuente no convencional) mediante la extracción húmeda–alcalina, modificar el almidón mediante esterificación y finalmente obtener microcápsulas con probióticos con 131 una concentración adecuada que pueda ser útil como aditivo en la industria alimentaria mediante secado por aspersión. Materiales y métodos Granos de amaranto (Amaranthus hipochondriacus), variedad nutrisol, fueron donados por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP México). En este estudio fueron utilizadas las cepas de Bifidobacterium breve ATCC 15700 y Lactobacillus casei ATCC 334, como microorganismos probióticos, obtenidos de la colección de cepas “American Type Culture Collection” (ATCC*, Manassas, VA). Fue utilizado como control, el almidón de maíz ceroso, hidrolizado enzimáticamente y modificado, N–lok, obtenido de National Starch and Chemical de México, S.A. de C.V. Extracción del almidón de amaranto La extracción del almidón de amaranto se realizó a través de una molienda húmeda–alcalina con algunas modificaciones [3,13]. 1 Kg de grano de amaranto se colocó en un recipiente y se agregaron 1.5 L de hidróxido de sodio (NaOH) 0.1 N, de manera que el grano quedó totalmente cubierto por la solución, se dejó 24 h en reposo con agitación repentina. Se utilizó una solución de NaOH 0.1N para solubilizar las glutelinas encontradas en el grano de amaranto. Se lavó el grano con agua hasta retirar totalmente los residuos de NaOH, posteriormente, se realizó una molienda húmeda con hielo en un molino de piedras (Fumasa), la suspensión de amaranto molido fue tamizada, con la finalidad de obtener el almidón, a través de una serie de mallas con abertura de 841 µm, 595 µm, 420 µm, 250 µm, 177 µm, 149 µm, 74 µm y 62.5 µm, mientras se enjuagaba el residuo que quedó en la malla con una solución fría de bisulfito de sodio (NaHSO3) 0.1 N. Se centrifugó la suspensión a 2500 rpm por 10 min en un equipo hirme Labortechnik, Germany modelo Z513K, el precipitado fue extendido en recipientes de aluminio y secado en un horno Felisa a 40 °C, posteriormente se molió en un equipo Mini Pulvex modelo 100 y finalmente se tamizó usando una malla con abertura de 250 µm. 132 Caracterización química y morfológica del almidón de amaranto El contenido de humedad se determinó de acuerdo al método 934.0, para el contenido de proteína se utilizó el método 32.1.22 con algunas modificaciones en un equipo micro Kjeldhal Gerhardt (el factor de conversión utilizado para el amaranto fue 5.85), la determinación del extracto etéreo se realizó de acuerdo al método 30.10, cenizas se determinó por el método 942.05 [14]. Se obtuvo el contenido de amilosa [15]. La caracterización morfológica de los gránulos se llevó a cabo por microscopía electrónica de barrido [16]. Perfiles de viscosidad Se obtuvo el perfil de viscosidad en un equipo 3C Rapid Visco Analyzer (Newport Scientific pty ltd, Sydney Australia). Se colocaron 2.5 g (base seca) de muestra cribada por una malla de 250 µm, adicionando la cantidad de agua destilada necesaria para alcanzar un peso total de 28 g de suspensión en un recipiente de aluminio. La muestra se colocó en el viscosímetro, el cual produce una agitación rápida durante 10 s, para luego estabilizarse a velocidad constante de 75 rpm. La temperatura inicial de 50 °C fue mantenida durante un minuto y posteriormente elevada a 92 °C a una velocidad de calentamiento de 5.6 °C/min. Una vez alcanzada esta temperatura, se mantuvo constante durante 5 min; el enfriamiento se llevó a cabo a la misma velocidad, hasta alcanzar 50 °C. La temperatura final se mantuvo constante durante 2 min y el tiempo total de la prueba fue de 23 min, manteniendo una agitación constante durante todo el análisis. Propiedades térmicas Para llevar a cabo los análisis térmicos se usó un calorímetro diferencial de barrido (DSC Mettler Toledo modelo 821). 3 mg de muestra molida y cribada con malla 60 (250 µm) y 7 mg de agua destilada fueron colocados en un crisol de aluminio de 40 µL, que fue sellado con una prensa Mettler Toledo. El crisol se colocó en el equipo; la muestra fue sometida a calentamiento desde 30 133 hasta 100 °C, a una velocidad de calentamiento de 10 °C/min. Del termograma obtenido se determinaron los siguientes parámetros: temperatura de inicio (To), temperatura final (Tc), temperatura de pico (Tp), así como la entalpía de gelatinización (ΔH). Esterificación del almidón nativo Previa hidrolisis, almidones hidrolizados fueron esterificados [17]. La fosfatación de almidón se realizó en un extrusor de tornillo simple (cinvestav–ipn). Las temperaturas del barril fueron 50, 130 y 170 ºC en las zonas de alimentación, de transición y de alta presión, respectivamente, con una velocidad de tornillo de 80 rpm y de alimentación de 35 rpm, relación de compresión del tornillo de 2:1 y un dado con un diámetro de salida de 4.0 mm. Se emplearon 4 g de tripolifosfato de sodio/100 g de almidón acondicionado a 25% de humedad, pH de 4.5–5.0 y almacenadas en bolsas de polipropileno a 4 ºC. Posteriormente, las muestras fueron extrudidas y molidas a 250 μm. Para la acetilación se dispersaron 100 g de almidón hidrolizado por ácido en 230 mL de agua destilada, se ajustó el pH a 8.0 con solución acuosa de NaOH al 3% y se adicionaron por goteo 2.5 g de anhídrido acético/100 g de almidón en agitación constante. La suspensión de almidón se mantuvo en agitación por 10 min adicionales después de la adición del reactivo y posteriormente fue centrifugada a 6000 rpm durante 10 min. La pasta del almidón succinatado fue secada en un horno Felisa a una temperatura de 40 ºC por 24 h, luego molido en un equipo (Mini Pulvex modelo 100) y cribado en una malla de 250 µm [18]. Una vez llevada a cabo la modificación química, las muestras fueron acondicionadas a 25% de humedad y extrudidas en las mismas condiciones de extrusión descritas para la fosfatación de almidón. Finalmente se realizó la succinatación, se preparó una suspensión en agua al 30–35% de sólidos del almidón (base seca), se mantuvo en agitación constante y se le adicionó por goteo, anhídrido n–octenil succínico en una proporción de 2 mL/100 g de almidón en base seca, durante 2 h y se ajustó continuamente a un pH de 8.0–8.5 con una solución de NaOH al 3%. Se mantuvieron las mismas condiciones 134 durante un tiempo total de 6 h. Posteriormente se ajustó el pH a 5.0 y la suspensión fue centrifugada a 6000 rpm, durante 10 min en una centrifuga Heme Labortechnik, Germany modelo Z513K. Se llevaron a cabo 2 lavados del sedimento con agua destilada para eliminar residuos del reactivo. La pasta del almidón succinatado fue secada en un horno Felisa a una temperatura de 40 ºC por 24 h, luego molido (Mini Pulvex modelo 100) y cribado en una malla de 250 µm [17]. Microencapsulación de Bifidobacterium breve ATCC 15700 y Lactobacillus casei ATCC 334 Las células de ambas bacterias fueron obtenidas separadamente después de la activación por doble transferencia en caldo Lactobacilli MRS, sobre condiciones de anaerobiosis a 37 °C por 48 h. El paquete celular obtenido fue resuspendido en 10 mL de una solución al 12% de leche reconstituida, la suspensión celular (con ~109 UFC g–1) fue mezclada con una solución de almidón modificado (acetilado, succinatado o fosfatado) y almidón control, se usaron 20 g (base seca/100 mL de agua destilada estéril) y homogenizadas previo al secado por aspersión. Las microcápsulas fueron preparadas por el proceso de secado por aspersión en un secador SD–Basic de LabPlant (Huddersfield, UK). El conteo bacteriano en las microcápsulas se realizó utilizando el método de vaciado en placa [19]. Sobrevivencia después del proceso del secado por aspersión El recuento bacteriano después del secado por aspersión se realizó por triplicado por el método de vaciado en placa. Se tomaron 1 g de microcápsulas y se colocaron en 9.0 mL de diluyente citrato de sodio al 2%, posteriormente con la ayuda de un equipo vortex se rompieron las microcápsulas. Se tomó 1 mL de la solución y se colocó en 9 mL de solución diluyente de peptona; se realizaron 8 diluciones más de la muestra. Posteriormente se tomó una alícuota de 1 mL de las 1° a 8° diluciones y se colocaron en cajas Petri para luego agregarles agar MRS y homogeneizarlas. A conti135 nuación, las cajas fueron incubadas (incubadora Thermo Forma) a 37 °C durante 36 h y se realizó el recuento de colonias (contador de colonias Felisa). La viabilidad de las bacterias fue determinada en la suspensión de almidón por el método de vaciado en placa (con ~109 UFC g–1) antes del proceso de secado por aspersión, obteniendo las UFC, inmediatamente después del proceso se realizó el conteo bacteriano en el polvo recolectado [19]. Caracterización de las microcápsulas después del secado por aspersión El contenido de humedad de las microcápsulas fue determinado por diferencia de peso en las muestras antes y después del secado en estufa a 100 ºC en presencia de sílica gel durante 24 h (o peso constante) y para la determinación de la actividad de agua de las microcápsulas se empleó un equipo Aqua Lab CX– 2 (USA), las muestras fueron colocadas en contenedores propios del equipo y la medición se realizó a 25 °C. Se observaron las microcápsulas mediante microscopia electrónica de barrido bajo el mismo procedimiento y condiciones en que fue observado el almidón nativo. Resultados y discusión Caracterización química y morfológica del almidón de amaranto nativo El almidón nativo de amaranto presentó un valor de humedad de 10.1%, este valor es similar a lo reportado por otros autores [20, 21]. Para el almidón nativo de amaranto se obtuvo 3.2% de proteína (base seca), valor relativamente alto comparado con la extracción realizada con tratamientos enzimáticos y moliendas húmedas durante la extracción del polímero. Investigadores reportaron que el contenido de proteína del almidón de Amaranthus mantegazzianus fue de 1.47%, lo cual fue un resultado menor que lo encontrado en el presente trabajo, esta diferencia puede atribuirse al método de extracción con el que se aisló el almidón [22]. Otros autores reportaron valores entre 0.10% a 0.22% de proteína, sin embargo, durante el proceso de extracción se utilizaron enzimas proteasas que dieron como resultado 136 un bajo contenido proteico, lo que hace al proceso de un elevado costo [3]. Se obtuvieron valores del extracto etéreo de 1.7% para el almidón nativo de amaranto, estos valores son similares a los reportados por otros autores [23]. Se ha reportado, para el almidón de amaranto, un contenido de grasa de 0.2%, las variaciones en el porcentaje de grasa fueron atribuidos a las diferentes especies de amaranto [24]. Finalmente, dentro de la caracterización de almidón nativo se encontró un contenido de cenizas de 0.8%, este valor es similar a lo reportado por otros autores [23], el grano de amaranto está constituido por una importante cantidad de minerales como fósforo, potasio, magnesio, hierro y calcio, entre otros, los cuales no son separados completamente durante la extracción alcalina del almidón [25]. El contenido de amilosa es un factor importante que afecta ciertas propiedades del almidón, como la capacidad de hinchamiento, la solubilidad y la formación de geles [26], el porcentaje de amilosa para el almidón extraído fue de 12.38%, lo que se traduce en un alto contenido de amilopectina, existe una gran variedad de porcentajes de amilosa reportados en la literatura para el almidón de amaranto, que van desde el 5.79% hasta el 24.2%, lo que puede ser atribuido al método de extracción del almidón, factores ambientales y biológicos [21, 27], es importante destacar que el bajo contenido de amilosa en el almidón de amaranto, es una propiedad muy importante para sus aplicaciones futuras en la industria alimentaria y farmacéuticas, siendo este almidón una alterativa ante otros cultivos, (Posición fig. 10A). El examen microscópico de los gránulos finos de almidón de amaranto mostró uniformidad en la forma hexagonal y de tamaño muy pequeño, el cual varió de 1 a 5 µm (fig. 1). Se observó que el método de extracción no dañó estas características de los gránulos. Los gránulos están íntegros sin grietas, ni daño alguno. En la microfotografía se observa que los gránulos de almidón de amaranto forman aglomerados, este fenómeno es muy común en los gránulos pequeños, lo que se atribuye a los residuos de proteína y lípidos que no son removidos durante la extracción del almidón [28]. 137 Fig. 10A. Microfotografía de los gránulos de almidón nativo de amaranto obtenido por molienda húmeda–alcalina. Perfiles de viscosidad Por lo general, los almidones en estado nativo, presentan una naturaleza hidrofílica, son poco solubles en agua fría y producen pastas de alta viscosidad. Al ser suspendidos en agua y calentados, los gránulos del almidón nativo de amaranto, se obtuvieron los parámetros de viscosidad, obteniéndose valores de viscosidad máxima de 1771 cP, viscosidad mínima de 1135 cP, viscosidad final de 1203.50 cP y finalmente una viscosidad de retrogradación de 68.50 cP. Resultados similares fueron reportados por otros investigadores para el almidón de amaranto nativo [27]. Es importante mencionar que el comportamiento del perfil viscoamilografico del almidón de amaranto muestra un comportamiento normal, similar al de los almidones de cereales y raíces. Ha sido reportado que la viscosidad del almidón de amaranto presenta valores más bajos de viscosidad en comparación con almidones de cereales convencionales, la posible razón a este comportamiento es debido al bajo contenido de amilosa presente en el amaranto y al tamaño de gránulo [20]. Además, las cadenas 138 de corta longitud del almidón de amaranto (amilosa), podrían explicar la baja viscosidad que presenta este almidón, debido a que moléculas más grandes contribuyen más a la viscosidad en una solución o emulsión, desde un punto de vista reológico. Por otro lado, cabe mencionar que propiedades como el bajo valor de retrogradación obtenido a partir del perfil viscoamilografico, le confieren características importantes al almidón de amaranto, como la estabilidad ante el enfriamiento y posiblemente el bajo grado de sinéresis del almidón, por lo que este puede ser de gran potencial para el uso de agentes espesantes, aplicado como aditivo en salsas, sopas frías y productos refrigerados. Ha sido reportado que el almidón de amaranto presenta mayor estabilidad a condiciones de enfriamiento que el almidón ceroso de maíz y el de plátano [24]. Propiedades térmicas A partir del termograma del almidón nativo, se obtuvieron los parámetros térmicos que incluyen: temperatura de inicio (64.20 ºC), de pico (69.41 ºC) y final de gelatinización (75.26 ºC). Con respecto a la temperatura de gelatinización, los resultados fueron similares a los reportados por otros investigadores para el almidón nativo de amaranto [23, 29]. El método de extracción es un factor que puede inducir variaciones en las propiedades térmicas del almidón [3]. Con respecto a la entalpía de gelatinización (ΔH) se obtuvo un valor de 10.49 (J/g). Investigadores reportaron un valor de 2.58 (J/g), valor bajo comparado con el obtenido en este trabajo, de acuerdo al valor obtenido de ΔH, podría indicar una mayor compactación en la estructura molecular interna y un mayor grado de cristalinidad en el mismo, comparado con aquellos de menor ΔH [27]. Las variaciones entre muestras en la estructura cristalina producen diferencias en las temperaturas de gelatinización. Los granos poco compactos presentan generalmente gránulos de almidón de mayores tamaños (>10 μm). Los gránulos con cristalinidad alta muestran altas temperaturas y entalpías de gelatinización [30]. 139 Sobrevivencia después del proceso del secado por aspersión El almidón nativo fue modificado químicamente, se realizó la fosfatación, la acetilación y la succinatación. Estos almidones modificados fueron empleados para la microencapsulación de B. breve ATCC 15700 y L. casei ATCC 334, en la tabla 1 se presentan los resultados obtenidos para la sobrevivencia de B. breve ATCC 15700 y L. casei ATCC 334 durante el proceso de secado por aspersión. Se observó que la microencapsulación por secado por aspersión es un proceso eficiente que puede producir grandes cantidades de material. Sin embargo, esta económica y efectiva tecnología es raramente considerada para la microencapsulación de microorganismos debido a la alta mortalidad, resultado de la deshidratación e inactivación térmica que sufren los microorganismos. El efecto del secado por aspersión sobre la membrana de la célula puede conducir a un incremento en la permeabilidad de la célula, que podría dar como resultado la salida de componentes intracelulares desde el interior de la célula hacia el medio que la rodea. La membrana citoplasmática es la más susceptible al estrés asociado por el secado, la pared celular, el adn y el arn también son afectados, dando como resultado una pérdida en la actividad metabólica [31]. De manera general, se puede observar que los almidones acetilado y fosfatado de amaranto presentaron las menores pérdidas de microorganismos, en comparación con el almidón succinatado y el control (N–lok). Fueron reportadas, para Bifidobacterium lactis, pérdidas de 1 a 3 Log de acuerdo a las condiciones de proceso de secado; mayores pérdidas en la sobrevivencia de las células microencapsuladas se encontraron en función al incremento en la temperatura de entrada y salida del secador, materiales como el acetato ftalato de celulosa fueron evaluados, garantizando la protección de los microorganismos durante el proceso del secado; sin embargo este material es utilizado en la industria farmacéutica como aditivo entérico de costo elevado [32]. En otro estudio, Bifidobacterium longum (BCRC 14605) y Lactobacillus acidophilus (BCRC 14079), fueron microencapsulados, utilizando la tecnología de secado por 140 aspersión, empleándose como materiales de pared una mezcla de maltodextrinas y goma arábiga; los autores reportaron eficiencias del proceso de secado entre el 45.65% y 52.38%, además evaluaron el efecto de la temperatura de entrada para cada microorganismo, donde encontraron un decremento de la sobrevivencia de ambos microorganismos con el incremento de la temperatura de entrada del secador. También reportaron que la concentración final de ambos géneros fue superior a 107 UFC/g después del secado por aspersión, lo cual es un resultado favorable de acuerdo a las recomendaciones como mínimo para efectos terapéuticos, estos resultados son similares a los obtenidos en este trabajo [33]. Para el caso de Lactobacillus casei ATCC 334, la sobrevivencia después del secado fue mayor a 108 UFC/g, resultado favorable de acuerdo a lo recomendado con el fin de producir beneficios terapéuticos. Para Lactobacillus casei ATCC 334, se observó que el mejor material que protegió estas células durante el proceso de secado por aspersión fue el almidón de amaranto fosfatado, seguido del succinatado de amaranto y N–lok. Comparando la sobrevivencia entre cada género, se observó que se presenta una mayor sensibilidad a las condiciones de secado por el género Lactobacillus, esto concuerda con lo reportado por otros investigadores [32]. Para Lactobacillus rhamnosus GG (LGG), el cual fue microencapsulado por secado por aspersión y liofilización, se presentaron pérdidas menores a 2 Log UFC/g, sin embargo, los mejores resultados fueron para los microorganismos que fueron encapsulados por secado por aspersión con respecto a los liofilizados, los autores reportaron que las posibles diferencias con lo reportado en la literatura, con respecto al mejor método, es posiblemente resultado de las condiciones de liofilización [34]. En general, todos los almidones modificados de amaranto presentaron buena protección sobre las condiciones del secado por aspersión, incluso comparándolo con el almidón comercial N–lok, el cual es un almidón de costo elevado, por lo anterior, los almidones obtenidos en el laboratorio y de una fuente no convencional, están ofreciendo ventajas sobre su aplicación como material de pared durante el secado de los microorganismos, 141 Tabla 10B. Sobrevivencia de microorganismos B. breve ATCC 15700 y L. casei ATCC 334 durante el proceso de secado por aspersión encapsulados con diferentes almidones modificados de amaranto. Caracterización de las microcápsulas después del secado por aspersión Se obtuvieron microcápsulas (polvos obtenidos después del proceso de secado) para el género Bifidobacterium, las cuales mostraron una actividad de agua en un rango de 0.31 a 0.36, y humedades entre 3.8% a 6.2%, estos valores son similares a los reportados por otros investigadores para polvos, obtenidos después del secado por aspersión, quienes reportaron que estos parámetros disminuyen con el incremento de la temperatura de secado [32]. Para el género Lactobacillus se obtuvieron actividades de agua entre 0.32 y 0.45 y contenidos de humedad en un rango de 4.5% a 5.8%. Similares resultados a los encontrados para el género Bifidobacterium, considerando que fueron las mismas condiciones de secado para todos los materiales analizados. En general, los microorganismos presentan una mayor sobrevivencia a bajas actividades de agua, sin embargo, después del estrés provocado por el secado, podría disminuir la sobrevivencia. El bajo contenido de agua inducido por el secado por aspersión, proporciona una reducción significante en la difusividad y por lo tanto en el transporte de oxígeno al interior de las células (Bifidobacterium bifidum), lo que da como resultado un incremento en la sobrevivencia de los microorganismos [33]. El bajo contenido de humedad y actividad de agua encontrados en las microcápsulas podría favorecer la sobrevivencia de los 142 microorganismos encapsulados. Por otro lado, las microcápsulas de Bifidobacterium breve ATCC 15700 (dato no mostrado) y Lactobacillus casei ATCC 334 (fig. 2) fueron similares en morfología y tamaño. Presentaron una cobertura uniforme de las células y no se observó evidencia de la presencia de células en el exterior de las microcápsulas. La forma de las microcápsulas, en todos los materiales de pared, fue característica de microcápsulas producidas por secado por aspersión con identaciones en la superficie, como resultado de la evaporación rápida del agua. A temperaturas más elevadas de secado por aspersión, el efecto de indentaciones en la superficie de las microcápsulas, disminuye por un efecto de expansión rápida de las partículas. La presencia de indentaciones afecta negativamente el libre flujo de los polvos, debido a que conduce a la formación de agregados [35]. El tamaño de las microcápsulas fue menor a 20 micras en todos los almidones modificados, esta característica puede contribuir a reducir el impacto sobre la textura cuando se incorporan en un sistema alimenticio. Los probióticos son demasiado grandes (generalmente 4.1 µm) para la nanotecnología, por lo que la microencapsulación es una herramienta útil para mejorar la viabilidad de los probióticos activos [36]. 143 Conclusiones A través de la molienda húmeda es posible obtener almidón de nativo con buenas características fisicoquímicas y estructurales, los almidones modificados de amaranto (fosfatado, acetilado y succinatado) presentaron excelentes propiedades para la encapsulación eficiente de microorganismos probióticos durante el secado por aspersión. Las microcápsulas obtenidas presentaron buenas características, principalmente en la sobreviviencia de los microrganismos Bifidobacterium breve ATCC 15700 y Lactobacillus casei ATCC 334 después del secado por aspersión, así como en el tamaño de estas (menor a 50 µ), lo cual representa una ventaja, si estas son adicionadas a diferentes matrices alimentarias, ya que podría esperarse un menor impacto de la textura en alimentos en los que las microcápsulas sean adicionadas. Es importante el estudio de diferentes fuentes de almidones, ya que estos pueden ofrecer diferentes ventajas y aplicaciones en la encapsulación de una gran variedad de principios bioactivos. En nuestro grupo de trabajo, uno de los objetivos a seguir, es continuar en la búsqueda de información sobre la microencapsulación por diferentes métodos, utilizando fuentes novedosas de materiales de pared, así como una gran variedad de compuestos bioactivos, los cuales puedan ser utilizados en la industria alimentaria y que estos cumplan con las características de estabilidad y puedan proporcionar un efecto benéfico en la salud del consumidor. Referencias 1. Lehmann, J. W. 1996. Case history of grain amaranth as an alternative crop. Cereal Foods World. 41:399-403. 2. Paredes-López, O.; Schevenin, M. L.; Hernández-López, D.; Cárabez-Trejo A. 1989. Amaranth starch-isolation and partial characterization. Starch/Stäke 41:205-207. 3. Radosavljevic, M.; Jane, J.; Johnson, L. A. 1998. Isolation of Amaranth Starch by Diluted Alkaline-Protease Treatment. Cereal Chemistry. 75(2): 212–216. 4. Saunders, R. M.; Becker R. 1984. “Amaranthus: A potential food and feed resource”, in Advances in Cereal Science and 144 Technology. “Ed. Y. Pomeranz. Americam Association of cereal Chemists. St. Paul, MN. 5. Hermansson, A. M.; Svegmark, K. 1996. Developments in the understanding of starch functionality. Trends in Food Science and Technology. 7(11):345-353. 6. Xie, H. G.; Zheng, J. N.; Li, X. X.; Liu, X. D.; Zhu, J.; Wang, F.; Xie, W. Y.; Ma, X. J. 2009. Effect of Surface Morphology and Charge on the Amount and Conformation of Fibrinogen Adsorbed onto Alginate/Chitosan Microcapsules. Langmuir. 26(8): 5587-5594. 7. Brown, S. B.; Orlando C. M. 1988. Reactive extrusion, in Encyclopedia of Polymer Science and Engineering, Vol. 14 (Eds. H. F. Mark, N. M. Bikales, C.G. Overberger, G. Menges, J. I. Kroschwitz) Wiley, New York. 8. Weinbreck, F.; Bodnár, I.; Marco, M. L. 2010. Can encapsulation lengthen the shelf-life of probiotic bacteria in dry products?. International Journal Food Microbiology. 136:364-367. 9. Miranda-Novales, MG. 2008. Probióticos y micronutrimentos ¿Son útiles para la diarrea aguda? Boletín médico del Hospital general de México. 65:157-166. 10. Zhao J.; Yan X.; Wu W. 2008. Genetic variations and cellular receptors of canine distemper virus-a review. Wei Sheng Wu Xue Bao 48. 2008. pp. 986-991. 11. Anal, A.K.; Singh, H. 2007. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery review. Trends Food Science Technology. 18:240-251. 12. Gilliland, S. E.; Speck, M. L. Antagonistic action of Lactobacillus acidophilus toward intestinal and food borne pathogens in associative cultures. Journal Food Protection. 40. 1977. pp. 820–823. 13. Myers, D. J.; Fox, S. R. 1994. Alkali wet-milling characteristics of pearled and unpearled amaranth seed. Cereal Chemistry. 71:96-99. 14. AACC. 2000. Approved Methods of the American Association of Cereal Chemists. American Association of Cereal Chemists, St. Paul, MN. Vol II(10 th Ed). 145 15. Williams, P. C., Kuzina, F. D.; Hlynka, L. 1970. A rapid colorimetric procedure for estimating the amylase content of starches and flour. Cereal Chemistry. 47:411. 16. Gunning, Y. M.; Gunning, P. A.; Kemsley, E. K. 1999. Factors affecting the release of flavour encapsulated in carbohydrate matrixes. Journal of Agriculture and Food Chemistry. 47:51985205. 17. Murúa-Pagola, B.; Beristain-Guevara, C. I.; Martínez-Bustos, F. 2009. Preparation of starch derivatives using reactive extrusion and evaluation of modified starches as shell materials for encapsulation of flavoring agents by spray drying. Journal of Food Engineering. 91:380-386. 18. Phillips, D. L.; Liu, H.; Pan, D.; Corke, H. 1999. General application of Raman spectroscopy for the determination of level of acetylation in modified starches. Cereal Chemistry. 76 (3):439–443. 19. Falfán-Cortés, RN.; Gaytán- Martínez M.; Verdalet-Guzmán I.; Amaya Llano SL.; Ferreira Grosso CR.; Martínez-Bustos F. 2014. Evaluation of Modified Amaranth Starch as Shell Material for Encapsulation of Probiotics. Cereal Chem. 91(3):300–308. 20. Pérez, E.; Bahnassey, Y. A.; Breene, W. M. 1993. A simple Laboratory Scale Method for isolation of amaranthus. Starch/ Stärke. 45(6):211-214. 21. Calixto, C.; Arnao, S. 2004. Aislamiento y caracterización parcial (I) del almidón nativo de Amaranthus caudatus Linneo. Revista Química del Perú. 70(1): 48-54. 22. Manni, D.; Santiago, L.; Andrich, O.; Grosso C. 2008. 2do Encuentro de Jóvenes Investigadores en Ciencia y Tecnología de Materiales. Misiones, Argentina. 23. Uriyapongson, Y.; Rayas-Duarte, P. 1994. Comparison of yiel and properties of amaranth starches using wet and dry-wet milling processes. Cereal Chemistry. 71: 571-577. 24. Bello-Pérez, L. A.; De León, Y. P.; Agama-Acevedo, E.; ParedesLópez, O. 1998. Isolation and Partial Characterization of Amaranth and Banana Starches. Starch/Stärke. 10:409-413. 146 25. Gamel, T. H.; Linssen, J. P.; Mesallam, A. S.; Damir, A. A.; Shekib, L. A. 2006. Effect of seed treatments on the chemical composition of two amaranth species: oil, sugars, fibres, minerals and vitamins. Journal of the Science of Food and Agriculture. 86:82–89. 26. Choi, S. G; Kerr, W. L. Swelling characteristics of native and chemically modified wheat starches as a function of heating temperature and time. Starch. 56. 2004. pp. 181-189. 27. Yangzhou, J. Q.; Stuttgart, M. K. 1999. Characterization of Amaranthus cruenctus and Chenopodium quinoa Starch. Starch-Stärke. 51:116-1120. 28. Qian, J. Y.; Kuhn, M. 1999. Characterization of Amaranthus cruentus and Chenopodium quinoa starch. Starch/Stärke. 51(4): 116-120. 29. Wu, H. X.; Yue, S. X.; Sun, H. L.; Corke, H. 1995. Physical properties of starch from two genotypes of Amaranthus cruentus of agricultural significance in China. Starch/Stärke. 47: 295–297. 30. Narváez, E. D.; Figueroa, J. D.; Taba, S.; Rincón, F. 2006. Kernel microstructure of Latin American races of maize and their thermal and rheological properties. Cereal Chemistry. 83(6): 605-610. 31. Teixeira, P.; Castro, H.; Mohacsi-Farkas, C.; Kirby, R. 1997. Identification of sites of injury in Lactobacillus bulgaris during heat stress. Journal of Applied Microbiology. 83:219-226. 32. Favaro-Trindale, C. S.; Grosso, C. R. F. 2002. Microencapsula- tion of L acidophilus (La-05) and B lactis (Bb-12) and evaluation of their survival at the pH values of the stomach and in bile. Journal of Microencapsulation. 19: 485-494. 33. Lieh-C, S.; Chin-Wen, L.; Ming-Ju, C. 2007. Development of an Oriental-style dairy product coagulated by microcapsules containing probiotics and filtrates from fermented rice. Society of Dairy Technology. 60(1):1-10. 34. Ying, D.Y.; Phoon, M. Ch.; Sanguansri, L.; Weerakkody, R.; Burgar, I.; Augustin, M. A. 2010. Microencapsulated Lactobacillus rhamnosus GG Powders: Relationship of Powder Phys147 ical Properties to Probiotic Survival during Storage. Journal of Food Science. 75(9): 588-595. 35. Rosenberg, M.; Young, S. L. 1993. Whey proteins as microencapsulating agents. Microencapsulation of anhydrous milkfat – structure evaluation. Food Structure. 12: 31-41. 36. Akhiar, M. 2010. Enhancement of Probiotics Survival by Microencapsulation with Alginate and Prebiotics. Basic Biotechnology Journal. 6: 13-18. 148 Análisis fisicoquímico y determinación de actividad antioxidante del capulín (Prunus serotina) Castañeda–Ovando, A.,* Martínez–Torres, E., Contreras–López, E., Jaimez–Ordaz, J., Añorve–Morga, J., González–Olivarez, L.G. *Cuerpo Académico de Propiedades y Funcionalidad de Alimentos, Universidad Autónoma del Estado de Hidalgo. Carr. Pachuca–Tulancingo, km 4.5, Mineral de la Reforma, Hidalgo, México. CP. 42184. Tel. 01(771)7172000, ext. 2512, e–mail: ovandoa@ uaeh.edu.mx Resumen El objetivo del presente trabajo de investigación fue la caracterización fisicoquímica y el análisis de la actividad antioxidante del fruto de capulín (Prunus serotina). El análisis proximal y azúcares reductores se realizó por separado a la pulpa, piel, hueso y el capulín entero con la finalidad de identificar la composición química. Los resultados obtenidos se compararon con los reportados en otros trabajos de investigación, existe variación debido a las diferencias que existen entre las especies. El capulín entero presentó una composición del 62.42% de humedad, 0.88% cenizas, 0.50% de grasa, 3.10% de proteína, 11.93% de fibra y 21.17% de carbohidratos. Los azucares reductores del capulín entero fue de 0.13 g/g de fruto, en comparación con otros frutos reportados como las ciruelas (Spondias purpurea) que oscilan entre 0.11 y 0.52 g/100 g. Los °Brix del capulín se obtuvo un promedio de 18.33, pH 4.83, acidez 8.5 mg ácido tartárico/100g de capulín y la capacidad antioxidante de 403 mg TE/100 g de capulín. El resultado de la actividad antioxidante del capulín es alto en comparación con otros frutos ricos en antioxidantes por lo que su consumo se sugiere, así mismo la aplicación de este fruto en la industria alimentaria. Palabras clave: actividad antioxidante, análisis fisicoquímico, capulín. 149 Introducción Prunus serotina (Rosaceae) es un árbol de 60–90 metros de altura, nativo del norte de América, ampliamente distribuido en México, comúnmente llamado ‘’capulín”, o cereza negra americana [1]. La corteza ha sido utilizada por pueblos indígenas de las regiones de América del Norte para los síntomas relacionados con la diabetes y tradicionalmente para el tratamiento de enfermedades inflamatorias, tales como fiebre, frío, y dolor de garganta. Se sabe que ejercen propiedades contra el cáncer y los efectos antiproliferativos a través de la regulación a la baja de la ciclina D1 expresión en células humanas de cáncer de colon [1]. Los frutos de P. serotina se utilizan en la medicina tradicional mexicana para el tratamiento de la diarrea y la tos. Estas frutas son también parte de la dieta mexicana, y se consumen frescas, secas o preparadas en mermelada [1]. Hace algunos años se realizó un estudio de este fruto; de acuerdo a las estadísticas, resultó que es una especie de poca importancia económica, con una superficie cultivada de 78 hectáreas, una producción de 293 toneladas, con un valor de producción de $774,000.00 y entre los estados productores destacan el Distrito Federal y el Estado de México [2]. Este hecho es de esperarse, ya que no se han dado más usos a este fruto, por lo que su impacto industrial y económico es inversamente proporcional a las propiedades que tiene. En este sentido, se ha estudiado que el capulín contiene como antocianinas mayoritarias a la cianidina–3–glucósido y la cianidina–3–rutinósido [3], lo que lo hace viable para utilizarlo en la elaboración de otros productos con propiedades funcionales. Materiales y métodos Muestras Las muestras de capulín (3.380 kg) con la que se trabajó se adquirieron en un establecimiento comercial. Una vez lavados los frutos, a 2.2 kg se les extrajo el hueso y la pulpa; los pericarpios resultantes se liofilizaron, con la finalidad de conservarlos para los análisis posteriores. El resto se congeló a –5 °C. 150 Análisis proximal El análisis proximal se realizó a muestras de capulín entero, pulpa, piel y hueso del fruto de capulín. Todos los análisis siguieron las metodologías de la AOAC [4]. Humedad El contenido de humedad se llevó a cabo mediante el método AOAC 925.09, por secado en estufa. En charolas de aluminio a peso constante se colocaron muestras de 5 g y se llevó a peso constante en una estufa a 105 °C por un tiempo de 4 horas. El procedimiento se realizó por triplicado. Cenizas Para la determinación de cenizas totales por el método AOAC 923.03 se utilizaron crisoles a peso constante, se colocaron de 2 a 3 g de muestra y se incineró en parrilla de calentamiento hasta la desaparición del humo. Posteriormente, los crisoles se llevaron a una mufla a 550 °C por 6 horas aproximadamente. El análisis se realizó por triplicado. Grasa cruda El contenido de grasa se determinó mediante el Método AOAC 920.39 (Método Soxhlet). Para lo cual, se colocó la muestra libre de humedad, en un dedal de celulosa y se introdujo en el equipo Soxhlet. En un matraz balón de 250 mL a peso constante se adicionaron 150 mL de éter de petróleo, se procedió a calentamiento moderado hasta la extracción de grasa. Para finalizar se recuperó el solvente y el resto se eliminó colocando el matraz en una estufa a 65 °C. El análisis se realizó por triplicado. Proteína cruda La determinación se realizó por el método AOAC 990.03 (Método Dumas). En una cápsula de estaño se pesaron aproximadamente 100 mg de muestra libre de grasa y humedad, y se introdujo en un equipo Dumas LECO FP–528. La muestra se sometió a una combustión a 800 °C para convertir todo el nitrógeno presente 151 en la materia orgánica a nitrógeno gaseoso, para convertir este último en % de proteína, se utilizó un factor de conversión de 6.25. La determinación se realizó por triplicado. Fibra cruda La determinación de fibra se realizó por el método AOAC 7.073. Se pesaron de 1 a 2g de muestra libre de humedad y grasa y se colocaron en un vaso de Berzelius de 600 mL. Se procedió a una digestión ácida con H2SO4 al 1.25% por 30 minutos a reflujo, se filtró en una tela de lino y se prosiguió con una digestión básica con NaOH al 1.25% por 30 minutos a reflujo. Se filtró la muestra no digerida con la misma tela de lino, se colocó el resto de la muestra y la tela en un crisol y se llevó a peso constante en estufa a 105°C por 1 hora. Se incineró en una parrilla de calentamiento hasta desaparición de humo y colocó en una mufla a 550 °C por 6 horas. Se realizó por triplicado, analizando un blanco para los cálculos finales. Determinación de azúcares reductores Se realizó la determinación de azúcares reductores a muestras de capulín entero, piel, pulpa y hueso. La determinación se realizó por el método del ácido 3,5–dinitrosalicílico (dns), el cual se basa en la reducción del dns (de color amarillo) por los azúcares reductores al ácido 3–amino–5–dinitrosalicílico de color rojo previo calentamiento por 5 minutos a 100 °C. Después, se tomó la lectura de la absorbancia a λ=540 nm en un espectrofotómetro GENESYS 10S UV–VIS, se preparó una serie de estándares a partir de una solución patrón de glucosa para realizar la curva de calibración. Las muestras se analizaron por triplicado. Determinación de sólidos solubles totales (°Brix) Se añadió al prisma 5 gotas del jugo del fruto y se determinó el porcentaje de sólidos solubles totales directamente en la escala, a 18 ºC. Se utilizó un refractómetro digital Reichert AR200. 152 Determinación de pH Se pesaron 75 g del fruto de capulín sin hueso, molido en 200 mL de agua destilada se tomaron las lecturas de pH directamente en un potenciómetro pH/ORP/ISE Meter (HANNA H3221). Determinación de acidez titulable Se pesaron 75 g de capulín sin hueso y molido, se mezclaron con 200 mL de agua destilada y se llevó a calentamiento a 70 °C por 1 hora, se filtró y el residuo se lavó con agua caliente, se aforó a 500 mL. Se tomaron alícuotas de 25 mL y se adicionaron 75 mL de agua previamente hervida y fría. Se valoró con una solución de NaOH 0.1N por el método descrito en la NMX–F–102–S 1978 y expresado en mg de ácido tartárico/100g de capulín. Determinación de la actividad antioxidante La actividad antioxidante del fruto de capulín se determinó mediante el método del DPPH. Se preparó una solución patrón con Trolox (antioxidante de referencia) y se realizó una curva patrón, utilizando el DPPH (2,2–Diphenyl–1picrylhydrazyl) como secuestrante de radicales libres, se tomaron las absorbancias en un espectrofotómetro UV–VIS a 515 nm. El resultado se expresó como mg de trolox/100 g de muestra. Determinación de fenoles totales Curva de calibración La cuantificación se realizó utilizando el reactivo de Folin–Ciocalteau (tungstofosfato y molibdofosfato). Para ello, se preparó una curva de calibración en el intervalo de 0 a 30 mg/L de ácido gálico; a cada uno de los estándares se les agregó 1.5 mL de reactivo de Folin–Ciocalteau y 4 mL de carbonato de sodio al 7.5%, los matraces se mantuvieron en agitación en vortex durante 1 min y las soluciones se aforaron a 10 mL con agua destilada. Los estándares se colocaron en un baño de agua precalentado a 50°C y se incubaron durante 10 min. A continuación, se midieron las absorbancias a 760 nm. 153 Extracto de capulín Se pesaron aproximadamente 5 g de capulín y se agregó 100 mL de agua destilada. Se tomó una alícuota de 500 µL del extracto de capulín y se trasnfirieron a un matraz volumétrico de 10 mL, adicionando 1.5 mL de reactivo de Folin–Ciocalteau y 4 mL de carbonato de sodio al 7.5%, completando el volumen con agua destilada. Después, se incubó a mezcla a 50 °C durante 10 min, tomando las lecturas de absorbancia a 760 nm. El análisis se realizó por triplicado. Medida de antocianinas Obtención del extracto La extracción se realizó de acuerdo al método descrito por Giusti y Wrolstad [5]; por lo que, se pesaron 50 g de piel de capulín liofilizado y se sumergieron en 500 mL de solución de HCl al 2% en etanol, manteniéndose en maceración por 24 horas. Posteriormente, la solución se filtró y el filtrado obtenido se aforó a 500 mL con solución etanólica acidificada al 2%. Determinación de antocianinas monoméricas El contenido de antocianinas se determinó mediante el método de pH diferencial descrito por Wrolstad y colaboradores [6]. Se tomaron 2 alícuotas de 1 mL de extracto y se transfirieron a dos matraces volumétricos de 10 mL. Las soluciones de los extractos se aforaron con de KCl 0.025 M (pH 1) y con una solución amortiguadora de acetatos (pH 4.5), respectivamente. Después se obtuvieron los espectros en el intervalo de 250–750 nm. Resultados y discusión Análisis proximal Los resultados obtenidos del análisis proximal del fruto del capulín que se muestran en la Tabla 1, difieren con los resultados reportados por otros autores [7,8], sobre todo en el contenido de proteína y carbohidratos. 154 Tabla 11A. Análisis proximal del fruto de capulín La variabilidad de los resultados obtenidos y los reportados se le atribuye a la diferencia que existen entre las especies de los frutos de capulín, a las condiciones ambientales, variedad, madurez del fruto, tipo de suelo en donde se cultivan los frutos, manejo de muestra y forma en que se expresan los resultados, ya que en algunos casos sólo se reporta como la parte comestible del fruto. Azúcares reductores Se tomó como referencia la curva patrón con glucosa para la obtención de los resultados, donde se obtuvo un coeficiente de correlación de 0.999. Es importante mencionar que el contenido de azúcares reductores pueden ser interferentes en los análisis de actividad antioxidante y fenoles totales por ser especies reactivas. Los resultados se muestran en la Tabla 2, en la que se puede apreciar que la pulpa es la principal fuente de azúcares reductores, seguida de la piel. Tabla 11B. Azúcares reductores del fruto de capulín (n=3). 155 La mayor concentración de azúcares reductores se encuentra en la pulpa de capulín con una concentración de 196.33 mg/g de muestra, la menor concentración está en el hueso de capulín con una concentración de 18.51 mg/g de muestra. Parámetros fisicoquímicos Se obtuvo un promedio de 18.33 °Brix del fruto de capulín, con un valor mayor en comparación con el contenido de sólidos solubles totales de la ciruela (Spondias purpurea) que oscilan de 7.0 a 15.6 ºBrix [9] o en pulpa de vid Palieri de 13 °Brix [10]. El pH del capulín obtenido es de 4.83 como se muestra en la Tabla 3; este valor no tiene variación significativa en comparación con el pH de la pulpa de vid Palieri de 4.50 [10], en cambio la pulpa de frutos colectados en poblaciones silvestres y cultivadas de diferentes variedades de ciruelas mexicanas Spondias purpurea L. en Jalisco, Colima y Nayarit con un valor de pH de 2.7 a 3.3 [9]. Como se puede observar en el fruto de capulín, aún con un pH de 4.83 se conserva el color del fruto, lo que indica que hay otros componentes en el fruto que estabilizan las antocianinas, responsables del color. El valor de la acidez del fruto de capulín es de 8.50 mg de ácido tartárico/100 g de capulín, este no varía significativamente al compararlo con la acidez de 0.86% de la pulpa de vid Palieri [10]. Recientemente el interés por estudiar alimentos con aporte de antioxidantes es más frecuente, en la Tabla 3 se muestra que el fruto de capulín es fuente de antioxidantes y compuestos fenólicos. La actividad antioxidante del capulín es de 398.73 mg de Trolox por 100 g de fruto fresco. Esta propiedad es dada, sobre todo, por las antocianinas presentes en la piel de los frutos, y proporcionan colores desde el rojo o azul al púrpura [11]. Comparando la actividad antioxidante del capulín con otros frutos rojos como el de las cerezas de 3.365, la ciruela de 6.259 y las fresas de 3.577 µmol TE/100g [11]. Dado los resultados el fruto de capulín (Prunus serotina) es una muy buena fuente de antioxidantes que pueden beneficiar a la salud humana, 156 Tabla 11C. Resultados para los parámetros fisicoquímicos evaluados para el capulín Conclusiones El fruto del capulín tiene propiedades que se pueden utilizar para el desarrollo de otros productos alimenticios. De todos los parámetros fisicoquímicos medidos, cabe resaltar a las antocianinas monoméricas, fenoles totales y actividad antioxidante, los cuales fueron valores altos, lo que permite que el fruto del capulín sea aprovechado para la elaboración de bebidas, confites o jaleas con propiedades benéficas para la salud (actividad antioxidante). Referencias 1. Aguerrebere I.; Molina R.; Oomah B.; Drover J. 2011. Characteristics of Prunus serotina seed oil. Food Chemistry. 124:983– 990. 157 2. Molina M.; Córdova T. 2006. Informe nacional sobre el estado de los recursos fitogenéticos para la agricultura y la alimentación sagarpa: somefi. 3. Castañeda O.; Ondra S.; Havel J.; Pacheco L.; Galán V.; Contreras L. 2012. Identification of Anthocyanins in Red Grape, Plum and Capulin by MALDI-ToF MS. Journal of Mexican Chemical Society. 56(4):378-383. 4. AOAC. 1995. Official Methods of Analysis of the Association of Official Analytical Chemists International (16Th ed., Vol. II). (P. Cunniff, ed). 5. Giusti, M.M.; Wrolstad, R.E. 2001. Anthocyanins. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy. In: R. E. Wrolstad (Ed.), Current Protocols in Food Analytical Chemistry, New York. 6. Wrolstad, R. E.; Durst, R. W.; Lee, J. 2005. Tracking color and pigment changes in anthocyanin products. Trends in Food Science & Technology. 16:423-428. 7. Pérez L, A.; Palacios G, B.; Castro B, A. 2008. Sistema Mexicano de Alimentos Equivalentes. Ed. Ogali: México. Tercera edición Pp.19. 8. Revilla C,; Ibarra A.; Luna V. 2010. Cuantificación de compuestos fenólicos y actividad vasodilatadora. Recuperado el 6 de Abril de 2014 de http://www.veranos.ugto.mx/Memorias/12Verano CienciaRegionCentro/documentos/258.pdf. 9. Ramírez H.; Barrios E.; Castellanos R.; Muñoz U.; Palomino H.; Pimienta B. 2007. Sistemas de producción de Spondias purpurea (Anacardiaceae) en el centro-occidente de México. Rev. Biol. Trop. 56(2):675-687. 10. García V.; Pérez V. 2004. La granada. Alimento rico en polifenoles antioxidantes y bajo en calorías. Alim. Nutri. Salud. 11(4):113-120. 11. Gil A.; Ruíz L. 2010. Tratado de nutrición, composición y calidad nutritiva de los alimentos. Ed. Médica Panamericana: España. 158 Cólera y su agente etiológico Rangel–Vargas Esmeralda,* Castro–Rosas Javier*, Gómez–Aldapa Carlos Alberto*, Falfán Cortés Reyna Nallely1 y Rodríguez Marín María Luisa1 *Licenciatura de Química en Alimentos/ Cuerpo Académico de Química en Alimentos, Instituto de Ciencias Básica e Ingeniería, Universidad Autónoma del Estado de Hidalgo (uaeh), Ciudad del Conocimiento, Carretera Pachuca–Tulancingo km. 4.5. 42183 Mineral de la Reforma, Hidalgo, México. Tel. 771 7172000 ext. 2516. 1Investigador colaborador por las Cátedras Conacyt, Licenciatura en Química en Alimentos, uaeh. e_mail: [email protected] Resumen El cólera es una enfermedad infectocontagiosa de origen alimentario, caracterizada por presentar diarrea profusa y la cual tiene como agente la bacteria Vibrio cholerae. A lo largo de la historia se han presentado siete pandemias (aunque ya se habla de una octava pandemia), las cuales se describen en este artículo y en las que se observa que este padecimiento se ha vuelto endémico en países pobres donde las condiciones de higiene son mínimas, lo cual provoca la propagación de dicho enfermedad. Nuestro país ha sido uno de los países que ha sido afectado por algunas de estas pandemias. Sin embargo, tanto la prevención como la propagación de dicho agente etiológico puede ser evitado manteniendo las condiciones de higiene adecuadas por lo cual la vigilancia de este microorganismo tanto en el ambiente como en alimentos se ha vuelto importante, sobre todo en épocas de desastres naturales donde las condiciones tanto ambientales como de higiene suelen conjuntarse para mostrarse adecuadas para la proliferación de este microorganismo. Palabras clave: Cólera, Vibro cholerae, pandemias. 159 El cólera El cólera es uno de los padecimientos que ha provocado innumerables muertes a lo largo de la historia. El más dramático ejemplo documentado, fue el ocurrido en 1994 en los campos de refugiados Rwandeses en Goma, Zaire, con 14 000 defunciones [1]. El cólera ha afectado muchas partes del mundo. Tan sólo de 1992 a 1993 se reportaron 800 000 caso de cólera en el hemisferio oeste con 8 000 defunciones [2]. En nuestro país entre 1991 y 1993 se registraron 21 564 casos con 326 defunciones [3]. El cólera es una enfermedad aguda e infecciosa. Fue descrita antes de la época de Hipócrates en el siglo v a. de C. [4]. En Asia, entre los siglos xv y xviii se describieron varias epidemias de la enfermedad. A mediados del siglo xix John Snow, en Inglaterra, fue el primero en describir las medidas de prevención de la enfermedad con base en estudios epidemiológicos de la epidemia ocurrida en Londres [4]. En 1833 Roberto Koch descubrió el agente causal del cólera y lo describió como un bacilo curvo de gran movilidad, al que llamó Vibrio comma [5]. Desde principios de siglo xix hasta nuestros días, se han registrado siete pandemias de cólera que partieron todas ellas del lejano Oriente, en su mayoría del subcontinente Indio, especialmente de la región de Bengala, hoy representada por la provincia de Calcuta y la República de Bangladesh [5]. La evidencia epidemiológica indica que las primeras seis fueron causadas por el biotípo clásico de Vibrio cholerae O1. Este biotipo “desapareció” en casi todas las regiones que afectó, al menos por dos razones: la inmunización contraída al afectarse amplios segmentos de la población, y la dificultad del bacilo para sobrevivir en el ambiente exterior. En contraste, la séptima pandemia que comenzó en 1961 en las islas Sulawesi (Indonesia), es causada por el biotipo El Tor de Vibro cholerae O1, el cual posee menor virulencia, patogenicidad y letalidad que el biotipo clásico, pero mayor capacidad de sobrevivir en el medio ambiente [6, 4]. Además, este biotipo se difunde más lentamente en la población, aunque persiste por años en muchos territorios invadidos. Mientras el biotipo clásico ha ido desapareciendo dejando sólo un reducto en Ban160 gladesh, El Tor muestra tendencia a persistir en el ecosistema de muchos países, tornándose endémico [4]. El cólera es una de las causas más importantes de morbilidad y mortalidad en algunos países de Asia y de África, y desde 1991 también en Latinoamérica [7, 8, 9]. La enfermedad es la expresión de un proceso infeccioso intestinal causado por V. cholerae O1, patógeno exclusivamente humano. Manifestaciones clínicas, dosis infectante y periodo de incubación El cólera se origina por la liberación de una toxina una vez que el V. cholerae ha colonizado el intestino humano. El padecimiento es una enfermedad intestinal aguda y grave en algunos casos, que se caracteriza por la aparición brusca de diarrea acuosa y abundante, vómitos, deshidratación rápida, acidosis, colapso circulatorio, taquicardia, taquipnea, hipotensión, alteraciones en el sistema nervioso central como estupor, convulsiones, contracciones musculares involuntarias y coma [4]. En ausencia de tratamiento, la muerte puede ocurrir en 80% de las víctimas en un periodo tan corto como 10 a 18 h a partir del comienzo de los síntomas [10]. El examen coprológico muestra heces liquidas abundantes con aspecto de agua de arroz. Con frecuencia en las heces es posible la aparición de moco, células epiteliales y grandes cantidades del patógeno (>106 células/mL) [11]. El examen histopatológico del instestino delgado y grueso revela hiperemia, y como V. cholerae no es un patógeno invasivo, no existe respuesta inflamatoria [12]. La infección es en ocasiones asintomática, o sólo provoca una leve sintomatología. En el primer caso, las personas infectadas excretan al microorganismo en números elevados, convirtiéndose así en fuentes activas de contaminación del agua y/o de los alimentos [13]. La duración del estado portador puede ir desde 5 a 19 días [11]. La dosis infectante de V. cholerae se ha estimado entre 106– 108 células viables del patógeno [14]. Sin embargo, en algunos individuos con aclorhidria la dosis puede ser de sólo 100 células. El periodo de incubación va de 6 h hasta 5 días. Tanto el perio161 do de incubación como la dosis infectante, dependen en gran medida del tamaño del inoculo, acidez gástrica, cantidad y tipo de alimento ingerido, presencia de anticuerpos por infecciones previas, entre otros [14, 15]. Es importante destacar que el tratamiento efectivo contra el padecimiento es la hidratación [4]. Antes de la implantación de esta terapia, oral o intravenosa, un gran número de personas afectadas perecía; por ejemplo, se estima que en la India entre 1900 y 1950 anualmente ocurrían 100, 000 defunciones de cólera [10]. En nuestros días, gracias a la hidratación oportuna se han evitado muchas muertes. Mecanismos de transmisión El papel del agua y de los alimentos en la transmisión del cólera está bien establecido [16]. Se conocen dos ciclos en la propagación del padecimiento: a) ingestión de agua contaminada con excretas de pacientes o portadores y b) consumo de alimentos contaminados por agua contaminada con excretas de pacientes o portadores del microorganismo o por contaminación directa de los alimentos (manos) por portadores [17, 18]. La transmisión hídrica ha sido el mecanismo más importante y determinante de las epidemias del cólera a través de los siglos. El agua a su vez, es fuente de contaminación de alimentos y de utensilios de cocina [19]. El agua de pozos superficiales, de las cañerías, reservorios intra–domiciliarios, de los arroyos, ríos, lagunas y lagos, se contamina con las heces de personas enfermas o portadores asintomáticos. Por otro lado, los tratamientos inadecuados de las aguas residuales favorecen la sobrevivencia del vibrión convirtiéndose en fuentes de contaminación, dando lugar a la aparición de brotes. El agua contaminada puede acarrear miles o cientos de miles de bacilos por cada mililitro, e infectar al humano si sobrevive la barrera de la acidez estomacal. Por medio del agua el microorganismo puede pasar de un país o continente a otro. Por ejemplo, McCarthy [20], aisló V. cholerae O1 a partir de agua no potable recolectada en barcos procedentes de diferentes destinos; de 19 barcos analizados, 5 resultaron po162 sitivos a V.cholerae O1, serotipo Inaba, biotipo El Tor, toxigénico. El agua contaminada es peligrosa cuando se consume sin tratar o en el hielo, en refrescos casi neutros, neutro o alcalinos [21]. Al consumir mucha agua se diluye la acidez gástrica y se favorece su paso hacia el intestino [22]; el hielo es un buen vehículo del microorganismo porque este puede sobrevivir a la congelación por tiempos prolongados [23, 24]. El papel de los alimentos contaminados en la transmisión del cólera fue intuido por Snow, y lo recalcó en sus clásicas “medidas para prevenir el cólera” [2]. Muchos autores habían demostrado desde principios de siglo que el vibrión colérico sobrevive varias horas en alimentos ordinarios. También se ha demostrado que puede multiplicarse en la carne y pescado. Algunos alimentos pueden participar en la transmisión del cólera si se preparan bajo condiciones peligrosas (por un portador, por ejemplo) [18], si se consumen crudos (hortalizas regadas con agua de residuales) o después de tres horas o más de haber sido cocidos, sin adecuado recalentamiento, previa recontaminación [25, 26]. Se ha encontrado que los alimentos de origen marino juegan un papel importante en la transmisión del padecimiento. El consumo de bivalvos crudos (ostiones y mejillones) se ha asociado a brotes explosivos en las costas de Italia [27] y casos esporádicos en los EE. UU. [28]. Se ha encontrado que estos alimentos se contaminan principalmente de origen (en el mar), por lo cual se recomienda consumirlos completamente cocidos. El consumo de verduras crudas regadas con aguas negras, sin previo tratamiento antimicrobiano, representa un riesgo importante de infección. Diferentes estudios han mostrado que el vibrión puede sobrevivir durante tiempo prolongado e incluso multiplicares en diversas verduras (germinado de alfalfa, por ejemplo [29]. El patógeno es capaz de multiplicarse en los alimentos e incrementar considerablemente su número. Se han presentado, además, brotes asociados al consumo de hortalizas regadas con aguas negras, como lechuga, col y cilantro [30]. 163 Aspectos microbiológicos El V. cholerae O1 se encuentra situado dentro del Orden Pseudomonadales, familia Vibrionaceae. Las especies del género Vibrio son gram–negativas y tiene forma de bacilo corto, recto o curvo a manera de una coma, mide 1.4 a 2.6 cm de longitud por 0.5 a 0.8 cm de diámetro. Es una bacteria no esporulada que en cultivos frescos y puros se presenta de tamaño uniforme, mientras que en cultivos viejos se torna pleomórfica, con formas ocasionales esféricas o filamentosas y cadenas de bacilos. No forma endosporas. Posee un flagelo polar que le imparte movimiento vibrátil. Son aerobios facultativos, poseen ambos metabolismos, respiratorio y fermentativo [31] El patógeno tiene capacidad de fermentar la glucosa lo que le distingue de otras Pseudomonadaceae. La mayoría de los vibrios producen citocromo–oxidasa, lo que les distingue de las Enterobacteriaceae. Son halotolerantes, con afinidad al medio alcalino, y muy sensibles a los ácidos. No fijan el nitrógeno, todos son quimiorganótrofos, muchos capaces de crecer en un medio mineral únicamente con D– glucosa y cloruro de amonio. Sólo unas cuantas cepas necesitan factores orgánicos de crecimiento. Los inónes sodio estimulan el crecimiento en todas las especies y son un requerimiento para la mayoría; la mínima concentración necesaria es del orden de 5–700 mM, por lo que muchas especies crecen bien en medios que contengan agua de mar [32]. El patógeno puede encontrarse en hábitats acuáticos con variedad de salinidad y son comunes en ambientes marinos. También puede encontrarse en agua dulce donde, dependiendo de diversos factores, su sobrevivencia puede ser de horas hasta días [33, 34]. V. cholerae es susceptible a la desecación, el calor, desinfectantes químicos como el cloro y a antibióticos como las tetraciclinas [4]. Clasificación serológica Se han descrito más de 140 grupos serológicos de acuerdo al antígeno somático O de V. cholerae, entre los cuales el grupo O1 produce la enterotoxina colérica [35]. Las cepas que no reaccionan con el antígeno O1 son llamadas V. cholerae no–O1 [4]. El antígeno O somático, es un polisacárido típico de las bacterias 164 gram–negartivas, el cual es un componente de la membrana externa de la célula. Las porciones lipídicas tienen actividad endotóxica y la especificidad antigénica depende de los polisacáridos. El antígeno O es importante para su diagnóstico, a diferencia del antígeno H (flagelar) que es compartido con muchos vibrios no patógenos [36]. Las cepas del serovar O1 muestran notable consistencia en su comportamiento fisiológico e inmunológico [4], pero diversidad genética, aún dentro de una región geográfica [10]. A estas cepas se les denomina epidémicas. Muchas cepas de otro serovares tienen propiedades patógenas y pueden causar diversas formas de diarrea o lesiones extraintestinales [4]. El V. cholerae O1 incluye dos biotipos, el Clásico y El Tor. Se cree que el biotipo clásico generó las pandemias del siglo xix. Las primeras cepas de El Tor fueron aisladas a principios del siglo xx de cadáveres de peregrinos que permanecieron en la estación de cuarentena El Tor en la península del Sinaí [5]. El Tor es el biotipo que actualmente causa la séptima pandemia de cólera [5]. El biotipo clásico se distingue por su alta tasa de ataque, generar cuadros de diarrea graves, ser muy virulento, y poseer una tasa de letalidad de 10 hasta 50 por ciento. El biotipo El Tor es menos virulento, tiene una menor tasa de ataque y una letalidad considerablemente más baja que el clásico. Mientras el clásico ha ido desapareciendo, dejando sólo un reducto en Bangladesh. El Tor muestra tendencia a persistir en el ecosistema de muchos países, tornándose endémico [4]. Biquímicamente los biotipos se diferencian por la producción de acetilmetilcarbinol (reacción de Voges Proskauer), hemaglutinación de eritrocitos de pollo, sensibilidad a la polimixina y sensibilidad a los fagos lV y V [4]. Los dos biotipos comprenden tres serotipos asociados a antígenos O: el Inaba y el Ogawa, que son los principales y el Hikojima, que es raro. Esta especificidad se debe a la presencia de tres antígenos llamados A, B, y C. El serotipo Inaba contiene los antígenos A y C; el serotipo Ogawa los antígenos A y B; y el serotipo Hikojima los tres A, B y C [5]. Existen evidencias que sugieren que los tipos Inaba e Hikojima resultaron de mutaciones in vivo. Por 165 otro lado, el serotipo Hikojima es poco estable y se ha reportado que puede experimentar interconversiones transformándose a menudo en cualquiera de los otros serotipos [37]. En el laboratorio los serotipos se diferencian mediante pruebas de aglutinación en láminas, de cepas que primero han aglutinado francamente con suero de conejo polivalente anti O1, y después con sueros específicos anti–Inaba o anti–Ogawa [38]. Existen cepas de V. cholerae que no aglutinan con el antisuero O1 que se denominan V. cholerae no–O1. Los vibrios no–O1 pueden causar gastroenteritis de uno a tres días de evolución, así como infecciones extraintestinales como septicemia, otitis media, infección de heridas y cistitis [4]. Fagotipia De enorme valor para el estudio epidemiológico de V. cholerae es su fagotipificación; el sistema que se emplea consta de cinco grupos de fagos [39]. El fago O149 (perteneciente a fago IV clásico) está relacionado con la cepa Ogawa 154 del biotipo clásico. Se ha reportado que este fago lisa todas las cepas de V. cholerae clásico, en tanto que las del biotipo El Tor son resistentes. El contenido de lipopolisacáridos de la superficie celular es semejante para ambos biotipos, pero en El Tor hay menos hexosamina y carece de galactosamina; esto influye en la conformación del receptor para el fago O149 por lo que la célula no es atacada [39]. V. cholerae clásico NIH 41 tiene los fagos V. cholerae A1 y V. cholerae A2 que lisan a las cepas El Tor. Con estos fagos se han obtenido sondas para hibridación de ADN; ambos fagos están íntimamente relacionados con el fago kappa V. cholerae. Los genotipos de V. cholerae O1 circulantes descritos en la actualidad, forman tres grupos que tienen patrones diferentes para enzimas de restricción [40]: 1) cepas australianas; 2) cepas de la pandemia americana (El Tor); 3) cepas El Tor del Golfo de México. Factores de Virulencia (S). La patogenicidad del cólera se basa en una variedad de factores de virulencia muy organizados. El principal mecanismo de patogenicidad es la producción de una toxina. La enterotoxina es bastante similar a la toxina de E. coli [41] y es la responsable de la diarrea característica de la enferme166 dad. Es de naturaleza proteica, lábil al calor y de peso molecular cercano a 84 kilodaltones. La información para su síntesis se encuentra codificada en el genoma de un bacteriófago filamentoso [42]. La toxina está formada por una subunidad A1 (12 kDa), una A2 (7 kDa) y cinco subunidades B (10 kda). Las subunidades B se fijan al gangliósido GM1 ubicado en la membrana celular del epitelio del intestino delgado. La subunidad A penetra a la célula y activa el complejo enzimático adenilatociclasa lo cual incrementa los niveles intracelulares de AMPc y la hipersecreción de sales y agua [43]. Esto provoca diarrea secretora dando como resultado una concentración de Na + y Cl– ligeramente inferiores a las del plasma; la concentración del bicarbonato es aproximadamente el doble y la de iones K+ es tres a cinco veces mayor que la plasmática [43]. En algunos casos un individuo con cólera puede perder hasta 30 litros de agua en un día [5]. La pérdida de agua es la alteración más importante, ya que de ella se derivan los demás signos y síntomas. En consecuencia, el tratamiento primario efectivo para el cólera consiste en la rehidratación de los pacientes. Se ha reportado que los tres serotipos de V. cholera producen esta toxina colérica. [44]. Recientemente se han descrito otras dos toxinas producidas por V. cholerae conocidas como toxina ZOT (toxina zonula ocludens) que altera la unión entre los eritrocitos y la toxina ACE (enterotoxina celular accesoria) [14]. Aparte la toxina colérica, V. cholerae es capaz de regular la síntesis del flagelo polar, importante en la quimiotaxis y la penetración de la barrera mucosa [45]. Produce una proteasa que disuelve el gel mucoso, y una serie de hemaglutininas solubles y asociadas a la bacteria [46]. Las hemaglutininas que este patógeno sintetiza son similares a las de E. coli enterotoxigénica y juegan un papel muy importante en los mecanismos de colonización. Difieren en cuanto a la especificidad del eritrocito, que aglutinan a la fase de crecimiento en que se expresan, a su inhibición por azúcares libres y a los requerimientos de cationes divalentes [43]. La hemaglutinina principal del biotipo El Tor aglutina eritrocitos de pollo y es sensible a la D–manosa y a la D–fructosa. La hemaglutinina del Clásico es sensible a la L–fructosa [4]. 167 Se han descrito, además, dos tipos de pili (o fimbria), el (Toxin Coregulated Pilus) y el acf (Accesory Colonization Factor). Son estructuras poliméricas formadas por varios tipos de proteínas que al parecer participan en la asociación y colonización del patógeno en las microvellosidad [45]. El patógeno es capaz de producir neuroaminidasas (que convierten gangliosidos en receptores de la toxina colérica), hemolisina/citolisinas (serie de proteínas reguladas por hierro que favorecen la sobrevivencia del patógeno en microambientes del intestino con limitaciones de este catión) y factor inhibidor de los canales de sodio [46]. tcp Prevención y control del cólera En la actualidad las medidas que se aplican en muchos países endémicos de cólera, incluido México, para prevenir y controlar el padecimiento se basan en el mejoramiento del saneamiento ambiental, fomento para la salud, higiene de los alimentos, control de brotes y vigilancia epidemiológica. Estas medidas, sin embargo, no han sido eficientes debido en gran parte al incompleto conocimiento de la ecología del microorganismo [15]. Esto dificulta la comprensión de la epidemiología de la enfermedad, ya que entonces resulta difícil determinar el ciclo del patógeno en la naturaleza. Por ejemplo, no se sabe exactamente qué mecanismos entran en acción por parte del microorganismo para sobrevivir largo tiempo fuera del intestino humano, o por qué razón el padecimiento se presenta de forma súbita en una población y de igual forma desaparece. Para la prevención y control racional de padecimientos como el cólera, se requiere una más amplia información de las fuentes y mecanismos de contaminación del agua y alimentos así como de la epidemiología y ecología del patógeno [47, 48]. Actualmente, se conoce muy bien el papel de los alimentos en la transmisión del cólera [48]. Se sabe que la enfermedad tiende a prevalecer en los países con pobres condiciones de saneamiento ambiental y con deficientes sistemas sanitarios de vigilancia y control de los alimentos [49]. 168 Existe por otra parte, abundante información sobre la genética del microorganismo; de hecho recientemente se reportó la secuenciación completa del ADN del patógeno [50]. En la actualidad las medidas que se siguen para la prevención y control del cólera, así como el saneamiento ambiental y los sistemas de vigilancia sanitaria de los alimentos y de salud pública, son mejores que hace 100 o 50 años. Sin embargo, la incidencia del padecimiento en muchas regiones del mundo continúa elevada. Esto lleva a cuestionar la eficiencia de las medidas y acciones que se aplican para la prevención del cólera. Comportamiento de v. Cholerae en los alimentos Al igual que otros microorganismos trasmitidos por alimentos, V. cholerae muestra potencial para desarrollar en ellos. Es bien sabido que el destino de este patógeno en el medio ambiente y alimentos depende del tipo y nivel de los factores ecológicos prevalentes [51, 43]). Dentro de estos factores sobresalen el estado fisiológico del microorganismo, la naturaleza y composición del sustrato involucrado, la humedad relativa, la temperatura, el número inicial y el efecto de sustancias antimicrobianas [51]. Cabe destacar que a pesar de la importancia del cólera, y a diferencia de otros como la salmonelosis o listeriosis, la investigación acerca de los factores ecológicos que afectan la sobrevivencia del patógeno en el medio ambiente o alimentos, es más bien discreta. Esta desatención puede explicarse, en parte, debido a la baja incidencia del padecimiento en aquellos países que tradicionalmente destinan importantes recursos a la investigación (como los EE. UU.) no constituye para ellos una prioridad [52]. Sin embargo, para lograr un control y prevención eficientes del padecimiento, es necesario generar esa información y con base en ella, elaborar y diseñar medidas racionales encaminadas a lograr tales objetivos. V. cholerae tiene potencial para desarrollar en los alimentos cocinados tales como arroz, pollo, lentejas, leche [25]. Este hecho es muy importante ya que con ello se incrementa el riesgo de infección. En otras palabras, para que ocurra la infección se re169 quiere por lo general de un número elevado del microorganismo [43]. En nuestro laboratorio hemos encontrado que V. cholerae en caldo soya tripticasa a 35 °C, en tan solo 5 h es capaz de alcanzar 108 UFC/ml [53]. Este estudio nos da una idea de la magnitud del riesgo que representa el abuso de la temperatura durante el almacenamiento o manejo de los alimentos. Cabe mencionar que temperaturas cercanas a 35° pueden alcanzarse dentro de una cocina o durante los meses cálidos. El pH y la temperatura del alimento tienen una influencia notable en el desarrollo del microorganismo. V. cholerae es incapaz de multiplicarse en alimentos ácidos como los cítricos donde por el contrario tiende a morir rápidamente [5]. A diferencia, en alimentos de acidez intermedia sobrevive al menos 8 horas [54]. También crece en algunas verduras crudas como el germinado de alfalfa [29]. Sin embargo, al parecer este desarrollo está fuertemente influenciado por la flora nativa del alimento. Es de esperar que V. cholerae sea un mal competidor de la flora autóctona del alimento y por tanto, sea antagonizado fácilmente. En agua de mar incrementa su número hasta 6 log10 en tan sólo 24 horas a 30 º [32]. Habiéndose o no multiplicado el nivel del riesgo va a estar en función de la capacidad del microorganismo para sobrevivir en el alimento. Se mantiene viable por largo tiempo en congelación y refrigeración. La sobrevivencia se ha evaluado en alimentos como cangrejos, camarones y ostiones en congelación y refrigeración. Sobrevive al menos 15 días bajo tales circunstancias [24]. En nuestro laboratorio hemos observado que el patógeno sobrevive en germinado de alfalfa después de 15 días a 5–7º, con una reducción de tan solo 1 log10. [29]. Moreno y Torres, [54] reportan que el patógeno puede sobrevivir en agua congelada a –15º al menos 63 días. El vibrión sin embargo, es susceptible al calor; suspendido en solución salina isotónica (SSI), se inactiva por completo al calentar paulatinamente la suspensión al alcanzar 60º [54]. Es de esperar, no obstante, que en un alimento el microorganismo no muestre un comportamiento igual al observado en la SSI, ya que los constituyentes del alimento pueden conferirle termoprotección. Guthrie et al. [56], determinaron la 170 sobrevivencia de cepas de V. cholerae O1 en arroz, pollo, pescado y cangrejo, sometidos a diversas temperaturas de recalentamiento (45º, 50º, 55º, 60º y 65º), y en congelación (5º) y refrigeración (–20º). El microorganismo sobrevivió mejor en pescado que en arroz y pollo, y a su vez; mejor en arroz que en pollo, sometidos estos alimentos a los mismos tratamientos. El tiempo de sobrevivencia en alimentos con bajo pH es generalmente menor a un día, y en alimentos desecados menor a dos días (WHO, 1991). El tiempo de sobrevivencia en utensilios y equipo varía de 4 a 48 h [57, 5]). Sin embargo, puede inactivarse en cucharas de plástico en tan sólo 15 min de contacto a temperatura ambiente [58]. Por otro lado, suspendido en SSI dentro de bolsas de plástico se inactiva dentro de 24 h de contacto [53]. Estos hallazgos son de un gran valor si se considera que en la actualidad la recolección de muestras de agua y alimentos para la búsqueda del patógeno tiende a realizarse en recipientes y bolsas de plástico; por lo tanto, estos materiales podrán estar interfiriendo en su recuperación, dando lugar a resultados falsos negativos. V. cholerae es susceptible a los antimicrobianos químicos como el cloro o el yodo, pero estos germicidas no son tan eficientes para eliminar al patógeno cuando se encuentra sobre verduras [59], o sobre el equipo en las plantas procesadoras de alimentos. Esta resistencia puede explicarse en parte debido a que en un alimento el microorganismo puede estar adherido y recubierto de un polisacárido (glicocálix) que lo protege contra la acción de los germicidas. De hecho la adherencia confiere protección a los microorganismos en contra de factores antimicrobianos [20]. Debe entenderse que el efecto de los factores ecológicos en el comportamiento del microorganismo no es un proceso estático, y que tales factores suelen variar (actividad acuosa por ejemplo) durante la elaboración, fabricación, comercialización o almacenamiento del alimento. Su efecto sobre el destino de un microorganismo en particular, puede ser positivo (sobrevivencia / desarrollo) o negativo (inactivación) dependiendo de las condiciones prevalentes al momento de ingresar al alimento y de su manejo ulterior. En consecuencia, un alimento es más o menos 171 peligroso dependiendo del tipo de microorganismos patógenos que contenga y de las facilidades que presente para su eventual sobrevivencia o desarrollo. Referencias 1. Siddique, A.K.; Salam, A.; Islam, M.S.; Akram, K.; Majumdar, R.N.; Zaman, K.; Fronczak, N.; Laston, S. 1995. Why treatment centers failed to prevent cholera deaths among Rwandan refugees in Goma, Zaire. Lancet. 345: 359-361. 2. Tauxe, R.; Seminario, L.; Tapia, R.; Libel, M. 1994. V. cholerae and cholera. American Society for Microbiology, Washington, D.C. The Latin American epidemic. 3. Secretaría de Salud. 1994. Situación del cólera en México. Boletín Cólera/Diarreas infecciosas. México. 4. Kumate, J.; Sepúlveda, J.; Gutiérrez, G. 1993. El Cólera. Epidemias, Endemias y Pandemias. Ed. Interamenricana, Mc Graw-Hill, México. 5. Mata, L. 1992. El Cólera: Historia, Prevención y Control. Ed. Universidad de Costa Rica. Costa Rica. 6. Heiser, V.G.; Carpenter, M.D. 1971. Recollection of cholera at the turn of the century. Bull, N.Y. Acad. Med. 47: 1211-1212. 7. Anónimo. 1991a. El cólera en las Americas. Actualización. Boletin epidemiológico OPS. Organización Panamericana de la Salud. 12: 1-14. 8. Anónimo. 1991e. World Health Organization. Weekly Epidemiological Record. 6: 41-48. 9. Valdespino, J.L.; Garcia, M.L.; Hinojosa, M.; Sarti. E.; Sepúlveda, J. 1991. Epidemia de cólera en las Americas. Ciencia y desarrollo. 17: 55-64. 10. Mekalanos, J. J.; Rubin, J.E.; Waldor, K. M. 1997. Cholera: molecular basis for emergence and pathogenesis. FEMS Imm. Med. Microbiol. 11. Dizony, J.J.; Fukumi, H.; Barua, D. 1967. Studies on cholera carriers. Bull. W.H.O. 37: 737-743. 12. Bennish, M.L. 1994. Cholera. Phatophysiology, clinical features and treatment. In: Wachsmuth, I.K., Blake, P.A. and 172 Olsvik, O. (Eds). Vibrio cholerae and Cholera; Molecular to global perspectives. Amer. Soc. Microbiol, U.S.A. 13. Charles, C.J.; Carpenter, M.D. 1971. Cholera: Diagnostic and treatment. Bull. N.Y. Acad. Med. 47: 1192-1203. 14. Kaper, J.B.; Morris Jr. J.G.; Levine, M.M. 1995. Cholera. Clin. Microbiol. Rev. 8: 48-86. 15. Escartín, E.F. 2000. Vibrio cholerae. En: Microbiología e inocuidad de los alimentos. Universidad Autónoma de Querétaro, México. 16. Black, R.E. 1986. Cholera: En Last, J.M. (ed). Public Healt and preventive Medicine. 12th ed. Appleton-Century-Crofts. 17. Mhalu, F.S.; Mtango, F.D.E.; Msengi, A.E. 1984. Hospital outbreaks of cholera transmitted through close person-to-person contact. Lancet. 2:82-84. 18. St-Louis, M.E.; Porter, J.D.; Helal, A.; Drame, K.; HargrettBean, N.; Well, J.G.; Tauxe, R.V. 1990. Epidemic cholera in west Africa: the role of food handling and high-risk food. Am.J.Epidemiol. 131: 719-728. 19. Feachem, R.G.; Miller, C.; Drasar, B. 1981. Environmental aspects of cholera epidemiology II. Occurrence and survival of Vibrio cholerae in the environment. Trop. Dis. Bull. 78: 865880. 20. McCarthy, S.A. 1996. Effects of temperature and salinity on survival of toxigenic Vibrio cholerae O1 in seawater. Microbiol. Ecol. 31:167-175. 21. Blake, P.A.; Rosenberg, M.L.; Florencia, J.; Bandeira, C.J.; Prado, Q.L.; Gangarosa, E.J. 1977. Cholera in Portugal, 1974. II Transmission by bottled mineral water. Amer.J. Epidemiol. 105: 344-348. 22. Pollitzer, R. 1957. Cholera studies. Bull. W.H.O. 16:738-857. 23. Miyaki, K.; Iwahara, S.; Sato, K.; Fujimoto, S.; Aibara, K. 1967. Basic studies on the viability of El Tor vibrios. Bull. W.H.O. 37: 773-775. 24. Reily, L.A.; Hackney, C.R. 1985. Survival of Vibrio cholera during cold storage artificially contaminated seafood. J. Food Sci. 50: 838-842. 173 25. Guthie, R.K.; Makukutu, C.A.; Gibson, R.W. 1985. Recovery of Vibrio cholerae O1 after heating and/or cooling. Dairy Food Sanit. 5: 427-430. 26. Makukutu, C.A.; Guthie, R.K. 1986. Behavior of Vibrio cholera in hot foods. Appl. Environ. Microbiol. 52: 824-827. 27. Baine, W.B.; Mazzoti, M.; Greco, D.; Jazzo, E.; Zampieri, A.; Angioni, G.; Digrola, M.; Gangarosa, E.J.; Pochiari, F. 1974. Epidemiology of cholera in Italy in 1973. Lancet. 1: 17301736. 28. Blake, P.A.; Allegra, D.T.; Snyder, J.D.; Barrett, T.J.; McFarland, L.; Caraway, C.T.; Feeley, J. C.; Craig, J.P.; Lee, J.V.; Puhr, N.D.; Feldman, R.A. 1980. Cholera a possible endemic focus in the United States. N. Engl. J. Med. 302: 305-309. 29. Castro-Rosas, J.; Escartín, E.F. 2000. Survival and growth of Vibrio cholerae O1, Salmonella typhi and Escherichia coli O157:H7 in alfalfa sprout. J. Food Sci. 65: 162-165. 30. Swerdlow, D. L.; Mintz,E. D.; Rodríguez, M.; Tejada, E.; Ocampo, C.; Espejo, L.; Greene, K. D.; Saldana, W.; Tauxe, R. V.; Well, J. G.; Bean, N. H.; Ries, A. A.; Pollack, M.; Vertiz, B.; Blake, P. A. 1992. Waterborn transmission of epidemic cholera in Trujillo, Peru: Lessons for a continent at risk. Lancet. 340: 28-32. 31. Baumann, P.; Shubert,H.W. 1984. Family II. Vibrionaceae Veron 1965, 5245 (AL), En: Krieg NR (de.) Bergey’s Manual of Systematic Bacteriology, Volumen 1, William and Wilkins, Baltimore. 516-550. 32. Ravel, J.; Knigt, T.I.; Monahan, E.C.; Hill, T.R.; Colwell, R.R.1995. Temperature-induced recovery of Vibrio cholerae from the viable but nonculturable state: growth or resuscitation?. Microb. 141: 337-343. 33. Rogers, R.; Cuffe, R.; Cossins, Y. 1980. The Queensland cholera incident of 1977; II the epidemiological investigation. Bull. World Health Org. 58: 665-669. 34. Bourque, A.; Cossins, Y.; Gray, B. 1986. Investigation of cholera acquired from de riverine environment in Queensland. Med. J. Austr. 144: 229-234. 174 35. Mooi, F.R.; Bik, E.M. 1997.The evolution of epidemic Vibrio cholerae strains. Trens Microbiol. 5: 161-165. 36. Anónimo. 1975. Diagnóstico de laboratorio de cólera. Boletin OPS. Organización Panamericana de Salud. 78: 161-171. 37. Stroeher, U.H.; Karageorgos, L.E.; Morona, R.; Manning, P.A. 1992. Serotype conversion in Vibrio cholerae O1. Proc. Natl. Acad. Sci. USA. 89: 2566-2570. 38. Kayser, C.A.; Tamplin, M.L.; Twedt, R.M. 1992. Vibrio. In Vanderzant, C. and Splitstoesser, D.F. (Eds.). Compendium of methods for the Microbiological Examination of Foods. 3h Edition. APHA. Washington, DC. 39. Mukerjeer, S. 1978. Principles and practices of typing Vibrio cholerae. In: Bergan. T. and Morris, J.R. (eds). Methods in microbiology. New York: Academic Press. 40. Waschsmuth, K.I.; Boop, C.A.; Fields, P.I. 1991. Difference between toxigenic Vibrio cholerae O1 from South America and US Gulf coast. Lancet. 337: 1097-1098. 41. Filkenstein, R.A. 1973. Cholera. CRC. Crit. Rev. Microbiol. 2: 553-623. 42. Waldor M.K.; Mekalanos J. J. 1996. Lysogenic conversion by a filamentous phage encoding cholera toxin. Science. 272:1910–1914. 43. Oliver, J.D.; Kaper, J.B. 1997. Vibrio species: 228-264. In Food microbiology. Fundamentals and Frontiers. Doyle, M.P., Beuchat, L.R. and Montville, T.J. (Eds). ASM Press, Washington, DC. 44. Levine, M.M.; Kaper, J.B.; Black, R.E.; Clements, M.L. 1983. New knowledge on pathogenesis of bacterial enteric infections as applied to vaccine development. Microbiol. Rev. 47: 510-550. 45. Kaufman, M.R.; Taylor, R.K. 1994. The toxin-coregulated pilus: Biogenesis and fuction. In: Wachsmuth, I.K., Blake, P.A. and Olsvik, O. (Eds). Vibrio cholerae and Cholera; Molecular to global perspectives. Am. Soc. Microbiol., U.S.A. 46. Holmgren, J.; Svennerholm, A.M. 1977. Mechanisms of disease and immunity in cholera, a review. J. Infec. Dis. 138: 105-108. 175 47. Buchanan, R.L.1990. HAPCC: A re-emerging approach to food safety. Trends Food Sci. Technol. 1(5): 104-106. 47. IAMFES. 1991. Procedures to Implement the Hazard Analisis Critical Control Point System. International Association of Milk, Food and Environmetal Sanitarians, Inc. Iowa. USA. 48. Huq, A.; Colwell, R.R. 1996. A microbiological paradox: viable but nonculturable bacteria with special reference to Vibrio cholerae. J. Food Prot. 59: 96-101. 49. Heidelberg.J.F.; Eisen, J.A.; Nelson, W.C.; Clayton, R.A.; Gwinn, M.L.; Dodson, R.J.; Haft, D.H.; Hickey, E.K.; Peterson, J.D.; Umayam, L.; Gill, S.R.; Nelson, K.E.; Read, T.D.; Tettelin, H.; Richardson, D.; Ermolaeva, M.D.; Vamathevan, J., Bass, S.; Qin, H.; Dragoi I.; Sellers, P.; McDonald, L.; Utterback, T.; Fleishmann, R.D.; Nierman, W.C.; White O.; Saizberg, S.L.; Smith, H.O.; Colwell, R.R.; Mekalanos, J.J.; Venter, J.C.; Fraser, C.M. 2000. DNA sequence of both chromosomes of the cholera pathogen Vibrio cholerae. Nature. 406: 477-483. 50. Anónimo. 1980a. Cholera and other vibrios associated with diarroheas. Bull. W.H.O. 58: 353-374. 51. Bean N.H.; Griffin PM. 1990. Foodborne disease outbreaks in the United States, 1973–1987: pathogens, vehicles and trends. Journal of Food Protection. 53: 804–16. 52. Castro Rosas J. 1997. Factores que afectan la viabilidad de Vibrio choleare O1 en algunos materiales plásticos. Tesis de licenciatura. Benemérita Universidad Autónoma de Puebla. 53. Maldonado Estrella E; Paleta Guadarrama C. 1998. Evaluación de riesgos microbianos (Escherichia coli enterotoxigénica y Vibrio cholerae) en la preparación de jícama y papayas cortadas. Carrera de Licenciado en Nutrición, Facultad de Ciencias Naturales. 54. Moreno Sánchez, F.; Torres Lozano, M. 1994. Efecto de la temperatura y cloruro de sodio en la sobrevivencia y desarrollo de cepas de Vibrio cholerae aisladas en el país. Carrera de Químico en Alimentos. Facultad de Química. 55. Guthie, R.K.; Makukutu, C.A.; Gibson, R.W. 1985. Recovery 176 of Vibrio cholerae O1 after heating and/or cooling. Dairy Food Sanit. 5: 427-430. 56. Anónimo. 1991. Riesgos de transmisión del cólera por los alimentos. Organización Panamericana de la Salud, Oficina Regional de la Organización Mundial de la Salud. Washington, D.C. 57. Fernández-Escartín, E. 1996. Survival of Vibrio Cholerae O1 on plastic materials. Internat. J. Food Microbiol. 31:197-204. 58. Castro-Rosas, J. and E. F. Escartín. 1999. Incidence and germicide sensitivity of Salmonella typhi and Vibrio cholerae O1 in alfalfa sprouts. J. Food Safety. 19:137-146. 177 PRODUCCIÓN DE ALIMENTOS VEGETALES EN LA AGROINDUSTRIA ALIMENTARIA: UNA PERSPECTIVA SOCIOCULTURAL Hernández–Martínez V.a, López–Molina A.a*, Aguilar–Arteaga K.a, Sánchez–Herrera S.G.a, Díaz–Batalla L.a aIngeniería Agroindustrial/ Biotecnología Agroindustrial Sustentable, Universidad Politécnica de Francisco I. Madero. Domicilio Conocido, Tepatepec, Hgo., México. CP 42660. Tel. 01 738 724 1174, ext 168 e–mail: [email protected] Resumen El presente escrito busca contribuir al estudio de la desnutrición de la población vulnerable y en exclusión social, para ello, hace un breve recuento de las diversas perspectivas desde las cuales se ha abordado la desnutrición, las necesidades nutrimentales mínimas necesarias para que se considera nutrición aceptable. Posteriormente se hace una presentación de las diversidad biológica y étnica de nuestro país, relacionándola con la calidad nutrimental de la población tanto de México como del Estado de Hidalgo. Se presenta una propuesta de abordaje de la problemática de la desnutrición, a partir del contexto sociocultural de la población vulnerable, reconociendo que la agroindustria alimentaria puede tener un papel preponderante en la producción de alimentos que respondan a las necesidades de la población y su contexto. Palabras clave: desnutrición, población vulnerable, contexto sociocultural. Introducción La desnutrición o mal nutrición es un problema multifactorial, que afecta a gran parte de la población mexicana, dicho fenómeno ha venido acentuándose en las últimas décadas [1]. siendo las poblaciones indígenas, rurales y migrantes de las grandes urbes las más vulnerables; su abordaje se ha dado desde las más 178 diversas disciplinas, pasando por el enfoque de la salud, el económico y el social, todos ellos buscando contribuir en la resolución de dicha problemática, si bien se han realizado esfuerzos en el combate de la desnutrición y malnutrición, estos no han logrado impactar eficazmente en la calidad nutrimental de la población, a pesar de que los programas gubernamentales que se han desarrollado para su combate incluyen alimentos que pretenden tener la calidad y cantidad calórica y proteica mínima necesaria para considerarse dentro de los parámetros mínimos aceptables, que según algunos estudios deben de ser de 2071 kcal y 63 gr de proteína al día [2]. Los esfuerzos realizados en el campo de la investigación alimentaria, han buscado diversas opciones para mitigar la desnutrición, el reino vegetal ha sido el más explorado, las investigaciones han arrojado que la soya (Glycine max) contiene un alto valor proteico por encima de las grasas y carbohidratos, por ello es una de las plantas más recurridas dentro de los programas gubernamentales. Si bien es ampliamente conocido su alto valor nutritivo, al ser un alimento de reciente introducción en la dieta de la población mexicana, su consumo es todavía mínimo si se considera a todo el territorio nacional, de tal manera que este alimento ha llegado a las poblaciones con altos índices de desnutrición a través de las despensas alimentarias que el gobierno reparte en sus diversos programas como cocinas comunitarias, y “70 y más”. Como consecuencia de ello, la soya no es consumida por la población destinataria de dichos programas y es frecuente que sea desechada o utilizada para alimentar a los animales domésticos, a partir de esto es necesario y urgente plantear otros escenarios, que permitan dar una respuesta al reto de proporcionar a la población de nuestro país alimentos que cubran las necesidades mínimas calóricas y proteicas, sin alejarse de su contexto sociocultural. En este sentido este trabajo plantea la necesidad de realizar investigaciones con perspectiva sociocultural que contribuyan a mejorar la calidad nutrimental de las poblaciones antes mencionadas. Desde este punto de vista, la agroindustria alimentaria tiene un papel preponderante, ya que es la disciplina 179 encargada de la transformación de las materias primas en productos con valor agregado, entendiéndose esto último no solamente como algo tangible, es decir, en sabor, color, olor, textura, sino en alimentos socialmente significativos e identitarios. Para ello este trabajo hace un recuento de los principales alimentos vegetales utilizados en México, para después centrar su atención en el Estado de Hidalgo, todo ello para enmarcar los niveles de desnutrición que se presentan en nuestro territorio. Finalmente, se hace una propuesta para su abordaje y posible resolución. Los alimentos vegetales en México Desde su aparición en la Tierra, la especie humana ha interaccionado con su ambiente, desde tiempos inmemoriales las personas se han servido de los elementos de la naturaleza y en particular de las plantas [3]. El reino vegetal en México es de la mayor importancia, es utilizada para la construcción de vivienda, como ornamental, como medicinal y como fuente de alimento, se calcula que en nuestro país existen más de 200 especies vegetales para uso comestible [4], esto como consecuencia de los diversos tipos de vegetación existentes en nuestro país [5]. Como es sabido gran parte del territorio mexicano tiene como base de su alimentación al maíz, frijol, calabaza y chile, aunque junto a estas existen otras especies que son consumidas por las poblaciones locales, uno de ellos son los quelites, ésta es una categoría que engloba a diversas especies vegetales como los quintoniles (Amaranthus spp.), verdolagas (Portulaca oleracea), papaloquelite (Porophyllum ruderale) y huauzontles (chenopodium sp.), entre muchas otras. Es importante mencionar que en algunas poblaciones se denomina quelite a una sola especie, aunque desde el punto de vista etimológico y de categorización del pueblo nahua, se refiere a la categoría ya mencionada. Por definición los quelites son aquellas plantas cuyas hojas, tallos tiernos y en ocasiones las inflorescencias inmaduras, son consumidas como verdura [4]. Si bien el vocablo quelite proviene del 180 nauatl quilitl o kilitl, su importancia es tal que varios pueblos lo consideran dentro de su cultura culinaria, así, esta categoría se conoce como kaka para el pueblo totonaco, yiwa o yube para el pueblo Ñu savi (mixteco) xakua para el purépecha, guilibá para los rarámuris (tarahumaras), bok itah para los tzeltales, itaj para los tsotsiles y k´ani para el pueblo ñhähñu (ídem). Esta es solo una de las manifestaciones de conocimiento de su entorno que los diferentes pueblos y culturas asentados en el territorio nacional, este conocimiento no es estático, muestra de ello es que algunas plantas traídas de otros continentes, ahora son considerados dentro de esta categoría. El Estado de Hidalgo El Estado de Hidalgo no es ajeno a la diversidad, ya que en su territorio la riqueza culinaria es basta, ejemplo de ello son los diversos platillos consumidos en la región del Valle del Mezquital, la Sierra otomí–tepehua y la región huasteca; en estas tres regiones, los recursos alimenticios reflejan el conocimiento que de su medio tienen las poblaciones asentadas en estos territorios, como consecuencia de la interrelación de los diversos tipos de vegetación existentes en el estado: bosque de coníferas, bosque mixto, matorral xerófilo, bosque mesófilo de montaña y bosque o selva tropical y los pueblos ñhähñu, tepehua y nahua. Es importante mencionar que este mosaico culinario, no solamente engloba a los pueblos indígenas asentados en territorio hidalguense, sino también considera aquellas aportaciones traídas por otras sociedades como la incorporación de la cebolla, el ajo y varias especias que son distintivas de la cocina ibérica y más tarde la llegada de la cocina inglesa, cuyo ejemplo más significativo son los pastes. De tal manera que la conjunción de todos estos elementos han dado lugar a la riqueza culinaria que actualmente tiene en el estado de Hidalgo como la segunda del país, sólo superado por el Estado de Oaxaca. Paradójicamente, esta gran diversidad culinaria no parece tener una correlación directa con la calidad nutricional de la población, sobre todo de aquella que se encuentra en pobreza, 181 pobreza extrema y exclusión social, que en muchos de los casos incluye a los pueblos indígenas, algunos estudios realizados muestran que las poblaciones asentadas en territorio hidalguense tienen una capacidad calórica por debajo de los estándares recomendados de 2071 kcal y 63 gr por día [2], esto significa que su dieta tiene deficiencias nutrimentales, aunado a esto, la globalización y fenómenos sociales como la migración han cambiado en los últimos años, lo que ha impactado significativamente en el régimen alimenticio, sobre todo por la entrada de productos con bajo contenido calórico como la llamada “comida chatarra”. Algunos estudios muestran de los refrescos de cola, que la combinación de ácido fosfórico con azúcar refinada y fructuosa dificulta la absorción de hierro en el organismo, lo que puede generar anemia, estos efectos se agudizan en niños, adultos mayores y mujeres embarazadas [6]. A consecuencia de esto, la política pública en materia de salud ha emprendido una serie de programas con el objetivo de aminorar la tasa de desnutrición, sobre todo en los estratos de población ya mencionados, sin embargo, estos esfuerzos no han tenido el impacto esperado y por tanto las condiciones nutrimentales de esta población siguen en condiciones similares. Una de las constantes en este tipo de proyectos es el uso de elementos que si bien tienen un alto contenido proteico, su consumo es escaso o nulo, sobre todo por parte de la población indígena, es común que los elementos no conocidos sean desechados o en el mejor de los casos consumidos por animales domésticos, quedando coartado, el objetivo perseguido. Bajo este panorama se visualizan dos rutas: la insistencia de consumo de alimentos con alto valor nutricional, pero ajenos a la cultura o la búsqueda de alternativas que ofrezcan alimentos con alto valor nutrimental, pero con apego y pertinencia cultural. El papel de la agroindustria en el problema de la desnutrición: una propuesta de abordaje La agroindustria alimentaria no es la única disciplina encargada de realizar investigación y plantear posibles escenarios 182 para la resolución de la problemática nutricional, es una área que puede coadyuvar en su abordaje, sobre todo si se toman en consideración los diversos escenarios socioculturales; para ello es necesaria la conformación de equipos interdisciplinarios, que en términos de Follari, se construye con base en elementos (categorías, leyes, teoría, métodos, etc.) preexistentes en disciplinas separadas y aún en especializaciones de éstas [7]. De tal manera que su abordaje sea desde una perspectiva holística. Si bien la principal función de los alimentos es cubrir las necesidades calóricas y proteicas que el cuerpo necesita para su funcionamiento es necesario tomar en consideración las variables sociales y cosmogónicas, que en la mayoría de los casos se manifiestan en prácticas culturales de la alimentación. Ejemplo de esto es la relación que mantienen las culturas de origen mesoamericano con el maíz, si bien es su principal alimento, este no solamente tiene esta acepción sino también como medicina y deidad [8], [9]. Además de ser el referente cultural por excelencia en nuestro territorio [10], e incluso como parte fundamental de una dimensión ético–político [11], que está relacionada con sistemas de producción, en donde la tecnología tiene un papel preponderante, como el caso del maíz transgénico. Como puede observarse, el abordaje de la alimentación no puede ser revisada desde una sola perspectiva, más aún cuando se trata de alimentos que dan sentido y pertinencia social a poblaciones y culturas, como es el caso del territorio mexicano. Esto no es exclusivo de México, así, las poblaciones en las que no tienen como base al maíz, no significa que su alimentación no esté ligado a una cosmovisión. Por ello realizar proyectos de investigación en la agroindustria alimentaria, que consideren el contexto y la cultura en la que se encuentra inmersa la población meta, es de suma importancia. Cambiar la cultura culinaria tiene sentido para una cosmovisión, requiere de una mayor complejidad, porque implica sensibilizar a la población en cuanto a las bondades nutrimentales de los alimentos propuestos, a expensas de que el apego cultural con los alimentos tradicionales sean mayores a los nuevos alimentos. 183 Discusión Realizar investigaciones en materia alimentaria, sobre todo para aquellas poblaciones vulnerables, es complejo, sobre todo si se toman en cuenta que a su alrededor se han construido ideas preconcebidas, basadas en el hecho de correlacionar la pobreza económica, con la pobreza cultural y por ende la alimentaria, acentuándose en poblaciones indígenas y rurales. De tal manera que la conclusión de esta correlación es en una doble ecuación; por un lado, la pobreza económica=a pobreza cultural, dentro de esta concepción el consumo de alimentos locales como quelites y frijoles se relaciona con una incapacidad para adquirir alimentos de la Canasta normativa alimentaria (cna) y por otro lado los sectores poblacionales que sí tienen la capacidad económica de adquirir los productos de la cna, consideran que los quelites y frijoles sinónimo de pobreza; con ello se refuerza la primera parte de la ecuación. La segunda parte está situada dentro de la misma población vulnerable, que ha dejado de consumir los alimentos locales, como parte de una estrategia para no ser considerado en el círculo de la pobreza. Esto último es reforzado por el fenómeno migratorio, que impacta directamente en dichas poblaciones. Algunas investigaciones se han realizado bajo el primer supuesto, que posteriormente se han puesto en marcha como política pública. Si bien se tienen las bases teórico–metodológicas para sustentar su aplicación sobre todo en la relación calórico– proteico. Como el caso de la soya, donde no han habido hasta el momento investigaciones que consideren su papel social y cultural de la alimentación. Sin embargo, es necesario insistir en el abordaje de la nutrición desde una perspectiva sociocultural, no solamente con el objetivo de combatir los altos índices de desnutrición, sino como un acto de justicia hacia la población vulnerable y excluida socialmente. Conclusiones El territorio nacional es considerado biodiverso, multicultural y multilingüe, por su riqueza biológica y étnica; sin embargo, 184 en términos nutrimentales, gran parte de la población originaria tiene una deficiencia en su capacidad calórica y proteica. La misma situación se presenta en el Estado de Hidalgo. Las acciones que hasta el momento se han realizado no han impactado significativamente, por ello es urgente hacer una reformulación de las políticas públicas y las investigaciones que les anteceden, tomando en consideración las características particulares de la población destinataria, logrando con ello incidir de manera más eficaz en los índices de desnutrición. Bajo este esquema, la agroindustria alimentaria tiene un área de oportunidad para desarrollar proyectos con pertinencia social y cultural que contribuyan a mejorar las condiciones de alimentación de la población, haciendo una correlación positiva entre academia y sociedad. Bibliografía 1. Contreras, E. 2009. Tala para la edad en escolares indígenas mexicanos 1994 -1999 un enfoque geoestadístico municipal. En: Balance y perspectivas del campo mexicano: a más de una década del TLCAN y del movimiento zapatista. Tomo V viejas y nuevas problemáticas en torno al género, la etnia y la edad. Vizcarra I. (coordinadora) Asociación Mexicana de estudios rurales, CONACYT, H. Cámara de diputados XL legislatura. México. D.F. 2. Torres, F. 2002. Aspectos regionales de la seguridad alimentaria en México. Revista Notas de Información y Análisis. 22. 3. Vallés J. 2012. Plantes alimentaries del Pirineu Catala, Llibres de Muntanya. 24. Farell Editores. Barcelona, España. 4. Castro, D. 2011. Los quelites, una tradición milenaria en México. Universidad Autónoma Chapingo. Chapingo, Texcoco, Estado de México. 5. Rzedowski, J. 2001. Flora fanerogámica del valle de México. Instituto de Ecología A.C. Xalapa, Veracruz, México. 6. González L. y Hersch, P. 2008. Alimentación y cultura Nahuas de Guerrero. Tlacuallihuan huehuemexicayotl mo Guerrero. Secretaría de Salud del Estado de Guerrero. Instituto 185 Nacional de Antropología e Historia. México. 7. Follari, R. 1999. La interdisciplina en la educación ambiental. Revista Tópicos en Educación Ambiental. 2. 8. López, A. 1984. Cuerpo humano e ideología Vol. 1. Las concepciones de los antiguos nahuas. Universidad Nacional Autónoma de México. México. D.F. 9. Hernández V. Etnobotánica de los recursos herbolarios de los nauas de Atlapexco, Hidalgo. Tesis de Maestría. Facultad de Ciencias. Universidad Nacional Autónoma de México. 10. Barros, C. Maíz, alimentación y cultura. Revista Ciencias 92-93 Octubre 2008 – Marzo 2009. Facultad de Ciencias. Universidad Nacional Autónoma de México. 11. Olivé, L. El maíz en México problemas ético – políticos. Revista Ciencias. 92-93. 186 Seguridad de Procesos en la Agroindustria López–Molina A.a*, Hernández–Martínez V.a, Aguilar–Arteaga K.a, Sánchez–Herrera S.G.a, Díaz–Batalla L.a aIngeniería Agroindustrial/ Biotecnología Agroindustrial Sustentable, Universidad Politécnica de Francisco I. Madero. Domicilio Conocido, Tepatepec, Hgo., México. CP. 42660. Tel. 01 738 724 1174, e–mail: [email protected] Resumen Este trabajo presenta una introducción a la seguridad de procesos, así como los lineamientos de seguridad inherente. Se realizó una revisión bibliográfica sobre los tipos de accidentes en la agroindustria y se discute las potenciales aplicaciones de seguridad de procesos para mejorarla. Finalmente, se presentan algunos casos históricos de accidentes para concientizar a los lectores sobre la importancia de la seguridad de procesos agroindustriales. Palabras alimentaria. clave: Seguridad agroindustrial, industria Introducción La agroindustria implica la combinación de dos procesos productivos, el agrícola y el industrial, para transformar de manera eficiente y rentable los productos provenientes del campo; siendo los procesos alimentarios los más importantes [1]. En México, el sector agroalimentario es muy importante, su aportación al Producto Interno Bruto (pib) es del 12%. Así mismo la agroindustria es uno de los principales empleadores del país, con una aportación al empleo de más de seis millones de personas [2]. Por otro lado, la seguridad para los trabajadores y la población relacionada a esta industria, en general, no ha sido atendida con la seriedad que se requiere, debido a que se tiene el concepto erróneo de que en esta industria no se maneja sustancias peligrosas. Sin embargo, las estadísticas indican que sufrir una lesión e incluso 187 perder la vida, es más probable para los trabajadores de la industria agrícola que para los trabajadores de una planta química [3]. Si bien es cierto, la mayor parte de los fallecimientos se debe a accidentes en el transporte (42.2%) y al contacto con objetos y equipos (17%), también ocurren fallecimientos ocasionados por explosiones, incendios o exposición a sustancias tóxicas (4.0%). Los costos asociados a las lesiones y muertes en el año 2011 sumaron 188.9 billones de dólares [4]. Con esto queda claro que la seguridad no afecta únicamente a los trabajadores, la empresa pierde la confianza de sus clientes y pierde grandes sumas de dinero en el pago de indemnizaciones y primas de seguro, de ahí la importancia de prevenir y disminuir la probabilidad de accidentes en la agroindustria. Seguridad de procesos La seguridad de procesos surgió en la industria química, sus orígenes se remontan al principios de siglo xix, cuando la empresa DuPont manufacturaba pólvora. Reconociendo que un pequeño incidente podría ocasionar un daño considerable e incluso la pérdida de la vida, DuPont dirigió las obras a ser construidas y operadas en condiciones de seguridad específicas. La seguridad de procesos continúo desarrollándose con la industria a través del siglo xix y xx, pero emergió como disciplina en todas las industrias después del grave accidente de Bhopal, India, en 1984, donde una fuga de isocianato de metilo provoco la muerte de más de 3,000 personas [5]. El objetivo de la seguridad de procesos es identificar, evaluar y prevenir los accidentes mayores; principalmente, aquellos relacionados con sustancias inflamables y tóxicas [6]. Seguridad inherente La seguridad inherente es una herramienta muy eficiente para prevenir accidentes industriales, fue propuesta por el Dr. Trevor Kletz [7]. La seguridad inherente para el diseño de plantas intenta evitar peligros en lugar de controlarlos mediante la adición de quipos de protección. Esto implica mejorar los procesos des188 de las primeras etapas del diseño [8]. Se basa en 4 lineamientos principales minimización, sustitución, moderación y simplificación. La minimización está dirigido a la reducción del inventario dentro de un solo equipo o conjunto de equipos. La cantidad de material peligroso representa un parámetro determinante en la estimación de consecuencias de un accidente (explosiones o incendios), la minimización reduce significativamente los peligros del proceso. La sustitución se refiere al uso de materiales más seguros en lugar de los peligrosos. Con ello, es posible remplazar refrigerantes y medios de transferencia de calor inflamables por unos no inflamables, solventes tóxicos por otros más seguros. La moderación se refiere a usar condiciones de operación menos extremas (altas temperaturas y presión). La moderación pude reducir significativamente la posibilidad de que ocurra un accidente y que se propague a equipos cercanos. La simplificación tiene como objetivo diseñar instalaciones eliminando complejidades incensarías y hacer que los errores operativos sean menos probables. Las plantas más simples son más seguras que las plantas complejas, debido a que reduce la probabilidad de errores y la falla de equipos. Además, las plantas simples son más económicas. Accidentes en la agroindustria De acuerdo al último reporte de la HSE (Health and Safety Executive por sus siglas en inglés) entre 2011 y 2012 se reportaron más de 4,700 lesionados en la industria alimentaria, 83% de estos trabajadores tuvieron que ausentarse por tres días a su trabajo y 17% tuvo daños mayores. Por desgracia, hubieron varias lesiones fatales [9]. El número de lesionados varia significativamente entre las empresas alimentarias, siendo la industria procesadora de aves de corral la que presenta un mayor número de lesionados, cerca de 2800 por cada 100,000 trabajadores del sector, mientras que la industria de los alimentos dietéticos es la que presenta menor número de lesiones, 30 por cada 100,000 trabajadores (ver fig. 1). Entre el 2000 y 2012 hubo 53 fatalidades en las industrias de manufactura de bebidas y alimentos. Estas fatalidades involucran el uso de maquinaria (38%), transporte 189 al lugar de trabajo (25%), caídas desde lugares altos (15%), asfixia en espacios confinados (11%), golpeados por un objeto (8%), muerte por ataque de animales (2%) y electrocutados (2%) [10]. Entre las principales causas de lesión que no ocasionaron fatalidades, la manipulación manual y resbalones representan el 50% de lesiones. A pesar de que otros accidentes, como caída desde alturas (6%) o golpes por un objeto en movimiento (13%), tienen menor porcentaje las lesiones por tales cuestiones a menudo causan lesiones más severas [9]. Fig. 14 A. Comparación de lesiones entre diferentes industrias de alimentos Entre el 2000 y 2014 se han registrado 24 accidentes mayores en las industrias procesadoras de alimentos, los cuales causaron la muerte de 13 personas y 20 lesionados. El accidente más frecuente son las emisiones tóxicas, seguido de las explosiones e incendios. En ocasiones ocurre más de un accidente, dándose la combinación explosión–incendio e inclusos explosión–incendio– emisión, cabe mencionar que estas emisiones no siempre son tóxicas (ver fig. 2.). Los accidentes ocurren con mayor frecuencia en países desarrollados (87.5%), mientras que en países en desarrollo la incidencia es menor (12.5%). Esto no implica que no ocurran accidentes en los países en desarrollo, probablemente 190 se debe a que los países desarrollados tiene una registro de todos los accidentes ocurridos en su territorio, mientras que en los países en desarrollo no se cuenta con instituciones ni sistemas para capturar esa información, además del número de empresas instaladas en el país. A pesar de que la ocurrencia de accidentes en los países en desarrollo es menor, el número de muertos es mayor (61.5%) comparado con los países desarrollados (38.5%), esto indica la falta de cultura y capacitación de los trabajadores con respecto a la seguridad [11]. Las sustancias involucradas, en accidentes mayores, son el amoniaco en 73.3% de los casos, Etanol en 13.3%, Propano y Metano, ambos con 6.7%. Fig.14 B. Accidentes mayores en la industria alimentaria. Ejemplo de accidente mayor Se considera un accidente mayor cuando se presenta una explosión, un incendio o la emisión de un gas tóxico. Estos tres accidentes son los más comunes en la industria química, debido a la naturaleza de las sustancias con que se trabaja. Por otro lado, se podría pensar que en la industria alimentaria la cantidad de sustancias con características inflamables y tóxicas son pocas. Probablemente se deba a que el concepto de inflamable se asocia fácilmente a sustancias en estado líquido o gaseoso, como el alcohol o gas butano; pocas veces se considera a un polvo como inflamable y mucho menos como explosivo. Sin embargo, 191 sustancias como la leche en polvo, azúcar, harinas, entre otros, poseen un gran poder calorífico y área superficial pequeña, lo que facilita su ignición. Muchos de estos polvos han ocasionado explosiones muy violentas llamadas dust explosions (explosiones de polvos, por su traducción del inglés) [12]. Una larga lista de lugares donde se han presentado este tipo de explosiones con el número de fallecidos y lesionados puede ser consultada en la bibliografía [13]. En la mayoría de estas explosiones están involucrados polvos de diferentes alimentos, granos, harinas, azúcar y leche, principalmente [12–14]. Una de estas explosiones sucedió en el estado de Georgia, Estados Unidos de Norte América, el siete de febrero de 2008, en la compañía de azúcar Imperial. En este accidente 14 trabajadores perdieron la vida, 8 de manera instantánea y seis sucumbieron días después como resultado de las lesiones, 42 resultaron lesionados, algunos con lesiones permanentes. El incidente comenzó con una explosión en los silos de almacenamiento de azúcar, la cual provoco varias explosiones e incendios posteriores, destruyendo los edificios de empacado, silos, parte del proceso de refinación y la zona de carga [15]. Otro evento lamentable sucedió en una instalación de almacenamiento de grano en Haysville, Kansas, 1998, donde una explosión de polvos causó la muerte de siete personas, y la onda expansiva dejó lesionados a diez trabajadores. La instalación donde ocurrió este accidente era una de las más grandes en el mundo, contenía 246 silos de concreto con una altura de 9.1 m y un diámetro de 36.6 m, tenía la capacidad de almacenar 246,400 m3. El accidente comenzó en el elevador de granos, donde una fuente de ignición desconocida incendio el polvo causando una serie de explosiones. Detalles más precisos de cómo sucedió el accidente no pudieron ser recolectado, debido a que los trabajadores presentes en el área murieron, [16]. 192 Discusión Como fue presentado, dentro de la agroindustria existe una alta probabilidad de accidentes. Los accidentes mayores más frecuentes son las emisiones de gases tóxicos, explosiones de polvos e incendios. Es necesario desarrollar estrategias que nos ayuden a prevenirlos o minimizar sus consecuencias. La seguridad de procesos es la herramienta para alcanzar este propósito, la seguridad de procesos es diferente a lo que se conoce como seguridad e higiene y no debemos confundirla. En México, no existe aún una cultura adecuada con respecto a la seguridad de los procesos. Sin embargo, se han presentado señales de cambio, debido a la influencia de países como Estados Unidos de América, Alemania, Japón, entre otros; los cuales, han impulsado fuertemente la cultura de seguridad en las industrias de procesos, para garantizar la integridad de los trabajadores. Aún falta investigación por hacerse con respecto a las explosiones de polvo y el trabajo en espacios confinados. Nuestro cuerpo académico estará trabajando en la prevención de estos accidentes, mediante el análisis de consecuencias, la optimización de la ubicación de equipos de proceso, la estimación del riesgo y el diseño basado en seguridad inherente. Bibliografía 1. fao. 2009. Agro-Industries for Development. CAB International. Roma. p. 46-47. 2. inegi. 2014. pib-Actividad de los Bienes y Servicios. http://www.inegi.org.mx/est/contenidos/proyectos/cn/bs/. 3. Crowl, D.A.; J.F. Louvar. Chemical process safety : fundamentals with applications. 2011. 3ra ed. Upper Saddle River, NJ. Prentice Hall. 4. NSC. 2013. Accident Facts. 2013. National Safety Council. 5. CCPS. 2012. Process Safety FAQs. http://www.aiche.org/ccps/about/process-safety-faqs. 6. CCPS. 2007. Guidelines for chemical process quantitative risk analysis. USA. Center for Chemical Process Safety, Wiley. 7. Kletz, T.A. 1985. “Inherently Safer Plants”. Plant/Operations 193 Progress, AIChE. 4(3):164. 8. Kletz, T.; Amyotte, P. 2010. Process Plants: A Handbook for Inherently Safer Design. Second ed. CRC Press Taylor & Francis Group. 9. HSE. 2013. Injury statistics. http://www.hse.gov.uk/food/statistics.htm. 10. HSE. 2013. Causes of fatal injury. http://www.hse.gov.uk./ food/fatal.htm. 11. Tauseef, S.M.; Abbasi, T; Abbasi, S.A. 2011. “Development of a new chemical process-industry accident database to assist in past accident analysis”. Journal of Loss Prevention in the Process Industries. 24(4): 426-431. 12. Eckhoff, R.K. 2003. Dust explosions in the process industries, Third Edition. Gulf Professional Pub. 13. Abbasi, T.; Abbasi, S.A. 2007. “Dust explosions-Cases, causes, consequences, and control”. Journal of Hazardous Materials. 140:7-44. 14. Eckhoff, R.K. 2005. “Current status and expected future trends in dust explosion research”. Journal of Loss Prevention in the Process Industries. 18(4-6):225-237. 15. CSB. 2009. Sugar Dust Explosion and Fire: Imperial Sugar Company. U.S. Chemical Safety and Hazard Investigation Board. 16. nfpa. 1999. Fire Investigation Summary Grain Elevator Explosion Haysville, Kansas June 8. National Fire Protection Association 194 EVALUACIÓN FARMACOLÓGICA DEL ALCALOIDE ERISODINA Sánchez– Herrera S.G.1*,, Noguez–Estrada J1, Rodríguez– Martínez N.1, Díaz–Batalla L1, Soto–Hernández M.R., Garín–Aguilar M.E *Ingenieria Agroindustrial/ Cuerpo Académico de Biotecnología Agroindustrial Sustentable, Universidad Politécnica de Francisco I. Madero. Domicilio Conocido, Tepatepec Francisco I. Madero, Hidalgo. México CP. 42660. Tel. 017387241171. e–mail: [email protected] Resumen En el presente trabajo se extrajo el alcaloide erisodina de las semillas del género Erythrina, se determinó la DL50 empleando diferentes dosis administrados por vía intraperitoneal a ratones, para así obtener la curva de dosis respuesta encontrando una DL50 de 66.08 mg/kg, así mismo, se realizó una prueba conductual a ratas en un laberinto elevado en T administrando el alcaloide erisodina, solución de NaCl, diazepam, erisodina, una mezcla de erisodina– diazepam y un grupo control sin tratamiento, se midieron las latencias de línea base, evitación y escape. Los resultados arrojados en esta prueba indican que la erisodina tuvo efectos notorios en la evitación 1, por lo cual se presume un probable efecto ansiogénico de este alcaloide. En la conducta de escape, probablemente la erisodina disminuya el efecto ansiolítico del diazepam. Palabras clave: Erisodina, DL50, Prueba conductual. Introducción Ciertas especies de Erythrina contienen propiedades medicinales, las cuales han sido utilizadas en diversas regiones y etnias de mundo para curar algunos padecimientos, así las hojas son empleadas para úlceras y abscesos y son tomadas internamente para curar las picaduras causadas por diversos insectos. 195 En otras regiones las cortezas son hervidas y tomadas 40 días después del nacimiento de los niños como anticonceptivo, en otras regiones las flores se toman en infusión contra el insomnio [1]. Así muchas de las propiedades de Erythrina son empleadas empíricamente por tal motivo la finalidad de este trabajo es aislar el alcaloide mayoritario el género y realizar la dosis letal media y la prueba conductual del mismo. Materiales y métodos Aislamiento de erisodina La erisodina fue aislada de semillas de Erythrina coralloides, de acuerdo al método descrito por Games, et al, 1974 [2]. Determinación de la DL 50 Se prepararon diversas dosis de alcaloides puros de erisodina (10, 20, 25, 30, 35, 40 y 60 mg/kg), las cuales se administraron vía intraperitoneal a ratones de la cepa CD1. Después se registraron los efectos farmacológicos. Los resultados se analizaron mediante un análisis Probit empleando métodos de regresión ponderada iterativa. Los valores de las dosis y el porcentaje de mortalidad se graficaron para obtener la dosis–respuesta que a través de regresión lineal permitió determinar a DL50 de los alcaloides evaluados. Prueba Conductual Se utilizaron ratas macho de la cepa Wistar, (250–300 gr) y se colocaron en cajas de acrílico en grupos de 5 sin restricción de alimento y agua. Para evaluar el efecto del alcaloide sobre la ansiedad, 30 minutos antes de la prueba a las ratas se les administró de forma intraperitoneal los siguientes tratamientos: 0.2 ml/kg de NaCl al 0.9%, 2 mg/kg de diazepam, 30 µmol/kg de erisodina, 30 µmol/kg + 3.0 mg de diazepam, y el último grupo no recibió tratamiento. Las ratas fueron manipuladas durante 5 días previos a la prueba. Posteriormente al 5o día se expusieron a un laberinto en forma de T, con tres brazos de iguales dimensiones, el laberinto 196 se encontraba elevado a 50 cm del piso. El experimento fue realizado en silencio, con un observador dentro del laboratorio. A partir de ese momento se contabilizo el tiempo en que la rata cruzo con sus 4 patas hacia alguno de los brazos abiertos. En seguida, el animal fue sacado del laberinto y se colocó en su caja durante 30 segundos y el procedimiento se repitió dos veces más, registrándose los tiempos de evitación EV1 y EV2. Para la evaluación de escape (esc) la rata fue colocada al final de brazo derecho abierto y se registró el tiempo que tardaba en abandonar sus 4 patas el brazo. Las latencias fueron analizadas con anova de medidas repetidas en un diseño mixto 5x3. Resultados y discusión La determinación de la DL50 es importante para establecer el índice terapéutico (o margen de seguridad de uso) de cualquier sustancia [3]. Las curvas de dosis–respuesta obtenidas (fig. 1) para la erisodina muestran que la DL50 fue de 66.08 mg/kg. Fig. 15A. Curva dosis–respuesta para erisodina. 197 Después de someter a los animales a la experiencia del laberinto, el valor medio de latencia (seg) de la línea base, la EV1, EV2 y el ESC fueron registrados en la siguiente tabla: Latencias (seg) Tratamiento lb ev1 ev2 esc Intacto 6.5 18.5 266.4 9.9 Salina 6.0 12.5 265.9 10 Diazepam 4.0 4.9 22.4 263.8 Erisodina 8.1 226.2 292.5 4.5 Eri +diazep. 6.1 5.5 42.0 52.4 El análisis indica que existen diferencias significativas para el factor droga y su interacción. La prueba post–hoc no detectó diferencias significativas durante las latencias de la LB, es decir que al exponer por primera vez al animal ante el laberinto su conducta exploratoria fue semejante, independientemente del tratamiento al que fueron sometidos. La ausencia de esta diferencias entre el intacto y salina durante la línea base indica que la manipulación de los animales al momento de la inyección no tuvo efecto alguno. El hecho de que el grupo que recibió erisodina presentara latencias altas en EV1 sugiere que la administración del alcaloide ocasiona que los sujetos eviten más rápidamente los brazos abiertos. Por otro lado la administración de diazepam ocasionó latencias EV2 significativamente menores a los grupos intactos y salina, lo que confirma lo hallazgos de Viana et al, 1994 [4], donde se evidencia el efecto ansiolítico del diazepam ya que los animales permanecen más tiempo en alguno de los brazos abiertos. Puede observarse que los grupos que recibieron diazepam y diazepam+erisodina presentan latencias de EV” bajas con respecto a los otros tratamientos y no son diferentes estadísticamente entre ellas. Estos datos indican que la erisodina no revierte el efecto de diazepam. En cuanto a las latencias de escape el análisis indica que existen diferencias significativas 198 entre las drogas empleadas y el escape. Por otro lado el análisis estadístico indica diferencias significativas entre el diazepam, el grupo tratado con erisodina+diazepam y el grupo formado por intacto, salina y erisodina. El hecho que con diazepam, el tiempo de permanencia en el brazo abierto sea mayor puede indicar que este fármaco ejerce un efecto ansiolítico ante situaciones como el miedo. Cuando se administró Erisodina+diazepam, los tiempos de latencia en el brazo abierto fueron mayores al del grupo intacto, salina y erisodina pero menores al del diazepam, esto nos indica que para este estudio probablemente la erisodina disminuya o contrarreste el efecto ansiolítico del diazepam, por lo cual se sugieren una serie de estudios para su confirmación. Conclusiones Para los resultados conductuales de ansiedad se concluye que al exponer por primera vez el animal al laberinto (línea base) su comportamiento fue igual sin importar el tratamiento al que fue sometido. Los tratamientos intacto y salina tuvieron un comportamiento similar en cada latencia evaluada. La administración del diazepam ocasionó latencias bajas confirmando su efecto ansiolítico: la erisodina tuvo efectos notorios en la evitación 1, por lo cual se presume un probable efecto ansiogénico de este alcaloide. En la conducta de escape, probablemente la erisodina disminuya el efecto ansiolítico del diazepam. Bibliografía 1. Hastings, R.B. 1990. Medicinal legumes of Mexico. Fabaceae Papilionoideae. Part One. Economic. Botany. 44: 336-348. 2. Games, D.E.; Jackson, A.H.; Khan, N.A.; Millington, D.D. 1974. Alkaloids of some Africa, Asian, Polynesian and Australian species of Erythrina. Lloydia. 37: 581-588. 3. Kuschinshy, G.; Lulmann, H. 1997. Manual de framacología. Ed. Marin España. 4. Viana, M.B.; Tomaz C.; Graeff F.G. 1994. The elevated T-Maze: 199 A new animal model of anxiety and memory. Phamacology biochemistry and behavior. 49: 549-554. 200 Diseño, Síntesis y Aplicación de Materiales Magnéticos para el Desarrollo de Nuevos Métodos de Análisis de Alimentos. Análisis de Aditivos Alimenticios Aguilar–Arteaga K.,a* Arteaga–Olguín I., Pérez–Moreno, F.,b Castañeda–Ovando A. b, López–Molina A.a, Hernández–Martínez V.a a*Ingeniería Agroindustrial/Laboratorio de Análisis Especiales. Domicilio Conocido Tepatepec Hgo., Francisco I. Madero, Hidalgo, México. CP. 42660. Tel. 7387241174, e–mail: kaguilar@upfim. edu.mx bUniversidad Autónoma del Estado de Hidalgo. Carretera Pachuca–Tulancingo., Mineral de la Reforma, Hidalgo, México. Tel 7172000. Resumen En el presente trabajo se describe la síntesis de materiales magnéticos con características adsorbentes para el análisis de aditivos alimenticios en muestras de alimentos, con la finalidad de determinar fraudes o bien para control de calidad. El método desarrollado involucra el diseño de materiales magnéticos con características adsorbentes y funcionalización adecuada para la adsorción y cuantificación de diversas especies utilizadas como aditivos alimenticios. El método propuesto es una opción de bajo costo, con posibilidades automatización. Palabras clave: Métodos magnéticos, Aditivos alimenticios, Partículas magnéticas. Métodos de análisis. Introducción El presente trabajo propone el uso de materiales magnéticos, con características adsorbentes útiles en el análisis de aditivos alimenticios, bien para control de calidad o determinación de fraudes. Recientemente se ha reportado la aplicación de este 201 tipo de materiales, en diversos métodos de análisis químicos, debido a que reúnen las características apropiadas para ser utilizados como adsorbentes. En la industria alimentaria se requieren de mejores métodos de análisis para determinar y cuantificar diversos analitos por cuestión de seguridad o bien para control de calidad. Se presentan los resultados de la síntesis de materiales magnéticos, así cómo parte de su caracterización. Las características que presentan los hace candidatos para ser utilizados en métodos de pretratamiento de muestra como extracción en fase sólida magnética (mspe), dispersión de matriz en fase sólida magnética (magnetic–mspd) y en métodos de determinación y análisis en flujo de tercera generación. Antecedentes A partir de la década de los setenta las separaciones magnéticas basadas en el uso de micro y nano partículas magnéticas han tomado gran importancia debido a su rápida y fácil separación de mezclas complejas, sin la necesidad de filtrar o centrifugar, además de su fácil manipulación, posible automatización y miniaturización. Este tipo de partículas han sido aplicadas en la inmovilización de biomoléculas como proteínas, enzimas, agentes bioactivos, grupos orgánicos, etc. para posteriormente ser utilizados en sistemas de análisis químicos, médicos y biotecnológicos. El tamaño y funcionalización de las partículas son características importantes para su aplicación, ya que estos dos factores definen la afinidad de las partículas hacia diferentes analitos. Es importante mencionar que el método de síntesis está relacionado directamente con el tamaño y las características de las partículas magnéticas. Las características fisicoquímicas y magnéticas de un material lo hacen apropiado para su aplicación [1–5]. Los sólidos magnéticos aplicados en separaciones químicas están compuestos de dos fases. Una paramagnética, compuesta principalmente por minerales de hierro u óxidos de hierro como la magnetita (Fe3O4), maghemita (g–Fe2O3) y una segunda fase no magnética formada por diversos materiales, entre los cuales se encuentran polímeros orgánicos, inorgánicos u otros óxidos 202 metálicos, que interactúan con los analitos contenidos en las muestras. Las fases presentes en los sólidos pueden estar asociadas en diversas morfologías. La figura 1 muestra las principales estructuras morfológicas reportadas. Es importante resaltar que el método de síntesis empleado y los materiales de partida están relacionados directamente con la morfología de las partículas obtenidas y por lo tanto con su aplicación [6–7]. La mspd es una técnica desarrollada en los años ochenta ampliamente utilizada en métodos de pretratamiento de muestras de plantas y alimentos, en matrices sólidas, semi–sólidas o con elevado grado de viscosidad. Una fase sólida es dispersada en una matriz de muestra, posteriormente es aislada con diversos analitos adsorbidos en la superficie de la fase sólida, para después llevar a cabo el proceso de elución. Recientemente se ha reportado la síntesis de materiales magnéticos con características adsorbentes adecuadas para ser utilizadas como fase sólida en mspd. Los métodos de pretratamiento de muestra que hacen uso de materiales magnéticos reúnen la fuerza magnética y diferentes métodos de separación e identificación de proteínas, ácidos nucléicos, organelos celulares e incluso células de matrices complejas. Recientemente se han utilizado para la preconcentración de analitos de naturaleza orgánica e inorgánica de interés económico, ambiental y alimenticio tales como iones metálicos, metales pesados, antiinflamatorios, antibióticos, analgésicos, pesticidas, insecticidas, colorantes, surfactantes, agentes carcinogénicos y compuestos fenólicos [8–13], Fig.16 A. Estructuras morfológicas reportadas para sólidos magnéticos. a) tipo core–shell, b) multicore, c) bead on bead y d) morfología tipo brush. 203 El presente trabajo pretende reunir las ventajas de las partículas magnéticas con las características ampliamente conocidas de los carbones activados, obtenidos a partir de desechos agropecuarios logrando la obtención de carbonos activados magnéticos (CAMs). La obtención de carbón activado a partir de desechos agrícolas no es nuevo, se han utilizado diversos métodos para la obtención de materiales con características adsorbentes adecuadas [14]. El objetivo de las nuevas investigaciones se ha enfocado en la modificación química y estructural del carbón activado para conferir propiedades diversas que lo hagan más versátil y de fácil aplicación. Esta versatilidad se debe básicamente a la presencia de las especies modificantes, se ha reportado la modificación del carbón activado con sales metálicas, óxidos metálicos, entre otras especies. Por otro lado, la obtención de carbón activado a partir de desechos agrícolas y pecuarios también representa una disminución de los costos de obtención, además de fomentar la conservación de bosques y selvas. Parte experimental En una primera etapa se obtuvo el carbón activado a partir de olote de maíz en base seca. Los olotes pasaron por un proceso de molienda y tamizado para reducir y homogenizar el tamaño de partícula, con la finalidad obtener una mejor difusión del agente activante y por tanto mayor grado de porosidad del carbón activado. El proceso de activación química y carbonización se llevó a cabo siguiendo el método reportado por Mohan et al, con algunas modificaciones, utilizando H3PO4 y KOH como agentes activantes [15]. Los carbonos obtenidos, en una segunda etapa, fueron magnetizados con magnetita sintetizada por el método de co–precipitación. La co–precipitación en medio básico de los iones Fe2+ y Fe3+ contenidos en solución acuosa, en relación molar 1:2. El tamaño, forma y composición de las partículas depende del tipo de sal utilizada (cloruros, nitratos, sulfatos, percloratos, etc.), relación Fe2+ y Fe3+, pH, fuerza iónica del medio, tipo de base utilizada, la adición de agentes quelantes, 204 temperatura y la velocidad de adición de la base. Este método genera partículas de magnetita mayores a 10 nm de diámetro. La síntesis por co–precipitación está representada en la siguiente reacción [16–17]. Fe 2+ + 2Fe 3++ 8OH- Fe3O4 + 4H2O La etapa de síntesis de los CAMs se resume en la fig. 2. Caracterización parcial de los carbonos activados. Una vez sintetizados los sólidos magnéticos se caracterizaron fisicoquímicamente, usando las siguientes técnicas instrumentales: Microscopia electrónica de barrido (sem) y espectroscopia de energía dispersiva (eds) así como la determinación del índice de yodo en los carbones activados obtenidos mediante la norma mexicana NMX–F–296–SCFI–2011[18]. Se está trabajando en la caracterización completa mediante otros métodos instrumentales para una caracterización fisicoquímica más completa y poder asociar la aplicación de los CAMs obtenidos con sus propiedades fisicoquímicas, Fig. 16 B. Esquema de secuencia general de obtención del CAM. 205 Discusión de resultados En la Tabla 1 se muestran los valores de número de yodo obtenidos para los carbones activados magnéticos sintetizados, los resultados muestran un índice de yodo superior para aquellos sólidos activados con koh que aquellos activados con H3PO4. Los resultados anteriores demuestran que el precursor utilizado posee bajo contenido de especies volátiles y alto contenido de carbono. El carbón activado se evalúa por su área o superficie activa de adsorción. Se determina la cantidad de N2 o de butano que es adsorbido por un carbón determinando el área bet. Cuanto mayor sea la cantidad de gas adsorbido mayor es su superficie, por lo tanto su capacidad de retención de moléculas de gas es mayor. Para la adsorción en fase líquida se emplea el índice de yodo, donde se evalúa la cantidad de yodo que adsorbe un carbón determinado y se compara su valor con los parámetros o valores estándar. Si el carbón será empleado en la adsorción de gases se caracteriza el material mediante el área bet. Si va a ser empleado para la adsorción de compuestos en fase líquida, como es el caso del tratamiento de aguas, el parámetro más importante a determinar es el índice de yodo. Tabla 16C. Índice de yodo para los carbones magnéticos activados obtenidos a partir de olote de maíz. Activación y Relación Magnetita Índice de yodo (DER n=3) H3PO4/1:1 750 mg⋅g–1 (2) H3PO4/1:2 650 mg⋅g–1 (4) KOH/1:1 1050 mg⋅g–1 (2) KOH/1:1 980 mg⋅g–1 (3) La figura 3 muestra micro fotografías representativas tomada a los CAMs obtenidos. Se muestran sólidos porosos, Sin embargo en la microfotografía 3b se observa material más poroso, este cam se obtuvo por activación con koh en suspensión, lo anterior 206 refuerza los resultados obtenidos con el Índice de yodo, mientras que la microfotografía 3a muestra un cam activado con H3PO4. El espectro eds representativo mostrado en la figura 3c corrobora la presencia de hierro en las matrices de los cam obtenidos mediante la síntesis descrita. De acuerdo con los resultados presentados podemos afirmar que los CAMs obtenidos son sólidos con características importantes para ser aplicados en métodos de de pretratamiento de muestras alimenticias para la determinación de aditivos, toxinas y contaminantes. Por otro lado también posean cara características deseables para ser utilizados en métodos industriales para la producción de alimentos. Actualmente se está trabajando en la determinación de fraudes alimenticios, para la determinación de aditivos como Aspartame y Acesulfame–K, mediante Magnetic–mspd–hplc, debido a que los CAMs obtenidos presentan alta selectividad hacia estas dos moléculas, Fig. 16D. a) microfotografía SEM para CAMs activado con H3PO4, b) microfotografía SEM para CAMs activado con H3PO4 y c)Espectro EDS representativo obtenido para los CAMs. 207 Conclusiones Se logró optimizar el proceso de síntesis para la obtención de los CAMs, mediante la cual se obtienen sólidos con características magnéticas y adsorbentes importantes para ser aplicados en métodos de pre–tratamiento de muestras alimenticias como la magnetic–MSPD. El proceso de activación es un paso determinante para la obtención de CAMs con elevada área superficial, asociada con el índice de yodo. El precursor (olote de maíz) de los CAMs obtenidos es una buena fuente de carbono debido a los elevados índices de yodo obtenidos. Referencias 1. Buschow K. H. J.; De Boer F. R. 2004. Physics of magnetism and magnetic materials, Kluwer Academic Publishers, USA. Pages 191. 2. Moliton A. 2007. Basic Electromagnetism and materials. Springerlink, USA. 119-155. 3. Jones D.H. 1989. Mossbauer spectroscopy and physics of supermagnetism. Hyperfine Interactions. 47 : 289-297. 4. Gupta, A. K.; Gupta, M. 2005. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials. 26(18): 3995-4021. 5. Dawes, C. C.; Jewess, P. J.; Murray, D. A. 2005. Thiophilic paramagnetic particles as a batch separation medium for the purification of antibodies from various source materials. Analytical Biochemistry. 338(2): 186-191. 6. Aguilar-Arteaga, K.; Rodríguez, J. A.; Barrado, E. 2010. Magnetic solids in analytical chemistry: a review. Analytica Chimica Acta. 674(2):157-165. 7. Safarik, I.; Safarikova, M. 2004. Magnetic techniques for the isolation and purification of proteins and peptides. BioMagnetic Research and Technology. 2(1): 7. 8. Zhai, Y.; He, Q.; Yang, X.; Han, Q. 2010. Solid phase extraction and preconcentration of trace mercury (II) from aqueous solution using magnetic nanoparticles doped with 1, 5-diphe208 nylcarbazide. Microchimica Acta. 169(3-4): 353-360. 9. Aguilar-Arteaga, K.; Rodríguez, J. A.; Miranda, J. M.; Medina, J.; Barrado, E. 2010. Determination of non-steroidal antiinflammatory drugs in wastewaters by magnetic matrix solid phase dispersion–HPLC. Talanta. 80(3):1152-1157. 10. Rodríguez, J. A.; Espinosa, J.; Aguilar-Arteaga, K.; Ibarra, I. S.; Miranda, J. M. 2010. Determination of tetracyclines in milk samples by magnetic solid phase extraction flow injection analysis. Microchimica Acta. 171:407-413. 11. Huang, C.; Hu, B. 2008. Silica-coated magnetic nanoparticles modified with g-mercaptopropyltrimethoxysilane for fast and selective solid phase extraction of trace amounts of Cd, Cu, Hg, and Pb in environmental and biological samples prior to their determination by inductively coupled plasma mass spectrometry. Spectrochimica Acta Part B: Atomic Spectroscopy. 63(3): 437-444. 12. Dong, J.; Xu, Z.; Wang, F. 2008. Engineering and characterization of mesoporous silica-coated magnetic particles for mercury removal from industrial effluents. Applied Surface Science. 254(11) : 3522-3530. 13. Luna D.; González A.; Gordon M.; Martín N. 2007. Obtención de carbón activado a partir de la cáscara de coco. ContactoS. 64:39-48. 14. Mohan, D.; Sarswat, A.; Singh, V. K.; Alexandre-Franco, M.; Pittman, C. U. 2011. Development of magnetic activated carbon from almond shells for trinitrophenol removal from water. Chemical Engineering Journal. 172(2):1111-1125. 15. Massart, R. 1981. Preparation of aqueous magnetic liquids in alkaline and acidic media. IEEE transactions on magnetics. 1247-1248. 16. Tamura, H.; Matijevic, E. 1982. Precipitation of cobalt ferrites. Journal of Colloid and Interface Science. 90(1): 100-109. 17. Norma Mexicana, NMX-F-296-SCFI-2011, Industria Azucarera y Alcoholera, Determinación del Número de Yodo en Muestras de Carbones Activados Empleados en la Refinación de Azúcar. 209 Efecto del mucílago del nopal (Opuntia ficus índica) de dos edades fisiológicas como agente coagulante–floculante en agua Residual Rodríguez–Martínez N.,* Sánchez – Herrera S.G1., Noguez – Estrada J. 1, Díaz – Batalla L1, Acosta – Percastegui A. *Ingenieria en Agrotecnología, /Cuerpo Académico Biotecnología Agroindustrial Sustentable, Universidad Politécnica de Francisco I. Madero. Carretera San Juan Tepa– Tepatepec km 2, Francisco I. Madero, Hidalgo. CP.42670. Tel 738 72 4 11 71, nrodriguez@ upfim.edu.mx 1Ingeniería agroindustrial, Universidad Politécnica de Francisco I. Madero Resumen El presente trabajo consistió en evaluar el efecto del mucílago del nopal (Opuntia ficus indica) de dos edades fisiológicas como coagulante–floculante natural en el tratamiento de agua residual. Se extrajo el mucílago del nopal de dos edades fisiológicas (cladodios jóvenes y cladodios maduros) y se adicionó en una dosis de 50 ml, 75 ml y 100 ml al agua residual proveniente del canal “Requena”, derivación del represo que abastece una parte de la zona de riego del Valle del Mezquital. Se evaluaron parámetros iniciales en el mucílago obtenido de los cladodios. Así mismo se caracterizó física y químicamente la mezcla de agua residual y el mucílago de cada uno de los tratamientos por triplicado sometido a la prueba de jarras. En relación a la concentración de Sólidos totales el tratamiento con 75 ml resultó ser el que removió mayor cantidad con relación al testigo hasta en un 25% de sólidos. La conductividad eléctrica incrementó con la agregación del mucílago tanto maduro como joven con valores que fluctúan entre 1365 a 1966 µS, lo que sugiere que a mayor concentración de mucílago la conductividad eléctrica incrementa. La turbidez registró un valor directamente proporcional a la agrega210 ción del mucílago independientemente si corresponde a un cladodio maduro o joven, guardando una relación menos marcada en el mucílago extraído de pencas maduras. El pH inicial del mucílago de pencas jóvenes y maduras, registra valores de 6 y 5.5, respectivamente, sin embargo, con la agregación de las dosis en los diferentes tratamientos el pH registra una tendencia a la neutralidad (7.1–7.3) en la mayoría de los tratamientos, con respecto al testigo (7.7). El uso del mucílago de nopal para el tratamiento del agua residual representa una alternativa al uso de productos químicos que son eficientes en la remoción de contaminantes pero que a su vez generan un nuevo problema al medio ambiente. Palabras clave: Mucílago caracterización físico–química. de nopal, agua residual, Introducción Las cactáceas constituyen una de las familias botánicas más abundantes en México, con una gran cantidad de géneros y especies, una extraordinaria variación en su morfología, así como la adaptación a distintos tipos de vegetación y medios ecológicos. El género Opuntia ficus indica, presenta adaptación en una diversidad de calidad de suelo, desde los fértiles hasta los agrestes, permitiendo su producción a gran escala en la mayoría de las zonas áridas y semiáridas del país. Estas zonas en México abarcan el 40% de la superficie total del país. Aunque existen pequeñas zonas áridas como producto de las condiciones climáticas locales, la mayor extensión se ubican en el cinturón o faja mundial de aridez. De los 32 estados que integran el territorio nacional, 25 presentan porciones áridas en mayor o menor proporción, entre los estados que destacan son: Aguascalientes, Baja California Norte, Baja California Sur, Coahuila y Sonora; de manera parcial se presenta en los estados de Colima, Chihuahua, Durango, Guanajuato, Guerrero, Hidalgo, Jalisco, México, Michoacán, Nuevo León, Oaxaca, Puebla, Querétaro, San Luis Potosí, Sinaloa, Tamaulipas, Tlaxcala, Yucatán y Zacatecas. De aquí la importancia de adaptar o generar tecnología para explotar racionalmente esta área. 211 El uso de efluentes provenientes de zonas urbanas para fines de riego en la agricultura, es una práctica que se incrementa cada día en particular en países subdesarrollados, en zonas áridas y semiáridas, así como en zonas con crecimiento demográfico constante en donde se presenta mayor explotación de recursos y generación de residuos. [1] De las 350,000 hectáreas de suelos agrícolas que emplean aguas residuales para el riego en México, más de 280 mil son regadas con aguas residuales sin tratamiento, con esto México ocupa el primer lugar en Latinoamérica en el uso de agua residual. [2] La mayoría de las tecnologías empleadas para el tratamiento de agua residual son caras e inoperables debido a la movilidad de los contaminantes generados durante el proceso, por lo a que es necesario optar por el uso de productos que realicen una similar función en relación con los químicos, en este sentido el mucílago de nopal es una alternativa para el tratamiento de agua, para tal efecto el presente trabajo tiene el propósito de evaluar el efecto del mucílago de nopal (Opuntia ficus indica) de dos edades fisiológicas como agente floculante–coagulante en el agua residual utilizada en el riego agrícola del Valle del Mezquital. Metodología La recolección de las raquetas de nopal de dos edades fisiológicas se llevó a cabo en la comunidad de Tepatepec, Municipio de Francisco I Madero, bajo un diseño completamente al azar considerando cladodios maduros y cladodios jóvenes de un plantío de aproximadamente 5 años, sin aparente presencia de plagas ni enfermedades y en tonalidades de raquetas uniformes. Para su extracción se consideró la técnica de eliminación de solutos de un líquido transfiriéndolos a una segunda fase líquida establecida por relación 1:1 [3]. Para la toma de la muestra del agua residual se consideraron los lineamientos generales y recomendaciones establecidas en la NMX–AA–3–1980 [4]. Se adicionó el mucílago de nopal en una dosis de 50 ml, 75 ml y 100 ml por litro de agua residual, dosis establecida por [3] y sometido a la prueba de jarras para simular el proceso de coagulación–floculación. Se determi212 naron parámetros como sólidos sedimentables según la norma mexicana NMX–AA–004–SCFI–2000 [5]. Los sólidos totales y volátiles se calcularon basado en la NMX–AA–034–SCFI–2011 [6]. Para determinar la turbiedad se aplicó la NMX–AA–038–SCFI– 2001 [7]. El Procedimiento para la obtención de la dureza tomó como referencia a la Norma Mexicana NMX–AA–072–SCFI–2001 [8]. La medición del pH se basó en la Norma Mexicana NMX– AA–008–SCFI–2000 [9] y la capacidad de conducir corriente eléctrica en presencia de iones disueltos se determinó por la NMX– AA–093–SCFI–2000 [10]. Todas las determinaciones se realizaron por triplicado. Resultados Los resultados de la extracción del mucílago maduro reflejó que de los 2 kilogramos de muestras recolectadas se obtuvieron 800 ml de mucílago y en los cladodios jóvenes la cantidad de mucílago fue de 1200 ml. Esto se atribuye a la cantidad de agua contenida en las raquetas y reportadas por [12] donde establece que el nopal joven tiene hasta en 91% de agua lo que infiere la cantidad de mucílago obtenido en cada tratamiento. En relación a la turbiedad (Ver fig. 1), ésta se incrementa con la agregación de mucílago de nopal en especial en las raquetas jóvenes, lo que sugiere que la adición de este elemento externo podrá inferir en algunos procesos relacionados con la capacidad del agua a la penetración de la luz por la presencia de materiales coloidales. Fig. 17A. Turbiedad registrada en los diferentes tratamientos con la adición de mucílago de cladodios jóvenes y maduros. 213 El potencial hidrógeno (pH) medido en el mucílago registra valores similares a los reportados por [11], donde establecen que el rango fluctúa entre 5.0 y 6.6. Los valores de la muestra de agua residual se encuentra clasificada como poco alcalina, clasificación que se modifica con la agregación del mucílago de ambos edades fisiológicas (Ver fig. 2), los cuales tienden a clasificarlos como pH neutros, aspecto deseable para la mayoría de las aguas destinadas al riego agrícola. Fig. 17B. Valores de Potencial Hidrógeno obtenido de los diferentes tratamientos con la adición de mucílago de cladodios jóvenes y maduros. La conductividad eléctrica presente en el mucílago refiere que la muestra contiene una cantidad de iones que como tal no favorecen el uso del mucílago, sin embargo al comparar al testigo con la agregación de las diferentes dosis en los tratamientos estudiados, sugieren que con el incremento de la cantidad de mucílago agregado al agua residual la conductividad eléctrica guarda una relación directamente proporcional, esto debido a la presencia de sólidos totales disueltos en los diferentes tratamientos. 214 Fig. 17C. Valores de Conductividad Eléctrica medida en los tratamientos con la agregación de mucílago de raquetas jóvenes y maduras. Conclusiones El uso del mucílago de nopal de diferentes edades fisiológicas tienen un efecto sobre la depuración de las aguas residuales y pueden ser una sustancia que permita la sustitución de un compuesto químico convencional que indudablemente provocara efectos positivos en el tratamiento para coagulación– floculación del agua residual, pero que así mismo provocara daños al ambiente. Referencias 1. Hernández, G.; Flores, F.; Solorio, J.; Alcalá, J. 1994. Riesgo de acumulación de Cd, Pb, Cr, y Co en tres series de suelos del DR 03, Estado de hidalgo, México. Revista Mexicana de Ciencias Geológicas. 11:53-61. 2. CNA, 2003. Comisión Nacional del Agua. EL Uso de aguas Residuales en la Agricultura de Riego. Subgerencia de Ingeniería, Riego y Drenaje. México. 3. Carpinteyro. U. 2011. Tratamiento de Aguas Residuales empleando polímeros naturales y biodegradabilidad de los lodos generados. Instituto Politécnico Nacional. Repositorio Digital. 215 4. Comisión Nacional del Agua. Página consultada 14 /11/2014. http://www.conagua.gob.mx/ c o n a g u a 07/Noticias/NMXAA-003-1980.pdf 5. Instituto Mexicano de Tecnología del Agua. Página consultada el 14/11/2014. https://www.imta.gob.mx/cotennser/.../NMX-AA004-SCFI-2000.pdf 6. conagua07. Página consultada ek 14/11/2014. www.conagua.gob.mx/conagua07/.../NMX-AA-034-SCFI-2001. pdf 7. Instituto Mexicano de Tecnología del Agua. Página consultada 12/11/2014. https://www.imta.gob.mx/cotennser/.../NMX-AA038-SCFI-2001.pdf 8. Comisión Nacional del Agua. Pagina consultada 10/11/2014. www.conagua.gob.mx/conagua07/.../NMX-AA-072-SCFI-2001. pdf 9. Comisión Nacional del Agua. Página consultada 10/11/2014. www.conagua.gob.mx/conagua07/.../NMX-AA-008-SCFI11.pdf 10. Comisión Nacional del Agua. Pagina consultada 9/11/2014. www.conagua.gob.mx/conagua07/.../NMX-AA-093-SCFI-2000. pdf 11. Saenz, C. 2000. Processing technologies: an alternative for cactus pear (opuntia spp) fruits and cladodes. Journal of Arid Enviroments. 46:209-225. 216 Recirculación del agua posterior al curtido como método para reducir el impacto ambiental y los costos de producción Noguez–Estrada J.,* Rodríguez–Martínez N., Díaz Batalla L.,1 Sánchez–Herrera SG. *Ingeniería agroindustrial, Universidad Politécnica de Francisco I. Madero. Domicilio conocido, Tepatepec, Hidalgo, México. CP. 42660. Tel. 01 738 724 04 52, e–mail: [email protected]. Resumen El presente trabajo tiene como objetivo reflejar la relevancia de los aspectos ambientales, sociales y económicos del sector de la producción de cueros y pieles, haciendo especial énfasis en los impactos ambientales negativos derivados de la curtiduría y sus posibles soluciones, así como reflexionar en relación con los beneficios económicos, ambientales y sociales que se pueden obtener al implementar mejoras tecnológicas y “buenas prácticas” en el proceso productivo. Además de ofrecer alternativas que pueden ser implementadas en los procesos de curtido, para minimizar la problemática generada por la contaminación de las aguas provenientes de las curtidurías residuales que se desechan al alcantarillado, buscando minimizar la carga contaminante mediante métodos de recirculación del agua posterior al curtido. Actualmente la contaminación ambiental es un tema que genera preocupación en todas partes del mundo, así por ejemplo el Río Turbio ubicado en la ciudad de León es uno de los más contaminados, ya que un gran número de tenerías desechan las aguas residuales al mismo. De acuerdo con información bibliográfica consultada, especializada para la minimización del cromo en los efluentes residuales generados por las industrias del curtido se encontraron las siguientes alternativas: Recirculación directa de baños de cromo, recirculación indirecta de baños de cromo, sistemas con recuperación de cromo y su reutilización. Por los requerimientos 217 para el productor de menor escala, la recirculación del agua puede ser una alternativa viable de implementar en sus procesos. Palabras clave: curtido, contaminación, cromo. recirculación, cuero, piel, Introducción Una de las características típicas de la ganadería en el Valle del Mezquital en el Estado de Hidalgo es el predominio de un sistema extensivo en el manejo de animales. Si bien el objetivo principal de la actividad es la producción de carne, se genera con ello una gran cantidad de pieles, que en la mayoría de los casos son recolectados y comercializados principalmente en la ciudad de León Guanajuato, generando poco valor al destinarse principalmente a la producción de cuero. En el curtido de cuero y piel, es necesario buscar nuevas tecnologías que permitan no sólo mitigar su efecto al ambiente, sino también que impacte en los costos de producción. Una alternativa puede ser el aprovechamiento sustentable de las pieles mediante el curtido con tecnologías limpias que permitan la reutilización del cromo, que además garanticen la calidad para su uso en peletería fina. Un aspecto muy importante a tener en cuenta dentro del sistema productivo en la industria de la curtiduría es la optimización de procesos a partir de un uso racional y eficiente de los recursos, ya que su uso irracional afecta la sostenibilidad del sistema en su ámbito económico, ambiental y social. Un uso adecuado de los insumos durante el proceso permite disminuir la contaminación, los costos de producción y garantizar la práctica de la actividad para generaciones futuras. Una de las alternativas para una gestión ambiental empresarial adecuada, puede ser el uso de sistemas de producción más limpia y buenas prácticas ambientales para un sistema de control operacional eficiente y efectivo que mitigue los efectos ambientales. La práctica de procesos eficientes y sustentables durante el curtido, pueden ser una alternativa para hacer rentable la acti218 vidad pecuaria en el Estado de Hidalgo, de tal manera que gran parte de la materia prima aquí generada se transformen en productos y prendas de gran valor que impacte en la economía de los productores y por ende de sus familias. La industria de la curtiduría La industrialización de las pieles que se utilizan en la elaboración de diversos objetos de piel con valor comercial, en forma genérica se conoce como “proceso de curtido”. El proceso completo se puede clasificar, básicamente en cuatro etapas; la primera que se denomina “ribera” y en ella se lleva a cabo la limpieza de la piel que se recibe como materia prima, la cual puede estar conservada con “sal común” (cloruro de sodio), en cuyo caso se denomina “verde salada” o recibirse fresca o seca. En esta etapa se eliminan todos los componentes de la piel que no son transformables a cuero, como sales de sodio, pelo y material proteínico. La segunda etapa comprende propiamente el proceso de “curtido”, mediante el cual se logra impartir estabilidad química y física a la piel evitando su putrefacción y haciéndola resistente a cambios de temperatura y humedad. En el curtido se utilizan materiales de origen vegetal (curtido vegetal) o sales inorgánicas, especialmente sales de cromo (curtido al cromo). La piel curtida se denomina cuero azul o con el término inglés wet blue. La tercera etapa se conoce como Recurtido, Teñido y Engrase rte, y en ella se logra que el cuero adquiera suavidad, color y otras características que son necesarias para fabricar artículos comerciales. Finalmente, en la cuarta etapa denominada “acabado” se imparte al cuero las características específicas que el mercado impone a cada tipo de producto, como puede ser el grabado, color y tacto, entre otros [1]. La industria del cuero genera grandes cargas de contaminantes en sus procesos, pero esto se puede contrarrestar tomando medidas de seguridad para prevenir y disminuir la contaminación. Existen medidas de fácil aplicación y como ventaja presentan disminución de costos en los procesos al reutilizar los productos químicos empleados y la disminución considerable de 219 agua. Actualmente el curtido de pieles con sales de cromo representa el 80% de la producción total de cueros en el mundo [ 2 ]. Características fisicoquímicas del cromo La forma trivalente (Cr III) representa al cromo como un elemento esencial y es más estable, mientras que el estado hexavalente (Cr IV) es altamente tóxico. El cromo trivalente es el más frecuente en el agua natural, las especies relativamente inertes es de cromo (Cr III) se consideran fundamentales para el mantenimiento de la glucosa, de los lípidos y de las proteínas. El cromo (Cr III) es cerca de 100 veces menos tóxico que el cromo (Cr VI). Por otra parte la solubilidad del cromo (Cr III) está limitada por la formación de diversos tipos de óxidos e hidróxidos [ 3 ]. Aproximadamente el 65% de los efluentes líquidos del proceso de curtido y preparado de cueros tienen su origen en las operaciones de ribera (lavado, remojo, pelambre, encalado y desencalado); 30% en las operaciones de curtido (piquelado, curtido, recurtido y teñido) y el 5% restante en el acabado. Los residuales generado en la etapa de curtido, es debido al cromo no fijado a la piel que supone alrededor de un 15% del cromo añadido al baño durante el proceso de curtido. Generalmente, los baños residuales del curtido se homogeneizan con el resto de efluentes industriales y el cromo se precipita como hidróxido de cromo, quedando retenido en los lodos. Este residuo por contener un metal pesado (cromo) podría ser definido como residuo peligroso ante la posibilidad de oxidarse a cromo hexavalente, lo cual traería consecuencias negativas al bioacumularse en organismos vivos y producir alteraciones genéticas [ 4 ]. El cromo trivalente, tal como se lo encuentra en la naturaleza, en principio no es peligroso para el hombre. Pero si es sometido a altas temperaturas se convierte en cromo hexavalente, una sustancia que ingresa en el cuerpo a través de las vías respiratorias el agua o los alimentos y puede provocar gastroenteritis aguda, hepatitis aguda, dermatitis alérgica, laringitis crónica, úlcera gastroduodenal, conjuntivitis crónica, rinofaringitis 220 crónica, perforación del tabique nasal y cáncer pulmonar. Los diversos compuestos del cromo hexavalente representan la mayor amenaza, especialmente debido a sus efectos genéticos. Los compuestos del Cr+6 actúan en casi todos los sistemas de ensayo diseñados para determinar sus efectos mutagénicos, por lo que el hecho de que atraviese la placenta significa un alto riesgo para los embriones y fetos. [2] Tecnologías limpias en el proceso de curtido La buena práctica ambiental consiste en minimizar la presencia de cromo, DQO y fenoles libres en los baños residuales. El objetivo es reducir el costo del tratamiento de las aguas residuales y en algunos casos minimizar el cromo en los vertidos de este proceso. Para lograrlo, se deben realizar procesos en los cuales se optimicen el uso de recurtientes de acuerdo al tipo de artículo a obtener, en función de las características deseadas, acompañada de un buen agotamiento, controlando pH, temperatura, tiempo y cantidad de agua. [ 2]. La producción más limpia, evita la contaminación ambiental al reducir la generación de residuos en cada etapa de la producción con el fin de minimizar o eliminar residuos antes de se generen contaminantes potenciales. La producción más limpia requiere el compromiso de la administración y un enfoque sistemático para la reducción de residuos en todo el proceso de producción. El desarrollo industrial basado en el uso de tecnologías limpias, reduciría las cargas contaminantes e incrementaría la eficiencia en el uso de la energía y la materia prima [5]. Recirculación directa La finalidad de emplear estos sistemas es principalmente para la disminución del cromo en las descargas contaminantes de los efluentes, reciclando especialmente el cromo presente en los baños y disminuyendo el consumo de agua. Los licores de curtido son recuperados, almacenados y reformulados sin sufrir otro tratamiento más que la eliminación de partículas sólidas y grasas. La recirculación directa de licores de cromo, consiste en un pro221 ceso básicamente convencional de curtido en el que el baño residual se recupera, se filtra y se almacena, posteriormente se evalúa su contenido de óxido de cromo y se ajusta a un pH de 3 con ácido sulfúrico, para usarlo como licor de piquel en la siguiente partida. El cromo que debe añadirse al proceso de recirculaciones es el porcentaje usado normalmente menos la cantidad que existe en el baño residual. En el curtido tradicional, solo el 40% del cromo traspasa la piel para cambiar la estructura de la proteína, del 26 al 30% se encuentra como desperdicio sólido y del 30 al 34% se observa en los afluentes. Una cierta cantidad de cromo que entra a los afluentes puede ser recobrado al escurrir y drenar el agua (21 al 24% del cromo ofertado), y otra fracción al precipitar el licor del recurtido (6% del cromo ofrecido) [6]. Los resultados de los análisis realizados para calcular el contenido de cromo son necesarios para la realización de los ajustes en cada proceso de precipitación y reúso. Actualmente no se tiene establecido un número aproximado de reúsos de baños de curtido, sin embargo de acuerdo con fuentes bibliográficas consultadas se pueden lograr de 7 a 10 reúsos de baños de cromo sin que las pieles presenten cambios en su estructura y color [7]. Normas oficiales mexicanas para evaluar la calidad del producto piel Pruebas químicas NMX–A–221–1982 (DGN) Curtiduría pruebas químicas del cuero determinación de las grasas y otros materiales solubles extractables con cloruro de metileno. NMX–A–223–1982 (DGN) Curtiduría —Pruebas químicas del cuero— Determinación de las materias orgánicas e inorgánicas extractables con agua (pérdida por lavado). NMX–A–224–1982 (DGN) Curtiduría —Pruebas químicas del cuero— Preparación de muestras para análisis. NMX–A–229–1982 (DGN) Curtiduría —Pruebas químicas del cuero— Determinación del ph y ph de un extracto acuoso de cuero. 222 NMX–A–230–1982 (DGN) Curtiduría–pruebas químicas del cuero – Determinación del contenido de cromo. Pruebas físicas NMX–A–220–1982 (DGN) Curtiduría–Pruebas físicas del cuero – Evaluación de la resistencia a la tracción, porcentaje de alargamiento debido a una carga determinada y porcentaje de alargamiento en la rotura. NMX–A–235–1983 (DGN) Industria de la curtiduría y del calzado – pruebas físicas del cuero–Determinación de la resistencia al desgarre. NMX–A–236–1983 (DGN) Industria de la curtiduría y del calzado – Pruebas físicas de cuero–Medición de la contracción superficial por inmersión en agua hirviendo. NMX–A–237–1982 (DGN) Industria de la curtiduría y del calzado–pruebas físicas del cuero–Medición de la dilatación y la resistencia de la flor por medio de la prueba de reventamiento por bola. Conclusiones La industria del curtido seguramente seguirá siendo rentable siempre y cuando se adopten mejoras ambientales en los procesos de producción, los procesos utilizados deberán considerar el reúso, tratamiento y manejo de sus residuales. Las pruebas químicas, así como físicas realizadas a licores residuales y a las pieles curtidas con procesos sustentables deberán garantizar la calidad del producto final, acorde con las necesidades de los consumidores. A lo largo de todo el proceso de curtido (ribera, curtido, recurtido y acabado) se pueden realizar mejoras en los procesos con la finalidad de disminuir la contaminación generada por esta industria; de igual forma, los desechos obtenidos en estas etapas, se pueden emplear en otro tipo de productos, no semejantes a los cueros curtidos. Con el empleo de sistemas de reúso de cromo se puede disminuir la carga contaminante debido a que el volumen de agua 223 residual será menor, además de disminuir el costo de producción por el ahorro de materia prima. El proceso de curtido con tecnologías limpias es sustentables, al cumplir no solamente con su compromiso ambiental, sino también al impactar en los costos y por lo tanto en la rentabilidad del negocio. Seguramente al implementar tecnologías limpias se deberá considerar también la responsabilidad social de la empresa. Bibliografía 1. Gutiérrez, M. 1999. Manual de procedimientos para el manejo adecuado de los residuos de la curtiduría. Instituto nacional de ecología, semarnap. 62 P. 2. Agencia de Protección Ambiental de los Estados unidos y ciatec a.c. 2006. Manual de Buenas Prácticas Ambientales para la Curtiembre en Centroamérica. 76 p. 3. Fabiani, C.; Ruscio, F.; Spadoni, M.; Pizzichini, M. 1997. Chromium (iii) “Salts Recovery Process Fromm Tannery Wastewaters”. Desalination. 108. 4. Gómez-Bustamante, J.; Echeverry-Giraldo, A. F. 2010. Análisis técnico y económico en la recirculación de aguas residuales de pelambre y curtido en una curtiembre. Tesis. Universidad Tecnológica de Pereira. Facultad de Ciencias Ambientales. 5. Alzate-Tejada A. M.; Tobón-Mejía, O. 2004. Manual ambiental sectorial. Centro Nacional de Producción más Limpia y Tecnologías Ambientales. 59. 6. Ludvík, J. 2000. Chrome balance in leather processing. United nations industrial development. 7. Josep M. Morera, J.; Bartoli, E.; Chico, R.; Solé, C.; Cabeza, L. 2011. “Minimization of the environmental Impact of chome tanning: a new process reusing the tanning floats”. Journal of Cleaner Production. July. 224 Índice Presentación 5 Avances y perspectivas de investigación LGAC: tecnofuncionalidad y nutrición molecular de compuestos bioactivos Alanís-García E., Cruz-Cansino N.S. Manríquez-Torres J.J., ArizaOrtega J.A. Delgado-Olivares, L., Ramírez-Moreno E. 7 Investigación en bioprocesos agroalimentarios Rodríguez-Hernández A. I., Vargas-Torres A., Chavarría-Hernández N. 31 Caracterización y aprovechamiento de recursos biológicos en el Valle del Mezquital Díaz-Batalla L., Hernández-Martínez V., Aguilar-Arteaga K., Lopez-Molina A., Conde-Mejía C. 39 Producción y transformación de Cambarellus montezumae y Tenebrio molitor para su uso como ingredientes alternos en alimentos Cerón-Ortiz A.N., Ángeles-Monroy M.A., Montufar-Serrano E., Limón-Mendoza M.A. 52 Caracterización de residuos agrícolas modificados químicamente para su aplicación en biotecnología Castañeda-Cisnero,Y. E., Guzmán-Ortiz, F. A., Téllez-Jurado, A., Román-Gutiérrez, A. D. 65 Evaluación física de diez variedades de cebada para la producción de maltas de acuerdo a la Norma NMX-FF-043SCFI-2003 Barrera-Hernández M, Guzmán-Orti F.A., Roldán-Rojas J.H., Román-Gutiérrez, A. D. 80 225 Producción de hidrógeno por métodos biológicos: Revisión F. Pineda Muñoz M. A. Lizardi Jiménez A. Arana Cuenca S. A. Medina Moreno y A. Jiménez González 93 Fermentación sólida: ventajas y aplicaciones biotecnológicas Callejas-Hernández F, Téllez-Jurado A, Muro-Urista C, AranaCuenca A 109 Efecto del almacenamiento a diferentes humedades relativas en la permeabilidad al vapor de agua de películas de harinas adicionadas con montmorillonita-Na. Rodríguez-Marín M. L., Castro-Rosas J., Gómez-Aldapa C.A. , Falfán Cortés R.N. 118 Utilización del Almidón de amaranto (Amaranthus hipochondriacus) en la tecnología de secado por aspersión Falfán-Cortés, RN., Martínez-Bustos, F., Gaytán-Martínez, M., Gómez-Aldapa CA 128 Análisis fisicoquímico y determinación de actividad antioxidante del capulín (Prunus serotina) Castañeda-Ovando A., Martínez-Torres E., Contreras-López E., Jaimez-Ordaz J., Añorve-Morga J., González-Olivarez L.G 149 Cólera y su agente etiológico Rangel-Vargas Esmeralda, Castro-Rosas Javier, Gómez-Aldapa Carlos Alberto, Falfán Cortés Reyna Nallely y Rodríguez Marín María Luisa 159 Producción de alimentos vegetales en la agroindustria alimentaria: una perspectiva sociocultural Hernández-Martínez V., López-Molina A., Aguilar-Arteaga K., Sánchez-Herrera S.G., Díaz-Batallas L. 178 226 Seguridad de Procesos en la Agroindustria López-Molina A., Hernández-Martínez V., Aguilar-Arteaga K., Sánchez-Herrera S.G., Díaz-Batalla L. 187 Evaluación farmacológica del alcaloide erisodina Sánchez- Herrera S.G., , Noguez-Estrada J, Rodríguez-Martínez N., Diaz-Batalla L, Soto-Hernández M.R., Garín-Aguilar M.E 195 Diseño, Síntesis y Aplicación de Materiales Magnéticos para el Desarrollo de Nuevos Métodos de Análisis de Alimentos. Análisis de Aditivos Alimenticios Aguilar-Arteaga K., Arteaga-Olguín I., Pérez-Moreno F., Castañeda-Ovando A. , López-Molina A., Hernández-Martínez V. 201 Efecto del mucílago del nopal (Opuntia ficus índica) de dos edades fisiológicas como agente coagulante-floculante en agua Residual Rodríguez-Martínez N., Sánchez-Herrera S.G., Noguez-Estrada J. , Díaz-Batalla L, Acosta-Percastegui A. 210 Recirculación del agua posterior al curtido como método para reducir el impacto ambiental y los costos de producción Noguez-Estrada J., Rodríguez-Martínez N., Díaz Batalla L., Sánchez-Herrera SG. 217 227 biotecnología y alimentos en hidalgo Líneas de investigación en desarrollo, coordinado por Luis Díaz Batalla y otros, se terminó de imprimir el día 25 de marzo de 2016 en la Ciudad de México, con un tiraje de 100 ejemplares en offset digital.