- Ninguna Categoria
Federico Svarc
Anuncio
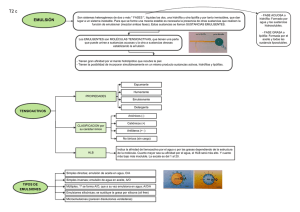
UN CASO DE UTILIZACIÓN DE NANOESTRUCTURAS EN LA INDUSTRIA COSMÉTICA Dr. FedericoSvarc Fabriquímica S.R.L. Buenos Aires. Argentina. Noviembre 2013 NANOTECNOLOGIA APLICADA A LA COSMETICA Introducción: - LIPOSOMAS - MICROEMULSIONES - EMULSIONES MULTIPLES - NANOSFERAS Noviembre 2013 LIPOSOMAS Son microvesículas esféricas constituidas por una o mas bicapas de moléculas fosfolipídicas dispuestas en forma concéntrica, que dejan atrapada entre las mismas la fase acuosa. La capacidad de vehiculización de moléculas hidrofílicas en su fase acuosa, así como de moléculas hidrofóbicas en su fase lipídica, les confiere la posibilidad de ser utilizadas como sistemas transportadores. El tamaño del liposoma oscila aproximadamente entre 200 A a 5 µm de diámetro. Noviembre 2013 Noviembre 2013 LIPOSOMAS cafeina Extractos vegetales d-Panthenol membrana bicapa de lecitina Noviembre 2013 Proteinas hidrolisadas Mucleo hidrofílico MICRO y NANO EMULSIONES Las emulsiones se clasifican en función del tamaño de las partículas dispersas en la fase continua:Macroemulsiones > 1 µm BLANCAS - Nanoemulsiones 0,1 – 1 µm BLANCO AZULADO - Microemulsiones 0.05 – 0.1 µm OPALESCENTE < 0.05 µm TRANSPARENTE Nanoemulsiones: son sistemas dispersos pseudoternarios transparentes, estables termodinámicamente. •Están constituidas por dos líquidos inmiscibles (aceite-agua), cantidades apropiadas de emulsionante, y/o co-emulsionante •La fase dispersa tiene tamaños de 10-200 nm. Noviembre 2013 DIFERENCIAS ENTRE MACRO Y MICROEMULSIONES Propiedad Emulsión Opaco Aspecto 0.15 - 100 um Diámetro fase interna Formación Agitación y/o calor Estabilidad termodinámcia Inestable Presencia de coemulsionantes No Concentración de emulsionante Baja Noviembre 2013 Nanoemulsión Translúcido 10 - 100 nm Espontánea Estable Relación específica con el emulsionante Alta Propiedades generales (1) Facilidad de preparación, por simple mezclado. Las microemulsiones poseen una baja Energía Libre de formación, pueden formarse sin energía mecánica y sin energía térmica. Por lo tanto una estabilidad termodinámica excelente. Transparencia, el diámetro de la gotita es menor a la longitud de onda de la luz. El sistema aparece transparente por que la luz lo atraviesa sin ser dispersada. ■ Noviembre 2013 Propiedades generales (2) ■ Estabilidad, El tamaño muy pequeño de las gotas causa una gran reducción en la fuerza de gravedad y la difusión Browniana mantiene a las gotas uniformemente distribuidas a través de todo el sistema. No se requiere espesante. El tamaño pequeño de las gotas previene cualquier floculación o coalescencia ya que las gotitas no son deformables ■ Vehiculización de activos: Debido a su pequeño tamaño, las gotas de nano emulsión pueden penetrar a través de la superficie de la piel y esto asegura la uniforme deposición y penetración de activos. Noviembre 2013 EMULSIONES MULTIPLES -Una emulsión múltiple se define como una emulsión de emulsión . -Es aquella en la cual subsisten las emulsiones aceite en agua (o/w) y agua en aceite (w/o) en forma simultánea. -Es aquella en la cual las gotas que constituyen la fase dispersa son a su vez, emulsiones. -Las emulsiones múltiples son verdaderos reservorios de productos incompatibles entre si. -Tienen la propiedad de “encapsular” sustancias cuando se utilizan ingredientes de fácil descomposición, o sustancias que pueden oxidarse fácilmente (p.e. esencias, vitamina C, etc.). Noviembre 2013 EMULSIONES MULTIPLES AGUA PELÍCULAS DE EMULSiONANTE Emulsión Múltiple ACEITE O/W/O ACEITE PELÍCULAS DE EMULSiONANTE AGUA W/O/W Noviembre 2013 Emusión común EMULSIONES MULTIPLES Noviembre 2013 NANOSFERAS Se trata de microesferas de un tamaño medio de 100 nanometros, son polímeros con un interior de matriz porosa. En dicha matriz el activo se halla adsorbido y es liberado en forma gradual. Presentan una gran superficie interfasial. Se crea un gradiente de concentración entre el interior y el exterior de la nanosfera, que produce un flujo del activo hacia el exterior, provocando una liberación sostenida del activo con lo que se mejora su biodisponibilidad. Noviembre 2013 Noviembre 2013 Porqué encapsular? Encapsulando moléculas activas en liposomas ó adsorbiéndolas en micropartículas esféricas se modifica su forma de liberación(fig 1). Noviembre 2013 Objetivo del estudio: Comparar “in vivo” el comportamiento de tres activos anticelulíticos: • TEA Hydroiodide • Compuesto A(1) • Compuesto B(2) (1) TEA Hydroiodide + Caffeine + Algae Extract + Hedera Helix Extract + Ruscus Acualeatus Root Extract (2) Idem adsorbido en microesferas porosas de diámetro 100 nm Noviembre 2013 Introducción: •Celulitis: Patología provocada por alteraciones progresivas del sistema microcirculatorio. •Caracterizada por la dilatación de los capilares, provoca edemas y formación de micro y macro-nódulos adiposos en muslos y glúteos. •Estas alteraciones producen una variación de la temperatura de la superficie cutánea, la que puede detectarse por termografía de contacto de cristales líquidos. • La bibliografía menciona que la Cafeína, los compuestos de Yodo orgánicos y algunos extractos vegetales son efectivos en su tratamiento Noviembre 2013 Materiales y métodos: Se prepararon tres cremas y un placebo Cuadro I -Cremas Composición % (p/p) T1 Cetearyl alcohol and Ceteareth-20 8,0 Octyldodecanol Propylene glycol Aqua TEA Hydroiodide T3 T4 (placebo) 8,0 8,0 8,0 5,0 5,0 5,0 5,0 3,0 3,0 3,0 3,0 c.s.p 100 T2 c.s.p 100 c.s.p. 100 c.s.p. 100 - - 1,0 - Compuesto A 10,0 - - - Compuesto B - 5,0 - - Noviembre 2013 Protocolo Experimental: • Ensayos de aplicación bajo supervisión médica (Jefe del Servicio de Cirugía Plástica del Hospital Ramos Mejía). • Panel de 12 mujeres voluntarias, entre 25 y 45 años de edad. • Con celulitis en estadios I, II y III. • Tiempo de ensayo: 2 meses. • Area de aplicación y control: muslos. • Una aplicación diaria, en domicilio, en ambas piernas. • Doble ciego para las pacientes (cremas identificadas únicamente como T1,T2, T3 y T4) • Controles a los 0, 30 y 60 días. • Forma de control: fotos digitales obtenidas a los tiempos de control utilizando una placa termográfica Cellu-VisionR. • Se procesaron las imágenes con el programa Mathlab 2007. Noviembre 2013 Diseño Experimental: Diseño Anova de bloques incompletos (Two way Anova ballanced factors) Voluntaria BC CM MD ND ML SM GM CP AR CS JV AZ Pierna Izquierda T1 T1 T1 T2 T1 T1 T3 T2 T1 T3 T2 T2 Pierna Derecha T3 T3 T2 T3 T4 T2 T4 T4 T4 T4 T4 T3 Noviembre 2013 Resultados Experimetales: Cuando la condición de la piernas es mala (nódulos celulíticos) la placa toma color marrón/rosado. Cuando se observan mejorías en microcirculación (temperatura más alta), vira al azul-celeste. Por cada punto se generaron las respectivas coordenadas (R,G,B), y genero un coeficiente (χ) definido como: puntos (pixeles) correspondientes a baja temperatura/ puntos totales Condición Inical Pierna Derecha 30 días de Tratamiento Pierna Derecha 60 días de Tratamiento Pierna Derecha Resultados Experimentales: Valores que toma el coeficiente de temperatura: 0 < χ < 1 La determinación de la “frontera” entre las zonas calientes y frías no arrojó resultados estadísticamente significativos. Tratamiento de CP con T2 Condición Inicial Pierna Izquierda Tratamiento 30 días Pierna Izquierda Tratamiento 60 días Pierna Izquierda Resultados a los 30 días: Se obtuvo, después de 30 días de tratamiento un p = 0,055 existe una diferencia significativa (Figura 2) entre los distintos tratamientos. T1 y T2 mejoraron el estado de la pierna. Figura 2 Noviembre 2013 Resultados a los 60 días: Despues de 2 meses de tratamiento, tanto T1 como T2 y T3 se mostraron efectivos (p=0,25) y claramente diferenciados del placebo (T4). Se observó un efecto sinérgico combinando activos lipolíticos y venotónicos (Figura 4). Figura 4 Noviembre 2013 Estudios in vitro: Objetivo: evaluar el comportamiento de liberación de los activos anticelulíticos: • • TEA Hydroiodide (TEAH) Caffeine (CAF) comparando su patrón de liberación cuando se encuentran disueltos y cuando están incorporados en microesferas porosas de tamaño medio 100 nm, dispersas en una solución hidroglicólica. Se quiso comprobar que una liberación más lenta de los activos contenidos en las microesferas permitiendo alcanzar una ventana de tiempo más amplia para el suministro de estos componentes, tal como fuera observado anteriormente in vivo. Noviembre 2013 Materiales y métodos: • Caracterización de las microesferas: Las microesferas se caracterizaron por ESEM Figura 2. Microesferas Cargadas s/membrana Figura 1. Microesferas Vacías Materiales y métodos: • Preparación de las membranas: (Gooris y Bouwstra []): • Modelo de piel: Membrana de policarbonato Millipore VMTP04700, de 50 nm de tamaño de poro. Solución equimolar de Colesterol, ácidos grasos de C18/C22 y Ceramidas III, IIIB y VI conteniendo 3,0 mg/ml en una mezcla de hexano /etanol (2:1 v/v). • Se depositó utilizando un aerógrafo, en forma de spray arrastrando el líquido con un ligero flujo de aire. • La masa promedio de la capa lipídica depositada fue de 1,5 mg/cm2. Materiales y métodos: • Caracterización de las membranas: La membrana preparada debe reproducir la estructura de empaquetamiento ortorrómbico de los lípidos en la capa córnea. Se produce un acoplamiento de corto alcance entre las cadenas, generándose un doblete característico en el FTIR. Materiales y métodos: • Estudio de permeación in vitro: celda de difusión de Franz: t = (32 ± 0,5) °C área de transferencia de 4,9 cm2 La concentración acumulada de droga se siguió en función del tiempo, midiendo su absorbancia en un espectrofotómetro Shimadzu UV-2401 PC. TEAH y CAF absorben entre 200 y 350 nm. Resultados y Discusión: En las figuras se muestran los perfiles de liberación de activos con concentraciones TEAH 1,4x10-2 M y CAF 4,6x10-3 M respectivamente en el compartimiento donor. Resultados y Discusión: •La capa lipídica reduce notablemente la permeabilidad de la membrana para TEAH y CAF. •Porcentajes de liberación alrededor de 9 % y 5 % a los 250 minutos, respectivamente. • Se observa que la liberación es más lenta a partir de los activos en dermoesferas. •La Figura 8 muestra el comportamiento a las 24 horas. Se alcanza una liberación del 40 % para TEAH. Segunda Etapa: • Las microesferas cargadas con el complejo anticelulítico fueron ensayadas en la emulsión utilizada para los estudios “in vivo”. • La liberación y permeación fué evaluada en distintas membranas para estudios in vitro, incluyendo la piel de oreja de cerdo íntegra, para determinar cuan realistas eran comparadas con la piel humana. Su comprensión puede ayudar a desarrollar ensayos más confiables. • También se quiso entender la influencia de la emulsión en la liberación de los activos. Noviembre 2013 Membranas utilizadas: • Se utilizaron tres membranas diferentes A, B y C en la celda de Franz. A: membrana de Policarbonato, Millipore VMTP04700, tamaño de poro 50 nm, porosidad 10%. B: Membrane A tratada por deposición de una capa de lípidos semejante a la composición de la del estrato córneo (ceramidas, ácidos grasos de cadena larga y colesterol). C: Piel íntegra de la oreja de un cerdo. La grasa subcutánea fué removida, y conservadas a −20 °C las muestras hasta su uso. Antes del uso se equilibrar a temperatura ambiente y posicionaron en la celda con el estrato córneo orientado al compartimiento donor. Noviembre 2013 Emulsión utilizada : •Semejante a los ensayos “in vivo”, con Reducel Dermosferas : 5,6 %. • La concentration de CAF en la emulsion fué 4,6 x 10-3 M, y la de TEAH 1,4 x 10-2M, similar a la de los experimentos de difusión anteriores en solución. Tratamiento de los datos: 1. La concentration acumulada de cada activo liberado tuvo en cuenta la remoción de las muestras previas y el carácter aditivo de las absorbancias. Las curvas de CAF and TEAH fueron graficadas función del tiempo. 2. La liberación y permeación de HHE y RARE se realizó primero en forma independiente, para evitar superposiciones, con microesferas cargandas con cada extracto por separado. 3. Se ensayaron ambas barreras B y C. Noviembre 2013 Noviembre 2013 Resultados para los extractos: A las 8, 24 y 72 horas la solución receptora fué muestreada y analizada por TLC. Para la detección de las manchas, se utilizó una lámpara UV y también utilizó reactivo anisaldehido/ácido sulfúrico. Se utilizó como patrón un extracto en acetato de etilo de cada planta . b.1. - Membrana B: Después de 8 hours de experimento, las cantidades de HHE y RARE en el compartimiento receptor fueron escasamente detectables. Después de dos días, comenzamos a detectar manchas en ambos casos. Después de tres días, ambos compuestos aparecieron en cantidades bajas, estimadas entre el 5 and 10 % de la carga inicial. Noviembre 2013 b.2- Membrana C: La permeación observada para las microesferas de HHE y RARE es mucho mayor, alcanzando un estimado de 20% después de 2 días, y alcanzando 40 % para HHE 50 % para RARE despúes de 3 días. Conclusiones: Nuestros resultados muestran que una membrana de policarbonato comercial es más realista simulando la piel humana que el modelo generalmente aceptado de la piel de oreja de cerdo, ó de la misma membrana artificial recubierta de una capa de lípidos de composición similar a la del estrato córneo. Noviembre 2013 Conclusiones II: •Estos resultados confirman que el estrato córneo constituye una barrera muy eficiente a la penetration de drogas, particular- mente sustancias iónic como TEAH. • También encontramos que una emulsión o/w dificulta sensiblemente la difusión, comparada con la que ocurre desde un medio acuoso. •Los resultados para los extractos son coherentes con los obtenidos para TEAH and CAF. Mostrando poca permeabilidad en la membrana tratada con lípidos , mientras que la piel de cerdo los deja pasar a similar velocidad. Noviembre 2013 Evolución de la ideas: Porqué no generar nanopartículas de sílice de tamaño controlado in situ para transportar sustancias? MODELO ELEGIDO: • La perfluorodecalina (PFD) se utiliza en medicina como transportadora de Oxígeno por vía sistémica. • Se le han comprobado usos cosméticos benéficos, tales como el incremento de la presión parcial de O2(g), la disminución de las arrugas y el incremento de la humedad. • Atribuimos la relativa falta de interés a la dificultad que se presenta para obtener emulsiones estables que la contengan. Noviembre 2013 Objetivos del trabajo: • Presentar las posibles aplicaciones de la PFD en cosmética partiendo de su estructura molecular y sus propiedades físico-químicas. • Avanzar algunas estrategias que se pueden aplicar a fin de incorporarla a formulaciones cosméticas. • Presentar recientes. Noviembre 2013 algunos resultados experimentales Fundamentos Teóricos: Las cadenas perfluorocarbonadas son muy distintas a las alquílicas: el grupo –CF3 demanda más espacio que el –CH3: el esqueleto carbonado es forzado a un arreglo helicoidal, en vez de la configuración lineal en zig-zag habitual. Las cadenas de los PFC´s son más rígidas, con uniones más fuertes. Perfluorodecalina Noviembre 2013 Fundamentos Teóricos: Se acorta la longitud de las uniones –C-C-, baja su reactividad al punto de no ser inflamables. También justifican la mayor afinidad por los gases y la menor tensión superficial en relación a los hidrocarburos. Su baja polarizabilidad las convierte en altamente hidrofóbicas, resultando además sistemas no-ideales en sus mezclas con los hidrocarburos. Son a la vez hidrofóbicas y lipofóbicas Noviembre 2013 Consecuencias: • • • • • Son difíciles de vehiculizar en formulaciones cosméticas. Solubilizan fácilmente moléculas gaseosas, cumplen la Ley de Henry. Se comportan como fluidos casi ideales. Tienen bajos puntos de ebullición y alta volatilidad en relación a su masa molar. No son metabolizados por el organismo humano. Solubilidad del O2(g) en solventes Noviembre 2013 Materiales y métodos: • En los ensayos hemos utilizado PFD, ó Cis-trans octafluorodecahidronaftaleno, caracterizado por: • Para lograr una emulsión al 5% de PFD en agua, utilizamos Pluronic F127 (Poloxamer 407), de estructura química: junto con Lecitina de Soja y Polisorbato 80. Se trabajó a 70oC y con agitación. Noviembre 2013 Resultados obtenidos: Emulsión de PFD obtenida Se logró obtener una emulsión relativamente estable, cuyo tamaño de partícula (diámetro medio de la fase dispersa, considerando partículas esféricas) fue estimado por medidas de dispersión de luz entre 150 y 250 nm. Se calculó a partir de medidas de Transmitancia % por la técnica de dilución, empleando un colorímetro Lamotte COD Plus. A partir de la emulsión así obtenida se determinaron las condiciones para obtener nanopartículas “in situ” por la vía sol-gel y “encapsular” la PFD. Noviembre 2013 Conclusiones: 1. La molécula de PFD es difícil de emulsionar, y obtener una emulsión estable en el tiempo. 2. Hemos logrado emulsiones estables PFD/agua utilizando una combinación de copolímeros de bloque de óxidos de Etileno y Propileno de alto HLB, Lecitina de Soja y Polisorbato 80. 3 El tamaño de partícula obtenido retarda la separación, que ocurre luego por un mecanismo difusión molecular (Ostwald). 4. Puede estabilizarse adicionalmente la dispersión obtenida utilizando ceras autoemulsionables. 5. Hemos estudiando otras estrategias para incorporar la PFD a formulaciones estables. Noviembre 2013 La última etapa: En un proceso de dos etapas, sobre la matriz de la emulsión obtenida según el procedimiento anterior, sintetizamos “in situ” via condensación homogénea partículas estables de sílice por acidificación de Silicato de Sodio bajo condiciones estrictamente controladas: 1. Formación de grupos silanol: Na2SiO3 + 3H2O ۛ→ ≡≡≡ SiۛOH 2. Reacciones de condensación, crecimiento de las nanopartículas ≡≡≡ SiۛOH + ≡≡≡ SiۛOH ۛ→ ≡≡≡ SiۛOۛSi ≡≡≡ Noviembre 2013 Resultados: • Para obtener partículas pequeñas y de tamaño uniforme encontramos indispensable retardar el proceso hidrolítico controlando la temperatura, el pH y la fuerza iónica del medio de reacción y manteniendo una agitación constante durante todo el tiempo. • Las muestras fueron depositadas en un soporte de sílice y escaneadas con un Microscopio Electrónico Supra 40 Zeiss (FESEM). • Las muestras, resuspendidas en Etanol absoluto fueron depositadas sobre una grilla de Cu, recubierta con C sublimado antes de someterlas a una Microscopía Electrónica de Transmisión (Philips CM200 provisto de EDAX Apollo EDX probe). Noviembre 2013 • Resultados II: •El área superficial y el tamaño de los mesoporos fueron determinados by por las isotermas de adsoción-desorción de N2(g) (Micromeritics). •Pudimos repetir la síntesis de las nanopartículas de sílice utilizando las condiciones óptimas halladas en una mayor escala a partir de materias primas industriales Imágenes SEM de nanoparticulas sintetizadas a pH Constante con [Si] variable en presencia de microemulsión Noviembre 2013 Imágenes de TEM de nanopartículs de silica conteniendo PFD, y resultados del análsis EDX Imágenes SEM de nanoparticulas de silica sntetizadas a [Si] constante con pH variable, sin microemulsión Noviembre 2013 Resultados III: 1. Las condiciones óptimas de síntesis elegidas para la encapsulation de la PFD (20% p/p) dan lugar a nanoparticulas monodispersas con diámetro(23±3) nm , con área superficial BET de (38,9 ± 1,1) m2/g, determineda de las isotermasde absorción de N2(g). 2. Aún en al alto vacío empleado en la TEM se encuentra una relación atómica aproximadamente 1:1 F:Si. 3. El mismo análisis realizado con silica pirogénica (dermosferas de 30 nm diámetro) conteniendo 50% p/p de PFD arroja una relación atómica1:10 F:Si. Noviembre 2013 3.El método sintético utilizado nos permitió obtener una población de Silica esencialmente monodispersa, cuyo tamaño medio es mayor que el de los materiales comerciales obtenidos por la vía pirogénica, los que son empleados habitualmente para formular cosméticos. Estos últimos declarana una superficie BET surface en el rango de 100 a 400 m2/g, y diámetros de partícula entre 7 y 20 nm. Noviembre 2013 Discusión y Conclusiones: • En éste trabajo pudimos obtener nanopartículas de Sílice de tamaño controlado potencialmente capaces de transportar PFD y otros activos lipofílicos e hidrofílicos mediante proceso de condensación. • Las partículas de Sílice del tipo de las que mostramos fueron encontradas potencialmente no tóxicas por el panel de expertos del CIR, y aptas para ser utilizadas en cosméticos y productos de uso personal. También son consideradas seguras por la FDA y la CE. Noviembre 2013 Gracias por su Atención ! [email protected] Noviembre 2013
Anuncio
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados