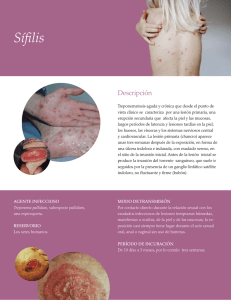
Norma Conjunta de Prevención de la Transmisión Vertical del VIH y
Anuncio

Documento Norma Conjunta de Prevención de la Transmisión Vertical del VIH y la sífilis Programa Nacional de Prevención y Control de la infección por VIH/SIDA e ITS División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública Ministerio de Salud Presentación El Ministerio de Salud, presenta y pone a disposición de los profesionales de salud la Norma Conjunta de Prevención de la Transmisión Vertical de la infección por VIH y sífilis. La prevención y la detección precoz del VIH y sífilis, son las intervenciones de mayor efectividad en el logro del objetivo de reducir la transmisión materno-infantil, por ello se constituyen en una importante herramienta de Salud Pública, con un enfoque integral que permite otorgar una atención oportuna a la mujer embarazada con infección por VIH y/o sífilis. Siendo la infección por VIH y sífilis importantes problemas de Salud Pública que afectan no sólo a las mujeres y sus recién nacidos, sino a toda la comunidad, y que ambas patologías son prevenibles mediante estrategias altamente costo-efectivas, Chile ha asumido el compromiso adscribiendo a la “Iniciativa de Eliminación de la Transmisión Materno Infantil del VIH y la sífilis en Latinoamérica” impulsada por OPS y UNICEF. En nombre del Gobierno de Chile, del Ministerio de Salud y del Programa Nacional de Prevención y Control de la infección por VIH/SIDA e ITS, vaya nuestro reconocimiento por la dedicación de quiénes en un arduo trabajo colaborativo han hecho realidad la elaboración de esta Norma que sin duda contribuirá a la protección de la salud de los niños, niñas y mujeres de nuestro país. Jorge Díaz Subsecretario de Salud Pública Introducción D ado que el manejo adecuado de las mujeres gestantes con sífilis o infección por virus de inmunodeficiencia humana (VIH) ha demostrado, según la evidencia científica disponible, ser la intervención más costo efectiva para evitar la transmisión de estas patologías a los recién nacidos, la legislación chilena ha considerado la detección y el tratamiento oportuno para ambas infecciones. En Chile, el diagnóstico de sífilis en mujeres embarazadas está normado desde el año 1976, estrategia que se ha optimizado a través del tiempo, implementándose el año 2000, los planes de Eliminación de la Sífilis Congénita, que abordaron la prevención, la atención oportuna y la vigilancia de casos. En infección por VIH, el primer protocolo de prevención de la transmisión vertical (AIDS-Aids Clinical Trial GroupACTG 076), data del año 1996. La Norma de Prevención de la Transmisión Vertical del VIH, del año 2005 incluye, el ofrecimiento universal del test a las mujeres embarazadas, protocolo farmacológico a las mujeres gestantes infectadas Rev Chilena Infectol 2013; 30 (3): 259-302 por VIH y sus hijos/as (garantizado en GES), y sucedáneos de leche materna durante seis meses. La detección de VIH y sífilis en las mujeres gestantes está considerada en el Examen de Medicina Preventiva de la Ley GES. A pesar de estos avances, Chile presenta desafíos en el ámbito de estas infecciones desde el enfoque de los determinantes sociales: prevención en mujeres en edad fértil, mejoría en los procesos clínicos (testeo, seguimiento y auditoría de los casos) y oportunidad de la información para la adopción de medidas correctivas y toma de decisiones. El presente documento normativo se enmarca en la legislación vigente para la infección por VIH y la sífilis y contempla como principales objetivos alcanzar las metas suscritas en los compromisos internacionales en el tema: Disminuir la transmisión vertical del VIH a menos de 2%, y disminuir la sífilis congénita a menos de 0,5 por 1.000 nacidos vivos. Por la naturaleza de la transmisión de estas infecciones, y sabiendo que existen situaciones de riesgo y vulnerabilidad en que ambas enfermedades pueden estar presente en una misma persona, se ha decidido estructurar el documenwww.sochinf.cl 259 Documento to en capítulos, algunos de los cuales abordarán de manera conjunta ambas patologías y capítulos donde se detalla el manejo y tratamiento específico para la infección por VIH y la sífilis, de tal forma que permita a los profesionales de la salud acceder de manera rápida a la información necesaria en relación a la mujer gestante y el recién nacido. Esperando que este documento sea de utilidad para todos los profesionales de salud que realizan la atención directa de la mujer gestante, sus parejas y los niños y niñas, así como para los profesionales que realizan la gestión de procesos en los establecimientos de la red asistencial pública y privada, dejamos en sus manos el fruto del trabajo conjunto de los comités científicos asesores en infección por VIH e ITS del Ministerio de Salud. Autores Claudia Bravo Guzmán Encargada de SIDA Pediátrico. Departamento Laboratorio Biomédico. Instituto de Salud Pública de Chile. Comité Científico Asesor VIH/SIDA Patricia Vásquez Toriello Jefa Unidad de Infectología Hospital San Juan de Dios. Profesora agregada Facultad de Medicina, Universidad de Chile. Miembro Comité Consultivo SIDA de la Sociedad Chilena de Infectología. Carlos Pilasi Menichetti Master en SIDA Universidad de Barcelona. Consejero técnico Médicos sin Fronteras, Francia. Carlos Beltrán Buendía Jefe Departamento de Infectología Complejo Asistencial Barros Luco. Profesor Titular Facultad de Medicina, Universidad de Santiago. Director de la Sociedad Médica de Santiago. Miembro Sociedad Chilena de Infectología. Elba Wu Hupat Docente Facultad de Medicina Occidente, Universidad de Chile. Presidenta Comité Nacional de SIDA Pediátrico, de la Sociedad Chilena de Pediatría. Presidenta Rama de Infectología de la Sociedad Chilena de Pediatría. Carmen Larrañaga Larrañaga Directora Departamento Virología. Facultad de Medicina, Universidad de Chile. Secretaria Comité Nacional de SIDA Pediátrico de la Sociedad Chilena de Pediatría. Judith Mora Riquelme Jefa Subdepartamento Virología Clínica. Departamento Laboratorio Biomédico. Instituto de Salud Pública de Chile. Carolina San Martín Saldías Jefa Sección SIDA. Departamento Laboratorio Biomédico. Instituto de Salud Pública de Chile. 260 www.sochinf.cl Comité Científico Asesor ITS Félix Fich Schilcrot Jefe Programa de Postgrado de Dermatología, Pontificia Universidad Católica de Chile. Aurelio Salvo Lizama Representante Sociedad Chilena de Dermatología. Médico Encargado UNACESS, Hospital Sótero del Río. Instructor Adjunto en ITS del Departamento Dermatología, Pontificia Universidad Católica de Chile. Ester Santander Cabello Encargada UNACESS, Hospital San José. Docente Universidad de Chile. Docente Universidad de Santiago. Docente Universidad Diego Portales. Soledad Bertoló Pérez Jefa Servicio Dermatología y Venereología Hospital San Juan de Dios. Médico Encargada UNACESS, Hospital San Juan de Dios. Docente Académico Dermatovenereología, Sede Occidente, Universidad de Chile. Rodrigo Blamey Díaz Representante Sociedad Chilena de Infectología. Miembro Comité Editorial Revista Chilena de Infectología. Jefe Unidad de Infectología Hospital del Salvador. Alejandra Reyes Jiménez Infectóloga Hospital Félix Bulnes. Ana Chávez Polanco Infectóloga Hospital Exequiel González Cortés. Sergio Silva Valenzuela Profesor Asistente de la Facultad de Medicina, Pontificia Universidad Católica de Chile. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento María Isabel Galaz Letelier Infectóloga, Hospital Roberto del Río. Comité Nacional de SIDA Pediátrico de Sociedad Chilena de Pediatría. Carmen Garcés Illanes Encargada del Programa de Salud de la Mujer. Encargada del Programa de ITS-VIH y Chile Crece Contigo. Servicio de Salud Metropolitana Norte. Diplomada en Salud Familiar, Sexualidad y VIH. Maité Riquelme Marín† Programa Nacional de Prevención y Control del VIH/ SIDA e ITS. División de Prevención y Control de Enfermedades. Subsecretaría de Salud Pública. Bárbara Galleguillos Galindo Departamento de Epidemiología. División de Planificación Sanitaria. Subsecretaría de Salud Pública. Genoveva Pacheco López Encargada del Programa ITS. Encargada del Programa de Salud Sexual y Reproductiva. Servicio de Salud Metropolitana Occidente. Paola Rubilar Ramírez Departamento de Epidemiología. División de Planificación Sanitaria. Subsecretaría de Salud Pública. Sara Villalobos Muñoz Licenciada en Salud Sexual, Magíster en Gestión Pública. Encargada del Programa VIH e ITS. Encargada del Programa del Adolescente, Género y Promoción. Servicio de Salud Osorno. Karen Cáceres Burton Departamento de Epidemiología. Unidad de Enfermedades Transmisibles División de Planificación Sanitaria. Subsecretaría de Salud Pública. María Angélica Martínez Tagle Programa Microbiología, Profesora Asociada Instituto de Ciencias Biomédicas. Facultad de Medicina Universidad de Chile. Magíster en Microbiología. Ph.D. Rossanna Camponovo Cruciani Médico Microbióloga. Representante Sociedad Chilena de Infectología. Liliana Urra Molina Experta en técnicas de laboratorio para sífilis. Ex Encargada del Laboratorio ETS Instituto de Salud Pública. Juan Carlos Hormazábal Opazo Jefe Subdepartamento Enfermedades Infecciosas. Departamento de Laboratorio Biomédico. Instituto de Salud Pública. Marcela Villanueva Aillapán Encargada Laboratorio ITS, Sección Bacteriología. Subdepartamento Enfermedades Infecciosas. Departamento de Laboratorio Biomédico. Instituto de Salud Pública. Participantes del Ministerio de Salud Ana María San Martín Venegas Jefa de Departamento Programa Nacional de Prevención y Control del VIH/SIDA e ITS. División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública. Rev Chilena Infectol 2013; 30 (3): 259-302 Maritza García Ochoa Departamento de Epidemiología. Unidad de Enfermedades Transmisibles. División de Planificación Sanitaria. Subsecretaría de Salud Pública. Revisores Miriam González Opazo Encargada Programa de la Mujer Departamento Ciclo Vital, División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública. José Novoa Pizarro Jefe de Neonatología, Hospital Padre Hurtado. Director Rama de Neonatología, Sociedad Chilena de Pediatría. Profesor Departamento de Pediatría, Facultad de Medicina CAS-Universidad del Desarrollo. Fernando Abarzúa Camus Unidad de Medicina Materno Fetal. Departamento de Obstetricia Programa Enfermedades Infecciosas, Pontificia Universidad Católica de Chile. Sociedad Chilena de Obstetricia y Ginecología. Patricia Mena Nannig Jefa Servicio Neonatología del Complejo Asistencial Dr. Sótero del Río. Directora Sociedad Chilena de Pediatría. www.sochinf.cl 261 Documento Axel Paredes Vargas Unidad de Alto Riesgo Obstétrico Servicio de Ginecología. Hospital Dr. Luis Tisné. Jeannette Dabanch Peña Asesora del Departamento de Epidemiología, División de Planificación Sanitaria. Subsecretaría de Salud Pública. 262 www.sochinf.cl Coordinadoras Gloria Berríos Campbell Programa Nacional de Prevención y Control del VIH/SIDA e ITS. División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública. Carolina Peredo Couratier Programa Nacional de Prevención y Control del VIH/SIDA e ITS. División de Prevención y Control de Enfermedades Subsecretaría de Salud Pública. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento La versión original-completa, incluyendo todos los anexos puede ser consultado en http://www.minsal.cl/portal/url/item/d84c1b1497766e48e040010164010137.pdf Indice Introducción ....................................................................................................................................................... 259 Autores ................................................................................................................................................................ 260 Índice ................................................................................................................................................................. 263 Glosario de términos . ........................................................................................................................................ 265 I. Descripción de la infección por VIH y sífilis .......................................................................................... 266 VIH . ........................................................................................................................................................... 266 Sífilis .......................................................................................................................................................... 266 II. Vigilancia epidemiológica de la infección por VIH/SIDA y sífilis en Chile ......................................... Proceso de la vigilancia epidemiológica...................................................................................................... Epidemiología de la infección por VIH/SIDA............................................................................................. Epidemiología de la sífilis............................................................................................................................ 268 268 271 272 III. Transmisión vertical del VIH y la sífilis ................................................................................................. 273 Transmisión vertical del VIH....................................................................................................................... 273 Transmisión vertical de la sífilis................................................................................................................... 274 IV. Objetivos del protocolo de prevención de transmisión vertical ........................................................... 274 V. Orientación, educación y consejería ....................................................................................................... 274 VI. Detección de la infección VIH en la mujer gestante . .............................................................................. 275 Exámenes de detección y confirmación....................................................................................................... 275 Atención de mujeres gestantes con infección por VIH................................................................................ 276 VII. Manejo y tratamiento del VIH en la mujer gestante ............................................................................ Mujeres gestantes sin TAR previa con y sin requerimiento propio de TAR ............................................... Inicio de TAR .............................................................................................................................................. Monitoreo de la mujer embarazada en TAR ............................................................................................... Situaciones especiales ................................................................................................................................. Mujeres gestantes con infección por VIH que han estado en contacto con ribavirina . ......................... Mujeres gestantes que han recibido TAR previa y actualmente están sin TAR ..................................... Mujeres en TAR que se embarazan ........................................................................................................ Mujer gestante que llega en semana 32 o más sin TAR ......................................................................... Mujer gestante con infección por VIH que llega al parto sin TAR previa ............................................. Antiretrovirales o combinaciones restringidas durante el embarazo . .................................................... Parto prematuro y rotura prematura de membranas .................................................................................... Amenaza de parto prematuro . ................................................................................................................ Rotura prematura de membranas . .......................................................................................................... 277 277 278 278 279 279 279 279 279 279 279 281 281 281 VIII.Manejo y tratamiento del parto en la mujer gestante con infección por VIH . ................................... Atención del parto ....................................................................................................................................... Antiretrovirales durante el parto o cesárea . ................................................................................................ Lactancia materna ....................................................................................................................................... 282 282 282 283 Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 263 Documento IX. Atención del recién nacido expuesto al VIH ........................................................................................... Evaluación del RN expuesto al VIH. .......................................................................................................... Diagnóstico de infección por VIH del RN y seguimiento .......................................................................... Antiretrovirales al recién nacido ................................................................................................................. Alimentación del recién nacido y lactante hijo de madre con infección por VIH ...................................... X. Detección de la sífilis en mujeres gestantes ............................................................................................. 285 Serología para sífilis y frecuencia de exámenes . ........................................................................................ 285 Diagnóstico de sífilis en la mujer gestante .................................................................................................. 287 XI. Manejo y tratamiento de la sífilis en la mujer gestante ......................................................................... Tratamiento ................................................................................................................................................. Dosis en mujeres gestantes no alérgicas a penicilina ............................................................................. Dosis en mujeres gestantes con alergia a la penicilina ........................................................................... Seguimiento y evaluación de la respuesta al tratamiento . .......................................................................... 283 283 284 285 285 288 288 288 289 289 XII. Manejo y tratamiento de la sífilis al parto............................................................................................... 290 XIII.Detección de sífilis en el recién nacido ..................................................................................................... 290 Manifestaciones clínicas............................................................................................................................... 290 Criterios para el diagnóstico......................................................................................................................... 291 XIV. Manejo del recién nacido hijo de madre con sífilis . ............................................................................... 292 Estudio.......................................................................................................................................................... 292 Tratamiento y seguimiento de la sífilis congénita........................................................................................ 292 XV. Anexos.......................................................................................................................................................... Anexo 3a: Algoritmo de confirmación de infección por VIH............................................................................... Anexo 3b: Algoritmo de confirmación de infección por VIH en pediatría........................................................... Anexo 4 : Flujograma de derivación...................................................................................................................... Anexo 5: Clasificación de ARV según la Food and Drug Administration ........................................................... Anexo 6: Principales toxicidades de los antiretrovirales....................................................................................... Anexo 7: Flujograma decisiones terapéuticas en sífilis congénita......................................................................... 294 294 296 297 298 299 300 XVI. Bibliografía . ............................................................................................................................................... 301 264 www.sochinf.cl Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Glosario de términos /r Boosting de ritonavir 3TC Lamivudina APP Amenaza de parto prematuro APRI Antiretroviral Pregnancy Registry International ARV Antiretroviral ATV Atazanavir AZT Zidovudina CV Carga viral d4T Estavudina ddI Didanosina EFV Efavirenz EMS Etilmetanosulfonato FPV Fosamprenavir FTC Emtricitabina INNTR Inhibidores no nucleósidos de la transcriptasa reversa INTR Inhibidores nucleósidos (nucleótidos) de la transcriptasa reversa IP Inhibidores de la proteasa ISP Instituto de Salud Pública ITS Infecciones de transmisión sexual LIA Inmunoblot LPV/r Lopinavir con boosting de ritonavir NVP Nevirapina PBQ Perfil bioquímico RPC Reacción de polimerasa en cadena RN Recién nacido RPM Rotura prematura de membranas RTV Ritonavir RVS Respuesta virológica sostenida SNC Sistema Nervioso Central SQV Saquinavir TAR Terapia antiretroviral TDF Tenofovir difumarato TR Transcriptasa reversa TV Transmisión vertical Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 265 Documento I. Descripción de la infección por VIH y sífilis Virus de inmunodeficiencia humana El VIH o virus de la inmunodeficiencia humana es un virus que se transmite entre las personas a través del contacto sexual, sanguíneo y vertical (de una mujer gestante infectada con el VIH a sus hijos/as durante la gestación, parto o lactancia) y que afecta el desempeño del sistema inmunológico del ser humano. Tabla 1. Clasificación de las etapas de la infección por VIH. CDC 1993. Enfermedades oportunistas en VIH/SIDA Etapa Sífilis Características A • Infección asintomática • Infección aguda • Linfadenopatía generalizada persistente B Infección crónica sintomática, sin condiciones definitorias de SIDA. Incluye: • Candidiasis orofaríngea o vaginal > 1 mes • Síndrome diarreico crónico > 1 mes • Síndrome febril prolongado > 1 mes • Baja de peso > 10 kg. • Leucoplaquia oral vellosa • Herpes zoster > 1 episodio o > 1 dermatoma • Listeriosis • Nocardiosis • Angiomatosis bacilar • Endocarditis, meningitis, neumonía, sepsis • Proceso inflamatorio pelviano • Polineuropatía periférica • Púrpura trombocitopénico idiopático • Displasia cervical C Condiciones clínicas indicadoras de SIDA. Incluye: • Tuberculosis pulmonar o extrapulmonar • Neumonía por Pneumocystis jiroveci • Criptococosis meníngea o extrapulmonar • Toxoplasmosis cerebral • Enfermedad por micobacterias atípicas • Retinitis por citomegalovirus • Candidiasis esofágica, traqueal o bronquial • Encefalopatía por VIH • Leucoencefalopatía multifocal progresiva • Criptosporidiasis crónica > 1 mes • Isosporosis crónica > 1 mes • Úlceras mucosas o cutáneas herpéticas crónicas > 1 mes • Neumonía recurrente. • Bacteremia recurrente por Salmonella spp. • Sarcoma de Kaposi • Linfoma no Hodgkin y/o linfoma de sistema nervioso central • Cáncer cervicouterino invasor • Síndrome consuntivo La sífilis es una enfermedad sistémica causada por Treponema pallidum, espiroqueta de reservorio humano exclusivo. La sífilis ha sido clasificada en etapa precoz y tardía, cuyo límite se sitúa por consenso nacional en un año. Esta clasificación tiene importancia epidemiológica por la posibilidad de transmisión de la enfermedad. Las lesiones mucosas y cutáneas húmedas de las formas precoces son contagiosas y las manifestaciones de las formas tardías no lo son. Siempre deben realizarse esfuerzos en precisar la etapa clínica para determinar un tratamiento correcto, pronóstico y seguimiento correspondiente. La evolución natural de la enfermedad tiene un curso variable, algunos de los infectados evolucionan espontáneamente hacia la recuperación total sin tratamiento; un porcentaje importante permanece en etapas latentes de la enfermedad que se evidencia solamente con test serológicos reactivos/positivos. La enfermedad se manifiesta clínicamente (sífilis primaria y secundaria), pudiendo evolucionar en forma excepcional hacia la etapa destructiva (sífilis terciaria) (Tabla 3). Tabla 3. Clasificación general de los estados de la sífilis a. Sífilis precoz Etapa A Infección primaria asintomático LGP Etapa B Infecciones y tumores no definitorios 1 (> 499) 3 (< 200) xxx : SIDA 266 www.sochinf.cl Etapa C Infecciones y tumores definitorios xxx xxx xxx - Sífilis primaria - Sífilis secundaria - Sífilis latente precoz - Sífilis latente tardía - Sífilis terciaria c. Sífilis congénita xxx 2 (200-499) b. Sífilis tardía Tabla 2. Clasificación según linfocitos CD4. CDC 1993 Linfocitos CD4 céls/mm3 La infección producida por el VIH tipo 1 o tipo 2, se caracteriza clínicamente por ser asintomática durante un período variable de tiempo, tras lo cual y debido a la ruptura del equilibrio entre la replicación viral y la respuesta inmune, el organismo desarrolla diversas infecciones, clásicas y oportunistas, y tumores, conformando el síndrome de inmunodeficiencia adquirida (SIDA), que es el estado avanzado de la enfermedad (Tabla 1). La infección por VIH se clasifica en etapas, utilizando como criterios la aparición de enfermedades oportunistas y el recuento de linfocitos CD4 en sangre periférica (Tabla 2). xxx - Sífilis congénita precoz - Sífilis congénita tardía d. Neurosífilis Para la etapificación de la sífilis se deben considerar la historia clínica y epidemiológica, el examen físico y los exámenes de laboratorio (Tabla 4). Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Tabla 4. Definición de caso de sífilis Estadio Definición de caso Sífilis primaria Presencia de una o más úlceras genitales y/o extragenitales, induradas, habitualmente no dolorosas (chancros) con serología no treponémica reactiva o antecedente de contacto con un caso confirmado. Clasificación CIE 10: Código A.51.0: Sífilis genital primaria, chancro sifilítico Código A.51.1: Sífilis primaria anal Código A.51.2: Sífilis primaria en otros sitios Sífilis secundaria Serología no treponémica reactiva en dilución igual o mayor a 1:4 con presencia de una o más de las siguientes manifestaciones clínicas: - Lesiones mucocutáneas localizadas o difusas - Compromiso del estado general similar a un estado gripal - Adenopatías múltiples no dolorosas Clasificación CIE 10: Código A.51.3: Sífilis secundaria de piel y membranas mucosas Código A.51.4: Otras sífilis secundarias Sífilis latente precoz Serología no treponémica reactiva sin síntomas ni signos actuales con uno o más de los siguientes antecedentes: - Seroconversión ocurrida durante los últimos 12 meses. - Contacto sexual con un caso de sífilis confirmada durante los últimos 12 meses. Clasificación CIE 10: Código A.51.5: Sífilis precoz latente Sífilis latente tardía Serología no treponémica reactiva, sin síntomas ni signos actuales, con uno o más de los siguientes antecedentes: - Seroconversión ocurrida en un tiempo mayor a 12 meses. - Contacto sexual con un caso de sífilis confirmada en un tiempo mayor a 12 meses. Clasificación CIE 10: Código A.52.8: Sífilis tardía latente Código A.52.9: Sífilis tardía no especificada Sífilis latente sin especificar Serología no treponémica reactiva y prueba treponémica positiva, sin síntomas y signos y sin antecedentes clínicos o serológicos que permitan definir tiempo de adquisición. Clasificación CIE 10: Código A.53.0: Sífilis latente no especificada como precoz ni tardía Sífilis terciaria Presencia de una o más de las siguientes manifestaciones compatibles con sífilis terciaria y serología treponémica y/o no treponémica reactiva: - Compromiso cardiovascular como aortitis, estenosis del ostium coronario, y otros. - Lesiones granulomatosas o gomas en cualquier tejido o víscera Clasificación CIE 10: Código A.52.0: Sífilis cardiovascular Código A.52.7: Otras sífilis tardías sintomáticas Neurosífilis Presencia de test no treponémico reactivo en líquido cefalorraquídeo, con o sin sintomatología neurológica. Clasificación CIE 10: Código A.52.1: Neurosífilis sintomática Código A.52.2: Neurosífilis asintomática Sífilis congénita precoz Serología no treponémica reactiva en los dos primeros años de vida con antecedente de madre con sífilis confirmada no tratada o inadecuadamente tratada durante la gestación, según normativa vigente y alguna de las siguientes condiciones: - Test no treponémico reactivo a cualquier dilución, con alteraciones de laboratorio y/o clínicas compatibles: hepatoesplenomegalia, rash máculopapular con compromiso de palmas y plantas, pénfigo sifilítico, coriza serohemorrágica, fisuras periorales y/o perianales (rágades), condilomas planos, pseudoparálisis de Parrot, compromiso del SNC Clasificación CIE 10: Código A.50.0: Sífilis congénita precoz sintomática - Test no treponémico reactivo mayor o igual a dos diluciones comparado con el test no treponémico de la madre, con lactante sin sintomatología Clasificación CIE 10: Código A.50.1: Sífilis congénita precoz latente Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 267 Documento Tabla 4. Definición de caso de sífilis (continuación) Estadio Definición de caso Sífilis congénita tardía Detección de serología no treponémica reactiva después de los dos primeros años de vida, con antecedente de madre con sífilis confirmada durante la gestación no tratada o inadecuadamente tratada y sin tratamiento al nacer, en ausencia de contacto sexual y alguna de las siguientes condiciones: - Ausencia de signos y síntomas. Clasificación CIE 10: Código A.50.6: Sífilis congénita tardía latente - Presencia de estigmas sifilíticos como queratitis intersticial, necrosante (gomas), compromiso cardiovascular, dientes de Hutchinson, molares en mora, perforación del paladar duro, nariz en silla de montar, tibias en “sable”, opacidades corneales, atrofia óptica, sordera por compromiso del VIII par craneal, articulación de Clutton (sinovitis e hidroartrosis de rodillas). Clasificación CIE 10: Código A.50.5: Otra forma de sífilis congénita tardía sintomática o Clasificación CIE 10 Código A.50.3: Oculopatía sifilítica congénita tardía - Presencia de test no treponémico reactivo en líquido cefalorraquídeo, con o sin sintomatología neurológica Clasificación CIE 10: Código A.50.4: Neurosífilis congénita tardía II. Vigilancia epidemiológica de la infección por VIH/SIDA y sífilis en Chile Proceso de la vigilancia epidemiológica La vigilancia epidemiológica de la infección por VIH/SIDA y la sífilis, es un proceso regular que permite caracterizar el comportamiento de estos problemas de salud pública en la población de nuestro país. Un objetivo específico de esta vigilancia es conocer los aspectos demográficos, la magnitud y tendencia de la transmisión vertical del VIH y sífilis. Esta información permite evaluar el impacto de las medidas de prevención y control implementadas en el país, así como también generar políticas de salud sustentables para reducir o eliminar la transmisión vertical del VIH y de la sífilis. Este proceso se realiza mediante la interacción de diferentes instancias que conforman la red de vigilancia epidemiológica: • Establecimientos de salud públicos y privados (ambulatorios, hospitalarios y prestadores individuales). • Laboratorios de la red pública de salud y laboratorios privados. • Servicios de Salud. • Instituto de Salud Pública (ISP). • Autoridad Sanitaria Regional (Secretarías Regionales Ministeriales de Salud). • Ministerio de Salud (Departamento de Epidemiología, Departamento de Estadísticas e Información en SaludDEIS). La red de vigilancia se desarrolla en tres niveles cuyos roles y responsabilidades se diferencian según el proceso en cuestión: 268 www.sochinf.cl • Proceso de vigilancia local: Establecimientos de salud públicos, privados. • Proceso de vigilancia regional: Secretaría Regional Ministerial de Salud. • Proceso de vigilancia nivel central: Ministerio de Salud. En Chile y de acuerdo con el Decreto Supremo Nº 158 del 22/10/2004, se establece que la sífilis en todas sus formas y la infección por VIH/SIDA, son enfermedades de notificación obligatoria universal, las cuales deben ser notificadas en forma diaria a la Autoridad Sanitaria (SEREMI) por el establecimiento asistencial que detecta el caso. La responsabilidad de la notificación, según el Art 6º del DS 158/2004 de dicho cuerpo legal, es del médico cirujano que atiende el enfermo en establecimientos asistenciales, sean públicos o privados o a quién el director del establecimiento designe en esta función. En el caso de detección de infección por VIH, los laboratorios clínicos y los centros de sangre públicos y privados, deben enviar las muestras serológicas que resulten reactivas a nivel local, al ISP con el formulario correspondiente para realizar los test confirmatorios. El proceso de vigilancia se inicia con la notificación de un caso confirmado a través del Boletín de Enfermedades de Notificación Obligatoria (ENO), el cual se envía a la Autoridad Sanitaria Regional (SEREMI). En todos los niveles se debe asegurar la calidad de los datos, es decir: información completa, concordante, y oportuna, utilizando los formularios correspondientes para la notificación. De esta manera se dispondrá de información consistente para el análisis de la situación epidemiológica. Es importante desarrollar sistemas de control, supervisión y validación de la información. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento La SEREMI de salud debe enviar la información obtenida desde el nivel local al Ministerio de Salud, donde se integra y se caracteriza la situación epidemiológica nacional. Con la información de la vigilancia epidemiológica, la SEREMI y el MINSAL deben elaborar informes regionales y nacionales respectivamente, los que permitirán a las autoridades conocer la situación, planificar y evaluar actividades relacionadas a estos temas de salud. Para los casos de infección por VIH, el ISP debe enviar mensualmente al MINSAL el registro de todos los exámenes derivados de los laboratorios clínicos, públicos y privados, que resulten confirmados como positivos. Esta información es relevante ya que permite conocer el total de casos detectados por los laboratorios y comparar con el registro de notificación de casos. Este análisis permite detectar y corregir la subnotificación y retroalimentar a la SEREMI de salud correspondiente. Registro de datos para la vigilancia epidemiológica Los datos de los pacientes que cumplan con la definición de caso para infección por VIH y sífilis deberán ser registrados en el boletín ENO, de acuerdo al marco legal vigente. Para el registro de los datos se cuenta con los siguientes formularios estandarizados: Boletín enfermedades de notificación obligatoria-ENO Este formulario permite registrar datos demográficos y clínicos de sífilis e infección por VIH. • Notificación de sífilis: Se debe realizar con el diagnóstico y según definición de caso. Es de responsabilidad del médico que realiza el diagnóstico o quien el director del establecimiento designe en esta función, en establecimientos públicos y privados. De acuerdo al Art 4º del DS 158/2004, en la sección de identificación del paciente, se puede omitir el nombre y apellido del caso, indicándose en su reemplazo el RUT y consignándose sólo la comuna, el diagnóstico y tipo o etapa de la infección. • Notificación de infección por VIH: Se debe realizar una vez recibida la confirmación positiva de la serología realizada por el ISP1. Realizar la notificación es responsabilidad del profesional designado por el Director del establecimiento público o privado. En la sección de identificación del paciente se debe colocar el código, el cual se construye con: la letra inicial del primer nombre, la letra inicial del apellido paterno y la letra inicial del apellido materno, fecha de nacimiento y los tres últimos dígitos del RUT con el dígito verificador, comuna y el diagnóstico2. Formulario para notificación de caso de infección por VIH/SIDA: Este formulario permite obtener datos socio-demográficos, factores de riesgo y la etapa clínica de la infección por VIH en el momento de la detección del caso. El formulario se completa una vez definida la etapa clínica e inmunológica con el recuento de linfocitos CD4. Es responsabilidad del médico que realiza el diagnóstico, quien debe llenar el formulario de notificación, según las instrucciones del mismo, completando todos los campos requeridos, incluyendo el RUT3. Formulario de notificación de cambio de etapa clínica de infección por VIH a SIDA: Este formulario permite conocer la evolución y cambio de etapa de simple infección por VIH a SIDA. Se realiza sólo una vez durante la evolución de cada usuario, si corresponde. En pacientes fallecidos con diagnóstico de infección por VIH/SIDA que no fueran detectados con anterioridad, el establecimiento completará el Formulario de Notificación de Caso de Infección por VIH/SIDA con la información que tenga disponible. Para el ingreso de casos que realiza la SEREMI al sistema en línea, se encuentra disponible la opción que permite la digitación de casos fallecidos; en esta situación existen campos que no son obligatorios. Definición de caso para la vigilancia epidemiológica de infección por VIH/SIDA y sífilis La notificación de los casos se debe realizar de acuerdo a las siguientes definiciones: Definición de caso de infección por VIH Caso confirmado: Toda persona cuyo resultado de test de laboratorio para infección por VIH ha sido confirmado por el Instituto de Salud Pública. Definición de caso etapa de infección por VIH y SIDA Toda persona que cumpla con criterios clínicos e inmunológicos establecidos en Circular B51/35 del 14/10/2010 “Vigilancia Epidemiológica de VIH/SIDA”. Circular B51/35 del 14/10/2010 “Vigilancia Epidemiológica de VIH/SIDA” http://epi.minsal.cl/epi/html/normas/circul/CircularVIHSIDAnew.pdf 2 Ord B22/Nº 4220 del 28/10/2009 “Codificación examen de detección de VIH” http://epi.minsal.cl/epi/html/normas/circul/ CircularVIHSIDAnew.pdf 3 Ley 19.628 del 25/10/2010 sobre Protección de la Vida Privada. 1 Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 269 Documento Roles y funciones en el proceso de vigilancia Forman parte de este proceso los establecimientos públicos y privados de atención abierta y cerrada, los laboratorios clínicos, el ISP, Autoridad Sanitaria Regional (SEREMI) y el Ministerio de Salud (Departamento de Epidemiología y Departamento de Estadísticas e Información en Salud-DEIS) (ver Flujorama). Rol de los establecimientos de salud públicos y privados • Detectar los casos (sífilis e infección por VIH/SIDA), designar a los responsables de la ejecución de las notificaciones para cumplir cabalmente con la vigilancia. • Los laboratorios clínicos deben derivar al ISP todos las muestras serológicas que resulten reactivas para infección por VIH, para la confirmación correspondiente. • Asegurar la confidencialidad y la integridad de la información. • El delegado de epidemiología de cada establecimiento debe velar por el adecuado cumplimiento y registro de todas estas actividades. • Difundir al interior del sector, la información epidemiológica nacional y regional con el objetivo de retroalimentar a las autoridades y equipos de salud, para la toma de decisiones. • Difundir a otras instancias gubernamentales, con el fin de coordinar acciones con el intersector. • Asegurar la confidencialidad de la información. Flujograma de notificación en caso de sífilis en mujeres embarazadas y sífilis congénita Caso confirmado de sífilis según definición de caso Elaborar Boletín ENO. Definir etapa clínica, según la definición de caso (CIE-10) Enviar Boletín ENO a SEREMI de Salud Instituto de Salud Pública • El ISP cumple el rol de confirmar todos los test reactivos para VIH derivados de los laboratorios clínicos públicos y privados. • Emitir el informe con el resultado final de confirmación del test para VIH al laboratorio que derivó la muestra. • Elaborar y enviar un informe con el total de exámenes confirmados positivos al MINSAL. • Asegurar la confidencialidad de la información. Flujograma de notificación en caso de infección por VIH Caso confirmado de infección por VIH Elaborar Boletín ENO Secretaría Regional Ministerial de Salud • Recibir y registrar la información derivada y contenida en el boletín ENO, en el Formulario de Notificación de Caso y Cambio de Etapa Clínica para infección por VIH/SIDA, derivados de los establecimientos de salud. • Asegurar la calidad y oportunidad de la información epidemiológica remitida. • Coordinar instancias de trabajo con los Servicios de Salud, direcciones médicas de establecimientos públicos y privados para análisis, complemento de información, evaluación de los procesos y corrección de los mismos. • Elaborar diagnósticos epidemiológicos regionales y comunales. • Asegurar la confidencialidad de la información. Enviar Boletín ENO a SEREMI de Salud Notificación en formularios específicos Caso confirmado con etapificación clínica e inmunológica Caso confirmado que cambia de etapa clínica de infección por VIH a SIDA Caso confirmado fallecido Elaborar formulario de notificación de caso de infección por VIH/SIDA Elaborar formulario de cambio de etapa de infección por VIH a SIDA Elaborar formulario de notificación de caso infección por VIH/SIDA Ministerio de Salud • Procesar, analizar y consolidar la información obtenida. Realizar análisis situacional y de tendencias manteniendo un diagnóstico actualizado de la situación de estas infecciones, a nivel nacional. Elaborar informes epidemiológicos. 270 www.sochinf.cl Enviar formulario de notificación de caso a SEREMI de Salud Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Epidemiología de la infección por VIH/SIDA El primer caso de infección por VIH/SIDA en Chile se diagnosticó en 1984 y desde entonces los casos nuevos han aumentado progresivamente notificándose hasta el año 2010 un total de 24.014 casos4, abarcando a todas las regiones del país. Sin embargo, en el último quinquenio, las tasas de incidencia de casos nuevos más altas se observan en las regiones de Arica y Parinacota, Tarapacá, Metropolitana y Valparaíso (en orden descendente). En 1985 se notificó la primera mujer con infección por VIH en el país, mientras que el primer caso pediátrico notificado fue en 1987. En Chile la infección afecta principalmente a hombres, cuyo número supera al de mujeres desde el inicio de la epidemia. Sin embargo, las mujeres aumentan su participación en el total de casos y en los últimos años la proporción hombre: mujer muestra una tendencia a la disminución, llegando en el último quinquenio a 3,8 en infección por VIH y 5,9 en SIDA (Gráfico 1). Lo anterior puede estar influenciado por una mayor oportunidad de acceso al diagnóstico en las mujeres considerando las normativas vigentes en el país. Al analizar las notificaciones por grupos de edad, se constata que tanto en hombres como en mujeres, la mayor concentración de casos de infección por VIH se ubica en los grupos entre 20 y 29 años, un decenio antes que en los casos de SIDA. Se destaca que este grupo muestra tasas ascendentes en los últimos tres quinquenios. La prevalencia de infección por VIH observada en po- blación general entre 18-64 años es de 0,21% para el año 2010, sin diferencias significativas entre ambos sexos5. La prevalencia estimada para el año 2011 en población total de 15 y más años es de 0,37%, mientras que en el grupo de 15 a 49 años llega a 0,46%, cifras más altas a la observada en la medición transversal mencionada6. La prevalencia estimada en mujeres en edad fértil (de 15 a 49 años) es de 0,07% para el año 2011. En relación a la vía de exposición, los datos muestran que la principal vía es la sexual, con 95% de los casos. En las mujeres el principal mecanismo de transmisión es el heterosexual, mientras que en los hombres la exposición homobisexual es la más declarada (94% y 74% en el último quinquenio, respectivamente). Desde 1987 fecha en que se notificó el primer caso pediátrico y hasta diciembre del 2011, se han diagnosticado 326 casos de niños/as nacidos/as de madres seropositivas para VIH. La tasa de la transmisión vertical del VIH muestra un descenso notorio y sostenido a través del tiempo, pasando de una cifra cercana a 30% en el período previo a la implementación en 1996, del primer protocolo de prevención de la transmisión vertical (ACTG 076) a 1,6% observado en el año 2010, mediado por la aplicación del actual protocolo de prevención. La transmisión madre-hijo ha disminuido como vía de exposición, llegando en el período 2006-2010 a 0,7% en infección por VIH y 0,6% en SIDA, del total de casos reportados. Casos de infección por VIH notificados según sexo y razón hombre mujer. Chile 1986-2010 Gráfico 1. Casos de SIDA e infección por VIH notificados según sexo y razón hombre mujer. 1986-2010. Fuente: Informe evolución de la infección por VIH/SIDA en Chile 1984-2010. Departamento Epidemiología. Minsal. Informe Epidemiológico VIH/SIDA 1984-2010, Departamento Epidemiología. Ministerio de Salud. Encuesta Nacional de Salud, Ministerio de Salud. 2009-2010 6 Modelo de Proyecciones y Estimaciones Spectrum. ONUSIDA. 2011 4 5 Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 271 Documento Epidemiología de la sífilis Sífilis gestacional Durante los últimos 10 años se han hecho esfuerzos para mejorar la detección y notificación de casos de sífilis en las mujeres gestantes, como parte de las estrategias de eliminación de la sífilis congénita, lo que podría explicar la variabilidad de las tasas registradas en el período. En el año 2001 la tasa de sífilis en mujeres embarazada correspondía a 2,1 por cien mil mujeres en edad fértil, incrementándose paulatinamente, hasta presentar un descenso de las notificaciones en el año 2005, posteriormente aumenta alcanzando la tasa máxima de la década de 9,1 por cien mil mujeres en edad fértil en el año 2007. A partir del año 2008 la tasa desciende presentando en el año 2011 una tasa de 6,8 por cien mil mujeres en edad fértil. En el año 2011, el 49% de las mujeres embarazadas se encuentran en el grupo de edad de 20 a 29 años, mientras que el grupo de 30 a 39 años le sigue con 27,7%, se destaca que el grupo de mujeres embarazadas de 15 a 19 Tasa por 100.000 hbtes. En los últimos 22 años la sífilis se ha presentado en Chile con tasas de incidencia variables, alcanzando el peak el año 1992 (38,3 por cien mil hbtes). A contar de 1993 en adelante se observa un descenso sostenido, para estabilizarse con tasas alrededor de 20 por cien mil hbtes. La incidencia más baja, se observó el año 2005, con una tasa de 17,4 por cien mil hbtes, manteniéndose hasta el año 2010 con tasas inferiores a 20 por cien mil hbtes. El año 2011 se observó un leve repunte, alcanzándose una tasa de 23 por cien mil hbtes (Gráfico 2). Al analizar la incidencia acumulada por sexo durante los últimos 10 años, se observa que ésta es mayor en mujeres. Sin embargo, durante el año 2010 y 2011 se presenta una inversión de esta relación debido a un aumento de la tasa en hombres, la que llega el año 2011 a 25,4 por cien mil hbtes, mientras que la tasa en mujeres fue de 20,8 por cien mil hbtes (Gráfico 3). Tasa por 100.000 hbtes. Gráfico 2. Tasas de incidencia de sífilis. Chile, 1990-2011&. Fuente: ENOS-DEIS-MINSAL. (a): datos provisorios. Gráfico 3. Tasa de notificación de sífilis, según sexo y edad. Chile, año 2011&.Fuente: ENODEIS-MINSAL. &Datos provisorios. 272 www.sochinf.cl Grupo de edad (años) Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Mujeres embarazadas Sífilis congénita Gráfico 4. Casos de sífilis en mujeres embarazadas y sífilis congénita. Chile 2001-2011&. Fuente: ENO-DEIS-MINSAL. & Datos Provisorios año 2011. años concentra 18,1% del total de casos notificados en mujeres gestantes. El 57,6% corresponde a sífilis precoz y 25,1% a sífilis tardía. Sífilis congénita En el año 2011, del total de casos notificados de sífilis, 1,5% corresponde a sífilis congénita. En el período analizado la tasa de sífilis congénita se ha mantenido estable, bajo 0,5 por mil nacidos vivos, presentando fluctuaciones entre 0,16 por mil nacidos vivos corregidos (NVC) el 2001 y 0,31 el año 2008. La tasa de sífilis congénita del año 2011 es de 0,24 por mil nacidos vivos (Tabla 5). En el Gráfico 4 se comparan las notificaciones realizadas en el período 2001-2011 de sífilis en mujeres embarazadas y congénita, observándose que durante el periodo, las notificaciones de sífilis congénita se mantienen relativamente estables, mientras que las notificaciones de las mujeres embarazadas fluctúan en el tiempo. Llama la atención el año 2005, en que la cantidad de casos notificados en mujeres gestantes desciende bruscamente lo que podría atribuirse a dificultades en el proceso de notificación. Al analizar la mortalidad acumulada por sífilis en el período 2001-2009, 39% corresponde a sífilis congénita. Se destaca que desde el 2000 al 2004 el mayor número de muertes por sífilis se concentra en los menores de 1 año. Durante el 2008 y 2009, no se registran muertes por sífilis congénita en menores de 5 años. III. Transmisión vertical del VIH y la sífilis Se denomina transmisión vertical del VIH y la sífilis a la transmisión de estas infecciones desde la madre al hijo/a durante la gestación y el parto. Considera también la transmisión del VIH a través de la leche materna. Transmisión vertical del VIH Actualmente no se conoce con exactitud por qué algunos hijos de madres seropositivas para VIH se infectan y Rev Chilena Infectol 2013; 30 (3): 259-302 Tabla 5. Casos y tasas de sífilis congénita. Chile 2000-2011* Año Casos Pobl NVC Tasa* 2000 68 261.993 0,26 2001 41 259.069 0,16 2002 65 251.559 0,26 2003 59 246.827 0,24 2004 61 424.476 0,25 2005 48 230.831 0,21 2006 59 243.561 0,24 2007 57 242.054 0,24 2008 76 248.366 0,31 2009 64 253.584 0,25 & 59 253.584 0,23 2011& 61 253.584 2010 0,24 Fuente: Boletines ENO-DEIS. *Tasa por mil NVC. Información preliminar. & otros no, pero se han identificado factores de riesgo que aumentan y estrategias preventivas que disminuyen la tasa de transmisión. El diagnóstico de infección por VIH en la mujer embarazada y la aplicación del protocolo completo para la prevención de transmisión vertical (TV) permiten reducir la tasa de transmisión de entre 13 a 48% hasta menos de 2%. La TV del VIH se produce en 35% de los casos durante el embarazo y aproximadamente en 65% durante el parto, por exposición del recién nacido (RN) a sangre materna, secreciones cervico-vaginales o líquido amniótico. La lactancia materna agrega un riesgo adicional de 14% hasta 29%. Se han identificado factores que aumentan el riesgo de TV, siendo la carga viral (CV) materna el principal factor www.sochinf.cl 273 Documento independiente de riesgo de transmisión. Cargas virales menores a 1.000 copias ARN/mL se asocian a tasas de TV significativamente más bajas, pero no existe un umbral con el cual se pueda asegurar que no habrá infección del feto o RN. Ciertas infecciones de transmisión sexual (ITS) también aumentan el riesgo de transmisión. De igual forma, recuentos bajos de CD4 maternos son un factor de riesgo de TV, independiente de la CV. Las intervenciones probadas para prevenir la TV tienen máxima eficacia cuando se aplican durante el embarazo, parto y al RN. Sin embargo, en situaciones de embarazo avanzado o parto en que los resultados confirmatorios no se obtendrán en forma oportuna, el beneficio de la aplicación de los protocolos supera ampliamente los riesgos de su uso en caso de falsos positivos. Estas consideraciones aplican también para los test rápidos. Transmisión vertical de la sífilis El diagnóstico de sífilis en mujeres gestantes constituye una urgencia médica pues se trata de una enfermedad infecciosa sistémica con alto riesgo de transmisión hacia el niño/a en gestación. Riesgo de transmisión de la sífilis durante la gestación • Sífilis primaria, secundaria y latente precoz (menos de un año de evolución): 75 a 95% • Sífilis latente tardía y terciaria (más de un año de evolución): 10 a 35 % Si la mujer gestante con sífilis es tratada en forma oportuna y adecuada se evitará la enfermedad en 100% de los/las RNs. Si el diagnóstico y tratamiento de la mujer gestante no se realiza de manera oportuna, los resultados esperados son: • Aborto en 25 % de los casos. • Mortinato en 25% de los casos. • El 50% restante que corresponde a los RN vivos, tiene una alta probabilidad de estar infectado. IV. Objetivos del protocolo de prevención de transmisión vertical Objetivo principal Reducir la transmisión materno-infantil del VIH y la sífilis en los niños y niñas expuestos/as al riesgo. Objetivos secundarios • Fortalecer la prevención primaria de la infección por VIH y la sífilis en las mujeres y sus parejas. • Mejorar el acceso a la detección precoz del VIH y sífilis en la mujer gestante, su pareja y su hijo/a. • Mejorar el tratamiento oportuno de la infección por VIH/SIDA y de la sífilis en la mujer gestante, su pareja y su hijo/a. 274 www.sochinf.cl • Reducir la CV de la madre seropositiva para VIH a niveles indetectables o cercanos a la indetectabilidad. • Disminuir la exposición del RN hijo/a de madre seropositiva para VIH a sangre, secreciones genitales o líquido amniótico. • Eliminar la exposición del niño/a al VIH a través de la leche materna. • Promover y facilitar el acceso a medidas preventivas en mujeres gestantes y sus parejas para evitar reinfecciones. Metas • Disminuir la transmisión vertical del VIH al 2% o menos. • Mantener o disminuir la incidencia de la sífilis congénita, incluidos los mortinatos, a 0,5 casos por 1.000 nacidos vivos. V. Orientación, educación y consejería post test En el control de la gestación, se debe explicar a la mujer gestante la importancia de los exámenes y las intervenciones disponibles para disminuir la TV. Incluyendo la entrega de preservativos mensuales en cada control prenatal, con el objeto de facilitar la adopción de medidas preventivas frente a estas infecciones. En este diálogo se puede abordar posibles dificultades en la negociación de su uso. Incentivar la participación de las parejas masculinas en el control prenatal puede contribuir a la decisión preventiva de ambos. La información debe ser clara y precisa que permita a la persona aclarar dudas y temores, así como valorar la necesidad de interconsultar a otros profecionales o especialistas. Esta actividad debe incluir: • Información sobre los elementos básicos de la transmisión y prevención de la infección por VIH/SIDA y la sífilis. • Información sobre la transmisión vertical del VIH y sífilis. • Solicitud de los exámenes de detección del VIH y sífilis. • Firma del Consentimiento Informado o denegación del examen. • Derivación a toma de muestra para exámenes. • Entrega de información sobre espacios de consejería en gestión de riesgo directa y telefónica. • Registro de la actividad en documentos correspondientes, incluyendo la Agenda Salud de la Mujer o el carné maternal. Con posterioridad al examen se deben realizar las siguientes actividades: • Entrega del resultado final del examen de detección de la infección por VIH, con consejería post test. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento • Entrega del resultado de detección de sífilis. • Refuerzo de estrategias preventivas de la infección por VIH, sífilis y otras ITS durante el embarazo. • Entrega de material informativo para la prevención de la infección por VIH, sífilis y otras ITS. • Brindar apoyo emocional si el resultado de uno o ambos exámenes es reactivo o positivo. • Informar sobre el procedimiento de control de embarazo y/o seguimiento en los niveles de especialidades y derivación correspondiente si uno o ambos exámenes es (son) reactivo (s) o positivo (s). • Entrega de condones mensuales para la prevención primaria si el resultado del examen es negativo y para la prevención secundaria, si el resultado de uno o ambos exámenes es (son) reactivo (s) o positivo (s). • Promover la concurrencia de la pareja, para la orientación e información, oferta del examen para el diagnóstico de sífilis e infección por VIH, especialmente en las personas más vulnerables y que presenten mayor riesgo de adquirir el VIH y otras ITS. • Apoyo a la adherencia a tratamiento, exámenes y a controles periódicos si corresponde. • Registro de la actividad en documentos correspondientes. VI. Detección la infección por VIH en la mujer gestante Exámenes de detección y confirmación7 Serología para VIH Esta norma considera el acceso universal del test de detección de VIH a las mujeres gestantes, sin diagnóstico conocido de infección por VIH, en el primer control prenatal. En caso de denegación, continuar orientando, educando y ofreciendo el examen en los controles posteriores, con énfasis en los beneficios del protocolo de prevención de TV. Si el resultado del examen es negativo, se debe repetir entre la semana 32-34 de gestación en aquellas mujeres que tengan mayor riesgo de adquirir el VIH: antecedentes de abuso de alcohol o drogas, parejas nuevas durante la gestación o multiparejas (mujeres que viven en la calle, trabajadoras sexuales, etc), antecedentes en ella o su pareja de hepatitis B, hepatitis C, tuberculosis, sífilis u otra ITS y en casos conocidos de serodiscordancia y su pareja sea seropositiva para VIH. El tamizaje para detectar infección por VIH se realiza a nivel local mediante reactivos de diferentes marcas comerciales que han sido evaluados y recomendados por el ISP, y que se encuentran disponibles en el mercado. Los reactivos comerciales pueden ser: instrumentales, los que requieren de equipamiento específico y profesional capacitado, tanto en el manejo del equipo como en la interpretación de los resultados, o visuales los que requieren de un profesional capacitado para la interpretación de los resultados. Para las técnicas visuales que utilizan muestras de suero o plasma, se debe extraer la muestra y esperar a que coagule (entre 1 y dos horas) o centrifugar, lo que requiere un procedimiento adicional en el laboratorio que puede aumentar el tiempo de proceso del test visual. El tamizaje para la detección de infección por VIH debe ser realizado por laboratorios que se encuentren adscritos al Programa de Evaluación Externa de la Calidad del ISP (PEEC VIH). Si el resultado local es no reactivo, es decir, no se detectó anticuerpos/antígenos específicos para VIH, el laboratorio envía el resultado al lugar de la toma de muestra del establecimiento de origen, donde se informará a la usuaria según se describe en el capítulo V de esta norma. Las muestras reactivas deben ser reanalizadas en duplicado con la misma técnica y, en caso de obtenerse resultados reactivos en dos de los tres análisis, el laboratorio debe enviar la misma muestra al ISP para la confirmación de infección por VIH. En el caso de mujeres gestantes, todo resultado reactivo en el nivel local debe ser informado al establecimiento de origen para iniciar las coordinaciones necesarias con el Centro de Atención de VIH/SIDA o el médico especialista correspondiente para evitar pérdida de seguimiento. El diagnóstico de la infección viral en adultos y niños mayores de 2 años, se realiza principalmente con la demostración de la presencia de anticuerpos específicos anti-VIH en el suero o plasma del paciente. Para ello, se ha implementado un algoritmo de confirmación el que incluye distintos tipos de técnicas, (técnicas de tamizaje y técnicas confirmatorias) las cuales son realizadas de acuerdo al estadio de la infección del paciente. El resultado final de la confirmación dependerá del análisis de todas las técnicas que han sido realizadas para cada una de las muestras y que están incluidas dentro del algoritmo de confirmación. (Anexo 3a). Los resultados negativos del ISP se deben entregar según se describe en el capítulo V de esta norma. En el caso que el ISP confirme el resultado positivo de la muestra enviada, el establecimiento que solicitó el examen debe tomar una segunda muestra para la confirmación de identidad antes de la entrega del resultado. En esta nueva muestra se realizará un solo tamizaje con el mismo reactivo comercial originalmente utilizado por el laboratorio. En caso de resultar reactivo, confirma la identidad de la persona y determina que el procedimiento no tiene errores, por lo tanto, se debe entregar el resultado a la mujer gestante, según se describe en el capítulo V de esta norma. Manual de Procedimientos para la Detección y Diagnóstico de la Infección por VIH. 7 Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 275 Documento En la eventualidad que la confirmación de identidad resulte negativa o discordante con el informe del ISP, no se debe informar el resultado a la persona, el laboratorio debe comunicarse con el Centro Nacional de Referencia de SIDA del ISP. Aquellas mujeres que llegan en trabajo de parto sin serología conocida para VIH, deben acceder a un test de tamizaje instrumental o visual, previa firma del consentimiento informado o de denegación, en caso de rechazo. Todas las maternidades deben disponer de test de tamizaje, instrumental o visual evaluado y recomendado por el ISP para la detección en estos casos de urgencia, el que está considerado solamente en mujeres gestantes en trabajo de parto que no fueron estudiadas previamente, o que se desconoce su serología, y que es necesario evaluar y decidir rápidamente la profilaxis medicamentosa para evitar la infección por VIH al RN lo que, incluso al momento del parto, reduce notoriamente las posibilidades de TV. El resultado “reactivo” en este contexto de urgencia, considera a la paciente potencialmente positiva y se aplica el protocolo establecido de prevención de la TV. La mujer gestante debe ser informada de su situación indicando que se aplicará un protocolo preventivo mientras se espera el resultado de confirmación. La muestra reactiva para VIH debe ser sometida a un nuevo examen en el mismo laboratorio, en duplicado, utilizando el mismo test de tamizaje. En el caso de obtenerse resultados reactivos en al menos dos de los tres exámenes se debe enviar al ISP para la confirmación. Resumen • Realizar un test de tamizaje para infección por VIH a toda mujer gestante al ingreso del control prenatal. • Si el resultado del examen es negativo, se debe repetir entre las semanas 32-34 de gestación en aquellas mujeres que tengan mayor riesgo de adquirir el VIH: antecedentes de abuso de alcohol o drogas, parejas nuevas durante la gestación o multiparejas (mujeres que viven en la calle, trabajadoras sexuales, etc), antecedentes en ella o su pareja de hepatitis B, hepatitis C, tuberculosis, sífilis u otra ITS y en casos conocidos de serodiscordancia y su pareja sea seropositiva para VIH. • Todo resultado reactivo a nivel local, debe ser enviado a confirmación al ISP. • En las mujeres que llegan al parto sin serología para VIH conocida, revisar en laboratorio si ésta ha sido tomada. Si no se dispone del resultado, se debe realizar un tamizaje para la detección de VIH urgente (instrumental o visual). Si éste resultara reactivo, aplicar de inmediato el protocolo de prevención de TV, incluyendo suspensión de la lactancia materna. 276 www.sochinf.cl Atención de la mujer gestante seropositiva para VIH A todas las mujeres gestantes con test para VIH positivo confirmado por el ISP, se les debe realizar la prueba de identidad y ser derivadas al Centro de Atención de VIH, y a la Unidad de Alto Riesgo Obstétrico, o como se señala en el Flujograma de derivación (Anexo 4). En el sistema privado de salud, la paciente debe ser derivada a los establecimientos y especialistas de su red. En ambos casos se debe procurar que la mujer gestante seropositiva para VIH acuda con su pareja para realizar su estudio y tratamiento si corresponde. En aquellas mujeres gestantes cuyo examen resulta reactivo desde la semana 20 en adelante (sea éste el primer examen o corresponda al tercer trimestre), la derivación es inmediata al Centro de Atención VIH o al especialista correspondiente, sin esperar la confirmación del ISP para la aplicación del protocolo de TV. Los controles de embarazo, en el sistema público deberán ser hechos en una unidad de Alto Riesgo Obstétrico, y los controles de infección por VIH en los Centros de Atención de VIH/SIDA; en el sistema privado de salud los controles serán realizados por los médicos especialistas en los establecimientos de su red. Debe existir coordinación entre las diferentes instancias de atención de la mujer gestante, para compartir los resultados de exámenes, procedimientos, tratamientos y evolución de las patologías y del embarazo para asegurar la calidad y oportunidad de las intervenciones, en favor del bienestar del binomio. La atención de la mujer gestante seropositiva para VIH, debe incluir anamnesis, examen físico y obstétrico completo, así como exámenes que permitan monitorear el estado de salud e identificar co-morbilidades. Se ha demostrado beneficio cuando la atención del embarazo, el parto y del recién nacido es otorgada por un equipo multidisciplinario experto en el manejo de la infección por VIH. Este equipo debe considerar: un médico tratante de VIH, un obstetra que maneje temas de alto riesgo obstétrico, un matrón/a, un pediatra así como profesionales de salud mental y de apoyo social en caso necesario. Cada maternidad debe designar un obstetra encargado de la atención de pacientas infectadas por VIH, responsable de la aplicación del protocolo en el establecimiento y su difusión en los diferentes niveles de atención, además será interconsultor para casos especiales o para solucionar las dudas que puedan surgir en el manejo de alguna paciente. Exámenes La etapificación clínica e inmunológica de la infección por VIH en la mujer gestante, permite determinar sus propios requerimientos de TAR y eventualmente modificar el momento de inicio y el tipo de TAR. Para ello, se deben efectuar los siguientes exámenes: Rev Chilena Infectol 2013; 30 (3): 259-302 Documento • CD4 y CV para definir la necesidad de tratamiento por su propia condición. • Genotipificación viral en caso de protocolo previo de prevención de TV, o en caso de primoinfección por VIH durante el embarazo o en caso de pareja seropositiva para VIH que esté en TAR. La realización de la genotipificación no debe retrasar el inicio de TAR, la cual debe ajustarse a las recomendaciones nacionales sin esperar el resultado de este examen. • En el control de 34 semanas se debe repetir la cuantificación de CD4 y CV cuyo resultado determinará la conducta obstétrica (vía de resolución del parto). Exámenes generales al ingreso La solicitud debe ser complementaria entre la atención infectológica y obstétrica (en el sistema público entre Centro de Atención del VIH y Alto Riesgo Obstétrico): • Hemograma. • Perfil bioquímico que incluya pruebas hepáticas y creatininemia. • Perfil lipídico. • Grupo y Rh, test de Coombs indirecto. • Orina completa y urocultivo. • VDRL o RPR, si no se lo ha realizado, o le corresponde por edad gestacional o por control de sífilis. • Pesquisa de otras ITS. • Antígeno de superficie para hepatitis B y anticuerpo anticore de virus hepatitis B. • Serología para virus hepatitis C. • Serología para Toxoplasma gondii IgG e IgM. • Serología de enfermedad de Chagas. • PPD. • PAP. • Ecografía a las 12 a 14 semanas (antes de las 18 semanas) para determinar la edad gestacional (EG) y la fecha de la última regla (FUR) operacional, si procede. Exámenes en los siguientes controles • Realizar evaluación ecográfica excluyendo procedimientos invasores: - Ecografía de primer trimestre ya señalada para precisar la EG. - Ecografía morfológica de segundo trimestre (22 a 24 semanas). - Ecografía a las 32-34 semanas para el control de crecimiento fetal. - Ecografía extra según evolución clínica • Perfil lipídico y perfil bioquímico a las 28 semanas. • Sedimento urinario a las 28 semanas. • Prueba de tolerancia a la glucosa oral (PTGO), 24 a 28 semanas. Rev Chilena Infectol 2013; 30 (3): 259-302 Resumen • Todas las mujeres gestantes con test diagnóstico para VIH positivo deben ser derivadas en el sistema público al Centro de Atención de VIH y a la Unidad de Alto Riesgo Obstétrico; y a los especialistas correspondientes en el sistema privado. • Aquella mujer gestante con examen reactivo, obtenido desde la semana 20 en adelante, debe ser derivada de inmediato al médico tratante de infección por VIH sin esperar la confirmación del ISP para la aplicación del protocolo de TV. • Debe existir coordinación entre las diferentes instancias de atención de la mujer gestante, en favor del bienestar del binomio. VII. Manejo y tratamiento del VIH en la mujer gestante Mujeres gestantes sin TAR previa con y sin requerimiento propio de TAR Como se mencionara anteriormente, la mayoría de los casos de TV se producen en el periparto, especialmente durante el parto. Por ello se debe alcanzar una CV indetectable en la última fase del embarazo y parto, lo que se mide en la semana 34. Sin embargo, frente a CV muy altas incluida la primoinfección, el riesgo de TV aumenta así como los tiempos necesarios para lograr una disminución de la CV a niveles inferiores a 1.000 copias ARN/mL. Por otra parte, debido a la toxicidad de los ARV, se intenta limitar su uso al período de máxima eficacia, considerando riesgos y beneficios de exponer a la madre y al feto a estos fármacos por un período de tiempo mayor. Las mujeres asintomáticas que no requieren TAR por su propia salud, deben iniciar tratamiento TAR para prevención de la TV. Es importante considerar un esquema adecuado de tres ARV que permita supresión viral en forma oportuna y continuar TAR post parto. En este escenario, se debe iniciar TAR en la semana 20, una vez finalizado el período de organogénesis. En los casos de CV > de 100.000 copias ARN/mL, se debe adelantar el inicio de TAR a la semana 14. Sin embargo, las mujeres sin TAR previa con indicación de TAR por su condición clínica y/o inmunológica deben seguir las recomendaciones de TAR para adultos, de acuerdo a los criterios de inclusión de la Guía Clínica VIH/SIDA vigente, en cuyo caso debe iniciar tratamiento independientemente de la CV y la semana de gestación, teniendo en cuenta los ARV recomendados para embarazo. www.sochinf.cl 277 Documento Resumen • Iniciar TAR para la prevención de la TV del VIH en mujeres embarazadas sin tratamiento previo, a partir de la semana 20 de gestación. • La TAR debe iniciarse en la semana 14 cuando la CV es mayor de 100.000 copias ARN/mL. • La TAR debe iniciarse de inmediato si la mujer embarazada tiene criterios clínicos o inmunológicos de inicio de TAR. • Si la seroconversión se produce durante la gestación, deberá iniciarse TAR de inmediato. • Todas las mujeres gestantes que inician TAR para prevenir la TV, deben continuar el tratamiento post parto. Inicio de TAR Combinación de análogos nucleósidos a usar La elección de la combinación de inhibidores nucleósidos de la transcriptasa reversa (INTR) a utilizar para la prevención de TV depende de su eficacia en reducir la TV, su toxicidad en la mujer embarazada y el RN, así como el riesgo teratogénico. La FDA clasifica los medicamentos de acuerdo al riesgo de teratogenicidad en cinco categorías (Anexo 5), encontrándose los INTR en categorías B o C. La mayor experiencia de uso de INTR en embarazo se tiene con AZT (categoría C) que ha demostrado alta eficacia en reducir la TV del VIH, incluso usado como monoterapia y con efectos protectores de la transmisión que van más allá de su acción reduciendo la CV materna. La resistencia a AZT es baja por su alta barrera genética, por lo que en general no existen limitaciones importantes para su uso en relación a eficacia. En lo que respecta a toxicidad, el uso de AZT durante el embarazo no ha sido asociado a una mayor incidencia de anemia severa o neutropenia, como tampoco su asociación con otros INTR, excepto ddI. Sobre 3.000 embarazos expuestos a AZT y 3TC no se ha demostrado una mayor incidencia de malformaciones en los fetos expuestos. Por lo que debe intentarse siempre, incluir el AZT en los esquemas. Lamivudina, en combinación con AZT, ha demostrado mayor eficacia en prevenir la TV que AZT en monoterapia. No hay suficiente evidencia comparativa de la eficacia de otras combinaciones de INTR en la prevención de la TV. En particular con tenofovir (TDF) existe poca evidencia de su seguridad en embarazo y preocupación por sus potenciales efectos óseos en el feto. Si existe anemia o neutropenia basales o secundarias a toxicidad moderadas a graves grados 3 y 4 respectivamente (Anexo 6), se indica cambiar zidovudina por abacavir, previa realización del test de HLA-B*5701. En mujeres con HLA-B*5701 positivo no se debe iniciar abacavir y se usa la asociación de tenofovir con lamivudina o emtricitabina. 278 www.sochinf.cl Tercer anti-retroviral a usar Lopinavir/ritonavir ha demostrado elevada actividad antiretroviral intrínseca y hay estudios que comprueban su eficacia y seguridad en el embarazo. Existe también amplia evidencia con el uso de saquinavir reforzado con ritonavir, que también es de eficacia probada. Existen diferencias en la farmacocinética de los IP en la mujer embarazada especialmente durante el último trimestre; sin embargo, la evidencia de eficacia virológica de estos ARV en embarazo no avalan variaciones en la dosificación. Nevirapina ha sido ampliamente usada en la prevención de la TV, pero su uso se ha asociado con la aparición de resistencia viral, tanto en la madre como en los niños que nacieron con infección por VIH a pesar de la profilaxis, limitando las opciones terapéuticas futuras del binomio. Por otra parte en mujeres tiene una mayor incidencia de toxicidad hepática e hipersensibilidad, en particular cuando los recuentos CD4 maternos son mayores de 250 céls/mm3. En mujeres con recuentos inferiores a 250 céls/mm3 y que no han recibido nevirapina previamente, podría considerarse su uso, en particular si existe contraindicación relativa para el uso de inhibidores de proteasa. Resumen • Se indica el uso de AZT/3TC en la prevención de la transmisión vertical del VIH. • Si existe anemia o neutropenia grados 3 y 4 respectivamente, se indica cambiar zidovudina por abacavir. • En mujeres con HLA-B*5701 positivo no usar abacavir, indicar tenofovir con lamivudina o emtricitabina. • Como tercer ARV indicar lopinavir/ritonavir o saquinavir/ritonavir. • El uso de nevirapina se puede considerar en pacientes con recuentos CD4 menores a 250 céls/mm3. Monitoreo de la mujer embarazada en TAR La eficacia de la TAR se mide con la disminución de la CV. Una TAR se considera eficaz si hay una disminución de alrededor de 1 logaritmo (log) de la CV a las dos semanas de iniciada la TAR y 1,5 log a las cuatro semanas. Para ser considerada eficaz, la TAR debe lograr una disminución de 2 log. de la CV entre las 28 y 34 semanas de embarazo. A las seis semanas de iniciada la terapia deberá controlarse CV y posteriormente en forma mensual hasta que se haga indetectable. En la semana 34 debe realizarse una CV para definir la conducta obstétrica, para adicionar otro ARV, si fuera necesario y determinar TAR del recién nacido. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Resumen • Se debe controlar CV a las 6 semanas de iniciada TAR durante la gestación y posteriormente en forma mensual hasta la semana 34. • CV de semana 34 de gestación define la conducta obstétrica (vía de resolución del parto) y TAR adicional al binomio. Situaciones especiales Mujeres gestantes seropositivas para VIH que ha estado en contacto con ribavirina Por los efectos teratogénicos, debe evitarse el embarazo en mujeres en tratamiento con ribavirina y hasta cuatro meses después de haberlo suspendido. También se debe evitar el embarazo, si la pareja está en tratamiento con ribavirina o la ha recibido en los últimos siete meses. Si la mujer gestante ha estado expuesta por su propia condición o por su pareja, debe ser derivada de inmediato al médico que controla la hepatitis e informar al equipo perinatal. Mujeres gestantes que han recibido TAR previa y actualmente están sin TAR En estas personas se debe obtener una historia completa de las terapias usadas y de estudios genotípicos previos, hacer CV y recuento de linfocitos CD4 al ingreso, realizar genotipo aún estando sin TAR, e iniciar terapia basada en todos estos antecedentes, considerando los fármacos recomendados como seguros en el embarazo y el recuento de linfocitos en el caso de usar nevirapina. Se debe incluir zidovudina si es posible y adecuar luego el esquema de acuerdo al resultado del estudio genotípico, teniendo en consideración que la interpretación de un test de genotipo en pacientes con terapia suspendida es complejo y puede ocultar mutaciones. Por esto mismo se recomienda una CV a las 4-6 semanas de iniciado el esquema y si está fallando debe repetirse la genotipificación. En las mujeres embarazadas que han usado previamente nevirapina en dosis única en el parto, iniciar un esquema con lopinavir/ritonavir. Mujeres en TAR que se embarazan En estos casos se recomienda continuar TAR si está con CV indetectable, revisar el esquema de tratamiento y cambiar aquellos fármacos con riesgos teratogénicos (efavirenz) y las que aumentan toxicidad (d4T), incluyendo zidovudina en el esquema si es posible. Si está recibiendo nevirapina y está con CV indetectable, se puede mantener el esquema, independiente del recuento de linfocitos CD4, que en estos casos no se ha asociado a hepatotoxicidad. Si la mujer gestante en TAR tiene CV detectable Rev Chilena Infectol 2013; 30 (3): 259-302 > 1.000 copias ARN/mL, la realización de un estudio de genotipificación permitirá adecuar la TAR según los resultados de resistencia. Toda mujer embarazada en TAR con una CV > 1.000 copias ARN/mL en la semana 34, debe realizarse un examen de genotipo y adicionar una dosis de nevirapina en el momento del parto. No se ha demostrado hepatotoxicidad con dosis única de nevirapina en pacientes con CD4 mayores de 250 céls/ mm3. Los resultados del estudio de resistencia ayudan a seleccionar la TAR para el RN. Mujer gestante que llega en la semana 32 o más sin TAR En estos casos aún se puede lograr una buena respuesta a TAR ya que, si bien la transmisión puede haber ocurrido durante el embarazo, el período de mayor susceptibilidad es el periparto. Es fundamental tomar CD4 y CV basales urgente e iniciar TAR con IP sin esperar los resultados de los exámenes. Si se logra obtener rápidamente el recuento de linfocitos CD4 y éstos son menores de 250 céls/mm3 es posible iniciar TAR con nevirapina. Si se inicia TAR con IP y no se puede realizar una CV cercana al parto o la CV es mayor de 1.000 copias ARN/mL puede considerarse agregar una dosis única de nevirapina en el preparto. Mujer gestante seropositiva para VIH que llega al parto sin TAR previa Si es posible, deben tomarse muestras basales para CD4 y CV e iniciar inmediatamente zidovudina endovenosa según esquema, más una dosis única de 200 mg de nevirapina. Indicar AZT/3TC por una semana para reducir el riesgo de resistencia futura a nevirapina, que tiene una vida media prolongada. Para la continuidad del tratamiento de la madre, se puede iniciar un IP postparto y mantener este esquema (AZT/3TC) hasta obtener los resultados de CD4 y CV e indicar el mejor esquema de acuerdo a sus condiciones. En estos casos la resolución del parto es por cesárea Antiretrovirales o combinaciones restringidas durante el embarazo La infección por VIH por si misma no aumenta el riesgo de malformaciones congénitas. El riesgo de teratogenicidad de los diferentes ARV ha sido evaluado en estudios observacionales y en un registro colaborativo de mujeres embarazadas expuestas a TAR. El “Antiretroviral Pregnancy Registry International” (APRI), con datos de más de 5.000 pacientes expuestas a TAR entre 1989 y 2007 encuentra una prevalencia de 2,6 de defectos congénitos por 100 RNs vivos entre las pacientes que recibieron TAR en cualquier momento del embarazo. En las mujeres embarazadas que recibieron TAR en el primer trimestre del embarazo la prevalencia fue de 3,0% www.sochinf.cl 279 Documento y en las que lo hicieron en el segundo y tercer trimestre fue de 2,2%. Estas cifras no difieren del 3,1% de defectos congénitos de la población general para Estados Unidos de América. De acuerdo a la FDA, los ARV están clasificados mayoritariamente en categorías B o C, es decir que su seguridad no está demostrada en humanos y los estudios en animales no muestran riesgos para el feto o no son concluyentes (Anexo 5). Cabe destacar que efavirenz (EFV), un INNTR de uso frecuente en TAR de primera línea, es el único ARV en categoría D de la FDA en base a evidencia en animales de un significativo mayor riesgo de malformaciones del tubo neural, pese a que una revisión de la base de datos de APRI no mostró un riesgo mayor de malformaciones en RNs expuestos a EFV en el primer trimestre respecto de la población general. Sin embargo, existen cuatro casos retrospectivos de malformaciones del tubo neural en RNs expuestos a EFV durante la organogénesis. También la APRI ha registrado una incidencia de malformaciones congénitas de 5,8% en RN de mujeres embarazadas que recibieron ddI durante el primer trimestre en comparación con 1% en mujeres embarazadas expuestas más tardíamente durante la gestación, pero no se demostró un patrón definido que hiciera sugerir la restricción en su uso. La probabilidad de que el uso de TAR, especialmente con IP, se asocie a parto prematuro ha sido ampliamente investigada; sin embargo, la evidencia actual no sugiere un riesgo mayor de parto de pretérmino por el uso de ARV. Otra consideración a tener en cuenta al usar ARV durante el embarazo es la potencial toxicidad materna. Los INTR tienen afinidad variable por la ADN polimerasa gamma mitocondrial lo que puede determinar una depleción del ADN y disfunción de la mitocondria. Se ha observado que esta forma de toxicidad es más frecuente en mujeres. Clínicamente se puede presentar con neuropatía, miopatía, cardiomiopatía, pancreatitis, esteatosis hepática o acidosis láctica. Se han descrito casos de acidosis láctica fatal en mujeres que han recibido d4T o la combinación d4T-ddI, los dos INTR en uso con mayor impacto en la ADN polimerasa. Esta complicación es similar e indistinguible del hígado graso agudo y el síndrome HELLP (del inglés: hemolysis, elevated liver enzymes, low platelets count) en el embarazo, que se correlacionarían con predisposición genética recesiva que se traduce en una disminución de la actividad mitocondrial en su función oxidativa de los ácidos grasos. La nevirapina, un INNTR de amplio uso en la prevención de la TV del VIH, se asocia a riesgo de hepatotoxicidad y rash inmunomediados. El riesgo se ha correlacionado con el uso en mujeres con CD4 > 250 céls/ mm3 al momento de recibirlo. No es claro que el embarazo aumente el riesgo de hepatotoxicidad, pero se han descrito casos fatales en mujeres embarazadas. Nelfinavir ha sido ampliamente usado durante el 280 www.sochinf.cl embarazo para prevenir la TV del VIH; sin embargo, el registro sanitario para su uso fue retirado en Chile y otros países debido a la presencia, en concentraciones superiores a las permitidas, de etilmetanosulfonato (EMS), una sustancia teratogénica y carcinogénica originada en la etilación del mesilato. Resumen de situaciones especiales Mujer gestante seropositiva para VIH que ha estado en contacto con ribavirina • Evitar embarazo en mujeres que están o han estado expuestas a la ribavirina. • Derivar a mujer gestante expuesta a ribavirina al médico que controla la hepatitis e informar al equipo perinatal. Mujer gestantes que han recibido TAR previa y actualmente están sin TAR • En exposición previa a ARV y sin TAR actual, realizar genotipificación y diseñar esquema terapéutico en base a los antecedentes y el genotipo actual. • Se debe realizar CV entre la 4a o 6a semanas de iniciada la TAR y un nuevo estudio genotípico si hay fracaso, para ajuste de TAR. • Si ha habido uso de nevirapina, aún en dosis única intraparto, utilizar lopinavir/ritonavir en lugar de nevirapina. Mujeres en TAR que se embarazan • Mantener la TAR si están con CV indetectable. • Si el esquema contiene efavirenz, cambiar por lopinavir/ritonavir o por saquinavir/ritonavir. • Realizar genotipificación en mujeres embarazadas en TAR con CV > 1.000 copias ARN/mL y adicionar dosis única de nevirapina en el momento del parto. Mujer gestante que llega en semana 32 o más sin TAR • Tomar CD4 y CV e iniciar de inmediato TAR con AZT/3TC + IP reforzado. • Si CD4 < 250 céls/mm3 se puede usar nevirapina en lugar de un IP reforzado. • Si CV > 1.000 copias ARN/mL, se puede adicionar dosis única de nevirapina en el momento del parto. • Continuar con TAR post parto Mujer gestante seropositiva para VIH que llega al parto sin TAR previa • Zidovudina endovenosa según esquema. • Dosis única de nevirapina. • Resolución del parto por cesárea. • Usar AZT/3TC por una semana, agregar IP, hasta evaluar el mejor esquema para continuar tratamiento. Antiretrovirales o combinaciones restringidas durante el embarazo • No usar efavirenz, nelfinavir y la asociación de d4T-ddI en mujeres embarazadas. Se deben cambiar estos ARV en los esquemas terapéuticos en las mujeres con TAR previa, que se embarazan. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Parto prematuro y rotura prematura de membranas Mujer gestante seropositiva para VIH con amenaza de parto prematuro o rotura prematura de membranas son dos situaciones, que junto con el momento del parto, son consideradas de riesgo para la TV por lo que merecen una especial atención dentro de los cuidados médicos durante el embarazo. Amenaza de parto prematuro (APP) La prematuridad es la principal causa de morbimortalidad perinatal en el mundo desarrollado, suponiendo hasta 70% de las muertes neonatales y causa de 75% de la morbilidad. Se le considera un síndrome cuyas causas son múltiples y que incluyen patologías placentarias, infecciosas, distensión uterina aumentada, etc. Algunos autores encuentran una asociación entre el parto de pretérmino y la infección por el VIH. Las causas y mecanismos de la prematuridad en la infección por VIH son desconocidos y por tanto no existe ninguna estrategia preventiva que nos pueda garantizar la ausencia de prematuridad. El riesgo de una APP es que se produzca un parto antes de las 37 semanas. Su diagnóstico se basa en la presencia de contracciones uterinas y la aparición de modificaciones cervicales antes de esta fecha. Distintos autores han observado tasas significativamente superiores de prematuridad en la población de mujeres embarazadas seropositivas al VIH, aunque los trabajos suelen resaltar la presencia de factores confundentes en este grupo de gestantes, que hacen aumentar dicha prevalencia, tales como la adicción a drogas o la ausencia de control prenatal. Otros aspectos más específicos de la infección por el VIH que harían aumentar la prevalencia del parto de pretérmino serían el deterioro del estado inmune materno o el tratamiento antiretroviral, sobre todo en el caso de pacientes que reciben TAR previa al embarazo. Debido a que el problema del parto prematuro es aún un tema que no está resuelto, deberán adoptarse todas las medidas necesarias para prevenirlo, de acuerdo a lo establecido en la Guía Prevención de Parto Prematuro vigente, en coordinación con el médico tratante de la infección por VIH/SIDA. Deben adoptarse todas las medidas necesarias para prevenir el parto prematuro en gestantes con infección por VIH, entre otras: • Realizar tamizaje de las infecciones ginecológicas, relacionadas con el mayor riesgo de parto pretérmino, que incluya: - Anamnesis dirigida sobre flujo genital patológico. - Especuloscopia y exámenes de laboratorio, si corresponde. • Incentivar la reducción del consumo de tóxicos como tabaco, alcohol y drogas. • Procurar un buen estado nutricional durante la gestación. Rev Chilena Infectol 2013; 30 (3): 259-302 • Evaluar competencia cervical, y la necesidad de un cerclaje, en los casos con antecedente de cirugía en el cuello uterino, lo anterior debido a la alta incidencia de displasia asociada a infección por VIH. • En casos de factores de riesgo para parto prematuro (prematuridad previa, RPM, corioamnionitis, metrorragia persistente de segundo trimestre), realizar cervicometría en semana 24 de gestación. • Control semanal a partir de la semana 34 con monitorización fetal y si hay dinámica uterina, realizar tacto vaginal. • Sólo se administra profilaxis antibiótica si está indicado por presencia de rotura prematura de membranas, colonización vaginal por Streptococcus agalactiae (estreptococo del grupo B) o cuadros infecciosos específicos. En presencia de contracciones regulares, aunque las modificaciones cervicales sean escasas, se indica la administración, (junto con el tratamiento tocolítico) de AZT ev 2 mg/kg/hora durante la primera hora, seguida de 1 mg/ kg/hora hasta que ceda la dinámica uterina, de acuerdo a lo establecido en esta norma sobre la administración de ARV durante el parto. Si no se consigue frenar el cuadro y se desencadena el parto y/o se produce la rotura de las membranas, se deberá realizar una cesárea. Rotura prematura de membranas La rotura prematura de membranas (RPM) es la pérdida de la integridad de las membranas ovulares antes del inicio del parto, con la consiguiente salida de líquido amniótico y la comunicación de la cavidad amniótica con el canal endocervical y la vagina. Es uno de los más frecuentes fenómenos obstétricos, apareciendo en alrededor de 10% de las gestaciones y en 25% de los casos se produce sin haber alcanzado el término de la gestación. Puede dar lugar a una serie de complicaciones como infecciones maternas, fetales o neonatales, parto prematuro, entre otros, por lo cual requiere de un manejo específico. Antes del uso de TAR en el embarazo, varios estudios encontraron una relación entre la duración de la rotura de membrana y la TV, sobre todo si dicha duración es superior a cuatro horas. El riesgo de TV aumenta en 2% por cada hora que las membranas permanecen rotas en mujeres con menos de 24 horas de rotura. Al desconocerse el riesgo de infección fetal en pacientes con RPM y CV plasmática muy baja y/o que reciben TAR, el tratamiento de la RPM en estas pacientes no ha sido bien aclarado. El manejo dependerá fundamentalmente, de la edad gestacional. Frente a la RPM en mujeres gestantes con infección por VIH, la conducta de cuidados generales será la señalada en la Guía de Prevención del Parto Prematuro vigente, según la edad gestacional, asegurándose la administración de TAR y la resolución del parto vía cesárea. www.sochinf.cl 281 Documento En embarazos de término con RPM se aconseja llevar a cabo una inducción inmediata del parto si el índice de Bishop es favorable y si no está contraindicado el parto vaginal. Resumen • Deben adoptarse todas las medidas necesarias para prevenir el parto prematuro, de acuerdo a lo establecido en la Guía de Prevención de Parto Prematuro vigente, en coordinación con el médico tratante de los pacientes con infección por VIH/SIDA. • En presencia de contracciones regulares, se indica la administración, (junto con el tratamiento tocolítico) de AZT ev 2 mg/kg/hora durante la primera hora, seguida de 1 mg/kg/hora hasta que ceda la dinámica uterina. Si se desencadena el parto y/o se produce la rotura de las membranas, se deberá realizar una cesárea. VIII. Manejo y tratamiento del parto en mujer gestante seropositiva para VIH Atención del parto En las mujeres que llegan sin serología conocida para VIH al parto se debe revisar en laboratorio si ésta ha sido tomada. Si no se dispone del resultado, se debe realizar un tamizaje para VIH urgente, previa entrega de información y firma del consentimiento informado o denegación del examen. En todos los casos con resultado reactivo de un test para VIH en que no alcance a recibirse la confirmación antes del parto, deberá aplicarse el protocolo completo en la sala de partos incluyendo suspensión de la lactancia, según se describe más adelante (Lactancia materna). La cesárea electiva a las 38 semanas de gestación, antes de una eventual rotura de membranas o del inicio del trabajo de parto espontáneo, reduce sustancialmente el riesgo de transmisión del VIH. Por sí sola, disminuye en 50% el riesgo de transmisión del VIH y, asociada a la TAR durante el período prenatal, el parto y al RN, logra reducciones cercanas a 90% con tasas finales de TV menores a 2%. Sin embargo, los fundamentos científicos avalados por la evidencia actual indican que para las usuarias de TAR que tienen CV < 1.000 copias ARN/mL los beneficios de la cesárea son insuficientes para sacar conclusiones definitivas sobre la vía del parto, especialmente si se considera que la cesárea aumenta la morbilidad infecciosa, en 7-10 veces con respecto a parto vaginal. Por lo anterior, la vía del parto (vaginal o cesárea) debe ser evaluada considerando los criterios que permitan disminuir los riesgos tanto para el feto como la madre. Se debe informar a la mujer gestante sobre su situación 282 www.sochinf.cl particular, de tal manera de favorecer la aceptación de la vía de parto indicada por el médico. Los procedimientos obstétricos que aumentan el riesgo de exposición del feto a la sangre materna, tales como amniocentesis, biopsia de vellosidades y monitoreo invasor, han sido citados por algunos pero no todos los investigadores, como factores de riesgo de transmisión. En el manejo obstétrico no hay contraindicación para el uso de oxitocina, pero los derivados del ergot se acumulan en pacientes que reciben inhibidores de proteasa por la acción inhibitoria de éstos sobre el citocromo 3A4 y se ha descrito vasoconstricción exagerada e isquemia con el uso asociado. Resumen • Indicar cesárea en las mujeres con infección por VIH sin TAR durante el embarazo, en aquellas que no tienen resultado de CV a la semana 34 o si ésta es > 1.000 copias ARN/mL. • Puede permitirse parto vaginal en madres con TAR desde las 24 semanas de gestación o antes, con CV < 1.000 copias ARN/mL en la semana 34 y que además cumplan con las siguientes condiciones: edad gestacional mayor de 37 semanas, feto único en presentación cefálica, condiciones obstétricas favorables y atención por médico especialista. • Evitar maniobras invasoras: amniocentesis, biopsia de vellosidades coriales, monitorización interna, rotura artificial de membranas, parto instrumental (fórceps, espátulas). • Evitar el uso de metilergonovina si la paciente utiliza IP. Antiretrovirales durante el parto o cesárea El uso de AZT ev durante el parto permite niveles plasmáticos fetales efectivos, los cuales debido a su paso placentario generan una profilaxis pre-exposición. Esto, acompañado del uso de AZT en suspensión, vía oral al RN por 6 semanas, permite una profilaxis post exposición que en su conjunto tiene impacto en la TV, independientemente de si la gestante recibió AZT dentro de su esquema ARV, durante el embarazo o incluso la eventualidad de resistencia a AZT. Deberá utilizarse AZT de 200 mg/mL intravenoso intraparto en las dosis que se indican, independientemente de la vía escogida de parto: • Dosis de carga 2 mg/kg, a pasar en 1 hora. • Dosis de mantención: 1 mg/kg/hr. La dosis de carga se inicia 4 horas antes de la cirugía o en el inicio del trabajo de parto, la dosis de mantención es hasta la ligadura del cordón. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento En caso de no disponer de AZT de 200 mg/mL se indica el uso de AZT/3TC (300-150 mg) vía oral al inicio del trabajo de parto o 4 horas antes de la cesárea programada, repetir cada 3 horas hasta la ligadura del cordón. Deberá asociarse nevirapina en dosis de 200 mg por 1 vez antes de la cesárea, en cualquiera de las siguientes situaciones: • Inicio tardío del protocolo (más allá de las 34 semanas y que no alcanzan a completar las 4 semanas de TAR al parto). • CV de semana 34 > 1.000 copias/mL. • Diagnóstico de infección por VIH intraparto que no recibió TAR. Cuando se usa NVP intraparto, se le debe asociar AZT/3TC por 7 días post-parto para reducir el riesgo de desarrollar resistencia a NVP. Se puede agregar un IP post parto y mantener este esquema (AZT/3TC) hasta obtener los resultados de CD4 y CV e indicar el mejor esquema de acuerdo a sus condiciones. En Chile, la esterilización femenina y masculina están reguladas por el Ministerio de Salud, a través de la Resolución Exenta Nº 2326, del 30 de noviembre del 2000 y de las Normas Nacionales sobre Regulación de la Fertilidad, del 2007 que señalan que es una decisión personal que requiere de la firma de un consentimiento informado para ANTICONCEPCIÓN QUIRÚRGICA VOLUNTARIA. Resumen • Usar AZT de 200 mg/mL intravenoso intraparto: - Dosis de carga 2 mg/kg, a pasar en 1 hora, iniciar 4 horas antes de cirugía o inicio del trabajo de parto - Dosis de mantención: 1 mg/kg/h hasta la ligadura del cordón. • En caso de no disponer de AZT de 200 mg/mL se indica AZT/3TC (300/150 mg), al inicio del trabajo de parto o 4 horas antes de la cesárea programada, repetir cada 3 horas hasta la ligadura del cordón. • Asociar nevirapina en dosis de 200 mg por 1 vez antes de la cesárea, en caso de ausencia o inicio tardío de protocolo, y/o CV de semana 34 > 1.000 copias/mL Lactancia materna La suspensión de la lactancia materna reduce la tasa adicional de transmisión del VIH a los niños, que es variable, dependiendo de una serie de factores, tanto virales como maternos y de la duración del amamantamiento. La transmisión por lactancia obedece a la presencia de virus libre y asociado a células en la leche materna lo que ha sido detectado tanto por cultivo viral como por RPC. Rev Chilena Infectol 2013; 30 (3): 259-302 Como el calostro y la leche emitida tempranamente post parto son más ricas en células y por otra parte el sistema inmune en el recién nacido es más inmaduro, la posibilidad de transmisión del VIH por la alimentación a pecho es mayor durante el primer mes de vida. En Chile las condiciones de saneamiento ambiental y acceso a agua potable permiten la sustitución segura de la lactancia materna por la artificial, por lo tanto deberá suspenderse la lactancia materna a todos los hijos de madre seropositiva para VIH. En caso de test positivo intraparto, y elementos que sugieran comprensión y adherencia a las indicaciones, se indica la extracción manual de la leche y el reemplazo de la lactancia por sucedáneo de leche materna hasta el informe definitivo del ISP. Si el informe del ISP descarta la infección por VIH se indica iniciar la lactancia materna. Si el informe del ISP confirma la infección por VIH se indica supresión farmacológica de la producción láctea. Para la interrupción farmacológica de la lactancia materna, se debe administrar como 1ª línea cabergolina 0,25 mg cada 12 hrs. por dos días inmediatamente post parto. El fármaco alternativo es bromocriptina en dosis de 2,5 mg cada 12 horas por 7-10 días inmediatamente post parto. Resumen • Suspender la lactancia materna, en TODAS las mujeres seropositivas para VIH confirmadas, dado que los riesgos potenciales a lo que se expone un RN hijo de madre seropositiva, especialmente al calostro, superan ampliamente las desventajas de la suspensión de la lactancia materna. • Prohibir SIEMPRE, la lactancia materna exclusiva o mixta en madres seopositivas para VIH, la alimentación por nodrizas y por leche proveniente de bancos de leche. • Interrumpir la lactancia con cabergolina 0,25 mg cada 12 hrs. por dos días o bromocriptina en dosis de 2,5 mg cada 12 horas por 7-10 días inmediatamente post parto. IX. Atención del recién nacido expuesto al VIH Evaluación del RN expuesto al VIH Manejo inmediato Los objetivos de la atención del RN son evitar que un niño no infectado, adquiera la infección por VIH durante el período de trabajo de parto, parto y especialmente en el período de RN inmediato. Para ello deben implementarse las siguientes medidas: • Evitar el monitoreo invasor. • Aspiración orofaríngea prolija y suave con máquina de aspiración y lavado bucofaríngeo. www.sochinf.cl 283 Documento • Baño con abundante agua, jabón y enjuague. Eliminar el agua previa cloración. • Aseo de la piel donde se colocará vitamina K y otros tratamientos inyectables. • Alimentar con sucedáneo de la leche materna, prohibiendo lactancia materna y por nodrizas. Manejo mediato El RN debe ser evaluado en forma cuidadosa en busca de elementos que sugieran infección por VIH y/o efectos tóxicos de los ARV recibidos durante el embarazo y/o parto. La evaluación del RN incluye: Examen físico: dirigido a pesquisar hepatomegalia, esplenomegalia, adenopatías, etc. Exámenes de evaluación general: es indispensable realizar un hemograma precoz y periódico, ya que el efecto adverso más frecuente del AZT es la anemia, que generalmente es leve o moderada, pero puede ser intensa. Exámenes infectológicos: dirigidos a la pesquisa de infecciones que puede haber transmitido la madre durante el embarazo y/o parto, tales como toxoplasmosis, chagas, sífilis, rubéola, citomegalovirus, herpes simplex, hepatitis B, entre otras. El estudio de estas infecciones se debe orientar según los antecedentes maternos, incluyendo el antecedente clínico o epidemiológico de tuberculosis. Los exámenes realizados a la madre en relación a estas infecciones deberán adjuntarse a los datos del RN en el momento de su egreso de la maternidad. Evaluación inmunológica en el recién nacido expuesto al VIH: Solicitar dentro de la primeras 48 horas de vida, hemograma y recuentos de linfocitos CD4, con el fin de completar o diferir el programa de vacunación en el recién nacido. La vacuna BCG debe ser administrada según esquema habitual, sin embargo, debe ser diferida cuando el porcentaje de linfocitos CD4 sea inferior al 35% del total de linfocitos, hasta que los valores de CD4 sean normales para su edad. El seguimiento de la inmunidad celular y de la inmunidad humoral será programada por el médico tratante de SIDA Pediátrico correspondiente. Resumen • Alimentar con sucedáneo de la leche materna. • Evaluar al RN en busca de elementos que sugieran infección por VIH, efectos tóxicos de los ARV y otras infecciones transmitidas por la madre • Vacuna BCG, administrar según esquema habitual. Diferir si el porcentaje de linfocitos CD4 es inferior al 35% del total de linfocitos, hasta que los valores de CD4 sean normales para su edad. 284 www.sochinf.cl Diagnóstico de infección por VIH del RN y seguimiento Para realizar el diagnóstico de infección por VIH en niños menores de 2 años, hijos de madre seropositiva confirmada o en proceso de confirmación por el ISP, se debe enviar 4 ml de sangre con anticoagulante EDTA para realizar técnicas serológicas y moleculares de acuerdo al algoritmo establecido (Anexo 3b). La primera muestra de sangre se debe tomar dentro de las primeras 48 horas de vida. Si el resultado de la primera RPC es positivo, se tomará de inmediato la segunda muestra. Para hacer diagnóstico de infección, deben resultar positivos al menos 2 RPC. Si el resultado de la primera RPC es negativo, se tomará una segunda muestra entre los 15 y los 30 días de vida y se repetirá una tercera a los 3 meses de edad. Para descartar la infección, se debe tener dos resultados negativos de RPC, posterior a los 15 días de nacido. Todos los niños hijos de madre seropositiva para VIH deberán continuar sus controles en forma ambulatoria con un médico pediatra capacitado en la infección por VIH/SIDA, hasta precisar su situación en relación a la infección por VIH. Este pediatra autorizará la entrega de sustitutos de la leche materna, indicará medicamentos profilácticos de infecciones oportunistas y evaluará la pertinencia del uso de tratamiento antiretroviral según el caso. Todo hijo de madre que recibió TAR preventiva o para tratamiento de su propia patología, requiere seguimiento hasta la edad adulta, para pesquisar posibles efectos adversos, especialmente carcinogénesis (mínimo un control anual). Los casos de niños con infección por VIH confirmada deben ser notificados al Ministerio de Salud. Resumen • Para el diagnóstico de infección por VIH en niños menores de 2 años, hijos de madre seropositivas para VIH, se debe tomar la primera muestra de sangre dentro de las primeras 48 horas de vida. • Si la primera RPC es positiva, tomar de inmediato una segunda muestra. Para hacer diagnóstico de infección, deben resultar positivas al menos dos RPC. • Si la primera RPC es negativa, tomar segunda muestra entre los 15 y los 30 días de vida y una tercera a los 3 meses de edad. Para descartar la infección, se debe tener dos resultados negativos de RPC, posterior a los 15 días de nacido. • Todos los hijos de madre seropositiva para VIH deberán continuar sus controles en forma ambulatoria con un médico pediatra capacitado en VIH/SIDA. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Antiretrovirales al recién nacido Los RNs hijos de madre infectada con VIH que reciben el protocolo completo de prevención de la TV, y llegan al parto con CV indetectable, tienen un riesgo muy bajo de adquirir el VIH, a diferencia de aquellos expuestos al VIH especialmente durante el parto en que la mujer gestante tiene CV detectable. La mayoría de los estudios que demuestran la eficacia de la administración de ARV a RN como prevención post exposición, han sido realizados en RN expuestos a CV detectables durante la gestación, durante el parto y aún durante la lactancia materna en situaciones de aplicación insuficiente o nula del protocolo de prevención y de mantención de la lactancia materna. La administración de ARV al RN debe considerar no solamente la potencia del fármaco sino especialmente la evidencia existente en cuanto a la toxicidad en el RN y los aspectos farmacocinéticos complejos que resultan del metabolismo más lento de los ARV en RN, especialmente si son prematuros. En general se indica la administración de AZT a todos los RN hijos de madres infectadas con VIH aunque hayan recibido el protocolo completo de prevención de la TV, en base a la evidencia existente de eficacia de la profilaxis post exposición. El antecedente de resistencia materna a AZT no limita esta indicación por la existencia de subpoblaciones virales sensibles; sin embargo, en estos casos y en situaciones de administración de protocolos maternos incompletos o insuficientes para la supresión de la viremia se recomienda el uso de combinaciones de ARV al RN. La administración de AZT en suspensión al RN, se inicia entre las 6 y 12 horas de vida, en dosis de 2 mg/kg cada 6 horas, por 6 semanas. En RN que no puedan ser alimentados por vía oral se deberá administrar vía ev hasta que se pueda utilizar vía oral. La dosis indicada es de 1,5 mg/kg cada 6 horas ev para RN de término y de 1,5 mg/kg cada 12 horas ev para RN de pretérmino de menos de 35 semanas. A los RN hijos de madres que recibieron NVP como parte de la prevención de la TV, se debe administrar AZT por 6 semanas y agregar dos dosis de NVP solución oral de 2 mg/kg, a partir de las primeras 4 horas de vida y la segunda a las 48 a 72 horas de vida. A los RN de madres que no recibieron protocolo de prevención de la transmisión vertical o que sólo recibieron profilaxis intraparto se les debe administrar AZT por 6 semanas, en las dosis antes señaladas y dos dosis de NVP. A los RN de madres con viremia persistente a pesar de la administración de ARV o de madres con resistencia conocida a ARV se les debe administrar ARV adicionales en base a los antecedentes clínicos, virológicos, a la disponibilidad de formulaciones pediátricas y a la evaluación de expertos. Rev Chilena Infectol 2013; 30 (3): 259-302 Resumen • Todo RN hijo de madre con examen para VIH reactivo al parto y los hijos de madres infectadas con VIH confirmado por ISP, deben recibir TAR. • Todo RN hijo de madre seropositiva para VIH, debe recibir AZT 2 mg/kg cada 6 horas, vía oral, por 6 semanas a partir de las 6 a 12 horas de vida. • Los RN que no puedan recibir AZT suspensión oral, utilizar vía ev, en dosis de 1,5 mg/kg cada 6 horas para RN de término y de 1,5 mg/kg cada 12 horas para RN de pretérmino de menos de 35 semanas. • Los RN hijos de madres que recibieron NVP, administrar AZT por 6 semanas y agregar dos dosis de NVP solución oral de 2 mg/kg, a partir de las primeras 4 horas de vida y la segunda a las 48 a 72 horas de vida. • A los RN de madres que no recibieron protocolo de prevención de la TV o que sólo recibieron profilaxis intraparto se les debe administrar AZT por 6 semanas, en las dosis antes señaladas y dos dosis de NVP. • A los RN de madres con viremia persistente o de madres con resistencia a ARV se les deben adicionar ARV en base a los antecedentes clínicos, virológicos, la disponibilidad de formulaciones pediátricas y de la evaluación de expertos. Alimentación del recién nacido y lactante hijo de madre seropositiva para VIH Los RN hijos de madres infectadas con VIH deben recibir leche maternizada exclusiva hasta los 5 meses, 29 días, y se debe proceder a la interrupción farmacológica de la lactancia en la madre. A partir de los 6 meses los lactantes deben ingresar al Programa Nacional de Alimentación Complementaria. X. Detección de sífilis en mujeres gestantes Serología para sífilis y frecuencia de exámenes Existen dos tipos de exámenes de laboratorio, que permiten realizar el diagnóstico de sífilis, los no treponémicos, que se utilizan preferentemente como técnicas de tamizaje diagnóstico y para seguimiento y los treponémicos, que se utilizan como medio de confirmación diagnóstica (Tabla 6). Pruebas no treponémicas: VDRL (Venereal Disease Research Laboratory) Este tradicional método de laboratorio se fundamenta en una reacción antígeno-anticuerpo. Es la técnica no treponémica estándar, que se realiza en una lámina de vidrio con círculos de 14 mm de diámetro, utiliza una suspensión de antígeno, que el laboratorio debe preparar www.sochinf.cl 285 Documento Tabla 6. Sensibilidad y especificidad de los exámenes serológicos para sífilis Sensibilidad (%) según etapa clínica Sensibilidad Examen Primaria Especificidad Secundaria Latente precoz Latente tardía VDRL8 80 (70-87) 100 80 (71-100) 71 (37-94) 98 % RPR9 86 (81-100) 100 80 (53-100) 73 (36-96) 98 % FTA-Abs 98 (93-100) 100 100 96 99 % MHA-TP9 82 (69-90) 100 100 94 99 % ELISA 100 99 % 9 92 (88-97) 100 99 (96-100) USR 80 (72-88) 100 95 (88-100) Inmuno-cromatografía 93 100 9 100 71 (37-94) 100 99 % 99 % *Entre paréntesis resultados variables reportados. 8 CDC (Centers for Disease Control and Prevention, Atlanta, USA.) 9 Manual of clinica microbiology, 9na ed. 2007. Murray et al. diariamente. Esta suspensión se compone de cardiolipina, lecitina, colesterol en alcohol absoluto. La reacción se detecta visualmente al microscopio con aumento 100x. El examen VDRL mide anticuerpos IgM e IgG producidos como respuesta frente al proceso infeccioso de la sífilis y que reaccionan frente al material lipoidal liberado de las células hospederas dañadas, así como al material lipoproteico y posiblemente cardiolipina, liberado desde los treponemas. Los anticuerpos antilipoidales son anticuerpos que se producen no sólo como consecuencia de la sífilis, sino que en algunos casos puede asociarse a enfermedades autoinmunes, empleo de drogas endovenosas, endocarditis bacteriana y enfermedades infecciosas como TBC, infección por VIH, mononucleosis infecciosa y enfermedad periodontal, en las cuales hay daño de los tejidos. La técnica VDRL permite el análisis cualitativo y cuantitativo de las muestras de suero y líquido cefalorraquídeo. Se utiliza para monitorear el tratamiento ya que el VDRL a diferencia de otras técnicas, desciende precozmente sus diluciones después del tratamiento adecuado del paciente. Las diluciones de suero que se analizan son: sin diluir y reactivo débil, que equivalen a dilución 1:1. Las diluciones continúan en progresión geométrica, 1:2, 1:4, 1:8, 1:16, 1:32, 1:64, 1:128, 1:256 o más. En una persona sana sin antecedentes de sífilis el resultado debiera ser “no reactivo”. Actualmente está disponible una técnica de microfloculación basada en el VDRL, que detecta anticuerpos IgG e IgM, denominada USR (Unheated Serum Reagin). Este método se describe como VDRL modificado (según indicaciones de la OMS), porque el antígeno de USR contiene EDTA, elemento que hace más estable la técnica y que a diferencia del antígeno de VDRL, éste 286 www.sochinf.cl ya viene listo para su uso y no es necesario prepararlo diariamente y además contiene cloruro de colina lo que evita inactivar (calentar) las muestras. La técnica de USR permite el análisis cualitativo y cuantitativo de las muestras de suero y se discute su utilidad en líquido cefalorraquídeo. RPR (Rapid Plasma Reagin) El examen RPR detecta anticuerpos IgG e IgM producto de la respuesta inmune frente al material lipoidal liberado desde las células dañadas del hospedero, así como en respuesta a material lipoproteico, liberado desde los treponemas. Al igual que el VDRL, los anticuerpos antilipoidales que detecta este examen, pueden no solo ser producto de la sífilis, sino también en respuesta a otras enfermedades. El fundamento de esta técnica es una reacción antígeno-anticuerpo. Este fenómeno se visualiza en una tarjeta con cubierta plástica, en la cual se deposita suero y suspensión de antígeno, se rota a 100 r.p.m. durante 8 minutos y se observa a ojo desnudo. Si hay presencia de anticuerpos, éstos se combinan con las partículas lipídicas del antígeno produciendo aglutinación. Las partículas del carbón coaglutinan con los anticuerpos y se presentan como grumos negros sobre el fondo blanco de la tarjeta. Si no hay anticuerpos presentes se observa un color gris uniforme, un punto negro o una imagen de cola de humo. Es importante recordar que las diluciones de VDRL, USR y RPR no son equivalentes, ni comparables entre sí. Por lo anterior, los pacientes sometidos a seguimiento deben ser controlados siempre con la misma técnica. Pruebas treponémicas: FTA-Abs (Fluorescent Treponemal Antibody Absorption) Es una técnica de inmunofluorescencia indirecta, tradicionalmente utilizada como examen confirmatorio de sífilis. Esta técnica utiliza como antígeno blanco al T. pallidum fijado en láminas. Este examen requiere personal altamente entrenado y es operador dependiente, por lo que actualmente se realiza en el Centro Nacional de Referencia de la Red Asistencial, el ISP. El FTA-Abs es un examen cualitativo que se hace positivo como resultado del proceso infeccioso y permanece así por toda la vida. Por lo tanto, esta técnica no se utiliza para el seguimiento del paciente. MHA-TP (Microhemaglutination Assay for Antibody to Treponema pallidum) Es una técnica de hemoaglutinación pasiva basada en el fenómeno de la aglutinación producto de la reacción entre eritrocitos (sensibilizados con el antígeno de T. pallidum) y los anticuerpos presentes en el suero del Rev Chilena Infectol 2013; 30 (3): 259-302 Documento paciente infectado. Se emplea como examen confirmatorio, pero es menos sensible en las etapas precoz y tardía de la enfermedad que la técnica de FTA-Abs. Por su costo-efectividad es recomendable que este examen esté disponible en los laboratorios regionales de la Red Asistencial del sistema público. Test de ELISA para Treponema (Enzyme Linked Immunosorbent Assay) Es una técnica inmunoenzimática que detecta anticuerpos treponémicos específicos, altamente estandarizada, que se dispone en plataformas automatizadas, y a diferencia de las técnicas treponémicas anteriores no es operador dependiente, por lo que se ha recomendado de elección para tamizaje en donaciones de sangre. Inmunocromatografía Es una técnica cualitativa para detección de anticuerpos específicos contra T. pallidum. Se basa en un sistema de reacciones inmunológicas realizadas sobre una banda por migración. Cuando está presente el anticuerpo se forma un conjugado antígeno-anticuerpo que migra y se va a fijar a la zona de resultado dando una línea coloreada. El tamizaje para sífilis se realiza con examen no treponémico (VDRL/RPR) durante tres momentos de la gestación. • Primer examen: En el ingreso al control prenatal. • Segundo examen: A las 24 semanas de gestación. • Tercer examen: Entre las 32 y 34 semanas de gestación. Todo tamizaje que presente un resultado reactivo, debe ser cuantificado. Los laboratorios deben informar siempre al médico clínico la técnica utilizada. • Mujer gestante que presenta serología no treponémica reactiva. • Mujer gestante con serología para sífilis negativa cuya pareja presenta serología no treponémica reactiva. En ambos casos se debe realizar tratamiento inmediato, independiente de la dilución del examen no treponémico. Caso clínico confirmado: Sífilis primaria: Mujer gestante con serología no treponémica reactiva y lesiones de sífilis primaria (presencia de chancro primario, y/o adenopatía regional). Sífilis secundaria: Mujer gestante con serología no treponémica reactiva a diluciones iguales o mayores de 1:4, examen treponémico reactivo y manifestaciones clínicas compatibles: • lesiones cutáneas: máculas, pápulas o lesiones pápulo escamosas, no pruriginosas, distribuidas simétricamente, principalmente en el tronco y las extremidades. Es frecuente la localización palmoplantar. • lesiones mucosas: condilomas planos, parches mucosos, “boqueras” y otras. Los condilomas planos se localizan en áreas húmedas y calientes como la región vulvar, perianal, y pliegues, se presentan como pápulas o nódulos húmedos con olor característico. Los parches mucosos, en forma de placas blanquecinas húmedas, se ubican en la mucosa bucal y genital. El compromiso de fanéreos se manifiesta por alopecia en parches y alopecia de la cola de las cejas. La linfadenopatía se caracteriza por ganglios generalizados, pequeños y no dolorosos. Resumen • El tamizaje de sífilis en mujeres gestantes se realiza con exámenes no treponémicos en tres momentos de la gestación: al ingreso, a las 24 y entre las 32 y 34 semanas de embarazo. • Todo tamizaje que presente un resultado reactivo, debe ser cuantificado. Los laboratorios deben informar siempre al médico clínico la técnica utilizada. Diagnóstico de sífilis en la mujer gestante El diagnóstico de sífilis es el resultado de la correlación entre la clínica, los exámenes de laboratorio y los antecedentes epidemiológicos (Tabla 7). La sífilis ha sido clasificada en etapa precoz y tardía, cuyo límite se sitúa por consenso nacional en un año. Caso clínico probable: Se considera caso probable: Rev Chilena Infectol 2013; 30 (3): 259-302 Tabla 7. Etapas clínicas de la sífilis Período de tiempo promedio (1-90 días) 21 días Etapas Incubación Sífilis primaria Sífilis secundaria Sífilis latente precoz Sífilis latente tardía Sífilis terciaria Negativo Se hace positivo Diluciones elevadas mayor o igual a 1: 4 Dilución baja o alta Dilución baja o negativo Dilución baja o negativo Transmisibilidad sexual No Sí Sí Sí No No Riesgo de neurosífilis No Sí Sí Sí Sí Sí No se dispone de evidencia que descarte o confirme riesgo Sí Sí Sí Sí No se dispone de evidencia que descarte o confirme riesgo Resultado del VDRL Riesgo de transmisión vertical Hasta 1 año Más de 1 año www.sochinf.cl 287 Documento Sífilis latente precoz: Mujer gestante con serología no treponémica y test treponémico reactivo, ausencia de signos y síntomas, y/o que presenten antecedentes de: • Seroconversión o aumento del test no treponémico (VDRL) en más de dos diluciones durante los últimos 12 meses. • Síntomas concordantes con sífilis primaria o secundaria no tratada durante los últimos 12 meses. • Contacto sexual en los últimos 12 meses con pareja que tuvo sífilis primaria o secundaria o probable sífilis latente precoz. definido por la red asistencial para evaluación de la unidad feto placentaria y prevención de un parto prematuro. Los contactos sexuales de la mujer gestante deben ser estudiados y tratados siempre, independiente de su serología, debido a la existencia del periodo de ventana para las pruebas no treponémicas. De no tratarse a la pareja se considera el tratamiento inadecuado y al recién nacido en riesgo potencial de sífilis congénita. Sífilis latente tardía: Mujer gestante con serología no treponémica reactiva a diluciones bajas y test treponémico reactivo en ausencia de signos y síntomas, con uno o más de los siguientes antecedentes: • Seroconversión ocurrida en un tiempo mayor a 12 meses. • Contacto sexual con un caso de sífilis confirmada en un tiempo mayor a 12 meses. • El diagnóstico de sífilis es el resultado de la correlación entre la clínica, los exámenes de laboratorio y los antecedentes epidemiológicos. • Siempre deben realizarse esfuerzos en precisar la etapa clínica para determinar el tratamiento correcto, pronóstico y seguimiento correspondiente. Sífilis terciaria: Mujer gestante con presencia de manifestaciones compatibles con sífilis terciaria y serología treponémica y/o no treponémica reactiva: • Compromiso cardiovascular como aortitis, estenosis del ostium coronario, y otros. • Lesiones granulomatosas o gomas en cualquier tejido o viscera. XI. Manejo y tratamiento de la sífilis en la mujer gestante Tratamiento Toda mujer gestante con serología reactiva a cualquier dilución, debe recibir un tratamiento inicial (primera dosis) en el lugar donde se realiza el control del embarazo, con penicilina benzatina en 2.400.000 UI por vía intramuscular. Luego debe ser derivada dentro de la semana para estudio de confirmación, etapificación, completar tratamiento y seguimiento hasta el parto, a la UNACESS correspondiente en el sistema público o con médico dermatovenerólogo en el sistema privado de salud, de tal manera de asegurar la atención oportuna y el corte en la cadena de transmisión10. En localidades aisladas, el estudio, manejo y seguimiento del caso debe ser realizado por el equipo local responsable del control prenatal, asesorado por la UNACESS correspondiente. Toda mujer gestante mayor de 24 semanas con sospecha diagnóstica de sífilis secundaria (VDRL mayor o igual a 1:4 y manifestaciones clínicas compatibles) debe además ser derivada dentro de las 24 horas, al establecimiento Resumen Dosis en mujeres gestantes no alérgicas a penicilina Sífilis primaria, sífilis secundaria, sífilis latente precoz (sífilis de menos de 1 año de evolución): Medicamento Dosis Vía Frecuencia Duración Penicilina benzatina 2.400.000 UI intramuscular semanal 2 semanas consecutivas Sífilis latente tardía (sífilis con más de 1 año de evolución): Medicamento Dosis Vía Frecuencia Duración Penicilina benzatina 2.400.000 UI intramuscular semanal 3 semanas consecutivas Reacción de Jarisch-Herxheimer Es una reacción febril aguda, que se presenta en algunos pacientes dentro de las horas posteriores al tratamiento de sífilis con penicilina. Se manifiesta en 50% de los casos de sífilis primaria, en 90% de sífilis secundaria y 25% en sífilis latente precoz. Es poco frecuente en sífilis latente tardía. Esta reacción puede ocurrir también, posterior a un tratamiento antibiótico por otra causa, en pacientes portadores de una sífilis no detectada. El mecanismo de producción no está bien definido; sin embargo, podría deberse a la destrucción masiva de espiroquetas. Se presenta 4 a 12 horas después de la primera dosis de penicilina, manteniéndose por pocas horas y no se repite con tratamientos posteriores. Los pacientes presentan decaimiento, fiebre leve a moderada, con escalofríos y Código Sanitario, Título II, Párrafo II de las Enfermedades Venéreas; Reglamento sobre Infecciones de Transmisión Sexual. Decreto 206 del 2007. 10 288 www.sochinf.cl Rev Chilena Infectol 2013; 30 (3): 259-302 Documento rubor, debido a vasodilatación periférica. Las lesiones mucosas y cutáneas pueden exacerbarse y, a veces, puede presentarse un rash de sífilis secundaria por primera vez. Es conveniente advertir a los pacientes sobre la probabilidad de que se presente esta reacción y que en caso de presentarse, deben reposar algunas horas. La reacción Herxheimer puede producir distress respiratorio fetal y amenaza de parto prematuro o aborto. Esta reacción no debe confundirse con una reacción adversa a penicilina. Dosis en mujeres gestantes con alergia a penicilina En mujeres gestantes con alergia documentada a penicilina o a sus derivados, el tratamiento es eritromicina, en dosis de acuerdo a la etapa de la enfermedad en que sean diagnosticadas. La eritromicina no es efectiva para prevenir la sífilis congénita, por tener un paso transplacentario pobre e irregular. El uso de ceftriaxona no tiene evidencias científicas para la prevención de sífilis congénita; sin embargo, en algunos estudios ha demostrado eficacia en pacientes no gestantes. Debido a la reacción cruzada que pudiera existir a ceftriaxona en personas con alergia a penicilina, se puede utilizar como alternativa en casos de alergia no documentada y no tipo I (hipersensibilidad inmediata), requiriendo de todas las medidas de control y monitoreo para evitar un shock anafiláctico. No se debe usar ceftriaxona en personas con alergia a penicilina tipo I. Todo tratamiento de sífilis en mujeres gestantes que se realice con medicamentos diferentes a penicilina se considera, para efectos de estudio en el RN como “tratamiento inadecuado” y al RN como caso probable o presunto de sífilis congénita. Situación que debe ser informada a la mujer gestante. Sífilis primaria, sífilis secundaria, sífilis latente precoz (sífilis de menos de 1 año de evolución) Medicamento Dosis Vía Frecuencia Duración Eritromicina 500 mg Oral Cada 6 horas 14 días consecutivos Ceftriaxona* 1 gr intramuscular diaria 14 días * La administración de ceftriaxona en pacientes que refieren alergia a penicilina (no documentada) requiere de todas las medidas de control y monitoreo para evitar un shock anafiláctico debido a la posibilidad de reacción cruzada. Rev Chilena Infectol 2013; 30 (3): 259-302 Sífilis latente tardía (sífilis con más de 1 año de evolución) Medicamento Dosis Vía Frecuencia Duración Eritromicina 500 mg Oral Cada 6 horas 28 días consecutivos Ceftriaxo1 gr intradiaria 14 días na* muscular * La administración de ceftriaxona en pacientes que refieren alergia a penicilina (no documentada) requiere de todas las medidas de control y monitoreo para evitar un shock anafiláctico debido a la posibilidad de reacción cruzada. Resumen • Toda mujer gestante con serología reactiva para sífilis debe recibir tratamiento con penicilina benzatina en 2.400.000 UI por vía intramuscular, repitiendo semanalmente de acuerdo a la etapificación de la enfermedad. • La mujer gestante alérgica a penicilina debe recibir tratamiento con eritromicina en dosis de acuerdo a etapificación de la enfermedad. • Toda mujer gestante mayor de 24 semanas con sospecha diagnóstica de sífilis secundaria debe ser derivada dentro de las 24 horas, para evaluación de la unidad feto placentaria y prevención de parto prematuro. • Los contactos sexuales de la mujer gestante deben ser estudiados y tratados siempre. Seguimiento y evaluación de la respuesta al tratamiento Debe realizarse seguimiento serológico con VDRL mensual hasta el parto a la mujer gestante tratada adecuadamente, para detectar una posible reinfección y tratar en forma oportuna. Un tratamiento exitoso, según etapa se define: • Sífilis precoz: Disminución en dos o más diluciones de serología (con la misma técnica) al mes post tratamiento. • Sífilis tardía: Por imposibilidad de evidenciar disminución de diluciones, se evalúa la respuesta al tratamiento según sea la evolución clínica. Fracaso del tratamiento y/o reinfección se define según etapa como: • Sífilis precoz: la mantención o aumento de diluciones (con la misma técnica). • Sífilis tardía: el aumento de dos o más diluciones (con la misma técnica). Resumen • Debe realizarse seguimiento serológico con VDRL mensual hasta el parto a la mujer gestante para evaluar la respuesta a tratamiento y detectar reinfecciones. www.sochinf.cl 289 Documento XII. Manejo y tratamiento de la sífilis al parto Debe testearse con examen no treponémico a toda mujer gestante al momento de ingresar a la Maternidad por motivo de atención de parto, aborto o mortinato. El laboratorio debe comprometerse a entregar el resultado antes del alta de la paciente. La serología materna reactiva al parto no es sinónimo de sífilis, debiendo evaluarse el comportamiento de la curva serológica, para descartar una reinfección. El hallazgo de serología reactiva en la madre al momento del parto o aborto, sin historia de sífilis previa, debe ser considerada sífilis presunta por lo que debe recibir tratamiento inicial (primera dosis), con penicilina benzatina en 2.400.000 UI por vía intramuscular, tomar examen treponémico para confirmar diagnóstico y el RN debe ser evaluado para sífilis al nacer. Al alta, la mujer debe ser derivada para etapificación, completar tratamiento y manejo de contactos a la UNACESS en el sistema público o al dermatovenerólogo en el sistema privado. Los establecimientos asistenciales (maternidades y laboratorios) deben mantener registros de los abortos y mortinatos y la correspondiente información de la serología materna para sífilis a fin de realizar los análisis estadísticos, epidemiológicos y auditorías de caso. Debe realizarse seguimiento serológico con VDRL mensual hasta el parto a la mujer gestante para evaluar respuesta a tratamiento y detectar reinfecciones. La sífilis congénita puede prevenirse y tratarse eficazmente in utero, siempre y cuando el diagnóstico se haga en forma oportuna y el tratamiento sea adecuado, en la mujer gestante y su pareja. Manifestaciones clínicas Aborto o mortinato: Más de 50% de los fetos infectados muere. • Toda mujer atendida por causa de parto o pérdida reproductiva (aborto o mortinato) debe ser testeada para sífilis con VDRL/RPR. • Ninguna puérpera puede ser dada de alta sin conocer su resultado serológico para sífilis. • Toda puérpera con resultado serológico reactivo para sífilis debe ser referida para etapificación, completar tratamiento y manejo de contactos, cuando corresponda. • Todos los establecimientos asistenciales deben Multisistémica: Corresponde al niño que nace gravemente enfermo, con retraso del crecimiento, anemia, hepato-esplenomegalia, lesiones cutáneas variadas, compromiso del SNC. Es la forma menos frecuente, indistinguible de otros cuadros sépticos pero generalmente de fácil diagnóstico por serología. XIII. Detección de sífilis en el recién nacido Sífilis congénita corresponde a la infección transplacentaria por T. pallidum al producto de la gestación, desde una madre con sífilis no tratada o inadecuadamente tratada. Ocurre una diseminación hematógena de la infecwww.sochinf.cl La gravedad de la infección se relaciona con el momento en que la madre adquirió la sífilis y, por lo tanto, con el estadio de infección materna al momento del embarazo, la edad gestacional al momento de la infección, la carga de treponemas que infectan al feto y la oportunidad de la respuesta inmunológica de la madre. Resumen mantener registros de los abortos y mortinatos y la correspondiente información de la serología materna para sífilis. 290 ción comprometiendo prácticamente todos los sistemas y tejidos del organismo, siendo piel, mucosas, huesos, hígado, bazo y sistema nervioso central los más afectados. El RN infectado puede presentarse con una amplia gama de manifestaciones: desde asintomático hasta gravemente enfermo. El diagnóstico es complejo por el paso de anticuerpos IgG maternos (treponémicos y no treponémicos) al feto, lo que dificulta la interpretación de los resultados serológicos. Las manifestaciones de la infección por T. pallidum in utero dependen de: • La etapa evolutiva de la enfermedad en la mujer gestante. • Edad gestacional, al momento de la infección. • Tratamiento efectivo en la mujer gestante. Oligosintomática: Se presenta generalmente en los primeros seis meses de vida. Las principales manifestaciones son rinorrea serohemática, lesiones cutáneas descamativas y alteraciones óseas. El cuadro clínico con escasa signología hace que frecuentemente se haga un diagnóstico tardío. Asintomática: Constituye la forma de presentación más frecuente. El 60% de los RN infectados son asintomáticos al nacimiento, los que desarrollarán síntomas a las 3 a 8 semanas si no reciben tratamiento. Las manifestaciones clínicas en los hijos de madre con sífilis no tratada o inadecuadamente tratada se clasifican en precoces y tardías: Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Sífilis congénita precoz: Se manifiesta hasta los dos primeros años de vida como: Cuadro multisistémico fulminante, similar a otros cuadros sépticos del recién nacido. Lesiones cutáneas y mucosas a partir de las 2 a 10 semanas de vida: - Lesiones mucosas: rinitis mucosa, mucopurulenta o sanguinolenta entre los 7 y 14 días de nacido. Los parches mucosos son placas blanquecinas de la lengua, borde lingual y garganta que pueden producir estridor laríngeo. Aparecen además rágades y condilomas planos. - Lesiones cutáneas: exantema maculo papular simétrico y, menos frecuente pero muy específico, lesiones ampollares palmo- plantares (pénfigo sifilítico asociado a una alta mortalidad). Lesiones óseas: osteocondritis que puede generar una pseudo parálisis de Parrot, epifisitis y periostitis de las falanges proximales (dactilitis) detectadas por radiografía, generalmente después del primer mes de vida. Linfadenopatía generalizada. Bajo peso al nacer. Anemia, trombocitopenia e ictericia. Hepato-esplenomegalia. Alteración de líquido cefalorraquídeo con o sin manifestaciones neurológicas. Manifestaciones oculares: uveítis, glaucoma y coriorretinitis en “sal y pimienta”. Compromiso renal: glomerulonefritis o síndrome nefrótico. Otras: neumonía alba, miocarditis, pancreatitis, etc. Sífilis congénita tardía: Manifestaciones que aparecen después de los dos años de vida, siendo más frecuente en la pubertad debido a la inflamación crónica de los tejidos afectados. Las manifestaciones de la sífilis congénita tardía son similares a las de la sífilis terciaria del adulto: • Queratitis intersticial. • Formación de granulomas necrosantes (gomas). • Sífilis cardiovascular (poco frecuente). Algunos casos pueden presentar secuelas (denominadas estigmas) como: • Dientes de Hutchinson. • Molares de mora. • Perforación del paladar duro. • Nariz en silla de montar. • Tibias en “sable”. • Opacidades corneales. • Atrofia óptica. • Sordera por compromiso del octavo par. • Hidrartrosis (articulación de Clutton). Rev Chilena Infectol 2013; 30 (3): 259-302 Neurosífilis: Se puede presentar tanto en etapa precoz como tardía con o sin manifestaciones neurológicas. Criterios para el diagnóstico El diagnóstico es el resultado del análisis de los antecedentes epidemiológicos maternos, serología neonatal, examen físico del niño/a y las alteraciones de exámenes radiológicos y de laboratorio: Antecedentes epidemiológicos maternos: • ITS de la madre y sus parejas/contactos sexuales, durante el embarazo actual o en embarazos anteriores. • Ausencia de control de embarazo, o control irregular. • Abuso de sustancias (alcohol, drogas, medicamentos, etc.) • Situación de riesgo social. • Tratamiento inadecuado o incompleto de la madre y sus parejas/contactos sexuales. Definición de tratamiento adecuado de la mujer gestante para evaluar riesgo del recién nacido/a 1. Penicilina benzatina 2.400.000 UI última dosis al menos 1 mes antes del parto. 2. Al parto, reducción de más de dos diluciones del VDRL.. La mujer gestante que recibió eritromicina u otro antibiótico se considera como inadecuadamente tratada. Serología neonatal El hallazgo de test serológicos treponémicos y no treponémicos reactivos al nacimiento puede deberse al traspaso transplacentario de IgG materna y no deben ser considerados diagnóstico. Hasta el momento no hay disponible una prueba diagnóstica que permita asegurar la presencia de infección en un RN. Si no existe infección, los anticuerpos adquiridos por el RN en forma pasiva a través de la placenta, deben disminuir a los 3 meses de edad y desaparecer a los 6 meses. Por lo general, el VDRL se hace NO REACTIVO a los 3 meses de edad. La IgM específica reactiva para Treponema pallidum en el RN, es signo sugerente de infección. Se detecta en más de 80% de los niños sintomáticos, pero suele estar ausente en hasta 35% de los niños asintomáticos. Tiene valor diagnóstico, sólo si la madre no recibió tratamiento o ha sido inadecuadamente tratada. Los exámenes treponémicos no son útiles para el diagnóstico de sífilis congénita; sin embargo, confirman el diagnóstico de forma retrospectiva cuando son positivos después de los 12 meses de vida. En la misma situación www.sochinf.cl 291 Documento un test treponémico negativo no descarta este diagnóstico, porque el recién nacido tratado precozmente podría no haber alcanzado a montar respuesta inmune. En un RN un VDRL reactivo en dos o más diluciones mayores a la dilución materna tiene valor diagnóstico de sífilis congénita. (Por ejemplo: madre VDRL 1:2 y RN VDRL 1:8). Si este criterio no está presente, no descarta diagnóstico ya que esto se debe a que hay evidencia de muestras pareadas de suero de madres infectadas y sus hijos que indica que sólo 30% de los niños tiene diluciones superiores a los de la madre. El único método útil para el diagnóstico de neurosífilis es el VDRL reactivo en LCR. Ningún RN debe ser dado de alta sin conocer el estado serológico para sífilis de la madre. Examen físico del niño/a: La presencia de signos de sífilis descritos en las formas clínicas sugiere caso probable o presunto. Alteraciones de exámenes radiológicos y de laboratorio: • VDRL reactivo en líquido cefalorraquídeo. • Hallazgos anormales en el LCR de acuerdo a la edad gestacional y/o cronológica. La interpretación de estos parámetros en el RN es difícil por su amplia variabilidad, pero valores de leucocitos mayores a 10-20 por mm3 y/o proteínas mayor a 40 mg/dl, se consideran como límite normal. • Alteración de función hepática y renal compatibles con las manifestaciones clínicas descritas. • Rx. de huesos largos compatible con los hallazgos descritos. Definición clínica de sífilis congénita Probable o presunta: Recién nacido hijo de madre con sífilis, con o sin signos sugerentes de infección o con imposibilidad de descartarla. Confirmada: Descrita en capítulo de vigilancia epidemiológica. Resumen • El diagnóstico de sífilis congénita se realiza con el análisis de los antecedentes maternos, análisis de la serología neonatal, examen físico del niño/a y el resultado de exámenes radiológicos y de laboratorio. • Ningún RN debe ser dado de alta sin conocer el estado serológico para sífilis de la madre. 292 www.sochinf.cl XIV. Manejo del recién nacido hijo de madre con sífilis Estudio Se debe estudiar y tratar todos los RN que: - Evidencien enfermedad activa (examen físico, radiografías, laboratorio). - Sean hijos de madres inadecuadamente tratadas de acuerdo a la definición establecida. - Madres con serología reactiva sin control de embarazo. - Madres que no hayan presentado respuesta esperada al tratamiento o que se sospeche reinfección. - Madres con sífilis tratada pero con seguimiento serológico insuficiente. - Madres cuyos contactos sexuales no han sido tratados. - Madres sin historia de sífilis previa, con serología reactiva al parto a cualquier dilución (en este caso se debe tomar prueba treponémica a la mujer gestante para confirmar la sífilis). La evaluación clínica y de laboratorio de los recién nacidos de las madres antes descritas incluye: - Examen físico completo para determinar la existencia de manifestaciones clínicas de sífilis congénita precoz. - VDRL en sangre y LCR. - Estudio citoquímico de LCR. - Hemograma y recuento de plaquetas. - Exámenes de función hepática (transaminasas, bilirrubina y protrombina) y función renal de acuerdo a la clínica (Orina completa, nitrógeno ureico o urea). - Radiografía de huesos largos. - Fondo de ojo. - Rx. de tórax, en caso de presentar sintomatología respiratoria. Resumen • Se debe estudiar y tratar a todos los RN que presenten evidencias clínicas sospechosas de sífilis congénita. • Se debe estudiar y tratar todos los recién nacidos hijos de madres con sífilis no tratada, inadecuadamente tratada y/o sin tratamiento de contacto sexuales. Penicilina sódica es el tratamiento de elección (50.000 UI por kilo de peso por dosis). La frecuencia de administración debe adecuarse según avanza la edad del recién nacido (Tabla 8). En Anexo 7 se presenta flujograma de decisiones terapéuticas, para sífilis congénita. Penicilina benzatina no alcanza concentraciones de fármaco detectables en líquido cefalorraquídeo, por lo que no es adecuada para el tratamiento de la sífilis congénita. El RN con neurosífilis se debe tratar por 10 días. En caso de punción lumbar frustra o hemorrágica, no insistir. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Tabla 8. Tratamiento y seguimiento de la sífilis congénita Edad Medicamento Dosis Vía Frecuencia Duración 0 – 7 días Penicilina sódica 50.000 UI por kilo de peso endovenosa cada 12 horas Por 10 días consecutivos 8 - 28 días Penicilina sódica 50.000 UI por kilo de peso endovenosa cada 8 horas Por 10 días consecutivos Más de 28 días Penicilina sódica 50.000 UI por kilo de peso endovenosa cada 4 ó 6 horas Por 10 días consecutivos Para el seguimiento del RN se diferencian tres situaciones específicas: Madre adecuadamente tratada y RN con VDRL periférico reactivo no tratado RN con sífilis congénita tratada (probable y/o confirmada) RN con neurosífilis - Control médico y VDRL al mes, a los 2 meses, a los 3 meses o hasta que el VDRL sea NO REACTIVO. - Si las diluciones de VDRL se mantienen estables o aumentan se debe reevaluar al niño/a e indicar tratamiento. - A los 6 meses de vida, debe negativizarse el VDRL, en caso contrario, reevaluar al niño/a. - Alta luego de corroborar que el VDRL sea NO REACTIVO. - Control médico y con VDRL al mes, a los 2, 3, 6 y 12 meses de vida. - Si el VDRL permanece reactivo a los 6 meses de edad, se debe reevaluar al niño/a. - A los 12 meses de edad realizar pruebas treponémicas. - Control médico y VDRL al mes, a los 2, 3, 6 y 12 meses de vida. - Control de VDRL en LCR a los 6 meses de edad, para corroborar que sea NO REACTIVO. En caso contrario, reevaluar y volver a tratar al niño/a. - A los 12 meses de edad realizar pruebas treponémicas. - Realizar seguimiento neurológico, por otorrino y oftalmólogo a los 3, 6 y 12 meses de edad. Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 293 Documento XV. Anexos Anexo 3a: Algoritmo de confirmación de infección por VIH ALGORITMO DE CONFIRMACIÓN DE INFECCIÓN POR VIH (Excepto para hijos de madres VIH(+) menores de 2 años) PR-243.01-001 Muestra 2º muestra sangre TAMIZAJE 1 / TAMIZAJE 2 SOP/SOP GEN/SOP GEN/GEN IFI SOP GEN IND Sí 1 ¿2º muestra? No LIA GEN IND SOP Ag p24* POS POS: positivo, NEG: negativo, INDET: indeterminado, SSNM: se solicita nueva muestra de sangre. *Screening. Nota: En casos excepcionales algunas muestras podrian no seguir este algoritmo. 294 www.sochinf.cl Resultado ISP POSITIVO Resultado ISP SSNM No NEG ¿Tamizajes 1y2 bajos? Sí Resultado ISP NEGATIVO Rev Chilena Infectol 2013; 30 (3): 259-302 Documento ALGORITMO DE CONFIRMACIÓN DE INFECCIÓN POR VIH (Excepto para hijos de madres VIH (+) menores de 2 años) PR-243.01-001 1 LIA POS IND NEG Ag p24* NEG ¿Tamizajes 1y2 bajos? RPC POS Resultado ISP POSITIVO NEG Resultado ISP NEGATIVO POS: positivo, NEG: negativo, INDET: indeterminado, SSNM: se solicita nueva muestra de sangre. *Screening. Nota: En casos excepcionales algunas muestras podrian no seguir este algoritmo. Rev Chilena Infectol 2013; 30 (3): 259-302 www.sochinf.cl 295 Documento Anexo 3b: Algoritmo de confirmación de infección por VIH en pediatría ALGORITMO DE CONFIRMACIÓN DE VIH SIDA PEDIÁTRICO (Excepto los hijos de madres VIH (+) mayores o iguales a la edad de 2 años) IT-243.01-001 Rev. 1 TAMIZAJE 1 POS Ag p24 POS NEG RPC RPC POS RESULTADO ISP SSNM 2º muestra inmediatamente después de la primera muestra NEG POS RESULTADO ISP a) Recién nacidos: SSNM 2º muestra al mes de edad 3º muestra a los tres meses de edad. b) Niños > 1 mes y < 18 meses: SSNM 2º muestra al mes después de la primera. c) Niños > 18 meses y < 24 meses: NEGATIVO POS: positivo, NEG: negativo, INDET: indeterminado, SSNM: se solicita nueva muestra de sangre. 296 www.sochinf.cl Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Anexo 4: Flujograma de derivación CONTROL DE EMBARAZO Examen con orientación pre test NO REACTIVO REACTIVO LOCAL INSTITUTO DE SALUD PÚBLICA Confirmado positivo Atención VIH/SIDA Confirmado negativo Alto riesgo obstétrico ARV Parto cesárea electiva ARV y suspensión lactancia Neonatología ARV Inicio estudio VIH y sustituto leche materna Atención VIH/SIDA pediátrico Estudio VIH Rev Chilena Infectol 2013; 30 (3): 259-302 VIH (-) VIH (+) Control anual (Efectos adversos ARV) Control según guías clínicas vigentes www.sochinf.cl 297 Documento Anexo 5: Clasificación de antiretrovirales según FDA Consideraciones y Recomendaciones de uso en embarazo Antiretroviral 298 www.sochinf.cl Clasificación Consideraciones FDA Recomendaciones Zidovudina (AZT) C Sin evidencia de teratogenicidad. Bien tolerado, seguridad a corto plazo demostrada para madre e hijo. INTR preferido para usar en combinaciones de ARV basado en estudios de eficacia y amplia experiencia. Lamivudina (3TC) C Sin evidencia de teratogenicidad. Si existe coinfección con VHB puede producir reactivación si se suspende post parto. Debido a amplia experiencia en su uso, en combinación con AZT es el régimen recomendado. Didanosina (ddI) B Puede producir acidosis láctica fatal si se combina con d4T. INTR alternativo. Abacavir (ABC) C Sin evidencia de teratogenicidad. Hipersensibilidad. en 5-8% en mujeres no embarazadas; se desconoce datos en embarazo. INTR alternativo. Tenofovir (TDF) B Sin evidencia de teratogenicidad. Desmineralización ósea en uso crónico de significado clínico incierto. INTR alternativo después de haber considerado otros ARV. Monitorizar función renal por toxicidad renal. Efavirenz (EFV) D Malformaciones significativas. Debe evitarse en 1er trimestre. Deberá considerarse sólo después de haber analizado otras alternativas. Nevirapina (NVP) B Sin evidencia de teratogenicidad. Aumento de toxicidad hepática potencialmente letal en mujeres con CD4>250/mm3 al inicio de terapia. Si la mujer se embaraza utilizando NVP y es bien tolerada puede continuarse independiente de los CD4. Atazanavir (ATV) B Sin evidencia de teratogenicidad. Riesgo de aumento de bilirrubina en RN no observado clínicamente. IP alternativo. Indicar potenciado con ritonavir. Lopinavir/ritonavir (LPV/r) C Bien tolerado. Seguridad a corto plazo demostrada en estudios fase I / II IP de elección. Se han descrito hiperglicemia o exacerbación de diabetes mellitus y cetoacidosis diabética. Saquinavir (SQV) B Sin evidencia de teratogenicidad. Bien tolerado. Seguridad a corto plazo demostrada para madre e hijo. IP alternativo. Indicar potenciado con ritonavir. Ritonavir (RTV) B Sin evidencia de teratogenicidad. Experiencia limitada en dosis completa en embarazo. Se recomienda su uso asociado a otro IP para aumentar los niveles del segundo IP. Fosamprenavir (FPV) C Limitada experiencia en humanos. Datos insuficientes para recomendar su uso. Darunavir (DRV) C Sin experiencia en humanos. Datos insuficientes para recomendar su uso. Enfuvirtida (T20) B Limitada experiencia en humanos. Datos insuficientes para recomendar su uso. Raltegravir (RAL) C Sin experiencia en humanos. Datos insuficientes para recomendar su uso. Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Anexo 6: Principales toxicidades de los antiretrovirales ARV Toxicidad principal Otras toxicidades AZT Anemia, neutropenia Gastrointestinal, cefalea, rash d4T Polineuropatía, lipoatrofia, acidosis láctica Pancreatitis, esteatosis hepática 3TC -- Gastrointestinal, cefalea ddI Pancreatitis, polineuropatía Gastrointestinal, hiperuricemia Abacavir Reacción de hipersensibilidad Gastrointestinal Tenofovir -- Gastrointestinal, renal Efavirenz SNC: vértigo, psicosis Rash, hepatotoxicidad, dislipidemia Nevirapina Rash, hepatotoxicidad -- IP (excepto atazanavir) Lipodistrofia, dislipidemia, diabetes mellitus Hepatotoxicidad, gastrointestinal, osteonecrosis Indinavir Metabólicas, hiperbilirrubinemia, litiasis renal Gastrointestinal Atazanavir Hiperbilirrubinemia, rash Gastrointestinal • La toxicidad mitocondrial por inhibición de la ADN polimerasa gamma es común a todos los INTR siendo máxima para d4T y mínima para abacavir. • La toxicidad metabólica: lipodistrofia, dislipidemia, intolerancia a los hidratos de carbono y aumento del riesgo cardiovascular es común a todos los IP, excepto atazanavir. Graduación de las principales toxicidades Hematocrito (%) Grado 1 Grado 2 Grado 3 Grado 4 28,5 – 31,4 24 – 28,4 19,5 – 23,9 < 19,5 Hemoglobina (grs/100 ml) Glóbulos blancos (/mm3) 9,5 – 11 8,0 – 9,4 6,5 – 7,9 < 6.5 2.500 – 3.999 1.000 – 2.499 800 – 999 < 800 Recuento neutrófilos (/mm3) 1.000 – 1.499 750 – 999 500 – 749 < 500 Recuento plaquetas (/mm3) 75.000 – 99.000 50.000 –74.999 20.000 – 49.999 < 20.000 o petequias Hiperglicemia (mgs/100 ml) 116 – 160 161 – 250 251 – 500 > 500 o cetoacidosis Hipertrigliceridemia (mgs/100 ml) 250 – 400 401 – 750 751 – 1.250 > 1.250 Acidosis metabólica (HCO3:mEq/lt) 19 – 21 15 – 18 10 - 14 < 10 Creatinina (x límite máx normal) 1,1 – 1,5 1,6 – 3,0 3,1 – 6,0 > 6 o diálisis Bilirrubina (x límite máx normal) 1,1 – 1,5 1,6 – 2,5 2,6 – 5.0 >5 GOT (x límite máx normal) 1,25 – 2,5 2,6 – 5,0 5,1 – 10,0 > 10 GPT (x límite máx normal) 1,25 – 2,5 2,6 – 5,0 5,1 – 10.0 > 10 GGT (x límite máx normal) 1,25 – 2,5 2,6 – 5,0 5,1 – 10,0 > 10 Fosfatasas alcalinas (x lím máx normal) 1,25 – 2,5 2,6 – 5,0 5,1 – 10,0 > 10 Lipasa (x límite máx normal) 1,1 – 1,39 1,4 – 2,09 2,1 – 5,0 > 5 o pancreatitis Amilasa (x límite máx normal) 1,1 – 1,39 1,4 – 2,09 2,1 – 5,0 > 5 o pancreatitis Vómitos Aislados Frecuentes Hipotensión o hidratación EV Hipotensión severa y/u hospitalización Diarrea 3 – 4 x día 5 – 7 y/o nocturna > 7, hipotensión, hidratación ev Hipotensión severa y/u hospitalización Litiasis renal Grado 4: Hematuria severa y/o insuficiencia renal obstructiva Polineuropatía Alteración del SNC Alergia Leve Requiere tratamiento Interfiere con el sueño Limita la marcha Ansiedad o depresión leve Moderada Severa, requiere asistencia Psicosis aguda y/u hospitalización Rash leve y/o prurito Máculas o máculo-pápulas difusas Generalizadas Anafilaxis, Stevens Johnson o exfoliación Hipersensibilidad a abacavir Rev Chilena Infectol 2013; 30 (3): 259-302 Grado 4: Rash con fiebre y/o síntomas digestivos o respiratorios www.sochinf.cl 299 Documento Anexo 7: Flujograma decisiones terapéuticas en sífilis congénita MADRE CON VDRL REACTIVO AL PARTO Falso positivo a VDRL No reactivo Test treponémico Reactivo Sí PREGUNTAR 1.¿Fue tratada adecuadamente, según norma? 2. ¿La dilución materna al parto es menor en dos diluciones a la obtenida en el momento del diagnóstico de sífilis? Cierre de caso RN sintomático ¿Sífilis congénita descartada? No No RN con sífilis congénita probable VDRL al RN Sí Cierre de caso RN asintomático Evaluar al niño/a • Evaluar con exámenes • Hospitalizar al RN • Tratamiento • Evaluar con exámenes • Tratamiento ¿Sífilis congénita confirmada? Sí No Al alta derivar a seguimiento hasta el año de vida en establecimiento definido por la red Ingresa a proceso vigilancia (notificación de caso) • Al año de vida exámenes treponémicos No ¿Sífilis congénita confirmada? Sí Sífilis congénita probable Sin posibilidad de confirmar o descartar Cierre de caso 300 www.sochinf.cl Rev Chilena Infectol 2013; 30 (3): 259-302 Documento Referencias bibliográficas 1.- Organización Panamericana de la Salud, Centro Latinoamericano de Perinatología, Salud de la Mujer y Reproductiva, UNICEF. Iniciativa regional para la eliminación de la transmisión maternoinfantil de VIH y de la Sífilis congénita en América Latina y el Caribe: “Guía clínica para la eliminación de la transmisión materno infantil del VIH y de la Sífilis congénita en América Latina y el Caribe”. Washington, D.C.: OPS. 2009. 2.- Organización Panamericana de la Salud, Centro Latinoamericano de Perinatología, Salud de la Mujer y Reproductiva, UNICEF. “Iniciativa regional para la eliminación de la transmisión materno infantil de VIH y de la Sífilis congénita en América Latina y el Caribe: documento conceptual”. Montevideo: CLAP/ SMR; set. 2009. 3.- Estrategia Nacional de Eliminación de la Transmisión Vertical del VIH y Sífilis en Chile, Minsal, 2011. 4.- Ministerio de Salud Chile. Departamento de Epidemiología. Evolución del VIH-SIDA Chile 1984-2010. Disponible en http://epi. minsal.cl/epi/html/bolets/ reportes/VIH-SIDA/ InformePais_1984-2010_vih_sida.pdf (acceso el 23 de junio de 2011). 5.- Ministerio de Salud Chile. Guía Clínica Síndrome de Inmunodeficiencia Adquirida. VIH/SIDA. Santiago: MINSAL, 2010. 6.- The Working Group on Mother-To-Child Transmission of HIV. Rates of mother- to-child transmission of HIV-1 in Africa, America, and Europe: results from 13 perinatal studies. J Acquir Immune Defic Syndr Hum Retrovirol 1995; 8 (5): 506-10. 7.- Adjorlolo-Johnson G, de Cock K, Ekpini E, Vetter K, Sibailly T, Brattegaard K, et al. Prospective comparison of mother-to-child transmission of HIV-1 and HIV-2 in Abidjan, Ivory Coast. JAMA 1994; 272: 462-73. 8.- Comisión Nacional del SIDA, Subsecretaría de Salud Pública, Ministerio de Salud Chile. Norma de Prevención de la Transmisión Vertical del VIH. Agosto 2005. 9.- Public Health Service Task Force Recommendations for the Use of Antiretroviral Drugs in Pregnant HIV-1 Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States, April 29; 2009 http://aidsinfo.nih.gov/contentfiles/ PerinatalGL.pdf (acceso el 23 de mayo de 2009). 10.- Dunn D, Newell M, Ades A, Peckham C. Risk of human immunodeficiency virus type 1 transmission through breastfeeding. Lancet 1992; 340: 585-8. 11.- Wen SW, Smith G, Yang Q, Walker M. Epidemiology of preterm birth and neonatal outcome. Semin Fetal Neonatal Med 2004; 9 (6): 429-35. Rev Chilena Infectol 2013; 30 (3): 259-302 12.- Cooper E R, Charurat M, Mofenson L, Hanson IC, Pitt J, Díaz C et al. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and prevention of perinatal HIV-1 transmission. J Acquir Immune Defic Syndr 2002; 29(5):84-494. 13.- European Collaborative Study. Pregnancyrelated changes in the longer-term management of HIV-infected women in Europe. Eur J Obstet Gynecol Reprod Biol 2003; 111 (1): 3-8. 14.- Ellis J, Williams H, Graves W, Lindsay M K. Human immunodeficiency virus infection is a risk factor for adverse perinatal outcome. Am J Obstet Gynecol 2002; 186: 903-6. 15.- Tuomala R E, Watts DH, Li D, Vajaranant M, Pitt J, Hammill H, et al. Improved obstetric outcomes and few maternal toxicities are associated with antiretroviral therapy, including highly active antiretroviral therapy during pregnancy. J Acquir Immune Defic Syndr 2005; 38 (4): 449-73. 16.- Brocklehurst P, French R. The association between maternal HIV infection and perinatal outcome: a systematic review of the literature and meta-analysis. Br J Obstet Gynaecol 1998; 105: 836-48. 17.- Stratton P, Tuomala RE, Abboud R, Rodríguez E, Rich K, Pitt J, et al. Obstetric and newborn outcomes in a cohort of HIV-infected pregnant women: a report of the women and infants transmission study. J Acquir Immune Defic Syndr Hum Retrovirol 1999; 20 (2): 179-86. 18.- European Collaborative Study. Vertical transmission of HIV-1: maternal immune status and obstetric factors. AIDS 1996; 10:1675-81. 19.- Lorenzi P, Spicher VM, Laubereau B, Hirschel B, Kind C, Rudin C, et al. Antiretroviral therapies in pregnancy: maternal, fetal and neonatal effects: Swiss HIV Cohort Study, the Swiss Collaborative HIV and Pregnancy Study and the Swiss Neonatal Study. AIDS 1998; 12 (18): F241-7. 20.- The European Collaborative Study and the Swiss Mother and Child HIV Cohort Study. Combination antiretroviral therapy and duration of pregnancy. AIDS 2000; 14:2913-20. 21.- Goldstein P J, Smit R, Stevens M, Sever J L. Association between HIV in pregnancy and antiretroviral therapy, including protease inhibitors and low birth weight infants. Infect Dis Obstet Gynecol 2000; 8 (2): 94-8. 22.- European Collaborative Study. Increased risk of adverse pregnancy outcomes in HIV-infected women treated with highly active antiretroviral therapy in Europe _Research letter_. AIDS 2004; 18: 2337-9. 23.- Sociedad Española de Obstetricia y Ginecología (SEGO). Protocolos asistenciales en Obstetricia. Rotura prematura de membranas (2003). Disponible en: http://www.sego.es. 24.- Minkoff H, Burns D N, Landesman S, Youchah J, Goedert J J, Nugent R P, et al. The relationship of the duration of ruptured membranes to vertical transmission of human immunodeficiency virus. Am J Obstet Gynecol 1995; 173: 585-9. 25.- Landesman S, Kaiish L A, Burns D N, Minkoff H, Fox H E, Zorrilla C, et al. Obstetrical factors and the transmission of human immunodeficiency virus type 1 from mother to child. N Engl J Med 1996; 334: 1617-23. 26.- The International Perinatal HIV Group. Duration of ruptured membranes and vertical transmission of HIV-1: a meta-analysis from 15 prospective cohort studies. AIDS 2001; 15: 35727.- Anderson J E, Ebrahim S H, Sansom S. Women’s knowledge about treatment to prevent mother-to-child human immunodeficiency virus transmission. Obstet Gynecol 2004; 103 (1): 165-8. 28.- Ministerio de Salud Chile. Comisión Nacional del SIDA. Área de Atención Integral. Modelo de Atención Integral a Personas Viviendo con VIH/ SIDA. Junio 2005. Disponible en: http://w w w.redsalud.gov.cl/archivos/vih/ modeloatencionFINALenPDF.pdf. (acceso el 16 de abril de 2012). 29.- Martínez-Rebollar M, Lonca M, Pérez I, Soy D, Brunet M, Martin R, et al. Pharmacokinetic study of saquinavir 500 mg plus ritonavir (1000/100 mg twice a day) in HIV-positive pregnant women. Ther Drug Monit 2011; 33 (6): 772-7. doi: 10.1097/ FTD.0b013e318236376d. 30.- Coll O, Suy A, Hernández S, Pisa S, Lonca M, Thorne C, et al. Prenatal diagnosis in human immunodeficiency virus-infected women: a new screening program for chromosomal anomalies. Am J Obstet Gynecol 2006; 194 (1): 192-8. Disponible en http://www.apregistry. com/ 31.- Antiretroviral Pregnancy Registry Steering Committee. Antiretroviral Pregnancy Registry international interim report for 1 Jan 1989 - 31 July 2008. Wilmington, NC: Registry Coordinating Center; 2008. Available at: http:// www. APRegistry.com. 32.- Kourtis A P, Schmid C H, Jamieson D J, Lau J. Use of antiretroviral therapy in pregnant HIV-infected women and the risk of premature delivery: a meta-analysis. AIDS 2007; 21: 607-15. 33.- Sibai BM. Diagnosis, controversies and management of the syndrome of hemolysis, elevated liver enzymes and low platelet count. Obst Gynecol 2004; 103 (5 Pt1): 981-91. 34.- Grimbert S, Fisch C, Deschamps D, Berson A, Fromenty B, Feldmann G, et al. Effects of female sex hormones on mitochondria: possible role in acute fatty liver of pregnancy Am J Physiol 1995; 268 (1 Pt 1): G107-15. www.sochinf.cl 301 Documento 35.- Cooper E R, Charurat M, Mofenson L, Hanson I C, Pitt J, Díaz C, et al; Women and Infants’ Transmission Study Group. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and prevention of perinatal HIV-1 transmission J Acquir Immune Defic Syndr 2002; 29 (5): 484-94. 36.- American College of Obstetricians and Gynecologists. ACOG practice bulletin number 47, October 2003: Prophylactic Antibiotics in Labor and Delivery. Obstet Gynecol, 2003. 102(4):875-82. http://www.ncbi.nlm.nih.gov/ pubmed/14551023. 37.- Committee on Obstetric Practice. ACOG committee opinion scheduled cesarean delivery and the prevention of vertical transmission of HIV infection. Number 234, May 2000 (replaces number 219, August 1999). Int J Gynaecol Obstet 2001; 73 (3): 279-81. http:// www.ncbi.nlm.nih.gov/ pubmed/11424912. 38.- Maiques V, García-Tejedor A, Perales A, Cordoba J, Esteban RJ. HIV detection in amniotic fluid samples: Amniocentesis can be performed in HIV pregnant women? European J Obstet & Gyneco Reprod Biol 2003; 108 (2): 137-41. 39.- Stratton P, Tuomala RE, Abboud R, Rodríguez E, Rich K, Pitt J, et al. Obstetric and newborn outcomes in a cohort of HIVinfected pregnant women: a report of the women and infants transmission study. 302 www.sochinf.cl J Acquir Immune Defic Sydnr Hum Retrovirol 1999; 20: 179-86. 40.- Ciarnello A, Freedberg K, Chu J , Lockman S, Hughes M, Currier J, et al. Lopinavir/ ritonavir (LPV/r)-compared to nevirapine(NVP)-based ART following receipt of single dose nevirapine for prevention of mother- to-child transmission in South Africa : a cost-effectiveness analysis of the OCTANE (ACTG A5208) trial, 5th IAS Conference on Pathogenesis, Treatment and Prevention, Cape Town, South Africa, abstract 1862, July 2009. 41.- Ministerio de Salud Chile. Comisión Nacional del SIDA. Norma de Manejo y Tratamiento de Infecciones de Transmisión Sexual. Julio de 2008. Disponible en: http://www.redsalud.gov. cl/portal/url/ item/85381414c56411a9e0400101 1e015920.pdf (acceso el 16 de abril de 2012). 42.- CDC, Sexually Transmitted Diseases Treatment Guidelines, 2010. Disponible http://www.cdc. gov/std/treatment/2010 (acceso el 2 de febrero de 2012). 43.- CDC, “Syphilis Testing Algorithms Using Treponemal Tests for Initial Screening-Four Laboratories, New York City, 2005-2006”, agosto 2008. 44.- Quattordio L E, Milani P L, Milani H L. Diagnóstico serológico de sífilis. Correlación de resultados según técnicas disponibles en el laboratorio. Acta bioquim. clin. latinoam 2004; 38 (3): 301-6. 45.- Müller I, Brade V, Hagedorn H-J, Starube E, Schörner C, Frosch M, et al. Is serological testing a reliable tool in laboratory diagnosis of syphilis? Meta-analysis of eight external quality control surveys performed by the German Infection Serology Proficiency Testing Program. J Clin Microbiol 2006; 44 (4): 1335-41. 46.- IUSTI: 2008. European Guidelines on the Management of Syphilis. www.iusti.org/ regions/europe/euroguidelines.htm Int J STD AIDS 2009 (may); 20 (5): 300-9 doi 10.1258/ ijsa.208.008510. 47.- Canadian Sti Best Practice Laboratory Guidelines: The laboratory diagnosis of syphilis. Can J Infect Dis Med Microbiol 2005; 16 (1): 11. 48.- Manavi K, Young H, McMillan A. The sensitivity of syphilis assays in detecting different stages of early syphilis. International J STD & AIDS 2006; 17: 768-71. 49.- Juárez-Figueroa L, Uribe-Salas F, García-Cisneros S, Olamendi- Portugal M, Conde-Glez C J. Evaluation of a rapid strip and a particle agglutination tests for syphilis diagnosis. Diagn Microbiol Infect Dis 2007; 59 (2): 123-6. 50.- Murray PR, Baron EJ, Pfaller MA, Tenover FC, Yolken RH. Manual of Clinical Microbiology. 9º Ed, 2007. 51.- García C P, Salazar J A, Perret P C, Chávez P A, Millan O Z, Goycoolea M M, et al. Evaluación de métodos diagnósticos para sífilis congénita” en Rev Chilena Infectol 2000; 17 (4): 289-96. Rev Chilena Infectol 2013; 30 (3): 259-302