GRASAS Y ACEITES COMESTIBLES Gilma Beatriz Medina
Anuncio

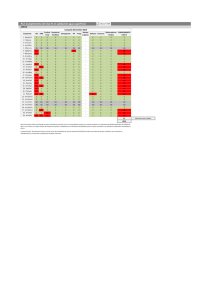
GRASAS Y ACEITES COMESTIBLES Gilma Beatriz Medina Montoya Departamento de Alimentos Facultad de Química Farmacéutica FUNCION: ENERGETICA: Aporte de calorías. • Aislamiento contra el frío. TRANSPORTE: Favorecen absorción de Ca. Vehículo de nutrientes liposolubles ESTRUCTURAL: Hace parte de la membrana celular. • Forman parte de los órganos sensoriales . PROTECTORA: Formación de tejido adiposo. Absorción de impactos. REGULADORA: Regulación de las actividades celulares por acción de las hormonas. ORIGEN VEGETAL Nuez de palma Semilla de algodón Semillas de maní Germen de maíz Fruto de olivo Capa fibrosa del fruto de la palma Semilla de soya Semillas de girasol Canola ANIMAL Lardo Grasa de cerdo Dripping / sebo comestible de bovinos Grasa de res Grasa de leche • Aceites marinos Cómo se utilizan en la industria de los alimentos? Margarinas, mantequillas, mantecas, frituras, chocolates, repostería, panadería, cremas, salsas, mayonesas. CLASIFICACIÓN • LIPIDOS SIMPLES: • Grasas y aceites: Esteres de glicerol con ácidos monocarboxílicos • Ceras: Esteres de alcoholes monohidroxilados y ácidos grasos • LIPIDOS COMPUESTOS: • Fosfolípidos • Glucolípidos Lipoproteínas COMPUESTOS ASOCIADOS: • Ácidos grasos • Pigmentos • Vitaminas liposolubles • Esteroles • Hidrocarburos COMPOSICION FRACCIÓN LIPÍDICA (Saponificable) Triglicéridos Diglicéridos Monoglicéridos Ácidos grasos libres Como el Ácido Oléico. FRACCIÓN NO LIPÍDICA (No saponificable) Esteroles Antioxidantes Pigmentos Vitaminas Fosfolípidos Otros: hidrocarburos, cetonas Colesterol FRACCIÓN LIPÍDICA “SAPONIFICABLE” Esteres del glicerol y ácidos alifáticos de cadena larga saturados o no. SIMPLES O MIXTOS REACCIÓN DE FORMACIÓN DE UN “TRIGLICÉRIDO” ÁCIDOS GRASOS Cadenas lineales con número par de carbonos. Amplio espectro de longitudes de cadena (4 átomos de carbono, algunos aceites de pescado con 30 y los mas frecuentes con 18). Sus dobles enlaces están en configuración cis pero pueden cambiar a trans (isomerización geométrica). Perfil trans similar al de un AG saturado, con puntos de fusión más elevados que sus isómeros en cis. Los AG esenciales son cis. Representan el 95% del peso del TRIGLICÉRIDO. Son su porción reactiva y le confiere propiedades físicas y químicas. Su punto de fusión aumenta con el Peso Molecular y con la disminución de las insaturaciones. CLASIFICACIÓN DE LOS ACIDOS GRASOS Saturados: Carnes, lácteos, yema de huevo y algunos alimentos procesados industrialmente. Generalmente son sólidas a la temperatura ambiente. • Mono insaturados: Aceite de oliva, canola, y aceitunas, soja, maní, almendras, nueces. Poli insaturados: Aceites vegetales de: girasol, maíz, soja y de uva. Algunos pescados son ricos en Ácidos grasos poli insaturados. Composición en Ácidos grasos de aceites de origen vegetal (gramos/100 gramos aceite) ACEITE Grasas Grasas Grasas Saturadas Monoinsaturadas Poliinsaturadas Ácidos Ácidos Grasos Grasos Omega-6 Omega-3 Razón omega6/ omega-3 MARAVILLA 12 23.9 64 63.8 0.16 399 MAÍZ 13.6 26.1 59.9 57.7 2.2 26.2 CANOLA 7.4 65.8 26.7 19.4 7.3 2.7 PEPA DE UVA 11.7 16.2 72.1 71.1 1.0 71.1 SOYA 14.7 22.3 63.0 56 7 8 OLIVA 5.2 72.2 14.7 13.9 0.8 Estructura y nomenclatura de los ácidos grasos: ÁCIDOS GRASOS SATURADOS E INSATURADOS DE MAYOR INTERÉS BIOLÓGICO: NOMBRE COMÚN “Ácido….” ÁTOMOS DE CARBONO ESTRUCTURA PUNTO DE FUSIÓN (°C) Ácidos grasos saturados Láurico 12 CH3(CH2)10COOH 44,2 Mirístico 14 CH3(CH2)12COOH 54 Palmítico 16 CH3(CH2)14COOH 63 Esteárico 18 CH3(CH2)16COOH 69,6 Araquídico 20 CH3(CH2)18COOH 76,5 Lignocérico 24 CH3(CH2)22COOH 86 Ácidos grasos insaturados Palmitoleico 16 CH3(CH2)5CH=CH(CH2)COOH -0,5 Oleico 18 CH3(CH2)7CH=CH(CH2)7COOH 13,4 Linoleico 18 CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH -3 Linolénico 18 CH3(CH2)CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH -11 Araquidónico 20 CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH FRACCIÓN NO LIPÍDICA “INSAPONIFICABLE” Esteroles: Químicamente inertes Colesterol y fitoesteroles Antioxidantes: 0.05-0.2%. Tocoferoles o Vitamina E Fosfolípidos Vitaminas Liposolubles Colorantes y pigmentos: Carotenoides -49,5 17.4 Clorofilas Fosfoglicéridos: Fosfatidilcolina Fosfatidilinositol Fosfatidilserina Fosfatidiletanolamina Estructura de los Fosfolípidos “X” Representa: La colina, etanolámina, serina, inositol, glicerol PROCESOS DE EXTRACCIÓN DE GRASAS Y ACEITES Prensado Extracción por disolventes Una combinación de prensado y extracción por disolventes. PROCESOS DE EXTRACCIÓN DE GRASAS Y ACEITES REFINAMIENTO DE ACEITES Los aceites contienen impurezas que deben ser eliminadas y deben ser sometidos a diferentes procesos y operaciones para conseguir mejores propiedades organolépticas, liberándolos de fosfátidos, ácidos grasos libres, pigmentos y sustancias que produzcan mal olor y sabor. FLUJOGRAMA PROCESO DE REFINACIÓN SEDIMENTACIÓN Y DESGOMADO El proceso consiste en tratar el aceite con agua o vapor de agua, (hidratación y precipitación de los fosfátidos). Se realiza en tanques dotados de un agitador, para incorporar el agua (2% v/v) a una temperatura de 70ºC. El aceite pasa a una centrifuga de gran, velocidad, en la que se separan los fosfátidos, junto con el agua en exceso, del aceite desgomado. Los fosfátidos son deshidratados, y es de donde se obtienen las lecitinas. (tienen valor comercial y se aplican, por su carácter emulgente, en diversas industrias de alimentación.) Eliminar fosfátidos y glicolípidos, sin este refinamiento, los triglicéridos se alteran con mayor facilidad y adquieren sabores y olores desagradables Otros problemas indeseables son: decantación en los tanques de almacenamiento, mayor susceptibilidad a la oxidación, formación de espumas durante el calentamiento. PROCESO DE REFINACIÓN NEUTRALIZACIÓN Elimina ácidos grasos libres, reduce los monoacilglicéridos y fosfátidos que pudieron haber quedado después del desgomado. Los aceites bien neutralizados contienen menos de 0.1% AGL. Esto es recomendable especialmente si los aceites se utilizarán para el proceso de hidrogenación. TECNOLOGÍAS PARA MODICAR LAS GRASAS Hidrogenación Interesterificacion Fraccionamiento HIDROGENACIÓN La saturación con hidrogeno de enlaces dobles, en los glicéridos con cadenas de ácidos grasos insaturados, da lugar a la elevación de puntos de fusión y naturalmente a la disminución del “ÍY”. La reacción de hidrogenación es selectiva y los ácidos grasos más insaturados tienen tendencia a reaccionar primero. Pueden formarse isómeros trans por la acción del catalizador. El valor absoluto del IR depende del IY y del peso molecular medio de los glicéridos. Con la hidrogenación, o adición directa de hidrógeno a los enlaces dobles de los ácidos grasos insaturados, se pretende modificar el comportamiento físico de determinados aceites y grasas. La hidrogenación se aplica especialmente a las grasas liquidas que se han de transformar en plásticas, destinadas fundamentalmente a la preparación de margarinas y sortéennos, mejoran su color y estabilidad. Proceso de Hidrogenación INTERESTERIFICACIÓN Técnica que cambia posición de los ácidos grasos dentro de la molécula del triglicérido cambiando su punto de fusión y las propiedades de cristalización de las grasas nuevas Tecnología para producir grasas con cero TRANS, mantiene la configuración CIS natural. Se obtienen cocientes P/S superiores a 1.2 mínimo recomendado por la Asociación americana del corazón. Se mantiene el Índice de Yodo y no hay saturación con H de los AGE. En el proceso se mezclan grasas en un ambiente de Nitrógeno a T por debajo de 100 grados centígrados usando catalizadores como metóxido de sodio. FRACCIONAMIENTO Las grasas y los aceites se fraccionan para aumentar su valor comercial, o hacer productos especiales. Grasas y aceites no son sustancias homogéneas, sino mezclas de triglicéridos con diferentes puntos de fusión, no tienen un punto de fusión definido. Esta característica se explota para los propósitos de separación. El fraccionamiento es un proceso puramente físico. La separación es guiada exclusivamente por el punto de fusión o, por la solubilidad en un solvente adecuado. REACCIONES INVOLUCRADAS EN EL DETERIORO DE LAS GRASAS HIDRÓLISIS ENRANCIAMIENTO POLIMERIZACIÓN INTERESTERIFICACIÓN HALOGENACIÓN ISOMERIZACIÓN Generalmente ocurren en: Enlace “ester” y en “insaturaciones de los AG”. HIDRÓLISIS Se produce en presencia de agua y calor, También es ocasionada por lipasas O por origen microbiano. Provocan la ruptura del enlace éster de los triglicéridos, descomponiéndose en monoglicéridos, diglicéridos y ácidos grasos libres, y en menor cantidad, se pueden formar metilcetonas y lactonas. La consecuencia directa recae sobre la calidad bromatológica, aumenta el grado de acidez, incidiendo en el olor y sabor. Medida preventiva: conservar materias primas a bajas temperaturas (refrigeración, congelación) y evitar contacto con agua. Como consecuencia de la hidrólisis suele decrecer el punto de humo y aumentar la acidez. ENRANCIAMIENTO Oxidativa o auto oxidación: Se modifican las propiedades organolépticas, hay pérdida de calidad y se disminuye su valor nutritivo al destruirse ácidos grasos esenciales (linoléico y linolénico), y afectarse vitaminas con estructuras insaturadas (vitamina A). Mecanismos de reacción: 1. Período de iniciación: Agentes pro-oxidantes (calor, radiaciones, iones metálicos, etc.) se originan radicales libres de los ácidos grasos insaturados a partir del hidrógeno que se sitúa en posición alfa respecto del doble enlace. Estos radicales libres son muy reactivos. RH ---------------------------> R* + H* 2. Período de propagación: El oxígeno del aire reacciona con el radical libre, originándose hidroperóxidos que a su vez pueden reaccionar con otros ácidos grasos para originar nuevos radicales libres activos. Además, los propios peróxidos pueden suministrar radicales libres al descomponerse, originando alcolxiradicales que posteriormente darán lugar a compuestos secundarios más pequeños (aldehídos, cetonas, entre otros). R* + O2 ------------------> R-O-O* R-O-O* +RH ------------------> R-OOH + R* Son reacciones en cadena, cuyos límites son: - Ausencia de oxígeno. - Reacción entre radicales libres. 3. Período de terminación. Al reaccionar entre sí los radicales libres se originan dímeros. R* + R* ------------------> R-R R* + R-O-O* --------------> R-O-O-R Siempre desaparece el ácido graso original, y como productos finales se pueden encontrar: - Polímeros diversos. - Hidroperóxidos R-OOH - Dímeros con puente de oxígeno R-O-O-R. Se evita la propagación con antioxidantes: tocoferoles y vitamina E (naturales) y otros artificiales derivados del ácido gálico y del anisol (BHA, BHT, TBHQ). Oxidación por lipoxidasas: Alteración de tipo enzimático, debido a la presencia de lipoxidasas en algunos vegetales y en ciertas carnes de animales. Cataliza la oxidación de ácidos grasos insaturados específicos, aquellos que contengan el sistema 1,4-pentadieno cis-cis, como es el caso de los ácidos: linoléico, linolénico y araquidónico. Se inicia el proceso con la formación de radicales libres en presencia de oxígeno. POLIMERIZACIÓN La presencia de radicales libres que se combinan entre sí o con los ácidos grasos forman polímeros lineales (con diferente grado de longitud y ramificación) o cíclicos (sobre todo en presencia de dobles enlaces). Estos compuestos tienen mayor tamaño y peso molecular, por lo que tienden a aumentar la viscosidad del aceite formando espuma y una capa de consistencia plástica en la superficie del aceite y en el recipiente. HALOGENACIÓN Se utiliza para controlar la proporción de halógenos en el aceite. Esta proporción se mide en proporciones de yodo/cloro. Límites permitidos CAOC: 1,0-1,2. Para encontrar la relación yodo/cloro, se realizan dos determinaciones: a. Determinación de yodo b. Determinación de halógenos totales ISOMERIZACIÓN Uno de los parámetros más sensibles que se utiliza para detectar los cambios químicos resultantes de unas condiciones de elaboración severas es la isomerización cis-trans, especialmente en el ácido linoléico. Altos contenidos de ácidos insaturados en un aceite evitan la formación de isómeros trans a temperaturas controladas. CARACTERIZACIÓN Y ANÁLISIS DE LAS MATERIAS GRASAS Objetivos: Identificar atributos físicos y químicos Control de criterios de calidad, pureza, adulteraciones y falsificaciones Caracterizar su calidad frente a las normas Caracterizar valor nutricional. Control de procesos tecnológicos. MÉTODOS CLÁSICOS DE ANÁLISIS (Métodos Oficiales) Métodos de “IDENTIFICACIÓN” Punto de fusión Punto de humo Prueba de frío Densidad Índice de refracción Índice de yodo Índice de Saponificación Material insaponificable Métodos de identificación Punto de humo: Determinan que tipos de aceites pueden ser utilizados para procesos donde se utilizan temperaturas altas. Punto de fusión: Determina la temperatura a la cual se encuentran en equilibrio las fases sólida y líquida, a una atmosfera de presión. Punto de frio: Control de hidrogenación, ya que existe una correlación bastante buena entre esta y la consistencia de la grasa plastificada. Densidad o gravedad específica No varía mucho para aceite puro y fresco. NTC: 336 Promedio : Menor que 1. Se determina con picnómetro a 25 °C , si la grasa es líquida. Si la muestra es sólida se funde a 40 °C o 60 °C. Aumenta cuando aumenta el PM de los ácidos grasos no saturados, y desciende cuando aumenta la temperatura. Índice de refracción Se mide con refractómetro de ABBE T = 25 °C para aceites T = 40 °C grasa parcialmente hidrogenadas T = 60 °C grasas hidrogenadas T = 80 °C Ceras Aumenta a medida que aumenta la temperatura. Valor promedio para grasas y aceites: 1.4400-1.4800 El índice de refracción aumenta a medida que aumenta el PM de los ácidos grasos. Índice de Yodo Mide el grado de insaturación (dobles enlaces no conjugados) Se aprovecha la capacidad de adición que tienen los halógenos sobre los dobles enlaces, bajo condiciones específicas. Orden de reactividad: Cl > Br > I METODOS: Reactivo de Wijs Mezclas Interhalógenos con baja Reactivo de Hannus reactividad y alta selectividad. Propiedad química relacionada con el índice de refracción. Determina si las grasas o aceites están combinados con otros aceites. Índice de saponificación Se define: mg de KOH necesarios para saponificar 1 g de grasa Saponificar: hacer reaccionar una sustancia alcalina con una grasa para formar un jabón. El Índice de Saponificación es 1/ PM de los ácidos grasos Ac. Butírico 4C 556.6 Ac. Laúrico 12 C 263.4 Ac. Palmítico 16 C 208.5 Ac. Esteárico 18 C 188.5 Material Insaponificable Se determina saponificando la grasa y separando el insaponificable con éter. CONTENIDO INSAPONIFICABLE DE GRASAS Y ACEITES ACEITE O GRASA M. INSAPONIFICABLE % Manteca de cacao 0.2 – 1.0 Coco < 0.5 Bacalao 3.3 – 4.7 Hígado de tiburón 13.0 – 20.0 Oliva 0.7 – 1.1 Palma 0.3 – 1.0 Maíz 0.8 – 2.0 Semillas de algodón < 1.5 Cacahuetes 0.2 – 0.8 Manteca de cerdo < 0.8 Semillas de mostaza 0.7 – 1.5 ADULTERACIONES MÁS FRECUENTES Adición de aceites de pescado a aceites vegetales. Adición de aceites livianos de petróleo. Adición de aceite de algodón y ajonjolí a otros aceites. Mezclas de aceites saturados en insaturados. Reutilización de aceites. LOS MÉTODOS CLÁSICOS DE ANÁLISIS (Métodos Oficiales) Métodos de determinación de “CALIDAD” Características organolépticas Índice de Acidez Prueba de rancidez Índice de peróxido Material insaponificable • Humedad Características organolépticas Olor, color, textura característicos del producto. Cada aceite presenta olor característico al producto del cual fue extraído. Parámetros iníciales para determinar si el producto se acepta o rechaza o si debe realizarse análisis más profundos. Métodos de análisis implementados y certificados en las industrias de aceites y grasas. Índice de Acidez Se define : mg de KOH necesarios para neutralizar los ácidos grasos libres contenidos en 1.0 g de grasa o aceite. El resultado se expresa en ácido oleico o en % FFA. Según la norma Icontec 218, la acidez libre mide el grado de descomposición lipolítica de los GLICERIDOS (hidrólisis enzimática, tratamiento químico, acción bacteriana). Tamaño Muestra: 50g: Muestra con % acidez < 0.2% 25g: Muestra con % acidez (0.2-1%) REACCIÓN O PRUEBA DE KREIS “Determinación de rancidez” Método comercial para detectar la rancidez. Su principio se basa en una reacción entre la floroglucina y un constituyente de la grasa. Se produce un color intenso el cual indica el grado de rancidez de la grasa (comparado frente a una muestra estándar). Índice de peróxido Se define: meq-g de oxígeno por Kg de grasa. Determina las sustancias capaces de oxidar el KI I metálico Grasas y aceites empiezan a descomponerse cuando son aislados de su ambiente natural sabor y olor desagradable El principal desarrollo de la Rancidez es llevado a cabo por oxidación Atmosférica (autoxidación). Esta es acelerada por exposición al calor y a la luz, por la humedad y trazas de metales (Cu, Ni, Fe). El O2 es tomado por la grasa Hidroperóxidos. A mayor grado de Insaturación ( mayor IY), mayor posibilidad de RANCIDEZ Índice de peróxido hasta 5 Aceite fresco Índice de peróxido en fábrica 0 peróxido Técnicas instrumentales aplicadas al análisis de compuestos lipídicos Espectroscopia IR y cromatografía de gases: (AGT) Cromatografía en capa fina, columna, HPLC, CLAE Métodos espectrofotométricos: UV-visible y fluorescencia. Técnicas modernas de análisis de aceites comestibles. Análisis de ácidos grasos, mono-, di- y triglicéridos. Análisis estructural de triglicéridos Análisis de vitamina E, esteroles y fosfolípidos. Análisis de componentes minoritarios y contaminantes mediante cromatografía de gases y de líquidos. Detección de aceites refinados y de otros aceites vegetales en aceite de oliva. Análisis de compuestos fenólicos, vitaminas y aditivos. Detección de residuos de plaguicidas, contaminantes, y otros agentes indeseables. BIBLIOGRAFÍA DESROSIER, N.W. "Elementos de tecnología de alimentos" Ed. Continental. 11ª Reimpresión, México 1996, pags. 210-211 BRENNAN, J.G. "Las operaciones de la ingeniería de los alimentos" Ed. Acribia, 3ª Edición, España 1998, pags. 257-258 PRIMO, Y.E. "Química de los alimentos", Ed. Síntesis. España 1998, pags. 186-195 BADUI, S. D. "Química de los alimentos" Ed. Pearson Education. 3ª Edición. México 1999, pags. 233-241 Excerpted with permission from The National Cottonseed Products Association Guide to Edible Oils. http://oregonstate.edu/instruct/nfm236/lipids/index.cfm "Manual de practicas de tecnología de granos II", Universidad de Sonora, México 1995, pags. 18-20.