Glícidos resumo
Anuncio

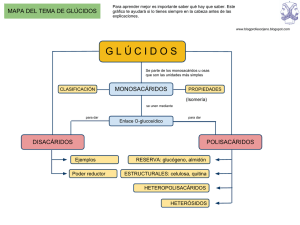
Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza GLÍCIDOS : características xerais Biomoléculas formadas por C, H y O, en una proporción CnH2nOn Tamén se lles chama hidratos de carbono ou carbohidratos. O nome glícido deriva da palabra «glícosa» Características: Nos glícidos sempre hai un grupo carbonilo, é dicir, un carbono unido a un osíxeno mediante un doble enlace O grupo carbonilo pode ser: • Un grupo aldehído (—CHO) • Un grupo cetónico (—CO—) O R C H O R C R Os glícidos poden definirse como polihidroxialdehídos o polihidroxicetonas GLÍCIDOS : clasificación Se clasifican en dous grandes grupos: 1. OSAS OU MONOSACÁRIDOS: son os monómeros e están constituidos por unha soa cadea polihidroxialdehídica ou polihidroxicetónica aldosas cetosas 2. ÓSIDOS: son glícidos máis complexos, derivados das osas pola unión de varios monosacáridos Dentro dos ÓSIDOS, podemos distinguir: 2.1 - HOLÓSIDOS: so están formados pola unión de osas ou monosacáridos Oligosacáridos. Unión de 2 a 10 monosacáridos. Os máis importantes son os disacáridos (unión de dous monosacáridos). Outros son trisacáridos, tetrasacáridos, etc Polisacáridos. Unión de máis de 10 monosacáridos A súa vez, poden ser: Homopolisacáridos: teñen un único tipo de monosacárido Heteropolisacáridos: teñen máis dun tipo de monosacárido 2.2 - HETERÓSIDOS: formados por monosacáridos e outras moléculas, como proteínas (glicoproteínas) ou lípidos (glicolípidos) B - Estructura química dos monosacáridos GLÍCIDOS : funcións 1 - Función estrutural. Formando parte de diversas estruturas. • Moleculares: ribosa e desoxirribosa que constitúen os ácidos nucleicos • Celulares: celulosa, hemicelulosa e pectinas das paredes celulares vexetais • Orgánicas: quitina do exoesqueleto dos artrópodos 2 - Función enerxética. • Fonte de enerxía: glicosa • Reserva de enerxía: almidón e o glicóxeno 3 - Outras funcións específicas: Antibiótico (estreptomicina) Vitamina (vitamina C) Anticoagulante (heparina) ……… OSAS ou MONOSACÁRIDOS A – Propiedades xerais • Glícidos máis sinxelos. Constituidos por una sola cadena polihidroxialdehídica ou polihidroxicetónica. • A partir de 5 carbonos son inestables ciclación. • Nomeanse engadindo a terminación -osa ao número de carbonos Por exemplo, triosa, tetrosa, pentosa, hexosa, etc • A formula xeral é : Cn(H2O)n • O grupo carbonilo dalles propiedades reductoras (desprenden e-) • Función enerxética e nalgúns casos estrutural C – Propiedades físicas A súa solubilidade na auga debese a que tanto os radicais hidroxilo (-OH) como os radicais hidróxeno (-H) presentan unha elevada polaridade eléctrica e establecen pontes de hidróxeno coas moléculas de auga, que tamén son polares, dispersándose así as moléculas do glícido C – Propiedades químicas 1. Poder reductor: os monosacáridos cun grupo aldehído ou cetona son capaces de oxidarse, é dicir, de perder electróns, fronte a outras substancias que, ao aceptalos, se reducen (véase APÉNDICE: reacción de Fehling) 2. Capacidad para asociarse con grupos amino mediante enlaces N-glicosídicos, formado entre un -OH e un composto aminado, propio de aminoazúcres 3. Isomería OSAS : ISOMERÍA ISÓMEROS: Compostos que comparten a mesma fórmula química molecular (número de átomos de cada clase), pero que presentan distinta fórmula estrutural (átomos unidos de forma diferente) Tipos de isomería: 1. Isómeros funcionais ou estruturais: diferéncianse polo grupo funcional. 2. Isómeros espaciais ou estereoisómeros: diferéncianse na disposición espacial dos átomos. Se deben á existencia de carbonos asimétricos. Tipos: enantiómeros y epímeros 3. Isómeros ópticos: En función de cómo desvíen o plano da luz polarizada O monosacáridos de 5 ou máis átomos de carbono poden presentar outros tipos de isomería 2.2. otras formas 3. ISOMERÍA ÓPTICA Cuando se fai incidir un plano de luz polarizada sobre unha disolución de monosacáridos que posúen carbonos asimétricos, o plano de luz se desvía. - Se a desviación é cara a dereita o isómero é destróxiro e se representa con ( +) - Se a desviación é cara a esquerda o isómero é levóxiro e se representa con ( ) OSAS : Estructura En disolución, os monosacáridos de cinco ou máis átomos de carbono dan lugar a estruturas cíclicas pechadas, xerando un carbono asimétrico adicional na molécula, denominado carbono anomérico • O carbono anomérico permite a existencia de dous novos estereoisómeros, denominados anómeros (α y β) carbono anomérico C1 α-D-glucopiranosa PROYECCIÓN DE HAWORTH (libro páx. 31) GLICOSA: conformacións no espazo. En realidade, as estruturas cíclicas da glicosa no son planas, como indican os modelos estudados, senón que poden adoptar dos conformacións no espazo debido a que os enlaces oriéntanse no espazo e non nun plano. D β Forma “trans” o Z Forma “cis” o E OSAS : Interese biolóxico • Los monosacáridos deben su importancia biológica al hecho de encontrarse: - como monómeros de todos los glúcidos - libres actuando como nutrientes para que la célula pueda obtener energía - como intermediarios en el metabolismo energético celular TRIOSAS • Gliceraldehído (aldotriosa) y dihidroxiacetona (cetotriosa) • La fórmula empírica de ambas es C3H6O3 • Son abundantes en el interior de la célula, ya que participan en el metabolismo de la glucosa y las grasas • No forman estructuras cíclicas PENTOSAS No se encuentran libres en la naturaleza, sino formando parte de otros compuestos • Ribosa y desoxirribosa (aldopentosas) forman parte del ARN y ADN respectivamente. En disolución forman estructuras cíclicas • Ribulosa (cetopentosa) desempeña un importante papel en la fotosíntesis, debido a que se une a la molécula de dióxido de carbono (CO2), que queda así incorporada al ciclo de la materia viva HEXOSAS Son los monosacáridos más abundantes en la naturaleza • Glucosa (aldohexosa): se encuentra libre o formando parte de polisacáridos de reserva (glucógeno, almidón) o estructurales (celulosa) • Galactosa: no suele encontrarse en estado libre; forma parte de la lactosa, de polisacáridos complejos o de heterósidos • Manosa: se encuentra en la corteza de algunos árboles. Forma parte de polisacáridos presentes en bacterias, fermentos, hongos y algunos árboles. También forma parte de la estreptomicina (antibiótico) Glicosa. Na naturaleza atópase como D-(+)- glucopiranosa, polo que tamén se lle chama dextrosa (glúcido dextrógiro). Moi común en vexetais (uvas) e animais. É o monosacárido máis importante xa que ten numerosas funcións biolóxicas: - en forma libre (no sangue 1 por mil, froitas) - formando parte de polisacáridos de reserva (almidón, glicóxeno) - formando parte de polisacáridos estructurais (celulosa) - almacena a enerxía solar durante a fotosíntese - é o principal combustible metabólico das células En disolución existe un equilibrio entre a forma cíclica (95%)e a forma aberta (menos do 5 % do total). D 5 1 β Β-D-glucopiranosa Fructosa (cetohexosa): denominada también como levulosa por ser muy levógira. Se encuentra en estado libre en las frutas, miel y en el líquido seminal, donde nutre a los espermatozoides. En el hígado se transforma en glucosa. También forma parte del disacárido de sacarosa y de algunos polisacáridos 5 2 α α-D-fructofuranosa OSAS : Compostos derivados • Originados por reducción: forman desoxiazúcares, pierden un oxígeno en alguno de los carbonos • Originados por oxidación: forman azúcares ácidos, el grupo carbonilo (–CHO) se transforma en carboxilo (–COOH) ganan un oxígeno • Originados por substitución: forman aminoazúcares, como la N-acetil-glucosamina al sustituir OH por NH2 Desoxirribosa Ác. glucurónico Glucosamina HOLÓSIDOS : OLIGOSACÁRIDOS Son glícidos formados pola unión de cadeas curtas de osas mediante enlaces o-glicosídicos. Son hidrolizables, cristalizables, solubles e de sabor doce. 1 - ENLACE O-GLUCOSÍDICO: • Formado entre os -OH de dous monosacáridos con desprendemento dunha molécula de auga. • Pde ser α-glicosídico si o primeiro monosacárido é α e β-glucosídico si o primeiro monosacárido é β. Por exemplo, entre o C1 dunha α-D-glucopiranosa e o C4 de outra D-glucopiranosa (α o β) se establece un enlace tipo α (1 4) α-glucosídico (14) 2 - TIPOS DE ENLACE O-GLICOSÍDICO: 1. Enlace monocarbonílico: entre o carbono anomérico do primeiro monosacárido e un carbono non anomérico do segundo. Conserva a capacidade reductora. carbono anomérico C1 2. Enlace dicarbonílico: entre os dous carbonos anoméricos dos dous monosacáridos. Perde a capacidad reductora carbono anomérico C2 PRÁCTICA: PROBA DE FEHLING Permite comprobar se un glícido é reductor ou non. Os mono e disacáridos excepto la sacarosa son redutores, o resto non. • Calentar unha disolución composta polo glícido que se investiga e sulfato de cobre (II) • Se o glícido é redutor, se oxidará, reducindo ao sulfato de cobre (II), de cor azul, a óxido de cobre (I), de color vermello-laranxa • Se o glícido non é redutor, a reacción non se producirá e a cor non cambiará HOLÓSIDOS : DISACÁRIDOS CON INTERESE BIOLÓXICO Maltosa. Disacárido formado por duas moléculas de glicosa (D-glucopiranosa) unidas mediante enlace α (l4). A maltosa atópase libre naos gráns xerminado de cebada. La cebada germinada artificialmente se utiliza para fabricar cerveza, y tostada se emplea como sustitutivo del café, es la llamada malta. En la industria se obtiene a partir de la hidrólisis del almidón y del glucógeno. La maltosa se hidroliza fácilmente y tiene carácter reductor α-D-glucopiranosaaa α-D-glucopiranosa α -D-glucopiranosil (1 4) α-D-glucopiranosa Lactosa: disacárido formado por una molécula de β-D-galactopiranosa y otra de β-D-glucopiranosa unidas por medio de un enlace β (l4). Se encuentra libre en la leche de los mamíferos Β -D-galactopiranosil (1 4) Β -D-glucopiranosa Sacarosa: disacárido formado por una molécula de α-D-glucopiranosa y otra de βD-fructofuranosa unidas mediante un enlace α (12). Se encuentra en la caña de azúcar y en la remolacha azucarera. Reserva glucídica de las plantas). Carece de poder reductor. α-D-glucopiranosa Β –D-fructofuranosa α -D-glucopiranosil (1 2) Β –D-fructofuranósido Enlace dicarbonílico Isomaltosa: disacárido formado por dos moléculas de α-D-glucopiranosa mediante enlace α (16). No se encuentra libre en la naturaleza. Se obtiene por hidrólisis de la amilopectina (un componente del almidón) y del glucógeno. Proviene de los puntos de ramificación α (16) de estos polisacáridos. Celobiosa: disacárido formado por dos moléculas de β-D-glucopiranosa unidas mediante enlace β (l4). No se encuentra libre en la naturaleza, se obtiene por hidrólisis de la celulosa con un enzima denominado celulasa. Conserva el poder reductor PRINCIPALES DISACÁRIDOS CON INTERÉS BIOLÓGICO Disacárido Monosacáridos unidos MALTOSA α-D-glucopiranosas α (l4) ISOMALTOSA α-D-glucopiranosas α (16) LACTOSA β-D-galactopiranosa Enlace β-D-glucopiranosa β (l4) CELOBIOSA SACAROSA β-D-glucopiranosas α-D-glucopiranosa β-D-fructofuranosa α (12) HOLÓSIDOS : POLISACÁRIDOS Formados por la unión de más de 10 monosacáridos mediante enlaces O-glucosídicos, con la generación de una molécula de agua por cada enlace • Pesos moleculares muy elevados • No tienen sabor dulce • Pueden ser insolubles (celulosa), o formar dispersiones coloidales (almidón) • Funciones estructurales (con enlaces β-glucosídicos) o de reserva energética (enlaces α-glucosídicos) - Los enlaces α son más débiles que los enlaces β, por lo que se crean y destruyen con facilidad • Clasificación: - Homopolisacáridos: polímeros de un solo tipo de monosacárido - Heteropolisacáridos: polímeros de más de un tipo de monosacárido HOMOPOLISACÁRIDOS Función de reserva energética (enlaces α) Almidón Función estructural (enlace β) Celulosa HETEROPOLISACÁRIDOS enlace α Pectina Agar agar Glucógeno Quitina Goma arábiga - Los polisacáridos de reserva suelen ser ramificados para movilizar más rápidamente los restos de monosacáridos, glucosa en ambos casos; mientras que los polisacáridos estructurales suelen presentar estructura lineal HOMOPOLISACÁRIDOS CON FUNCIÓN DE RESERVA • Glucógeno: - Principal elemento de reserva de los animales que se encuentra en el hígado y músculos - Formado por cadenas muy largas y ramificadas de glucosa Cada 8-10 HOMOPOLISACÁRIDOS CON FUNCIÓN DE ESTRUCTURAL • Celulosa: - Elemento principal de la pared celular vegetal - Polímero de β-D-glucosa unidas mediante enlaces β(14) (celobiosas) - Formado por cadenas lineales no ramificadas de β-D-glucosa que se unen entre sí por puentes de hidrógeno, constituyendo microfibras Estas se unen para formar fibras que se unen para dar lugar a fibras de celulosa - La pared celular vegetal persiste tras la muerte de las células, constituyendo las fibras vegetales (algodón, lino, cáñamo, esparto, etc.) y el interior del tronco de los árboles (el leño o madera) β HOMOPOLISACÁRIDOS CON FUNCIÓN DE ESTRUCTURAL • Quitina: - Polímero de N-acetil-D-glucosamina (un derivado de la glucosa) - Constituye el exoesqueleto de los artrópodos (en los crustáceos se encuentra impregnada de carbonato cálcico, lo que aumenta su dureza) y las paredes celulares de los hongos - Forma cadenas paralelas que se organizan en capas alternas, lo que les confiere gran resistencia HETEROPOLISACÁRIDOS Polisacáridos compostos por varios tipos de monosacáridos Hemicelulosas: conxunto moi heteroxéneo de polisacáridos, entre outros, glicosa, galactosa e fucosa. Unha cadea liñal dun msc da que xurden ramificacións doutros. Na parede de células vexetais. Pectinas: polímero do ácido galacturónico (derivado por oxidación) en cadeas liñais intercalado con outros monosacáridos como a ramnosa, da que xurden ramificacións. Na parede de células vexetais. Agar-agar: polímero de D/L-galactosa que se atopaen en algas vermellas. Utilízase na industria alimentaria e para preparar medios de cultivo. Glicosaminoglicanos (mucopolisacáridos): formado por ácido glicurónico (derivado por oxidación) e N-acetil-glicosamina ou N-acetil-galactosamina (derivados por substitución). Atópanse na substancia intercelular dos tecidos conectivos. Entre eles destacan: • Ácido hialurónico (p.e. humor vítreo) • Condroitina (tecidos cartilaxinoso e óseo) • Heparina (anticoagulante) HETERÓSIDOS Grupo moi variado. Teñen unha parte glicídica e unha non glicídica (aglicón). 1 - GLICOLÍPIDOS • O aglicón é o lípido ceramida unido a un oligosacárido complexo. • Destacan: Cerebrósidos e gangliósidos, compoñentes da membrana externa das bacterias Gram negativas e das membranas das células nerviosas. • Parece que interveñen no recoñecemento celular proporcionando as células a súas “señas de identidade” e como receptores de moléculas extracelulares. 2 - GLICOPROTEÍNAS • O aglicón é unha proteína. • Destacan: Mucoproteínas; glicoproteínas sanguíneas; peptidoglicanos … • Funcións moi variadas Mucoproteínas ou mucinas, en vías respiratorias, dixestivas e uroxenitais, lubricando e impediendo infeccións bacterianas. Glicoproteínas sanguíneas ou séricas, presentes no sangue, como a protrombina e as inmunoglobulinas Glicoproteínas estructurais da membrana plasmática, que presentan gran heteroxeneidade, debido as variacións na secuencia de monosacáridos; xunto aos glicolípidos actúan en procesos de recoñecemento celular. Peptidoglicanos, componente ríxido da parede celulars bacteriana. Hormonas como a luteinizante (LH) ou a foliculoestimulante (FSH) Outras moléculas que actúan como principios activos de plantas medicinales como por exemplo a digitalina con propiedades cardiotónicas. APÉNDICE: PRUEBA DE LUGOL Permite comprobar la presencia de almidon. Reactivo de Lugol (solución de yodo e yoduro potásico) El almidón es un polisacárido vegetal formado por dos componentes: la amilosa y la amilopectina. En presencia del reactivo de Lugol la amilosa se colorea de azul-violota debido no a una reacción química sino a la adsorción o fijación de yodo en la superficie de la molécula de amilosa, lo cual sólo ocurre en frío.