* Resonancia * Fuerzas intermoleculares:
Anuncio

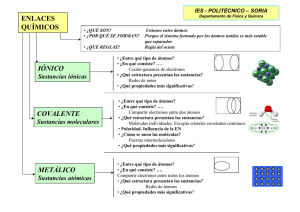
ENLACE QUÍMICO (Resumen) Establecimiento de uniones entre átomos para dar lugar a agrupaciones más estables que los átomos originales. Los responsables de la unión entre los átomos son los electrones de la última capa de la corteza de los átomos. IÓNICO Se establece entre átomos que tiendan a ceder fácilmente e-, con otros que tiendan a cogerlos fácilmente. Entre átomos con elevada diferencia de EN Propiedades: - No se forman moléculas, sino redes cristalinas. Para separar los iones de la red se requiere bastante energía. - Son sólidos no conductores. (Cargas estáticas en la red iónica). - Elevado punto de fusión. - Duros y quebradizos. - En disolución conducen la corriente eléctrica. * Geometría compuestos iónicos (Índice coordinación) * Energía reticular Ciclo de BORN-HABER Partículas: IONES COVALENTE Se establece entre átomos de similar apetencia por los electrones, compartiendo pares de e- de tal forma que cada átomo se rodee por 8 e- en su última capa. Uso de diagramas de Lewis HOMONUCLEAR Molécula formada por átomos iguales. HETERONUCLEAR Molécula formada por átomos diferentes. CRISTALES COVALENTES CONTINUOS: * Compuestos covalentes formados por redes gigantes, no por moléculas aisladas. * Esta estructura confiere a estos compuestos propiedades muy específicas (sólidos muy duros de elevadas temperaturas de fusión) Estructura del diamante. Partículas: MOLÉCULAS Polaridad de un enlace: Desplazamiento del par de ehacia el átomo más EN del enlace. (momento dipolar) Enlace covalente coordinado ( o dativo): El par de e- lo aporta uno de los átomos. METÁLICO Los electrones de valencia de cada átomo pasan a un "fondo común", formando una nube electrónica que rodea a los iones positivos que integran la red metálica. Moléculas de agua. * Resonancia * Fuerzas intermoleculares: - Puentes de hidrógeno - Fuerzas dipolo-dipolo - Fuerzas de Van der Waals (dipolos instantáneos) * Diagramas de Lewis (regla del octeto) * Geometría molecular - Teoría del enlace de valencia (TEV) - Modelo de pares de electrones (RPECV) - Hibridación de orbitales atómicos - Modelo de orbitales moleculares Propiedades: - Alta conductividad térmica y eléctrica (movilidad de los e-). - Dúctiles (hilos) y maleables (láminas), su deformación no implica ni rotura de enlaces ni mayor aproximación de iones de igual carga (como en los compuestos iónicos). - Puntos de fusión moderados o altos. Partículas: ÁTOMOS Propiedades: - Todos son malos conductores del calor y la electricidad (los e- están sujetos en el enlace). Moléculas apolares: - Fuerzas entre moléculas débiles. - Son generalmente gases, si es líquido o sólido tª ebullición o fusión bajas. - Poco solubles en agua y disolventes polares, solubles en apolares. Moléculas polares: - Generalmente líquidos y algunos sólidos. Cuanto mas polares mayores tª de ebullición o fusión.