guia para la vigilancia por laboratorio de leptospira
Anuncio

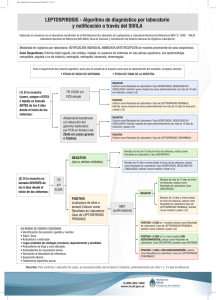
GUIA PARA LA VIGILANCIA POR LABORATORIO DE LEPTOSPIRA DIRECCION DE REDES EN SALUD PÚBLICA GRUPO DE MICROBIOLOGIA 19 DE DICIEMBRE DE 2014 Dirección Fernando Pio de la Hoz Director General Instituto Nacional de Salud Coordinación Mauricio Beltrán Durán Director Técnico Redes en Salud Pública Cesar Augusto Ramirez Segura Subdirector Laboratorio Nacional de Referencia Dirección de Redes en Salud Pública Carolina Duarte Valderrama Coordinadora Grupo de Microbiología Laboratorio Nacional de Referencia Dirección de Redes en Salud Pública Esther Cristina Barros- Marysol Gonzalez Hormiga Equipo Técnico Subdirección Laboratorio Nacional de Referencia Dirección de Redes en Salud Pública Elaborado por Solmara Bello Grupo de Microbiología Subdirección Laboratorio Nacional de Referencia (SLNR) Dirección Redes en Salud Pública OBJETIVOS DE LA GUÍA Describir los lineamientos y el proceso de vigilancia por laboratorio para el evento Leptospira Precisar cómo se articula la red nacional de laboratorios para la vigilancia de leptospirosis por laboratorio, así como describir las funciones en cada uno de los niveles. Describir los procesos de obtención, transporte y conservación de las muestras para la vigilancia del evento. Detallar los fundamentos técnico-científicos de los ensayos de laboratorio útiles en la vigilancia de la Leptospirosis. DEFINICIONES Y ABREVIATURAS Zoonosis: Es una enfermedad que puede transmitirse de animales vertebrados a humanos. ELISA: Es una prueba cualitativa para determinar presencia de anticuerpos contra leptospira, para definir caso probable. Microaglutinación: Es la prueba de referencia internacional cuantitativa para la titulación de anticuerpos séricos contra los diferentes serovares de Leptospira, en la que se utilizan microorganismos vivos como antígeno, haciendo diluciones de suero problema, tomando como positiva la dilución más alta en la que el suero aglutina. Serovar o serotipo: Grupo de microorganismos clasificados juntos sobre la base de su estructura antigénica, en el caso de la Leptospira los lipopolisacaridos (LSP), son los principales antígenos utilizados para su clasificación. Abreviaturas, acrónimos y siglas MAT: Microaglutinación ELISA: Enzime Linked Inmunosorbent Assay. GENERALIDADES Agente infeccioso La leptospirosis es una enfermedad zoonótica producida por las leptospiras que son bacterias pertenecientes al orden Spirochaetales y a la familia Leptospiraceae, mediante técnicas de hibridación del ADN se ha podido establecer la caracterización de diferentes especies de leptospiras. Las leptospiras consideradas como saprófitas pertenecen a las especies L. biflexa, L. meyeri y L. Wolbachii. Las L. interrogans consideradas como las patógenas se encuentran divididas en siete especies L. borgpetersenii, L. inidai, L. interrogans, L. kirschneri, L. noguchii, L. santarosai y L. weilii. De acuerdo con la estructura antigénica las leptospiras se clasifican en serovares (serotipos), de los cuales se reconocen más de 260 en el mundo.1 La leptospirosis es una enfermedad de gran incidencia en regiones tropicales, debido a factores ambientales, climáticos y sociales que favorecen la transmisión. En algunas zonas templadas y tropicales es considerada una enfermedad re-emergente.2 Reservorios Los reservorios más comunes son las ratas, perros, bovinos, porcinos, equinos, zorrillos, cabras, conejos y murciélagos. Las ratas y los bovinos se han considerado como los reservorios más importantes, hecho que se explica porque el pH alcalino de la orina en estos animales favorece la supervivencia de Leptospira; como el hombre tiene una orina relativamente ácida para el germen, es considerado un mal reservorio, pero sí es un huésped susceptible a todas las serovariedades patógenas de Leptospira.2,3,4 Transmisión La causa más frecuente de contagio para el hombre es el contacto indirecto con animales infectados, a través de aguas, suelos húmedos, vegetación o alimentos contaminados con la orina; otros animales pueden infectarse directamente con material post-aborto, placentas infectadas o por contacto sexual. La infección con la serovariedad Icterohaemorragiae es la más común en el hombre y se asocia con la exposición a perros infectados, aunque también es de alta prevalencia en los roedores.2,5 Epidemiologia La mayoría de los casos se presentan en adultos jóvenes entre los 20 y 40 años, siendo más afectados los hombres que las mujeres, pero en las regiones donde hombres y mujeres trabajan en idénticas condiciones, la tendencia de la enfermedad es a igualarse en los dos sexos, hecho que comprueba la existencia de un factor ocupacional para la enfermedad.2,6 Generalmente, se reconocen tres tipos de exposición para el hombre: una ocupacional, que afecta a trabajadores que están expuestos directamente al animal infectado o a sus residuos, siendo Hardjo (asociado a bovinos), y Pomona (asociado a porcinos), los serovares con los que más frecuentemente se está en contacto en esta categoría de riesgo. Otra es la exposición recreativa, que se presenta en personas que acampan, bañistas, excursionistas o exploradores y deportistas, así como la exposición causada por inundaciones y desastres naturales.2,5,7 En Colombia existen pocos datos sobre prevalencia de la leptospirosis humana en población general, lo mismo que sobre factores de riesgo asociados con la enfermedad y formas de exposición. El primer registro de la enfermedad en Colombia es de finales de la década de los 60, donde se registra la enfermedad humana causada por el serovar Icterohaemorragiae con 4,28% de humanos positivos. El único brote epidémico documentado en el país se inicia en agosto de 1995, en el departamento de Atlántico, con un total de 47 casos confirmados y 284 casos sospechosos, con una letalidad del 17% entre los casos confirmados. Se aisló Leptospira de las serovariedades Icterohaemorragiae, Pomona y Canicola (Datos del Departamento Administrativo de Salud de Barranquilla, 1996).2,8 De acuerdo con la información del Sistema Nacional de Vigilancia en salud Pública, hasta la semana epidemiológica 52 de 2013, se han notificado al Sivigila 2263 casos totales de leptospirosis en Colombia y en comparación con el mismo periodo del año anterior, se observa un aumento del 13,94% de la notificación para el 2013.9 Las cinco entidades territoriales por procedencia con mayor proporción de casos confirmados hasta la semana 52 son Antioquia (33,04%), Valle del Cauca (19,07%), Cartagena y Atlántico (4,61% cada una) y Barranquilla (3,86%) acumulando el 65,21% de la notificación del país.9 Los serovares más frecuentes reportados en nuestro país son Australis Autumnalis e Icterohaemorrhagiae, los cuales se asocian principalmente a los porcinos y ratas. 10 Aspectos clínicos Los síntomas iníciales característicos además de fiebre de tres a diez o más días de presentación, incluyen cefalea, escalofríos, vómito, mialgias generalizadas, inyección conjuntival, malestar y a veces postración. La primera fase se denomina bacteremia, ya que la leptospira se distribuye por todo el organismo y se puede encontrar en sangre. La segunda fase, es la inmune, en la cual se pueden detectar anticuerpos en suero, la bacteria ya no se encuentra en sangre y se inicia la eliminación de esta por orina. 11, 12 Diagnóstico diferencial Dengue, fiebre Q, malaria, tuberculosis pulmonar, hepatitis vírica, meningitis bacteriana, influenza, brucelosis, ehrlichiosis, sepsis, fiebre amarilla, además de las infecciones simultáneas que pueden ocurrir entre dengue y leptospirosis. DIAGNÓSTICO POR LABORATORIO Tipos de muestras, recolección y transporte La muestra indicada para el diagnóstico de ELISA IgM y MAT, es el suero pareado (obtención de la primera muestra al inicio de síntomas y la segunda de 10 a 15 días obtenida la primera). La muestra de suero es obtenida a partir de sangre total recolectada en tubo seco, generalmente por venopuncion. La sangre total debe separase (centrifugarse) una vez esté coagulada, proceso que se produce de 20 a 30 minutos después de su obtención. Tiempo de recolección: la primera muestra debe recolectarse cuando el paciente se encuentra en su fase aguda, y la segunda muestra de 10 a 15 días después obtenida la primera muestra. Las muestras de suero debe conservarse a temperatura de refrigeración de 2°C a 8°C, a esta temperatura no se deben conservar por más de 7 días, para tiempos de conservación mayores conservar -20°C. Evitar congelación y descongelación repetida de las muestras. Volumen de la muestra Se debe enviar mínimo 1ml de suero. Aptitud de la muestra Las causas de rechazo de la muestras son la No identificación adecuada de la muestra, cantidad escasa, lipemia o hemolizada. Envase de la muestra El envase adecuado para el transporte y conservación de las muestras es criovial tapa rosca, para evitar derrame de la muestra. Identificación de la muestra Debe existir una identificación inequívoca de la muestra, escrita en forma clara, en tinta indeleble, con datos mínimos básicos, que deben ser establecidos por el laboratorio, de acuerdo al tipo de muestra. Rotulada así: Nombre del paciente o código de la muestra, tipo de análisis, sexo del paciente, edad, fecha de la toma de la muestra y marcar primera y segunda muestras respectivamente Bioseguridad y Elementos de protección personal Manejo de medidas básicas de bioseguridad como el uso de batas, guantes, tapabocas y gafas. Personal que recolecta la muestra: personal de salud como los profesionales de enfermería, medicina, bacteriología y personal auxiliar. Recomendaciones sobre ingesta de alimentos (ayuno) o medicamentos, Se recomienda que la muestra se obtenga cuando el paciente se encuentre en ayuno, para evitar interferentes. Documentos para el envío de muestras La muestra para la confirmación de Leptospira debe remitirse con la ficha epidemiológica (Ficha de datos básicos del Sistema Nacional de Vigilancia en Salud Pública del INS y la ficha de Leptospirosis código INS: 445) y el formato de solicitud del análisis FORR01.5030-032. Ensayos de Laboratorio asociados a la vigilancia del evento Los ensayos de laboratorios para el diagnóstico del evento son: ELISA IgM Esta técnica es un ELISA indirecta, las microtiras reactivas están recubiertas con el antígeno (fase solida). Los anticuerpos específicos presentes en la muestra del paciente se ligan a estos antígenos de la fase sólida. Este test es cualitativo para la detección de anticuerpos humanos de género específico contra las leptospiras en suero, y su utilidad está dada en los pacientes con fase aguda de la enfermedad. Resultados de laboratorio: un resultado positivo indica presencia de anticuerpos IgM, un resultado negativo indica ausencia de anticuerpos IgM. Microaglutinación (MAT) Es una prueba serológica de referencia para la detección de anticuerpos aglutinantes contra antígenos vivos de Leptospira con el fin de determinar el serovar causante de la infección. Resultados de laboratorio: existe infección en curso cuando se da el proceso de seroconversión o aumento en cuatro veces el titulo, para monosuero se considera títulos ≥1:400, aunque esto puede variar si se trata de una población endémica. El flujograma diagnóstico y las responsabilidades por niveles se describen en la figura 1. Flujo de información toda muestra captada en el sistema de vigilancia por laboratorio debe ser remitida al LSPD, y este a su vez debe de remitir toda muestra positiva por la técnica de ELISA al INS para ser procesada para la confirmación del caso por la técnica de MAT. Figura 1. Flujograma diagnóstico Leptospira • • • Toma de muestras pareadas Procesamiento y reporte del ELISA IgM. Envío de muestras pareadas con resultado positivo por ELISA a LDSP. Realizar proceso de control de calidad a través del LSPD. • • • Seguimiento a la notificación. Apoyo a las entidades territoriales en la implementación de medidas de prevención y control. Asesoría y asistencia técnica. Envío de muestras pareadas al INS Realizar el proceso de control de calidad a través del LDSP • • • • • • • Seguimiento a la notificación. Apoyo a las entidades territoriales en la implementación de medidas de prevención y control. Asesoría y asistencia técnica. Procesamiento y reporte de microaglutinación (MAT) y procesos de patología Laboratorio de la IPS Dirección departamental de salud y LSPD Instituto Nacional de Salud CONTROL DE CALIDAD Para el evento de Leptospira se realizar el Programa de Evaluación Externa del Desempeño Indirecto (PEEDI9 Se debe remitir al Grupo de Microbiología del INS, 3 – 10 muestras positivas y 3 – 10 muestras negativas mensualmente. Con el formato (FORR01.5030-143) diligenciado completamente, con el fin de realizar la supervisión. ESTRUCTURA Y FUNCIONES DE LA RNL PARA EL EVENTO DE LEPTOSPIROSIS Funciones del laboratorio nacional de referencia (LNR) Dentro de las funciones enmarcadas en la vigilancia por laboratorio del evento se encuentran: Realizar la confirmación por la técnica de MAT, los casos sospechosos con resultados positivos en los ensayos de Elisa IgM. El LNR sólo procesará muestras pareadas con una diferencia mínima de 10-15 días entre la toma de la primera y la segunda muestra, teniendo en cuenta que las muestras deben ser enviadas en adecuadas condiciones al laboratorio adjuntando la ficha de notificación completamente diligenciada y el formato de envío de muestras de suero para el diagnóstico de síndrome febril. El laboratorio de Microbiología realizará el control de calidad indirecto a los Laboratorios Departamentales de Salud Pública para la prueba de ELISA IgM. Cabe resaltar que la subdirección de laboratorio nacional de referencia no procesará ninguna muestra con técnica de ELISA para diagnóstico individual de caso, ya que esta responsabilidad recae directamente sobre el laboratorio clínico de la IPS que atiende el caso. El laboratorio de patología, recibirá las muestras de tejidos para el procesamiento y enviará oportunamente los resultados a las entidades territoriales Otras funciones: Hacer seguimiento y retroalimentación del cumplimiento de los lineamientos nacionales para leptospirosis por parte de las entidades territoriales. Fortalecer la Red nacional de diagnóstico de leptospirosis. Funciones del Laboratorio de Salud Pública (LSP) Recibir y remitir al laboratorio del Grupo de Microbiología del Instituto Nacional de Salud las muestras de suero pareadas de los casos sospechosos de leptospirosis que presenten un resultado positivo de anticuerpos IgM por técnica de ELISA para realizar la prueba de oro, microaglutinación (MAT). Dichas muestras deben ser enviadas de forma obligatoria con la ficha única de notificación obligatoria de leptospirosis ya que ninguna muestra será procesada en el laboratorio nacional si no son derivadas del proceso de vigilancia rutinaria del evento y con el formato de envío de muestras de suero para el diagnóstico de síndrome febril. Realizar el control de calidad pertinente a los laboratorios de diagnóstico en su jurisdicción y realizar un informe de retroalimentación con los resultados a los laboratorios evaluados. Participar en el programa de control de calidad que realiza el grupo de microbiología de la subdirección Red Nacional de laboratorio (RNL). Mantener una base de datos actualizada con las muestras recibidas por municipios y los resultados luego del procesamiento de las mismas, manteniendo la estructura de las variables relacionadas con el diagnóstico establecidas en el sistema nacional de vigilancia de leptospirosis (ficha única de notificación). Retroalimentar los resultados de los casos a las IPS, direcciones locales y departamentales de salud para realizar las acciones necesarias con el paciente y ajustar los casos en el sistema de vigilancia. Funciones de los laboratorios públicos y privados o referente para el evento en el nivel municipal y/o local según corresponda El laboratorio clínico debe obtener la muestra e informarle al paciente que debe obtenerse segunda muestra de 10 a 15 días recolectada la primera, solicitar al médico o enfermera la ficha de notificación la cual debe estar diligenciada en su totalidad con letra clara y legible y procesar las muestras de suero para detección de anticuerpos IgM mediante la pruebas tamiz ELISA IgM (incluida en el POS) e informar el resultado al médico tratante y al área de vigilancia epidemiológica de la institución o del nivel local, según corresponda. Además estas muestras deben ser remitidas al Laboratorio Departamental de Salud Pública (LDSP) para el proceso de control de calidad. En caso de que el paciente no acuda a la toma de la segunda muestra el laboratorio debe dar conocimiento de la situación al grupo de epidemiología de la institución para hacer seguimiento y captación del caso para garantizar la recolección de la segunda muestra. Realizar las pruebas diagnósticas necesarias para la confirmación del caso teniendo en cuenta los diagnósticos compatibles para leptospirosis de acuerdo al cuadro clínico y antecedentes del paciente (dengue, influenza, malaria, fiebre amarilla, rickettsiosis, hepatitis, entre otras), y según el nivel de complejidad de la institución. En caso de fallecimiento de un paciente con impresión diagnóstica de leptospirosis, se debe realizar autopsia clínica según lo establecido en el Decreto 786 de 1990, con el fin de enviar muestras de tejidos (riñón, hígado, pulmón y cerebro) al laboratorio departamental de salud pública. Además es necesario realizar un comité de vigilancia epidemiológica para identificar los determinantes y factores asociados a este caso de mortalidad y enviar el informe a la secretaria local o municipal de salud. Estos casos deberán ser notificados de forma inmediata al área de epidemiología. De ser necesario, pueden solicitar apoyo técnico para el análisis de los casos a las autoridades locales, departamentales o nacionales. prestando toda la colaboración y poniendo a disposición la información necesaria. Capacitar y actualizar permanentemente a los profesionales de la salud en el diagnóstico, tratamiento, seguimiento y vigilancia de la leptospirosis en su área de influencia. El flujograma de las muestras a través de la red de laboratorios se observa en la figura 2 Figura 2. Flujograma de las muestras a través de la red de laboratorios: IPS Obtención de primera muestra y comunicarle al paciente la fecha para obtención de segunda muestra. Realizar ELISA IgM para Leptospira Informar al médico, al paciente y a epidemiología en caso de ser positiva Enviar la muestra pareada o monosuero para fallecidos al laboratorio de salud pública (LSP) Registrar las muestras Confirmarlo por ELISA IgM Informar a epidemiología LSP Informar a epidemiología SIVILAB y programas Confirmar por la técnica MAT Ingresarlo en la vigilancia por laboratorio I N S Enviarlo al INS con la documentación solicitada Registrarlo Informar a los LSP los resultados Entregarlo en el laboratorio de Microbiología Registrar la muestra en la central de muestras del INS Analizar los datos anualmente y publicarlos en boletines y revistas médicas INS REFERENCIAS BIBLIOGRÁFICAS 1. Los criterios de operación para la Red Nacional De Laboratorios De Salud Pública, Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE) 2. Guía ECJ y otras encefalopatías espongiformes transmisibles humanas. (Instituto de Salud Carlos III de España) 3. Park SY, Effler PV, Nakata M, Sasaki D. Leptospirosis after flooding of a University Campus- Hawaii-2004. Morbility and Mortality Weekly report . 2006; 5: 5 4. Acosta H, Moreno C. Leptospirosis. Revisión de tema. Colombia médica. 25, 1994; p.36-42 5. Manual para la Identificación y Prueba de Susceptibilidad a los Antimicrobianos (CDC) 6. Tucundura F. Morfological alterations in the kidney of rats with natural and experimental leptospira infection. J. Comp. Path . 2007, 137, p.231-238. 7. Monahan A. Miller, M, Nally, J. Leptospirosis risks during recreational activities. Journal applied Microbiology. 2009, ISSN 1364- 5072 8. Florez, P. Situación de la leptospirosis en el Urabá antioqueño colombiano: estudio sero epidemiológico y factores de riesgo en la población general urbana. Instituto Colombiano de medicina tropical CES, Medellín Colombia. Marzo 2007 p 4. 9. Protocolo de vigilancia en salud publica leptospirosis. (Instituto Nacional de Salud – Colombia) 10. Grupo de Microbiología-INS.2014. http://www.ins.gov.co/tramites-y servicios/examenesdeinterésensaludpublica/Microbiologa/Microbiología.%20%20Lepto spira%202012.pdf. 11. Spchler A, Vilaca P. Predictors of lethality in severe leptospirosis in urban Brazil. Am J. Trop Med. December 2008, 79 (6) 911 – 914 12. Moctezuma A. Leptospira and leptospirosis. Veterinary Microbiology. 2009.http://www.med.monash.edu.au/microbiology/staff/adler/proftemp.html.