Descargar PDF
Anuncio

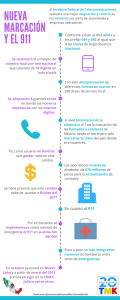
Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. originales Marcación de leucocitos utilizando coloide estannoso-99mTc a partir de muestras de sangre entera G. RABILLER, L. QUESTA, R. GALLI, F. VISCUSI, E. EL TAMER Centro de Medicina Nuclear del Hospital de Clínicas José de San Martín. Universidad de Buenos Aires. Comisión Nacional de Energía Atómica. Buenos Aires. Argentina. Resumen.—Se presenta la preparación de un radiocoloide que permite la marcación de leucocitos utilizando su capacidad de fagocitosis. Dado que esta función es exclusiva de los glóbulos blancos, no ejerciéndola otras células sanguíneas, se probó la utilización de un coloide de fluoruro estannoso marcado con 99mTc (F2Sn-99mTc) a fin de marcar dichas células en muestras de sangre entera. Mediante técnicas de separación celular en gradientes de densidad y adquisición de imágenes en cámara gamma de la distribución de radioactividad en tubos con Percol 90 %, se observó que la marcación lograda es selectiva y de alta eficiencia para leucocitos (en todos los casos fue mayor del 70 %), óptima reproducibilidad, bajo costo y baja toxicidad celular. PALABRAS CLAVE: Marcación de leucocitos. Fagocitosis. Coloide. Imágenes de infección. LABELING OF LEUKOCYTES USING STANNOUS 99MTC-COLLOID IN WHOLE BLOOD SAMPLES Summary.—This paper presents the preparation of a radiocolloid that still makes it possible to label leukocytes using its fagocitosis capacity. Given that this function is exclusively of the white blood cells, not being exercised by other blood cells, the use of a stannous fluoride radiocolloid labeled with 99mTc (F2Sn-99mTc) was tested in order to label leukocytes in whole blood samples. Using cellular separation techniques in density gradients and acquisition of images in gamma camera of radioactivity distribution in Percol, it was observed that the white cells labeling achieved was selective and with high efficiency for leukocytes (in all cases, it was superior to 70 %), optimal reproducibility, low cost and low cellular toxicity. KEY WORDS: Leucocyte labelling. Phagocytosis. Colloid. Infection imaging. Recibido: 22-10-02. Aceptado: 30-06-03. Correspondencia: Bioq. G. RABILLER DE LIS Centro de Medicina Nuclear del Hospital de Clínicas José de San Martín. Universidad de Buenos Aires Comisión Nacional de Energía Atómica Avda. Córdoba 2351 Ciudad de Buenos Aires 1120 Argentina E-mail: [email protected] 22 INTRODUCCIÓN Los primeros métodos de marcación de leucocitos se basaron en la captación de un radiofármaco mediante la capacidad propia de este tipo de células de fagocitar partículas1,2. Para este fin se prepararon compuestos coloidales o partículas para marcar con 99m Tc. Estos fueron dejados de lado cuando surgen en el mercado radiofármacos lipofílicos capaces de ingresar en el leucocito atravesando la membrana celular (Ej. 99mTc-Exametazina –HMPAO e 111In– oxima)3,9-12. Evidentemente, dado que todas las membranas celulares son lipofílicas, esta última metodología requiere la separación de leucocitos previa a la marcación, siendo una ventaja para los métodos que utilizan la capacidad fagocítica, la posibilidad de realizarlos en una muestra de sangre entera, tal como lo demostraron Hanna R et al4,5,14 (fig. 1). En experimentos de separación celular en gradiente de densidad, Hanna et al demostraron que un 80 % de la actividad se une a leucocitos, mientras que Mock y English discuten el método asegurando que un importante porcentaje se une a eritrocitos6. En el presente trabajo se muestra por centelleografía de columnas de Percol 90 % (gradiente de densidad) que la actividad se concentra en proporciones mayores al 70 % en la capa leucocitaria coincidentemente con lo que demuestran otros autores usando métodos autorradiográficos7. El coloide de F2Sn-99mTc es de fácil preparación, es económico y reduce la manipulación de muestras de sangre, dado que no requiere la separación de leucocitos. Frente a estas considerables ventajas, este radiofármaco, deberá probarse en estudios “in vitro” de quimiotaxis e “in vivo” en convalidación clínica y comparación con otros productos8,13. Rev Esp Med Nucl, 2004;23(1):22-6 38 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rabiller G, et al. Marcación de leucocitos utilizando coloide estannoso-99mTc a partir de muestras de sangre entera FIG. 2.—A) Marcación de leucocitos en muestras de sangre entera, separación en Percol y centelleograma. B) Separación con Hespan 6 % post-marcación de leucocitos, localización de la capa leucocitaria en columna de Percol y centelleografía en cámara gamma. FIG. 1.—A) Marcación de leucocitos en una muestra de sangre entera. B) Marcación de leucocitos separados con Hespan 6 %. Separación en columnas de Percol 90 %. MATERIALES Y MÉTODOS Preparación de coloide estannoso Se preparó un coloide estannoso a partir de una solución acuosa de FNa y otra de F2Sn marcándola posteriormente con 99mTc mediante rotación por una hora. Para este fin se procedió de la siguiente manera: Se disolvieron 5 mg de FNa en 5 ml de solución fisiológica nitrogenada. Este vial se identificó con la letra A. En otro frasco se pesaron 64 mg de F2Sn que se disolvieron en 10 ml de solución fisiológica también nitrogenada. Se identifico como vial B. En un frasco identificado como vial C, se colocaron 4 ml de la solución A y se adicionó 1 ml de la solución B. A 2,5 ml de elución de 99mTcO4– con una actividad aproximada de 50 mCi (1850 MBq) se agregó la solución preparada en el vial C, filtrándolo a través de una membrana tipo millipore de poro 0,22 um. El coloide se marcó incubando esta solución durante una hora a temperatura ambiente con rotación 39 continua. Los controles de calidad se realizaron por cromatografía utilizando como fase fija ITLC, y con metil-etil-cetona o solución fisiológica como fase móvil. Concluido el proceso de marcación y control de calidad se adicionó 1,5 ml del radiocoloide (99mTc-SnF2) a 20 ml de sangre entera fresca, heparinizada (100 UI/ml) y se mezcló con agitación suave a 37 °C en baño de agua durante 1 hora (fig. 2). Validación de la marcación de leucocitos A fin de validar la marcación de leucocitos en una muestra de sangre entera se siguieron los pasos que se describen a continuación: 1. Marcación de leucocitos separados de muestras de sangre extraída con ACD, sedimentando glóbulos rojos mediante el agregado de HESPAN 6 % (fig. 1B). 2. Marcación de muestras de sangre entera extraídas con Heparina 100 Ul/ml mediante el agregado directo del radiocoloide (fig. 1A). Todas las muestras se incubaron con radiocoloide durante una hora a 37 °C con agitación constante. 3. Centrifugación en Percol 90 % (partículas de sílica de 15-30 nm de diámetro revestidas de PVP Rev Esp Med Nucl, 2004;23(1):22-6 23 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rabiller G, et al. Marcación de leucocitos utilizando coloide estannoso-99mTc a partir de muestras de sangre entera Percol es capaz, por si mismo, de generar espontáneamente gradientes, mediante centrifugación a moderada velocidad. El rango de densidades formado está dentro de 1,0 y 1,3 g/ml y son isoosmóticos19. Las células se ubican en la fracción superior mientras que en la fracción inferior lo hace el coloide libre. Ambas columnas fueron centelleografiadas en cámara gamma (figs. 2A y B) obteniéndose imágenes de la distribución de actividad y de los correspondientes perfiles a partir de los cuales se realizó la integración de las distintas áreas. 4. En todas las marcaciones se determinó el porcentaje de células viables mediante el uso de la técnica de coloración de azul tripán y posterior observación en microscopio. Para la realización del conteo se uso una cámara de Newbauer procediendo del mismo modo que para un recuento leucocitario. Se contó el número de células coloreadas (azules) que por alteración de la permeabilidad de la membrana, permitieron el ingreso del colorante al citoplasma, lo cual indica una alteración de su viabilidad. Se usó como criterio estadístico el conteo de no menos de 200 células y se determinó sobre ellas el porcentaje de alteraciones. 5. Posteriormente se analizó al microscopio la composición celular de las capas, localizadas por centelleografía en cámara gamma respetando la distribución de radioactividad, habiendo en la capa superior más del 80 % de leucocitos. La distribución de la radioactividad guarda la misma proporción. A 100 80 60 40 20 0 Cromatografía ITLC en MEK Radiocoloide 99mTc B 100 80 60 40 20 0 Cromatografía ITLC en Sol. Fis. Radiocoloide RESULTADOS Productos intermedios Eficiencia de marcación del radiofármaco FIG. 3.—A y B) Control de calidad cromatográfico del radiocoloide. –polivinil pinolidona– no dializable)19 y centelleografía en cámara gamma a fin de observar la distribución de radioactividad en las capas celulares. El Percol al 90 % se preparó agregando 1 ml de ClNa 1,5 molar a 9 ml de Percol al 100 %. De esta solución se tomaron 6 ml y se colocaron en tubos de centrífuga de aproximadamente 10 ml. Esta operación se realizó siempre por duplicado. Sobre la superficie de uno de ellos se agregó 1 ml de sangre entera marcada con coloide y en el otro, 1 ml de leucocitos separados post marcación de sangre entera con HESPAN al 6 %. Se centrífugo a 150 g (1150 rpm) por 30 minutos. El 24 El control cromatográfico en ITLC mostró que la preparación del coloide permitía la obtención de un radiofármaco con 90 % + /– 0,4 % de eficiencia de marcación (n = 10) (figs. 3A y B). Eficiencia de marcación de leucocitos Las muestras de sangre entera heparinizadas (100 U.I./ml) se marcaron con radiocoloide. a) La eficiencia de marcación de leucocitos fue determinada en Percol según el método ya descripto. El porcentaje de actividad en la fracción leucocitaria fue del 74 % + /– 4 % (siendo n = 5). Mediante un Rev Esp Med Nucl, 2004;23(1):22-6 40 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rabiller G, et al. Marcación de leucocitos utilizando coloide estannoso-99mTc a partir de muestras de sangre entera microscopio óptico se corroboró que el 80 % de las células que componían esta capa eran leucocitos. b) Se separaron leucocitos a partir de alícuotas de sangre entera marcada, según procedimientos convencionales. Luego las fracciones leucocitarias se sembraron en columnas de Percol al 90 %. Se comparó la ubicación de la capa leucocitaria identificada mediante la observación en el microscopio y centelleografía en cámara gamma, con la capa de mayor concentración de actividad de la muestra de sangre entera marcada. Se observó que ambas capas resultaron coincidentes (fig. 1 y figs. 2A y 2B). Control de calidad directo Otra fracción de estas muestras de sangre entera marcada se centrifugó a 200 g, según lo indicado en el método de Hanna et al4,5, y se determinó la actividad en plasma y en la fracción celular. Considerando que en esta última, los leucocitos, exclusivamente tienen capacidad de fagocitosis, se determinó cuantitativamente la eficiencia de marcación siendo de 75 % + /– 4 % (para n = 5). Viabilidad celular El porcentaje de células viables fue del 95 % + /– 2 %, es decir, no más del 7 % alteró su viabilidad durante la marcación (fig. 4). DISCUSIÓN Si bien existen antecedentes en la bibliografía acerca de la marcación de leucocitos, aprovechando su capacidad fagocítica mediante un radiocoloide en muestras de sangre entera, esta técnica ha sido discutida por algunos autores quienes argumentan uniones inespecíficas a eritrocitos. Por este motivo se han utilizado otros radiofármacos, tales como el HMPAO-99mTc y Oxima-In11115. El costo de estos productos es generalmente elevado; además la ventaja de no separar leucocitos previos a la marcación, evitando manipuleos riesgosos para el paciente y el operador, motivaron la realización del presente trabajo. Los resultados evidencian la posibilidad de marcar leucocitos en las condiciones descriptas, aclarando la 41 FIG. 4.—Foto de campo microscópico, donde se observa una célula coloreada que indica alteración de su viabilidad. controversia planteada por algunos autores. La actividad no asociada a células puede eliminarse centrifugando la muestra de sangre marcada durante 5 minutos a 150 g (1.500 rpm), separando el plasma y agregando el mismo volumen de solución fisiológica previamente a la reinyección. Un radiofármaco similar se encuentra disponible comercialmente, no obstante, el utilizado en esta experiencia fue preparado en nuestro laboratorio. Si bien contamos con campana de flujo laminar y el equipamiento necesario para obtener un producto estéril, el mismo se preparó sólo con la finalidad de ensayarlo “in vitro”. En una etapa futura, se propondrá para su fraccionamiento y liofilización, en áreas recomendadas a tal efecto16,17. A fin de completar los estudios radiofarmacéuticos de este producto próximamente se realizarán ensayos de estabilidad del radiocoloide y se completarán las pruebas de viabilidad celular analizando la quimiotáxis de los leucocitos marcados18. La estabilidad de las células marcadas ya fue estudiada por Hanna et al en 19844. CONCLUSIÓN La preparación de este radiocoloide permite la marcación de leucocitos utilizando su capacidad de fagocitosis aún en presencia de otras células sanguíneas. Mediante esta técnica la marcación de leucocitos es selectiva, de alta reproducibilidad, bajo costo, baja toxicidad celular y fundamentalmente alta eficiencia de marcación celular (superior al 70 %). Rev Esp Med Nucl, 2004;23(1):22-6 25 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Rabiller G, et al. Marcación de leucocitos utilizando coloide estannoso-99mTc a partir de muestras de sangre entera BIBLIOGRAFÍA 1. Fisher CH, Scheffel U, Tsam MF, Rhodes BA, Wagner HN. Leukocyte tagging by phagocitosis of Tc-99m HAS microspheres. Use in localization of experimental abscesses by external scanning. J Nucl Med 1975;16:527. 2. McAfee JG, Thakur ML. Survey of radioactive agents for in vitro labeling phagocytic leukocytes. II. Particles. J Nucl Med 1976;17:488-92. 3. P.A. Delima Ramos, J. Martín Comin, M.T. Bajen, M Roca Y. Ricart, M. Castell, J. Mora, R. Puchal and M. Ramos. Simultaneous administration of 99mTc - HMPAO – labeled autologous leukocytes and 111 In – labeled non-specific polyclonal human inmunoglobulin G in bone and point injections. Nucl Med Commun 1996;17:749-57. 4. Hanna R, Braun T, Levendel A, Lomas F. Radiochemistry and biostability of autologous leucocytes labeled with Tc-99m stannous colloid in whole blood. Eur J Nucl Med 1984;9:216-9. 5. Hanna R, Lomas F. Identification of factors affecting technetium 99m leucocyte labelling by phagocytic engulfment and development of an optimal technique. Eur J Nucl Med 1986;12:159-62. 6. Mock BH, English D. Leukocyte labelling with technetium-99m tin colloids. J Nucl Med 1987;28:1471-7. 7. Mathew R. B. Puncher, Philip J. Blower Labelling of leucocytes with colloidal 99mTc - SnF2: an investigation of the labeling process by autoradiography. Eur J Nuc Med 1995;22:101-7. 8. J. Martin-Comin, E. Prats. Clinical applications of radiolabeled blood elements in inflammatory bowel disease the Q J Nucl Med 1999;43:74-82. 9. Segal AW, Ensell J, Munro M. 111In tagged leukocytes in the diagnosis of inflammatory bowel disease. Lancet 1981;2:230-7. 26 10. Saverymuttu SH, Peters AM, Lavander JP, Hodgson HJ, Chadwich WS. 111In-labelled autologous leukocytes in inflammatory bowel disease. Gastroenterology 1981;80:1273. 11. Peters AM, Osman S, Henderson BL, Kelly JD, Danpure HD, Hawker RJ, et al. Clinical experience with 99m Tc-hexamethylpropylene amine oxime for labeling leucocytes and imaging inflammation. Lancet 1986;25:946-9. 12. Peters AM, Lavender JP, Danpure HD, Osman S, Saveryuttu SH. Technetium 99m analogous phagocyte scanning: a new imaging technique for inflammatory bowel disease. Br Med J 1986(a); 293:450-1. 13. Segarra I, Roca M, Baliellas C, Vilar L, Ricart Y, Mora M, et al. Granulocyte-specific monoclonal antibody technetium-99mBW 250/183 and Indium-111 oxine-labelled leucocyte scintigraphy in inflammatory bowel disease. Eur J Nucl Med 1991; 18:715-9. 14. Radpharm Scientific leucocyte labeling bit, package insert, 1994 Radpharm Scientific, PO Box 223, Kippax ACT, Australia 2615. 15. M Roca, J Martin-Comin, et al. A consensus protocol for white blood cells labeling with technetium-99m hexamethylpropylene amine oxime. Eur J Nucl Med 1998;25:797-9. 16. Hirch JI, Tatum JL, Fratkin MJ, et al. Preparation and evaluation of a 99mTc-SnF2 colloid kit for leucocyte labeling. J Nuc Med 1986;15(2):159-62. 17. Martinadale AA, Peris MJ, Turner JH, et al. Technetium-99m leucocyte labeling using a lyophilized stannous fluoride colloid kit. Prog Clin Biol Res 1990;21(9105):257-60. 18. Roca M, Iglesias F, García V, Armero F, Díaz MC. Chemotaxis, viability and labeling stability of leucocytes labeled with 99mTc-Exometazime stabilized and metylene blue. J Nucl Med 2001;42:505-8. 19. Percoll methodology. Separation News 1 (1979) Pharmacia Biotech. Rev Esp Med Nucl, 2004;23(1):22-6 42