APÉNDICE 15.2:
Anuncio

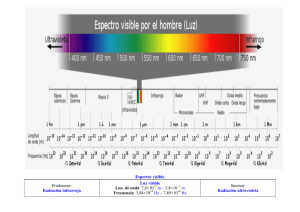
Curso l Física I Autor l Lorenzo Iparraguirre CAPÍTULO 11: Vibraciones y rotaciones de moléculas diatómicas. Algunos conceptos que hemos visto pueden ser aplicados con facilidad al estudio de los movimientos de algunas moléculas simples, como las diatómicas. Desde el punto de vista de la dinámica se pueden ignorar muchas de las complejidades de la nube electrónica que une los átomos en la molécula, porque lo que interesa es que toda la masa de esta nube es despreciable, y el sistema se caracteriza por tener casi toda la masa concentrada en los núcleos. Esto nos permite elaborar un modelo el cual la molécula se asimila a un sistema dos partículas unidas por un resorte. Este sistema puede realizar movimientos vibratorios que consisten en alejamientos y aproximaciones entre las partículas, así como rotaciones en las diversas orientaciones del espacio. En este capítulo se estudian estas posibilidades enmarcadas en detalles experimentales reales. 11.1.- Vibraciones moleculares Energía potencial interatómica en moléculas diatómicas. La unión de dos átomos en una molécula diatómica se produce por la distribución de la carga electrónica, que si alcanza valores adecuados entre los núcleos, ejerce fuerzas atractivas sobre los mismos suficientes para equilibrar la repulsión electrostática entre ellos. La forma de la nube electrónica en sus diferentes estados orbitales posibles depende de las leyes cuánticas, y aquí basta con saber que la carga negativa entre los núcleos produce un efecto atractivo sobre los núcleos positivos, y que cuando las molécula se forma, hay una distancia de equilibrio internuclear, en la cual la atracción mencionada equilibra a la repulsión entre los núcleos. Un “agente externo” debería hacer trabajo positivo tanto para separar como para aproximar los átomos a partir de una situación inicial hipotética con la separación de equilibrio, porque para distancias mayores que la de equilibrio predomina la atracción, y para menores la repulsión. 353 Curso l Física I Autor l Lorenzo Iparraguirre Ahora bien, dado que las fuerzas eléctricas se debilitan con la distancia, es claro que si los núcleos se separan suficientemente más allá de esa distancia de equilibrio, la fuerza de atracción necesariamente irá desapareciendo, hasta que finalmente podremos considerar que se ha disociado la molécula. Por otra parte, si los núcleos se aproximan más allá de la separación de equilibrio, los estados orbitales electrónicos no podrán mantener la cantidad de carga negativa entre ellos, y predominará la repulsión, que podrá llegar a ser infinita: la distancia internuclear nunca podrá llegar a ser cero. Esto es lo que se lee en una gráfica típica de energía potencial Ep(x), donde x es la distancia “interatómica” (léase entre los núcleos) en una molécula diatómica (figura 11.1). Esta función se determina con ayuda de modelos teóricos y de datos experimentales, como por ejemplo la energía necesaria para disociar las moléculas, la distancia de equilibrio, etc. E (J) nube electrónica Ep(x) E*p(x) x0 x (a) (b) x E(x0)= Fig. 11.1: a) Energía potencial interatómica en una molécula diatómica. Ep* representa una función de segundo grado que puede aproximar a la función real Ep en la cercanía de la posición de equilibrio x0. b) Esquema de la molécula que muestra que x representa la distancia entre los núcleos. Oscilaciones pequeñas en la cercanía de la posición de equilibrio estable Ahora bien, dada la forma de la función Ep(x), que por razones físicas elementales siempre deberá ser similar a la mostrada en la figura, es claro que en la cercanía de la posición de equilibrio siempre podrá ser aproximada razonablemente con una función de segundo grado como la Ep*(x) mostrada en línea de trazos. Para energías totales negativas no mucho mayores que E(x0), la distancia internuclear x oscilará dentro de valores próximos a x0, y no habrá gran diferencia entre la energía que indica Ep o la que indica Ep*. Ahora bien, una función de segundo grado, como Ep*, corresponde a una fuerza elástica, y en estas condiciones las oscilaciones serán armónicas. Esto nos indica uno de los aspectos más importantes de la fuerza elástica: sirve para aproximar cualquier caso de vibración cerca de una posición de equilibrio, como se discute a continuación. Sabemos que la energía potencial de una fuerza elástica con constante elástica k, y con posición de equilibrio en x0 es, en forma general Ep*(x) = ½ k (x – x0) + C. Para este caso queremos hacer coincidir Ep*(x) con la función experimental Ep(x) en la vecindad de x0, y para ello la constante C debe ser el valor de Ep(x) en el mínimo, , como puede verse sustituyendo x = x0. De manera que podemos aproximar el problema experimental real, con la función energía potencial elástica: Ep*(x) = ½ k (x - x0)2 (11.1) Curso l Física I Autor l Lorenzo Iparraguirre El valor de la constante k, en la gráfica, regula que las ramas de la parábola sean más o menos cerradas, y se relaciona directamente con las características de las ligaduras químicas entre los átomos. Así por ejemplo, es importante saber que, en términos generales, es típico encontrar los siguientes órdenes de magnitud en los valores de la constante de fuerza en función del tipo de ligadura: Uniones covalentes simples como en H2 k = 5102 Nm-1 Uniones covalentes dobles como en O2 k = 12102 Nm-1 Uniones covalentes triples como en N2 k = 20102 Nm-1 Uniones iónicas como en NaCl k = 1102 Nm-1 Para poder utilizar estas ideas en situaciones prácticas del dominio atómico es necesario tener en cuenta el problema de la reducción al sistema centro de masa, debido a que la energía potencial está expresada en términos de la distancia interatómica x, como si uno de los átomos estuviese fijo en el origen, pero para aplicar las Leyes de la Dinámica, lo que debe estar fijo es el CM. Como ya vimos en el capítulo anterior, para esto lo único que necesitamos es hacer los cálculos como si tuviésemos un cuerpo de masa reducida, , en el extremo de un resorte de longitud de equilibrio x0, y constante elástica k, con el otro extremo fijo en el origen. De manera que la frecuencia de las oscilaciones estará dada por la expresión que corresponde a las oscilaciones elásticas, 2 = k/m, pero con m sustituido por : f 1 2 k 1 k = m1 m 2 2 m1 m 2 (11.2) Siendo la masa reducida, que ya hemos encontrado en el capítulo anterior: m1 m 2 m1 m 2 (11.3) Como veremos a continuación, experimentalmente resulta bastante sencillo determinar la frecuencia de vibración de estas moléculas. De manera que, cuando que las masas de los átomos son conocidas, a partir de la frecuencias puede determinar la constante de fuerza de la unión (utilizando (11.2), para tener datos de la unión química. Ahora nos falta tratar el problema de cómo se determina la frecuencia de movimientos de partículas que por su pequeñez no pueden ser vistas. Nociones de espectroscopía de vibraciones moleculares. Cuando lo que oscila es un átomo, la determinación de las frecuencias de oscilación no se puede hacer directamente, observando cómo oscila una partícula tan pequeña, sino que lo que se hace es analizar la radiación absorbida o emitida por la partícula oscilante cuando se interactúa con ella perturbándola de alguna manera. 355 Curso l Física I Autor l Lorenzo Iparraguirre Esto es el tema de estudio de la espectroscopía, que es el estudio de los espectros de las radiaciones. Hablemos un poco sobre los espectros. Si un haz de luz blanca se hace pasar por un prisma dispuesto adecuadamente, puede lograrse que luego continúe su marcha descompuesto en un conjunto de haces de colores que inciden separados sobre una pantalla. Si cada uno de estos haces de color se hace pasar nuevamente por un prisma, ya no se logra una ulterior descomposición, mientras que si se logra reunir todos los colores, nuevamente se obtiene el color blanco. Esto nos sugiere que el haz blanco es mezcla de ciertos colores que constituyen componentes “puros”, es decir que ya no son mezcla de otros. El conjunto de todos los colores componentes del haz, presentados desplegados sobre la pantalla de observación constituye el “espectro de colores componentes de la luz blanca”, o más simplemente, el “espectro de la luz blanca”. El aparato capaz de mostrar separadamente los componentes del haz, en este caso el conjunto de prisma + pantalla dispuestos adecuadamente (en otros casos puede haber muchos elementos más sofisticados), constituye el espectroscopio. El ojo humano no es buen analizador espectral, pues es sensible sólo al efecto global de la mezcla, y así resulta que la luz blanca, o de cualquier color, puede obtenerse con diferentes mezclas de colores componentes, sin que el ojo perciba diferencia. Son necesarios diferentes aparatos y técnicas espectroscópicas para analizar la composición espectral de diferentes radiaciones. La luz está constituida por ondas de campos electromagnéticos. Las ondas electromagnéticas en general son generadas por vibraciones de partículas cargadas, y su espectro completo abarca, en teoría, desde la frecuencia cero hasta infinito, aunque en la práctica las de frecuencia más baja suelen ser las ondas que se utilizan para las transmisiones radiofónicas, es decir, las ondas de “radio”, de algunos miles de ciclos por segundo, y las de frecuencia más alta son los rayos gamma, y los rayos cósmicos, con frecuencias de 1023 ciclos por segundo. La parte del espectro electromagnético que impresiona nustra retina como luz visible es la que tiene frecuencia desde poco más de 1014 ciclos por segundo para el color rojo, hasta casi 1016 ciclos por segundo para el color violeta. Es importante saber que, para cada zona del espectro electromagnético existen diferentes métodos, aparatos, y sistemas de detección y estudio. Así podemos mencionar la “espectroscopía UV” (para detectar radiación “ultravioleta”), la “espectroscopía IR” (para radiación “infrarroja”), la de “microondas”, etc., cada una con diferentes aparatos y técnicas específicas. El ultravioleta es la parte de frecuencias más allá de los 1016 ciclos por segundo, y el infrarrojo es la parte de frecuencias menores que 1014 ciclos por segundo. En esta parte encontraremos las vibraciones moleculares que ahora nos ocupan. Si llegásemos a frecuencias de 1011 ciclos por segundo, ya hablaríamos de “microondas”. Podemos tener un ejemplo diferente, en el campo de las vibraciones mecánicas, pensando en los sonidos. Las ondas sonoras son vibraciones mecánicas de elementos macroscópicos. Analizando un sonido cualquiera se encuentra que en general no contiene una frecuencia bien definida, sino que suele ser una mezcla de vibraciones de diferentes frecuencias. Con un analizador adecuado puede obtenerse todo el espectro de frecuencias componentes. El sonido de cada componente de frecuencia bien definida, constituye una nota pura. Para el caso que nos interesa ahora, de la absorción o emisión de ondas electromagnéticas por vibraciones de partículas cargadas en el dominio atómico o molecular, la teoría que debe utilizarse para estudiar sus características es la teoría cuántica, no la clásica. Curso l Física I Autor l Lorenzo Iparraguirre El caso con la teoría cuántica Un elemento fundamental que hay que considerar es la cuantificación de los valores de energía, que para este caso nos dice que los valores permitidos de la energía son: En = (n + ½) h f + Ep(x0) (11.4) Donde: n es cualquier número natural de 0 en adelante. f es la frecuencia de oscilación determinada por la teoría clásica: f = 1 2 k h 6,62610-34 Js , es la constante de Planck, Ep(x0) es el valor arbitrario de la energía potencial en la posición de equilibrio (para este caso sería , aunque no tiene importancia en lo que vamos a hacer). En la siguiente figura se ilustran niveles posibles para nuestro caso de interés. Si es el valor de la energía potencial en el fondo del “pozo”, el estado de menor energía total posible tiene energía E0 = + ½ h f (ver figura 11.2)). Aquí encontramos algo que no tiene explicación clásica: aún con la mínima energía posible, tiene lugar una vibración con cierta cantidad de energía cinética media que no puede quitarse al sistema. Si la temperatura es suficientemente baja, como puede considerarse la temperatura ambiente en general, el sistema estará en este nivel de menor energía, denominado “fundamental”. La cantidad de energía D0 = ½ h f, se denomina “energía de disociación”, pues es la energía que se debe suministrar al sistema (supuesto que se parte de este estado de mínima energía) para que la energía total llegue al valor E = 0, con el cual x , y la molécula se disocia (ver figura). E (J) Ep(x) x x0 0 E(x0) = - En línea de trazos los niveles que corresponderían a oscilaciones elásticas puras. E4 E3 E2 E1 E0 D0 hf hf 2 Fig. 11.2: Se indican niveles de energía total para las vibraciones posibles de los átomos en una molécula biatómica. En línea de trazos se indica una función cuadrática que aproxima la parte cercana a la posición de equilibrio. Esta función corresponde a una fuerza elástica pura, y para ella vale exactamente la fórmula En = (n + ½) h f . Ésta constituye una buena aproximación para los niveles más bajos de la vibración de la molécula. 357 Curso l Física I Autor l Lorenzo Iparraguirre No sólo la energía total de la oscilación está cuantificada, sino que la energía de la radiación también se considera que viaja en “paquetes” denominados “fotones”, cada uno de energía hf. Cuando una partícula oscilando con la energía de un nivel cualquiera En , es perturbada por algún agente externo, como puede ser un haz de radiación electromagnética, puede absorber (o perder) un fotón energía y pasar a un nivel de más (o menos) energía, siempre que la energía del fotón sea la exacta para pasar a otro nivel permitido de energía de vibración. Es decir, en una radiación con mezcla de fotones de varias frecuencias, la partícula oscilante sólo podrá absorber fotones de la energía que le permita llegar exactamente al nivel En+1 (si los hay en el haz). Y si la partícula pierde energía, lo hace emitiendo la cantidad hf exacta para quedar en el nivel En-1. NOTA: Si el electrón en el estado n es afectado por un choque con otra partícula, puede saltar a cualquier nivel m, absorbiendo la energía exacta (m – n) h f. Pero si el choque es con un fotón, es decir absorbe (o emite) radiación electromagnética, hay que aplicar una regla de selección, que dice que n = 1: un electrón sujeto a una fuerza elástica sólo puede absorber/emitir fotones saltando a un nivel consecutivo superior/inferior. Ahora bien, tenemos que la energía exacta para saltar al próximo nivel superior, o inferior, en el caso de las oscilaciones elásticas de frecuencia f, vale: En+1 - En = hf (11.5) Pero esa es la energía de un fotón de esa misma frecuencia. De manera que, en resumen, un conjunto de sistemas en estas condiciones, sólo absorberá de un haz que lo perturbe, un conjunto de fotones de la frecuencia exacta prevista por la teoría clásica de la oscilación, o en caso contrario, si emite, sólo emitirá fotones de esa misma frecuencia exacta. Para el caso que nos interesa, podemos considerar el siguiente procedimiento experimental. Espectros de absorción y emisión Una fuente de radiación electromagnética emite un haz de ondas de frecuencia f hacia una muestra de la sustancia que se supone contiene moléculas con átomos que pueden vibrar con frecuencia f0. Dos detectores registran la intensidad de la radiación que llega a dos lugares diferentes: D1 detecta en la dirección de marcha original del haz, lo que recibe es lo que hubiera llegado sin interposición de la muestra, menos lo que ésta absorbe o dispersa en otras direcciones; D2 detecta en una dirección muy distinta, por ejemplo a 90o de la dirección original; allí no detectaría nada proveniente directamente del haz original, y sólo puede recibir algo que sea irradiado por la muestra. Curso l Física I Autor l Lorenzo Iparraguirre muestra fuente D1 irradiación por parte de la muestra D2 Fig. 11.3: Esquema de un dispositivo experimental para detectar absorción o emisión de radiación por parte de una muestra. De manera que, mientras la frecuencia de la radiación emitida por la fuente, que se va variando lentamente, no coincide con f0, la muestra se comporta prácticamente como transparente para ella: no absorbe energía, y deja pasar toda la radiación sin afectarla. En esta situación D1 registra algo constante, y D2 no registra nada. Por otra parte, cuando f se acerca mucho, y pasa por el valor f0 , una gran cantidad de energía es absorbida y reirradiada en todas direcciones. D1 registra una disminución en la intensidad recibida, mientras D2 registra un “ pico” de emisión. intensidad en D2 intensidad en D1 f0 f0 f f Espectro de emisión Espectro de absorción Fig. 11.4: Espectros de absorción y emisión para una muestra que tiene un única frecuencia de vibración. Cualquiera de los espectros nos informa de manera equivalente sobre la frecuencia de oscilación del sistema. Con esta idea esquemática, se puede trabajar sólo para detectar emisión, o sólo absorción, dependiendo de muchas posibilidades de los diferentes aparatos y técnicas, detalles en los que no estamos interesados aquí. La siguiente tabla 11.1 contiene los datos que nos permitirán considerar muchas situaciones reales. NOTA: LA VISIÓN CLÁSICA. En la teoría clásica hubiéramos planteado que los sistemas atómicos que podían vibrar con frecuencia f0, al ser sacudidos o excitados por radiación de frecuencia f, sólo entran en resonancia, absorbiendo y reirradiando en todas direcciones cantidades apreciables de energía, cuando la frecuencia excitadora coincide con la f0 propia del sistema. Éste es un caso en el cual con la teoría clásica se llega a la misma conclusión que con la cuántica. 359 Curso l Física I Autor l Lorenzo Iparraguirre Tabla 11.1: datos de ligaduras de algunas moléculas diatómicas: frecuencia de oscilación, constante de fuerza y longitud de la ligadura, y energía de disociación. frecuencia k longitud ligadura Energía de disociación 1013 s-1 ( Nm-1 ) ( pm ) ( kcal / mol ) H2 12,48 520 74,1 104 D2 8,97 530 74,1 104 HCl 8,66 480 127,5 103 O2 4,67 1140 120,7 119 N2 6,99 2250 109,4 227 CO 6,43 1860 112,8 257 NO 5,63 1550 115,1 150 NaNa 0,473 17 307,8 18 NaCl 1,13 120 236,1 98 KCl 0,834 82 266,7 101 F2 2,68 460 142 38 LiCl 1,94 143 202 111 ClCl 1,67 320 198,8 58 Molécula Ejemplo desarrollado 1 Dadas las siguientes frecuencias encontradas experimentalmente, encuentre aproximadamente la constante de fuerza de la ligadura, y según ese valor determine el tipo de unión que puede estar involucrada. F2 2,671013 s-1 ; CO 6,431013 s-1 ; KCl 0,8341013 s-1 Desarrollo Para cada molécula calculamos la masa reducida, y luego obtenemos la constante de fuerza con la expresión k = 4 2 f2 , obtenida despejando de (11.2). Obtenemos así: F2 : = 9,5 uma = 1,58·10-26 kg , CO : = 6,86 uma = 1,14·10-26 kg , KCl : = 18,61 uma = 3,09·10-26 kg , k = 444 N/m k = 1858 N/m k = 85 N/m Considerando los valores típicos aproximados de la constante de fuerza en diferentes ligaduras, que se dieron hace varias páginas en este capítulo, encontramos que podemos clasificar: F2 : covalente simple (valor típico 500 N/m) CO : covalente triple (valor típico 2000 N/m) KCl : iónica (valor típico 100 N/m) Curso l Física I Autor l Lorenzo Iparraguirre Ejemplo desarrollado 2 La ligadura H-H en la molécula de H2 tiene una longitud de 74,1 pm, una energía de disociación de 104 kcal/mol, y una constante de fuerza de aproximadamente 520 N/m. a) Encuentre la frecuencia de las vibraciones posibles de esta molécula. Corroborar con valores de tablas. b) Suponiendo que el sistema se pudiera considerar un oscilador armónico para todas las energías hasta llegar a la disociación, y que fuera válida exactamente la fórmula cuántica de los niveles de energía En = (n + ½) h f , encuentre cuántos niveles de vibración posible habría. c) Considerando que el deuterio, o hidrógeno pesado (D = 2H), sólo difiere del hidrógeno en la masa del núcleo, ya que éste está formado por un protón junto con un neutrón, explique qué valores espera para la molécula D2 (en función de los valores correspondientes a la de H2) para la longitud de la ligadura D-D, para la energía de disociación, para la constante de fuerza, y para la frecuencia de las oscilaciones. Corroborar con valores de tablas. Desarrollo a) Para calcular la frecuencia necesitamos la constante de fuerza, que es dato, y la masa reducida. 11 0,5 uma 0,8310-27 kg 11 1 520 12,61013 1/s f 2 0,83 10 27 (Dentro del 1% corrobora el valor de la tabla: 12,481013 1/s). b) Debemos contar cuántas veces entra el espaciado entre niveles en la energía de disociación. Espaciado entre niveles: h f 6,62610-3412,61013 8,3510-20 J. 104 4180 Energía de disociación: D0 104 kcal/mol 7,2210-19 J 23 6,022 10 Número de niveles: parte entera de (D0/hf) = 8 Esto es una aproximación considerando que el espaciado entre niveles se mantuviese constante e igual al del oscilador armónico para todas las energías. No tenemos elementos para mejorar esta aproximación (un cálculo mejor indicaría que entran algunos niveles más, como se podría corroborar experimentalmente). c) Para la molécula de deuterio se espera muy aproximadamente la misma energía de disociación, la misma longitud de la ligadura, y la misma constante de fuerza que para la de hidrógeno, porque la nube electrónica que forma la ligadura sólo depende de la carga nuclear, que es la misma para ambas moléculas. En cambio se espera una diferencia importante para la frecuencia de oscilación, ya que depende de la masa. Para el deuterio sería: 2 2 1 uma =1,6610-27 kg 22 1 520 f =8,911013 1/s 2 1,66 10 27 (Dentro del 1% corrobora el valor de la tabla: 8,971013 1/s). 361 Curso l Física I Autor l Lorenzo Iparraguirre 11.2.- Rotaciones de moléculas diatómicas rígidas El espectro del rotador rígido. El caso más simple de rotación de una molécula consiste en el caso de dos átomos unidos de manera que pueda asimilarse a un sistema rígido, el cual constituirá un primer modelo útil para lograr familiaridad con los conceptos más básicos del tema. Este modelo se denomina modelo del rotador rígido. Ya hemos visto que la unión entre los átomos de la molécula no es rígida, pero, dado que como veremos al final, se necesita mucha más energía para cambiar el estado de vibración que el estado de rotación, resulta que es fácil encontrar situaciones en las cuales este modelo representa bastante bien la realidad. Por otra parte, al final del capítulo se muestra que es sencillo combinar la teoría de la rotación con la de vibración. Consideremos dos partículas, de masas m1 y m2, unidas por algún elemento ideal que mantiene una distancia d, fija, entre ambas. Este sistema, que es el llamado rotador rígido, puede moverse de muy variadas maneras, combinando traslación con rotación, pero ya sabemos que se lo debe describir desde el sistema CM, y allí sólo podrá ejecutar rotaciones puras alrededor de ejes que pasen precisamente por el CM. m2 v2 CM d v1 m1 Fig. 11.5: Esquema de una posible rotación de una molécula “rotador rígido”, descripta en el sistema CM. En este caso tendremos dos partículas desarrollando un movimiento circular uniforme en el plano de la hoja alrededor del CM, y, desde el punto de vista del sistema rígido completo, podemos decir que es un cuerpo con momento de inercia I (respecto del CM), que realiza una rotación intrínseca. En el lenguaje de las rotaciones podemos escribir: J = I = m1 r12 + m2 r22 Ec = ½ I 2 = ½ m1 r12 2 + ½ m2 r22 2 (11.6) (11.7) Y ya hemos visto que estas expresiones también se pueden escribir en función de la masa reducida y la distancia relativa entre las partículas, utilizando I = d2, con lo cual tendremos: J = d2 = I Ec = ½ d2 2 = J2 2 d2 (11.8) (11.9) Curso l Física I Autor l Lorenzo Iparraguirre La Mecánica Cuántica no impone directamente niveles cuantificados a la energía en este caso, pero que sí lo hace, de la manera que ya hemos visto, con la cantidad de movimiento angular, y a través de ésta resulta la cuantificación de la energía, de la siguiente manera. El módulo de la cantidad de movimiento angular resulta cuantificado según el número j, que puede tomar cualquier valor entero desde cero en adelante (j = 0, 1, 2, 3, ...), según la expresión (fue la expresión (13.13) del capítulo anterior): h J = j( j 1) = j( j 1) (11.10) 2 En donde como ya hemos visto = h/2 1,0545910-34 Js, se considera la unidad de momento angular para los fenómenos de nivel atómico. De manera que, introduciendo en (11.9) la cuantificación de J, resultan valores cuantificados para la energía cinética, la cual además, en este modelo simple, es también la energía total: Ej = j ( j 1) 2 (11.11) 2 d2 El espectro contendrá entonces las radiaciones con energías que correspondan a los saltos que sean posibles entre estos niveles, los cuales están dados por lo que se denomina “reglas de selección”. Para el caso de radiación electromagnética perturbando a este sistema las reglas de selección son: j = 1 (11.12) De manera que sólo puede haber transiciones entre niveles consecutivos. Ahora tenemos que la energía es una función cuadrática del número cuántico j, y la energía del correspondiente fotón, dada por la diferencia entre niveles consecutivos será diferente para cada nivel, según la expresión: 2 Ej+1j = Ej+1 - Ej = [( j 1)( j 2) j( j 1)] 2 d2 = ( j 1) 2 (11.13) d2 Dado que a su vez la energía del fotón depende de la frecuencia según: Ef = h f = 2 f , las frecuencias que podrán encontrarse en el espectro estarán dadas por: ( j 1) fj = (11.14) 2d 2 Es decir, a partir de la frecuencia f0 = /2d2, correspondiente a la transición j = 1 j = 0, el espectro contiene todos sus múltiplos enteros: 2 f0 , 3 f0 , . . . , etc. 363 Curso l Física I Autor l Lorenzo Iparraguirre Intensidad en un detector que registra espectro de emisión f0 2f0 3f0 4f0 f Fig. 11.6: Frecuencias que contiene un espectro de rotación pura. Es importante tener idea del orden de magnitud de los valores de frecuencia que pueden corresponder a estos espectros. Si tenemos en cuenta que la masas típicas pueden ir desde 0,5 hasta 102 uma (tomemos 10 uma), mientras que la distancia internuclear típica puede ser de 0,2 nm, obtenemos para f0 valores del orden de 1011 Hz (energía del orden de 10-22 J para cada fotón), que están entre las microondas y el infrarrojo “lejano”. En general las líneas correspondientes a los demás valores de j, estarán también en el infrarrojo. Ahora bien, la figura 11.6 muestra en qué valores de frecuencia se puede encontrar absorción o emisión de radiación, pero no pretende indicar en qué valores la intensidad detectada puede ser mayor o menor – por eso se han dibujado todas las líneas de la misma altura. Para especular sobre la posible altura de las líneas tenemos que pensar en otro aspecto del fenómeno: cuando irradiamos una muestra con la frecuencia exacta que corresponde a una absorción, digamos del nivel j para pasar al j+1, sólo podemos esperar mucha absorción si hay muchos sistemas que están en nivel j. Es decir esperamos una absorción proporcional al número de sistemas que haya previamente en el nivel j (lo que se denomina “número de ocupación” del nivel). No podría haber absorción, por ejemplo, si previamente no hubiera ninguna molécula con energía Ej. Lo mismo vale para la emisión: la emisión desde el nivel j al j1, necesariamente tiene que ser proporcional al número de sistemas que ocupan previamente el nivel j. De manera que la intensidad de las distintas líneas del espectro debe depender fuertemente de la temperatura, que es la que determina la distribución, o sea la cantidad relativa de moléculas en cada nivel de energía. Si se tiene en cuenta que a temperatura ambiente las energías cinéticas promedio de las moléculas debido a la agitación térmica están en el orden de k T 10-23300 > 10-21J, y que eso es lo que se puede esperar en promedio que reciba cada molécula cuando es chocada al azar, se encuentra que (a temperatura ambiente) sólo una porción pequeña del total de moléculas de un gas estará en los niveles más bajos, y que mayoritariamente estarán distribuidas al azar entre niveles correspondientes a valores de j relativamente grandes. Esto significa que al irradiar una muestra típica con frecuencias en el infrarrojo lejano, se detecte un espectro como el mostrado en la figura 11.7, en la cual se ve que la intensidad es muy pqueña en las frecuencias más bajas, tiene un máximo en una zona que corresponde a la energía media de la agitación térmica, y decrece para frecuencias mayores, debido a la ausencia de moléculas con energías mucho mayores que el promedio correspondiente a la temperatura. Curso l Física I Autor l Lorenzo Iparraguirre Intensidad f Fig. 11.7: Forma típica de un espectro de rotación puro. La forma global está regulada por la población de los distintos niveles, la cual depende tanto de la temperatura como de la multiplicidad de los niveles. NOTA:1 LA MULTIPLICIDAD DE LOS NIVELES Además hay otro efecto que influye sobre la intensidad de las líneas del espectro, y es de lo que se denomina “multiplicidad de los niveles”. Ésta tiene que ver con el número cuántico m, que se refiere a las orientaciones en el espacio de las rotaciones, como ya vimos en el capítulo anterior. El número m es entero, y va, de 1 en 1, desde –j hasta +j. Esto significa que para cada número de momento angular j (es decir, en este caso para cada nivel de energía), hay 2 j + 1 valores posibles de m, y eso quiere decir, 2 j + 1 posibilidades de existencia diferentes. O sea, ejemplificando: hay un estado sin rotación, de energía E0 = 0, tres estados de rotación 1, y energía E1, cinco estados de rotación 2, y energía E2, etc. En la práctica esto se traduce en que cada nivel tiene probabilidad de poblarse proporcional a las posibilidades que ofrece, o sea, a la multiplicidad 2 j + 1. Esto tiende a hacer más intensas las líneas correspondientes a las energías mayores, mientras estas energías no lleguen a ser mucho mayores que la energía media de la agitación térmica. NOTA 2: EL EFECTO CENTRÍFUGO Como aclaración vale decir que en la práctica las líneas no resultan exactamente equiespaciadas porque para valores grandes de j, el aumento de momento angular trae aparejado (debido a la fuerza centrífuga) un aumento de la distancia interatómica d, que significa, según las expresiones (11.13) o (11.14), que las líneas se juntan un poco, para valores grandes de j, con respecto al espaciamiento uniforme que se esperaría para el caso del sistema idealmente rígido. Ejemplo desarrollado Un espectro de absorción de radiación infrarroja por parte de una muestra gaseosa consiste en una serie de varias líneas equiespaciadas, con una separación de 1,158×10 11 Hz . a) Determine si lo que se observa puede ser un espectro de rotación de CO, de NO, o de O2 . b) Si la parte más intensa del espectro llega aproximadamente hasta la 7 ma u 8va línea, desapareciendo prácticamente el espectro algunas líneas más allá, determine aproximadamente la energía de rotación que es mayoritaria en las moléculas de la muestra, y a través de ella, estime la temperatura. Desarrollo a) Por la descripción es claro que sí puede ser un espectro de rotación. 365 Curso l Física I Autor l Lorenzo Iparraguirre Ahora, a partir de la expresión (11.14), teniendo los valores de todas las frecuencias, podemos calcular el momento de inercia de la molécula. Por ejemplo tomamos j = 0 f0 = 1,158 1011 Hz I = 1,45 10-46 kgm2. Luego, a partir de las distancias interatómicas de la tabla calculamos los momentos de inercia de estas moléculas (I = d2), y obtenemos (en 10-46 kgm2): 1,45 para CO, 1,64 para NO, y 1,93 para O2. Queda claro que lo que se observa puede ser un espectro de CO, y no de los otros compuestos. b) Si las líneas alrededor de la 7ª u 8ª son fuertes, significa que esos niveles están muy poblados, y el hecho de que más allá la intensidad decaiga también significa que es pobre la población de los niveles correspondientes. Podemos esperar que el valor medio de la energía cinética de rotación alrededor de un eje, dado por kB T, esté cercano a E8. Calculando E8 con (11.11) obtenemos E8 = 2,7 10-21 J, y de allí T alrededor de 200 K. Rotación y vibración de moléculas diatómicas. Después de introducir el tema estudiando un sistema de dos partículas que rota rígidamente, sin posibilidades de vibración a lo largo de la ligadura entre las partículas, estamos en condiciones de considerar el caso real, en el cual la unión no se comporta rígidamente, y la vibración resulta combinada con la rotación del sistema en diversos grados. La energía total de un sistema que puede vibrar y rotar (no existe la posibilidad de la traslación porque se considera en reposo el centro de masa) es la suma de la energía cinética de rotación, más la energía total (cinética más potencial) correspondiente a la vibración. Como cada término de esta suma está cuantificado, la energía total estará determinada por los dos números cuánticos independientes correspondientes: En,j = En + Ej = (n + ½) j ( j 1) 2 k + 2 d2 (11.15) Ahora bien, como ya hemos visto, el primer término es mucho más grande que el segundo, el cual en la práctica tiene el efecto de producir una pequeña corrección al valor entregado por el primero. Si lo interpretamos en términos de un esquema de niveles de energía, podremos imaginar que cada nivel de energía vibracional dado por un número n, se ha transformado, o “desdoblado” en un conjunto de niveles muy próximos, correspondientes a los diferentes valores de j que son posibles. E (J) Ep(x) x E4 j=3 j=2 j=1 j=0 E3 E2 E1 E0 n=1 n=0 n = 1 j =1 n =1 j =-1 j=3 j=2 j=1 j=0 Fig. 11.8: Esquema de niveles y transiciones posibles teniendo en cuenta rotación y vibración. Se ha representado cómo la separación entre niveles vibracionales es muy superior a la de niveles rotacionales. Curso l Física I Autor l Lorenzo Iparraguirre Según las reglas de selección impuestas por la mecánica cuántica, las transiciones permitidas para emisión/absorción de fotones son: n = 0, 1, y j = 1 (11.16) Tenemos así dos tipos de transiciones. Por una parte las transiciones sin cambio de estado vibracional (n = 0), que corresponden a cambios solamente en el momento angular, regulados por la regla de selección j = 1, y dan lugar al espectro de rotaciones que se describió en el punto anterior, en el infrarrojo lejano. Por otra parte, cuando hay cambio de estado vibracional, tenemos transiciones como las indicadas en la figura, dadas por las reglas n = 1, y j = 1. Como se deduce fácilmente de la figura, la energía absorbida o emitida en estas transiciones tiene aproximadamente el valor correspondiente a la diferencia de energía entre niveles vibracionales, con pequeñas perturbaciones o correcciones dadas por el término indicativo de la variación de estado rotacional. Es decir, si fv es la frecuencia correspondiente a la vibración armónica pura, y fj son las frecuencias correspondientes al espectro de rotación pura, ahora se encuentra un espectro con absorciones y emisiones en todas las frecuencias: fv fj , con j = 0, 1, 2, 3, . . . (11.17) Es decir, para cada frecuencia fj en la cual hay una línea de absorción en el espectro de rotación pura (en el infrarrojo lejano, como se dijo), hay dos líneas cerca de fv, que aparecen como alteraciones o desdoblamientos del espectro de vibración: una en fv + fj , y otra en fv fj . De manera que, como se muestra en la figura, en la vecindad de la frecuencia fv, se encuentra todo el espectro de rotación dos veces, una a cada lado del valor fv. La línea situada exactamente en fv , en cambio, paradójicamente, ha desaparecido, ya que correspondería a una transición n = 1, j = 0, que no está permitida. Intensidad f fv Fig. 11.9: Forma general del espectro de vibraciones combinadas con rotaciones. Aplicando un poco de deducción mezclada con un poco de imaginación podemos decir que el hecho de que la separación entre niveles de vibración sea mucho mayor que entre niveles de rotación nos muestra que en un ambiente suficientemente frío una molécula puede recibir por los inevitables choques, energías que le alcanzan para cambiar su estado de rotación pero no para sacarlo de su estado fundamental de vibración, con lo cual su comportamiento corresponde muy bien al del rotador rígido que se ha propuesto como modelo inicialmente para las rotaciones. Por ejemplo, en la molécula N2, la energía para saltar de nivel vibracional (5·10-20 J) sería aproximadamente 10 veces más grande que la energía cinética media de cualquier grado de libertad a temperatura ambiente (4·10-21J), y a su vez esta última sería 10 veces más grande que la energía necesaria para cambiar entre los primeros modos rotacionales (10-22 J). Esto significa claramente que a temperatura ambiente las moléculas de N2 viajan chocando y cambiando caóticamente tanto la orientación como la rapidez de la traslación y la rotación, pero sin comenzar a vibrar (más allá de la vibración fundamental que no puede eliminarse). 367