c A p I T u L o 1
Anuncio

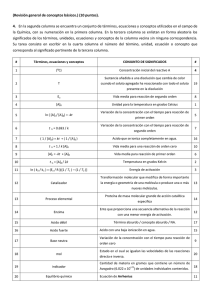
c
A
p
u
~
I T
L
o
QUE ESTUDIAN
LOS BIOQUrMICOS
13
1
14
Que estudion los bioqulmicos
y transformacion de la energia. Para que los organismos adopten formas particulares e intervengan en procesos especfficos se requiere orden. Inevitablemente, la reduccion del desorden, 0 entropia, es un proceso que requiere energia. Los organismos
se distinguen por utilizar energia con el fin de crear orden, y los organismos complejos 10 hacen en forma continua. Lo que se sabe acerca de como los organismos
usan energia para crear estructuras ordenadas y llevar a cabo procesos ordenados,
es el fruto de aiios de trabajo realizado por miles de bioquirnicos. Una de las mas
importantes contribuciones de la bioquimica a la biologia es el entendimiento que
se ha logrado acerca de como los procesos qufmicos son capaces de crear orden.
La reproduccion es el proceso que de manera mas caracteristica separa a los organismos de la materia inanimada. Tanto los organismos celulares como los no celulares dan origen a otros organismos similares como parte de un ciclo de vida que
puede ser simple 0 complejo. Por supuesto, la division celular es un paso esencial
en la reproduccion de los organismos celulares. Por medio de la energia se elaboran
nuevas moleculas que se incorporan a nuevas estructuras en un proceso de desarrollo preciso que lleva a la formacion de dos nuevas celulas. En contraste con la mayoria
de las celulas, los virus y otros organismos no celulares, incluso menos complejos, son
en su totalidad parasitos 0 simbiontes, es decir, dependen de celulas hospederas especfficas que les proporcionen un medio en el que se pueda efectuar la reproduccion por
procesos que de ninguna manera se asemejan a la division celular. Por consiguiente,
en el caso de todos los organismos, sean celulares 0 no, el sitio donde tiene lugar la accion es la celula y esta es la entidad esencial para la reproduccion.
El bioquimico considera a la celula como una maquina extremadamente compleja y refinada. Tales maquinas poseen capacidades que estan lejos de asemejarse a
las que presentan las maquinas comunes fabricadas por el hombre. Una determinada celula presenta gran numero de respuestas a los cambios del ambiente. Las celulas de un organismo multicelular deben ser capaces de interactuar para producir el
conjunto de respuestas aun mas amplio que caracteriza a los organismos superiores.
La "adaptabilidad" es una caracteristica de la celula-maquina. Los organismos
complejos detectan y procesan de manera elaborada estimulos provenientes del
ambiente y del propio medio interno del organismo. Movimiento, secrecion, division celular, etc., se efectuan bajo un control preciso para hacer que el organismo
entero crezca y se reproduzca.
Del mismo modo, el bioquimico debe conocer las capacidades de cambio y adaptacion de los organismos, no solo en el marco de tiempo de un organismo individual, sino tambien en la escala de tiempo geologico. No basta considerar cualquier
organismo no celular, monocelular 0 multicelular en forma aislada 0 solamente tal
como existe en el momento. Los organismos se pueden clasificar como pertenecientes
a especies 0 grupos taxonomicos 0 funcionales similares. Los organismos intercambian, 0 al menos transrniten, informacion de control simbolicamente codificada; esto
es, poseen sistemas geneticos. Las capacidades de la progenie son reflejo de las del
(los) progenitor(es), y la progenie sigue planes definidos de desarrollo. Tales planes,
aunque definidos, no son rigidos; el medio y el tiempo los modifica. Los organismos no se pueden entender sin considerar antes como fueron sus predecesores. Los
organismos han evolucionado y se han adaptado a condiciones cambiantes a 10 largo
de una escala de tiempo geologica y continuan haciendolo. Por consiguiente, los
bioquimicos buscan la explicacion quimica de como los organismos se adaptan a
su medio tanto a corto plazo como a traves de las etapas geologicas.
La celula lleva a cabo la mas elaborada de las trans formaciones quimicas a la
vez que mantiene su medio interno dentro de limites definidamente controlados . Las
EI punto de vista de los bioqurmicos
75
celulas tienen lfmites y, dentro de estos lfmites, tambien tienen compartimientos. En
ellos, miles de tipos de moleculas pequefias y macromoleculas, en un medio acuoso, sufren transformaciones qufmicas e intercambian materia y calor con el exterior
de la celula. El elaborado funcionamiento macroscopico de los sistemas vivos hace
pensar anticipadamente en una gran variedad de mecanismos reguladores y catalfticos microscopicos. Hasta ahora solo una pequefia fraccion de estos se entienden a
nivel molecular.
Afortunadamente, los resultados obtenidos hasta el momento muestran una sorprendente coherencia con la biologfa desde el punto de vista de los bioqufmicos.
Se ha observado que los organismos, desde la entidad no celular mas simple hasta
las plantas superiores y los vertebrados ma~.~complejos, tienen en comun muchas
estructuras y reacciones qufmicas. Asf, al estudiar un organismo en particular, el
bioqufmico es capaz de predecir las reacciones bioqufmicas de este partiendo del
conocimiento que ya se tiene de otros organismos, incluso solo lejanamente relacionados. Este importante principio, que los organismos presentan a nivel qufmico una
unidad que no se espera al observar su diversidad biologica, influye en gran manera
sobre el pensamiento de los bioqufmicos.
1.2
EL PUNTO DE VISTA DE LOS BIOQuiMICOS
La bioqufmica tiene sus rafces en la medicina, la nutricion, la agricultura, la fermentacion y los procesos qufmicos de los productos naturales. Actualmente, se ocupa
del estndio qufmico de las moleculas que se encuentran en el interior de los sistemas
vivos 0 asociadas con estos, en especial los procesos qufmicos relacionados con las
interacciones de dichas moleculas. La mayorfa de los bioqufmicos laboran dentro
de un marco de trabajo, con una filosoffa particular. La hipotesis que por 10 general
no se expresa consiste en que es posible explicar las actividades de las celulas en
terminos de fenomenos ffsicos y qufmicos por complejas que sean. El desarrollo
de este conocimiento ha requerido y seguini requiriendo la cuidadosa aplicacion
de las leyes y los metodos de la ffsica y la qufmica en combinaci6n con la cuidadosa
manipulacion biologica de los sistemas en estudio.
La bioqufmica es una ciencia reduccionista en gran medida, pero no del todo.
Los bioqufmicos rutinariamente rompen las celulas y fraccionan el material liberado en el extracto con el proposito de obtener aislado uno u otro componente de la
celula. El bioqufmico trata de preparar extractos y fracciones con el fin de reducir
el numero de las variables fuera de control y obtener un resultado definido y confiable. La celula tiene capacidades que estan mas aHa de las que presentan sus subsistemas, pero el conocimiento que se tiene acerca de la celula se ha obtenido en gran
parte mediante el estudio de partes aisladas de la celula, incluso moleculas individuales.
El estudio de una enzima in vitro es un ejemplo comun del metoda reduccionista.
Las enzimas son los principales catalizadores in vivo de las celulas. En el tubo de
ensayo, las enzimas facilitan las complejas trans formaciones qufmicas que, en ausencia de dichos catalizadores, ocurrirfan s610 a una velocidad imperceptible.
EI investigador selecciona las condiciones de temperatura, concentraci6n, etc.
que es posible controlar en el tuba de ensayo y permite que la enzima trans forme
los sustratos autenticamente biologicos en productos tambien autenticamente biol6gicos. Sin embargo , es muy probable que las condiciones que son convenientes para
16
Que estudian los bioqufmicos
el investigador reflejen s610 ligeramente las condiciones de la celula intacta. Asi-
mismo, se requiere cuidado y una considerable atenci6n a la fisiologia detallada del
sistema para interpretar los resultados en el contexto de la celula intacta. A menudo, los resultados deben correlacionarse con otros datos bioquimicos, fisiol6gicos
o geneticos antes de que se pueda ofrecer una respuesta al problema.
Varios metodos bioquimicos modernos no son reduccionistas pero aprovechan
los avances tecnol6gicos para estudiar sistemas integros. Para completar este apartado se analizan cuatro de tales metodos. Cada uno permite que el investigador trate
directamente con el organismo integro y no obstante aprenda con gran precisi6n
el curso de una reacci6n en particular, las consecuencias de introducir un cambio
especffico en una estructura particular, etc .
Los radiois6topos son medios que permiten a los bioquimicos observar transformaciones metab61icas en el organismo intacto. Las formas radiactivas de moleculas especfficas, a menudo s610 con los ,homos en una posici6n especffica en las
moleculas marcadas, permiten localizar las moleculas radiactivas entre un numero
casi ilimitado de otras moleculas. Estas sensibilidad y especificidad se obtienen como resultado de procesos at6micos, como el decaimiento radiactivo, que generan
partfculas subat6micas de gran contenido de energfa faciles de detectar. Los procesos at6micos tipicamente tienen 10 5 0 mas veces la energia de los procesos quimicos. Asi, se puede preparar acido acetico con uno 0 sus dos atomos de carbono
radiactivos, es decir, con atomos de 14C radiactivos e inestables en lugar de los del
12C no radiactivos y mucho mas abundantes. Cuando el acetato radiactivo entra en
contacto con un organismo integro, parte se incorporara a los compuestos, tales
como los Ifpidos, que en ese momenta este sintetizando el organismo (ver, por
ejemplo, el capitulo 13). La diferencia quimica entre los acetatos con atomos de
14C y de 12C es tan pequena que las dos formas de acetato son intercambiables
en las reacciones bioquimicas. EI analisis subsecuente de los extractos preparados
a partir del organismo 0 sus secreciones revelara que compuestos se han formado a
partir del acetato radiactivo, aquellos que sean radiactivos. Aunque este analisis
requiere la ruptura de celulas como en el metodo reduccionista antes descrito, la
incorporacion ocurre en el organismo integro. Por consiguiente, si se realiza apropiadamente el experimento, los resultados deben retlejar el metabolismo del organismo integro.
EI empleo de la espectroscopia de resonancia magnetica nuclear, abreviada RMN,
constituye un segundo metodo. La RMN permite la vigilancia continua de reacciones quimicas especfficas en celulas intactas . Por ejemplo, las senales de resonancia
magnetica nuclear de los iones de fosfato inorganico en una celula permiten estimar
la concentraci6n del ion hidr6geno (ver secci6n 1.6) en la misma.
La tecnologia del DNA recombinante (ver capitulo 22) permite cambiar genes
in vitro, de un lugar a otro en un cromosoma. Incluso, los genes se pueden sintetizar, reacomodar, 0 efectuar ambas cosas, in vitro. Despues estos pueden emplearse
para transformar organismos y producir nuevos genotipos. De esta manera, es posible determinar las consecuencias bioquimicas para el organismo integro de cambiar
un solo gene.
La transferencia de macromoleculas 0 incluso organelos celulares de un organismo
a otro constituye el cuarto ejemplo de un metodo no reduccionista y con el minimo de alteraci6n de la celula. A la fecha se encuentran bien desarrolladas la microinyecci6n y otras tecnologias para lograr 10 anterior, al menos en el caso de la
transferencia a celulas individuales. A menudo, las macromoleculas 0 los organelos
realizaran su funci6n en la celula receptora, 10 que permitira determinar por ejem-
Plan de este libra
17
plo los efectos de diferentes ambientes celulares, pnicticamente inalterados, sobre
el funcionamiento de una enzima 0 proteina en particular.
1.3
PLAN DE ESTE LI BRO
Esta edicion consta de tres secciones:
En la parte I , Estructura y funcion de las biomoleculas, se trata uno de los objetivos mas antiguos de la bioquimica: la caracterizacion quimica de las macromoleculas y los compuestos de bajo peso molecular de los sistemas vivos . Aunque
la celula es la principal estructura de los sistemas vivos, se reserva una discusion
a fondo sobre ella hasta el capitulo 8, el primero de la parte 2. EI propos ito de
10 anterior es que dicho capitulo se fundamente en las descripciones precedentes
de los componentes celulares, de modo que la celula, junto con sus membranas
y compartimientos, se presente en terminos bioquimicos .
La parte 2 es : Metabolismo energetico y biosfntesis de moleculas pequenas. En
ella se describen las reacciones qufmicas especfficas y controladas en alto grado
por medio de las cuales las moleculas pequenas y algunas macromoleculas son
sintetizadas, interconvertidas y metabolizadas para producir energfa.
La parte 3 es: Genes, ex presion genica y metabolismo de las macromoleculas
portadoras de informacion. EI tema principal es el control genetico de la celula
que se efectua a traves de la sintesis de macromoleculas biologicas.
Como introduccion a la parte 1, cabe senalar que la mayorfa de las moleculas organicas de los sistemas vivos se incluyen dentro de una de cuatro clases generales :
carbohidratos, protefnas, acidos nucleicos y lfpidos. Casi toda la masa de estas
moleculas organicas consta de solo seis elementos: carbono, hidrogeno , oxigeno,
nitrogeno, fosforo y azufre. Los carbohidratos, compuestos principalmente de
carbono, hidrogeno y oxfgeno, sirven principalmente como fuentes de energfa y
materiales estructurales. No obstante, tambien determinan la polaridad de las protefnas y los lfpidos a los que estan unidos y a menudo funcionan como sitios de reconocimiento. Cuando funcionan como tales, las porciones de carbohidrato de las
macromoleculas biologicas pueden controlar la localizacion subcelular y otras importantes caracterfsticas de estas. Se considera a los carbohidratos como la primera
de las cuatro clases porque ilustran en forma sencilla y directa ciertas caracterfsticas
qufmicas importantes de las moleculas biol6gicas, como la asimetrfa molecular.
Las protefnas son polfmeros de aminoacidos y son las macromoleculas biol6gicas que muestran la mayor diversidad de funciones, entre otras el servir como estructuras y componentes estructurales, catalizadores y hormonas.
Los acidos nucleicos, las macromoleculas informativas, son contribuyentes esenciales de las propiedades mas caracterfsticas de los sistemas vivos: la reproduccion
y el control genetico. Los acidos nucleicos de bajo peso molecular participan en
el metabolismo energetico y la biosfntesis.
Los lfpidos constituyen los depositos de energfa y los principales elementos estructurales de las membranas celulares . Algunos lfpidos acruan como hormonas y
otros tipos de sen ales biologicas; otros son intermediarios metabolicos clave.
Aunque los constituyentes organicos y la mayorfa de los inorganicos de la celula
son determinantes para la estructura y el funcionamiento de la rnisma, comprenden
78
Que estudion los bioquimicos
solo una pequefia fraccion de la masa de una celula tfpica. Por supuesto, el compuesto mas abundante de la celula es el agua.
1.4 ALGUNAS PROPIEDADES IMPORTANTES DEL AGUA
Sin lugar a dudas, ningun factor ha tenido mas influencia en el desarrollo de la vida
sobre la tierra que las peculiares propiedades del agua asf como su abundancia en
nuestro planeta. Considere el grupo de compuestos que se mencionan en la tabla
1.1. Estos se pueden comparar con el agua porque todos tienen protones unidos a\
oxigeno 0 a algun otro atomo electronegativo. Como puede verse, el H20 tiene la
temperatura de ebullicion mas alta, el calor especffico de vaporizacion mas alto,
y por mucho, la temperatura de fusion mas alta de todos estos compuestos. Pauling
expreso el comportamiento anormal del H20 en otra forma, la compara con los
hidruros de otros elementos del Grupo VI de la tabla peri6dica: H2S, H2Se y H2 Te.
Cuando se hace 10 anterior se podrfa predecir que el H2 0 deberfa tener una temperatura de ebullicion de -lOooC en vez de + lOO°C.
La molecula de agua esta muy polarizada, es decir, sus electrones no estan uniformemente distribuidos en ella. El atomo electronegativo del oxfgeno tiende a captar electrones de los atomos de hidrogeno, 10 que deja una carga positiva neta
alrededor del proton. A causa de esta polarizacion, las moleculas del agua actuan
como dipolos y se orientan tanto hacia los iones positivos como hacia los negativos.
A su vez, esta propiedad explica la extraordinaria capacidad del agua para actuar
como solvente de los compuestos polares. Los iones ya sea positivos 0 negativos
de una red cristalina son atrafdos por las moleculas dipolares del agua y se solubilizan. Una vez en solucion, tanto los iones con carga positiva como los de carga negativa, son rodeados por capas protectoras de moleculas de agua, de modo que
disrninuye la interaccion entre estos iones con cargas opuestas.
Las elevadas temperaturas de ebullicion y de fusion del H20, asf como su alto
calor de vaporizacion son el resultado de la interaccion entre moleculas de agua adyacentes que se conoee como puente de hidr6geno. En pocas palabras, e1 termino
puente de hidr6geno se refiere a la interaccion de un atomo de hidrogeno, unido
en forma covalente a un atomo eleetronegativo con los electrones de un segundo
atomo electronegativo al que no esm direetamente unido en forma covalente. EI atomo de hidrogeno tiende a asociarse con el segundo atomo electronegativo al compartir el par de electrones libres de este atomo: de esta manera, se forma un enlace
TABLA 1.1 A lgunas propiedades frsicas del agua y otros compuestos
Substancia
Agua
Etanol
Metanol
NH3
H2S
HF
Temperatura
de fusion
(0C)
0
-114
-98
- 78
-83
-92
Temperatura
de ebullicion
(0C)
100
78
65
-33
-60
19
Calor de
vaporizacion
(col/g)
Capacidad
ca/orifica
(col/g)
Calor de
fusion
(col/g)
540
204
263
327
132
360
1.00
0.58
0.60
1.12
80
25
22
84
17
55
Algunos propiedodes importontes del oguo
19
debil de aproximadamente 4.5 kcal/mol. En los materiales biol6gicos, los dos atomos
que mas comunmente participan en los enlaces de hidr6geno son el nitr6geno y el oxigeno. En el hielo, las moleculas de agua esmn unidas casi en su totalidad por enlaces
de hidr6geno. Aun en el agua liquida se presentan pequeiias cadenas transitorias de moleculas de agua como resultado de esta interacci6n.
La energia necesaria para romper incluso el mas estable enlace de hidr6geno (de
4 a 10 kcal/mol) es mucho mejor que la requerida para romper la mayoria de los
enlaces covalentes. En una soluci6n acuosa los enlaces de hidr6geno se forman y
se rompen facilmente. El efecto acumulativo del enlace de hidr6geno en el agua
es un factor importante para explicar muchas de las propiedades excepcionales del
H2 0. De esta manera, la energia extra que se requiere para hervir el agua 0 fundir
el hielo se puede atribuir a la gran cantidad de enlaces de hidr6geno.
Otra de las propiedades extraordinarias del agua la hacen un medio ideal para
los organismos vivos. La capacidad calorifica especffica del H20, el numero de
calorfas requerido para elevar la temperatura de 1 g de agua de 15 a 16°C, es 1.0;
y es notablemente alta entre las de varios disolventes con enlaces de hidr6geno considerados en la tabla 1.1. S610 pocos disolventes, como el amonfaco lfquido, tienen
capacidades calorificas mayores que la del agua. Cuanto mayor sea el calor especffico de una substancia, menor sera el cambio de temperafiini que resulte cuando
ciicna sub!;iancia absorba una cantidad dada de calor. De este modo, las propiedades
del agua la hacen apropiada para mantener relativamente constante la temperatura
de un organismo vivo.
Como ya se mencion6, el~al()r_de vaporizaci6n del agua es muy alto. Expresado
como el calor especffico de vaporizacion-{calorfas aDsorbidas por gramo de agua
vaporizada), el valor para el agua es de 540 en su punto de ebullici6n e incluso mayor a temperaturas mas bajas. pste ~lt9_Yll!~r ~.~sulta, de_ gran _utilidad para que los .
organismos vivos mantengan con stante su temperatura" ya que es po sible disipar
una -gran caritidad de-calor' por vaporizaci6n del agua.
De igual manera el alto calor de fusi6n del agua (tabla 1.1Lr:.~,:,!sJf!..import,!ncia
en la estabilizaci6n del medio biol6gico . Aunque en las formas superiores de vida
nira vez se congela el agua, el calor desprendido por esta al congelarse es un factor
importante para disminuir la cafda de temperatura de un cuerpo de agua durante
el invierno. Asi, un gramo de H2 0 al congelarse a DoC, debe ceder 80 veces tanto
calor como el que pierde al disminuir de 1 a DoC exactamente antes de congelarse.
Por ultimo, debe citarse otro ejemplo de una propiedad del H20 que es de. gran
impOftmlcia-61016gica':-'erlIiO'se- expande al solidificarse, y por 10 tanto el hielo
eS1nenos denso que el agua. S6lo otras pocas substancias se expanden al congelarse. La importancia de esta propiedad para los procesos bio16gicos se ha reconocido
desde hace tiempo. Si el hielo fuera mas pesado que el agua, se hundirfa. Esto significa que los oceanos, lagos y corrientes de agua se congelarfan del fondo hacia la
20
Que estudion los bioquimicos
superficie, y una vez congelados, serf.a . e;<trema~amente diffcil que se fund~eran.
Obviarnente, una situaci6n asf no permltma que dlChos c~erpos de agua constltuyeran el habitat de muchas formas vivientes, como efectlvamente sucede.: .~o_que.
sucede en la realidad es que ·el agua Ifquida, mas caliente, se va al fondo de--tos
lagos y el hielo se mantiene sobre la superficie, donde el calor proveniente del
medio externo 10 aJcanza y 10 funde.
Otras propiedades del agua tales como su alta tension Sllp.erfici~LJ ..SLLeltwadaconstante dielectrica son ~uy importantes deSck el punto de vista de la biologfa.
Sin embargo, para estas se reconiienda al estudiante que consulte la publicacion clasica de Henderson, The Fitness of the Environment, en la que se discute este tern a
en forma mas detallada. En cambio, en la siguiente seccion se considera la capacidad del agua de disociarse en iones hidrogeno (H +) e hidroxilo (OH -), asf como los mecanismos que controlan las concentraciones de estos iones en las soluciones
acuosas , tanto experimental mente como en el organismo vivo. Para esto, primero
se estudia la Ley de accion de masas y el producto ionico deL agua.
1.5
LA LEY DE ACCION DE MASAS
Para la reaccion
A+B~C+O
(1 . 1)
en la que dos reactivos, A y B reaccionan para formar dos productos, C y D, se
puede escribir la expresion
(1.2)
Esta es una expresion matematica de la ley de acci6n de masas, aplicada a la reaccion 1.1, que establece que, en el equiLibrio, eL producto de Las concentraciones
de las substancias formadas dividido entre eL producto de Las concentraciones de
Los reactivos es igual a una constante conocida como La constante de equilibrio,
Keq- Esta constante es invariable para cualquier temperatura dada. Si varfa la concentracion de cualquiera de los componentes simples de la reaccion, tambien debe
carnbiarse la concentracion de por 10 menos uno de los otros componentes para cumplir las condiciones del equilibrio definido por KeqPara ser precisos, se debe distinguir entre la concentracion de reactivos y productos de esta reaccion y la actividad 0 concentraci6n efectiva de dichos reactivos.
yyroc;luctos. Desde haceI'i'iiicho-tie"mpo se reconoce que la concentracion de una
substancia no refleja de manera precisa su reactividad en una reaccion qufmica. Es
mas, estas discrepancias en el comportarniento son apreciables cuando la concentracion del reactivo es alta. A concentraciones altas, las moleculas individuales del reactivo pueden ejercer una atraccion mutua 0 presentar alteraciones en sus interacciones
con el solvente en el que ocurre la reaccion. Por otro lado, en soluciones diluidas,
la reactividad qufrnica puede ser proporcional a la concentracion de los reactivos,
10 que indica que tales interacciones son insignificantes . Para corregir la diferencia
entre concentracion y concentracion efectiva, se introdujo el coeficiente de actividad, 'Y. Asf se tiene que,
Disociaci6n del agua
21
donde QA se refiere a la actividad y CA a la concentraci6n de la substancia. El coeficiente de actividad no es una cantidad fija, sino que su valor varia dependiendo
de la composici6n de la soluci6n. A concentraciones muy bajas, el coeficiente de
actividad del soluto se aproxima a la unidad porque hay muy poca interacci6n entre
soluto y soluto, si es que existe alguna. Si la diluci6n es infinita, la actividad es
igual a la concentraci6n. Para los prop6sitos de este libro, por 10 general no se distinguini entre actividad y concentraci6n, en vez de esto, se usani el ultimo termino.
Las mas de las veces no se introduce un error serio con esto ya que la concentraci6n
de los reactivos en muchas de las reacciones biol6gicas es muy baja; 10 anterior
incluye la concentraci6n del ion H +, tema de la subsecci6n siguiente.
1.6
DISOCIACION DEL AGUA Y SU PRODUCTO IONICO, Kw
EI agua esta lejos de servir simplemente como un disolvente inerte para las reacciones bioqufmicas. Ademas de su capacidad como disolvente, el agua es qufmicamente reactiva. Es un electr6lito debil que se disocia s610 ligeramente para formar iones
H+ y OH - .
( l A)
El valor de la constante de equilibrio para esta reaccion de disociacion se ha medido
con precision, y a 25°C tiene un valor de 1.8 X 10 -16 moles/litro. Esto es,
KeQ
=
C~COH- =
l. 8 X 10- 16
H20
La concentracion de H20 (C H20) en agua pura puede calcularse dividiendo 1000
g/litro entre 18 g/mol, 10 que da un valor de 55.5 moles/litro. Puesto que la concentracion del H 20 en soluciones acuosas diluidas es esencialmente inmutable con respecto a la del agua pura, se puede tomar este valor como una constante. De hecho,
usualmente se Ie incorpora a la expresion de la disociacion del agua, para dar
CWC OH -
= l. 8 X 10- 16 X 55.5 = l.01 X 10- 14
Kw = l.0 1 X 10- 14
=
(l. 5)
a 25°C.
Esta nueva constante K w , Hamada producto i6nico del agua, expresa la relaci6n entre la concentracion de los iones H + Y OH - en soluciones acuosas diluidas; por ejemplo, esta relacion se puede usar para ca1cular la concentracion de H +
en el agua pura. Para hacerio, sea x igual a la concentracion de H +. Como en el
agua pura se produce un OH - por cada H + que se forma al disociarse una molecula de H 20, x debe ser igual tambien a la concentracion de OH - . Sustituyendo
en la ecuacion 1.5 se tiene
(x)(x) = l.01 X 10- 14 = x 2
Por 10 tanto,
x=lXlO- 7
= Cw = COH - = l. 0 X 10- 7 molll
22
Que estudian los bioquimicos
1.7
pH
En 1909, Sorensen introdujo el termino pH como una manera conveniente de expresar la concentraci6n del ion H + por medio de una funci6n logarftmica de base
10; el pH se puede definir como
(l.6)
donde aH + se define como la actividad del H +. Si se asume que el coeficiente de
actividad tiene un valor de 1, entonces
1
pH = log [H+] = -log [H+]
(1.7)
En esta ecuaci6n, para indicar que se esm tratando con concentraciones, se usan
parentesis angulares 0 corchetes. De esta manera, la concentraci6n del H+, (CH +),
se representa como [H +].
El ion hidr6geno es una de las pocas substancias para las que se estima de manera rutinaria tanto su concentraci6n como su actividad en ellaboratorio de bioqufmica. El medidor de pH 0 potenci6metro es un instrumento electroqufmico conectado
ados electrodos. Estos esmn en contacto con una soluci6n, uno directamente y el
otro a traves de una membrana de vidrio especial que es mucho mas permeable a
los protones que a la mayorfa de los otros cationes. La diferencia de potencial entre
los dos electrodos, que es 10 que mide el instrumento, se relaciona logarftmicamente con la actividad del ion hidr6geno y de aquf con el pH segun se defini6 en la
ecuaci6n 1.6. (Cabe hacer notar que en algunos sistemas de medici6n de pH modernos se combinan los dos electrodos en un electrodo "concentrico".)
El siguiente ejemplo indica la diferencia entre actividad y concentraci6n. El pH
de una soluci6n de HCl O.IM cuando se determina con un medidor de pH es 1.09.
Este valor se puede sustituir en la ecuaci6n 1.6 ya que el instrumento mide actividades.
1
l.09= log8 H+
8 H+
= 10-1.09
= 8.1 X 10- 2 moles/litro
Es de esperarse que la concentraci6n del ion hidr6geno en una soluci6n de HCl
O.IM sea 0.1 molesllitro ya que el HCl es un acido fuerte, totaimente disociado.
El coeficiente de actividad se puede calcular como
y = 8 w /[H+]
= 0.081/0.1
=0.81
De este modo, incluso a una concentraci6n de O.IM, el coeficiente de actividad para
los iones hidr6geno en una soluci6n de HCl es s610 ligeramente menQr que 1.
Acidos Bronsted
23
A las menores concentraciones del ion hidr6geno caracterfsticas de la mayorfa de las
reacciones bioqufmicas se acerca mas a la unidad.
Es importante reca1car que el pH es una funci6n logarftmica; por 10 tanto, cuando el pH de una soluci6n disminuye una unidad, de 5 a 4, la concentraci6n de H +
aumenta 10 veces, de 10 - 5M a 10 -4M. Cuando el pH aumenta tres decimas, de 6 a
6.3, la concentraci6n de H + disminuye en un factor de alrededor de 2, de 10 -6M
a 5 x 1O- 7M.
Si se apJica el termino del pH a la expresi6n del producto i6nico para el agua
pura, se obtiene otra expresi6n util
[W] X [OW] = l.0 X 10- 14
Se toman los logaritmos de esta ecuaci6n
log [W]
+ log [OW]
log (l.0 X 10- 14)
=-14
=
y se muItiplica por - 1
-log [W] - log [OW] = 14
Si ahora se define -log [OH -] como pOH, una definici6n similar a la de pH, se
tiene una expresi6n que relaciona pH y pOH en cualquier soluci6n acuosa
pH + pOH
1.8
=
14
(l.8)
ACiOOS BRONSTEO
Bronsted propuso una definici6n de acidos y bases muy uti! en bioquimica. Defini6
un dcido como cualquier substancia que puede ceder un proton, y una base como
una substancia que puede aceptar un proton. Los estudiantes de bioqufmica deben
entender plenamente el concepto de Bronsted, aunque otras definiciones de acidos,
de manera notable la propuesta por Lewis, son todavfa mas generales.
Las siguientes substancias encerradas en 6valos constituyen ejemplos de acidos
Bronsted:
~-->H++C I -
W + CH 3 COO-
y la expresi6n generalizada seria
24
Que estudian los bioquimicos
Las bases correspondientes se muestran ahora reaccionando con un proton:
CICH 3COO NH3
+ H+ ------> HCI
+ W ------> CH 3COOH
+ H+ ------> NH t
Cabe hacer notar que la primera de estas tres reacciones no ocurre en un grado apreciable en solucion acuosa porque el HCI es un acido fuerte.
La base correspondiente al acido debil generalizado HA es
Se acostumbra referirse al par acido-base como sigue: HA (0 HA + en el caso de
las aminas protonadas) es el acido Bronsted porque puede ceder un proton; al anion
A - (0 A neutra en el caso de las aminas) se Ie llama base conjugada porque puede aceptar el proton para formar el acido HA.
1.9
IONIZACION DE ACiDOS DEBllES
EI acido c1orhfdrico (HCI), un acido mineral muy conocido, esta completamente
disociado en H20.
(1.9)
Notese que la disociacion se representa como una reaccion irreversible. Lo mismo
ocurre en el caso de las bases fuertes, tales como el NaOH, y las sales de bases
y acidos fuertes, tales como el NaC!. En contraste con los acidos fuertes, los acidos
debiles solo esmn parcialmente ionizados en solucion acuosa. Esto se representa por
una ionizacion reversible del acido debil generalizado, HA.
HA
IAcido
conjugado,
1)
-!-
H2O
IBase
~
~
H30 +
conjugada,
IAcido
co njugado,
2)
2)
+
AIBase
conjugada,
1)
o la mas simple
(1. 10)
El H2 0 acepta el proton que cede el HA para formar el ion hidronio , H30 +. Aunque estrictamente es correcto reconocer que el proton esta hidratado en la solucion,
tarnbien estan otros iones, y generalmente se escriben las formulas para los iones
en la forma simple, no hidratada. Por 10 tanto, la constante de equilibrio se puede
escribir como
(111)
donde Ka es la constante de disociacion para el acido debil.
lonizaci6n de bases de biles
1.10
25
IONIZACION DE BASES DEBILES
Una manera de considerar la ionizacion de una base debil es por analogia directa
con la ionizacion de una base fuerte, esto es, escribir la reaccion como reversible
en vez de la reaccion irreversible NAOH - Na + + OH - . Es decir, tanto una base fuerte como una base debil puede definirse como una substancia que suministra
iones OH - al disociarse.
BOH~B + +OH­
Keq = Kb =
(1.12)
[B+][OW]
[BOH]
Por ejemplo, en los manuales de quimica a la Kb hidroxido de amonio (NH40H) se
asigna un valor del 1.8 x 10 -5 . Por 10 tanto, el grado de disociacion del NH40H es
identico al del acido acetico (CH 3COOH; Ka = 1.8 x 10 -5). Por supuesto, la diferencia mas importante es que el NH 40H se disocia para formar iones hidroxilo (OH -),
mientras que el CH 3COOH se disocia para formar protones (H+), ademas de que el
pH de las soluciones 0.1 M de estas dos substancias de ninguna manera es similar,
el de la primera tiene un valor superior a 7 y la segunda, acido acetico, inferior a 7.
EI grupo de las aminas organicas (por ejemplo, los grupos amino de los aminoacidos) es uno de los tipos mas comunes de bases debiles de la bioquirnica. Cuando
tales compuestos se representan por la formula general R - NH2 , no contienen grupos hidroxilo que se puedan disociar como en la reacci6n 1.12. Note que inc1uso
el hidroxido de amonio se puede escribir con este criterio, como HNH2 , 0 mas simplemente, NH 3 . Tales compuestos pueden ionizarse en H20 para producir iones hidroxilo de acuerdo con una ecuacion similar a la ecuacion 1.10.
RNH2
0,
+
H2O
OW
+
RNHt
IBase
conjugada,
IAcido
conjugado,
IBase
conjugada,
11
(Acido
conjugado,
21
21
11
de otra manera,
(1.13)
RNH2
+
H30 +
H2O
~
~
+
RNHt
{Base
(Acid a
{Base
conjugada,
conjugado,
conjugada,
IAcido
conjugado,
11
21
2J
11
que se simplifica a
RNH2 + W
~
RNHt
En la primera representacion de esta reaccion, el H2 0 sirve como un acido que
aporta un proton a la base RNH 2 . La constante de ionizacion correspondiente es
(1.14)
que por analogia con la ecuaci6n 1.12 se puede reescribir como
(1.15)
26
Que estudian los bioquimicos
La versi6n simplificada de la ecuaci6n 1.13 se puede escribir a la inversa, como
se hizo para el NH4 + en la secci6n 1.8. Esta es la disociaci6n de un acido Bronsted debil.
RNHt == RN Hz + W
La correspondiente constante del equilibrio de la disociaci6n se define mediante
K
a
=
[RNHz][W]
[RNHt]
(1.16)
Por consiguiente, no s6lo es posible sino conveniente, tratar tanto los acidos como
las bases debiles como acidos Br6nsted simplemente escribiendo la disociaci6n de
la forma protonada de la base. Tanto los valores de pKb como de pKa para bases
debiles se publican en forma de tablas. Note que estas dos cantidades se relacionan
en una forma simple. Dada una de ellas, es po sible ca1cular la otra. Multiplicando
la ecuaci6n 1. 15 por la ecuaci6n 1. 16, se obtiene
o
(1.17)
pKa + pKb = - log Kw = 14
1.11
LA ECUACION DE HENDERSON-HASSELBALCH
Henderson y Hasselba1ch han reordenado la ecuaci6n de la ley de las masas como
se aplica a la ionizaci6n de los acidos debiles, para obtener una util expresi6n conocida como la ecuaci6n de Henderson-Hasselba1ch. Considere la ionizaci6n de un
acido debil generalizado HA.
HA==W+A[W][A-]
Kion -- Ka -- .o...-~....:.
[HA]
Reordenando los terminos, se tiene
Tomando logaritmos, se encuentra
log [W ] = log Ka
+ log
[HA]
[A-]
y multiplicando por - 1,
[H Al
-log [W] = -log Ka - log [A-:-l
Si se define -log Ka como pKa Y -log [HA]/[A -] se sustituye por [A - /[HA],
se obtiene
Curvas de titulaci6n
27
(1.18)
Observe que cuando [A -] = [HA], pH = pKa porque ellogaritmo de 1 es cero.
Esta forma de la ecuaci6n de Henderson-Hasselbalch se puede escribir en una
expresi6n general en la que se reemplaza [A -] con el termino "base conjugada"
y [HA] con el de "acido conjugado"
(1.19)
Entonces, esta expresi6n no s6lo se puede aplicar a los acidos debiles como el acido
acetico, sino tambien a la ionizaci6n de los iones amonio y los gropos amonio sustituidos que se encuentran en los aminoacidos. En este caso, los iones NH4 + 0 los
gropos amino protonados RNH3 + son los acidos conjugados que se disocian para
dar lugar a protones y las bases conjugadas NH3 y RNH2 , respectivamente.
NHt;::::::::=: NH3 + W
RNHt;::::::::=: RNH2 + W
Aplicando la ecuaci6n 1.19 a la amina protonada, se tiene
pH = pK
a
+ log [RNH 21
[RNHtl
(l.20)
A menudo los manuales de bioquimica enumeran los valores de Ka (0 pKa) para los
acidos conjugados de substancias normalmente consideradas como bases (par ejemplo: NH40H, aminoacidos, aminas organicas) . Si no 10 hacen asi, seguramente se
enumeran los valores de Kb (0 pKb; ver ecuaci6n 1.17) para la ionizaci6n de la base
debil, y entonces debe calcularse primero Ka 0 (PKa) antes de emplear la ecuaci6n
de Henderson-Hasselbalch generalizada. Aunque se debe tener mayor cuidado para
identificar correctamente los pares acido-base conjugados en esa expresi6n, su empleo permite determinar directamente el pH de mezc1as de bases debiles y sus sales.
1.12
CURVAS DE TITULACION Y ACCION AMORTIGUADORA
En la figura 1.1 se muestra la curva de titulaci6n que se obtiene al titular 100 rnl
de una soluci6n de CH3COOH O.IN con NaOH O.IN. Esta curva se obtiene experimentalmente en ellaboratorio rnidiendo el pH del CH3COOH O.IN antes y despues de la adici6n de diferentes alfcuotas de NaOH O.IN. Asirnismo, la curva se
puede calcular mediante la ecuaci6n de Henderson-Hasselbalch para todos los puntos excepto el primero, en cuyo caso no se ha agregado cantidad de NaOH, y el
ultimo, para el que se ha afiadido una cantidad estequiometrica (100 rnI) de NaOH
O.IN. Resulta obvio que no se puede usar la ecuaci6n de Henderson-Hasselbalch
para determinar el pH en los lfmites de la titulaci6n, cuando la relaci6n de sal a
acido tiene un valor de cero 0 bien infinito.
28
Que estudian los bioqufmicos
A partir de la ecuacion 1.11 se puede calcular el pH de la solucion de acido acetico antes de afiadir cualquier cantidad de NaOH. La disociacion de acido acetico puro
en agua genera concentraciones iguales del ion acetato y de protones. Si se establece la concentracion del ion acetato y los protones igual a x y la concentracion del
acido acetico sin disociar igual a (C - x), la ecuacion 1.1 se convierte en
o
( 1. 2 1)
x2
=
KaCC- x)
la que es una ecuacion cuadratica. Esta se puede resolver para x mediante los metodos estandar para las ecuaciones cuadraticas. 0 bien, se puede simplificar para un
grado limitado de disociacion si se acepta que (C-x) es aproximadamente igual a
C. Entonces,
x= VKaC
(1.22)
Puesto que el valor de la Ka para el acido acetico es J. 8 x 10 - 5 Y la concentracion
del acido acetico en el ejemplo es O.IM, x = 1.3 X 10-3 . Como x es pequefia
comparada con C (0.1 M), la suposicion implicada en la aproximacion anterior se
justifica; y de hecho, se obtiene la misma respuesta al resolver la ecuaci6n cuadratica. Para x = [H +] = O.0013M, pH = 2.88, valor que concuerda con el de la curva 1 de la figura 1. 1.
Al final de la titulacion del acido acetico (curva 1, figura 1.1). Se tendran 200 ml
de solucion de acetato de sodio 0.05M. La reaccion que describe el equilibrio en este
punto de la titulacion; esto es, el punto final de la titulacion, es
La con stante de equilibrio se escribe como
K = .:...-[H_A-=-c)['----O_H-=--)
[Ac)[ H2 0)
A partir de esta se deriva
KH.U'
=
K[H 0) = [HAc)[OH-)
2
[Ac )
debido a que la concentracion del agua se mantiene aproximadamente constante.
El subfndice "Hidr" indica que el anion acetato experimenta una reaccion de hidrolisis. Por analogfa con la ecuacion desarrollada en el parrafo anterior, se hace
[OH - ] = [HAc] = x. Entonces,
suponiendo que la concentracion del anion acetato, C, no haya variado significativamente de 0.05M debido a la reaccion de hidrolisis. EI estudiante podra demostrar
Curvas de titulaci6n
29
14 , I
i
13 1·--- -
20
30
40
50
60
70
0.1 N NaOH (ml)
80
90
100
110
FIGURA 1.1 Curvo de tituloci6n de (1) 100 ml de CH 3COOH 0. 1N, (2) 100 ml de
HCI 0.1 N, Y (3) 100 ml de NH4Ci 0.1 N, con NoOH 0.1 N.
que KHidr = KwiKa' EI resultado es [OH-] = 5.3 x 1O - 6M, 10 cual corresponde
a un pH de 8.7, otra vez de acuerdo con la curva 1 de la figura 1.1.
Al considerar la forma de la curva de titulacion del acido acetico, se observa
que el cambio en el pH por unidad de alcali agregado es mayor al inicio y al final
de la titulacion; mientras que a la mitad de la misma, se obtiene el menor cambio
en el pH por cada unidad de alcali . En otras palabras, una mezcla equimolecular
de acetato de sodio y acido acetico muestra menos cambio inicial de pH, al afiadir
el acido 0 el alcali, que una solucion compuesta principalmente ya sea de acido acetico 0 de acetato de sodio. La capacidad de una solucion para resistir un cambio
de pH se conoce como su accion amortiguadora, y puede demostrarse que una solu··
cion amortiguadora presenta su rruixima accion a la mitad de la titulacion. Esto
corresponde a [HA] = [A -] en la ecuacion de Henderson-Hasselbalch; esto es,
cuando el pH es igual al pKa (ecuacion 1.18). En la figura 1.1, el punto de la
maxima acci6n amortiguadora para el acido acetico y los aniones acetato esta en el pH de
4 .74, que es el valor del pKa del acido acetico .
Otra manera de representar la condicion que existe cuando el pH de una mezcla
de acido acetico y acetato de sodio es igual al pKa, es sefialar el hecho de que a
este pH el acido esta semiionizado . Esto es, la mitad de la especie "acetato total "
esta presente como CH3COOH no disociado, rnientras que la otra rnitad esta en for-
30
Que estudion los bioquimicos
rna de ion acetato, CH3COO -. Esta es una de las maneras mas utiles para distinguir los acidos debiles individuales, puesto que a su pKa cualquiera de ellos estara
serniionizado. El pKa es tambien una propiedad caracterfstica de cada acido, porque la constante de ionizacion es una funcion de las propiedades inherentes del acido debil.
En la figura 1. 1 tambien se representa la curva de titulacion del HCI O.IN. En
este caso no es po sible usar la ecuacion de Henderson-Hasselbalch para calcular
la curva del HCl, ya que solo es apJicable a electrolitos debiles. En cambio, se puede calcular el pH en cualquier punto sobre la curva del HCl determinando los mil iequivalentes de HCI restante y haciendo la correccion por volumen. As!, cuando
se agregan 30 ml de NaOH O.IN, quedaran 7.0 meq de HCl en un volumen de
130 ml. Por 10 tanto, la concentracion de H+ sera 7.0/130 0 0.054M. Si no se torna en cuenta el coeficiente de actividad, es posible calcular el pH a partir de la
ecuacion 1.7 como 1.27.
La curva 3 de la figura 1.1 es la curva de titulacion obtenida al titular 100 ml
de NH4Cl O.IN con NaOH 0.1N. En esta titulacion los iones OH - cedidos por
el NaOH neutralizan a los protones donados por el NH4 +
Otra vez, la ecuacion de Henderson-Hasselbalch no resulta util cuando se calcula
el pH de la soluci6n de NH 4CI antes de aiiadir cualquier cantidad de NaOH. En
cambio, se puede usar una ecuacion de la forma de la ecuacion 1.21 6 1.22, con
NH4 + como el acido y NH3 como la base conjugada. No obstante, la ecuacion de
Henderson-Hasselbalch se puede emplear para determinar cualquiera de los otros
puntos sobre la curva, en tanto el NH4 Cl no se hay a titulado por completo .
Hasta ahora, solo se han considerado acidos monobasicos, tales como el acido
acetico. Los acidos polibasicos 0 poliproticos, que comunmente se encuentran en
bioqufmica, son acidos capaces de ionizarse para ceder mas de un proton por molecui a de acido. Cada paso de la disociacion lleva asociada una Kian 0 Ka. En el caso
del acido fosf6rico (H 3P04), la ionizaci6n completa de una mol de este acido puede
suministrar tres protones.
H3 P0 4
H2 P0 4
HPO~ -
=== H+ + H P0 4
=== W + HPO~­
=== W +
2
PO~-
Kal
Ka2
Ka3
=
=
=
7,5 X 10- 3
6,2 X 10- 8
4,8 X 10- 13
pKal
pKa2
pKa3
=
=
=
2,12
7,21
12,32
Esto significa que a un pH de 2.12, la primera ionizacion del H 3P04 esta a medio
completar; sin embargo, el pH debe ser de 12.32 antes de que la tercera y ultima
ionizacion del acido se encuentre al 50 %. A un pH de 7, el que con mas frecuencia
se encuentra en la celula, el segundo proton del acido fosforico (pKa2 = 7.21) estara disociado aproximadamente a la mitad. A este pH el monoanion H2 P04 - Y el
diani6n HP0 4 2 - del acido fosforico estaran presentes en la misma concentracion
aproximadamente. Un ester del acido fosforico , como el fosfato de cx-gJicerol, solo
tiene dos ionizaciones. Estas corresponden aproximadamente a los dos primeros valores del pKa del acido fosforico, de modo que a un pH de 7 las especies mas abundantes que se indican enseguida estan presentes en aproximadamente la misma
concentracion. Asf el ester fosfato
Curvas de titu/aci6n
31
parece estar "perdiendo" el "ultimo" pKa. Esto se debe en gran medida a efectos electrostaticos. Resulta mas diffcil eliminar un proton cargado positivamente de
un monoanion fosfato 0 de un monoanion del ester fosfato que del acido fosforico
o su ester sin ionizar. De esta manera, en el caso de ambos compuestos la primera
ionizacion corresponde a la de un acido similarmente fuerte, y la segunda, a la de
un acido sirnilarmente debil, ya que estan implicadas las mismas cargas ionicas para
el acido fosf6rico y su monoester.
Muchos de los acidos organicos comunes encontrados en el metabolismo intermediario son poliproticos; por ejemplo, el acido succfnico se ioniza de acuerdo
al siguiente esquema:
COOH
I
CH 2
I
CH 2
I
COOH
COO-
pK",
= 4.2
I
CH 2
I
CH 2
I
+
COO-
H+
I
CH 2
pK(1
COOH
= 5.6
6H 2
I
COO-
+
H+
A un pH de 7.0 en la celula, el acido succfnico existini predominantemente como
el dianion -OOC-CH2 -CHr COO -, al que comunmente se hace referencia como
succinato. La mayorfa de los monoacidos organicos que funcionan como metabolitos en la celula; por ejemplo, los acidos palmftico, lactico y piruvico, son acido<;
tan fuertes como el acido acetico 0 mas que el. Por consiguiente, al igual Ijue ~I
succinato, tambien estaran presentes en la forma anionica. Esto ha llevado a usar
de manera comun los nombres de los iones (palmitato , lactato y piruvato) en lugar
de los nombres de los acidos que los originan en las discusiones bioqufmicas sobre
estos. No obstante, en este texto sera una practica comun emplear las formulas de
los acidos sin disociar al escribir las reacciones qufmicas. En la tabla 1.2 se indican
los valores del pKa para varios de los acidos organicos comunmente encontrados
en el metabolismo intermediario.
TABLA 1.2 pKa de algunos acidos organicos
Acido
ACido
Acido
Acido
Acido
Acido
Acido
Acido
Acido
Acido
acetico (CH 3COOH)
acetoacetico (CH 3COCH 2 COOH)
cftrico (HOOCCH 2C(OH)(COOH)CH 2COOH)
f6rmico (HCOOH)
fumarico (HOOCCH=CHCOOH)
DL-glicerico (CH 20HCHOHCOOH)
DL-lactico (CH 3CHOHCOOH)
DL-malico (HOOCCH 2CHOHCOOH)
pinivico (CH 3COCOOH)
succfnico (HOOCCH 2 CH 2 COOH)
4 .74
3.58
3.09
3.62
3.03
3.55
3.86
3.40
2.50
4.18
4 .75
4.54
5.26
5.56
5.41
32
Que estudian los bioquimicos
1. 13
DETERMINACION DE LOS VALORES DE pKa
El pKa de cualquier grupo disociable es una propiedad caracteristica de una molecula, relativamente facil de determinar. Esto se hace en el laboratorio preparando
experimentalmente una curva de titulacion con un potenciometro para la medicion
del pH, una bureta y un compuesto titulador. A medida que se agregan cantidades
conocidas de alcali 0 acido a una solucion de la substancia desconocida, se determina el pH, y se esta en condiciones de construir la curva de titulacion. A partir de
esta curva se puede determinar el punto de inflexion (pKa) . Esto es posible en el
caso de moleculas con grupos titulables simples, como el acido acetico, y en el de
moleculas tales como el acido fosforico que experimentan multiples ionizaciones.
Sin embargo, cuando los valores del pKa son muy cercanos entre si, como sucede
con el acido citrico por ejemplo (tabla 1.2), los valores del pKa no corresponden
exactamente a los puntos de inflexion por 10 que se requiere un anal isis mate matico
mas complejo para determinarlos.
En este punto, se recomienda al estudiante hacer un repaso de la estequiometria
quimica. Es necesario entender plenamente el significado de peso molecular en gramos (mol) y peso equivalente en gramos (equivalente), asi como el de molaridad,
molalidad y normalidad. La bioquimica es una ciencia cuantitativa y el estudiante
debe en tender inmediatamente terminos como milimol y micromol. Por ejemplo,
en relacion con las titulaciones, se debe saber que de ninguna manera son similares
la concentracion de H + del H2S04 O. IN y del CH 3 COOH O.lN, aunque 1 litro de
cada una de estas soluciones contenga la misma cantidad de acido titulable total.
1. 14
SOLUCIONES AMORTIGUADORAS
La regulacion del pH es una propiedad esencial de los sistemas biologicos . EI pH
del plasma sanguineo humano se mantiene dentro de 0.2 de unidad de pH de 7.2
a 7.3 ; los valores fuera de estos limites no son compatibles con la vida. Las enzimas
(capitulo 4) encargadas de catalizar las reacciones tanto dentro como fuera de las
celulas frecuentemente presentan su maxima accion catalitica a un pH definido , y
algunas tienen actividad catalitica significativa solo dentro de un estrecho intervalo
de pH . Las reacciones metabolicas constantemente producen acidos y bases Bronsted, a menudo en cantidades no balanceadas . Cualquier desequilibrio que tienda a
mover el pH fuera del intervalo de actividad optima de la celula debe compensarse.
La regulacion del pH en los sistemas bioquimicos naturales se lleva a cabo tanto
por soluciones amortiguadoras , el tema de esta seccion , como por mecanismos activos que requieren energia.
Los sistemas biologicos contienen proteinas, sustratos organicos y sales inorganicas disueltos, muchos de los cuales actuan como amortiguadores del pH. En el
laboratorio, el bioquimico desea examinar las reacciones in vitro en condiciones tales
que sea minima el cambio en el pH. Las mas de las veces estas condiciones se obtienen mediante el empleo de amortiguadores del pH eficientes, preferiblemente inertes, en las reacciones que se estudian. Los amortiguadores incIuyen acidos debiles
como los acidos fosforico , acetico y maleico, 0 bases debiles como el amoniaco ,
la piridina y el tris-(hidroximetil)amino metano.
Si se tiene un pleno entendimiento de la ionizacion de los electrolitos debiles es
posible hablar de las soluciones amortiguadas. Una soluci6n amortiguada es aque-
Soluciones amortiguadoros
33
Ita que resiste un cambia en su pH al agregarsele un acida a un alcali . Es muy
comlln que la soluci6n amortiguadora consista en una mezcla de un acido Bronsted
debil y su base conjugada; por ejemplo, las mezclas de acido acetico y acetato de
sodio 0 de hidr6xido de amonio y cloruro de amonio son soluciones amortiguadoras
del pH.
Considerese el mecanismo por el cual una soluci6n amortiguadora ejerce control
sobre grandes cambios del pH. Cuando se agrega un aIcali (por ejemplo, NaOH)
a una mezcla de acido acetico (CH 3COOH) y acetato de potasio (CH 3COOK), se
lleva a cabo la siguiente reacci6n:
Esta reacci6n indica que el ion OH - reaccion6 con los protones proporcionados
por la disociaci6n del acido ctebil y form6 agua.
Al agregar el alcali hay una disociaci6n ulterior del CH3COOH disponible para suministrar protones adicionales y asi mantener la concentraci6n del H +, esto es, el
pH, sin cambio.
Cuando se agrega acido a una soluci6n amortiguadora de acetato, ocurre la reacci6n siguiente:
Los protones agregados (por ejemplo, en forma de HCI) se combinan rapidamente
con el ani6n CH3COO - presente en la mezcla amortiguadora (como acetato de potasio) para formar el acido debil no disociado CH3COOH. En consecuencia el cambio en el pH resulta mucho menor del que ocurriria en ausencia de la base conjugada.
Al discutir los aspectos cuantitativos de la acci6n amortiguadora, se debe sefialar
que son dos los factores que determinan la eficacia 0 capacidad de una soluci6n
para este prop6sito. Es claro que la concentraci6n molar de los componentes amortiguadores es uno de ellos. La capacidad amortiguadora es directamente proporcional a la concentraci6n de los componentes de la soluci6n amortiguadora. A estas
alturas conviene mencionar la manera convencional que se emplea para referirse
a la concentraci6n de las soluciones amortiguadoras. Esta se define como la suma
de la concentraci6n del acido debil y la de su base conjugadas. Asi, una soluci6n
amortiguadora de acetato O.IM podrfa contener 0.05 moles de acido acetico y 0.05
moles de acetato de sodio en I litro de H20. Asimismo, podria contener 0.065 moles
de acido acetico y 0.035 de acetato de sodio en 1 litro de H20.
EI segundo factor que influye en la efectividad de una soluci6n amortiguadora del
pH es la relaci6n entre la concentraci6n de la base conjugada y la concentraci6n
del acido debil. Desde un punto de vista cuantitativo, pareceria evidente que el amortiguador mas efectivo seria el que tuviera concentraciones iguales de componentes
basicos y acidos, ya que una mezcla semejante surninistraria cantidades iguales de
componentes basicos 0 acidos para reaccionar, respectivamente, con acido 0 aIcali.
De manera similar, el analisis de la curva de titulaci6n del acido acetico (figura 1.1)
revela que el minimo cambio en el pH que resulta de la adici6n de una unidad de
34
Que estudian los bioquimicos
alcali (0 acido) ocurre en el pKa del acido acetico. Mediante metodos matematicos
es posible probar que esto es asf. A este pH, ya se ha visto que la relacion entre
el CH3COO - y el CH3COOH es 1. Por otro lado, a valores de pH muy alejados
del pKa (y por 10 tanto, a relaciones entre base conjugada y acido que difieren bastante de la unidad), el cambio en el pH por cada unidad de acido 0 alcali agregado
es mucho mayor, esto es, la capacidad amortiguadora es considerablemente menor.
Una vez establecidos los dos factores que influyen en la capacidad amortiguadora,
se pueden considerar las decisiones implicadas en la seleccion de un amortiguador
que sea efectivo al valor de pH deseado, por ejemplo, pH = 5. Evidentemente, 10
mas deseable es seleccionar un acido debil con un pKa de 5.0. Si esto no es posible, la primera opcion es aquel acido debil cuyo pKa se acerque mas a 5.0. Ademas, es evidente que se querra emplear una concentracion tan alta como sea
compatible con otras caracterfsticas del sistema. Sin embargo, una concentracion
de sal demasiado alta a menudo inhibe la actividad de las enzimas 0 de otros sistemas fisiologicos. Asimismo, la solubilidad de los componentes del amortiguador
limita la concentracion que puede emplearse.
En la tabla 1.3 se indican los valores de pKa de algunos amortiguadores comunmente
empleados en bioqufmica.
1.15
AMORTIGUADORES FISIOLOGICOS
La capacidad de ionizarse es una propiedad esencial de muchos compuestos biologicos. Los acidos organicos, aminoacidos, protefnas, nuc1eotidos y otros esteres fosTABLA 1.3 Soluciones amortiguadoras
Compuesto
Acido N-(2-acetamido-)iminodiacetico (ADA)
Acido acetico
Cloruro de amonio
Acido carb6nico
Acido cftrico
Dietanolamina
Etanolamina
Acido fumarico
Glicina
Glicilglicina
Histidina
Acido N-2-hidroxietilpiperazfn-N' -2etansulf6nico (HEPES)
Acido maleico
Acido 2-(N-morfolin)-etansulf6nico (MES)
Acido fosf6rico
Acido pirofosf6rico
Trietanolamina
Tris-(hidroximetil)aminometano (Tris)
Acido N-Tris(hidroximetil)metil-2aminoetansulf6nico (TES)
Dietilbarbiturato s6dico
Acido etilendiarnintetraacetico
6.6
4.7
9.3
6.1
3.1
8.9
10.3
4.7
5.4
4.5
9.5
8.1
6.0
9.2
9.5
3.0
2.3
3. 1
1.8
7.6
2.0
6.2
2.1
0 .9
7.8
8.0
7.5
6.3
7.2
2.0
12.3
6.7
9.4
2.7
6.2
10.3
8.0
2.0
Amortiguadores fisio/6gicos
35
fato son ejemplos de compuestos bioqufmicos que se ionizan a diferentes grados
en los sistemas biologicos. Puesto que el pH de la mayorfa de los fluidos biologicos
es cercano a 7, el grado de disociacion de algunos de estos compuestos puede ser
total en ese punto. Por ejemplo , la primera ionizacion del H3P04 sera completa;
la segunda ionizacion (pKa2 = 7.2) sera semicompleta de manera aproximada. Mas
adelante se encontraran otros ejemplos en el Iibro. Es posible que surja la pregunta
acerca de cuales de estos son fisiologicamente importantes como amortiguadores
del pH en el organismo intacto. La respuesta depende de varios factores incluyendo
los mencionados en la seccion precedente; esto es, la concentracion molar de los
componentes del amortiguador y la relacion de la concentracion de la base conjugada a la del acido debil. EI primero de estos factores parecerfa descartar a muchos
de los compuestos encontrados en eI metabolismo intermediario en el que rara vez
es grande la concentracion de tales metabolitos. Esto incluirfa los esteres del acido
fosforico de la glicolisis, los acidos organicos del cicio de Krebs, y los aminoacidos
libres. Sin embargo, en las plantas , ciertos acidos organicos (malico, cftrico 0 isocftrico) se acumulan en las vacuolas y, en ese caso, tienen una funcion importante
en la determinacion del pH en esa parte de la celula. Las levaduras tambien acumuIan concentraciones relativamente grandes de esteres del acido fosforico durante la
glicolisis.
En los animales, se encuentra en la sangre en circulacion un complejo sistema
de control del pH, con elementos de control tanto amortiguadores como activos.
Entre los componentes de este sistema se incIuyen CO2 y HC0 3 , NaH2P04 y
Na2HP02, las form as oxigenada y no oxigenada de la hemoglobina y las protefnas
del plasma. Dos de estos merecen mas amplios comentarios . Puesto que el pKal
para el H2C03 es 6.1, la relacion de la base conjugada al acido debil es aproximadamente 20: 1 en el intervalo normal del pH de la sangre que es de 7.35 a 7.45.
Consecuentemente, cabrfa esperar que el par H2CO r HC0 3 - no sea muy efectivo
como amortiguador del pH. No obstante, el par acido carbonico-bicarbonato tiene
una funcion importante en el control del pH, ya que la sangre esta sujeta a intercambio de CO 2 con los tejidos y la atmosfera. EI acido debil H2C03 se equilibra nipidamente con el CO2 disuelto en el plasma (ecuacion 1.23). La enzima anhidrasa
carb6nica que se encuentra en los globulos rojos de la sangre cataliza este equilibrio.
(l.23)
A su vez, el CO 2 disuelto esta en equilibrio con el CO 2 atmosferico y, dependiendo de la presion parcial del CO2 en la fase gaseosa, escapara hacia fase aerea (como en los pulmones donde se espira el CO 2) 0 entrara a la sangre (como en los
tejidos perifericos donde se espira el CO2) 0 entrara a la sangre (como en los tejidos perifericos donde se produce CO2 por la respiracion celular). Asf, el sistema
amortiguador H2COr HC0 3 - es menos importante que el rapido equilibrio
CO 2,,, H2C0 3 que convierte al CO2 en un acido esencialmente muy volatil, cuya
cantidad total se controla dentro de ciertos Ifmites en la sangre a fin de mantener
la relacion entre la base conjugada (HC0 3 -) y el acido debil (H 2C03) de 20:1.
Las dos formas de la hemoglobina encontradas en la sangre (hemoglobina oxigenada , HHb02, y hemoglobina desoxigenada. HHb) constituyen el otro sistema importante de control del pH de la sangre. La capacidad amortiguadora de las
hemoglobinas, la protefna mas abundante de la sangre, se debe en gran medida al
grupo imidazol de los residuos de histidina (ver seccion 3. 14.3). La hemoglobina
contenida en llitro de sangre puede amortiguar 27.5 meq de H+ (esto es, teo rica-
36
Que estudion los bioquimicos
mente se requieren 27.5 meq de acido para cambiar el pH en una unidad). En contraste, las proteinas del plasma s610 pueden amortiguar 4.24 meq de H +. El control
activo del pH por las hemoglobinas ocurre porque las dos formas de hemoglobina
difieren en sus pKa; la HHb02 es el acido mas fuerte y se disocia con un pKa\ de 6.2
pKaJ
=
6.2
Por 10 tanto, en los pulmones donde la presi6n parcial del O2 es alta, la HHb02
predominara sobre la forma desoxigenada y asi la sangre tiende a volverse mas acida. En los tejidos perifericos donde la presi6n parcial del O2 es relativamente mas
baja, predominara la HHb con el mas alto pKa\ de 7.7, y el pH tendera a aumentar, ya que el equilibrio que se indica abajo se desplaza hacia la izquierda.
HHb~W+Hb-.
pKaJ
=
7.7
Los dos efectos compensan la baja concentraci6n de CO2 en los pulmones con respecto a la que existe en los tejidos perifericos, y los dos efectos operando juntos
hacen que el cambio en el pH sea minimo. Por consiguiente, el control del pH de
la sangre es un ejemplo de la maquinaria bioquimica (ver secci6n 1.1) que es absolutamente esencial para la adecuada funci6n de los sistemas bio16gicos.
BI BLiOGRAFiA
1. L.l. Henderson, The Fitness of the Environment, Boston: Beacon Press, 1958.
2. l.H. Segel, Biochemical Calculations, 2nd ed. New York: Wiley, 1976.
PROBLEMAS DE REPASO
1. l,Que constituye la biosfera de la Tierra?
2. l,CuaIes son algunas de las ventajas y desventajas potenciales de estudiar una reacci6n
bioquimica particular aislada, cuando los componentes celulares purificados se hallan en
un tubo de ensayo, en vez de hacerlo en celulas intactas?
3. l, Que propiedades del agua la hacen particularmente adecuada para sustentar la vida sobre
nuestro planeta?
4. l,CuaI seria aproximadamente el pH de una soluci6n que se prepara disolviendo 0.02 moles de acido f6rmico y 0.012 moles de NaOH en agua para dar un volumen final de 100 ml?
5. Calcular la composici6n de soluciones amortiguadoras. Es necesario que cada soluci6n
amortiguadora sea de etanolamina (H 2 N-CH 2 -CH 2 -OH) O. 1OM y contenga acido acetico. El pH de una debe ser 5.0 y el de la otra 9.2. l,CuaI de estas dos soluciones tendra
la mayor capacidad amortiguadora?