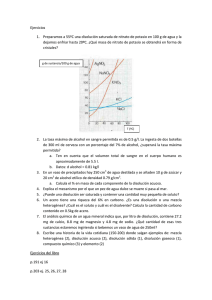
1. Un soluto A tiene una KD de 4 entre agua y cloroformo a) Calcula
Anuncio

LABORATORIO DE QUÍMICA ANALÍTICA 1 FECHA DE ENTREGA: 20-Mayo-15 Elaboró. Q. Everardo Tapia Mendoza Serie de problemas 8. Extracción líquido-líquido. NOMBRE: ___________________________________________________________________________________ 1. Un soluto A tiene una KD de 4 entre agua y cloroformo a) Calcula la concentración de A en el cloroformo cuando se alcanza el equilibrio, si la concentración de A medida en la fase acuosa en el equilibrio es de 0.02 M. b) Si el volumen de agua es de 80 mL y el cloroformo de 10 mL. ¿Cuál es el porcentaje de A en la fase orgánica y en la acuosa? c) Utilizando el volumen del inciso anterior. Calcule el número de moles de A en la fase orgánica y en la acuosa? d) ¿Cuál es la concentración de A en los 80 mL de agua antes de iniciar la extracción? 2. Se tienen 50 mL de una disolución de ácido benzoico (2 x 10-3 M) en agua. Indique lo siguiente: a) ¿Cuál es el porcentaje de extracción obtenido si se usan 20 mL de diclorometano? La KD del ácido benzocio en agua y diclorometano es de 14.9. b) ¿Cuál es el porcentaje de extracción obtenido si se usan 5 mL de diclorometano? c) ¿Cuál es el porcentaje de extracción obtenido si se usan 30 mL de diclorometano? d) Concluya. Para tener una mejor cuantitatividad en la extracción de un soluto en la fase acuosa a la orgánica. ¿Es preferible utilizar volúmenes pequeños o grandes de fase orgánica? 3. Si una extracción es cuantitativa cuando el 99% de soluto es extraído, ¿cuál deberá ser el valor de KD si Vac = Vorg? REPASO DE EJERCICIOS DE SOLUBILIDAD. (Estos son ejercicios por si requieren practicar para el examen) 1. Si la concentración del ion Ag+ en una disolución acuosa saturada de Ag2CrO4 es 1.56 x 10-4 M. a) Calcule el producto de solubilidad de dicha sal b) A 50 mL de una disolución 0.001 M de Ag+ se agregan 25 mmol de K2CrO4. ¿Hay precipitación? AYUDA: Considera que no hay un cambio en el volumen. c) En caso de que exista precipitado ¿Qué porcentaje de plata precipitó? 2. Si a 100 mL de una disolución de Mn2+ 0.05 M se ajusta a pH= 8 ¿Qué % de manganeso estará precipitado? Kps (Mn(OH)2) = 2.0 x 10-13 ¿Qué pH hay que imponer a la disolución anterior para que todo en manganeso este soluble? 3. Calcule la cantidad necesaria de NaBrO3 que requiere añadir a una disolución de [Ba2+] 0.01 M para precipitar al menos el 90 % del Ba como su respectivo bromato. pKs (bromato de bario) 5.50.