Capítulo 3. Interacciones químicas débiles
Anuncio
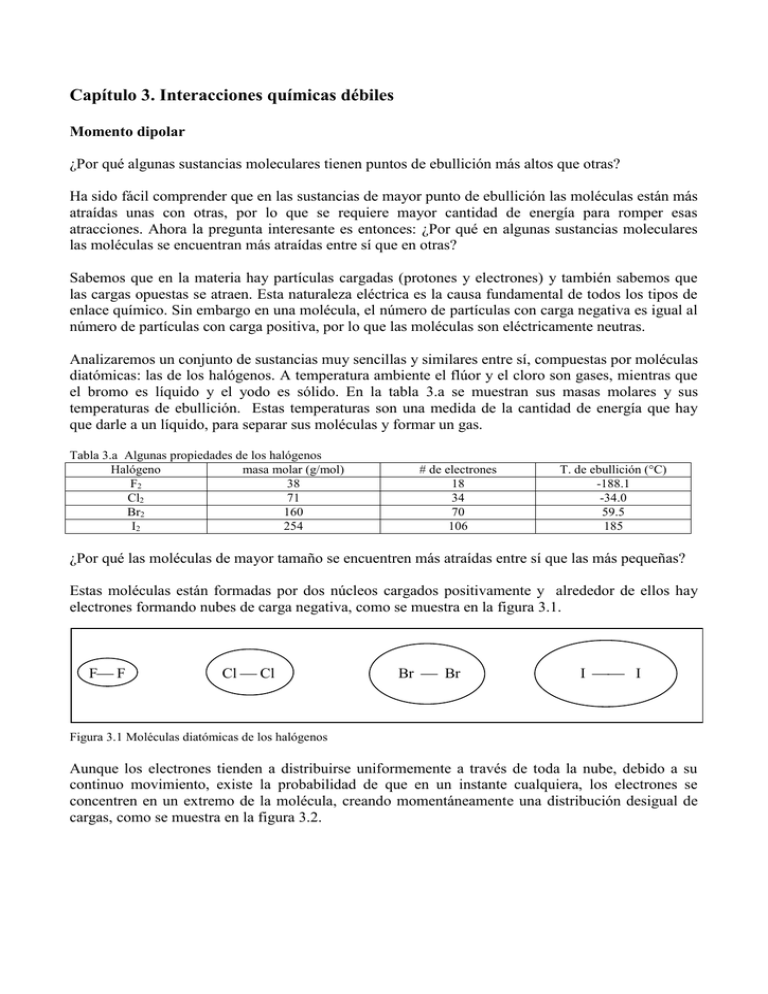
Capítulo 3. Interacciones químicas débiles Momento dipolar ¿Por qué algunas sustancias moleculares tienen puntos de ebullición más altos que otras? Ha sido fácil comprender que en las sustancias de mayor punto de ebullición las moléculas están más atraídas unas con otras, por lo que se requiere mayor cantidad de energía para romper esas atracciones. Ahora la pregunta interesante es entonces: ¿Por qué en algunas sustancias moleculares las moléculas se encuentran más atraídas entre sí que en otras? Sabemos que en la materia hay partículas cargadas (protones y electrones) y también sabemos que las cargas opuestas se atraen. Esta naturaleza eléctrica es la causa fundamental de todos los tipos de enlace químico. Sin embargo en una molécula, el número de partículas con carga negativa es igual al número de partículas con carga positiva, por lo que las moléculas son eléctricamente neutras. Analizaremos un conjunto de sustancias muy sencillas y similares entre sí, compuestas por moléculas diatómicas: las de los halógenos. A temperatura ambiente el flúor y el cloro son gases, mientras que el bromo es líquido y el yodo es sólido. En la tabla 3.a se muestran sus masas molares y sus temperaturas de ebullición. Estas temperaturas son una medida de la cantidad de energía que hay que darle a un líquido, para separar sus moléculas y formar un gas. Tabla 3.a Algunas propiedades de los halógenos Halógeno masa molar (g/mol) F2 38 Cl2 71 Br2 160 I2 254 # de electrones 18 34 70 106 T. de ebullición (°C) -188.1 -34.0 59.5 185 ¿Por qué las moléculas de mayor tamaño se encuentren más atraídas entre sí que las más pequeñas? Estas moléculas están formadas por dos núcleos cargados positivamente y alrededor de ellos hay electrones formando nubes de carga negativa, como se muestra en la figura 3.1. F F Cl Cl Br Br I I Figura 3.1 Moléculas diatómicas de los halógenos Aunque los electrones tienden a distribuirse uniformemente a través de toda la nube, debido a su continuo movimiento, existe la probabilidad de que en un instante cualquiera, los electrones se concentren en un extremo de la molécula, creando momentáneamente una distribución desigual de cargas, como se muestra en la figura 3.2. + + + I + - I - - Figura 3.2 Molécula de yodo en la que los electrones se han distribuido de manera desigual. Cuando, como en este caso, hay cargas de la misma magnitud q pero de signo opuesto separadas por una distancia r, se dice que existe un momento dipolar, o momento dipolo: = qr En este caso particular, como el de la molécula de I2, se le llama dipolo instantáneo, pues la separación de cargas no es permanente. Sin embargo la probabilidad de que las cargas se distribuyan momentáneamente de manera no homogénea, aumenta con el número de electrones en la nube, así como del volumen total en el que éstos se mueven. Como se generan polos de carga, se dice que la molécula se polariza. La polarizabilidad en las moléculas de los halógenos aumenta con el tamaño, es decir Menos polarizable F2 < Cl2 < Br2 < I2 Más polarizable Ahora imaginemos lo que sucede cuando una molécula de yodo que se encuentra polarizada, se acerca a una molécula de yodo no polarizada. (Figura 3.3) Un dipolo instantáneo en una molécula, puede inducir un momento dipolo en una molécula vecina, y el efecto puede propagarse a todo el material. + + + I + - I - - + + + I + - I - - + + + I + - I - - Figura 3.3 interacción entre moléculas de yodo polarizadas. A este tipo de interacciones entre moléculas se le llama dipolo instantáneo - dipolo inducido.1 Aunque es una interacción débil, es la responsable de las variaciones en las temperaturas de ebullición de los halógenos y es más importante a medida que aumenta el tamaño de la molécula. Este efecto también explica el aumento en las temperaturas de ebullición (y aun de fusión) de algunos hidrocarburos, como se ve en tabla 3.b. Idea clave: Las interacciones dipolo instantáneo-dipolo inducido son mayores entre mayor sea la polarizabilidad de la molécula. La polarizabilidad de una molécula aumenta entre mayor volumen y mayor número de electrones en ella. Los átomos menos electronegativos son más polarizables. 1 A este tipo de interacciones también se les conoce como Fuerzas de London, o Fuerzas de dispersión. Tabla 3.b Hidrocarburos lineales, sus masas molares y temperaturas de ebullición y fusión. Hidrocarburo Masa molar (g/mol) Temperatura de ebullición (°C) Temperatura de fusión (°C) Metano 16 -164 -182.0 Etano 30 -88.6 -183.3 Propano 44 -42.1 -187.9 n-butano 58 -0.5 -138.4 n-pentano 72 36.1 -130.2 n-hexano 86 69 -95.0 n-heptano 100 98.4 -90.6 n-octano 114 125.7 -56.8 n-nonano 128 150.8 -51.1 n-decano 142 174.1 -29.7 Dipolos permanentes No en todos los átomos la atracción de los electrones hacia el núcleo es igual. Esto es importante cuando se forma un enlace covalente entre dos átomos con distinta capacidad de atraer a los electrones, o electronegatividad. Un ejemplo es el HCl. Como el cloro atrae más a la nube electrónica que el hidrógeno, en esta molécula hay mayor densidad electrónica negativa cerca de él, mientras que cerca del hidrógeno, hay una deficiencia de carga negativa. En esta molécula la nube electrónica se encuentra polarizada; en el HCl hay un dipolo permanente.(Figura 3.4) Esto se representa mediante la letra griega seguida del signo correspondiente a la carga en exceso. - H - - -- - - Cl - - - - - - Figura 3.4 Nube electrónica polarizada de la molécula de HCl Cuando un enlace covalente presenta un dipolo se dice que se forma un enlace covalente polar. Las moléculas que están formadas por átomos diferentes, generalmente forman enlaces covalentes polares. En general, los electrones que participan en un enlace covalente están más cercanos del átomo con mayor electronegatividad, y la carga parcial negativa (-) se sitúa sobre ese átomo. De manera correspondiente, la carga parcial positiva (+) queda en el átomo menor electronegatividad. Las moléculas que poseen dipolos permanentes, se atraen unas a otras con mucha más fuerza que moléculas de estructura similar y tamaño semejante, sin dipolos permanentes; se dice que entre ellas hay una interacción dipolo-dipolo. Esto se refleja en mayores temperaturas de ebullición para las sustancias polares, pues es necesario aplicar una mayor cantidad de energía para romper las atracciones entre las moléculas. En la Figura 3.5 se muestran algunas parejas de sustancias no polares y polares de masa molar muy parecida, con sus temperaturas de ebullición. En cada caso, la flecha indica la posición del vector momento dipolo para la molécula. Sustancias no polares Sustancias polares Figura 3.5 Temperaturas de ebullición de algunas sustancias polares y no polares. Cuidado: Una molécula puede ser no polar aunque tenga enlaces polares. Dado que el momento dipolo es un vector definido entre dos átomos unidos por un enlace, en las moléculas poliatómicas con varios enlaces polares, los vectores momento dipolar pueden cancelarse unos con otros debido a su arreglo geométrico. Este es el caso de las siguientes moléculas, (Figura 3.6) que a pesar de tener enlaces polares, su momento dipolar global es igual a cero. Figura 3.6 moléculas no polares con enlaces polares. Una molécula polar colocada junto a una molécula no polar, induce un dipolo en esta última, estableciéndose en ellas lo que se conoce como una interacción dipolo-dipolo inducido. Este tipo de interacción es la responsable de que haya sustancias polares miscibles con sustancias no polares, como el caso de los hidrocarburos y los alcoholes, como en el caso de algunas gasolinas. Puentes de hidrógeno Entre los enlaces polares, un caso particularmente importante es aquél formado por un átomo de hidrógeno y un átomo que tenga un alto valor de electronegatividad, como el F, el O ó el N. Este tipo de átomos, siempre tiene pares de electrones no compartidos al formar moléculas. Un ejemplo de moléculas en las que tenemos este tipo de enlaces serían los alcoholes, que tienen fórmula general R-O(-)-H(+), donde los símbolos - y +, se refieren a que sobre el átomo junto al cual se escribieron, hay una carga negativa o positiva parcial, lo que justamente genera el momento dipolar. Como se puede ver en la Figura 3.7, un átomo de hidrógeno enlazado a una molécula de metanol, puede interactuar fuertemente con uno de los pares de electrones no compartidos en el átomo de oxígeno de una molécula vecina, formando un "puente" entre dos moléculas de metanol. Esta interacción es mucho más fuerte que una interacción dipolo-dipolo en la que no exista puente de hidrógeno. Esto se manifiesta en las elevadas temperaturas de ebullición de los líquidos cuyas moléculas forman puentes de hidrógeno entre sí. Resulta muy ilustrativo comparar el éter metílico CH3-O-CH3, con el etanol CH3-CH2-OH. Estas dos sustancias son isómeros, es decir tienen la misma fórmula condensada, pero el acomodo de sus átomos es distinto. Ambas tienen un momento dipolar diferente de cero (1.3D para el éter y 1.69D para el etanol). Sin embargo, entre moléculas de éter metílico, CH3-O-CH3, no pueden formarse puentes de hidrógeno, pues en ellas los átomos de hidrógeno solamente se encuentran formando enlaces muy poco polares con los átomos de carbono. En el etanol, CH3-CH2-OH, existe un enlace O-H que es muy polar, de manera que ese átomo de hidrógeno puede formar puentes con otros átomos de oxígeno en moléculas vecinas. Las diferencias físicas son muy notables: el etanol es un líquido a temperatura ambiente, y su punto de ebullición es de 78°C, mientras que el éter metílico es un gas con punto de ebullición de -25°C. Otros ejemplos pueden verse en la Figura 3.8. Idea clave: Existen puentes de hidrógeno entre moléculas que poseen enlaces entre átomos de hidrógeno y átomos muy electronegativos como nitrógeno, oxígeno o flúor. H H H C H O H O C H H H H H H C O O H H C H H H Figura 3.7 Puentes de hidrógeno en el metanol. Las flechas indican los vectores momento dipolo de los enlaces polares. Figura 3.8 Comparación en las temperaturas de ebullición de sustancias polares de masa molar semejante sin puente de hidrógeno y con él. El agua, la sustancia más importante en nuestro planeta, está compuesta por moléculas polares capaces de formar puentes de hidrógeno de una manera única. Comparemos a la molécula de agua, H2O, con algunas que podríamos considerar parecidas, compuestas sólo por átomos de hidrógeno y algún átomo muy electronegativo: el NH3, el HF, el H2S, el HCl. Todas estas moléculas pueden formar enlaces tipo puente de hidrógeno, y de hecho los forman, pero los puntos de ebullición (Tabla 3.c estas sustancias nos dicen que las atracciones entre sus moléculas son mucho menores que las que se dan entre las moléculas de agua. ¿Qué característica estructural es la que hace al agua tan diferente? Tabla 3.c Temperaturas de ebullición de algunas sustancias con puentes de hidrógeno Sustancia H 2O NH3 HF HCl H2S Temperatura ebullición (°C) 100.0 -33.0 19.9 -85.0 -60.0 Momento dipolar (D) 1.87 1.46 1.92 1.08 1.10 En la Figura 3.9 se muestran los puentes de hidrógeno posibles entre las moléculas de las diferentes sustancias analizadas. Podemos ver que, mientras el HF tiene sólo un átomo de hidrógeno para establecer puentes, el amoniaco, aunque tiene tres, sólo tiene un par de electrones no compartidos sobre el nitrógeno. El agua, en cambio, tiene dos átomos de hidrógeno unidos al átomo de oxígeno, que a su vez tiene dos pares de electrones no compartidos. Esto permite que cada molécula de agua pueda participar simultáneamente en cuatro enlaces de puente de hidrógeno. En el H2S, el número de átomos de hidrógeno y el número de electrones no compartidos en el átomo electronegativo, es el mismo que en el agua, sin embargo, su comportamiento es muy distinto al del agua, pues es un gas a temperatura ambiente. Esto puede explicarse mediante la diferencia en los valores de electronegatividad entre el O(3.5) y el S(2.5). El carácter polar del enlace O-H es mucho más marcado que el del enlace S-H, ya es mayor la diferencia de electronegatividades. H H F H F H F H F H F H F H F H F H H H H H N N H H H H H N H H H N H N H H N H H H H O H H H O O H H H O H H O H O H H O H Figura 3.9 Puentes de hidrógeno en HF, NH3 y H2O Interacciones ion-dipolo Los compuestos formados por iones, como el NaCl, forman sólidos cristalinos en los que las partículas que los constituyen se encuentran fuertemente atraídos por lo que se lama una interacción ion-ion. Esta interacción, sin embargo puede en muchos casos, ser vencida al poner a esa sustancia iónica en contacto con agua. Las moléculas de agua, con sus dipolos permanentes, pueden interactuar fuertemente con ambos tipos de iones, según se muestra en la Figura 3.10. Algunos disolventes polares, como los alcoholes, también pueden ser capaces, en algunos casos, de vencer las interacciones ion-ion, para disolver a un compuesto iónico mediante interacciones ion-dipolo. H O H H H H O O Na O + H O H H O H Cl H H H H O H Figura 3.10 Interacciones ion-dipolo. Una reflexión para cerrar el capítulo titulado “Interacciones débiles”: ¿Qué tan débiles son éstas? En el capítulo 2 se presentaron en las tablas 2.II y 2.III algunos ejemplos de energías de enlace para enlaces covalentes comunes. Los valores para estos ejemplos varían bastante, ya que van aproximadamente desde los 100 hasta los 1000 kJ/mol. Como puede verse en la tabla 3.IV, algunas de las interacciones “débiles” que hemos discutido en este capítulo tienen energías de asociación dentro del intervalo de los valores correspondientes para algunos enlaces covalentes. Un caso particularmente interesante es en de las interacciones ión-dipolo: el valor de la energía de asociación para K+ - H2O es de 52.5 kJ/mol, mientras que para el Ni2+ -H2O es 362.2 kJ/mol, casi siete veces mayor y del orden de un enlace covalente típico (ver tablas 3.d, 2.b y 2.c). Tabla 3.d Tipo de interacción Dipolo instantáneo- dipolo inducido Dipolo-dipolo inducido Dipolo-dipolo Puente de hidrógeno Ion-dipolo Ion-ion Enlace covalente sencillo Ejemplo Cl2, H2, CH4, CCl4 Energía de asociación 0.5 a 5 kJ/mol I2-acetona Acetona Alcoholes, agua Na(H2O)+, Cu(H2O)2+ KCl, MgO H2, F2 2 a 5 kJ/mol 5 a 20 kJ/mol 5 a 50 kJ/mol 60-350 kJ/(mol de pares ion-dipolo) 400-500 kJ/(mol de pares iónicos) 150-500 kJ/mol Efectivamente en una disolución acuosa de una sal de níquel (como por ejemplo el NiSO4) las moléculas de agua están tan fuertemente enlazadas con este catión, que al evaporar el agua, lo que se obtiene es cloruro de níquel hexahidratado, NiSO46H2O. Esta sustancia tiene propiedades fisicoquímicas distintas a las del NiSO4 anhidro, debido a que realmente está constituida por cationes complejos de Ni(H2O)62+ (hexaacuo níquel II) en los que las moléculas de agua y el ion Ni2+ están unidos mediante enlaces covalentes. Figura 3.11 Estructura del sulfato de níquel hexahidratado Entonces, tratándose de energías de asociación, ¿hasta dónde puede considerarse que se trata de una interacción ión- dipolo y a partir de dónde que se trata de un enlace covalente? El célebre Linus Pauling aseveraba que “Diremos que existe un enlace químico entre dos átomos o grupos de átomos en el caso en el que las fuerzas que actúan entre ellos son tales que llevan a la formación de un agregado con suficiente estabilidad como para hacerle conveniente a un químico considerarlo como una especie molecular independiente”. Es importante hacer énfasis en la palabra “conveniente” y en la palabra “considerarlo”. Como ya se comentó ampliamente en el capítulo anterior, los químicos estamos continuamente intentando clasificar tanto a las sustancias como a las interacciones. Sin embargo las propiedades de éstas varían de manera continua, por lo que muy a menudo la clasificación fracasa o se termina por crear una nueva categoría para las sustancias o las interacciones que se resisten a caer en alguna de las existentes. En otros casos, como éste, en que la división entre las categorías puede darse basándonos en alguna cantidad medible, suele ser arbitrario el valor de los límites que se le pone a esta cantidad para separar las categorías. Este es el caso ahora, ya que todas las interacciones que hemos descrito, tienen asociada una entalpía y recordemos que, como se discutió en el capítulo 2, la formación de cualquier enlace es un proceso exotérmico. A+B A-B H < 0 La entalpía de hidratación se ha determinado experimentalmente para una gran cantidad de iones. La mayoría de los iones metálicos de los bloques s, p y d se enlazan con seis moléculas de agua cuando se encuentran en disolución. Por esto es que la entalpía de hidratación corresponde el cambio de energía para el siguiente proceso: En la tabla 3.e se presentan los valores de entalpía de hidratación para un conjunto de cationes metálicos, agrupados según su carga eléctrica y en orden creciente de tamaño. Puede verse claramente que el proceso de hidratación es más exotérmico entre más grande sea la carga de un ion y más pequeño sea su tamaño. Tabla 3.e M+ + Na K+ Rb+ Cs+ Valores de entalpía de hidratación para diversos cationes. Hhidr (kJ/mol) -405 -321 -296 -263 M+2 2+ Mg Ca2+ Sr2+ Ba2+ Hhidr (kJ/mol) -1922 -1592 -1445 -1304 M+3 3+ Al Cr3+ Fe3+ In3+ Hhidr (kJ/mol) -4660 -4402 -4376 -4109 Una aplicación: La expulsión salina Muchas sustancias polares son solubles en agua gracias a las interacciones dipolo-dipolo que sus moléculas establecen con ella. Un ejemplo muy conocido es el del alcohol etílico (o etanol), que forma parte de muchas bebidas alcohólicas en combinación con el agua. Si a una mezcla de agua con etanol se le añade una cantidad suficiente de sal común (cloruro de sodio), el alcohol y el agua se pueden separar formando dos fases. Se sabe que los alquimistas descubrieron esto, ya que existen textos del siglo XII donde describen como añadiéndole sal al vino, podían obtener “un agua inflamable”. En la actualidad a este procedimiento de le conoce como “expulsión salina” (salting out) y se utiliza con frecuencia como método de separación. Preguntas y Ejercicios 1. En cada una de los incisos siguientes se presenta una pareja de sustancias, de las cuales una es gaseosa a temperatura ambiente, y la otra no. En cada pareja, señala cuál es la sustancia gaseosa y explica a qué se debe la diferencia a. CO2 COCl2 b. CCl4 CF4 c. Cl2 Br2 d. CH3- O -CH3 CH3-CH2-OH e. CH2Cl2 CH4 f. ClF NaF g. CS2 CO2 h. N2O3 As2O3 2.- Relacionar las siguientes columnas, asociando los hechos de la izquierda con el tipo de interacción que los gobierna La sal se disuelve en agua El etanol y el agua son miscibles Interacción dipolo instantáneo - dipolo inducido Interacción ión-ión El Br2 es un líquido Enlace covalente El Br2 es una molécula diatómica Interacción ión- dipolo inducido El NaCl tiene una alta temperatura de fusión Puente de hidrógeno La acetona y el éter son miscibles Interacción dipolo-dipolo inducido Al mezclar I2 con I- se forma I3- Interacción dipolo-dipolo El I2 se disuelve un poco en agua Interacción ión-dipolo 3. El octano, que es un hidrocarburo contenido en las gasolinas, flota sobre el agua porque es menos denso que ésta. Explica, mediante fuerzas intermoleculares, esta diferencia en la densidad de estas dos sustancias. 4. Al agregar sal a un refresco con gas, éste se sale. ¿Por qué?¿Qué tipo de interacción existe entre el gas (CO2) y el agua del refresco, y cuál es la que existe entre la sal (NaCl) y el agua? 5. Antiguamente los tanques oxígeno para buceo se diluían con nitrógeno (N2), pero hace tiempo que se utiliza helio para este fin ya que el nitrógeno se disuelve considerablemente en la sangre a presiones elevadas, y al salir a la superficie, forma burbujas que pueden causar hasta la muerte del buceador. Con base en las interacciones químicas débiles, explica por qué el helio se disuelve menos en la sangre que el nitrógeno.






