propiedades periódicas - primero de bachillerato internacional
Anuncio
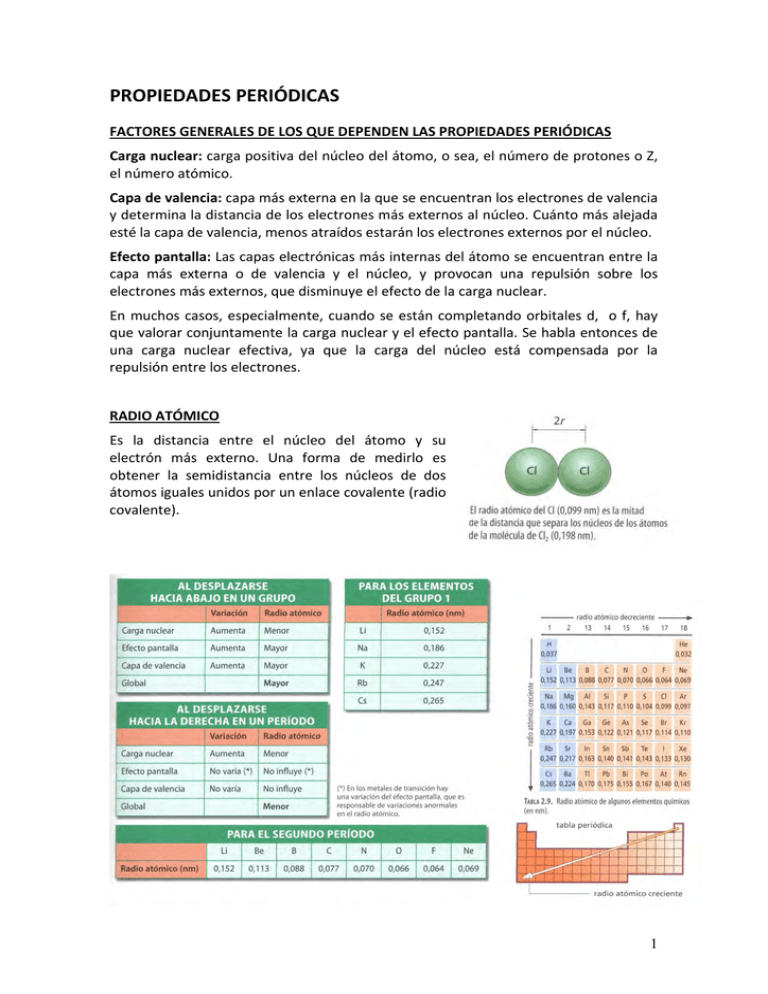
PROPIEDADES PERIÓDICAS FACTORES GENERALES DE LOS QUE DEPENDEN LAS PROPIEDADES PERIÓDICAS Carga nuclear: carga positiva del núcleo del átomo, o sea, el número de protones o Z, el número atómico. Capa de valencia: capa más externa en la que se encuentran los electrones de valencia y determina la distancia de los electrones más externos al núcleo. Cuánto más alejada esté la capa de valencia, menos atraídos estarán los electrones externos por el núcleo. Efecto pantalla: Las capas electrónicas más internas del átomo se encuentran entre la capa más externa o de valencia y el núcleo, y provocan una repulsión sobre los electrones más externos, que disminuye el efecto de la carga nuclear. En muchos casos, especialmente, cuando se están completando orbitales d, o f, hay que valorar conjuntamente la carga nuclear y el efecto pantalla. Se habla entonces de una carga nuclear efectiva, ya que la carga del núcleo está compensada por la repulsión entre los electrones. RADIO ATÓMICO Es la distancia entre el núcleo del átomo y su electrón más externo. Una forma de medirlo es obtener la semidistancia entre los núcleos de dos átomos iguales unidos por un enlace covalente (radio covalente). 1 Al aumentar la carga nuclear, el radio atómico tiende a ser menor, ya que aumenta la atracción electrostática del núcleo sobre los electrones. Al descender en un grupo, aumenta el efecto pantalla y el número de capas (aumenta n) por lo que el radio atómico aumenta. Las repulsiones entre electrones son mayores y disminuye la capa nuclear efectiva. Los electrones estarán menos atraídos por el núcleo. Al avanzar en un periodo, la capa de valencia es la misma, pero aumenta el número de protones, la carga nuclear es mayor, por lo que aumenta la atracción sobre los electrones y el radio disminuye, a excepción de los gases nobles. RADIO IÓNICO El radio iónico es el tamaño del anión o catión de un elemento químico. En los cationes, disminuye el tamaño porque los electrones más externos pasan a ser de la capa anterior, mientras que en los aniones, la carga del núcleo es la misma, hay más electrones por lo que la repulsión es mayor, y en consecuencia, aumenta el tamaño, respecto al átomo del que proceden. 2 ENERGÍA O POTENCIAL DE IONIZACIÓN (EI) Se define como la energía necesaria que hay que proporcionar a un átomo para arrancar un electrón de su capa de valencia. X + EI X+ + e‐ Se mide en KJ/mol ó eV/átomo. Es un proceso endotérmico. En los grupos y en los periodos, al aumentar la carga nuclear, aumenta la atracción del núcleo sobre los electrones y se necesita más EI para arrancar electrones (mayor EI). Al descender en un grupo, se intensifica el efecto pantalla, pues aumenta el número de capas de electrones entre el núcleo y la capa más externa. Disminuye la carga nuclear efectiva y se necesita menos energía para arrancar el electrón de valencia (menor EI). Este efecto compensa la acción de la carga nuclear. Al avanzar en un periodo aumenta la carga nuclear y aumenta la EI aunque puede haber discontinuidades si al perder un electrón se pierde una estructura de capa cerrada o de semicapa cerrada (orbitales semi llenos). Al aumentar la capa de valencia, los electrones que la ocupan están más alejados del núcleo, lo que hace que este ejerza menor fuerza electrostática sobre ellos, están menos atraídos y se necesita menos EI para arrancarlos (menor EI). 3 Podemos arrancar más electrones en cada átomo. En general, la primera EI es menor que la segunda, esta, menor que la tercera y así sucesivamente, ya que se están arrancando electrones a un ión, no a un átomo neutro o a un catión con mayor carga negativa. Ahora bien, si al arrancar electrones, el ión llega a alcanzar estructura de gas noble, cuando se procede a arrancar otro electrón la EI es mayor pues perdería estabilidad. AFINIDAD ELECTRÓNICA (AE) Es la energía que libera un átomo que se encuentra en estado gaseoso cuando gana 1 electrón. X + e‐ X‐ + AE Se mide en KJ/mol ó eV/átomo. Es un proceso exotérmico. En los grupos y en los periodos, al aumentar la carga nuclear, aumenta la atracción del núcleo sobre los electrones y se libera más energía (mayor AE). Al descender en un grupo, se intensifica el efecto pantalla, pues aumenta el número de capas de electrones entre el núcleo y la capa más externa. Disminuye la carga nuclear efectiva y se libera menos energía al captar un electrón (menor AE). Al aumentar la capa de valencia, elelectrón que gane el átomo estará más alejado del núcleo y experimenta menos atracción, por lo que se liberará menos energía (menor AE). 4 ELECTRONEGATIVIDAD Es la tendencia que presenta un átomo a ganar el par de electrones de un enlace químico. Se mide en KJ/mol o en unidades arbitrarias. La electronegatividad depende de la energía de ionización y de la afinidad electrónica, y como ambas medidas son mayores según nos desplazamos al subir en un grupo y desplazarnos hacia la derecha en un periodo, la electronegatividad aumenta en la misma forma. Son una excepción de los gases nobles, que no tienen electronegatividad por no presentar tendencia a enlazarse con otros átomos. OTRAS PROPIEDADES Carácter metálico: los metales tienden a perder electrones con facilidad (baja EI) y presentan poca tendencia a ganarlos (baja AE). Los metales más reactivos se encuentran en la parte inferior e izquierda de la tabla periódica. Los no metales más activos o reactivos se encuentran en la parte superior y derecha de la tabla. Carácter oxidante: Un elemento es oxidante si al reaccionar con otro, gana electrones y es reductor si los pierde. Dados dos elementos químicos, en general, será más oxidante el más electronegativo y más reductor el menos electronegativo. 5 ENLACE QUÍMICO La mayor parte de las sustancias que existen en la naturaleza están formadas por uno o más tipos de átomos enlazados, formando moléculas, redes cristalinas, etc, que les confiere una mayor estabilidad. El enlace químico es el conjunto de fuerzas que mantienen unidos los átomos cuando forman moléculas o cristales, así como las fuerzas que mantienen unidas las moléculas cuando se presentan en estado sólido o líquido. ELECTRONEGATIVIDAD Y TIPO DE ENLACE El valor relativo de la electronegatividad de los átomos que se enlazan determina su comportamiento, y en general, su tipo de enlace. Si ambos átomos tienen electronegatividades muy diferentes, uno de ello perderá el electrón o electrones del enlace y formará un ión positivo o catión, y el otro los ganará formándose un enlace iónico. Si los dos átomos presentan gran tendencia a ganar electrones, o sus electronegatividades son altas y parecidas, se enlazarán compartiendo los electrones de la capa de valencia y formando un enlace covalente. Cuando los átomos que se combinan tienen la misma electronegatividad, los electrones compartidos son atraídos por igual por los dos átomos y forman un enlace covalente apolar. Cuando los átomos que se combinan tienen distinta electronegatividad, los electrones compartidos se distribuyen de forma asimétrica y están más próximos al átomo más electronegativo, formando un enlace covalente polar. Si los dos átomos tienen muy poca tendencia a ganar electrones, o sus electronegatividades son bajas y parecidas, los electrones de valencia formarán una nube o mar de electrones que se mueven por toda la red de cationes pero sin capacidad de salir de ella debido a las atracciones electrostáticas. Este enlace se llama metálico. TEORÍA DE LEWIS Lewis ideó una representación bidimensional de las fórmulas para saber que átomos estaban enlazados y como era el enlace entre ellos. La representación de Lewis parte del símbolo del elemento químico y distribuye a u alrededor los electrones de la capa de valencia. Hasta los cuatro primeros electrones, se colocan uno a cada lado del símbolo, y si el elemento tiene más electrones se reparten formando parejas. 6 Regla del octeto: Lewis establece que los átomos ganan, pierden o comparten electrones para lograr la configuración del gas noble más próximo (ns2np6), con 8 electrones en sus capas de valencia, a excepción de los elementos con número atómico muy bajo que tenderán a formar la configuración del He (1s2). Los átomos que alcancen la configuración de gas noble ganando o perdiendo electrones, formarán iones y se unirán entre sí formando un enlace iónico, mientras que los que los compartan formarán un enlace covalente. ENLACE IÓNICO El enlace iónico se establece cuando se combinan elementos con electronegatividades muy diferentes. El más electronegativo formará iones negativos y el menos electronegativo, iones positivos. El enlace se produce por la atracción electrostática entre los iones de distinto signo. Proceso: I. Formación de iones Na (g) + EINa Na+ (g) + 1 e‐ Na (g) + 495,8 kJ/mol Na+ (g) + 1 e‐ Cl (g) + 1 e‐ Cl‐ (g) + AECl Cl (g) + 1 e‐ Cl‐ (g) + 348,6 kJ/mol El balance energético es E = 495,8 – 348,6 = 147,2 kJ/mol El valor positivo nos indica que la formación del NaCl es desfavorable en términos energéticos. Esto contradice la realidad, ya que el NaCl es más abundante que el Na y el Cl2. Y además el Na está en estado sólido y hay que comunicarle energía para pasarlo a estado gaseoso y al Cl2 hay que comunicarle energía para romper su enlace. Lo que ocurre es que los iones se ordenan en una red cristalina sólida, proceso en el que liberan gran cantidad de energía, que se llama energía de red (U). La energía de red es la energía que se libera cuando se forma un mol de un compuesto iónico a partir de sus iones constituyentes en estado gaseoso. Se mide en kJ/mol. II. Formación del enlace Na+ (g) + Cl‐ (g) NaCl (s) + U Na+ (g) + Cl‐ (g) NaCl (s) + 787 kJ/mol A través del ciclo de Born‐Haber podemos realizar un estudio termodinámico desde el punto de vista energético de todos los procesos que intervienen en la formación de 1 mol de un compuesto iónico a partir de sus constituyentes. Vamos a comprobar que la formación NaCl(s) a partir de sus constituyentes es un proceso exotérmico. 7 CICLOS DE BORN‐HABER PROPIEDADES DE LOS COMPUESTOS IÓNICOS Forman grandes redes cristalinas, lo que determina sus propiedades características. Son sólidos a temperatura ambiente, con elevados puntos de fusión, Para fundir un compuesto iónico hay que romper la red cristalina. Cuanto mayor sea su energía de red, el punto de fusión será más alto. Son solubles en disolventes polares. La disolución de un compuesto iónico supone la ruptura de la red cristalina. Entre las moléculas del disolvente y los iones debe haber unas fuerzas de interacción mayores que las que les mantienen unidos en la red cristalina. Esto se consigue cuando el disolvente es muy polar, como es el caso del agua, donde varias moléculas del disolvente rodean a un ión (solvatación) No conducen la corriente eléctrica en estado sólido, pero si lo hacen en estado fundido o en disolución, ya que los iones quedan libres. Son duros y grágiles. La dureza mide la resistencia al rayado. Para rayar un cristal iónico, hay que romper la red cristalina, lo que supone un aporte de energía capaz de superar la atracción electrostática entre los iones. La fragilidad mide la resistencia a los golpes. Al golpear un plano de la red cristalina, los iones se desplazan por lo que aparecen repulsiones electrostáticas y el cristal se quiebra. 8 ESTRUCTURA DE LOS CRISTALES IÓNICOS Los iones que forman un compuesto iónico se ordenan formando una red cristalina que depende fundamentalmente de la proporción de aniones y cationes y de sus respectivos tamaños. Como los iones son partículas cargadas, la energía electrostática es EK Q anión Q catión U E d enlace K = constante de Coulomb de = distancia entre los iones = ranión + rcatión La energía de red es proporcional a la energía electrostática, es decir aumenta con la carga de los iones y disminuye con el tamaño de los mismos. U E Energía de red (U) Aumenta Z Aumenta Z Energía de red (U) kJ/mol F‐ Cl‐ Br‐ I‐ Li+ 1036 853 807 757 Na+ 923 787 747 704 K+ 821 715 682 649 Rb+ 785 689 660 630 ‐ Energías de red‐ La energía de red es una medida de la estabilidad del cristal iónico y cuánto mayor sea (en valor absoluto), más difícil es romper el cristal. - Para un mismo catión, la Energía de red disminuye cuando aumenta el anión. La carga es la misma, pero el radio del anión F‐ es más pequeño que el del I‐. - Para un mismo anión, la Energía de red disminuye cuando aumenta el catión. La carga es la misma, pero el radio del Li+ es más pequeño el del Rb+. 9 Muchas propiedades dependen de la energía de red en los compuestos iónicos: - Punto de fusión: Para fundir un compuesto hay que romper la red cristalina. Cuánto mayor sea su energía de red, mayor punto de fusión tiene. Ej: Energia de red (U): LiF > LiCl > LiBr > LiI T fusión: LiF > LiCl > LiBr > LiI - Solubilidad: Para disolver un compuesto también hay que romper la red. Cuánto mayor sea su energía de red, menor será su solubilidad Ej: Solubilidad: LiF < LiCl < LiBr < LiI Ejercicio A partir de KBr, RbI y NaF, asigna los puntos de fusión 642ºC, 734ºC y 996ºC y ordénalos según su solubilidad kJ/mol F‐ Cl‐ Br‐ I‐ Li+ Na+ 1 K+ 2 Rb+ 3 Energía de red (U) : NaF > KBr > RbI Todos tienen la misma carga, pero la distancia entre iones (ranión + rcatión) es más pequeña en el NaF y mayor en RbI. radiocatión : Na+ < K+ < Rb+ (recordar que estos cationes han perdido la capa externa adquiriendo configuración de gas noble y su tamaño disminuye en relación al átomo neutro del que proceden, y como el Na+ es el que menos capas presenta, es el más pequeño) radioanión : F‐ < Br‐ < I‐ (recordar que estos aniones han completado la capa para adquirir configuración de gas noble y su tamaño aumenta en relación al átomo neutro del que proceden, y como el F‐ es el que menos capas presenta, es el más pequeño) denlace: NaF < KBr < RbI Energía de red (U) : NaF > KBr > RbI T fusión: NaF (996ºC) > KBr (734ºC) > RbI (642ºC) El que más energía de red tenga, más punto de fusión tiene, es decir, mas energía hay que comunicarle para romper su red. Solubilidad: NaF < KBr < RbI El que más energía de red tenga, menos soluble es ya que los iones están más atraídos. 10 ENLACE COVALENTE En el enlace covalente se comparten uno omás pares de electrones entre átomos con electronegatividades altas y similares. Diferencia de electronegatividades > 1,7 0,4‐1,7 < 0,4 0 Principalmente iónico Covalente polar Principalmente covalente Covalente apolar Un enlace covalente polar tiene cierto carácter iónico cuya proporción depende de la diferencia de electronegatividades entre los átomos que se enlazan. Cuando los electrones compartidos proceden de átomos con distintas electronegatividades, los electrones se distribuyen de forma asimétrica y el átomo más electronegativo presenta una densidad de carga ‐ y el más electropositivo presenta una densidad de carga +. Si las electronegatividades son similares, se trata de un compuesto apolar y su comportamiento químico es diferente. TEORÍA DE LEWIS APLICADA A LOS ENLACES IÓNICO Y COVALENTE Ejemplos de enlace iónico Los átomos ganan y pierden electrones cumpliendo la regla del octeto y forman un compuesto iónico. Ej.: NaCl EN: Na 0.9 Cl 3.0 electrones de valencia: Na 1e‐ Cl 7e‐ Diferencia EN = 3.0 ‐ 0.9 = 2.1 Compuesto iónico .. .. +: Cl : ‐ . Na. + : Cl Na .. .. Ej.: Na2O EN: Na 0.9 O 3.5 electrones de valencia: Na 1e‐ O 6e‐ Diferencia EN = 3.5 ‐ 0.9 = 2.6 Compuesto iónico .. . + : O : 2‐ . 2 Na. + : O 2 Na .. .. Ej.: Al2O3 EN: Al 1.5 O 3.5 electrones de valencia: Al 3e‐ O 6e‐ Diferencia EN = 3.5 ‐ 1.5 = 2.0 Compuesto iónico . . . 2 Al . + 3 : O .. . .. 2 Al 3+ 3 : O : 2‐ .. 11 Enlace covalente Los átomos comparten electrones cumpliendo la regla del octeto y forman una molécula covalente. Ej.: HCl EN: H 2.1 Cl 3.0 electrones de valencia: H 1e‐ Cl 7e‐ Diferencia EN = 3.5‐2.1 = 1.4 Molécula covalente polar .. .. .. _ Cl : . : H . + : Cl : H Cl H .. .. .. Ej.: CH4 EN: H 2.1 C 2.5 electrones de valencia: H 1e‐ C 4e‐ Diferencia EN = 2.5‐2.1 = 0.4 Molécula covalente (Es apolar, pues por simetría su momento dipolar es 0) . . C . + 4 H. . H .. H : C : H .. H H H C H H En general, para construir una estructura de Lewis: - Los átomos de H son siempre terminales ya que sólo pueden acomodar 2 electrones en su capa de valencia. - Los átomos centrales suelen ser los de menor electronegatividad - Los átomos de C son casi siempre átomos centrales - A excepción de un gran número de moléculas orgánicas en forma de cadena, las moléculas tienen estructuras simétricas. - Se alternan átomos más electronegativos con átomos más electropositivos. - Se empiezan completando los octetos de los átomos terminales y finalmente el del átomo central. Ej.: H3PO4 EN: P 2.1 O 3.5 electrones de valencia: P 5e‐ O 6e‐ Diferencia EN = 3.5‐2.1 = 1.4 Molécula covalente polar . .. . P . + 4 .O. + 3 H. .. .. .. : O .. H .. . . . .. . .. H H .. O .. . P.. . O .. : O: .. O H H O P O H O 12 + Ej.: NH4 H .. H .. N .. H .. H + + H H N H H + Ej.: NO2 + + : O : .. N .. : O : .. .. :O .. N O .. : Se llaman pares solitarios a los pares de electrones no compartidos Se llaman pares enlazantes a los pares de electrones compartidos ENLACE COVALENTE COORDINADO DATIVO Dos electrones compartidos proceden del mismo átomo: especie dadora y el que los recibe es la especie receptora. .. : O .. .. S .. .. :O .. : :O .. .. S S O :O .. : O ESTRUCTURAS RESONANTES, ENLACE DESLOCALIZADO Estas estructuras se representan mediante enlaces deslocalizados, es decir, los electrones del enlace no están asignados a ningún par de átomos en concreto, sino que son compartidos por toda la molécula, lo que se representa con una línea discontinua. O O O O O O O O O 13 TEORÍA DE REPULSIÓN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA (TRPECV) Muchas propiedades de las sustancias no son fáciles de justificar, pero su geometría puede explicar muchas de sus propiedades. Por ej., BCl3 y NCl3 por Lewis, tienen una estructura similar, salvo el par de electrones no compartido (par no enlazante) en el N. Su distinto punto de ebullición 12°C y 71°C es debido a que estas moléculas tienen una geometría diferente. La TRPECV explica la geometría de las sustancias covalentes y afirma que todos los pares de electrones de la capa de valencia de los átomos que forman los enlaces covalentes se sitúan lo más alejado posible unos de los otros, para que las repulsiones sean mínimas. Llamamos a cada par de electrones, par enlazante o de enlace si están compartidos por dos átomos y par no enlazante, o solitario si el par de electrones es no compartido. Repulsión entre par no enlazante y par no enlazante > repulsión entre par no enlazante y par enlazante > repulsión entre par enlazante y par enlazante. Para determinar la geometría de una molécula, hay que tener en cuenta los pares enlazantes y los no enlazantes que rodean al átomo central. LA FORMA DE LAS MOLÉCULAS Para describir la forma de una molécula se necesita conocer las longitudes de enlace, distancia entre los átomos enlazados y los ángulos de enlace. Todas las moléculas biatómicas son lineales, tienen solamente un enlace y no hay ángulo de enlace. Una molécula triatómica tiene dos enlaces y un ángulo de enlace. Si el ángulo de enlace es 180°, los tres átomos se disponen en línea recta y la molécula es lineal. Para cualquier otro valor del ángulo de enlace, la molécula triatómica es angular. A excepción de algunas moléculas poliatómicas lineales o con forma plana, la mayoría de las moléculas poliatómicas presentan una figura tridimensional. Disposición de los pares de electrones para conseguir que las repulsiones entre ellos sean las mínimas 14 Ej.: CH4 Si consideramos la estructura de Lewis H .. H : C : H .. H Hay 4 pares enlazantes que forman ángulos de 90°. En cambio, si su disposición es tetraédrica, los ángulos son de 109,5° entre los pares enlazantes y la repulsión será menor. Ej.: NH3 y H2O En la molécula de NH3 hay 3 pares enlazantes entre el átomo central y los H, y un par no enlazante, que forman ángulos de 90° según Lewis. Si la disposición es tetraédrica, los ángulos son mayores y la repulsión entre pares de electrones será menor. Ahora bien, como hay un par no enlazante, ejercerá repulsión sobre los enlace vecinos y los ángulos entre ellos serán menores de lo previsto. En la molécula de H2O, es similar, sólo que los dos pares de electrones no enlazantes ejercen mayor repulsión sobre los dos enlaces O‐H y el ángulo decrece más. 15 16 APLICACIÓN DE LA TEORÍA RPECV 1. Escribir una estructura de Lewis aceptable para la molécula o ión poliatómico 2. Determinar el nº de grupos de electrones que hay alrededor del átomo central y establecer si son pares enlazantes o pares solitarios 3. Establecer la geometría de grupos de electrones alrededor del átomo central: lineal, trigonal‐plana, tetraédrica, bipiramidal‐trigonal u octaédrica. 4. Determinar la geometría molecular de las posiciones alrededor del átomo central. 17 Ej.: Indica la geometría de las siguientes moléculas: BeCl2, BF3, CH4, PCl3, PCl5, IF5 Nº pares enlazantes Nº pares no Nº total enlazantes de enlaces Geometría del átomo central Notación geometria molecular BeCl2 2 0 2 Lineal AX2 BF3 3 0 3 Trigonal‐ plana AX3 CH4 4 0 4 Tetraédrica AX4 Geometría de la molécula PCl3 3 1 4 Tetraédrica AX3E PCl5 IF5 5 5 0 1 5 6 Bipiramidal‐ trigonal AX5 Octaédrica AX5E Observar que solo coinciden los nombres de la geometría del átomo central y de la molécula cuando no hay pares solitarios. Ejercicios resueltos 1. Representa las siguientes estructuras de Lewis: CO2, CaCl2, H2S, CH3Cl, CH3OH, CaO. 18 2. Representa las siguientes estructuras de Lewis: SCl6, IF7. 3. En el laboratorio es posible obtener compuestos de nitrógeno como NCl3, pero nunca NCl5; sin embargo, si es posible obtener compuestos como PCl5. ¿Por qué? La capa de valencia del N es 2, en la cuál sólo hay un orbital s y tres orbitales p (2s, 2p), que admitirán como máximo 8 electrones. Para formar NCl5, se necesitan 10 electrones. En cambio, la capa de valencia del N es 3, lo que implica un orbital s, tres orbitales p y cinco orbitales d (3s, 3p, 3d)., que pueden admitir hasta un máximo de 18 electrones. Por ello, el P puede tener cinco enlaces covalentes con 10 electrones. 4. Dadas las siguientes especies químicas: H3O+ (ión hidronio) y NH3 a) Representa su estructura de Lewis b) Predice su geometría molecular 19 POLARIDAD MOLECULAR Cuando se forma un enlace covalente entre átomos con diferente electronegatividad, el enlace resultante es polar. El átomo más electronegativo atrae con más intensidad a los electrones compartidos, y por tanto, no se reparten por igual entre los átomos apareciendo una carga parcial negativa ‐ sobre el átomo más electronegativo y una carga parcial positiva + sobre el otro átomo. Se forma un dipolo permanente. Cuánto mayor esla diferencia de electronegatividades de los átomos enlazados más polar es el enlace covalente. La polaridad se mide a través del momento dipolar, El momento dipolar es un vector orientado del polo positivo (átomo más electronegativo) al polo negativo. Qiónica r Q = carga neta separada de los átomos. r = distancia entre los núcleos. El momento dipolar se mide en C.m o en Debye (D) 1 Debye (D) = 3,338.10‐30 C.m molécula enlace La polaridad de la molécula viene dada por molécula que es la suma de los momentos dipolares de todos los enlaces. Cuando la molécula es simétrica, estos se compensan y el molécula 0 . Entonces la molécula es apolar. Para establecer si una molécula es polar o apolar es imprescindible conocer su geometría. Ejemplos: 1. Ordenar de mayor a menor polaridad los enlaces de las siguientes moléculas: a) HI, HF, HBr, HCl b) CH4, BH3, H2O, HF a) La polaridad de un enlace aumenta al aumentar la diferencia entre los valores de la electronegatividad de los átomos enlazados covalentemente EN : F > Cl > Br > I La electronegatividad disminuye en un grupo Polaridad: H – F > H – Cl > H – Br > H – I b) Los elementos enlazados pertenecen al mismo periodo EN : F > O > C > B La electronegatividad aumenta en un periodo Polaridad: H – F > H – O > H – C > H – F 20 2. Explica por qué las moléculas CCl4, BCl3 y BeF2 no se comportan como dipolos a pesar de tener enlaces muy polares. El momento dipolar resultante de los enlaces es nulo. CCl4 : Tiene geometría tetraédrica. Los enlaces son polares pero la suma vectorial de sus momentos dipolares es cero. BCl3: La molécula es trigonal plana, con los tres enlaces equivalentes, formando 120°, por lo que se anulan entre sí. BeF2: Es lineal, por lo que los momentos dipolares son iguales pero de sentido contrario, y el momento dipolar de la molécula es cero. 3. Justifica por qué la molécula de metano es apolar CH4, mientras que la de clorometano CH3Cl, con la misma geometría, es polar Las dos tienen estructura tetraédrica. Metano AX4. La suma total de los momentos dipolares de los enlaces es cero, al ser todos iguales. Clorometano AX4. El momento dipolar del enlace C‐Cl es mayor que los momentos dipolares de los enlaces C‐H, por lo que la suma de todos los momentos dará un momento dipolar de la molécula dirigido desde el centro del tetraedro (C) hacia el átomo de Cloro. 4. Deduce la polaridad de las moléculas de agua y de amoníaco H2O: es una molécula muy polar. Los momentos dipolares de los enlaces H – O se ven reforzados por los dos pares de electrones no compartidos del oxígeno NH3: También es una molécula muy polar. Los momentos dipolares se orientan hacia el átomo de nitrógeno y se ven reforzados por el par de electrones no compartidos del nitrógeno. 21 PROPIEDADES DE LAS SUSTANCIAS COVALENTES Se presentan como moléculas y como redes Sustancias moleculares: Son átomos asociados formando moléculas. A temperatura ambiente pueden ser gases (O2, H2, N2, CH4, NH3, HCl, SO2, NO2, etc), líquidos (H2O, Br2, CH3 ‐CH2OH, CH3 ‐COOH, etc) ó sólidos (I2, glucosa, naftaleno, etc). La explicación de que muchas se presenten en estado gaseoso o líquido se debe a que las fuerzas intermoleculares son débiles, lo que produce que sus puntos de fusión y ebullición sean bajos. La solubilidad de estos compuestos es elevada en disolventes apolares y su capacidad conductora es nula, si bien en el caso de moléculas polares, cuanto mayor sea su polaridad, mayores serán sus puntos de fusión y ebullición, así como su solubilidad en disolventes polares y la conductividad eléctrica. Redes covalentes: Son sustancias de tipo macromolecular, es decir, están formadas por un número muy elevado de átomos iguales o distintos, unidos entre sí, formando redes cristalinas. En general, están formadas por átomos de C o Si. El C se presenta en forma de diamante (átomos de C en las tres direcciones del espacio con geometría sp3) o grafito (átomos de C con geometría sp2 que forman hexágonos unidos en dos direcciones formando láminas). El Si se presenta como SiO2 (sílice) formando minerales como cuarzo o la arena de las playas. Su estructura es tetraédrica con el Si como átomo central. Los sólidos covalentes tienen altos puntos de fusión y ebullición, son duros, malos conductores y en general, insolubles. FUERZAS INTERMOLECULARES Son fuerzas que se producen entre las moléculas y existen, incluso, entre átomos individuales que no forman enlace, como es el caso de los gases nobles y que afectan a sus propiedades físico‐químicas. La energía de los enlaces intermoleculares es inferior a 40 kJ/mol, mientras que la de los intramoleculares es entre 42 y 800 kJ/mol. Por ejemplo, comparemos la energía de las fuerzas intramoleculares (dentro de la propia molécula, enlace covalente) e intermoleculares (entre distintas moléculas) del cloruro de hidrógeno, HCl, y del hidrógeno, H2. 22 Cuanto más intensa es la fuerza intermolecular que une las moléculas mayor será el punto de fusión y ebullición, porque son éstas las fuerzas que debemos vencer para separarlas. En efecto, como vemos en los dos casos anteriores, el HCl, que forma fuerzas intermoleculares mucho más intensas, tiene un punto de ebullición más elevado que el del hidrógeno. Así pues, las moléculas covalentes pueden unirse entre sí mediante fuerzas intermoleculares, pero estas últimas no siempre tienen la misma intensidad. ¿De qué depende la mayor o menor intensidad de las fuerzas intermoleculares? Esencialmente, de la polaridad de la molécula. Es en base a este criterio, el de la polaridad, que estableceremos una clasificación de las fuerzas intermoleculares. Así, tendremos: Fuerzas intermoleculares entre moléculas polares. En este caso tenemos dos tipos: o Fuerzas dipolo – dipolo o fuerzas de Van der Waals. Se trata de fuerzas entre dipolos permanentes (por diferencia de electronegatividad entre los átomos en moléculas cuyos dipolos no se anulan por geometría). o Enlaces de hidrógeno o por puente de hidrógeno. Se presenta cuando la molécula tiene enlaces formados por un átomo de hidrógeno y un átomo pequeño y muy electronegativo, como flúor, nitrógeno u oxígeno. Fuerzas intermoleculares entre moléculas apolares. Reciben el nombre de fuerzas dipolo instantáneo – dipolo inducido, o también fuerzas de dispersión o fuerzas de London. En este caso, la mayor intensidad de este tipo de fuerzas dependerá de la masa. A mayor masa molecular, mayores fuerzas de dispersión y, por tanto, mayores puntos de fusión y de ebullición. No obstante, en general son fuerzas de carácter muy débil, de hecho son las más débiles de todas las fuerzas intermoleculares. Fuerzas de Van der Waals o dipolo‐dipolo Son fuerzas de tipo electrostático que mantienen unidas a las moléculas polares. Su valor oscila entre 0,1 y 35 kJ/mol. Por ej., entre moléculas de HCl o HI. Los dipolos permanentes originan atracciones entre cargas de signo opuesto (mucho más débiles que entre Cl‐ y Na+. 23 Enlace o puente de Hidrógeno Estas fuerzas se producen entre moléculas formadas por H y un átomo muy electronegativo y pequeño (tipo F, O o N). El elemento unido al H atrae gran parte de la carga del enlace, dejando al H con una fuerte densidad de carga positiva y quedando él con una gran densidad de carga negativa, lo que hace que las moléculas se unan entre sí por atracción electrostática. Oscilan, generalmente, entre 8 y 40 kJ/mol. Los puntos de fusión y ebullición de las sustancias disminuyen al hacerlo la masa molecular, pues hay que comunicar una menor energía para que pasen a gas. Si comparamos: H2Te (Te = ‐1,8 °C) H2Se (Te = ‐42 °C) H2S (Te = ‐59,6 °C) H2O (Te = 100 °C) Tiene menor masa molecular y en cambio, su punto de ebullición es mayor, debido a la energía adicional que hay que comunicarle para romper sus enlaces por puente de H, para pasarla a estado gaseoso. Además, la formación de puentes de hidrógeno es también la causa de la estructura altamente ordenada del hielo. Las otras moléculas del grupo, como H2S y H2Se, son levemente polares (electronegatividad del S: 2,5; electronegatividad del Se: 2,4; electronegatividad del H: 2,1). Pero, dado que las diferencias de electronegatividad son pequeñas, la magnitud de los dipolos permanentes formados es muy inferior a la de las moléculas de agua y, por este motivo, también es menor la magnitud de las fuerzas intermoleculares formadas (en este caso serán Fuerzas de Van der Waals o dipolo‐dipolo, por no presentar enlaces por puente de hidrógeno). Costará menos separar las moléculas y sus puntos de ebullición son muy inferiores a los del agua, a pesar de tener mayor masa molecular. El NH3, HF, alcoholes, aminas, ácidos carboxílicos presentan también enlaces por puentes de H. 24 Fuerzas de London o de dispersión: dipolo instantáneo – dipolo inducido Las fuerzas dipolo instantáneo – dipolo inducido se dan entre moléculas covalentes apolares, e incluso entre átomos no enlazados, como es el caso de los gases nobles. Se deben a la formación de dipolos instantáneos que se originan porque la molécula presenta en un momento determinado una distribución de carga asimétrica e induce un dipolo en la molécula vecina. La presencia de estas fuerzas explica que el O2 o el N2 puedan pasar a estado líquido o sólido si se enfrían suficientemente. El proceso se explica así: en las moléculas covalentes apolares, puede suceder que la nube electrónica, que estará en movimiento constante en torno a los núcleos atómicos, se halle más desplazada hacia un lado de la molécula durante un brevísimo lapso de tiempo. Así, la molécula que es normalmente apolar, se puede volver fugazmente polar y formar un dipolo instantáneo. Además, por un proceso de inducción, este dipolo instantáneo puede provocar, a su vez, el desplazamiento de la nube electrónica de las nubes vecinas, formando lo que se conoce como un “dipolo inducido”. Estas fuerzas de London, aumentan con el tamaño de la molécula y, por tanto, con la masa molecular. Esto es debido a que cuanto más grande es la molécula, más electrones tendrá, más grande será la nube electrónica y más alejada se hallará ésta del núcleo. Esto hace que, en las moléculas grandes, sea más fácil la formación de dipolos instantáneos. Se dice que estas moléculas son polarizables. 25 Por ejemplo, las moléculas diatómicas de los halógenos Cl2, Br2 e I2, presentan las siguientes características en cuánto a sus puntos de fusión y ebullición y su estado de agregación a temperatura ambiente: De forma esquemática, podemos representar la nube electrónica de cada una de estas moléculas cada vez más grande y, por tanto, más polarizable, tal y como podemos ver en la siguiente figura: Las fuerzas de London o de dispersión son las más débiles de todas las fuerzas intermoleculares, por lo que, en general, las moléculas covalentes apolares presentarán bajos puntos de fusión y ebullición, aumentando en un mismo grupo con el tamaño atómico. Lo mismo ocurre con los gases nobles, que son átomos que no forman enlace, en los cuales el punto de ebullición superior corresponde, en efecto, al más grande de la serie, el radón, por ser el más grande. P. de ebullición de gases nobles Helio: ‐269 ºC Neón: ‐246 ºC Argón: ‐186 ºC Criptón: ‐152 ºC Xenón: ‐108 ºC Radón: ‐62 ºC 26 ENLACE METÁLICO El enlace metálico es muy distinto al enlace iónico y covalente. - En los compuestos metálicos los átomos están muy próximos los unos a los otros y forman estructuras compactas. Además, presentan unas características propias, entre las que destaca la elevada conductividad eléctrica. Esta propiedad, la de la conductividad, requiere para ser explicada que los electrones implicados en el enlace metálico tengan libertad y facilidad de movimiento. Es por este motivo que, para que los metales tengan electrones móviles, requieren 2 características a nivel atómico: la primera, una energía de ionización baja (recordemos que la energía de ionización es la energía necesaria para arrancar un electrón de la capa de valencia) y la segunda, que posean orbitales de valencia vacíos y accesibles que permitan a los electrones moverse con facilidad. Teoría del mar de electrones o gas electrónico En la teoría del gas electrónico (también llamada del mar de electrones o de la nube electrónica), los átomos metálicos pierden sus electrones de valencia y forman una red compacta de cationes. Por ejemplo, en el caso del sodio, cuya configuración electrónica es: Los cationes Na+, formados por los núcleos atómicos y los electrones de las capas internas, se empaquetan y los electrones de valencia se mueven con libertad. Estos electrones no pertenecen ya a los átomos individuales, sino que son comunes a todos los átomos que forman la red. Se dice que los electrones están deslocalizados. Dependiendo del número de electrones de valencia que tenga el metal, habrá tantos electrones deslocalizados como átomos o más. Por ejemplo, en el sodio, que pierde un electrón, habrá tantos electrones como átomos de sodio, pero en el magnesio, que tiene 2 electrones de valencia y los pierde ambos, habrá el doble de electrones que de núcleos de Mg2+. Así, los cationes se disponen formando un retículo cristalino compacto o empaquetamiento metálico y cada catión se rodea del número máximo de cationes vecinos. Los electrones de valencia se mueven libremente por los intersticios de la red, formando el gas electrónico y actuando, además, como un colchón que evita la repulsión entre los distintos cationes. 27 Dada la libertad de movimiento de los electrones de valencia, esta teoría para el enlace metálico explica muy bien muchas de las propiedades metálicas, tales como la elevada conductividad eléctrica y térmica. También explica la ductilidad y la maleabilidad o la resistencia a la deformación, porque las capas de cationes pueden deslizarse unas sobre las otras, manteniendo el tipo de estructura y la fortaleza del enlace. Enlace metálico: teoría de bandas En función de su conductividad eléctrica, los sólidos se pueden clasificar en tres grupos: aislantes, conductores y semiconductores. Esta última propiedad, la semiconductividad, no puede ser explicada a partir del modelo del mar de electrones visto hasta ahora para el enlace metálico. Se requiere una teoría más profunda que es la teoría de bandas la cual, además de explicar la semiconductividad, explica también por qué los metales son muy buenos conductores de la electricidad. Consideremos el metal litio, cuya configuración electrónica es: Vemos que un átomo de litio presenta un orbital 1s lleno (con 2 electrones) y un orbital 2s semilleno (con 1 electrón). También podemos considerar a efectos prácticos los orbitales 2p, que estarán en la capa de valencia del litio, aunque vacíos. Pues bien, la Teoría de bandas considera que los orbitales atómicos de valencia de los N átomos del litio que estarán formando enlace metálico, se combinan entre sí para dar unos orbitales moleculares, pertenecientes a todo el cristal y con energías muy semejantes entre sí. Tan cercanos se hallan energéticamente estos orbitales moleculares formados, que decimos que dan lugar a una banda. Se obtienen tantos orbitales moleculares como orbitales atómicos se combinen. 28 Así, si tenemos N átomos de litio, tendremos N orbitales atómicos 2s que darán lugar a N orbitales moleculares que podemos llamar también 2s por facilidad de comprensión. Estos orbitales estarán muy próximos en energía y darán una banda 2s. Lo mismo sucederá con los orbitales 3N 2p de los N átomos de litio (cada átomo de litio tendrá 3 orbitales 2p, px, py y pz), aunque estén vacíos, dando lugar también a una banda 2p. A la banda formada por los orbitales 2s semillenos se le llama banda de valencia. A la banda vacía formada por los orbitales 2p, se la llama banda de conducción. Por tanto, en los metales, hay bandas de valencia, que son bandas en las que se hallan los electrones de valencia y pueden estar llenas o semillenas, dependiendo de la configuración electrónica del metal, y bandas de conducción, que pueden hallarse vacías o parcialmente vacías y facilitan la conducción porque son energéticamente accesibles. De hecho, los metales son conductores porque las bandas de valencia y de conducción se superponen, y esto hace que los electrones se muevan con libertad de una a otra. En el caso de los semiconductores, las bandas de valencia y de conducción no se superponen, pero la diferencia energética entre ambas es pequeña, por lo que una pequeña aportación energética hará que puedan promocionar electrones a la banda de conducción y, por tanto, conducir la corriente eléctrica. En los aislantes, por su parte, las dos bandas están tan alejadas que la banda de conducción es inaccesible, motivo por el cual son incapaces de conducir la corriente: 29 Propiedades de los elementos metálicos 1. Forman redes cristalinas metálicas, en las cuales los cationes se hallan perfectamente ordenados en el espacio, motivo por el cual los metales suelen presentar dureza y presentan una elevada densidad. 2. Elevadas conductividades térmica y eléctrica, debido a la gran movilidad de los electrones de valencia. 3. Gran deformabilidad, porque las capas de cationes se pueden desplazar entre sí sin alterar la estructura. Por ello se pueden estirar en hilos, como el cobre (propiedad que recibe el nombre de ductilidad) y también en láminas, como el aluminio (maleabilidad). 4. En general, altos puntos de fusión y ebullición, lo cual implica que hace falta una gran cantidad de energía para separar los átomos que forman el retículo cristalino. No obstante, sus puntos de fusión varían notablemente dentro de un intervalo muy amplio: el mercurio es líquido a temperatura ambiente, el galio funde a 29ºC y el wolframio a 3380ºC. 5. Brillo metálico. La mayoría de los metales pulidos no absorbe ninguna radiación luminosa incidente, sino que la refleja en su totalidad. De ahí que los vemos brillar con un brillo plateado en su mayoría. 6. Emisión de electrones. Ya vimos en la explicación del efecto fotoeléctrico que los metales pueden emitir electrones al ser irradiados con una radiación de la frecuencia adecuada. Del mismo modo, esto también puede suceder por calor, lo que recibe el nombre de efecto termoiónico. 30






