sarcoma de kaposi
Anuncio

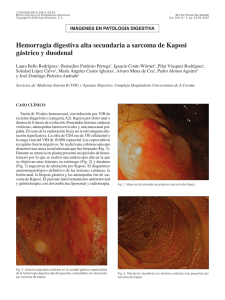
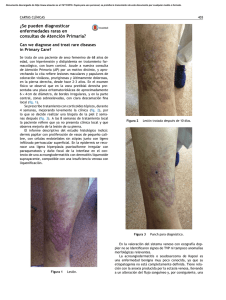
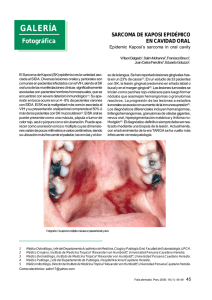
Sarcoma de Kaposi José Antonio Avilés Izquierdo Servicio de Dermatología, Hospital General Universitario Gregorio Marañón, Madrid Introducción Epidemiología Etiopatogenia Diagnóstico Tratamiento Bibliografía recomendada Introducción El sarcoma de Kaposi (SK) es un tumor de origen vascular descrito por primera vez en la literatura médica en 1872 por el dermatólogo húngaro Moritz Kaposi, denominado originalmente “sarcoma pigmentado múltiple idiopático”. Kaposi describió con este término una serie de tumores cutáneos o extracutáneos que afectaban principalmente a varones de edad avanzada y de ascendencia judía o mediterránea. Durante la mayor parte del siglo XX, el sarcoma de Kaposi fue un trastorno infrecuente y poco conocido por la comunidad médico-científica. Fue a partir de 1981, debido a la aparición de un gran número de casos de sarcoma de Kaposi en la costa oeste de Estados Unidos entre varones homosexuales portadores infectados por el VIH cuando este tumor se conoció universalmente, llegando a ser considerado la neoplasia más frecuente entre los pacientes con sida. Epidemiología Clásicamente se han descrito cuatro subtipos de sarcoma de Kaposi: sarcoma de Kaposi mediterráneo o clásico; sarcoma de Kaposi endémico o africano; sarcoma de Kaposi yatrogénico, en pacientes inmunodeprimidos; y sarcoma de Kaposi epidémico o asociado a sida. Todas estas formas, a pesar de compartir una histología común, tienen factores epidemiológicos (Tabla 1), clínicos y evolutivos característicos, por lo que la actitud terapéutica frente a cada una de ellas será diferente. Tabla 1. Epidemiología de los diferentes subtipos de sarcoma de Kaposi. Tipo Población de riesgo Edad Sexo (V/M) Clásico Europa del Este, judíos, 50-80 10-15/1 Adultos negros africanos 25-40 17/1 - Adenolinfático Niños negros 2-15 3/1 Yatrogénico Pacientes con enfermedades 20-60 2/1 (asociado a autoinmunes, conectivopatías, inmunosupresión) tratados con AZT, CSP o CE; 18-65 106/1 mediterráneos Endémico - Benigno nodular - Agresivo - Florido - Asociado a VIH receptores de trasplante renal Epidémico Homosexuales (95%), otros (asociado a VIH) (5%) El sarcoma de Kaposi clásico se localiza casi exclusivamente en miembros inferiores de ancianos y aunque existen casos de afectación sistémica o visceral, su curso suele ser crónico e indolente. La forma de sarcoma de Kaposi africano puede presentar un amplio espectro clínico, con diferentes manifestaciones y pronóstico según sus distintas variedades. La forma yatrogénica de sarcoma de Kaposi suele cursar con afectación exclusivamente cutánea y remite espontáneamente al suspender el tratamiento inmunosupresor. El sarcoma de Kaposi asociado a sida se caracteriza por presentar una distribución multicéntrica (Figura 1) y, en ocasiones, simétrica. Suele localizarse de forma electiva en ciertas zonas, como la mucosa oral, nariz, retroauricular, tronco, pene y extremidades (Figura 2). Aunque su aparición parece asociarse con el estado inmunitario del paciente (menos del 15% de los pacientes con sarcoma de Kaposi asociado a sida tienen más de 500 céls./ml de CD4), su progresión es impredecible y no se ha podido correlacionar con el grado de inmunosupresión, ya que puede manifestarse en cualquier estadio de la infección por el VIH. De hecho, el sarcoma de Kaposi puede ser la primera manifestación de sida en el 15% de los casos. [FIGURA 1] [FIGURA 2] Con la generalización del tratamiento antirretroviral de gran actividad (TARGA), la incidencia de sarcoma de Kaposi asociada a sida en los países desarrollados ha descendido notablemente en los últimos años. Sin embargo, el sarcoma de Kaposi asociado a sida sigue siendo un gran problema en los países en vías de desarrollado, especialmente en el África Subsahariana. Etiopatogenia Inicialmente se sospechó que el sarcoma de Kaposi se originaba a partir de un factor de transmisión sexual que afectaba a sujetos inmunodeprimidos. En 1988, estudios en ratones transgénicos que desarrollaron sarcoma de Kaposi señalaron al gen tat del VIH como perpetuador de la inmunosupresión y desencadenante de la transformación tumoral. Además, la proliferación de células endoteliales que comportan estos sarcomas vasculares parece verse estimulada por diversas citocinas (IL-1, IL-6) y factores de crecimiento (bFGF). En 1994, Chang y cols. lograron demostrar la presencia del virus del herpes humano tipo 8 en más del 90% de los casos de una serie de paciente con sarcoma de Kaposi asociado a sida, aislándose dicho virus tanto en piel como en vísceras afectadas por el sarcoma de Kaposi. Esto ha permitido utilizar en la actualidad la serología frente a este virus como factor pronóstico de desarrollo de sarcoma de Kaposi en pacientes VIH. Diagnóstico El diagnóstico del sarcoma de Kaposi asociado a sida es fundamentalmente clínico. Sin embargo, la confirmación histológica mediante biopsia de las lesiones resulta de gran ayuda y debe realizarse siempre que sea posible. El sarcoma de Kaposi asociado a sida suele manifestarse en forma de pequeñas pápulas violáceas de 1 a 2 cm de longitud, localizadas habitualmente en cuello, tronco y extremidades, aunque también pueden formar grandes placas o nódulos ulcerados. Sin embargo, el sarcoma de Kaposi puede afectar a mucosas, vísceras, adenopatías y sistema linfático. La cavidad oral es la mucosa afectada con mayor frecuencia, sobre todo el paladar, donde pueden aparecer tanto máculas como pápulas y nódulos. La conjuntiva ocular también suele afectarse con frecuencia, en forma de máculas relativamente benignas. La afectación visceral suele ser asintomática. Estudios posmortem sugieren una afectación visceral en más del 75% de los casos de sarcoma de Kaposi asociado a sida, aunque tan sólo en el 10%-20%, el sarcoma de Kaposi es la causa de la muerte del paciente. Se localiza con mayor frecuencia en el tracto gastrointestinal y los pulmones, pudiendo afectar a casi cualquier órgano. La afectación ganglionar y del sistema linfático suele acompañarse de edema local y complicar las lesiones cutáneas y subcutáneas con la aparición de dolor, maceración y úlceras. En cuanto a la histopatología del sarcoma de Kaposi, se describen diferentes estadios correspondientes a las diferentes formas clínicas. En la fase de mácula se observa una proliferación de células de supuesto origen endotelial, pequeñas, irregulares, en dermis reticular, alrededor de vasos y anejos normales, y con un infiltrado linfocítico variable. En la fase de placa o pápula existe una expansión de células fusiformes por toda la dermis y grasa subcutánea, junto con depósitos de hemosiderina. Finalmente, en la fase nodular, junto a grandes cúmulos de células fusiformes, se aprecia atipia celular, necrosis y extravasación de eritrocitos. La utilización del microscopio electrónico y la tinción inmunohistoquímica con CD34 permite distinguir el sarcoma de Kaposi de otras entidades englobadas con el término “pseudokaposi” por su similitud histológica, como la acroangiodermatitis. Otra técnica diagnóstica útil es la detección inmunohistoquímica del antígeno-1 nuclear del virus del herpes humano 8 latente. La utilización de técnicas de imagen como la tomografía axial computarizada (TAC) abdominal permite la detección precoz de la afectación ganglionar o hepatoesplénica de estos pacientes. La estadificación del sarcoma de Kaposi asociado a sida más utilizada, propuesta por el AIDS Clinical Trials Group en 1989, se muestra en la Tabla 2. Tabla 2. Clasificación por estadios del sarcoma de Kaposi según el AIDS Clinical Trials Group (ACTG). Pronóstico favorable (0) Tumor (T) Pronóstico desfavorable (1) Confinado a piel o ganglios Edema o ulceración asociada al linfáticos o mínima afectación sarcoma de Kaposi oral Afectación oral extensa Afectación gastrointestinal Otras afectaciones viscerales CD4 ≥200/mm3 CD4 <200/mm3 Enfermedad Sin infecciones oportunistas ni Infecciones oportunistas o sistémica (S) muguet muguet Sin síntomas B Síntomas B Karnofsky >70% Karnofsky <70% Sistema inmunológico (I) Otras enfermedades relacionadas con VIH (linfomas, etc.) Diagnóstico diferencial El sarcoma de Kaposi puede confundirse con un gran número de dermatosis, sobre todo en el caso de profesionales no familiarizados con esta enfermedad. En la Tabla 3 se enumeran las enfermedades cutáneas cuya morfología puede presentar más parecido con el sarcoma de Kaposi. Tabla 3. Diagnóstico diferencial del sarcoma de Kaposi. Angiomatosis bacilar Angioma en penacho Angioqueratoma Dermatitis por estasis grave Fibrohistiocitoma Granuloma piógeno Hiperpigmentación postinflamatoria Linfomas cutáneos Malformaciones venosas Melanoma Nevus azul Prúrigo nodular Tratamiento Dado que la evolución del sarcoma de Kaposi es muy variable, la aptitud terapéutica va a depender fundamentalmente tanto de la extensión y gravedad de las lesiones como del estado inmunitario del paciente. Esto determinará que el tratamiento del sarcoma de Kaposi vaya desde la abstención terapéutica hasta el tratamiento con poliquimioterapia. En general, el tratamiento local o intralesional está indicado en las siguientes situaciones: Número limitado de lesiones cutáneas Enfermedad localizada Mejoría estética de lesiones aisladas. Entre las modalidades de tratamiento local, contamos con las siguientes: Crioterapia. Técnica sencilla con una respuesta parcial o completa del 85%. Sin embargo, no suele conseguirse una curación histológica, ya que persisten células tumorales en la dermis reticular profunda y puede resultar bastante molesta para el paciente. Quimioterapia intralesional. Los citostáticos más empleados localmente son la vinblastina o la vincristina, a dosis de 0,1-0,2 mg/cm2 de lesión. Comparada con la crioterapia, tiene mejor respuesta en lesiones más de 1 cm de diámetro, pero con más efectos adversos (hiperpigmentación postinflamatoria, dolor, edema, úlceras y alopecia). Modificadores biológicos intralesionales, como el interferón (IFN) alfa o el factor de necrosis tumoral (TNF) alfa. Los resultados son similares a los anteriores, pero con mayor coste y efectos adversos. Radioterapia. Especialmente indicada para aliviar síntomas producidos por efecto masa (lesiones orales, adenopatías dolorosas, linfedema localizado de extremidades y genitales). Produce una mucositis grave en lesiones orofaríngeas. No se aconseja su uso con fines estéticos. Laserterapia. El láser de dióxido de carbono se usa principalmente en lesiones orales de gran tamaño. Cirugía excisional. Indicada en lesiones localizadas en zonas delicadas y seleccionadas. Retinoides tópicos. De reciente comercialización para esta indicación específica. Sin embargo, son muy caros. En aquellos pacientes que no han podido ser controlados con tratamiento local pueden utilizarse las siguientes modalidades de tratamiento sistémico. La combinación de estos fármacos con el TARGA obtiene los mejores resultados, ya que con ello se evita la progresión de la enfermedad sin disminuir excesivamente la inmunidad del paciente. Interferón sistémico. Con dosis de 20 millones U/m2 de superficie corporal se obtiene una tasa de respuesta del 20%-40%. No existen diferencias entre IFN alfa y beta. La respuesta a este tratamiento depende directamente de la cifra de CD4 antes del tratamiento. Interferón sistémico asociado a zidovudina. Con este tratamiento combinado se obtiene una mayor tasa de respuesta (30%-60%), pero con mayor toxicidad (pancitopenia, hepatotoxicidad, etc.). Quimioterapia sistémica. En el tratamiento del sarcoma de Kaposi se han empleado diferentes pautas de monoterapia o poliquimioterapia, con una respuesta variable (40%-80%). La poliquimioterapia está especialmente indicada en casos de sarcoma de Kaposi diseminado y comportamiento agresivo. Entre los citotóxicos empleados se encuentran vinblastina, vincristina, dacarbazina, doxorubicina bleomicina y etopósido. Bibliografía recomendada liposomal, actinomicina D, ciclofosfamida, Ablashi, D.V., Chatlynne, L.G., Whitman, J.E. Jr, Cesarman, E. Spectrum of Kaposi’s sarcoma - associated herpesvirus, or human herpesvirus 8, diseases. Clin Microbiol Rev 2002; 15: 439-464. Bahat, E., Akman, S., Karpuzoglu, G. y cols. Visceral Kaposi’s sarcoma with intracranial metastasis: A rare complication of renal transplantation. Pediatr Transplant 2002; 6: 505508. Brambilla, L., Boneschi, V., Taglioni, M., Ferrucci, S. Staging of classic Kaposi's sarcoma: A useful tool for therapeutic choices. Eur J Dermatol 2003; 13: 83-86. Brenner, B., Weissman-Brenner, A., Rakowsky, E. y cols. Classical Kaposi sarcoma: Pronostic factor analysis of 248 patients. Cancer 2002; 95: 1982-1987. Chang, Y., Cesarman, E., Pessin, M.S. y cols. Identification of herpesvirus-like sequences in AIDS-associated Kaposi’s sarcomas. Science 1994; 266: 1865-1869. Ensoli, B., Gendelman, R., Markham, P. y cols. Synergy between basic fibroblast growth factor and HIV-1 Tat protein in induction of Kaposi’s sarcoma. Nature 1994; 371: 674-680. Fitzpatrick, T.B. Dermatology in general medicine. Mc Graw-Hill, Boston 1999; 1195. Gill, J., Bourboulia, D., Wilkinson, J. y cols. Prospective study of the effects of antiretroviral therapy on Kaposi sarcoma-associated herpesvirus infection in patients with and without Kaposi sarcoma. J Acquir Inmune Defic Syndr 2002; 31: 384-390. Lázaro Ochaita, P. Dermatología. Texto y atlas. Meditécnica S.A., Madrid 1993; 542. Lundgren, J.D. Kaposi’s sarcoma and its management in AIDS patients. Scand J Infect Dis 1997; 29: 3-12. Miras Parra, F.J., Muñoz Medina, L., Álvarez de Cienfuegos Rodríguez, A., Gómez Jiménez, F.J., Gázquez Pérez, I. Afectación multisistémica en el sarcoma de Kaposi clásico agresivo. Ann Med Interna (Madrid) 2002; 19: 72-73. Moore, P.S., Gao, S.J., Domínguez, G. y cols. Primary characterization of a herpesvirus agent associated with Kaposi’s sarcoma. J Virol 1996; 70: 549-558. Nnoruka, E.N. Epidemic (human immunodeficiency virus-related) Kaposi's sarcoma in West African women. Int J Dermatol 2003; 42: 794-799. Portsmouth, S., Stebbing, J., Gill, J. y cols. A comparison of regimens based on non-nucleoside reverse transcriptase inhibitors or protease inhibitors in preventing Kaposi's sarcoma. AIDS 2003; 17: F17-22. Prakash, O., Tang, Z.Y., He, Y.E. y cols. Human Kaposi's sarcoma cell-mediated tumorigenesis in human immunodeficiency type 1 tat-expressing transgenic mice. J Natl Cancer Inst 2000; 92: 721-728. Reizis, Z., Trattner, A., Katzenelson, V. y cols. Flow cytometric DNA analysis of classic and steroid-induced Kaposi’s sarcoma. Br J Dermatol 1995; 132: 548-550. Scinicariello, F., Rady, P., Cloyd, M.W., Tyring, S.K. HPV 18 in HIV associated Kaposi’s sarcoma. Lancet 1991; 339: 548. Tappero, J.W., Conant, M.A., Wolfe, S.F., Berger, T.G. Kaposi’s sarcoma: Epidemiology, pathogenesis, histology, clinical spectrum, staging criteria and therapy. J Am Acad Derm 1993; 28: 371-387. Trattner, A., Hodak, E., David, M., Sandbank, M. The appearance of Kaposi sarcoma during corticosteroid therapy. Cancer 1993; 72: 1779-1783. Zalla, M.J. Kaposi’s sarcoma: An update. Dermatol Surg 1996; 22: 274-287. Zurrida, S., Bartoli, C., Nole, F. y cols. Classic Kaposi’s sarcoma: A review of 90 cases. J Dermatol 1992; 19: 548-552.