espectrometría en el ultravioleta, visible e infrarrojo cercano
Anuncio

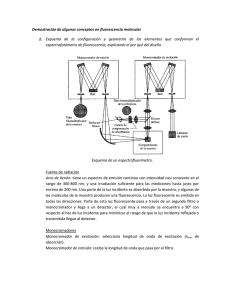
ANEXO ESPECTROSCOPÍA/ Versión 1.0/ MÓDULO 4/ CÁTEDRA DE FÍSICA/ FFYB/ UBA/ FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA ESPECTROMETRÍA EN EL ULTRAVIOLETA, VISIBLE E INFRARROJO CERCANO Las radiaciones de esta zona del espectro electromagnético poseen energía suficiente para promover la excitación de los electrones externos de algunas moléculas. Ello involucra · electrones de enlaces covalentes (en particular en orbitales ), · electrones no compartidos (electrones n) · electrones de subniveles d y f parcialmente llenos, de metales de transición. Figura 1: Energía involucrada en las transiciones de electrones enlazantes y no enlazantes a antienlazantes Los componentes de las moléculas que experimentan absorción de radiaciones se conocen como cromóforos. En el estado de menor energía los electrones externos están distribuidos en orbitales moleculares enlazantes, que pueden ser o según se trate de enlaces simples o múltiples. Cada orbital lleva asociado un orbital antienlazante, de mayor energía ( *); análogamente uno tiene asociado el correspondiente *. Los electrones n carecen de orbital antienlazante asociado. Las transiciones electrónicas implican la promoción desde el estado de menor energía hacia uno excitado de mayor energía. La figura detalla la energía involucrada en las diferentes transiciones y la zona del espectro en que se produce la absorción de energía. La región del ultravioleta de mayor aplicación es la que se extiende por encima de los 200 nm; a longitudes de onda menores entran a absorber energía las moléculas de oxígeno y se debe operar al vacío. Dentro de la denominada zona útil se producen transiciones *, n * y n *, dadas en orden creciente de longitud de onda (decreciente de Energía). Las transiciones comprenden enlaces múltiples, en tanto que las n son típicas de átomos con electrones libres (oxígeno, nitrógeno, fósforo, azufre, halógenos). ESPECTROMETRÍA EN EL INFRARROJO FUNDAMENTAL Las moléculas capaces de absorber energía radiante en el infrarrojo son las que forman dipolos entre enlaces específicos. Esta absorción implica movimientos entre los núcleos de los átomos del enlace. Existen movimientos de vibración y de torsión; estos últimos están asociados con cantidades de energía muy pequeñas, que corresponden a radiaciones de 100 cm-1 o menos ( > 100 m), y se ubican en lo que se conoce como infrarrojo lejano, que no se tratará en este texto. Cátedra de Física-FFYB-UBA [2] FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA Por su parte los movimientos de vibración pueden ser de alargamiento y de flexión. Las vibraciones de alargamiento involucran un cambio continuo en la distancia entre átomos a lo largo del eje de enlace, en tanto que las de flexión se caracterizan por un cambio en los ángulos entre los enlaces. Figura 2: Movimientos de vibración Los niveles de energía de vibración están cuantizados y las diferencias de energía entre el estado fundamental y el primer estado excitado producen las denominadas bandas de absorción fundamentales. Existen también bandas de absorción más débiles, conocidas como sobretonos o armónicos, que aparecen a múltiplos enteros de la frecuencia fundamental (2 , 3 , etc.) o a suma de estos múltiplos [(2 + 3) , etc.]. Para la mayor parte de las moléculas las bandas fundamentales de vibración se encuentran en la zona del infrarrojo fundamental, en tanto que los sobretonos aparecen en el infrarrojo cercano. La energía de vibración depende de: · la masa de los átomos involucrados · la fuerza de los enlaces · la forma de la molécula En función de lo expuesto, un enlace es semejante a un par de pequeñas esferas colocadas en los extremos de un resorte que se puede deformar. Extendiendo la comparación a la totalidad de la molécula se la puede concebir como una serie de bolillas de masas diferentes unidas por resortes de diversos niveles de elasticidad. Analizando la analogía se puede predecir que a mayor fortaleza del enlace (por ejemplo uniones dobles o triples) se requiere mayor energía para hacerlo vibrar, con lo que la absorción se produce a frecuencia más elevada. Como cada uno de los enlaces forma parte de la molécula, la absorción de energía quedará afectada por su entorno; así por ejemplo la conjugación o los puentes hidrógeno reducen la fuerza del enlace y desplazan la absorción hacia frecuencias menores. Para un mismo enlace, las vibraciones por alargamiento se producen a mayor frecuencia que las de flexión. TURBIDIMETRÍA Y NEFELOMETRÍA Se denomina turbidez a la propiedad óptica de una muestra líquida que contiene partículas en suspensión, las que producen difusión y absorción de las radiaciones que atraviesan la muestra. Este fenómeno se debe a la presencia de las partículas cuyo tamaño es del orden del de la longitud de onda de la radiación incidente. Hay dos métodos analíticos vinculados con la turbidez: · turbidimetría · nefelometría En turbidimetría se mide la radiación que pasa a través de la muestra en la dirección en que ésta se propaga. Cátedra de Física-FFYB-UBA [3] . FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA En nefelometría se mide la radiación difundida por una muestra turbia; esta medición se efectúa en un ángulo determinado respecto de la dirección de la radiación incidente, usualmente 90°. En la elección de la longitud de onda de incidencia se deben tomar en consideración la posibilidad de que la muestra absorba radiación (turbidimetría) o que emita fluorescencia (nefelometría). Las mediciones de turbidez se efectúan en base a una suspensión tipo. Ella se prepara disolviendo 5 g de sulfato de hidrazonio y 50 g de hexametiléntetraamina en 1000 cm3 de agua destilada y dejando reposar 48 h. De la reacción correspondiente resulta un polímero conocido como formazina, que desarrolla turbidez blanca. El patrón que así se obtiene define 4000 unidades de turbidez nefelométrica; éste se puede luego diluir para preparar distintas soluciones del valor deseado. Aplicaciones Las aplicaciones de la turbidimetría y la nefelometría son muy diversas. Normalmente cuando la suspensión en estudio contiene baja concentración de partículas y ellas son pequeñas se recurre a la nefelometría, en tanto que si es más elevada o de mayor tamaño, se recurre a la turbidimetría. Ejemplos de estas aplicaciones los constituyen mediciones de turbidez en aguas, bebidas y fármacos. En algunos casos se recurre a la formación de compuestos que imparten turbidez para determinar concentraciones o masas. Por ejemplo se puede determinar sulfato en pequeñas cantidades por formación de una suspensión de sulfato de bario o zinc mediante reacción con hexacianoferrato(II) de potasio. En estos casos se trata de mantener la estabilidad de las suspensiones agregando agentes tensioactivos adecuados. Los resultados son reproducibles y comparables si se controlan todas las variables que afectan el tamaño de la partícula. FLUORESCENCIMETRÍA Se entiende por luminiscencia la emisión de radiación por parte de moléculas que se encuentran excitadas. Cuando la excitación es producida por absorción de fotones los procesos de desexcitación involucrados son: fluorescencia y fosforescencia, en cambio si la molécula excitada es producida mediante una reacción química se está en presencia de quimioluminiscencia. La medida de la emisión luminiscente permite la determinación cuantitativa de muchas especies inorgánicas y orgánicas con concentraciones a nivel vestigio, siendo los métodos de fluorescencia los más difundidos. Un aspecto destacable es su elevada sensibilidad, con límites de detección que a menudo son unos tres órdenes más pequeños que los de la espectrometría de absorción. También son importantes el amplio intervalo de linealidad de las concentraciones y la selectividad de los procedimientos. Lamentablemente es limitado el número de sustancias capaces de producir este fenómeno. Estados excitados y luminiscencia. Ciertos compuestos al ser excitados mediante radiaciones con energías correspondientes al ultravioleta cercano o al visible, emiten la energía recibida, o parte de ella. Según el proceso que la produce, la emisión de radiación puede persistir durante un lapso muy breve (10-9 a 10-7 s) o mantenerse más tiempo (> 1 s). Cátedra de Física-FFYB-UBA [4] FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA Las moléculas, luego de ser excitadas desde el estado fundamental (So ) hasta un dado estado de vibración (Vo ... V4) dentro de un nivel electrónico de mayor energía (S1), comienzan de inmediato el proceso de relajación. En una primera etapa lo hacen hacia el estado de vibración más bajo dentro del nivel electrónico alcanzado (Vo en S1), sin emitir radiación; este proceso se denomina conversión interna. En una segunda etapa experimentan relajación hacia un nuevo estado de vibración (Vo ... V4), pero dentro del nivel electrónico correspondiente al estado fundamental (So), pudiendo conservar parte de la energía de excitación como energía de Figura III – 33 vibración en este último nivel Luminiscencia electrónico; esta etapa va acompañada de emisión de radiación y corresponde Figura 3: Procesos de luminiscencia a la fluorescencia, siendo la radiación emitida de mayor que la absorbida. El exceso de energía de vibración que las moléculas retienen se disipa más tarde por colisiones u otros procesos no radiantes. Consideremos ahora la participación de los electrones de enlace en el proceso de excitación. Como es sabido en un mismo orbital no puede haber más de dos electrones, cuyos espines deben ser antiparalelos. Un estado electrónico molecular en el cual los espines de los electrones están apareados se denomina singulete (S1). estado fundamental singulete (So) estado excitado singulete (S1) estado excitado triplete (T1) Como consecuencia del proceso de excitación S0 pasa a S1, y si la relajación vibratoria es lenta, uno de los electrones de valencia de cada par puede experimentar, dentro del nivel de mayor energía (S1), una inversión en su espín, pasando al estado conocido como triplete (T1), de energía algo menor. El retorno al estado fundamental desde este último estado requiere una relajación al estado singulete (So), lo que lleva más tiempo (1.10-4 a 10 s). Esta relajación desde T1 implica emisión de radiaciones y constituye la base de la fosforescencia. Como se desprende de examinar la Figura 3, si una molécula dada es capaz de presentar fluorescencia y también fosforescencia, esta última se produce a una longitud de onda un poco mayor. A bajas concentraciones la respuesta del detector es directamente proporcional a la concentración del analito, mientras que a altas concentraciones la misma se hace más débil, pudiéndose formar complejos de asociación entre moléculas en el estado fundamental y moléculas excitadas. Sustancias que producen fluorescencia En general la fluorescencia se produce por absorción de radiaciones de longitud de onda superiores a 250 nm, lo que involucra transiciones * y, menos frecuentemente, n *. Cátedra de Física-FFYB-UBA [5] FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA Por ello es de esperar fluorescencia en moléculas que contengan enlaces dobles conjugados, en particular las que presentan anillos bencénicos, simples o condensados. Los heterociclos sencillos no presentan fluorescencia, pero lo hacen si se fusionan con anillos aromáticos; así, por ejemplo, no es fluorescente la piridina, pero lo es la quinolina. Los sustituyentes que ayudan a deslocalizar electrones (grupos alquilo, amino, ciano, fluoro, hidroxi, metoxi, metilamino, dimetilamino) generalmente estimulan la emisión de fluorescencia. Por su parte los grupos que atraen electrones (halogenuro, en orden creciente de número atómico, carbonilo, en donde predominan transiciones * , nitro) atenúan o anulan el efecto, motivo por el cual no deben estar presentes en los solventes. Así, por ejemplo, la anilina tiene mayor intensidad de fluorescencia que el benceno, pero el nitrobenceno no es fluorescente. Es también importante considerar la rigidez de la estructura molecular; la fluorescencia se encuentra favorecida en moléculas rígidas, ya que experimentan movimientos moleculares más restringidos y menor pérdida de energía por relajación vibratoria. Asimismo la existencia de estructuras resonantes confiere estabilidad en el estado excitado; por ejemplo la fluorescencia de la anilina, que presenta tres formas de resonancia, se reduce a cero al disociarse y liberar el ion anilonio, con una única estructura. Los compuestos aromáticos débilmente fluorescentes o no fluorescentes son a menudo fosforescentes. Ello es debido a la posibilidad de transiciones * n. La fluorescencia se reduce al aumentar la temperatura ya que con ello se incrementa la relajación vibratoria. También el solvente tiene influencia; a mayor viscosidad sus moléculas se mueven con mayor lentitud, reduciendo la interacción con las del analito, con incremento de la fluorescencia. Aparatos El instrumental para fluorescencia de uso generalizado responde a una estructura general similar al usado en espectrometría en el ultravioleta – visible, sólo que contiene dos selectores de banda espectral: - primario o de excitación colocado entre la fuente de radiación y la cubeta, que permite el paso de la radiación capaz de producir la fluorescencia, separando las longitudes de onda a las cuales se produce el efecto - secundario o de emisión ubicado entre la cubeta y el detector, a fin de seleccionar un máximo de radiaciones luminiscentes, que se enfoca sobre este último. El selector de banda espectral secundario y el detector se ubican generalmente en ángulo recto con relación a la trayectoria de la radiación de la fuente, con lo que se logra atemperar los efectos de la fluorescencia debida a la cubeta y la radiación reflejada por ésta. Casi todos los instrumentos de fluorescencia son de doble haz para compensar las oscilaciones de flujo de la fuente. Es importante emplear una fuente de radiación de alta potencia por cuanto ella influye sobre la intensidad del proceso luminiscente. Entre ellas se pueden citar la de arco de xenón de alta presión y la de vapor de mercurio de baja presión. Figura 4: Esquema de un fluorescenciómetro de doble haz Cátedra de Física-FFYB-UBA [6] FUNDAMENTOS 1.0/ ESPECTROSCOPIA FUNDAMENTOS ESPECTROSCOPIA M4 / FISICA 1.0/ M4 / FISICA Las cubetas para contener la muestra pueden ser cilíndricas o rectangulares, de vidrio o de sílice. El compartimiento se debe diseñar de manera de reducir la cantidad de radiación dispersada que llega al detector. Los selectores de banda espectral suelen ser de filtro o de red, en tanto que el detector es un fotomultiplicador. En fluorescencimetría se pueden obtener dos tipos de espectrogramas: · espectrograma de excitación en el cual se mantiene fija la longitud de onda del selector de banda secundario y se varía la del primario · espectrograma de emisión en el cual se mantiene fija la longitud de onda del selector de banda primario y se varía la del secundario. El espectrograma de emisión aparece como una imagen especular del de excitación. Ellos permiten establecer las longitudes de onda más adecuadas para la excitación y la emisión. Para fosforescencia los instrumentos son similares, sólo que requieren adicionalmente de un dispositivo que, en forma alternada, irradie el analito y, luego de un lapso adecuando, permita llegar la luminiscencia al detector; y de una camisa refrigerante de la cubeta, con ventanas de cuarzo, para prevenir la degradación por colisiones de la radiación de salida. Como refrigerante se utiliza nitrógeno líquido. Debido a las diversas variables que intervienen no se pueden obtener con estos instrumentos las mismas lecturas para un conjunto dado de muestras de un día a otro. Por este motivo cada vez que se usan se los calibra ajustándolos a un nivel de sensibilidad reproducible. El reactivo más común para este fin es una solución de sulfato de quinina 1.10-5 M. Aplicaciones Los métodos de fluorescencia, por su elevada sensibilidad, encuentran aplicación en la determinación de contaminantes, fármacos, vitaminas y diversas drogas, a nivel vestigio, tanto en el ambiente como en organismos. También se utilizan para la determinación de cationes diamagnéticos (repelidos por campos magnéticos permanentes) no reducibles (generalmente de metales representativos), capaces de formar quelatos fluorescentes. Como ligantes se usan sustancias no fluorescentes con estructuras aromáticas con dos o más grupos dadores; la formación del quelato imparte rigidez a la molécula de ligante, dando posibilidad a la aparición de fluorescencia. Por ejemplo se pueden determinar pequeñas cantidades de aluminio por reacción con 8-hidroxiquinolina o de boro mediante combinación con benzoína. Se debe evitar la presencia de oxígeno disuelto ya que puede producir oxidación fotoquímica de las especies fluorescentes y/o atenuar el efecto debido a su paramagnetismo. Se lo desplaza por burbujeo con nitrógeno u otro gas inerte. QUIMIOLUMINISCENCIA. La quimioluminiscencia se produce cuando, por efecto de una reacción química, aparece una especie electrónicamente excitada, que emite radiación para volver al estado fundamental. La señal típica de una reacción de este tipo alcanza rápidamente un máximo cuando se completa la mezcla del analito y del reactivo, para decrecer luego en forma exponencial. La aplicación analítica de la quimioluminiscencia es de desarrollo relativamente reciente y no se encuentra muy difundida. El método encuentra uso en la determinación de contaminantes de la atmósfera (ozono, óxidos de nitrógeno y compuestos sulfurados). Cátedra de Física-FFYB-UBA [7]