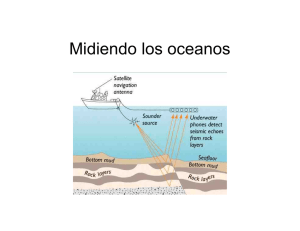
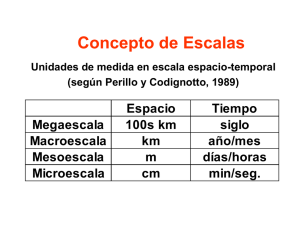
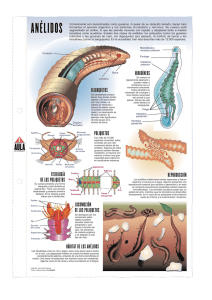
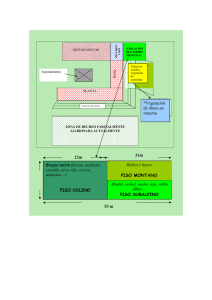
Poliquetos - Instituto Nacional de Ecología
Anuncio

Poliquetos (Annelida, Polychaeta) del talud continental suroriental del golfo de California y su relación con algunas variables ambientales Nuria Méndez1 INTRODUCCIÓN La clase Polychaeta representa el mayor grupo de invertebrados marinos, con más de 16,000 especies conocidas y pueden llegar a conformar el mayor componente biótico de la infauna marina (alrededor del 70 % de todas las especies e individuos), tanto cerca de la costa como en las grandes profundidades (Blake 1994). Los poliquetos son gusanos con muchos segmentos a lo largo del eje anteroposterior. Su nombre indica “muchas setas” (también denominadas sedas, quetas o cerdas) que están presentes en todas las especies del grupo. Presentan un elemento anterior con un lóbulo cefálico o prostomio, un elemento posterior o pigidio y la región media de naturaleza segmentada o tronco. La morfología de los representantes de las diferentes familias depende de su forma de vida y tipo de alimentación. Presentan diversas estructuras típicas de cada familia con carácter diagnóstico para su identificación taxonómica, las cuales han sido descritas por Fauchald (1977), Blake (1994) y Harris et al. (2009). Instituto de Ciencias del Mar y Limnología, Unidad Académica Mazatlán, Universidad Nacional Autónoma de México, Joel Montes Camarena s/n, Mazatlán 82040, Sinaloa, México. Correo-e: [email protected]. 1 161 El estudio de los poliquetos puede ser muy amplio debido a la gran cantidad de ambientes que habitan y a que todos los modos de reproducción y de estrategias de alimentación descritos para los invertebrados marinos están representados en el grupo. Se encuentran en sustratos blandos (arena, lodo, grava) o duros (rocas, corales, madera, metal) y algunos son pelágicos. En cuanto a la posición que ocupan en el sustrato, existen especies excavadoras que se entierran en el sedimento (infauna o endofauna) contribuyendo a su oxigenación y a la mineralización de la materia orgánica. Algunos segregan mucus que adhiere partículas de sedimento alrededor del cuerpo formando tubos para su protección o para incubar embriones (Blake 1994). Algunas especies viven sobre el sustrato (epifauna), ya sea blando o duro y el cuerpo o el tubo pueden estar total o parcialmente expuestos. Los tubos generalmente son largos en comparación con el tamaño del animal (en proporción variable dependiendo de la especie) y frecuentemente están orientados en posición oblicua al sedimento para facilitar la alimentación de los detritos depositados en la superficie (Fauchald y Jumars 1979). Con el fin de evitar confusiones de términos, en este capítulo el conjunto de organismos recolectados en la superficie del fondo con el trineo bentónico se han denominado epifauna, mientras que los organismos recolectados con la draga Karling, dentro del sedimento, se consideran como infauna, a pesar de que con ambos métodos pueden recolectarse representantes de la comunidad que vive dentro del sedimento y sobre él (Hendrickx 2012, Méndez y Hendrickx 2012). De acuerdo con Fauchald y Jumars (1979), Gambi y Giangrande (1985) y Blake (1994), las formas de alimentación de los poliquetos están estrechamente relacionadas con su forma de vida, de manera que los de vida libre tienden a ser carnívoros, carroñeros, detritívoros u omnívoros, mientras que algunos detritívoros y filtradores tienden a ser sedentarios y forman tubos, aunque existen excepciones. Los suspensívoros o filtradores extraen el alimento de la columna de agua. Los consumidores de depósito o detritívoros extraen el alimento del sedimento. Dentro de este grupo, se distinguen los consumidores de depósito de superficie que toman las partículas alimenticias de la superficie del sedimento con sus palpos o tentáculos y los consumidores de depósito de sub-superficie o excavadores, los cuales se entierran dentro del sustrato blando para alimentarse de las capas inferiores de sedimento. Los carnívoros pueden capturar presas vivas o muertas mediante faringes musculares, a menudo con mandíbulas robustas. Algunas especies de herbívoros pueden alimentarse de algas, mientras que los omnívoros pueden consumir, además, pequeños animales y detritos. 162 Biodiversidad y comunidades del talud continental del Pacífico mexicano La mayoría de los poliquetos presenta reproducción sexual, con la producción de larvas trocóforas (generalmente libres nadadoras) y metatrocóforas que pueden o no ser nadadoras libres. ANTECEDENTES Estudios faunísticos Hasta la fecha se han realizado varios estudios faunísticos sobre poliquetos de la plataforma continental en el sur de California, entre los que destacan los de Hartman (1938, 1939a, 1939b, 1944a, 1944b, 1944c, 1951, 1955, 1961, 1966, 1968, 1969), Fauchald (1968), Kudenov (1975a, 1975b, 1980) y Williams (1987). Los trabajos sobre poliquetos de la plataforma continental dentro del golfo de California corresponden a los autores mexicanos Sarti-Martínez (1984), LezcanoBustamante (1989), Hernández-Alcántara (1992) y Hernández-Alcántara y Solís-Weiss (1999). Otros estudios en el área están incluidos en Salazar-Vallejo et al. (1989) y en Salazar-Vallejo y Londoño-Mesa (2004), que realizaron la recopilación de la literatura existente sobre poliquetos en México. Recientemente, de León-González et al. (2009) editaron una serie con tres volúmenes sobre los poliquetos de México y América tropical, la cual comprende casi todas las familias de poliquetos de aguas tanto someras como profundas. Las familias que no se incluyen en esta obra, ya sea por falta de especialistas o por la escasez de ejemplares, son Polyodontidae, Sigalionidae, Pareulepidae, Lacydonidae, Lysaretidae, Paraonidae, Questidae, Apistobranchidae, Disomidae, Poecilochaetidae, Heterospionidae, Ctenodrilidae, Poebiidae, Scalibregmidae, Opheliidae, Sternaspidae, Arenicolidae, Sabellongidae, Protodrilidae y Myzostomidae. Los estudios de poliquetos realizados en mar profundo del golfo de California y áreas adyacentes son escasos y corresponden a Hartman (1960, 1963), quien estudió los poliquetos de las cuencas profundas del sureste del golfo de California. Posteriormente, Fauchald (1972) a partir de material recolectado durante la expedición del “Albatross” por Chamberlin (1919a) y Treadwell (1923), identificó 227 especies (de las cuales, 66 eran conocidas), así como material recolectado en el oeste de México y áreas adyacentes en el océano Pacífico durante dos cruceros realizados a bordo del buque “Velero IV”, en 1967 y 1970. Hasta la fecha existen varios estudios de poliquetos de mar profundo del golfo de California y zonas aledañas. Blake (1985), Solís-Weiss y Hilbig (1992) y Solís-Weiss y HernándezPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 163 Alcántara (1994) estudiaron los poliquetos de las ventilas hidrotermales de la Cuenca de Guaymas. Otros estudios concernientes a poliquetos de aguas profundas del Pacífico norte corresponden a Fauchald y Hanckock (1981), en la zona central de Oregón, y a Blake y Hilbig (1990) en los sistemas de San Juan de Fuca y en las crestas del sistema Explorer, situados en el Pacífico nororiental. Recientemente, Blake y Hilbig (1994) y Blake et al. (1995, 1996, 2000) realizaron un atlas taxonómico de la fauna de la cuenca de Santa María y del canal occidental de Santa Bárbara, de los cuales cuatro volúmenes (volumen 4 a 7) están dedicados a los poliquetos. Recientemente, la revisión de las muestras de los cruceros TALUD VI a TALUD VII permitió realizar un listado de poliquetos de fondos blandos profundos en el golfo de California suroriental (Méndez 2006). Este estudio demostró que la fauna de poliquetos de esta zona es muy similar a la registrada previamente en zonas aledañas por Hartman (1960, 1963) y por Fauchald (1972). Algunas consideraciones de tipo morfológico o de distribución que no habían sido observadas previamente se incluyeron en este trabajo. Estudios ecológicos La relación entre las variables ambientales y la macrofauna de los fondos profundos ha sido objeto de diversos estudios realizados en diferentes áreas geográficas como el Atlántico norte, el Pacífico oriental, el océano Índico, el margen occidental de África, en un monte submarino frente a México, en el mar Arábigo, al noroeste de Omán y en los márgenes de Perú y Chile (Sanders 1969, Levin et al. 1991, 1997, 2000, 2001, 2002, Rosenberg et al. 1991, Diaz y Rosenberg 1995, Cook et al. 2000, Gooday et al. 2000, 2001, Levin 2001, 2003). En estos estudios se ha destacado la importancia de ciertas variables ambientales en la distribución, la abundancia, el número de especies y la diversidad de la macrofauna bentónica del mar profundo. Las variables más estudiadas han sido la profundidad, la temperatura, la concentración de oxígeno disuelto, la cantidad de materia orgánica en el sedimento, el tamaño de grano del sedimento, la latitud y los pigmentos contenidos en el sedimento. Sin embargo, la importancia de dichas variables está en función del grupo estudiado y de las condiciones ambientales prevalecientes en las diferentes regiones. Específicamente en el Pacífico oriental, son escasos los estudios referentes a cómo los parámetros ambientales afectan la distribución de la fauna bentónica del mar profundo. La Agencia de Protección del Medio Ambiente de Estados Unidos 164 Biodiversidad y comunidades del talud continental del Pacífico mexicano y la Armada del mismo país subsidiaron tres estudios de endofauna bentónica de la plataforma continental de las islas Farallón, cerca de San Francisco (SAIC 1991; 1992; Blake et al. 1992). Por otro lado, Levin y Gage (1998) y Levin et al. (1991) estudiaron las relaciones entre los factores medioambientales y las comunidades de macrobentos en el sur de California y frente a Acapulco (México), respectivamente. Wishner et al. (1995), por su parte, estudiaron la distribución de las faunas bentónica y pelágica en relación con el límite inferior de la zona del mínimo de oxígeno (ZMO) en una montaña submarina frente a Acapulco. Únicamente se tiene conocimiento de un estudio ecológico realizado en el golfo de California, específico para el grupo de los poliquetos (Hernández-Alcántara y Solís-Weiss 2005), quienes relacionaron algunos parámetros ambientales con los poliquetos pertenecientes a la familia Spionidae, cuyos datos corresponden a la zona sublitoral, entre los 22.2 y 120 m de profundidad. Así, hasta la fecha no existía ningún estudio sobre las relaciones entre las variables ambientales y la fauna de poliquetos de mar profundo en el golfo de California. La primera caracterización de la zona del golfo de California suroriental con poliquetos infaunales se realizó recientemente con las muestras recolectadas con la draga tipo Karling en los cruceros TALUD VI a TALUD VII, entre 732 y 2110 m de profundidad (Méndez 2007). En este capítulo, se presenta información sobre la morfología y los hábitos de vida de los poliquetos tanto de la infauna como de la epifauna, y se analiza su relación con algunas variables ambientales. MATERIAL Y MÉTODOS Muestreo y laboratorio Se recolectaron muestras de macrofauna entre 730 y 2100 m de profundidad para obtener los representantes de la infauna con la draga Karling y los de la epifauna con el trineo bentónico. Los métodos de muestreo fueron descritos en Hendrickx (2012). Hasta la fecha, se ha trabajado el material de poliquetos correspondiente a los cruceros TALUD IV a VII, los cuales comprendieron la zona suroriental del golfo de California (Fig. 1). A pesar de que el trineo bentónico y la draga Karling generalmente se utilizaron simultáneamente, el número de estaciones para recolectar macrofauna con ambos equipos no siempre coincidió, ya que hubo una fuerte dependencia del tipo de sustrato de las corrientes, el clima y las cuestiones logísticas. Durante el crucero TALUD IV (agosto de 2000) se muestrearon diez estaciones Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 165 para recolectar organismos de la infauna y siete para los de la epifauna. El crucero TALUD V se llevó a cabo en diciembre de 2000 y se obtuvo material de la infauna en nueve estaciones, mientras que para la epifauna únicamente en cuatro estaciones. Durante el TALUD VI, en marzo de 2001, se muestrearon 12 estaciones para el material de la infauna y cuatro para la epifauna. El crucero TALUD VII se desarrolló en junio de 2001 y se recolectaron muestras de sedimento para la infauna en 13 estaciones y de epifauna en siete estaciones. (Fig. 1). Los poliquetos retenidos en la red, nombrados como epifauna y recolectados con el trineo bentónico, fueron separados directamente con pinzas. En el caso de la infauna, el sedimento recolectado con la draga Karling se tamizó a bordo del B/O “El Puma” a través de un tamiz de 0.5 mm de apertura de malla utilizando agua de mar para el lavado y los poliquetos retenidos fueron separados. Los poliquetos pertenecientes tanto a la infauna como a la epifauna fueron fijados con una solución de formol al 10 %. Los especímenes que se encontraron dentro de tubos de arena gruesos fueron fijados mediante la incorporación de formol al 10 % a través Figura 1. Área de estudio mostrando las estaciones de muestreo (TALUD IV= ; TALUD V= ; TALUD VI= ; TALUD VII= ). 166 Biodiversidad y comunidades del talud continental del Pacífico mexicano de un extremo del tubo utilizando, para ello, una jeringa sin aguja para evitar dañar a los organismos. En el laboratorio, todos los especímenes fueron lavados varias veces con agua corriente y, posteriormente, fueron preservados en etanol al 70 %. Los poliquetos fueron contados e identificados, de ser posible hasta nivel de especie mediante las claves de Chamberlin (1919b), Hartman (1944a, 1957, 1960, 1968, 1969), Pettibone (1966), Fauchald (1968, 1970, 1972, 1977), Fauchald y Hancock (1981), Paxton (1986), Hernández-Alcántara (1992), Blake y Hilbig (1994), Petersen (2000) y Blake et al. (1995, 1996, 2000). Para los análisis de granulometría y del contenido de materia orgánica en el sustrato, se obtuvieron submuestras de 200 a 250 g de sedimento de cada muestra recolectada con la draga Karling, las cuales fueron congeladas a bordo. En el laboratorio, una vez descongeladas las muestras, se realizaron análisis granulométricos de acuerdo con el método propuesto por Folk (1965), el cual consiste en secar la submuestra de sedimento a 60°C y, posteriormente, tamizarla en húmedo a través de una malla de 2 mm de abertura para separar la grava de la arena y de otra malla de 0.0625 mm para separar la arena del lodo (esta última fracción fue considerada como la mezcla de limo y arcilla). Las fracciones retenidas en los tamices (grava y arena) fueron secadas en una estufa a 60°C y posteriormente fueron pesadas. La fracción de lodo fue estimada como la diferencia entre el peso seco total de la muestra y el peso seco de la suma de las fracciones arenosa y gravillenta. El tamaño de grano fue calculado por regla de tres y, por lo tanto, fue expresado como porcentajes de grava, de arena y de lodo. El contenido de materia orgánica en el sedimento fue calculado de acuerdo con el método de pérdida por ignición de Dean (1974), que consiste en secar submuestras de sedimento de unos 2 g de peso húmedo en una estufa a 60°C durante 24 horas y pesarla. Posteriormente, se coloca en una mufla a 550 °C durante una hora para obtener el peso seco libre de cenizas. El porcentaje de materia orgánica se calcula por regla de tres y corresponde al material quemado en la mufla. Análisis de datos Con fines comparativos entre los dos equipos utilizados, la abundancia fue expresada en términos de densidad, como número de individuos por metro cuadrado (ind m-2). De acuerdo con Méndez y Hendrickx (2012), la densidad fue estimada considerando las características de los diferentes aparatos para recolectar las coPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 167 munidades de poliquetos de la infauna (draga Karling) y las de la epifauna (trineo bentónico). Para cada estación se calculó el índice de diversidad de Shannon (H’log2) considerando, por separado, los datos de densidad de poliquetos de la infauna y los de la epifauna (programa Primer 5.1 para Windows; Clarke y Gorley 2006). Con el fin de observar el posible efecto de la estacionalidad y la localización de las estaciones sobre la distribución de la poliquetofauna, se realizaron gráficas de escalamiento multidimensional (MDS por sus siglas en inglés) utilizando el índice de similitud de Bray-Curtis y la raíz cuarta de las densidades para evitar el efecto de las especies raras o muy abundantes (Field et al. 1982) en cada crucero y de la totalidad de los datos obtenidos durante los cuatro cruceros (programa Primer 5.1 para Windows; Clarke y Gorley 2006; datos no mostrados). Debido a que la mayoría de las muestras estaban agregadas (estrés = 0.01), se descartó la posibilidad de alguna influencia de las estaciones del año o de las posiciones de las localidades de muestreo, indicando que otras variables abióticas son las principales responsables de los patrones de distribución de los poliquetos en el área de estudio. Para comprobarlo, se obtuvieron los índices de correlación de Pearson (programa Excel 2000) entre pares de variables bióticas y abióticas. Las variables bióticas consideradas fueron la densidad, el número de especies y la diversidad, mientras que las abióticas fueron la profundidad, la temperatura, el oxígeno disuelto, el contenido de materia orgánica en el sedimento y los porcentajes de lodo, arena y grava. Este análisis se realizó por separado para las comunidades de la infauna y de la epifauna. Las especies características de cada una de las comunidades de poliquetos estudiadas se obtuvieron mediante la dominancia y la frecuencia de aparición en las estaciones muestreadas. Las especies o taxa dominantes se determinaron de acuerdo con el índice de dominancia media propuesto por Picard (1965), cuya fórmula es: Dm= (ni/N)x100, donde Dm= índice de dominancia media para la especie i; ni= número de individuos pertenecientes a la especie i; N= número total de individuos pertenecientes a todas las especies. Las especies consideradas como dominantes son aquellas cuya dominancia media es mayor o igual a uno. La frecuencia de aparición de las especies en las estaciones fue calculada de acuerdo con el índice de Glémarec (1964), siguiendo la fórmula: 168 Biodiversidad y comunidades del talud continental del Pacífico mexicano F= (mi x 100)/M, donde mi= número de muestras en las que aparece la especie i; M= número total de muestras. Las especies consideradas como frecuentes son las que presentan un valor de F mayor o igual al 15 %. Con el fin de conocer a fondo cuales son los factores ambientales que más influyen en la distribución de los poliquetos tanto de la infauna como de la epifauna del golfo de California suroriental, se realizó un análisis de correspondencias canónicas (programa Multi Variate Statistical Package; Kovach 1998). Los valores de las variables bióticas fueron las densidades de las especies dominantes y frecuentes para cada comunidad de poliquetos durante todo el estudio y considerando todas las estaciones muestreadas. Las variables abióticas fueron la profundidad, la temperatura, el oxígeno disuelto, el contenido de materia orgánica en el sedimento y los porcentajes de lodo, de arena y de grava. Para evitar distorsión de los datos, en dichos análisis se consideraron únicamente las variables abióticas que presentaron correlación de Pearson significativa con al menos una de las variables bióticas. RESULTADOS Fauna La posición e intervalos de profundidad de las estaciones en donde se encontraron poliquetos pertenecientes a la infauna y a la epifauna se encuentran en el cuadro 1. Las estaciones que fueron muestreadas con la draga Karling y con el trineo bentónico se detallan en las secciones referentes a la infauna y a la epifauna, respectivamente. Las posiciones de las estaciones corresponden a la primera vez que cada una de ellas fue visitada. Se encontraron 106 taxa de poliquetos correspondientes a 34 familias, de los cuales 73 se identificaron a nivel de especie. Algunos especímenes adicionales de los géneros Polydora, Cirratulus, Tharyx, Notomastus, Eumida, Sthenolepis, Sigambra, Pareurythoe, Amage, Samytha y Thelepus no pudieron ser identificados a nivel de especie debido a su deterioro. Asimismo, algunos ejemplares de las familias Spionidae, Maldanidae, Opheliidae, Phyllodocidae, Nereididae, Glyceridae, Lumbrineridae, Ampharetidae, Sabellidae y Serpulidae carecían de estructuras imprescindibles para la identificación taxonómica, por lo que únicaPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 169 Cuadro 1. Posiciones e intervalos de profundidad de las estaciones donde se recolectaron poliquetos. Intervalos de profundidad (m) Estación Latitud N Longitud O TALUD IV TALUD V TALUD VI 3 22 00.2 106 28.1 732 770-780 4 22 04.6 106 34.7 11901250 5 22 00.7 106 39.9 151514701620 1530 6 22 00.0 106 48.1 19502010 11 23 15.0 106 59.0 850-870 825-855 12 23 18.6 107 26.9 11601170 13b 23 30.3 107 44.0 14 23 16.3 107 40.7 2220-2250 18 19 24 15.0 24 16.4 108 17.1 108 24.3 908-944 1196-1200 20 24 14.8 108 35.2 1500-2000 25 26 24 51.7 24 56.3 108 57.9 109 11.8 778-800 1200-1274 27 25 01.2 109 11.1 - 800-860 12801310 - 28 32b 33 33b 24 52.6 26 03.0 25 45.8 26 06.5 109 37.7 109 55.4 109 48.7 110 06.7 2024-2040 1060-1090 - - 34 25 43.8 109 54.0 1244 - 34b 26 05.5 110 10.5 - - 12401270 - 35 25 57.8 110 11.4 2000-2100 - - 170 20802140 940-990 11801200 - 890-950 11601200 12501440 830-850 11901270 15801600 - Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD VII 740-750 12001230 780-790 10401120 14001450 950-1010 11601180 780-850 11801220 15801600 850-880 12601300 15001520 - Cuadro 2. Lista de poliquetos y su presencia en la comunidad de la Infauna (I) y en la epifauna (E) recolectados con la draga Karling y el trineo bentónico, respectivamente. Especies Orbiniidae Califia calida Hartman, 1957 Leitoscoloplos elongatus (Johnson, 1901) Phylo nudus (Moore, 1911) Paraonidae Aedicira alisetosa Fauchald, 1972 Aedicira longicirrata Fauchald, 1972 Paraonis pycnobranchiata Fauchald, 1972 Spionidae Polydora sp Prionospio vermillionensis Fauchald, 1972 Spiophanes fimbriata Moore, 1923 Spionidae sp Poecilochaetidae Poecilochaetus johnsoni Hartman, 1939 Heterospionidae Heterospio catalinensis (Hartman, 1944) Chaetopteridae Phyllochaetopterus limicolus Hartman, 1960 Cirratulidae Aphelochaeta monilaris Hartman, 1960 Aphelochaeta multifilis (Moore, 1909) Chaetozone corona Berkeley y Berkeley, 1941 Chaetozone setosa Malmgren, 1867 Cirratulus sinincolens Chamberlin, 1919 Cirratulus cf sinincolens Chamberlin, 1919 Cirratulus sp Tharyx tesselata Hartman, 1960 Tharyx sp Capitellidae Neoheteromastus lineus Hartman, 1960 Notomastus sp Poliquetos (A nnelida , Polychaeta ) I X X X X X X X E X X X X X X X X X X X X X X X X X X X X X del talud continental suroriental 171 Cuadro 2. Continúa. Especies Maldanidae Asychis ramosus Levenstein, 1961 Maldane cristata Treadwell, 1923 Maldanidae sp 1 Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 4 Maldanidae sp 5 Maldanidae sp 6 Maldanidae sp 7 Maldanidae sp 8 Maldanidae indeterminados Opheliidae Ophelina acuminata (Hartman, 1960) Travisia brevis Moore, 1923 Opheliidae indeterminados Scalibregmidae Scalibregma inflatum Rathke, 1843 Phyllodocidae Eteone sp Eulalia anoculata Fauchald, 1972 Eulalia strigata Hartman, 1968 Eumida sanguinea (Oersted, 1843) Eumida sp Paranaitis polynoides (Moore, 1909) Steggoa gracilior Chamberlin, 1919 Phyllodocidae indeterminados Aphroditidae Aphrodita parva Moore, 1905 Laetmonice pellucida Moore, 1903 Polynoidae Halosydna johnsoni (Darboux, 1899) Polynoidae sp 1 172 I X X X X X X X X X X X X X X Biodiversidad y comunidades del talud continental del Pacífico mexicano E X X X X X X X X X X X X X X X X X X X X Cuadro 2. Continúa. Especies Polynoidae sp 2 Polynoidae sp 3 Sigalionidae Leanira alba Moore, 1910 Sthenolepis sp Pilargiidae Ancistrosyllis hartmanae Pettibone, 1966 Sigambra sp Syllidae Exogone lourei Berkeley & Berkeley, 1938 Nereididae Ceratocephale pacifica Hartman, 1960 Ceratonereis vermillionensis Fauchald, 1972 Nereis anoculopsis Fauchald, 1972 Nereididae indeterminados Glyceridae Glyceridae indeterminados Goniadidae Goniada brunnea Treadwell, 1906 Nephtyidae Nephtys paradoxa Malm, 1874 Amphinomidae "Pareurythoe" sp Pseudeurythoe ambigua (Monro, 1933) Onuphidae Anchinothria fissurata Fauchald, 1972 Nothria abyssalis Fauchald, 1968 Onuphis iridescens (Johnson, 1901) Onuphis profundi Fauchald, 1968 Eunicidae Eunice megabranchia Fauchald, 1970 Lumbrineridae Eranno bicirrata (Treadwell, 1929) Poliquetos (A nnelida , Polychaeta ) I X X X X X X X E X X X X X X X X X X X X X X X X X X X del talud continental suroriental 173 Cuadro 2. Continúa. Especies Lumbrineris cedroensis Fauchald, 1970 Ninoe foliosa Fauchald, 1972 Ninoe fuscoides Fauchald, 1972 Ninoe longibranchia Fauchald, 1972 Lumbrineridae indeterminados Arabellidae Drilonereis falcata Moore, 1911 Sternaspidae Sternaspis fossor Stimpson, 1854 Flabelligeridae Brada pluribranchiata (Moore, 1923) Ilyphagus ilyvestis Hartman 1960 Pherusa abyssalis Fauchald, 1972 Fauveliopsidae Fauveliopsis rugosa Fauchald, 1972 Ampharetidae Amage n. sp ? Ampharete acutifrons (Grube, 1860) Ampharete arctica Malmgren, 1866 Amphicteis scaphobranchia Moore, 1906 Egamella quadribranchiata Fauchald, 1972 Melinna exilia Fauchald, 1972 Melinnampharete gracilis Hartman, 1969 Mexamage corrugata Fauchald, 1972 Paramage scutata Moore, 1923 Samytha n sp? Samythella pala Fauchald, 1972 Schistocomus hiltoni Chamberlin, 1919 Ampharetidae indeterminados Terebellidae Thelepus hamatus Moore, 1905 Thelepus setosus (Quatrefages, 1865) Thelepus sp 174 I X X X X X X X X X X X X X X X X X X X Biodiversidad y comunidades del talud continental del Pacífico mexicano E X X X X X X X X X X X X X X X X X X X X Cuadro 2. Continúa. Especies Streblosoma crassibranchia Treadwell, 1914 Trichobranchidae Terebellides stroemi Sars, 1835 Sabellidae Chone gracilis Moore, 1906 Pseudopotamilla intermedia Moore, 1905 Sabellidae indeterminados Serpulidae Serpulidae indeterminados I X X X X X E X X X mente pudieron ser catalogados como “indeterminados”. Los anfarétidos Amage sp. y Samytha sp. presentan características que no coinciden con los especímenes de los mismos géneros registrados en el golfo de California, por lo que probablemente son especies no descritas. Se encontraron 83 taxa pertenecientes a la comunidad de poliquetos de la infauna y 52 a la de la epifauna, de los cuales únicamente 29 pertenecieron tanto a la infauna como a la epifauna (Cuadro 2). En algunos casos, los nombres de especies registrados en Méndez (2006) han sido actualizados aquí debido a cambios en la literatura reciente. La revisión y actualización de la literatura han propiciado cambios de nombres de especies (por ejemplo, Terebellides stroemi, Chaetozone setosa y Ampharete arctica, que también fueron registradas en mar profundo por Fauchald (1972) pero habían sido consideradas como cosmopolitas) o cambios en la ubicación taxonómica, como el género Travisia, que actualmente está ubicado dentro de la familia Scalibregmidae (Julio Parapar, com. pers.). Las familias mejor representadas en el área de estudio fueron Ampharetidae (13 taxa), Maldanidae (11 taxa), Cirratulidae (9 taxa) y Phyllodocidae (8 taxa). De acuerdo con su presencia en las diferentes estaciones de muestreo y en los diferentes cruceros, las especies más representativas del área de estudio fueron Melinna exilia, Melinnampharete gracilis, Thelepus hamatus, Mexamage corrugata, Terebellides stroemi, Fauveliopsis rugosa, Nothria iridiscens, Califia calida, Neoheteromastus lineus y Maldane cristata. El pilárgido Ancistrosyllis hartmanae constituye un nuevo registro de distribución en fondos blandos del golfo de California o áreas adyacentes. Asimismo, se encontraron nuevos registros de disPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 175 Cuadro 3. Descripción de los tubos o estructuras protectoras no descritas con anterioridad. ND, no hay datos; LC, lodo compacto; CH, capa hialina; DE, diámetro externo; L, longitud; P, proporción entre organismo y tubo. Eespecies LC CH Chaetopteridae Phyllochaetopterus limicolus Maldanidae Maldane cristata Onuphidae Anchinothria fissurata Eunicidae Eunice megabranchia Fauveliopsidae Fauveliopsis rugosa ND ND ND ND Si Si 0.5 ND ND 0.5 ND ND Esponjas ND ND Conchas de escafópodos (Cadulus fusiformis, Rhabdus dalli, Fissidentalium megathyris, Dentalium agassizi) y lodo petrificado Si Si ND ND Si Si Ampharetidae Ampharete acutifrons Ampharete arctica Amphicteis scaphobranchia Egamella quadribranchiata Melinna exilia Melinnampharete gracilis Mexamage corrugata Paramage scutata Schistocomus hiltoni 176 DE L (cm) (cm) P 0.5 a 20 0.6 1 Tubo hialino cubierto de fango 12 1.5 Tubo hialino duro, a veces con anémonas o tubos serpúlidos 1/7 25 Si 1/3 1/6 Si ND ND 0.3 0.2 Si Si 1 Si Si ND ND 1 Otras estructuras 30 15 Tubo arenoso con algas y foraminíferos Lodo de varios colores Lodo compacto y arena fina con foraminíferos y percebes 1/ a Lodo compacto y arena fina 1/10 1/3 a Con foraminíferos 1/2 Algunos con esponjas y foraminíferos 1/10 Biodiversidad y comunidades del talud continental del Pacífico mexicano Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 177 Orbiniidae Califia calida Phylo nudus Paraonidae Aedicira alisetosa Spionidae Spiophanes fimbriata Chaetopteridae Phyllochaetopterus limicolus Cirratulidae Aphelocheta multifilis Chaetozone setosa Cirratulus sp Tharyx sp Capitellidae Neoheteromastus lineus Notomastus sp Maldanidae Especies 5.8 Talud IV 3 18 19 2.5 0.8 20 3.3 25 0.8 1.7 1.7 0.8 26 0.8 0.8 28 0.8 33 34 35 0.8 0.8 Talud V 3 5 6 4.0 12 14 2.5 18 0.8 0.8 19 1.7 25 0.8 0.8 26 Cuadro 4. Densidad estimada (ind/m2) de poliquetos de la infauna recolectados con la draga Karling durante los cruceros TALUD IV y V. Especies Biodiversidad y comunidades del talud continental del Pacífico mexicano Asychis ramosus Maldane cristata Maldanidae sp 1 Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 4 Maldanidae sp 5 Maldanidae indeterminados Opheliidae Ophelina pallida Travisia brevis Scalibregmidae Scalibregma inflatum Phyllodocidae Eulalia strigata Polynoidae Polynoidae sp 2 Sigalionidae Sthenolepis sp Pilargiidae Cuadro 4. Continúa. 178 0.8 1.7 Talud IV 3 18 0.8 0.8 1.7 19 0.8 20 1.7 3.3 25 26 0.8 28 0.8 5.0 9.1 33 7.4 34 0.8 35 0.8 Talud V 3 5 0.8 6 0.8 12 0.8 0.8 14 0.8 18 0.8 19 0.8 25 0.8 26 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 179 Ancistrosyllis hartmanae Nereididae Ceratonereis vermillionensis Nereis anoculopsis Nereididae indeterminados Glyceridae Glyceridae indeterminados Goniadidae Goniada brunnea Nephtyidae Nephtys paradoxa Amphinomidae (?) Pareurythoe sp. Pseudeurythoe ambigua Onuphidae Onuphis iridescens Onuphis profundi Eunicidae Eunice megabranchia Lumbrineridae Especies Cuadro 4. Continúa. Talud IV 3 18 0.8 19 0.8 0.8 20 0.8 0.8 0.8 25 0.8 1.7 26 0.8 28 0.8 0.8 1.7 0.8 33 34 35 0.8 Talud V 3 5 12 0.8 0.8 0.8 0.8 6 0.8 14 18 1.7 19 25 26 Especies Biodiversidad y comunidades del talud continental del Pacífico mexicano Lumbrineris cedroensis Lumbrineridae indeterminados Sternaspidae Sternaspis fossor Flabelligeridae Brada pluribranchiata Fauveliopsidae Fauveliopsis rugosa Ampharetidae Ampharete arctica Melinna exilia Melinnampharete gracilis Mexamage corrugata Samythella pala Schistocomus hiltoni Ampharetidae indeterminados Terebellidae Thelepus hamatus Cuadro 4. Continúa. 180 0.8 8.3 25 0.8 20 1.7 0.8 1.7 0.8 19 7.4 0.8 0.8 0.8 Talud IV 3 18 0.8 0.8 26 0.8 0.8 28 0.8 3.3 2.5 17.4 0.8 33 34 0.8 0.8 35 1.7 2.5 1.7 Talud V 3 5 0.8 0.8 6 12 14 0.8 18 19 7.4 0.8 25 0.8 1.7 0.8 26 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 181 Thelepus setosus Streblosoma crassibranchia Trichobranchidae Terebellides stroemi Sabellidae Chone gracilis Especies Cuadro 4. Continúa. Talud IV 3 18 19 1.7 25 0.8 0.8 20 1.7 1.7 26 28 0.8 33 34 35 Talud V 3 5 6 0.8 12 0.8 14 18 19 25 26 182 Biodiversidad y comunidades del talud continental del Pacífico mexicano Polydora sp Prionospio vermillionensis Spiophanes fimbriata Poecilochaetidae Poecilochaetus johnsoni Heterospionidae Heterospio catalinensis Chaetopteridae Orbiniidae Califia calida Leitoscoloplos elongatus Paraonidae Aedicira alisetosa Aedicira longicirrata Paraonis pycnobranchiata Spionidae Especies 0.8 0.8 0.8 2.5 0.8 0.8 0.8 0.8 0.8 1.7 0.8 0.8 0.8 0.8 11 12 13b 18 19 25 26 27 3 4 26 27 34 TALUD VII 25 3 4 5 20 TALUD VI 11 12 18 19 0.8 0.8 0.8 1.7 32b 33b 34b Cuadro 5. Densidad estimada (ind/m2) de poliquetos de la infauna recolectados con la draga Karling durante los cruceros TALUD VI y VII. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 183 3 TALUD VII 1.7 1.7 9.1 2.5 2.5 0.8 2.5 0.8 0.8 0.8 2.5 3.3 1.7 1.7 1.7 1.7 0.8 0.8 7.4 0.8 0.8 1.7 0.8 1.7 3.3 14.9 1.7 1.7 0.8 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 25 26 27 0.8 0.8 0.8 1.7 0.8 3.3 0.8 0.8 1.7 TALUD VI Phyllochaetopterus limicolus Cirratulidae Aphelocheta monilaris Aphelocheta multifilis Chaetozone corona Chaetozone 0.8 setosa Tharyx tesselata Tharyx sp Capitellidae Neoheteromastus lineus Maldanidae Asychis ramosus Maldane cristata Maldanidae sp 2 Maldanidae sp 3 Maldanidae sp 5 Maldanidae sp 6 Maldanidae sp 7 Maldanidae sp 8 Especies Cuadro 5. Continúa. 4.1 2.5 0.8 0.8 0.8 8.3 15.7 32b 33b 34b 0.8 0.8 184 Biodiversidad y comunidades del talud continental del Pacífico mexicano Maldanidae indeterminados Opheliidae Ophelina pallida Travisia brevis Opheliidae indeterminados Scalibregmidae Scalibregma inflatum Phyllodocidae Eteone sp Eulalia anoculata Paranaitis polynoides Polynoidae Halosydna johnsoni Sigalionidae Leanira alba Pilargiidae Sigambra sp Syllidae Especies 0.8 0.8 0.8 3 4 5 11 12 18 19 20 25 2.5 1.7 3.3 TALUD VI Cuadro 5. Continúa. 0.8 0.8 0.8 0.8 0.8 1.7 4 TALUD VII 26 27 34 3 0.8 0.8 0.8 11 12 13b 18 19 25 1.7 0.8 26 27 2.5 2.5 0.8 1.7 32b 33b 34b 3.3 0.8 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 185 Melinnampharete gracilis Mexamage corrugata Samythella pala Schistocomus hiltoni Ampharetidae indeterminados Terebellidae Thelepus hamatus Streblosoma crassibranchia Trichobranchidae Terebellides stroemi Sabellidae Chone gracilis Especies 0.8 3 4 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8 26 27 32b 33b 34b 0.8 1.7 0.8 1.7 0.8 19 25 1.7 0.8 0.8 1.7 11 12 13b 18 0.8 0.8 3.3 25 26 27 34 3 4 TALUD VII 0.8 0.8 5 11 12 18 19 20 0.8 0.8 TALUD VI Cuadro 5. Continúa. 186 Biodiversidad y comunidades del talud continental del Pacífico mexicano V TALUD IV Estación 3 18 19 20 25 26 28 33 34 35 3 5 6 12 14 18 19 25 26 3.6 3.7 3.1 5.1 3.7 2.0 4.3 3.5 2.5 5.5 3.0 2.2 3.8 2.1 5.0 4.0 5.2 3.8 793 926 1198 1510 789 1237 2032 1075 1220 2050 732 1568 1980 1165 2110 965 1190 830 1295 0.19 1.03 0.73 1.26 0.29 0.76 2.20 0.51 0.79 1.68 0.12 1.15 1.88 0.54 1.98 0.15 0.38 0.13 0.53 Tempera- Oxígeno tura (°C) (ml/l) Profundidad media (m) 18.78 14.03 15.19 15.47 9.86 14.69 14.96 13.86 8.26 10.27 17.23 15.67 15.50 11.03 13.64 13.74 14.05 10.87 13.81 Materia orgánica (%) 99.4 99.2 99.5 98.1 99.1 99.4 99.2 99.9 20.6 93.5 100.0 99.9 94.9 26.5 100.0 100.0 100.0 98.1 100.0 Lodo (%) 0.6 0.8 0.5 1.9 0.9 0.6 0.8 0.1 79.4 6.5 0.0 0.1 5.1 73.5 0.0 0.0 0.0 1.5 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.4 0.0 Grava (%) 0.0 11.6 8.3 11.6 27.3 10.7 5.8 43.8 7.4 3.3 1.7 7.4 4.1 3.3 3.3 3.3 5.0 10.7 5.8 Densidad (ind/m2) 0 7 7 9 10 9 7 12 1 4 1 6 5 4 4 2 5 4 6 0.0 2.3 2.7 3.0 2.7 3.1 2.9 2.7 0.0 2.0 0.0 2.4 2.3 2.0 2.0 0.8 1.9 1.4 2.5 Número de Diversidad especies (H’log2) Cuadro 6. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la infauna con la draga Karling. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 187 VII TALUD VI Estación 3 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 Cuadro 6. Continúa 775 1220 1500 840 1105 920 1180 1345 840 1230 1590 1200 745 1215 785 1080 1425 980 1170 Profundidad media (m) 5.8 3.7 2.8 5.9 4.1 5.3 3.7 3.0 5.6 3.7 2.8 3.5 6.2 3.6 5.6 3.9 3.0 5.2 3.6 0.21 1.74 0.17 0.50 0.29 0.73 1.28 0.22 1.40 1.43 0.87 0.77 0.82 0.15 0.18 1.04 0.13 0.08 Tempera- Oxígeno tura (°C) (ml/l) 19.90 14.67 13.36 15.58 10.66 12.21 14.41 14.52 10.90 13.06 11.58 14.41 17.42 8.55 17.47 13.97 10.55 13.12 12.56 Materia orgánica (%) 98.8 91.8 92.7 98.8 93.6 99.8 99.6 99.7 97.3 99.5 97.8 99.6 60.3 93.7 100.0 99.9 88.4 100.0 100.0 Lodo (%) 1.2 8.2 7.3 1.2 6.4 0.2 0.4 0.3 2.7 0.5 2.2 0.4 1.0 4.6 0.0 0.1 10.4 0.0 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 38.7 1.7 0.0 0.0 1.2 0.0 0.0 Grava (%) 1.7 2.5 12.4 0.8 0.0 14.9 5.0 19.8 10.7 8.3 14.9 13.2 0.8 33.9 23.1 3.3 23.1 4.1 8.3 Densidad (ind/m2) 2 3 10 1 0 7 6 13 7 6 11 11 1 13 1 3 14 4 8 1.0 1.0 3.2 0.0 0.0 2.0 2.5 3.5 2.6 2.3 3.2 3.3 0.0 2.5 0.0 1.5 3.3 1.9 2.9 Número de Diversidad especies (H’log2) 188 Biodiversidad y comunidades del talud continental del Pacífico mexicano TALUD Estación 25 26 27 32b 33b 34b Cuadro 6. Continúa 4.7 3.6 2.7 5.9 3.6 3.0 815 1200 1550 865 1270 1510 0.04 0.35 1.39 0.10 0.60 0.78 Tempera- Oxígeno tura (°C) (ml/l) Profundidad media (m) 12.21 13.42 14.76 14.74 15.87 15.36 Materia orgánica (%) 99.7 97.6 100.0 100.0 99.8 100.0 Lodo (%) 0.3 2.4 0.0 0.0 0.2 0.0 Arena (%) 0.0 0.0 0.0 0.0 0.0 0.0 Grava (%) 23.1 6.6 33.9 0.8 29.8 31.4 Densidad (ind/m2) 4 6 15 1 22 10 0.9 2.4 3.0 0.0 4.2 2.2 Número de Diversidad especies (H’log2) Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 189 TALUD VI TALUD VII 3 4 5 11 12 18 19 20 25 26 27 34 3 4 11 12 13b 18 19 25 26 27 32b Exogone lourei 0.8 0.8 0.8 Nereididae Ceratocephale 23.1 pacifica Nereididae 0.8 indeterminados Goniadidae Goniada 0.8 1.7 brunnea Amphinomidae Pseudeurythoe 1.7 ambigua Onuphidae Onuphis 0.8 0.8 19.0 1.7 1.7 0.8 0.8 iridescens Onuphis 1.7 profundi Eunicidae Eunice 0.8 megabranchia Lumbrineridae Eranno bicirrata 0.8 0.8 Ninoe foliosa 0.8 Ninoe fuscoides 0.8 Especies Cuadro 5. Continúa. 0.8 0.8 2.5 0.8 33b 34b 190 Biodiversidad y comunidades del talud continental del Pacífico mexicano Ninoe longibranchia Lumbrineridae indeterminados Arabellidae Drilonereis falcata Sternaspidae Sternaspis fossor Flabelligeridae Brada pluribranchiata Ilyphagus ilyvestis Pherusa abyssalis Fauveliopsidae Fauveliopsis rugosa Ampharetidae Ampharete arctica Melinna exilia Especies 5 0.8 0.8 3 4 TALUD VI Cuadro 5. Continúa. 1.7 0.8 2.5 2.5 0.0 0.8 1.7 1.7 2.5 2.5 0.8 0.8 0.8 26 27 34 3 4 1.7 0.8 25 1.7 11 12 18 19 20 0.8 1.7 2.5 0.8 19.0 1.7 11 12 13b 18 19 25 TALUD VII 0.8 0.8 1.7 0.8 0.8 0.8 26 27 32b 33b 34b 0.8 Cuadro 7. Índices de correlación de Pearson entre las variables abióticas y bióticas calculados con los datos de la comunidad de poliquetos del sedimento (***) p<0.001; (**) p<0.01; NS= no significativo). Variables Profundidad Temperatura Oxígeno Materia orgánica Lodo Arena Grava Densidad NS ** -0.160 NS NS NS NS NS Número de especies *** 0.297 *** -0.441 *** 0.327 ** -0.168 ** 0.219 ** -0.170 ** -0.186 Diversidad *** 0.476 *** -0.594 *** 0.472 ** -0.194 *** 0.253 ** -0.172 *** -0.256 tribución batimétrica para Eumida sanguinea (2000 a 2100 m), Steggoa gracilior (1244 m), Halosydna johnsoni (1160 a 1230 m), Ancistrosyllis hartmanae (1500 a 2040 m), Pseudeurythoe ambigua (890 a 2140 m) y Melinnampharete gracilis (700-1500 m) (Méndez 2006, 2009). Con el fin de facilitar futuros estudios taxonómicos, se describieron los tubos o estructuras de protección de Maldane cristata, Anchinothria fissurata, Eunice megabranchia, Paramage scutata, Ampharete acutifrons, Amphicteis scaphobranchiata, Egamella quadribranchiata, Melinna exilia y Mexamage corrugata, los cuales no habían sido descritos con anterioridad, así como los de Phyllochaetopterus limicolus, Fauveliopsis rugosa, Ampharete arctica, Melinnampharete gracilis y Schistocomus hiltoni, cuya descripción actual complementa la información mencionada previamente por otros autores (Cuadro 3). Estas descripciones se basan en la consistencia del tubo (generalmente consisten de una capa hialina a la cual se agregan partículas de lodo o arena), en el diámetro externo, en la longitud, a la proporción del animal con respecto a la longitud del tubo expresado en números fragmentarios (por ejemplo, el animal ocupa 1/6 parte del tubo), así como en la presencia de otras estructuras que sirven de protección al gusano, tales como esponjas o tubos hialinos muy duros (Figs. 2, 4 y 5). Los ejemplares de F. rugosa se encontraron en conchas de los escafópodos Cadulus (Gadila) fusiformis Pilsbry y Sharp, 1898 (Fig. 3a), Rhabdus dalli (Pilsbry y Sharp, 1897) (Fig. 3b), Fissidentalium megathyris (Dall, 1890) (Fig. 3c) y Dentalium agassizi Pilsbry y Sharp, 1897 (Fig. 3d), así como en foraminíferos, probablemente del género Bathysiphon (Sergio Salazar-Vallejo, com. pers.) (Fig. 3e). Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 191 Figura 2. Tubos y otras estructuras protectoras de a) Phyllochaetopterus limicolus, b) Maldane cristata, c) Anchinothria fissurata, d) Eunice megabranchia (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos b-d tomadas por Beatriz Yáñez Rivera). a b c d 192 Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 3. Conchas de los escafópodos y formainíferos en los que se encontraron especímenes de Fauveliopsis rugosa. A) Cadulus (Gadila) fusiformis, b) Rhabdus dalli, c) Fissidentalium megathyris, d) Dentalium agassizi y e) foraminíferos. Escalas 0.5 cm; las flechas señalan a los gusanos. Fotos tomadas por Beatriz Yáñez Rivera). a b d c e Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 193 Figura 4. Tubos de los anfarétidos a) Ampharete acutifrons, b) Ampharete arctica, c) Amphicteis scaphobranchia, d) Egamella quadribranchiata, e) Melinna exilia (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos tomadas por Beatriz Yáñez Rivera). a d 194 b c e Biodiversidad y comunidades del talud continental del Pacífico mexicano Figura 5. Tubos de los anfarétidos a) Melinnampharete gracilis, b) Mexamage corrugata, c) Paramage scutata, d) Schistocomus hiltoni (las escalas equivalen a 0.5 cm; las flechas señalan a los gusanos; fotos tomadas por Beatriz Yáñez Rivera). a b c d Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 195 Comunidad de poliquetos de la infauna recolectados con la draga Karling Las familias mejor representadas en la comunidad de poliquetos de la infauna, en términos de número de especies dentro del área de estudio, fueron Maldanidae (11 taxa, de los cuales nueve no pudieron ser identificados a nivel de especie), Cirratulidae (cinco especies y dos géneros), Ampharetidae (seis especies y un taxón indeterminado) y Lumbrineridae (cinco especies y un taxón indeterminado) (Cuadros 4 y 5). De acuerdo con la dominancia (Dm ≥ 1 %) y la frecuencia (F ≥ 15 %), 26 taxa resultaron ser los más representativos a lo largo del área de estudio durante los cuatro cruceros: Ampharetidae indeterminados, Ampharete arctica, Aphelochaeta multifilis, Brada pluribranchiata, Califia calida, Ceratocephale pacifica, Chaetozone setosa, Exogone lourei, Fauveliopsis rugosa, Lumbrineridae indeterminados, Maldanidae indeterminados, Maldane cristata, Mexamage corrugata, Melinna exilia, Melinnampharete gracilis, Maldanidae sp. 1, Maldanidae sp. 3, Nereididae indeterminados, Neoheteromastus lineus, Onuphis iridescens, Phyllochaetopterus limicolus, Sternaspis fossor, Thelepus hamatus, Terebellides stroemi, Tharyx sp. y Monticellina tesselata. Los valores de las variables abióticas (profundidad, temperatura, concentración de oxígeno disuelto, contenido de materia orgánica en el sedimento y porcentaje de lodo, de arena y de grava) y de las variables bióticas (densidad, número de especies y diversidad) registrados en las estaciones de muestreo donde se recolectaron poliquetos de la infauna se presentan en el cuadro 6. Los valores del índice de correlación de Pearson indicaron que la profundidad, la temperatura y el oxígeno disuelto fueron las principales variables abióticas responsables del número de especies y de los valores de diversidad de la comunidad de poliquetos de la infauna, mientras que la densidad sólo estuvo significativamente relacionada (negativamente) con la temperatura. El contenido de materia orgánica en el sedimento presentó también una correlación significativa, pero menor que las otras variables, con el número de especies y la diversidad. Los porcentajes de lodo y grava, en términos generales, presentaron una mayor correlación con la diversidad (Cuadro 7). La distribución de las 26 especies dominantes y frecuentes pertenecientes a la comunidad de la infauna, de acuerdo con las variables bióticas obtenidas en el análisis de correspondencias canónicas, indicaron que 34.6 % de la varianza está explicado por el primer eje canónico y 22.1 % por el segundo. La representación espacial de estas especies en relación con las variables abióticas (esquema no mostrado aquí) indicaron que la profundidad fue la variable que más influye en la distribución de los 196 Biodiversidad y comunidades del talud continental del Pacífico mexicano poliquetos; sin embargo, esta distribución estuvo también fuertemente influenciada por el oxígeno disuelto y la temperatura. En cambio, la materia orgánica y la composición granulométrica del sedimento fueron menos importantes (Méndez 2007). Este esquema, sin embargo, sugiere que las especies no dependen exclusivamente de una de las variables abióticas, ya que se localizan un tanto conglomeradas en el gráfico, lo que sugiere que su distribución en el golfo de California suroriental está dada por la combinación de la profundidad, el oxígeno y la temperatura, principalmente. Comunidad de poliquetos de la epifauna recolectados con el trineo bentónico Las familias mejor representadas en la superficie del sustrato, en términos de número de taxa dentro del área de estudio fueron Ampharetidae (10 taxa, de los cuales se identificaron ocho especies y dos géneros), Maldanidae (seis taxa, de los cuales únicamente se pudo identificar una especie) y Phyllodocidae (cinco taxa con tres especies, un género y un taxón indeterminado) (Cuadros 8 y 9) El cuadro 10 incluye los resultados del análisis de las variables bióticas (densidad, número de especies, diversidad) y de las variables abióticas (profundidad, temperatura, concentración de oxígeno disuelto, contenido de materia orgánica en el sedimento y porcentaje de lodo, de arena y de grava), registrados en las estaciones de muestreo donde se recolectaron poliquetos de la epifauna. En el caso de las estaciones 13 y 14 (TALUD IV) y 11 (TALUD V), no se registraron los valores de las variables abióticas debido a problemas de tipo logístico. El anfarétido Melinnampharete gracilis presentó una abundancia extrema (alrededor de 16,000 individuos en un solo arrastre con el trineo bentónico, equivalente a 4.16 ind m-2; Fig. 5a) en la estación 25 del TALUD IV (Méndez 2009), lo que ocasionó un sesgo considerable en los valores de dominancia de las demás especies, ya que se vieron tan reducidos que únicamente resultaban dos especies dominantes. Por este motivo, en el caso de la comunidad que vive en la superficie del sustrato, esta especie fue eliminada de los análisis de dominancia, frecuencia y análisis de correspondencias canónicas. Asimismo, el límite inferior de la frecuencia fue considerado como mayor o igual a 10 %, debido a que utilizando el 15 %, como recomienda Glémarec (1964), únicamente resultaban siete taxa dominantes y frecuentes, con los cuales la interpretación de los resultados del análisis de correspondencias canónicas habría sido dudosa. Así, los 11 taxa más representativos Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 197 198 Biodiversidad y comunidades del talud continental del Pacífico mexicano 0.0076 0.0022 25 0.0003 33 0.0046 34 Polynoidae Aphrodita parva Aphroditidae 0.0003 0.0005 0.0011 20 0.0003 14 Eumida sp 13 Talud IV Steggoa gracilior Eumida sanguinea Phyllodocidae Maldanidae indeterminados Maldanidae sp 4 Maldanidae sp 1 Maldane cristata Maldanidae Neoheteromastus lineus Capitellidae Cirratulus cf sinincolens Cirratulidae Spionidae sp Spionidae Especies 0.0003 35 11 0.0005 18 0.0003 25 0.0008 0.0005 0.0003 0.0081 0.0035 3 TALUD V Cuadro 8. Densidad estimada (ind/m2) de poliquetos de la epifauna recolectados con el trineo bentónico durante los cruceros TALUD IV y V. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 199 Fauveliopsidae Brada pluribranchiata Flabelligeridae Sternaspis fossor Sternaspidae Lumbrineridae indeterminados Ninoe fuscoides Lumbrineridae Eunice megabranchia Eunicidae Nothria abyssalis Anchinothria fissurata Onuphidae "Pareurythoe" sp Amphinomidae Nereis anoculopsis Nereididae Polynoidae sp 3 Polynoidae sp 1 Especies Cuadro 8. Continúa. 13 Talud IV 0.0027 14 20 25 0.0003 0.0005 0.0008 0.0003 0.0003 33 34 0.0003 0.0062 0.0003 35 0.0124 0.0003 3 TALUD V 11 0.0003 0.0003 18 25 200 Biodiversidad y comunidades del talud continental del Pacífico mexicano 25 33 34 35 Serpulidae indeterminados Serpulidae Sabellidae indeterminados Sabellidae Thelepus setosus Thelepus hamatus Terebellidae Schistocomus hiltoni Samytha n sp? Melinnampharete gracilis Melinna exilia 0.0003 0.0097 0.0003 0.0095 Ampharete arctica Egamella quadribranchiata 4.1684 0.0057 Ampharete acutifrons Ampharetidae 0.0805 3 20 13 14 TALUD V Talud IV Fauveliopsis rugosa ESPECIES Cuadro 8. Continúa. 11 0.0008 0.0005 0.0038 0.0259 0.0003 0.0003 0.0005 18 0.0011 25 Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 201 Orbiniidae Califia calida Chaetopteridae Phyllochaetopterus limicolus Cirratulidae Aphelocheta multifilis Cirratulus sinincolens Maldanidae Maldane cristata Maldanidae sp 5 Maldanidae sp 8 Maldanidae indeterminados Phyllodocidae Paranaitis polynoides Phyllodocidae indeterminados Aphroditidae Aphrodita parva Especies 0.0005 3 TALUD VI 0.0005 18 0.0003 11 13b 18 0.0003 0.0003 0.0297 0.0003 0.0019 0.0003 0.0003 4 0.0008 0.0005 3 0.0008 0.0005 34 0.0070 25 TALUD VII 25 0.0003 0.0019 32b Cuadro 9. Densidad estimada (ind/m2) de poliquetos de la epifauna recolectados con el trineo bentónico durante los cruceros TALUD VI y VII. 202 Biodiversidad y comunidades del talud continental del Pacífico mexicano Laetmonice pellucida Amphinomidae Pseudeurythoe ambigua Onuphidae Nothria abyssalis Eunicidae Eunice megabranchia Lumbrineridae Lumbrineridae indeterminados Arabellidae Drilonereis falcata Flabelligeridae Brada pluribranchiata Fauveliopsidae Fauveliopsis rugosa Ampharetidae Amage sp ? Amphicteis scaphobranchia Melinna exilia Especies Cuadro 9. Continúa. 3 TALUD VI 18 0.0108 0.0014 0.0005 0.0003 0.0003 25 0.0005 0.0141 0.0003 34 0.0011 3 4 TALUD VII 0.0003 11 13b 0.0003 0.0003 0.0003 0.0011 0.0003 18 0.0035 25 32b Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 203 Melinnampharete gracilis Paramage scutata Schistocomus hiltoni Terebellidae Thelepus hamatus Thelepus setosus Thelepus sp Streblosoma crassibranchia Sabellidae Chone gracilis Pseudopotamilla intermedia Especies Cuadro 9. Continúa. TALUD VI 3 18 0.0003 25 0.0003 0.0003 0.0057 34 3 4 TALUD VII 0.0003 0.0003 11 13b 0.0003 0.0030 18 0.0003 0.0003 0.0003 25 0.1508 32b 204 Biodiversidad y comunidades del talud continental del Pacífico mexicano VII VI V IV TALUD Estación 13 14 20 25 33 34 35 3 11 18 25 3 18 25 34 3 4 11 13b 18 Profundidad media (m) 1510 789 1075 1220 2050 732 965 830 775 920 840 1200 745 1215 785 1425 980 Temperatura (°C) 3.1 5.1 4.3 3.5 2.5 5.5 5.0 5.2 5.8 5.3 5.6 3.5 6.2 3.6 5.6 3.0 5.2 Oxígeno (ml/l) 1.26 0.29 0.51 0.79 1.68 0.12 0.15 0.13 0.21 0.29 0.22 0.87 0.77 0.82 0.15 1.04 0.13 Materia orgánica (%) 15.47 9.86 13.86 8.26 10.27 17.23 13.74 10.87 19.90 12.21 10.90 14.41 17.42 8.55 17.47 10.55 13.12 Lodo (%) 98.1 99.1 99.9 20.6 93.5 100.0 100.0 98.1 98.8 99.8 97.3 99.6 60.3 93.7 100.0 88.4 100.0 Arena (%) 1.9 0.9 0.1 79.4 6.5 0.0 0.0 1.5 1.2 0.2 2.7 0.4 1.0 4.6 0.0 10.4 0.0 Grava (%) 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.4 0.0 0.0 0.0 0.0 38.7 1.7 0.0 1.2 0.0 Densidad (ind/m2) 0.0000 0.0027 0.0016 4.2662 0.0005 0.0054 0.0262 0.0211 0.0357 0.0024 0.0016 0.0005 0.0005 0.0519 0.0216 0.0016 0.0000 0.0011 0.0003 0.0086 Número de especies 0 1 2 9 2 4 6 4 7 6 3 1 1 12 7 2 0 4 1 11 Diversidad (H’log2) 0.0 0.0 0.9 0.2 1.0 0.8 1.8 1.1 1.4 2.5 1.3 0.0 0.0 1.9 1.4 0.9 0.0 2.0 0.0 2.8 Cuadro 10. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la epifauna con el trineo bentónico. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 205 TALUD Profundidad Estación media (m) 25 815 32b 865 Temperatura (°C) 4.7 5.9 Oxígeno (ml/l) 0.04 0.10 Materia orgánica (%) 12.21 14.74 Lodo (%) 99.7 100.0 Arena (%) 0.3 0.0 Grava (%) 0.0 0.0 Densidad (ind/m2) 0.1549 0.0022 Número de especies 4 2 Diversidad (H’log2) 0.2 0.5 Tabla 10. Variables abióticas y bióticas registradas durante el muestreo de los poliquetos de la epifauna con el trineo bentónico. Cuadro 11. Índices de correlación de Pearson entre las variables abióticas y bióticas calculados en la comunidad de poliquetos de superficie (***) p<0.001; (**) p<0.01; NS= no significativo). Variables Profundidad Temperatura Oxígeno Materia orgánica Lodo Arena Grava Densidad ** -0.203 *** 0.246 *** -0.258 ** -0.149 NS NS NS Número de especies *** - 0.290 *** 0.443 *** - 0.347 *** -0.257 NS NS NS Diversidad *** - 0.261 *** 0.427 *** 0.333 NS NS NS NS a lo largo del área de estudio durante los cuatro cruceros fueron: Ampharetidae indeterminados, Ampharete arctica, Aphrodita parva, Brada pluribranchiata, Califia calida, Cirratulus sinincolens, Cirratulus cf. sinincolens Fauveliopsis rugosa, Maldane cristata, Melinna exilia, Nothria abyssalis y Schistocomus hiltoni. Los análisis de correlación de Pearson indicaron que la densidad, el número de especies y la diversidad presentaron una correlación significativa negativa con la profundidad y positiva con la temperatura. El oxígeno disuelto y la materia orgánica se correlacionaron significativamente con la densidad y el número de especies de manera inversa y únicamente el oxígeno se correlacionó positivamente con la diversidad (Cuadro 11). Las correlaciones de los diferentes porcentajes de tamaño de grano con las variables bióticas resultaron no significativas. En el caso de las especies de la epifauna, los resultados del análisis de correspondencias canónicas indicaron que el primer factor extrajo 22 % de la varianza, mientras que el segundo 19.7 %. La distribución espacial de las 11 especies dominantes y frecuentes de acuerdo con las variables abióticas indicó que las variables más importantes que influyen sobre la distribución de los poliquetos epibentónicos son el oxígeno disuelto, la temperatura y la profundidad, mientras que la materia orgánica es menos importante. La representación espacial de estas especies en relación con las variables abióticas (esquema no mostrado aquí) sugiere asociaciones de ciertas especies con algunas de las variables ambientales, tales como C. calida con valores altos de temperatura, A. arctica y N. abyssalis con valores máximos de oxígeno, y B. pluribranchiata y C. cf. sinnincolens con valores altos de materia orgánica (Méndez, datos no publicados). 206 Biodiversidad y comunidades del talud continental del Pacífico mexicano DISCUSIÓN Fauna Todas las especies recolectadas en el golfo de California suroriental habían sido registradas previamente en aguas profundas con excepción de dos: Halosydna johnsoni (Hartman 1939a, 1968, Berkeley y Berkeley 1939, 1941, Rioja 1962, Kudenov 1975a), y Ancistrosyllis hartmanae (Pettibone 1966; Fiege y Bögemann 1999), las cuales habían sido encontradas únicamente en aguas someras. Además, se consiguió el primer registro para las aguas del golfo de California y áreas adyacentes (Méndez 2006). La familia Ampharetidae fue la mejor representada en términos de número de taxa en las dos comunidades de poliquetos estudiadas. Desde hace tiempo, se sabe que la densidad de los anfarétidos aumenta con la profundidad y que la familia es dominante en sedimentos abisales (Day 1967, Fauchald y Jumars 1979, Hernández-Alcántara y Solís-Weiss 1993). Por su parte, Fauchald y Jumars (1979) demostraron que algunos poliquetos de mar profundo construyen tubos de ventilación para soportar las condiciones hipóxicas y que los anfarétidos construyen tubos continuamente, lo que puede representar una forma eficiente de locomoción. Muchos de los tubos de anfarétidos recolectados eran largos (más de 30 cm de longitud), anchos (más de 1 cm de diámetro) y robustos (Cuadro 3; Figs. 4 y 5), lo que explica el éxito de esta familia en el área de estudio. Además, los miembros de esta familia son consumidores de depósito, lo que favorece su presencia sobre o dentro del sedimento de este ambiente con altos contenidos de materia orgánica (Fauchald y Jumars 1979). Los maldánidos también estuvieron bien representados en términos de número de taxa, tanto de la epifauna como de la infauna. De acuerdo con Fauchald y Jumars (1979) y Gambi y Giangrande (1985), muchos maldánidos son tubícolas y están generalmente representados por consumidores de depósito de sub-superficie. Los altos contenidos de materia orgánica en el sedimento, así como la dominancia de lodo compacto explican el éxito de los miembros de la familia en este ambiente. La familia Cirratulidae estuvo mejor representada en la comunidad de poliquetos de la infauna. Los miembros de esta familia están catalogados como consumidores de depósito y generalmente son considerados como gusanos no selectivos (Fauchald y Jumars 1979, Gambi y Giangrande 1985). Los cirratúlidos (Levin et al. 2000) y en especial muchas especies del género Tharyx (Jumars 1975), están Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 207 considerados como uno de los taxa de la macrofauna más abundantes en el mar profundo y este estudio no fue la excepción. La familia Phyllodocidae, cuyas especies son consideradas, en su mayoría, como carnívoras que cazan las presas con la faringe muscular (Fauchald y Jumars 1979) estuvo mejor representada en la epifauna. Gambi y Giangrande (1985) clasificaron esta familia dentro del grupo de los carnívoros, móviles, con faringe sin mandíbulas o estructuras duras, lo que explica su mayor éxito en la superficie del sedimento. Sin embargo, algunos géneros como Eteone pueden ser, además, detritívoros, lo que explica la presencia de Eteone sp. únicamente en la infauna. El hábito de alimentación de depósito tanto de superficie como de sub-superficie parece ser muy importante para las especies habitantes de las zonas batiales y abisales (Fauchald y Jumars 1979). Este es el caso de las especies dominantes y frecuentes pertenecientes a las familias tubícolas Chaetopteridae, Capitellidae y Terebellidae y las no tubícolas Orbiniidae, Flabelligeridae, Syllidae y Sternaspidae. Pocas especies pertenecientes a las familias predominantemente carnívoras (Lumbrineridae) y omnívoras (Nereididae y Onuphidae) fueron también dominantes y frecuentes; éstas probablemente no compiten por alimento con los detritívoros, permitiendo el equilibrio en los fondos marinos profundos. Las especies que resultaron dominantes y frecuentes, tanto en las muestras de la epifauna como en la infauna, pueden ser consideradas como las más representativas de la zona de estudio. Estas fueron el orbínido Califia calida, el maldánido Maldane cristata, el flabeligérido Brada pluribranchiata, el fauveliópsido Fauveliopsis rugosa y los anfarétidos Ampharete arctica, Melinna exilia y Melinnampharete gracilis. El orbínido Califia calida (Fig. 6a) vive en la plataforma continental hasta profundidades abisales, cerca de la isla de San Pedro en Baja California (Fauchald 1972). Hartman (1957) la registró, por primera vez, en la cuenca de San Pedro, en el sur de California, entre 480 y 764.4 m de profundidad, en lodo verdoso. Posteriormente, Hartman, (1969) la encontró en la cuenca de San Pedro y en alta mar, en la plataforma continental profunda y en profundidades abisales, asociada con limo y esponjas silíceas. El maldánido Maldane cristata (Figs. 2b, 6b) ha sido encontrado en lodo en el sur de California y oeste de México, desde la plataforma continental, hasta cañones submarinos (Hartman 1969). Fauchald (1972) lo registró en aguas profundas del sur de California y de Baja California, y también ha sido recolectado en aguas profundas frente a Panamá, en la trinchera de Centroamérica. 208 Biodiversidad y comunidades del talud continental del Pacífico mexicano El flabeligérido Brada pluribranchiata (Fig. 6c) se distribuye en el sur de California, en plataformas y cañones profundos, de 123 a 1400 m, en arenas negras y lodo (Hartman 1969). El fauveliópsido Fauveliopsis rugosa (Fig. 6d) se ha registrado en la isla de Cedros y en cabo Falso, Baja California y frente a las islas Tres Marías (Fauchald 1972). Los ejemplares recolectados en este estudio fueron encontrados dentro de conchas de escafópodos (Figs 3a-d) y en foraminíferos (Fig. 3e). El anfarétido Ampharete arctica (Figs. 4b y 6e) vive en sedimentos mixtos desde la plataforma continental hasta profundidades abisales y se ha considerado como una especie cosmopolita (Hartman 1969, Fauchald 1972). El anfafrétido Melinna exilia (Figs. 4e, 6f) había sido registrado únicamente en una localidad de la cuenca de Guaymas, en el golfo de California (Fauchald 1972). El anfarétido Melinnampharete gracilis (Figs. 5a y 6g) se ha registrado en la cuenca de Santa Cruz a 1846 m, en lodo (Hartman 1969), y en aguas profundas a ambos lados de la península de Baja California (Fauchald 1972). De acuerdo con Salazar-Vallejo y Londoño-Mesa (2004), M. gracilis es la única especie del género Melinnampharete conocida en el Pacífico oriental tropical. Comunidades de poliquetos de la infauna y de la epifauna Los valores de densidad de organismos registrados en la epifauna difirieron, considerablemente, de los obtenidos para la infauna. El trineo bentónico está diseñado para recolectar organismos de la epifauna y algunos poliquetos, especialmente los tubícolas, pueden ser atrapados por este aparato debido a que cuando se encuentran en posición vertical dentro del sustrato, una porción del tubo de unos 2 cm sobresale del sedimento. La naturaleza lodosa del sustrato en la mayoría de las estaciones muestreadas provocó que el trineo se hundiera un poco en el sedimento, favoreciendo la captura únicamente de los tubos que sobresalían. Este hecho, aunado a que la malla interna de la red mide 2.5 cm, tuvo como consecuencia que el trineo haya recolectado menor número de especies que la draga Karling, ya que únicamente fueron atrapados los ejemplares de mayor tamaño o los gusanos pequeños que estaban asociados a otros organismos o sustratos capturados durante el arrastre. Además, no hay que descartar la posibilidad de que varios especímenes se pudieron perder durante el ascenso del trineo en la columna de agua. Estos son los motivos principales de que las densidades registradas en el trineo hayan resultado considerablemente menores que las de la draga Karling. Sin embargo, el Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 209 número de individuos registrados en cada lance fue considerablemente mayor en el trineo que en la draga debido, principalmente, a que el área barrida por el trineo es muchísimo mayor que la de la draga Karling, además de que esta última, una vez llena, no recolecta más sedimento (ver Hendrickx 2012). Relación con el ambiente Los resultados obtenidos en este estudio demostraron que las comunidades de poliquetos de la epifauna y de la infauna del golfo de California suroriental dependen, fuertemente, de la combinación del efecto de la profundidad, la concentración de oxígeno disuelto y la temperatura. Estudios previos realizados en el mar profundo con diferentes grupos de la macrofauna bentónica han demostrado que la profundidad, el oxígeno y la materia orgánica influyen fuertemente sobre la diversidad Figura 6. Especies más representativas de la zona de estudio por su dominancia y frecuencia. a) Califia calida, b) Maldane cristata, c) Brada pluribranchiata, d) Fauveliopsis rugosa, e) Ampharete arctica, f) Melinna exilia, g) Melinnampharete gracilis (a, según Taylor 1984; b según Hartman 1969; d-g, según Fauchald 1972; a, b, e, f, g, región anterior; c, d, animal completo). A C B F E 210 G Biodiversidad y comunidades del talud continental del Pacífico mexicano D del macrobentos (Levin y Gage 1998), siendo la profundidad uno de los factores que más afectan la distribución de la macrofauna (Jumars 1976, Grassle 1989), como se demostró en los análisis de correlación y de correspondencias canónicas de las dos comunidades estudiadas. Sin embargo, la diversidad de la macrofauna bentónica de mar profundo en función de la profundidad aparentemente es más evidente en otros grupos pertenecientes a la macrofauna bentónica (moluscos y crustáceos) como lo han demostrado Levin et al. (2000) en el noroeste del mar Arábigo y Levin et al. (2001) en el Atlántico norte. Estos autores encontraron que diversos grupos pertenecientes a la macrofauna bentónica, como los poliquetos, oligoquetos, moluscos y algunos foraminíferos grandes, dependen de la posición batimétrica de la zona del mínimo de oxígeno. Asimismo, Hendrickx (2003a, b) indicó la fuerte dependencia de las comunidades de camarones pandálidos y de la cigala del Pacífico Nephropsis occidentalis en ambientes con hipoxia, localizados entre los 1000 y 1500 m de profundidad en esta misma zona de estudio. Hendrickx (2001) propuso que las estaciones de muestreo con concentración de oxígeno superiores a 2.0 ml l-1 (en profundidades mayores a 2000 m) estaban habitadas por muy pocas especies de decápodos que fueron recolectados con el trineo bentónico. Lo mismo ocurrió con los poliquetos de la epifauna, donde se observó una correlación negativa entre el número de especies y el oxígeno. Asimismo, Levin (2003) observó un decremento fuerte en la densidad de la macrofauna en el estrato de menor concentración de oxígeno. Lo mismo ocurrió con la densidad de poliquetos de la epifauna, la cual presentó una correlación negativa con el oxígeno. En cambio, en el caso de los poliquetos de la infauna, se encontró un mayor número de especies y mayor diversidad debido, probablemente, a que en esta comunidad se encontraron especies pertenecientes a familias con todos los hábitos alimenticios registrados para el grupo de poliquetos (Fauchald y Jumars 1979, Gambi y Giangrande 1985). Este patrón también fue observado en otras regiones del mundo como el margen occidental de África (Sanders 1969), el Pacífico oriental en México (Levin et al. 1991), el noroeste del mar Arábigo (Levin et al. 1997, 2000) y en los márgenes de Perú y Chile (Levin et al. 2002). Los poliquetos constituyen el taxón más tolerante a concentraciones bajas de oxígeno disuelto (Diaz y Rosenberg 1995) y, por lo tanto, son dominantes en las zonas del mínimo de oxígeno (Levin 2001, 2003). Sin embargo, la distribución observada de los poliquetos en relación con el oxígeno en la zona de estudio indica que es difícil distinguir la importancia del estrés producido por el mínimo de oxígeno en la determinación de los cambios de densidad, riqueza específica y diversidad. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 211 La ausencia de patrones claros de la densidad, riqueza específica y diversidad de los poliquetos en función de las diferentes concentraciones de oxígeno fue también observada en las comunidades de moluscos de la misma zona de estudio por Zamorano et al. (2007). Por otro lado, Narayanaswamy et al. (2003, 2005) mencionaron la importancia de la temperatura en la distribución de los poliquetos de mar profundo del Atlántico nororiental. Esto concuerda con los resultados de este estudio, ya que se observó una fuerte dependencia de las especies de poliquetos en relación con la temperatura. Sin embargo, el patrón observado entre la comunidad de la epifauna y la de la infauna es inverso. En el caso de esta última comunidad, se observó una correlación negativa y, tras un análisis minucioso, se llegó a la conclusión de que el intervalo preferido para los poliquetos de la infauna es de 2.5 a 4°C (Méndez 2007). Por el contrario, se observó una correlación significativa de la temperatura con la comunidad de la epifauna, pero positiva. Esta discrepancia en ambas comunidades apoya la idea de que la distribución de los poliquetos en esta área no está afectada directamente por una variable ambiental, sino por la combinación de la profundidad, la concentración de oxígeno y la temperatura, las cuales están fuertemente correlacionadas entre sí, como lo han sugerido Wishner et al. (1995) para comunidades pelágicas y bentónicas en una montaña submarina frente a Acapulco. El contenido de materia orgánica en el sedimento ha sido considerado como otro factor importante en la distribución de los poliquetos de mar profundo. Cook et al. (2000) y Gooday et al. (2000, 2001) concluyeron que los poliquetos frecuentemente han demostrado tendencias paralelas a lo largo de gradientes de oxígeno y la materia orgánica. Esto coincide con los valores de densidad y con el número de especies de la comunidad de la epifauna en relación con la materia orgánica (Cuadro 11); sin embargo, en el caso de la comunidad de la infauana, la correlación entre estas dos variables resultó no significativa (Cuadro 7) debido, probablemente, a que el contenido de materia orgánica fue siempre alto y homogéneo en toda el área de estudio. Esto sugiere que en el golfo de California suroriental, para ambas comunidades de poliquetos de aguas profundas, la materia orgánica no es un factor limitante en comparación con las demás variables. La importancia de la materia orgánica ha sido también establecida para la riqueza específica y la diversidad, como fue observado por Levin y Gage (1998) en el Atlántico norte, el Pacífico oriental y el océano Índico, donde el carbono orgánico resultó influir fuertemente en la diversidad de poliquetos. Levin et al. (1994) observaron una reducción de la diversidad en los sitios más enriquecidos de fondos 212 Biodiversidad y comunidades del talud continental del Pacífico mexicano batiales de Carolina del norte y en una montaña submarina frente a Acapulco, como ocurre aquí en ambas comunidades de poliquetos, en las que la diversidad y la materia orgánica mostraron una correlación inversa. En relación con el número de especies, de acuerdo con Levin y Gage (1998) los niveles elevados de materia orgánica pueden conducir a la reducción del número de especies y, por lo tanto, incrementar la dominancia, lo que explica la correlación negativa entre la riqueza específica y la materia orgánica en las dos comunidades estudiadas. De acuerdo con Jumars (1976), los organismos detritívoros de gran talla se ven favorecidos en el mar profundo donde el contenido de materia orgánica es alto. Muchas de las especies dominantes y frecuentes de ambas comunidades estudiadas pertenecen a la categoría de consumidores de depósito (Fauchald y Jumars 1979; Gambi y Giangrande 1985). Así, las cantidades elevadas de materia orgánica registradas en el golfo de California suroriental demuestran que los poliquetos no estaban limitados en cuanto al alimento, al menos durante el período de estudio. El contenido de materia orgánica está inversamente relacionado con el tamaño de grano del sedimento (Milliman 1994). Los análisis de granulometría y de materia orgánica mostraron que las características del sedimento fueron relativamente homogéneas en el golfo de California suroriental, ya que hubo una gran dominancia de lodo en la mayoría de las estaciones y la materia orgánica fue siempre elevada (de 8.26 a 18.78 %) (Cuadros 6 y 10). Por lo tanto, ambas variables, especialmente la composición granulométrica del sedimento, fueron menos importantes que las mencionadas anteriormente en lo que se refiere a patrones de distribución de los poliquetos. A diferencia de los poliquetos de aguas someras, la la composición granulométrica del sedimento no resultó ser un factor limitante en la distribución de ambas comunidades de poliquetos, especialmente los de la epifauna, cuyas correlaciones con las variables bióticas resultaron no significativas (Cuadros 7 y 11). La falta de importancia del tamaño de grano observada en este estudio está apoyada por resultados similares en el Atlántico norte, el Pacífico oriental y el océano Índico, donde los porcentajes de arena y grava fueron considerados como factores no significativos en la distribución de la macrofauna de mar profundo (Levin y Gage 1998). Por el contrario, las correlaciones significativas entre las variables bióticas de la comunidad de la infauna con las características del sedimento se explica por la fuerte asociación de algunos poliquetos con el fondo blando debida a la formación de tubos y por el hábito excavador (tamaño de grano) y por la alimentación de detritos (materia orgánica) de algunas familias (Wieser 1959, Rhoads 1974, Gray 1981). Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 213 Los resultados de este estudio indican que las comunidades de poliquetos, tanto de la infauna como de la epifauna habitantes del mar profundo del golfo de California suroriental, no se distribuyen siguiendo algún gradiente de temperatura, profundidad, oxígeno, contenido de materia orgánica o tamaño de grano de los sedimentos (Méndez 2007, Méndez, datos no publicados). Las especies no fueron encontradas en intervalos específicos de estas variables dificultando, por lo tanto, el establecimiento de patrones de distribución basados en los análisis de la fauna de poliquetos. Varios estudios de mar profundo realizados en diferentes regiones del mundo (Rosenberg et al. 1991, Etter y Grassle 1992, Diaz y Rosenberg 1995, Wishner et al. 1995, Levin y Gage 1998, Levin et al. 2000, 2001, Rex et al. 2000, Levin 2001, Hendrickx 2003a, Narayanaswamy et al. 2003, 2005) han revelado que la densidad de la macrofauna batial, la riqueza de especies y la diversidad están fuertemente influenciadas por la concentración de oxígeno disuelto y la profundidad. Sin embargo, estos estudios también indican que hay otros factores tales como la temperatura, la materia orgánica en sedimentos, el tamaño de grano, la latitud y los pigmentos del sedimento que son parámetros importantes en la distribución de la macrofauna. En conclusión, los estudios realizados dentro del proyecto TALUD han demostrado que la distribución de los poliquetos de la infauna y la epifauna de aguas profundas del golfo de California suroriental está controlada por la combinación de diversas variables ambientales, siendo la profundidad, la concentración de oxígeno disuelto y la temperatura las más sobresalientes. AGRADECIMIENTOS Este estudio fue financiado por los proyectos 31805-N de Conacyt y IN217306-3 de PAPIIT. Se agradece al Consejo Técnico de la Investigación Científica de la UNAM por otorgar el tiempo de uso del buque oceanográfico “El Puma”. Agradezco al Dr. Eduardo Peters, Director General de Ordenamiento Ecológico y Conservación de los Ecosistemas, a la Dra. Margarita Caso, Directora de Conservación de Ecosistemas y al M. en C. Pablo Zamorano, Jefe del Departamento de Ecología de Comunidades del Instituto Nacional de Ecología por la invitación a participar en la elaboración de este capítulo. La recolección de las muestras de sedimento se realizó gracias a la ayuda de la tripulación del B/O “El Puma”, así como de estudiantes y personal técnico (Arturo Toledano, José Salgado y Arturo Núñez) de la Unidad Académica Mazatlán 214 Biodiversidad y comunidades del talud continental del Pacífico mexicano del Instituto de Ciencias del Mar y Limnología, UNAM. Agradezco a Leslie Harris, Kristian Fauchald, Sergio Salazar y Luis Carrera por su ayuda en la identificación de algunos ejemplares dudosos. Arturo Toledano identificó los moluscos escafópodos. Beatriz Yáñez colaboró en la elaboración de las figuras. REFERENCIAS Berkeley, E. y C. Berkeley. 1939. On a collection of Polychaeta, chiefly from the West Coast of Mexico. The Annals and Magazine of Natural History 11(3): 321-346. Berkeley, E. y C. Berkeley. 1941. On a collection of Polychaeta from Southern California. Bulletin of the Southern California Academy of Sciences 40: 16-59. Blake, J.A. 1985. Polychaeta from the vicinity of deep-sea geothermal vents in the Eastern Pacific I: Euphrosinidae, Phyllodocidae, Hesionidae, Nereidae, Glyceridae, Dorvilleidae, Orbiniidae, and Maldanidae. Bulletin of the Biological Society of Washington 6: 67-101. Blake, J.A. 1994. Introduction to the Polychaeta. Pp 37-108. En: J.A. Blake y B. Hilbig (eds.). Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 4. Annelida Part 1. Oligochaeta and Polychaeta (Phyllodocidae to Paralacydoniidae). Santa Barbara Museum of Natural History. Blake, J.A. y B. Hilbig. 1990. Polychaeta from the vicinity of deep-sea hydrothermal vents in the Eastern Pacific II. New species and records from the Juan de Fuca and Explorer ridge systems. Pacific Science 44: 219-253. Blake, J.A. y B. Hilbig. 1994. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 4. Annelida Part 1. Oligochaeta and Polychaeta (Phyllodocidae to Paralacydoniidae). Santa Barbara Museum of Natural History. 369 pp. Blake, J.A., B. Hilbig y P.H. Scott. 1995. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 5. Annelida Part 2. Polychaeta (Phyllodocida, Amphinomida and Eunicida). Santa Barbara Museum of Natural History. 378 pp. Blake, J.A., B. Hilbig y P.H. Scott. 1996. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 6. Annelida Part 3. Polychaeta (Orbiniidae to Cossuridae). Santa Barbara Museum of Natural History. 418 pp. Blake, J.A., B. Hilbig y P.H. Scott. 2000. Taxonomic Atlas of the Santa Maria Basin and Western Santa Barbara Channel. Vol. 7. Annelida Part 4. Polychaeta (Flabelligeridae to Ampharetidae). Santa Barbara Museum of Natural History. 348 pp. Blake, J.A., J.A. Muramoto, B. Hilbig y I.P. Williams. 1992. Biological and sedimentological investigations of the sea floor at the proposed U.S. Navy Ocean disposal site. July 1991 surPoliquetos (A nnelida , Polychaeta ) del talud continental suroriental 215 vey (R/V Wecoma). Benthic biology and sediment characterization. Final Report submitted to PRC Environmental Management, Inc., Honolulu, Hawai, 130 pp., apéndice A-D. Chamberlin, R.V. 1919a. The Annelida Polychaeta. Memories of the Museum of Comparative Zoology Harvard 48: 1-514. Chamberlin, R.V. 1919b. New polychaetous annelids from Laguna Beach, California. Journal of Entomology and Zoology 11: 1-23. Clarke, K.R. y R.N. Gorley. 2006. PRIMER v6: User Manual/Tutorial. PRIMER-E, Plymouth. Cook, A.A., P.J.D. Lambshead, L.E. Hawkins, N. Mitchell y L.A. Levin. 2000. Nematode abundance at the oxygen minimum zone in the Arabian Sea. Deep-Sea Research, Part II 47: 75-85. Day, J.H. 1967. A Monograph on the Polychaeta of Southern Africa. Part I: Errantia. Part II: Sedentaria. British Museum of Natural History 656: 1-878. Dean, W.E., Jr. 1974. Determination of carbonate and organic matter in calcareous sediments and sedimentary rocks by loss of ignition: comparison with other methods. Journal of Sedimentary Petrology 44: 242-248. De León-González, J.A., J.R Bastida-Zavala, L.F. Carrera-Parra, M.E. García-Garza, A. PeñaRivera, S.I. Salazar-Vallejo, V. Solís-Weiss (comps.). 2009. Poliquetos (Annelida: Polychaeta) de México y América Tropical. Tomos I-III. Universidad Autónoma de Nuevo León, Nuevo León. 737 pp. Diaz, R.J. y R. Rosenberg. 1995. Marine benthic hypoxia: a review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: an Annual Review 33: 245-303. Etter, R.J. y J.F. Grassle. 1992. Patterns of species diversity in the deep sea as a function of sediment particle size diversity. Nature 360: 576-578. Fauchald, K. 1968. Onuphidae (Polychaeta) from Western Mexico. Allan Hancock Monographs in Marine Biology 3: 1-82. Fauchald, K. 1970. Polychaetous annelids of the families Eunicidae, Lumbrineridae, Iphitimidae, Arabellidae, Lysaretidae and Dorvilleidae from western Mexico. Allan Hancock Monographs in Marine Biology 5: 1-335. Fauchald, K. 1972. Benthic polychaetous annelids from deep water off western Mexico and adjacent areas in the Eastern Pacific Ocean. Allan Hancock Monographs in Marine Biology 7: 1-575. Fauchald, K. 1977. The polychaete worms. Definitions and keys to the orders, families and genera. Natural History Museum of Los Angeles County, and Allan Hancock Foundation. Univeristy of Southern California Science Series 8: 1-188. 216 Biodiversidad y comunidades del talud continental del Pacífico mexicano Fauchald, K. y D.R. Hancock. 1981. Deep-water polychaetes from a transect off central Oregon. Allan Hancock Monographs in Marine Biology 11: 1-73. Fauchald, K. y P.A. Jumars. 1979. The diet of worms: a study of polychaete feeding guilds. Oceanography and Marine Biology: an Annual Review 17: 193-284. Fiege, D. y M. Boggemann. 1999. Ancistrosyllis fioronii, a new species of Pilargidae from the North Sea, with a key and synoptic table of characters for all species of the genus Ancistrosyllis McIntosh 1879 (Annelida, Polychaeta, Pilargidae). Senckenbergiana Biologica 78:135-140. Field, J.G., K.R. Clarke y R.M. Warwick. 1982. A practical strategy for analysing multispecies distribution patterns. Marine Ecology Progress Series 8: 37-52. Folk, R.L. 1965. Petrology of Sedimentary Rocks. Hemphills Publications Company, Austin. 170 pp. Gambi, M.C. y A. Giangrande. 1985. Caratterizzazione e distribuzione delle catagorie trofiche dei policheti nei fondi mobili del golfo di Salerno. Oebalia 11: 223-240. Glémarec, M. 1964. Bionomie benthique de la partie orientale du golfe du Morbihan. Cahiers de Biologie Marine 5: 33-96. Grassle, J.F. 1989. Species diversity in deep-sea communities. Trends in Ecology and Evolution 4: 12-15. Gray, J.S. 1981. The Ecology of Marine Sediments. An introduction to the Structure and Function of Benthic Communities. Cambridge University Press. Cambridge. 185 pp. Gooday, A.J., J.A. Hughes y L.A. Levin. 2001. The foraminiferal macrofauna from three North Carolina (U.S.A.) slope sites with contrasting carbon flux: a comparison with the metazoan macrofauna. Deep-Sea Research, Part II 48: 1709-1739. Gooday, A.J., J.M. Bernhard, L.A. Levin y S. Suhr. 2000. Foraminifera in the Arabian Sea OMZ and other oxygen deficient settings: taxonomic composition, diversity and relation to metazoan faunas. Deep-Sea Research, Part II 47: 54-73. Harris, L.H., J.A. de León-González y S.I. Salazar-Vallejo. 2009. Morfología, métodos, clave para familias y clasificación. Pp 3-32. En: de León-González, J.A., J.R BastidaZavala, L.F. Carrera-Parra, M.E. García-Garza, A. Peña-Rivera, S.I. Salazar-Vallejo y V. Solís-Weiss (comps.). Poliquetos (Annelida:Polychaeta) de México y América Tropical. Tomo I. Universidad Autónoma de Nuevo León. Nuevo León. Hartman, 0. 1938. Descriptions of new species and new generic records of Polychaetous annelids from California of the families Glyceridae, Eunicidae, Stauronereidae, and Opheliidae. University of California. Publications in Zoology 43: 93-1 1 1. Hartman, O. 1939a. Polychaetous annelids. Part I. Aphroditidae to Pisionidae. Allan Hancock Pacific Expeditions 7: 1-156. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 217 Hartman, O. 1939b. New species of polychaetous annelids from Southern California. Allan Hancock Pacific Expeditions 7: 157-172. Hartman, O. 1944a. Polychaetous annelids. Part V. Eunicea. Allan Hancock Pacific Expeditions 10: 1-237. Hartman, O. 1944b. Polychaetous annelids from California, including the descriptions of two new genera and nine new species. Allan Hancock Pacific Expeditions 10: 239-307. Hartman, O. 1944c. Polychaetous annelids. Part. VI. Paraonidae, Magelonidae, Longosomidae, Ctenodrilidae, and Sabellariidae. Allan Hancock Pacific Expeditions 10: 311-389. Hartman, O. 1951. Literature of the polychaetous annelids. Edwards Brothers Inc. Ann Arbor, Michigan. 290 pp. Hartman, 0. 1955. Quantitative survey of the benthos of San Pedro Basin, southern California. Part. l. Preliminary Results. Allan Hancock Pacific Expeditions 19: 1-185. Hartman, O. 1957. Orbiniidae, Apistobranchidae, Paraonidae and Longosomidae. Allan Hancock Pacific Expeditions 15: 207-393. Hartman, 0. 1960. Systematic account of some marine invertebrate animals from the deep basins off southern California. Allan Hancock Pacific Expeditions 22: 69-215. Hartman, O. 1961. Polychaetous annelids from California. Allan Hancock Pacific Expeditions 25: 1-226. Hartman, O. 1963. Submarine canyons of southern California Polychaetous annelids. Allan Hancock Pacific Expeditions 27: 1-93. Hartman, O. 1966. Quantitative survey of the benthos of San Pedro Basin, Southern California. Part II. Final results and conclusions. Allan Hancock Pacific Expeditions 19: 187-456. Hartman, O. 1968. Atlas of errantiate polychaetous annelids from California. Allan Hancock Foundation. University of Southern California, Los Angeles. 828 pp. Hartman, O. 1969. Atlas of sedentariate polychaetous annelids from California. Allan Hancock Foundation. University of Southern California, Los Angeles. 812 p. Hendrickx, M.E. 2001. Occurrence of a continental slope decapod crustacean community along the edge of the minimum oxygen zone in the south eastern Gulf of California, México. Belgian Journal of Zoology 131: 95- 110. Hendrickx, M.E. 2003a. Size and abundance of deep water shrimps on the continental slope of the SE Gulf of California, México. Pp. 227- 234. En: M.E. Hendrickx (ed.), Contributions to the Study of East Pacific Crustaceans. Vol. 2. Instituto de Ciencias del Mar y Limnología, UNAM. Hendrickx, M.E. 2003b. Distribution and size of the Pacific deep water lobsterette Nephropsis occidentalis Faxon, 1893 (Decapoda, Astacidea, Nephropidae) in the Gulf of California, México. Crustaceana 76: 207-216. 218 Biodiversidad y comunidades del talud continental del Pacífico mexicano Hendrickx, M.E. 2012. Operaciones oceanográficas en aguas profundas: los retos del pasado, del presente y del proyecto TALUD en el Pacífico mexicano (1989-2009). Pp. 19-99. En: En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Hernández-Alcántara, P. 1992. Los poliquetos (Annelida: Polychaeta) de la plataforma continental del Golfo de California, México. Taxonomía, Abundancia numérica y distribución geográfica. Tesis de Maestría, Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, México D.F. 427 pp. Hernández-Alcántara, P. y V. Solís-Weiss. 1993. Distribución latitudinal y batimétrica de los anélidos poliquetos del Orden Terebellomorpha de la plataforma continental del Golfo de California, México. Cuaderno Mexicano de Zoología 1: 65-72. Hernández-Alcántara, P. y V. Solís-Weiss. 1999. Systematics and distribution of the polychaetes (Annelida: Polychaeta) from the sublittoral zone in the Gulf of California. Oceánides 13 (2), 14 (1): 25-38. Hernández-Alcántara. P. y V. Solís-Weiss. 2005. Seasonal variations of the Spionida (Palpata: Canalipalpata) in the sublittoral zone of the Gulf of California. Marine Ecology 26: 273-285. Jumars, P.A. 1975. Target species for deep-sea studies in ecology, genetics, and physiology. Zoological Journal of the Linnean Society 57: 341-348. Jumars, P.A. 1976. Deep-sea species diversity: does it have a characteristic scale? Journal of Marine Research 34: 217-246. Kovach WL. 1998. MVSP -a Multivariate Statistical Package for Windows, ver. 3.0. Kovach Computing Services: Pentraeth, Wales. Kudenov, J.D. 1975a. Errant polychaetes from the Gulf of California, Mexico. Journal of Natural History. London 9: 65-91 Kudenov, J.D. 1975b. Sedentary polychaetes from the Gulf of California, Mexico. Journal of Natural History. London 9: 205-231. Kudenov, J.D. 1980. Annelida: Polychaeta (Bristleworms). Pp. 77-123. En: R. Brusca (ed.). Common intertidal invertebrates of the Gulf of California. University of Arizona. Tucson. 513 pp. Levin, L.A. 2001. Oxygen minimum zone influence on the community structure of deepsea benthos. En: ASLO Meeting. Aquatic Sciences Meeting. Albuquerque, NM. 12-16 de febrero de 2001. Abstracts. Levin, L.A. 2003. Oxygen minimum zone benthos: adaptation and community response to hypoxia. Oceanography and Marine Biology. An Annual Review 41: 1-45. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 219 Levin, L.A. y J.D. Gage. 1998. Relationship between oxygen, organic matter and diversity of bathyal macrofauna. Deep-Sea Research, Part II 45: 129-163. Levin, L.A., C.L. Huggett y K.F. Wishner. 1991. Control of deep-sea benthic community structure by oxygen and organic-matter gradients in the eastern Pacific Ocean. Journal of Marine Research 49: 763-800. Levin, L.A., G.R. Plaia y C.L. Huggett. 1994. The influence of natural organic enhancement on life histories and community structure of bathyal polychaetes. Pp. 261-283. En: C.M. Young y K.J. Eckelbarger (eds.). Reproduction, Larval Biology, and Recruitment of the Deep-Sea Benthos. Columbia University Press, New York. Levin, L.A., J.D. Gage, C. Martin y P.A. Lamont. 2000. Macrobenthic community structure within and beneath the oxygen minimum zone, NW Arabian Sea. Deep-Sea Research, Part II., 47: 189-226. Levin, L.A., J. Gage, P. Lamont, L. Cammidge, C. Martin, A. Patience y J. Crooks. 1997. Infaunal community structure in a low-oxygen, organic rich habitat on the Oman Continental slope, NW Arabian Sea. Pp. 223-230 En: L.E. Hawkins y S. Hutchinson (eds.). Responses of Marine Organisms to their Environments. Proceedings of the 30th European Marine Biology Symposium, 18-22 de agosto de 1995. University of Southampton, Southampton. Levin, L.A., A.E. Rathburn, C. Neira, J. Sellanes, P. Muñoz, V. Gallardo y M. Salamanca. 2002. Benthic processes on the Peru margin: A transect across the oxygen minimum zone during the 1997-1998 El Niño. Progress in Oceanography 53: 1-27. Levin, L.A., J.E. Etter, M.A. Rex, A.J. Gooday, C.R. Smith, J. Pineda, C.T. Stuart, R.R. Hessler y D. Pawson. 2001. Environmental influences on regional deep-sea species diversity. Annual Review of Ecology and Systematics 32: 51-93. Lezcano-Bustamante, B.G. 1989. Estudio prospectivo de la distribución, diversidad y abundancia de las poblaciones de anélidos poliquetos en la porción sur del golfo de California. Tesis de Biólogo. Facultad de Ciencias, Universidad Nacional Autónoma de México, México D.F. 98 pp. Méndez, N. 2006. Deep-water polychaetes (Annelida) from the southeastern Gulf of California, Mexico. Revista de Biología Tropical 54: 773-785. Méndez, N. 2007. Relationships between deep-water polychaete fauna and environmental factors in the southeastern Gulf of California, Mexico. Scientia Marina 71(3): 605-622. Méndez, N. 2009. Distribution and extraordinary abundance of the deep-sea Melinnampharete gracilis Hartman, 1969 (Polychaeta: Ampharetidae) in the Gulf of California, México. Cahiers de Biologie Marine 50:273-276 220 Biodiversidad y comunidades del talud continental del Pacífico mexicano Méndez, N. y M.E. Hendrickx. 2012. Recolección y cuantificación de macrofauna de mar profundo: el caso de estudio del poliqueto Melinnampharete gracilis Hartman, 1969 (Ampharetidae). Pp. 229-246. En: P. Zamorano, M.E. Hendrickx y M. Caso (eds.). Biodiversidad y comunidades del talud continental del Pacífico mexicano. Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales (Semarnat). Milliman, J.D. 1994. Organic matter content in U.S. Atlantic continental slope sediments: decoupling the grain-size factor. Deep-Sea Research, Part II 41: 797-808. Narayanaswamy, B.E., T.D. Nickell y J.D. Gage. 2003. Appropriate levels of taxonomic discrimination in deep-sea studies: species vs family. Marine Ecology Progress Series 257: 59-68. Narayanaswamy, B.E., B.J. Bett y J.D. Gage. 2005. Ecology of bathyal polychaete fauna at an Arctic-Atlantic boundary (Faroe-Shetland Channel, North-east Atlantic). Marine Biology Research 1: 20-32. Paxton, H. 1986. Generic revision and relationships of the family Onuphidae (Annelida: Polychaeta). Records of the Australian Museum 38(1-2): 1-74. Petersen, M.E. 2000. A new genus of Fauveliopsidae (Annelida: Polychaeta), with a review of its species and redescription of some described taxa. Bulletin of Marine Science 67: 491-515. Pettibone, M.H. 1966. Revision of the Pilargidae (Annelida: Polychaeta) including descriptions of new species, and redescription of the pelagic Podarmus ploa Chamberlin (Polynoidae). Proceedings of the United States Natural Museum 118: 155-208. Picard, J. 1965. Recherches qualitatives sur les biocénoses marines des substrats meubles dragables de la région marsellaise. Recueil des Travaux de la Station Marine d’Endoume 36: 1-60. Rex, M.A., C.T. Stuart y G. Coyne. 2000. Latitudinal gradients of species richness in the deep-sea benthos of the North Atlantic. Proceedings of the National Academy of Sciences of the United States of America 97: 4082-4085. Rhoads, C.D. 1974. Organism-sediment relations on the muddy sea floor. Oceanography and Marine Biology: an Annual Review 12: 263-300. Rioja, E. 1962. Estudios anelidológicos. XXVI. Algunos anélidos poliquetos de las Costas del Pacífico de México. Anales del Instituto de Biología, México 33: 131-229. Rosenberg, R., B. Hellman y B. Johansson. 1991. Hypoxic tolerance on marine benthic fauna. Marine Ecology Progress Series 79: 127-131. SAIC (Science Applications International Corporation). 1991. Biological and sedimentological investigations of the sea floor at the proposed U.S. Navy 103 Ocean Disposal Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 221 Sit. Report submitted to PRC Environmental Management, Inc., San Francisco. 95 pp, Appendices A-C. SAIC (Science Applications International Corporation). 1992. Benthic ecology and sediment characterization. Ocean studies report for detailed physical and biological oceanographic studies for an ocean site designation effort under the Marine Protection, Research and Sanctuaries Act of 1972 (MPRSA). Report prepared for U.S. Environmental Protection Agency, Region IX, San Francisco, CA. Salazar-Vallejo S.I. y Londoño-Mesa M.H. 2004. Lista de especies y bibliografía de poliquetos (Polychaeta) del Pacífico Oriental Tropical. Anales del Instituto de Biología. Universidad Nacional Autónoma de México. Serie Zoología 75: 9-97. Salazar-Vallejo, S.I., J.A. de León-González y H. Salaices-Polanco. 1989. Poliquetos (Annelida: Polychaeta) de México. Libros Universitarios, Universidad Autónoma de Baja California Sur. La Paz. 212 pp. Sanders, H.L. 1969. Benthic marine diversity and the stability-time hypothesis. Brookhaven Symposia on Biology 22: 71-81. Sarti-Martínez, A.L. 1984. Estudio prospectivo de la distribución, abundancia y diversidad de los anélidos poliquetos de la zona norte del golfo de California. Tesis de Biólogo. Facultad de Ciencias, Universidad Nacional Autónoma de México, México D.F. 53 pp. Solís-Weiss, V. y B. Hilbig. 1992. Redescription of Ophryotrocha platykephale Blake (Polychaeta, Dorvilleidae) from the Guaymas Basin hydrothermal vents. Bulletin of the Southern California Academy of Sciences 91: 92-96. Solís-Weiss, V. y P. Hernández-Alcántara. 1994. Amphisamytha fauchaldi: a new species of Ampharetid (Annelida: Polychaeta) from the hydrothermal vents at Guaymas Basin, Mexico. Bulletin of the Southern California Academy of Sciences 93: 127134. Taylor, J.L. 1984. Orbiniidae. Pp 1-38. En: J.M. Uebelacker y P.G. Johnson (eds.). Taxonomic Guide to the Polychaetes of the Northern Gulf of Mexico. Mobile, Barry A. Vittor & Associates Inc. Louisiana. Treadwell, A.L. 1923. Polychaetous annelids from lower California with descriptions of new species. American Museum Novitates 74: 1-11. Williams, S.J. 1987. Taxonomic notes on some Ampharetidae (Polychaeta) from Southern California. Bulletin of the Biological Society of Washington 7: 251258. Wieser, W. 1959. The effect of grain size on the distribution of small invertebrates inhabiting the beaches of Puget Sound. Limnology and Oceanography 4: 181-194. 222 Biodiversidad y comunidades del talud continental del Pacífico mexicano Wishner, K.F., C.J. Ashjian, C. Gelfman, M.M. Gowing, L. Kann, L.A. Levin, L.S. Mulineaux y J. Saltzman. 1995. Pelagic and benthic ecology of the lower interface of the Eastern Tropical Pacific oxygen minimum zone. Deep-Sea Research, Part I 42: 93-115. Zamorano, P., M.E. Hendrickx y A. Toledano-Granados. 2007. Distribution and ecology of deep-water mollusks from the continental slope, southeastern Gulf of California, Mexico. Marine Biology 150(5): 883-892. Poliquetos (A nnelida , Polychaeta ) del talud continental suroriental 223