Espectroscopia de IR
Anuncio

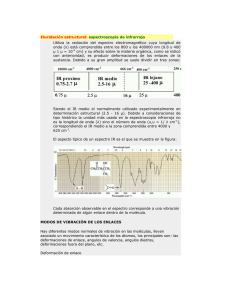
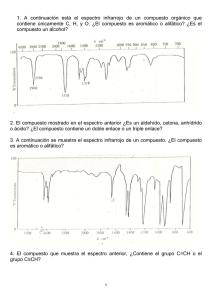
Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS) Elucidación Estructural de Compuestos Orgánicos • • • • Resonancia Magnética Nuclear (RMN) Espectrometría de Masa (MS) Espectroscopía de Infrarojo (IR) Espectroscopía de Ultravioleta-visible(UV-VIS). Compuestos < 1000 uma. 1. Poseer conocimiento general de los principales grupos funcionales. 2. Interpretar los datos espectroscópicos. 3. Aplicar un secuencia sistemática y organizada. 4. Evitar inferir información apartir de ausencia o de datos negativos. 5. Mantener una perspectiva adecuada cuando se encuentran datos incongruentes o que crean conflicto. Compuesto Formula Molecular, MS Identificacion de Grupos Funcionales, IR Conectividad de los carbonos, RMN Posición de los sustituyentes o Grupos funcionales, RMN 2D Estereoquímica, RMN 2D, R-X HO OH 1305/3 HO OH OH O HO HO OH OH HO O HO HO OH OH Palytoxin, es el producto natural más tóxico del que se tiene conocimiento (>5 mg), (coral blando Palythoa toxica) OH HO OH OH HO OH HO HO HO O HO OH OH HO OH O OH OH HO OH O OH HO HO OH O O O HO O OH HO O N O H2N OH OH O N OH MW 2706 C129H223N3O54 Que es la Espectroscopía? Los átomos y las moléculas interaccionan con la Radiación Electromagnética (RE) en una amplio rango de variedad. Los átomos y moléculas pueden absorver y/o emitir RE. La absorción de RE estimula diferentes tipos de movimientos en átomos y/o moléculas. Los patrones de absorción y/o emisión son llamados espectros. El campo de la Espectroscopía se concentra en la interpretación de los espectros en terminos de estructura atómica y molecular. ¿Qué es la Radiación Electromagnética? Definición: la radiación electromagnética se compone de paquetes de energía sin masa, asociados a campos electromagnéticos y propagándose a una velocidad constante, igual a la velocidad de la luz. Onda electromagnética Campo magnético Campo eléctrico Campo eléctrico Campo magnético Propagación de Radiación electromagnética Caracterización de la Radiación Electromagnética Longitud de Onda: l Distancia entre dos máximos consecutivos Longitud de onda Max Max Min Frecuencia: n No son independientes: y miden la energía de la radiación: ln = c E = hn Número de picos que atraviesen esta superficie cada segundo El espectro electromagnético El espectro electromagnético es el intervalo de todas las frecuencias posibles, desde cero hasta el infinito. Radio Infrarrojo Visible Ultravioleta Rayos X Rayos gamma m Edificios Humanos Abejas Longitud de onda larga Frecuencia pequeña Baja energía Cabezas de Organismos alfiler unicelulares Moléculas Átomos Núcleos atómicos Longitud de onda corta Frecuencia alta Alta energía El espectro electromagnético En la práctica, en el espectro se representan desde las bajas frecuencias de radio hasta las altas frecuencias de los rayos gamma. Radio Infrarrojo Visible Ultravioleta Rayos X Rayos gamma m Edificios Humanos Abejas Cabezas de Organismos alfiler unicelulares Ondas de Radio: Moléculas Átomos Núcleos atómicos Parte visible del espectro: 0.5 mm < l < 500 m 0.4 mm < l < 0.7 mm 0.5 MHz < n < 500 GHz 430 THz < n < 750 THz 6 décadas Media década El espectro electromagnético Electrones de valencia Cuanto más elevada es la frecuencia, más corta es la longitud de onda. Los rayos X provocan la ionización de las moléculas debido a su alta energía, mientras que las microondas afectarán al movimiento rotacional de la molécula. Los rayos de infrarrojos provocarán vibraciones moleculares. RADIACION EFECTO INFORMACIÓN OBTENIDA Resonancia Magnética Nuclear Grupos funcionales, subestructuras, conectividades, estereoquímica, etc… a partir de datos de desplazamiento químico, áreas de los picos y constantes de acoplamiento observadas. Transiciones de los momentos magnéticos de los eléctrones. Movimiento rotacional ESR Resonancia de spin electrónico Infrarrojo Deformación de los enlaces químicos. Vibración de los enlaces Infrarrojo UV-Visible Transiciones electrónicas entre los orbítales atómicos y moleculares Ultravioleta-Visible Radio Frecuencias Microondas Rayos X y cósmicos Transiciones de spín electrónico o nuclear en los átomos de la molécula TÉCNICA ESPECTROSCÓPICA Ionizaciones de las moléculas Rayos X Grupos funcionales a partir de las absorciones observadas. Existencia de cromóforos y/o conjugación en la molécula a partir de las absorciones observadas Estructura total de la molécula incluida la estereoquímica de la misma a partir de las posiciones relativas de los átomos. Características de los Métodos Espectrométricos más Importantes Vibraciones moleculares Los enlaces covalentes vibran solo a ciertas frecuencias. Si el enlace se alarga, aparece una fuerza restauradora que hace que los dos átomos tiendan a juntarse hasta su longitud de enlace de equilibrio. Si el enlace se comprime, la fuerza restauradora hace que los átomos se separen. Cuando el enlace se alarga o se comprime, y a continuación se deja en libertad, los átomos vibran Las vibraciones moleculares dependen de las masas de los átomos. Los átomos pesados vibran lentamente, por lo que tendrán una frecuencia más baja que los átomos más ligeros. La frecuencia de una vibración disminuye al aumentar la masa atómica. La frecuencia también aumenta con la energía de enlace, por lo que un doble enlace C=C tendrá una frecuencia más elevada que un enlace sencillo C-C. Frecuencias de tensión de enlace. Modos de vibración Tensión y flexión de los enlaces. Una molécula no lineal con n átomos tiene 3n - 6 modos de vibración fundamental. El agua tiene 3(3) - 6 = 3 modos. Dos modos son de tensión y uno de flexión. Movimientos de Estiramiento de un grupo CH2 Simétrico Antisimétrico Movimientos de deformación. CH2 En el plano Tijeras En el plano Balanceo Movimientos de deformación. CH2 Fuera del plano Torsión Fuera del plano Torsión Zonas del espectro Frecuencia cm-1 4500 2500 2000 1800 1650 1500 DEFORMACION 650 Huella Dactilar TENSION Mayor energía 2,5 l en m 4 5 5,5 6,1 6,6 15 2.- Zonas del espectro Frecuencia cm-1 4500 2500 2000 CC O-H N-H C-H 1800 C=C=C CN Comb X=C=Y Ar 1650 4 C-Cl C=N C=O C-O C=C (C,O,N,S) 2,5 l en m 650 1500 5 5,5 6,1 Mayor energía C-N C-C 6,6 15 Diagrama de un espectrofotómetro infrarrojo. Un espectrofotómetro infrarrojo mide la frecuencia de la luz infrarroja que son absorbidas por un compuesto Espectro infrarrojo de alcano. Un alcano mostrará frecuencias de tensión y flexión solamente para C-H y C-C. La tensión C-H es una banda ancha entre 2800 y 3000 cm-1, una banda presente en prácticamente todos los compuestos orgánicos. En este ejemplo, la importancia recae en lo que no se ve, es decir, la ausencia de bandas indica la presencia en ningún otro grupo funcional. Frecuencias de la tensión C-H Los alcanos, alquenos y alquinos también tienen frecuencias de tensión C-H características. Los enlaces carbono-hidrógeno que tienen átomos de carbono con hibridación sp3 generalmente absorben a frecuencias justo por debajo de (a la derecha de) 3000 cm-1, mientras que los que tienen átomos de carbono con hibridación sp2 absorben justo por encima de (a la izquierda de) 3000 cm-1. Un porcentaje mayor del carácter s en los orbitales híbridos hará que el enlace C-C sea más fuerte. El enlace C-H de un átomo de carbono con hibridación sp3 será ligeramente más débil que el enlace C-H de un átomo de carbono con hibridación sp2 o sp. Espectro infrarrojo de alqueno. Las absorciones más importantes del espectro del 1-hexeno son los estiramientos C=C a 1642 cm-1 y =C-H a 3080 cm-1. Espectro infrarrojo de alquinos. Los alquinos terminales tienen una tensión C-H (alquinilo) característica a alrededor de 3300 cm-1 y una tensión de triple enlace C-C a aproximadamente 2100 - 2200 cm-1. Los alquinos internos no pueden mostrar la tensión C-H acetilénica. El momento dipolar pequeño del triple enlace disustituido limita la tensión y hace que el triple enlace C-C no sea visible Espectro de IR de los alcoholes. El alcohol O-H absorbe alrededor de 3300 cm-1 y normalmente tiene una banda ancha y fuerte. Esta banda se debe a los distintos reordenamientos del enlace de hidrógeno que tienen lugar. La forma ancha se debe a la naturaleza diversa de las interacciones de los enlaces de hidrógeno de las moléculas de alcohol. Existe una banda de tensión C-O centrada próxima a 1050 cm-1. Espectro de IR de las aminas. Los enlaces de hidrógeno que se forman entre el nitrógeno y el hidrógeno son más débiles que aquellos que se forman con el oxígeno y el hidrógeno. Las aminas, como los alcoholes, tendrán una banda ancha centrada alrededor de 3300 cm-1, pero no tan fuerte. Podrían existir picos agudos superpuestos en la zona de absorción de tensión dependiendo del número de hidrógenos que el nitrógeno tenga; una amina secundaria tendrá un pico agudo, mientras que una amina primaria tendrá dos picos agudos. Las aminas terciarias no mostrarán picos agudos porque no hay un enlace N-H. Cetonas, aldehídos y ácidos. Las vibraciones de tensión C=O de las cetonas, aldehídos y ácidos carboxílicos sencillos se producen a frecuencias de aproximadamente 1710 cm-1. Estas frecuencias son más altas que las de los dobles enlaces C=C, debido a que el doble enlace C=O es más fuerte y más rígido. La tensión C=O es fuerte e inconfundible. Dependiendo de qué más esté unido al carbonilo, existen otras bandas que se pueden buscar para diferenciar entre aldehídos, cetonas y ácidos. IR de los compuestos cetona. El espectro de la 2-heptanona muestra una absorción fuerte a 1718 cm-1. IR de los compuestos aldehido. El aldehído tiene la tensión C=O a 1720 cm-1, pero también tiene dos bandas de tensión distintas para el enlace C-H del aldehído a 2720 y 2820 cm-1 IR de los ácidos carboxílicos. Los ácidos carboxílicos presentan una absorción O-H ancha entre 2500 y 3500 cm-1. Esta absorción ancha ocupa por completo la región de tensión C-H, con más amplitud. La tensión del doble enlace C=O será aguda e intensa a 1711 cm-1. Los dos picos tienen que estar presentes para identificar al compuesto como un ácido carboxílico Frecuencias de los compuestos carbonilo conjugados. La deslocalización de los electrones pi reduce la densidad electrónica de los dobles enlaces de los grupos carbonilo, debilitándolos y disminuyendo la frecuencia de tensión de las cetonas, aldehídos y ácidos conjugados desde 1710 cm-1 a 1685 cm-1. La tensión del doble enlace C=C puede que no sea clara en el espectro IR porque es mucho más débil que la absorción C=O. La presencia del doble enlace C=C se suele deducir por su efecto en la frecuencia del grupo C=O y por la presencia de absorciones del tipo =C-H por encima de 3000 cm-1. IR de los nitrilos Un triple enlace carbono-nitrógeno tiene una absorción intensa y aguda centrada alrededor de 2200 a 2300 cm-1. Los enlaces nitrilo son más polares que los triples enlaces carbono-carbono, por lo que los nitrilos producen absorciones más fuertes que los alquinos. Resumen de las frecuencias de tensión en el IR. El espectro IR tiene distintas regiones. La parte izquierda del espectro muestra las tensiones C-H, O-H y N-H. Los enlaces triples absorben alrededor de 2200 cm-1 seguidos por los enlaces dobles hacia la derecha a alrededor de 1700 cm-1. La región por debajo de 1400 cm-1 se denomina región de huella dactilar. Diagrama de un espectrómetro de masas. Un flujo de electrones hace que las moléculas se ionicen y se fragmenten. La mezcla de iones es acelerada y pasa a través de un campo magnético, donde las trayectorias de los iones más ligeros se desvían más que las trayectorias de los iones más pesados. Variando el campo magnético, el espectrómetro permite registrar la abundancia de iones de cada masa. El radio de curvatura exacto de la trayectoria de un ión depende de la relación masacarga, simbolizada por m/z. En esta expresión, m es la masa del ión (en uma: unidades de masa atómica) y z es su carga. La mayoría de los iones tiene una carga de +1, por lo que su desviación tendrá un radio de curvatura que dependerá sólo de la masa. Espectro de masas del 2,4dimetilpentano En el espectro, al pico más alto se le denomina pico base y se le asigna una abundancia del 100%. La abundancia de los demás picos se da como porcentaje con relación al pico base. El ión molecular (M+) corresponde a la masa de la primera molécula Cromatografía de gases: espectrómetro de masas (CG-EM). La columna del cromatógrafo de gases separa la mezcla en sus componentes. El espectrómetro de masas cuadrupolar explora el espectro de masas de los componentes a medida que abandonan la columna. A medida que la muestra pasa a través de la columna, los componentes más volátiles se mueven a través de la columna más rápidamente que los componentes más volátiles. Los componentes separados dejan la columna en distintos momentos, pasando a través de la línea de transferencia hacia la fuente de iones del espectrómetro de masas, donde las moléculas se ionizan y pueden fragmentarse Espectro de masas del 2-metilpentano El pico base corresponde a la pérdida de un radical propilo para dar lugar a un catión isopropilo. La fragmentación de un alcano ramificado se produce frecuentemente en la rama del átomo de carbono que da lugar al catión y al radical más sustituidos Espectro de masas del 2-hexeno. El catión-radical del 2-hexeno se rompe por un enlace alílico para dar lugar a un catión metil-alílico estabilizado por resonancia, m/z = 55. Espectro de masas del 3-metil-1-butanol. El pico intenso a m/z = 70 es el pico M - 18, correspondiente a la pérdida de agua. El ión molecular no es visible porque pierde agua muy fácilmente Efecto isotópico del cloro El espectro de MS del 2-cloropropano. Los elementos más pesados no están formados por un solo isótopo, sino que contienen isótopos más pesados en cantidades variables. Los isótopos más pesados dan lugar a picos pequeños a números de masa superiores a los del pico del ión molecular M+. La altura de los picos M+, M + 1 y M + 2 dependerá de la composición isotópica del elemento en cuestión. El cloro es una mezcla del 35Cl con un 75,5 % y del 37Cl con un 24,5 % . El pico del ión molecular M+ tiene 35Cl siendo tres veces más elevado que el pico M + 2, el cual tiene 37Cl. Efecto isotópico del bromo. Observe que los picos M+ y M + 2 tienen aproximadamente la mima altura. El bromo es una mezcla del 79Br con un 50,5 por ciento y del 81Br con un 49,5 por ciento . El pico del ión molecular M+ tiene 79Br siendo tan alto como el pico M + 2, el cual tiene 81Br.