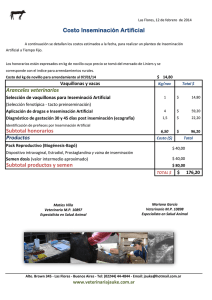
Inseminación artificial TÉCNICAS DE REPRODUCCIÓN ASISTIDA
Anuncio

Inseminación artificial Dr. J. Martínez Salazar Dr. Juan A. García Velasco IVI-­‐Madrid BLOQUE IV TÉCNICAS DE REPRODUCCIÓN ASISTIDA MÁSTER EN REPRODUCCIÓN HUMANA Contenido La inseminación intrauterina: factores que afectan al resultado ................................................ 2 1. Parámetros espermáticos ...................................................................................................... 3 2. Edad de la paciente ............................................................................................................... 4 3. ¿Por qué estimular la ovulación a mujeres normoovuladoras? .............................................. 4 4. ¿Inseminación artificial o coito programado? ........................................................................ 4 5. Técnica de inseminación artificial .......................................................................................... 5 6. Reposo tras la inseminación .................................................................................................. 6 7. Número de ciclos de inseminación a realizar ......................................................................... 6 8. Selección de sexo .................................................................................................................. 7 9. ¿Es útil la ecografía 3D-­‐Doppler en la inseminación? ............................................................. 7 10. Parejas serodiscordantes para el VIH y la Hepatitis C. .......................................................... 8 11. Fármacos para la estimulación ovárica ................................................................................ 8 12. Conclusiones ....................................................................................................................... 9 13. Bibliografía ........................................................................................................................ 10 UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 1 de 13 MÁSTER EN REPRODUCCIÓN HUMANA La inseminación intrauterina: factores que afectan al resultado Desde que John Hunter describiera la utilidad de colocar los espermatozoides dentro del tracto genital femenino de forma artificial 1 hasta hoy, son muchas y muy diversas los causas que han hecho que los resultados de una inseminación intrauterina hayan mejorado sustancialmente. Sin duda alguna, la inseminación artificial es uno de los procedimientos de reproducción asistida más empleados en nuestro país y fuera de él. Una simple búsqueda en MedLine pone de manifiesto casi 8.000 publicaciones en los últimos años, sin tener en cuenta todas aquellas no recogidas por esta base de datos. Siendo un poco más concretos, y ateniéndonos al registro de la Sociedad Española de Fertilidad ʹel único existente en nuestro país-­‐, y al que comunican de forma voluntaria y no todos el número de ciclos realizado así como su resultado-­‐, durante 2010 se realizaron al menos 28.204 ciclos de inseminación, de los cuales 22.087 fueron con semen de la pareja y 6.117 con semen de donante (www.sefertilidad.com). Estas cifras ponen de manifiesto la relevancia del tema a tratar. En el presente artículo revisaremos cómo afectan al resultado de una inseminación artificial no sólo las indicaciones sino la técnica en sí, los fármacos empleados así algunos aspectos más novedosos al respecto. Como en cualquier técnica de reproducción asistida (TRA), existe un balance exquisito entre los beneficios conseguidos y el riesgo asumido. En concreto, en la inseminación artificial, veremos como a mayor número de óvulos disponibles, mayor será el porcentaje de gestación, pero al mismo tiempo, aumentarán las complicaciones, como la gestación múltiple y la hiperestimulación ovárica. En la figura-­‐1 se muestran los resultados de nuestro grupo en el año 2011 en los que hemos realizado inseminación artificial. Figura-1 UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 2 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 1. Parámetros espermáticos En el año 2010 la Organización Mundial de la Salud (OMS) realizó una revisión y actualización de los valores de referencia del Manual de valoración seminal para establecer una muestra ĐŽŵŽ ͞ŶŽƌŵŽnjŽŽƐƉĠƌŵŝĐĂ͘͟ ƐƚĂ ƌĞǀŝƐŝſŶ ƉƌĞƐĞŶƚĂ ƵŶ ŶŝǀĞů ĚĞ ĚĞƚĂůůĞ ŵƵĐŚŽƐ ŵĄƐ ĞůĞǀĂĚŽ que la anterior, afectando los cambios a todos los parámetros seminales2. En la figura-­‐2 se muestras los diferentes criterios de valoración de los parámetros seminales entre ambos manuales. Estos cambios han modificado los criterios que seguíamos hasta hace poco para recomendar una técnica reproductiva. Actualmente hay pocos trabajos publicados utilizando estos nuevos criterios, pero desde el punto de vista clínico el parámetro más útil es la cantidad total de espermatozoides móviles después de la capacitación (TSM). Merviel et al 3 estudian los factores predictivos de gestación en ciclos de inseminación artificial revisando 1038 ciclos y observan en relación a los datos seminales que los mejores resultados se obtienen en mujeres jóvenes (<30 años) y semen con TSM >5 millones. Figura-2. Comparación parámetros seminales La morfología espermática sigue siendo un parámetro de dudosa utilidad. Así, el valor de normalidad de la morfología espermática en los nuevos criterios ha descendido de un 15% a un 4% siguiendo el criterio estricto de Tygerberg (OMS, 1999). En los últimos años se ha publicados números artículos en defensa o detrimento de la importancia de la morfología espermática, pero salvo casos extremos con elevadas anomalías, se ha hecho difícil unificar los criterios de valoración morfología de las muestras y su implicación clínica. Recientemente, Zhang et al4 estudian el efecto de la morfología aislada en ciclos de IA en pacientes con concentración y movilidad espermática normal y observa la menor tasa de gestación (7,6%) en los sémenes con menos del 5% de formas normales, aunque no directamente significativa que la de los otros grupos; así como el mejor factor predictivo de éxito fue la edad menor de 35 años y la cantidad total de espermatozoides móviles mayor a 5 millones. En general, podemos recomendar que en sémenes con teratozoospermia mayores al 4% -­‐siguiendo los criterios actuales de 2010-­‐ debemos indicar técnicas reproductivas superiores como la FIV. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 3 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 2. Edad de la paciente La edad es sin duda un factor determinante para la gestación, ya sea espontánea o mediante TRA. A pesar de ser un factor que no podemos tratar, es muy importante informar a la pareja de sus posibilidades respecto a una técnica concreta para que sus expectativas sean realistas. Este trabajo de nuestro grupo5 demuestra que la tasa de gestación por ciclos se mantenía prácticamente constante en un 25% hasta los 37 años, momento a partir del cual se iniciaba un declive rápido, siendo entre los 38 a 41 años tan sólo del 6.20%. Merviel et al 3 encuentran los mejores resultados en mujeres menores de 30 años. Estos datos pueden ayudarnos a decidir con la pareja cuántos ciclos vamos a realizar, para evitar perder un tiempo excesivo en caso de que fracasen, dado que otras técnicas como la FIV ofrecen resultados mucho mejores en mujeres de este grupo de edad. Como pauta general, no recomendamos realizar IA por encima de los 38 años. 3. ¿Por qué estimular la ovulación a mujeres normoovuladoras? Realmente, en mujeres normoovuladoras, podríamos considerar que la estimulación ovárica es innecesaria, y de hecho es correcto. A pesar de ello, sabemos que el incrementar el número de ovocitos disponibles para ser inseminados va a aumentar la tasa de gestación por ciclo, lo que va a reducir al espera de la pareja hasta conseguir una gestación. Cuando la pareja consulta con nosotros, en la mayoría de las ocasiones ya lleva tiempo esperando, buscando gestación de manera espontánea, y de alguna manera, dirigiendo sus relaciones sexuales hacia los días de máxima fertilidad. Por ello, cuando acude a nosotros, busca que este período de espera sea el menor posible, y la estimulación ovárica lo puede reducir. Entre un 60 y un 80% de las parejas van a gestar espontáneamente o con tratamiento en los dos primeros años de intentarlo. A partir del tercer año se ha estimado que la tasa de gestación disminuye un 1-­‐2% cada mes, lo que supone alrededor de un 20% por año6. Una estimación similar fue realizada por Crosignani hace 12 años 7, describiendo que la tasa de gestación en mujeres mayores de 30 años cae un 9% cada año. En 2009, la European Society of Human Reproduction (ESHRE) recomienda la necesidad de una estimulación ovárica controlada para conseguir resultados modestos en IA 8. Hay muchos trabajos que demuestran diferencias significativas favorables a la hiperestimulación ovárica controlada frente al ciclo natural9-­‐11. Es por ello por lo que a pesar de aumentar el riesgo de gestación múltiple, la estimulación ovárica controlada esta justificada en mujeres normoovuladoras. 4. ¿Inseminación artificial o coito programado? Frente a las relaciones sexuales, la inseminación artificial no sólo va a acercar los gametos entre sí al colocar los espermatozoides dentro de la cavidad uterina cerca de los ostia tubáricos sino que además va a aumentar su número tras la capacitación, e incluso puede corregir mínimas disfunciones que pudieran existir en la interacción moco-­‐semen al evitar el moco UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 4 de 13 MÁSTER EN REPRODUCCIÓN HUMANA cervical que pudiera ser hostil. Un meta análisis publicado por Duran en 2002 que incluye 22 trabajos en IA de origen inexplicado o masculina demuestra que frente al coito programado la inseminación duplica la capacidad de gestar9. 5. Técnica de inseminación artificial 1. Tipos de inseminación: Existen varios tipos de inseminación dependiendo de donde depositemos la muestra de semen capacitado: intracervical, intrauterina, intratubárica, intraperitoneal (DIPI) e intrafolicular (DIFI). Nosotros realizamos la intrauterina por su sencillez y elevada tasa de gestación. Varios trabajos12, 13 ponen de manifiesto la superioridad de la intrauterina sobre la intracervical y únicamente realizamos las otras en el caso de imposibilidad de canalización del cérvix. 2. Técnica de inseminación: Actualmente la realizamos bajo control ecográfico abdominal para visualizar correctamente la introducción del catéter en la cavidad endometrial y la confirmación del momento de la eyección seminal. Previamente realizamos una limpieza del flujo vaginal exocervical y del moco intracervical para evitar las posibles infecciones y arrastre de agentes nocivos hacia la cavidad uterina. El depósito del semen capacitado se realiza suavemente con un catéter blando. 3. Volumen de semen inseminado: Teniendo en cuenta que el útero es una cavidad virtual y de capacidad limitada, algunos autores han estudiado el efecto de diversos volúmenes de la muestra inseminada sobre el resultado del ciclo. Do Amaral et al 14 no encontró diferencias inseminando 0.5 mL frente a 3 mL. No obstante, en el IVI inseminamos con un volumen entre 0.3 y 0.5 mL para evitar el reflujo de la muestra. 4. Inseminación única versus doble por ciclo: Desde hace años, en el Instituto Valenciano de Infertilidad hemos realizado siempre dos inseminaciones en un mismo ciclo, basados en la literatura publicada, con trabajos que encontraban mejoría en la tasa de embarazo en casos de doble inseminación15, 16 mientras que otros no encuentran mejoría17. En la última revisión del Cochrane que incluye 6 trabajos randomizados se ĐŽŶĐůƵLJĞ ƋƵĞ ͞ĞůƵƐŽĚĞ ůĂŝŶƐĞŵŝŶĂĐŝſŶŝŶƚƌĂƵƚĞrina doble en un ciclo menstrual no ofrece un claro en la tasa de embarazo en los casos de esterilidad de origen desconocido18. Igualmente, Tonguc et al19 no encuentra diferencia significativas en tasas de embarazo estudiando 3 grupos de pacientes en los que les realizan IA: grupo 1 con inseminación a las 24 horas post-­‐hCG, grupo 2 con inseminación doble a las 24 y 36 horas y grupo 3 con inseminación única a las 36 horas post-­‐hCG. Con estos datos, nuestro grupo recientemente ha cambiado su protocolo de actuación en IA realizando una única inseminación intrauterina a las 36 horas post-­‐hCG acompañado de un estricto control de la programación del procedimiento. La realización de un único procedimiento facilita el cumplimiento del ciclo a los pacientes, disminuyen las molestias y se mantienen los resultados. 5. Sincronización de la inseminación: hCG y ecografía versus pico de LH. El momento de realizar la inseminación puede ser determinado mediante una estimación de la madurez ovocitaria en función del tamaño folicular medido mediante ecografía UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 5 de 13 MÁSTER EN REPRODUCCIÓN HUMANA transvaginal y la administración de hCG, o bien, mediante la observación del pico de LH en suero u orina a través de kits de LH. Recientemente, Kyrou et al 20 estudian los resultados en paciente que realizan IA en ciclo natural comparando ambas metodologías y observan una tasa de gestación del 20% en el grupo con determinación de pico de LH vs 12% en grupo de administración de hCG. En una revisión de Cochrane21 comparan los diferentes métodos de programación de la IA en ciclos estimulados y no encuentran diferencia entre ellos, de manera que aconsejan utilizar el que mejor se acomode a las necesidades del centro y las pacientes. 6. Programación de la inseminación: Clásicamente nosotros hemos realizado 2 inseminaciones por ciclo a las 12 y a las 36 horas aproximadamente, lo que permitía una flexibilidad importante. Varios trabajos han demostrado que una única inseminación programada a las 36 horas de la administración de la hCG o la determinación del pico de LH ofrece los mejores resultados frente a las realizadas a las 24 horas19, 22. Actualmente programamos la inseminación intrauterina 36 horas después de la hora de la administración de la hCG. 6. Reposo tras la inseminación No existe ninguna justificación racional para indicar reposo tras una inseminación artificial. Sin embargo, muchas mujeres sienten que deben reposar después de la inseminación e incluso reducir los esfuerzos físicos e incluso su jornada laboral para mejorar sus resultados. Lo cierto es que no hay ninguna justificación para ello, ya que en nada se distingue lo que ocurre después de la inseminación de lo que ocurre en una mujer que gesta espontáneamente. Tan solo hay un estudio publicado al respecto por un grupo canadiense. En 210 ciclos realizados, Salen et al23 comprobaron que el reposo durante 10 minutos después de la inseminación triplicaba los resultados obtenidos. A pesar de que los autores no justificaban estos resultados con una explicación, lo cierto es que es algo que empíricamente realizan todos los centros, ya que de esta manera la paciente se encuentra más segura y tranquila. 7. Número de ciclos de inseminación a realizar Evidentemente esto va a variar en función de muchos parámetros, pero básicamente son dos los que condicionan el número de ciclos a realizar, que son la edad de la paciente y los resultados del centro. No es lo mismo tratar a una mujer de 26 años, con quien a pesar de no tener fortuna, podemos insistir hasta 4 ó 6 ciclos, que una mujer de 42 años, que como hemos visto tiene unas posibilidades muy reducidas por su edad, y en quien insistir un excesivo número de ciclos puede hacerle perder un tiempo precioso. Pero, ¿cuántos ciclos sería lógico realizar en una paciente estándar?. Con nuestros propios datos24, parece lógico el realizar 4 ciclos de inseminación artificial antes de proceder a otras técnicas. La gran mayoría de los embarazos que vamos a conseguir con la inseminación artificial los encontramos en los tres o cuatro primeros ciclos. A partir de un 4º ciclo, la tasa de gestación disminuye lo suficiente como para recomendar a la pareja pasar a FIV-­‐ICSI. Aboulghar et al25 observaron que en 594 parejas con esterilidad de origen desconocido, la tasa UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 6 de 13 MÁSTER EN REPRODUCCIÓN HUMANA de gestación con inseminación artificial en los 3 primeros ciclos fue del 16.4% en los 1112 ciclos realizados. Si estas parejas realizaban de 4 a 6 ciclos (tres ciclos más), su tasa de gestación se reducía a un 5.6%. En cambio, cuando algunas de estas parejas con tres ciclos fallidos de inseminación pasaban a FIV/ICSI, el 37% conseguía gestación en el primer intento. Por ello, estos autores recomendaban un máximo de 3 ciclos de inseminación, y en caso de no conseguir gestación, pasar a FIV-­‐ICSI. 8. Selección de sexo Cuando una pareja necesita seleccionar el sexo de un hijo para evitar la transmisión de enfermedades ligadas al sexo, habitualmente recurre al diagnóstico genético preimplantatorio y estudio de los cromosomas sexuales mediante la tecnología de los arrays. En cambio, para favorecer que el hijo deseado tenga un sexo u otro por deseo de la pareja y no por motivos médicos ʹalgo que no es legal en nuestro país, al menos hoy en día-­‐, se puede recurrir una inseminación con semen enriquecido en espermatozoides que llevan el cromosoma deseado, X ó Y con resultados modestos. Para ello, se ha puesto a punto una tecnología que mediante citometría de flujo (cell sorting) se puede determinar con bastante fiabilidad si el espermatozoide lleva un cromosoma X o bien un cromosoma Y. El grupo de Fairfax ha descrito que en los 1241 ciclos realizado entre 1999 y 2001 la fiabilidad del método para la selección del cromosoma X fue del 89.5%, y para el cromosoma Y del 70%, con una tasa de gestación por ciclo del 14% 26. Además del balance familiar, otra aplicación de esta técnica podría ser el favorecer la formación de embriones de un sexo determinado en un programa de DPI. 9. ¿Es útil la ecografía 3D-­‐Doppler en la inseminación? La utilidad del Doppler en cualquier técnica de reproducción asistida sigue siendo muy controvertida. Si bien es cierto que puede aportar información pronóstica útil, muy pocas veces esta información nos va a permitir un cambio de actitud para mejorar los resultados. En este sentido, el estudio de la vascularización perifolicular nos puede orientar de la capacidad para gestar de una mujer concreta. Bhal et al27 estudiaron mediante doppler 182 ciclos de IAH no seleccionados, midiendo el IP de las arterias uterinas, del estroma ovárica así como el porcentaje del perímetro folicular que presentaba mapa doppler, que dividieron en <25%, 25-­‐ 50%, 50-­‐75% y >75%. Cuando más del 50% del perímetro folicular presentaba mapa doppler, la capacidad de gestar aumentaba 2.42 veces respecto a un mapa doppler más escaso. Por lo tanto, pese a ser una información interesante, no nos va a permitir inducir cambios en el protocolo para favorecer esta vascularización, por lo que su empleo de momento está restringido a estudios. En un reciente trabajo publicado por un grupo español 28 estudian los folículos preovulatorios y área subfolicular de 79 ciclos naturales para IA mediante ecografía 3D y power-­‐doppler y no encuentran ningún valor doppler que pronostique un mayor porcentaje de éxito, únicamente encuentran que en casos con volúmenes foliculares mayores presentan un mayor riesgo de ciclos anovulatorios. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 7 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 10. Parejas serodiscordantes para el VIH y la Hepatitis C. Otra nueva indicación para la IAH son las parejas serodiscordantes para HIV y hepatitis C, ya que el semen puede ser tratado para eliminar el virus contaminante y posteriormente proceder a la inseminación sin riesgo de contagio para la madre ni para el futuro hijo/a. Marina et al29 publicaron hace 14 años los resultados de su primera serie de pacientes VIH positivos. Mediante gradientes y swim-­‐up trataron 107 muestras de semen, comprobando mediante RT-­‐PCR que el 94.4% quedaban libres de VIH. La tasa de gestación por ciclo fue del 30.7%, ya que no se trata de parejas infértiles, y los 37 niños nacidos al igual que sus madres fueron HIV negativos. El VHC puede hallarse en el semen entre el 5-­‐30% de los varones con hepatitis C y tanto la Sociedad Americana de Fertilidad, así como el Centro para el control y prevención de enfermedades (CDC) de Atlanta consideran a la hepatitis C como una enfermedad de transmisión sexual y aconsejan el preservativos fuera de los momentos de la búsqueda de embarazo. Se estima que el riesgo de transmisión sin relaciones protegidas en un 2,5%. De ahí que se recomiende el lavado de semen para su uso en cualquier TRA comprobando mediante PCR que está libre de partículas virales30. A pesar de estos buenos resultados, se puede reducir aún más el riesgo si en vez de inseminar con varios miles de espermatozoides a la mujer, utilizamos un único espermatozoide para la obtención de un embrión mediante ICSI, lo que permitiría también el no emplear el total de esta muestra tan valiosa, pudiendo congelar el sobrante para otro embarazo u otro intento31. 11. Fármacos para la estimulación ovárica Existen numerosos trabajos en la literatura sobre los diversos protocolos que existen con varios fármacos para realizar una adecuada estimulación ovárica, que van desde el citrato de Clomifeno hasta las hormonas recombinantes actuales, con muy diversos resultados en función del diseño (la mayoría no son doble ciego y buscan tan solo la no inferioridad de un fármaco respecto a otro) y del tamaño muestral (la mayoría carecen de suficiente poder estadístico para afirmar una cosa u otra). Lo que está claro es que en lo que a tasas de gestación respecta, las gonadotropinas ofrecen una tasa de gestación casi el doble respecto al Clomifeno, y que entre las diferentes gonadotropinas no hay apenas diferencias, ya sean de origen urinario o recombinante. Al fin y al cabo, para una inseminación nos va a bastar con 2 ó 3 folículos, y de hecho, muchas de estas mujeres son normoovuladoras. Pese a que hasta hoy no ha habido grandes problemas con los productos de origen urinario, parece lógico que poco a poco vayan desapareciendo, como ocurrió con la insulina humana o con la hormona del crecimiento. Los nuevos fármacos obtenidos a través de tecnología recombinante ofrecen más seguridad, mejor control, más comodidad en su administración y más potencia sin aumentar los riesgos . Otro dato novedoso es la utilización de los antagonistas de la GnRH en la estimulación para IA. Varios trabajos han demostrado que entre el 14-­‐20% de los ciclos estimulados de IA presentan picos de LH y luteinizaciones prematuras con los subsiguientes resultados negativos para el ciclo32, 33. Algunos autores consideran que esta luteinización prematura pudiera estar UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 8 de 13 MÁSTER EN REPRODUCCIÓN HUMANA relacionada con la existencia de un pool ovocitario disminuido y la presencia de folículos dismaduros más que un efecto dependiente de la elevación de la LH34. Diversos estudios muestran resultados divergentes con el uso de antagonistas de la GnRH para IA. Ragni et al32 comunican tasas de embarazo con el grupo de antagonistas con dosis diarias de FSH-­‐r de 34% frente a un 6% en casos de antagonistas con dosis en días alternos. Similares resultados presenta Gomez-­‐Palomares35 (38% vs 14%) en ambos grupos. Recientemente, Bakas et al36 comparan ciclos de inseminación artificial con/sin antagonista en pacientes sin seleccionar y refieren una mejora en la tasa de embarazo (22% vs 11%), tasa acumulada de embarazo (52% vs 31%), así como una disminución de la tasa de luteinizaciones prematuras (1,7% vs 17%). Sin embargo, otro grupo no encuentran una mejora en las tasas de embarazo en los ciclos de IA de pacientes no seleccionada que utilizaban antagonistas de la GnRH37. En nuestro centro realizamos un estudio prospectivo para evaluar la eficacia de los antagonistas de la GnRH en termino de tasa de embarazo en ciclos de IA de pacientes con luteinización prematura33. Para ello, evaluamos 709 pacientes que realizaron un ciclo de inseminación artificial intrauterina (IA) en nuestro centro. Aquellas pacientes que presentaron luteinización prematura y no gestaron fueron sometidas en su siguiente ciclo de IA con el mismo protocolo de estimulación pero añadiendo un antagonista de la GnRH. En nuestra experiencia, evidenciamos aproximadamente un 25% de tasa de embarazos en ciclos con antagonistas comparadas con las tasas de embarazo de pacientes sin el uso de estos (12%). Por lo tanto, este estudio parece demostrar que la utilización de antagonistas de la GnRH en un determinado grupo de pacientes (aquellos con elevaciones prematuras de la LH como pacientes mayores de 38 años o con baja reserva oculta) que se someten a IA pueden mejorar sus resultados reproductivos. 12. Conclusiones La inseminación artificial es una técnica sencilla y barata que ofrece unos resultados clínicos alentadores. La edad es un factor determinante para el éxito, así como un semen adecuado respecto a motilidad y morfología. Frente a otras opciones, la inseminación intrauterina es la técnica de elección. Parece adecuado el realizar un máximo de 4 ciclos, ajustando este número en función de la edad de la paciente. La realización de una inseminación única bajo control ecográfico abdominal a las 36 horas de la administración de la hCG y el empleo de gonadotropinas recombinantes es la evolución lógica en el siglo XXI, por su mayor potencia, comodidad y su mejor control. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 9 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 13. Bibliografía 1. Remohí J, Gutierrez A, Cano F. Cuadrenos de Medicina Reproductiva: Panamericana; 1995. 2. Cooper TG, Noonan E, von Eckardstein S, Auger J, Baker HW, Behre HM, et al. World Health Organization reference values for human semen characteristics. Hum Reprod Update. 2010; 16(3): 231-­‐45. 3. Merviel P, Heraud MH, Grenier N, Lourdel E, Sanguinet P, Copin H. Predictive factors for pregnancy after intrauterine insemination (IUI): an analysis of 1038 cycles and a review of the literature. Fertil Steril. 2010; 93(1): 79-­‐88. 4. Sun Y, Li B, Fan L, Zhu W, Chen X, Feng J, et al. Does sperm morphology affect the outcome of intrauterine insemination in patients with normal sperm concentration and motility? Andrology. 2012; 44(5): 299-­‐304. 5. Zuzuarregui JL, Meseguer M, Garrido N, Simon C, Pellicer A, Remohi J. Parameters affecting the results in a program of artificial insemination with donor sperm. A 12-­‐year retrospective review of more than 1800 cycles. J Assist Reprod Genet. 2004; 21(4): 109-­‐18. 6. Stone BA, Vargyas JM, Ringler GE, Stein AL, Marrs RP. Determinants of the outcome of intrauterine insemination: analysis of outcomes of 9963 consecutive cycles. Am J Obstet Gynecol. 1999; 180(6 Pt 1): 1522-­‐34. 7. Crosignani PG, Rubin BL. Optimal use of infertility diagnostic tests and treatments. The ESHRE Capri Workshop Group. Hum Reprod. 2000; 15(3): 723-­‐32. 8. Intrauterine insemination. Hum Reprod Update. 2009; 15(3): 265-­‐77. 9. Duran HE, Morshedi M, Kruger T, Oehninger S. Intrauterine insemination: a systematic review on determinants of success. Hum Reprod Update. 2002; 8(4): 373-­‐84. 10. Matorras R, Diaz T, Corcostegui B, Ramon O, Pijoan JI, Rodriguez-­‐Escudero FJ. Ovarian stimulation in intrauterine insemination with donor sperm: a randomized study comparing clomiphene citrate in fixed protocol versus highly purified urinary FSH. Hum Reprod. 2002; 17(8): 2107-­‐11. 11. Ferrara I, Balet R, Grudzinskas JG. Intrauterine insemination with frozen donor sperm. Pregnancy outcome in relation to age and ovarian stimulation regime. Hum Reprod. 2002; 17(9): 2320-­‐4. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 10 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 12. Carroll N, Palmer JR. A comparison of intrauterine versus intracervical insemination in fertile single women. Fertil Steril. 2001; 75(4): 656-­‐60. 13. Goldberg JM, Mascha E, Falcone T, Attaran M. Comparison of intrauterine and intracervical insemination with frozen donor sperm: a meta-­‐analysis. Fertil Steril. 1999; 72(5): 792-­‐5. 14. Do Amaral VF, Ferriani RA, Dos Reis RM, De Sala MM, De Moura MD. Effect of inseminated volume on intrauterine insemination. J Assist Reprod Genet. 2001; 18(8): 413-­‐6. 15. Silverberg KM, Johnson JV, Olive DL, Burns WN, Schenken RS. A prospective, randomized trial comparing two different intrauterine insemination regimens in controlled ovarian hyperstimulation cycles. Fertil Steril. 1992; 57(2): 357-­‐61. 16. Ragni G, Maggioni P, Guermandi E, Testa A, Baroni E, Colombo M, et al. Efficacy of double intrauterine insemination in controlled ovarian hyperstimulation cycles. Fertil Steril. 1999; 72(4): 619-­‐22. 17. Garcia-­‐Velasco JA, Arici A, Zreik TG. Endogenous LH surge detection versus administration of HCG to correctly time intrauterine insemination: which provides a better pregnancy rate? Hum Reprod. 2000; 15(4): 975-­‐6. 18. Polyzos NP, Tzioras S, Mauri D, Tatsioni A. Double versus single intrauterine insemination for unexplained infertility: a meta-­‐analysis of randomized trials. Fertil Steril. 2010; 94(4): 1261-­‐ 6. 19. Tonguc E, Var T, Onalan G, Altinbas S, Tokmak A, Karakas N, et al. Comparison of the effectiveness of single versus double intrauterine insemination with three different timing regimens. Fertil Steril. 2010; 94(4): 1267-­‐70. 20. Kyrou D, Kolibianakis EM, Fatemi HM, Grimbizis GF, Theodoridis TD, Camus M, et al. Spontaneous triggering of ovulation versus HCG administration in patients undergoing IUI: a prospective randomized study. Reprod Biomed Online. 2012; 25(3): 278-­‐83. 21. Cantineau AE, Janssen MJ, Cohlen BJ. Synchronised approach for intrauterine insemination in subfertile couples. Cochrane Database Syst Rev. 2010; (4): CD006942. 22. Ghanem ME, Bakre NI, Emam MA, Al Boghdady LA, Helal AS, Elmetwally AG, et al. The effects of timing of intrauterine insemination in relation to ovulation and the number of inseminations on cycle pregnancy rate in common infertility etiologies. Hum Reprod. 2011; 26(3): 576-­‐83. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 11 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 23. Saleh A, Tan SL, Biljan MM, Tulandi T. A randomized study of the effect of 10 minutes of bed rest after intrauterine insemination. Fertil Steril. 2000; 74(3): 509-­‐11. 24. Remohí J, Cano F, Gutierrez A. Resultados de la inseminación artificial. In: Pellicer A, editor. Cuadernos de Medicina Reproductiva. Madrid: Médica Panamericana; 1995. p. 107-­‐27. 25. Aboulghar M, Mansour R, Serour G, Abdrazek A, Amin Y, Rhodes C. Controlled ovarian hyperstimulation and intrauterine insemination for treatment of unexplained infertility should be limited to a maximum of three trials. Fertil Steril. 2001; 75(1): 88-­‐91. 26. Fugger EF, Black SH, Keyvanfar K, Schulman JD. Births of normal daughters after MicroSort sperm separation and intrauterine insemination, in-­‐vitro fertilization, or intracytoplasmic sperm injection. Hum Reprod. 1998; 13(9): 2367-­‐70. 27. Bhal PS, Pugh ND, Gregory L, O'Brien S, Shaw RW. Perifollicular vascularity as a potential variable affecting outcome in stimulated intrauterine insemination treatment cycles: a study using transvaginal power Doppler. Hum Reprod. 2001; 16(8): 1682-­‐9. 28. Engels V, Sanfrutos L, Perez-­‐Medina T, Alvarez P, Zapardiel I, Godoy-­‐Tundidor S, et al. Periovulatory follicular volume and vascularization determined by 3D and power Doppler sonography as pregnancy predictors in intrauterine insemination cycles. J Clin Ultrasound. 2011; 39(5): 243-­‐7. 29. Marina S, Marina F, Alcolea R, Exposito R, Huguet J, Nadal J, et al. Human immunodeficiency virus type 1-­‐-­‐serodiscordant couples can bear healthy children after undergoing intrauterine insemination. Fertil Steril. 1998; 70(1): 35-­‐9. 30. Garrido N, Meseguer M, Simon C, Pellicer A, Remohi J. Assisted reproduction in HIV and HCV infected men of serodiscordant couples. Archives of andrology. 2004; 50(2): 105-­‐11. 31. Garrido N, Meseguer M, Bellver J, Remohi J, Simon C, Pellicer A. Report of the results of a 2 year programme of sperm wash and ICSI treatment for human immunodeficiency virus and hepatitis C virus serodiscordant couples. Hum Reprod. 2004; 19(11): 2581-­‐6. 32. Ragni G, Alagna F, Brigante C, Riccaboni A, Colombo M, Somigliana E, et al. GnRH antagonists and mild ovarian stimulation for intrauterine insemination: a randomized study comparing different gonadotrophin dosages. Hum Reprod. 2004; 19(1): 54-­‐8. 33. Martinez-­‐Salazar J, Cerrillo M, Quea G, Pacheco A, Garcia-­‐Velasco JA. GnRH antagonist ganirelix prevents premature luteinization in IUI cycles: rationale for its use. Reprod Biomed Online. 2009; 19(2): 156-­‐61. UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 12 de 13 MÁSTER EN REPRODUCCIÓN HUMANA 34. Younis JS, Ben-­‐Shlomo I, Ben-­‐Ami M. Premature luteinization defined by an increased progesterone/estradiol ratio on day of human chorionic gonadotropin administration is a manifestation of diminished ovarian responsiveness to controlled ovarian hyperstimulation. Fertil Steril. 2010; 93(6): e29; author reply e30. 35. Gomez-­‐Palomares JL, Acevedo-­‐Martin B, Chavez M, Manzanares MA, Ricciarelli E, Hernandez ER. Multifollicular recruitment in combination with gonadotropin-­‐releasing hormone antagonist increased pregnancy rates in intrauterine insemination cycles. Fertil Steril. 2008; 89(3): 620-­‐4. 36. Bakas P, Konidaris S, Liapis A, Gregoriou O, Tzanakaki D, Creatsas G. Role of gonadotropin-­‐ releasing hormone antagonist in the management of subfertile couples with intrauterine insemination and controlled ovarian stimulation. Fertil Steril. 2011; 95(6): 2024-­‐8. 37. Cantineau AE, Cohlen BJ, Klip H, Heineman MJ. The addition of GnRH antagonists in intrauterine insemination cycles with mild ovarian hyperstimulation does not increase live birth rates-­‐-­‐a randomized, double-­‐blinded, placebo-­‐controlled trial. Hum Reprod. 2011; 26(5): 1104-­‐11. © 2012 ʹ IVI Reservados todos los derechos UNIDAD 01: Inseminación artificial BLOQUE 4: TÉCNICAS DE REPRODUCCIÓN ASISTIDA Página 13 de 13