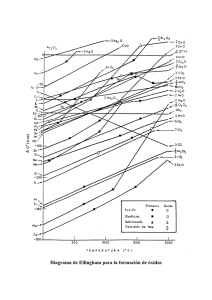
Caja de reacción. Isoterma de van`t Hoff Diagrama original de
Anuncio

Caja de reacción. Isoterma de van’t Hoff Diagrama original de Ellingham publicado en 1944 en el Journal of the Society of Chemical Industry Línea hipotética de oxidación de un metal Me en un diagrama ∆G0 – T Trazado de dos líneas hipotéticas de oxidación en un diagrama ∆G0 – T Diagrama de Richardson reducido Diagrama de Richardson completo Diagrama de Ellingham para el sistema carbono-oxígeno Diagrama de Ellingham para la formación de óxidos Relación CO2/CO como una función de la inversa de la temperatura para la reducción de óxidos metálicos con CO Relación H2O/H2 como una función de la inversa de la temperatura para la reducción de óxidos metálicos con H2 Equilibrios de reducción para distintos óxidos metálicos con CO (actividad 1 para el óxido metálico) Equilibrios de reducción para distintos óxidos metálicos con CO (actividad 0,05 para el óxido metálico) Representación de Arrhenius Energías de activación Esquema de una reacción heterogénea sólido-líquido Capa límite Influencia de la agitación en la lixiviación de cobre con amoniaco Influencia de la temperatura en la oxidación de C a CO. Entre 600 y 800ºC la Ea vale 41,5 kcal/mol (controla la reacción química) y entre 1100 y 1300ºC, 1,5 kcal/mol (controla la difusión). Influencia de la concentración en la disolución del CuO con ácido sulfúrico